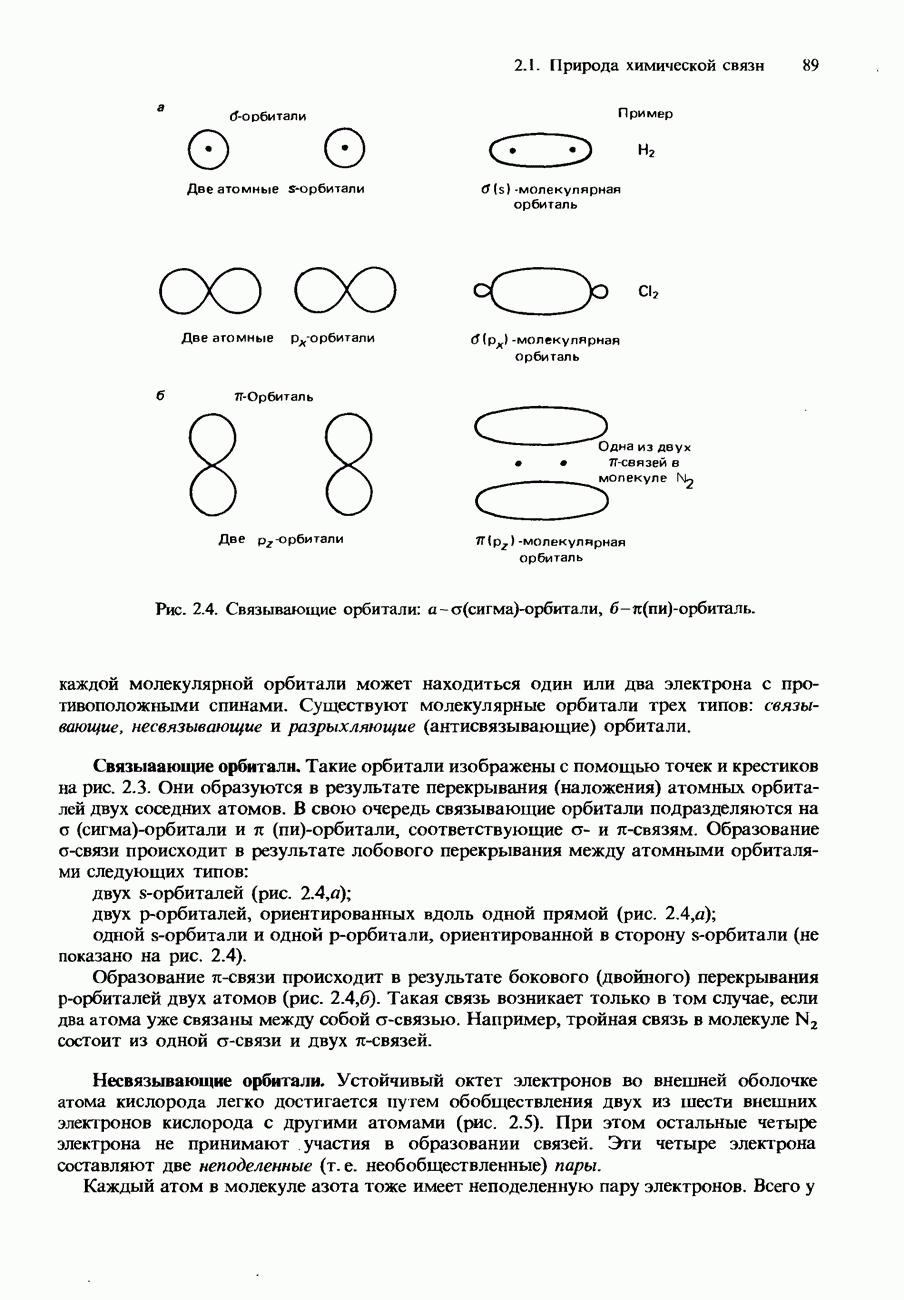
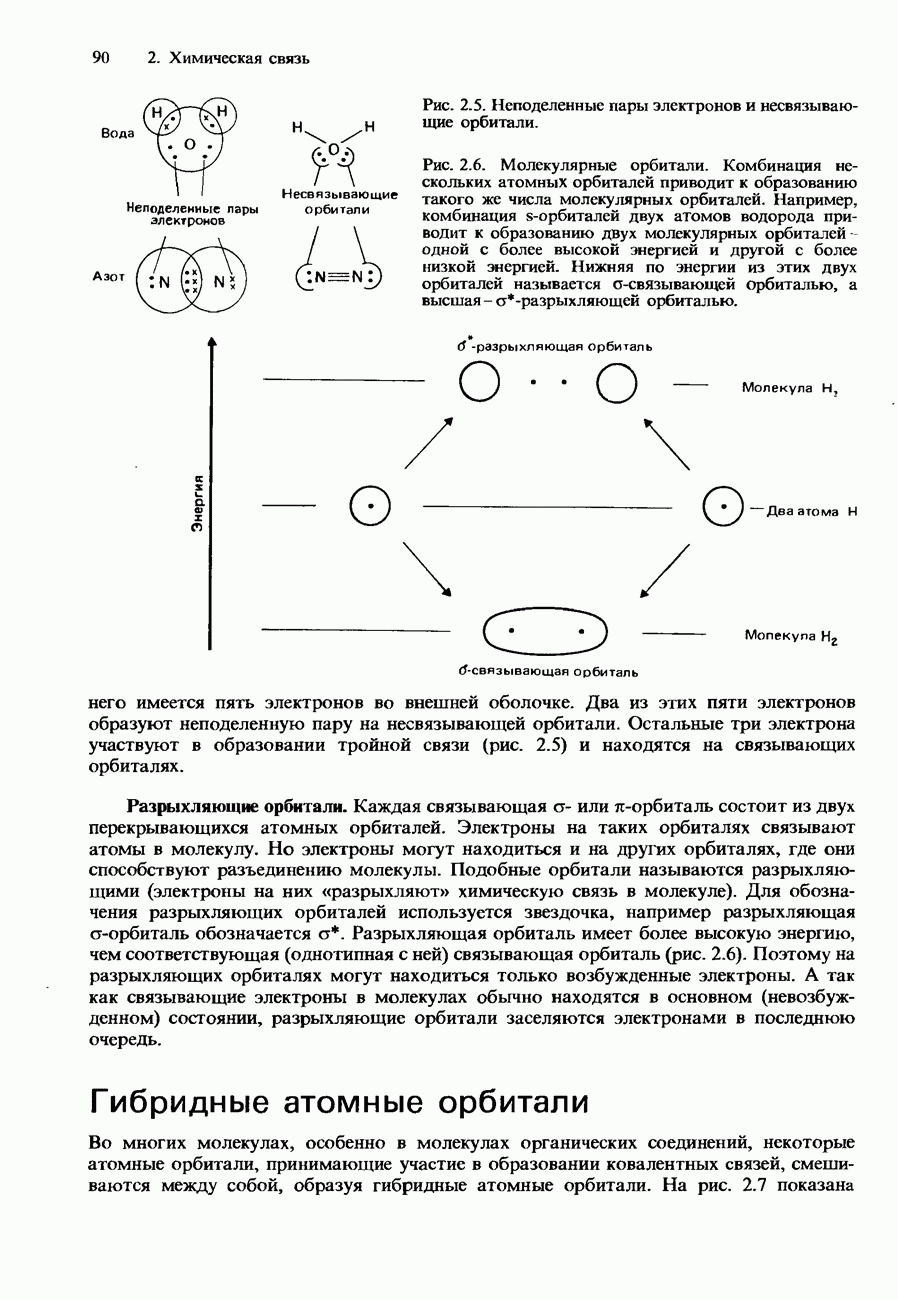
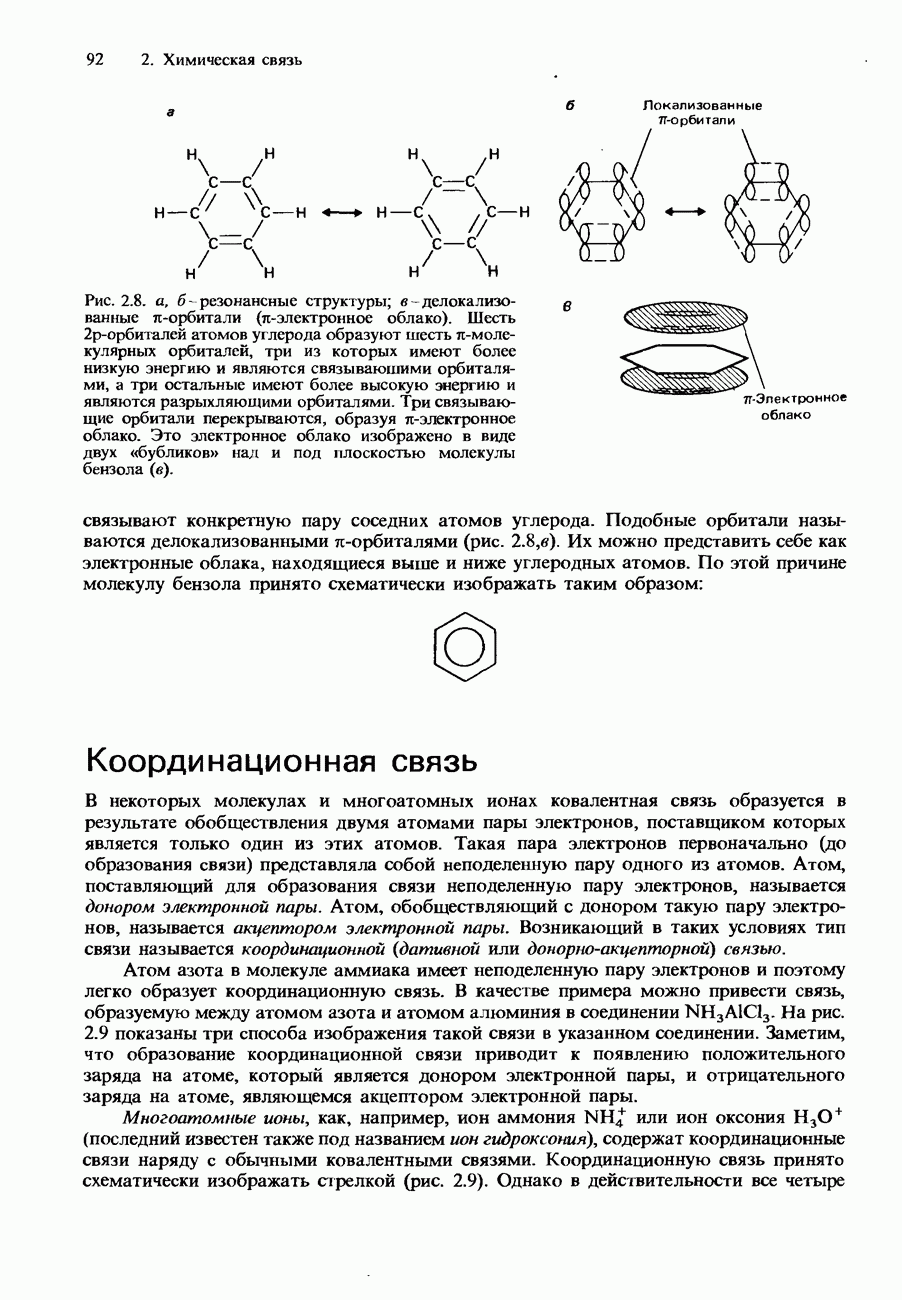
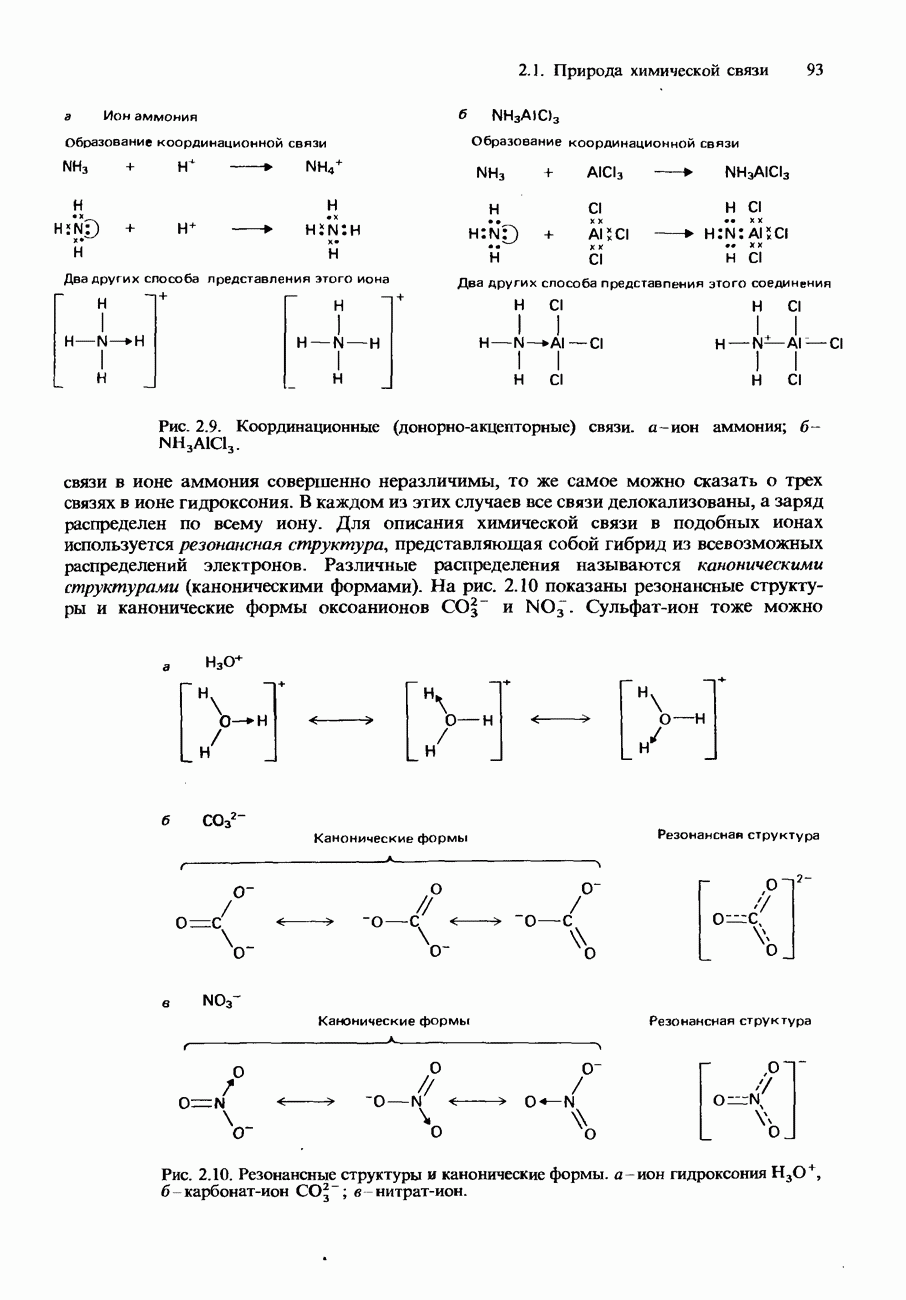
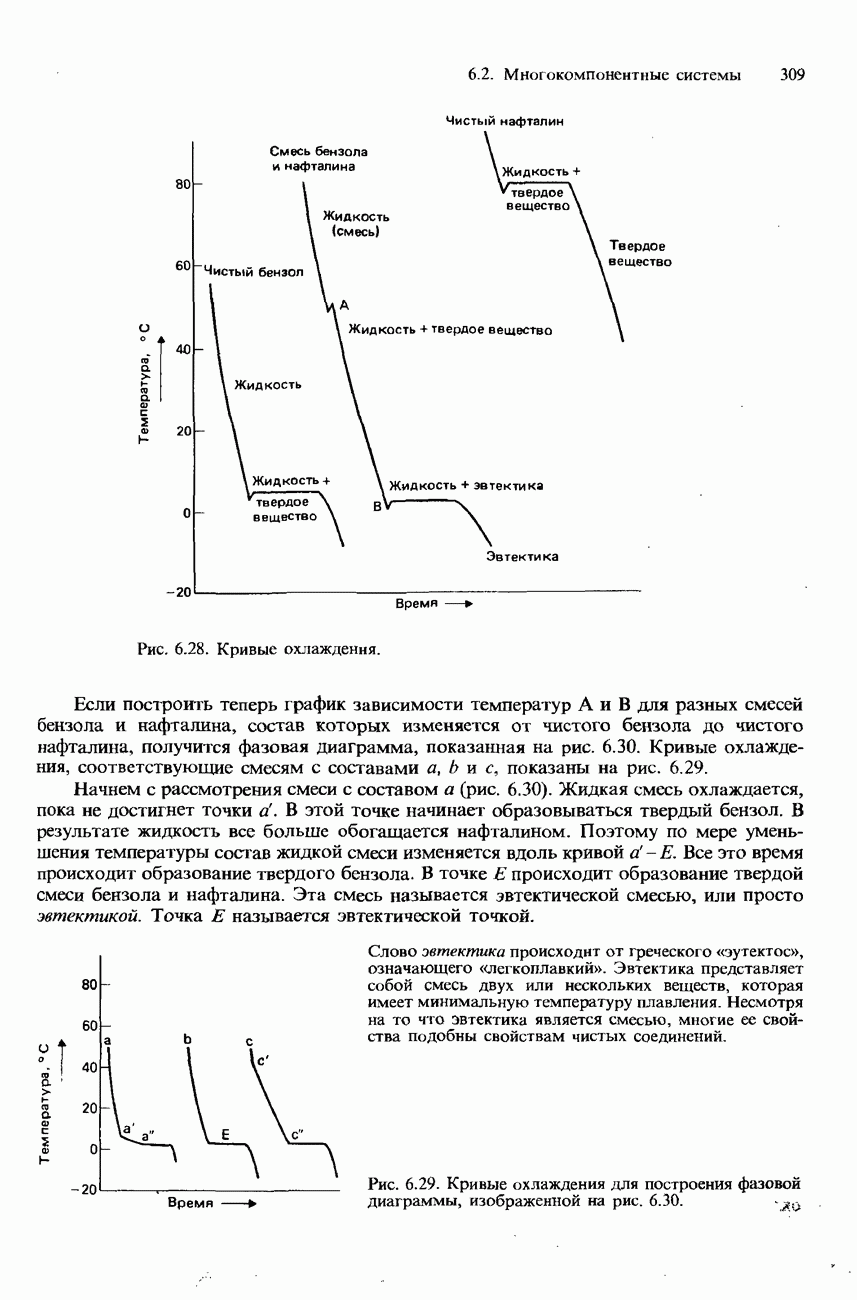
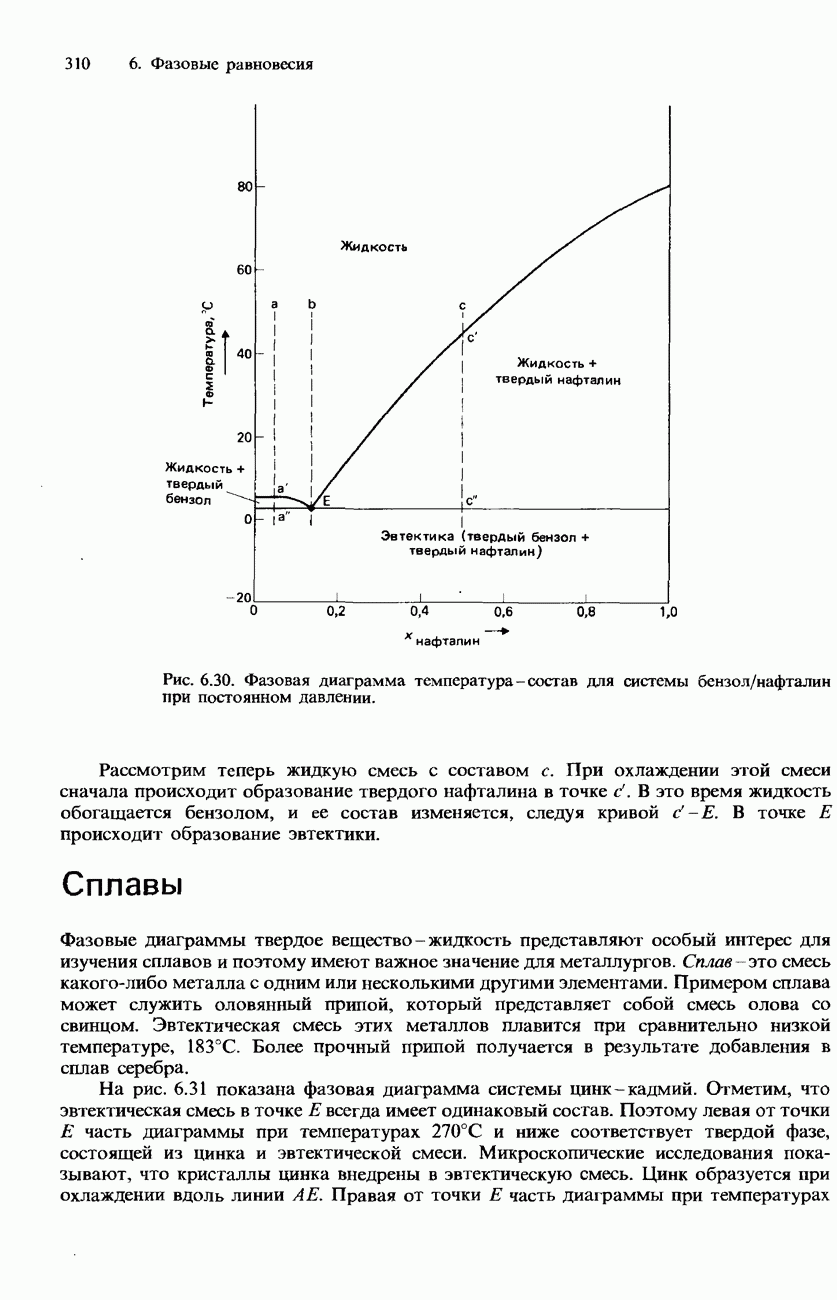
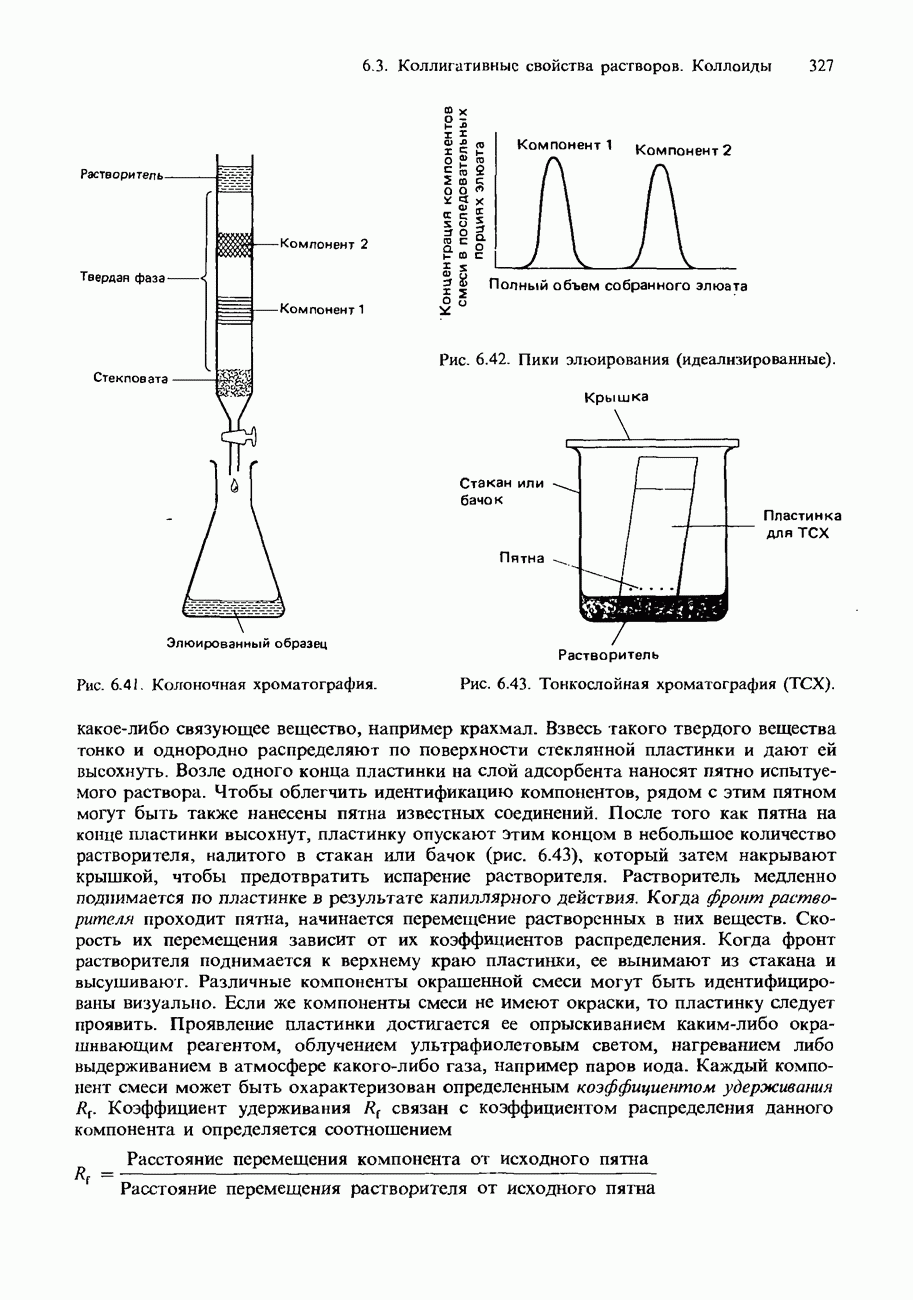
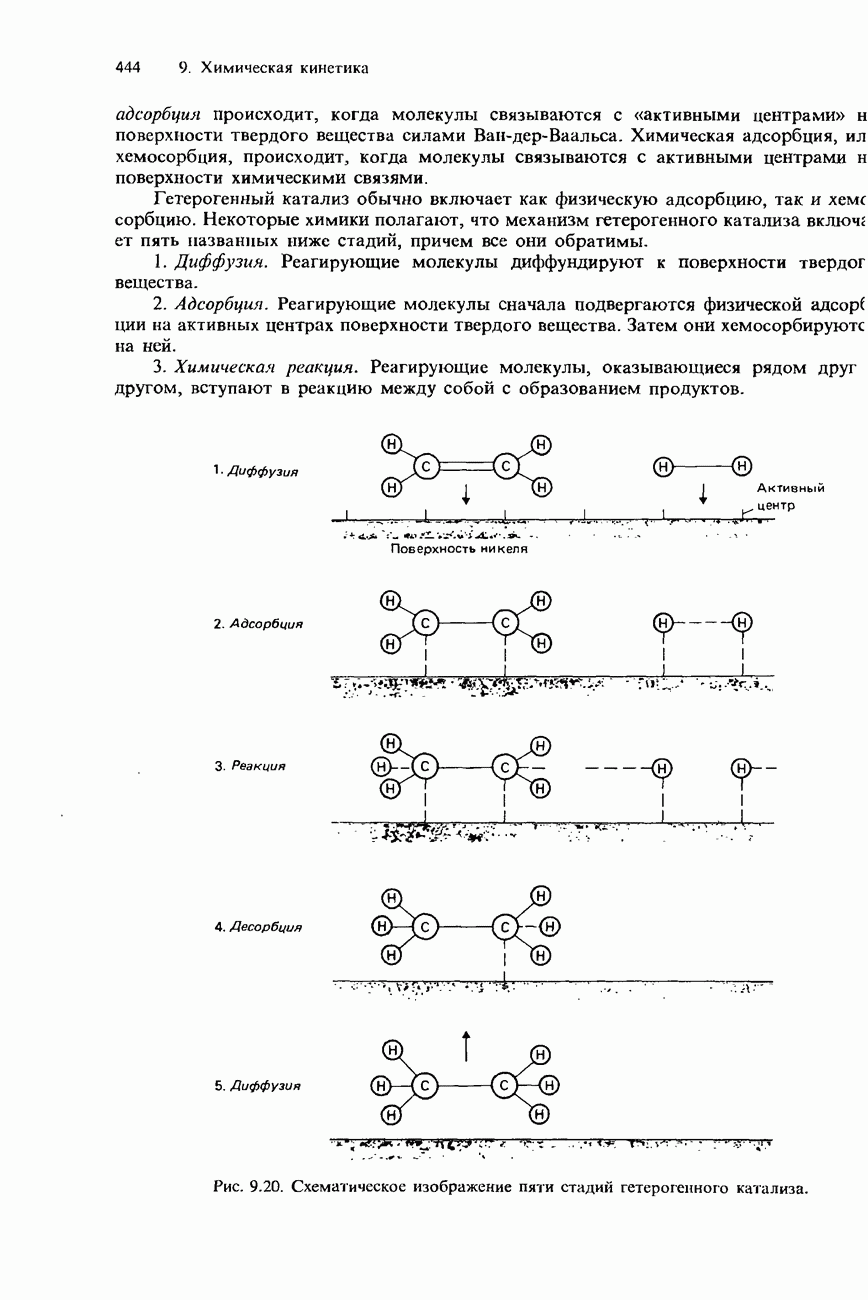
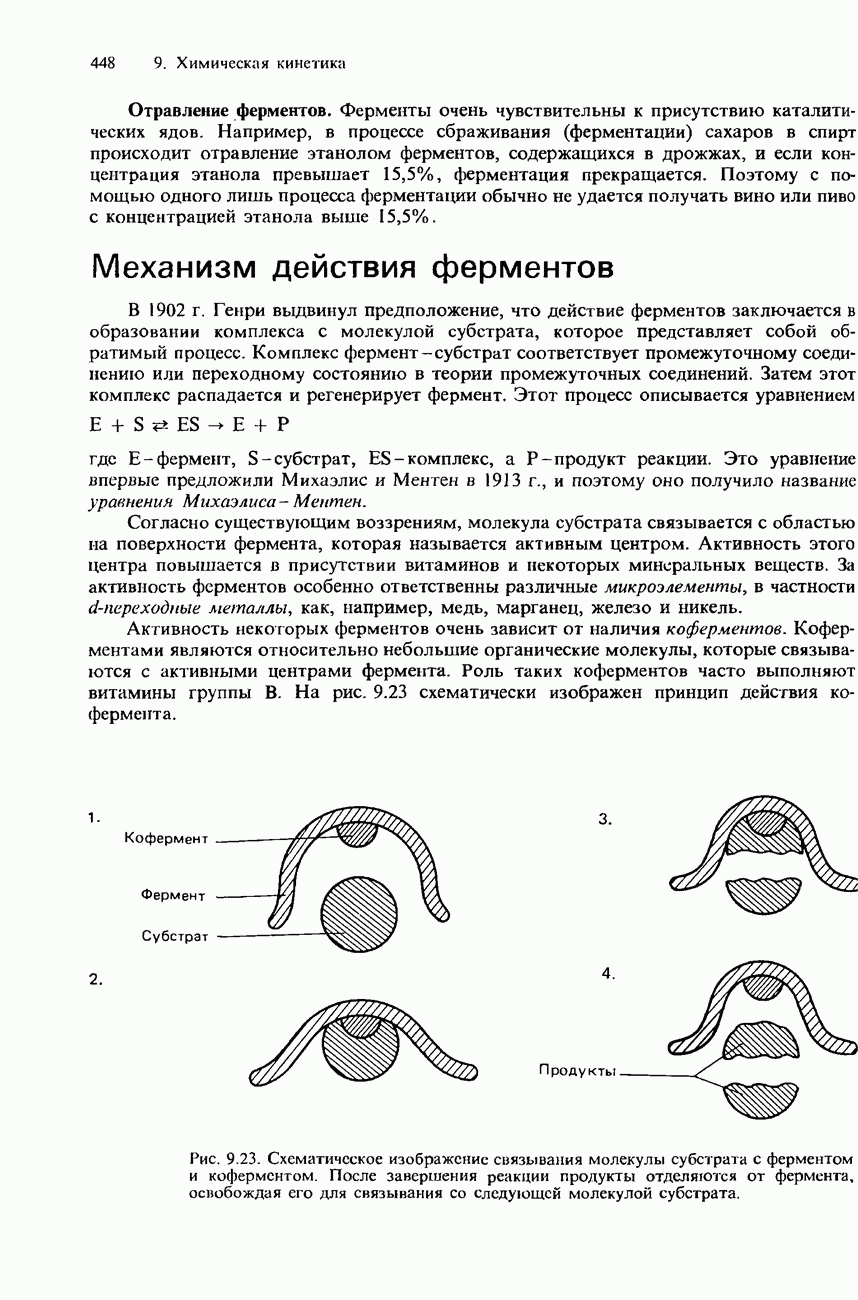
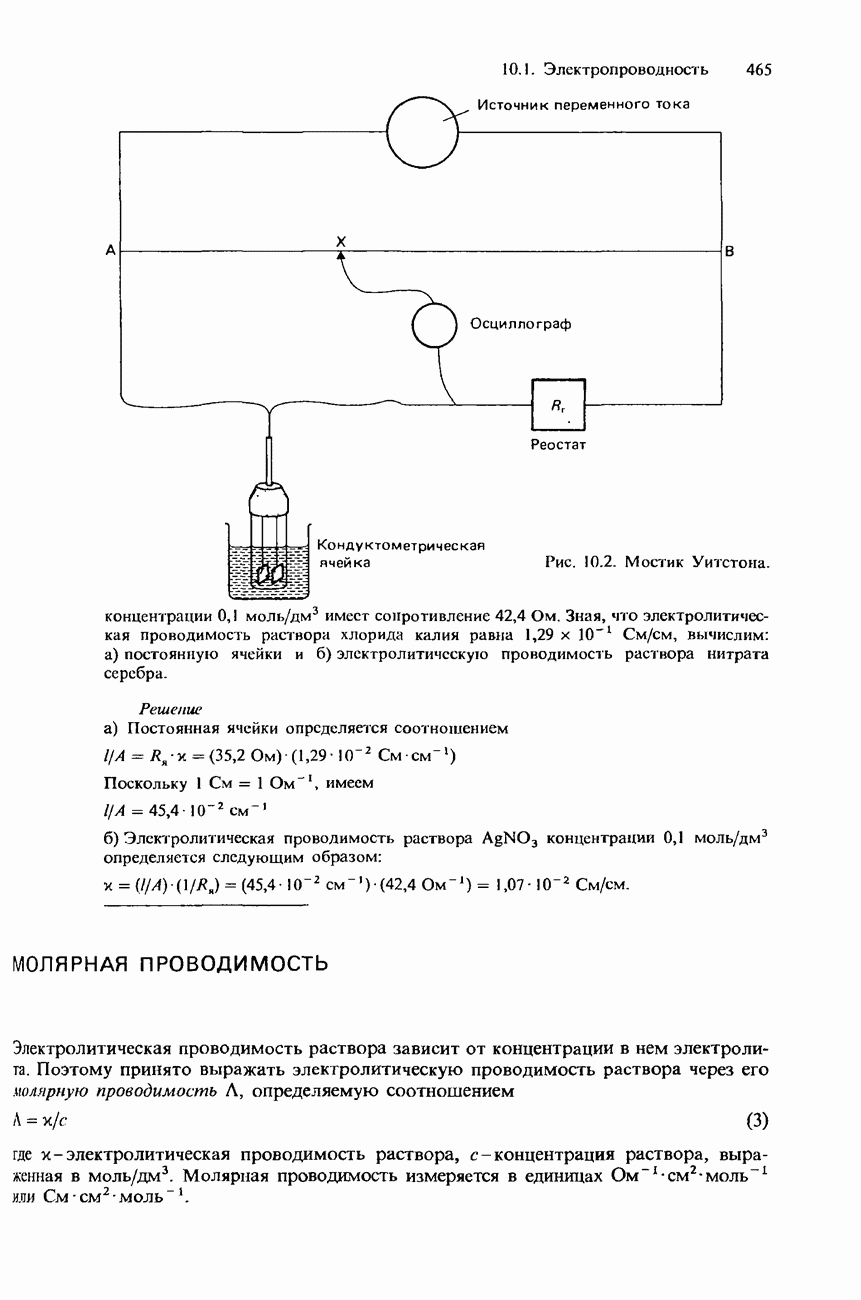
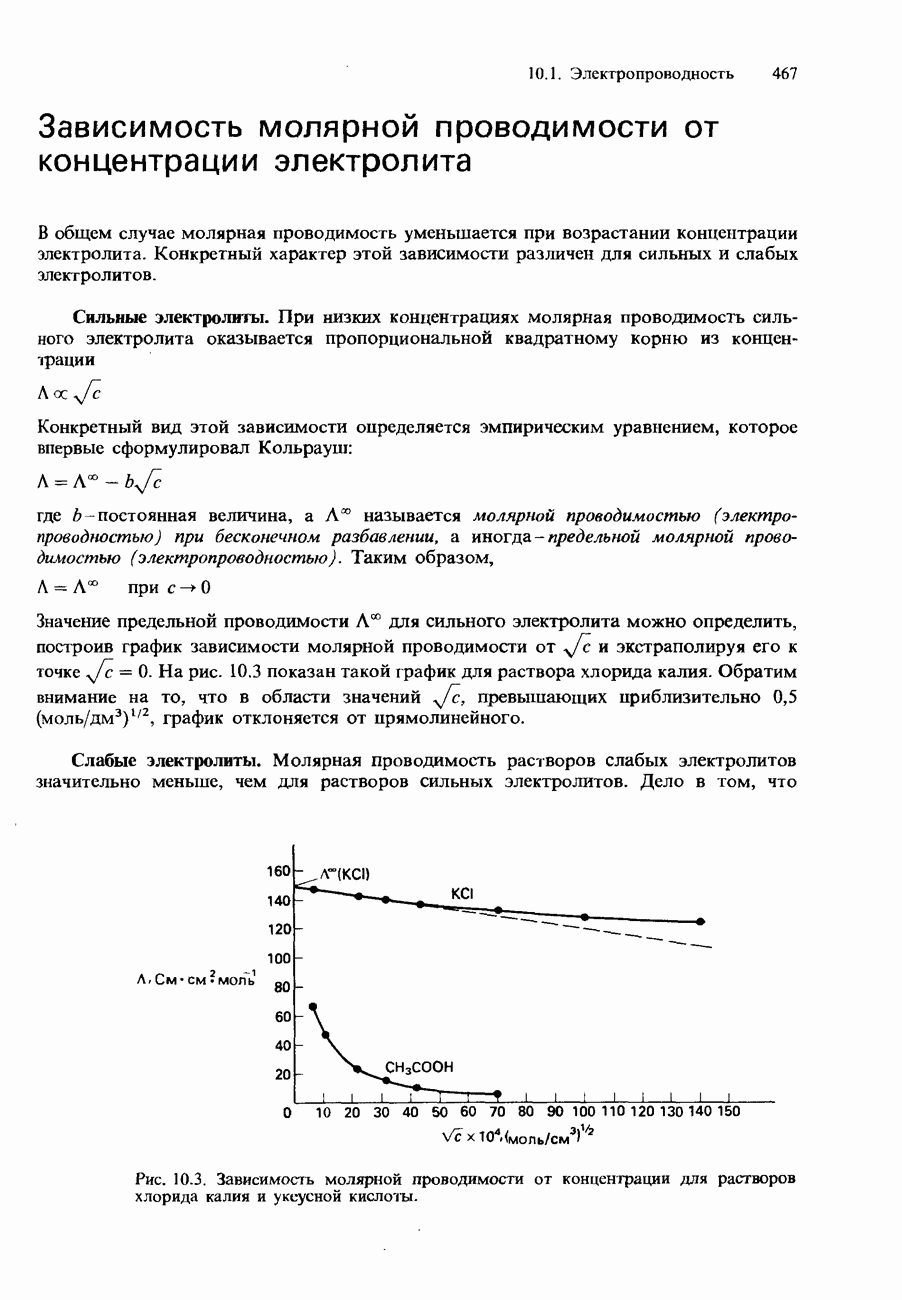
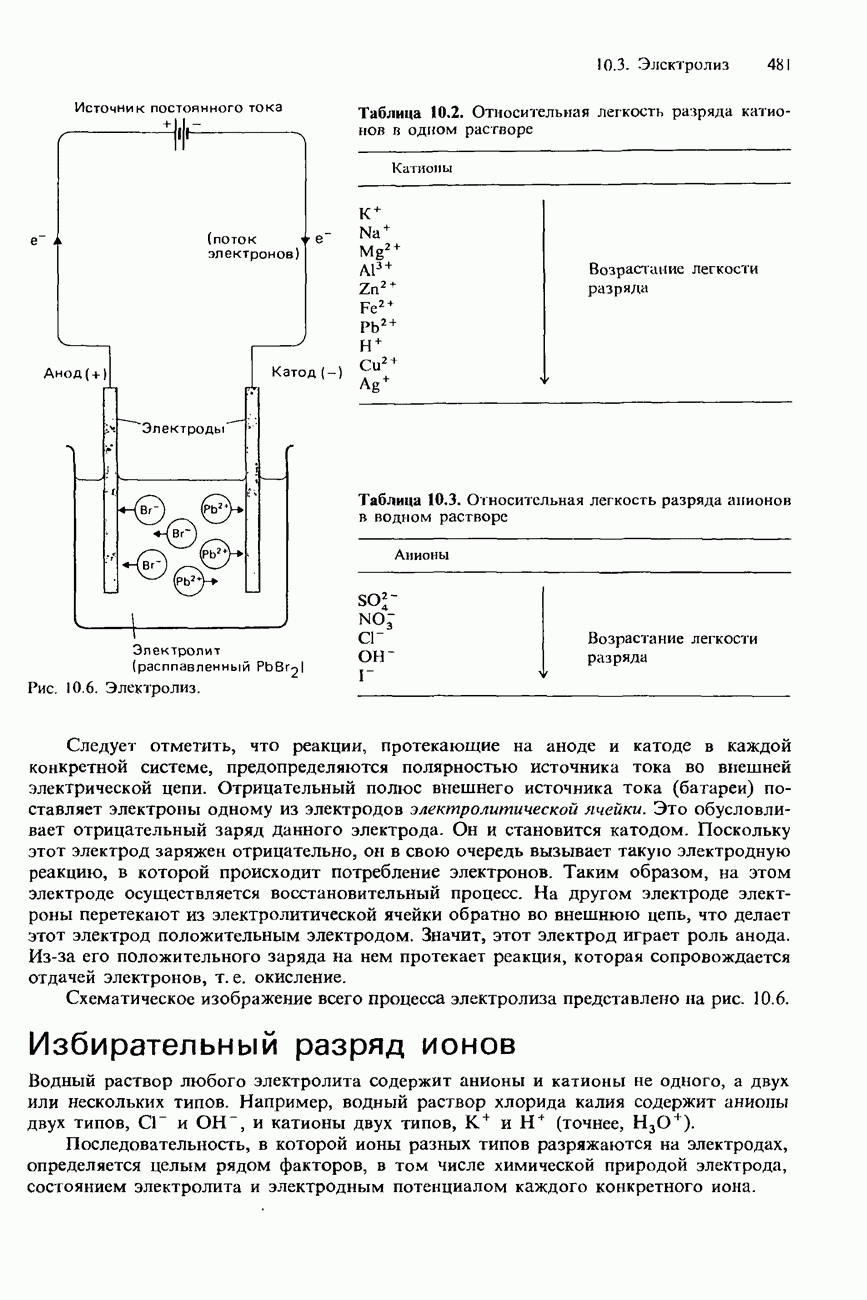
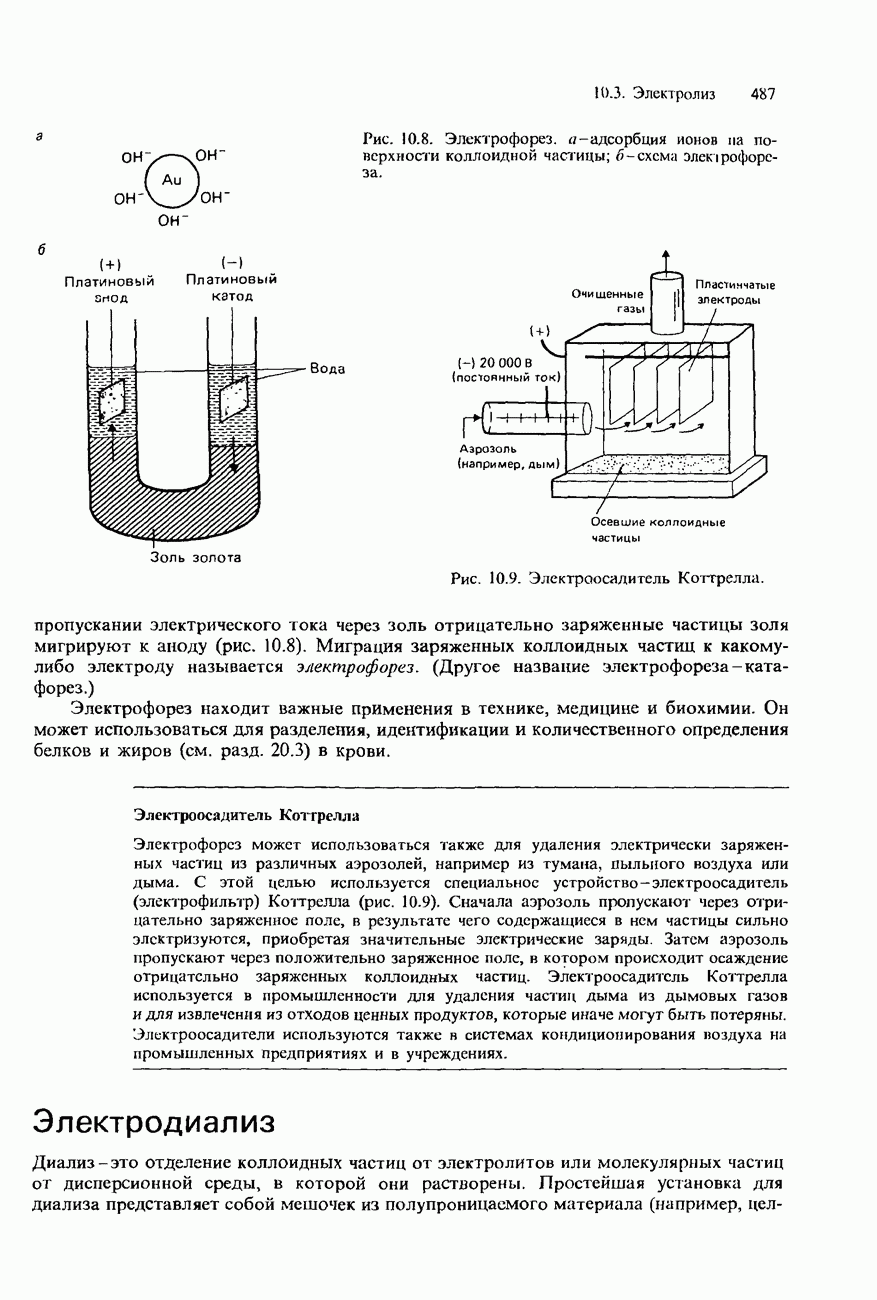
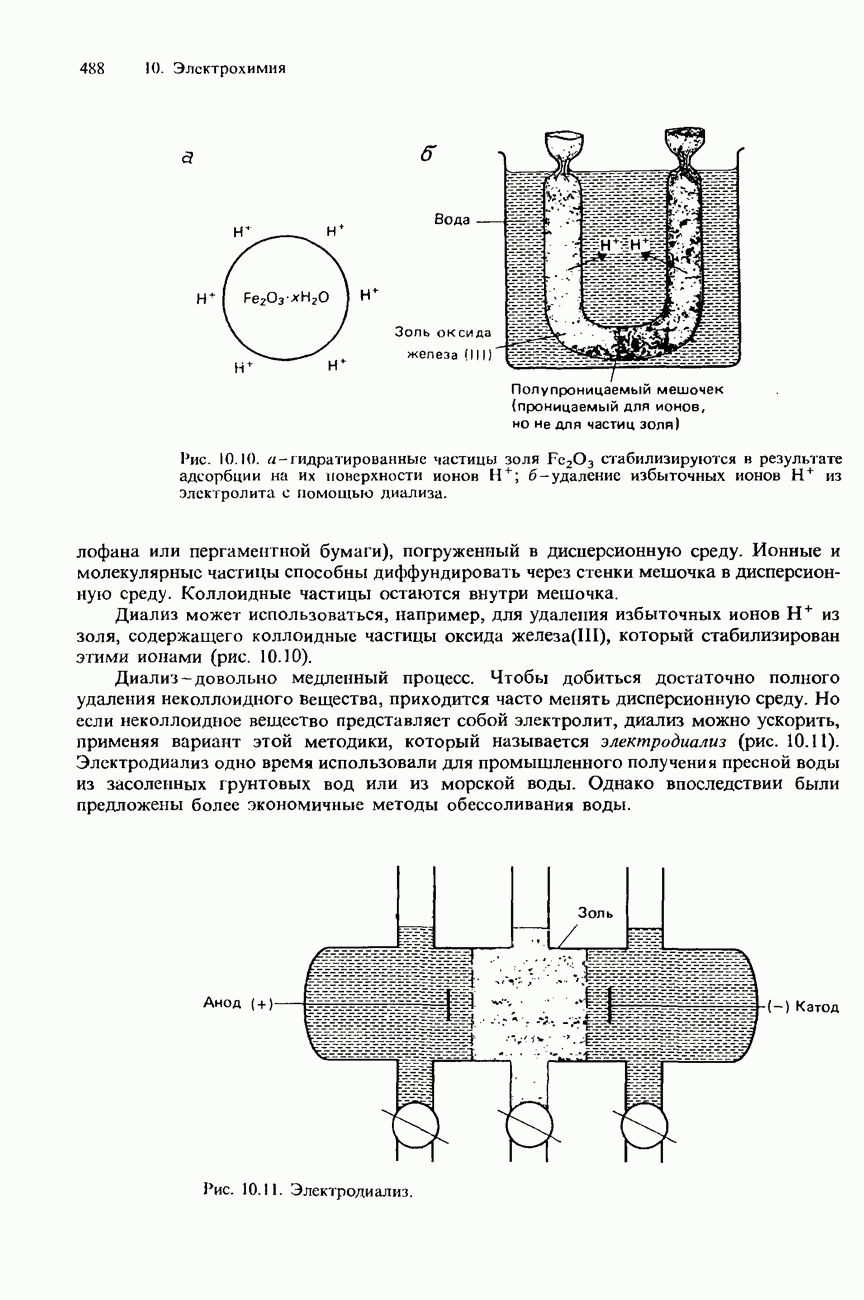
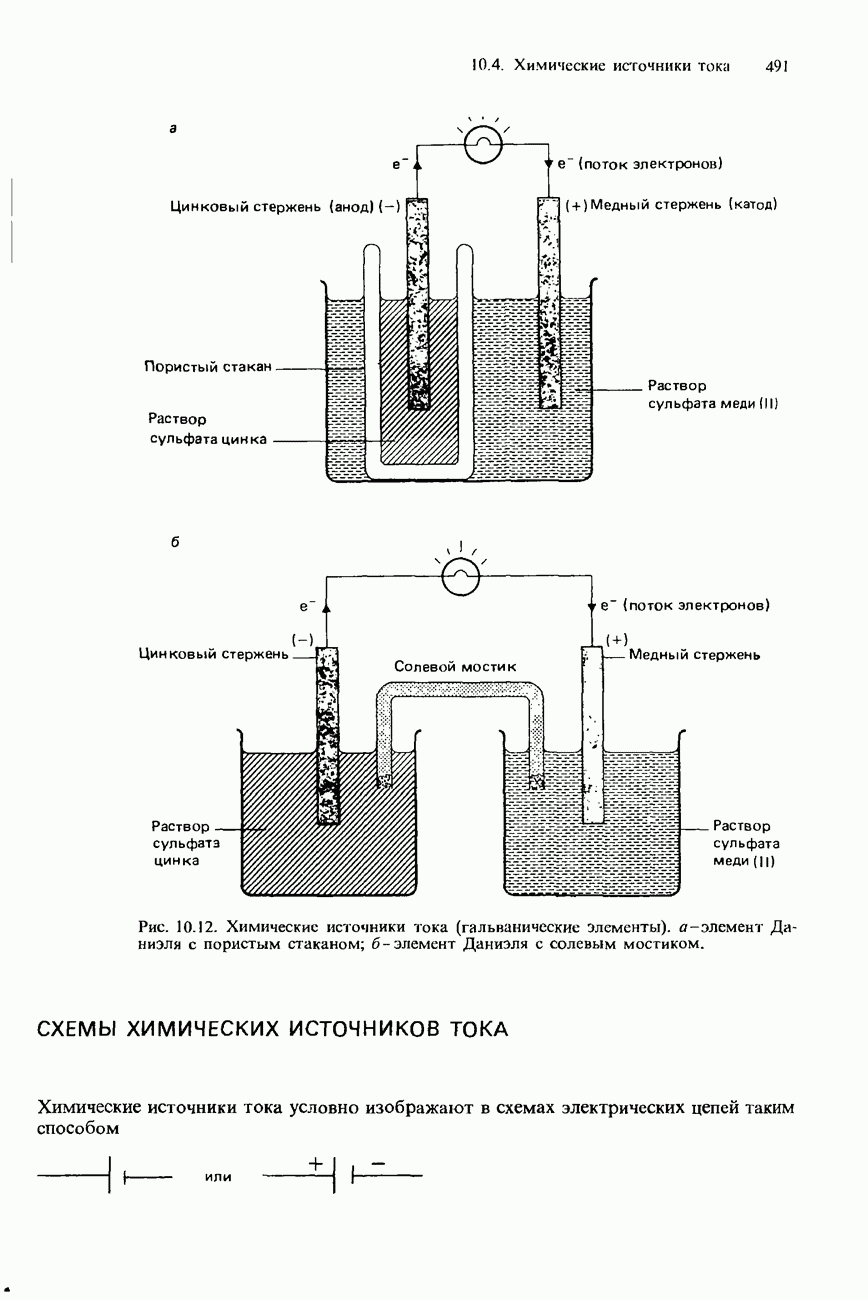
| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
НЕСМЕШИВАЮЩИЕСЯ ЖИДКОСТИ
Если обе жидкости нерастворимы одна в другой, то при их смешивании в любых пропорциях образуются два отдельных слоя. Такие жидкости называются несмешивающимися (например, ртуть/вода, дисульфид углерода/вода, хлоробензол/вода и фениламин/вода).
Экспериментально установлено, что полное давление пара в системе из двух несмешивающихся жидкостей равно сумме давлений пара двух чистых компонентов:

Перегонка с паром
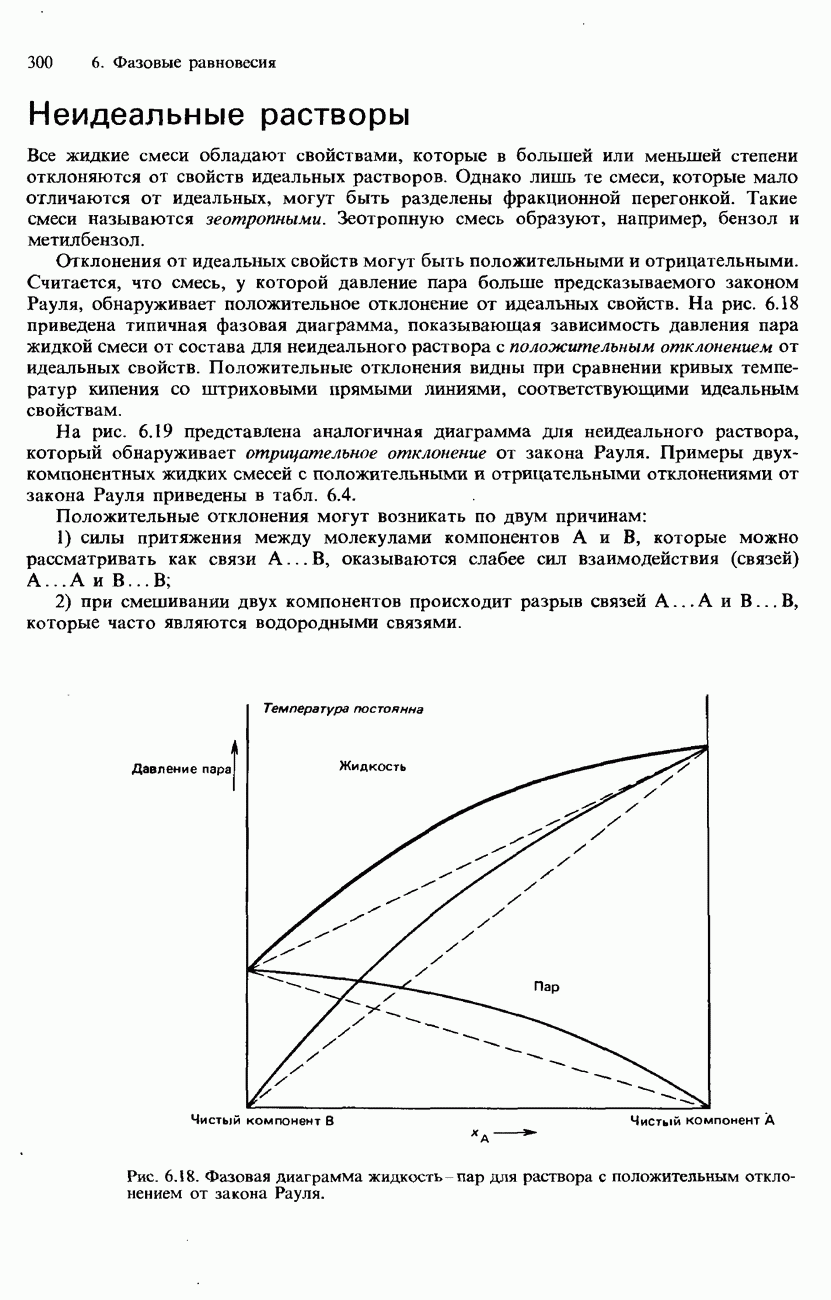
Поскольку полное давление пара в системе из двух несмешивающихся жидкостей больше давления пара каждого из ее компонентов, температура, при которой кипит смесь, ниже температуры кипения каждого из ее компонентов. На этом основана перегонка с паром. При давлении 1 атм вода имеет температуру кипения 100 °С.

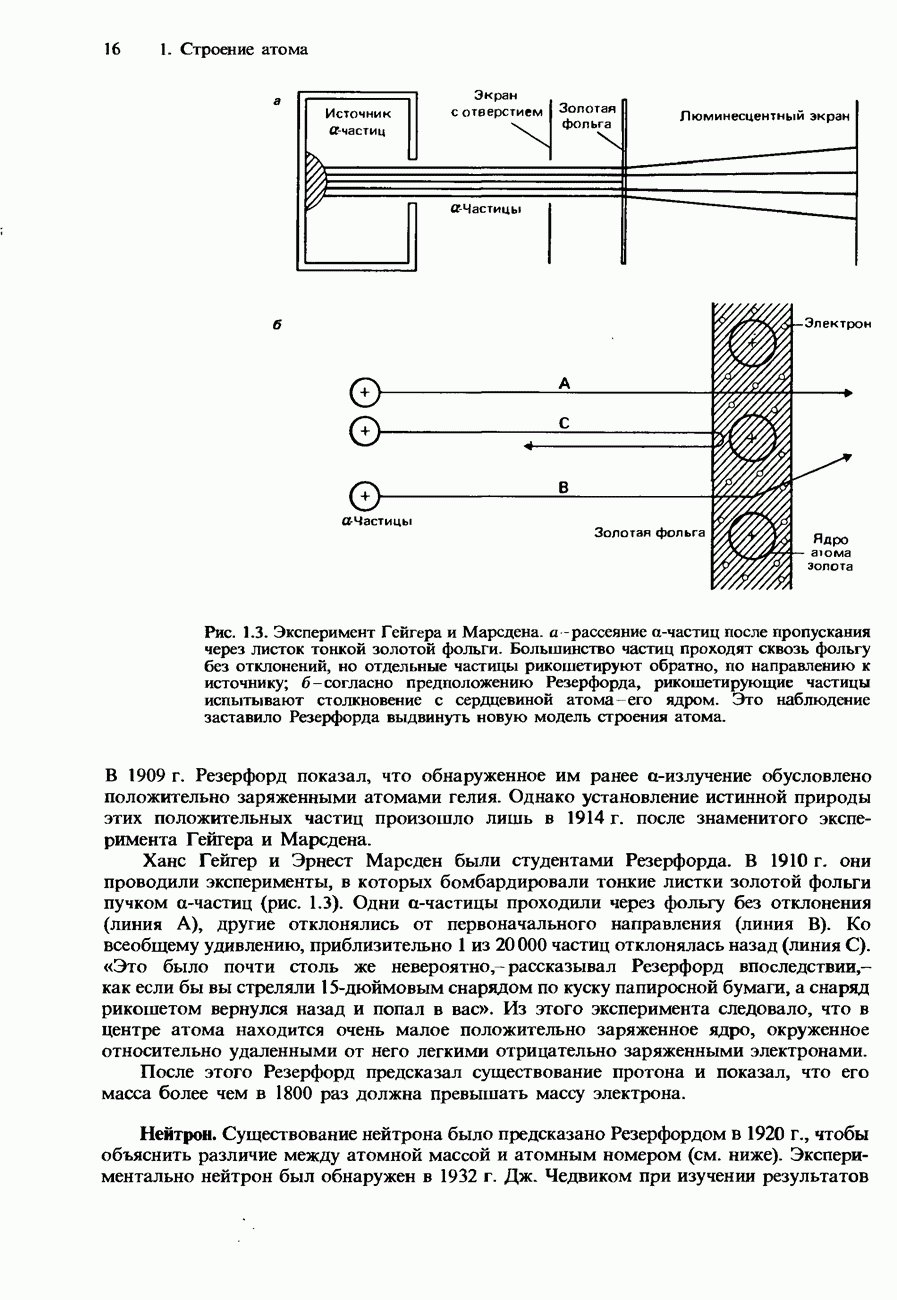
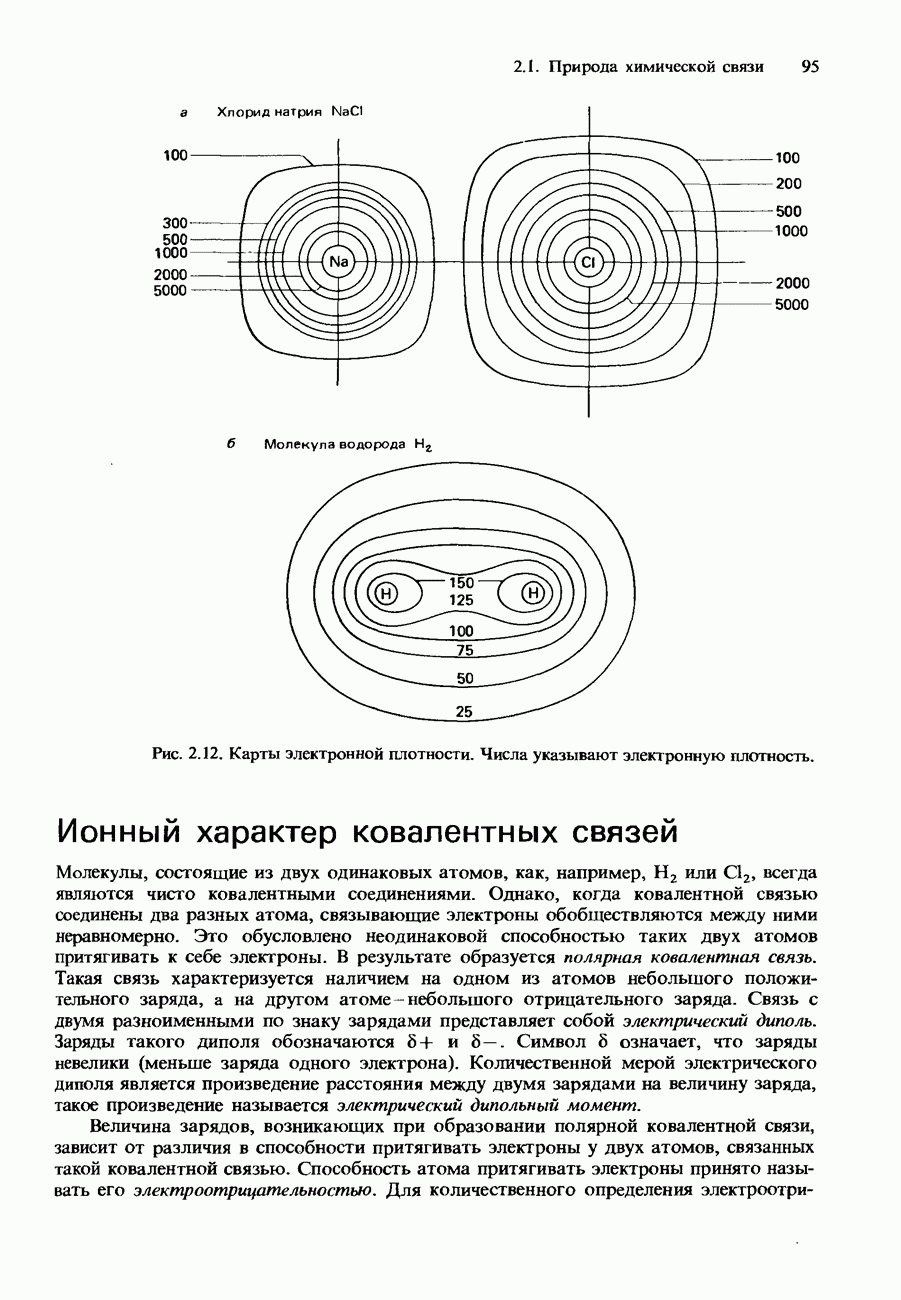
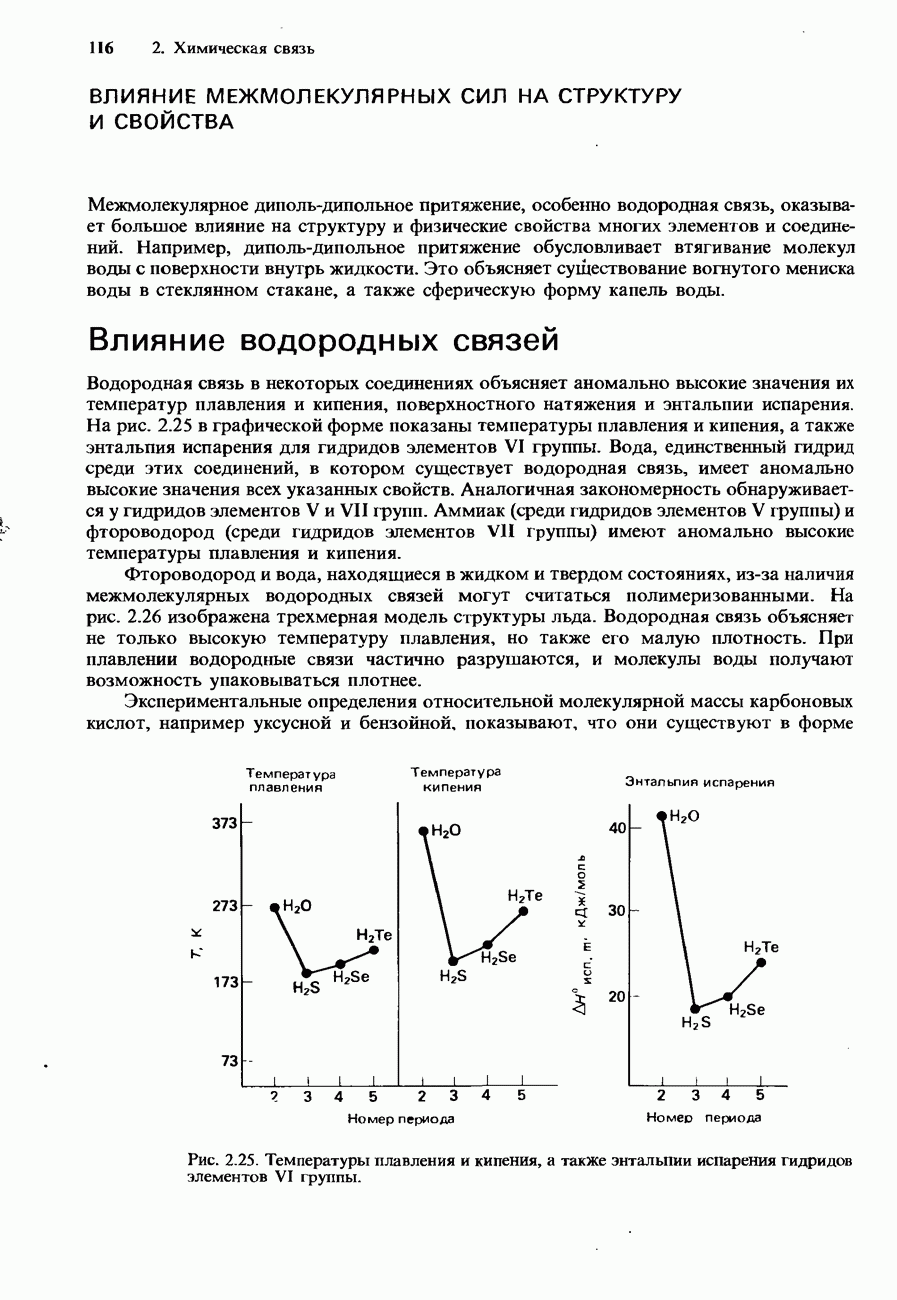
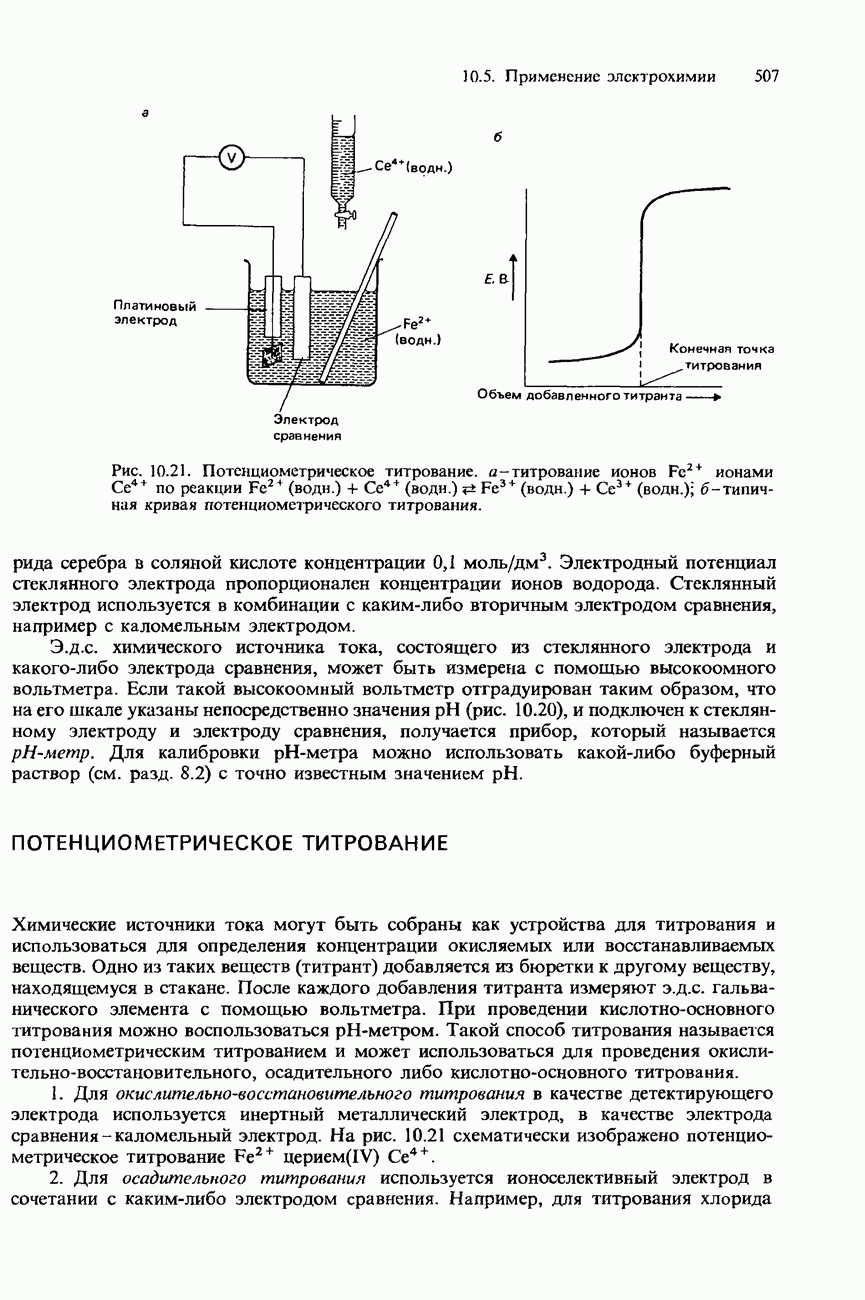
Рис. 6.23. Кривые давления пара для двух несмешивающихся жидкостей.

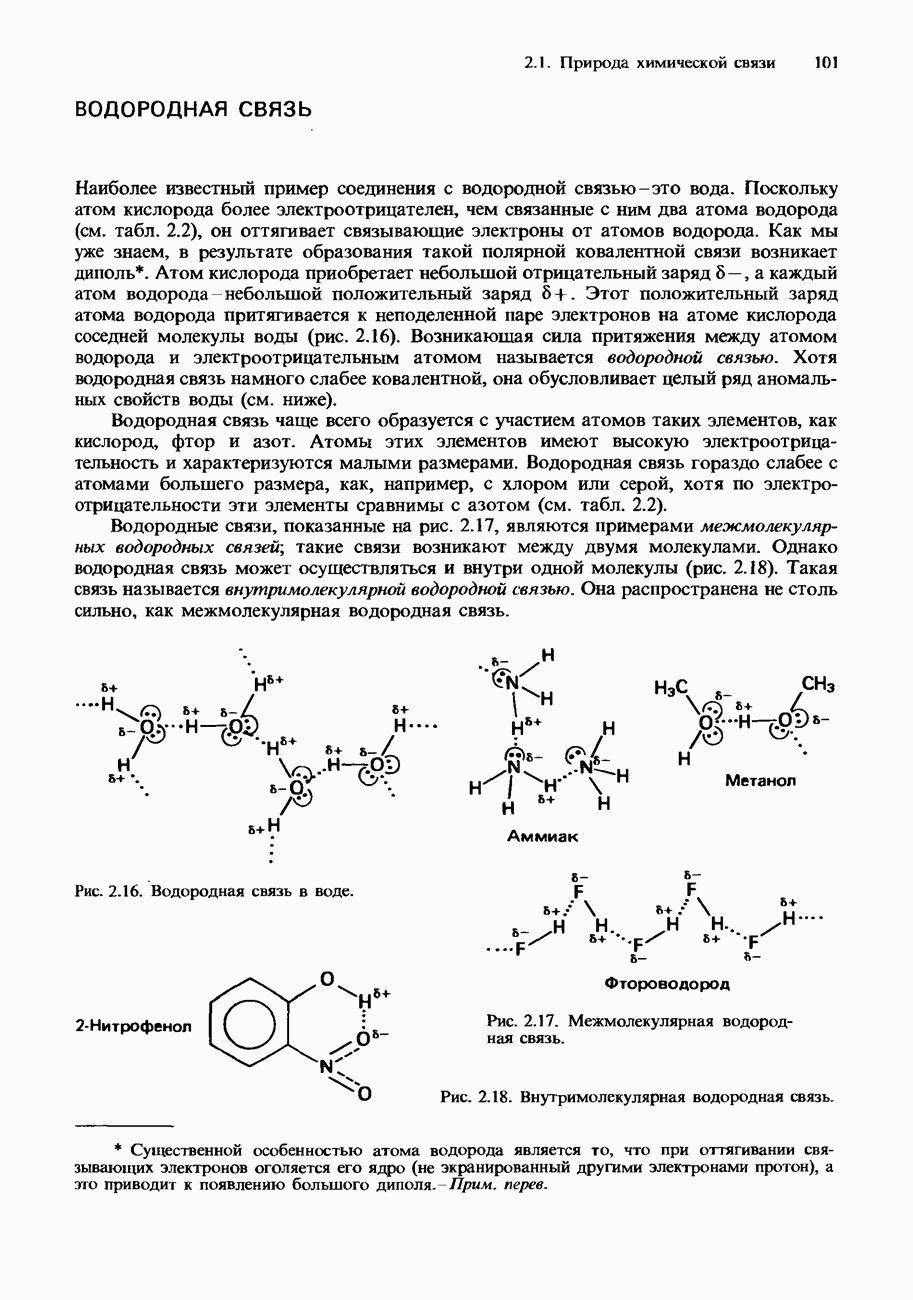
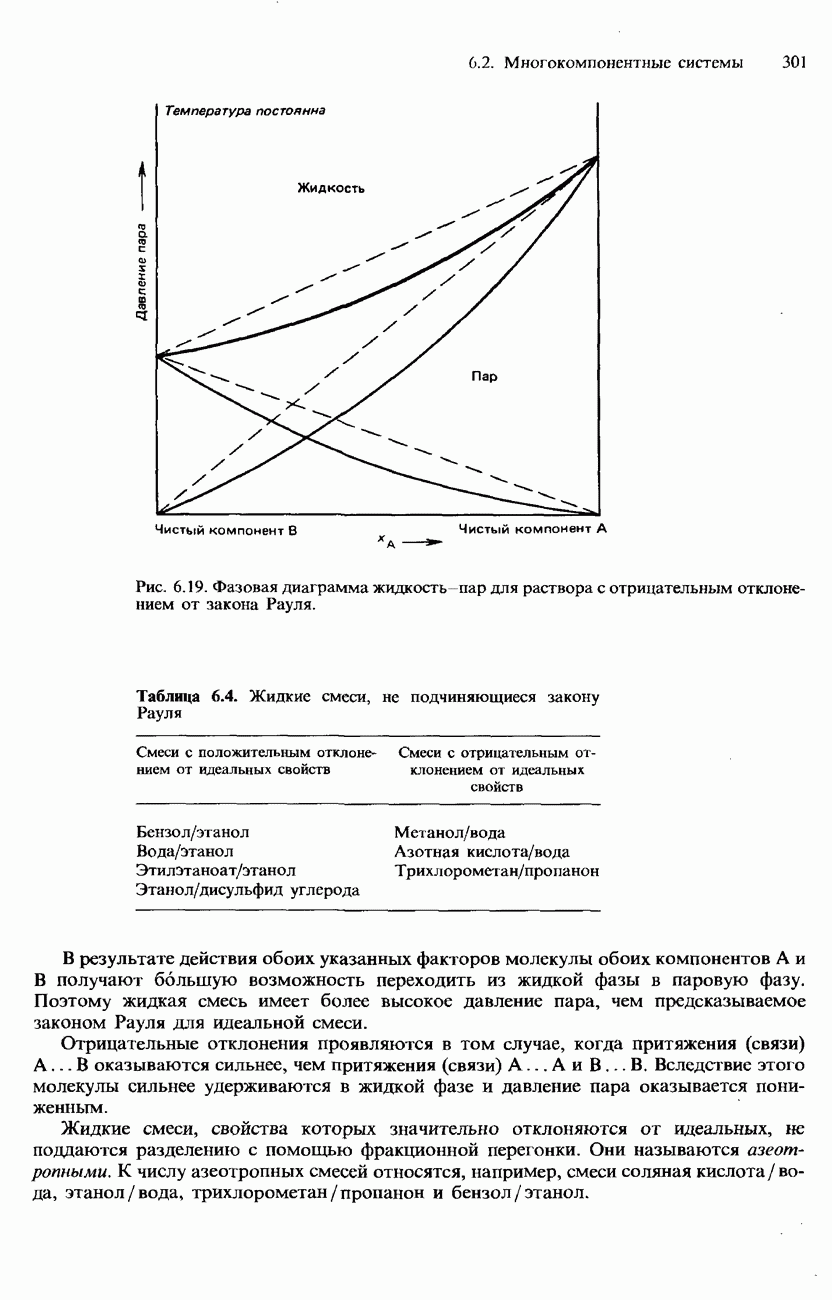
Рис. 6.24. Перегонка с паром нитробензола и воды.
Однако, если пропускать пар через жидкость, с которой вода не смешивается, давление пара повышается. Вследствие этого смесь кипит при пониженной температуре (рис. 6.23).
На рис. 6.24 показана схема установки, используемой для перегонки с паром. Требуемый продукт перегонки собирают в колбу и затем отделяют от воды с помощью делительной воронки.
Перегонку с паром используют в следующих целях:
1) для очистки таких жидкостей, как нитробензол или фениламин, которые имеют высокую температуру кипения. Перегонка при более низкой температуре устраняет
риск термического разложения жидкости. В настоящее время с этой целью вместо перегонки с паром предпочитают использовать вакуумную перегонку;
2) для экстрагирования растительных масел, например в парфюмерной промышленности.
Вычисление молярной массы с помощью перегонки с паром
Молярную массу жидкости, не смешивающейся с водой, можно вычислить на основании данных, полученных в результате ее перегонки с паром. Согласно закону Рауля, парциальное давление пара  жидкости А, молярная масса которой подлежит определению, и мольная доля
жидкости А, молярная масса которой подлежит определению, и мольная доля  этой жидкости связаны соотношением
этой жидкости связаны соотношением

Аналогичное соотношение можно записать также для воды

Исключая из этих двух уравнений рпот, получаем

Поскольку

где  - число молей жидкости А и воды соответственно, и
- число молей жидкости А и воды соответственно, и

то подстановка этих выражений в уравнение (1) дает соотношение

Из разд. 4.1 известно, что  где т - масса вещества в граммах, а М его молярная масса в граммах на моль. Подстановка этого выражения в уравнение (2) дает
где т - масса вещества в граммах, а М его молярная масса в граммах на моль. Подстановка этого выражения в уравнение (2) дает

Это уравнение позволяет вычислить молярную массу (МА) жидкости А.
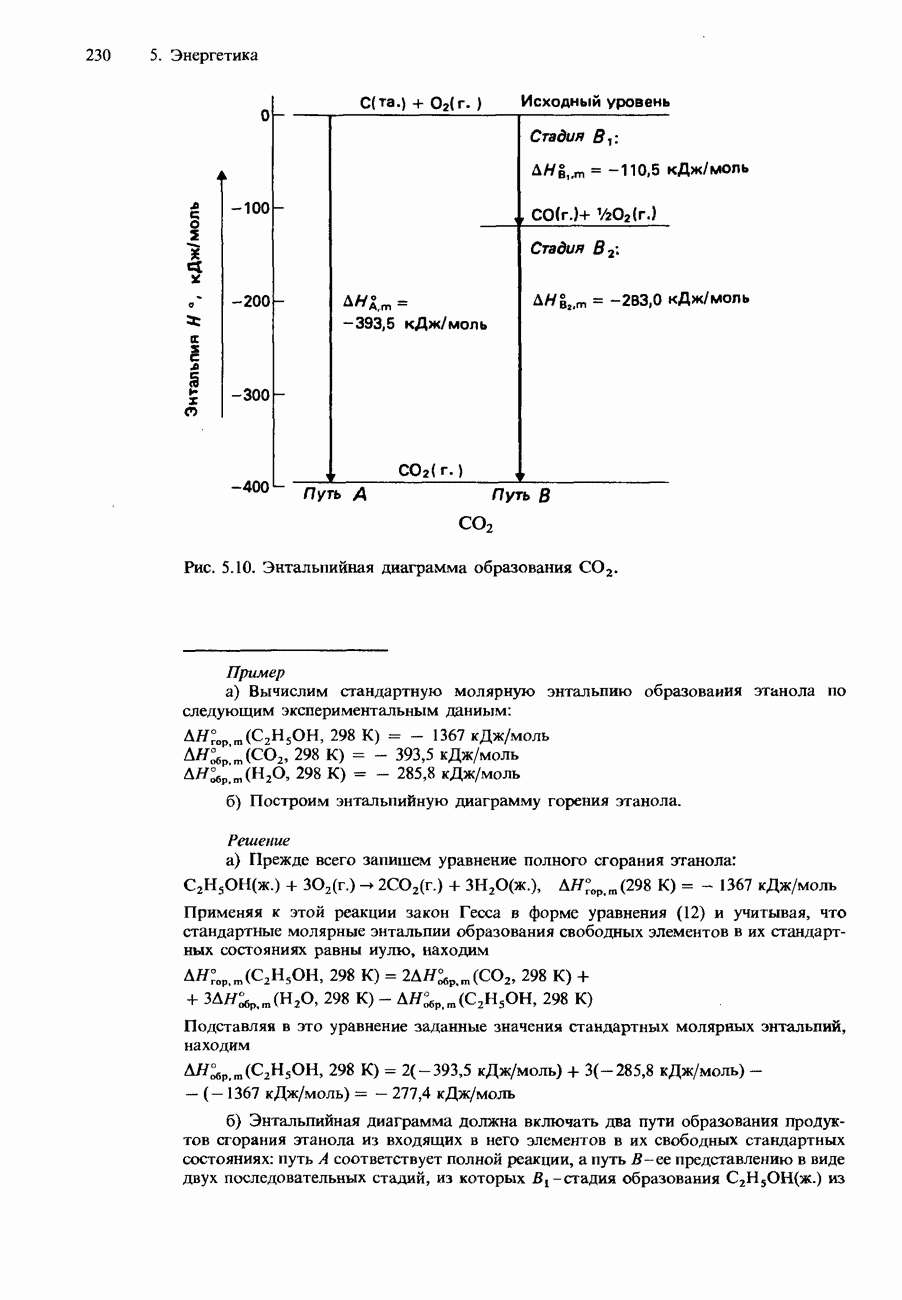
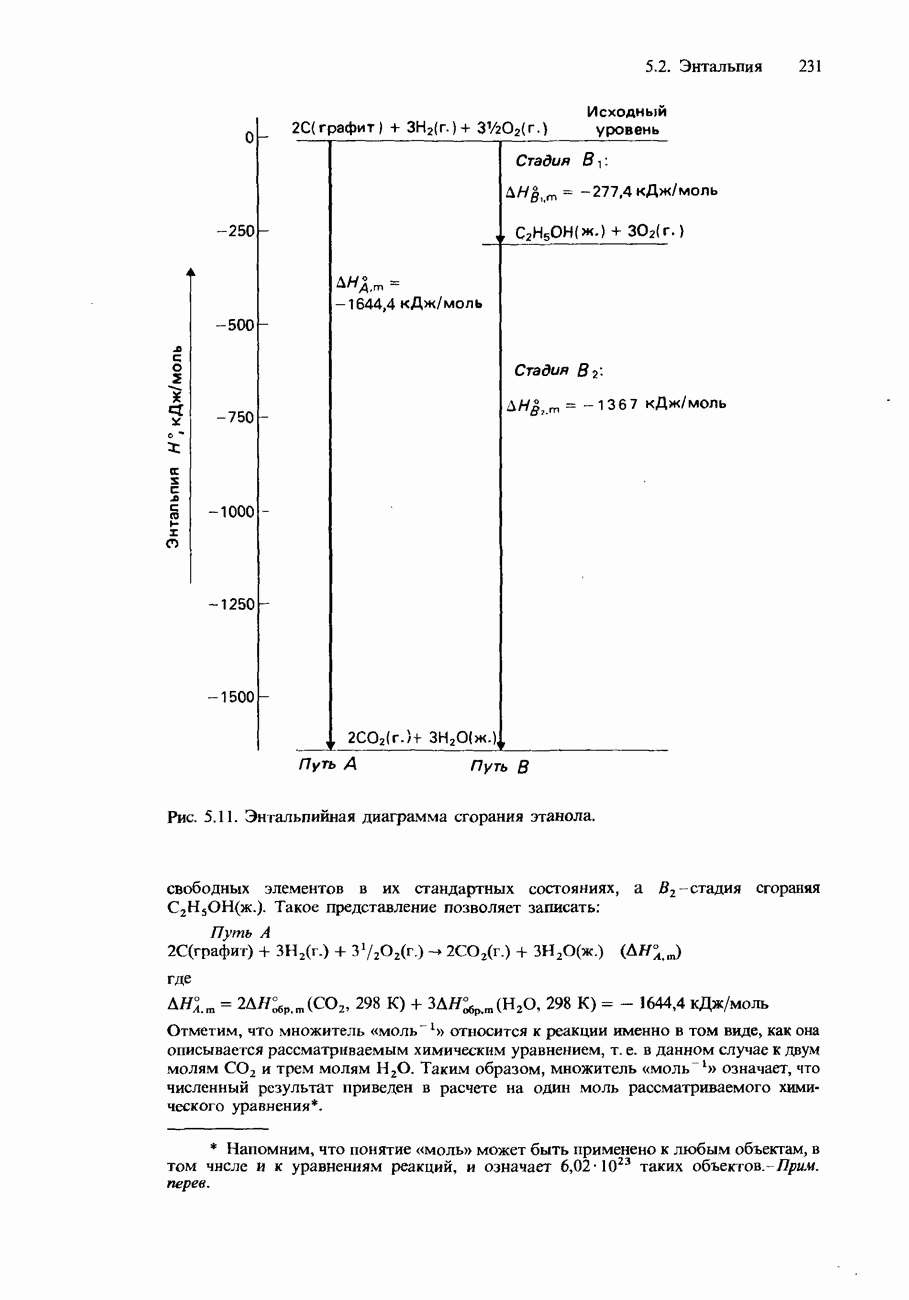
Пример
Образец фениламина  подвергался перегонке с паром при температуре
подвергался перегонке с паром при температуре  и давлении 1 атм. Установлено, что собранный дистиллат содержит 25,5 г воды и 7,4 г фениламина. Вычислим молярную массу фениламина.
и давлении 1 атм. Установлено, что собранный дистиллат содержит 25,5 г воды и 7,4 г фениламина. Вычислим молярную массу фениламина.
Решение
Для нахождения молярной массы  воспользуемся уравнением (3). Оно позволяет записать
воспользуемся уравнением (3). Оно позволяет записать

Поскольку смесь кипела при давлении 1 атм (760 мм  сумма парциальных давлений обоих компонентов должна быть равна 1 атм:
сумма парциальных давлений обоих компонентов должна быть равна 1 атм:

Справочные данные показывают, что при  Следовательно,
Следовательно,

Подставляя это значение и экспериментальные данные в записанное выше уравнение, получаем

Отметим, что молярная масса  вычисленная по его формуле, равна 93,13 г/моль.
вычисленная по его формуле, равна 93,13 г/моль.
Закон распределения
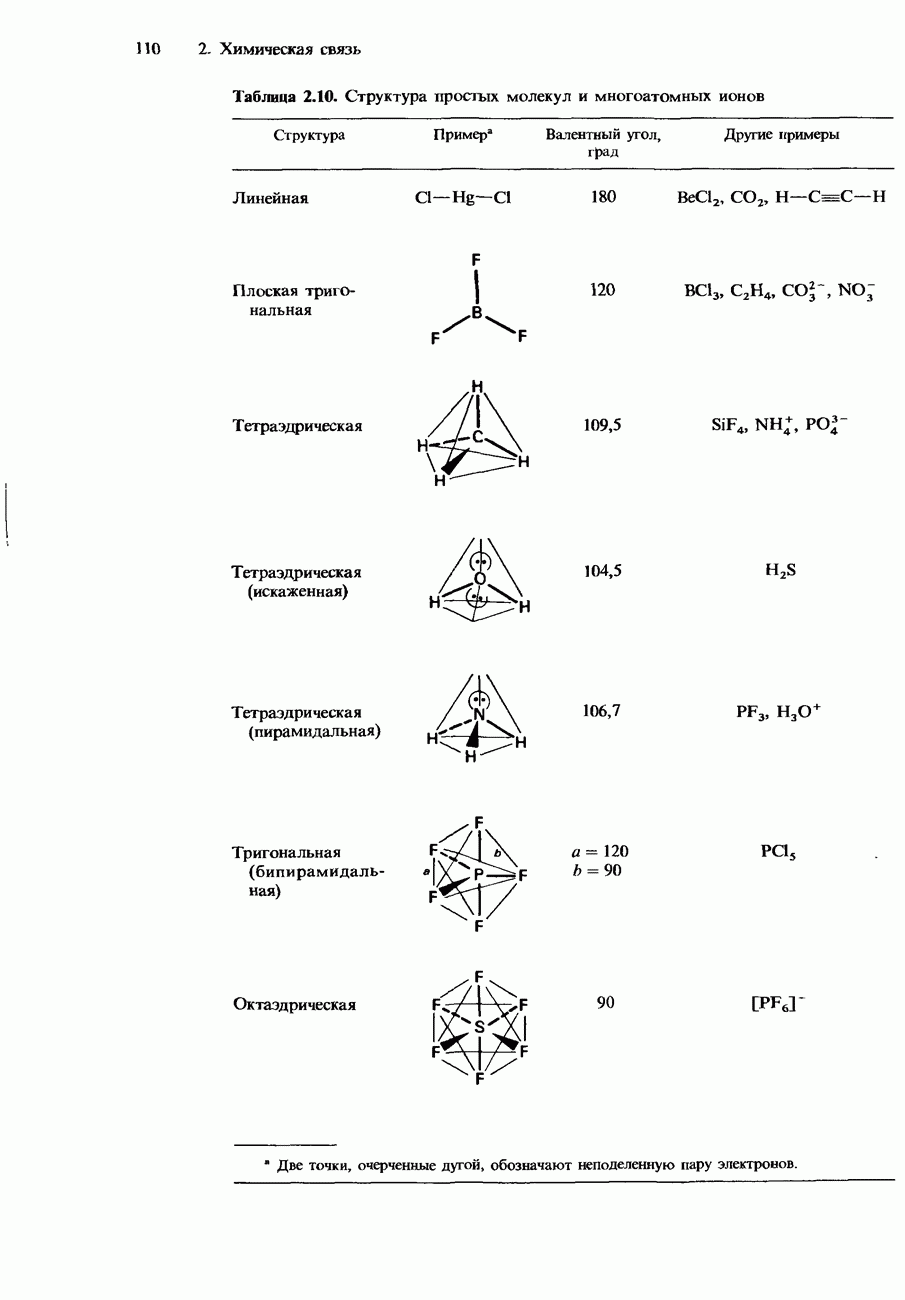
Если какое-либо вещество растворимо в двух несмешивающихся жидкостях, то при его растворении в смеси двух таких жидкостей оно само распределяется между ними. Отношение, в котором происходит это распределение, определяется законом распределения. Он утверждает, что растворимое вещество распределяется между двумя несмешивающимися жидкостями в постоянном отношении концентраций, не зависящем от количества добавляемого растворимого вещества.
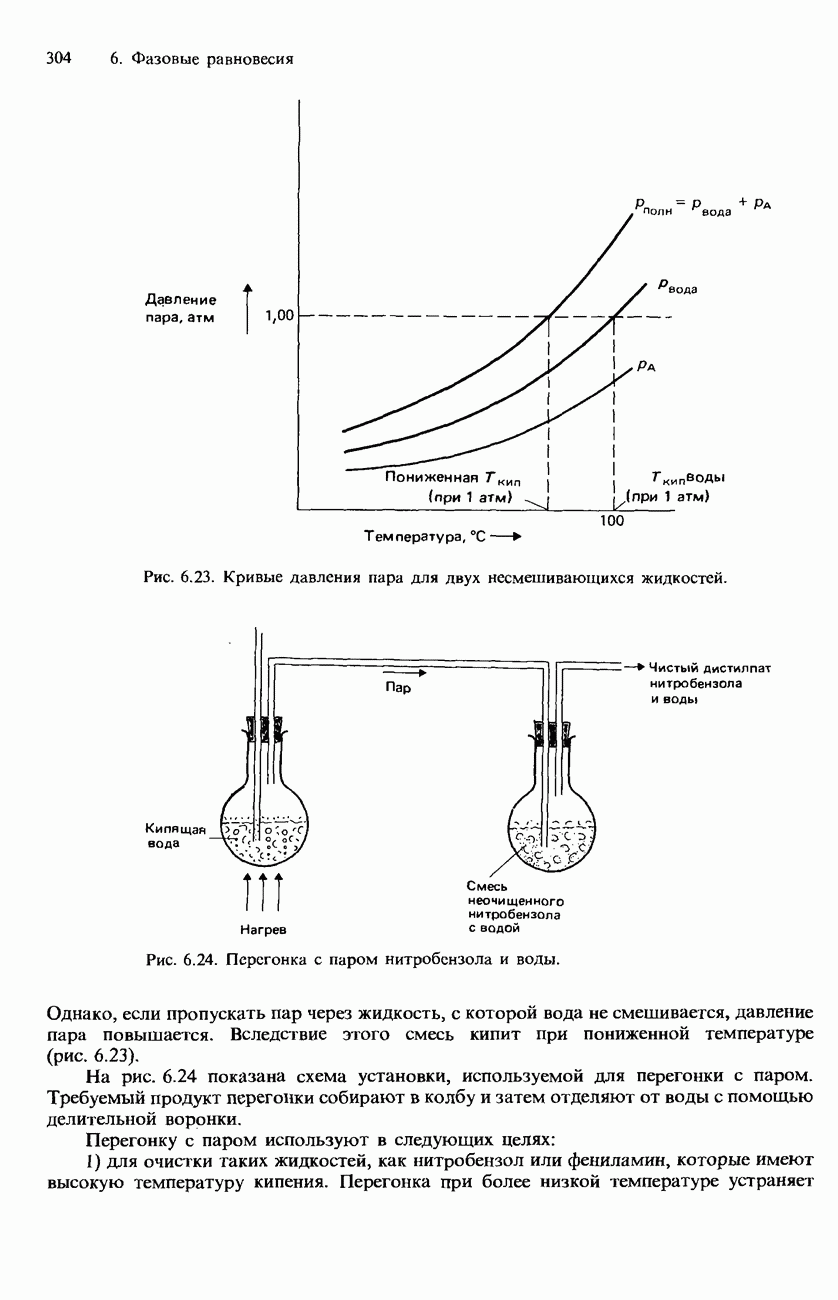
Закон распределения основан на экспериментальных наблюдениях. Рассмотрим, например, распределение иода между двумя несмешивающимися растворителями - водой и тетрахлорометаном (рис. 6.25). Если встряхивать иод с этими двумя растворителями, часть его растворится в воде, а часть в тетрахлорометане  . В конце концов в системе устанавливается динамическое равновесие. При этом скорость, с которой иод переходит из
. В конце концов в системе устанавливается динамическое равновесие. При этом скорость, с которой иод переходит из  в воду, уравнивается со скоростью, с которой иод переходит из воды в
в воду, уравнивается со скоростью, с которой иод переходит из воды в 

Независимо от того, какое количество иода используется в этом эксперименте, окончательное отношение концентраций оказывается постоянным. Полученная постоянная называется коэффициентом распределения К.

При  значение постоянной К для рассматриваемого равновесия равно 85. Это означает, что концентрация иода в
значение постоянной К для рассматриваемого равновесия равно 85. Это означает, что концентрация иода в  в 85 раз больше, чем в воде. Столь большое различие объясняется тем, что иод является неполярным растворяемым веществом. Поэтому он гораздо лучше растворим в неполярных растворителях, подобных
в 85 раз больше, чем в воде. Столь большое различие объясняется тем, что иод является неполярным растворяемым веществом. Поэтому он гораздо лучше растворим в неполярных растворителях, подобных  , чем в полярных, подобных воде. Коэффициент распределения иода в бензоле и воде достигает 400.
, чем в полярных, подобных воде. Коэффициент распределения иода в бензоле и воде достигает 400.
Закон распределения выполняется лишь при определенных условиях, а именно: 1) при постоянной температуре; 2) при достаточном разбавлении обоих растворов; 3) при условии, что растворенное вещество не реагирует, не ассоциирует и не диссоциирует в обоих растворителях.
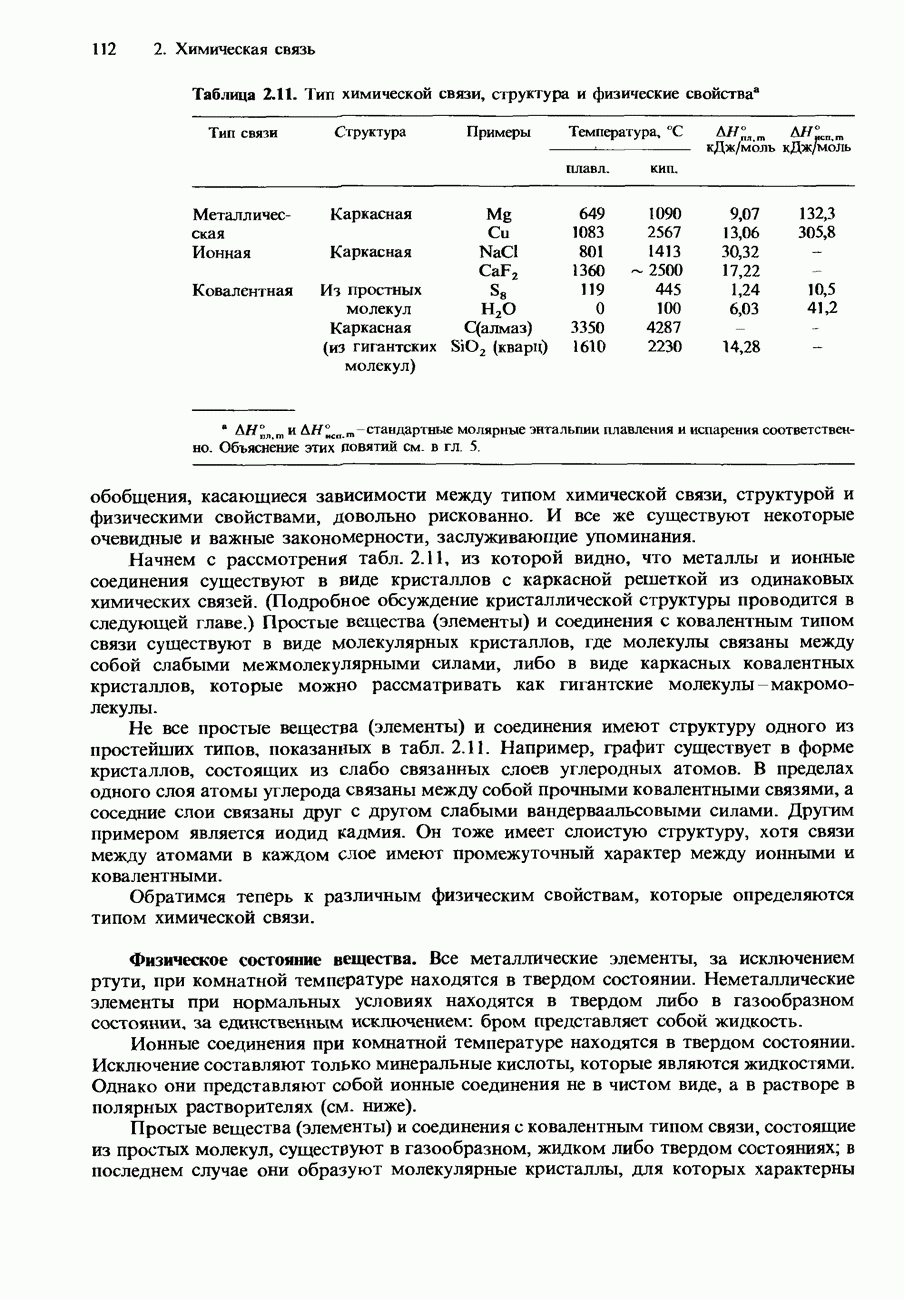
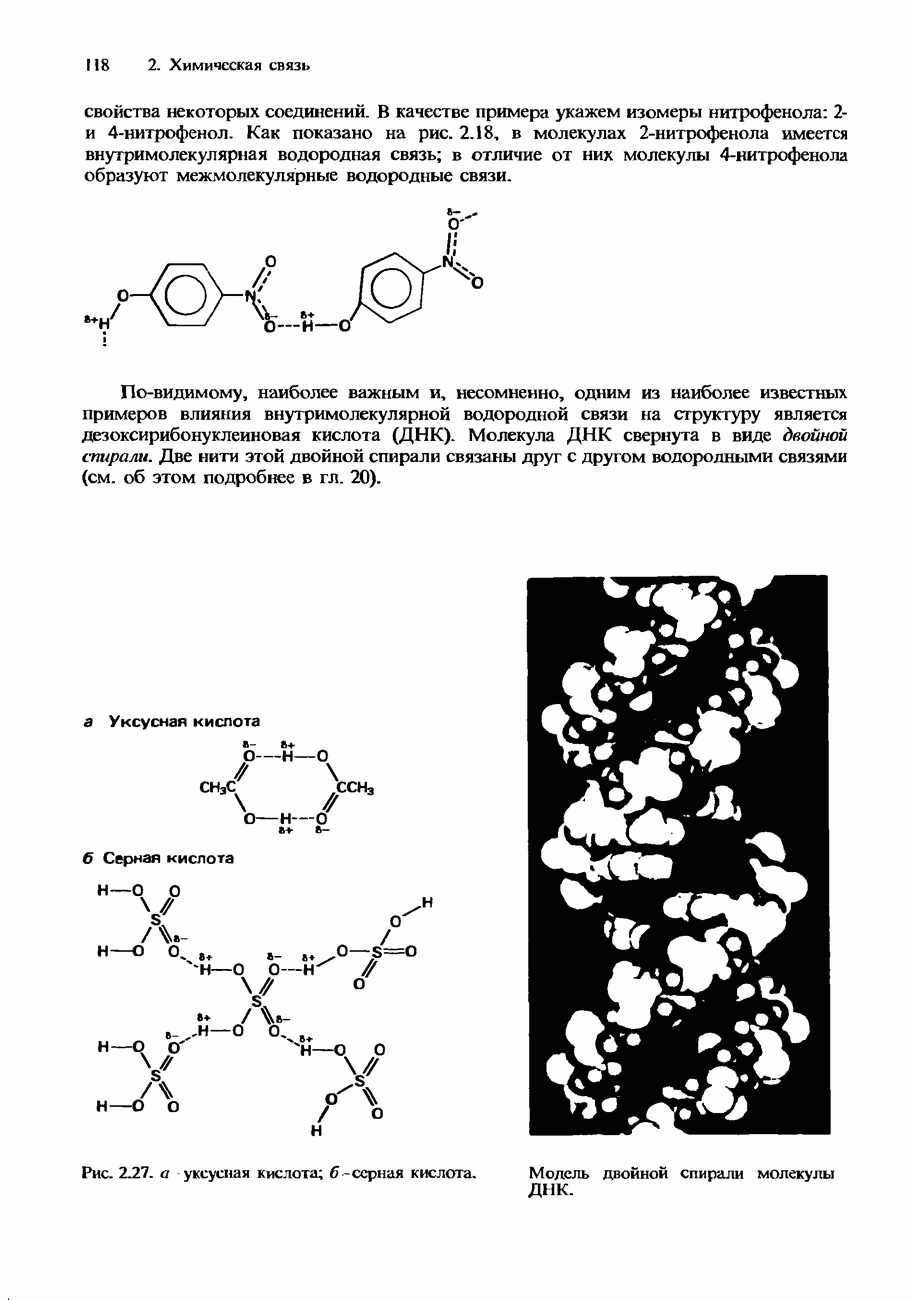
Например, коэффициент распределения для бензойной кислоты в бензоле и воде возрастает при повышении концентраций в обоих слоях. Это обусловлено образованием димеров бензойной кислоты в слое бензола. Образование димеров происходит вследствие возникновения водородных связей между двумя молекулами бензойной кислоты (рис. 6.26, а также материал гл. 2 и 3).

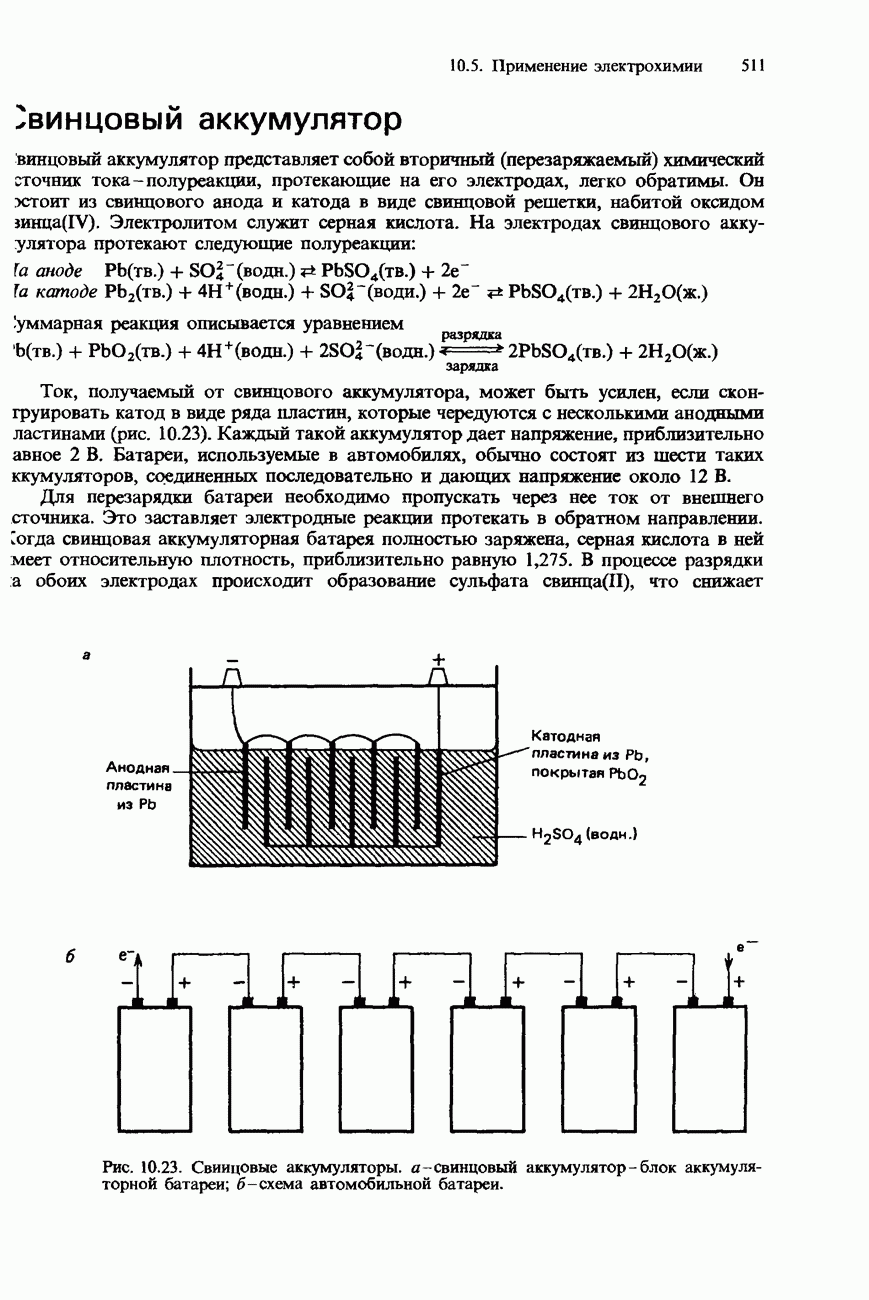
Рис. 6.25. Распределение иода между двумя несмешивающимися жидкостями.

Рис. 6.26. Ассоциация бензойной кислоты.

Рис. 6.27. Делительная воронка.
Применение закона распределения
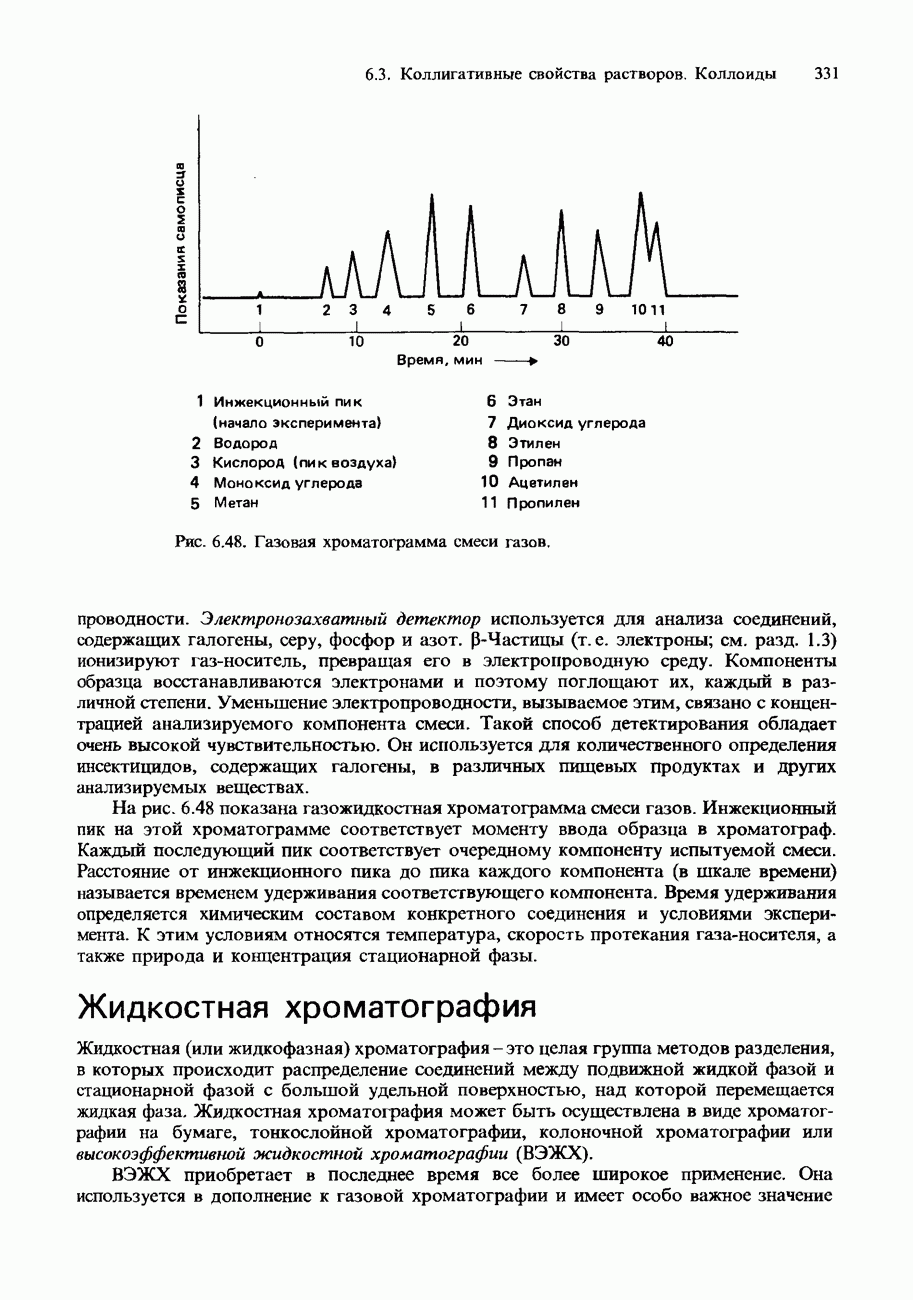
Закон распределения имеет ряд важных применений. Наиболее важные из них - жидкофазная хроматография и экстракция растворителем. Подробное обсуждение хроматографии проводится в разд. 6.3, поэтому здесь мы обсудим только экстракцию растворителем.
Экстракция растворителем
Две несмешивающиеся жидкости иногда используются как селективные растворители для компонентов какой-либо смеси. Такую смесь сначала встряхивают с двумя несмешивающимися жидкостями, а затем отделяют одну жидкость от другой. Каждый слой по нескольку раз подвергают экстракции с другим растворителем.
Такой способ используется для выделения солей урана из продуктов ядерного деления. Например, уранильную соль  можно отделить от
можно отделить от  с помощью бутанола и воды. С этой целью может использоваться методика противоточной экстракции. Уранильная соль лучше растворима в бутаноле,
с помощью бутанола и воды. С этой целью может использоваться методика противоточной экстракции. Уранильная соль лучше растворима в бутаноле,  лучше растворим в воде. Один из растворителей пропускают над твердой смесью, находящейся в колонке или башне. Затем над смесью в противоположном направлении пропускают другой растворитель. Этот процесс повторяют несколько раз.
лучше растворим в воде. Один из растворителей пропускают над твердой смесью, находящейся в колонке или башне. Затем над смесью в противоположном направлении пропускают другой растворитель. Этот процесс повторяют несколько раз.
По-видимому, наиболее известным примером применения экстракции растворителем
рителем в лабораторной практике является экстракция эфиром. Она используется для извлечения продуктов органического синтеза из их водного раствора. Водный раствор встряхивают с диэтиловым эфиром в делительной воронке и после отстаивания слои разделяют (рис. 6.27). Это позволяет удалить из продукта неорганические примеси, растворимые в воде. Раствор может быть подвергнут многократному разделению. В конце концов эфир выпаривают, получая чистый органический продукт.
Эта методика удобна в тех случаях, когда продукт представляет собой летучее или термически неустойчивое вещество. В таких случаях выпаривание растворителя должно производиться при низкой температуре. Диэтиловый эфир имеет температуру кипения 34,5°С и поэтому является очень подходящим растворителем для такой цели, однако его можно применять только при условии, что в лаборатории нет открытого пламени! Повторные экстракции с использованием небольших порций растворителя более эффективны, чем однократное использование большого объема растворителя.
| << Предыдущий параграф | Следующий параграф >> |
- ОТ ПЕРЕВОДЧИКА
- ПРЕДИСЛОВИЕ АВТОРА К РУССКОМУ ИЗДАНИЮ
- ПРЕДИСЛОВИЕ
- 1. СТРОЕНИЕ АТОМА
- 1.1. Субатомные частицы
- Модели атома
- Новые элементарные частицы
- МАССА АТОМА
- МАСС-СПЕКТРОМЕТРИЯ
- 1.2 Электронное строение атомов
- Связь между спектральными линиями и электронами (открытие Бора)
- Применение возбуждения электронов на практике
- Атомный спектр испускания водорода
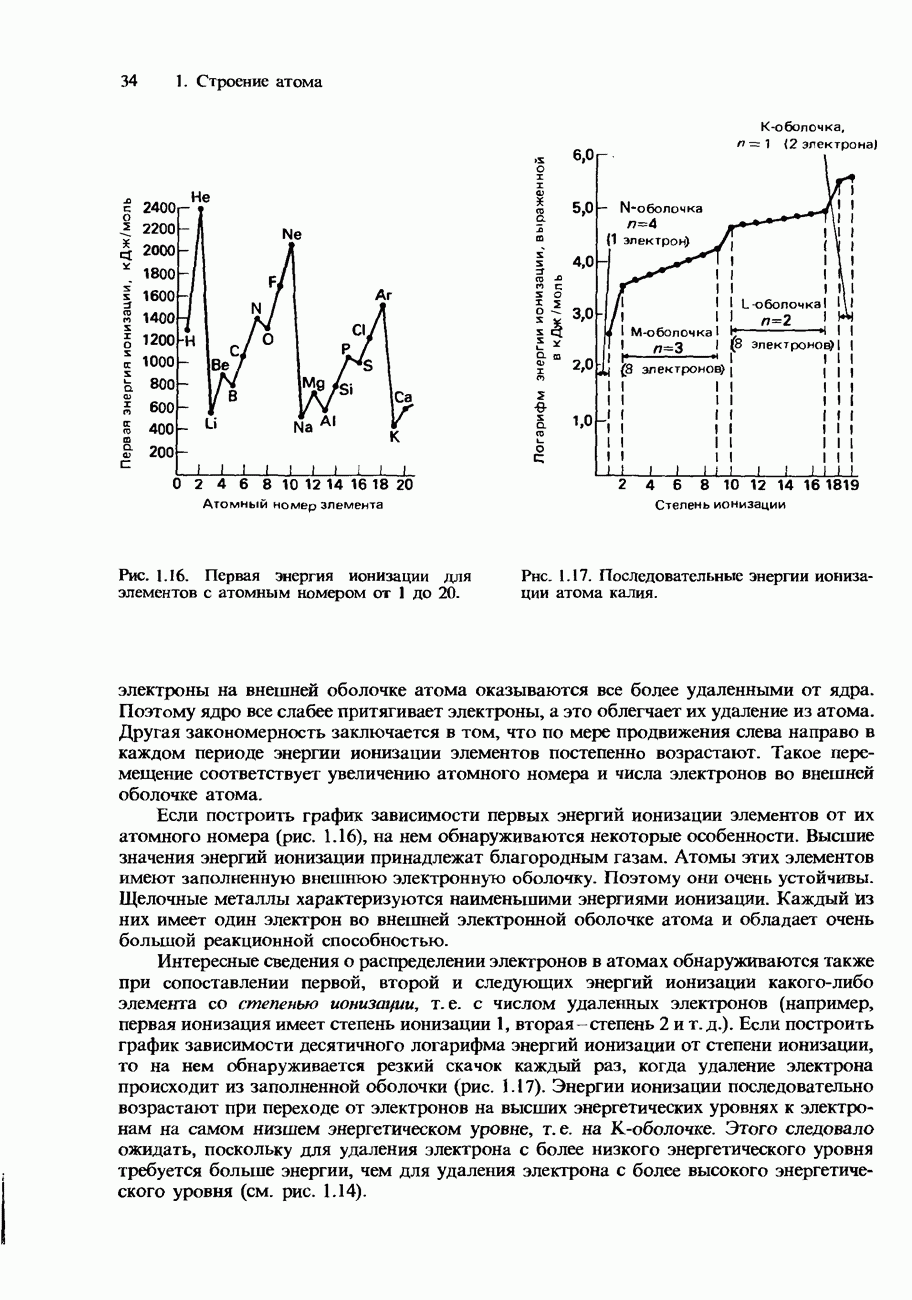
- ЭНЕРГИИ ИОНИЗАЦИИ
- Рассмотрение энергий ионизации в рамках модели атома, предложенной Бором
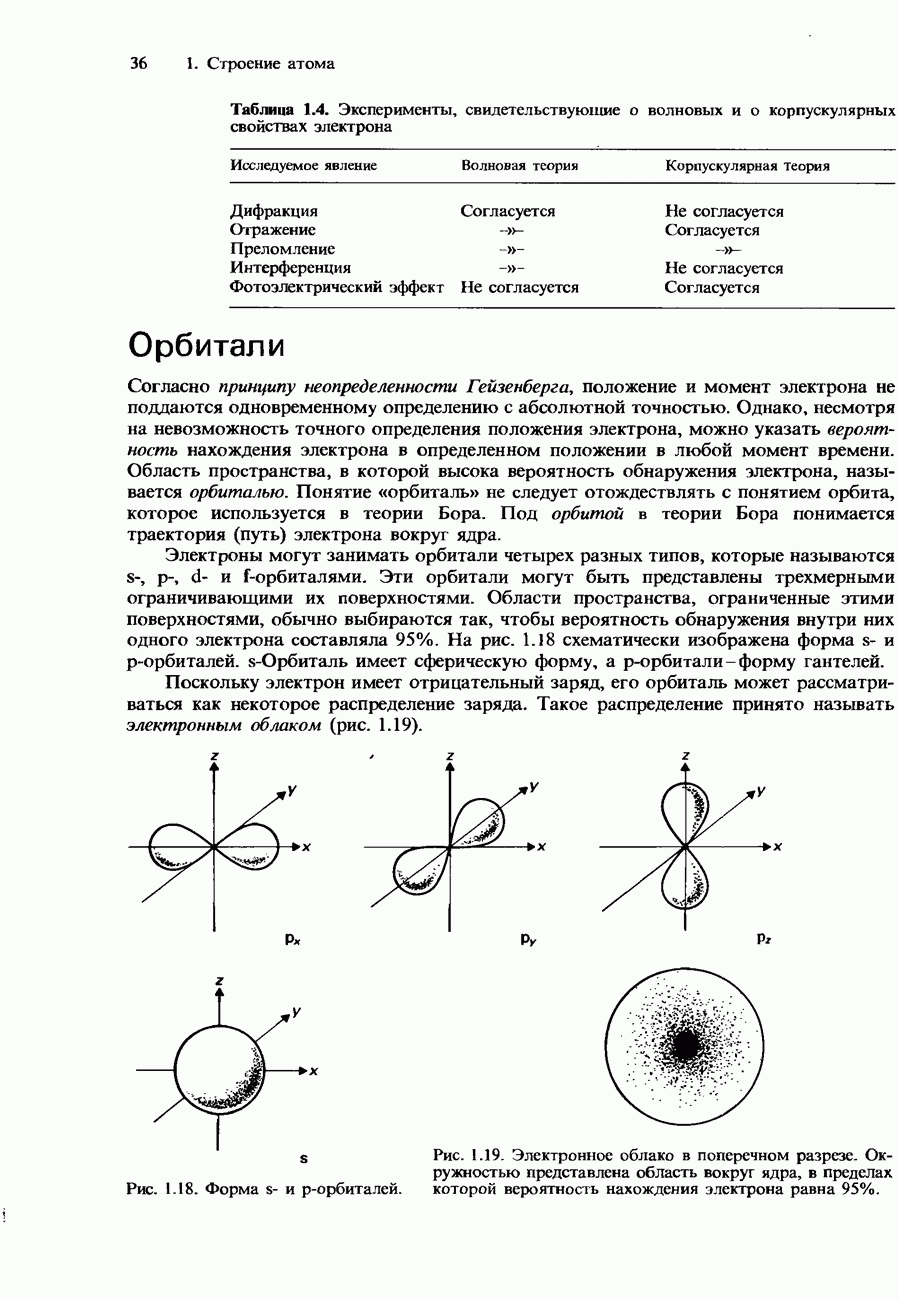
- ВОЛНОВАЯ ПРИРОДА ЭЛЕКТРОНА
- Орбитали
- КВАНТОВЫЕ ЧИСЛА
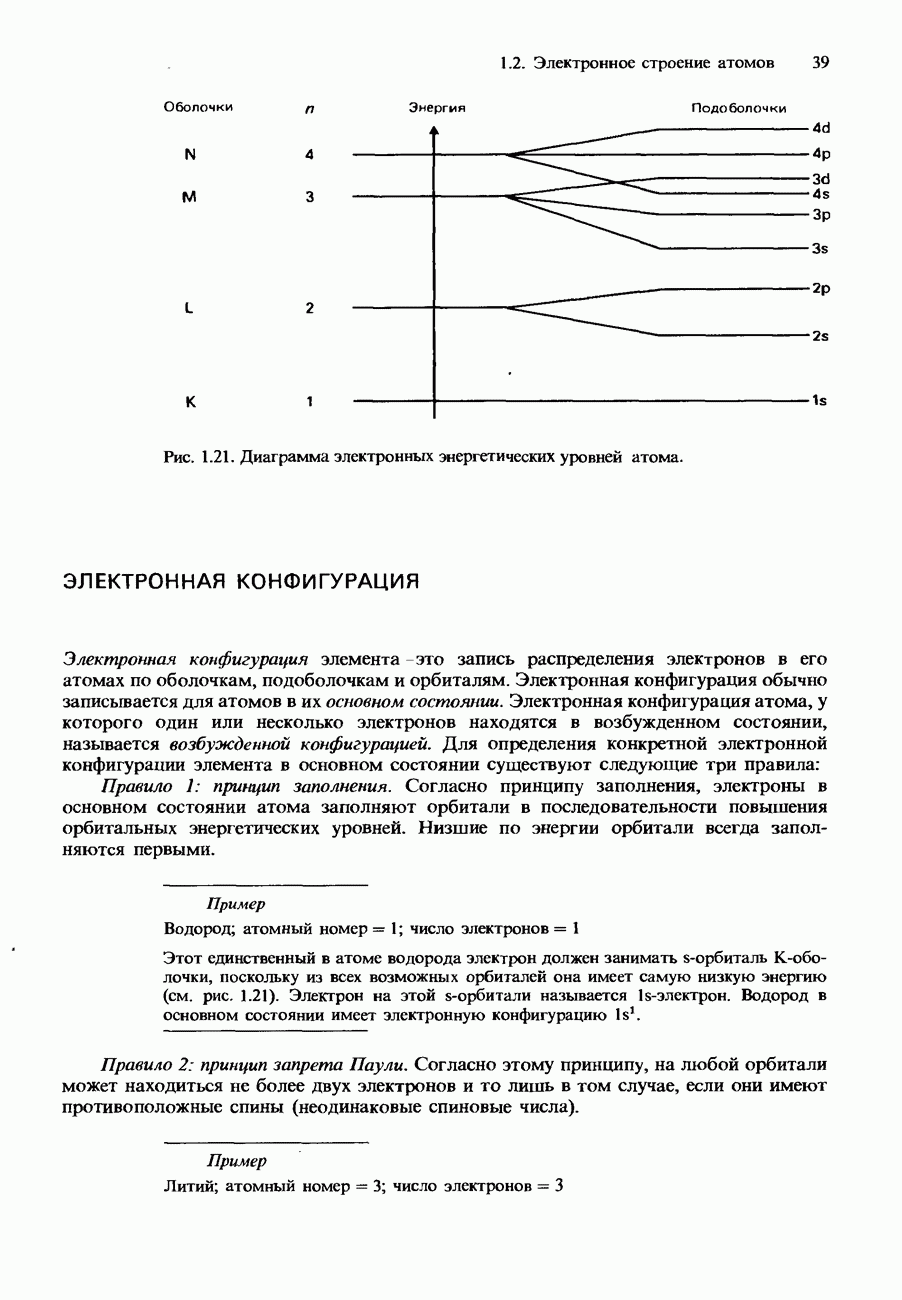
- ЭЛЕКТРОННАЯ КОНФИГУРАЦИЯ
- 1.3 Радиоактивность
- ИОНИЗИРУЮЩЕЕ ИЗЛУЧЕНИЕ
- Обнаружение и измерение радиоактивности
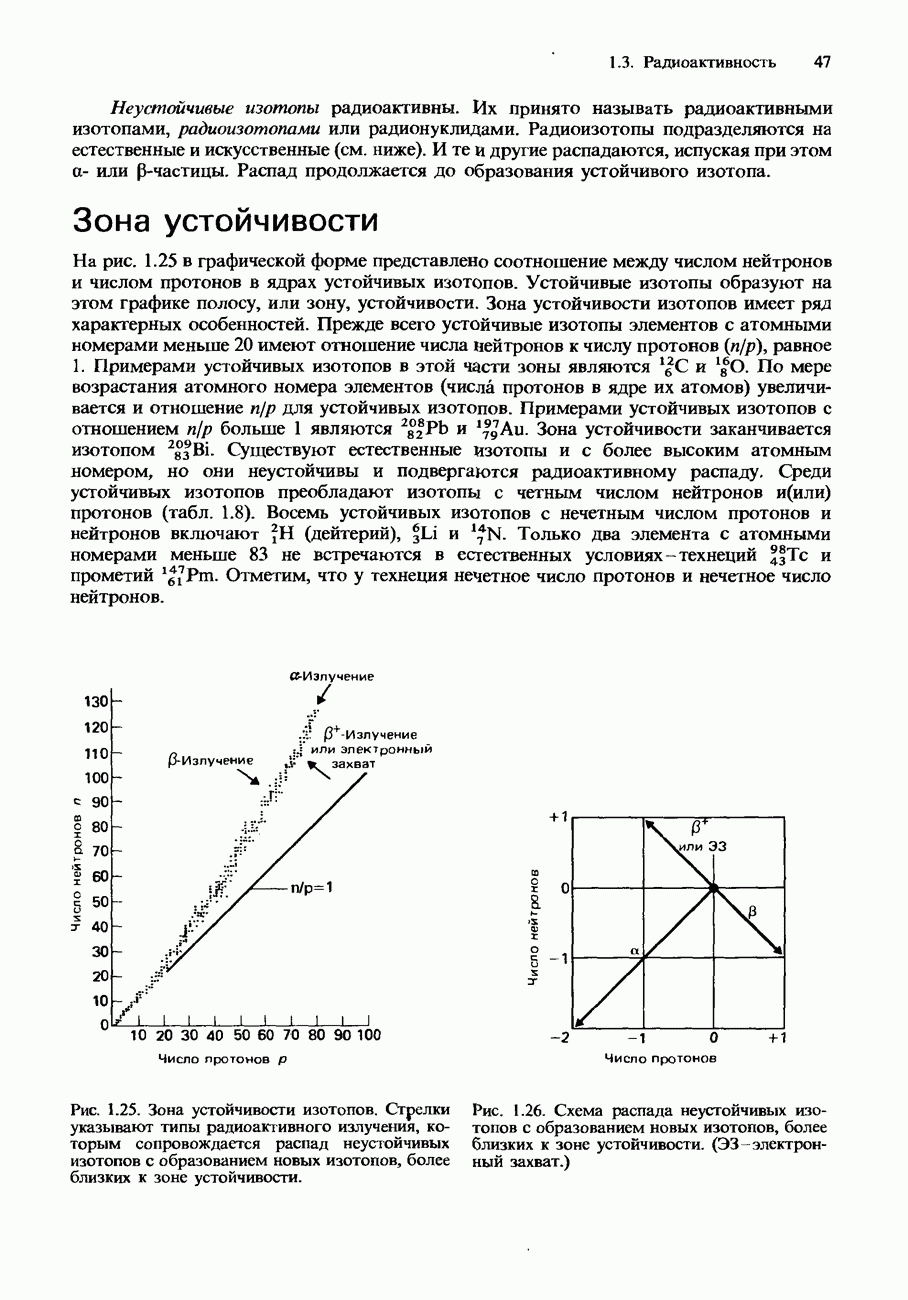
- УСТОЙЧИВЫЕ И НЕУСТОЙЧИВЫЕ ИЗОТОПЫ
- Зона устойчивости
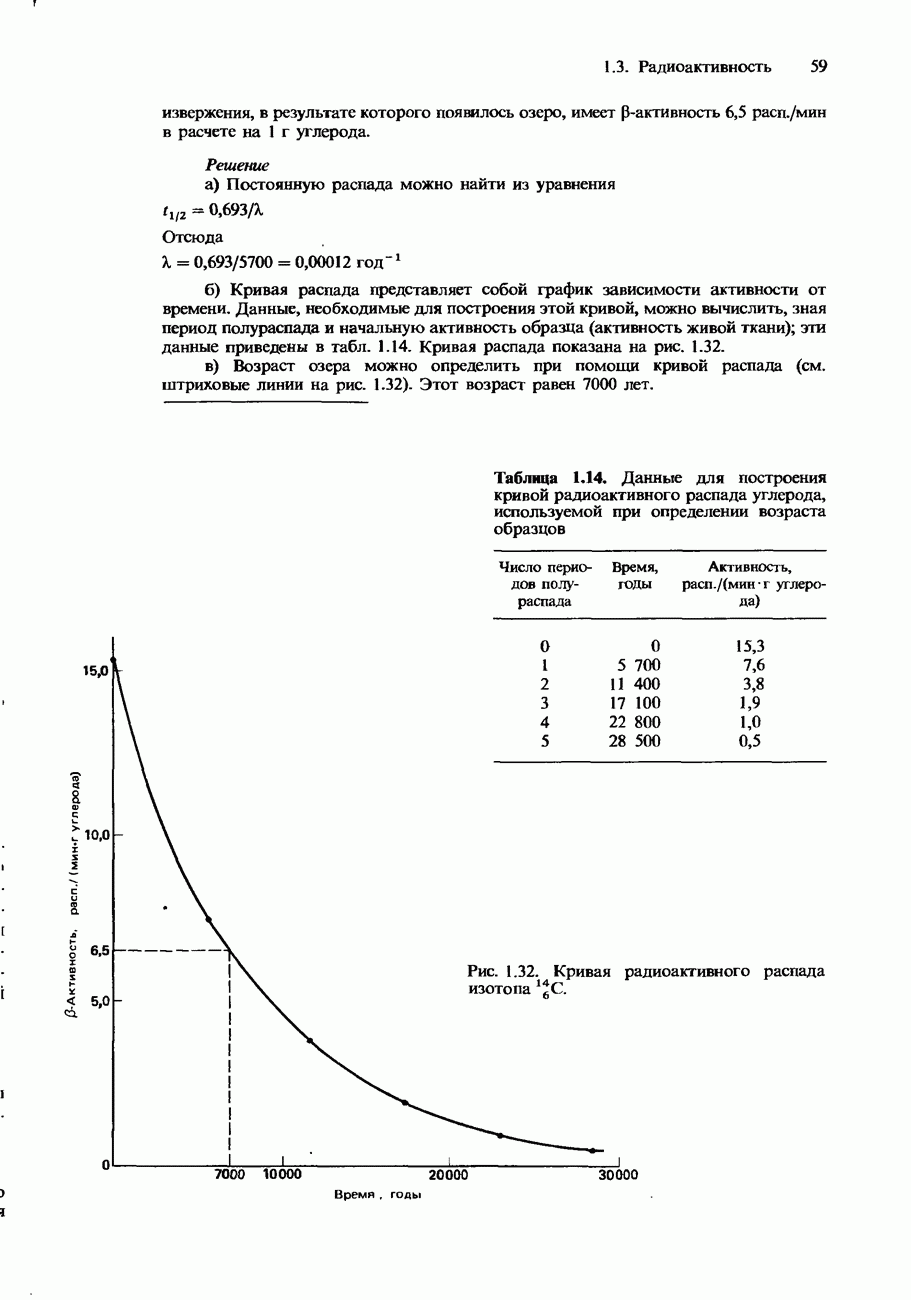
- Период полураспада
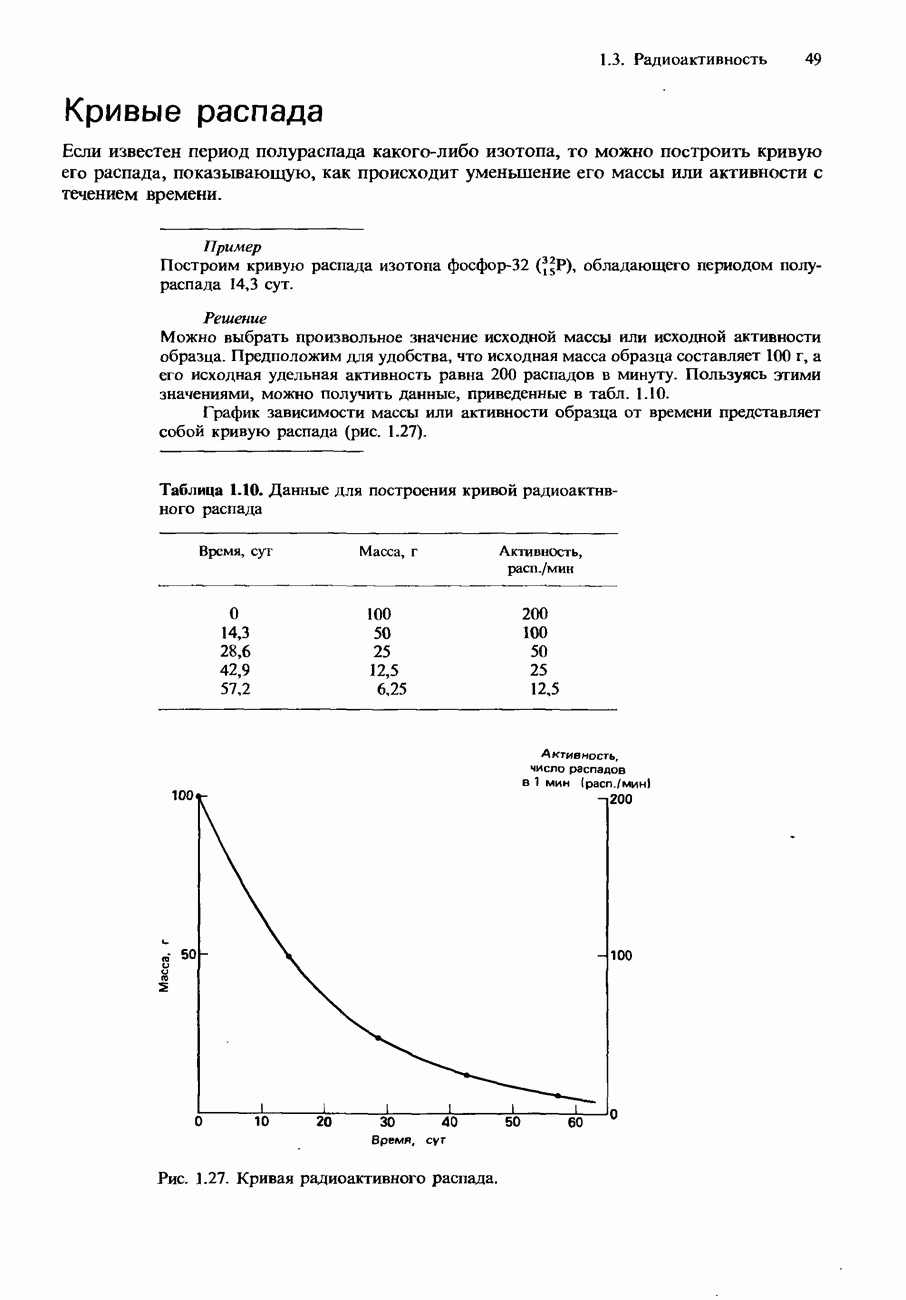
- Кривые распада
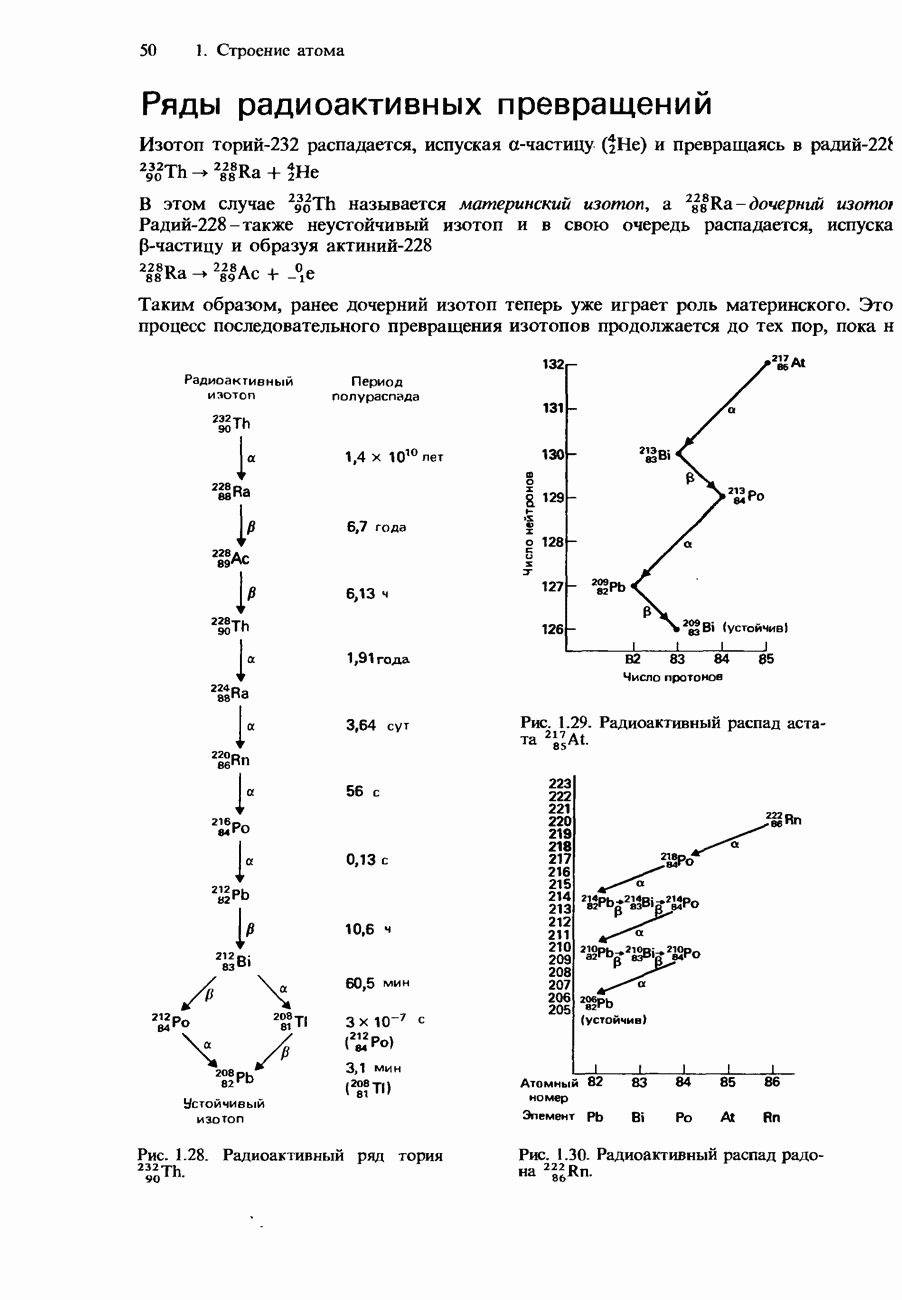
- Ряды радиоактивных превращений
- Естественные радиоизотопы
- ИСКУССТВЕННЫЕ ЯДЕРНЫЕ ПРЕВРАЩЕНИЯ
- Ускорители элементарных частиц
- Трансурановые элементы
- ПРИМЕНЕНИЯ ИЗОТОПОВ
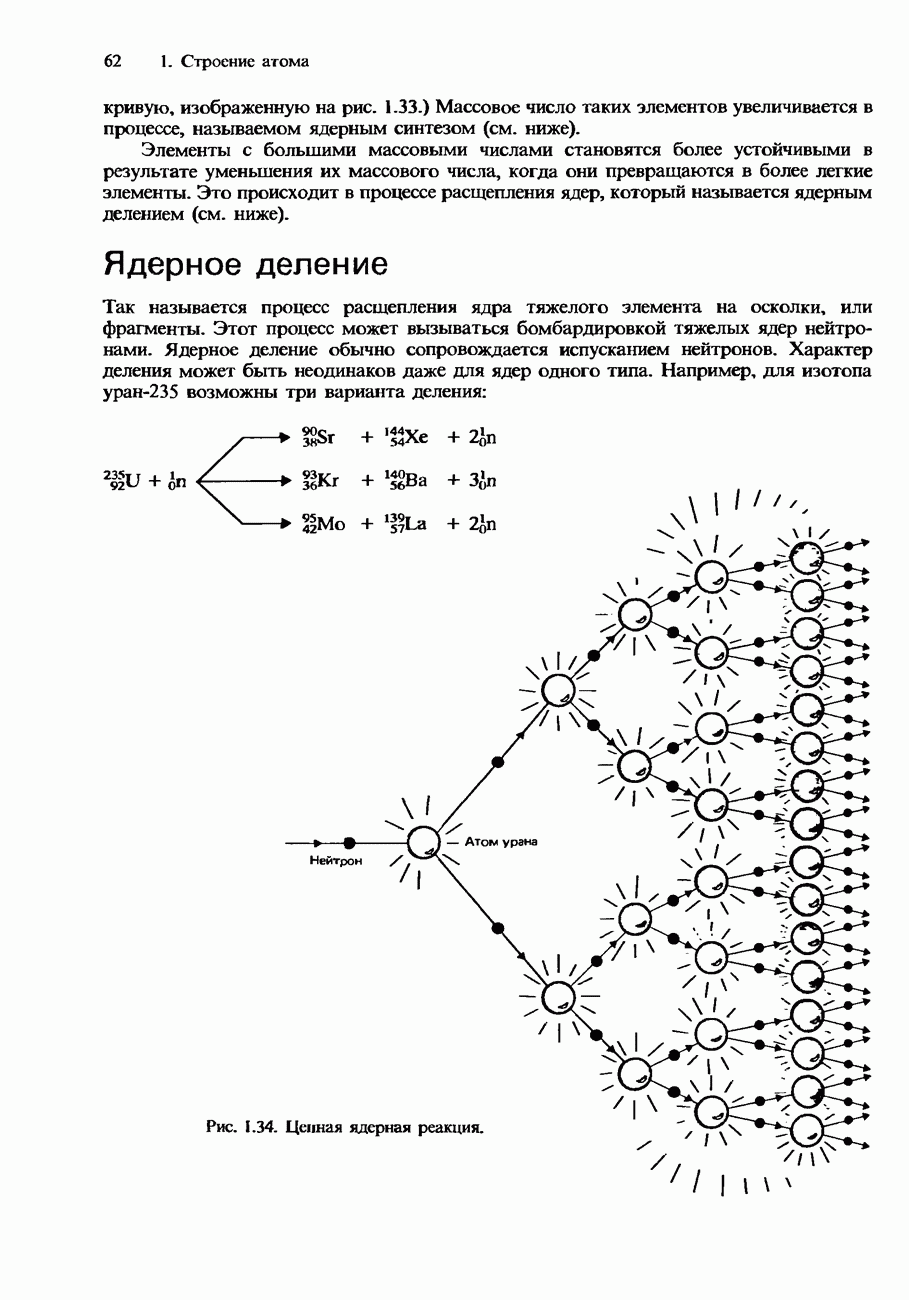
- ЯДЕРНОЕ ДЕЛЕНИЕ И ЯДЕРНЫЙ СИНТЕЗ
- Ядерное деление
- Ядерный синтез
- Ядерный синтез в звездах
- ЯДЕРНАЯ ЭНЕРГИЯ
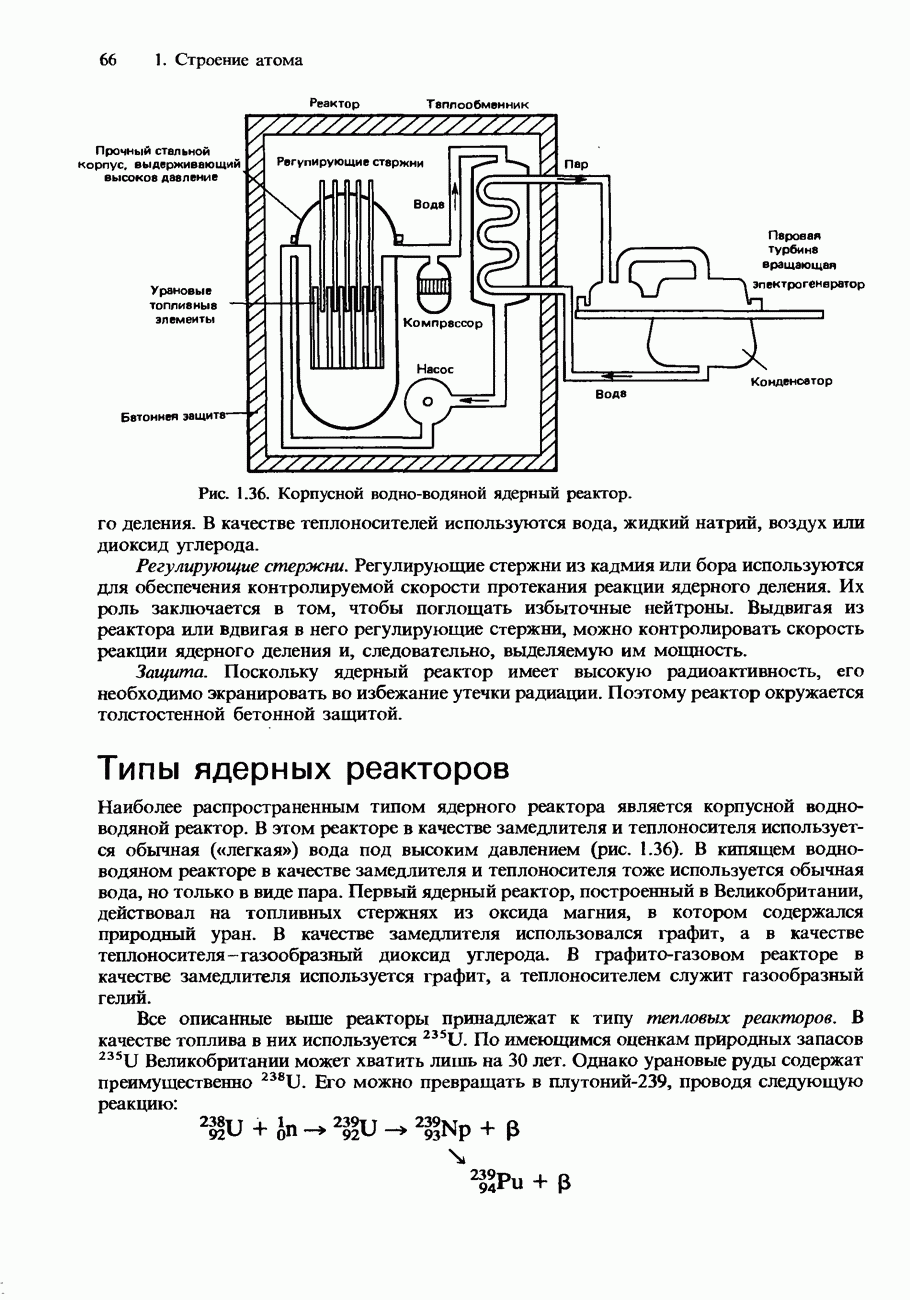
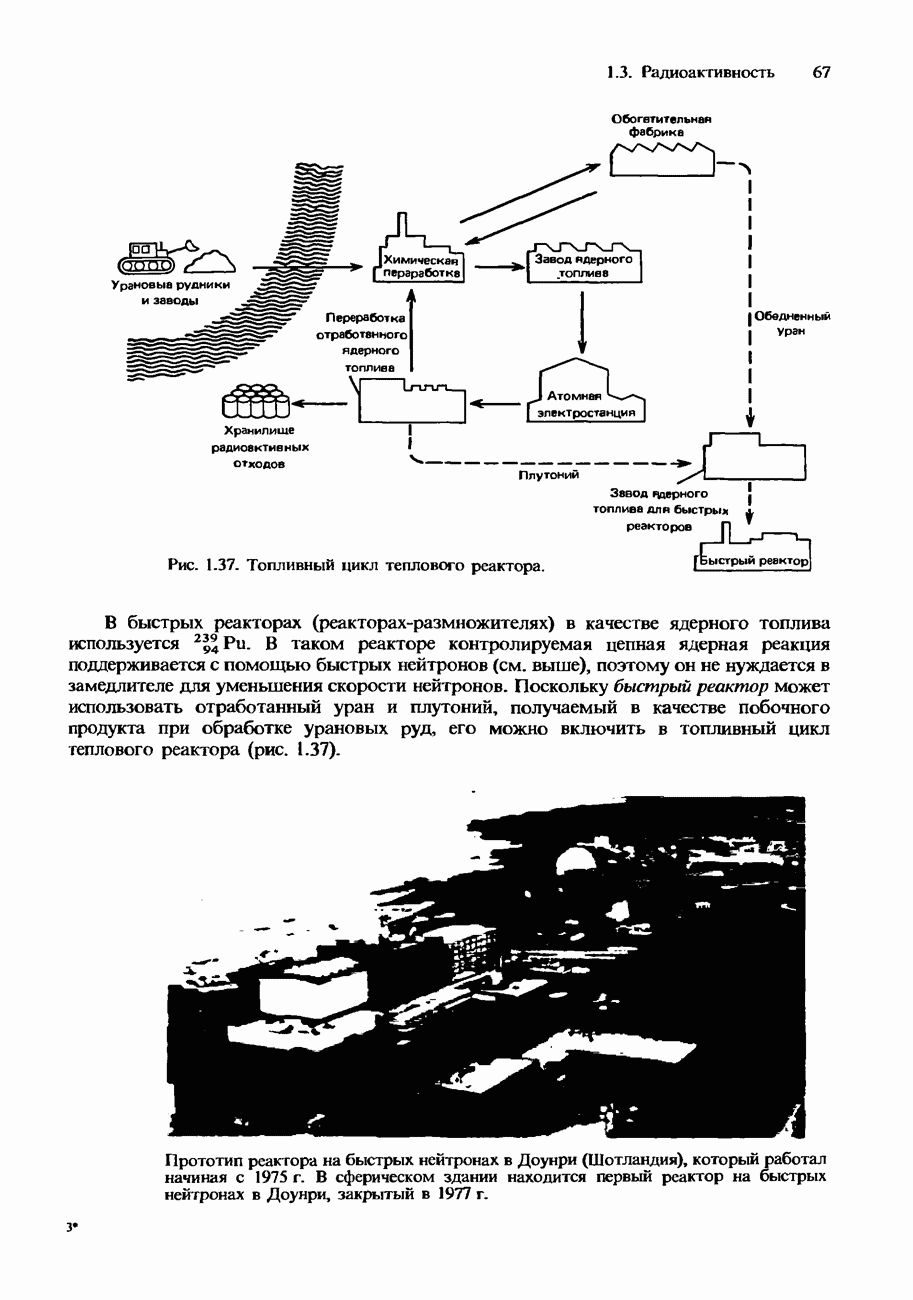
- Типы ядерных реакторов
- Радиоактивные ядерные отходы и их переработка
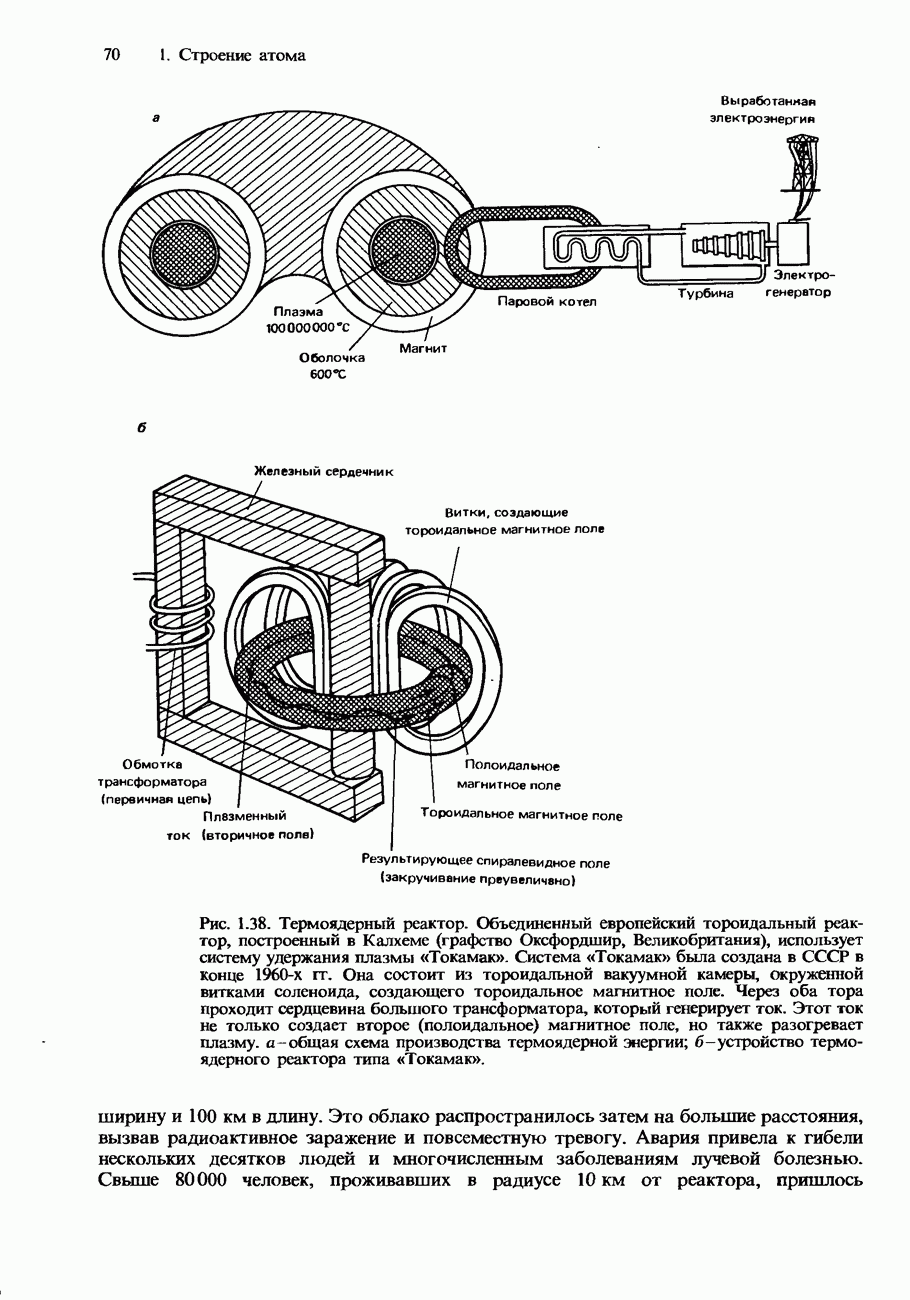
- Термоядерные реакторы
- Аргументы против использования ядерной энергии
- ЯДЕРНОЕ ОРУЖИЕ
- Ядерное разоружение
- ИСТОЧНИКИ РАДИАЦИИ И ЕЕ ВОЗДЕЙСТВИЕ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 2. ХИМИЧЕСКАЯ СВЯЗЬ
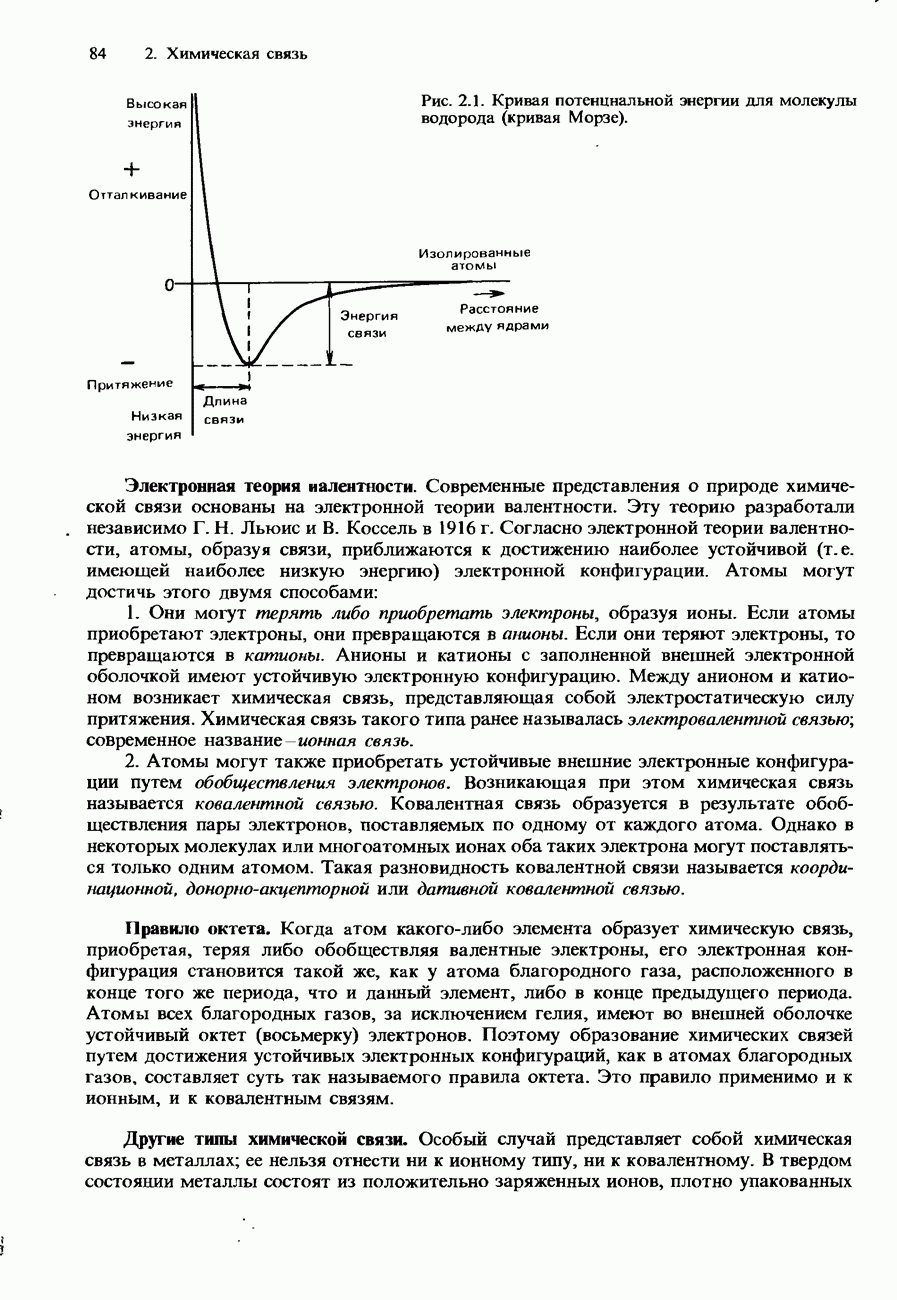
- 2.1. Природа химической связи
- ИОННАЯ СВЯЗЬ
- Устойчивость ионных соединений
- КОВАЛЕНТНАЯ СВЯЗЬ
- Молекулярные орбитали
- Гибридные атомные орбитали
- Делокализованные орбитали
- Координационная связь
- ИОННЫЙ И КОВАЛЕНТНЫЙ ХАРАКТЕР СВЯЗИ
- Ионный характер ковалентных связей
- Ионные и ковалентные соединения
- МЕТАЛЛИЧЕСКАЯ СВЯЗЬ
- Валентная зона и зона проводимости
- ВОДОРОДНАЯ СВЯЗЬ
- ВАНДЕРВААЛЬСОВЫ СИЛЫ
- Притяжение типа диполь-индуцированный диполь (индукционное)
- Что понимается под вандерваальсовыми силами
- 2.2. Влияние химической связи на свойства соединений
- Атомные радиусы
- ФОРМА ПРОСТЫХ МОЛЕКУЛ И МНОГОАТОМНЫХ ИОНОВ
- ТИП ХИМИЧЕСКОЙ СВЯЗИ, СТРУКТУРА И ФИЗИЧЕСКИЕ СВОЙСТВА
- ТИП СВЯЗИ И ХИМИЧЕСКИЕ СВОЙСТВА
- ВЛИЯНИЕ МЕЖМОЛЕКУЛЯРНЫХ СИЛ НА СТРУКТУРУ И СВОЙСТВА
- ВЛИЯНИЕ ВАНДЕРВААЛЬСОВЫХ СИЛ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 3 ГАЗЫ, ЖИДКОСТИ И ТВЕРДЫЕ ВЕЩЕСТВА
- 3.1. Газы и жидкости
- ГАЗОВЫЕ ЗАКОНЫ
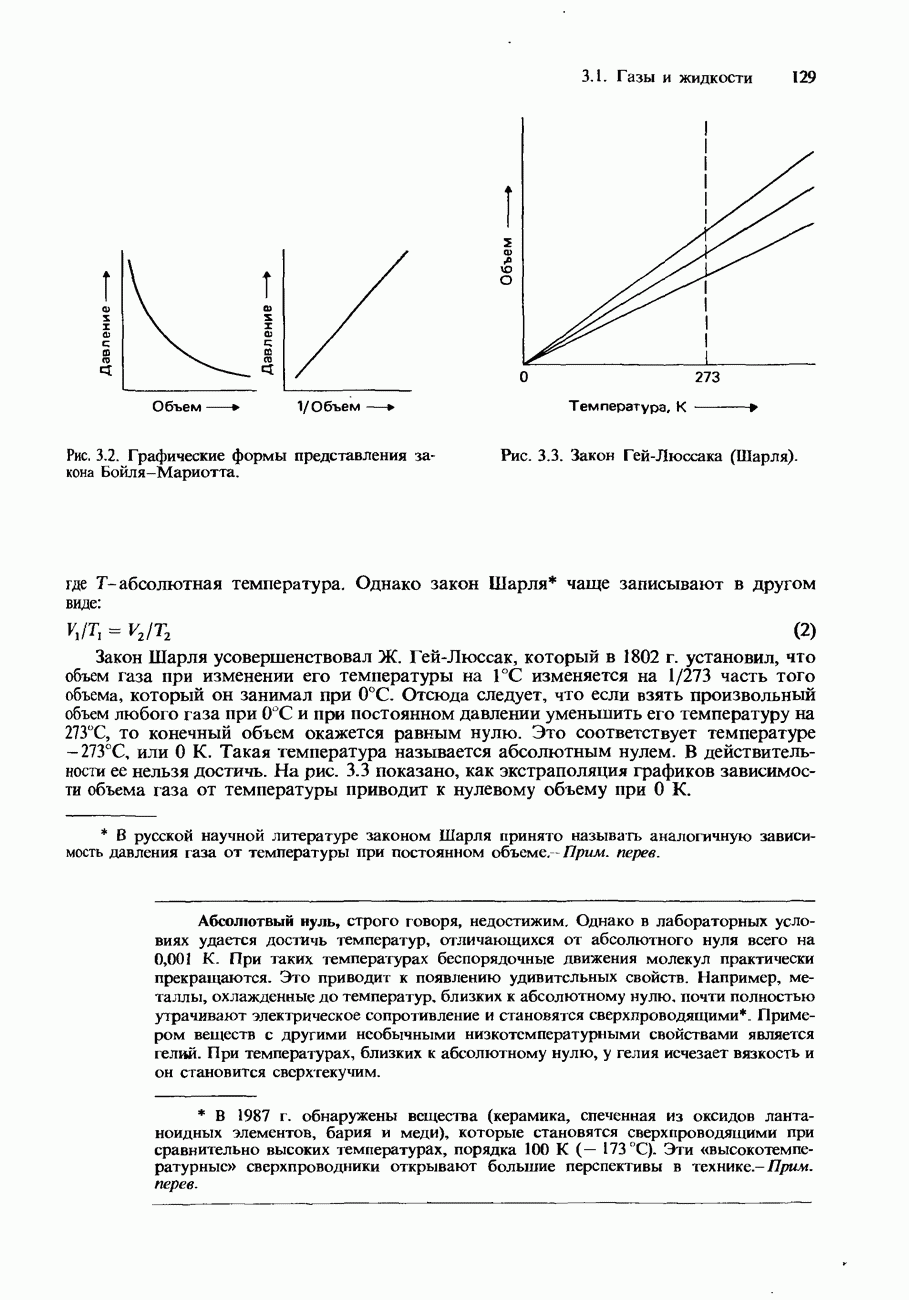
- Закон Бойля-Мариотта
- Закон Гей-Люссака (закон Шарля)
- Объединенный газовый закон
- Закон Авогадро
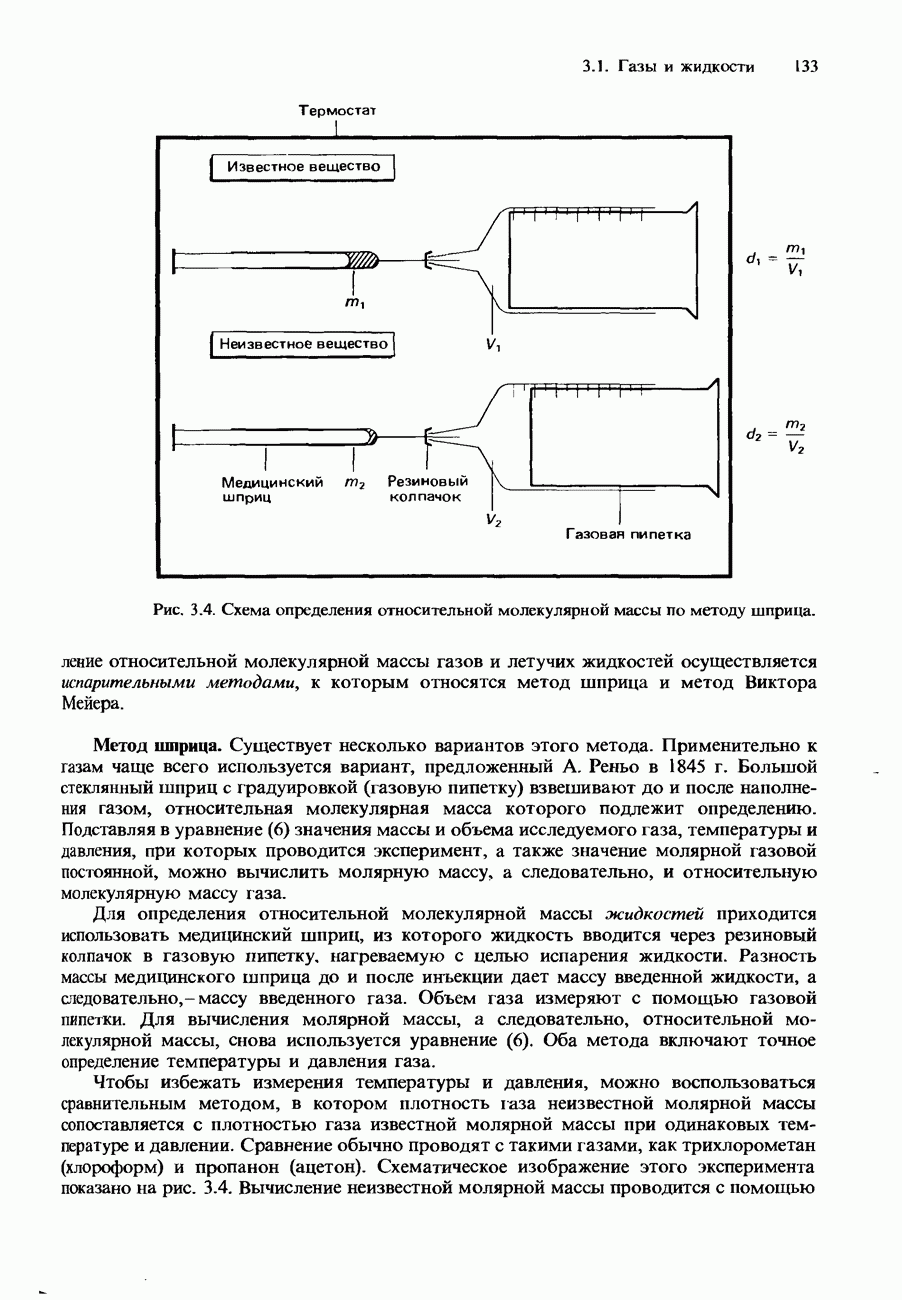
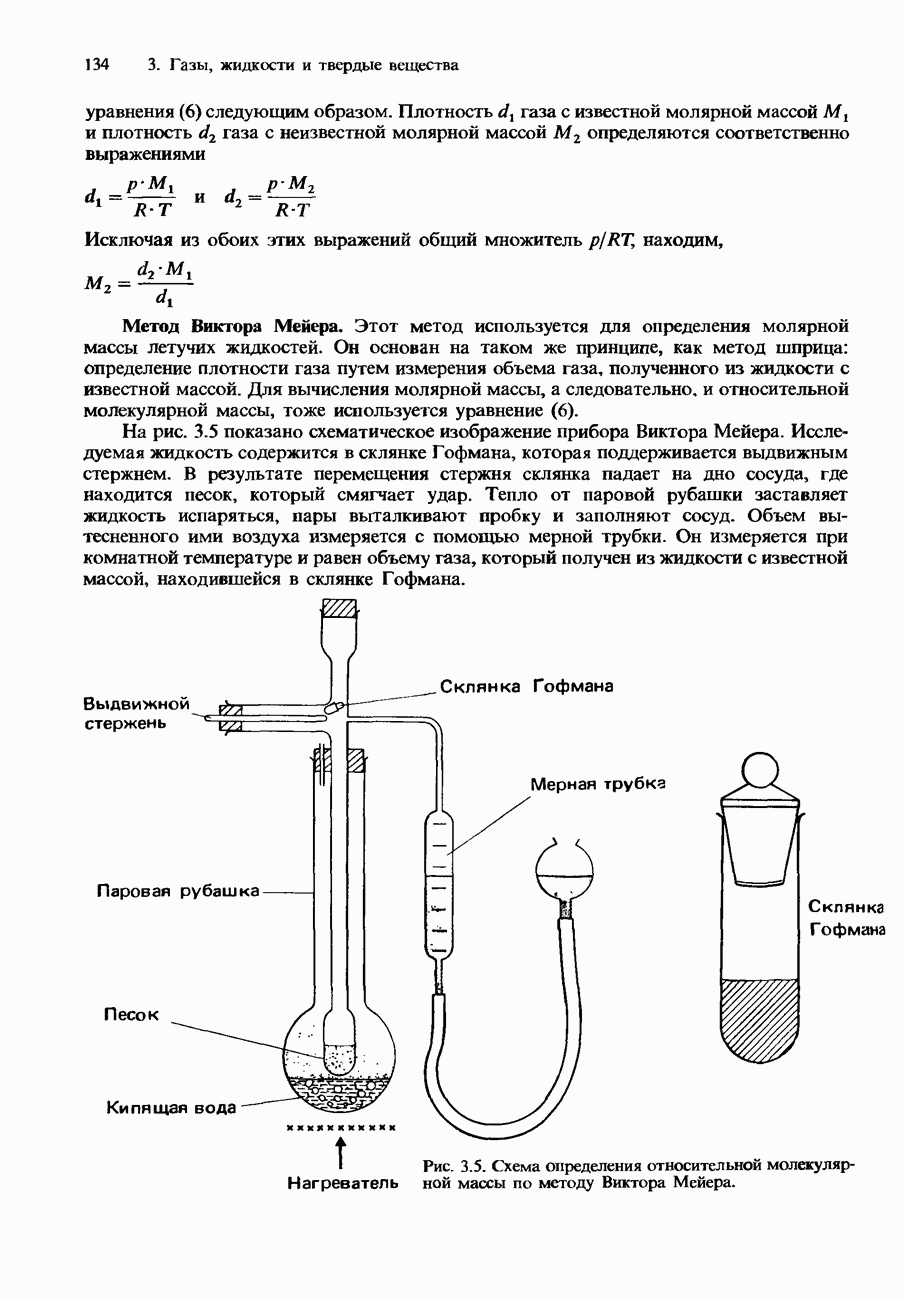
- Экспериментальное определение относительной молекулярной массы
- Закон парциальных давлений газов (закон Дальтона)
- Законы Грэхема
- КИНЕТИЧЕСКАЯ ТЕОРИЯ ГАЗОВ
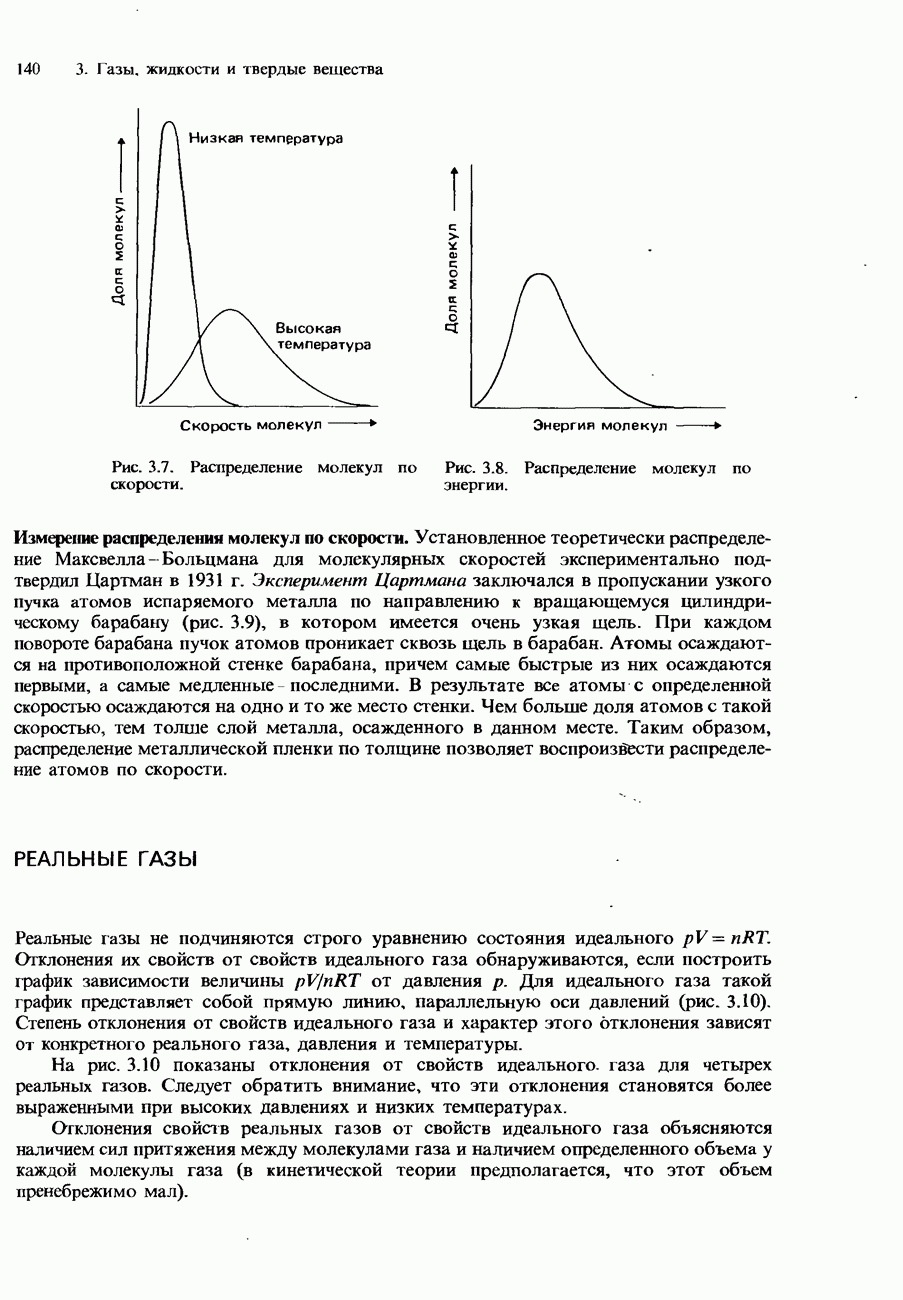
- Скорости молекул
- Распределение Максвелла-Больцмана
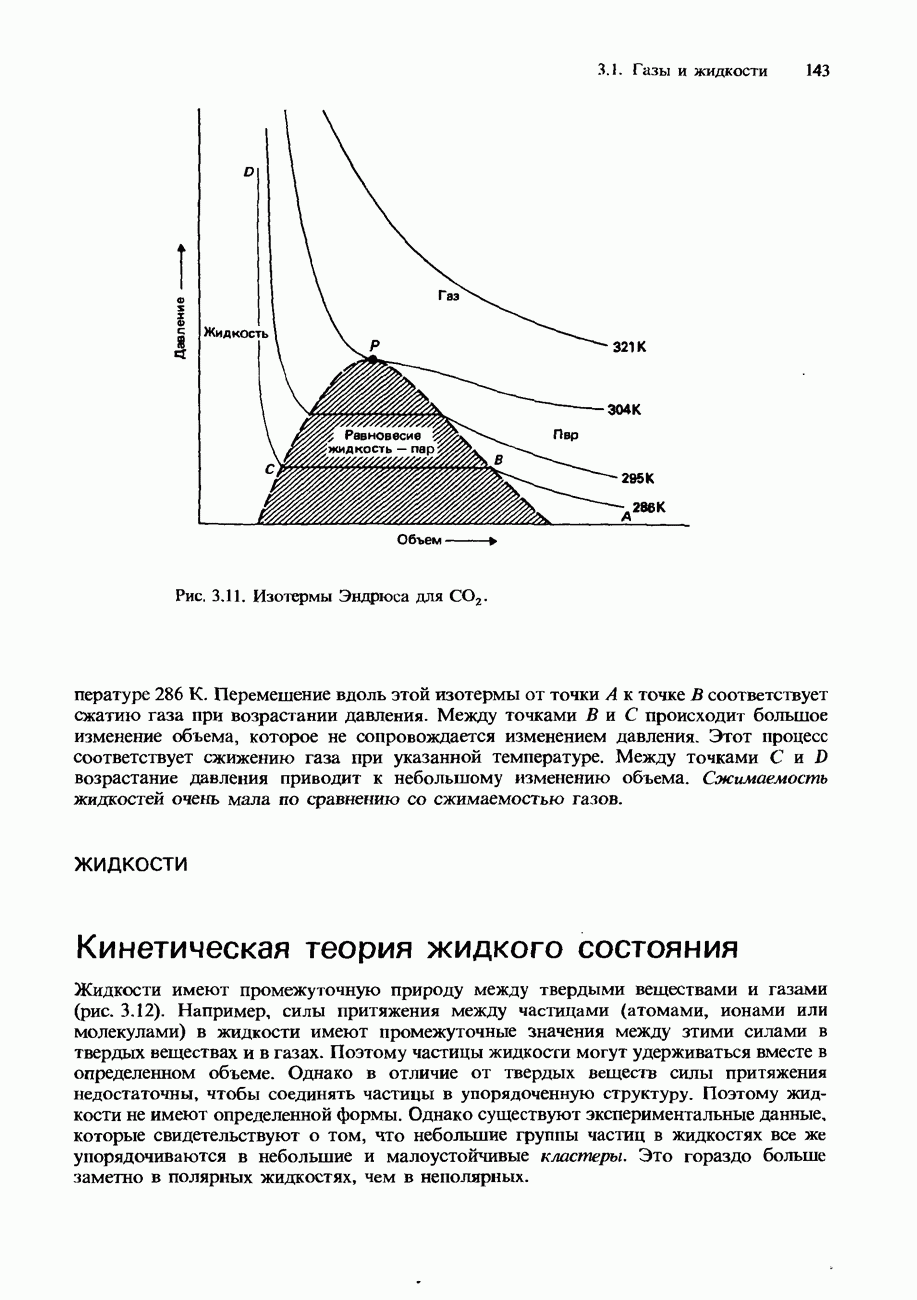
- РЕАЛЬНЫЕ ГАЗЫ
- Уравнение Ван-дер-Ваальса
- Сжижение газов
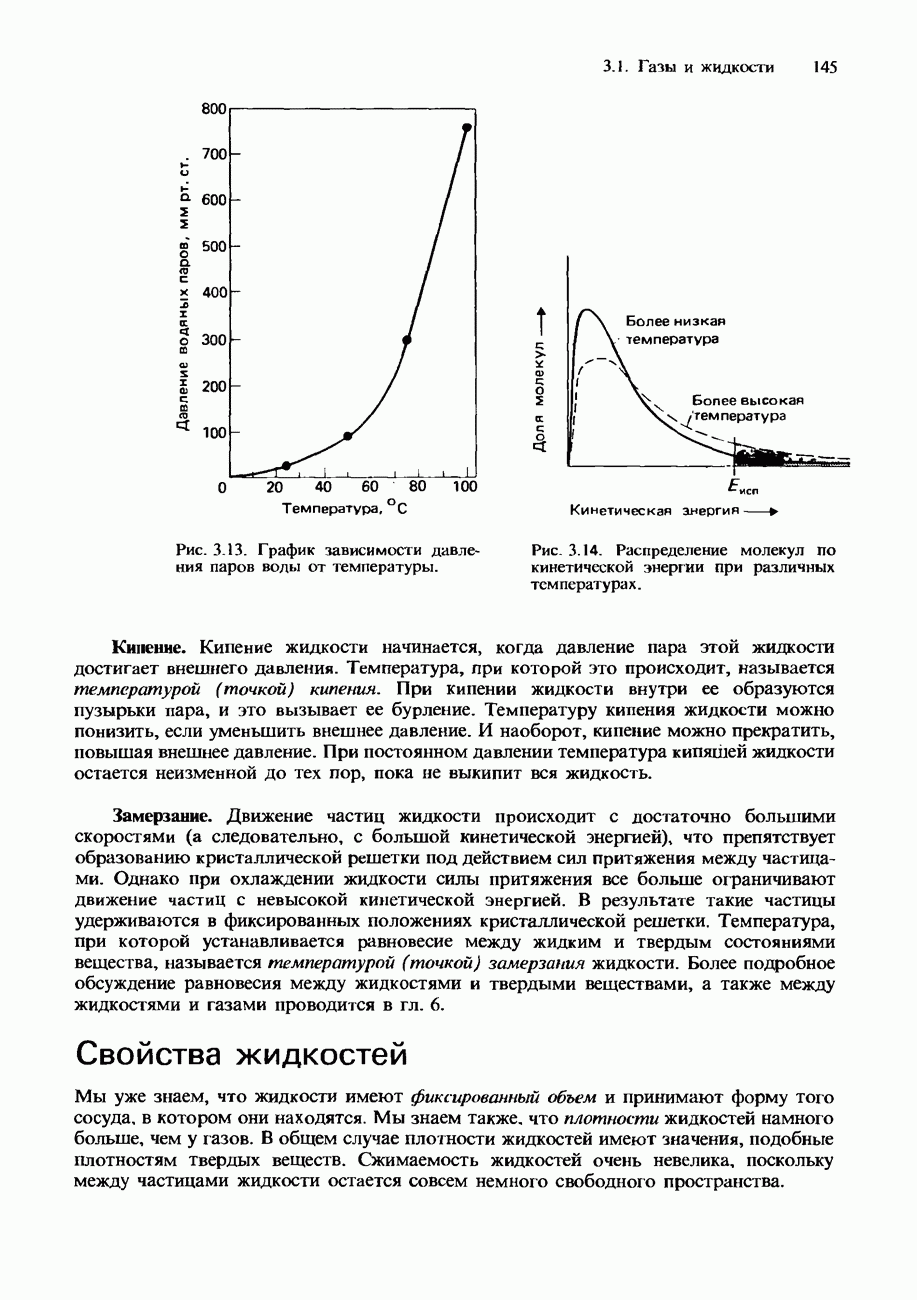
- ЖИДКОСТИ
- Свойства жидкостей
- 3.2. Твердые вещества
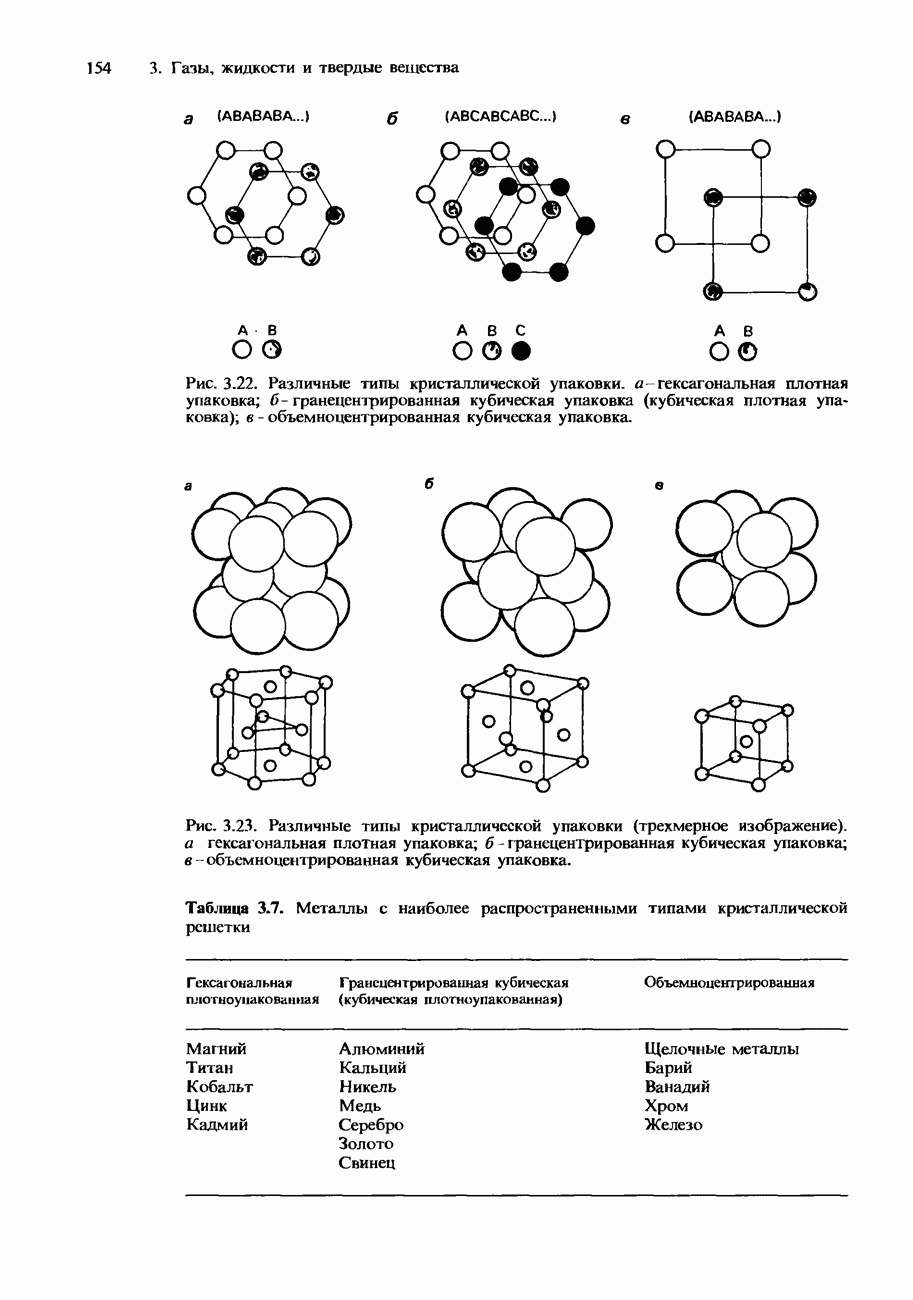
- КРИСТАЛЛИЧЕСКАЯ СТРУКТУРА
- Металлические кристаллы
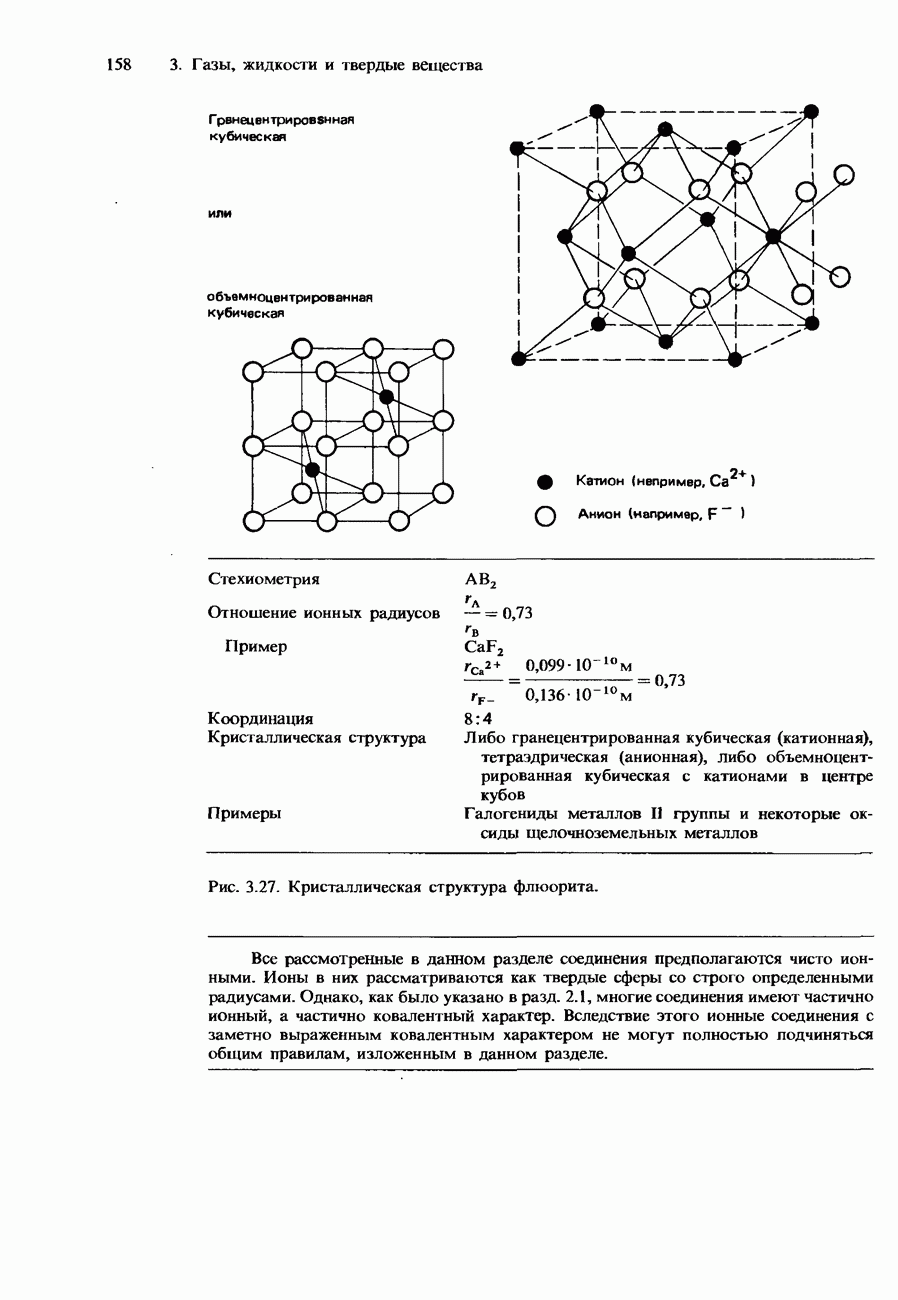
- Ионные кристаллы
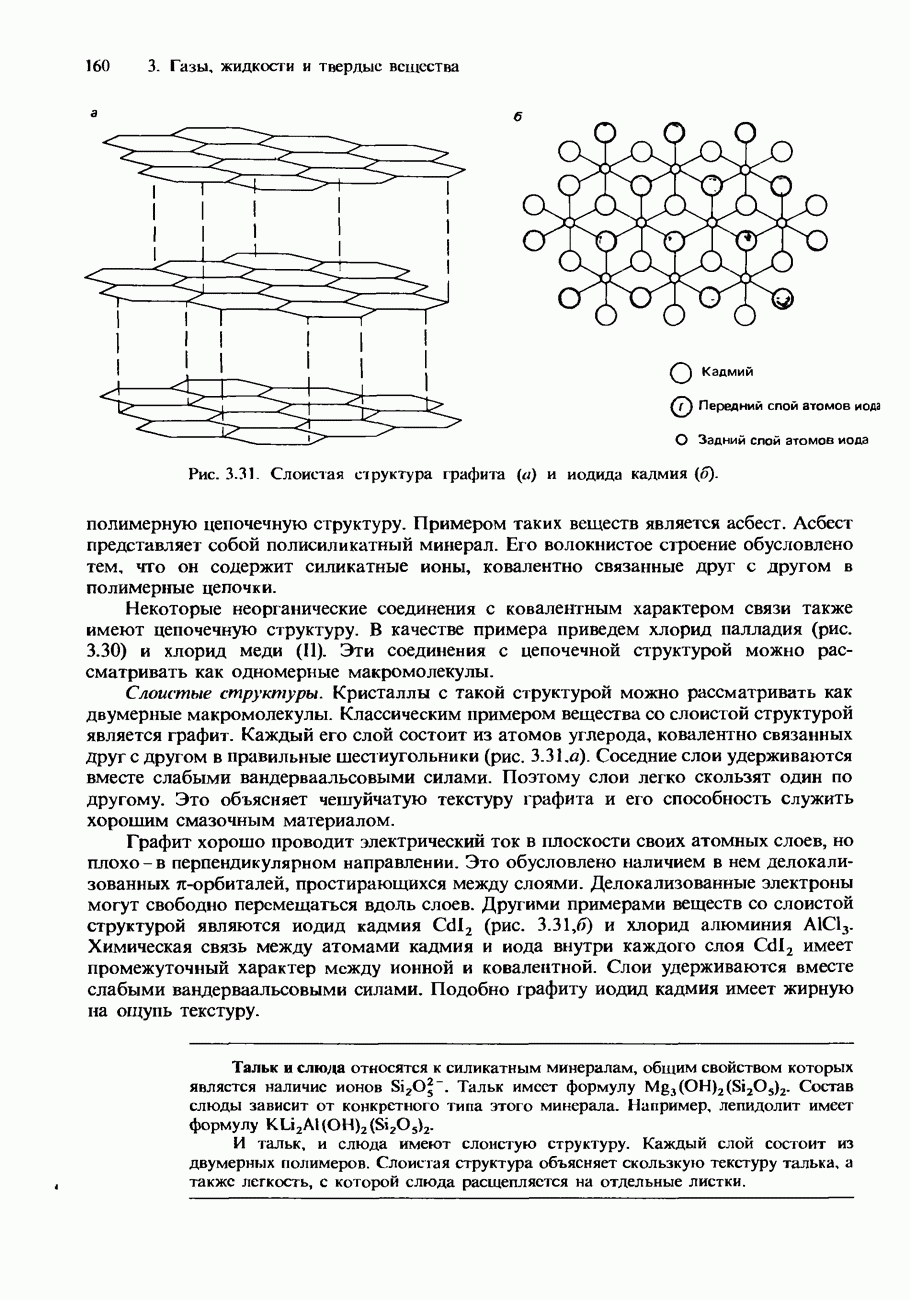
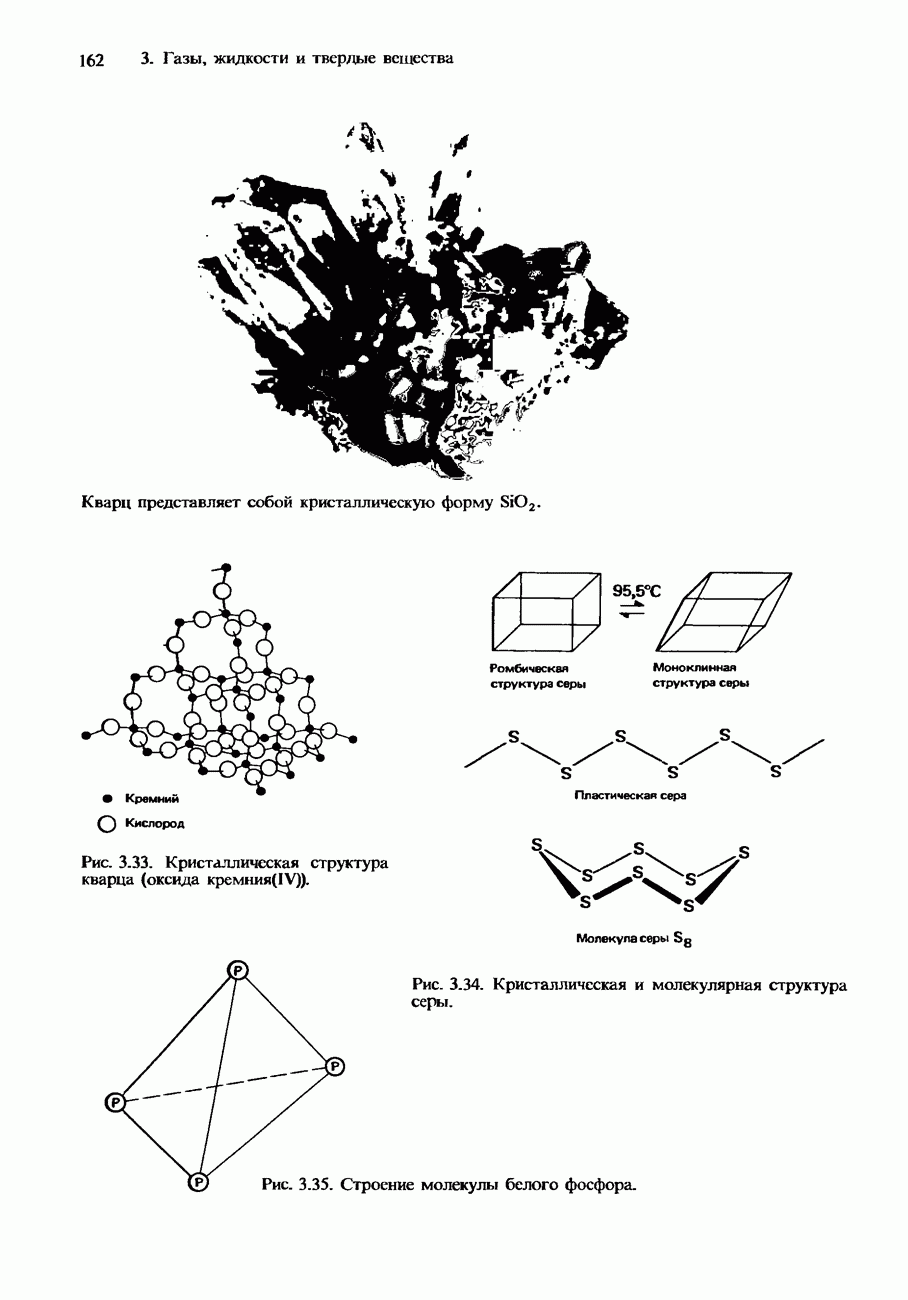
- Ковалентные кристаллы
- ИЗОМОРФИЗМ. ПОЛИМОРФИЗМ И АЛЛОТРОПИЯ
- СВОЙСТВА ТВЕРДЫХ ВЕЩЕСТВ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 4. СТЕХИОМЕТРИЯ
- 4.1. Стехиометрия и номенклатура
- Химические вещества
- Количественные законы химии
- Вес и масса
- НАЗВАНИЯ И ФОРМУЛЫ ХИМИЧЕСКИХ СОЕДИНЕНИЙ
- Химические формулы
- НОМЕНКЛАТУРА НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
- Степень окисления (состояние окисления)
- Элементы
- Бинарные соединения
- 4.2 Стехиометрические вычисления
- Молярная масса
- Число частиц вещества
- Процентный состав соединения
- Эмпирическая формула соединения
- Молярные постоянные и молярные величины
- Состав гомогенных смесей
- ХИМИЧЕСКИЕ УРАВНЕНИЯ
- ВЫХОД РЕАКЦИИ
- ПРОМЫШЛЕННАЯ СТЕХИОМЕТРИЯ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 5. ЭНЕРГЕТИКА
- 5.1. Термодинамика
- ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ
- 5.2. Энтальпия
- СТАНДАРТНЫЕ ИЗМЕНЕНИЯ ЭНТАЛЬПИИ
- ДРУГИЕ ИЗМЕНЕНИЯ ЭНТАЛЬПИИ
- КАЛОРИМЕТРИЯ
- КАЛОРИЙНОСТЬ ПИЩИ
- ЗАКОН ГЕССА
- 5.3 Энергия и структура
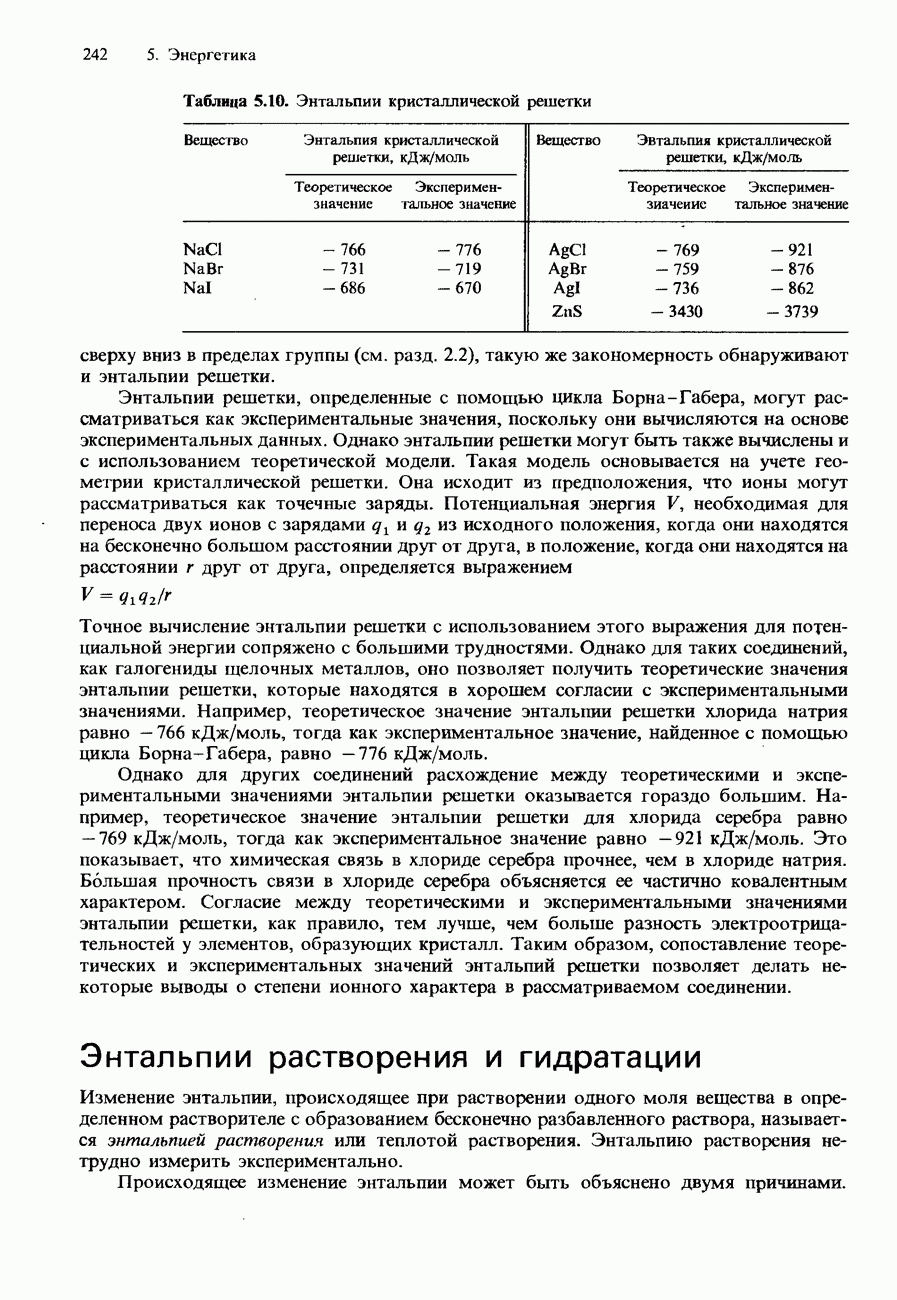
- ЭНТАЛЬПИЯ КРИСТАЛЛИЧЕСКОЙ РЕШЕТКИ
- Энтальпии растворения и гидратации
- ЭНТРОПИЯ
- СВОБОДНАЯ ЭНЕРГИЯ ГИББСА
- О ЧЕМ ПОЗВОЛЯЕТ СУДИТЬ ИЗМЕНЕНИЕ СВОБОДНОЙ ЭНЕРГИИ СИСТЕМЫ
- 5.4. Источники энергии
- НЕТРАДИЦИОННЫЕ ИСТОЧНИКИ ЭНЕРГИИ
- ЗАПАСАНИЕ ЭНЕРГИИ
- ПОТРЕБЛЕНИЕ ЭНЕРГИИ В ПРОШЛОМ, НАСТОЯЩЕМ И БУДУЩЕМ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 6. ФАЗОВЫЕ РАВНОВЕСИЯ
- 6.1. Равновесия и фазы
- ФАЗЫ И КОМПОНЕНТЫ
- Фазы
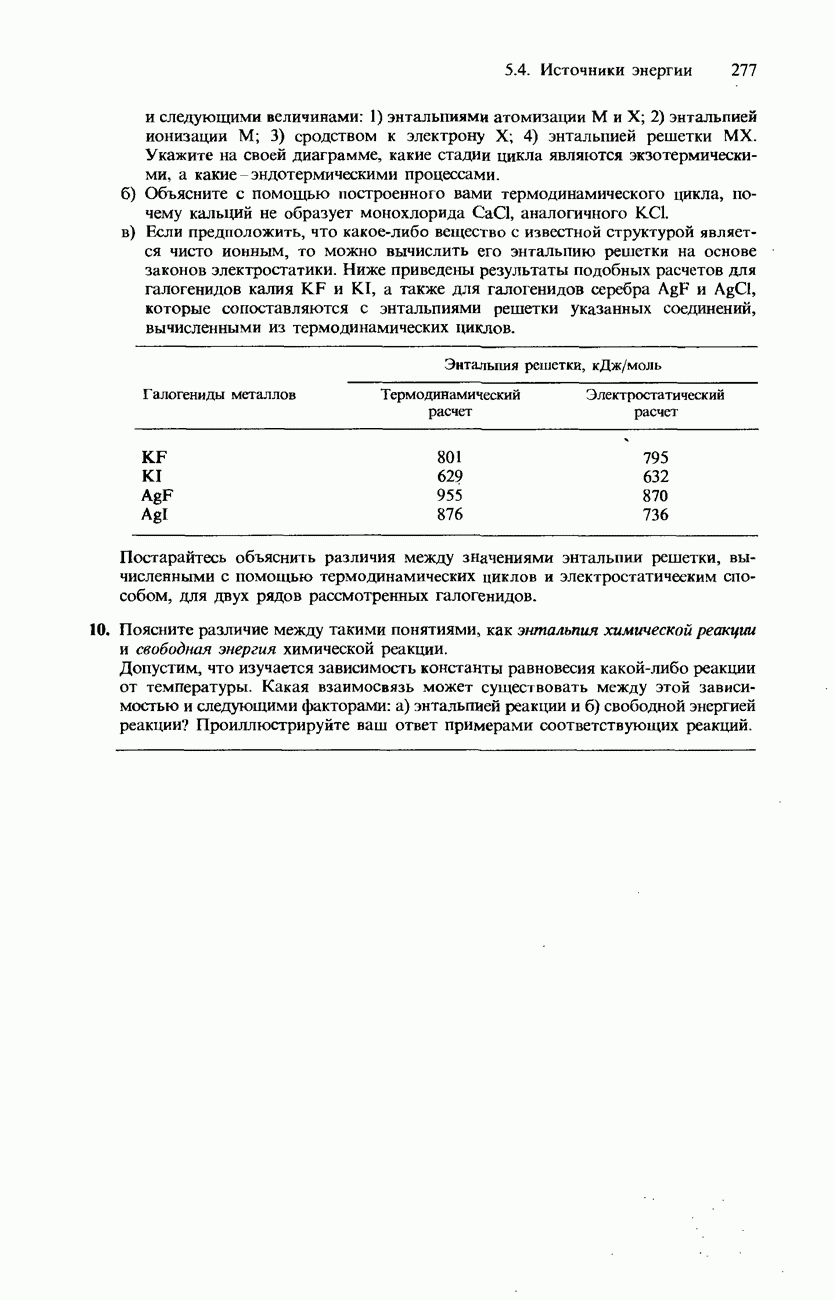
- ФАЗОВАЯ ДИАГРАММА ВОДЫ
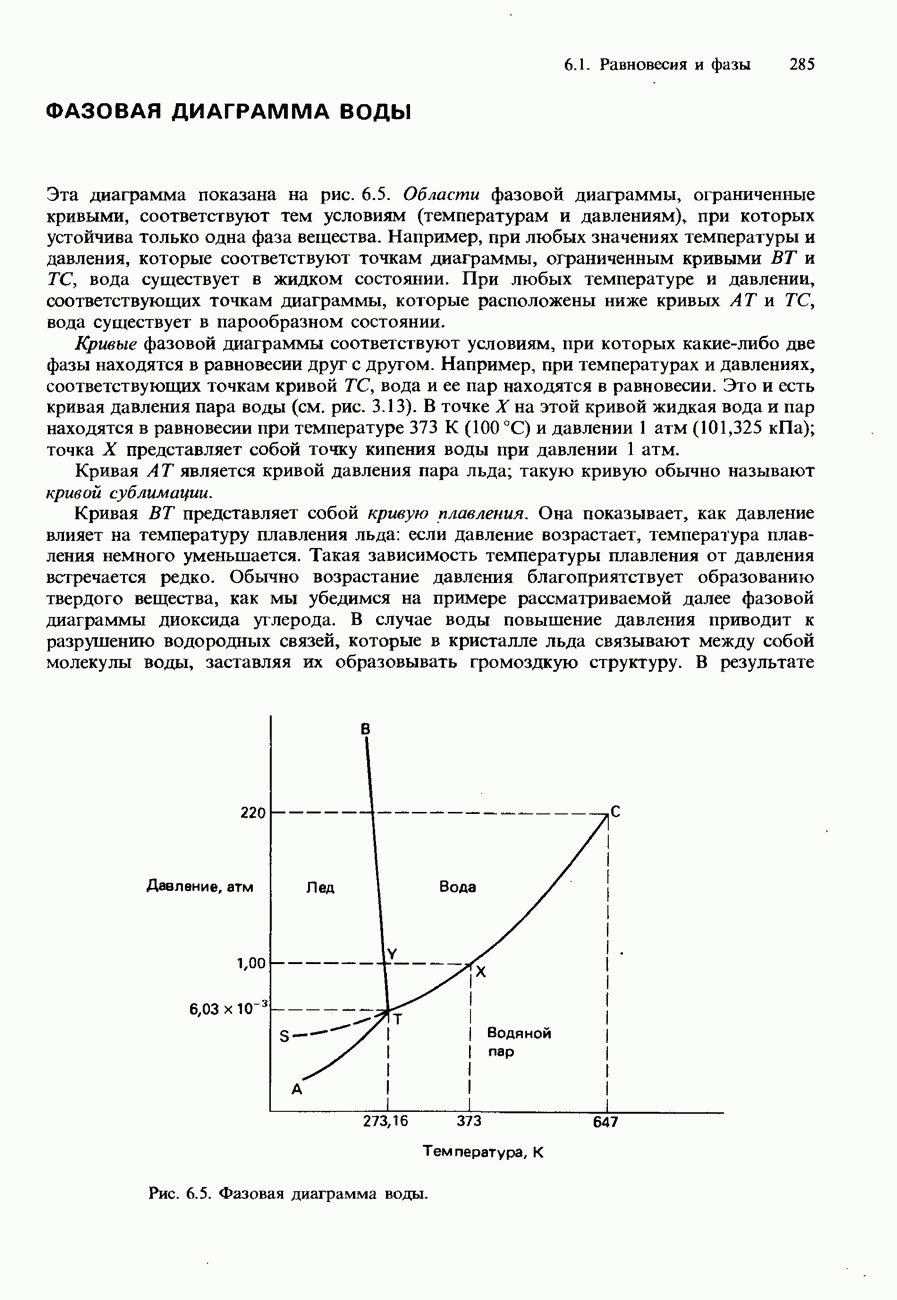
- ФАЗОВАЯ ДИАГРАММА ДИОКСИДА УГЛЕРОДА
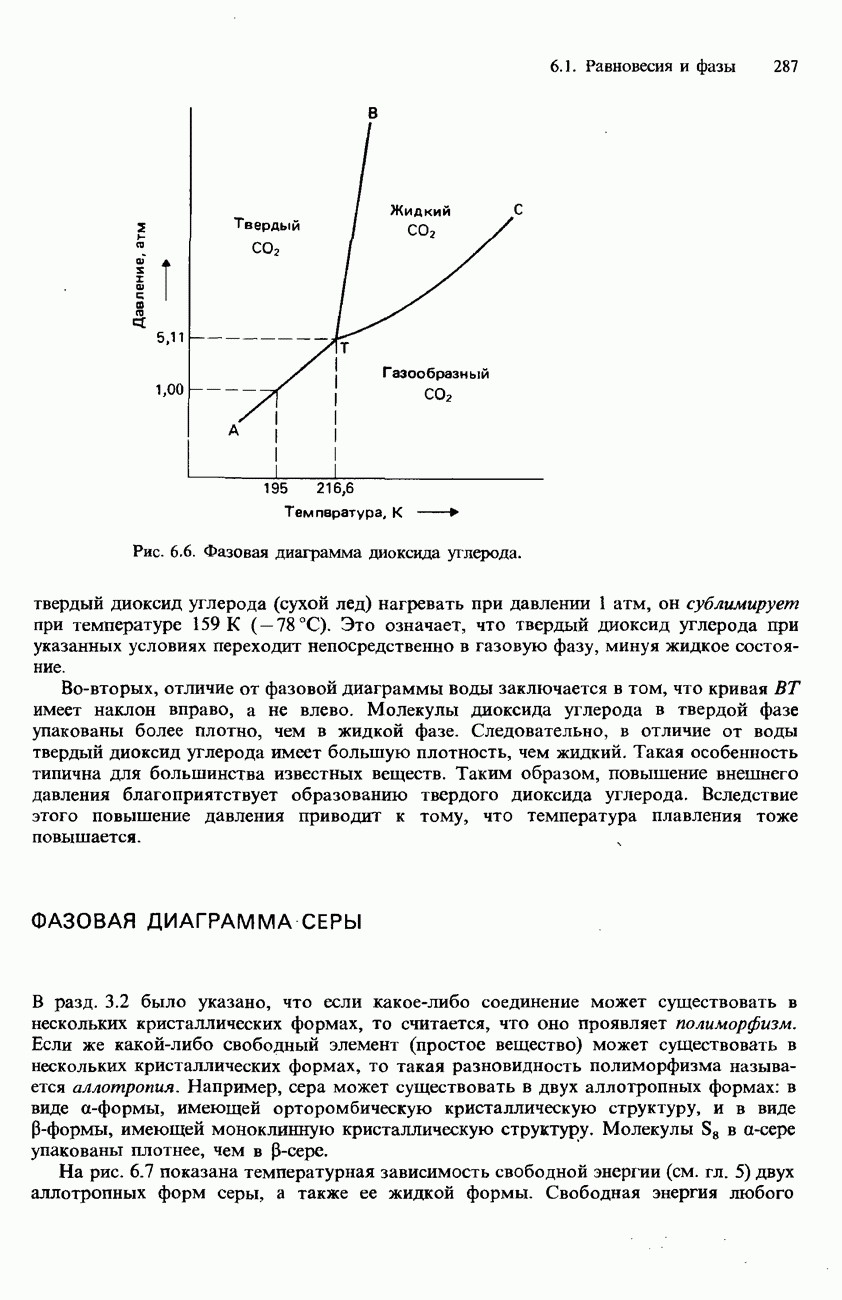
- ФАЗОВАЯ ДИАГРАММА СЕРЫ
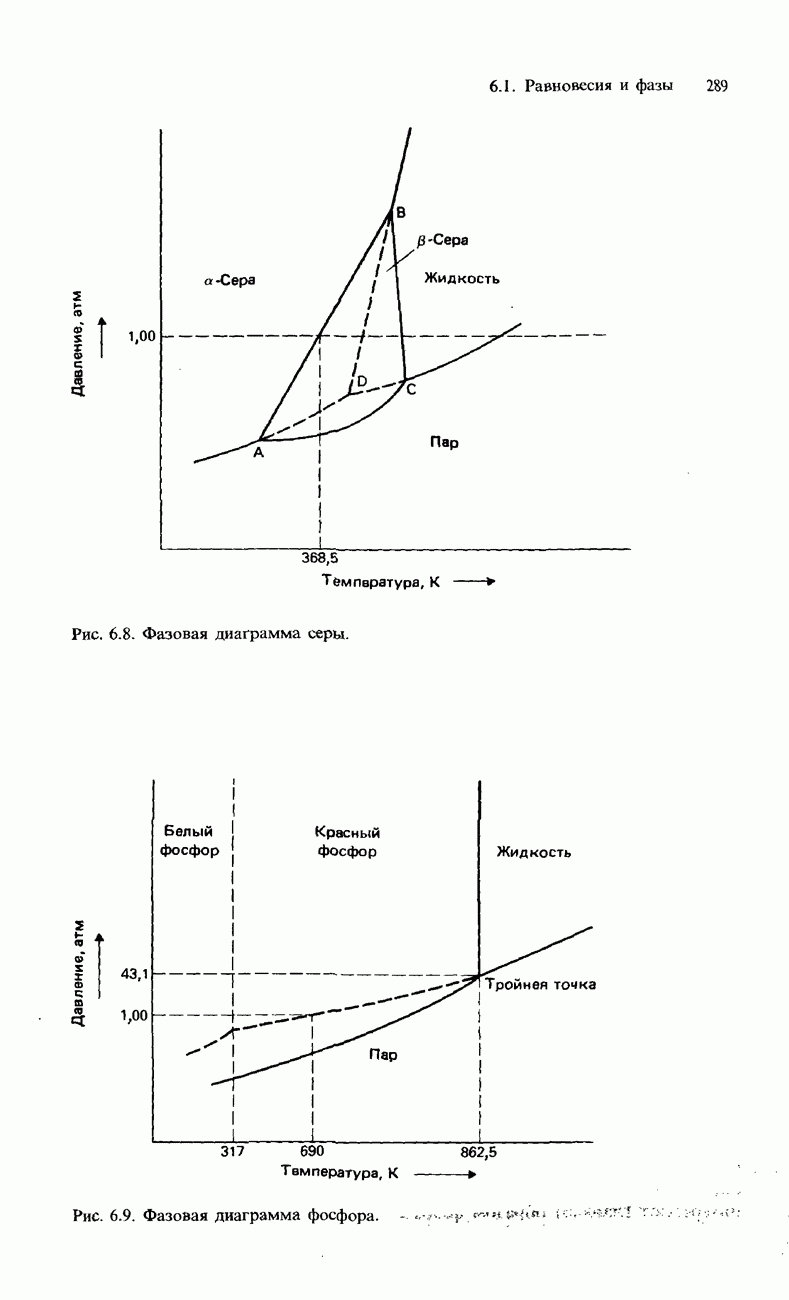
- ФАЗОВАЯ ДИАГРАММА ФОСФОРА
- 6.2. Многокомпонентные системы
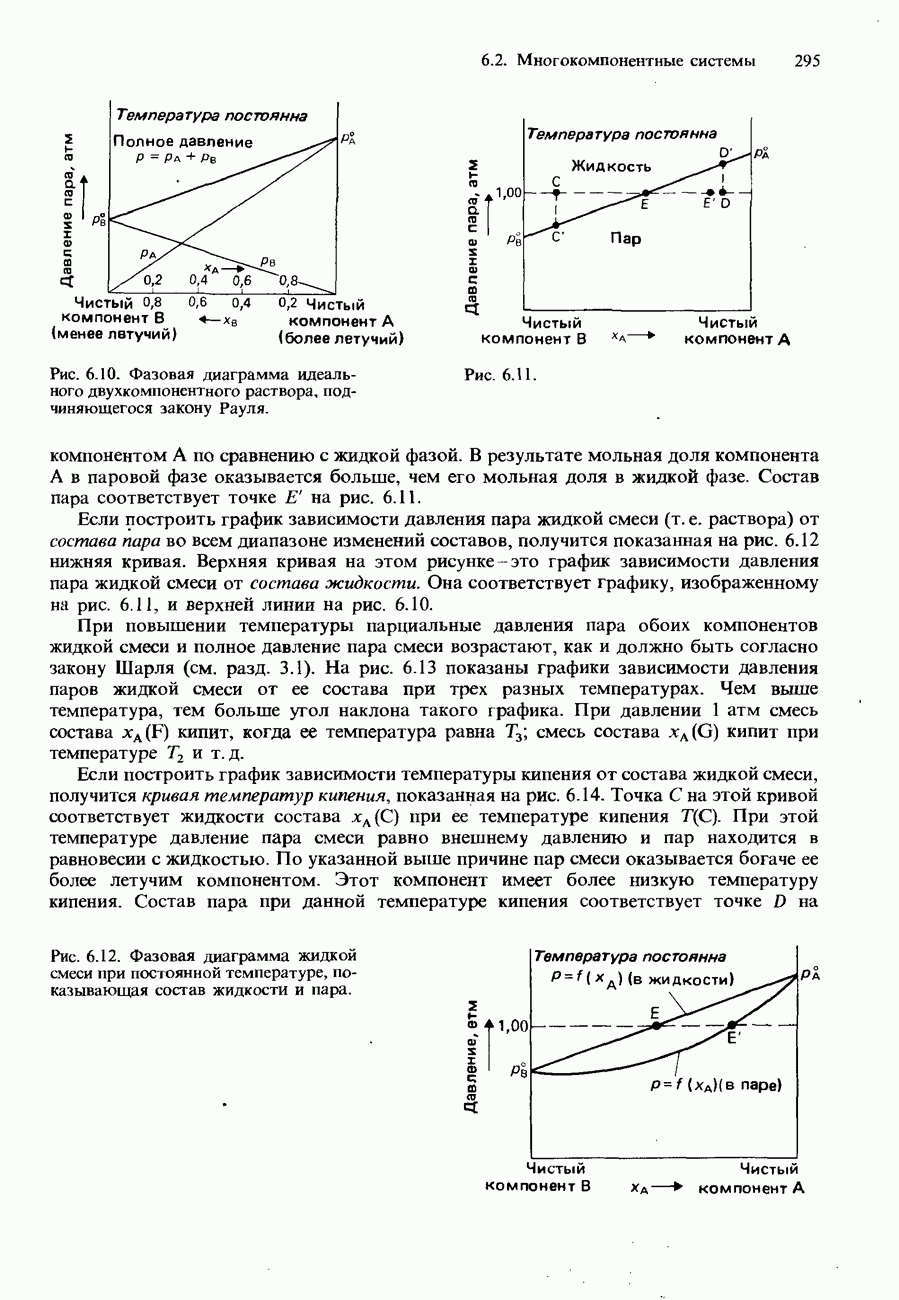
- ДВУХКОМПОНЕНТНЫЕ ЖИДКИЕ СМЕСИ
- ПОЛНОСТЬЮ СМЕШИВАЮЩИЕСЯ ЖИДКОСТИ
- Фазовые диаграммы полностью смешивающихся жидкостей
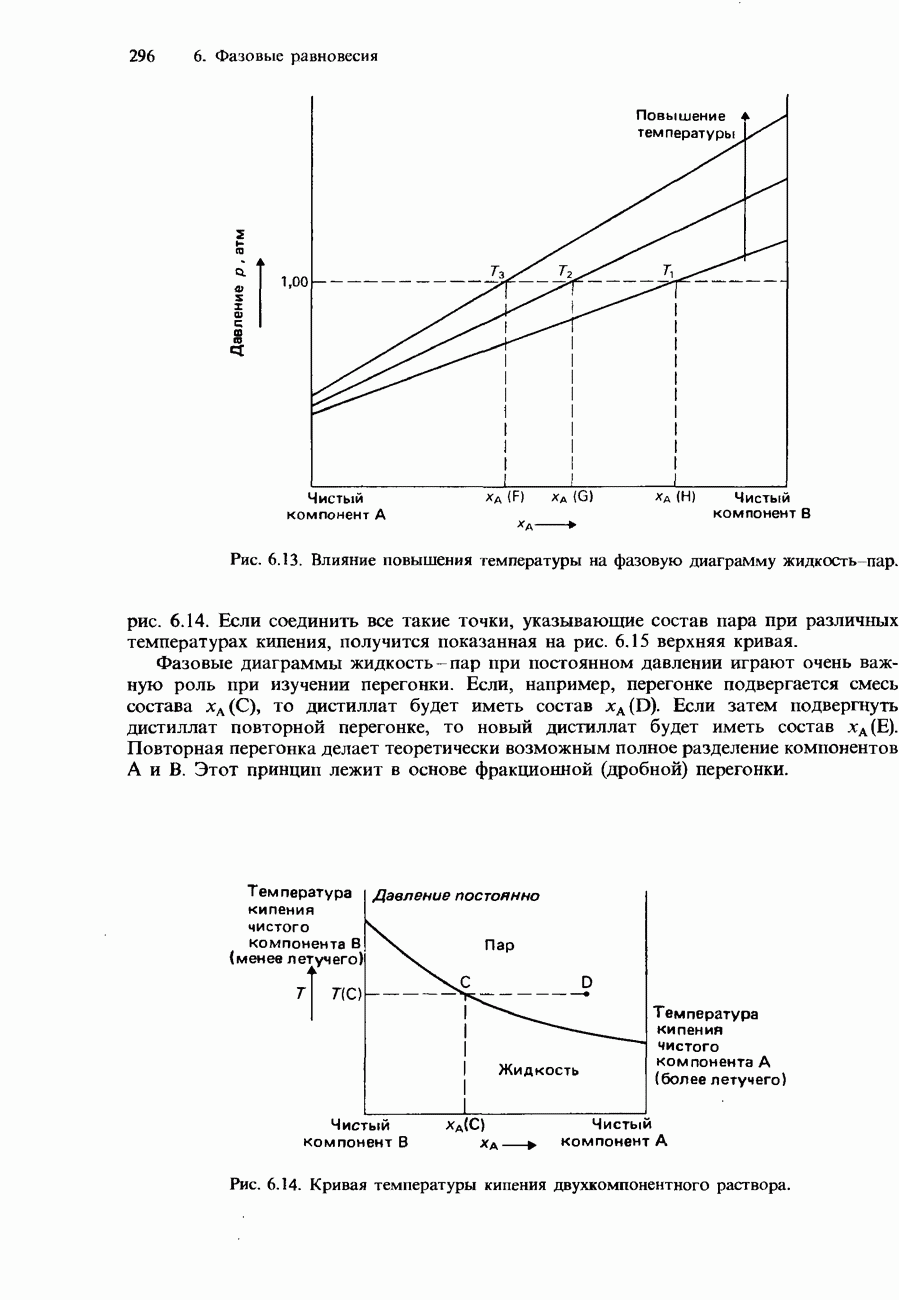
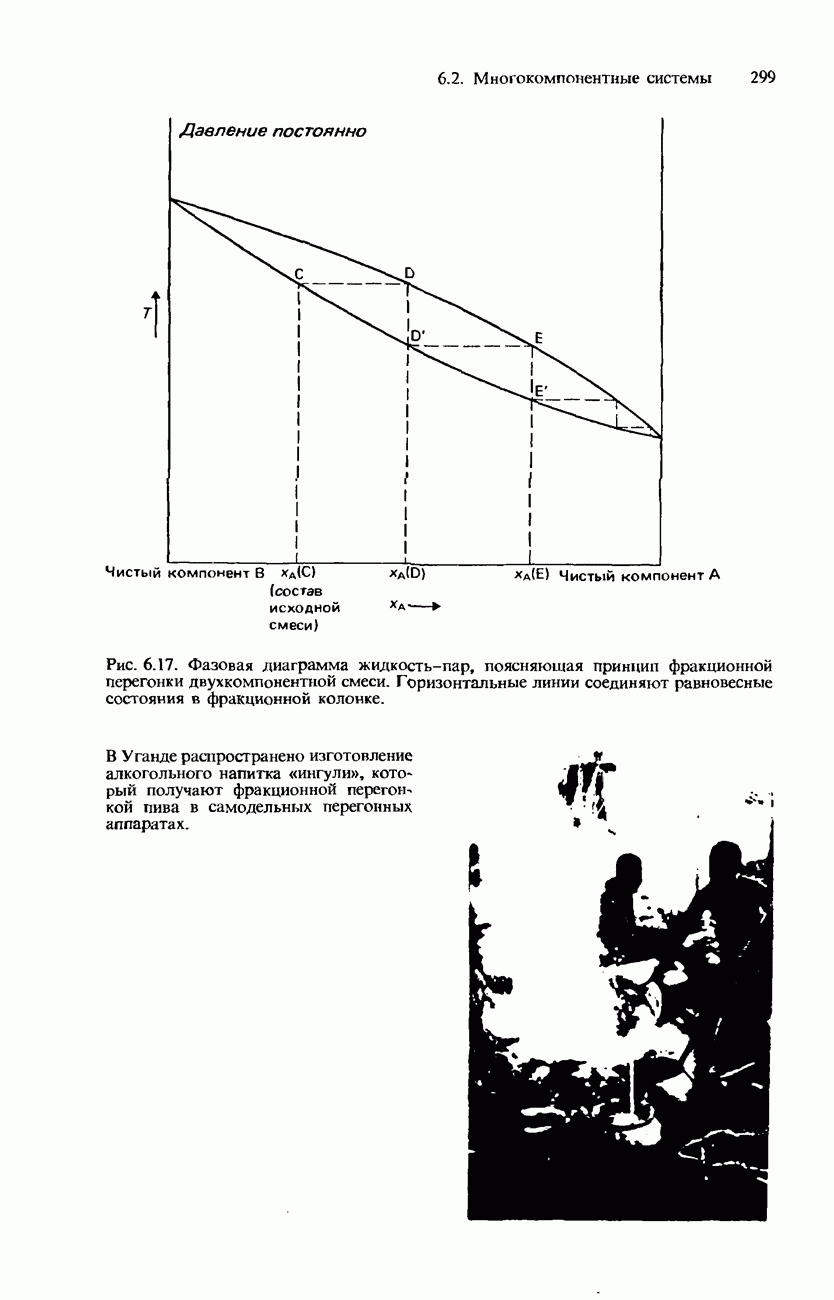
- Фракционная перегонка
- Неидеальные растворы
- ЧАСТИЧНО СМЕШИВАЮЩИЕСЯ ЖИДКОСТИ
- НЕСМЕШИВАЮЩИЕСЯ ЖИДКОСТИ
- РАВНОВЕСИЯ ТВЕРДОЕ ВЕЩЕСТВО-ЖИДКОСТЬ
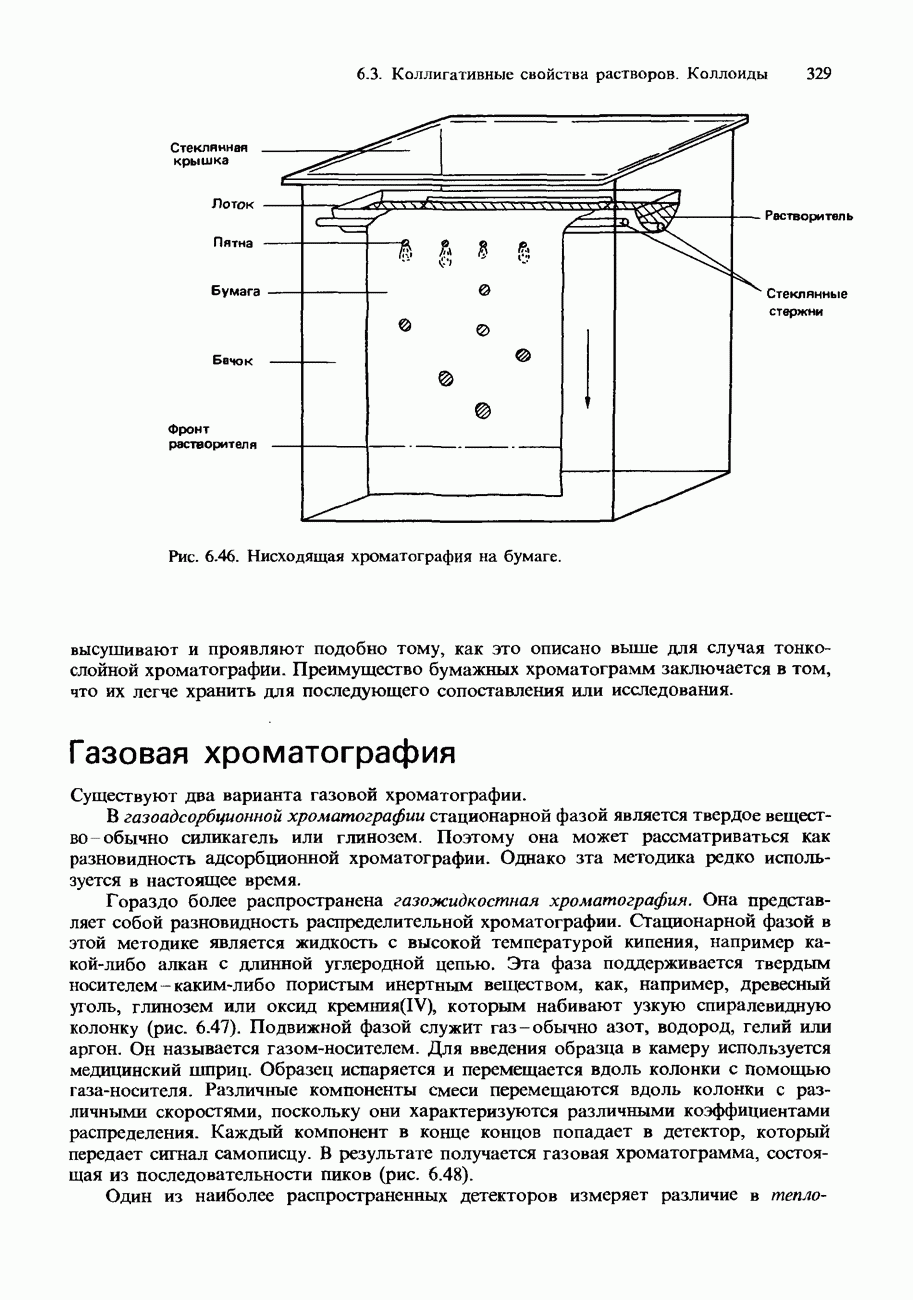
- 6.3. Коллигативные свойства растворов. Коллоиды Хроматография
- КОЛЛОИДЫ
- ХРОМАТОГРАФИЯ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 7. ХИМИЧЕСКОЕ РАВНОВЕСИЕ
- 7.1. Константа равновесия
- ЗАКОН ДЕЙСТВУЮЩИХ МАСС
- ВЛИЯНИЕ УСЛОВИЙ ПРОТЕКАНИЯ РЕАКЦИИ НА ПОЛОЖЕНИЕ РАВНОВЕСИЯ
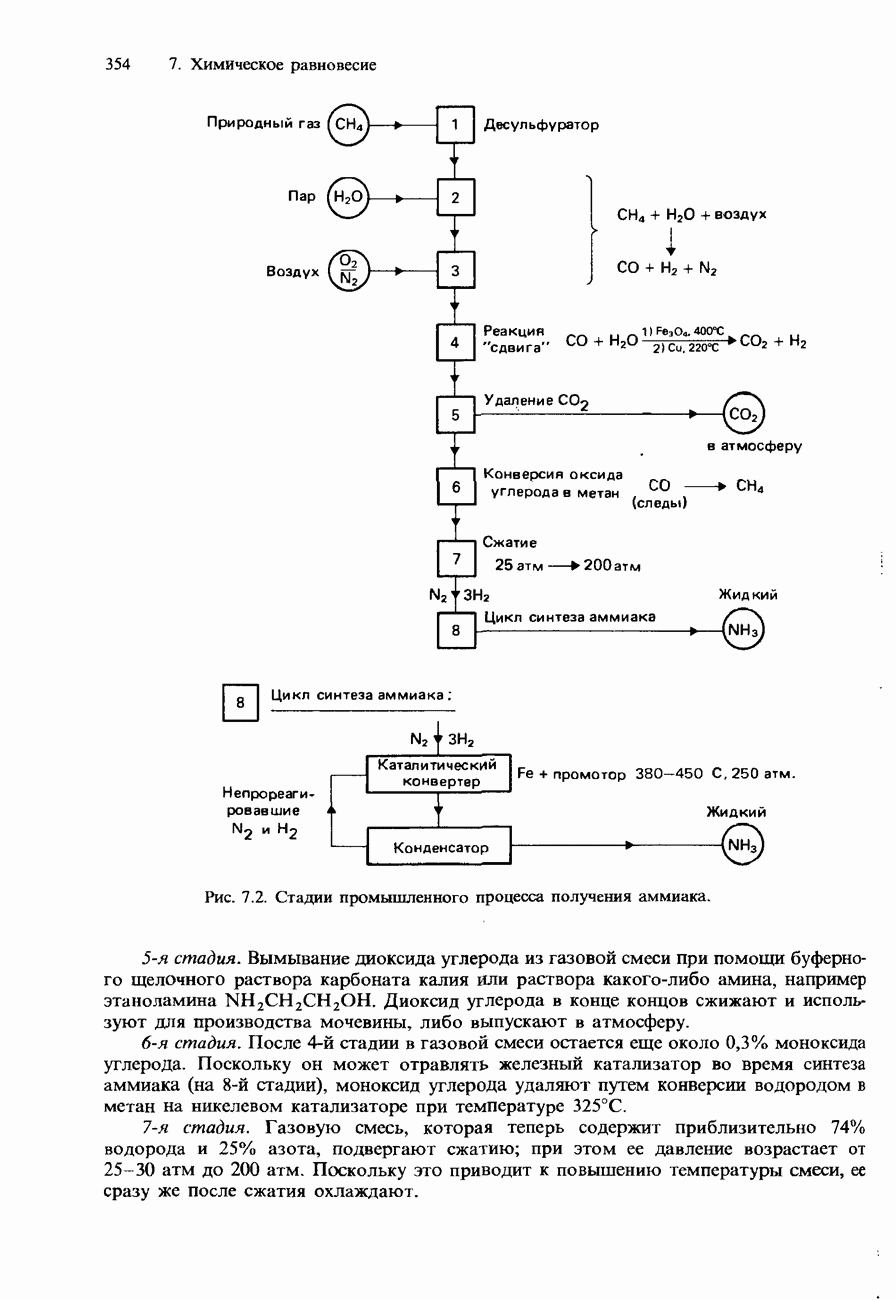
- 7.2. Получение аммиака и серной кислоты
- ПРОМЫШЛЕННОЕ ПОЛУЧЕНИЕ СЕРНОЙ КИСЛОТЫ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 8. ИОНЫ
- 8.1. Кислоты и основания
- ЭЛЕКТРОЛИТЫ
- КИСЛОТЫ И ОСНОВАНИЯ
- КОНСТАНТЫ ДИССОЦИАЦИИ
- ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ pH ШКАЛА ЕГО ЗНАЧЕНИЙ
- КИСЛОТНО-ОСНОВНЫЕ ИНДИКАТОРЫ И ТИТРОВАНИЕ
- 8.2. Соли, растворимость и устойчивость
- БУФЕРНЫЕ РАСТВОРЫ
- РАСТВОРИМОСТЬ
- РАВНОВЕСИЯ С УЧАСТИЕМ КОМПЛЕКСНЫХ ИОНОВ
- ИОННЫЙ ОБМЕН
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 9. ХИМИЧЕСКАЯ КИНЕТИКА
- 9.1. Скорость химической реакции
- МЕТОДЫ ИЗМЕРЕНИЯ СКОРОСТИ РЕАКЦИЙ
- СКОРОСТЬ РЕАКЦИИ И КОНЦЕНТРАЦИИ РЕАГЕНТОВ
- ЗАВИСИМОСТЬ КОНСТАНТЫ СКОРОСТИ ОТ ТЕМПЕРАТУРЫ УРАВНЕНИЕ АРРЕНИУСА
- 9.2. Механизмы реакций и катализ
- ТЕОРИЯ СТОЛКНОВЕНИЙ
- ТЕОРИЯ ПЕРЕХОДНОГО СОСТОЯНИЯ
- ЦЕПНЫЕ РЕАКЦИИ
- КАТАЛИЗ
- ТИПЫ КАТАЛИЗАТОРОВ
- ГОМОГЕННЫЙ КАТАЛИЗ
- ГЕТЕРОГЕННЫЙ КАТАЛИЗ
- ФЕРМЕНТАТИВНЫЙ КАТАЛИЗ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 10. ЭЛЕКТРОХИМИЯ
- 10.1. Электропроводность
- ПРОВОДНИКИ ЭЛЕКТРИЧЕСКОГО ТОКА И ЭЛЕКТРОПРОВОДНОСТЬ
- МОЛЯРНАЯ ПРОВОДИМОСТЬ
- КОНДУКТОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
- 10.2. Окислительно-восстановительные процессы
- ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
- ОПРЕДЕЛЕНИЕ СТЕХИОМЕТРИЧЕСКИХ КОЭФФИЦИЕНТОВ
- СТЕПЕНЬ ОКИСЛЕНИЯ
- ОКИСЛИТЕЛИ
- ВОССТАНОВИТЕЛИ
- ОКИСЛИТЕЛИ И ВОССТАНОВИТЕЛИ
- 10.3. Электролиз
- ЗАКОНЫ ЭЛЕКТРОЛИЗА ФАРАДЕЯ
- ПРОМЫШЛЕННЫЕ ПРИМЕНЕНИЯ ЭЛЕКТРОЛИЗА
- 10.4. Химические источники тока
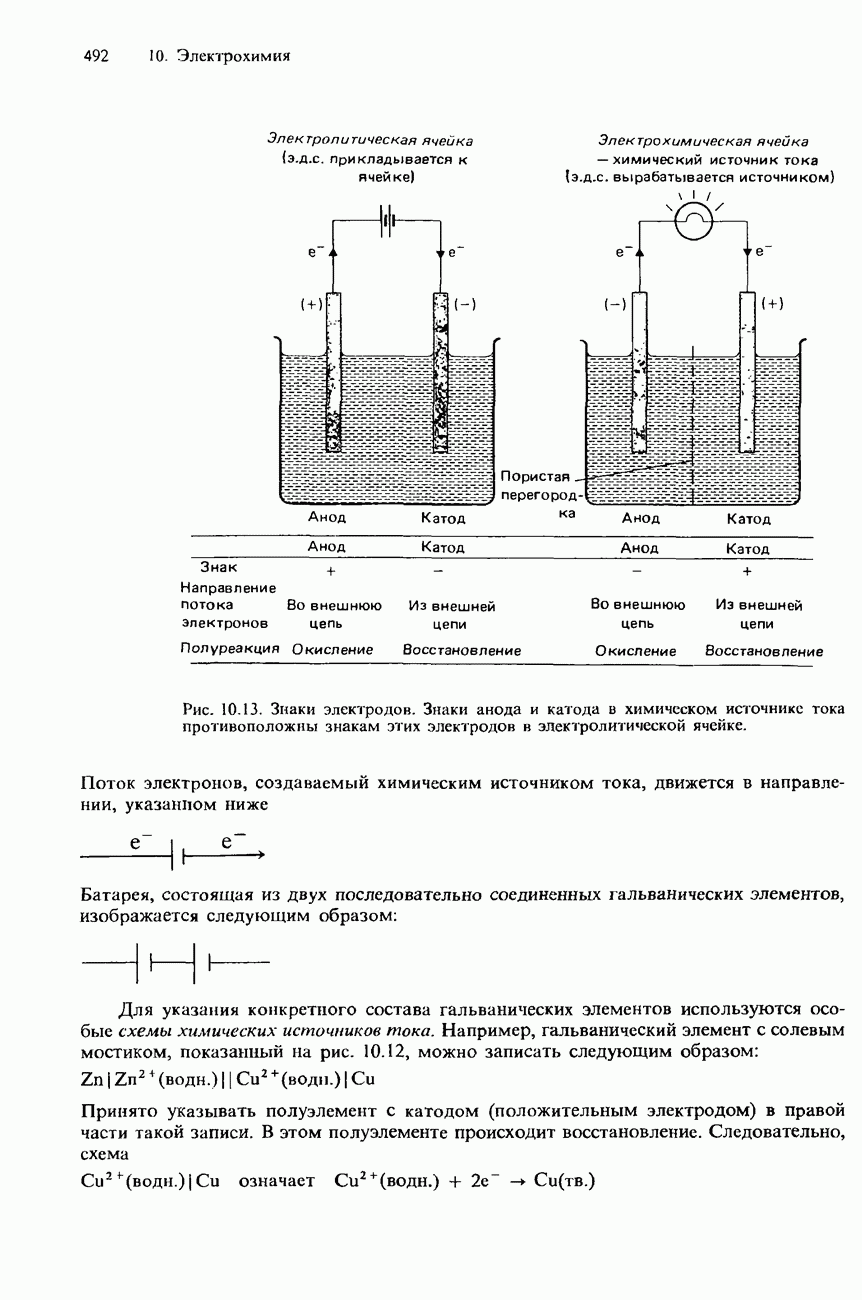
- СХЕМЫ ХИМИЧЕСКИХ ИСТОЧНИКОВ ТОКА
- ТИПЫ ПОЛУЭЛЕМЕНТОВ
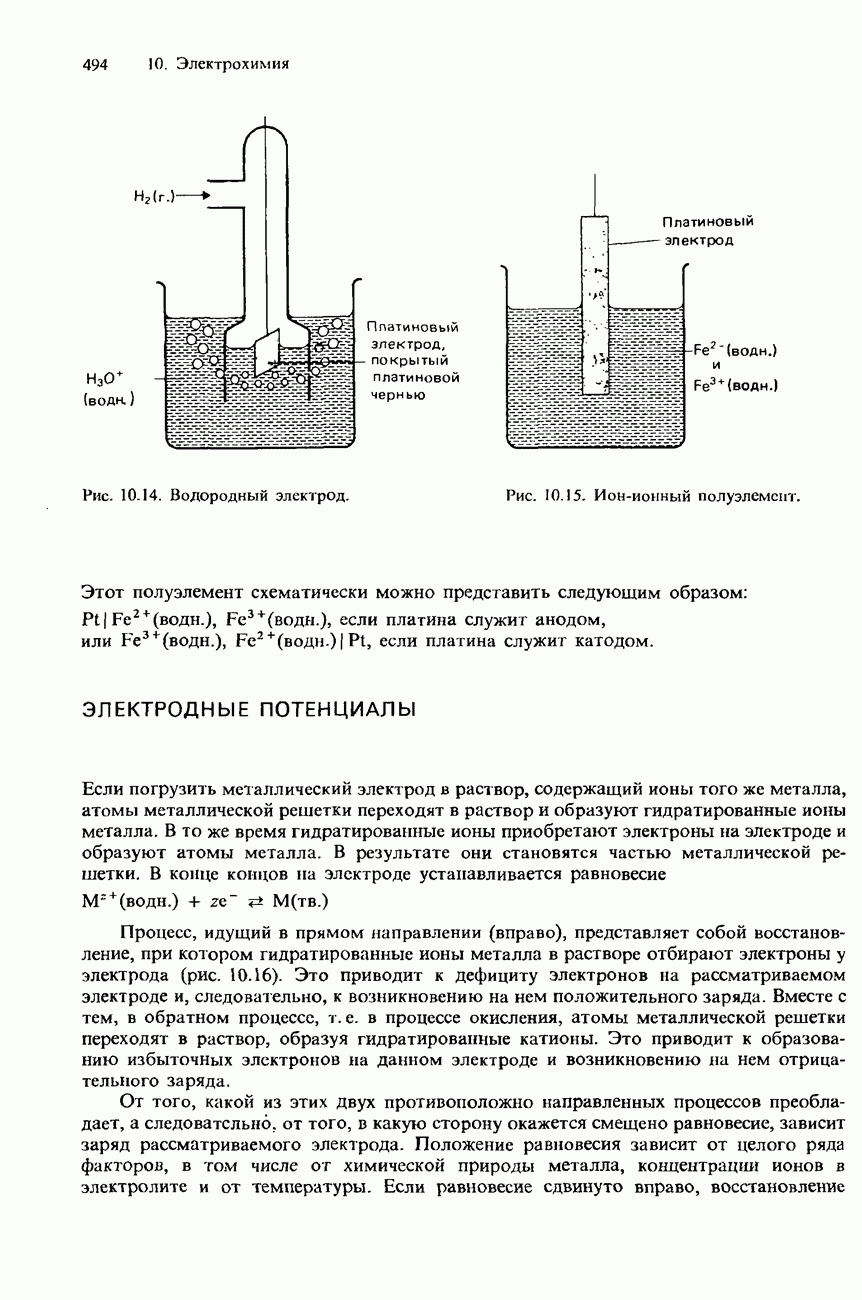
- ЭЛЕКТРОДНЫЕ ПОТЕНЦИАЛЫ
- ЭЛЕКТРОДВИЖУЩАЯ СИЛА ХИМИЧЕСКИХ ИСТОЧНИКОВ ТОКА
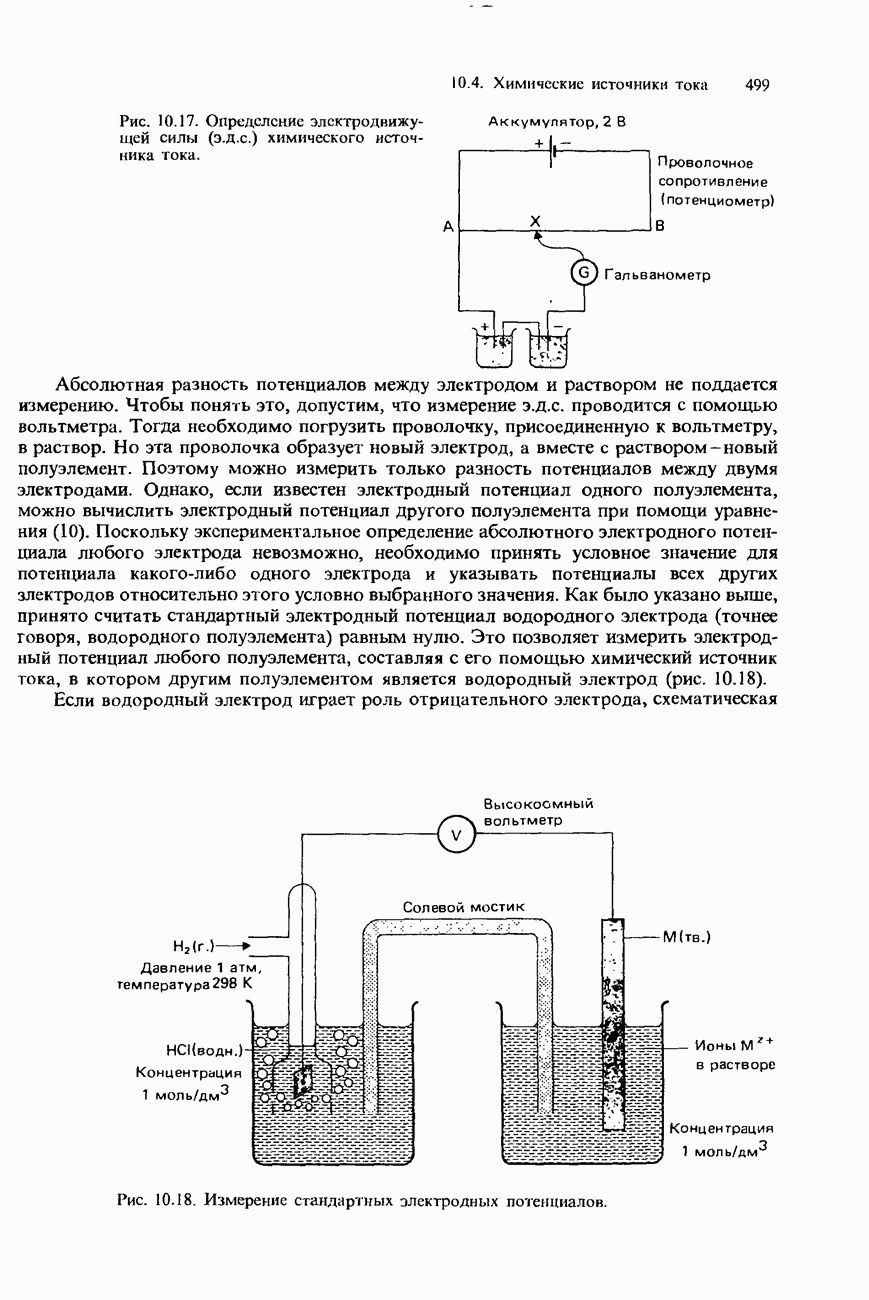
- ИЗМЕРЕНИЕ Э.Д.С. ХИМИЧЕСКИХ ИСТОЧНИКОВ ТОКА И ЭЛЕКТРОДНЫХ ПОТЕНЦИАЛОВ
- 10.5. Применения электрохимии
- ВЫЧИСЛЕНИЕ КОНСТАНТ РАВНОВЕСИЯ ДЛЯ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ
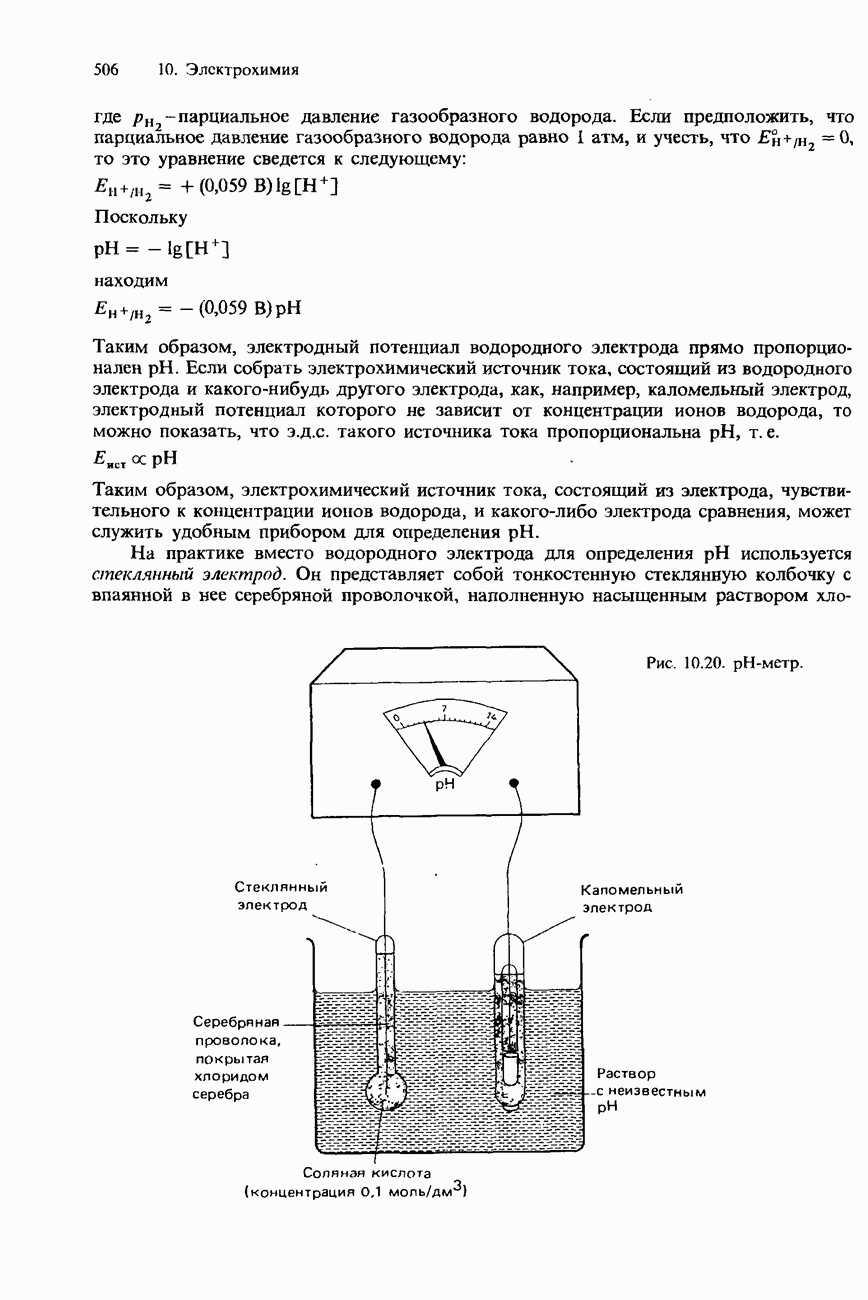
- ОПРЕДЕЛЕНИЕ pH РАСТВОРА
- ПОТЕНЦИОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
- ОСУЩЕСТВИМОСТЬ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ
- ОПРЕДЕЛЕНИЕ ВЕЛИЧИНЫ AG
- БАТАРЕИ И ПРОМЫШЛЕННЫЕ ИСТОЧНИКИ ТОКА
- МЕТАЛЛУРГИЯ
- КОРРОЗИЯ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ