| << Предыдущий параграф | Следующий параграф >> |
Пред.
След.
Макеты страниц
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
ДЛЯ СТУДЕНТОВ И ШКОЛЬНИКОВ ЕСТЬ
ZADANIA.TO
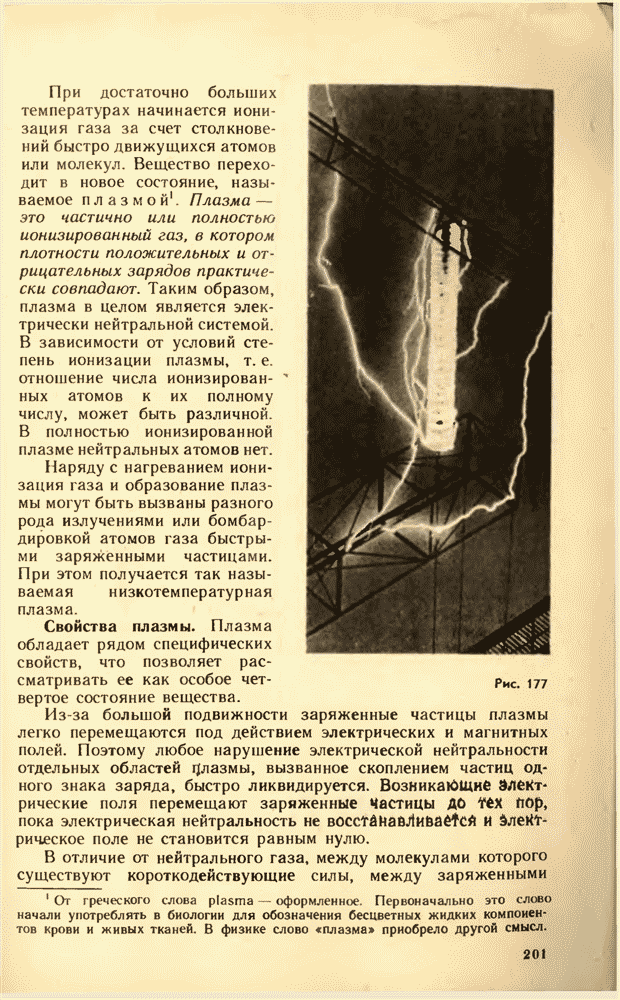
69. ЗАКОН ЭЛЕКТРОЛИЗА
При электролизе на электродах происходит выделение вещества. От чего зависит масса вещества, выделяющегося за определенное время  Очевидно, что эта масса равна произведению массы одного иона
Очевидно, что эта масса равна произведению массы одного иона  на число ионов достигших электрода за время
на число ионов достигших электрода за время 

Масса иона  согласно формуле (1.5) равна:
согласно формуле (1.5) равна:

где  молярная (или атомная) масса вещества,
молярная (или атомная) масса вещества,  постоянная Авогадро, т. е. число ионов в одном моле.
постоянная Авогадро, т. е. число ионов в одном моле.
Число ионов, достигших электрода, равно:

 — заряд, протекший через электролит за время
— заряд, протекший через электролит за время  — заряд иона, который определяется валентностью атома
— заряд иона, который определяется валентностью атома  — модуль элементарного заряда).
— модуль элементарного заряда).
При диссоциации молекул, состоящих из одновалентных атомов  возникают однозарядные ионы. Например, при диссоциации молекул
возникают однозарядные ионы. Например, при диссоциации молекул  возникают ионы
возникают ионы  Диссоциация молекулы медного купороса ведет к появлению двухзарядных ионов
Диссоциация молекулы медного купороса ведет к появлению двухзарядных ионов  так как атомы меди в данном соединении двухвалентны
так как атомы меди в данном соединении двухвалентны  Подставляя в формулу (10.1) выражения (10.2) и (10.3) и учитывая, что
Подставляя в формулу (10.1) выражения (10.2) и (10.3) и учитывая, что  получим:
получим:

Закон Фарадея. Обозначим через  коэффициент пропорциональности между массой вещества
коэффициент пропорциональности между массой вещества  и зарядом
и зарядом  Тогда
Тогда

 — коэффициент пропорциональности, зависящий от природы вещества.
— коэффициент пропорциональности, зависящий от природы вещества.
Следовательно, масса вещества, выделившегося на электроде за время  при прохождении электрического тока, пропорциональна силе тока и времени.
при прохождении электрического тока, пропорциональна силе тока и времени.
Это утверждение, полученное нами теоретически, впервые было установлено экспериментально Фарадеем и носит название закона электролиза Фарадея.
Из формулы (10.5) видно, что коэффициент  численно равен массе выделившегося на электродах вещества при переносе ионами заряда, равного I Кл. Величину
численно равен массе выделившегося на электродах вещества при переносе ионами заряда, равного I Кл. Величину  называют электрохимическим эквивалентом данного вещества и выражают в килограммах на кулон
называют электрохимическим эквивалентом данного вещества и выражают в килограммах на кулон 
Электрохимический эквивалент имеет простой физический

Рис. 166
смысл. Так как  то согласно
то согласно  отношению массы иона к его заряду.
отношению массы иона к его заряду.
Измеряя величины  и
и  можно определить электрохимические эквиваленты различных веществ.
можно определить электрохимические эквиваленты различных веществ.
Убедиться в справедливости закона Фарадея можно на опыте. Соберем установку, показанную на рисунке 166. Все три электролитические ванны заполнены одним и тем же раствором электролита, но токи, проходящие через них, различны. Обозначим силы токов через  Тогда
Тогда  Измеряя массы
Измеряя массы  выделившихся на электродах веществ в разных ваннах, можно убедиться, что они пропорциональны соответствующим силам тока
выделившихся на электродах веществ в разных ваннах, можно убедиться, что они пропорциональны соответствующим силам тока 
Постоянная Фарадея. Произведение элементарного заряда (заряда электрона) на постоянную Авогадро  носит название постоянной Фарадея:
носит название постоянной Фарадея:  Введя постоянную Фарадея в уравнение (10.4) для массы вещества, выделившегося при электролизе, получим:
Введя постоянную Фарадея в уравнение (10.4) для массы вещества, выделившегося при электролизе, получим:

Согласно формуле  численно равна заряду, который надо пропустить через раствор электролита, чтобы выделить на электроде массу вещества, численно равную отношению молярной массы вещества к валентности. Постоянная Фарадея, найденная из опыта, равна:
численно равна заряду, который надо пропустить через раствор электролита, чтобы выделить на электроде массу вещества, численно равную отношению молярной массы вещества к валентности. Постоянная Фарадея, найденная из опыта, равна: 
Определение заряда электрона. Зная постоянную Авогадро и постоянную Фарадея, можно найти модуль заряда электрона:

Именно таким путем и было впервые в  получено значение элементарного электрического заряда.
получено значение элементарного электрического заряда.
1. Что называют электролитической диссоциацией? 2. Почему при прохождении тока по раствору электролита происходит перенос вещества, а при прохождении по металлическому проводнику не происходит?
3. Сформулируйте закон Фарадея для электролиза. 4. Как можно определить элементарный электрический заряд по известному из опыта значению постоянной Фарадея?
| << Предыдущий параграф | Следующий параграф >> |
Оглавление
- ТЕПЛОВЫЕ ЯВЛЕНИЯ. МОЛЕКУЛЯРНАЯ ФИЗИКА
- Глава I. ОСНОВЫ МОЛЕКУЛЯРНО-КИНЕТИЧЕСКОЙ ТЕОРИИ
- 1. ОСНОВНЫЕ ПОЛОЖЕНИЯ МОЛЕКУЛЯРНО-КИНЕТИЧЕСКОЙ ТЕОРИИ. РАЗМЕРЫ МОЛЕКУЛ
- 2. МАССА МОЛЕКУЛ. ПОСТОЯННАЯ АВОГАДРО
- 3. БРОУНОВСКОЕ ДВИЖЕНИЕ.
- 4. СИЛЫ ВЗАИМОДЕЙСТВИЯ МОЛЕКУЛ
- 5. СТРОЕНИЕ ГАЗООБРАЗНЫХ, ЖИДКИХ И ТВЕРДЫХ ТЕЛ
- 6. ИДЕАЛЬНЫЙ ГАЗ В МОЛЕКУЛЯРНО-КИНЕТИЧЕСКОЙ ТЕОРИИ
- 7. ОСНОВНОЕ УРАВНЕНИЕ МОЛЕКУЛЯРНО-КИНЕТИЧЕСКОЙ ТЕОРИИ ГАЗОВ
- ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
- КРАТКИЕ ИТОГИ ГЛАВЫ I
- Глава II. ТЕМПЕРАТУРА. ЭНЕРГИЯ ТЕПЛОВОГО ДВИЖЕНИЯ МОЛЕКУЛ
- 8. ТЕПЛОВОЕ РАВНОВЕСИЕ. ТЕМПЕРАТУРА
- 9. ИЗМЕРЕНИЕ ТЕМПЕРАТУРЫ
- 10. АБСОЛЮТНАЯ ТЕМПЕРАТУРА. ТЕМПЕРАТУРА — МЕРА СРЕДНЕЙ КИНЕТИЧЕСКОЙ ЭНЕРГИИ МОЛЕКУЛ
- 11. ИЗМЕРЕНИЕ СКОРОСТЕЙ МОЛЕКУЛ ГАЗА
- ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
- КРАТКИЕ ИТОГИ ГЛАВЫ II
- Глава III. УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗА. ГАЗОВЫЕ ЗАКОНЫ
- 12. УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗА
- 13. ПРИМЕНЕНИЕ УРАВНЕНИЯ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗА К РАЗЛИЧНЫМ ПРОЦЕССАМ
- 14. ПРИМЕНЕНИЕ ГАЗОВ В ТЕХНИКЕ
- ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
- КРАТКИЕ ИТОГИ ГЛАВЫ III
- Глава IV. ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ
- 16. РАБОТА В ТЕРМОДИНАМИКЕ
- 17. КОЛИЧЕСТВО ТЕПЛОТЫ
- 18. ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ
- 19. ПРИМЕНЕНИЕ ПЕРВОГО ЗАКОНА ТЕРМОДИНАМИКИ К РАЗЛИЧНЫМ ПРОЦЕССАМ
- 20. НЕОБРАТИМОСТЬ ПРОЦЕССОВ В ПРИРОДЕ
- 21. ПРИНЦИПЫ ДЕЙСТВИЯ ТЕПЛОВЫХ ДВИГАТЕЛЕЙ
- 22. КОЭФФИЦИЕНТ ПОЛЕЗНОГО ДЕЙСТВИЯ (КПД) ТЕПЛОВОГО ДВИГАТЕЛЯ. ТЕПЛОВЫЕ ДВИГАТЕЛИ И ОХРАНА ПРИРОДЫ
- ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
- КРАТКИЕ ИТОГИ ГЛАВЫ IV
- Глава V. ВЗАИМНЫЕ ПРЕВРАЩЕНИЯ ЖИДКОСТЕЙ И ГАЗОВ
- 23. НАСЫЩЕННЫЙ ПАР
- 24. ЗАВИСИМОСТЬ ДАВЛЕНИЯ НАСЫЩЕННОГО ПАРА ОТ ТЕМПЕРАТУРЫ. КИПЕНИЕ. КРИТИЧЕСКАЯ ТЕМПЕРАТУРА
- 25. ВЛАЖНОСТЬ ВОЗДУХА
- ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
- КРАТКИЕ ИТОГИ ГЛАВЫ V
- Глава VI. ПОВЕРХНОСТНОЕ НАТЯЖЕНИЕ ЖИДКОСТЕЙ
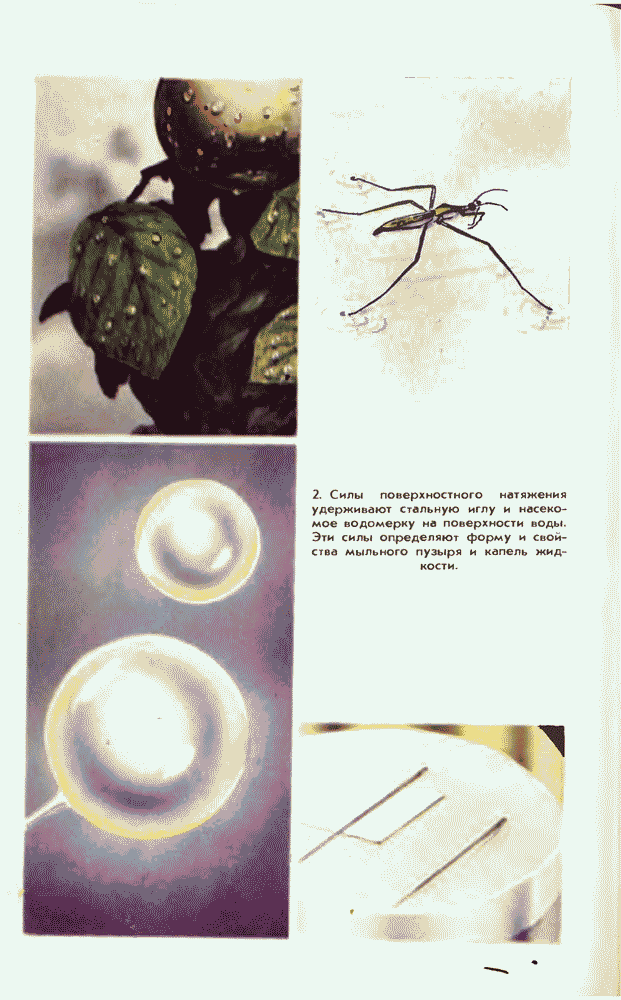
- 27. СИЛА ПОВЕРХНОСТНОГО НАТЯЖЕНИЯ
- 28. КАПИЛЛЯРНЫЕ ЯВЛЕНИЯ
- ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
- КРАТКИЕ ИТОГИ ГЛАВЫ VI
- Глава VII. ТВЕРДЫЕ ТЕЛА
- 29. КРИСТАЛЛИЧЕСКИЕ ТЕЛА
- 30. АМОРФНЫЕ ТЕЛА
- 31. ДЕФОРМАЦИЯ. ВИДЫ ДЕФОРМАЦИИ ТВЕРДЫХ ТЕЛ
- 32. МЕХАНИЧЕСКИЕ СВОЙСТВА ТВЕРДЫХ ТЕЛ. ДИАГРАММА РАСТЯЖЕНИЯ
- 33. ПЛАСТИЧНОСТЬ И ХРУПКОСТЬ
- ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
- КРАТКИЕ ИТОГИ ГЛАВЫ VII
- ОСНОВЫ ЭЛЕКТРОДИНАМИКИ
- 34. ЧТО ТАКОЕ ЭЛЕКТРОДИНАМИКА?
- Глава VIII. ЭЛЕКТРОСТАТИКА
- 35. ЭЛЕКТРИЧЕСКИЙ ЗАРЯД И ЭЛЕМЕНТАРНЫЕ ЧАСТИЦЫ
- 36. ЗАРЯЖЕННЫЕ ТЕЛА. ЭЛЕКТРИЗАЦИЯ ТЕЛ
- 37. ЗАКОН СОХРАНЕНИЯ ЭЛЕКТРИЧЕСКОГО ЗАРЯДА
- 38. ОСНОВНОЙ ЗАКОН ЭЛЕКТРОСТАТИКИ — ЗАКОН КУЛОНА
- 39. ЕДИНИЦА ЭЛЕКТРИЧЕСКОГО ЗАРЯДА
- ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
- 40. БЛИЗКОДЕЙСТВИЕ И ДЕЙСТВИЕ НА РАССТОЯНИИ
- 41. ЭЛЕКТРИЧЕСКОЕ ПОЛЕ
- 42. НАПРЯЖЕННОСТЬ ЭЛЕКТРИЧЕСКОГО ПОЛЯ. ПРИНЦИП СУПЕРПОЗИЦИИ ПОЛЕЙ
- 43. СИЛОВЫЕ ЛИНИИ ЭЛЕКТРИЧЕСКОГО ПОЛЯ
- 44. ПРОВОДНИКИ В ЭЛЕКТРОСТАТИЧЕСКОМ ПОЛЕ
- 45. НАПРЯЖЕННОСТЬ ЭЛЕКТРИЧЕСКОГО ПОЛЯ РАВНОМЕРНО ЗАРЯЖЕННОГО ПРОВОДЯЩЕГО ШАРА И БЕСКОНЕЧНОЙ ПЛОСКОСТИ
- 46. ДИЭЛЕКТРИКИ В ЭЛЕКТРОСТАТИЧЕСКОМ ПОЛЕ. ДВА ВИДА ДИЭЛЕКТРИКОВ
- 47. ПОЛЯРИЗАЦИЯ ДИЭЛЕКТРИКОВ. ДИЭЛЕКТРИЧЕСКАЯ ПРОНИЦАЕМОСТЬ
- 48. ПОТЕНЦИАЛЬНАЯ ЭНЕРГИЯ ЗАРЯЖЕННОГО ТЕЛА В ОДНОРОДНОМ ЭЛЕКТРОСТАТИЧЕСКОМ ПОЛЕ
- 49. ПОТЕНЦИАЛ ЭЛЕКТРОСТАТИЧЕСКОГО ПОЛЯ И РАЗНОСТЬ ПОТЕНЦИАЛОВ
- 50. ПОТЕНЦИАЛ ЭЛЕКТРИЧЕСКОГО ПОЛЯ ТОЧЕЧНОГО ЗАРЯДА
- 51. СВЯЗЬ МЕЖДУ НАПРЯЖЕННОСТЬЮ ЭЛЕКТРИЧЕСКОГО ПОЛЯ И РАЗНОСТЬЮ ПОТЕНЦИАЛОВ. ЭКВИПОТЕНЦИАЛЬНЫЕ ПОВЕРХНОСТИ
- 52. ИЗМЕРЕНИЕ РАЗНОСТИ ПОТЕНЦИАЛОВ
- ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
- 53. ЭЛЕКТРОЕМКОСТЬ. ЕДИНИЦЫ ЭЛЕКТРОЕМКОСТИ
- 54. КОНДЕНСАТОРЫ. ЭЛЕКТРОЕМКОСТЬ ПЛОСКОГО КОНДЕНСАТОРА
- 55. ЭНЕРГИЯ ЗАРЯЖЕННОГО КОНДЕНСАТОРА. ПРИМЕНЕНИЯ КОНДЕНСАТОРОВ
- ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
- КРАТКИЕ ИТОГИ ГЛАВЫ X
- Глава IX. ПОСТОЯННЫЙ ЭЛЕКТРИЧЕСКИЙ ТОК
- 56. ЭЛЕКТРИЧЕСКИЙ ТОК. СИЛА ТОКА
- 57. УСЛОВИЯ, НЕОБХОДИМЫЕ ДЛЯ СУЩЕСТВОВАНИЯ ЭЛЕКТРИЧЕСКОГО ТОКА
- 58. ЗАКОН ОМА ДЛЯ УЧАСТКА ЦЕПИ. СОПРОТИВЛЕНИЕ
- 59. ЗАВИСИМОСТЬ СОПРОТИВЛЕНИЯ ПРОВОДНИКА ОТ ТЕМПЕРАТУРЫ
- 60. СВЕРХПРОВОДИМОСТЬ
- 61. ЭЛЕКТРИЧЕСКИЕ ЦЕПИ. ПОСЛЕДОВАТЕЛЬНОЕ И ПАРАЛЛЕЛЬНОЕ СОЕДИНЕНИЯ ПРОВОДНИКОВ
- 62. ИЗМЕРЕНИЕ СИЛЫ ТОКА И НАПРЯЖЕНИЯ
- 63. РАБОТА И МОЩНОСТЬ ПОСТОЯННОГО ТОКА
- ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
- 64. ЭЛЕКТРОДВИЖУЩАЯ СИЛА
- 65. ЗАКОН ОМА ДЛЯ ЗАМКНУТОЙ ЦЕПИ
- ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
- КРАТКИЕ ИТОГИ ГЛАВЫ IX
- Глава X. ЭЛЕКТРИЧЕСКИЙ ТОК В РАЗЛИЧНЫХ СРЕДАХ
- 66. ЭЛЕКТРИЧЕСКАЯ ПРОВОДИМОСТЬ РАЗЛИЧНЫХ ВЕЩЕСТВ
- 67. ЭЛЕКТРОННАЯ ПРОВОДИМОСТЬ МЕТАЛЛОВ
- 68. ЭЛЕКТРИЧЕСКИЙ ТОК В ЖИДКОСТЯХ
- 69. ЗАКОН ЭЛЕКТРОЛИЗА
- 70. ЭЛЕКТРИЧЕСКИЙ ТОК В ГАЗАХ
- 71. НЕСАМОСТОЯТЕЛЬНЫЙ И САМОСТОЯТЕЛЬНЫЙ РАЗРЯДЫ
- 72. РАЗЛИЧНЫЕ ТИПЫ САМОСТОЯТЕЛЬНОГО РАЗРЯДА И ИХ ТЕХНИЧЕСКИЕ ПРИМЕНЕНИЯ
- 73. ПЛАЗМА
- 74. ЭЛЕКТРИЧЕСКИЙ ТОК В ВАКУУМЕ
- 75. ДВУХЭЛЕКТРОДНАЯ ЭЛЕКТРОННАЯ ЛАМПА-ДИОД
- 76. ЭЛЕКТРОННЫЕ ПУЧКИ. ЭЛЕКТРОННОЛУЧЕВАЯ ТРУБКА
- 77. ЭЛЕКТРИЧЕСКИЙ ТОК В ПОЛУПРОВОДНИКАХ
- 78. ЭЛЕКТРИЧЕСКАЯ ПРОВОДИМОСТЬ ПОЛУПРОВОДНИКОВ ПРИ НАЛИЧИИ ПРИМЕСЕЙ
- 79. ЭЛЕКТРИЧЕСКИЙ ТОК ЧЕРЕЗ КОНТАКТ ПОЛУПРОВОДНИКОВ p- И n- ТИПОВ
- 80. ПОЛУПРОВОДНИКОВЫЙ ДИОД
- 81. ТРАНЗИСТОР
- 82. ТЕРМИСТОРЫ И ФОТОРЕЗИСТОРЫ
- ПРИМЕР РЕШЕНИЯ ЗАДАЧИ
- КРАТКИЕ ИТОГИ ГЛАВЫ X
- Глава XI. МАГНИТНОЕ ПОЛЕ
- 83. ВЗАИМОДЕЙСТВИЕ ТОКОВ. МАГНИТНОЕ ПОЛЕ
- 84. ВЕКТОР МАГНИТНОЙ ИНДУКЦИИ
- 85. ЛИНИИ МАГНИТНОЙ ИНДУКЦИИ
- 86. ЭЛЕКТРОИЗМЕРИТЕЛЬНЫЕ ПРИБОРЫ
- 87. МОДУЛЬ ВЕКТОРА МАГНИТНОЙ ИНДУКЦИИ. МАГНИТНЫЙ ПОТОК
- 88. ЗАКОН АМПЕРА
- 89. ДЕЙСТВИЕ МАГНИТНОГО ПОЛЯ НА ДВИЖУЩИЙСЯ ЗАРЯД. СИЛА ЛОРЕНЦА
- 90. МАГНИТНЫЕ СВОЙСТВА ВЕЩЕСТВА
- ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
- КРАТКИЕ ИТОГИ ГЛАВЫ XI
- Глава XII. ЭЛЕКТРОМАГНИТНАЯ ИНДУКЦИЯ
- 91. ОТКРЫТИЕ ЭЛЕКТРОМАГНИТНОЙ ИНДУКЦИИ
- 92. НАПРАВЛЕНИЕ ИНДУКЦИОННОГО ТОКА. ПРАВИЛО ЛЕНЦА
- 93. ЗАКОН ЭЛЕКТРОМАГНИТНОЙ ИНДУКЦИИ
- 94. ВИХРЕВОЕ ЭЛЕКТРИЧЕСКОЕ ПОЛЕ
- 95. ЭДС ИНДУКЦИИ В ДВИЖУЩИХСЯ ПРОВОДНИКАХ
- 96. САМОИНДУКЦИЯ. ИНДУКТИВНОСТЬ
- 97. ЭНЕРГИЯ МАГНИТНОГО ПОЛЯ ТОКА
- 98. ОСНОВНЫЕ ЗАКОНЫ ЭЛЕКТРОДИНАМИКИ И ИХ ТЕХНИЧЕСКОЕ ПРИМЕНЕНИЕ
- ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
- КРАТКИЕ ИТОГИ ГЛАВЫ XII
- ЗАКЛЮЧЕНИЕ
- ЛАБОРАТОРНЫЕ РАБОТЫ
- ОТВЕТЫ К УПРАЖНЕНИЯМ