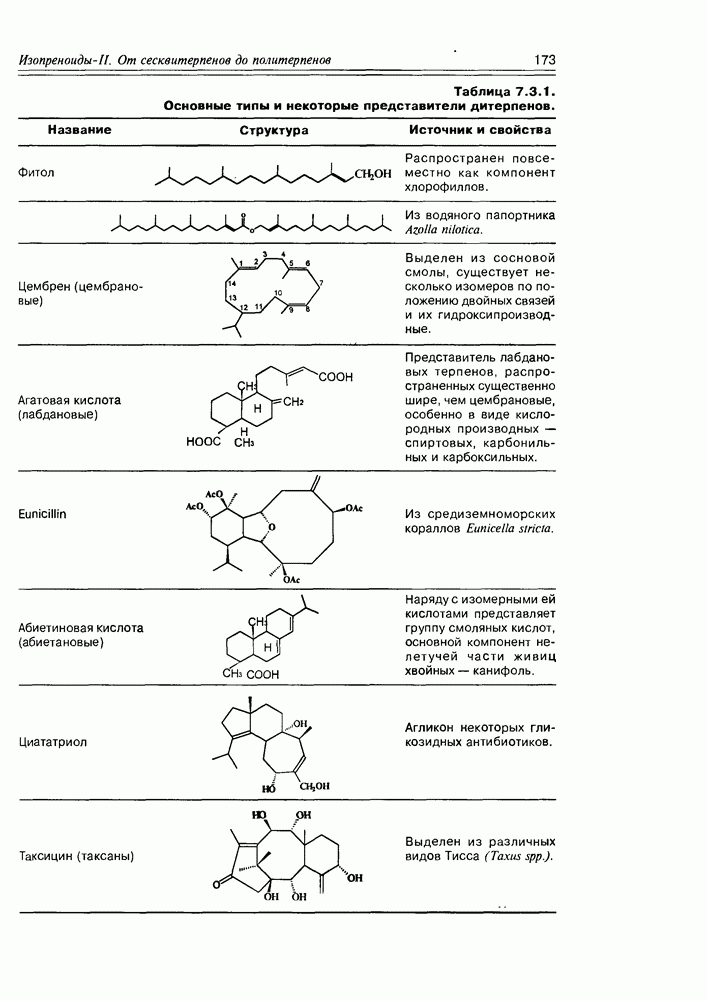
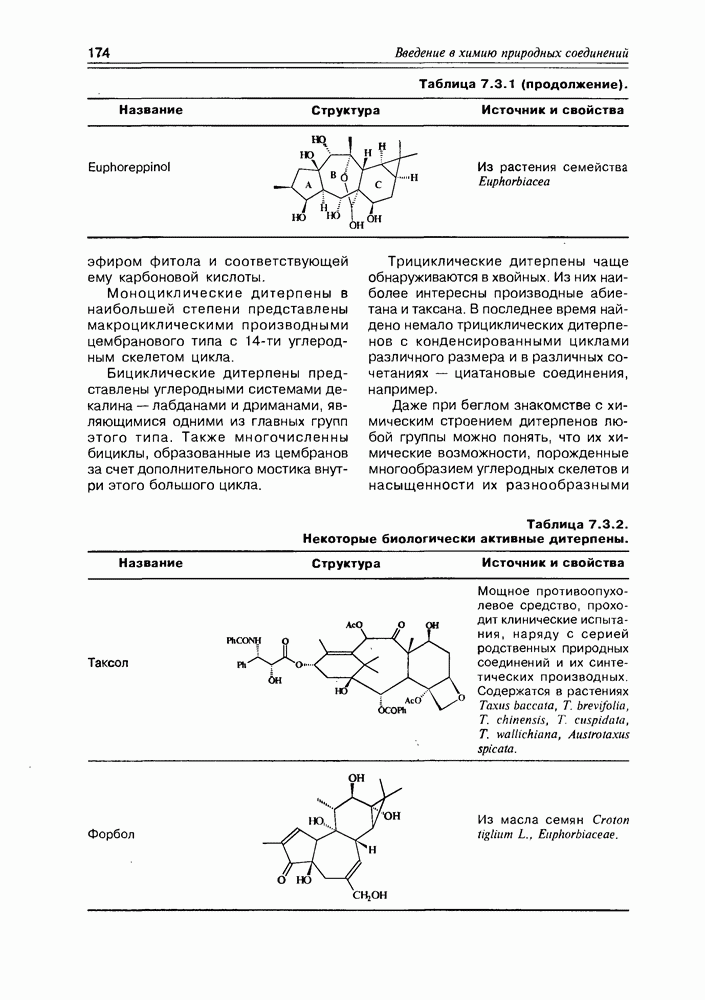
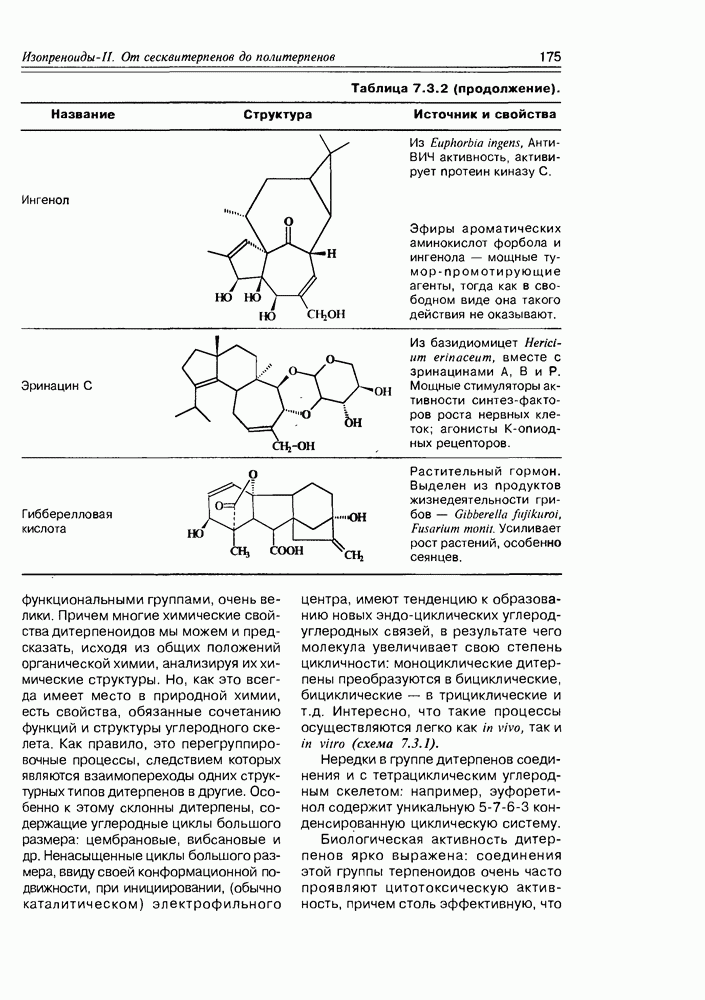
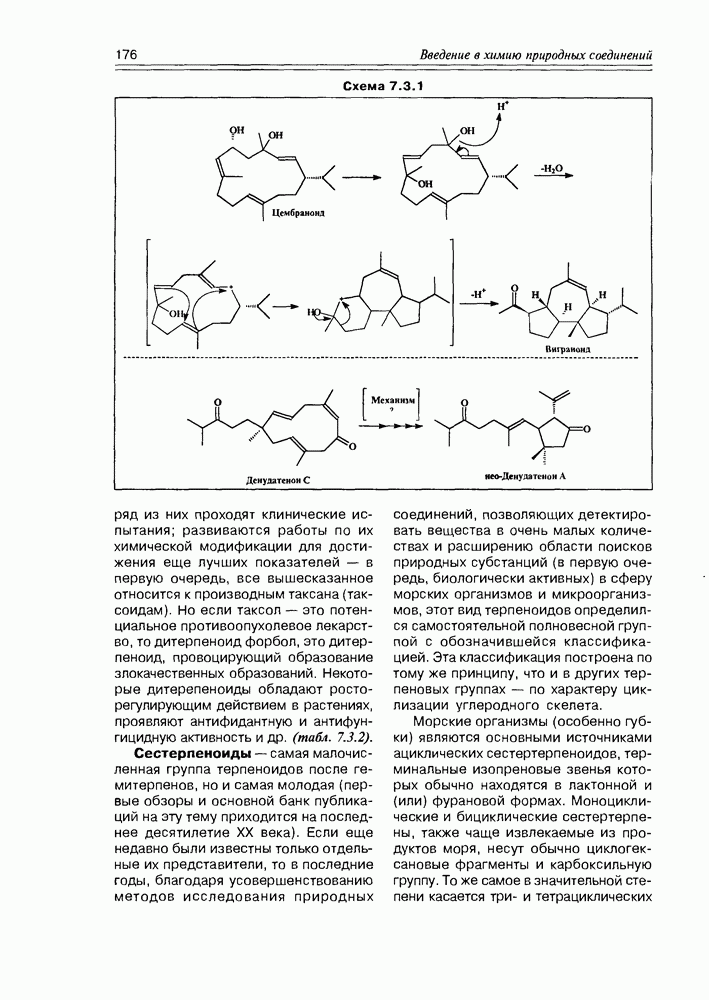
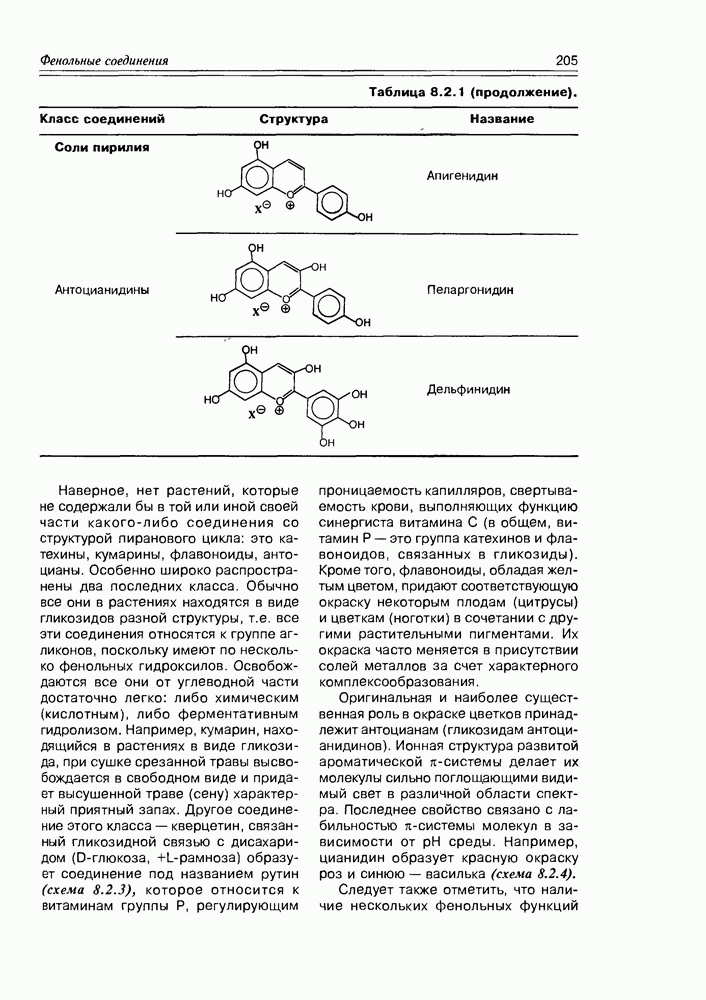
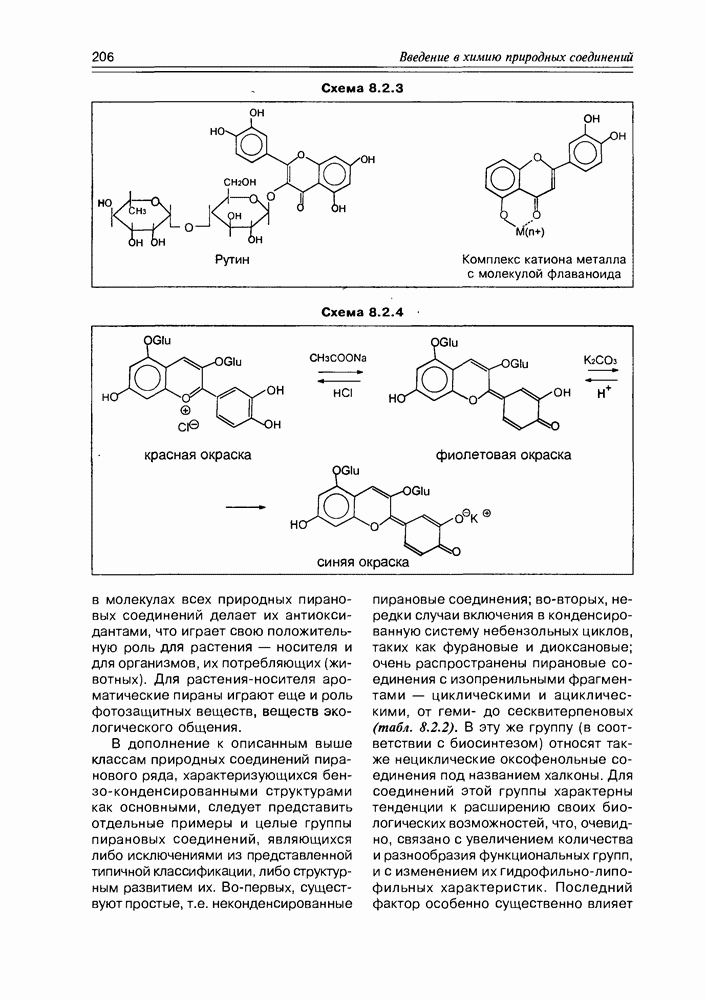
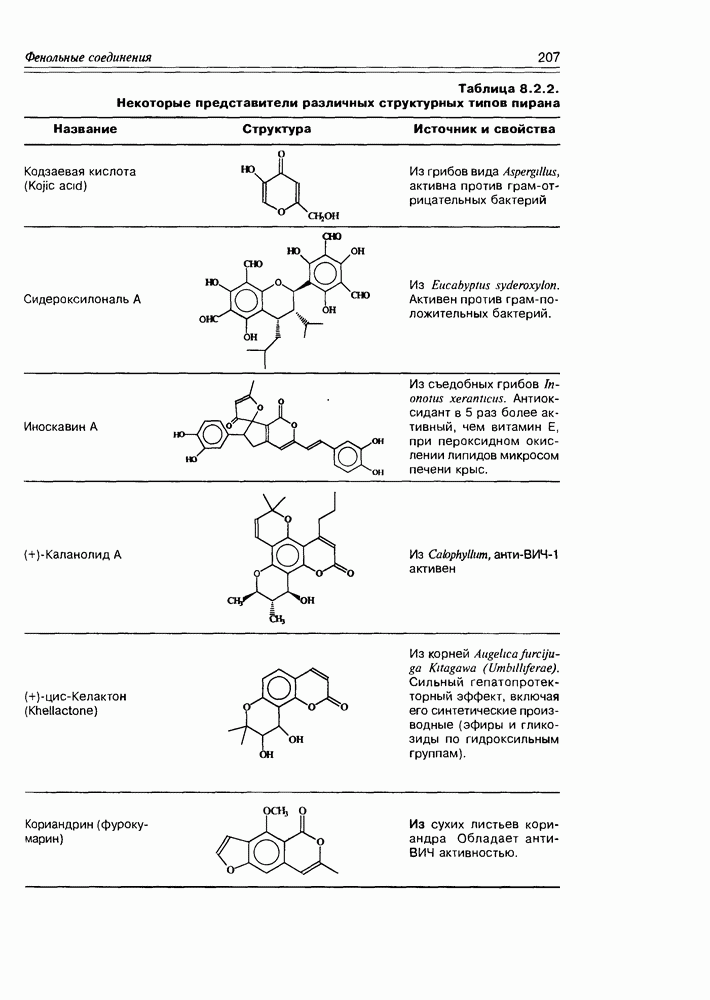
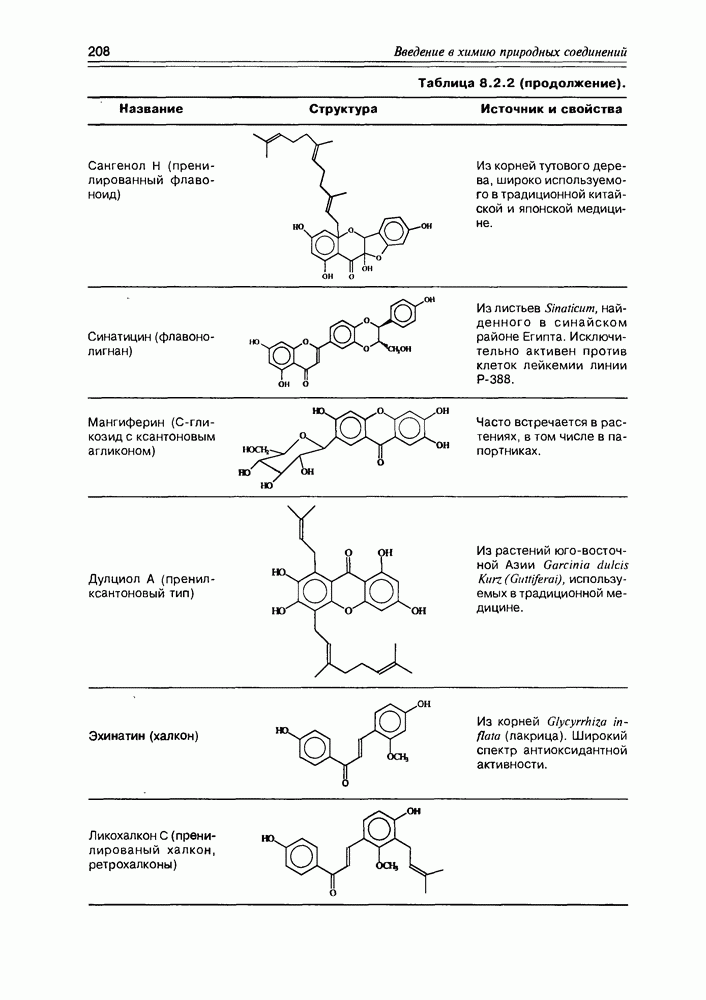
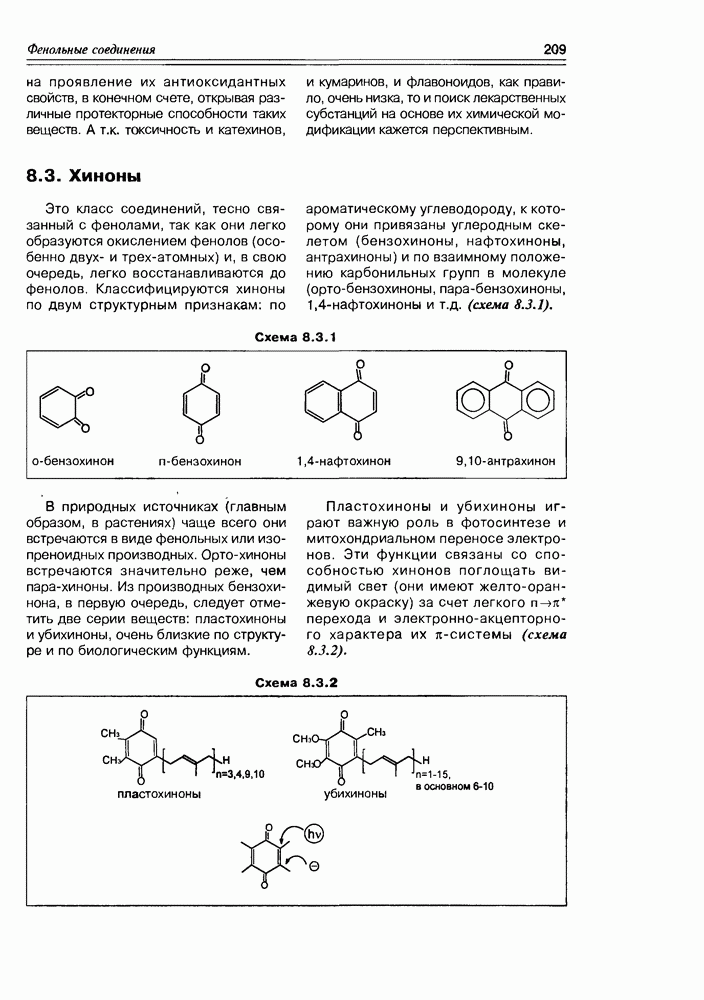
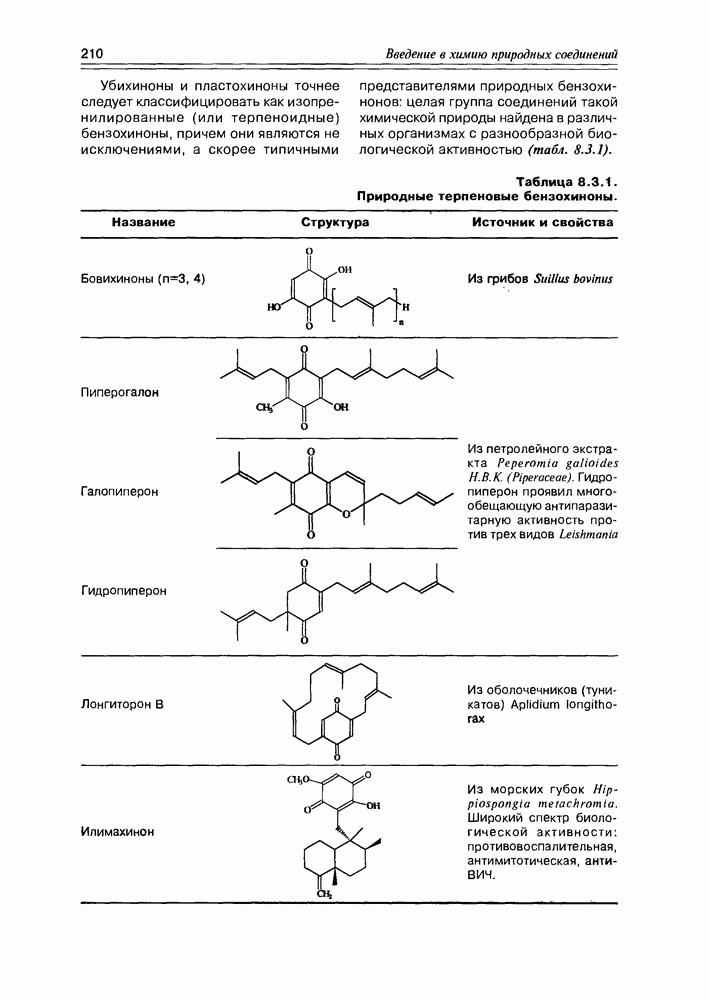
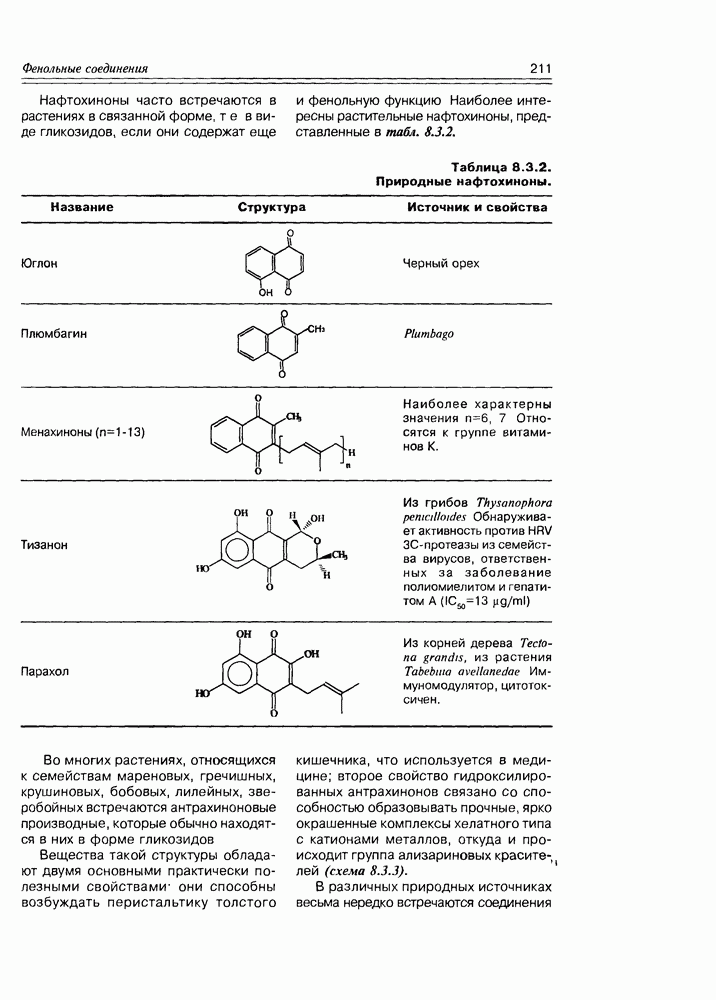
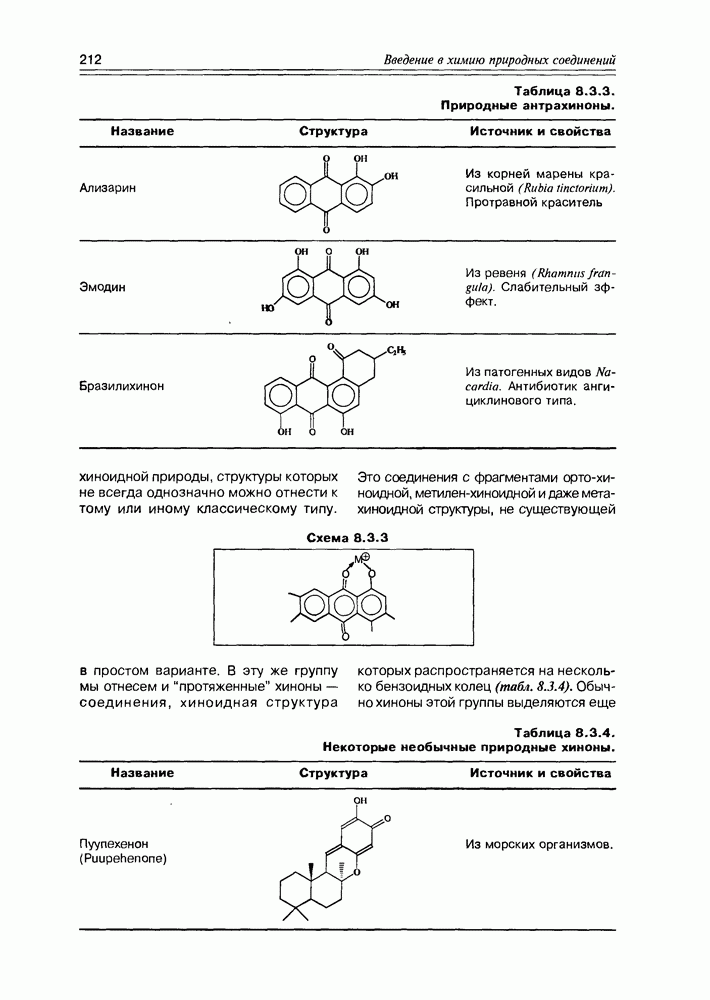
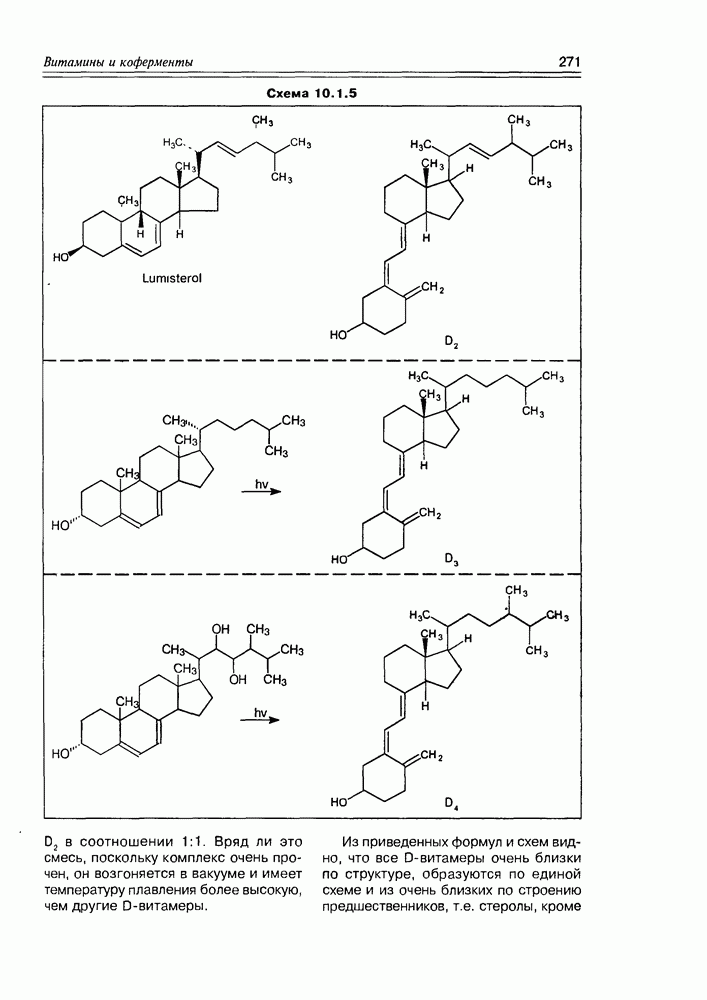
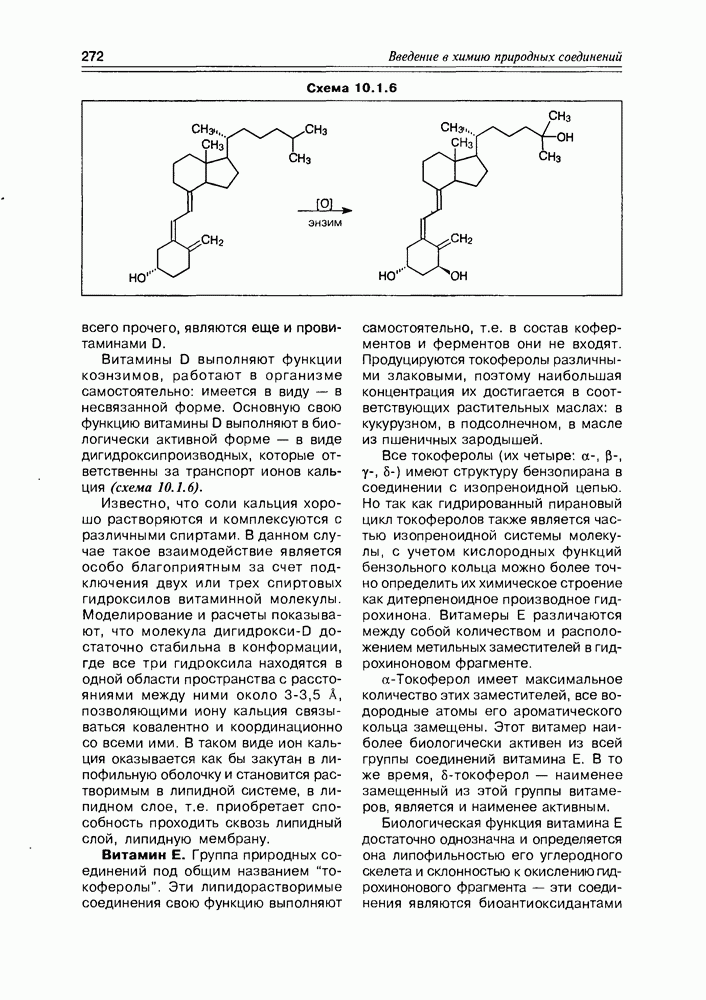
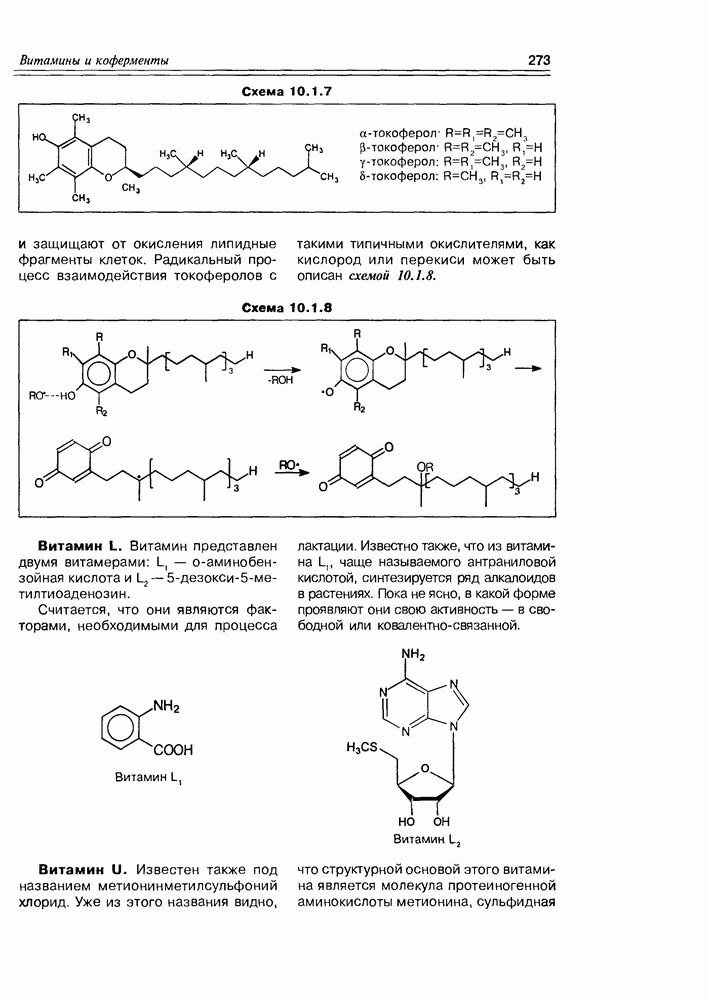
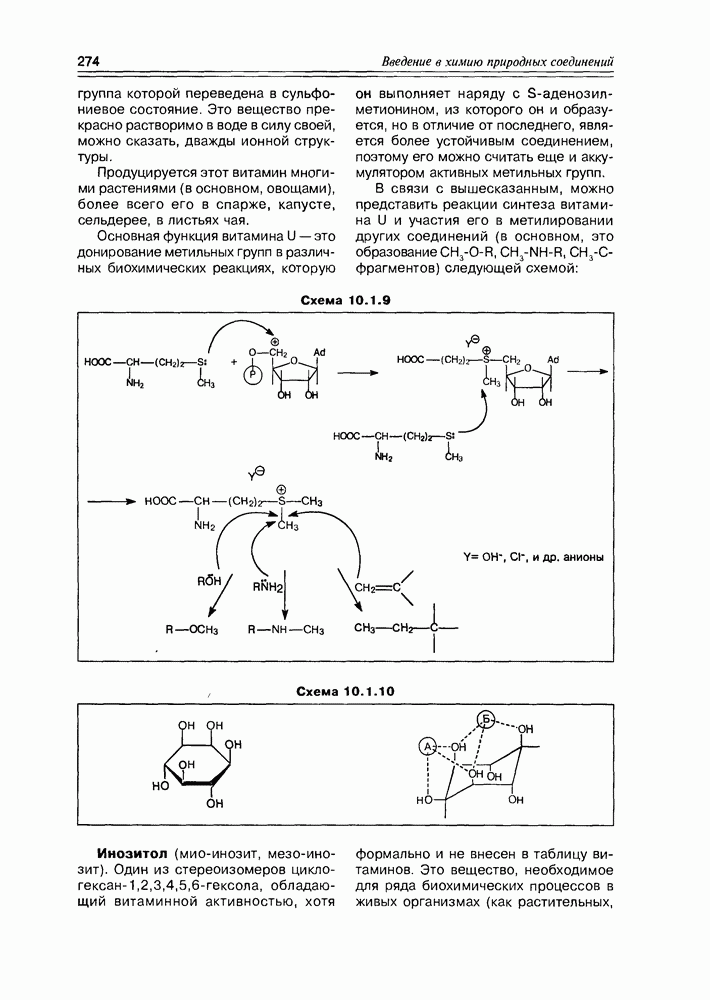
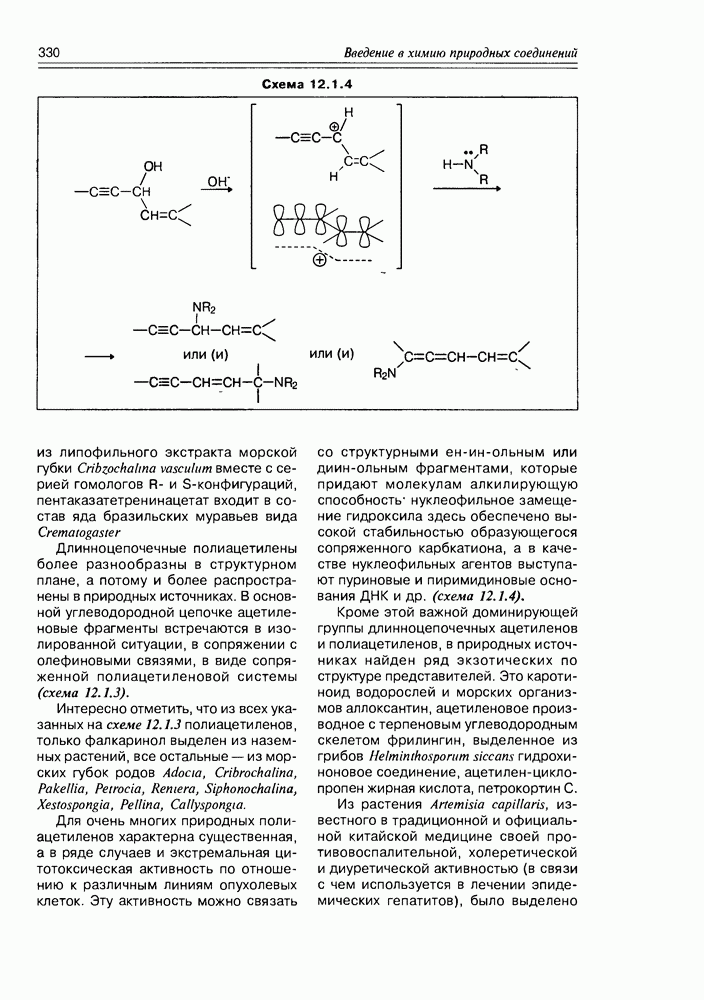
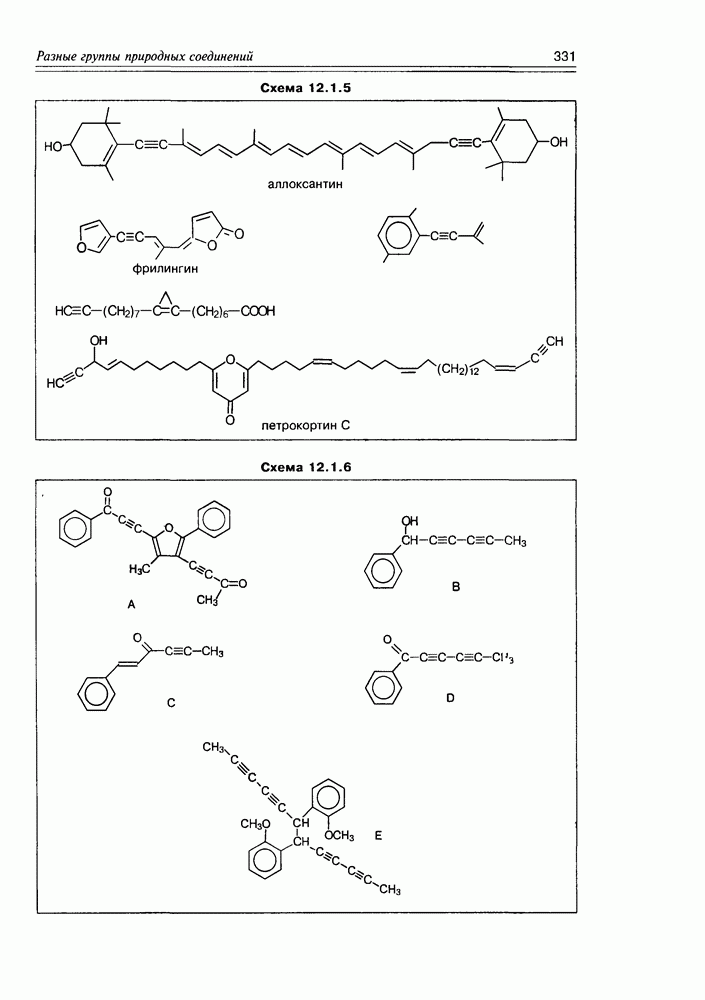
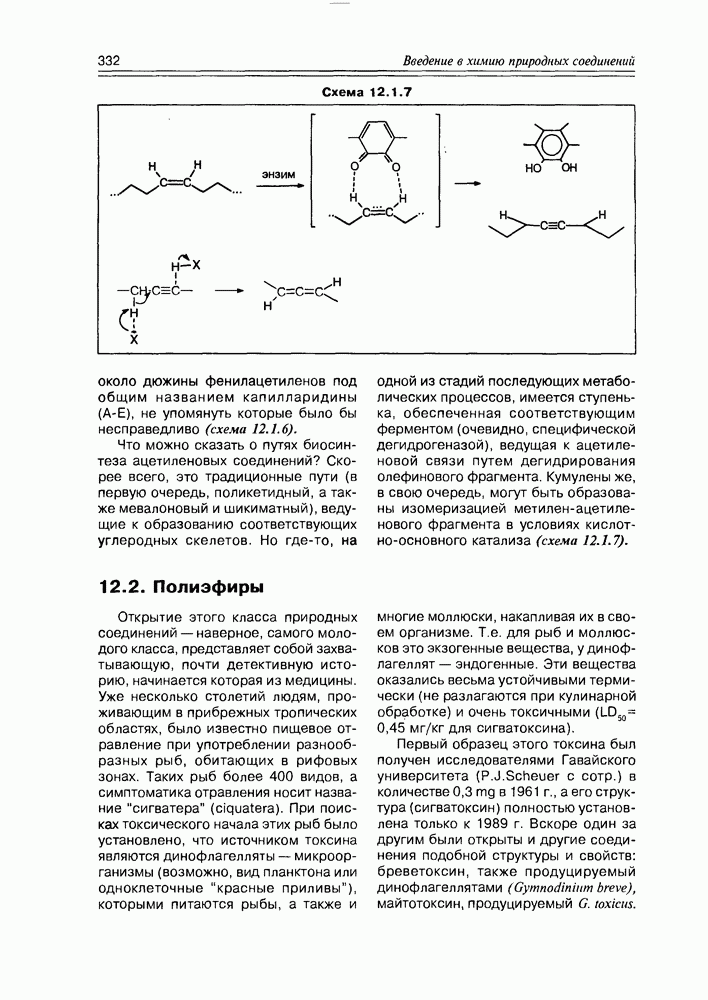
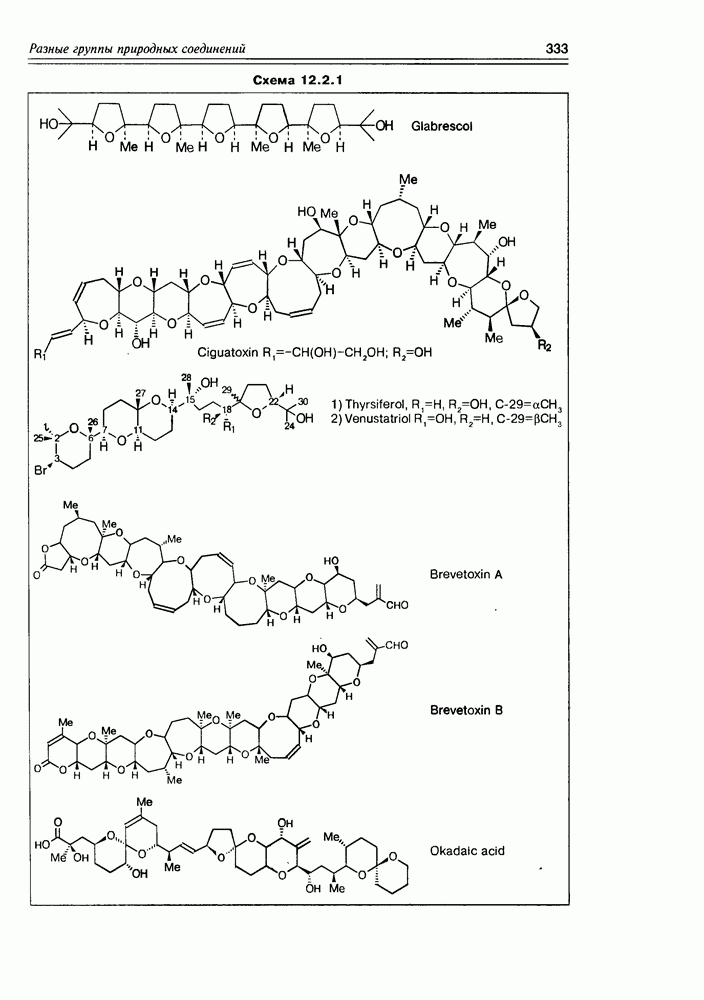
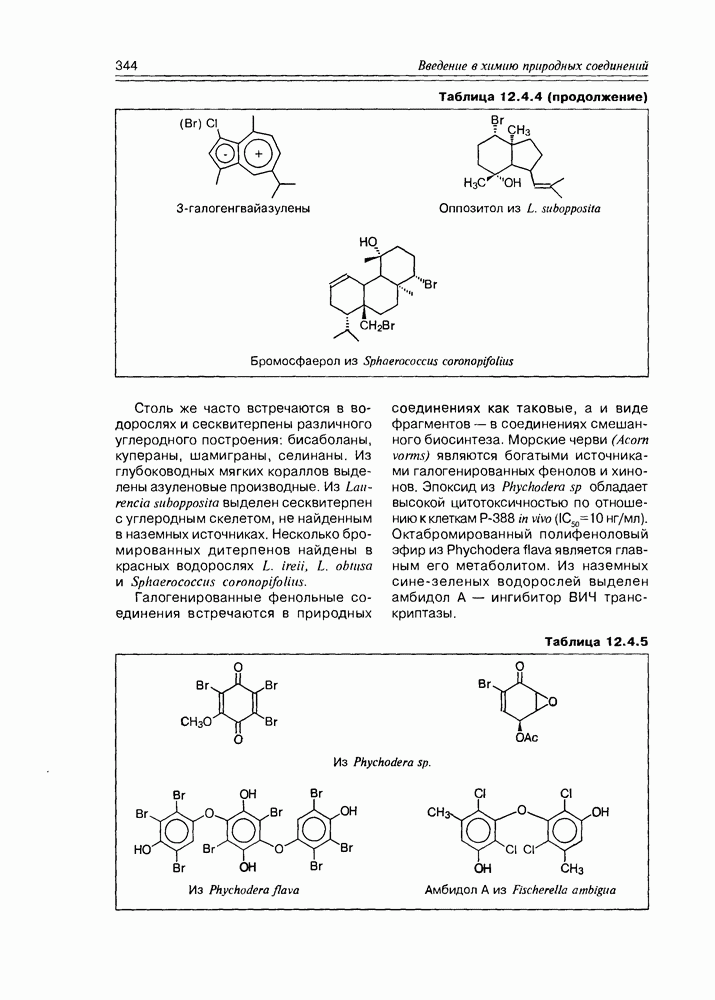
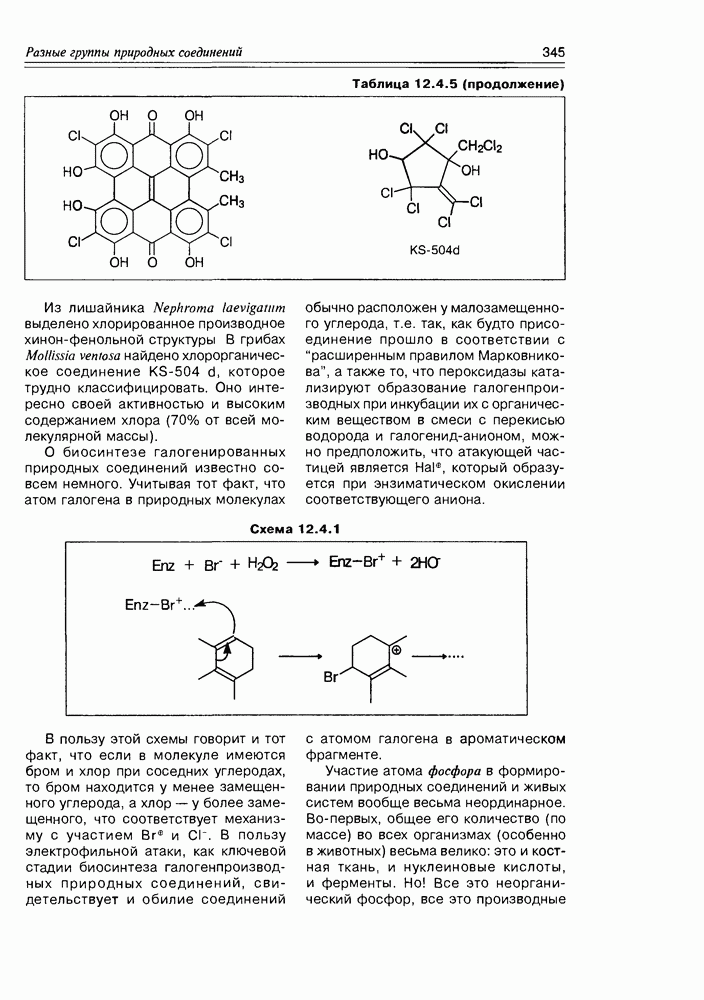
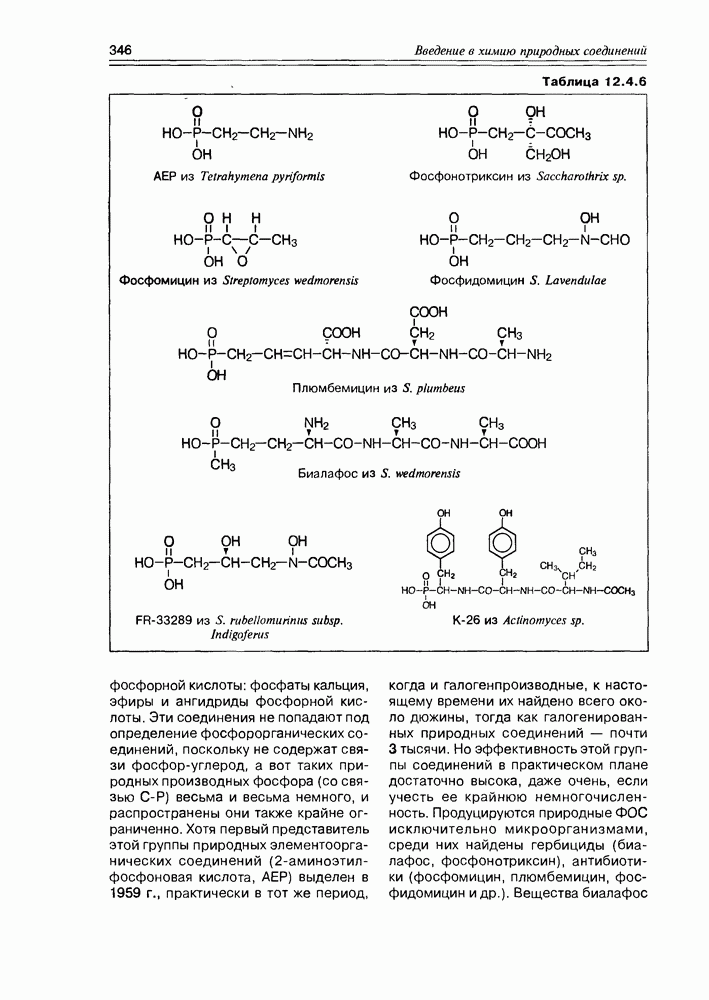
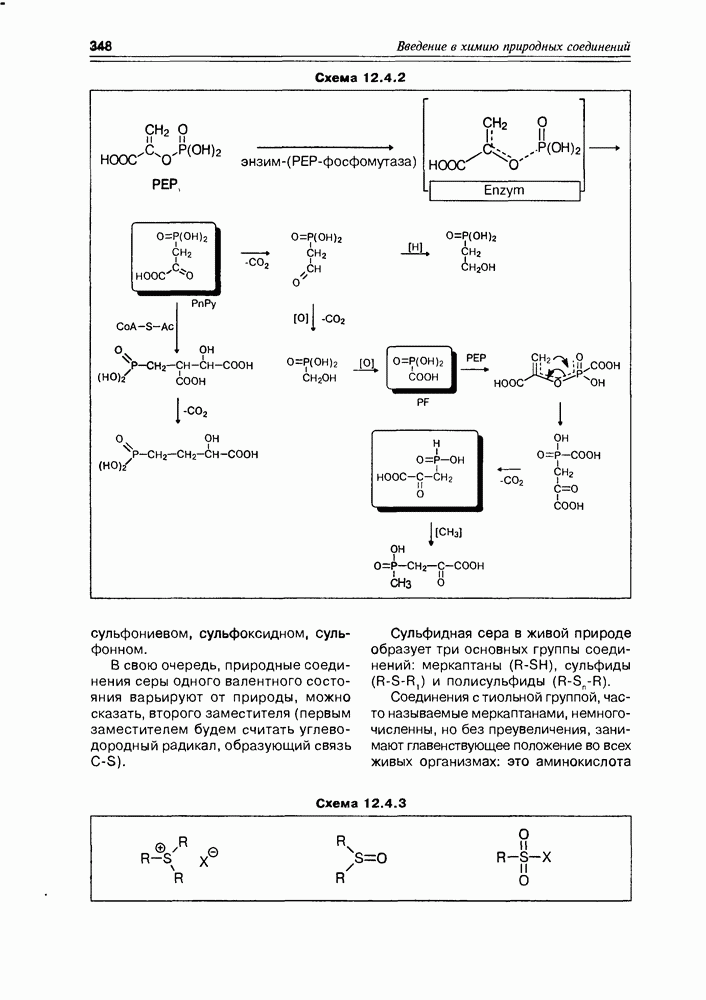
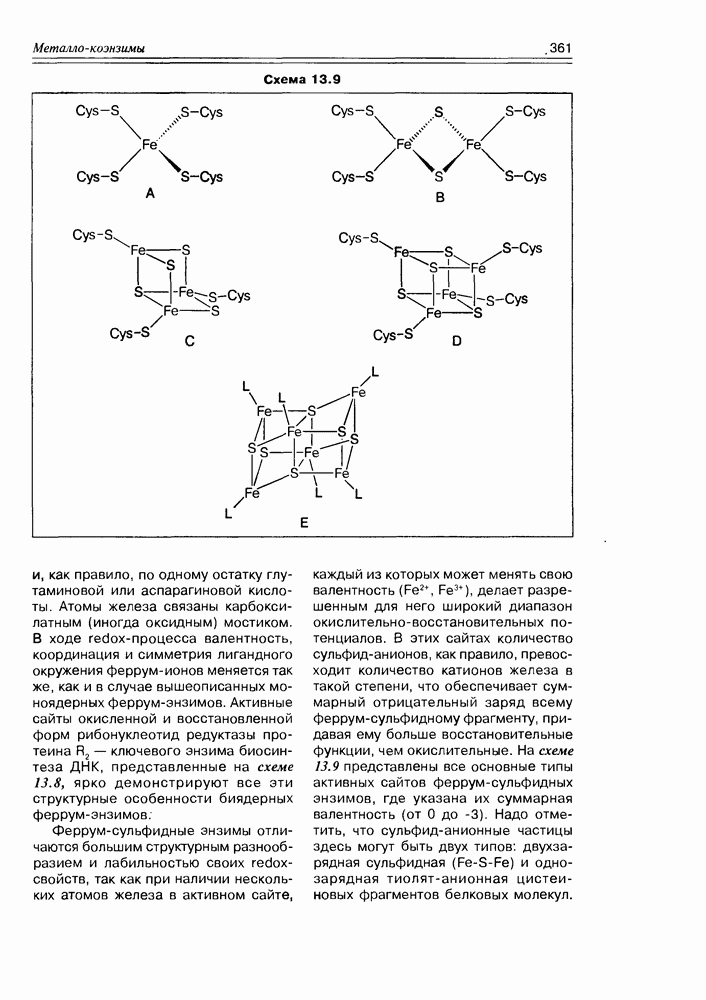
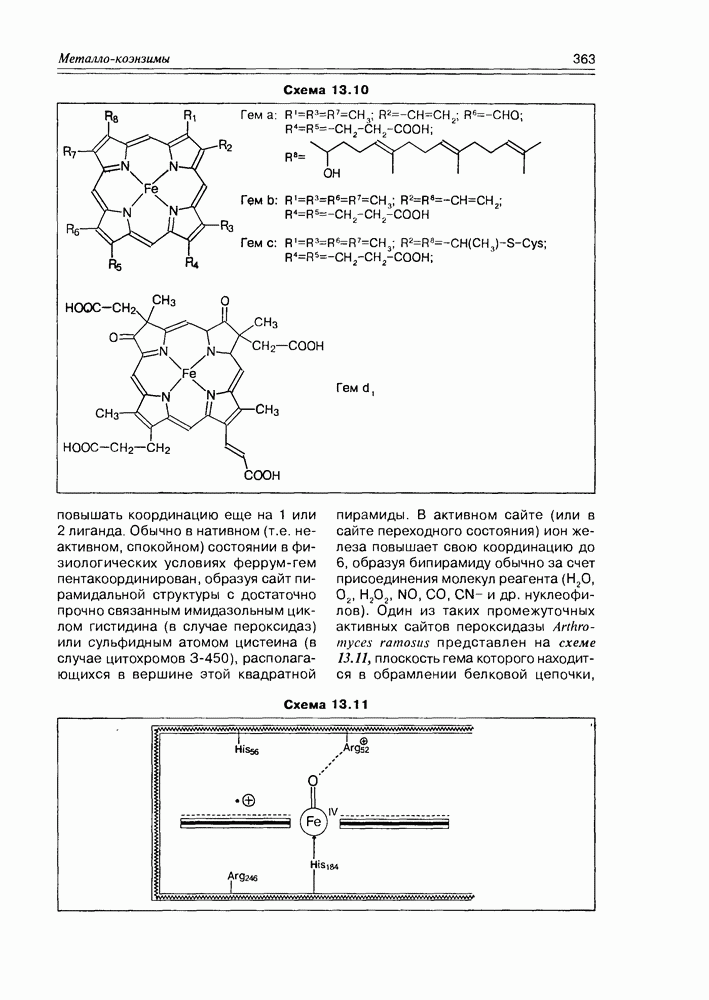
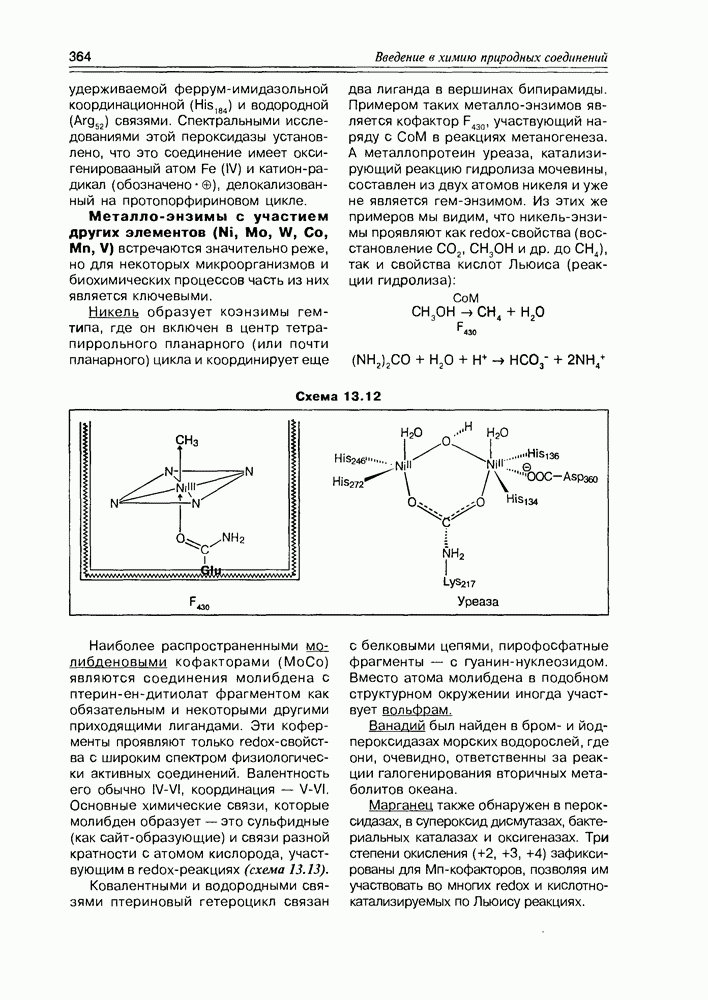
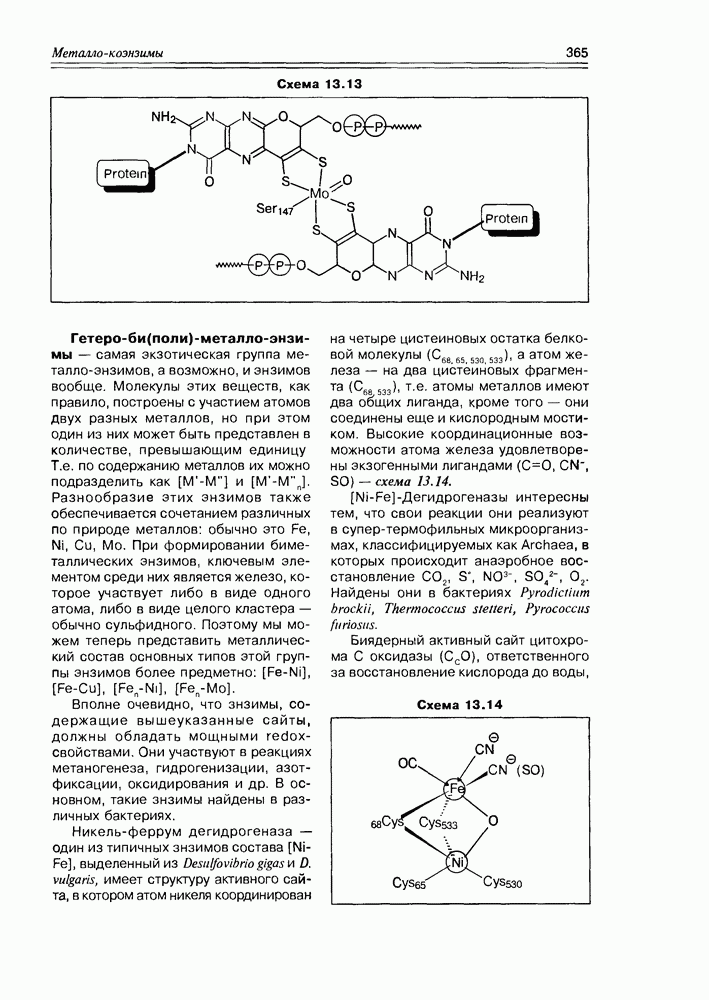
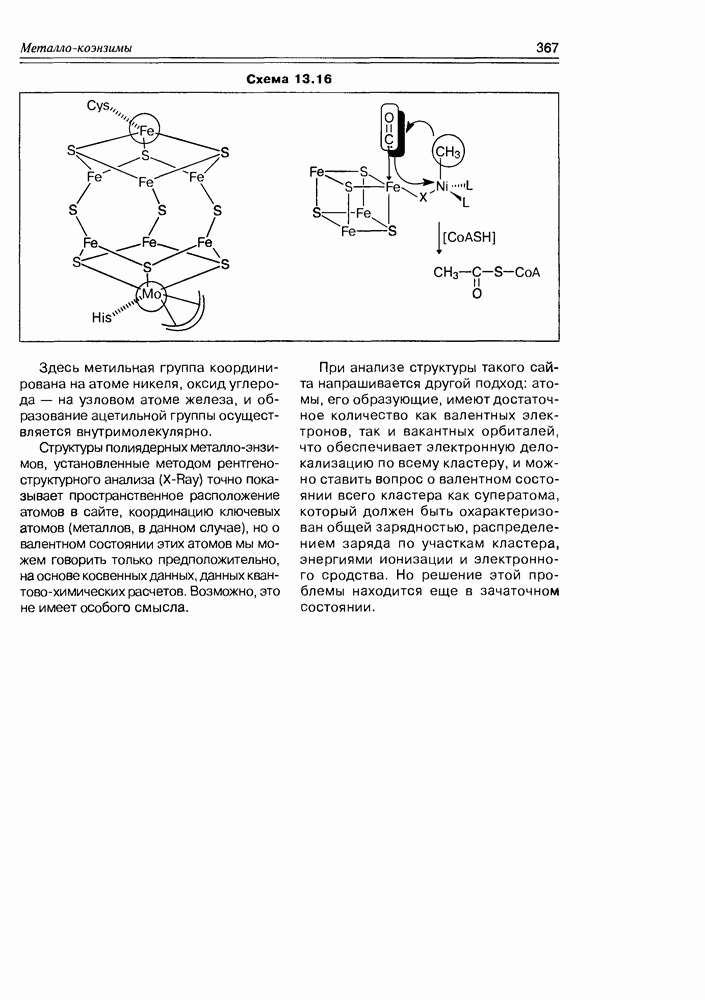
| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
3.3. Химические свойства моносахаридов
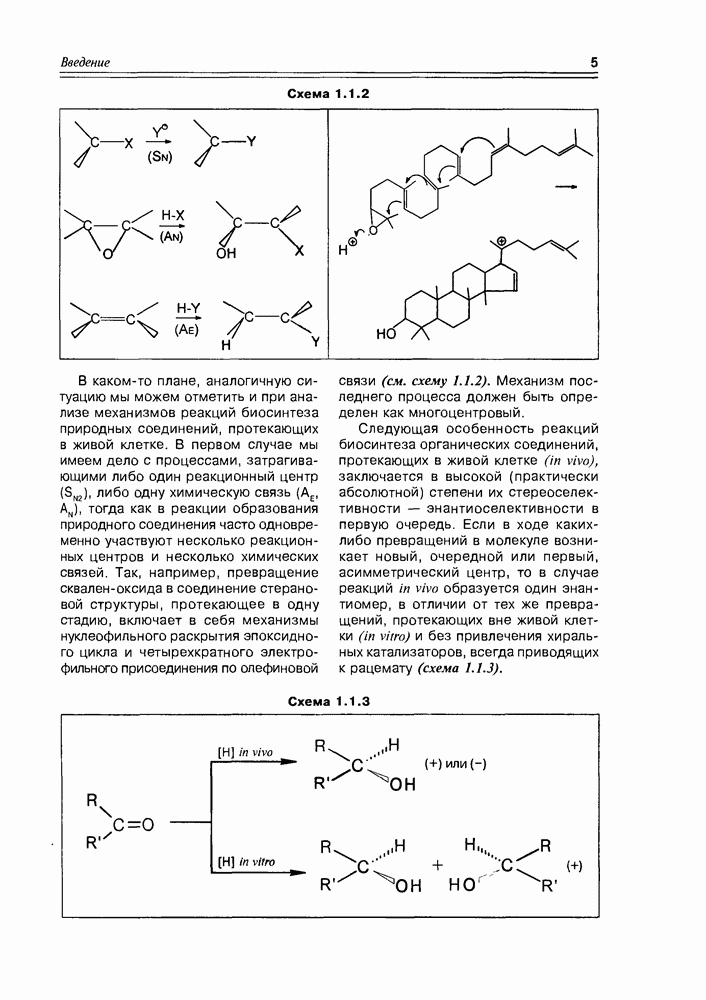
Химические свойства моносахаридов, как и других бифункциональных соединений, могут быть разделены на три группы: это свойства спиртов, карбонильных соединений, и специфические реакции, обязанные взаимному влиянию и взаимному участию спиртовых и карбонильных функций.
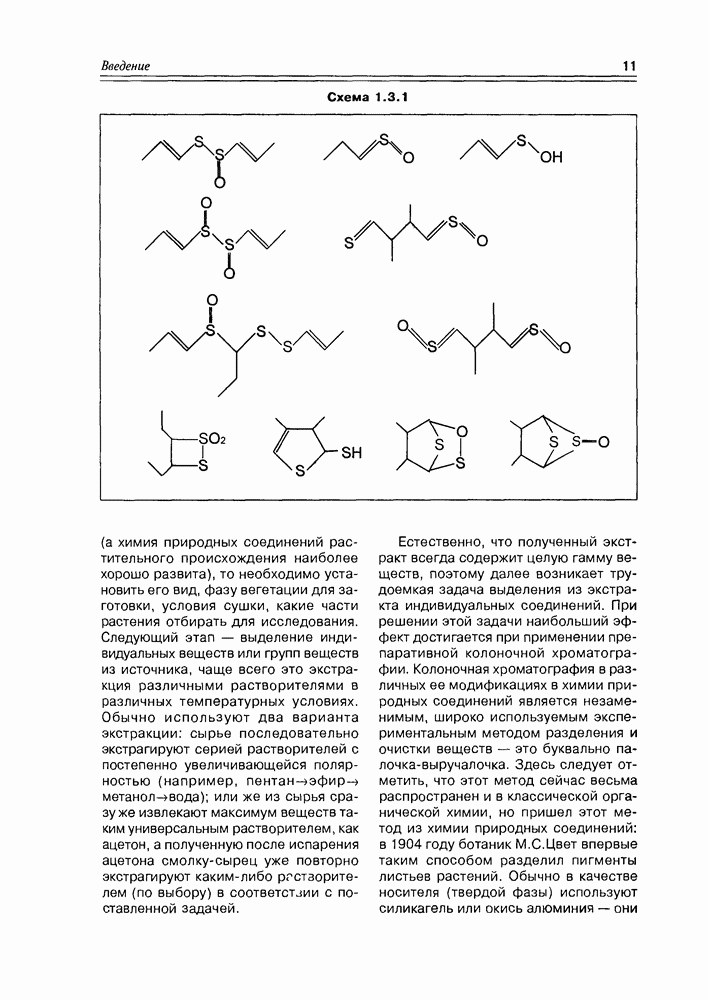
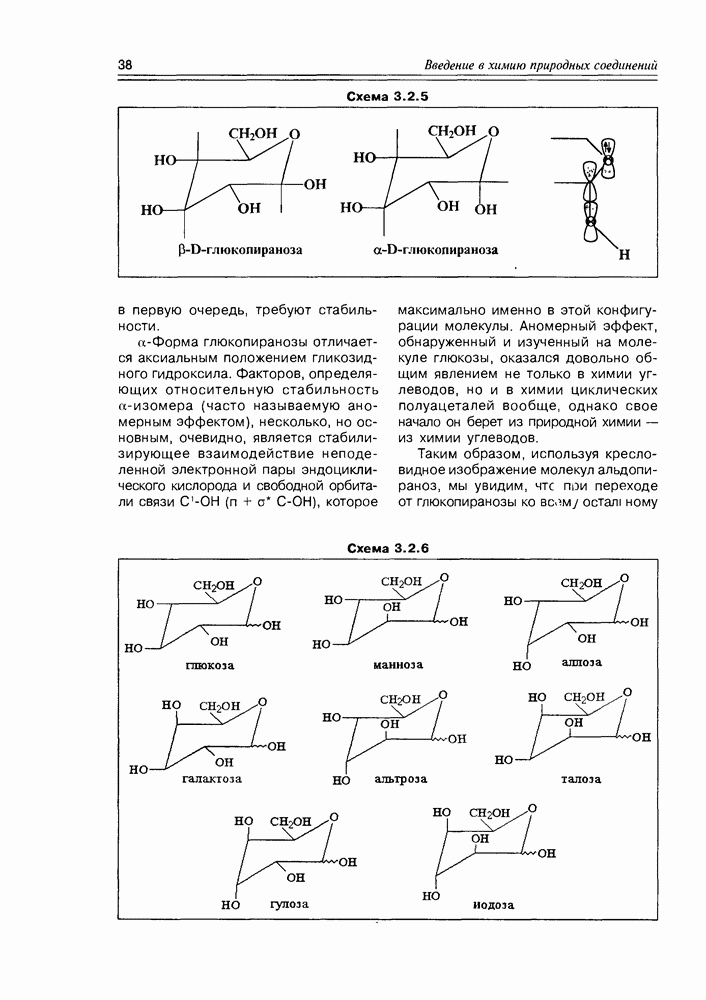
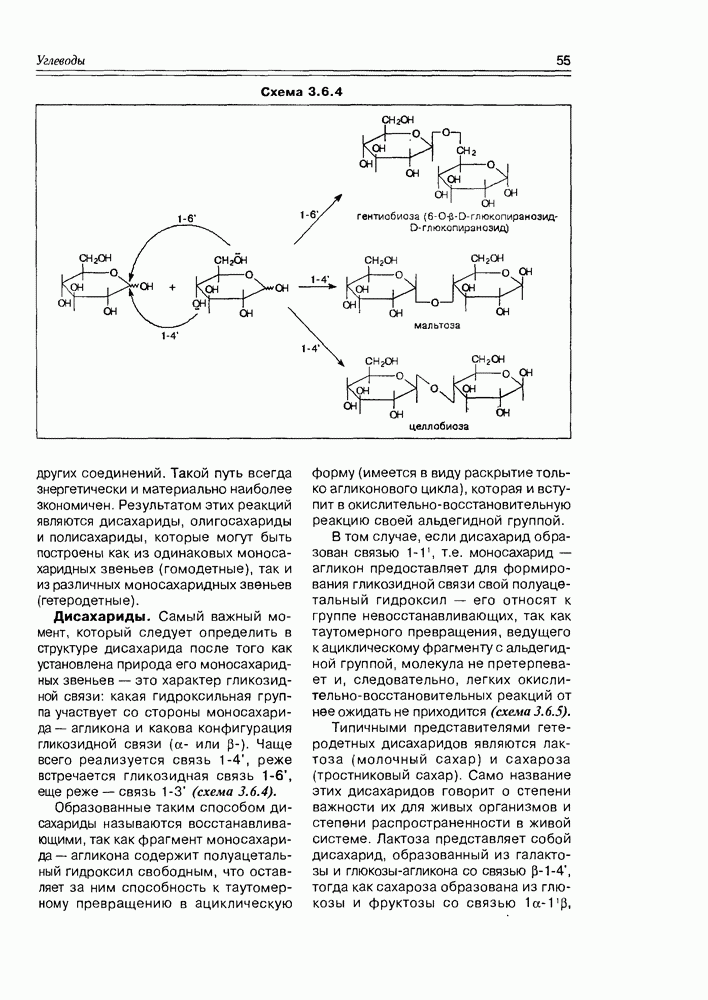
Из типичных спиртовых свойств моносахаридов следует отметить, в первую очередь, реакции этерификации различного типа, ведущие к образованию сложных эфиров карбоновых кислот, сложных эфиров минеральных кислот, простых алкиловых эфиров (схема 3.3.1). Так как в молекуле любого моносахарида содержится несколько спиртовых групп, то очевидно, что в любом случае эти реакции могут иметь различную степень кратности, т.е. могут быть получены, в зависимости от активности реагента, моноэфиры, дизфиры, триэфиры и т.д. При этом не полностью этерифицированные моносахара будут представлены еще и набором регио-изомеров. Таким образом, в одной только реакции ожидаемое многообразие получаемых эфиров более чем достаточно.
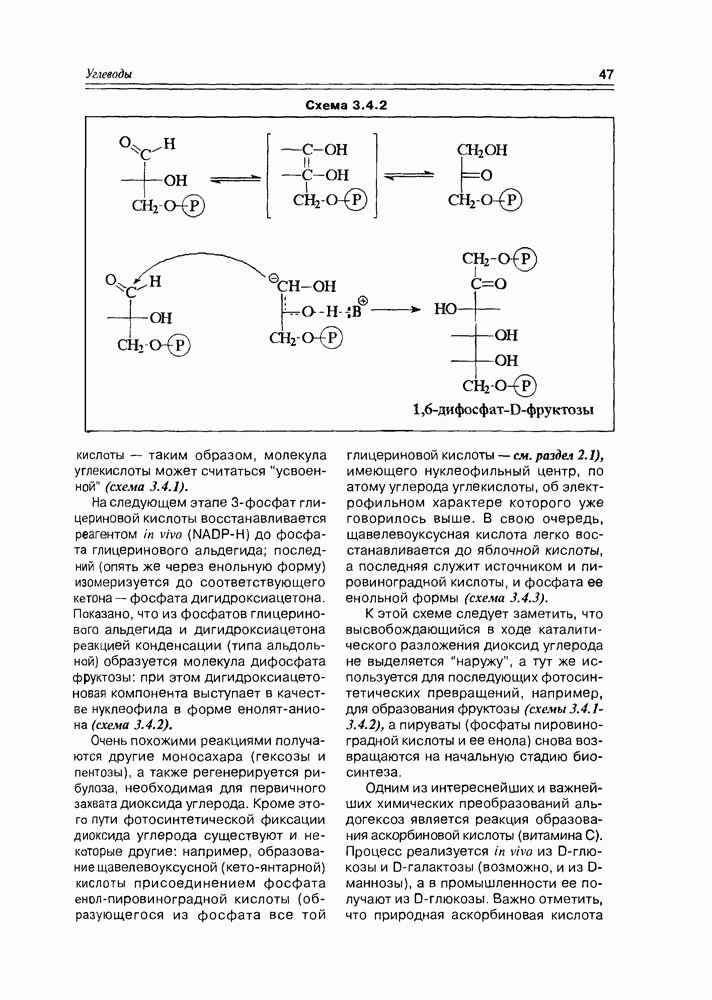
Реакции карбонильных групп моносахаридов всегда могут проявиться, так как в растворе моносахарида всегда имеется ациклический таутомер, всегда имеется хоть в каких-то количествах и тогда, независимо от количества этой формы, процесс таутомерии обеспечивает полное прохождение реакции по карбонильной группе, т.е. так, как будто все вещество в растворе имело нециклическую структуру. В первую очередь, здесь следует отметить различные реакции нуклеофильного присоединения, окислительно-восстановительные реакции, реакции азометиновой конденсации (схема 3.3.2).
Реакции окисления наиболее любопытны тем, что могут быть реализованы потрем направлениям (не считая многостадийное и деструктивное
Схема 3.3.1
(см. скан)
Схема 3.3.2
(см. скан)
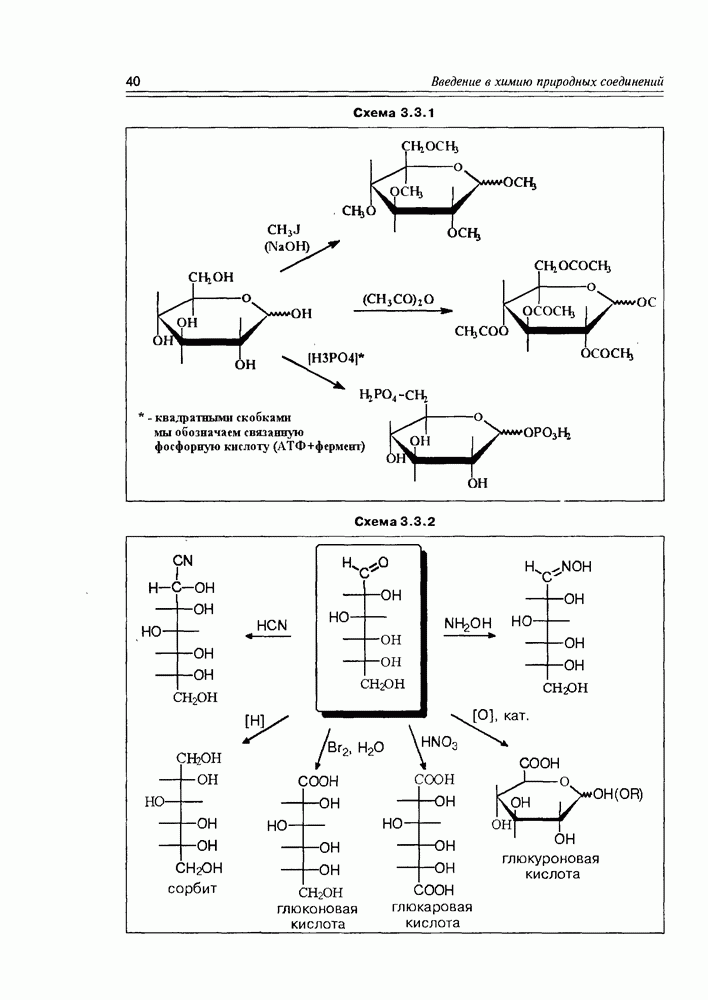
Схема 3.3.3

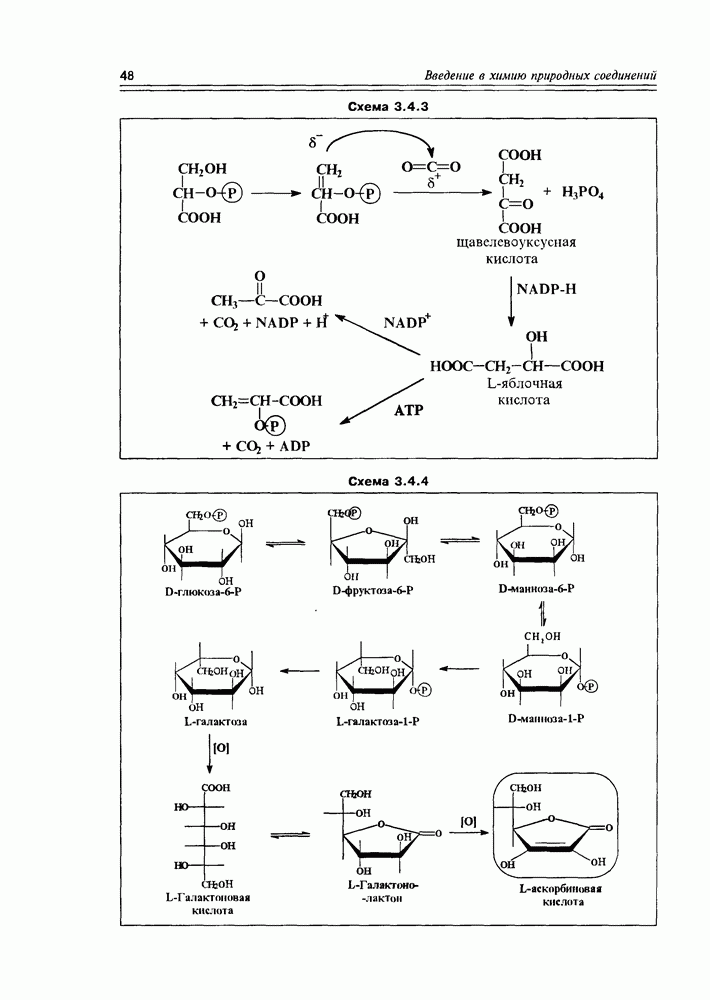
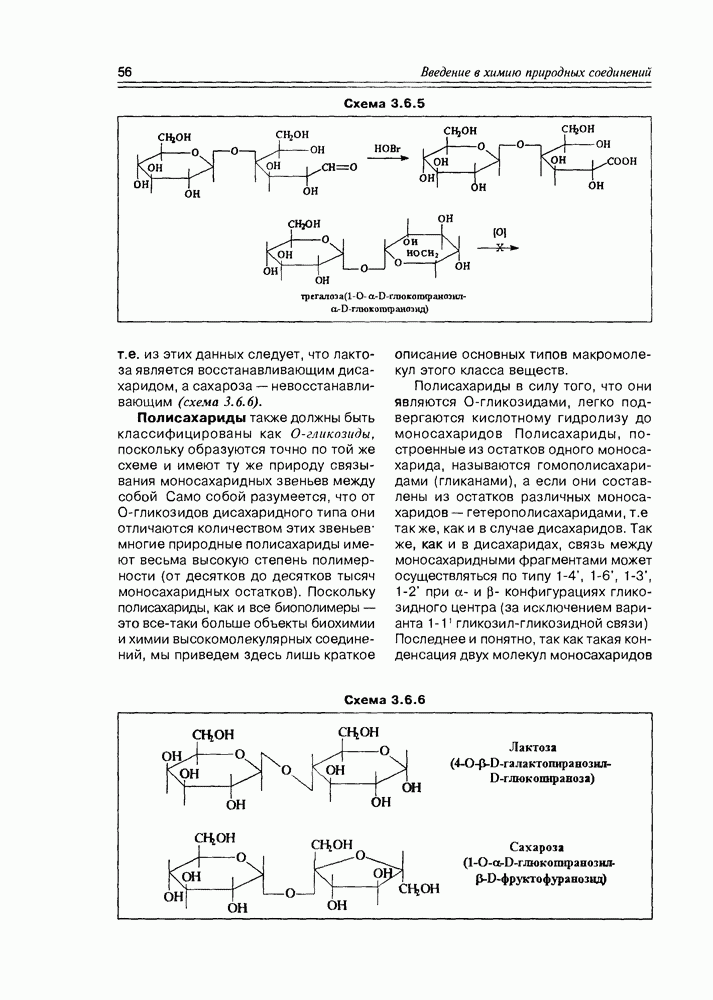
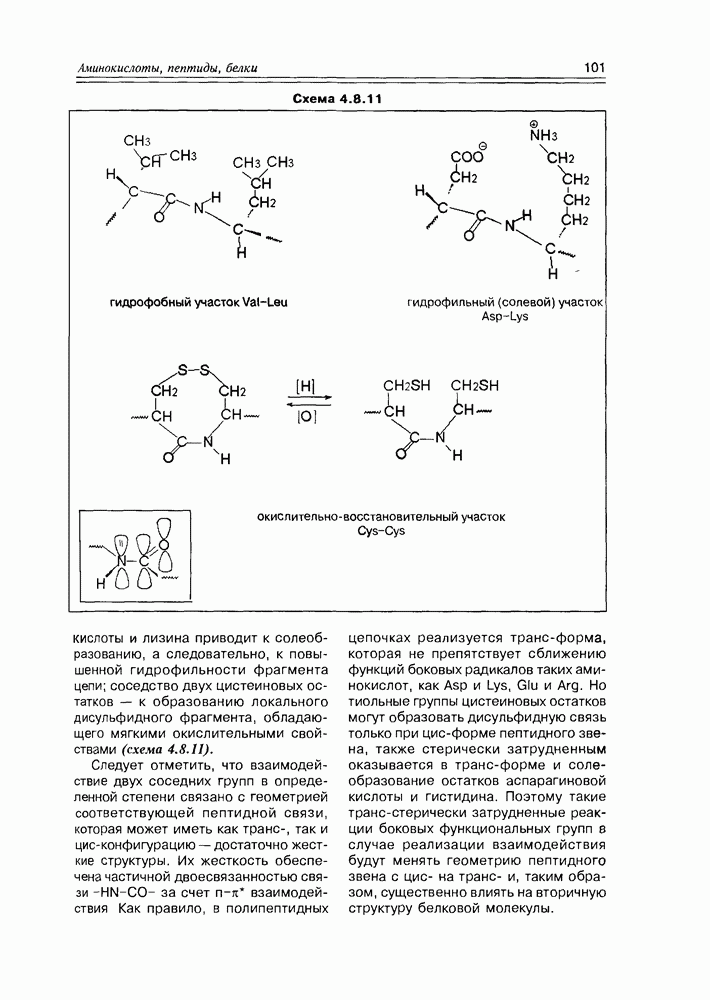
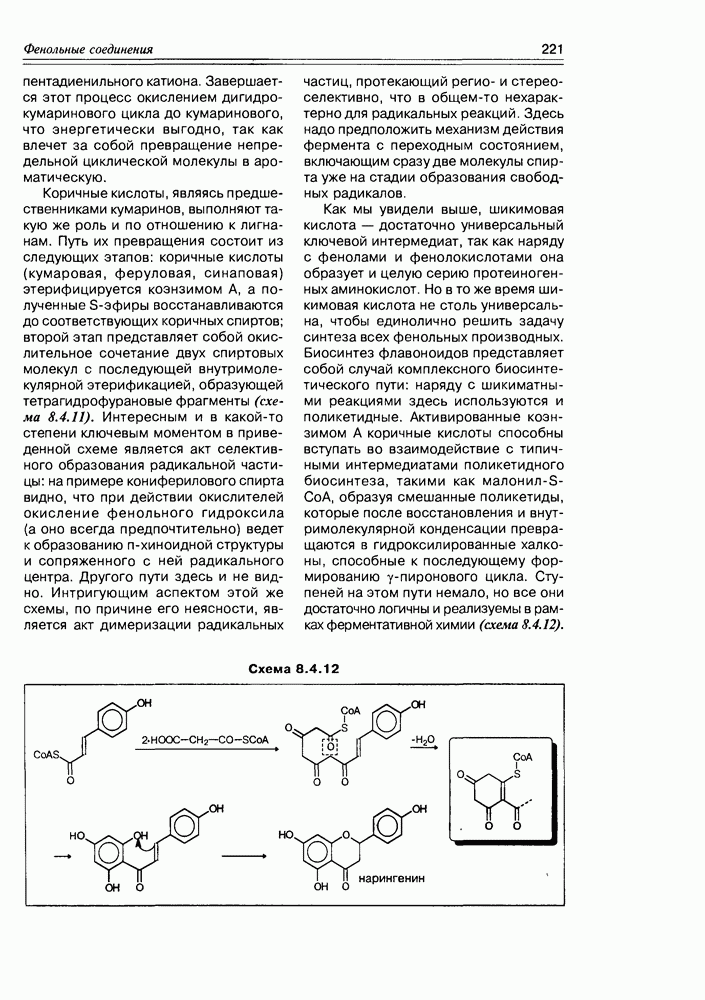
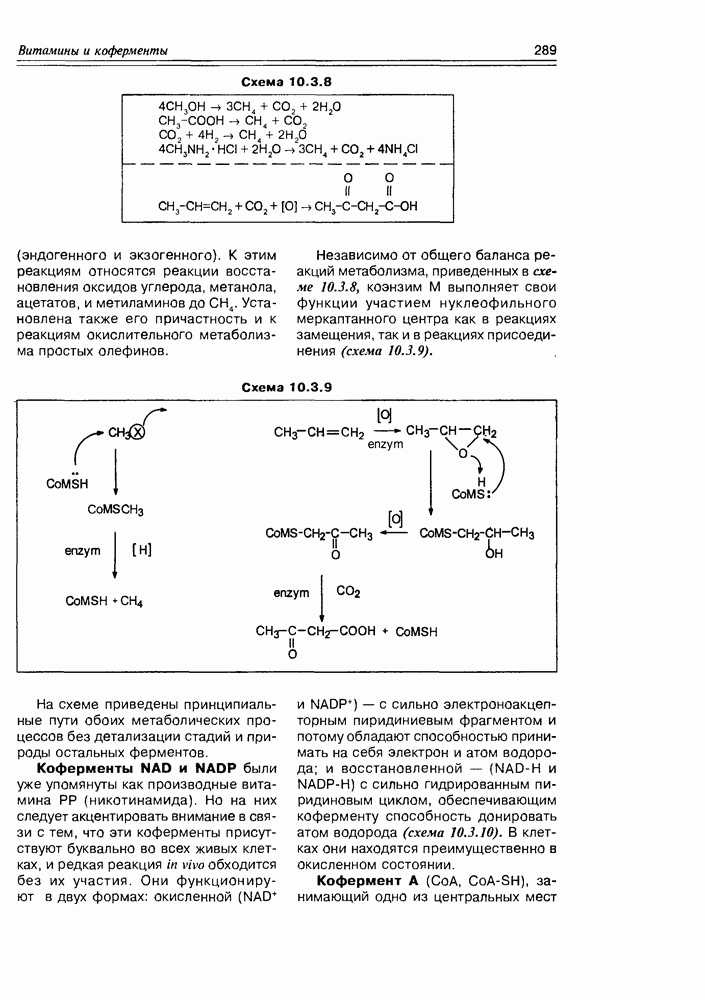
Наиболее мягкое окисление по альдегидной группе приводит к гликоновым кислотам, окисление немного более энергичное — переводит спиртовую группу в карбоксильную (гликаровые кислоты). Концевая спиртовая группа (первичная) может быть окислена до карбоксильной (не затрагивая альдегидной группы) при условии защиты последней, т.е. в условиях жесткой стабилизации циклической формы молекулы (например, этерификацией полуацетального гидроксила). При действии некоторых окислителей  циклическая форма альдогексоз окисляется непосредственно по полуацетальному гидроксилу с образованием S-лактонов, которые обычно перегруппировываются в более стабильные у лактоны (схема 3.3.3).
циклическая форма альдогексоз окисляется непосредственно по полуацетальному гидроксилу с образованием S-лактонов, которые обычно перегруппировываются в более стабильные у лактоны (схема 3.3.3).
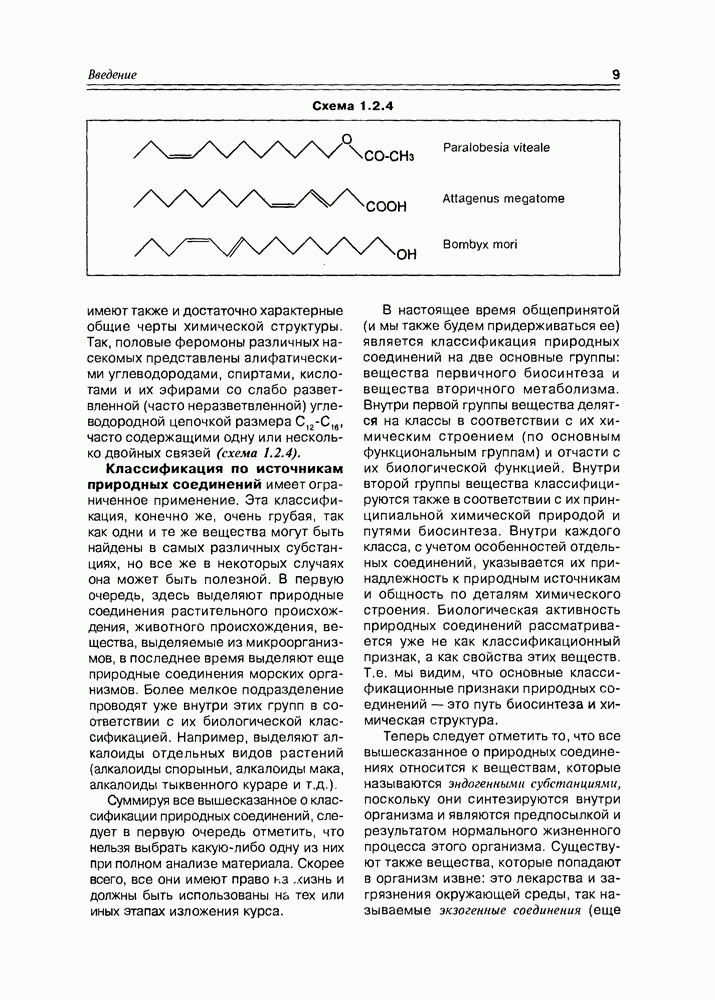
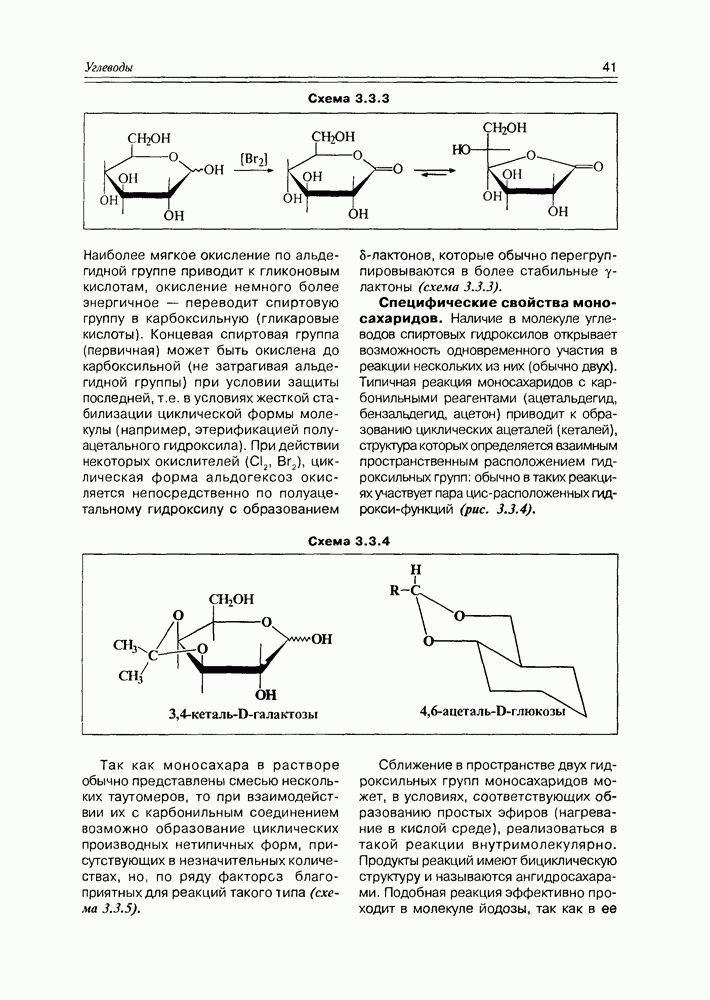
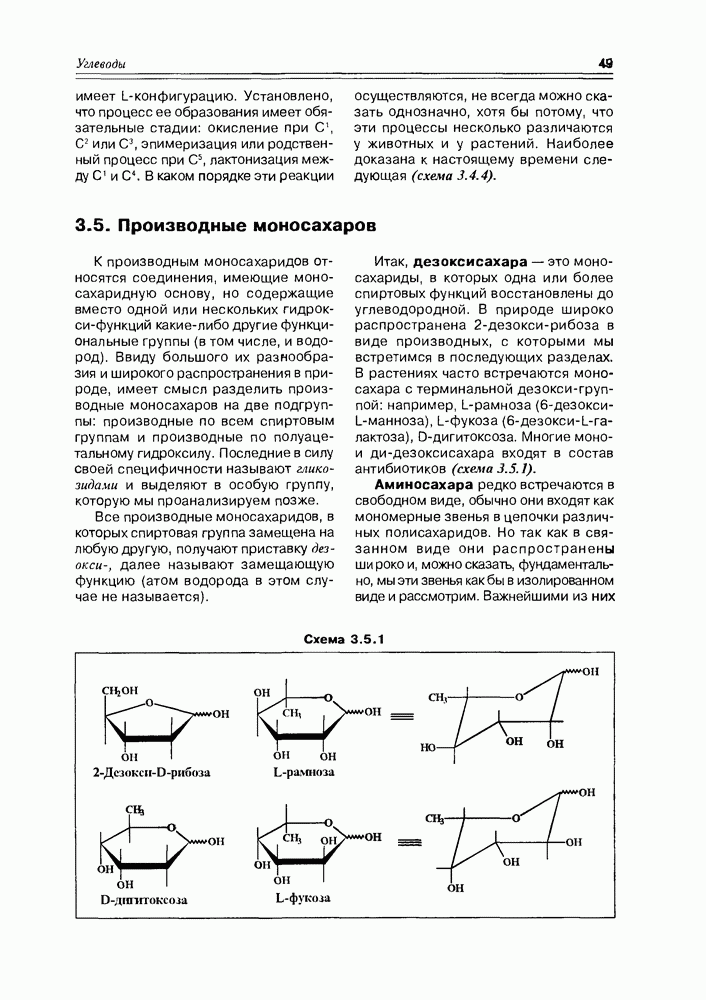
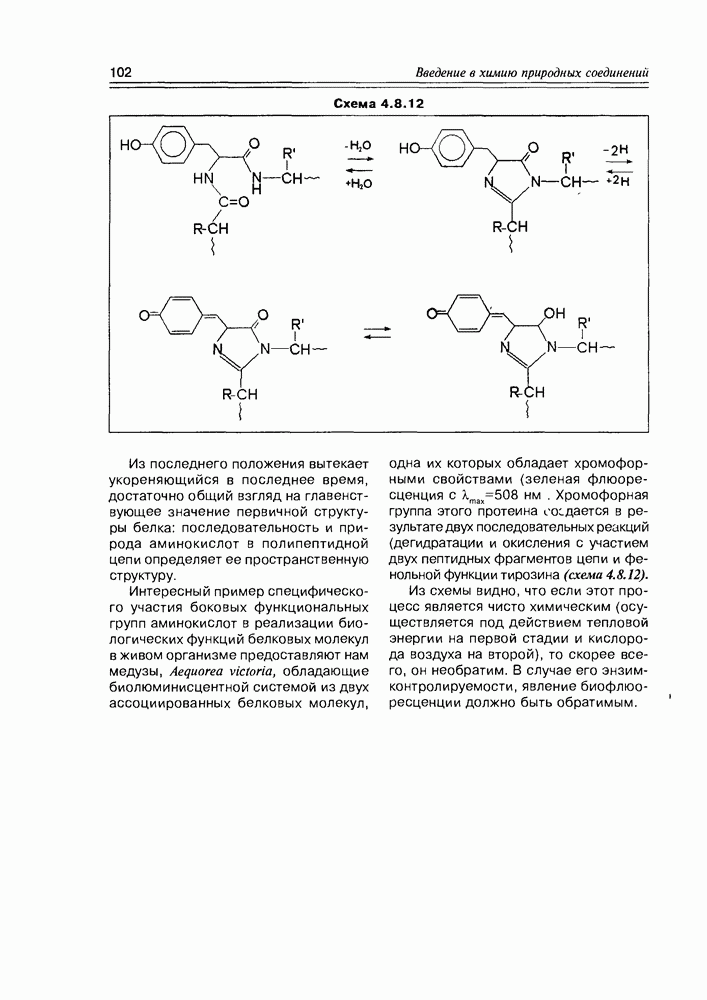
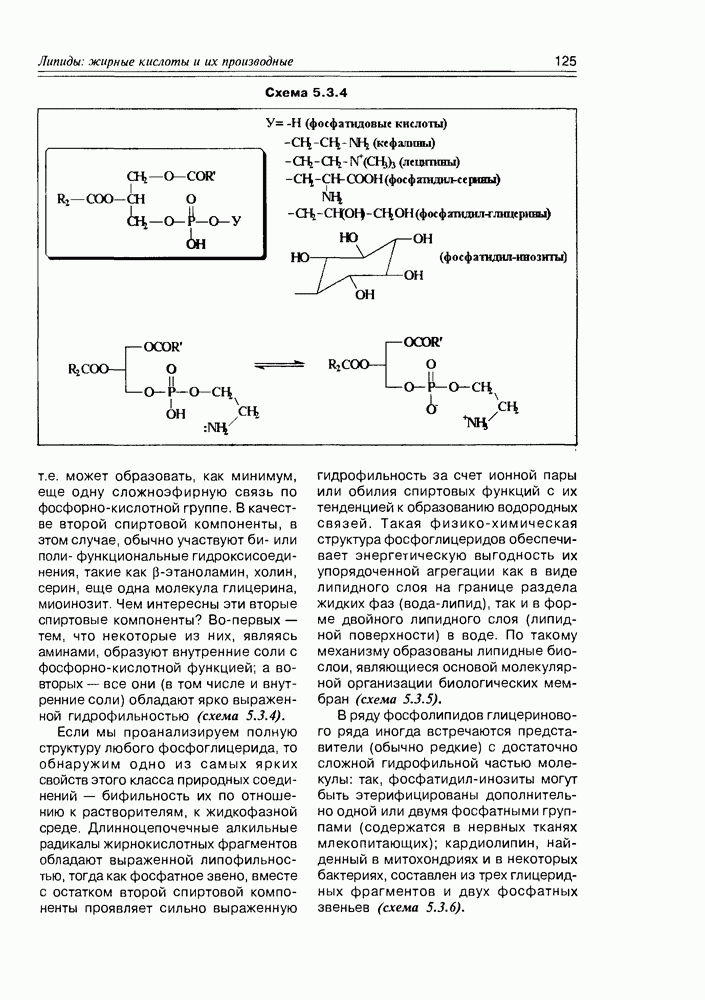
Специфические свойства моносахаридов. Наличие в молекуле углеводов спиртовых гидроксилов открывает возможность одновременного участия в реакции нескольких из них (обычно двух). Типичная реакция моносахаридов с карбонильными реагентами (ацетальдегид, бензальдегид, ацетон) приводит к образованию циклических ацеталей (кеталей), структура которых определяется взаимным пространственным расположением гидроксильных групп: обычно в таких реакциях участвует пара цис-расположенных гидрокси-функций (рис. 3.3.4).
Схема 3.3.4

Так как моносахара в растворе обычно представлены смесью нескольких таутомеров, то при взаимодействии их с карбонильным соединением возможно образование циклических производных нетипичных форм, присутствующих в незначительных количествах, но, по ряду факторсз благоприятных для реакций такого типа (схема 3.3.5).
Сближение в пространстве двух гидроксильных групп моносахаридов может, в условиях, соответствующих образованию простых эфиров (нагревание в кислой среде), реализоваться в такой реакции внутримолекулярно. Продукты реакций имеют бициклическую структуру и называются ангидросахарами. Подобная реакция эффективно проходит в молекуле йодозы, так как в ее
Схема 3.3.5

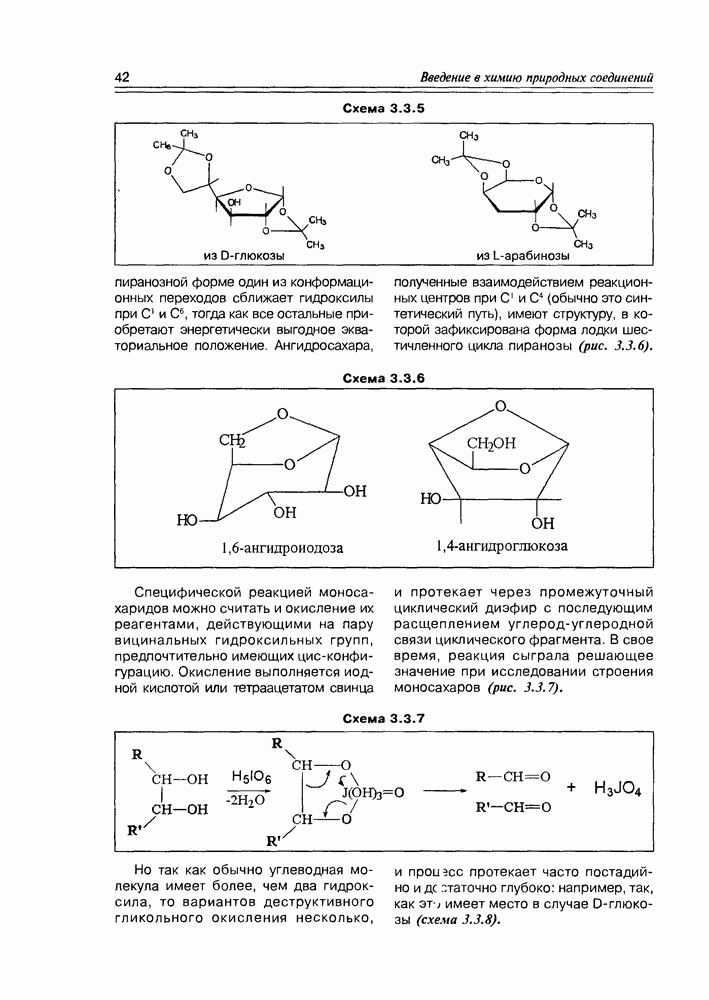
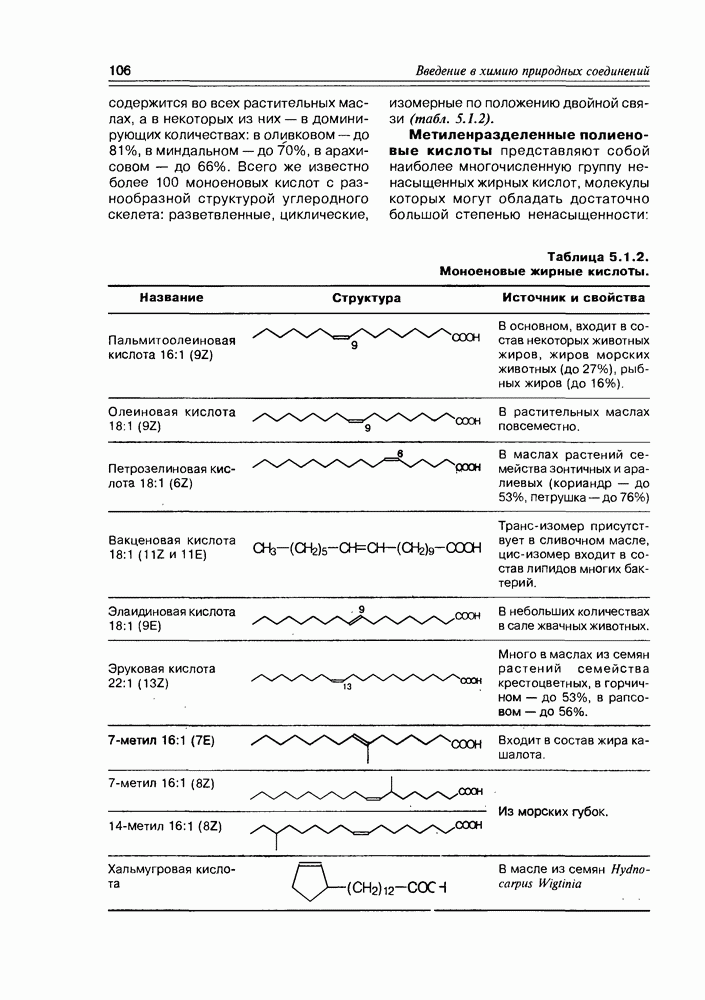
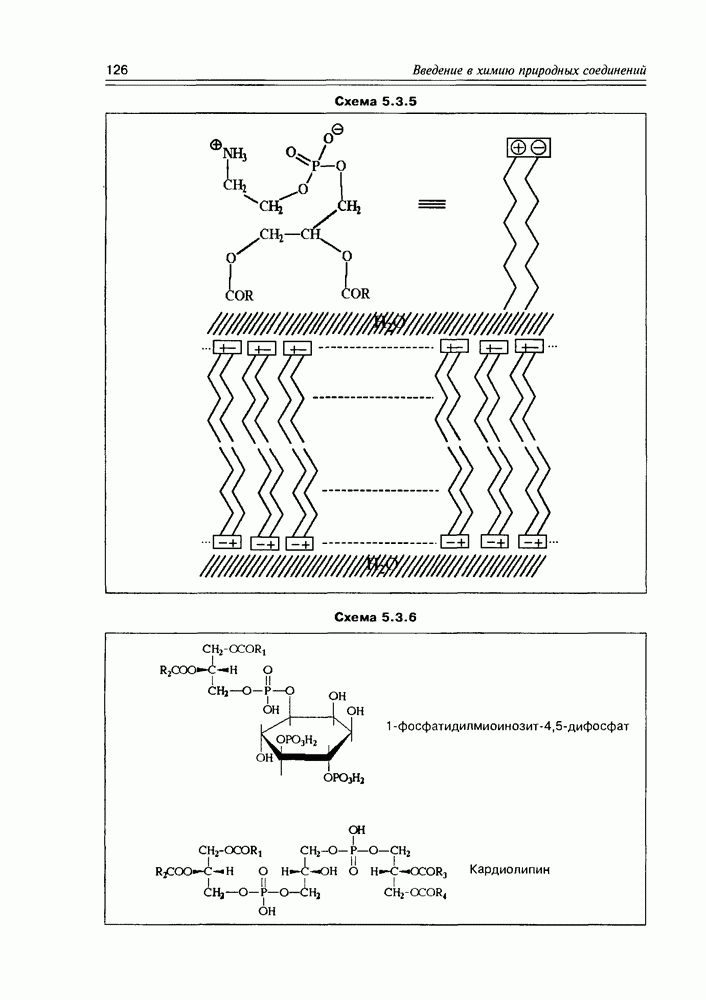
пиранозной форме один из конформационных переходов сближает гидроксилы при  тогда как все остальные приобретают энергетически выгодное экваториальное положение. Ангидросахара, полученные взаимодействием реакционных центров при С1 и С4 (обычно это синтетический путь), имеют структуру, в которой зафиксирована форма лодки шестичленного цикла пиранозы (рис. 3.3.6).
тогда как все остальные приобретают энергетически выгодное экваториальное положение. Ангидросахара, полученные взаимодействием реакционных центров при С1 и С4 (обычно это синтетический путь), имеют структуру, в которой зафиксирована форма лодки шестичленного цикла пиранозы (рис. 3.3.6).
Схема 3.3.6

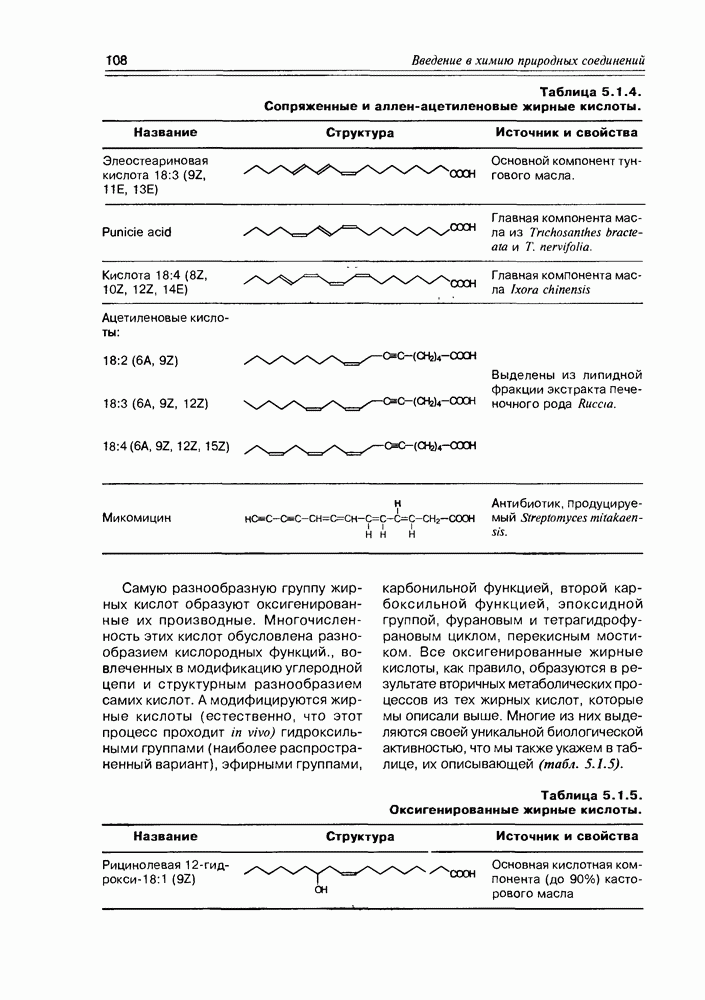
Специфической реакцией моносахаридов можно считать и окисление их реагентами, действующими на пару вицинальных гидроксильных групп, предпочтительно имеющих цис-конфигурацию. Окисление выполняется йодной кислотой или тетраацетатом свинца и протекает через промежуточный циклический диэфир с последующим расщеплением углерод-углеродной связи циклического фрагмента. В свое время, реакция сыграла решающее значение при исследовании строения моносахаров (рис. 3.3.7).
Схема 3.3.7

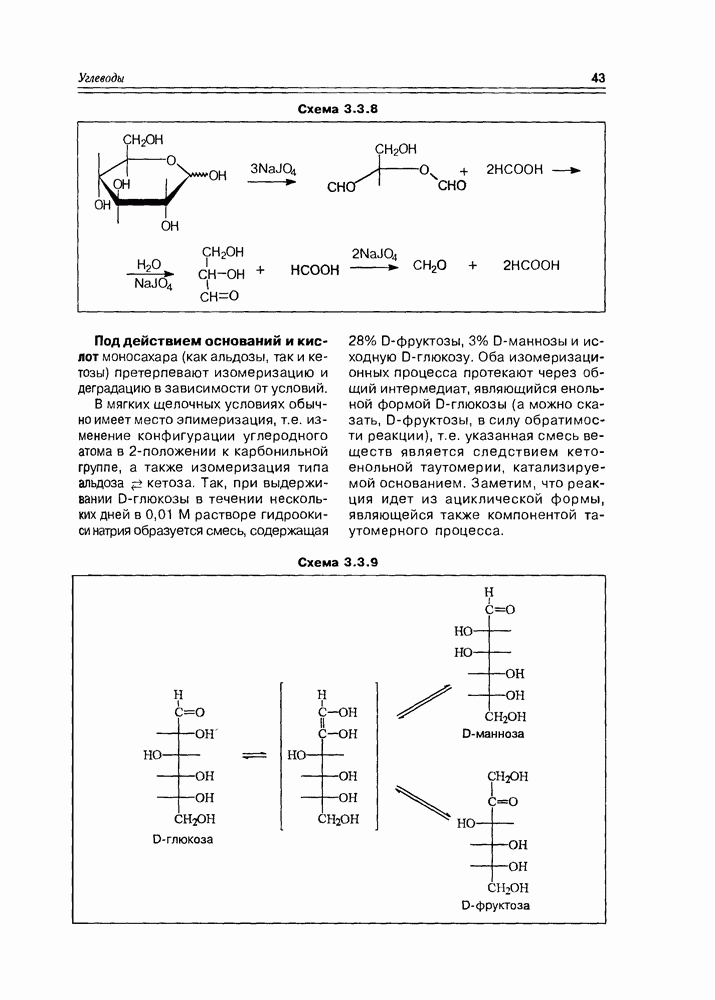
Но так как обычно углеводная молекула имеет более, чем два гидроксила, то вариантов деструктивного гликольного окисления несколько, и проиэсс протекает часто постадийно и достаточно глубоко: например, так, как  имеет место в случае D-глюкозы (схема 3.3.8).
имеет место в случае D-глюкозы (схема 3.3.8).
Схема 3.3.8

Под действием оснований и кислот моносахара (как альдозы, так и кетозы) претерпевают изомеризацию и деградацию в зависимости от условий.
В мягких щелочных условиях обычно имеет место эпимеризация, т.е. изменение конфигурации углеродного атома в 2-положении к карбонильной группе, а также изомеризация типа  . Так, при выдерживании
. Так, при выдерживании  -глюкозы в течении нескольких дней в 0,01 М растворе гидроокиси натрия образуется смесь, содержащая 28% D-фруктозы, 3% D-маннозы и исходную D-глюкозу. Оба изомеризационных процесса протекают через общий интермедиат, являющийся енольной формой D-глюкозы (а можно сказать, D-фруктозы, в силу обратимости реакции), т.е. указанная смесь веществ является следствием кетоенольной таутомерии, катализируемой основанием. Заметим, что реакция идет из ациклической формы, являющейся также компонентой таутомерного процесса.
-глюкозы в течении нескольких дней в 0,01 М растворе гидроокиси натрия образуется смесь, содержащая 28% D-фруктозы, 3% D-маннозы и исходную D-глюкозу. Оба изомеризационных процесса протекают через общий интермедиат, являющийся енольной формой D-глюкозы (а можно сказать, D-фруктозы, в силу обратимости реакции), т.е. указанная смесь веществ является следствием кетоенольной таутомерии, катализируемой основанием. Заметим, что реакция идет из ациклической формы, являющейся также компонентой таутомерного процесса.
Схема 3.3.9

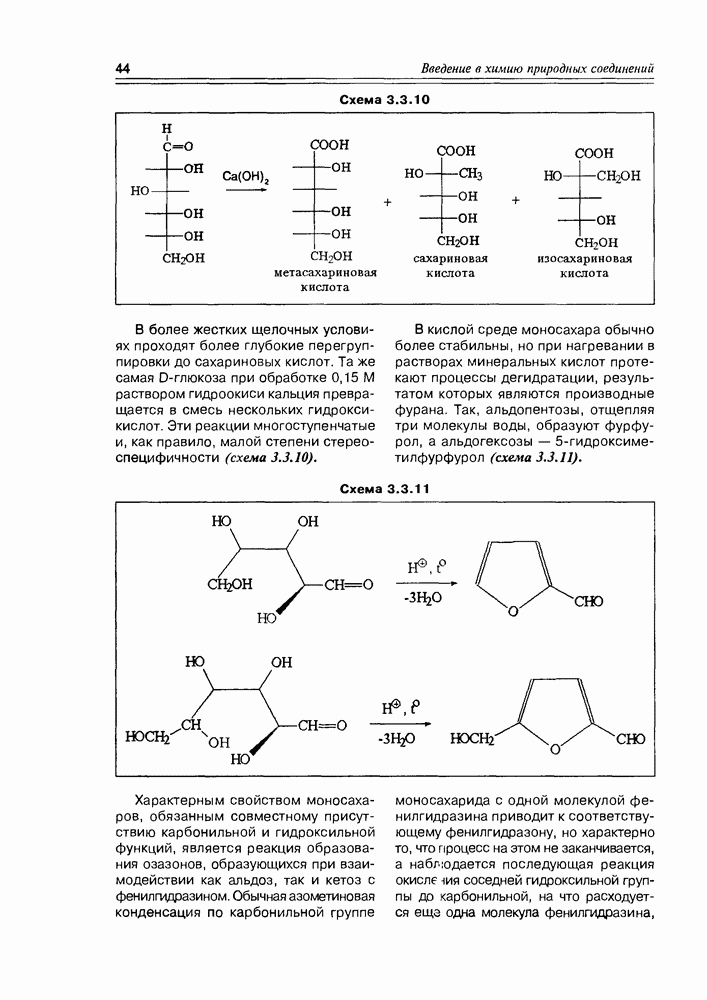
Схема 3.3.10

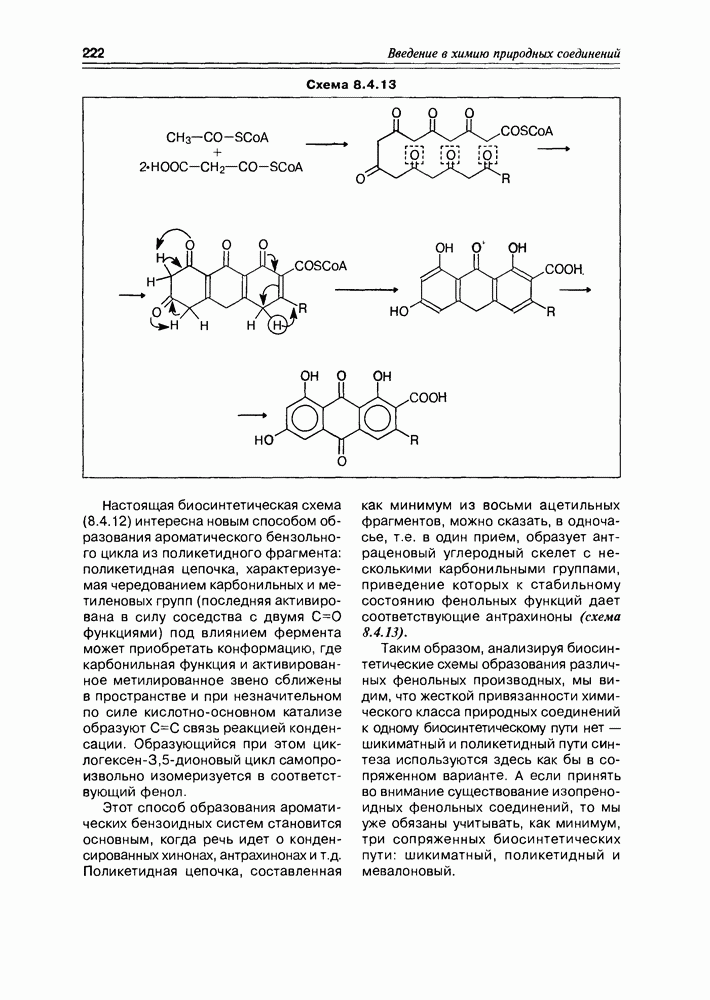
В более жестких щелочных условиях проходят более глубокие перегруппировки до сахариновых кислот. Та же самая D-глюкоза при обработке 0,15 М раствором гидроокиси кальция превращается в смесь нескольких гидроксикислот. Эти реакции многоступенчатые и, как правило, малой степени стереоспецифичности (схема 3.3.10).
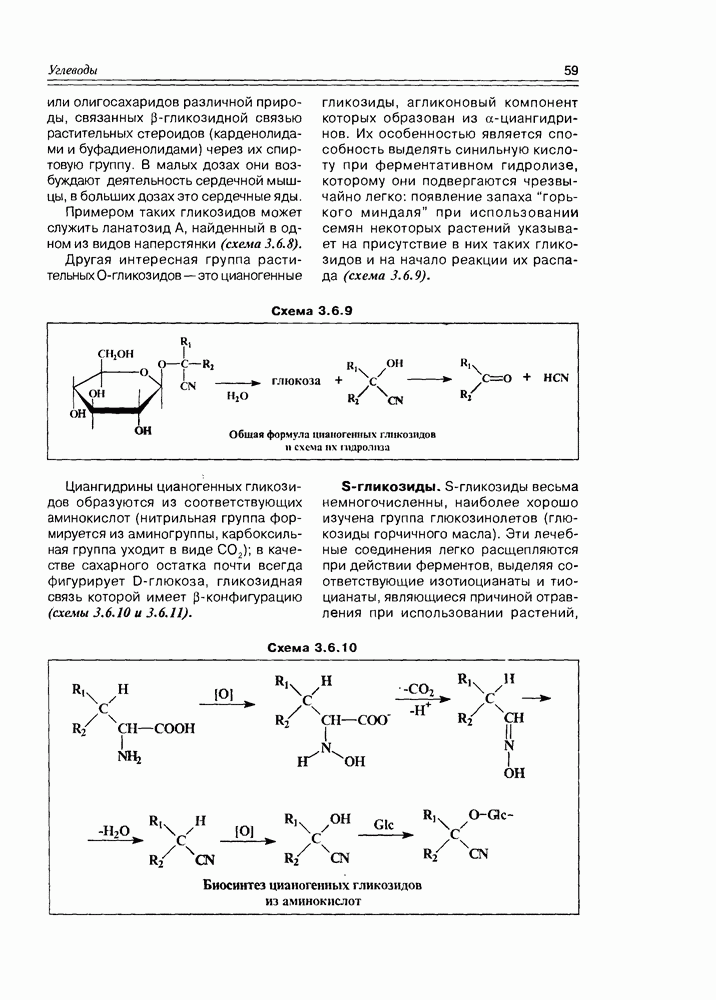
В кислой среде моносахара обычно более стабильны, но при нагревании в растворах минеральных кислот протекают процессы дегидратации, результатом которых являются производные фурана. Так, альдопентозы, отщепляя три молекулы воды, образуют фурфурол, а альдогексозы — 5-гидроксиметилфурфурол (схема 3.3.11).
Схема 3.3.11

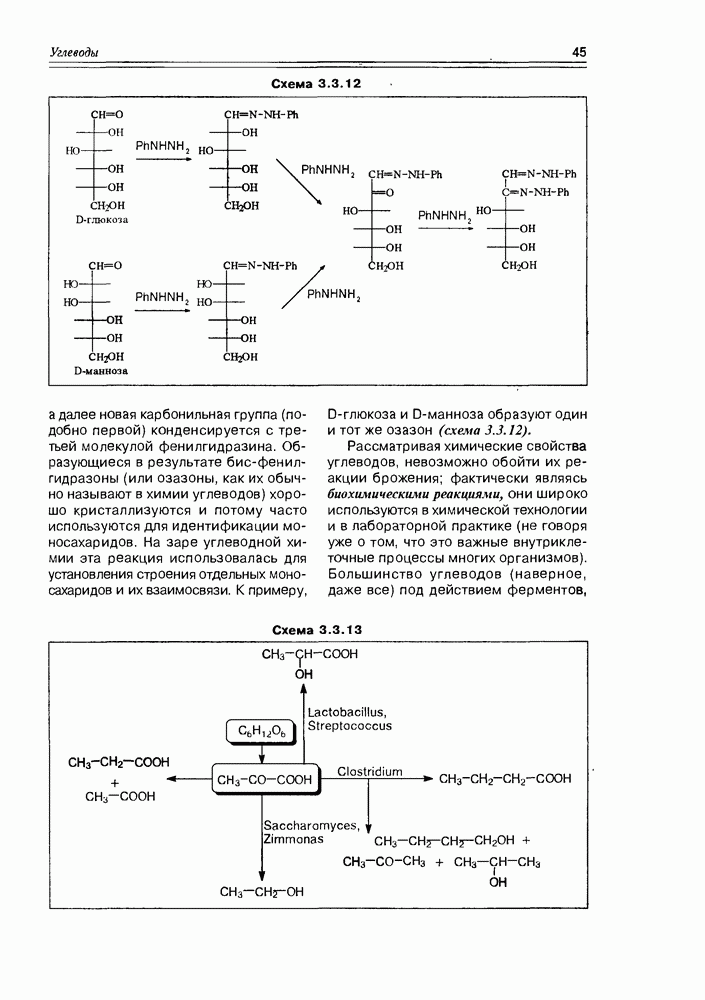
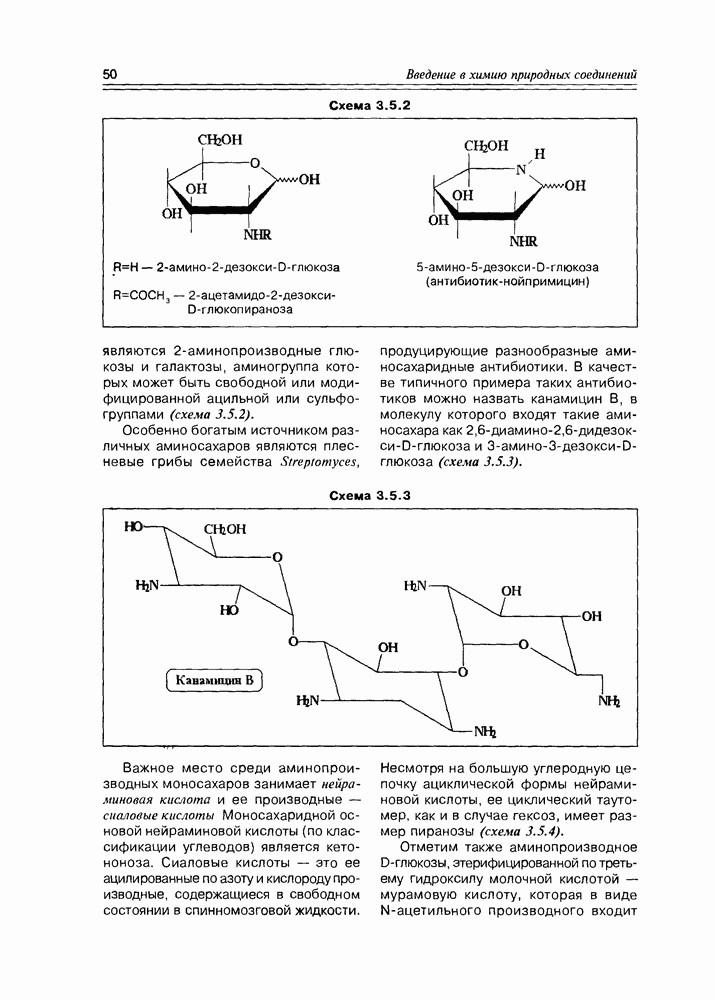
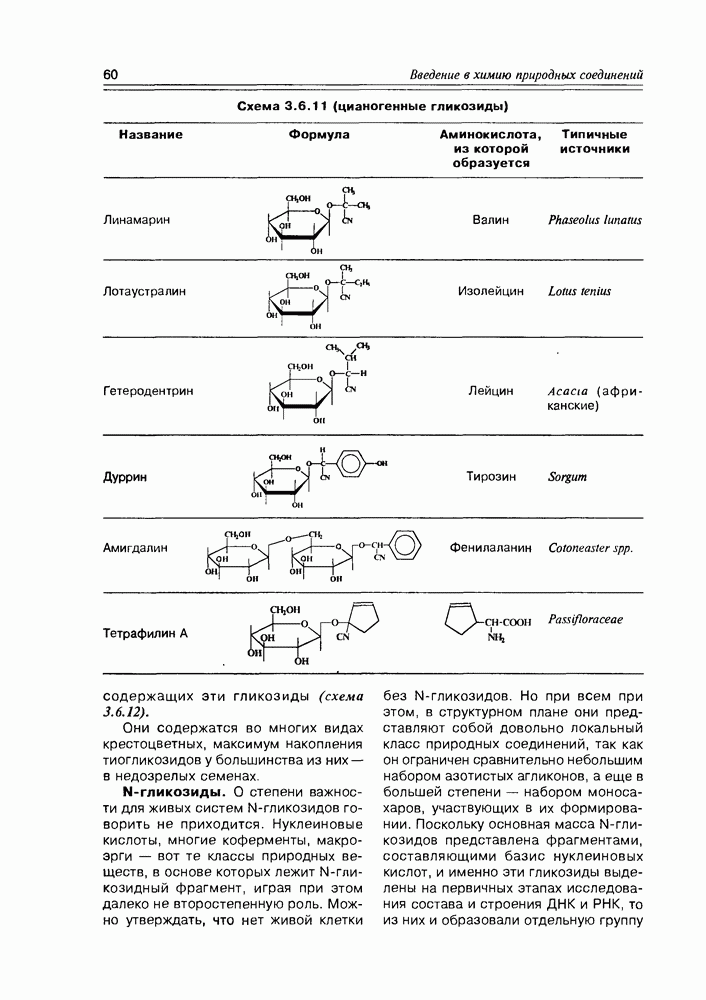
Характерным свойством моносахаров, обязанным совместному присутствию карбонильной и гидроксильной функций, является реакция образования озазонов, образующихся при взаимодействии как альдоз, так и кетоз с фенилгидразином. Обычная азометиновая конденсация по карбонильной группе моносахарида с одной молекулой фенилгидразина приводит к соответствующему фенилгидразону, но характерно то, что процесс на этом не заканчивается, а наблюдается последующая реакция окисления соседней гидроксильной группы до карбонильной, на что расходуется еще одна молекула фенилгидразина,
Схема 3.3.12

а далее новая карбонильная группа (подобно первой) конденсируется с третьей молекулой фенилгидразина. Образующиеся в результате биофенилгидразоны (или озазоны, как их обычно называют в химии углеводов) хорошо кристаллизуются и потому часто используются для идентификации моносахаридов. На заре углеводной химии эта реакция использовалась для установления строения отдельных моносахаридов и их взаимосвязи. К примеру, D-глюкоза и D-манноза образуют один и тот же озазон (схема 3.3.12).
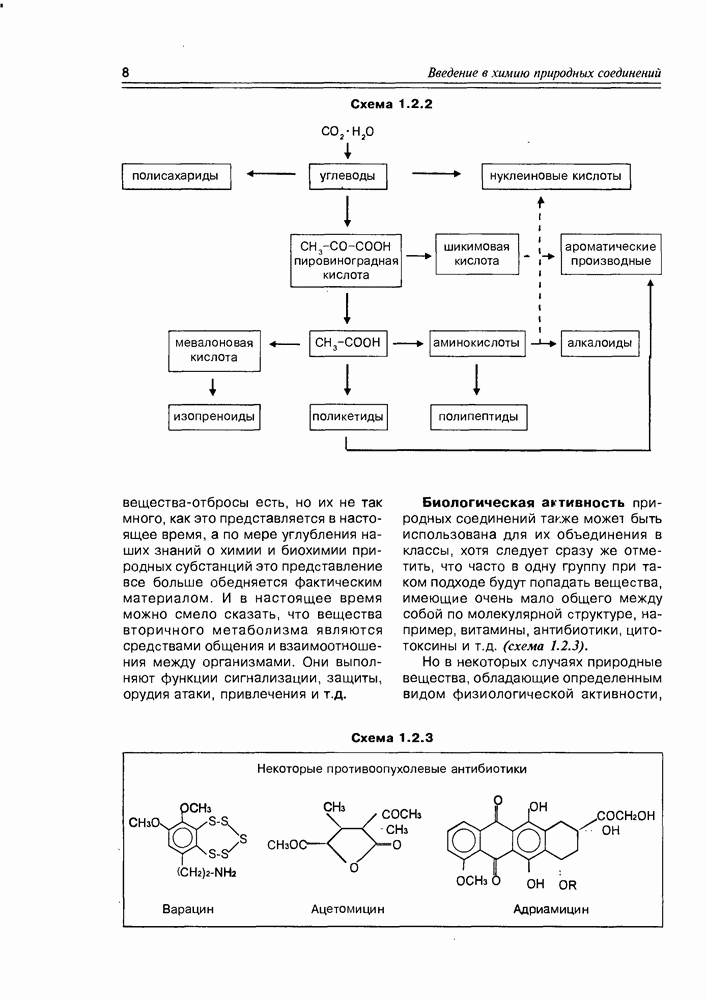
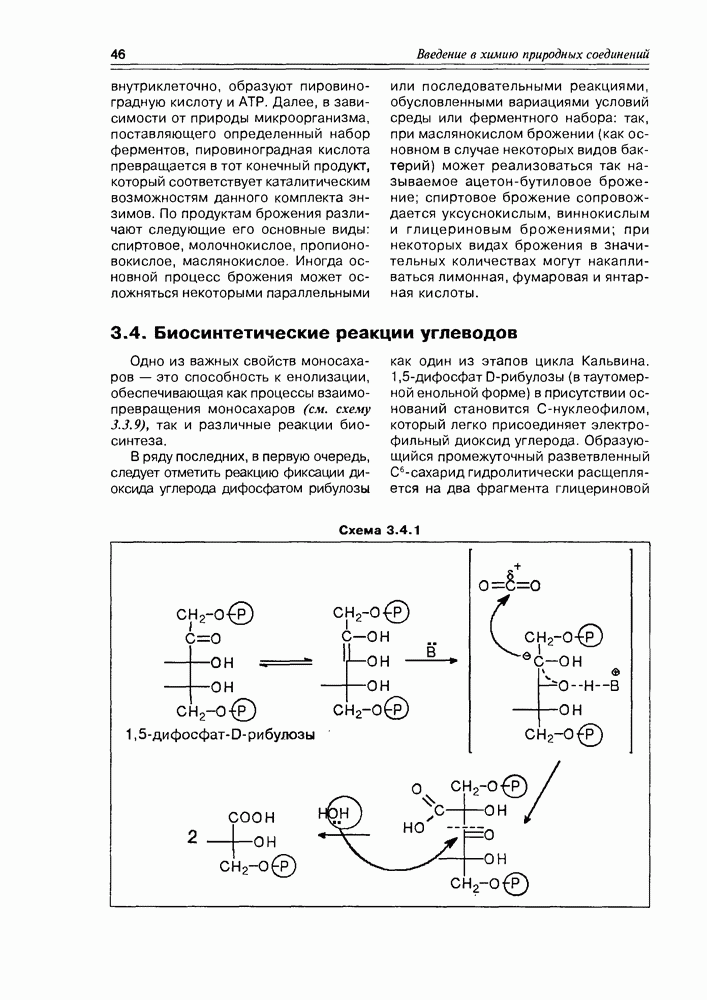
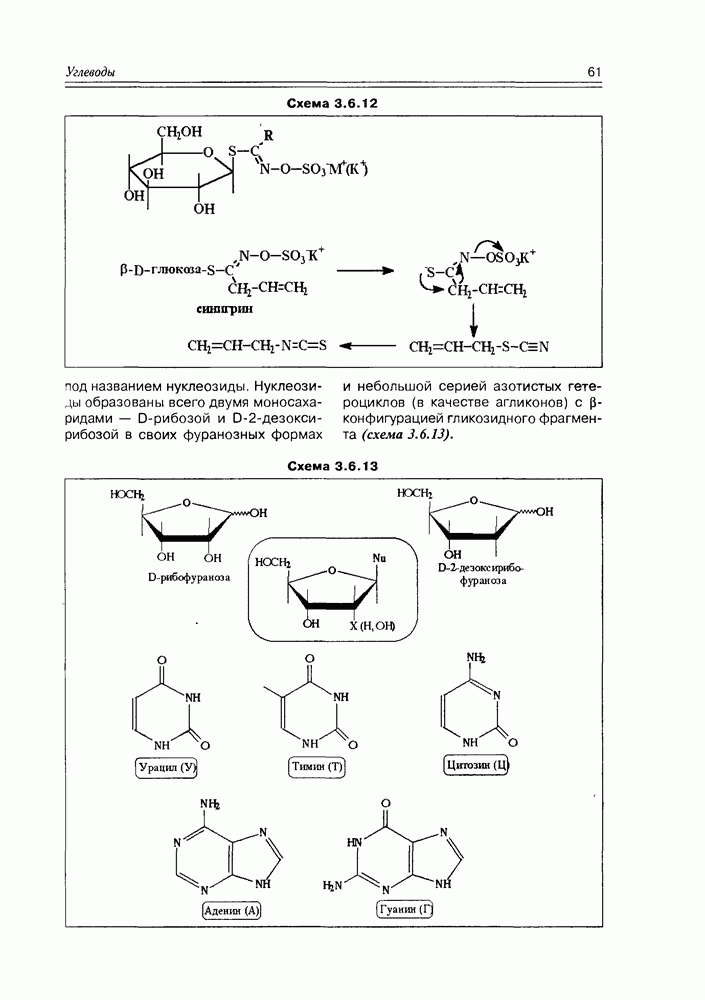
Рассматривая химические свойства углеводов, невозможно обойти их реакции брожения; фактически являясь биохимическими реакциями, они широко используются в химической технологии и в лабораторной практике (не говоря уже о том, что это важные внутриклеточные процессы многих организмов). Большинство углеводов (наверное, даже все) под действием ферментов,
Схема 3.3.13

внутриклеточно, образуют пировиноградную кислоту и АТР. Далее, в зависимости от природы микроорганизма, поставляющего определенный набор ферментов, пировиноградная кислота превращается в тот конечный продукт, который соответствует каталитическим возможностям данного комплекта энзимов. По продуктам брожения различают следующие его основные виды: спиртовое, молочнокислое, пропионовокислое, маслянокислое. Иногда основной процесс брожения может осложняться некоторыми параллельными
или последовательными реакциями, обусловленными вариациями условий среды или ферментного набора: так, при маслянокислом брожении (как основном в случае некоторых видов бактерий) может реализоваться так называемое ацетон-бутиловое брожение; спиртовое брожение сопровождается уксуснокислым, виннокислым и глицериновым брожениями; при некоторых видах брожения в значительных количествах могут накапливаться лимонная, фумаровая и янтарная кислоты.
| << Предыдущий параграф | Следующий параграф >> |
- ПРЕДИСЛОВИЕ АВТОРА
- Глава 1. ВВЕДЕНИЕ
- 1.1. Предмет химии природных соединений
- 1.2. Классификация природных соединений
- 1.3. Методология химии природных соединений
- 1.4. Углерод и жизнь
- Глава 2. ПРОСТЕЙШИЕ БИФУНКЦИОНАЛЬНЫЕ ПРИРОДНЫЕ СОЕДИНЕНИЯ — МОСТИК К МАССИВУ ПРИРОДНЫХ СОЕДИНЕНИЙ
- 2.2. Оксокислоты
- 2.3. Аминоспирты
- Глава 3. УГЛЕВОДЫ
- 3.2. Свойства и структура моносахаридов
- 3.3. Химические свойства моносахаридов
- 3.4. Биосинтетические реакции углеводов
- 3.6. Гликозиды
- Глава 4. АМИНОКИСЛОТЫ, ПЕПТИДЫ, БЕЛКИ
- 4.2. Химические свойства а-аминокислот
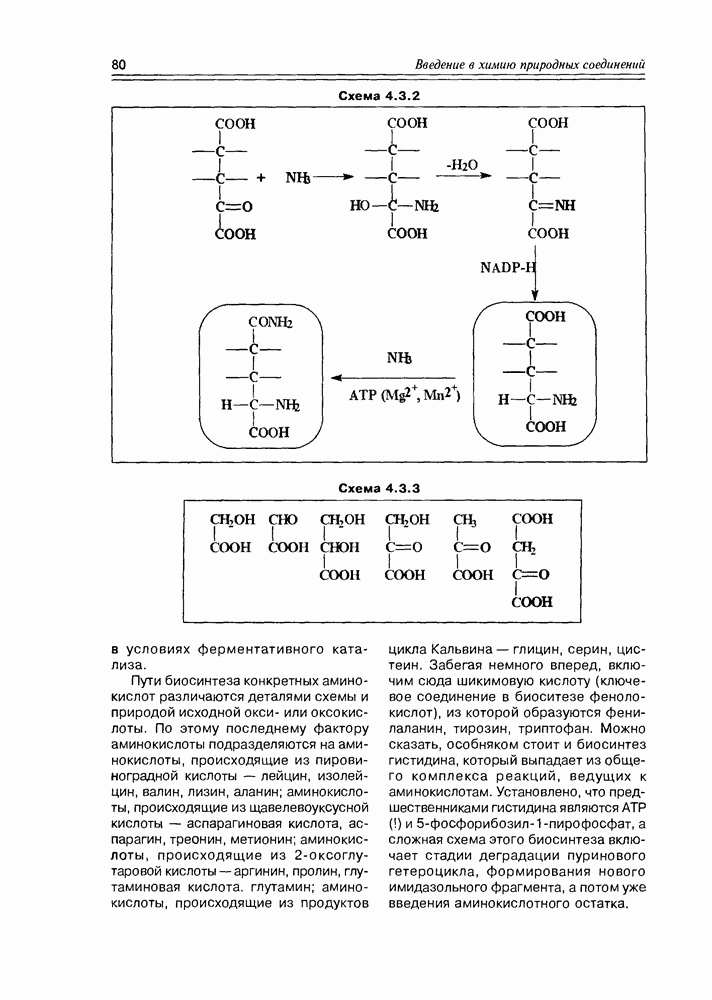
- 4.3. Биосинтез аминокислот
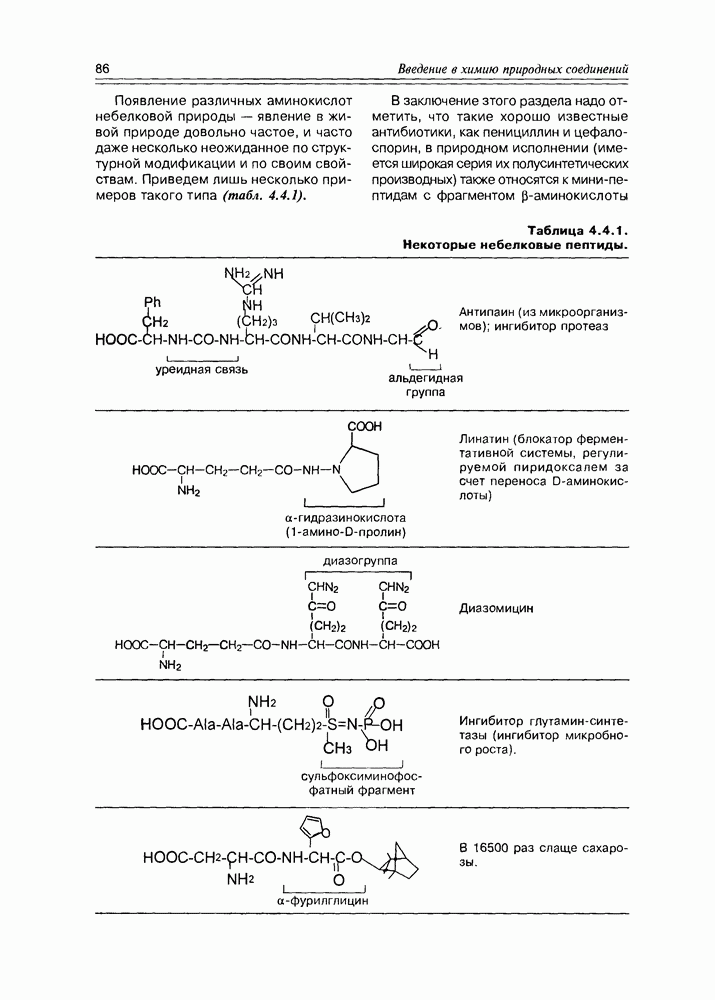
- 4.4. Полипептиды
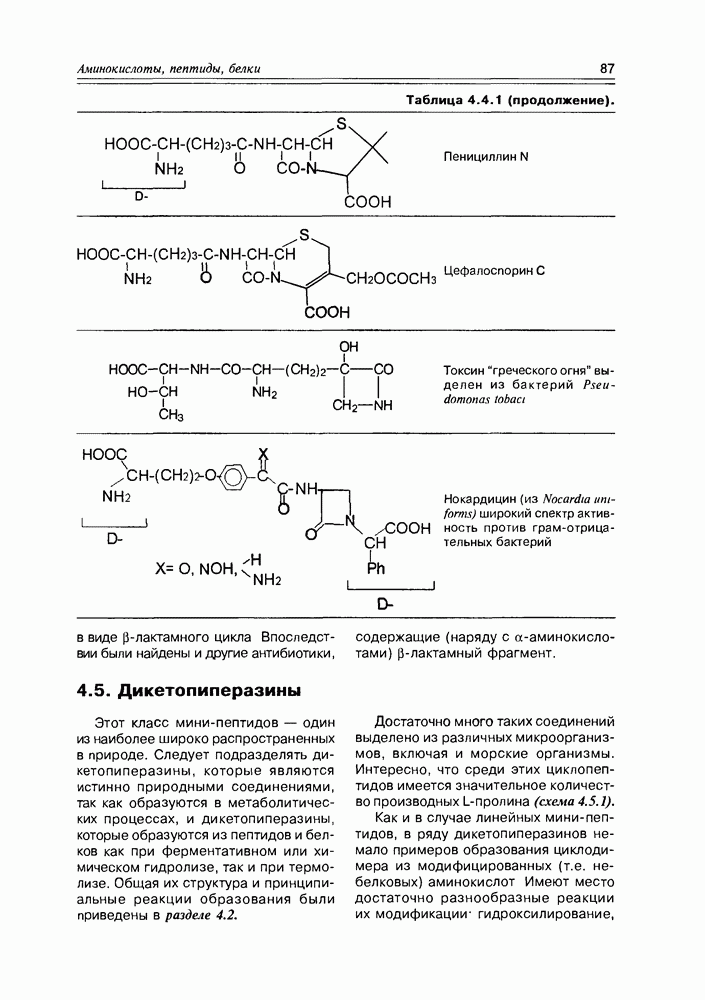
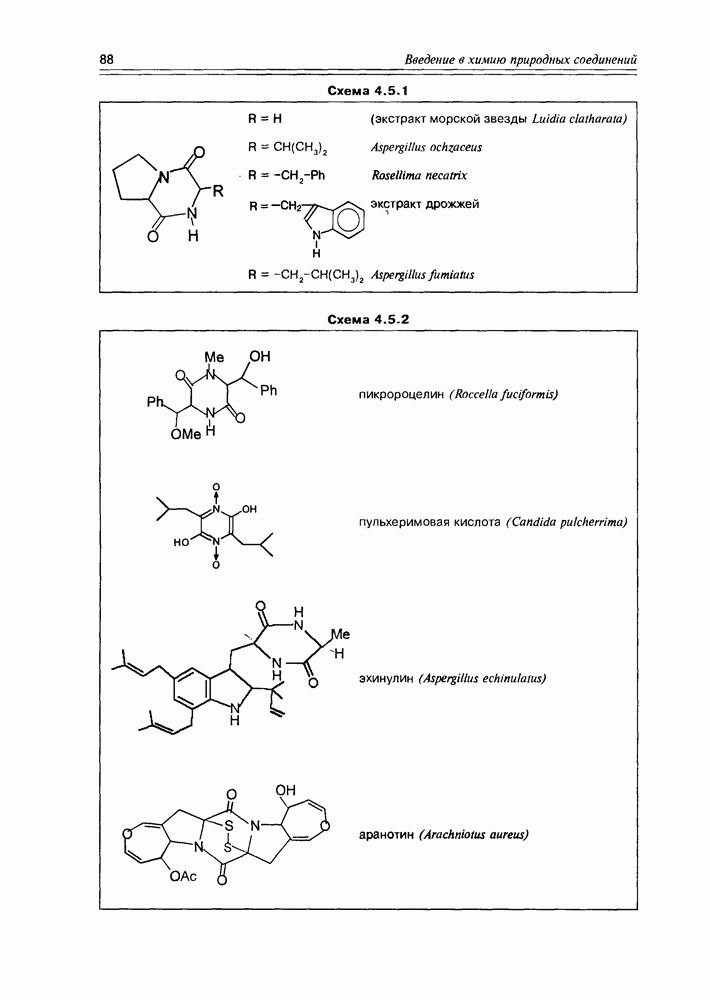
- 4.5. Дикетопиперазины
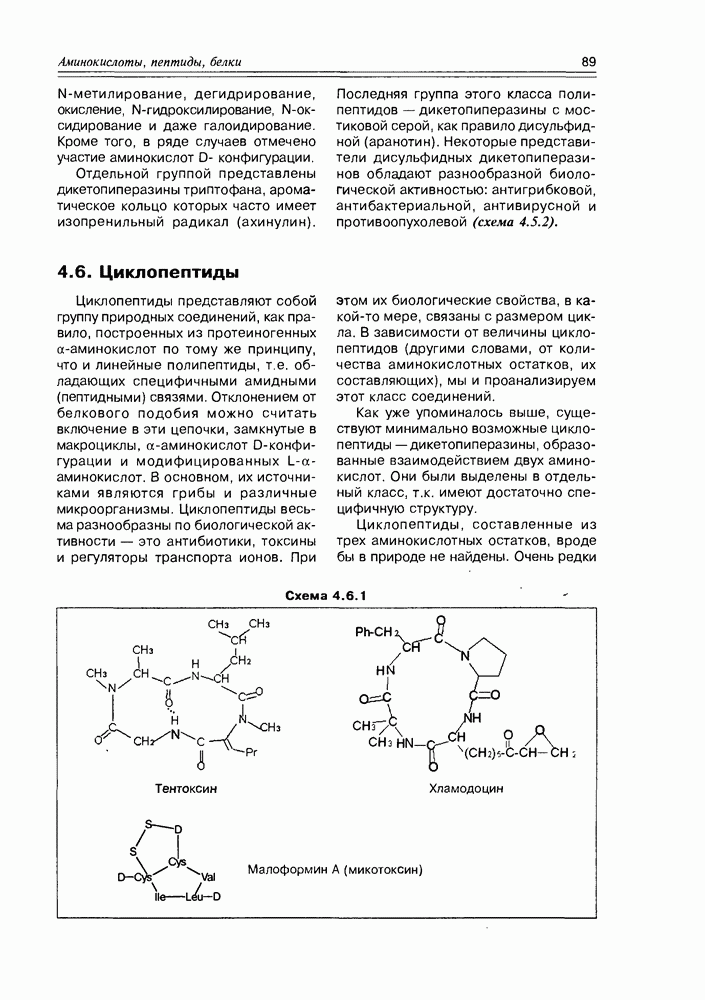
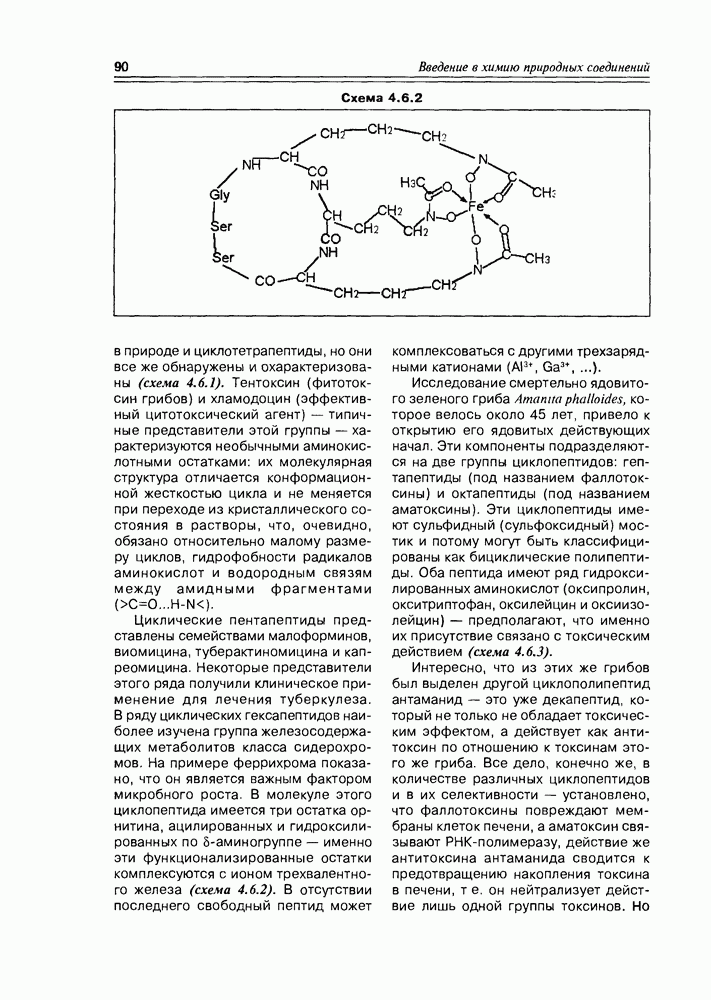
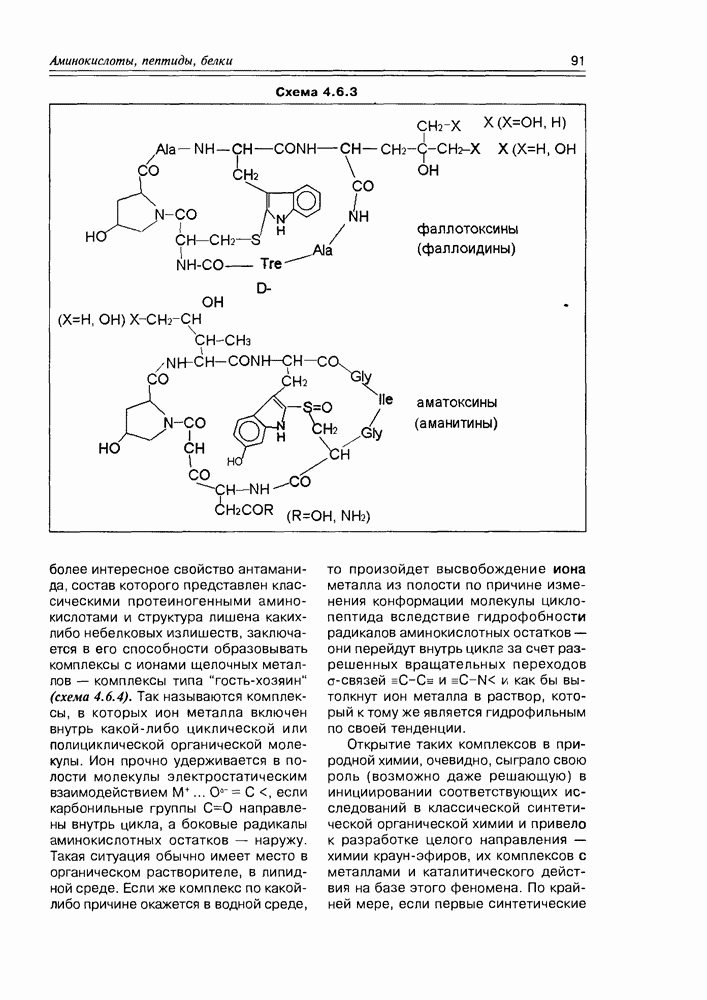
- 4.6. Циклопептиды
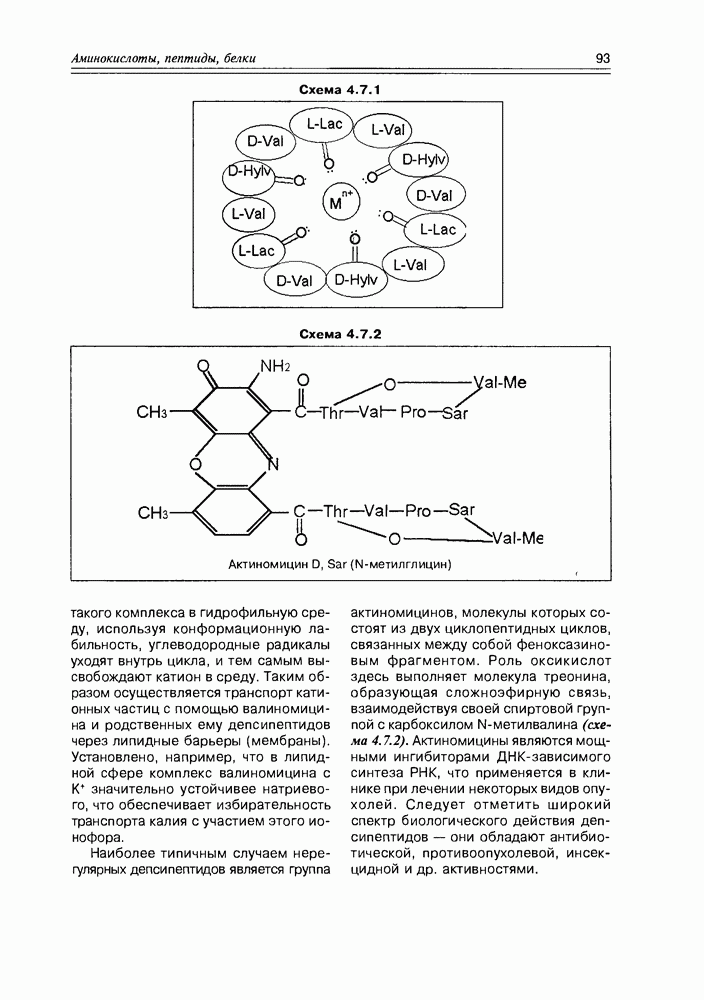
- 4.7. Депсипептиды
- 4.8. Белки
- Глава 5. ЛИПИДЫ: ЖИРНЫЕ КИСЛОТЫ И ИХ ПРОИЗВОДНЫЕ
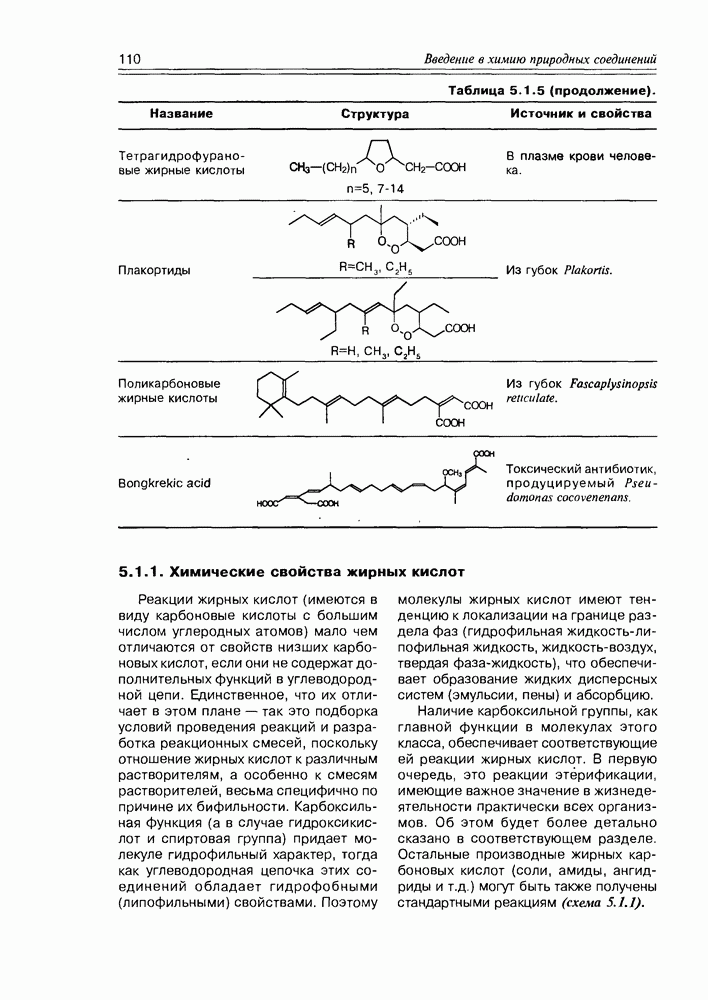
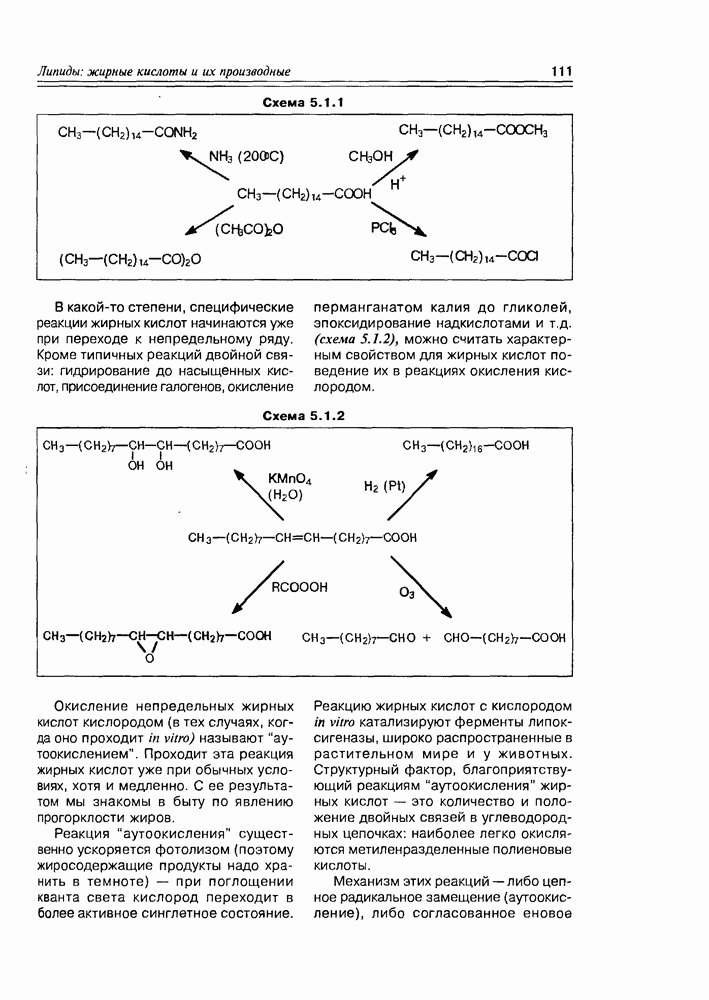
- 5.1.1. Химические свойства жирных кислот
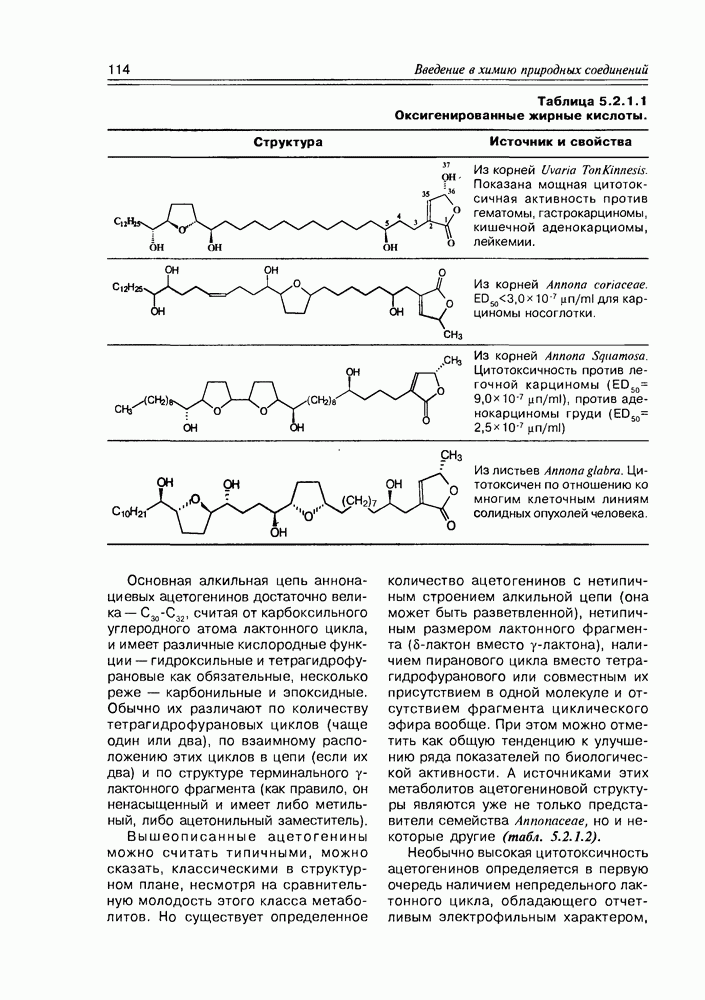
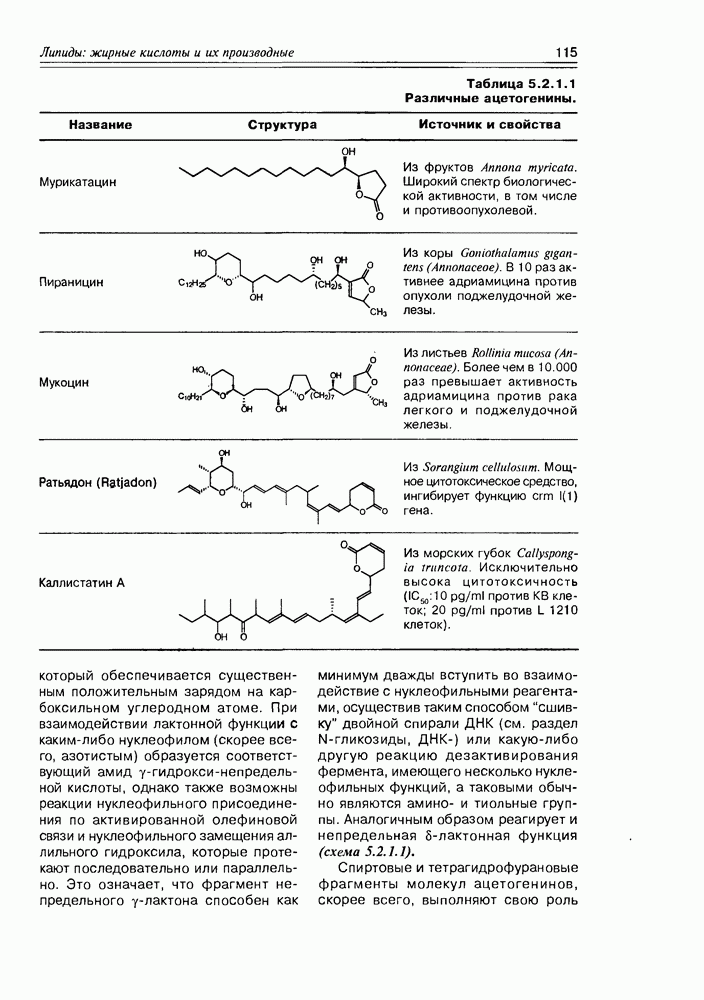
- 5.2. Метаболиты жирных кислот
- 5.2.2. Карбоциклические оксилипины
- 5.3. Жиры и жироподобные производные жирных кислот
- 5.4. Биосинтез жирных кислот и их производных
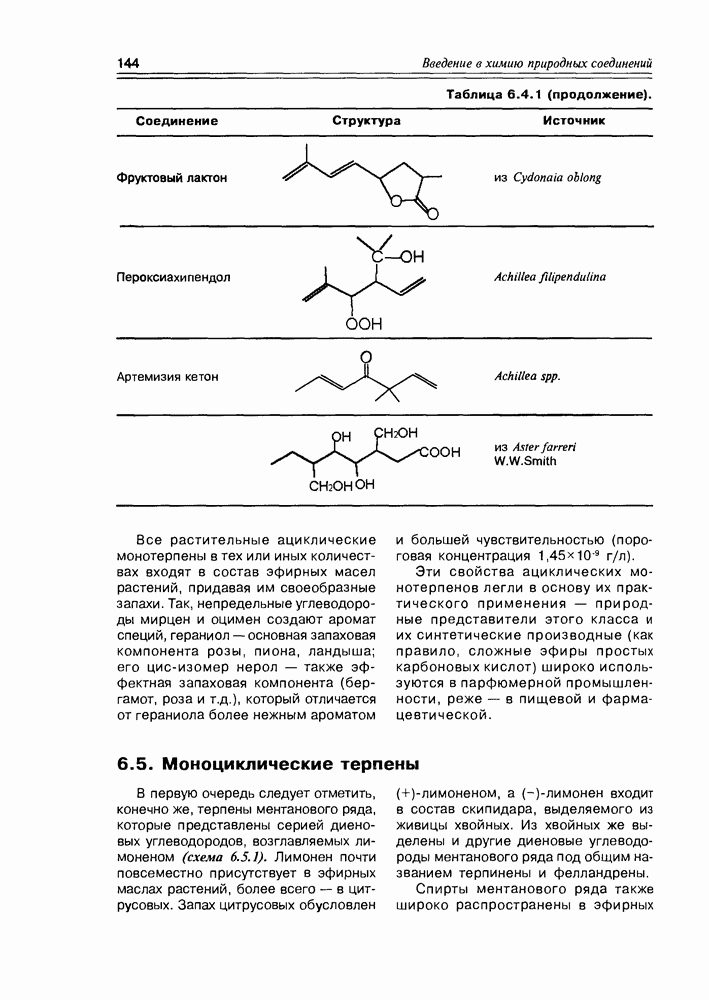
- Глава 6. ИЗОПРЕНОИДЫ-1
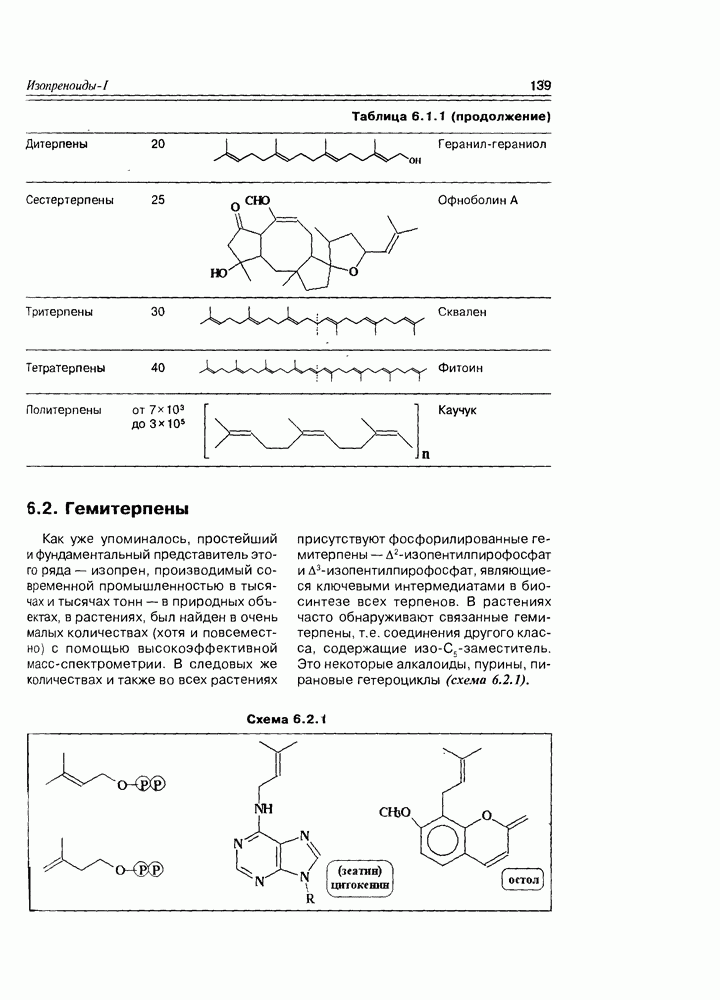
- 6.2. Гемитерпены
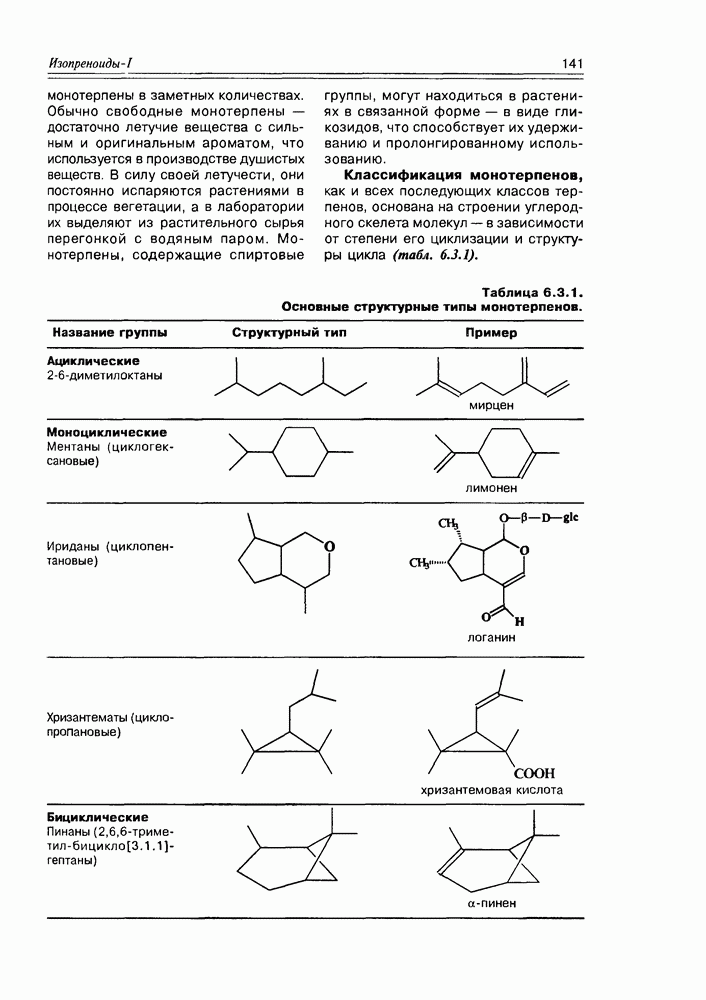
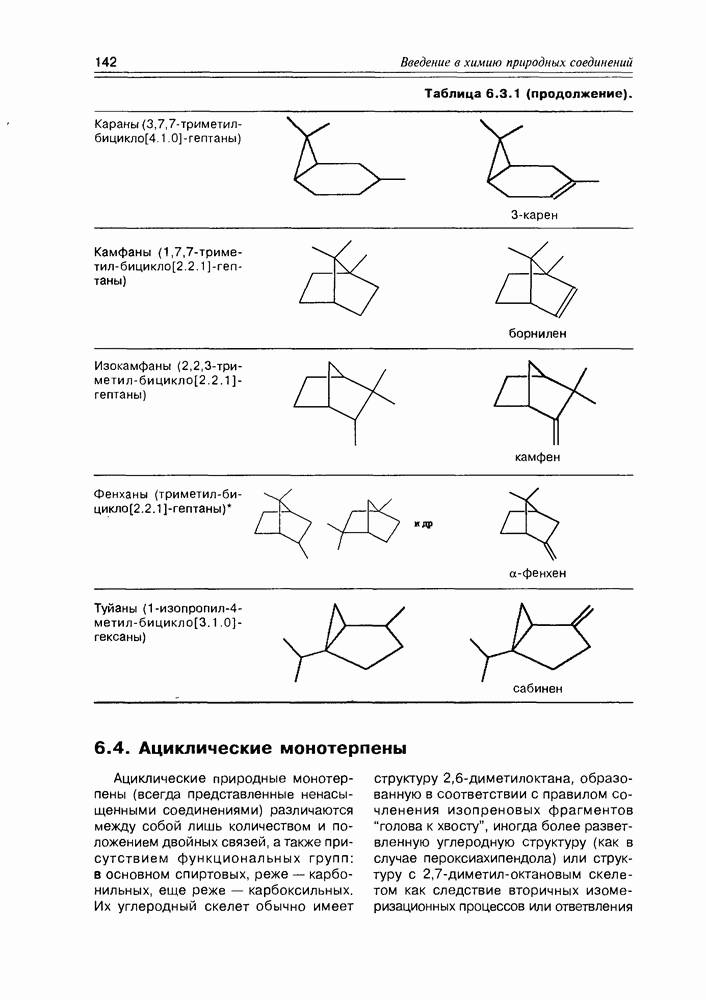
- 6.3. Монотерпены
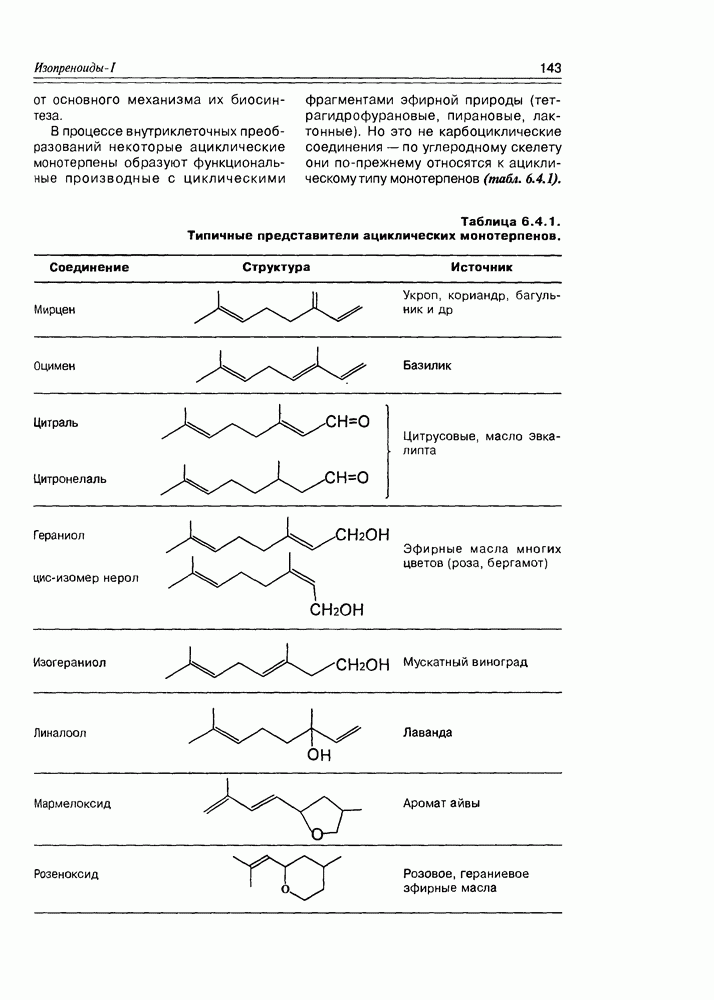
- 6.4. Ациклические монотерпены
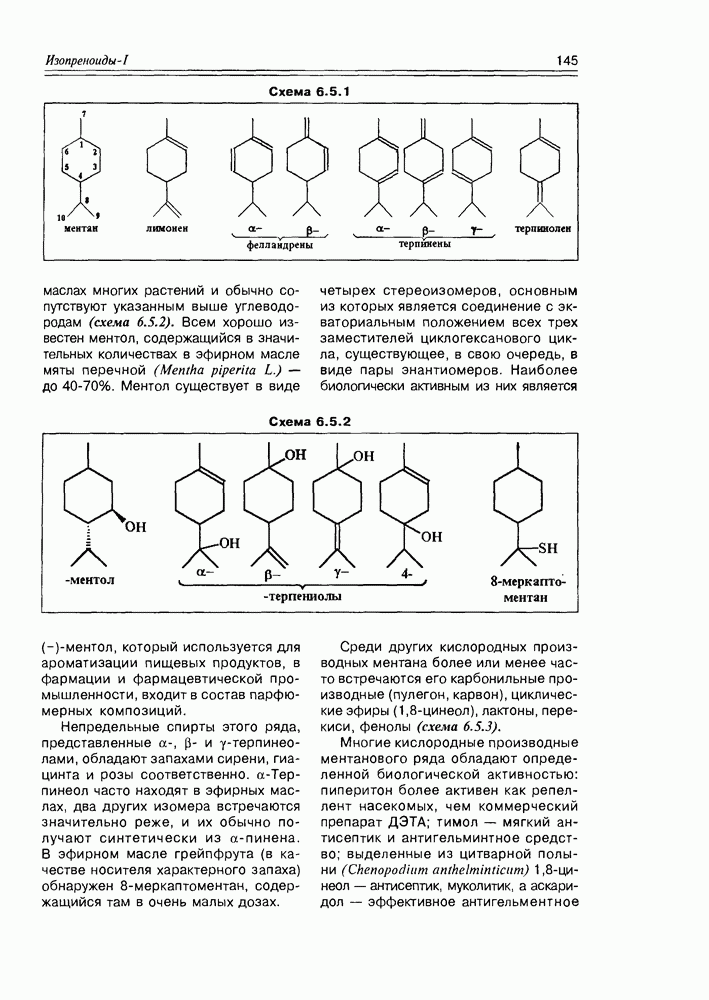
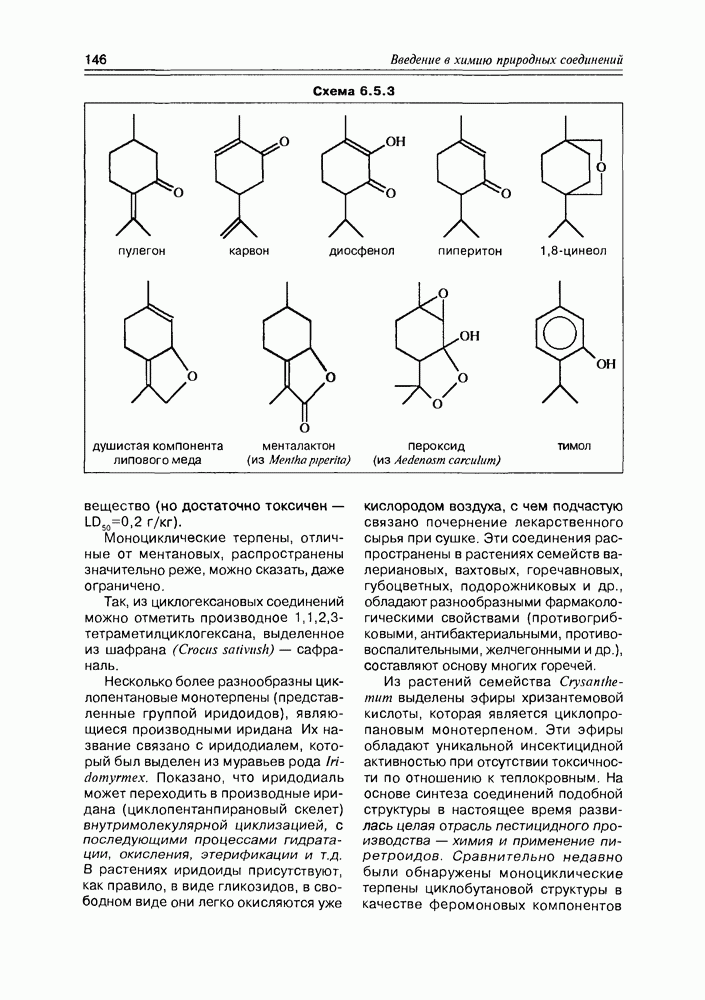
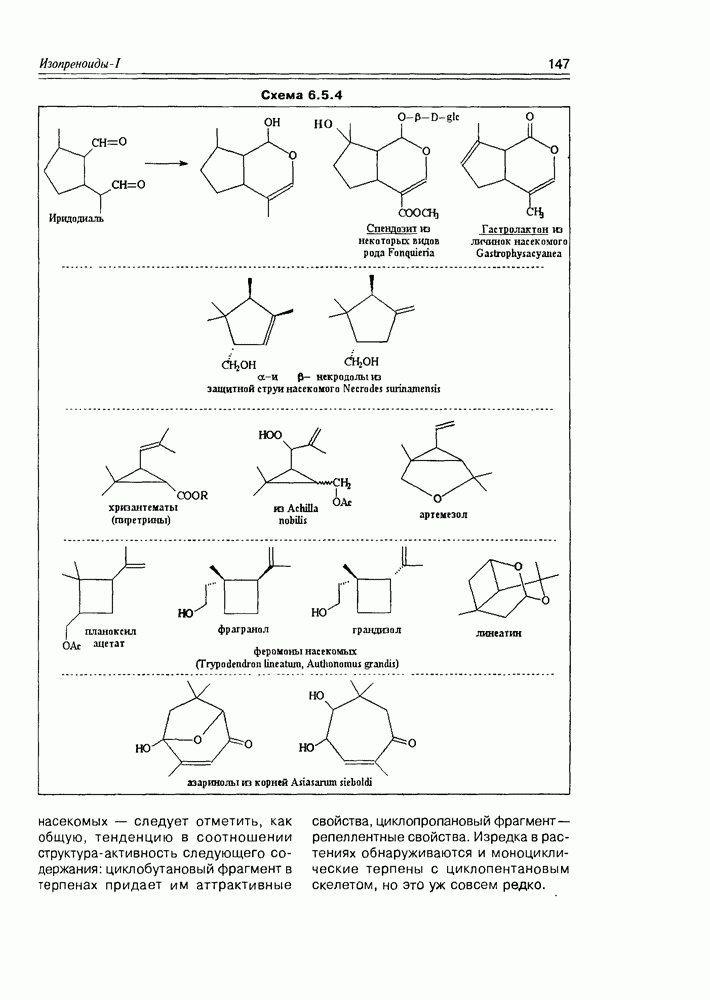
- 6.5. Моноциклические терпены
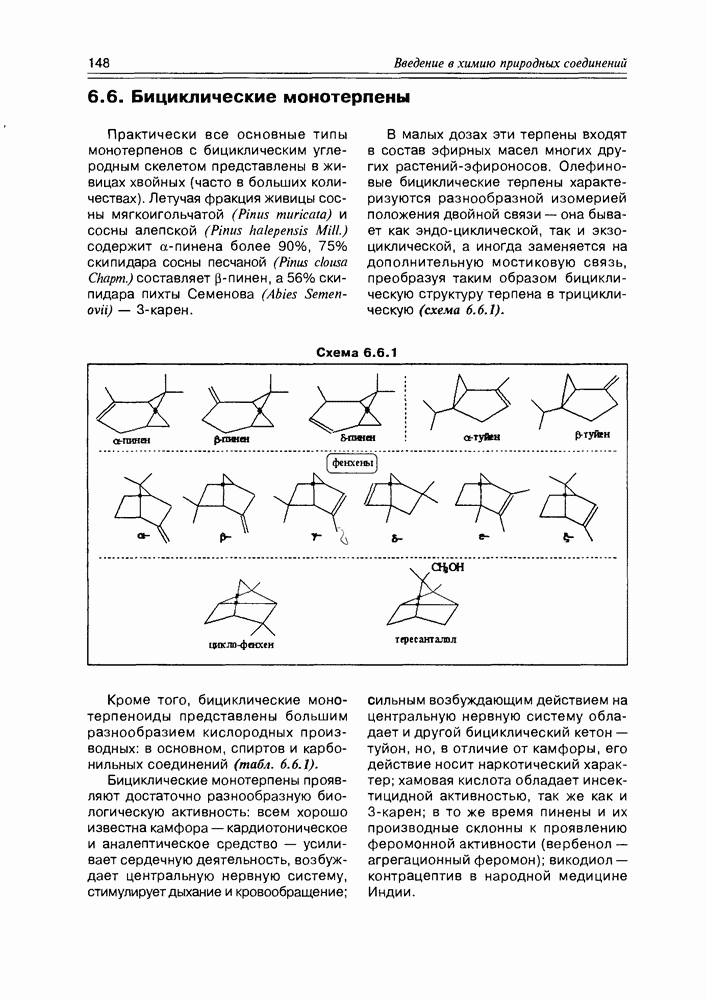
- 6.6. Бициклические монотерпены
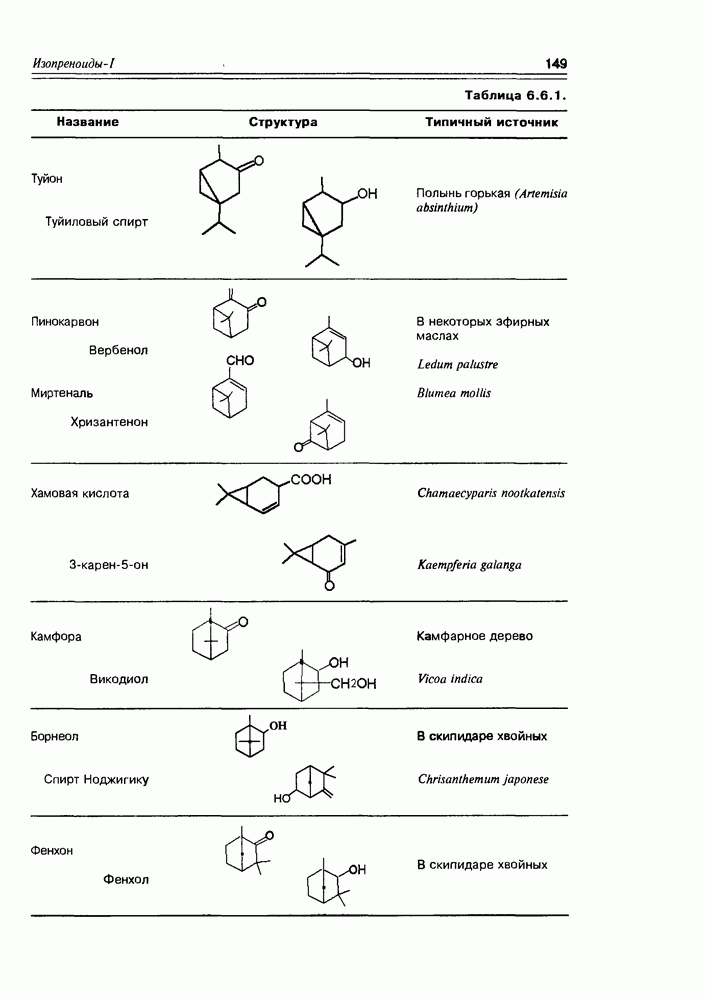
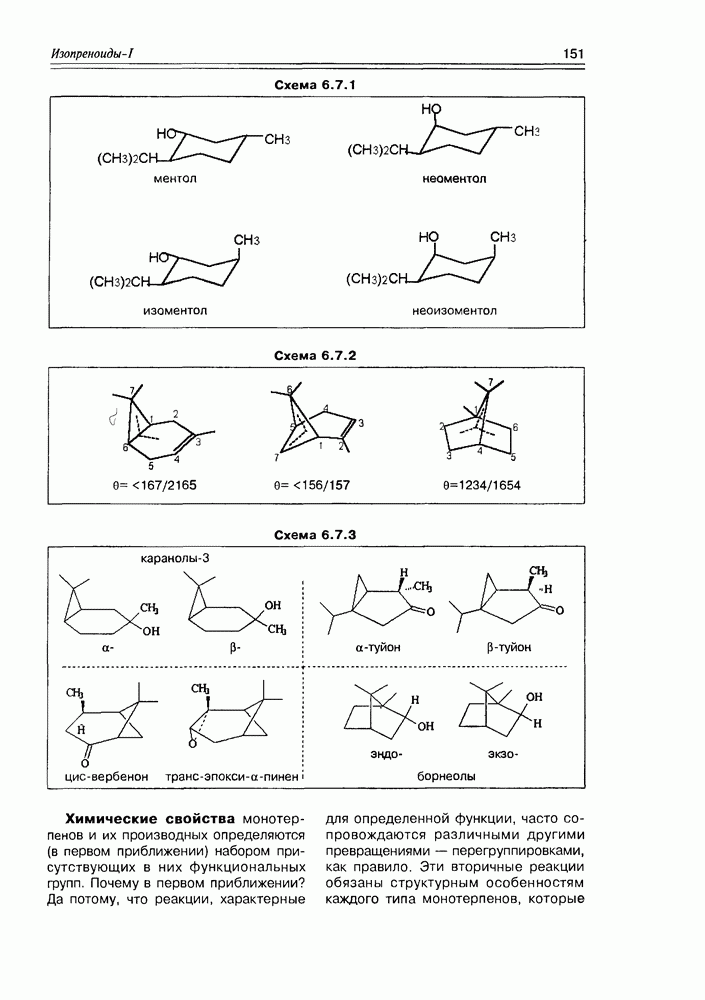
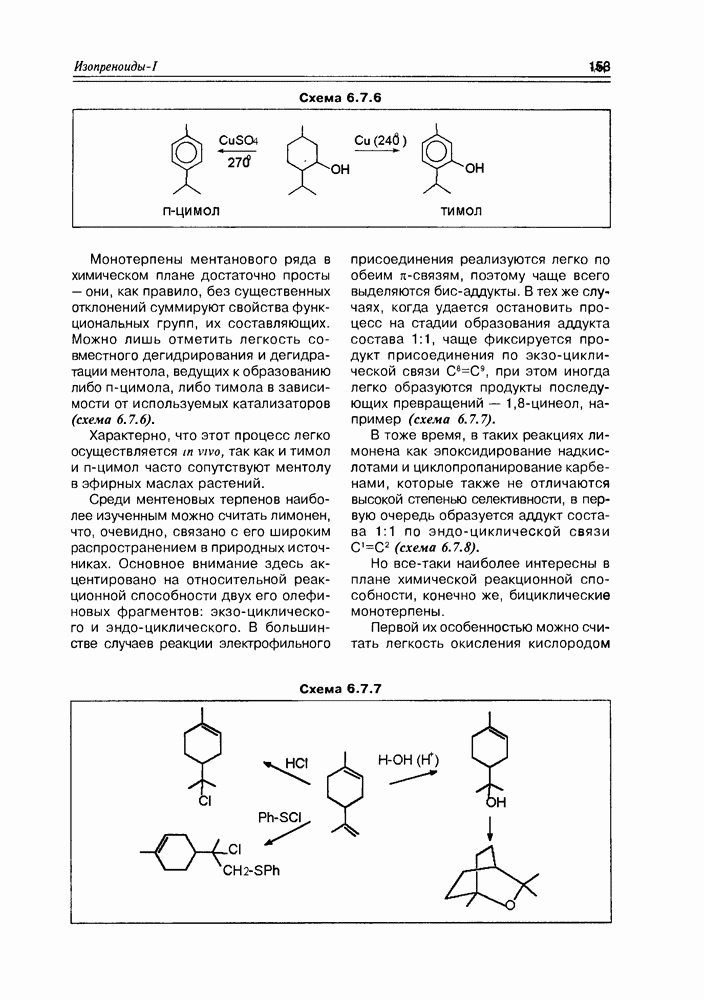
- 6.7. Строение и свойства монотерпенов
- 6.8. Биосинтез изопреноидов
- Глава 7. ИЗОПРЕНОИДЫ II. ОТ СЕСКВИТЕРПЕНОВ ДО ПОЛИТЕРПЕНОВ
- 7.2. Химические свойства сесквитерпенов
- 7.3. Дитерпены и сестертерпены
- 7.4. Тритерпеноиды и стероиды
- 7.5. Тетратерпеноиды — каротиноиды
- Глава 8. ФЕНОЛЬНЫЕ СОЕДИНЕНИЯ
- 8.2. Пираны
- 8.4. Биосинтез фенольных соединений
- Глава 9. АЛКАЛОИДЫ И ПОРФИРИНЫ
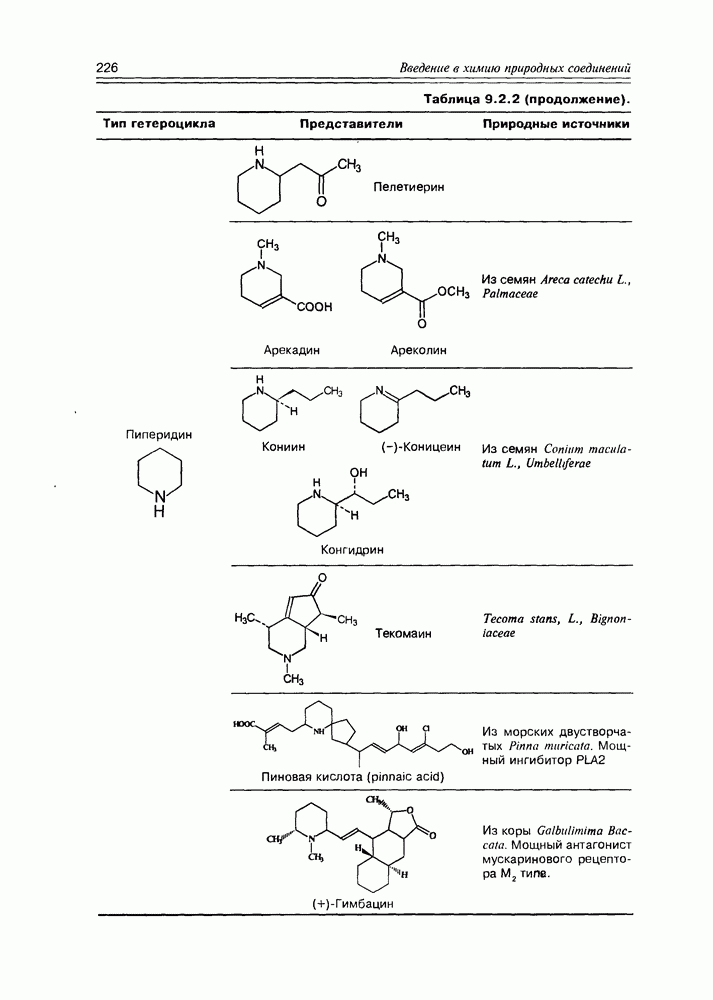
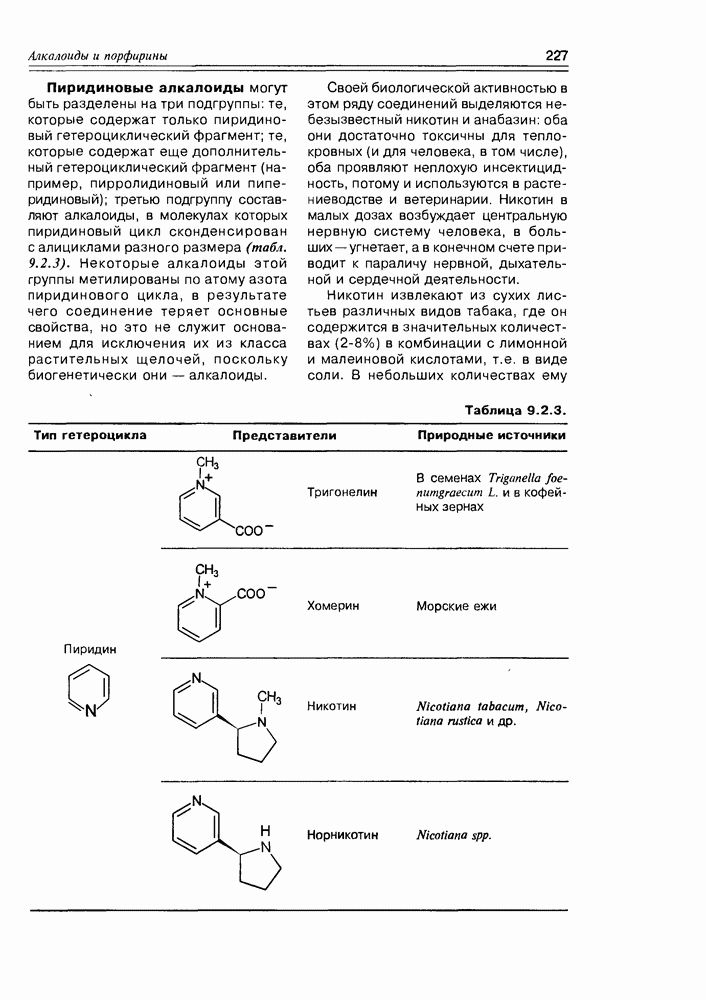
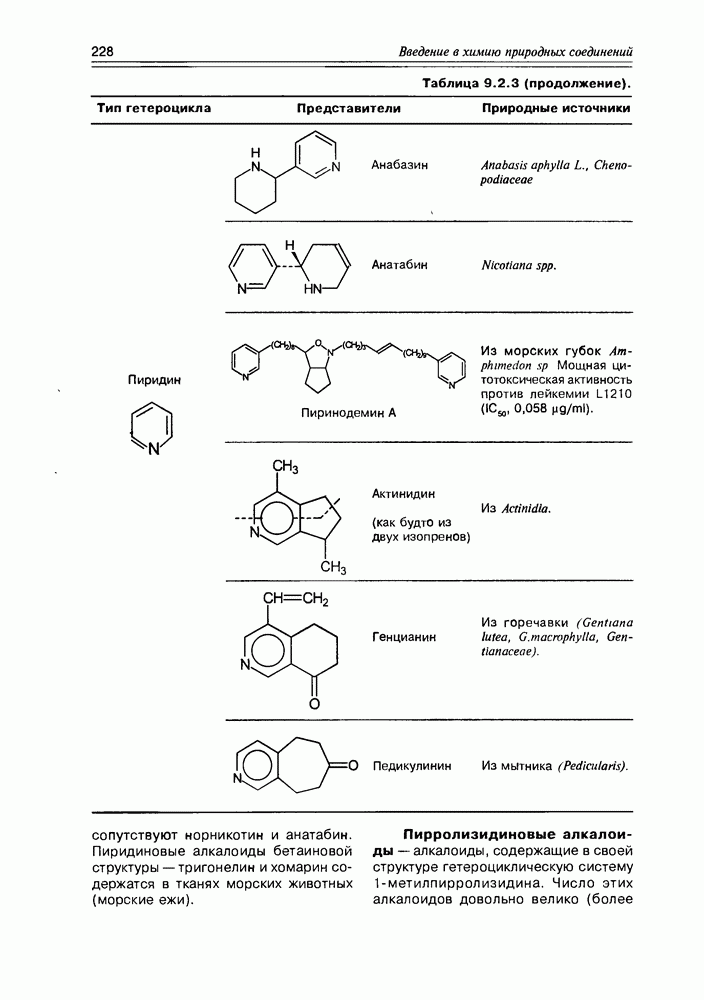
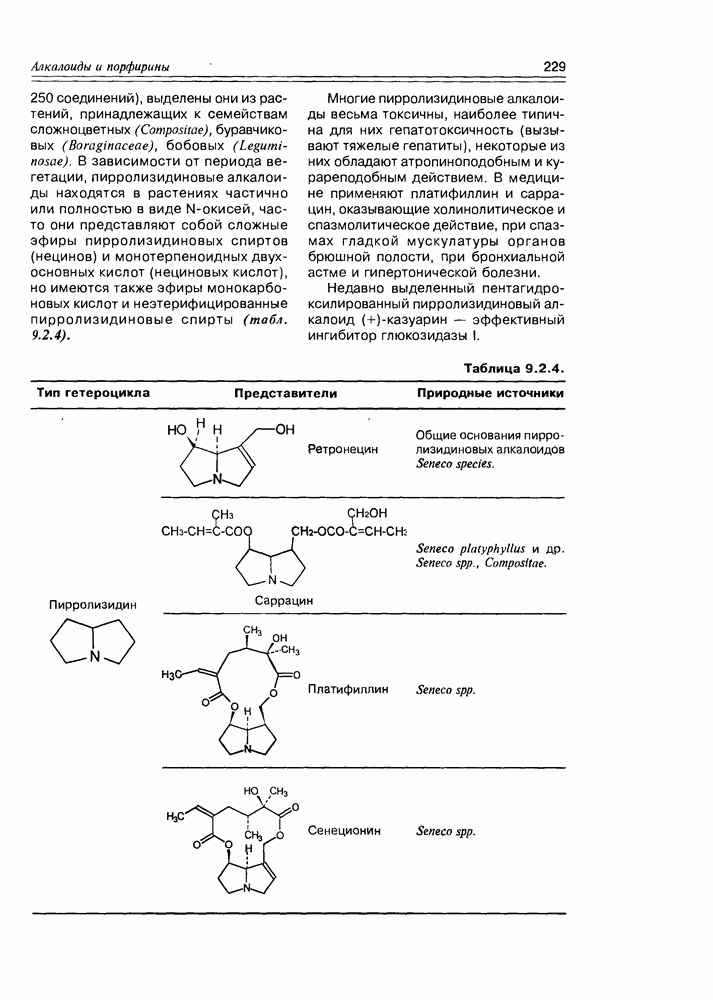
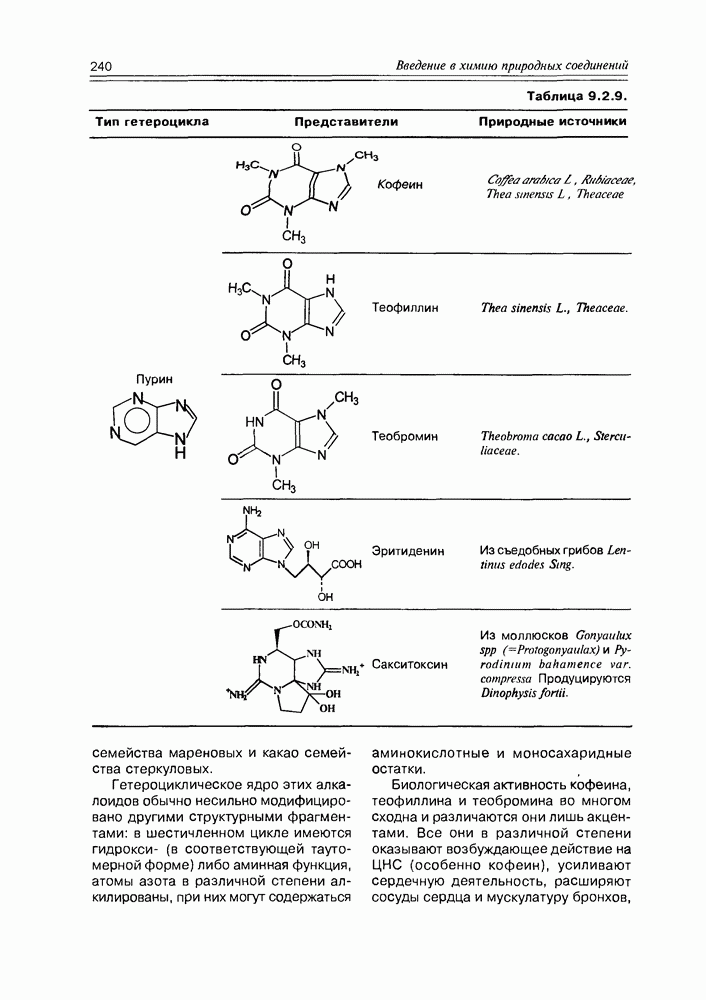
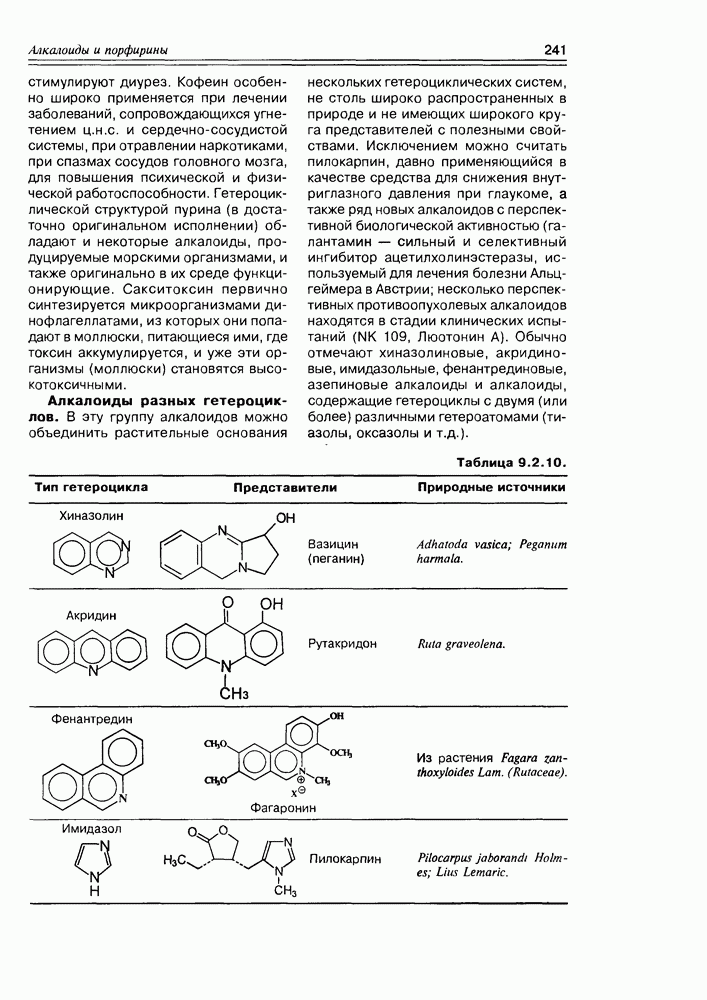
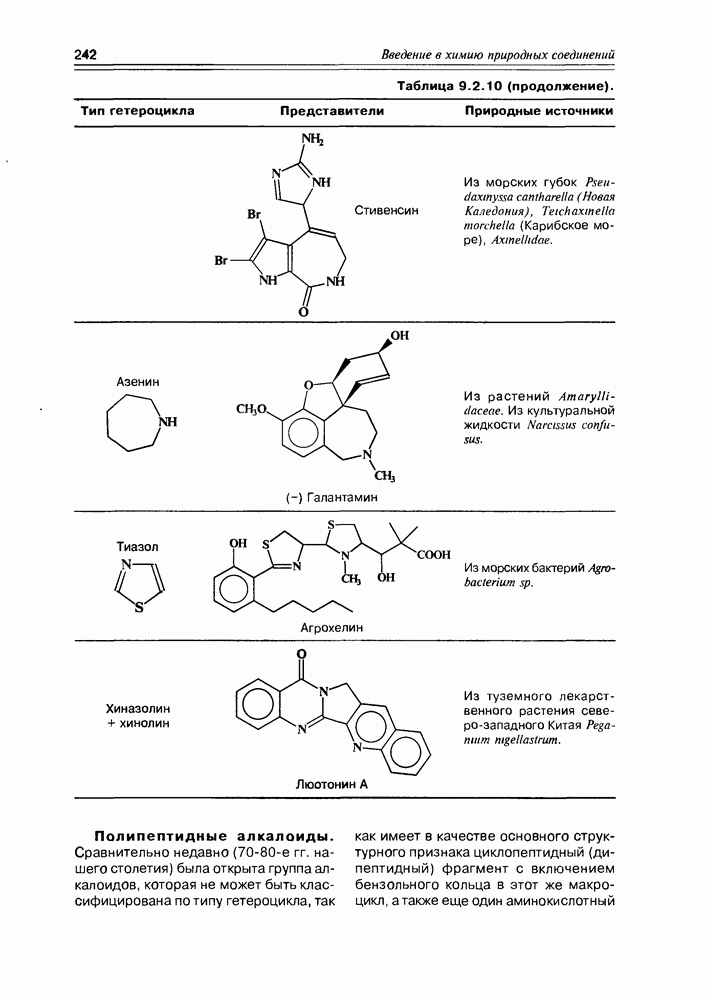
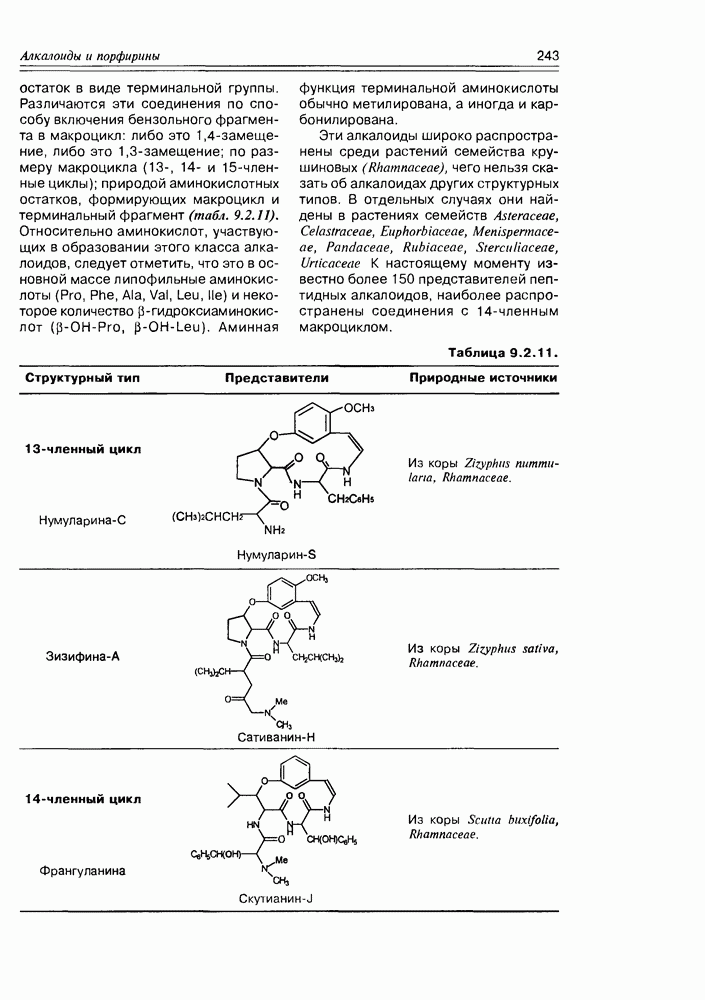
- 9.2. Истинные алкалоиды
- 9.3. Протоалкалоиды
- 9.5. Химические свойства и химические модификации алкалоидов
- 9.6. Аминокислоты и биосинтез алкалоидов
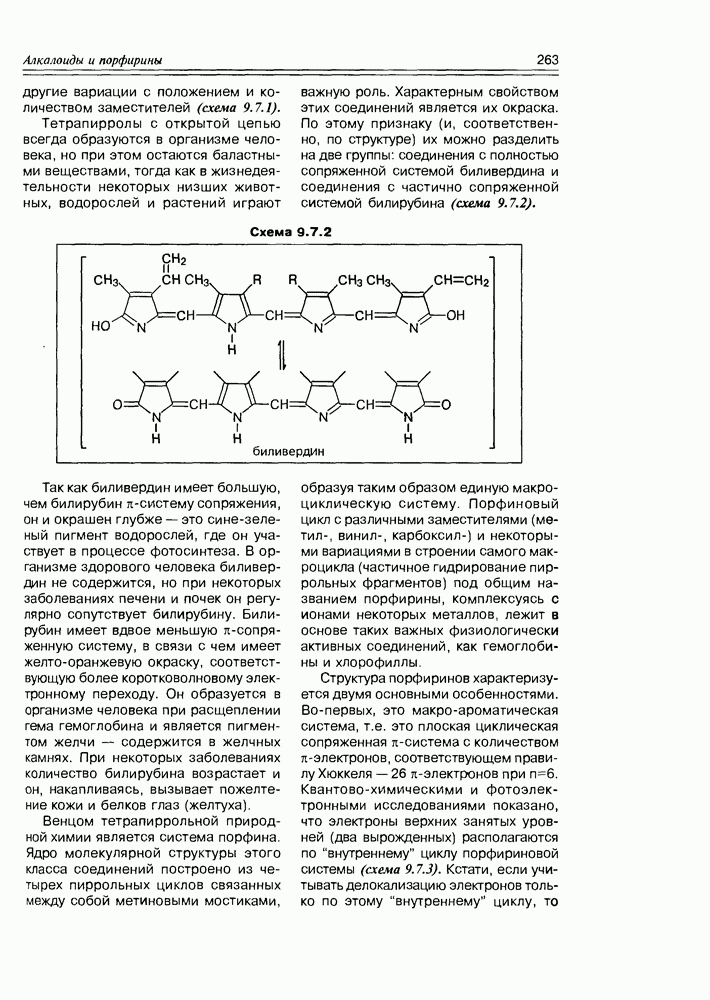
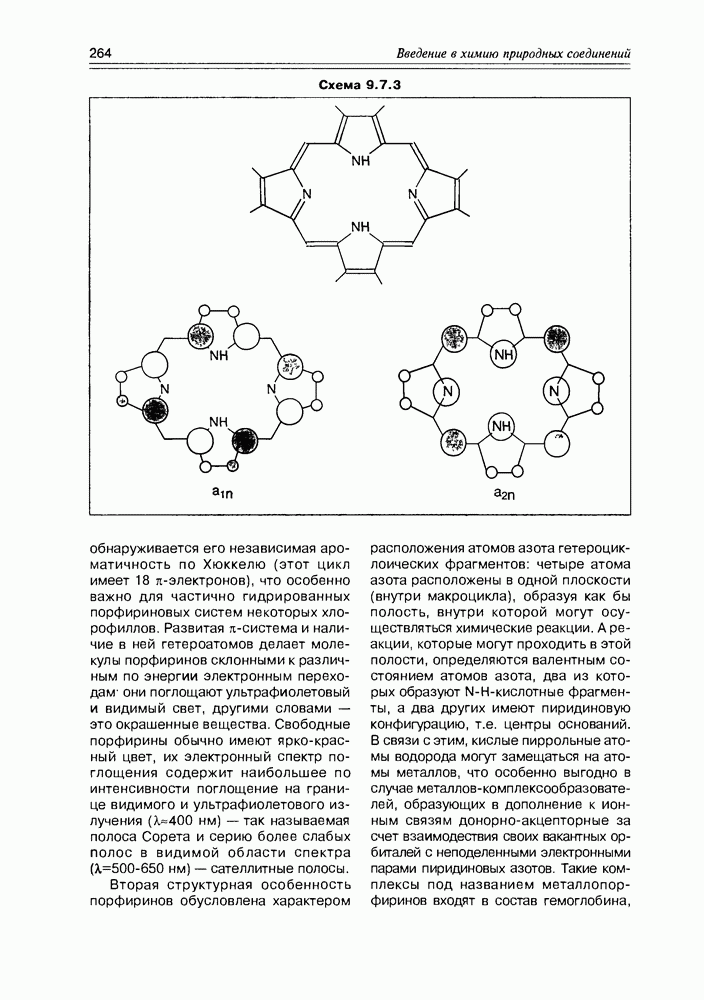
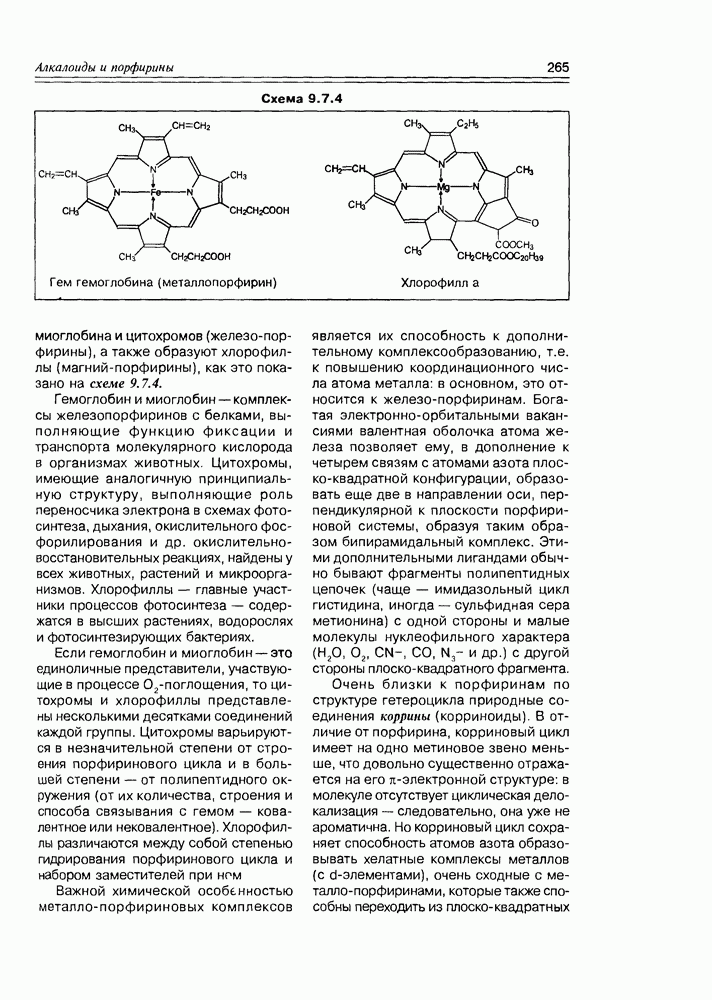
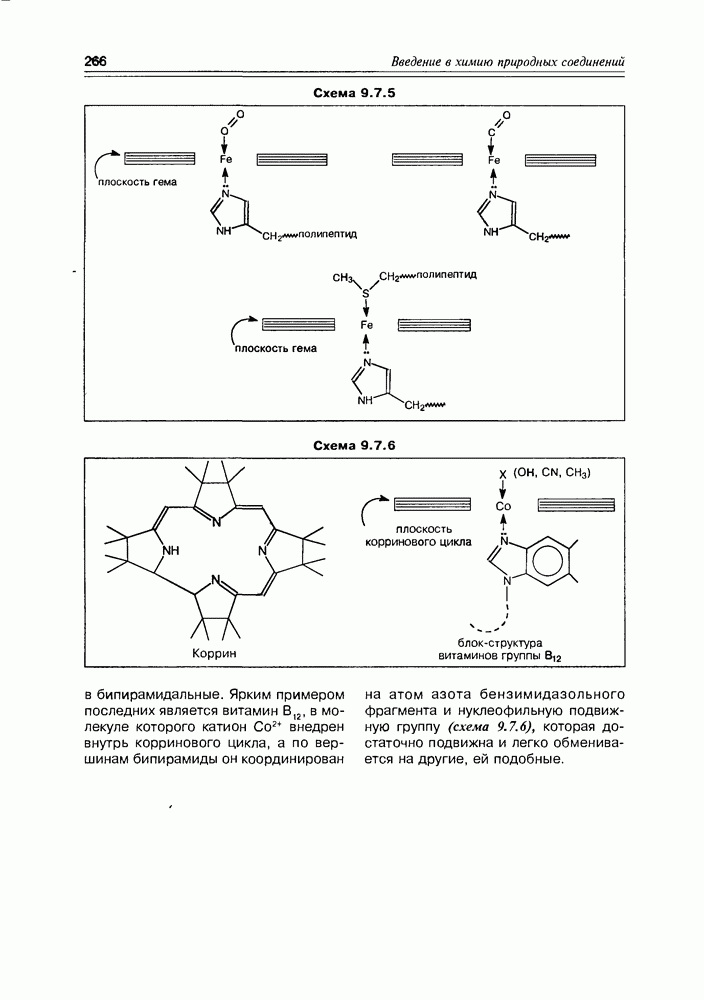
- 9.7. Порфирины
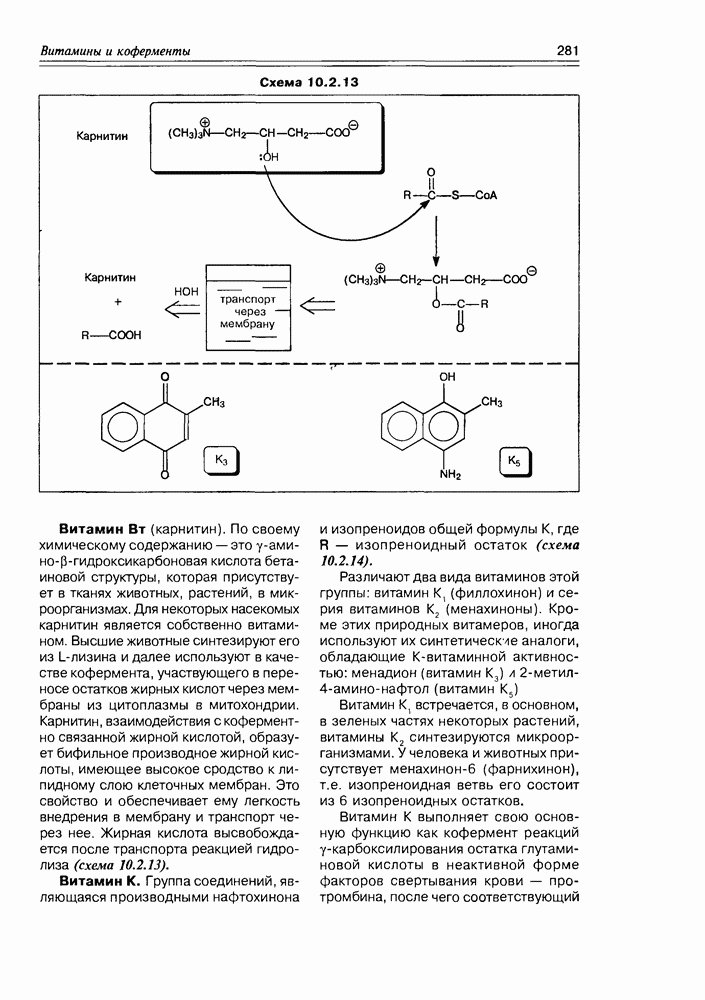
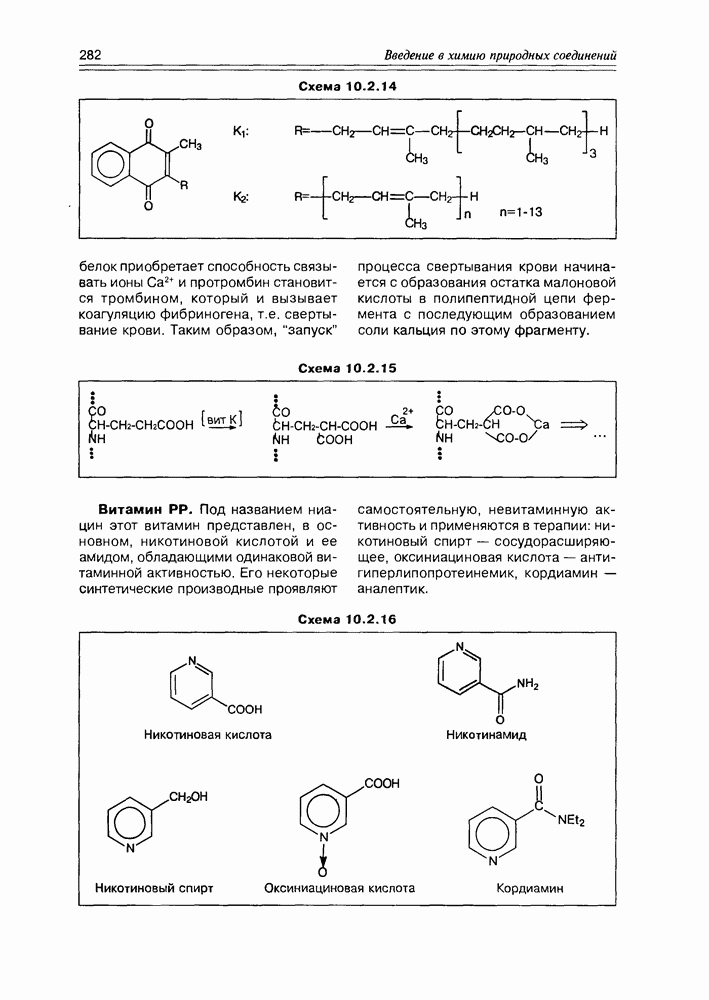
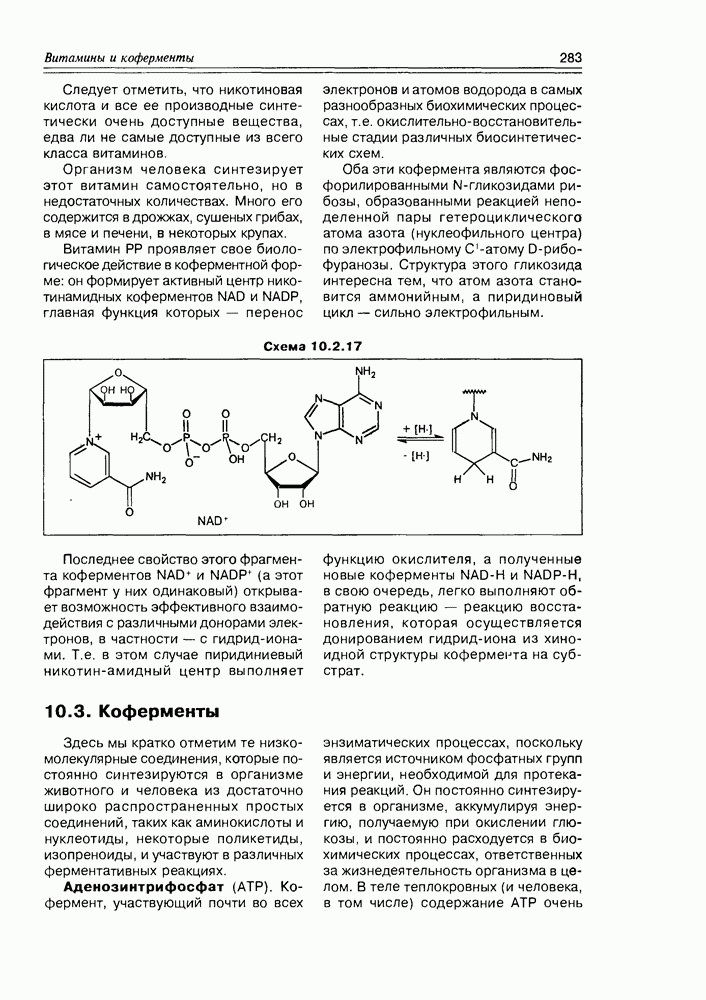
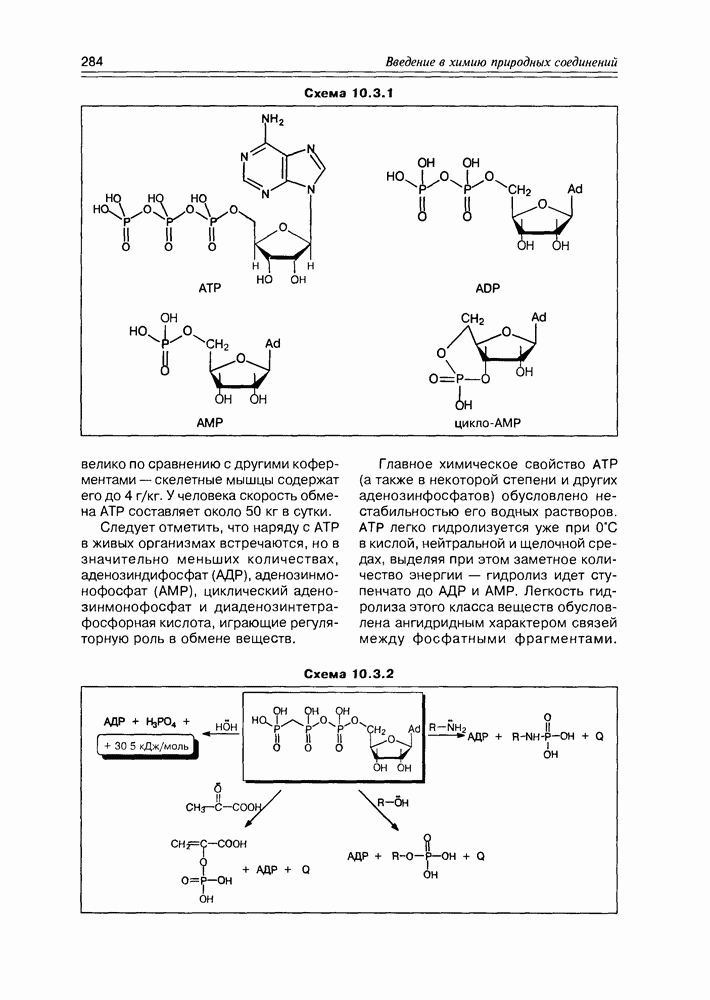
- Глава 10. ВИТАМИНЫ И КОФЕРМЕНТЫ
- 10.1. Витамины — собственно
- 10.2. Витамины-коферменты
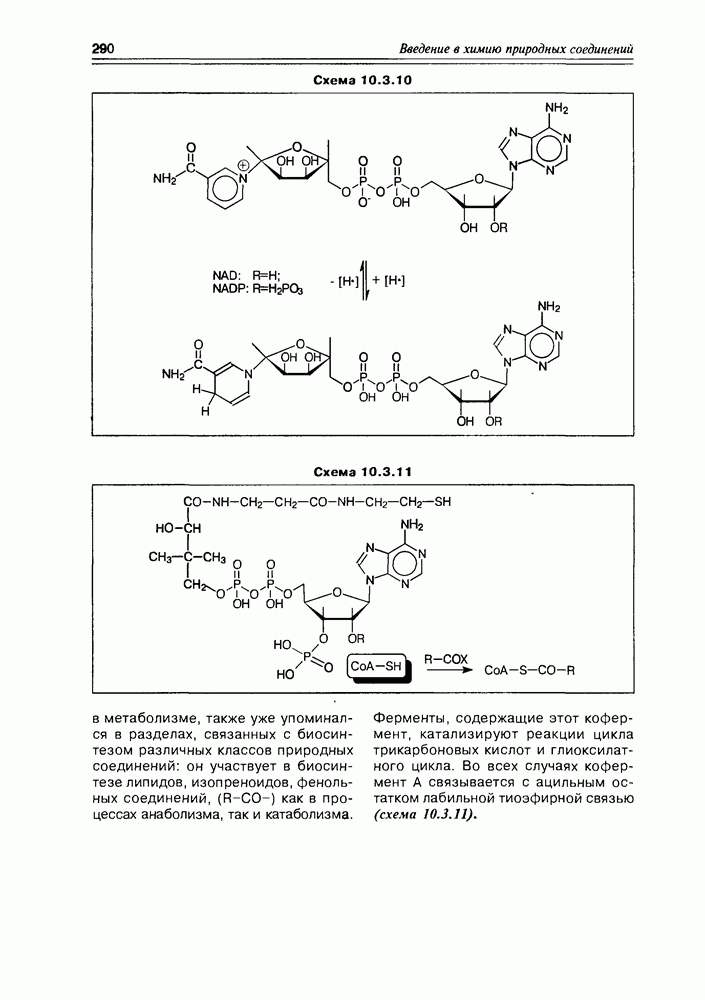
- 10.3. Коферменты
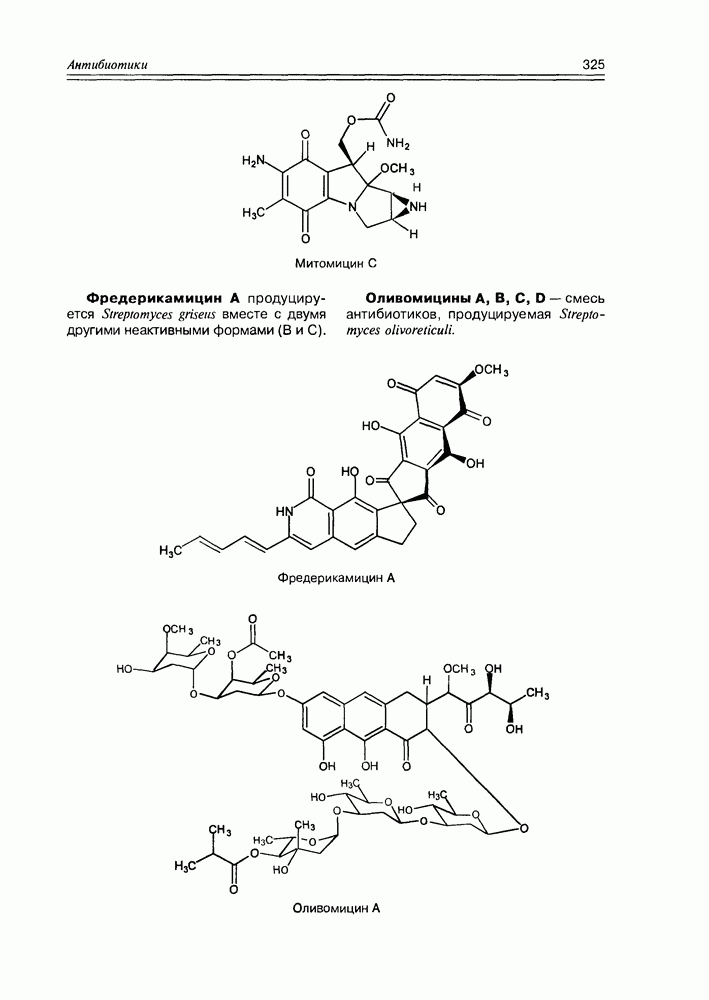
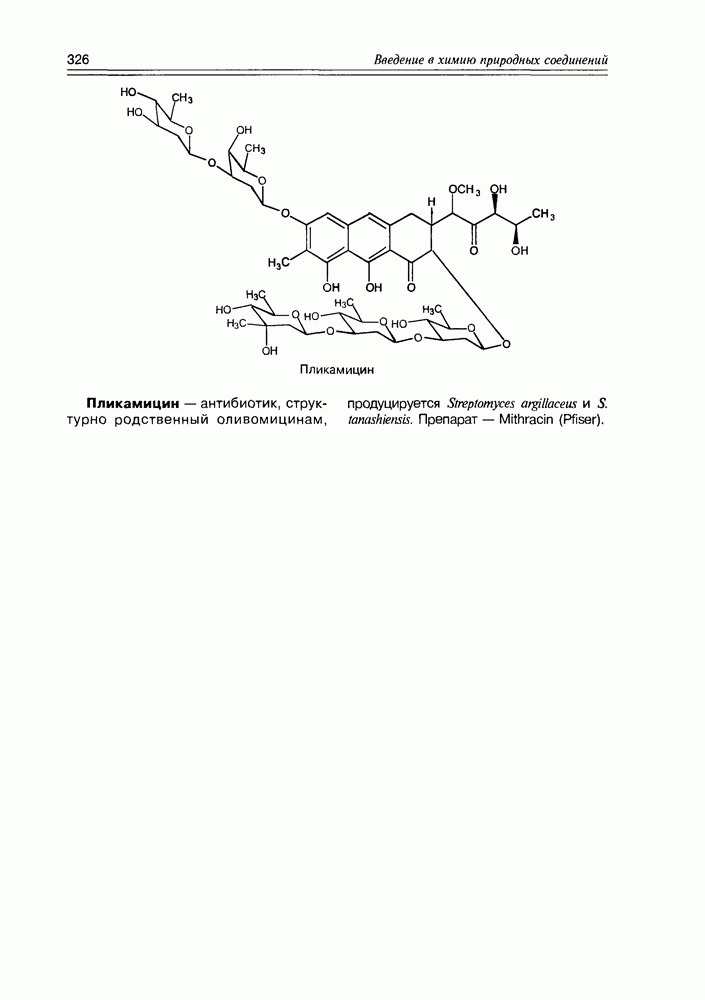
- Глава 11. АНТИБИОТИКИ
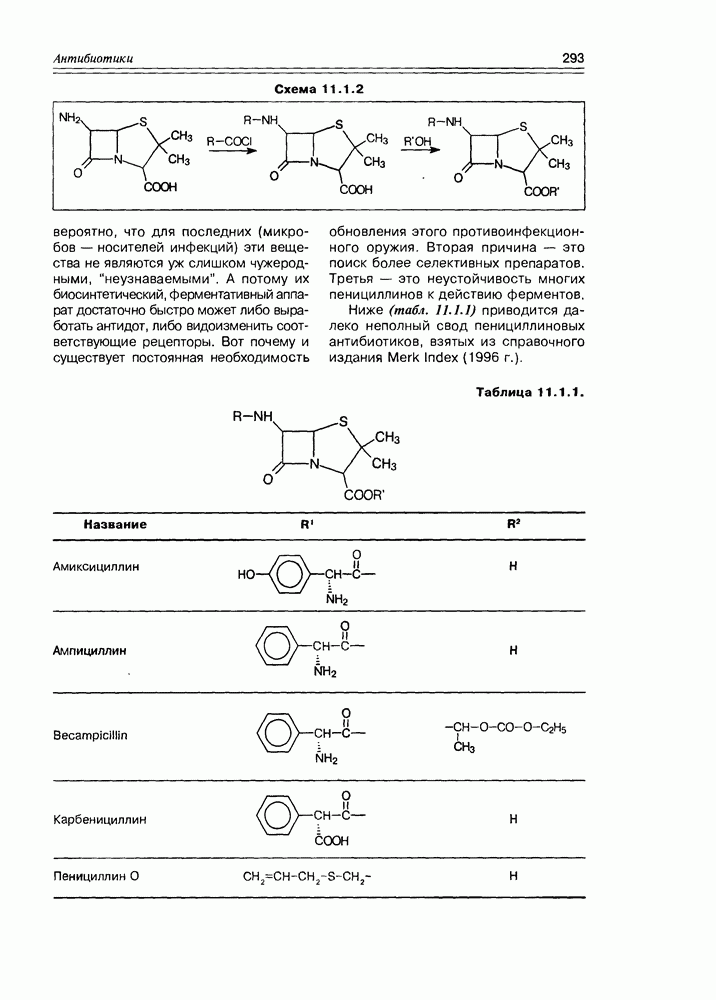
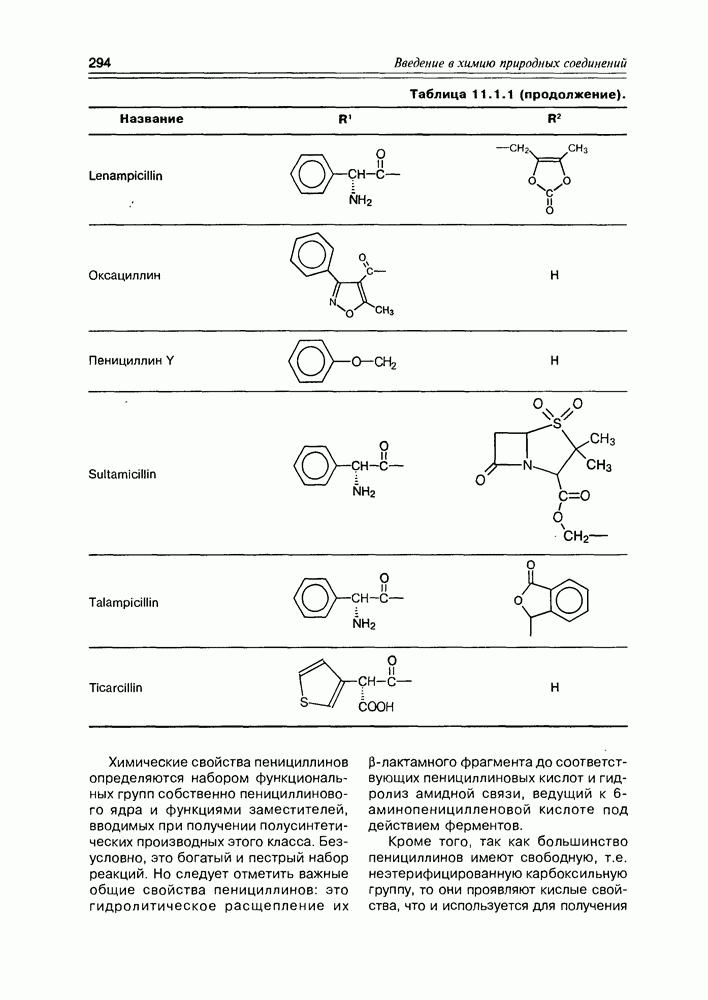
- 11.1. b-Лактамные антибиотики
- 11.2. Тетраценовые антибиотики
- 11.3. Аминогликозидные антибиотики
- 11.4. Пептидные антибиотики
- 11.5. Макролидные антибиотики
- 11.6. Полиэфирные антибиотики
- 11.7. Антибиотики разные
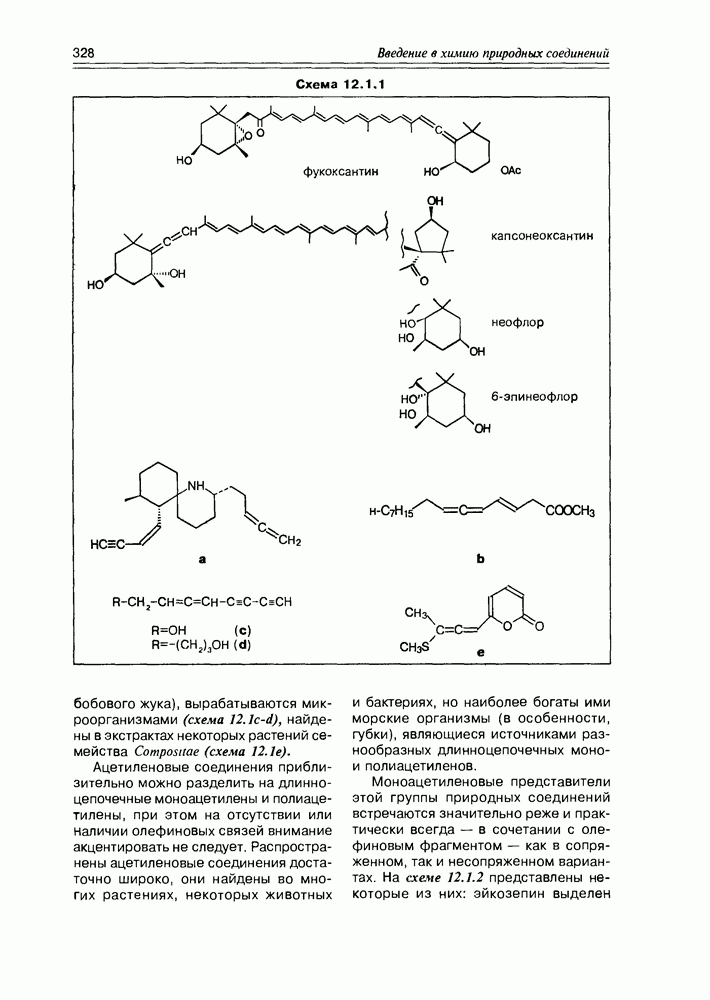
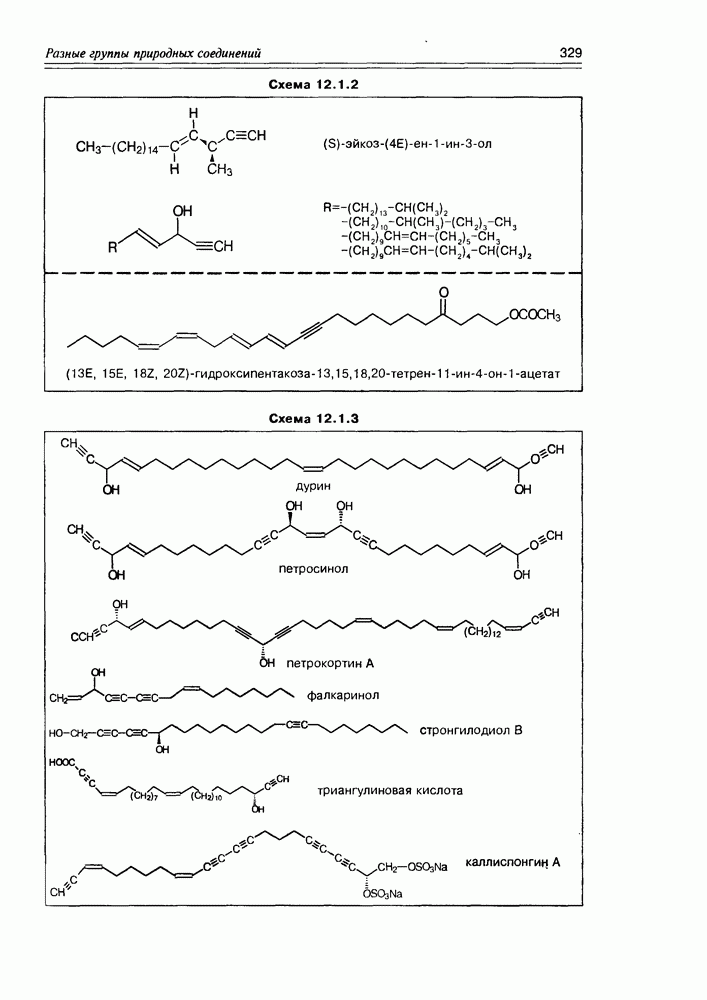
- Глава 12. РАЗНЫЕ ГРУППЫ ПРИРОДНЫХ СОЕДИНЕНИЙ
- 12.2. Полиэфиры
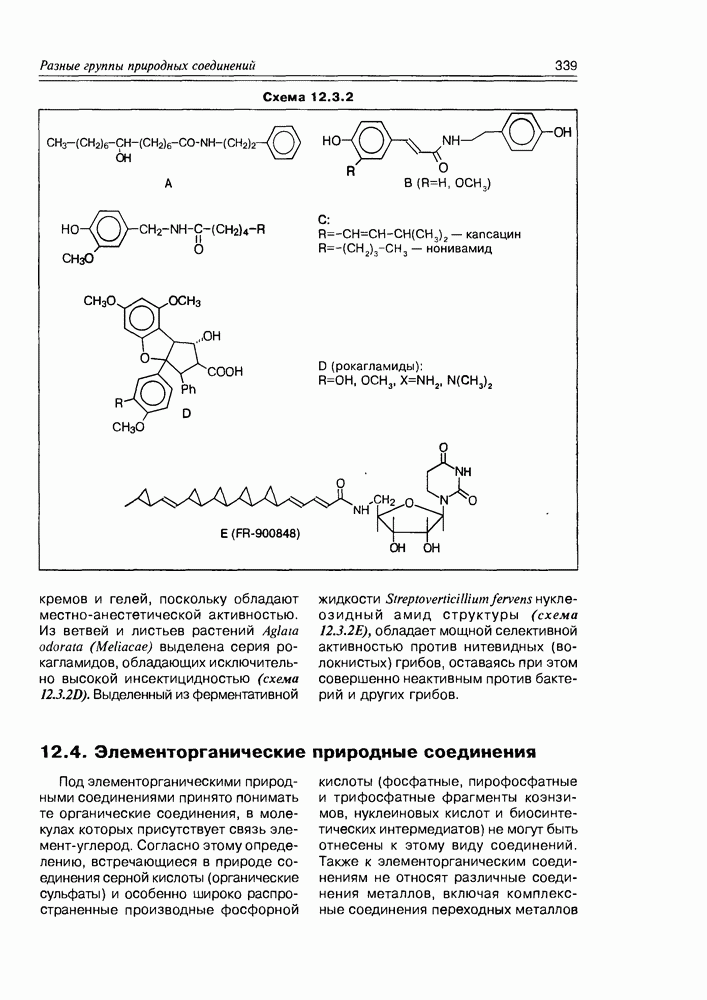
- 12.3. Амиды
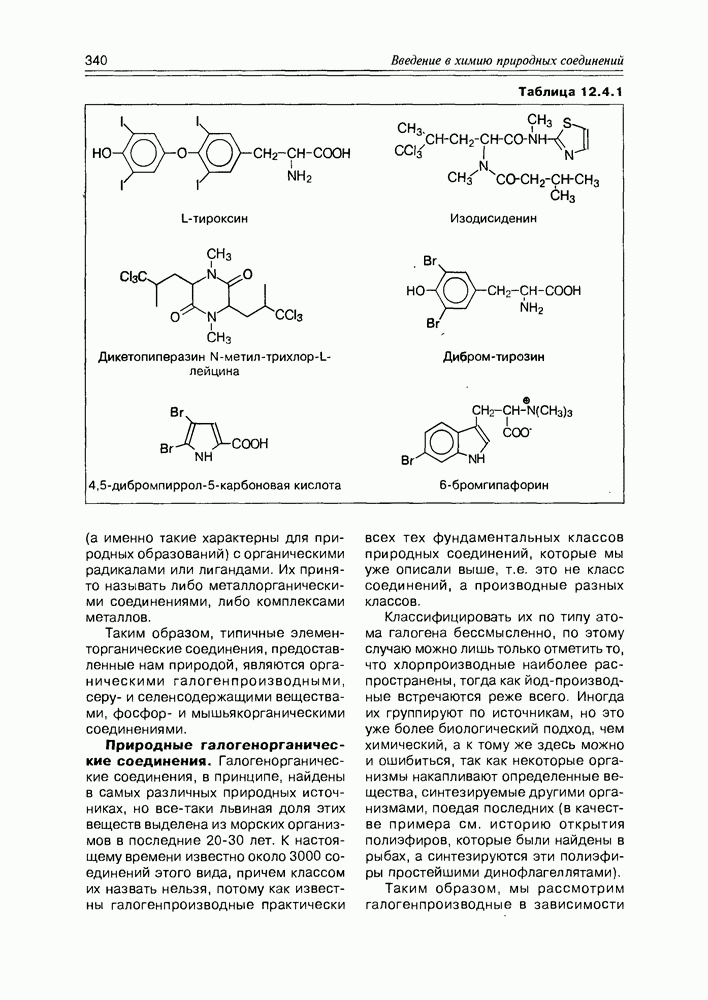
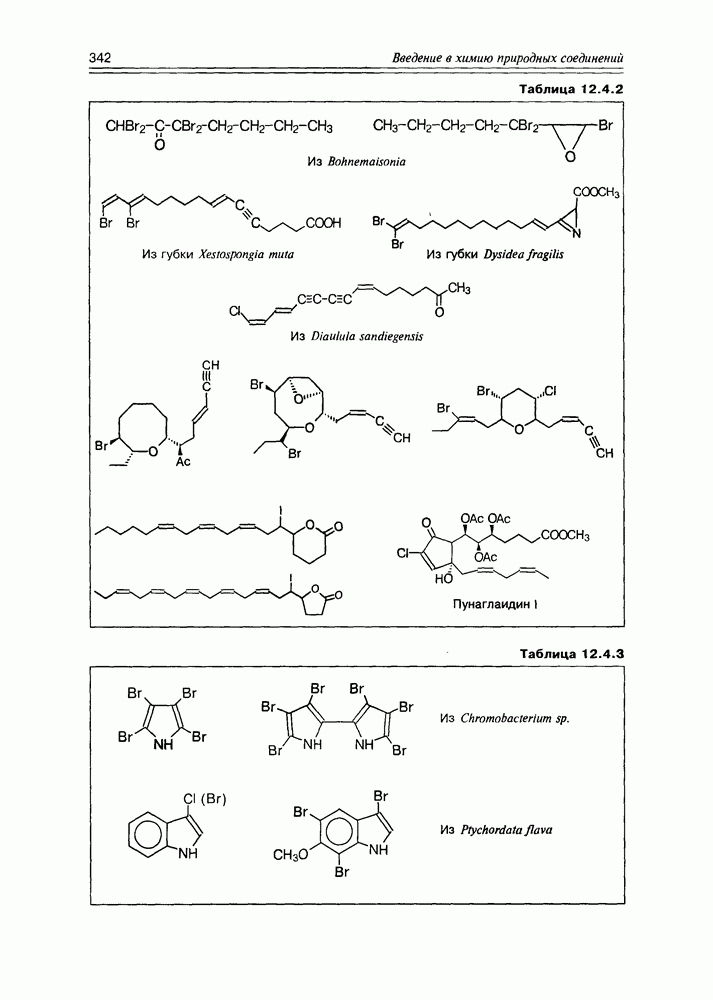
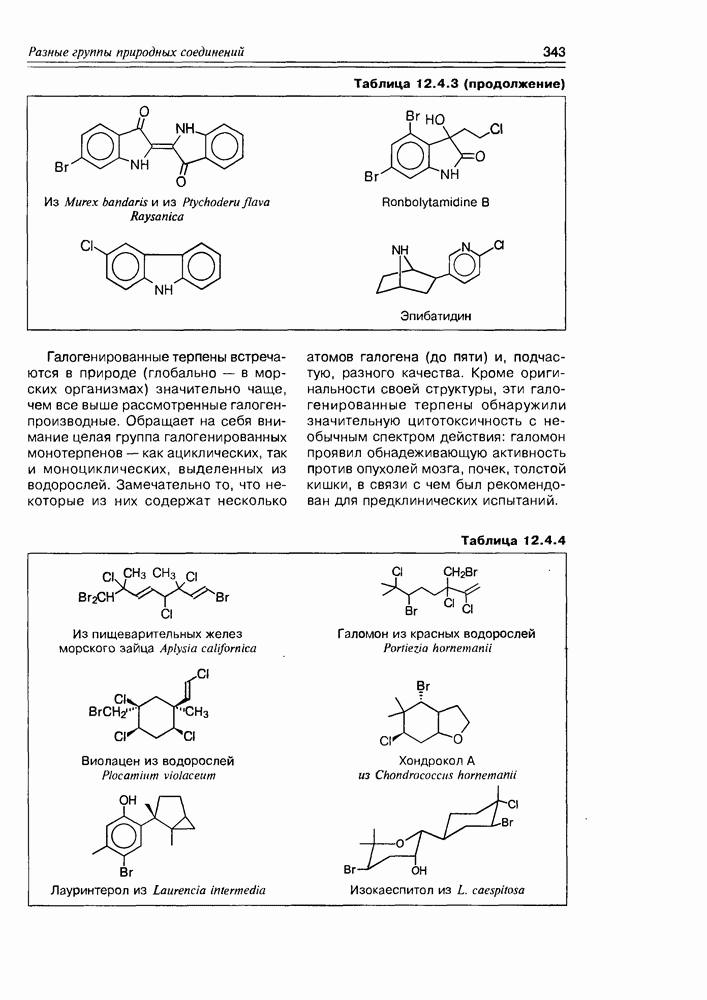
- 12.4. Элементорганические природные соединения
- Глава 13. МЕТАЛЛО-КОЭНЗИМЫ