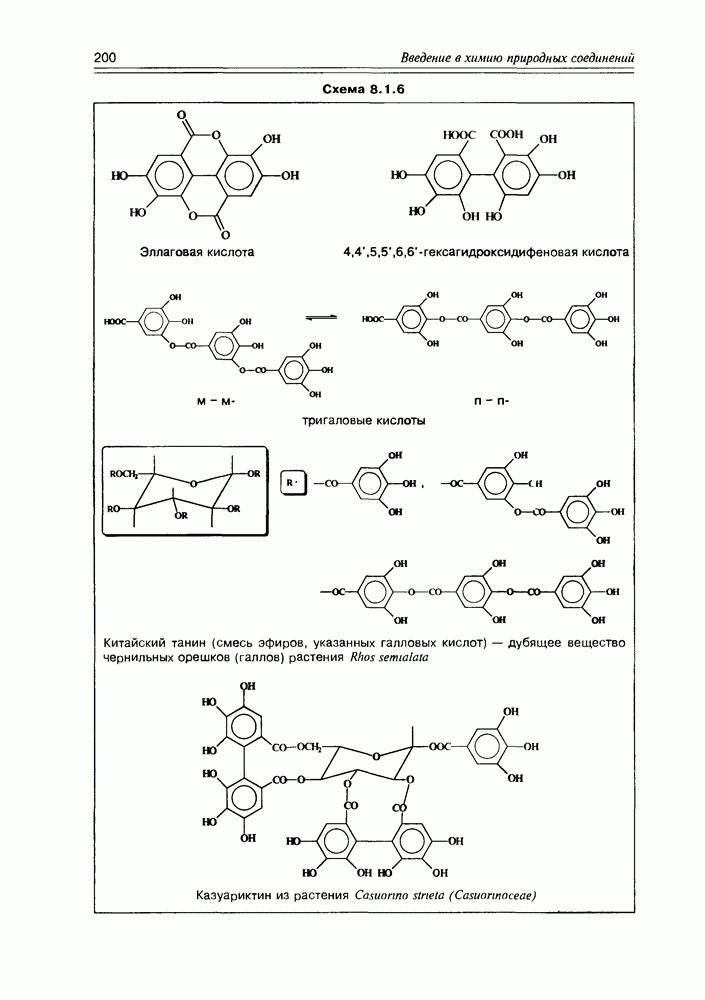
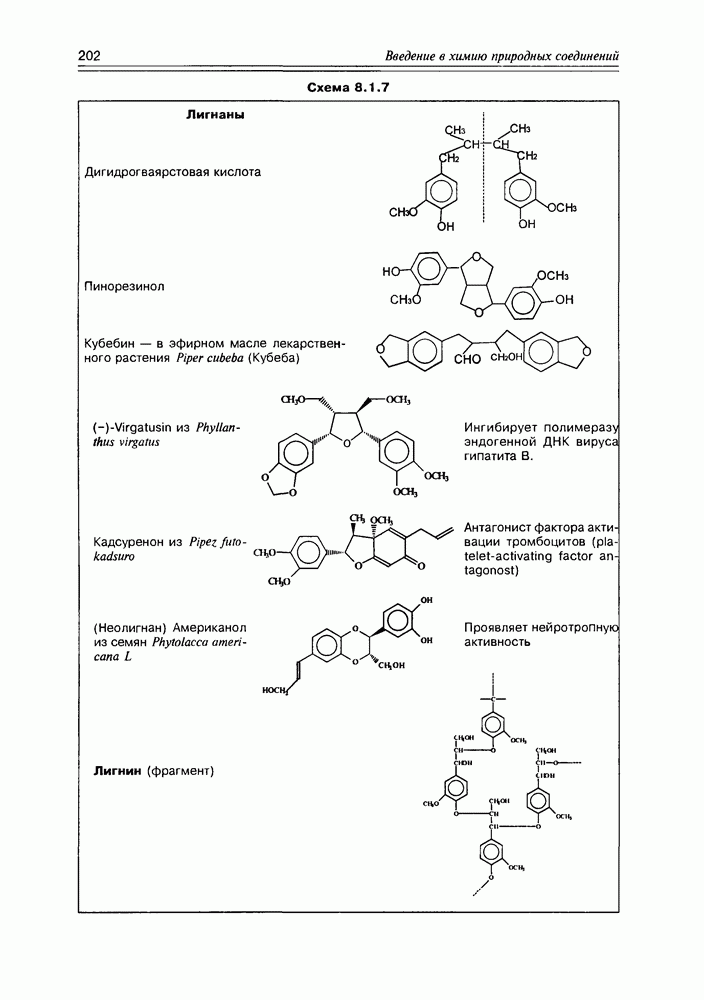
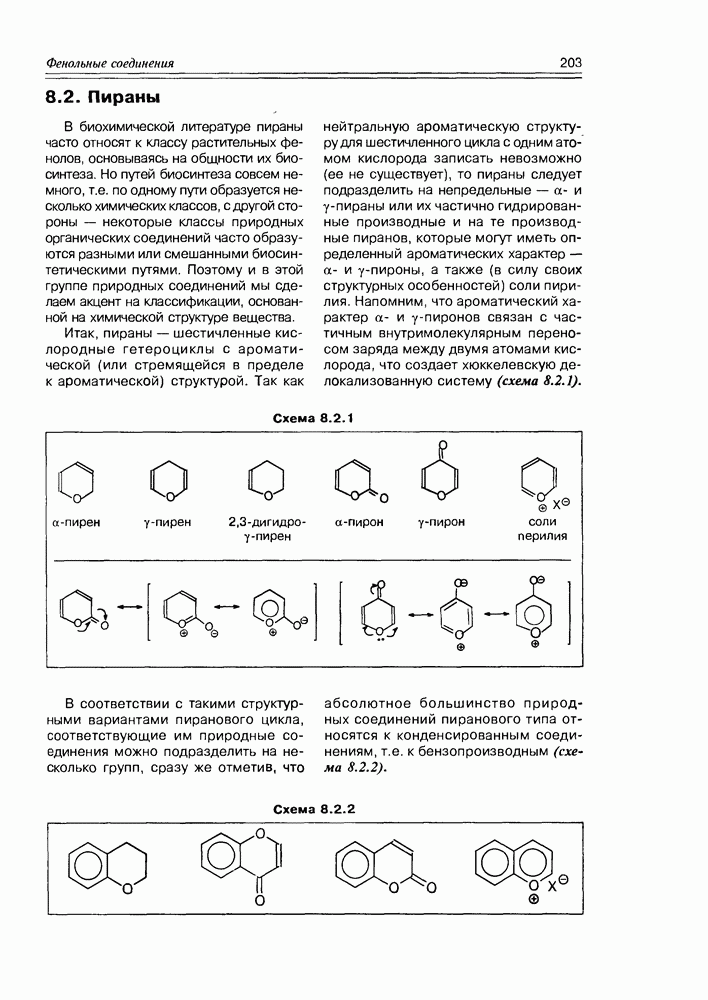
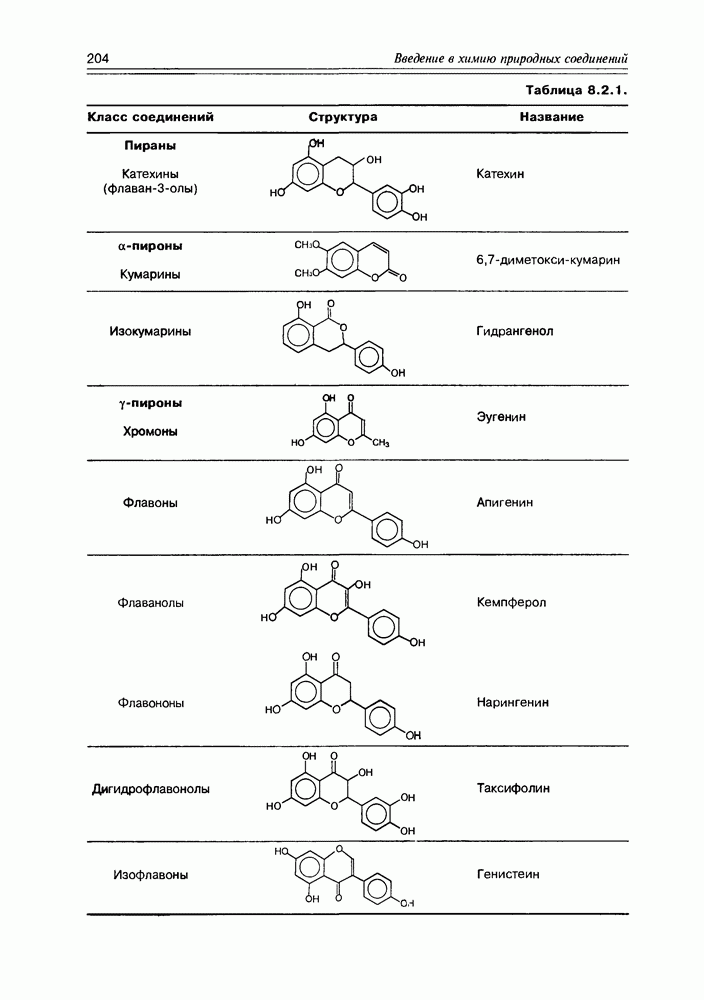
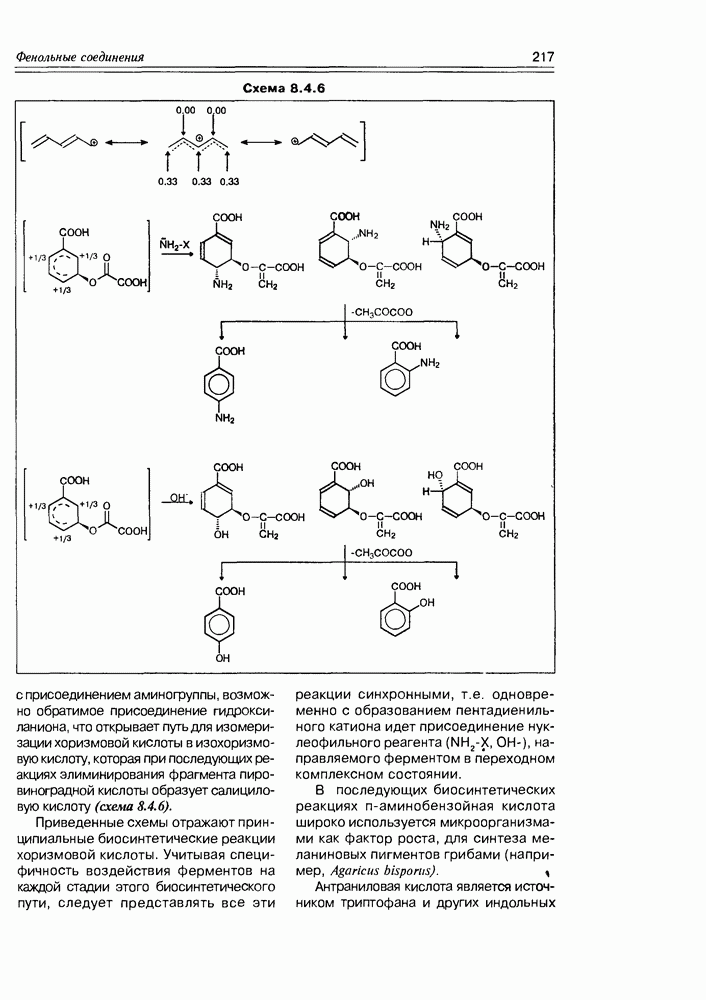
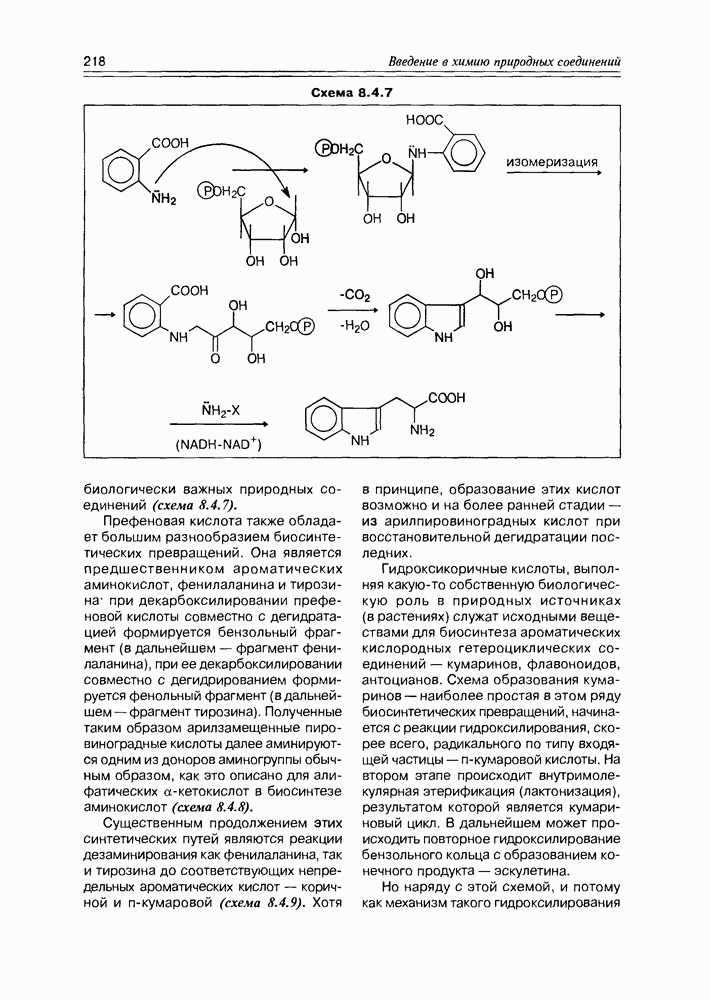
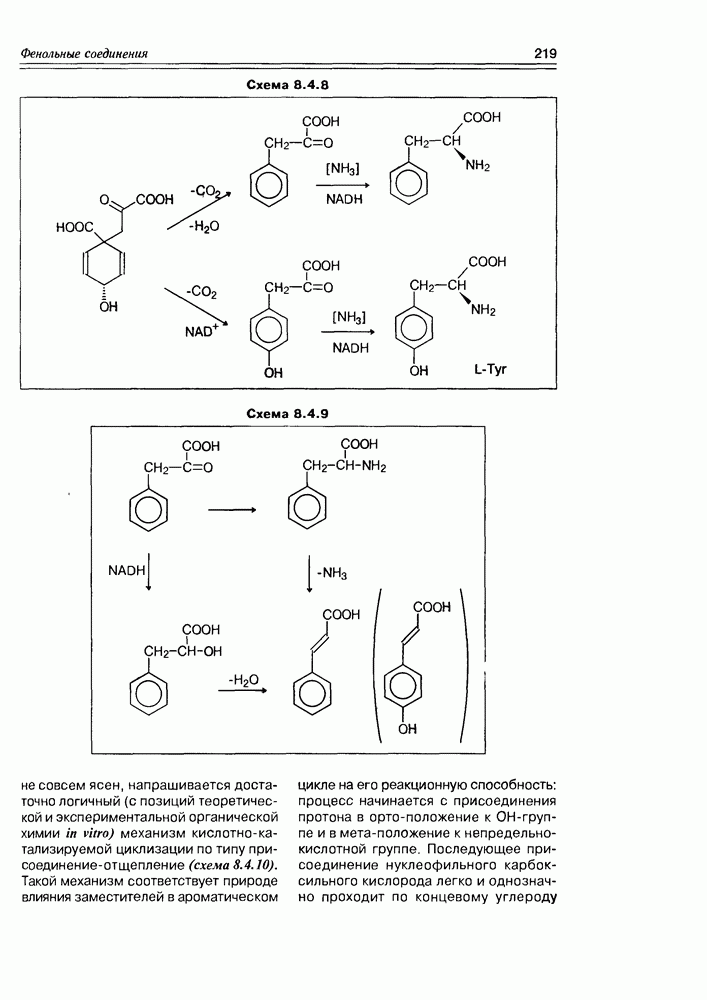
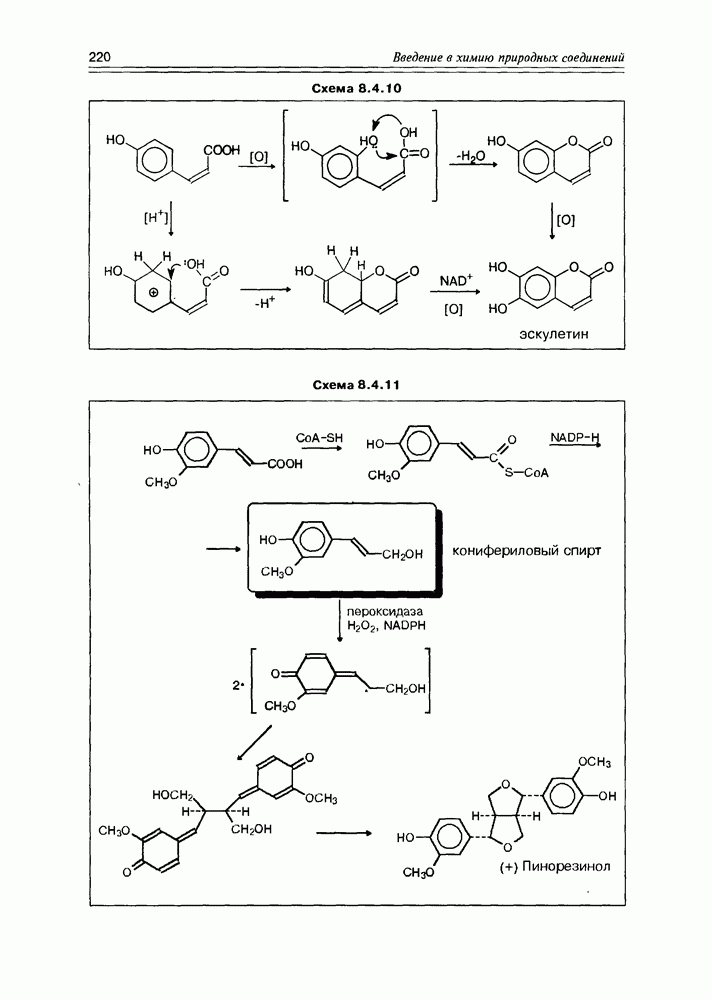
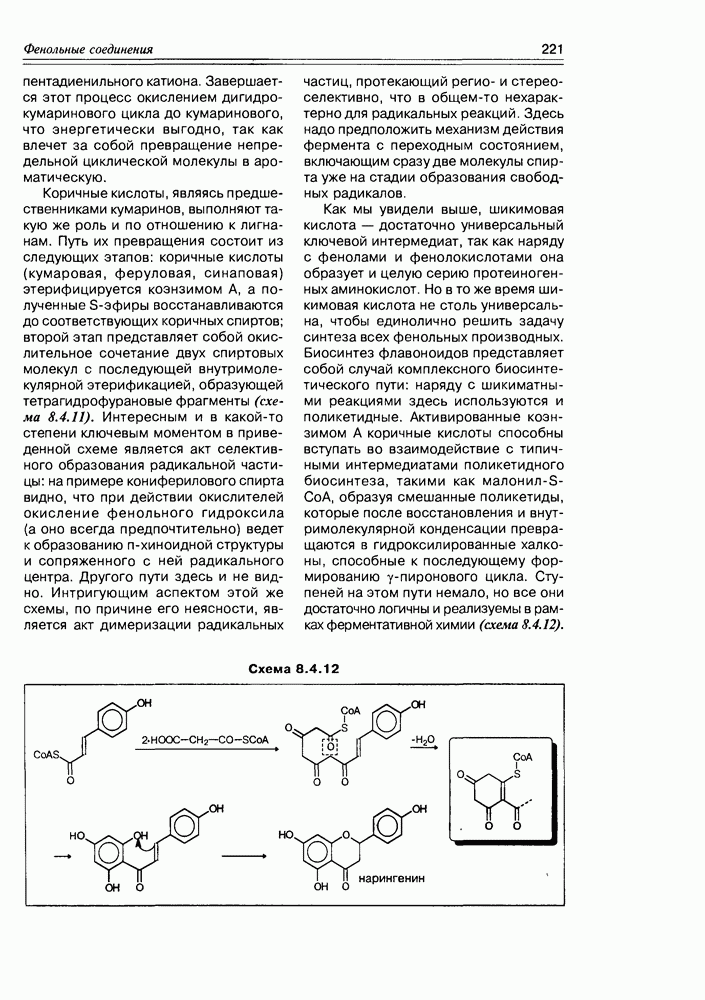
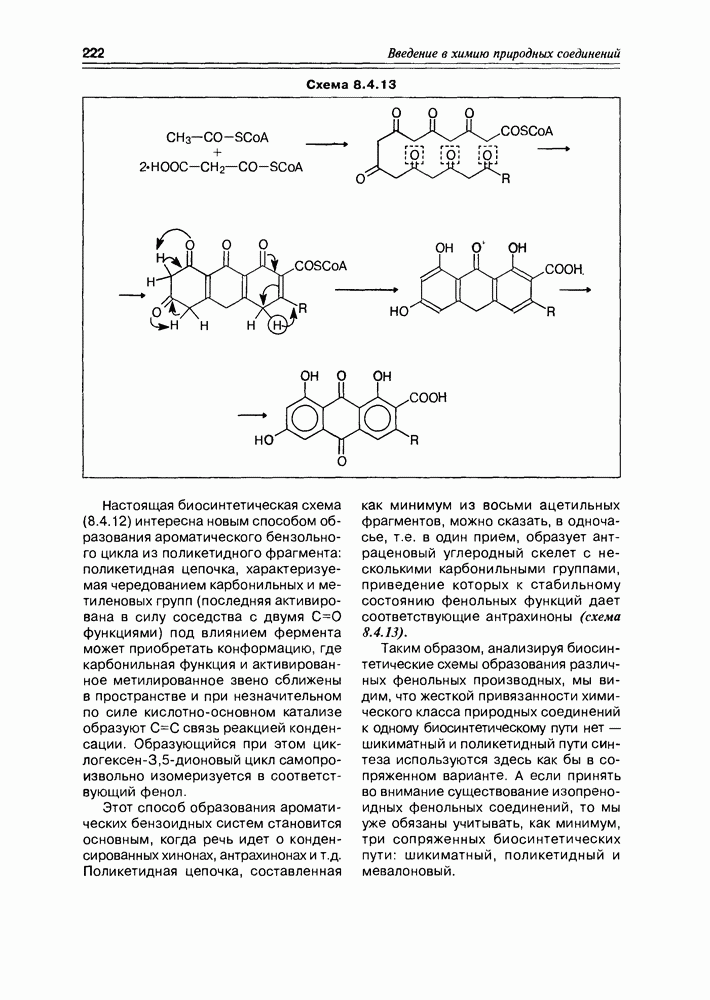
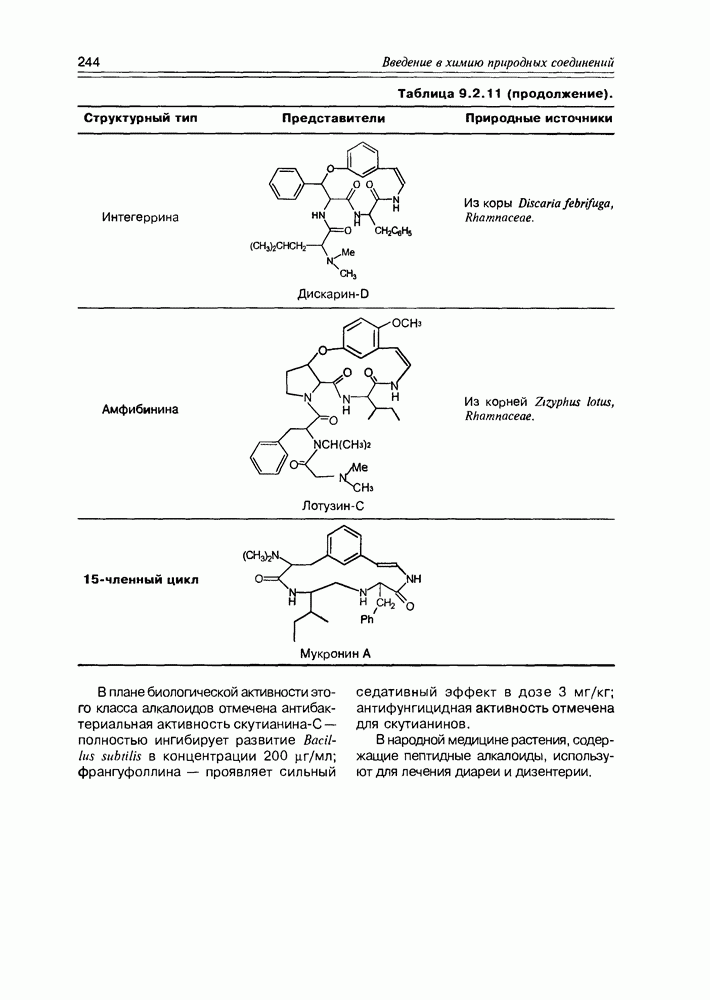
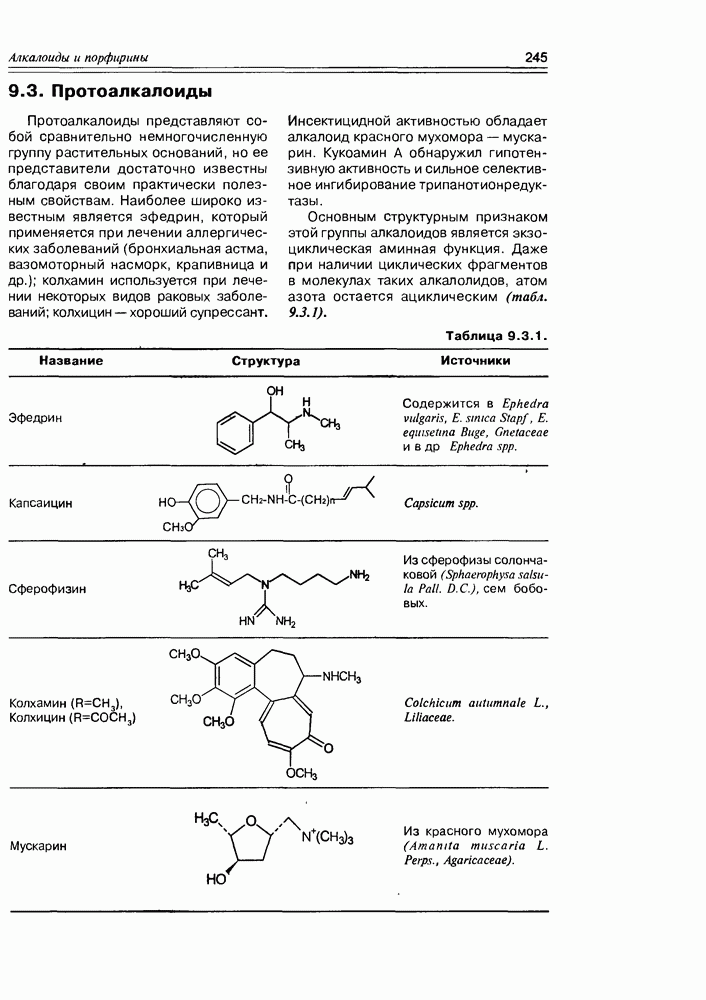
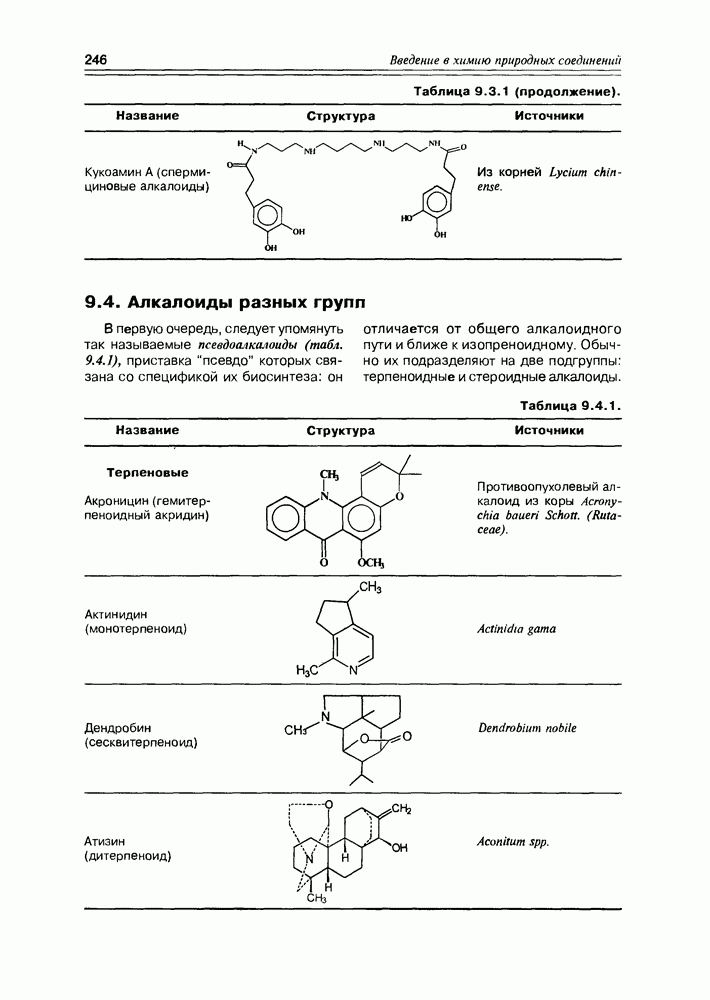
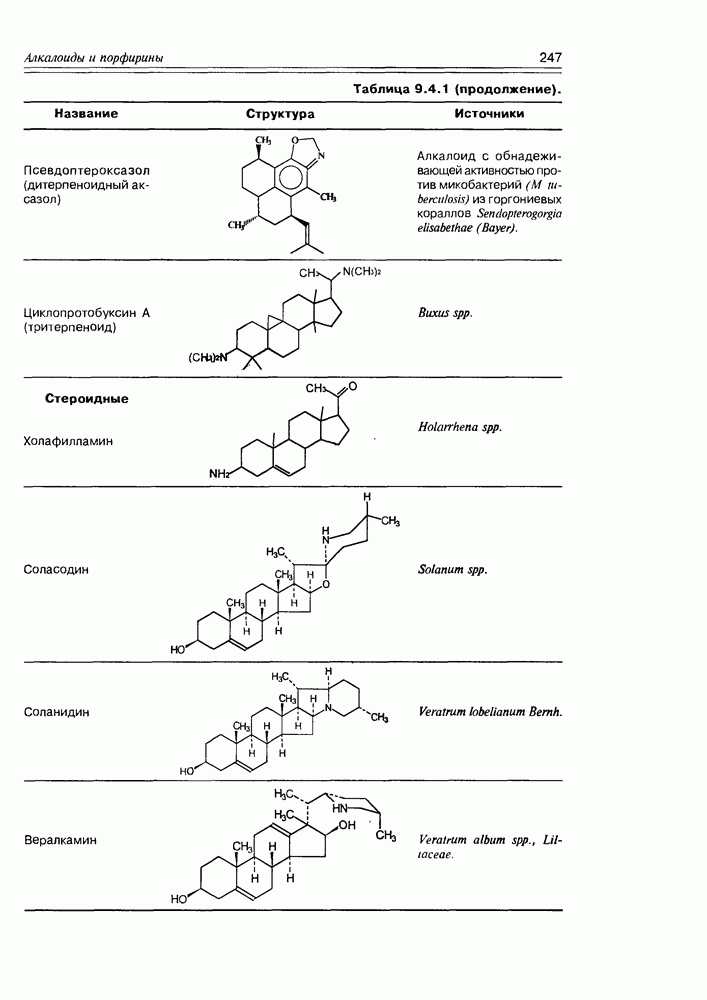
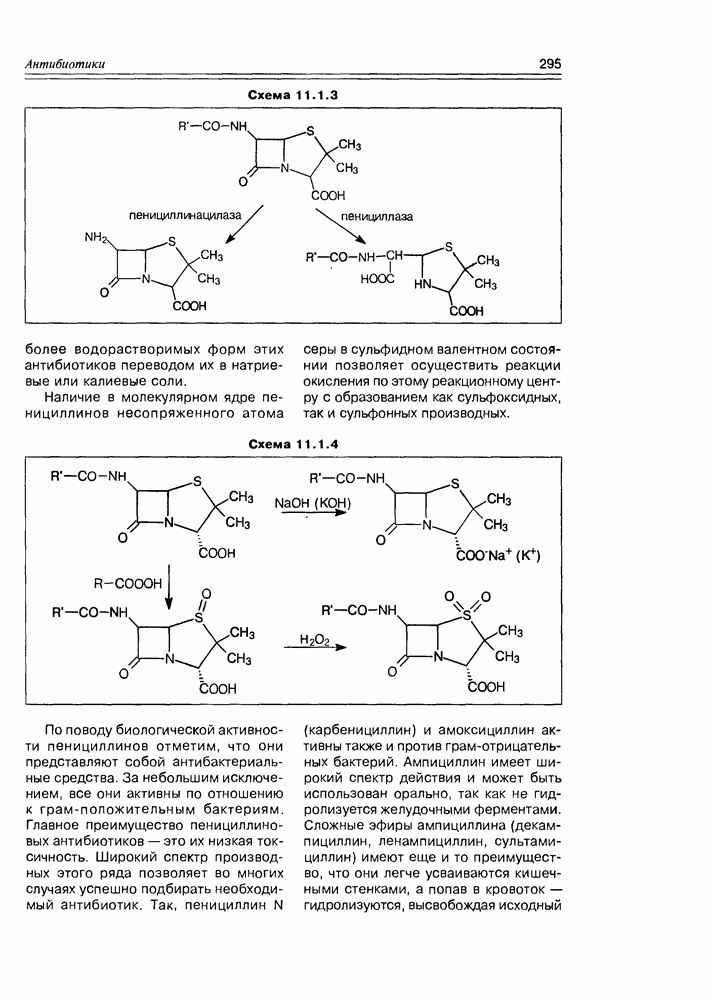
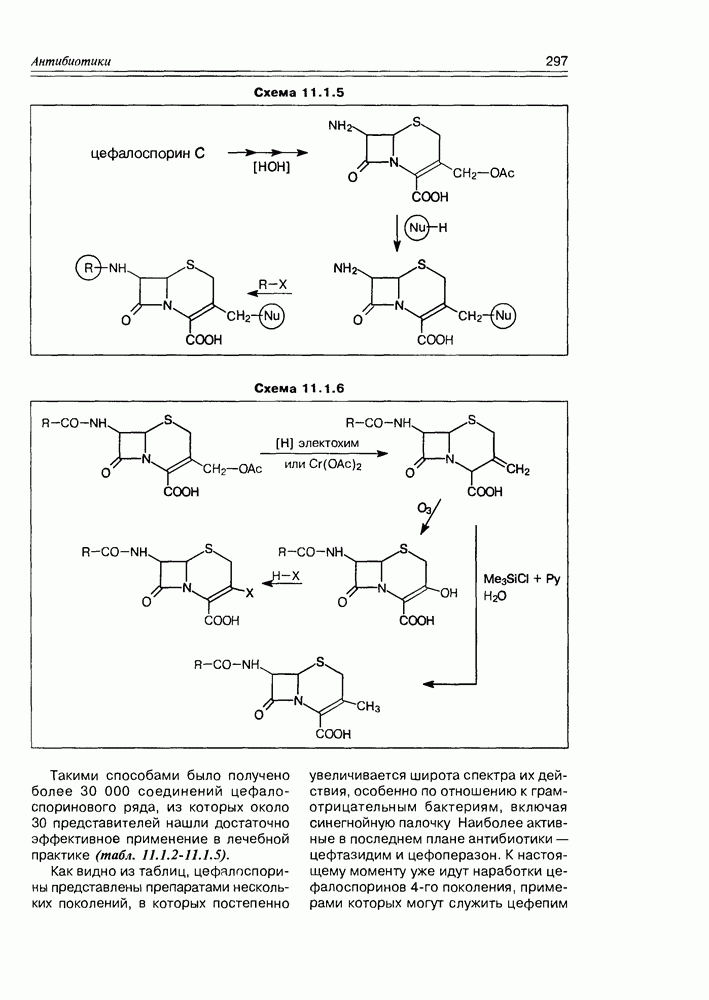
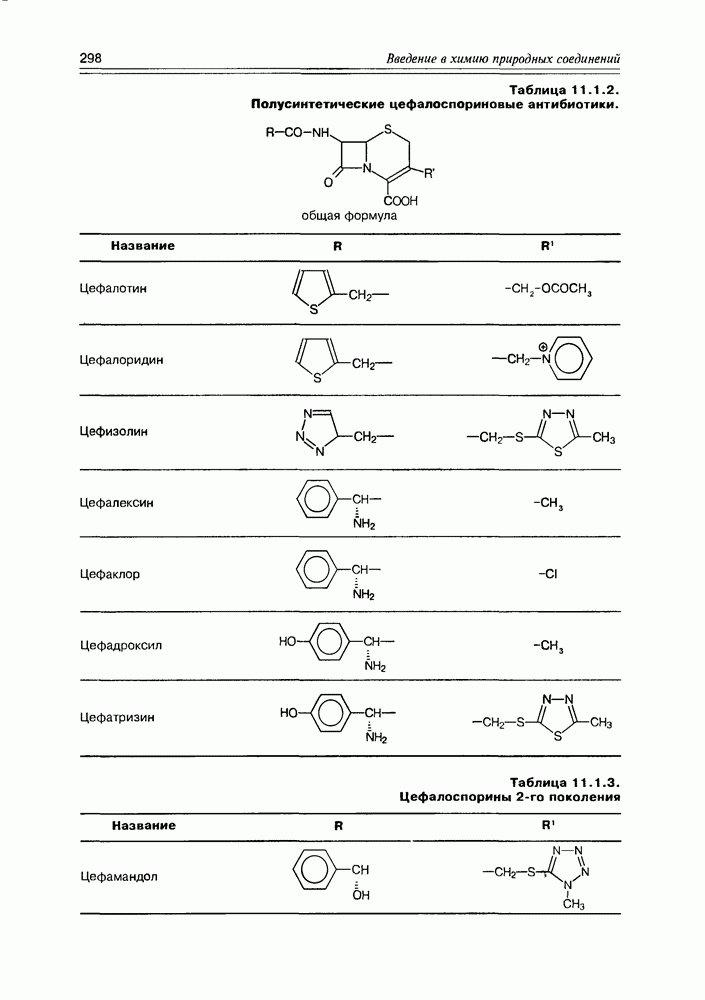
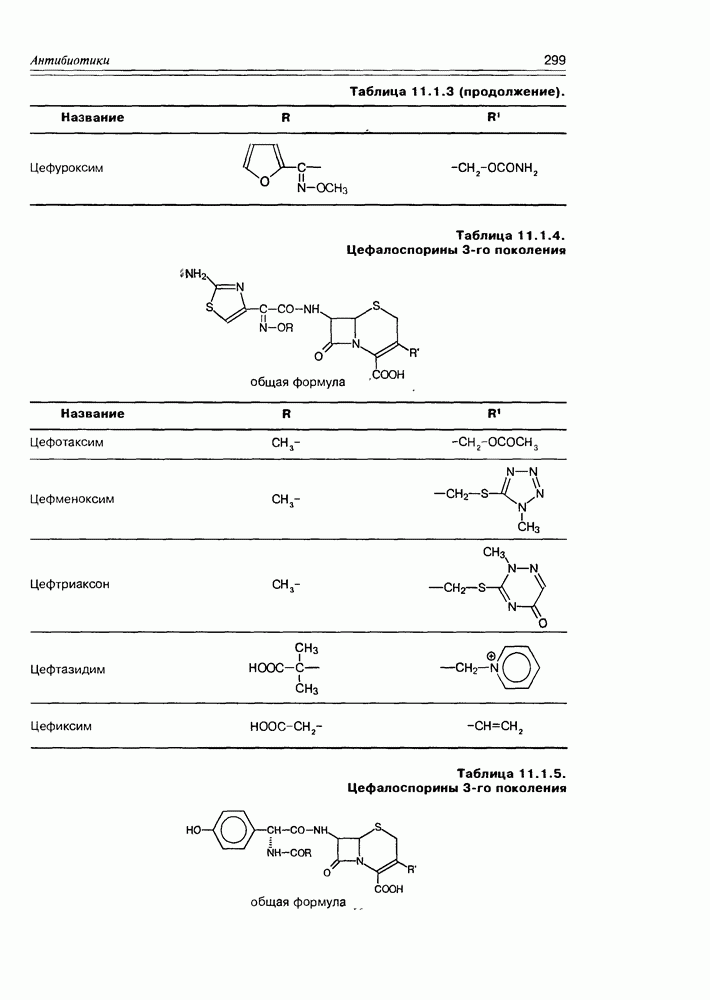
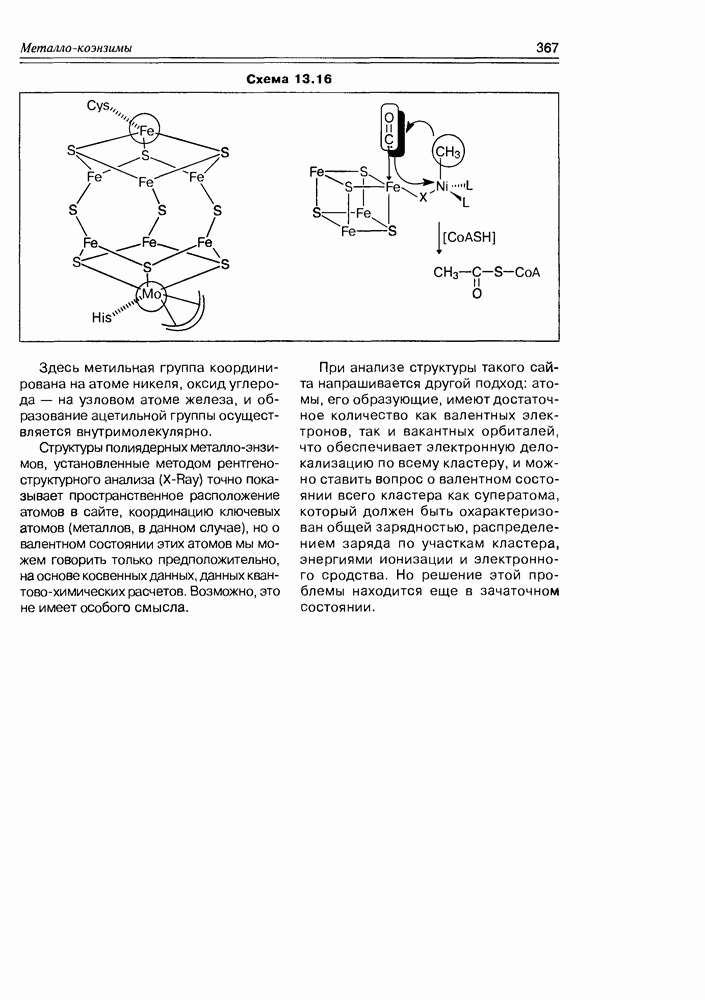
| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
Глава 3. УГЛЕВОДЫ
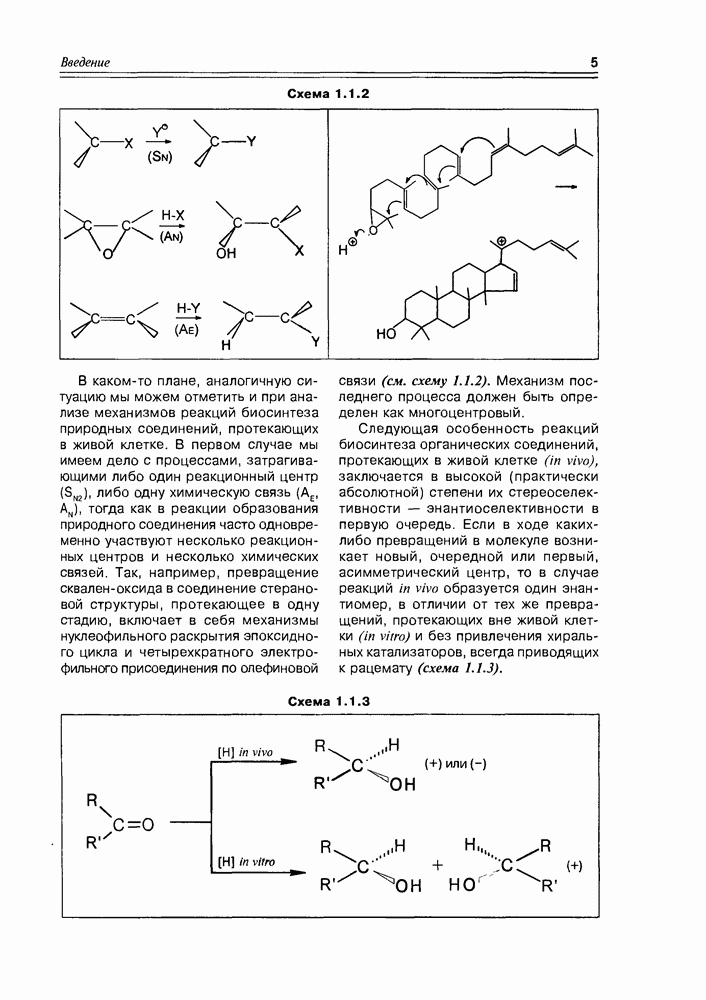
Нельзя сказать, что углеводы в меньшей степени распространены в природе, чем аминокислоты и белки, и что они играют меньшую роль в процессах жизнедеятельности самых различных организмов.
А если учесть, что глюкоза и подобные ей соединения образуются почти что из ничего, т.е. являются фактически первыми веществами живой клетки по биосинтетическому пути, то можно отдать им предпочтение в очередности написания. Если аминокислоты, и особенно их полимерные производные, полипептиды и белки, в большей степени сосредоточены в животных организмах, то углеводы и их производные — это прерогатива царства растений.
По химической классификации, все углеводы являются полигидроксикарбонильными соединениями. Номенклатура их, как и в большинстве случаев природной химии, носит тривиальный характер, систематический подход разработан и им удобно пользоваться при названии производных углеводов и обозначении характерных структурных элементов. Общее окончание для всех углеводов, исключая полимерные системы - оза.
Здесь следует отметить, что обычно углеводы подразделяют в первую очередь на моносахариды, олигосахариды и полисахариды. Но так как моносахара являются фундаментальными углеводными единицами, а олигосахара и полисахара — это не что иное, как их производные (гликозиды), то мы и будем придерживаться этой схемы: не выделять олигосахара в отдельный класс, рассматривая их как соответствующие производные моносахаров, а полисахара вынесем в отдельную главу "биополимеры". Таким образом, рассматривая химию углеводов, мы отождествляем их с моносахарами.
3.1. Классификация
Классификация углеводов ступенчатая. В первую очередь, отмечается количество атомов углерода углеводородной части молекулы — тетрозы, пентозы, гексозы, гептозы и т.д. Наиболее распространенными являются пентозы и гексозы. В зависимости от числа атомов углерода в моносахаридной цепочке, их подразделяют на низшие  триозы и тетрозы), обычные
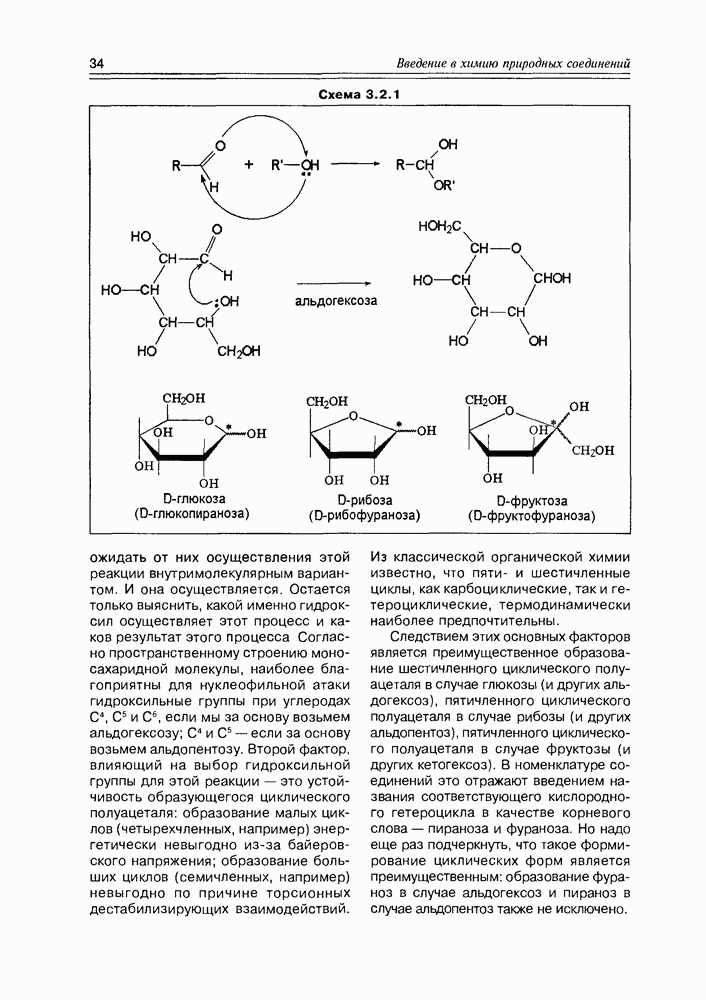
триозы и тетрозы), обычные  пентозы и гексозы) и высшие моносахара с количеством углеродных атомов от 7 до 10. Нормальные углеводы структурно расходуют один углеродный атом на карбонильную группу, при всех остальных углеродных атомах находится по одной гидроксильной группе. Вторая ступень классификации связана с расположением карбонильной группы в углеводородной цепи — либо это альдегидная группа, либо кетонная - и в соответствии с этим, мы имеем либо альдозы, либо кетозы. С учетом первой ступени классификации, мы можем теперь различать альдопентозы, альдокетозы, альдогексозы, кетогексозы и т.д.
пентозы и гексозы) и высшие моносахара с количеством углеродных атомов от 7 до 10. Нормальные углеводы структурно расходуют один углеродный атом на карбонильную группу, при всех остальных углеродных атомах находится по одной гидроксильной группе. Вторая ступень классификации связана с расположением карбонильной группы в углеводородной цепи — либо это альдегидная группа, либо кетонная - и в соответствии с этим, мы имеем либо альдозы, либо кетозы. С учетом первой ступени классификации, мы можем теперь различать альдопентозы, альдокетозы, альдогексозы, кетогексозы и т.д.
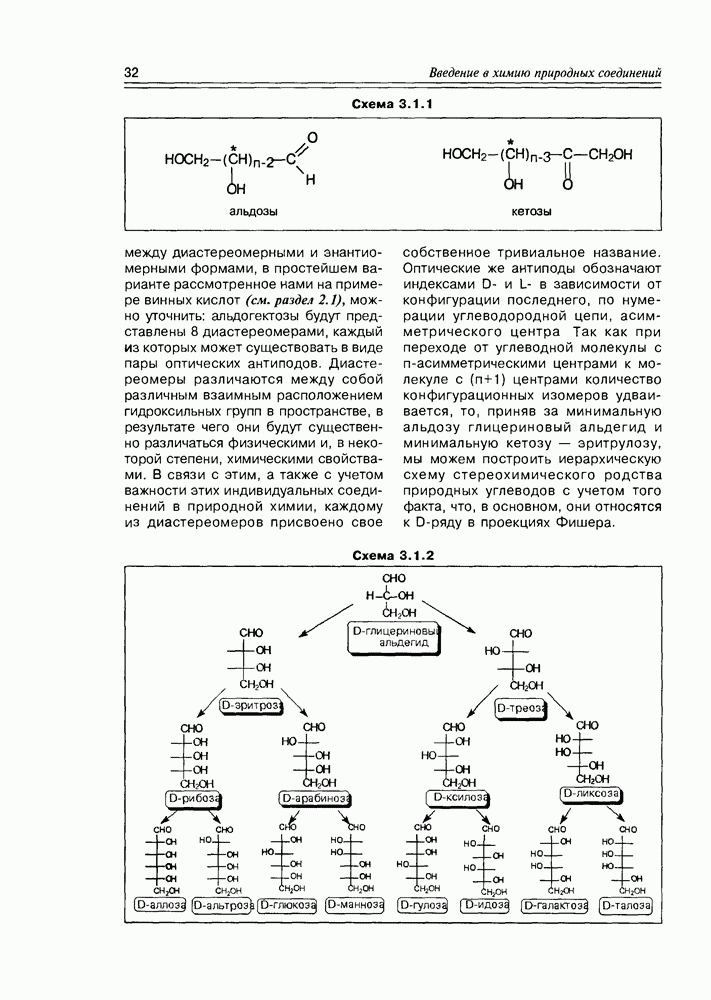
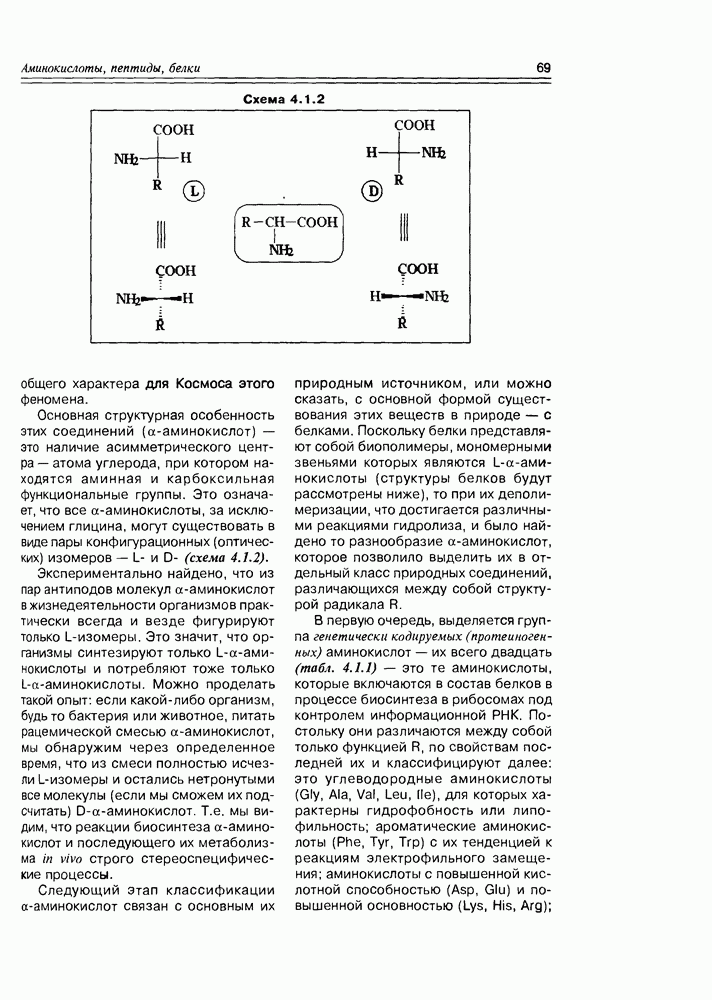
Следующий этап подразделения углеводов определяется пространственным структурным фактором, а именно, наличием асимметрических центров. Как видно на схеме 3.1.1, молекула альдозы содержит  асимметрических центра, молекула кетозы
асимметрических центра, молекула кетозы  таких центра: это значит, что альдогексозы могут существовать в виде 24 (16) конфигурационных изомеров, кетогексозы — в виде 23 (8) конфигурационных изомеров. Учитывая структурное соотношение
таких центра: это значит, что альдогексозы могут существовать в виде 24 (16) конфигурационных изомеров, кетогексозы — в виде 23 (8) конфигурационных изомеров. Учитывая структурное соотношение
Схема 3.1.1

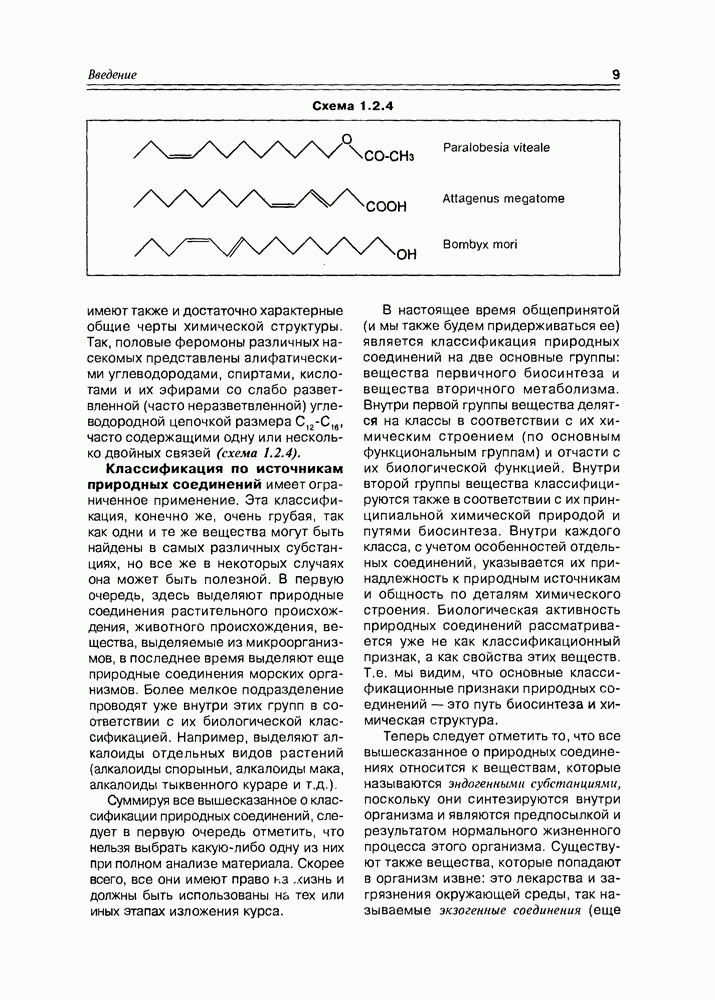
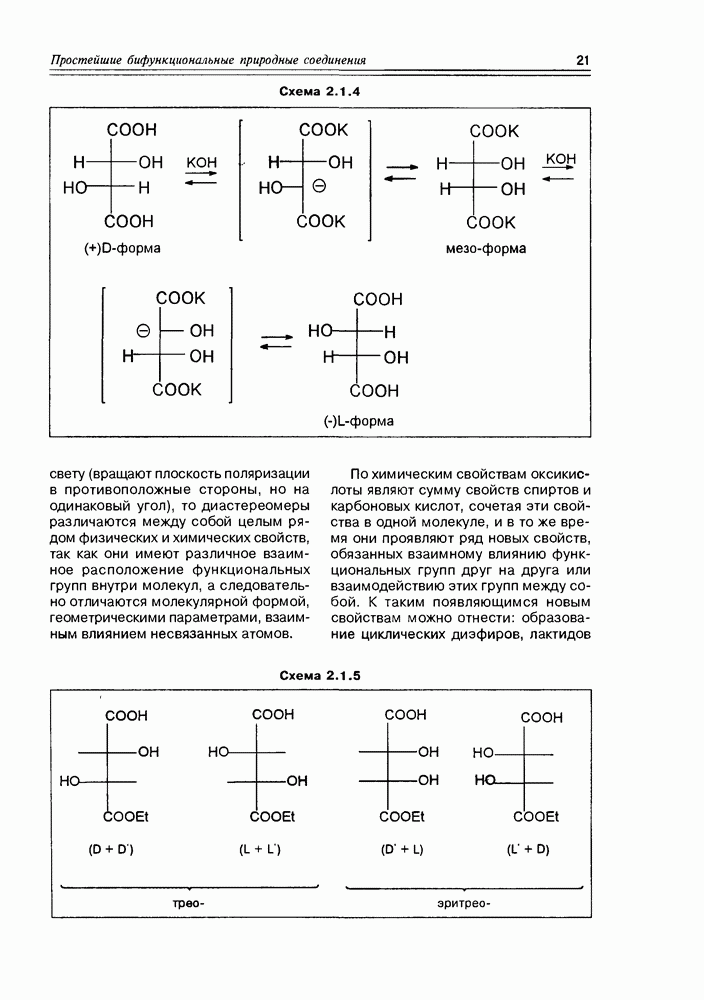
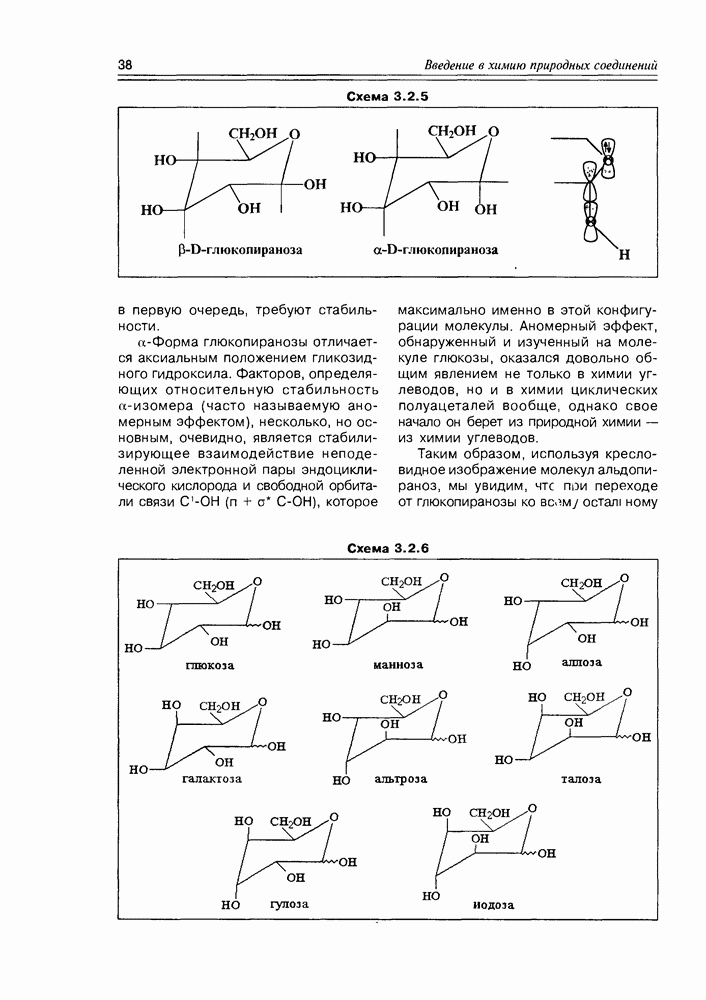
между диастереомерными и знантиомерными формами, в простейшем варианте рассмотренное нами на примере винных кислот (см. раздел 2.1), можно уточнить: альдогектозы будут представлены 8 диастереомерами, каждый из которых может существовать в виде пары оптических антиподов. Диастереомеры различаются между собой различным взаимным расположением гидроксильных групп в пространстве, в результате чего они будут существенно различаться физическими и, в некоторой степени, химическими свойствами. В связи с этим, а также с учетом важности этих индивидуальных соединений в природной химии, каждому из диастереомеров присвоено свое собственное тривиальное название. Оптические же антиподы обозначают индексами D- и L- в зависимости от конфигурации последнего, по нумерации углеводородной цепи, асимметрического центра Так как при переходе от углеводной молекулы с  -асимметрическими центрами к молекуле с
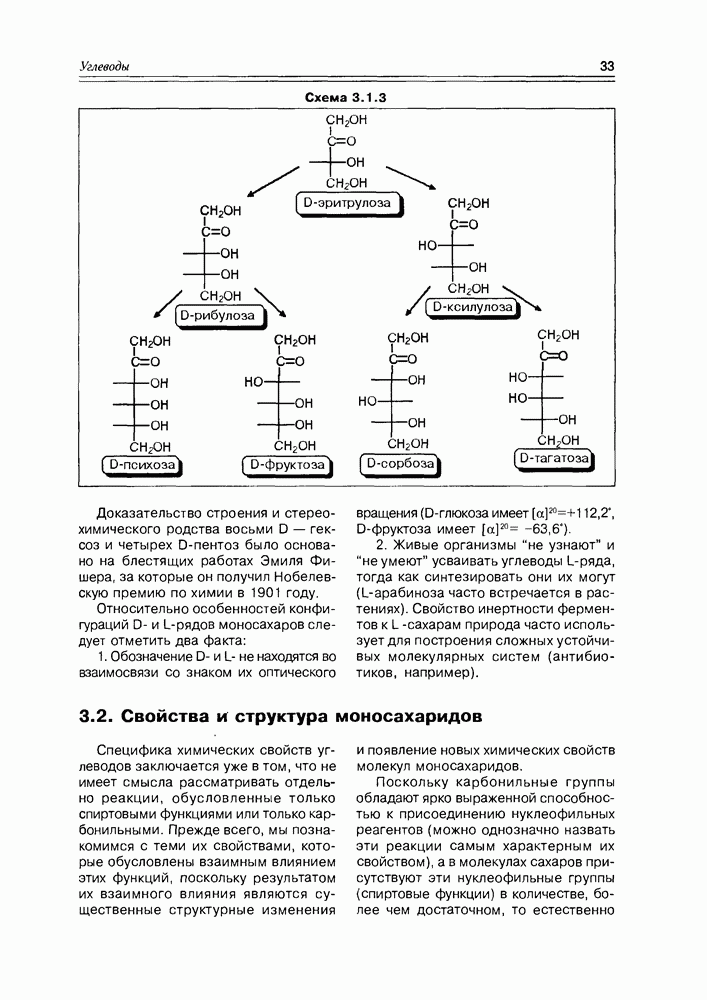
-асимметрическими центрами к молекуле с  центрами количество конфигурационных изомеров удваивается, то, приняв за минимальную альдозу глицериновый альдегид и минимальную кетозу — зритрулозу, мы можем построить иерархическую схему стереохимического родства природных углеводов с учетом того факта, что, в основном, они относятся к
центрами количество конфигурационных изомеров удваивается, то, приняв за минимальную альдозу глицериновый альдегид и минимальную кетозу — зритрулозу, мы можем построить иерархическую схему стереохимического родства природных углеводов с учетом того факта, что, в основном, они относятся к  -ряду в проекциях Фишера.
-ряду в проекциях Фишера.
Схема 3.1.2

Схема 3.1.3

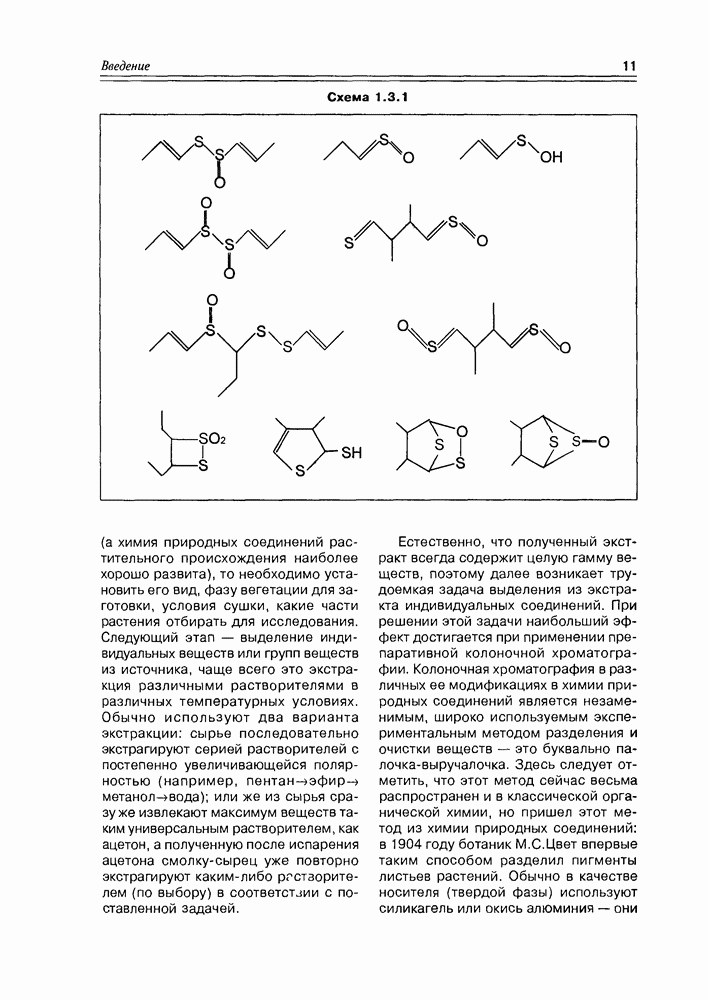
Доказательство строения и стерео-химического родства восьми D — гексоз и четырех  -пентоз было основано на блестящих работах Эмиля Фишера, за которые он получил Нобелевскую премию по химии в 1901 году.
-пентоз было основано на блестящих работах Эмиля Фишера, за которые он получил Нобелевскую премию по химии в 1901 году.
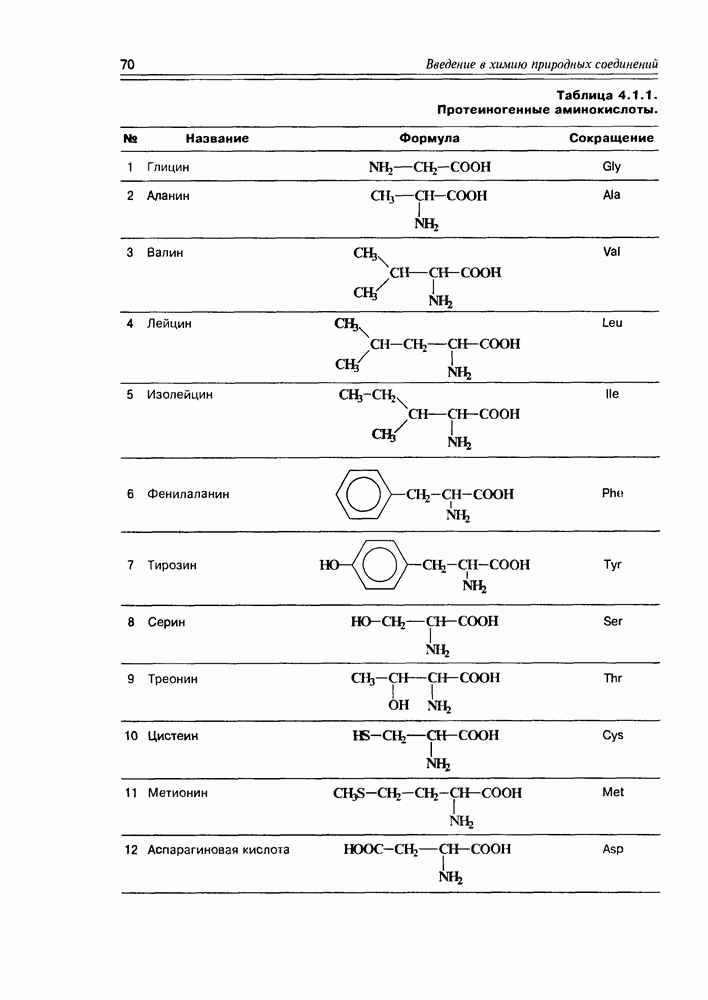
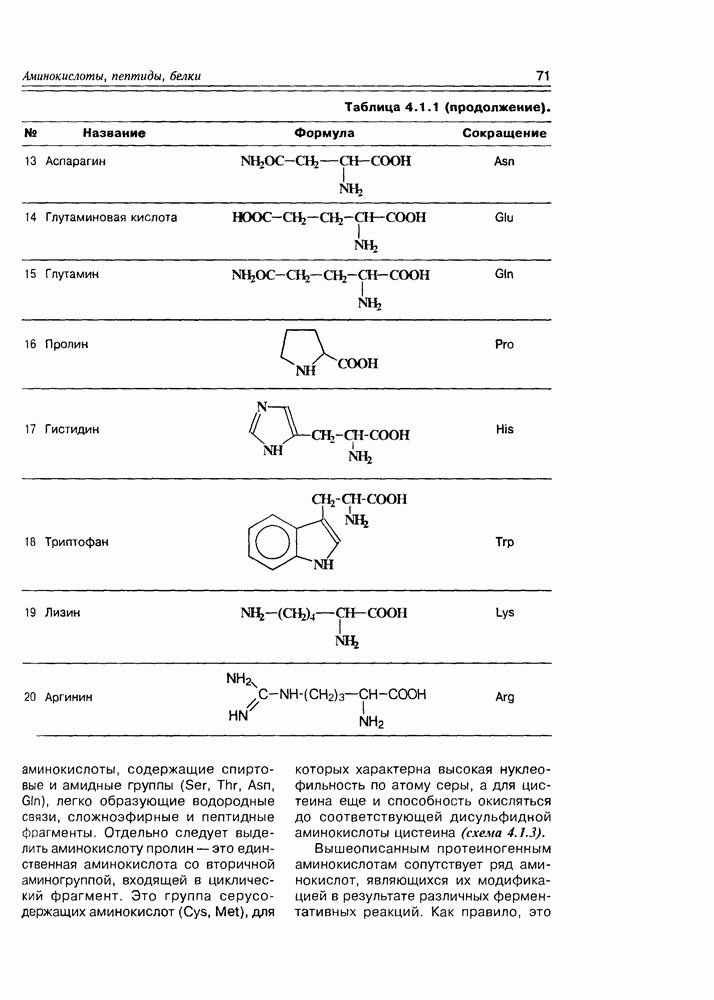
Относительно особенностей конфигураций D- и  -рядов моносахаров следует отметить два факта:
-рядов моносахаров следует отметить два факта:
1. Обозначение D- и L- не находятся во взаимосвязи со знаком их оптического вращения ( -глюкоза имеет
-глюкоза имеет  имеет
имеет  .
.
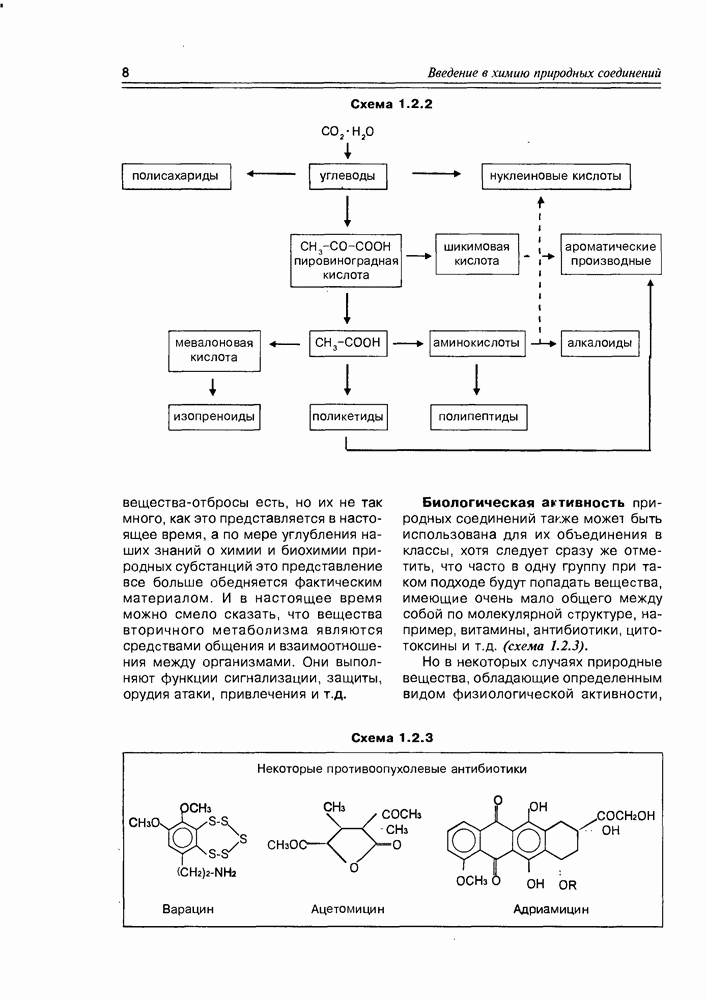
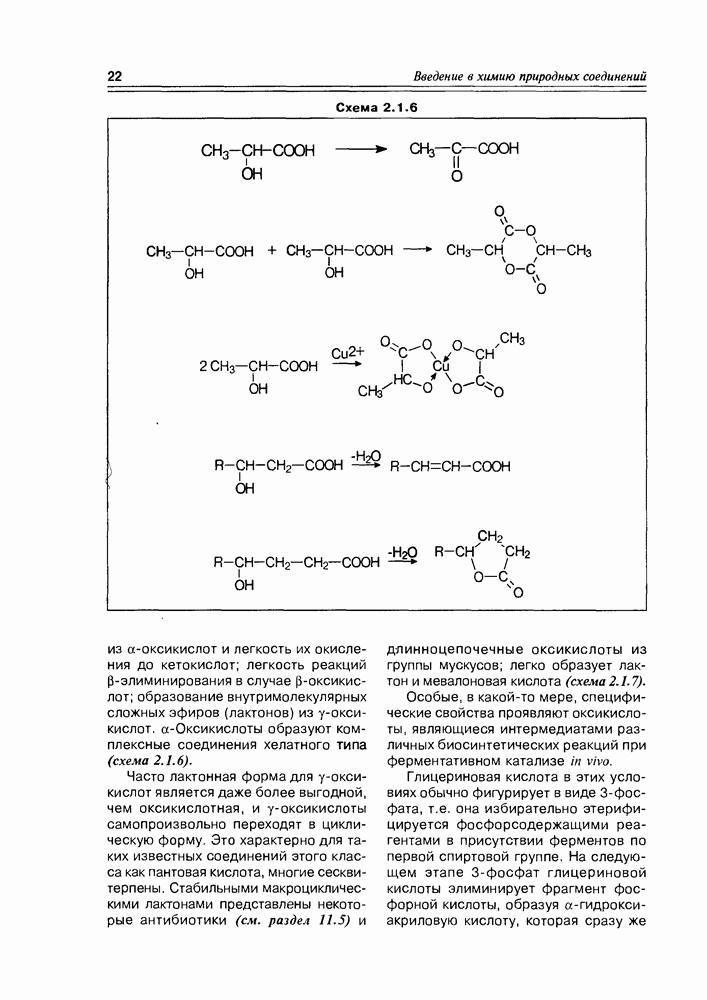
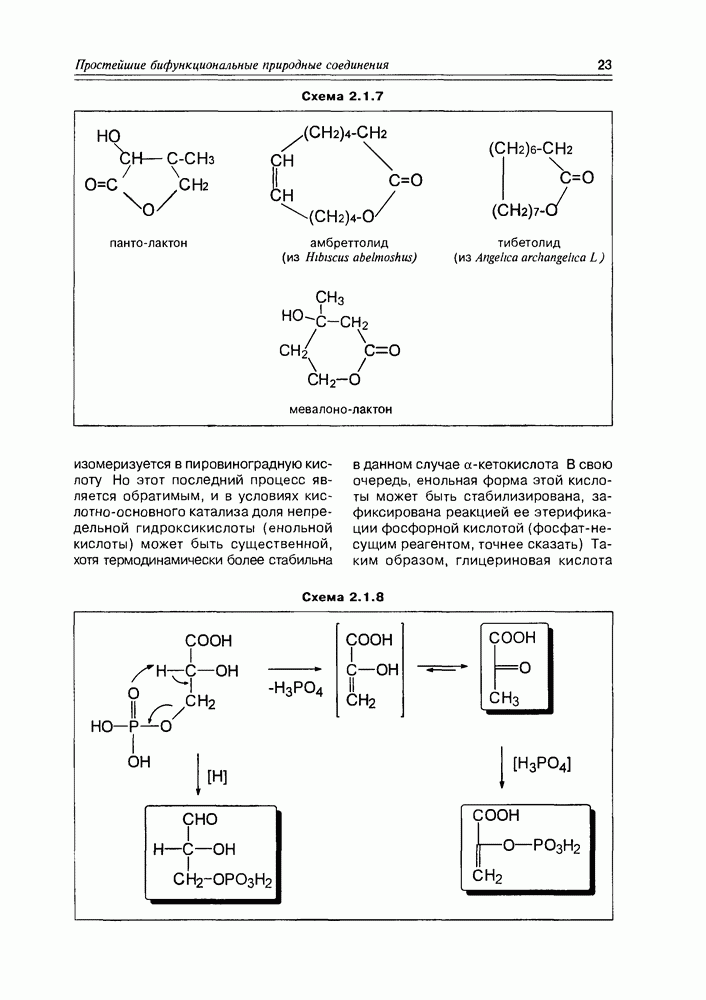
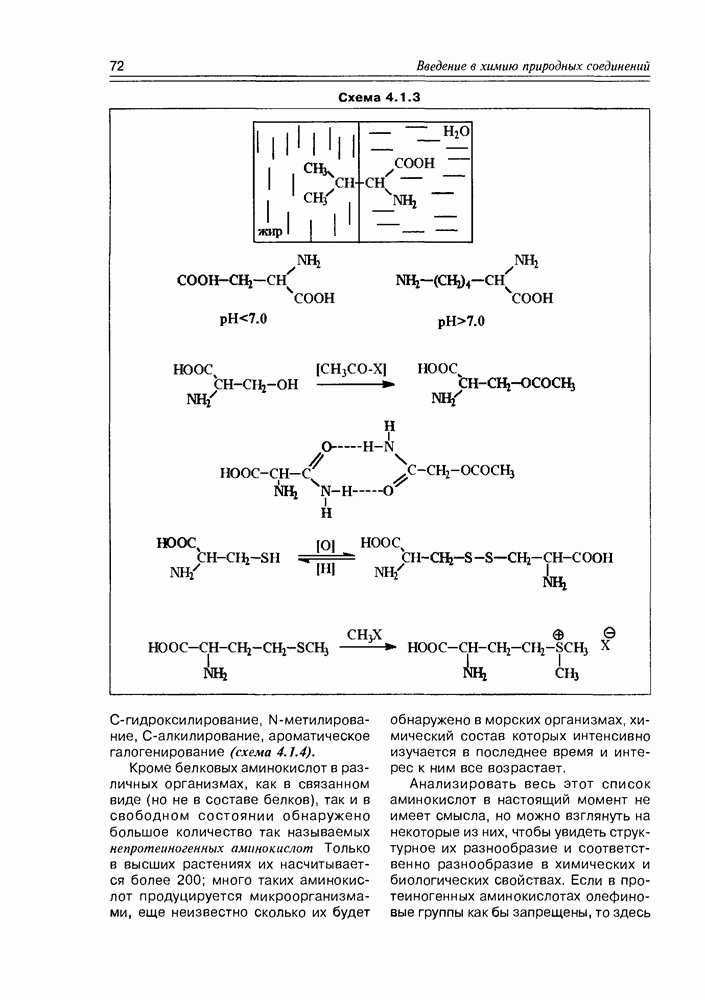
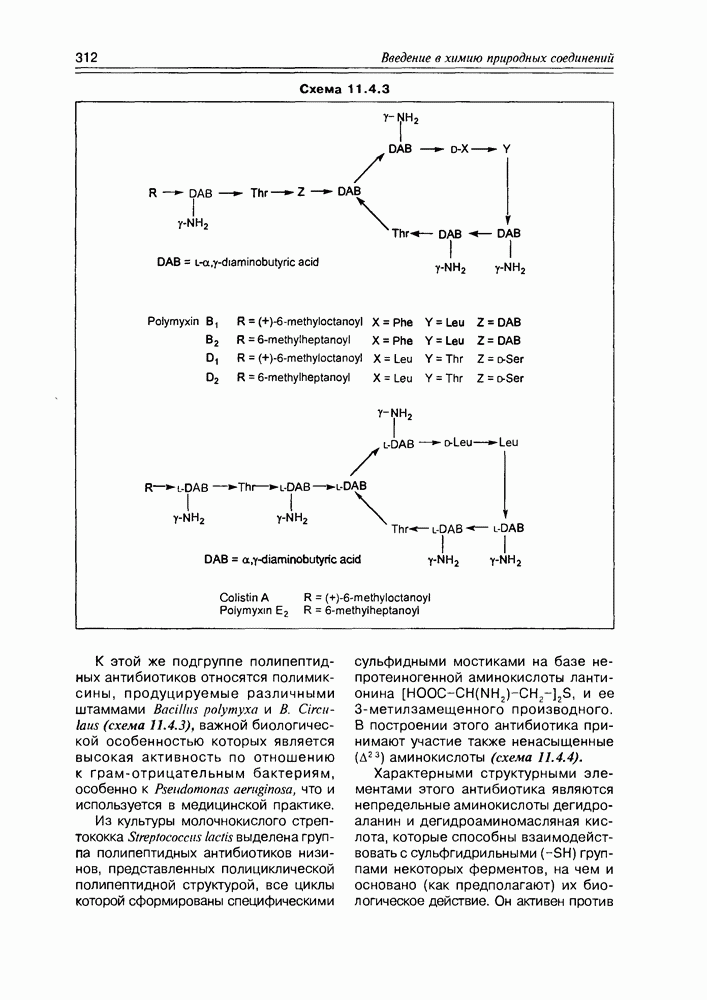
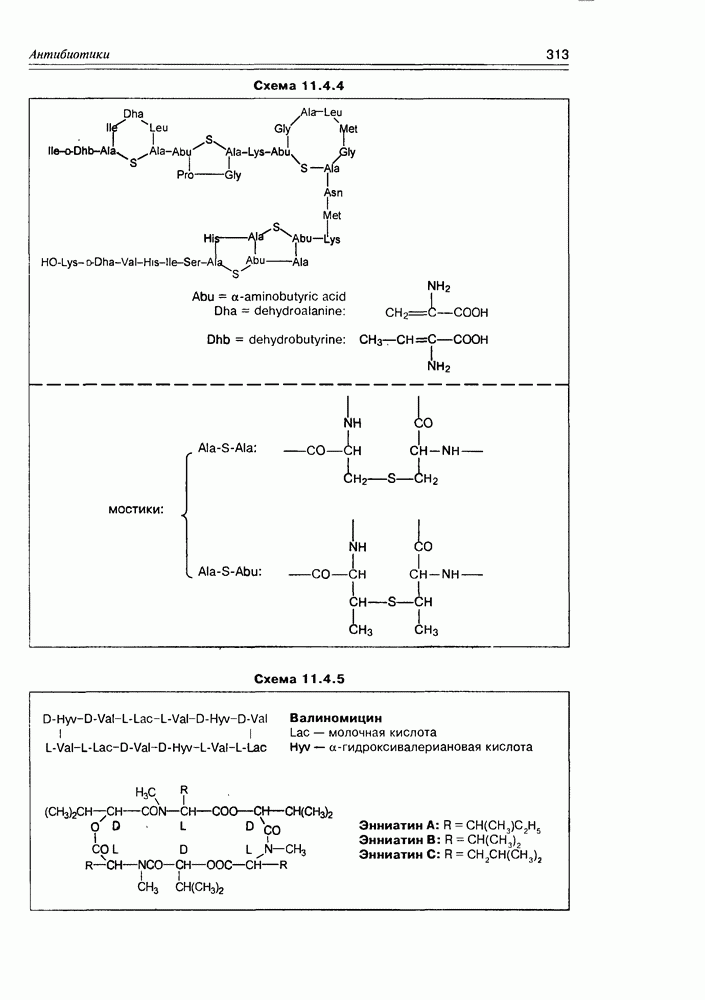
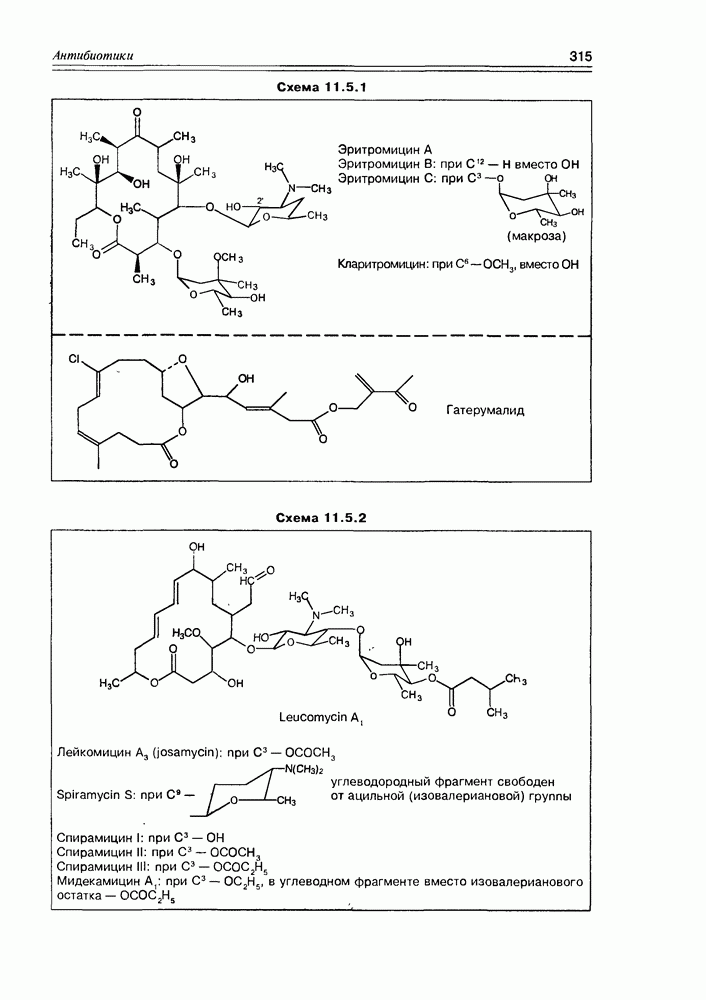
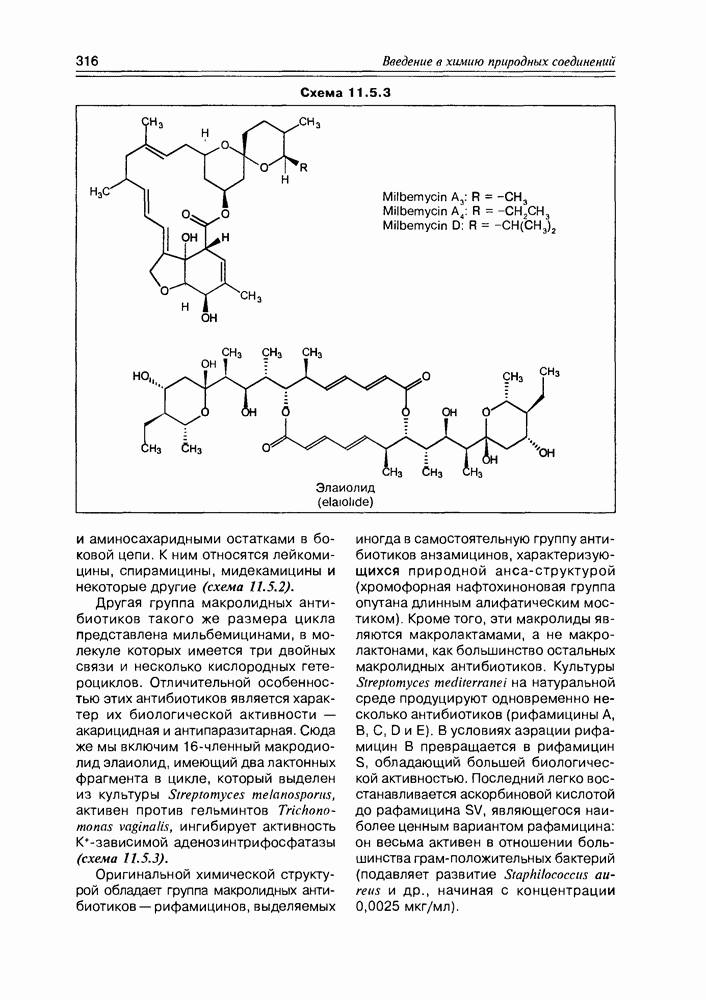
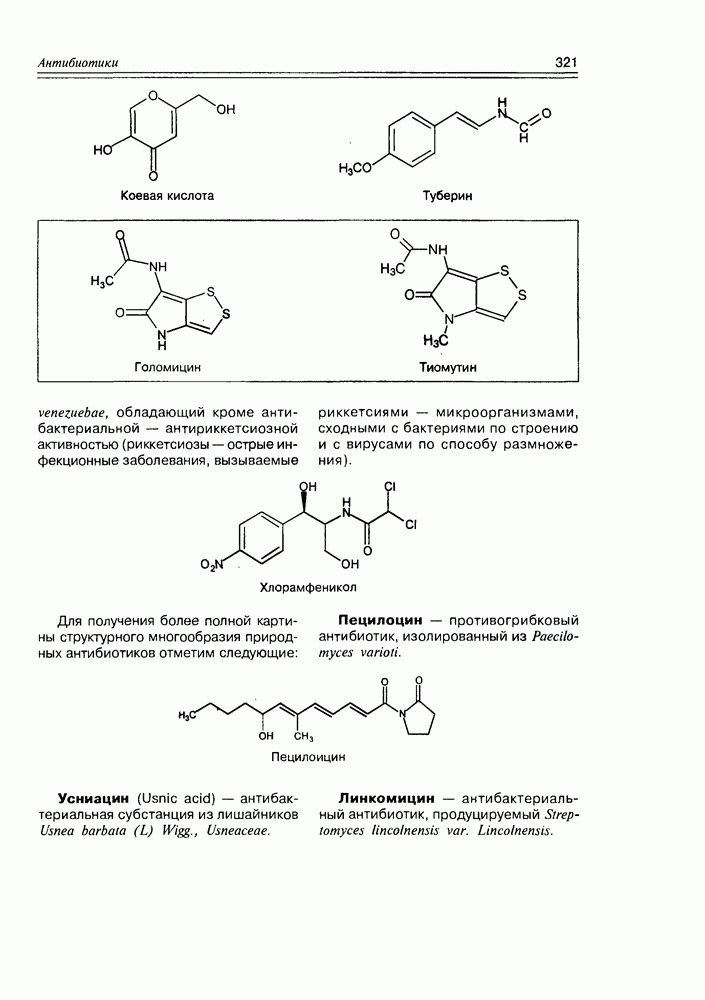
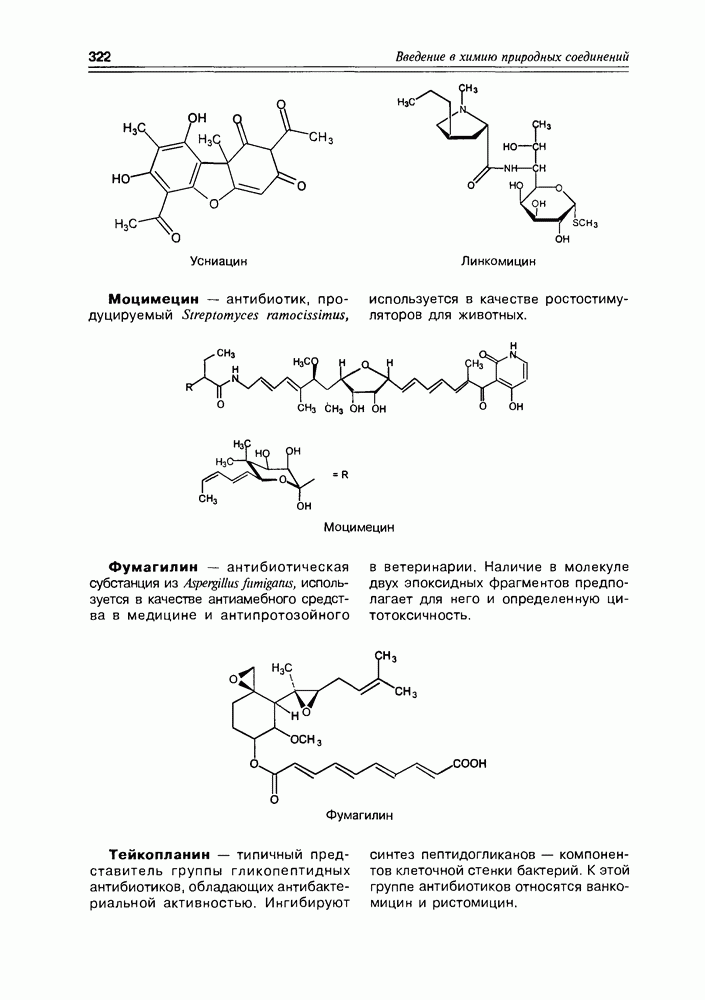
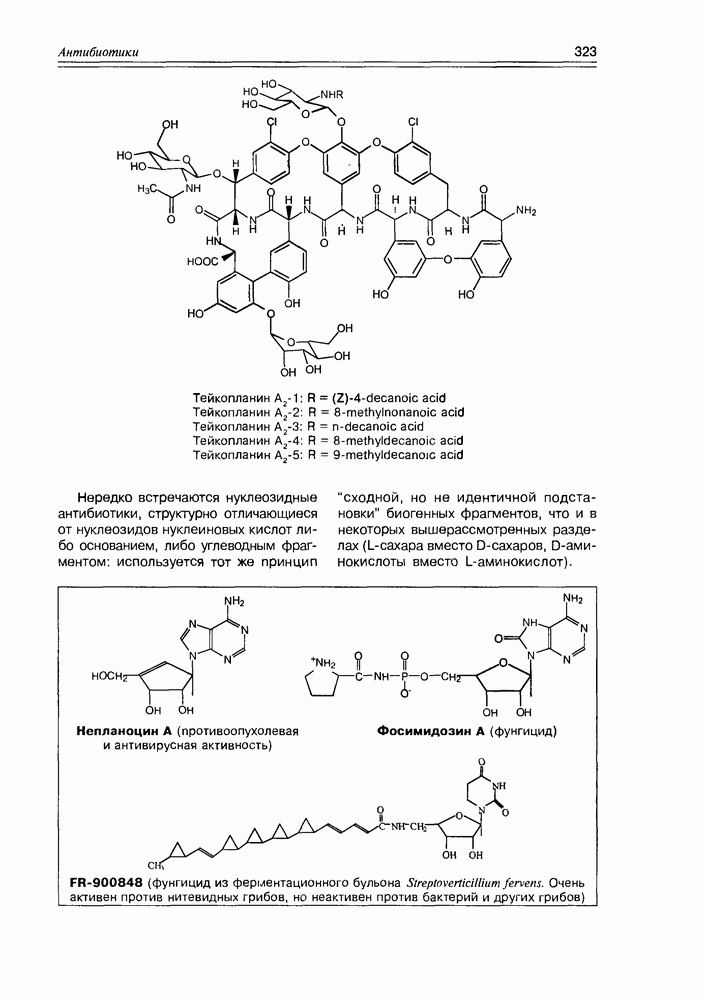
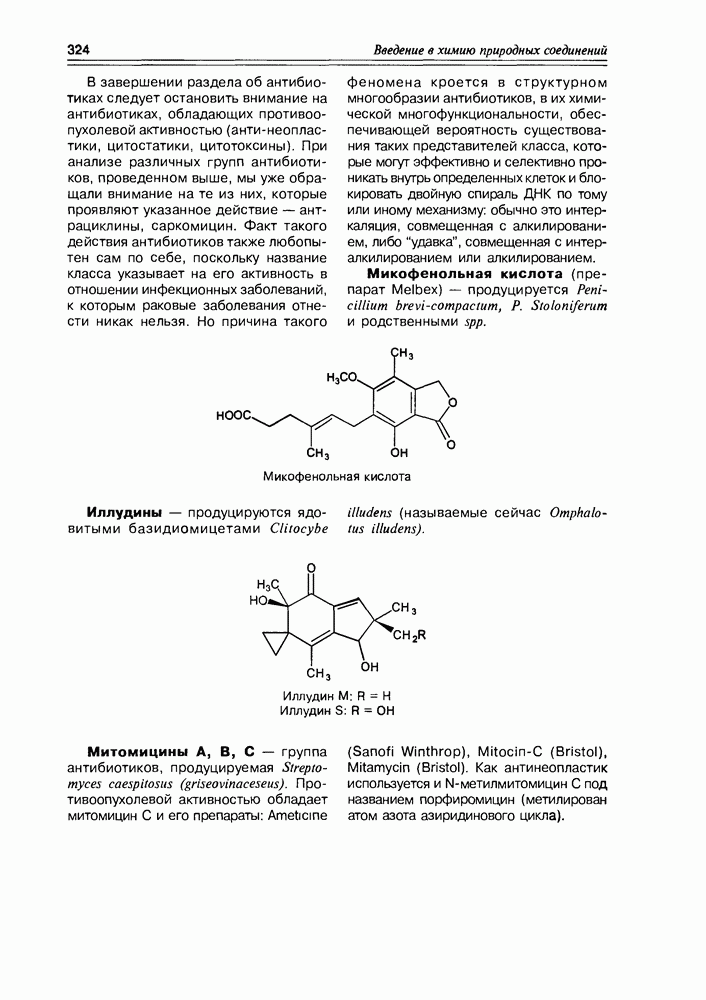
2. Живые организмы не узнают и “не умеют” усваивать углеводы L-ряда, тогда как синтезировать они их могут ( -арабиноза часто встречается в растениях). Свойство инертности ферментов к L-сахарам природа часто использует для построения сложных устойчивых молекулярных систем (антибиотиков, например).
-арабиноза часто встречается в растениях). Свойство инертности ферментов к L-сахарам природа часто использует для построения сложных устойчивых молекулярных систем (антибиотиков, например).
| << Предыдущий параграф | Следующий параграф >> |
- ПРЕДИСЛОВИЕ АВТОРА
- Глава 1. ВВЕДЕНИЕ
- 1.1. Предмет химии природных соединений
- 1.2. Классификация природных соединений
- 1.3. Методология химии природных соединений
- 1.4. Углерод и жизнь
- Глава 2. ПРОСТЕЙШИЕ БИФУНКЦИОНАЛЬНЫЕ ПРИРОДНЫЕ СОЕДИНЕНИЯ — МОСТИК К МАССИВУ ПРИРОДНЫХ СОЕДИНЕНИЙ
- 2.2. Оксокислоты
- 2.3. Аминоспирты
- Глава 3. УГЛЕВОДЫ
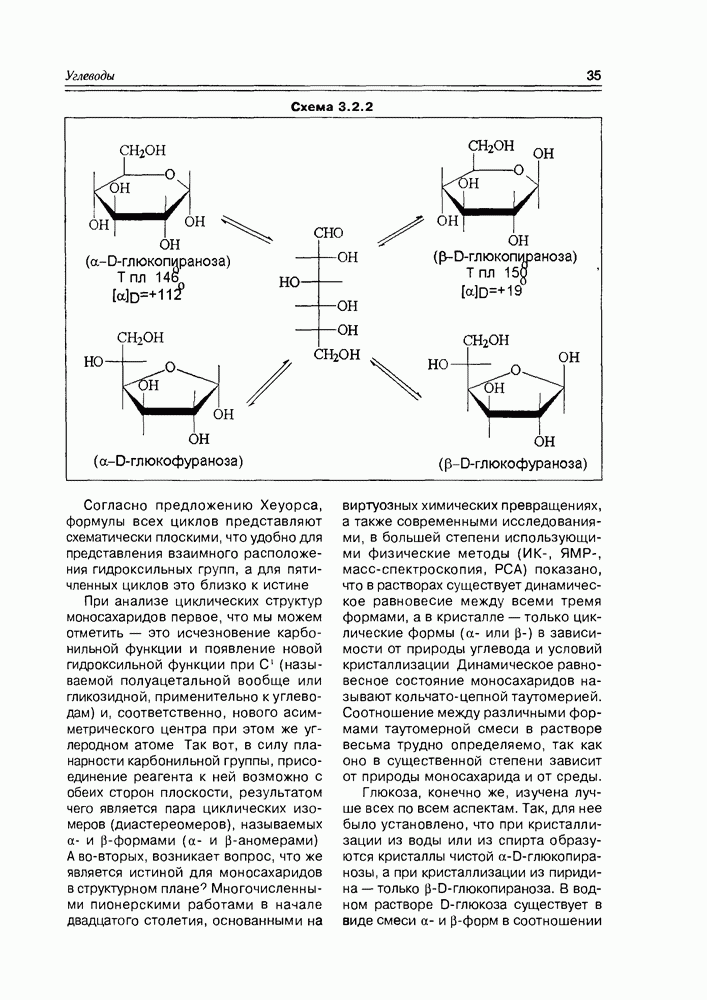
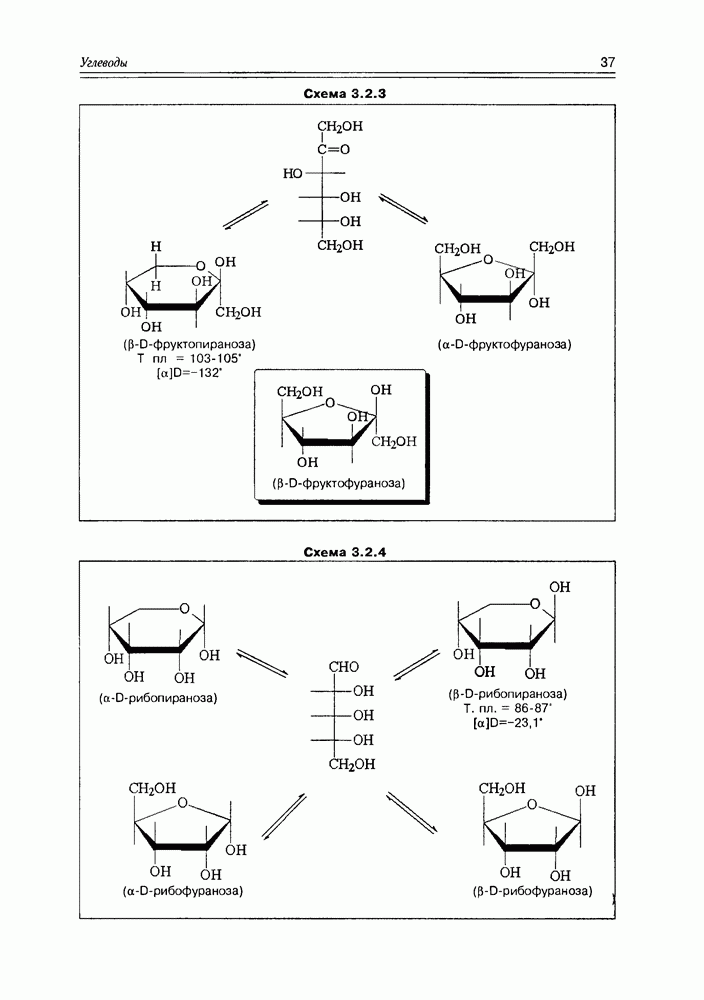
- 3.2. Свойства и структура моносахаридов
- 3.3. Химические свойства моносахаридов
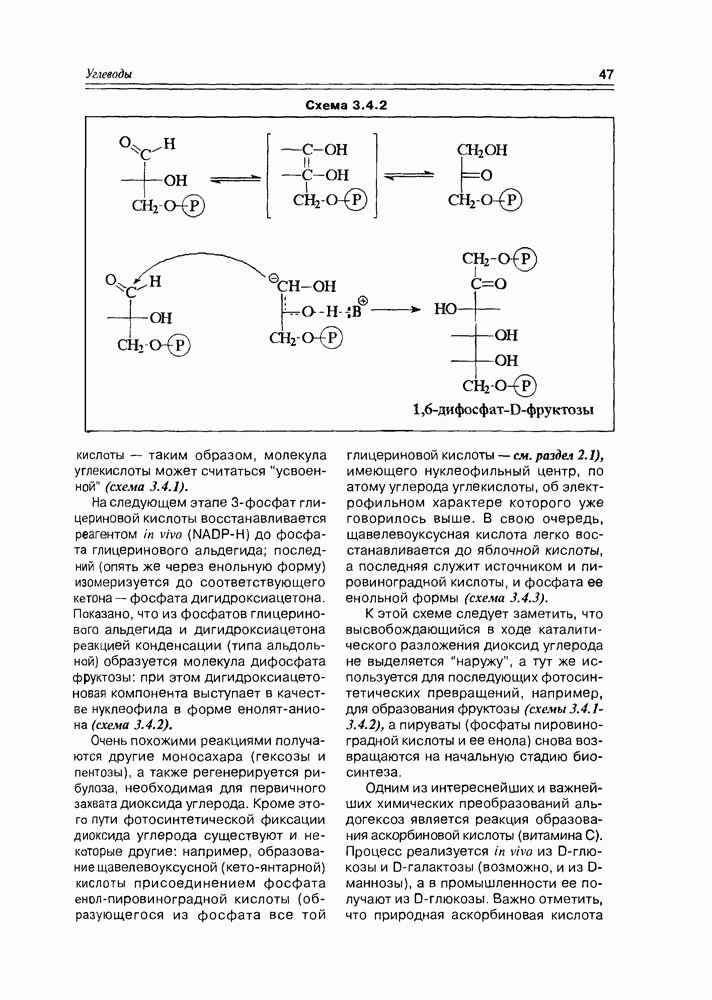
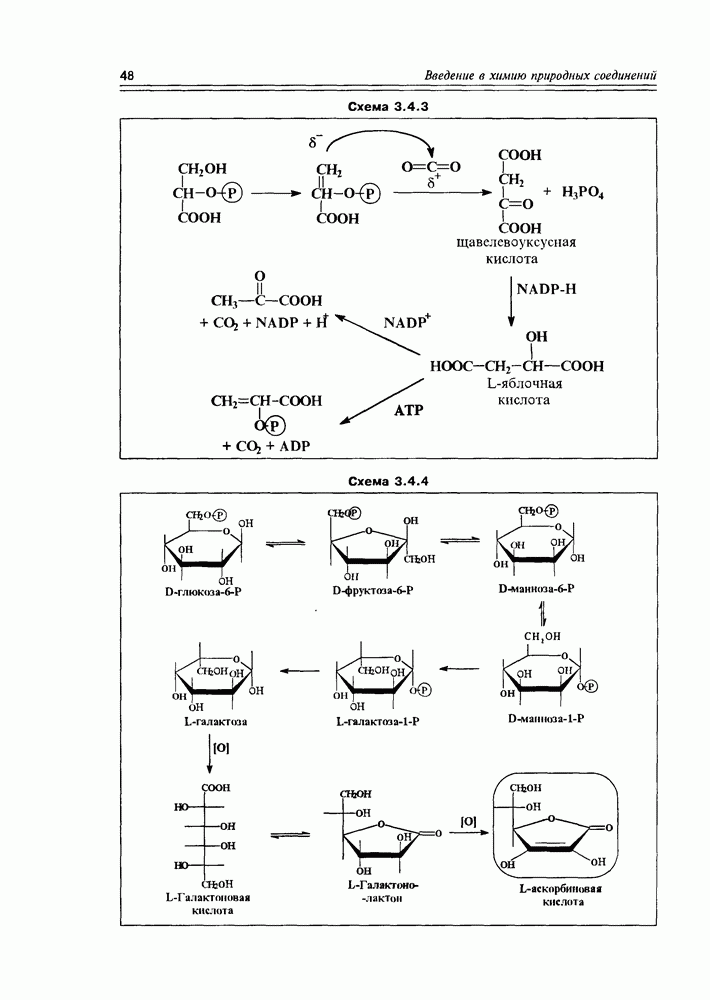
- 3.4. Биосинтетические реакции углеводов
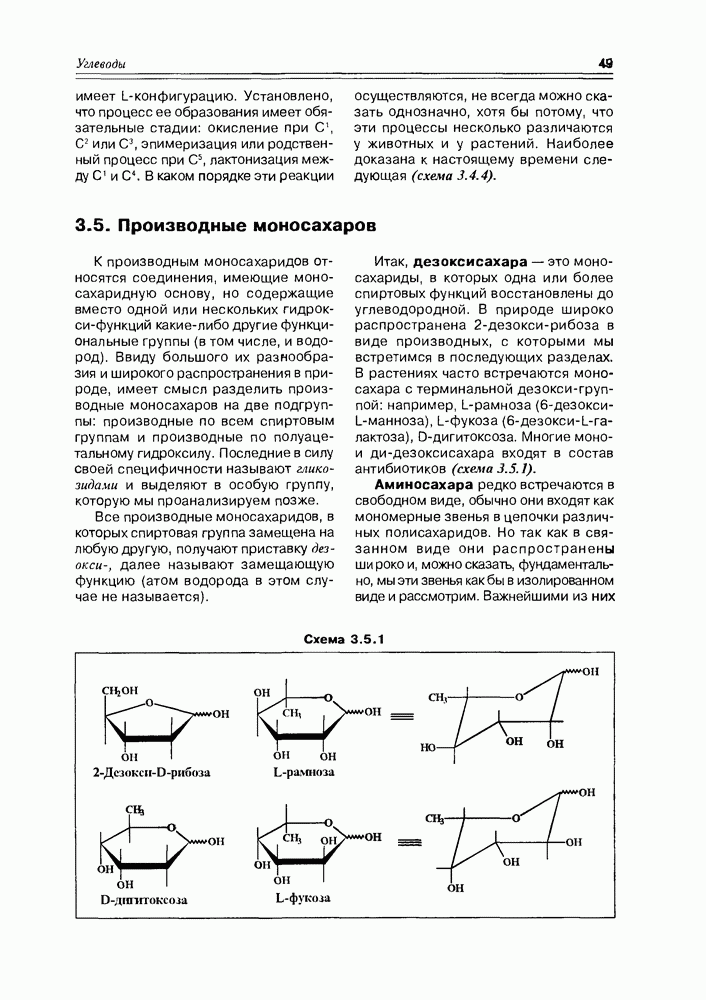
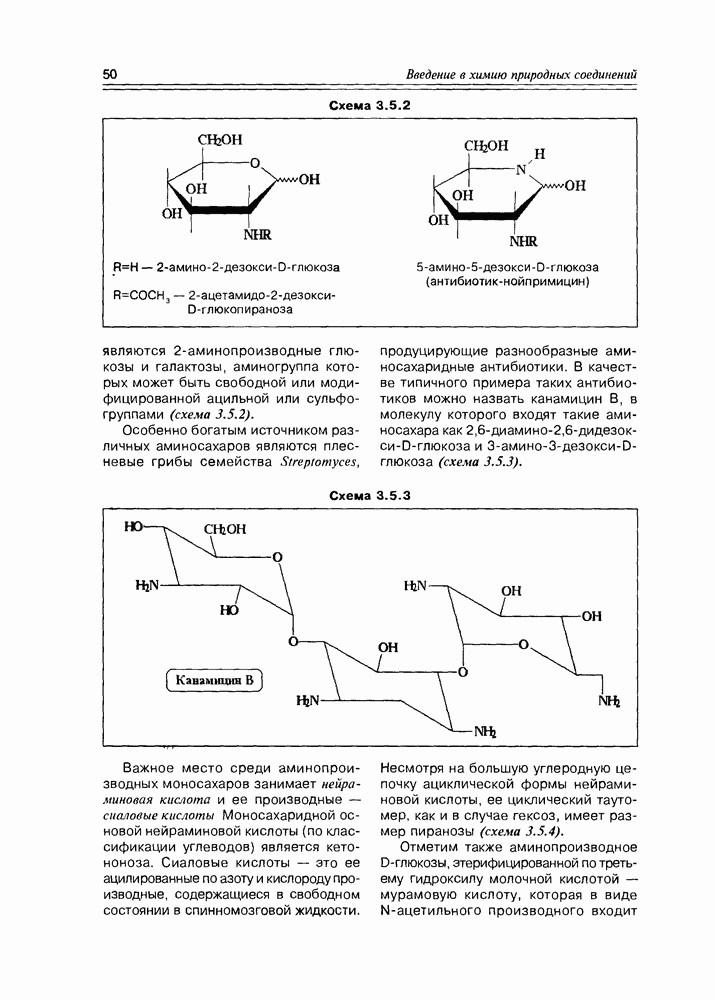
- 3.6. Гликозиды
- Глава 4. АМИНОКИСЛОТЫ, ПЕПТИДЫ, БЕЛКИ
- 4.2. Химические свойства а-аминокислот
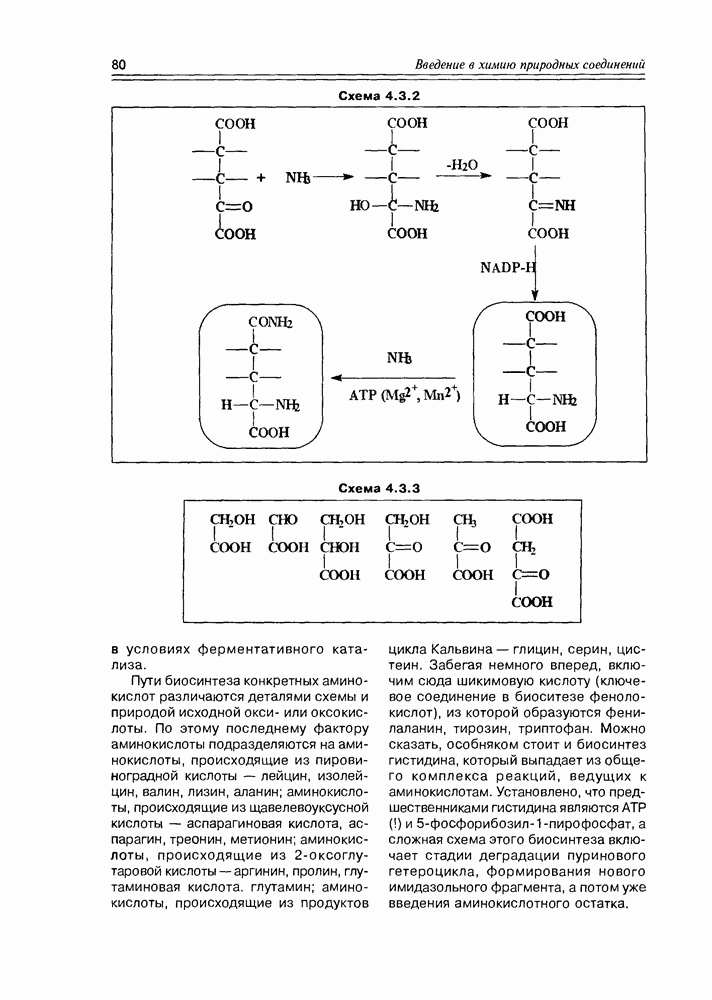
- 4.3. Биосинтез аминокислот
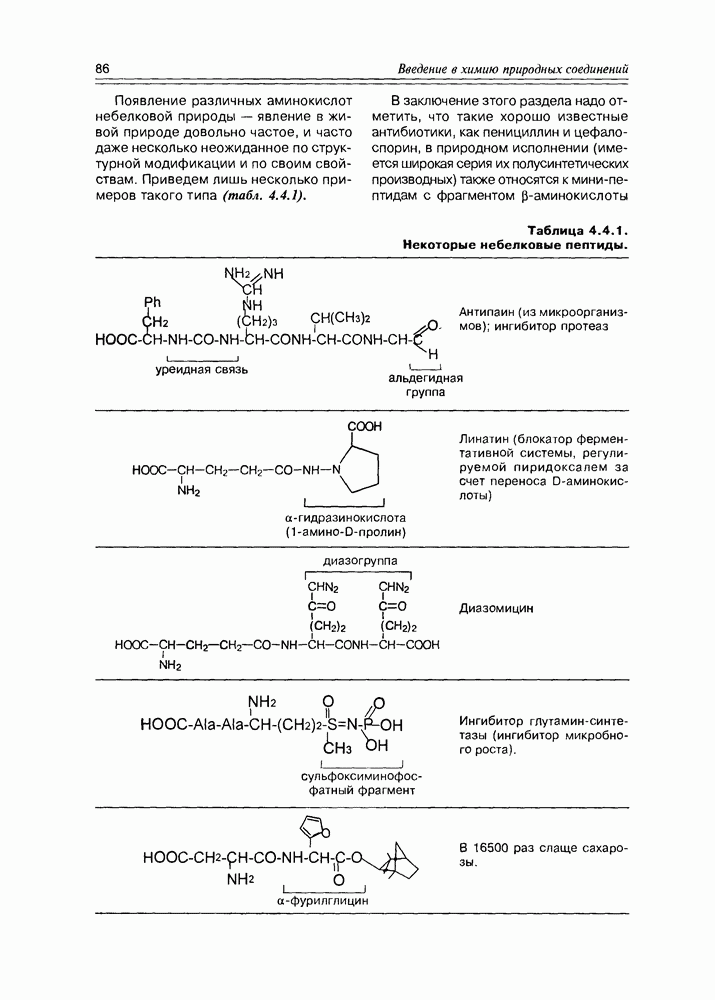
- 4.4. Полипептиды
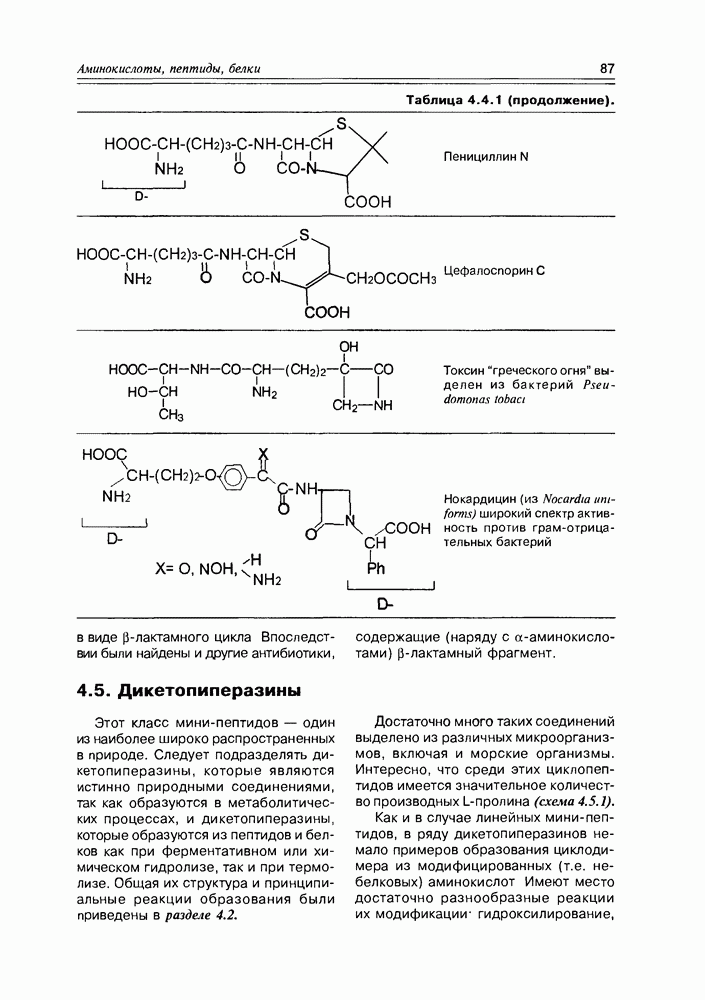
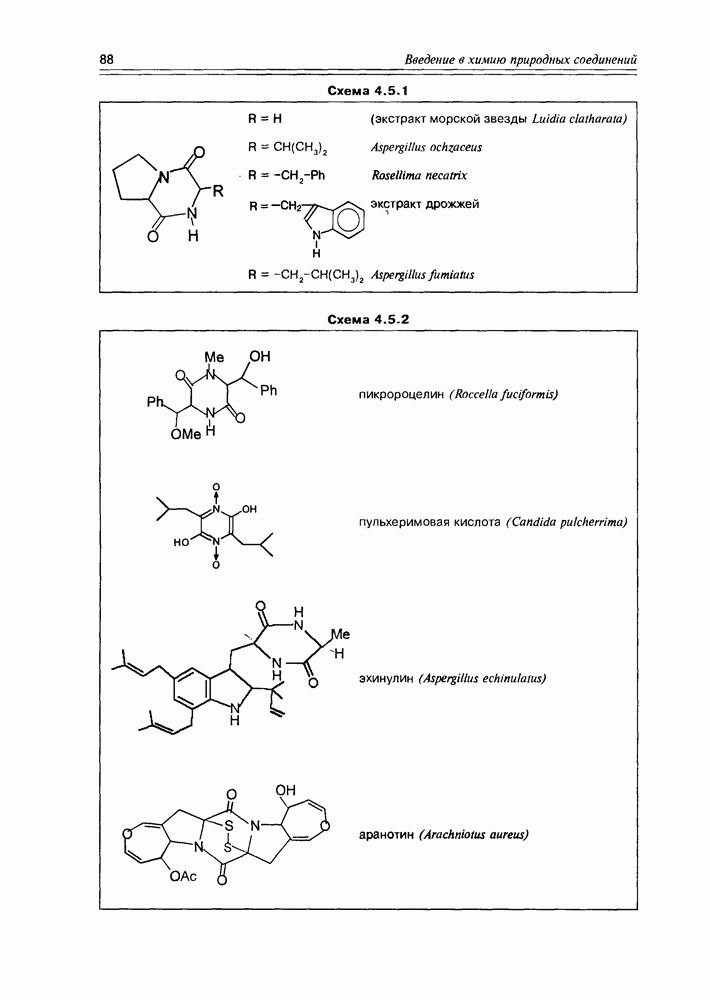
- 4.5. Дикетопиперазины
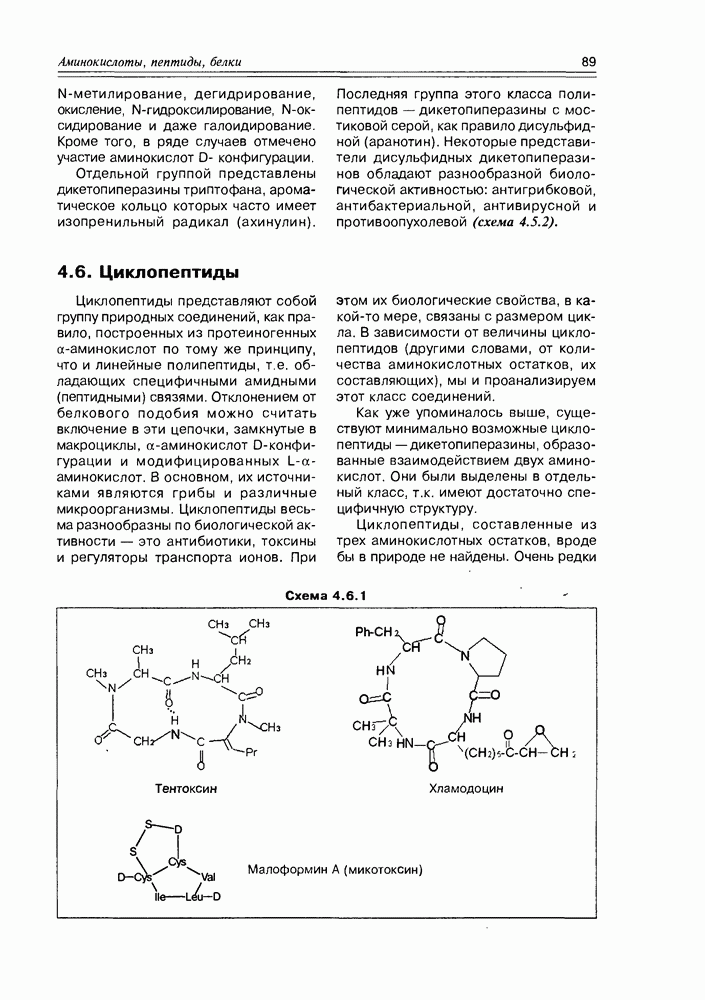
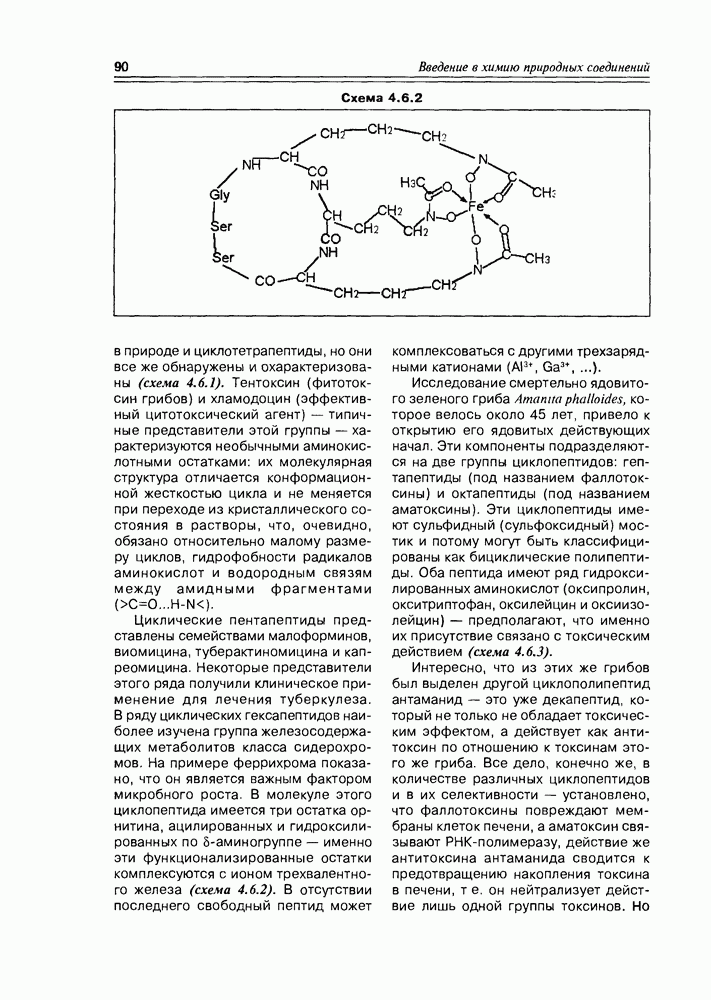
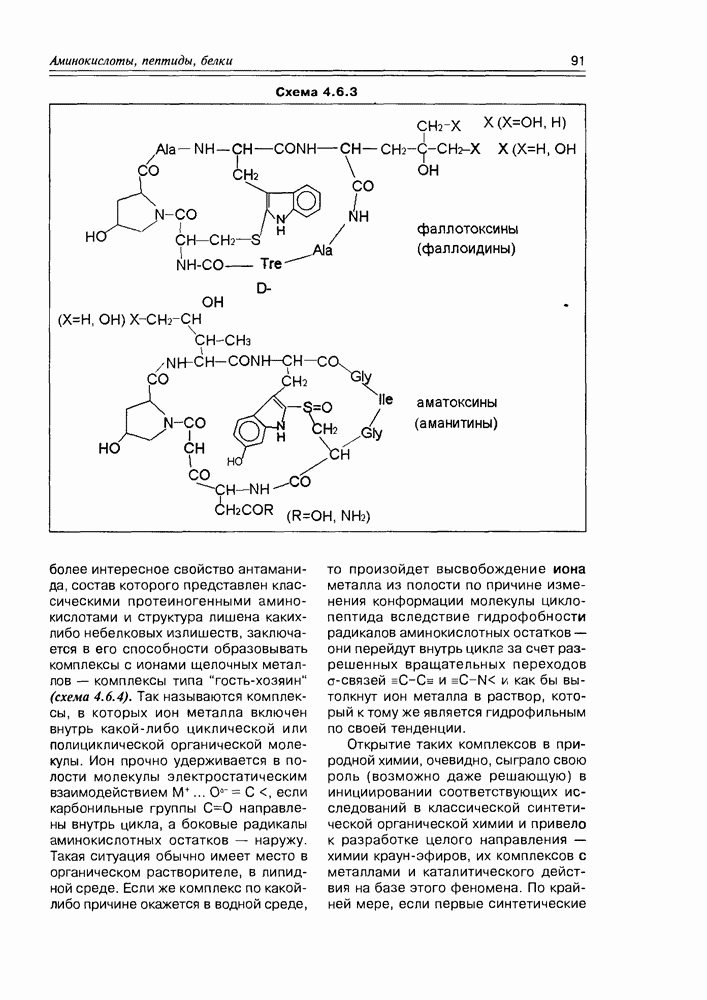
- 4.6. Циклопептиды
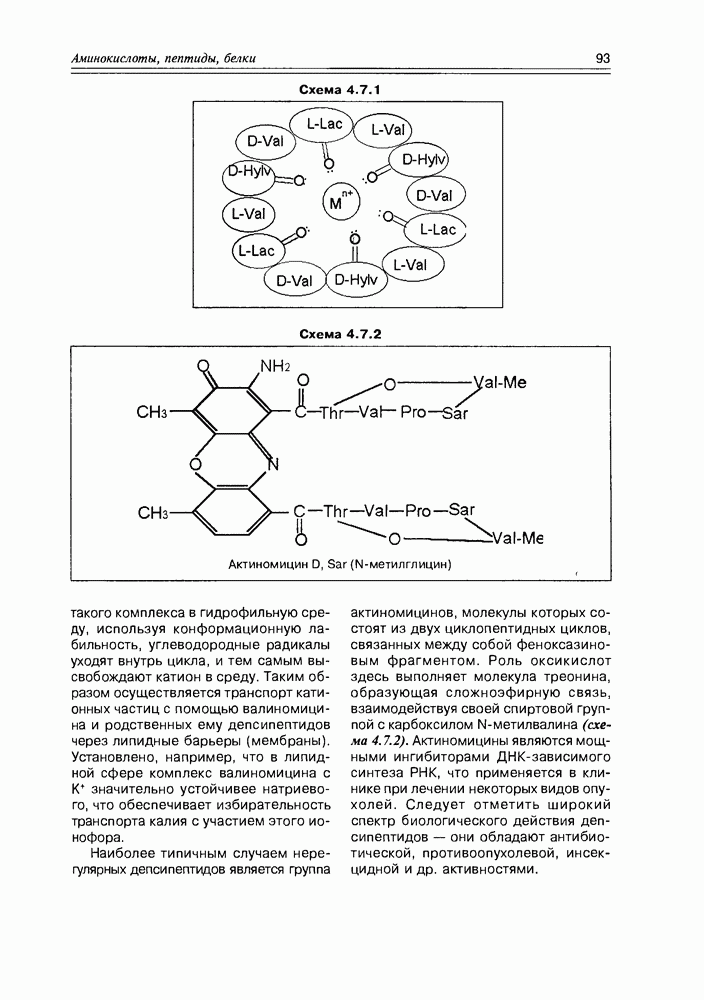
- 4.7. Депсипептиды
- 4.8. Белки
- Глава 5. ЛИПИДЫ: ЖИРНЫЕ КИСЛОТЫ И ИХ ПРОИЗВОДНЫЕ
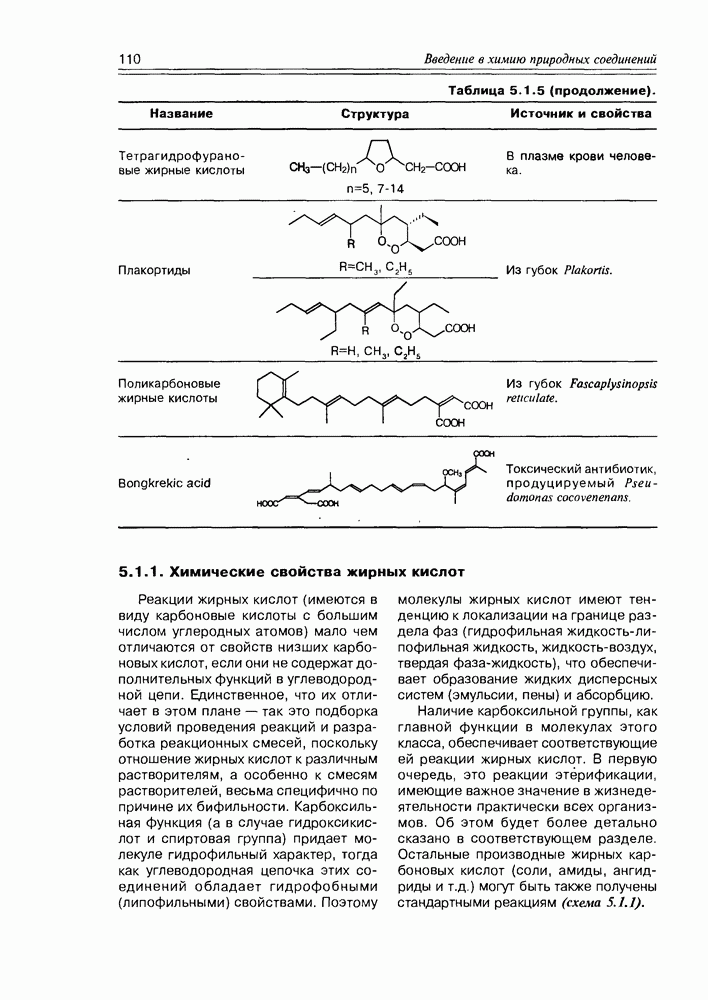
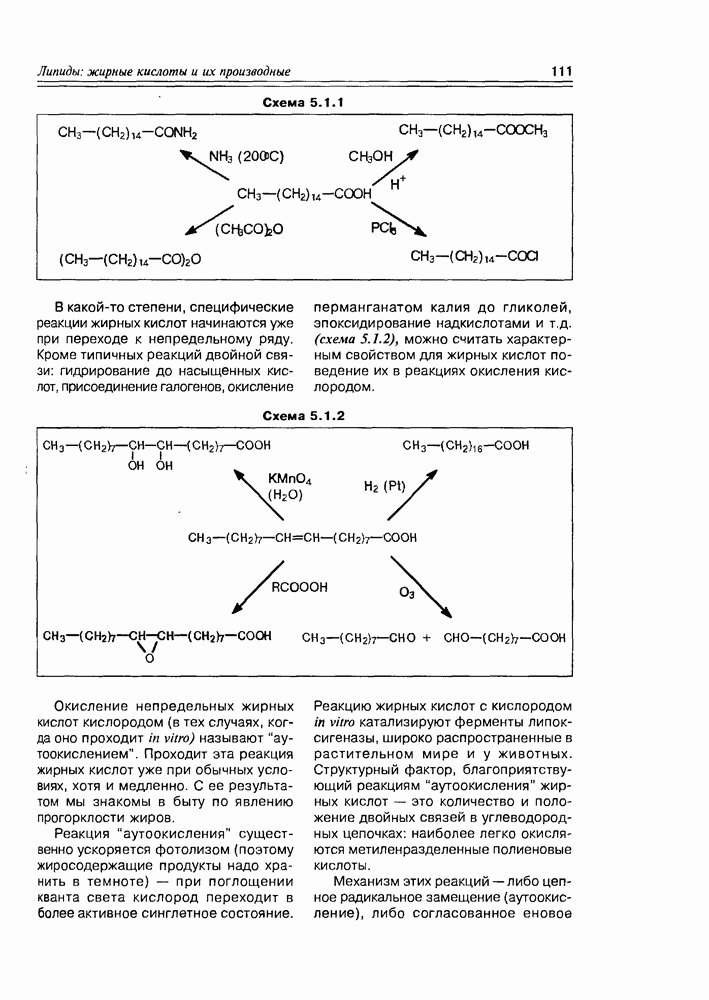
- 5.1.1. Химические свойства жирных кислот
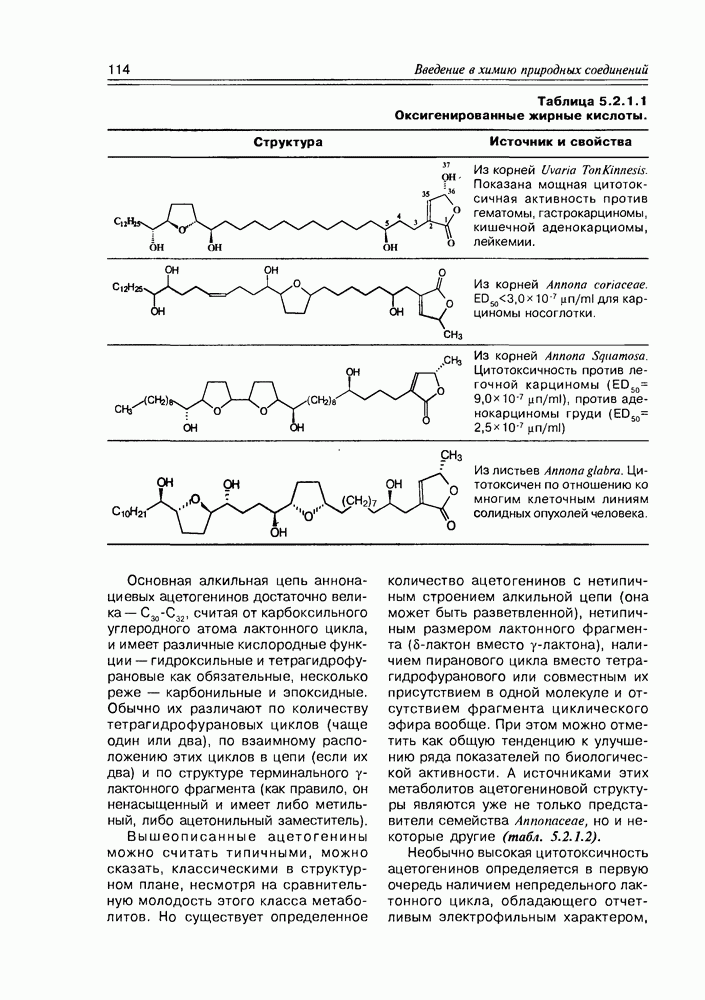
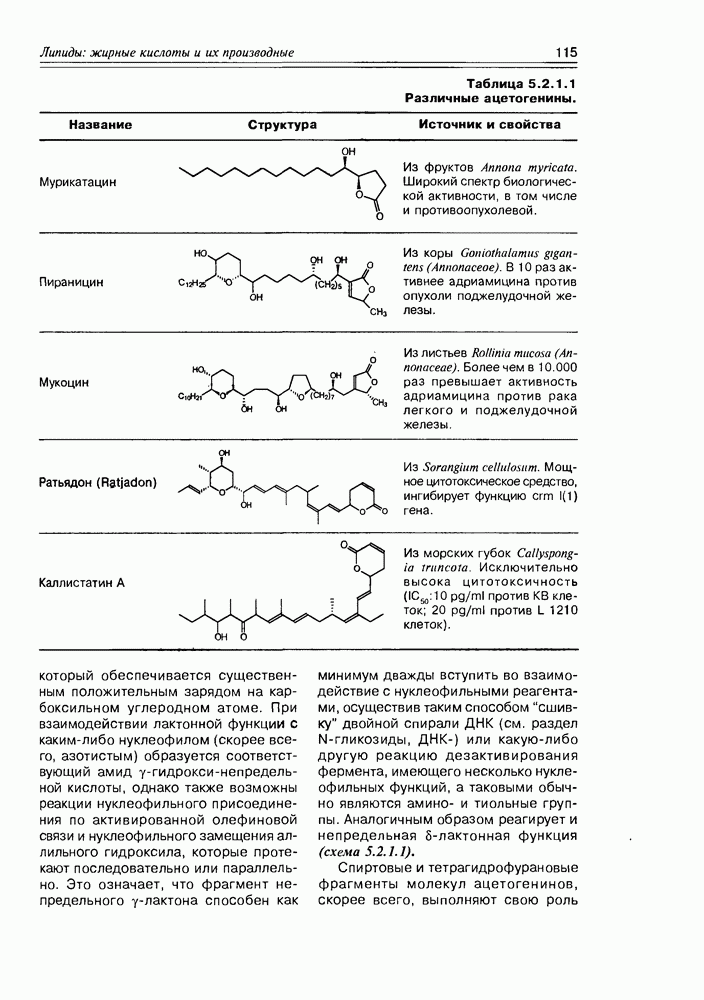
- 5.2. Метаболиты жирных кислот
- 5.2.2. Карбоциклические оксилипины
- 5.3. Жиры и жироподобные производные жирных кислот
- 5.4. Биосинтез жирных кислот и их производных
- Глава 6. ИЗОПРЕНОИДЫ-1
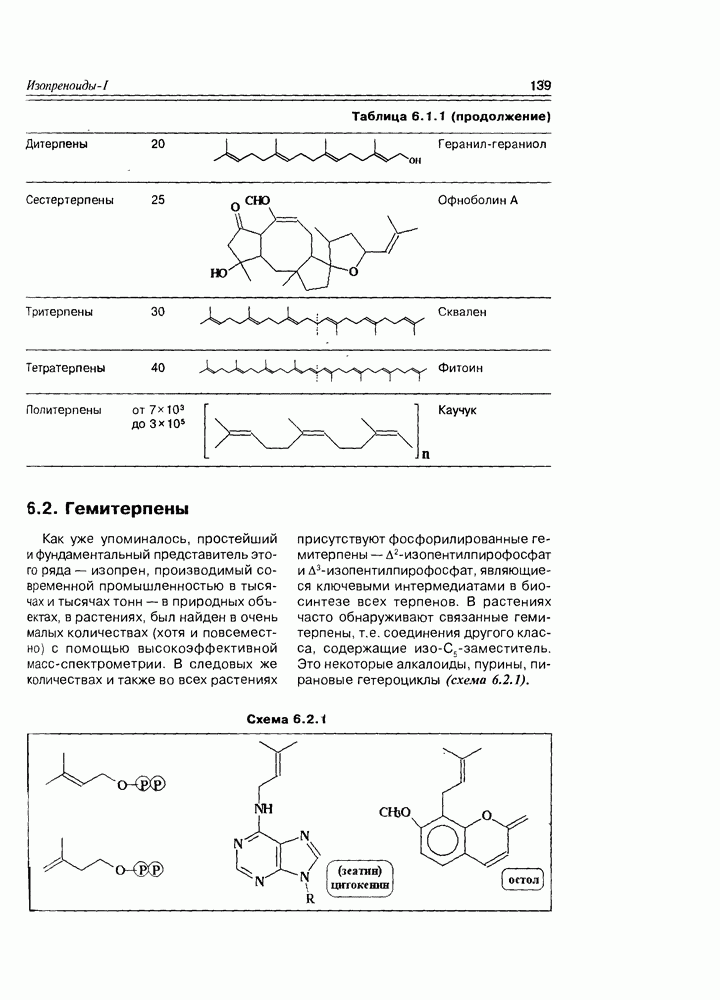
- 6.2. Гемитерпены
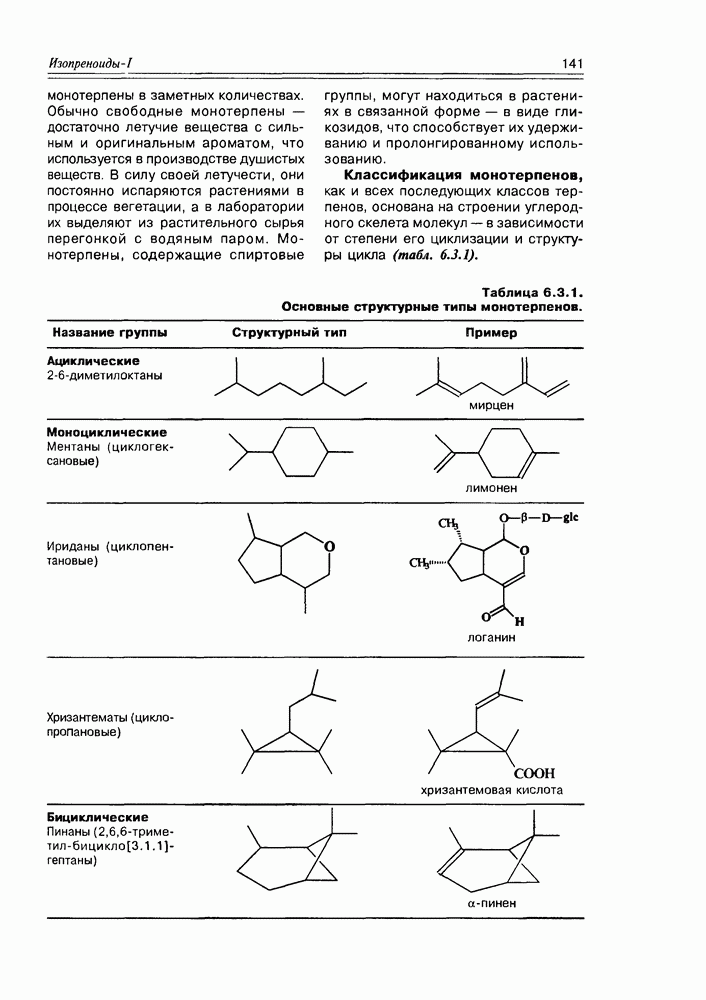
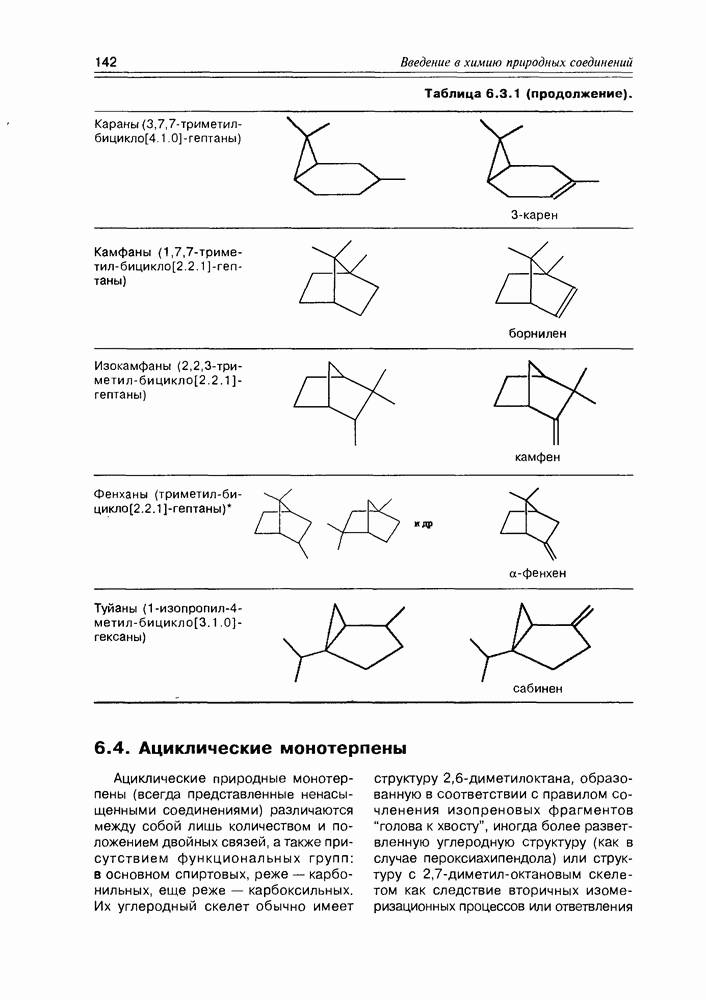
- 6.3. Монотерпены
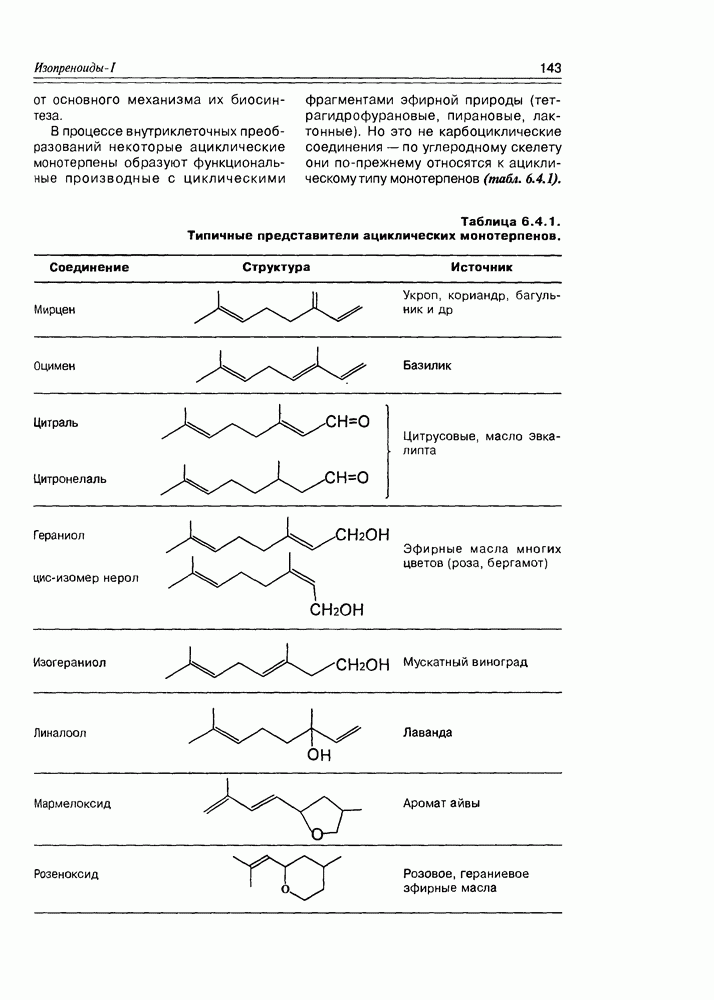
- 6.4. Ациклические монотерпены
- 6.5. Моноциклические терпены
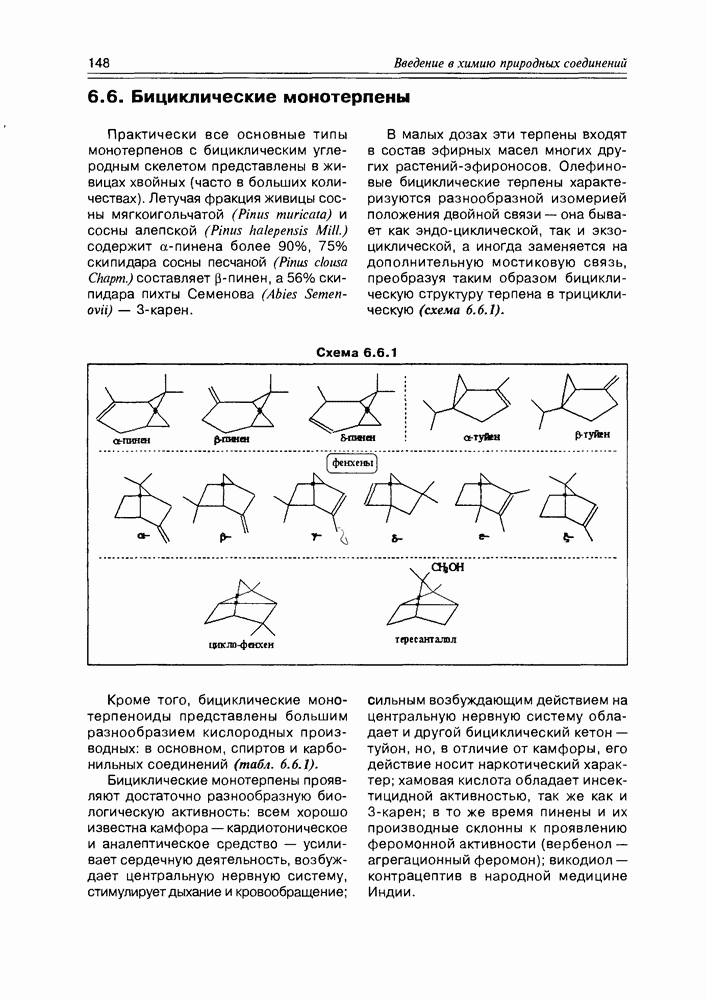
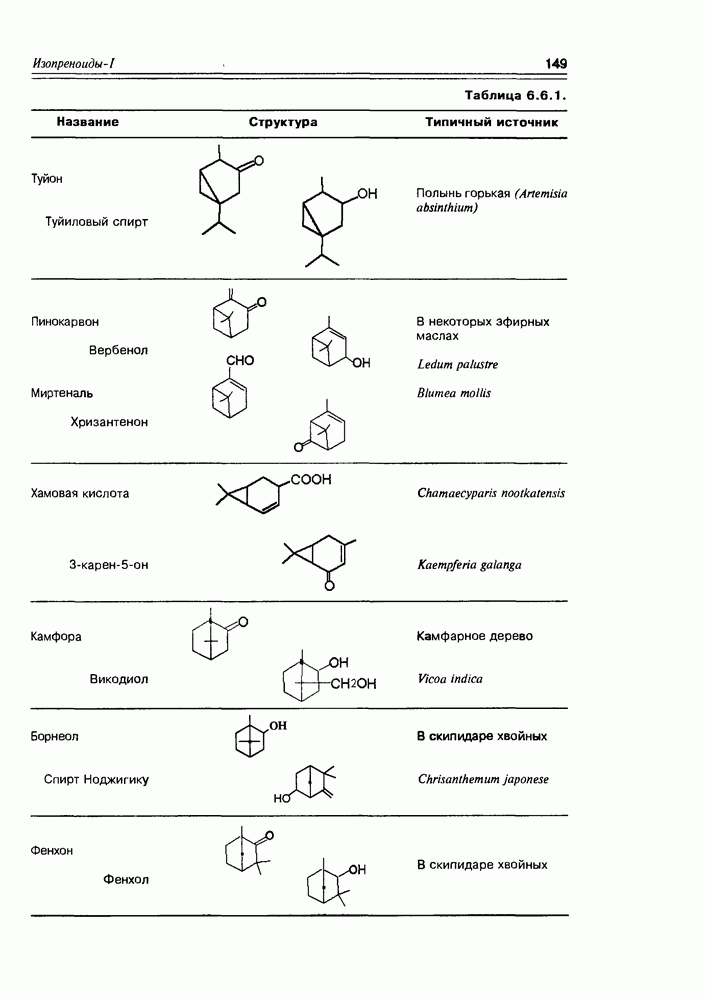
- 6.6. Бициклические монотерпены
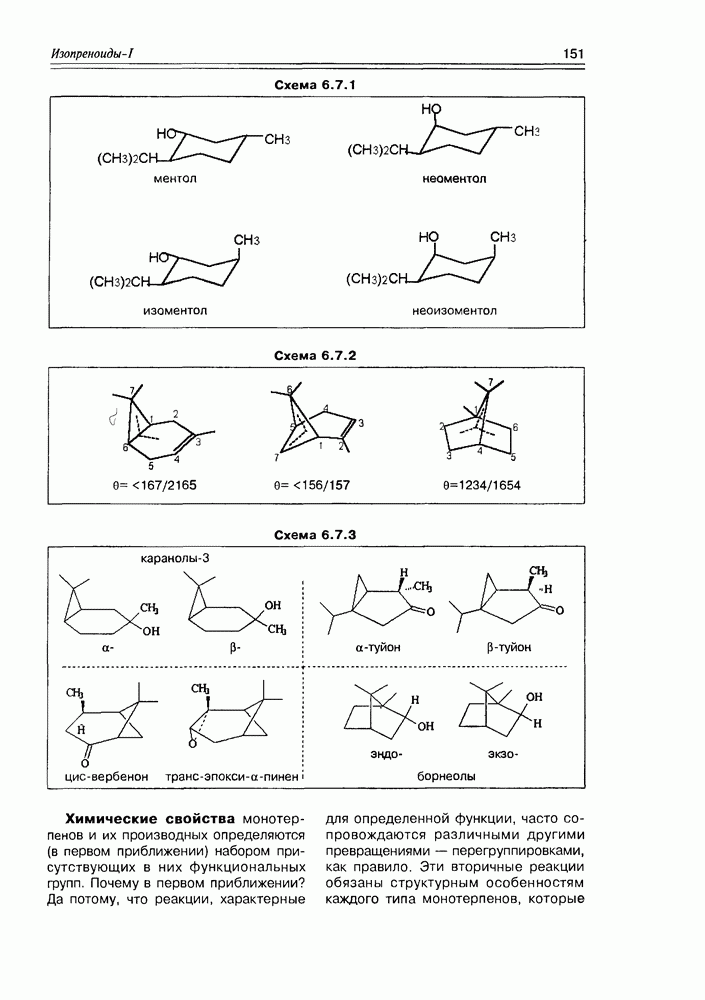
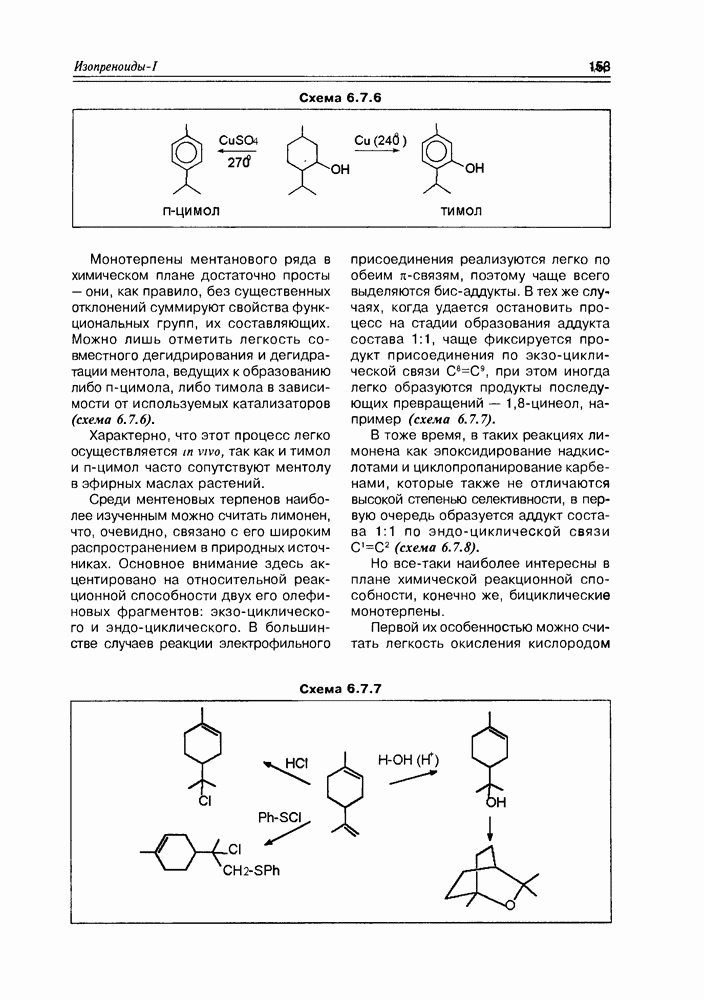
- 6.7. Строение и свойства монотерпенов
- 6.8. Биосинтез изопреноидов
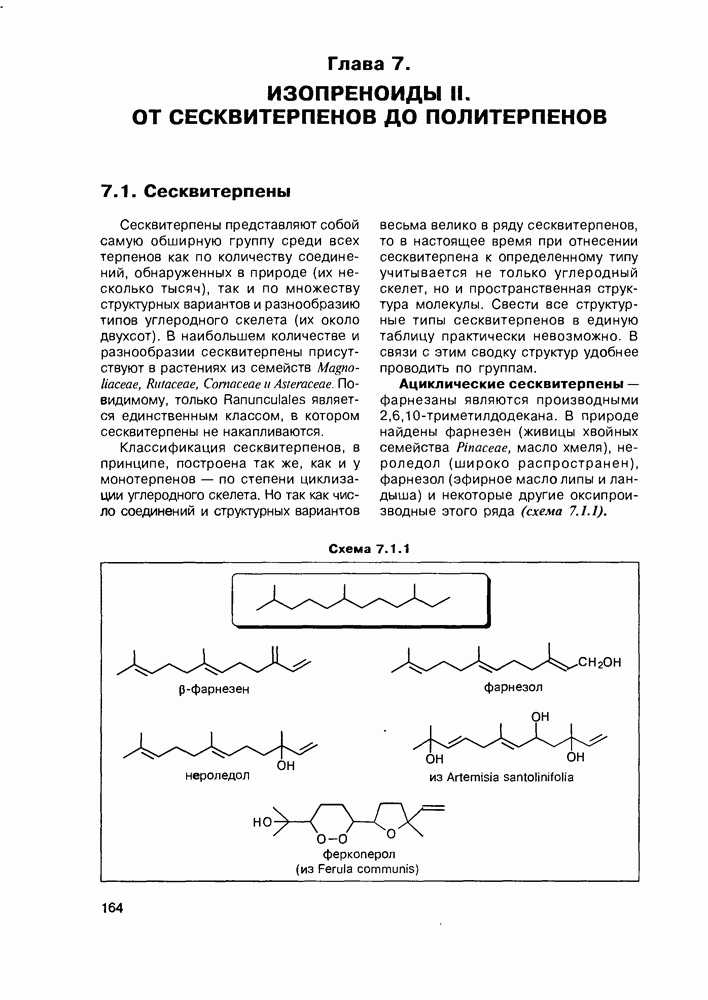
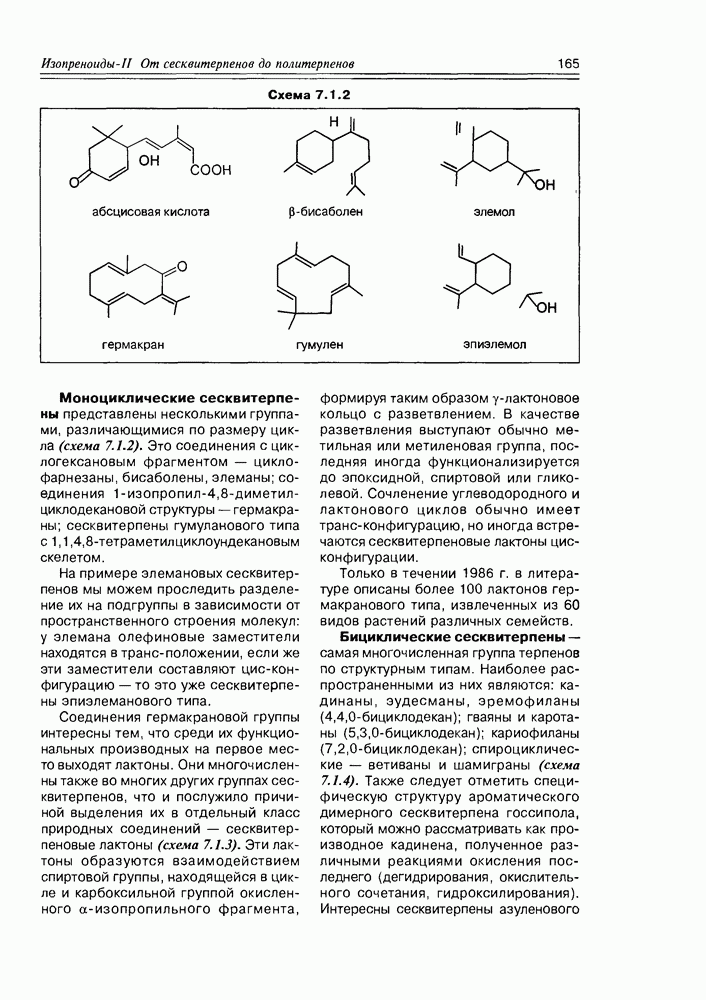
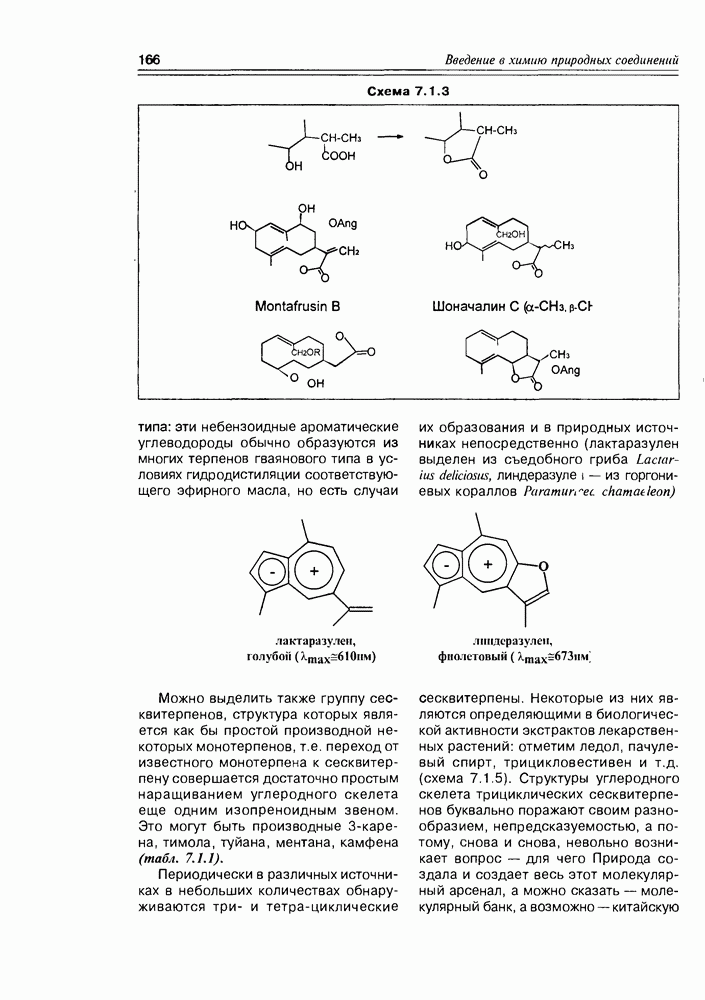
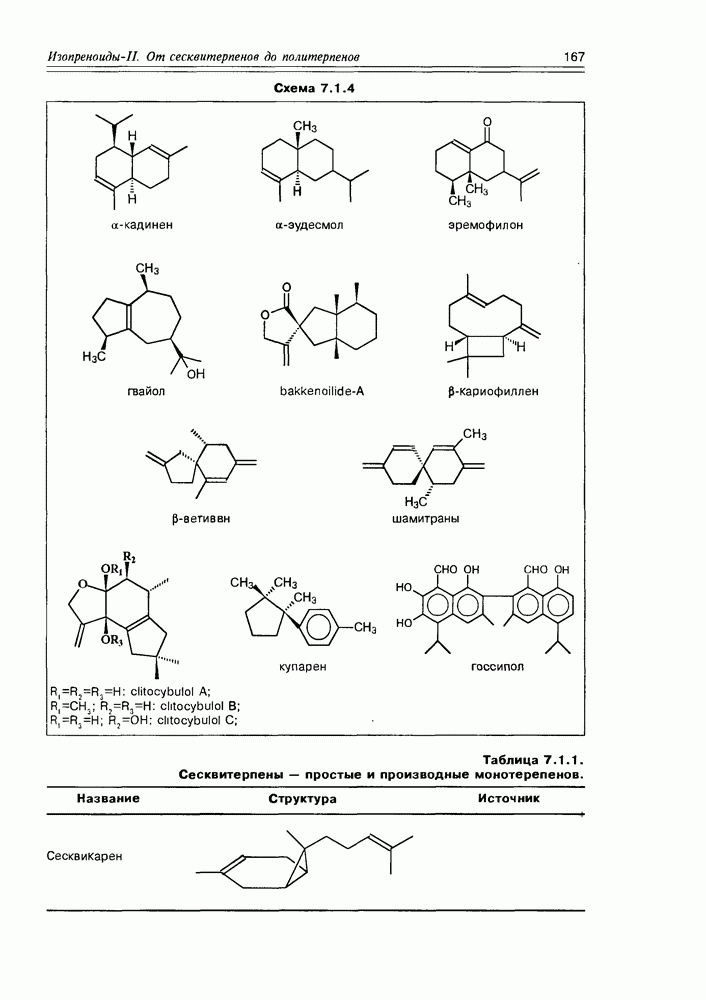
- Глава 7. ИЗОПРЕНОИДЫ II. ОТ СЕСКВИТЕРПЕНОВ ДО ПОЛИТЕРПЕНОВ
- 7.2. Химические свойства сесквитерпенов
- 7.3. Дитерпены и сестертерпены
- 7.4. Тритерпеноиды и стероиды
- 7.5. Тетратерпеноиды — каротиноиды
- Глава 8. ФЕНОЛЬНЫЕ СОЕДИНЕНИЯ
- 8.2. Пираны
- 8.4. Биосинтез фенольных соединений
- Глава 9. АЛКАЛОИДЫ И ПОРФИРИНЫ
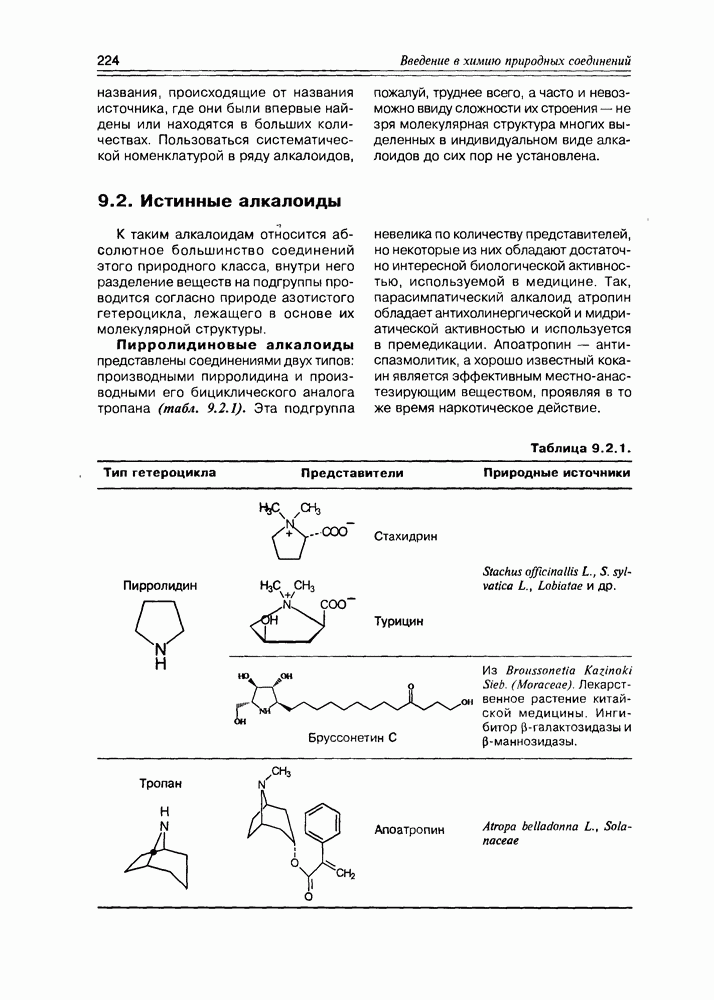
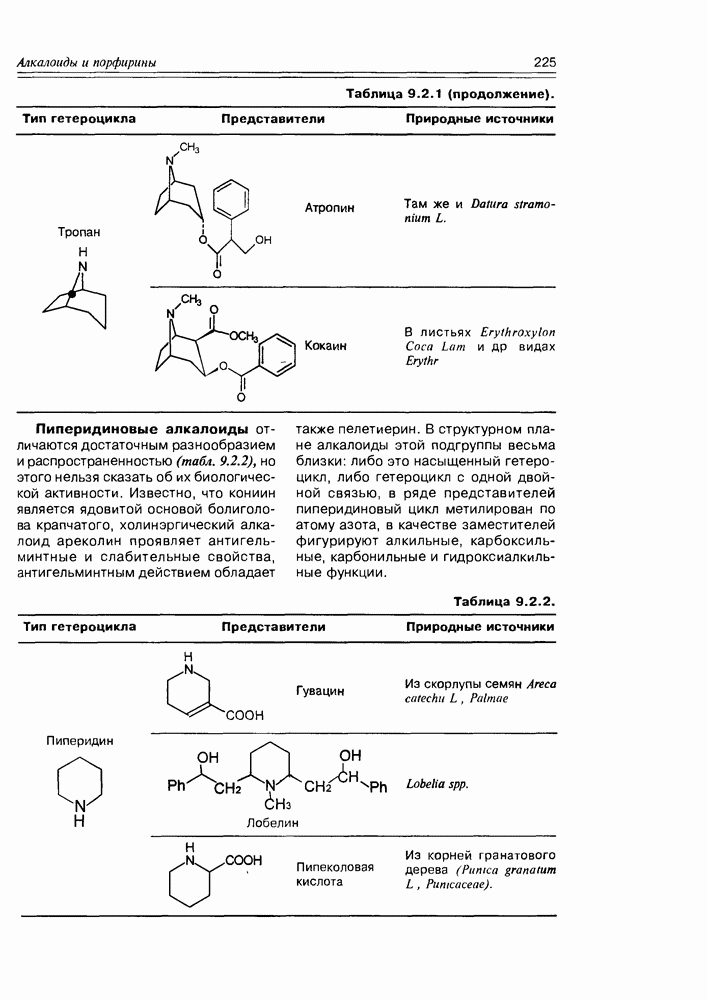
- 9.2. Истинные алкалоиды
- 9.3. Протоалкалоиды
- 9.5. Химические свойства и химические модификации алкалоидов
- 9.6. Аминокислоты и биосинтез алкалоидов
- 9.7. Порфирины
- Глава 10. ВИТАМИНЫ И КОФЕРМЕНТЫ
- 10.1. Витамины — собственно
- 10.2. Витамины-коферменты
- 10.3. Коферменты
- Глава 11. АНТИБИОТИКИ
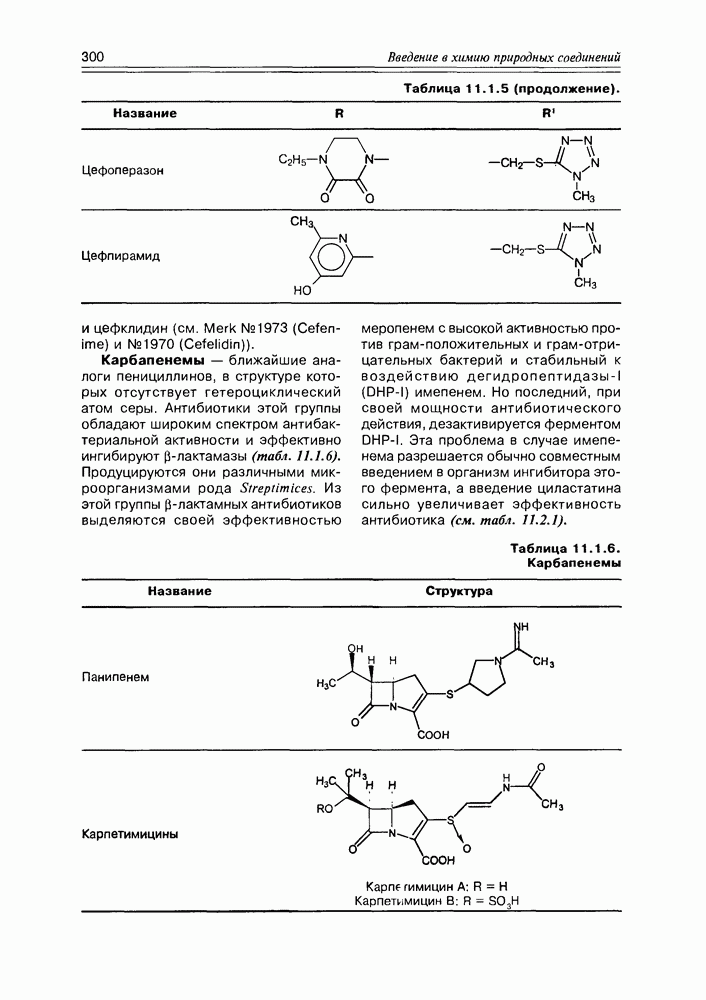
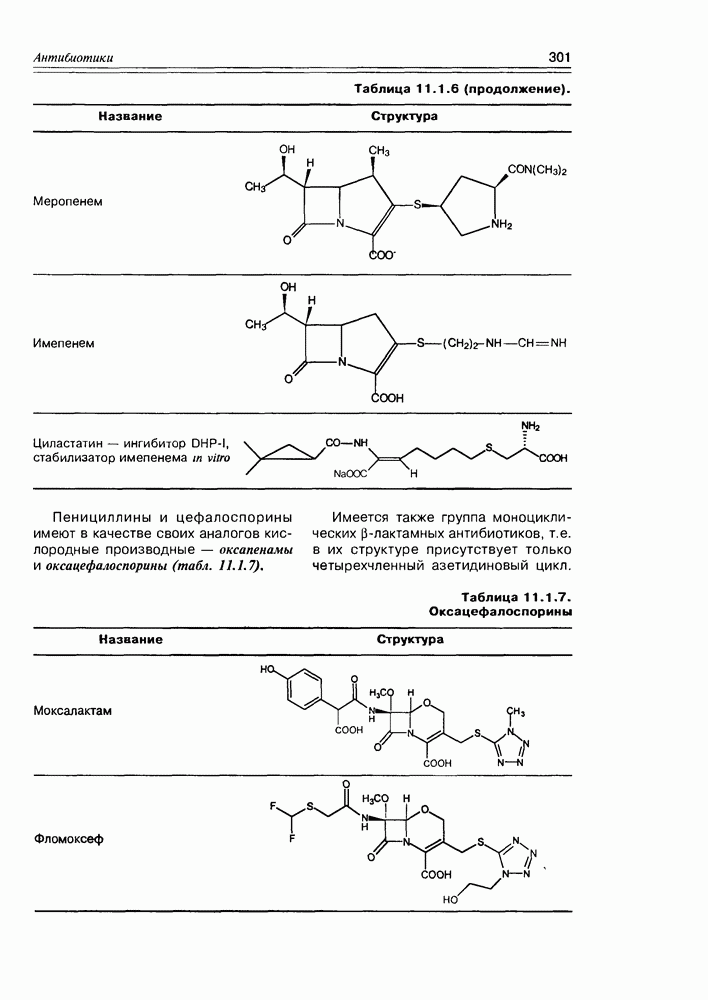
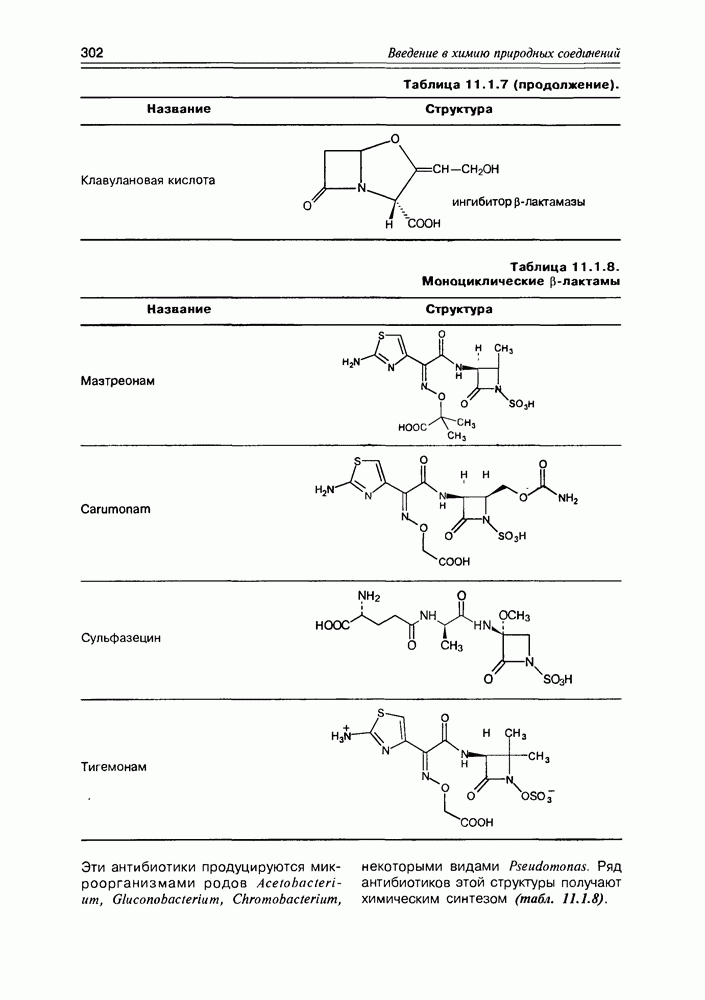
- 11.1. b-Лактамные антибиотики
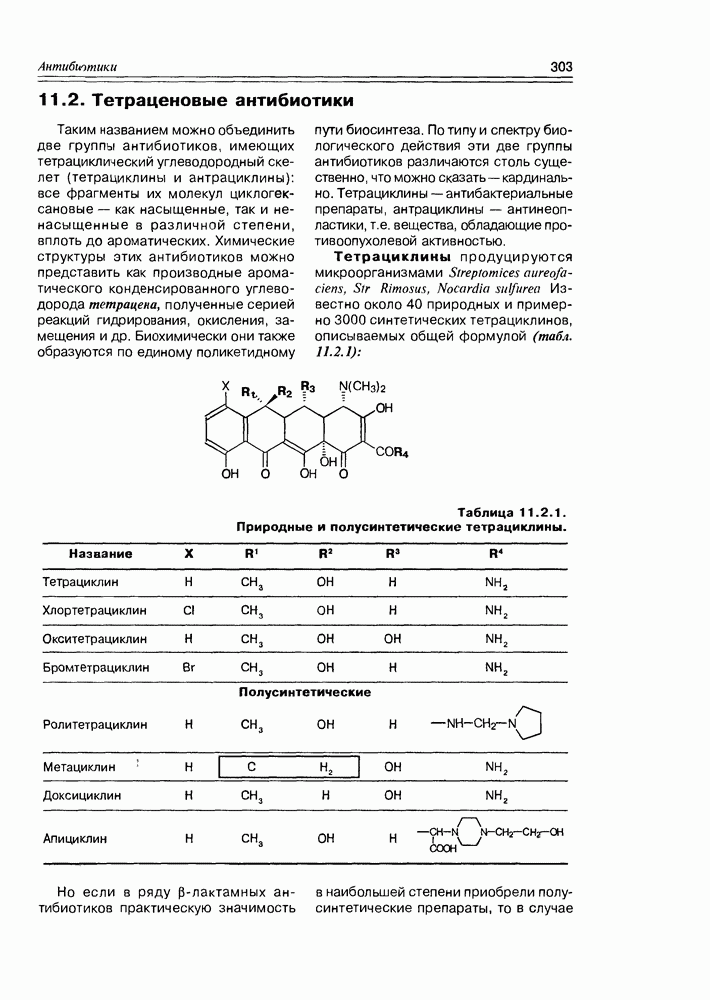
- 11.2. Тетраценовые антибиотики
- 11.3. Аминогликозидные антибиотики
- 11.4. Пептидные антибиотики
- 11.5. Макролидные антибиотики
- 11.6. Полиэфирные антибиотики
- 11.7. Антибиотики разные
- Глава 12. РАЗНЫЕ ГРУППЫ ПРИРОДНЫХ СОЕДИНЕНИЙ
- 12.2. Полиэфиры
- 12.3. Амиды
- 12.4. Элементорганические природные соединения
- Глава 13. МЕТАЛЛО-КОЭНЗИМЫ