| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
САМЫЙ ЛЕГКИЙ ГАЗ
Самый легкий из всех газов называется водородом. Он в 14 раз легче воздуха. Воздух же, надо заметить, в 770 раз легче воды.
Таким образом вода, с которой мы все так хорошо знакомы, заключает в своем составе наиболее легкое из всех известных нам на земле веществ.
А что это так, что вода не простое тело и водороду недаром дано его прозвище, я сейчас вам докажу.
Мы все безбоязненно пьем воду, она необходима для поддержания нашей жизни, она в количестве 58% входит в состав нашего тела.
Дело в том, что водород не растворен в воде, как сахар в стакане чая: он вместе с другим газом, кислородом, образует воду. В том-то и заключается удивительная тайна химических превращений, что вещества, вступая в соединения друг с другом, дают совершенно новые тела, а не простую смесь начальных веществ. Водород и кислород — газы. Смешиваясь, они дают смесь газов; соединяясь, — воду.
Перейдем к некоторым опытам.
Перед вами две двугорлые склянки, наполненные каждая на две трети водой; их горла ллотно заткнуты проваренными в парафине мягкими и упругими пробками; через первую пробку первой склянки пропущена почти до самого дна склянки стеклянная трубка, оканчивающаяся воронкой.
Вторая пробка этой склянки соединена с первой пробкой второй склянки изогнутой под прямыми углами стеклянной трубкой, которая в первой склянке опущена лишь немногим ниже пробки, а во второй доходит почти до дна. Из последней пробки выходит газоотводная трубка, изогнутая, как показано на рис. 12. Оттянутый кончик ее с узким отверстием погружен в воду пневматической ванны. Роль последней может играть обыкновенная глубокая тарелка.
Раньше чем приступить к опыту, я самым тщательным образом замазываю все пробки (кроме первой) замазкой, чтобы газ, который мы станем добывать, не нашел нигде выхода через зазоры между стеклом и пробкой.
Наполнив два-три узких и высоких стеклянных цилиндра водой, я прикрываю их квадратными кусочками матового стекла. Цилиндры, при нужде, можно заменить обыкновенными бутылками из-под минеральной воды или из-под кваса, — словом, достаточно толстостенными. Здесь же на столе у меня штатив с пробирками и полотенце; как можно дальше от прибора для добычи газа, всего лучше — на особом столике, поставленном нескольких шагах от первого, - спиртовая лампочка с колпаком (рис. 13).
В школах обычно добывают водород в подобных приборах, действуя серной кислотой на цинк.
Вы, вероятно, знаете, что серную кислоту наливают в стаканчики, которые на зиму ставят между двойными рамами окон. Она в высшей степени гигроскопична, т. е. отлично сушит воздух, отнимая от него влагу; оттого-то в этом случае окна и не «потеют». Обратите внимание, что с осени ее наливают не более четверти стакана, а к весне стаканчики почти полны,

Рис. 12. Добывание водорода.

Рис. 13. Спиртовая лампочка.
Металлы в большинстве случаев хорошо растворяются в серной кислоте, образуя соответствующие сернокислые соли и вытесняя из кислоты водород.
Применяемый для наполнения аэростатов водород долгое время добывали подобным образом; только вместо дорогого цинка брали дешевое железо в виде железного лома.
Однако, я покажу вам другой способ получения интересующего нас газа. Он гораздо удобнее и менее опасен.
Не будем забывать, что серная кислота — это вещество, с которым, чем меньше будем иметь дела, тем лучше, особенно когда нельзя обойтись каплей-другой, а приходится манипулировать с относительно большими количествами ее.
Я воспользуюсь тем, что многие металлы вытесняют водород не только из кислот, но и из воды. Правда, в большинстве случаев такое разложение происходит лишь при очень высокой температуре, но, по счастью, есть некоторые металлы, способные разлагать воду и при обыкновенной температуре.

Рис. 14. Неосторожный опыт с водородом.
К таким металлам принадлежит кальций. Я храню его в баночке с плотно притертой пробкой. Как видите, он залит какой-то жидкостью. Это — керосин, на который кальций не действует химически. Зато на воздухе этот металл быстро окисляется, ржавеет, превращается в известь (негашеную). Тот же процесс происходит под водою, только в этом случае образовавшаяся окись соединяется с избытком воды в водную окись кальция (так называемую гашеную известь).
Вынув кусочек серовато-белого металла щипчиками, осторожно обсушиваю его пропускной бумагой, удаляя следы керосина, не касаясь металла руками.
Теперь смотрите: я вынимаю из первой склянки первую пробку, быстро бросаю куски кальция в воду, сейчас же вновь закупориваю банку и обмазываю пробку замазкой.
Куски металла, упав на дно склянки, покрываются пузырьками газа, которые, оторвавшись от поверхности кусков, быстро всплывают вверх. Вскоре жидкость в банке кажется словно кипящей.
Выделяющийся газ вытесняет, вернее — увлекает с собой воздух и идет с ним вместе во вторую склянку, а оттуда из газоотводной трубки — в окружающую атмосферу, булькая пузырьками через воду.
Наполнив одну из пробирок водой, закрываю ее большим пальцем, переворачиваю и опускаю ее конец в воду тарелки, играющей у нас роль пневматической ванны. Отвожу палец в сторону и держу отверстие пробирки над отверстием трубки. Пузырьки газа, ранее выходившие через воду, идут в пробирку, вытесняя из нее воду. Вскоре пробирка наполняется газом. Опять закрываю ее пальцем, вынимаю из воды и быстро несу к столику, на котором стоит спиртовая лампочка. Держа пробирку отверстием вниз, подношу ее к пламени и открываю.
Слышали свист? Он показывает, что водород в пробирке смешан с воздухом и обращаться с ним надо осторожно.
Нужно, следовательно, подождать немного, пока выделяющийся водород вытеснит следы воздуха из аппарата. А чтобы не сидеть без дела, прочтите страничку из книги одного английского химика о том, как иногда может быть опасен взрыв водорода.
Вот что он пишет:
«Несколько лет тому назад рабочие, занятые при постройке большого парового котла для германского военного судна, по небрежности оставили внутри его несколько кусков цинка; им в голову не приходило, что этим они могут причинить смерть многим своим товарищам и повергнуть много рабочих семей в глубокое отчаяние. Паровик был поднят на судно и установлен на место. Несколько времени спустя, судно отправилось в пробное плавание. Трюм был переполнен занятыми кочегарами; машины впервые дрогнули и быстро погнали мощное судно по морю. Вода за это время нагрелась до чрезвычайно высокой температуры, и цинк быстро растворялся в ней, освобождая при этом значительное количество водородного газа. Этот газ вместе с воздухом образовал в паровике страшно взрывчатую смесь. Люди, работавшие вокруг паровика, конечно, ничего этого не подозревали, а между тем котел постепенно наполнялся все больше и больше этой смертельной смесью. Как вдруг, без малейших предупредительных признаков, с ослепительным блеском и оглушительным громом большой паровик разорвался на части, убив или искалечив всех находившихся в помещении людей, а само судно наполнилось облаком перегретого пара. Причина взрыва осталась тайной, пока в остатках паровика не нашли кусочков цинка
Таким образом, мы видим, что силы химического сродства, находясь под контролем, становятся полезными слугами, а вне контроля — страшными господами».
| << Предыдущий параграф | Следующий параграф >> |
- ПРЕДИСЛОВИЕ К 7-МУ ИЗДАНИЮ
- Введение. ЧТО ТАКОЕ ХИМИЯ
- ДОСТИЖЕНИЯ ХИМИИ В СССР
- ГЛАВА I. ХИМИЧЕСКАЯ «МАГИЯ» (реакции соединения)
- ПОСЛУШНАЯ ПАПИРОСА
- ТРИ «КИТА» ХИМИИ
- САМАЯ НУЖНАЯ КИСЛОТА
- КАТАЛИЗАТОРЫ ХИМИЧЕСКИХ РЕАКЦИЙ
- ГЛАВА II. ПРЕВРАЩЕНИЕ ЖИДКОСТЕИ (реакции обменного разложения)
- МОЛОКО… ИЗ ВОДЫ
- ВОДА И ВИНО В ОДНОЙ БУТЫЛКЕ
- ПРЕВРАЩЕНИЕ ВОДЫ В ЧЕРНИЛА И ОБРАТНО
- МНИМАЯ ОШИБКА ФИЗИКОВ
- ВОДА — В МОЛОКО, МОЛОКО — В ВОДУ
- ПРЕВРАЩЕНИЕ ВОДЫ В «КРОВЬ»
- КАК ОДНОЙ КРАСКОЙ КРАСЯТ В РАЗНЫЕ ЦВЕТА
- СЕКРЕТ СТАРЫХ КРАСИЛЬЩИКОВ
- ЗАБЫТОЕ СЛОВО
- «КАНЦЕЛЯРСКОЕ СЕМЕЧКО»
- ХИМИЯ ОРГАНИЧЕСКАЯ И НЕОРГАНИЧЕСКАЯ
- ФАБРИКИ КРАСОК — ПРЕДПРИЯТИЯ ДАЛЕКО НЕ НЕВИННЫЕ
- ЧТО СЛАЩЕ САХАРА?
- ЗОЛОТО РАСТВОРИМОЕ И РАСТВОРЕННОЕ
- ЗОЛОТО В СССР
- ИСТОРИЧЕСКИЙ КУРЬЕЗ
- ГЛАВА III. ОПЫТЫ С ГАЗАМИ
- САМЫЙ ЛЕГКИЙ ГАЗ
- ЗАМАЗКА МЕНДЕЛЕЕВА
- ВОДА ИЗ ОГНЯ
- «ВЗРЫВ» АЭРОСТАТА
- ПЕРЕЛИВАНИЕ… ВВЕРХ
- МЫЛЬНЫЕ ПУЗЫРИ
- ЗАГАДОЧНЫЙ ФОНТАН
- ИЗ ЖЕЛТОГО В ЗЕЛЕНОЕ БЕЗ ПРИБАВЛЕНИЯ СИНЕГО
- ПОСЛЕДНИЙ ПЕРМАНЕНТНЫЙ ГАЗ
- ГЛАВА IV. ГАЗ РАЗНООБРАЗНОГО ПРИМЕНЕНИЯ
- ХЛОР И ФАРАДЕЙ
- ХЛОР, ЦВЕТЫ И ЦВЕТА
- ОКРАСКА ХЛОРОМ В СИНИЙ ЦВЕТ
- ОКРАСКА ХЛОРОМ В КРАСНЫЙ ЦВЕТ
- ЕЩЕ ОКРАСКА ХЛОРОМ
- ГОРЕНИЕ БЕЗ ВОЗДУХА
- САМОВОСПЛАМЕНЕНИЕ
- И НЕГОРЮЧЕЕ МОЖЕТ ГОРЕТЬ
- ДЫМОВАЯ ЗАВЕСА
- ФЕЙЕРВЕРК В СКЛЯНКЕ
- ХЛОР В МИРОВОЙ ВОЙНЕ
- ЕЩЕ СТРАШНЫЙ ГАЗ
- «СТРАШНЫЙ СПУТНИК НАШИХ ЖИЛИЩ»
- ГОЛУБОЙ И ВОДЯНОЙ ГАЗЫ
- ГАЗЫ ДЫХАНИЯ И ГОРЕНИЯ
- РЕАКЦИИ ЭКЗО- И ЭНДОТЕРМИЧЕСКИЕ
- ГАЗ, В КОТОРОМ ГОРИТ ЖЕЛЕЗО
- ГОРЯЩЕЕ ЖЕЛЕЗО
- ОШИБКА ЖЮЛЯ ВЕРНА
- ЖИВЫЕ МЕРТВЕЦЫ
- ХИМИЯ НЕБА
- КУДА ДЕЛСЯ КУСОЧЕК УГЛЯ?
- ГЛАВА V. «НЕЧТО НЕВИДИМОЕ» И ОПЫТЫ С НИМ
- «ТАИНСТВЕННЫЙ» ОПЫТ С ВЕСАМИ
- ПРИРОДА — АРХИТЕКТОР
- ПЛАВАЮЩИЕ ПУЗЫРИ
- ОТЧЕГО СТРЕЛЯЕТ ПУШКА
- ОЧИСТИТЬ ЯЙЦО, НЕ РАЗБИВ СКОРЛУПЫ
- НЫРЯЮЩЕЕ ЯЙЦО
- РАСТУЩЕЕ ЯЙЦО
- ЯЙЦО В ГРАФИНЕ
- ГЛАВА VI. ОПАСНЫЕ ГАЗЫ
- ХИМИЧЕСКИЕ МОТЫЛЬКИ
- ПОДВОДНАЯ ЛОДКА ИЗ КОРОБОЧКИ
- ВРЕДНЫЕ ГАЗЫ, ПРИНОСЯЩИЕ ПОЛЬЗУ
- ДАР ВУЛКАНОВ
- ОПЫТЫ С СЕРНИСТЫМ ГАЗОМ
- ГАШЕНИЕ ОГНЯ ГОРЯЩЕЙ СЕРОЙ
- ЗЕЛЕНЫЙ ЛЕВ
- БЕЛЫЙ СНЕГИРЬ
- ГАЗ ТУХЛЫХ ЯИЦ
- КОЕ-ЧТО О ТРЕХЦВЕТНЫХ КОШКАХ
- ПРЕВРАЩЕНИЕ БЕЛОЙ КОШКИ В ЧЕРНУЮ
- ОТЧЕГО ТЕМНЕЮТ КАРТИНЫ
- НЕМНОГО ИСТОРИИ
- ХИМИЧЕСКОЕ ХЛЕБОПЕЧЕНИЕ
- ДОМАШНИЙ ОГНЕГАСИТЕЛЬ
- ОПАСНОСТЬ БЕЗОПАСНЫХ ВЕЩЕСТВ
- ВЗРЫВЧАТЫЕ ВЕЩЕСТВА
- КТО ИЗОБРЕЛ ПОРОХ?
- УКРОЩЕННЫЙ НИТРОГЛИЦЕРИН
- ПИКРИНОВАЯ КИСЛОТА И ТРОТИЛ
- МИРНОЕ ПРИМЕНЕНИЕ ВЗРЫВЧАТЫХ ВЕЩЕСТВ
- СИНИЙ ФОНТАН ИЗ КРАСНОЙ ВОДЫ
- КРАСНЫЙ ФОНТАН ИЗ СИНЕЙ ВОДЫ
- КУРЯЩИЙСЯ МЫЛЬНЫЙ ПУЗЫРЬ
- КОЕ-ЧТО О ВОЕННОЙ ХИМИИ
- ГЛАВА VII. БЕЗОПАСНАЯ ПИРОТЕХНИКА
- ОГОНЬ-ХУДОЖНИК
- БУМАГА, ГОРЯЩАЯ ЦВЕТНЫМ ПЛАМЕНЕМ
- ЦВЕТНОЕ ПЛАМЯ
- ПОДВОДНЫЙ ОГОНЬ
- «БОЛОНСКИЙ ФОСФОР»
- ГЛАВА VIII. КОЕ-ЧТО О КРИСТАЛЛАХ
- ЦВЕТНОЙ РАСТВОР БЕСЦВЕТНОГО ВЕЩЕСТВА
- МЕДЛЕННАЯ КРИСТАЛЛИЗАЦИЯ
- МГНОВЕННАЯ КРИСТАЛЛИЗАЦИЯ
- О СОЛЯХ В ПРИРОДЕ И В ТЕХНИКЕ
- ЗИМНИЙ САД… ЛЕТОМ
- САД ХИМИКА
- «САТУРНОВО ДЕРЕВО»
- КРИСТАЛЛИЗАЦИЯ МЕТАЛЛОВ
- ГЛАВА IX. НЕМНОГО ЭЛЕКТРОХИМИИ
- РАЗЛОЖЕНИЕ ВОДЫ
- ДВУХЦВЕТНАЯ ЖИДКОСТЬ В ОДНОМ СОСУДЕ
- РАФИНИРОВКА МЕДИ
- ГАЛЬВАНОСТЕГИЯ
- УПРОЩЕННАЯ ГАЛЬВАНОПЛАСТИКА
- МЕТАЛЛИЗАЦИЯ
- АЛЮМИНИЕВАЯ КАСТРЮЛЯ И ДНЕПРОСТРОЙ
- ГЛАВА X. ХИМИЧЕСКИЕ РАЗВЛЕЧЕНИЯ БЕЗ ПРИБОРОВ
- МГНОВЕННАЯ ФОТОГРАФИЯ, ДА ЕЩЕ ЦВЕТНАЯ
- СЕКРЕТНЫЕ ЧЕРНИЛА
- ПОЯВЛЯЮЩИЕСЯ И ИСЧЕЗАЮЩИЕ ЧЕРНИЛА
- МАГИЧЕСКИЕ КАРТИНКИ
- БУКЕТ ЦВЕТОВ — УКАЗАТЕЛЬ ПОГОДЫ
- ЖИВОПИСЬ ПО ДЕРЕВУ
- КРАСНЕЮЩИЕ ФИГУРКИ
- ЗЕЛЕНЫЕ КОЛОКОЛЬЧИКИ
- ПРЕВРАЩЕНИЕ БЕЛОЙ РОЗЫ В КРАСНУЮ
- СИНИЙ ХЛЕБ
- ГЛАВА XI. ХИМИЧЕСКИЕ ШУТКИ
- КАК СВАРИТЬ ЯЙЦО БЕЗ ОГНЯ
- РАССКАЗ О «НЕБЛАГОНРАВНОМ МАЛЬЧИКЕ»
- КЛЮЧЕВАЯ ВОДА В ЛЕТНИЙ ЗНОЙНЫЙ ДЕНЬ
- ЧТО НАПИСАНО ПЕРОМ…
- ЗАКЛЮЧЕНИЕ
- Приложение I. БЕЗ ЧЕГО НЕЛЬЗЯ ДЕЛАТЬ ОПЫТЫ
- КАК ГНУТЬ И ТЯНУТЬ СТЕКЛЯННЫЕ ТРУБКИ
- КАК НАГРЕВАТЬ, КИПЯТИТЬ И ВЫПАРИВАТЬ ЖИДКОСТИ
- КАК ОБРАЩАТЬСЯ СО СПИРТОВОЙ ЛАМПОЧКОЙ
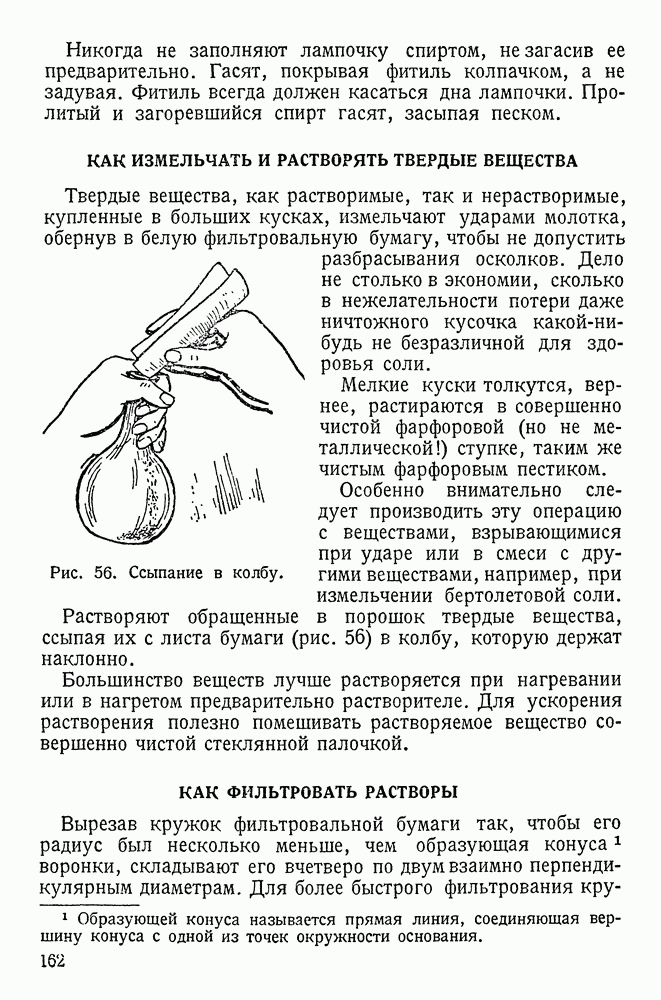
- КАК ИЗМЕЛЬЧАТЬ И РАСТВОРЯТЬ ТВЕРДЫЕ ВЕЩЕСТВА
- КАК ФИЛЬТРОВАТЬ РАСТВОРЫ
- КАК ОБРАЩАТЬСЯ С ОГНЕОПАСНЫМИ ВЕЩЕСТВАМИ
- Приложение II. ОБЩИЕ ПРАВИЛА
- ОБЩИЕ ПРАВИЛА ПРЕДОСТОРОЖНОСТИ
- Приложение III. ОСНОВНЫЕ ХИМИЧЕСКИЕ ЗАКОНЫ
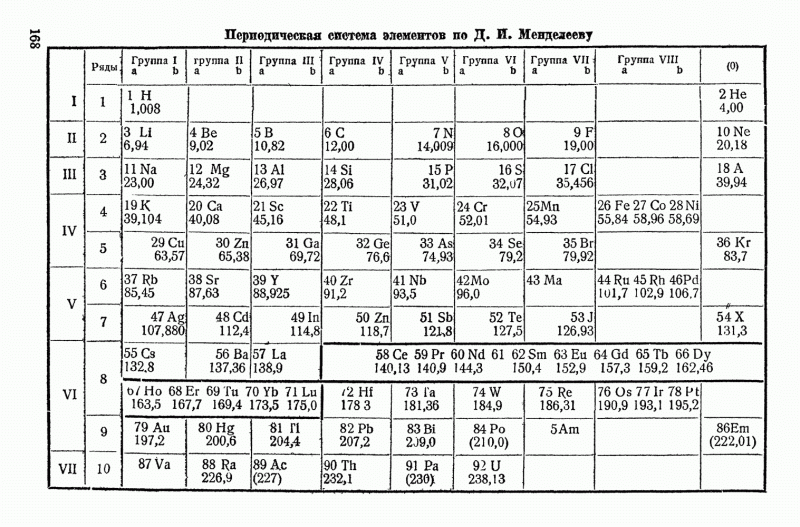
- ЗАКОН МЕНДЕЛЕЕВА
- СОВРЕМЕННЫЙ ВЗГЛЯД НА СТРОЕНИЕ ВЕЩЕСТВА
- ПЕРЕЧЕНЬ НАИБОЛЕЕ ПРИМЕНЯЕМЫХ В ТЕХНИКЕ ЭЛЕМЕНТОВ