| << Предыдущий параграф | Следующий параграф >> |
Пред.
След.
Макеты страниц
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
ДЛЯ СТУДЕНТОВ И ШКОЛЬНИКОВ ЕСТЬ
ZADANIA.TO
КАТАЛИЗАТОРЫ ХИМИЧЕСКИХ РЕАКЦИЙ
Не все реакции соединения идут так гладко, как показанное вам мною соединение хлористого водорода с аммиаком; во многих случаях вещества, могущие соединяться друг с другом, либо вовсе «не хотят» соединяться, либо соединяются крайне медленно.
В этих случаях прибегают к так называемым контактным реакциям (реакциям соприкосновения), происходящим при посредстве особых веществ — катализаторов, не входящих в состав конечного продукта реакции и остающихся по окончании реакции неизмененными.
Получение серной кислоты и является как раз примером таких контактных реакций.
Серная кислота получается соединением серного ангидрида с водой. Серный ангидрид получается, в свою очередь, присоединением атома кислорода к молекуле сернистого ангидрида.
С серой и сернистым ангидридом нам еще предстоит в дальнейшем познакомиться, а пока скажу, что сера, сгорая на воздухе, дает газообразный сернистый ангидрид, молекула которого состоит из одного атома серы и двух атомов кислорода. Серный же ангидрид — тело твердое, в молекуле которого имеется третий атом кислорода. Задача катализаторов — присоединить этот третий атом кислорода к молекуле сернистого ангидрида.
Решается она двояко: либо в свинцовую камеру вместе с сернистым ангидридом и парами воды вводят небольшое количество окислов азота, либо в камеру помещают губчатую платину. Первые отдают свой кислород сернистому ангидриду, а сами снова окисляются кислородом воздуха, вторая, сгущая на своей поверхности кислород, окисляет сернистый ангидрид в серный.
Сейчас в нашей химической промышленности широко пользуются катализаторами для получения весьма многих, преимущественно органических, соединений. Дореволюционная химическая промышленность использовать такие реакции не умела, да и самих производств, в которых они применяются, тогда не было.
| << Предыдущий параграф | Следующий параграф >> |
Оглавление
- ПРЕДИСЛОВИЕ К 7-МУ ИЗДАНИЮ
- Введение. ЧТО ТАКОЕ ХИМИЯ
- ДОСТИЖЕНИЯ ХИМИИ В СССР
- ГЛАВА I. ХИМИЧЕСКАЯ «МАГИЯ» (реакции соединения)
- ПОСЛУШНАЯ ПАПИРОСА
- ТРИ «КИТА» ХИМИИ
- САМАЯ НУЖНАЯ КИСЛОТА
- КАТАЛИЗАТОРЫ ХИМИЧЕСКИХ РЕАКЦИЙ
- ГЛАВА II. ПРЕВРАЩЕНИЕ ЖИДКОСТЕИ (реакции обменного разложения)
- МОЛОКО… ИЗ ВОДЫ
- ВОДА И ВИНО В ОДНОЙ БУТЫЛКЕ
- ПРЕВРАЩЕНИЕ ВОДЫ В ЧЕРНИЛА И ОБРАТНО
- МНИМАЯ ОШИБКА ФИЗИКОВ
- ВОДА — В МОЛОКО, МОЛОКО — В ВОДУ
- ПРЕВРАЩЕНИЕ ВОДЫ В «КРОВЬ»
- КАК ОДНОЙ КРАСКОЙ КРАСЯТ В РАЗНЫЕ ЦВЕТА
- СЕКРЕТ СТАРЫХ КРАСИЛЬЩИКОВ
- ЗАБЫТОЕ СЛОВО
- «КАНЦЕЛЯРСКОЕ СЕМЕЧКО»
- ХИМИЯ ОРГАНИЧЕСКАЯ И НЕОРГАНИЧЕСКАЯ
- ФАБРИКИ КРАСОК — ПРЕДПРИЯТИЯ ДАЛЕКО НЕ НЕВИННЫЕ
- ЧТО СЛАЩЕ САХАРА?
- ЗОЛОТО РАСТВОРИМОЕ И РАСТВОРЕННОЕ
- ЗОЛОТО В СССР
- ИСТОРИЧЕСКИЙ КУРЬЕЗ
- ГЛАВА III. ОПЫТЫ С ГАЗАМИ
- САМЫЙ ЛЕГКИЙ ГАЗ
- ЗАМАЗКА МЕНДЕЛЕЕВА
- ВОДА ИЗ ОГНЯ
- «ВЗРЫВ» АЭРОСТАТА
- ПЕРЕЛИВАНИЕ… ВВЕРХ
- МЫЛЬНЫЕ ПУЗЫРИ
- ЗАГАДОЧНЫЙ ФОНТАН
- ИЗ ЖЕЛТОГО В ЗЕЛЕНОЕ БЕЗ ПРИБАВЛЕНИЯ СИНЕГО
- ПОСЛЕДНИЙ ПЕРМАНЕНТНЫЙ ГАЗ
- ГЛАВА IV. ГАЗ РАЗНООБРАЗНОГО ПРИМЕНЕНИЯ
- ХЛОР И ФАРАДЕЙ
- ХЛОР, ЦВЕТЫ И ЦВЕТА
- ОКРАСКА ХЛОРОМ В СИНИЙ ЦВЕТ
- ОКРАСКА ХЛОРОМ В КРАСНЫЙ ЦВЕТ
- ЕЩЕ ОКРАСКА ХЛОРОМ
- ГОРЕНИЕ БЕЗ ВОЗДУХА
- САМОВОСПЛАМЕНЕНИЕ
- И НЕГОРЮЧЕЕ МОЖЕТ ГОРЕТЬ
- ДЫМОВАЯ ЗАВЕСА
- ФЕЙЕРВЕРК В СКЛЯНКЕ
- ХЛОР В МИРОВОЙ ВОЙНЕ
- ЕЩЕ СТРАШНЫЙ ГАЗ
- «СТРАШНЫЙ СПУТНИК НАШИХ ЖИЛИЩ»
- ГОЛУБОЙ И ВОДЯНОЙ ГАЗЫ
- ГАЗЫ ДЫХАНИЯ И ГОРЕНИЯ
- РЕАКЦИИ ЭКЗО- И ЭНДОТЕРМИЧЕСКИЕ
- ГАЗ, В КОТОРОМ ГОРИТ ЖЕЛЕЗО
- ГОРЯЩЕЕ ЖЕЛЕЗО
- ОШИБКА ЖЮЛЯ ВЕРНА
- ЖИВЫЕ МЕРТВЕЦЫ
- ХИМИЯ НЕБА
- КУДА ДЕЛСЯ КУСОЧЕК УГЛЯ?
- ГЛАВА V. «НЕЧТО НЕВИДИМОЕ» И ОПЫТЫ С НИМ
- «ТАИНСТВЕННЫЙ» ОПЫТ С ВЕСАМИ
- ПРИРОДА — АРХИТЕКТОР
- ПЛАВАЮЩИЕ ПУЗЫРИ
- ОТЧЕГО СТРЕЛЯЕТ ПУШКА
- ОЧИСТИТЬ ЯЙЦО, НЕ РАЗБИВ СКОРЛУПЫ
- НЫРЯЮЩЕЕ ЯЙЦО
- РАСТУЩЕЕ ЯЙЦО
- ЯЙЦО В ГРАФИНЕ
- ГЛАВА VI. ОПАСНЫЕ ГАЗЫ
- ХИМИЧЕСКИЕ МОТЫЛЬКИ
- ПОДВОДНАЯ ЛОДКА ИЗ КОРОБОЧКИ
- ВРЕДНЫЕ ГАЗЫ, ПРИНОСЯЩИЕ ПОЛЬЗУ
- ДАР ВУЛКАНОВ
- ОПЫТЫ С СЕРНИСТЫМ ГАЗОМ
- ГАШЕНИЕ ОГНЯ ГОРЯЩЕЙ СЕРОЙ
- ЗЕЛЕНЫЙ ЛЕВ
- БЕЛЫЙ СНЕГИРЬ
- ГАЗ ТУХЛЫХ ЯИЦ
- КОЕ-ЧТО О ТРЕХЦВЕТНЫХ КОШКАХ
- ПРЕВРАЩЕНИЕ БЕЛОЙ КОШКИ В ЧЕРНУЮ
- ОТЧЕГО ТЕМНЕЮТ КАРТИНЫ
- НЕМНОГО ИСТОРИИ
- ХИМИЧЕСКОЕ ХЛЕБОПЕЧЕНИЕ
- ДОМАШНИЙ ОГНЕГАСИТЕЛЬ
- ОПАСНОСТЬ БЕЗОПАСНЫХ ВЕЩЕСТВ
- ВЗРЫВЧАТЫЕ ВЕЩЕСТВА
- КТО ИЗОБРЕЛ ПОРОХ?
- УКРОЩЕННЫЙ НИТРОГЛИЦЕРИН
- ПИКРИНОВАЯ КИСЛОТА И ТРОТИЛ
- МИРНОЕ ПРИМЕНЕНИЕ ВЗРЫВЧАТЫХ ВЕЩЕСТВ
- СИНИЙ ФОНТАН ИЗ КРАСНОЙ ВОДЫ
- КРАСНЫЙ ФОНТАН ИЗ СИНЕЙ ВОДЫ
- КУРЯЩИЙСЯ МЫЛЬНЫЙ ПУЗЫРЬ
- КОЕ-ЧТО О ВОЕННОЙ ХИМИИ
- ГЛАВА VII. БЕЗОПАСНАЯ ПИРОТЕХНИКА
- ОГОНЬ-ХУДОЖНИК
- БУМАГА, ГОРЯЩАЯ ЦВЕТНЫМ ПЛАМЕНЕМ
- ЦВЕТНОЕ ПЛАМЯ
- ПОДВОДНЫЙ ОГОНЬ
- «БОЛОНСКИЙ ФОСФОР»
- ГЛАВА VIII. КОЕ-ЧТО О КРИСТАЛЛАХ
- ЦВЕТНОЙ РАСТВОР БЕСЦВЕТНОГО ВЕЩЕСТВА
- МЕДЛЕННАЯ КРИСТАЛЛИЗАЦИЯ
- МГНОВЕННАЯ КРИСТАЛЛИЗАЦИЯ
- О СОЛЯХ В ПРИРОДЕ И В ТЕХНИКЕ
- ЗИМНИЙ САД… ЛЕТОМ
- САД ХИМИКА
- «САТУРНОВО ДЕРЕВО»
- КРИСТАЛЛИЗАЦИЯ МЕТАЛЛОВ
- ГЛАВА IX. НЕМНОГО ЭЛЕКТРОХИМИИ
- РАЗЛОЖЕНИЕ ВОДЫ
- ДВУХЦВЕТНАЯ ЖИДКОСТЬ В ОДНОМ СОСУДЕ
- РАФИНИРОВКА МЕДИ
- ГАЛЬВАНОСТЕГИЯ
- УПРОЩЕННАЯ ГАЛЬВАНОПЛАСТИКА
- МЕТАЛЛИЗАЦИЯ
- АЛЮМИНИЕВАЯ КАСТРЮЛЯ И ДНЕПРОСТРОЙ
- ГЛАВА X. ХИМИЧЕСКИЕ РАЗВЛЕЧЕНИЯ БЕЗ ПРИБОРОВ
- МГНОВЕННАЯ ФОТОГРАФИЯ, ДА ЕЩЕ ЦВЕТНАЯ
- СЕКРЕТНЫЕ ЧЕРНИЛА
- ПОЯВЛЯЮЩИЕСЯ И ИСЧЕЗАЮЩИЕ ЧЕРНИЛА
- МАГИЧЕСКИЕ КАРТИНКИ
- БУКЕТ ЦВЕТОВ — УКАЗАТЕЛЬ ПОГОДЫ
- ЖИВОПИСЬ ПО ДЕРЕВУ
- КРАСНЕЮЩИЕ ФИГУРКИ
- ЗЕЛЕНЫЕ КОЛОКОЛЬЧИКИ
- ПРЕВРАЩЕНИЕ БЕЛОЙ РОЗЫ В КРАСНУЮ
- СИНИЙ ХЛЕБ
- ГЛАВА XI. ХИМИЧЕСКИЕ ШУТКИ
- КАК СВАРИТЬ ЯЙЦО БЕЗ ОГНЯ
- РАССКАЗ О «НЕБЛАГОНРАВНОМ МАЛЬЧИКЕ»
- КЛЮЧЕВАЯ ВОДА В ЛЕТНИЙ ЗНОЙНЫЙ ДЕНЬ
- ЧТО НАПИСАНО ПЕРОМ…
- ЗАКЛЮЧЕНИЕ
- Приложение I. БЕЗ ЧЕГО НЕЛЬЗЯ ДЕЛАТЬ ОПЫТЫ
- КАК ГНУТЬ И ТЯНУТЬ СТЕКЛЯННЫЕ ТРУБКИ
- КАК НАГРЕВАТЬ, КИПЯТИТЬ И ВЫПАРИВАТЬ ЖИДКОСТИ
- КАК ОБРАЩАТЬСЯ СО СПИРТОВОЙ ЛАМПОЧКОЙ
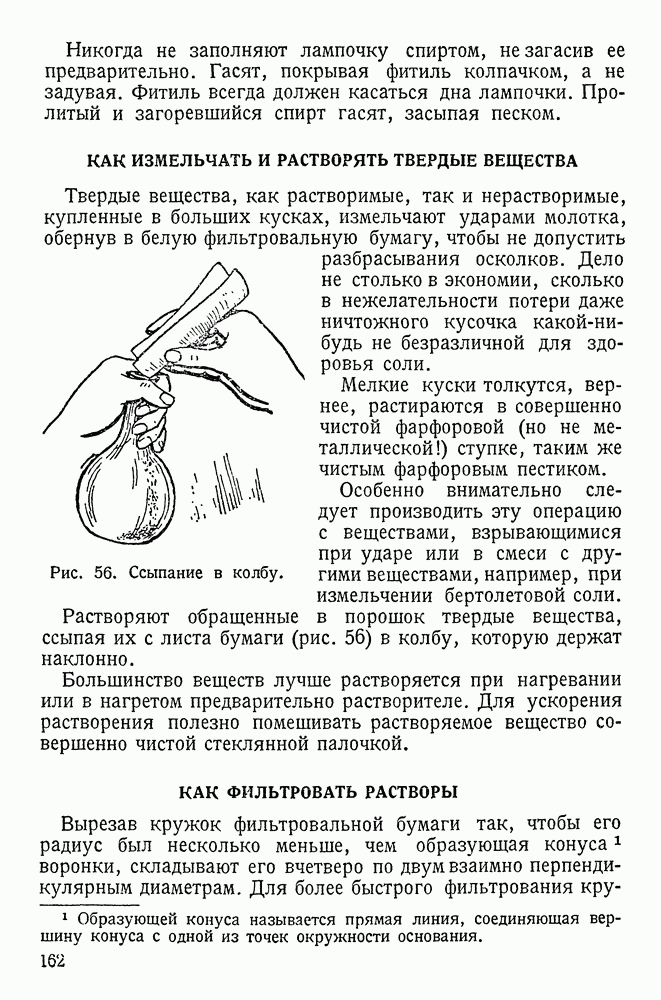
- КАК ИЗМЕЛЬЧАТЬ И РАСТВОРЯТЬ ТВЕРДЫЕ ВЕЩЕСТВА
- КАК ФИЛЬТРОВАТЬ РАСТВОРЫ
- КАК ОБРАЩАТЬСЯ С ОГНЕОПАСНЫМИ ВЕЩЕСТВАМИ
- Приложение II. ОБЩИЕ ПРАВИЛА
- ОБЩИЕ ПРАВИЛА ПРЕДОСТОРОЖНОСТИ
- Приложение III. ОСНОВНЫЕ ХИМИЧЕСКИЕ ЗАКОНЫ
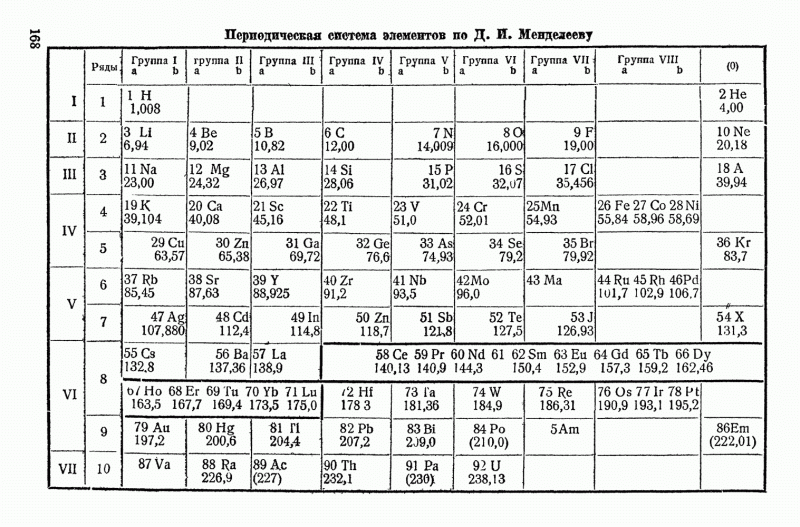
- ЗАКОН МЕНДЕЛЕЕВА
- СОВРЕМЕННЫЙ ВЗГЛЯД НА СТРОЕНИЕ ВЕЩЕСТВА
- ПЕРЕЧЕНЬ НАИБОЛЕЕ ПРИМЕНЯЕМЫХ В ТЕХНИКЕ ЭЛЕМЕНТОВ