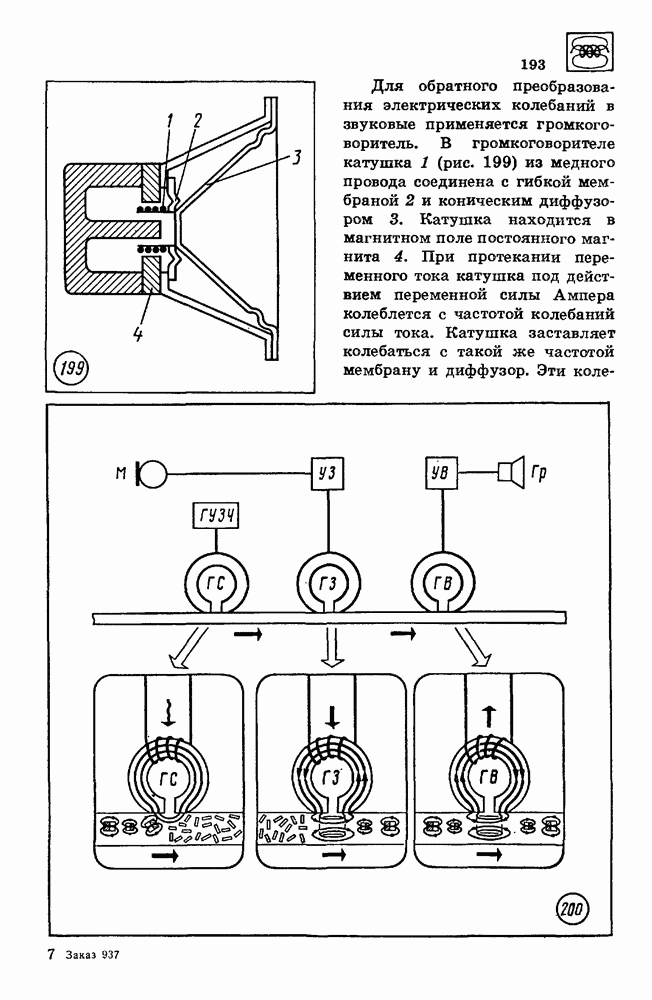
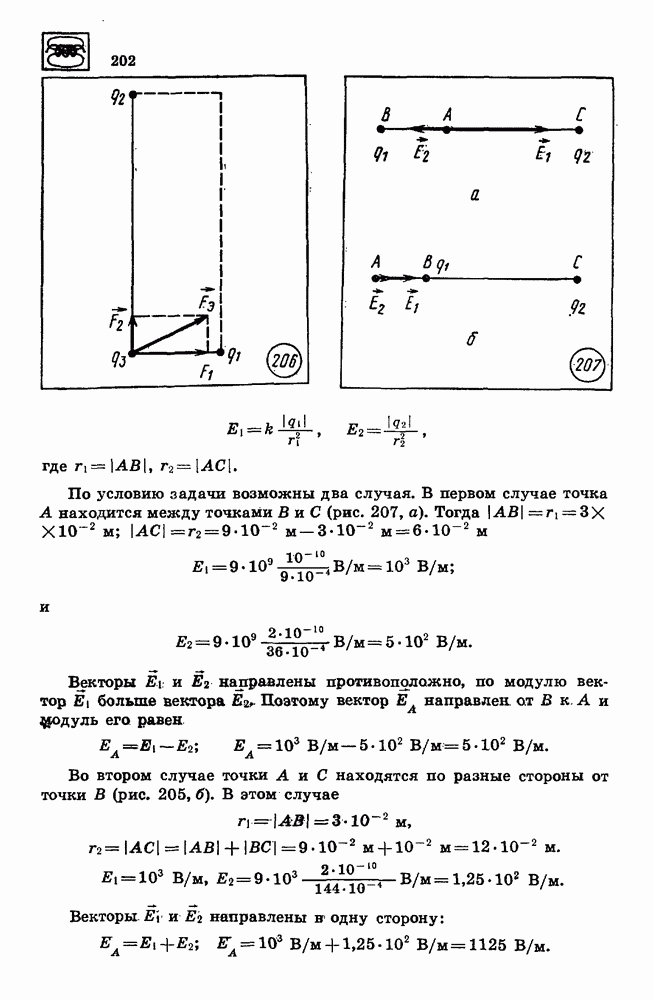
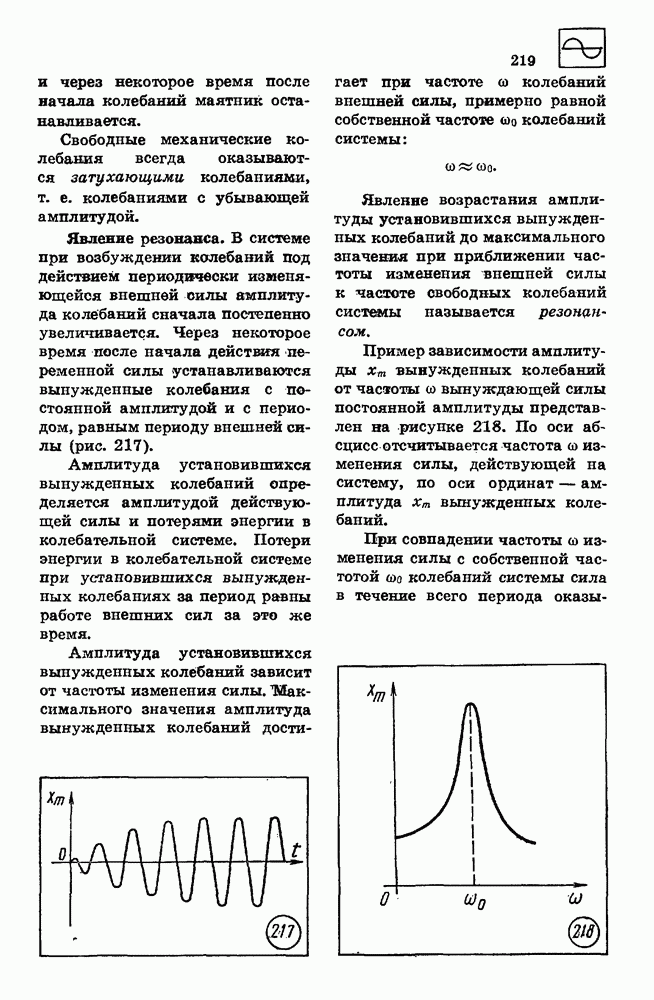
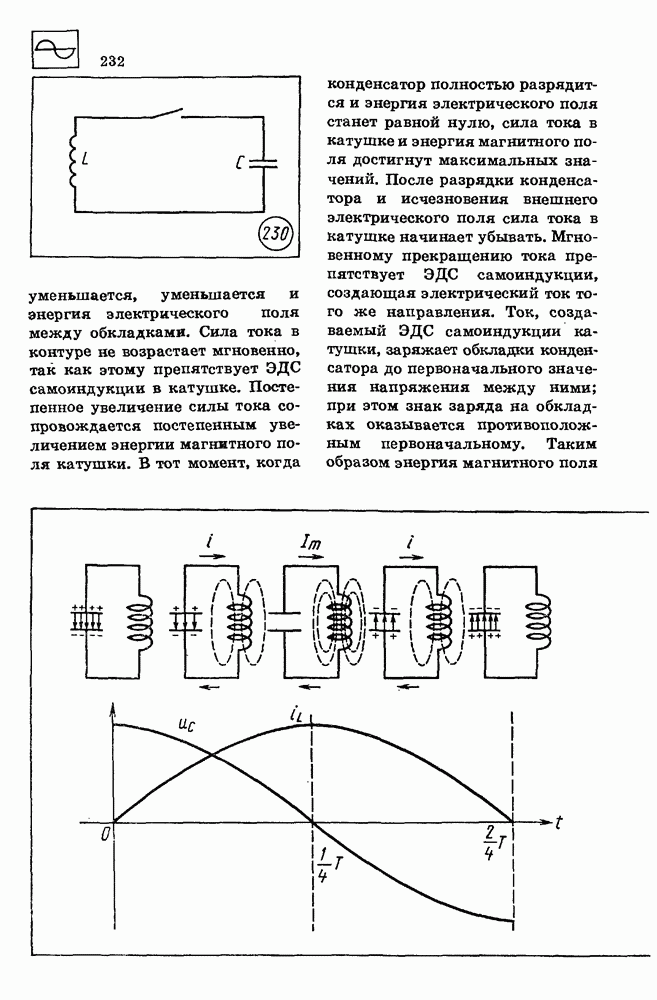
| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
28. ИСПАРЕНИЕ И КОНДЕНСАЦИЯ
Испарение.
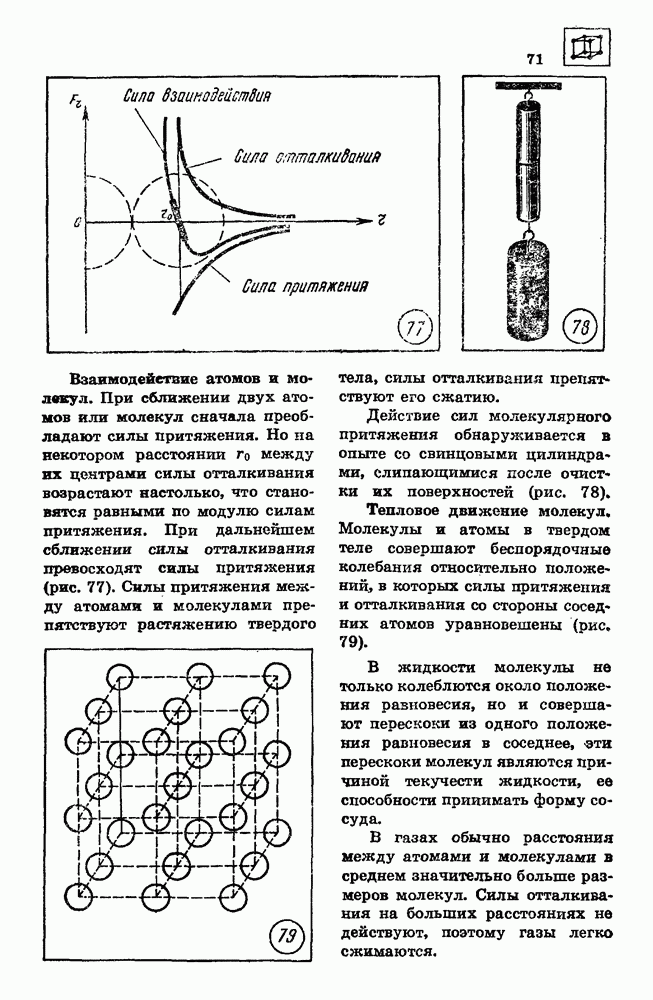
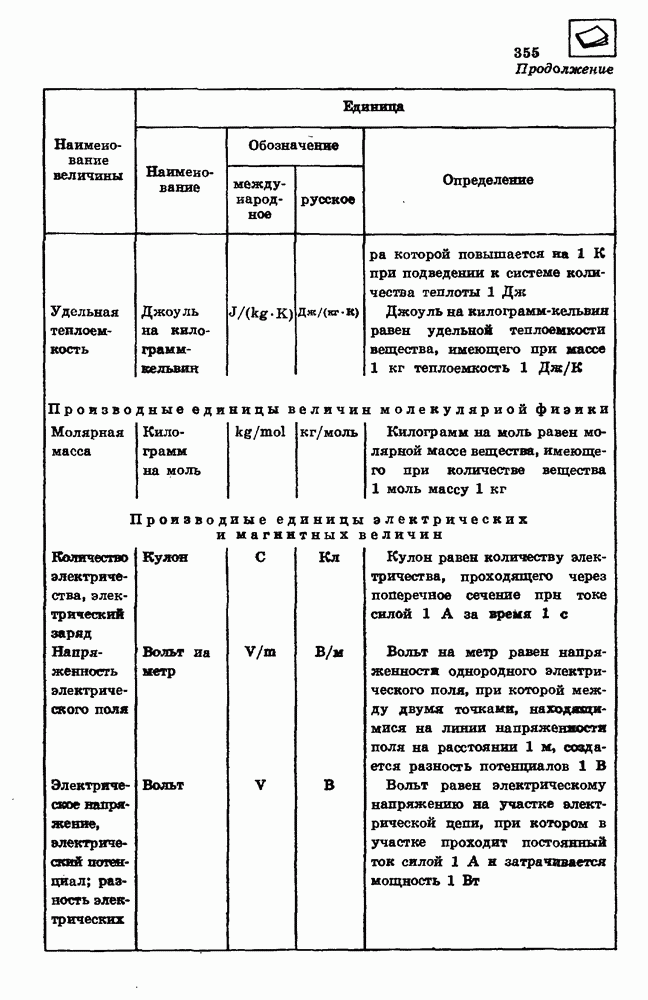
Неравномерное распределение кинетической энергии теплового движения молекул приводит к тому, что при любой температуре кинетическая энергия некоторых молекул жидкости или твердого тела может превышать потенциальную энергию их связи с остальными молекулами. Испарение — это процесс, при котором с поверхности жидкости или твердого тела вылетают молекулы, кинетическая энергия которых превышает потенциальную энергию взаимодействия молекул. Испарение сопровождается охлаждением жидкости.
Насыщенный и ненасыщенный пар.
Испарение жидкости в закрытом сосуде при неизменной температуре приводит к постепенному увеличению концентрации молекул испаряющегося вещества в газообразном состоянии. Через некоторое время после начала процесса испарения концентрация вещества в газообразном состоянии достигает такого значения, при котором число молекул, возвращающихся в жидкость в единицу времени, становится равным числу молекул, покидающих поверхность жидкости за то же время. Устанавливается динамическое равновесие между процессами испарения и конденсации вещества.
Вещество в газообразном состоянии, находящееся в динамическом равновесии с жидкостью, называется насыщенным паром. Пар, находящийся при давлении ниже давления насыщенного пара, называется ненасыщенным.
При сжатии насыщенного пара концентрация молекул пара увеличивается, равновесие между процессами испарения и конденсации нарушается и часть пара превращается в жидкость. При расширении насыщенного пара концентрация его молекул уменьшается и часть жидкости
превращается в пар. Таким образом, концентрация насыщенного пара остается постоянной независимо от объема. Так как давление газа пропорционально концентрации и температуре  , давление насыщенного пара при постоянной температуре не зависит от объема.
, давление насыщенного пара при постоянной температуре не зависит от объема.
Интенсивность процесса испарения увеличивается с возрастанием температуры жидкости. Поэтому динамическое равновесие мёжду испарением и конденсацией при повышении температуры устанавливается при больших концентрациях молекул газа.
Давление идеального газа при постоянной концентрации молекул возрастает прямо пропорционально абсолютной температуре. Так как в насыщенном паре при возрастании температуры концентрация молекул увеличивается, давление насыщенного пара с повышением температуры возрастает быстрее, чем давление идеального газа с постоянной концентрацией молекул (рис. 95).
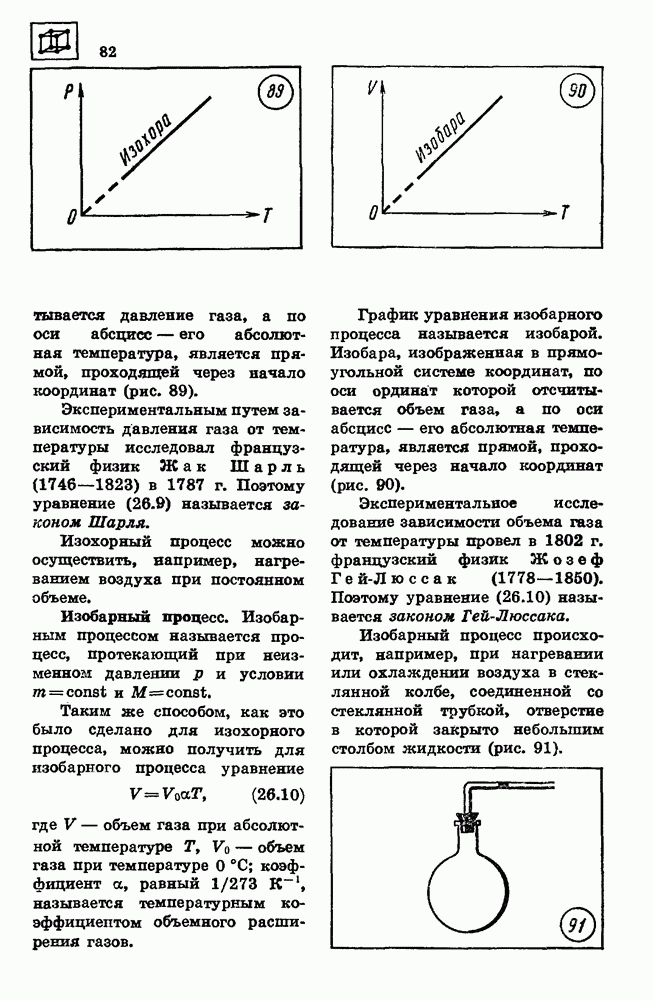
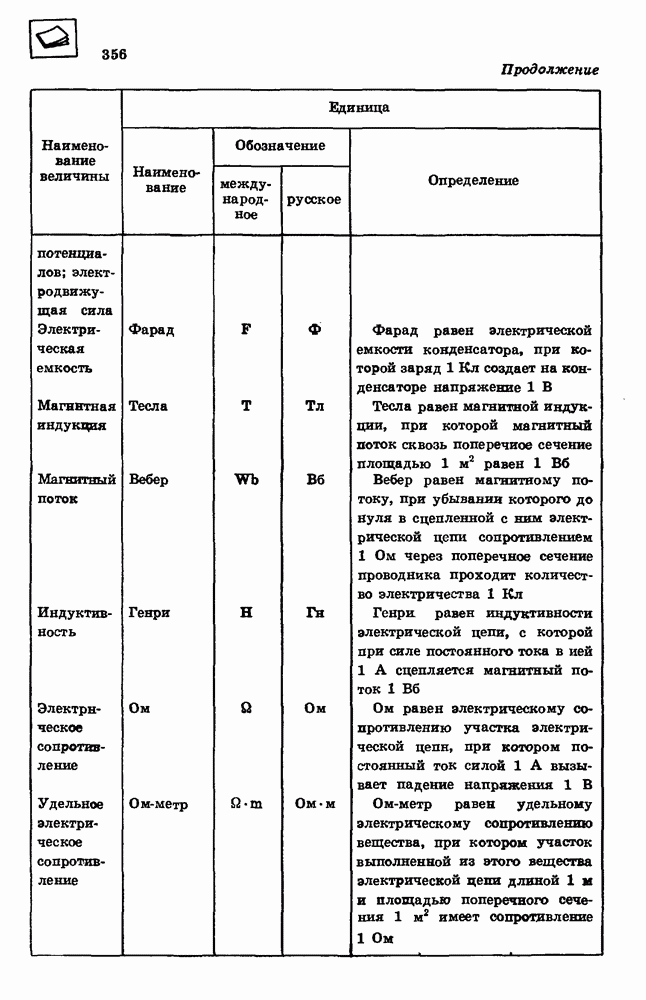
Кипение. Зависимость температуры кипения от давления.
Процесс испарения может происходить не только с поверхности жидкости, но и внутри жидкости. Пузырьки пара внутри жидкости расширяются и всплывают на поверхность, если давление насыщенного пара равно внешнему давлению или превышает его. Этот процесс называется кипением.
При температуре 100 °С давление насыщенного водяного пара равно нормальному атмосферному давлению, поэтому при нормальном давлении кипение воды происходит при 100 °С. При температуре 80 °С давление насыщенного пара примерно в два раза меньше нормального атмосферного давления. Поэтому вода кипит при 80 °С, если давление над ней уменьшить до 0,5 нормального атмосферного давления (рис. 96).
При понижении внешнего давления температура кипения жидкости понижается, при повышении давления температура кипения повышается.


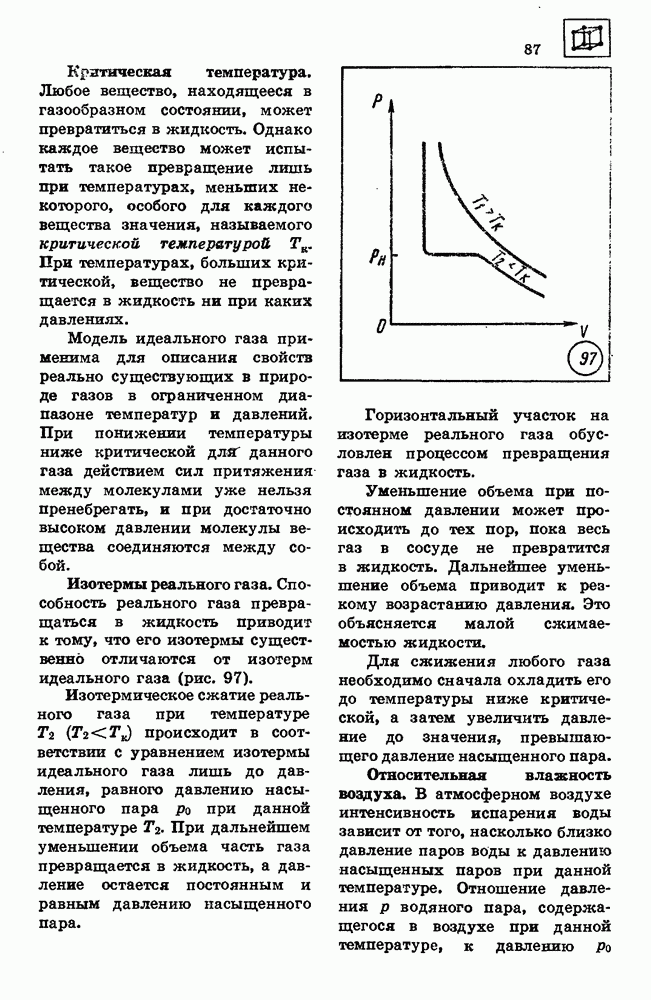
Критическая температура.
Любое вещество, находящееся в газообразном состоянии, может превратиться в жидкость. Однако каждое вещество может испытать такое превращение лишь при температурах, меньших некоторого, особого для каждого вещества значения, называемого критической температурой Тк. При температурах, больших критической, вещество не превращается в жидкость ни при каких давлениях.
Модель идеального газа применима для описания свойств реально существующих в природе газов в ограниченном диапазоне температур и давлений. При понижении температуры ниже критической для данного газа действием сил притяжения между молекулами уже нельзя пренебрегать, и при достаточно высоком давлении молекулы вещества соединяются между собой.
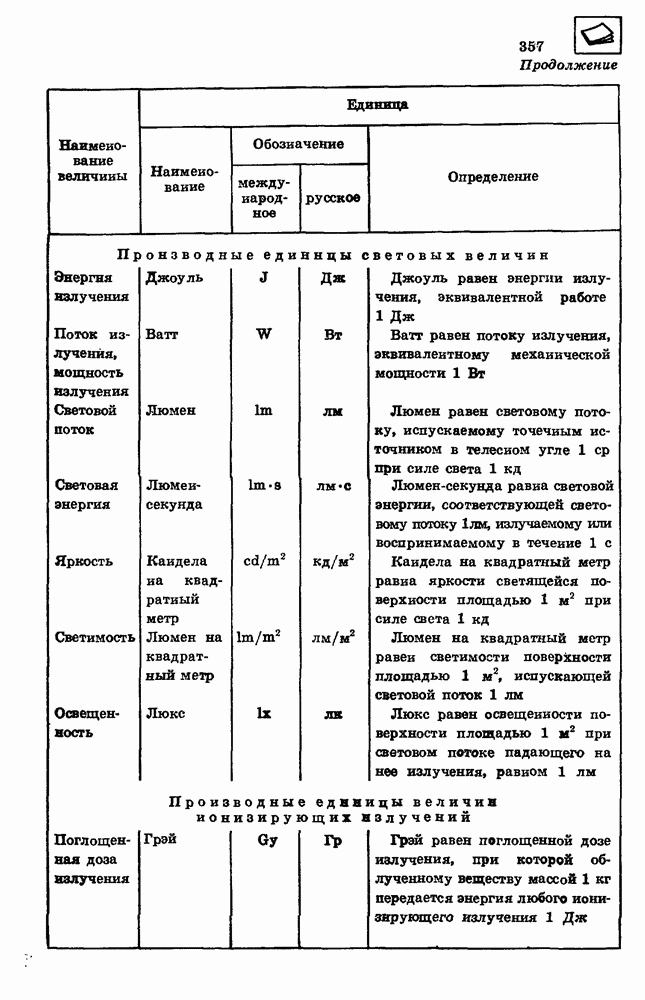
Изотермы реального газа.
Способность реального газа превращаться в жидкость приводит к тому, что его изотермы существенно отличаются от изотерм идеального газа (рис. 97).

Изотермическое сжатие реального газа при температуре  происходит в соответствии с уравнением изотермы идеального газа лишь до давления, равного давлению насыщенного пара
происходит в соответствии с уравнением изотермы идеального газа лишь до давления, равного давлению насыщенного пара  при данной температуре
при данной температуре  При дальнейшем уменьшении объема часть газа превращается в жидкость, а давление остается постоянным и равным давлению насыщенного пара.
При дальнейшем уменьшении объема часть газа превращается в жидкость, а давление остается постоянным и равным давлению насыщенного пара.
Горизонтальный участок на изотерме реального газа обусловлен процессом превращения газа в жидкость.
Уменьшение объема при постоянном давлении может происходить до тех пор, пока весь газ в сосуде не превратится в жидкость. Дальнейшее уменьшение объема приводит к резкому возрастанию давления. Это объясняется малой сжимаемостью жидкости.
Для сжижения любого газа необходимо сначала охладить его до температуры ниже критической, а затем увеличить давление до значения, превышающего давление насыщенного пара.
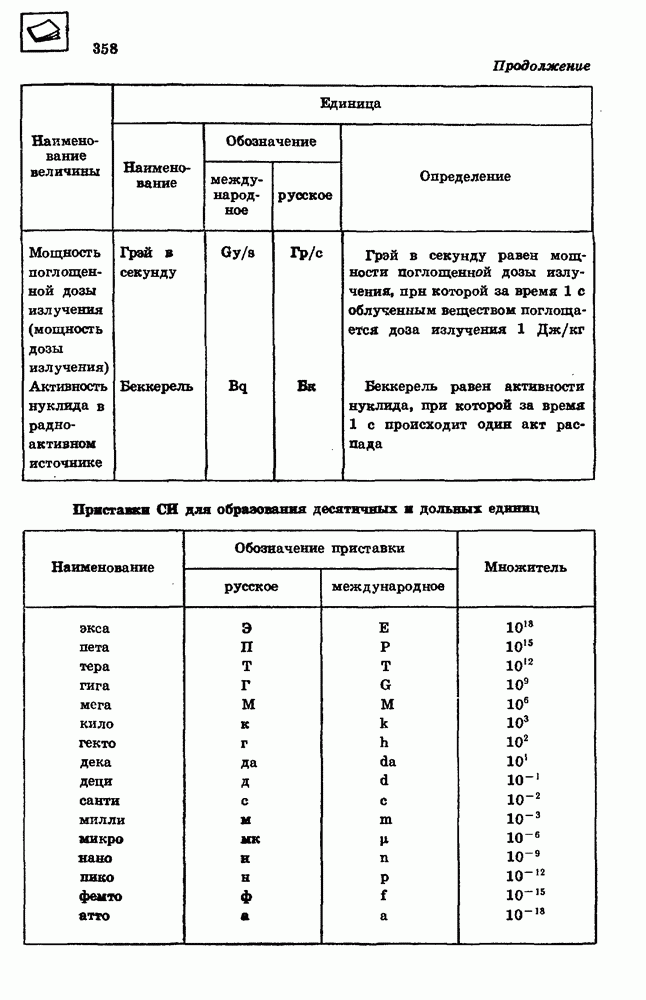
Относительная влажность воздуха.
В атмосферном воздухе интенсивность испарения воды зависит от того, насколько близко давление паров воды к давлению насыщенных паров при данной температуре. Отношение давления  водяного пара, содержащегося в воздухе при данной температуре, к давлению
водяного пара, содержащегося в воздухе при данной температуре, к давлению 
насыщенного водяного пара при той же температуре, выраженное в процентах, называется относительной влажностью воздуха:

При относительной влажности, равной 100%, устанавливается динамическое равновесие между процессами испарения и конденсации воды, в результате количество воды не уменьшается и не увеличивается.
Точка росы.
Так как давление насыщенного пара тем меньше, чем ниже температура, то при охлаждении воздуха находящийся в нем водяной пар при некоторой температуре становится насыщенным. Температура  при которой находящийся в воздухе водяной пар становится насыщенным, называется точкой росы.
при которой находящийся в воздухе водяной пар становится насыщенным, называется точкой росы.
По точке росы можно найти давление водяного пара в воздухе  Оно равно давлению насыщенного пара при температуре 11, равной точке росы. По значениям давления пара
Оно равно давлению насыщенного пара при температуре 11, равной точке росы. По значениям давления пара  и давления
и давления  насыщенного водяного пара при данной температуре можно определить относительную влажность воздуха (28.1).
насыщенного водяного пара при данной температуре можно определить относительную влажность воздуха (28.1).
| << Предыдущий параграф | Следующий параграф >> |
- 1. МЕХАНИЧЕСКОЕ ДВИЖЕНИЕ
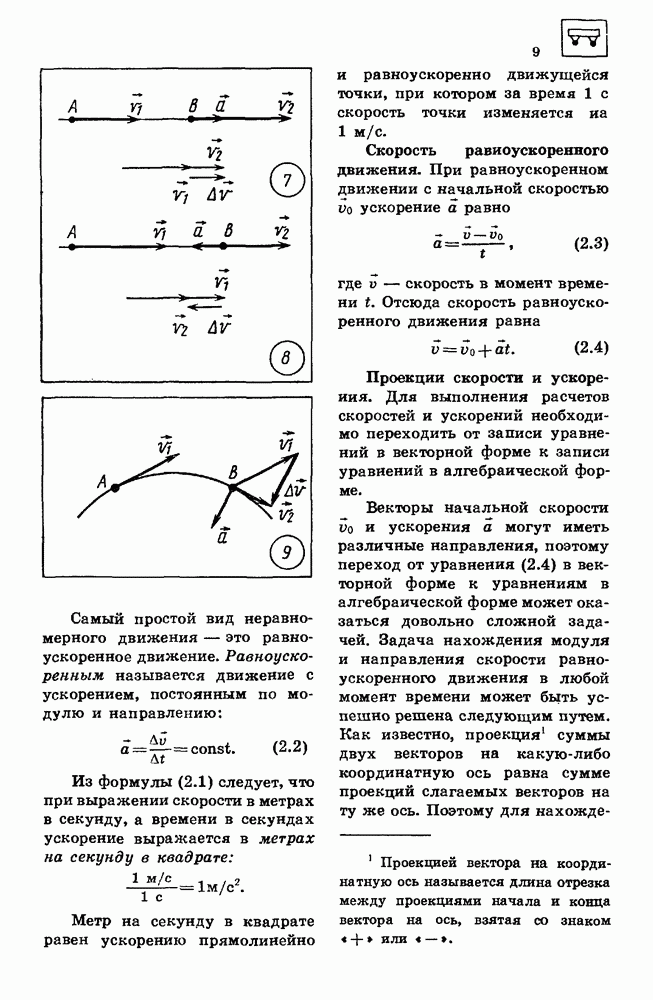
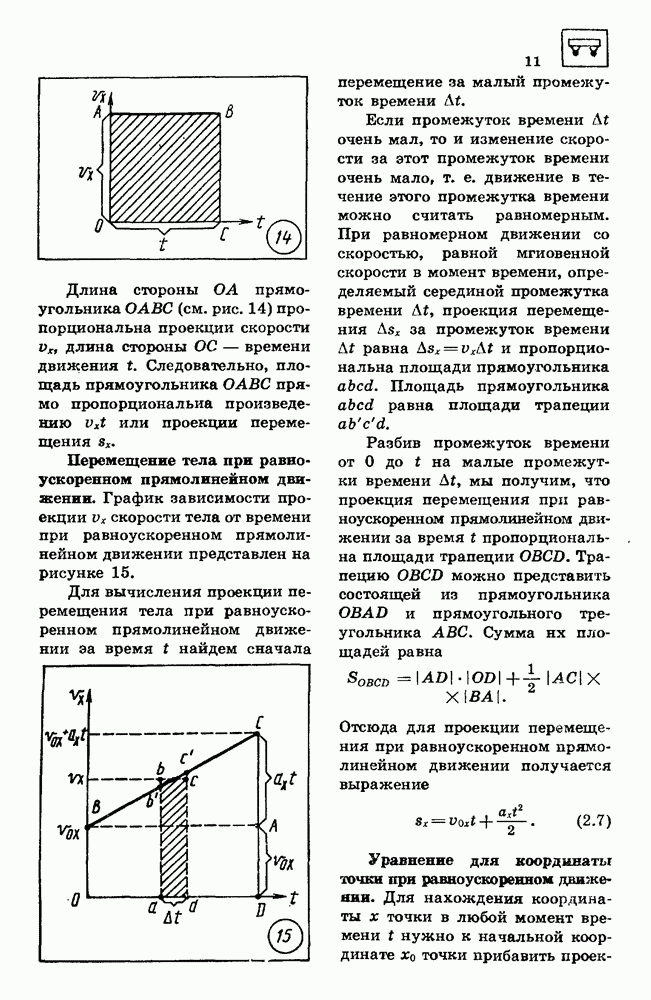
- 2. РАВНОУСКОРЕННОЕ ДВИЖЕНИЕ
- 3. РАВНОМЕРНОЕ ДВИЖЕНИЕ ПО ОКРУЖНОСТИ
- 4. ПЕРВЫЙ ЗАКОН НЬЮТОНА
- 5. МАССА ТЕЛА
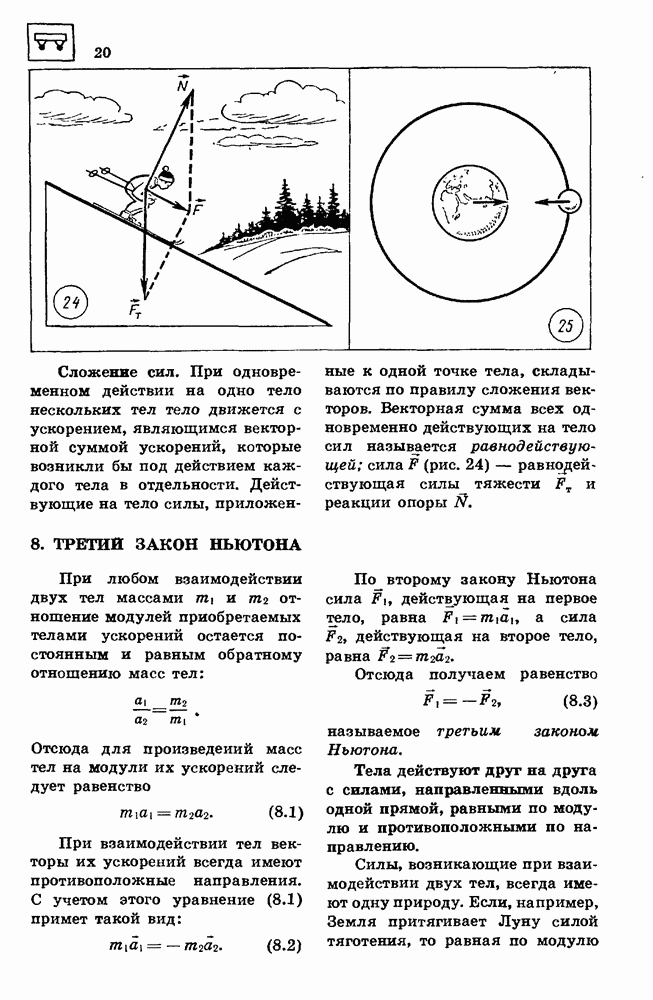
- 6. СИЛА
- 7. ВТОРОЙ ЗАКОН НЬЮТОНА
- 8. ТРЕТИЙ ЗАКОН НЬЮТОНА
- 9. ЗАКОН ВСЕМИРНОГО ТЯГОТЕНИЯ
- 10. ВЕС И НЕВЕСОМОСТЬ
- 11. ДВИЖЕНИЕ ТЕЛ ПОД ДЕЙСТВИЕМ СИЛЫ ТЯЖЕСТИ
- 12. СИЛА УПРУГОСТИ
- 13. СИЛЫ ТРЕНИЯ
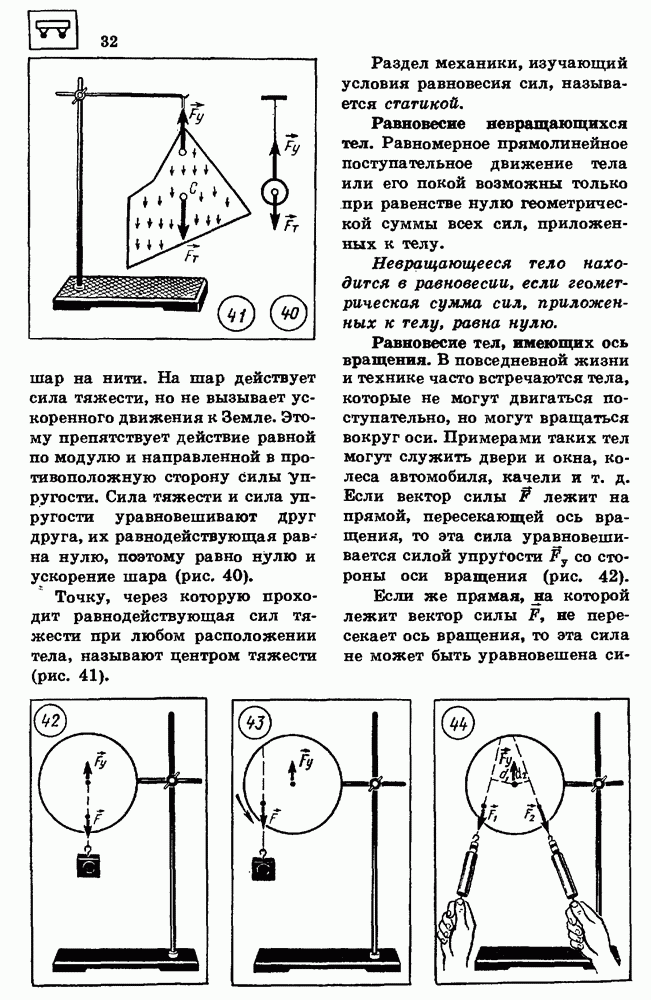
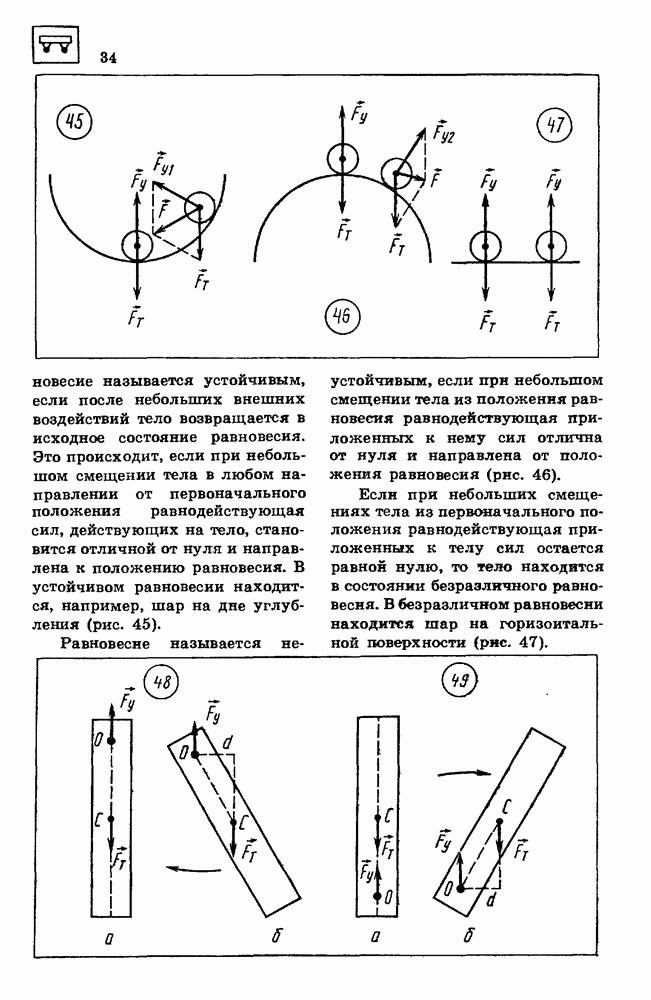
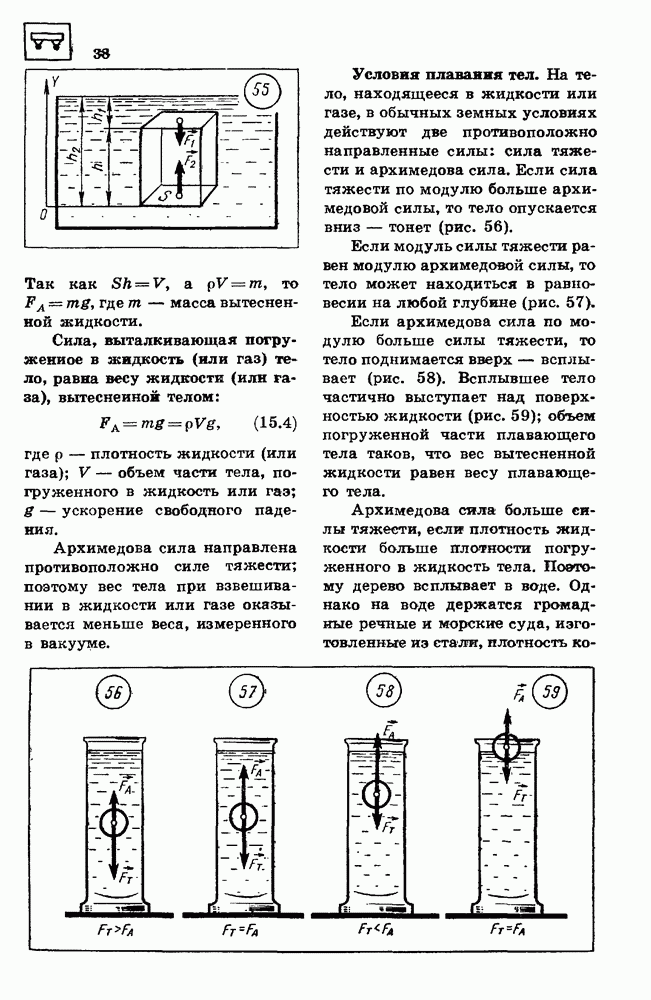
- 14. УСЛОВИЯ РАВНОВЕСИЯ ТЕЛ
- 15. ЭЛЕМЕНТЫ ГИДРОСТАТИКИ
- 16. ЗАКОН СОХРАНЕНИЯ ИМПУЛЬСА
- 17. РЕАКТИВНОЕ ДВИЖЕНИЕ
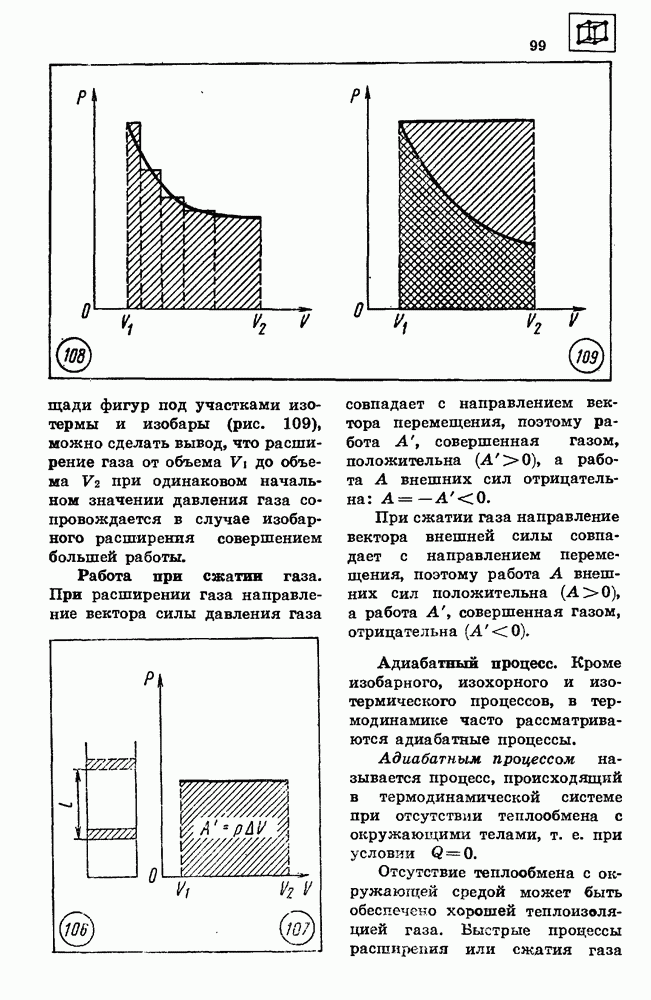
- 18. МЕХАНИЧЕСКАЯ РАБОТА
- 19. КИНЕТИЧЕСКАЯ ЭНЕРГИЯ
- 20. ПОТЕНЦИАЛЬНАЯ ЭНЕРГИЯ
- 21. ЗАКОН СОХРАНЕНИЯ ЭНЕРГИИ В МЕХАНИЧЕСКИХ ПРОЦЕССАХ
- ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
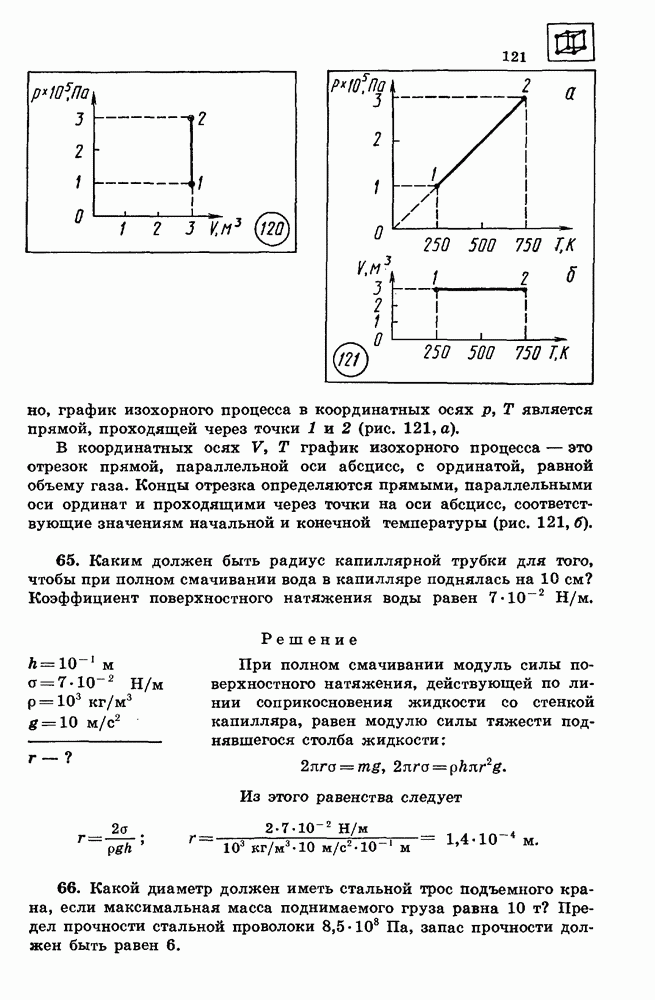
- 22. ОСНОВНЫЕ ПОЛОЖЕНИЯ МОЛЕКУЛЯРНО-КИНЕТИЧЕСКОИ ТЕОРИИ И ИХ ОПЫТНОЕ ОБОСНОВАНИЕ
- 23. МАССА МОЛЕКУЛ
- 24. ОСНОВНОЕ УРАВНЕНИЕ МОЛЕКУЛЯРНО-КИНЕТИЧЕСКОИ ТЕОРИИ ИДЕАЛЬНОГО ГАЗА
- 25. ТЕМПЕРАТУРА — МЕРА СРЕДНЕЙ КИНЕТИЧЕСКОЙ ЭНЕРГИИ МОЛЕКУЛ
- 28. УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗА
- 27. СВОЙСТВА ЖИДКОСТЕЙ
- 28. ИСПАРЕНИЕ И КОНДЕНСАЦИЯ
- 29. КРИСТАЛЛИЧЕСКИЕ И АМОРФНЫЕ ТЕЛА
- 30. МЕХАНИЧЕСКИЕ СВОЙСТВА ТВЕРДЫХ ЦЕЛ
- 31. ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ
- 32. КОЛИЧЕСТВО ТЕПЛОТЫ
- 33. РАБОТА ПРИ ИЗМЕНЕНИИ ОБЪЕМА ГАЗА
- 34. ПРИНЦИПЫ ДЕЙСТВИЯ ТЕПЛОВЫХ ДБИГАТЕЛЕЙ
- 35. ТЕПЛОВЫЕ МАШИНЫ
- ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
- 36. ЗАКОН СОХРАНЕНИЯ ЭЛЕКТРИЧЕСКОГО ЗАРЯДА
- 37. ЗАКОН КУЛОНА
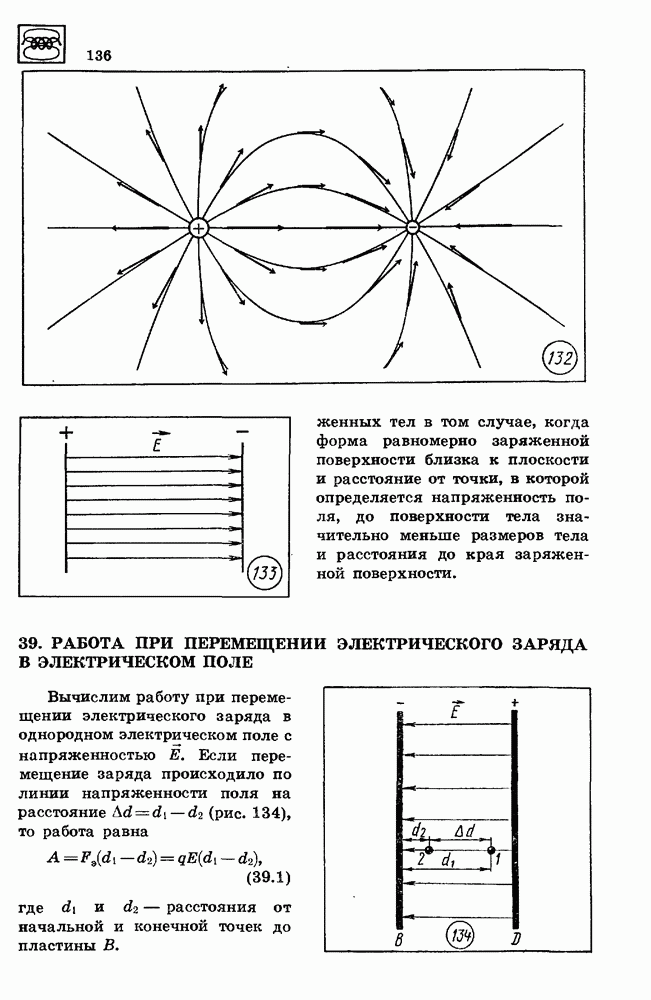
- 38. ЭЛЕКТРИЧЕСКОЕ ПОЛЕ
- 39. РАБОТА ПРИ ПЕРЕМЕЩЕНИИ ЭЛЕКТРИЧЕСКОГО ЗАРЯДА В ЭЛЕКТРИЧЕСКОМ ПОЛЕ
- 40. ПОТЕНЦИАЛ
- 41. ВЕЩЕСТВО В ЭЛЕКТРИЧЕСКОМ ПОЛЕ
- 42. ЭЛЕКТРОЕМКОСТЬ
- 43. ЗАКОН ОМА
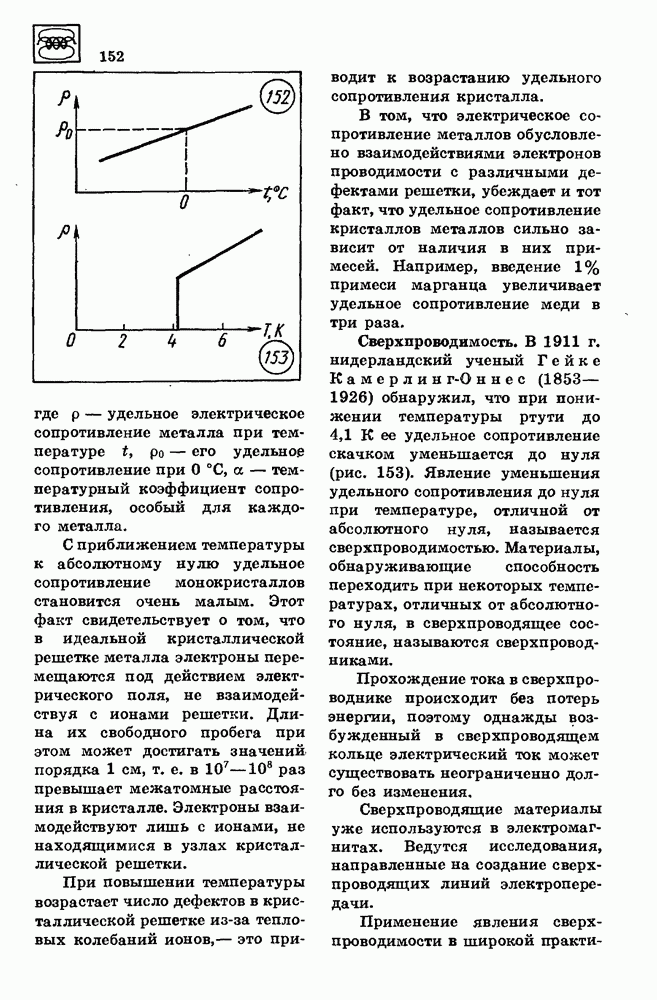
- 44. ЭЛЕКТРИЧЕСКИЙ ТОК В МЕТАЛЛАХ
- 45. ЭЛЕКТРИЧЕСКИЙ ТОК В ПОЛУПРОВОДНИКАХ
- 46. ПОЛУПРОВОДНИКОВЫЕ ПРИБОРЫ
- 47. ЭЛЕКТРИЧЕСКИЙ ТОК В ЭЛЕКТРОЛИТАХ
- 48. ОТКРЫТИЕ ЭЛЕКТРОНА
- 49. ЭЛЕКТРИЧЕСКИЙ ТОК В ГАЗАХ
- 50. ЭЛЕКТРИЧЕСКИИ ТОК В ВАКУУМЕ
- 51. МАГНИТНОЕ ПОЛЕ
- 52. СИЛА ЛОРЕНЦА
- 53. ВЕЩЕСТВО В МАГНИТНОМ ПОЛЕ
- 54. ЭЛЕКТРОМАГНИТНАЯ ИНДУКЦИЯ
- 55. САМОИНДУКЦИЯ
- 56. МАГНИТНАЯ ЗАПИСЬ ИНФОРМАЦИИ
- 57. МАШИНА ПОСТОЯННОГО ТОКА
- 58. ЭЛЕКТРОИЗМЕРИТЕЛЬНЫЕ ПРИБОРЫ
- ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
- 59. МЕХАНИЧЕСКИЕ КОЛЕБАНИЯ
- 60. ГАРМОНИЧЕСКИЕ КОЛЕБАНИЯ
- 61. ПРЕВРАЩЕНИЯ ЭНЕРГИИ ПРИ МЕХАНИЧЕСКИХ КОЛЕБАНИЯХ
- 62. РАСПРОСТРАНЕНИЕ КОЛЕБАНИИ В УПРУГОЙ СРЕДЕ
- 63. ЗВУКОВЫЕ ВОЛНЫ
- 64. ОТРАЖЕНИЕ И ПРЕЛОМЛЕНИЕ ВОЛН
- 65. ИНТЕРФЕРЕНЦИЯ, ДИФРАКЦИЯ И ПОЛЯРИЗАЦИЯ ВОЛН
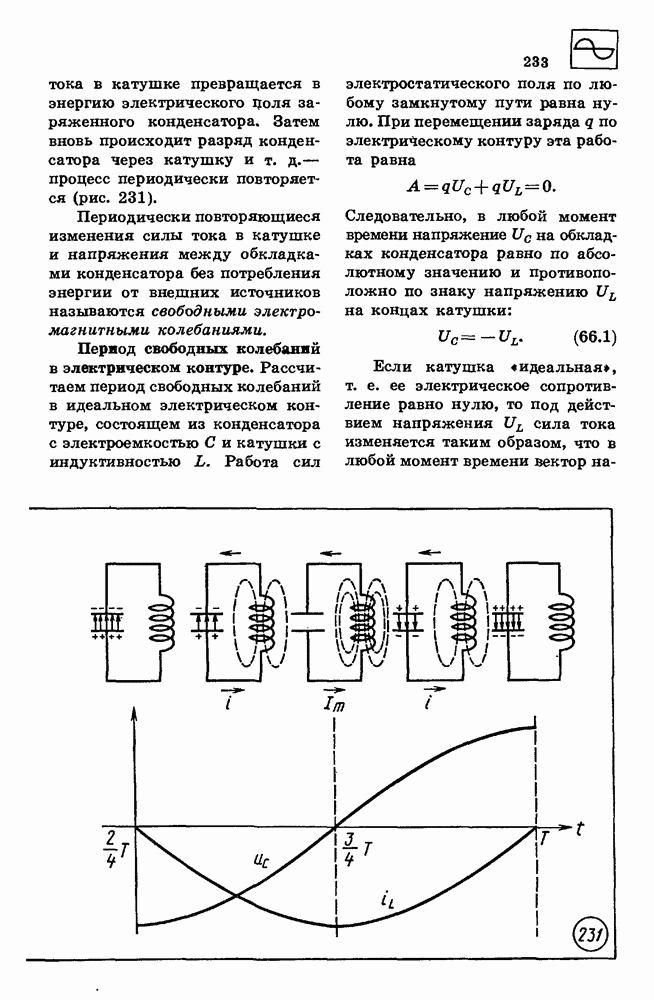
- 66. СВОБОДНЫЕ ЭЛЕКТРОМАГНИТНЫЕ КОЛЕБАНИЯ
- 67. АВТОКОЛЕБАТЕЛЬНЫЙ ГЕНЕРАТОР НЕЗАТУХАЮЩИХ ЭЛЕКТРОМАГНИТНЫХ КОЛЕБАНИИ
- 68. ПЕРЕМЕННЫЙ ЭЛЕКТРИЧЕСКИЙ ТОК
- 69. АКТИВНОЕ СОПРОТИВЛЕНИЕ В ЦЕПИ ПЕРЕМЕННОГО ТОКА
- 70. ИНДУКТИВНОСТЬ И ЕМКОСТЬ В ЦКТТИ ПЕРЕМЕННОГО ТОКА
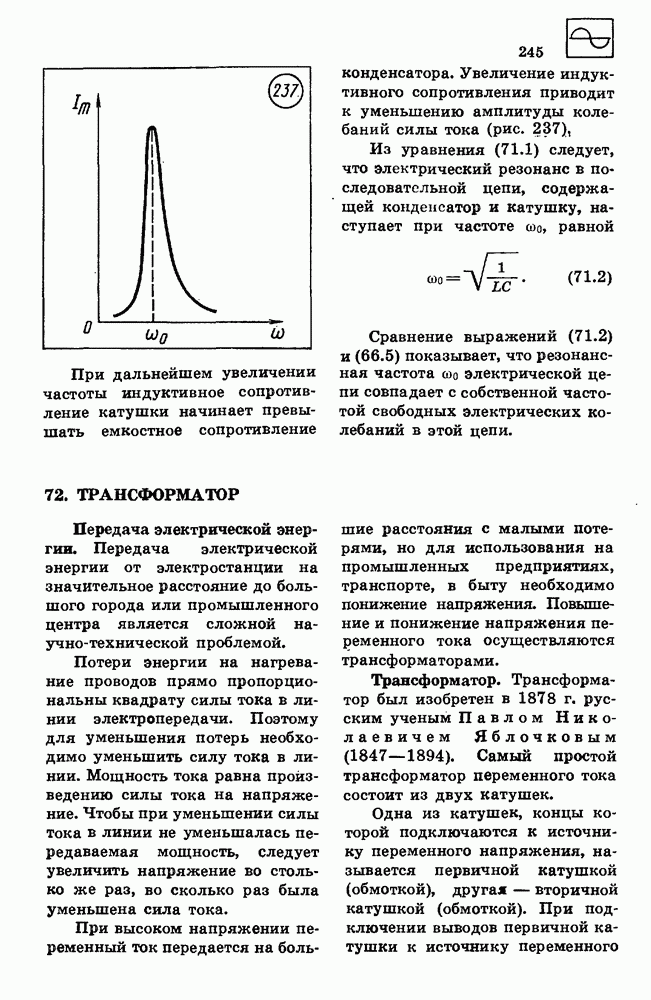
- 71. РЕЗОНАНС В ЭЛЕКТРИЧЕСКОЙ ЦЕПИ
- 72. ТРАНСФОРМАТОР
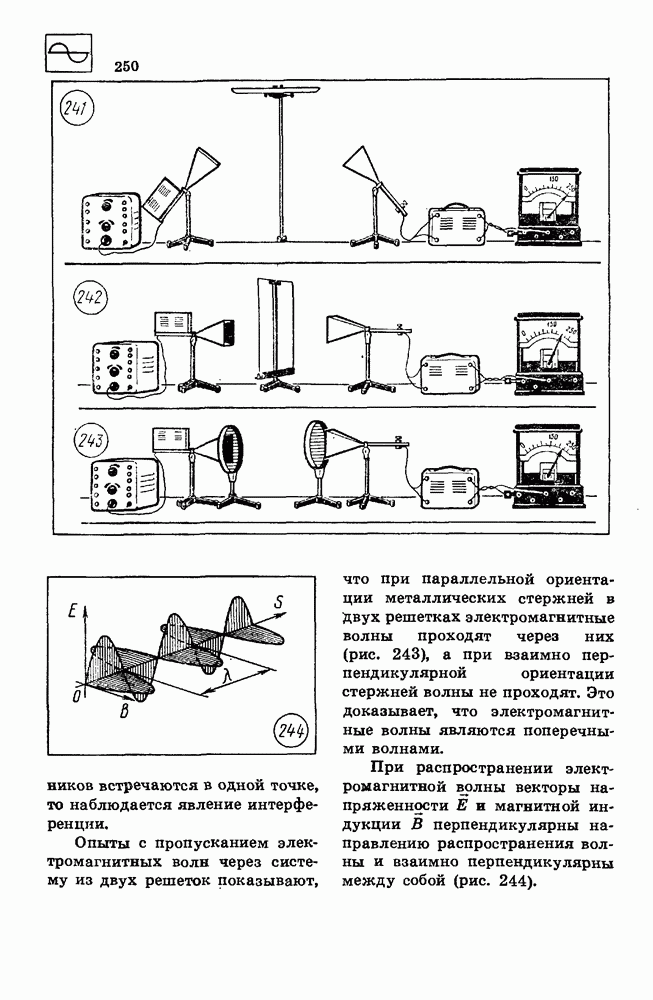
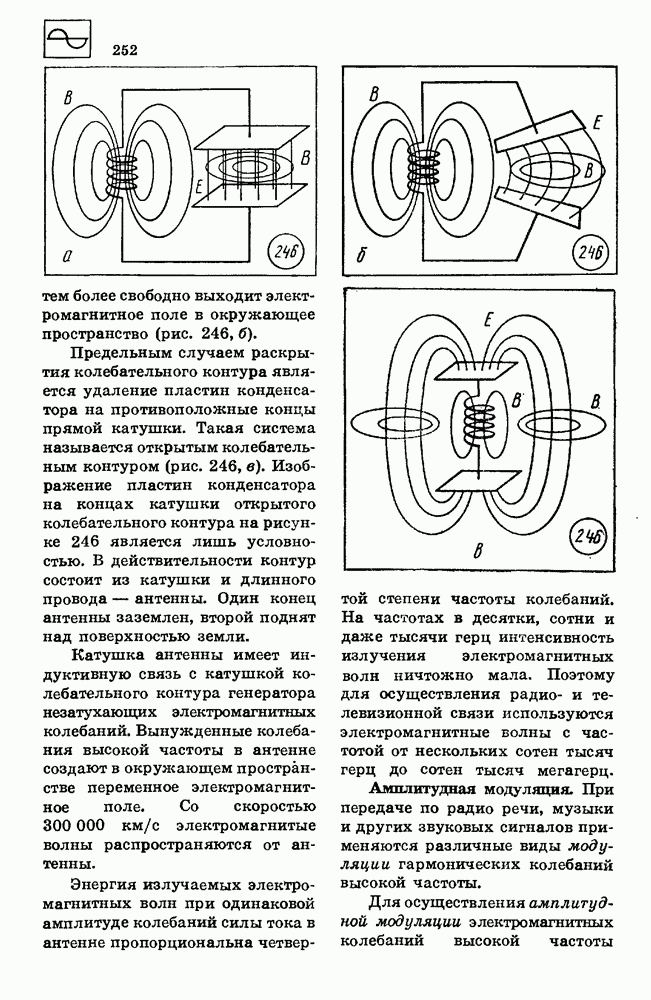
- 73. ЭЛЕКТРОМАГНИТНЫЕ ВОЛНЫ
- 74. ПРИНЦИПЫ РАДИОСВЯЗИ
- 75. ЭНЕРГИЯ ЭЛЕКТРОМАГНИТНЫХ ВОЛН
- 76. РАЗВИТОЕ ПРЕДСТАВЛЕНИИ О ПРИРОДЕ СВЕТА
- 77. ОТРАЖЕНИЕ И ПРЕЛОМЛЕНИЕ СВЕТА
- 78. ВОЛНОВЫЕ СВОЙСТВА СВЕТА
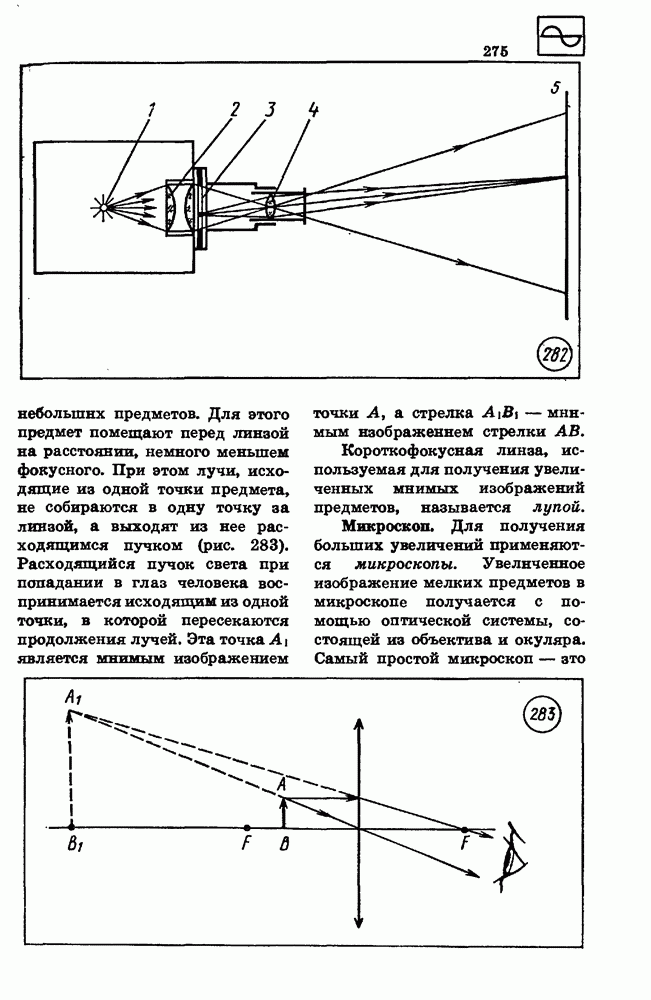
- 79. ОПТИЧЕСКИЕ ПРИБОРЫ
- 80. СПЕКТР ЭЛЕКТРОМАГНИТНЫХ ИЗЛУЧЕНИЙ
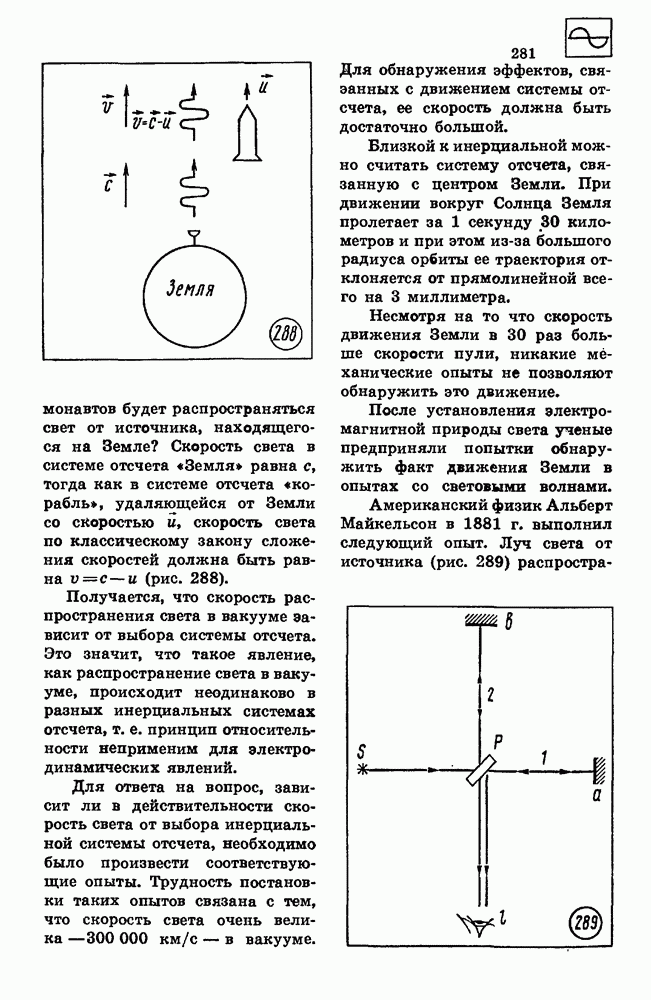
- 81. ЭЛЕМЕНТЫ ТЕОРИИ ОТНОСИТЕЛЬНОСТИ
- ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
- 82. КВАНТОВЫЕ СВОЙСТВА СВЕТА
- 83. ДОКАЗАТЕЛЬСТВА СЛОЖНОЙ СТРУКТУРЫ АТОМОВ
- 84. КВАНТОВЫЕ ПОСТУЛАТЫ БОРА
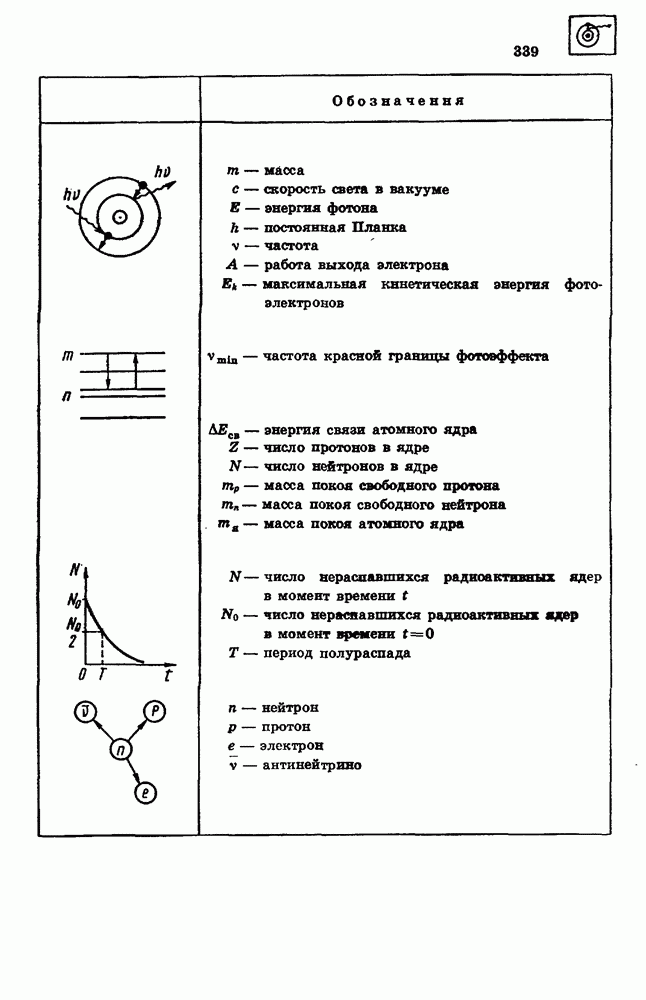
- 86. АТОМНОЕ ЯДРО
- 87. РАДИОАКТИВНОСТЬ
- 88. СВОЙСТВА ЯДЕРНЫХ ИЗЛУЧЕНИЙ
- 89. ЭКСПЕРИМЕНТАЛЬНЫЕ МЕТОДЫ РЕГИСТРАЦИИ ЗАРЯЖЕННЫХ ЧАСТИЦ
- 90. ЦЕПНАЯ РЕАКЦИЯ ДЕЛЕНИЯ ЯДЕР УРАНА
- 91. ЭЛЕМЕНТАРНЫЕ ЧАСТИЦЫ
- ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
- ПРИЛОЖЕНИЯ