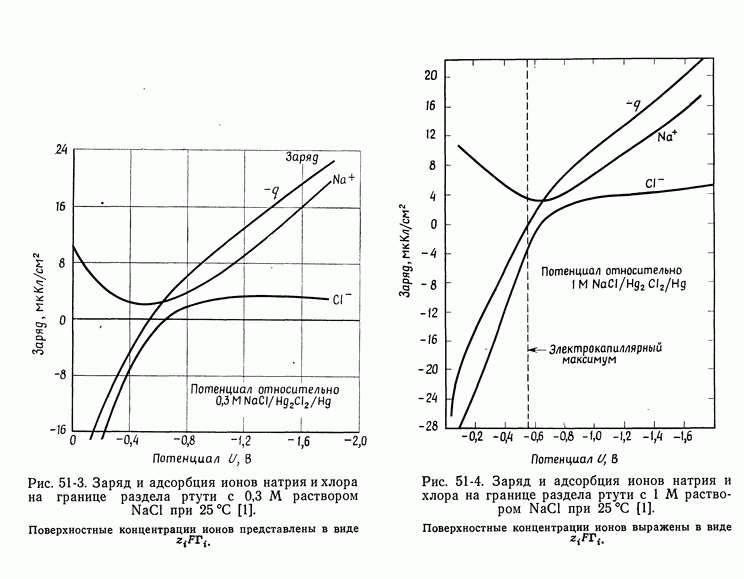
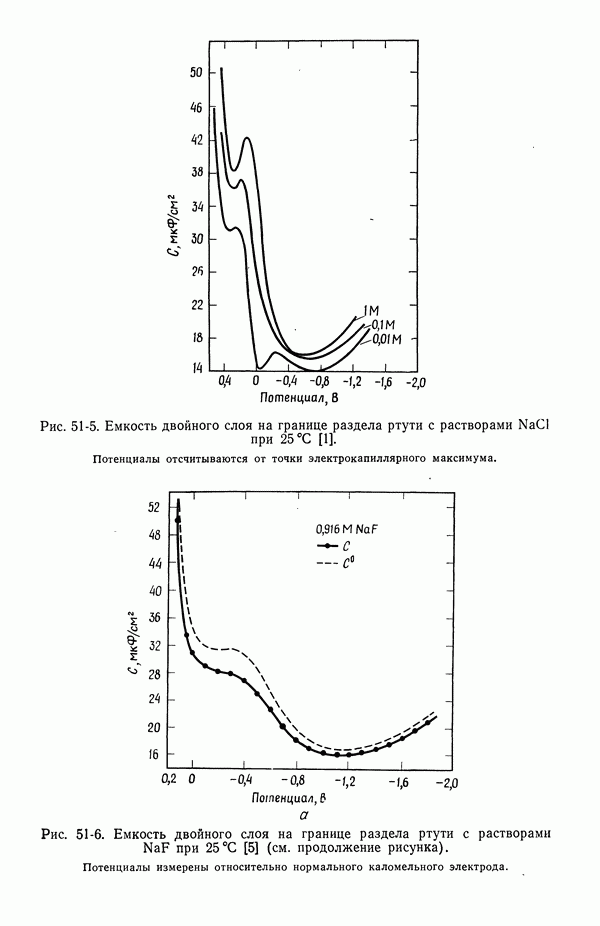
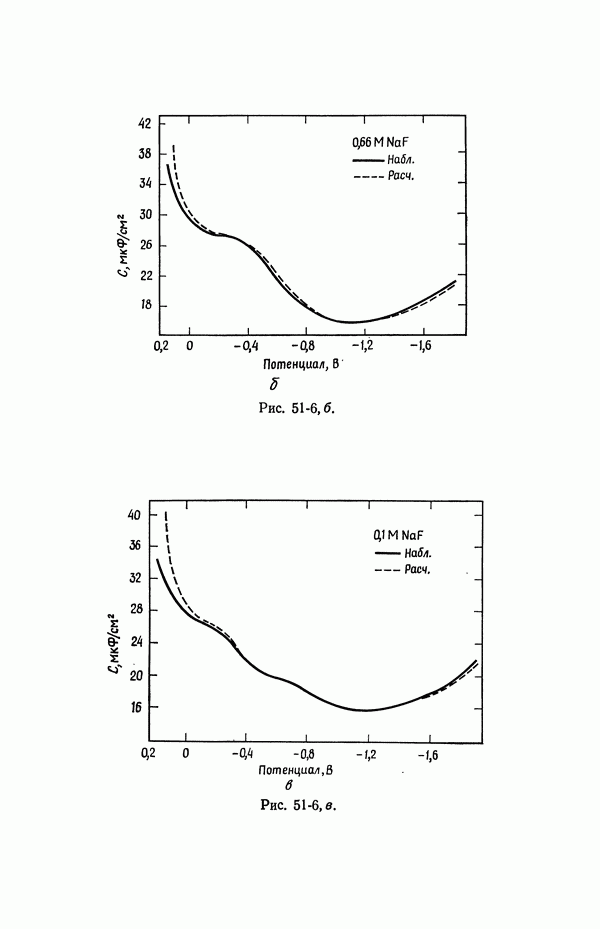
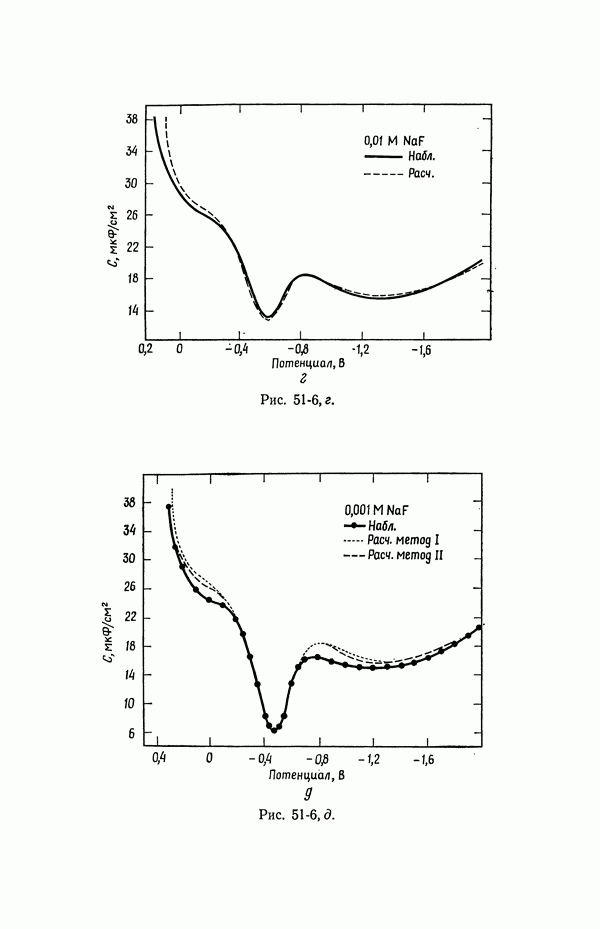
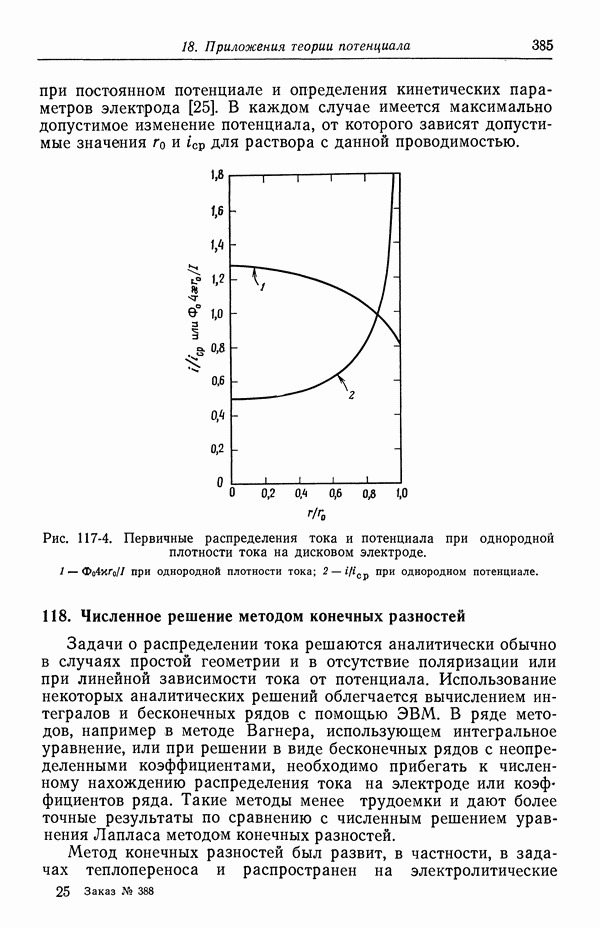
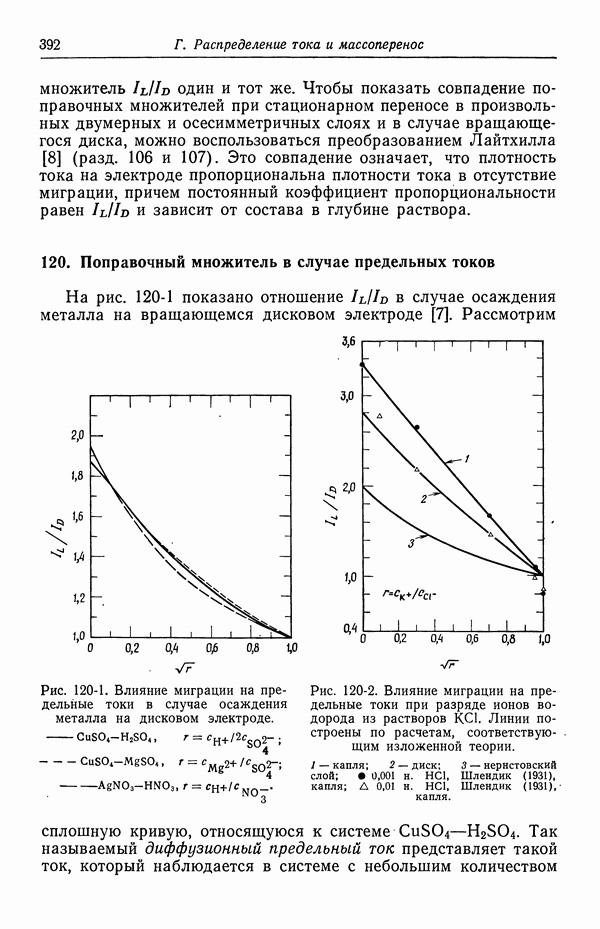
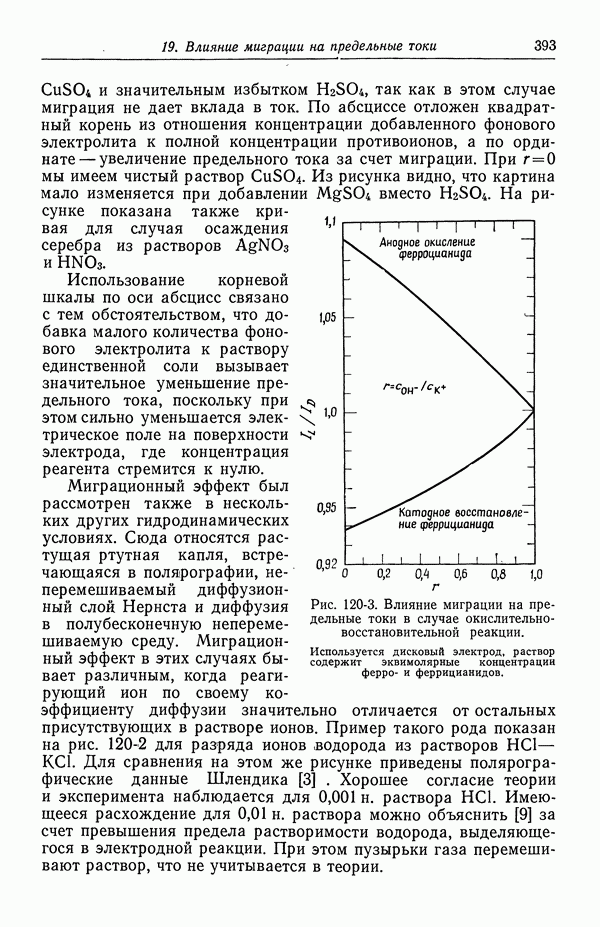
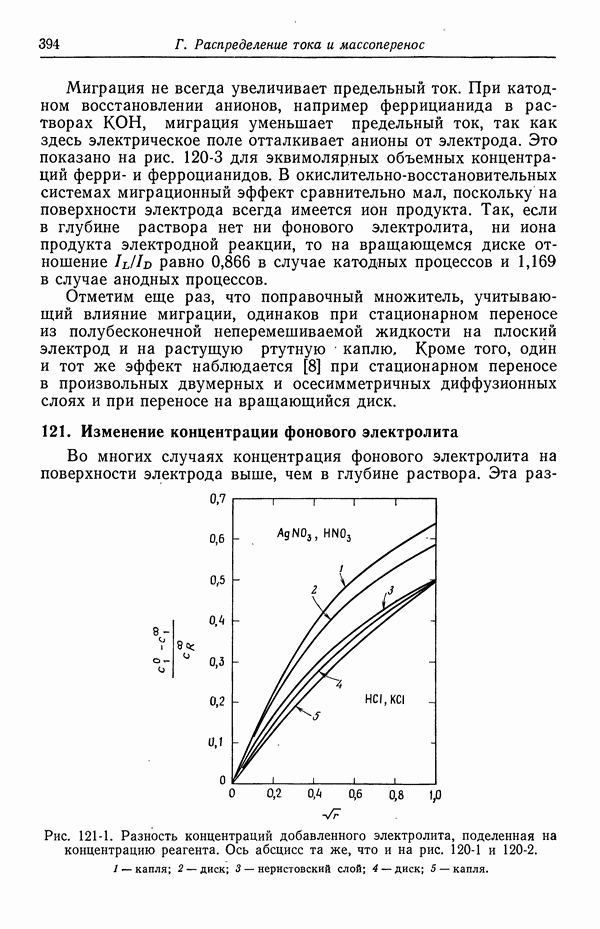
| << Предыдущий параграф | Следующий параграф >> |
Пред.
След.
Макеты страниц
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
ДЛЯ СТУДЕНТОВ И ШКОЛЬНИКОВ ЕСТЬ
ZADANIA.TO
13. Химический и электрохимический потенциалы
Химический потенциал нейтрального компонента является функцией температуры, давления и химического состава фазы, в которой он находится. Химический потенциал определяется следующим образом:

где G — свободная энергия Гиббса, А — свободная энергия Гельмгольца, U — внутреняя энергия, Я — энтальпия, S — энтропия, V — объем, Т — температура,  давление. При измерениях всегда определяют разность химических потенциалов в различных термодинамических состояниях и никогда — абсолютное значение химического потенциала в данном состоянии. Однако при табулировании результатов удобно приписать некоторую величину каждому термодинамическому состоянию. Это можно сделать, приписывая произвольную величину химическому потенциалу в некотором состоянии и определяя его величину в другом состоянии путем сравнения с данным стандартным состоянием.
давление. При измерениях всегда определяют разность химических потенциалов в различных термодинамических состояниях и никогда — абсолютное значение химического потенциала в данном состоянии. Однако при табулировании результатов удобно приписать некоторую величину каждому термодинамическому состоянию. Это можно сделать, приписывая произвольную величину химическому потенциалу в некотором состоянии и определяя его величину в другом состоянии путем сравнения с данным стандартным состоянием.
Например, химические потенциалы чистых элементов при  и давлении в одну атмосферу могут быть приняты равными нулю. Как только стандартное состояние точно установлено и табулированы значения химических потенциалов в других состояниях, экспериментальные результаты становятся однозначными. Мы вновь вернемся к этому вопросу при обсуждении данных по электрохимическим ячейкам.
и давлении в одну атмосферу могут быть приняты равными нулю. Как только стандартное состояние точно установлено и табулированы значения химических потенциалов в других состояниях, экспериментальные результаты становятся однозначными. Мы вновь вернемся к этому вопросу при обсуждении данных по электрохимическим ячейкам.
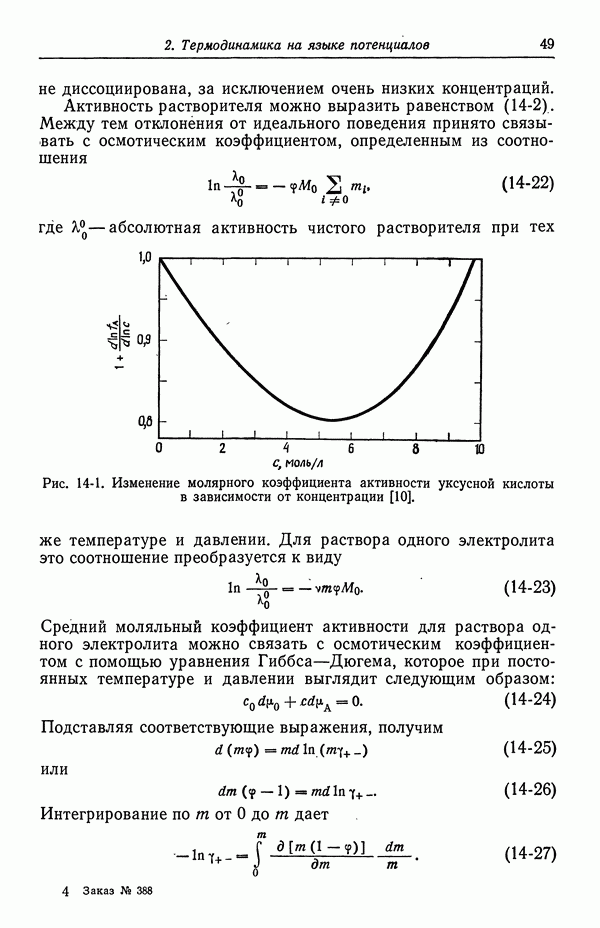
Электрохимический потенциал иона введен Гуггенгеймом [1], причем разность его значений в двух фазах определялась как работа по обратимому переносу одного грамм-иона из одной фазы в другую при постоянных температуре и объеме. Он зависит от температуры, давления, химического состава и электрического состояния фазы. Еще необходимо выяснить, насколько хорошо определены эти независимые переменные. Рассмотрим следующие случаи, в которых может фигурировать перенос ионов:
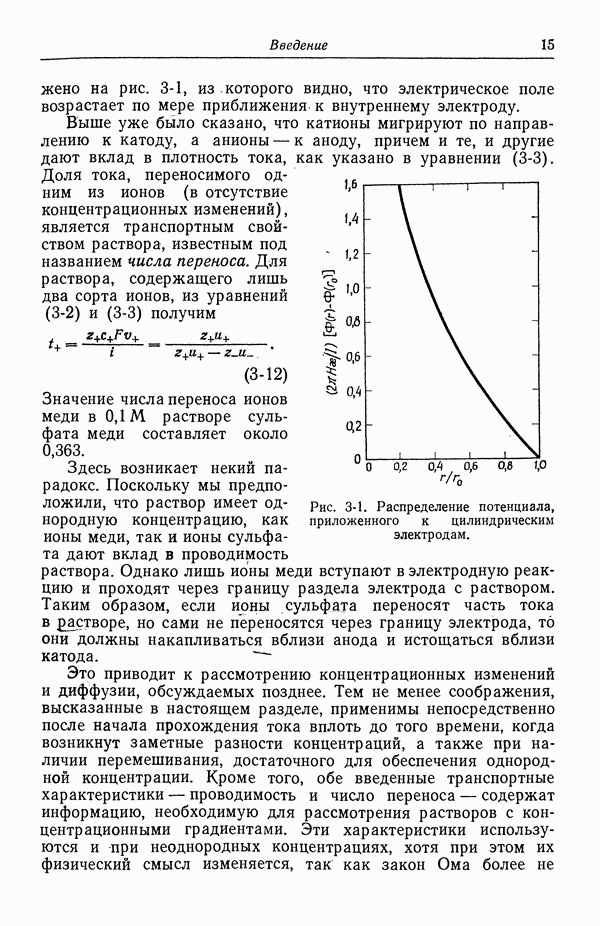
1. Постоянные температура и давление, одинаковые химические составы фаз  . Различия между фазами могут иметь лишь электрическую природу.
. Различия между фазами могут иметь лишь электрическую природу.
а) Для переноса одного грамм-иона компонента i из фазы  в фазу а работа переноса равна
в фазу а работа переноса равна

где различие между двумя фазами можно охарактеризовать разностью электрических потенциалов обеих фаз (второе соотношение).
б) Для переноса  грамм-ионов компонента 1 и
грамм-ионов компонента 1 и  грамм-ионов компонента 2 при условии, что
грамм-ионов компонента 2 при условии, что

работа переноса равна нулю. Такие электрически нейтральные комбинации ионов не зависят от электрического состояния фазы, и этот факт можно использовать для проверки данного выше определения разности потенциалов. Поскольку для нейтральных комбинаций полная работа переноса будет равна нулю, так что равенство (13-3) выполняется, имеем

Если применить равенство (13-2) к ионному компоненту 1, то можно объединить равенства (13-2) — (13-4) и выразить разность
электрохимических потенциалов ионного компонента 2 в виде

Следовательно, разность электрических потенциалов  определенная равенством (13-2), не зависит от того, какой из двух заряженных компонентов (1 или 2) используется в равенстве (13-2). В этом смысле разность электрических потенциалов определена корректно и совпадает с обычным представлением о разности потенциалов.
определенная равенством (13-2), не зависит от того, какой из двух заряженных компонентов (1 или 2) используется в равенстве (13-2). В этом смысле разность электрических потенциалов определена корректно и совпадает с обычным представлением о разности потенциалов.
2. Постоянные температура и давление, различные химические составы обеих фаз. При переносе нейтральных комбинаций ионов, удовлетворяющих равенству (13-3), зависимость от электрического состояния любой из фаз отсутствует. Таким образом, работа переноса будет зависеть лишь от различия химических составов. Работа переноса заряженного компонента по-прежнему будет даваться равенством

но его нельзя больше выразить просто через разности электрических потенциалов, поскольку химическое окружение переносимого компонента будет различным в обеих фазах.
Следует отметить, что до сих пор еще не установлено количественной характеристики или меры различия электрических состояний двух фаз с разным химическим составом. Возможно (и даже целесообразно для некоторых вычислительных целей) определить такую электрическую переменную, однако это неизбежно связано с элементом произвола и несущественно для рассмотрения термодинамических явлений. Несколько различных способов такого определения обсуждается в гл. 3. Обычное определение электрического потенциала основано скорее на электростатике, чем на термодинамике, так что здесь более уместно использование электрохимических потенциалов.
Представляет интерес вопрос о состоянии фазы, а также о том, находятся ли обе фазы в одинаковом состоянии. Если две фазы имеют различные составы, то вопрос о том, находятся ли они в одинаковом электрическом состоянии, с точки зрения термодинамики несуществен. С другой стороны, если обе фазы химически идентичны, то количественно описывать их электрические состояния удобно способом, совпадающим с обычным определением потенциала.
| << Предыдущий параграф | Следующий параграф >> |
Оглавление
- ПРЕДИСЛОВИЕ
- ПРЕДИСЛОВИЕ АВТОРА
- Глава 1. ВВЕДЕНИЕ
- 1. Термодинамика, кинетика электродных процессов и процессы переноса
- 2. Вращающиеся цилиндры
- 3. Прохождение тока в электролитах
- 4. Течение жидкости
- 5. Диффузионный слой
- 6. Концентрационные ячейки
- 7. Концентрационное перенапряжение
- 8. Поверхностное перенапряжение
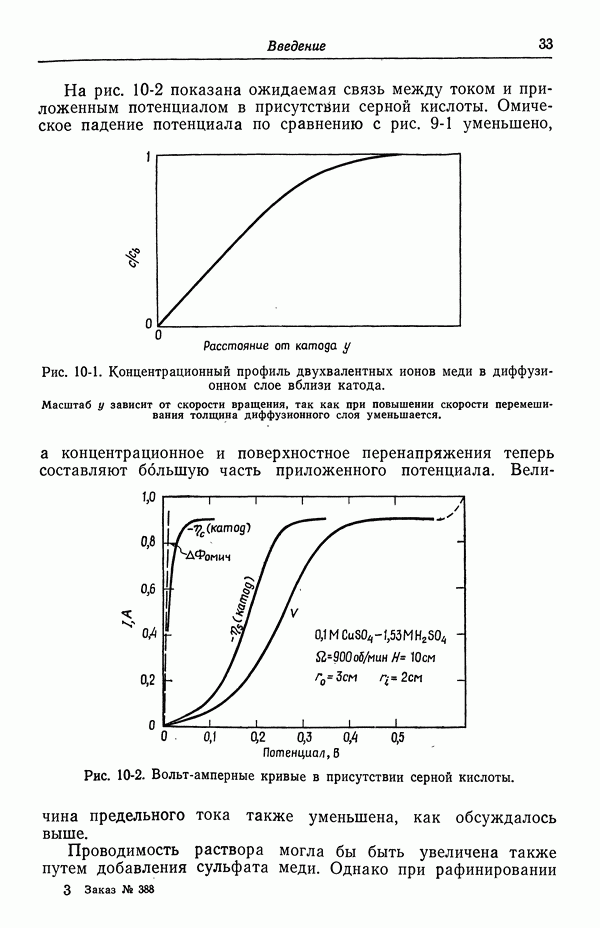
- 9. Потенциал ячейки
- 10. Фоновый электролит
- 11. Свободная конвекция
- СПИСОК ОБОЗНАЧЕНИЙ
- Часть А. ТЕРМОДИНАМИКА ЭЛЕКТРОХИМИЧЕСКИХ ЯЧЕЕК
- Глава 2. ТЕРМОДИНАМИКА НА ЯЗЫКЕ ЭЛЕКТРОХИМИЧЕСКИХ ПОТЕНЦИАЛОВ
- 12. Равновесие фаз
- 13. Химический и электрохимический потенциалы
- 14. Определение некоторых термодинамических функций
- 15. Ячейка с раствором однородной концентрации
- 16. Процессы переноса в областях контакта
- 17. Ячейка с одним электролитом переменной концентрации
- 18. Ячейка с двумя электролитами, концентрация одного из которых почти однородна
- 19. Ячейка с двумя электролитами переменной концентрации
- 20. Стандартный потенциал ячейки и коэффициенты активности
- ЗАДАЧИ
- СПИСОК ОБОЗНАЧЕНИЙ
- СПИСОК ЛИТЕРАТУРЫ
- Глава 3. ЭЛЕКТРИЧЕСКИЙ ПОТЕНЦИАЛ
- 22. Электростатический потенциал
- 23. Межмолекулярные силы
- 24. Внешний и внутренний потенциалы
- 25. Потенциалы электродов сравнения
- 26. Электрический потенциал в термодинамике
- СПИСОК ОБОЗНАЧЕНИЙ
- СПИСОК ЛИТЕРАТУРЫ
- Глава 4. КОЭФФИЦИЕНТЫ АКТИВНОСТИ
- 27. Распределение ионов в разбавленных растворах
- 28. Электрический вклад в свободную энергию
- 29. Недостатки модели Дебая—Хюккеля
- 30. Растворы бинарных электролитов
- 31. Многокомпонентные растворы
- 32. Измерение коэффициентов активности
- 33. Слабые электролиты
- ЗАДАЧИ
- СПИСОК ОБОЗНАЧЕНИЙ
- СПИСОК ЛИТЕРАТУРЫ
- Глава 5. ЭЛЕКТРОДЫ СРАВНЕНИЯ
- 34. Критерии выбора электродов сравнения
- 35. Экспериментальные факторы, влияющие на выбор электродов сравнения
- 36. Водородный электрод
- 37. Каломельный электрод и другие электроды типа ртуть—соль ртути
- 38. Окиснортутный электрод
- 39. Электроды типа серебро—галогенид серебра
- 40. Потенциалы относительно данного электрода сравнения
- СПИСОК ОБОЗНАЧЕНИЙ
- Глава 6. ПОТЕНЦИАЛЫ ЯЧЕЕК С ПЕРЕНОСОМ
- 41. Уравнение Нернста
- 42. Типы жидкостных соединений
- 43. Формулы для потенциалов жидкостных соединений
- 44. Определение концентрационных профилей
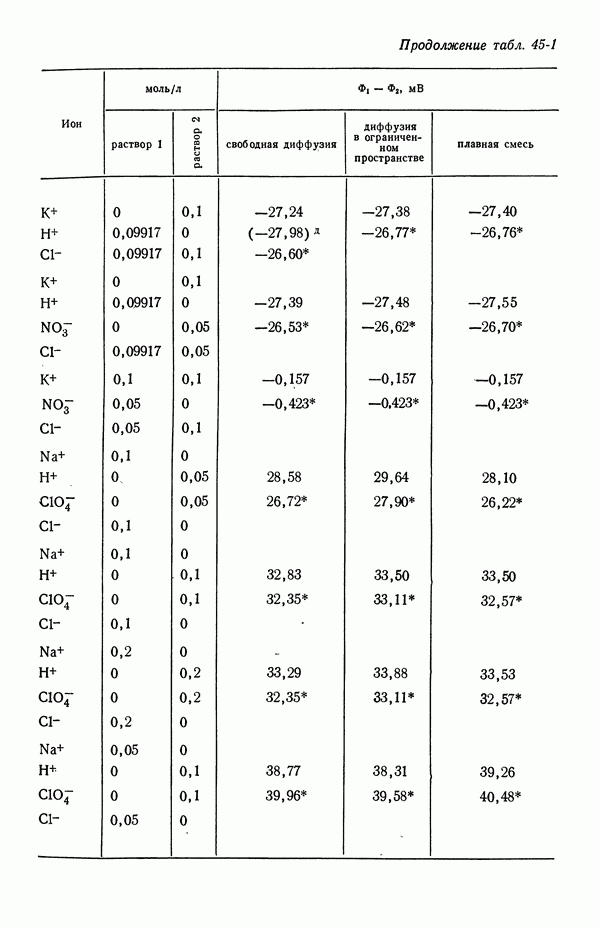
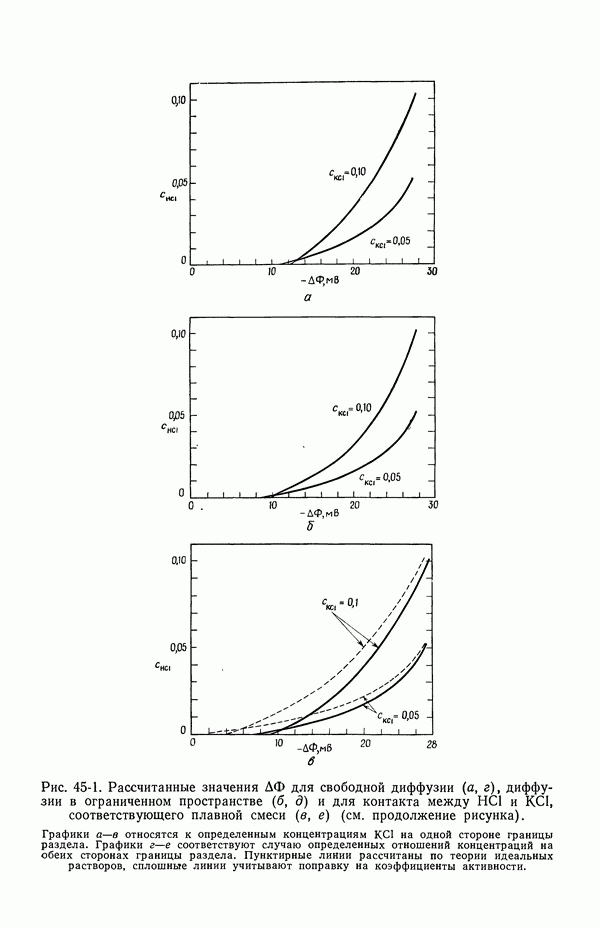
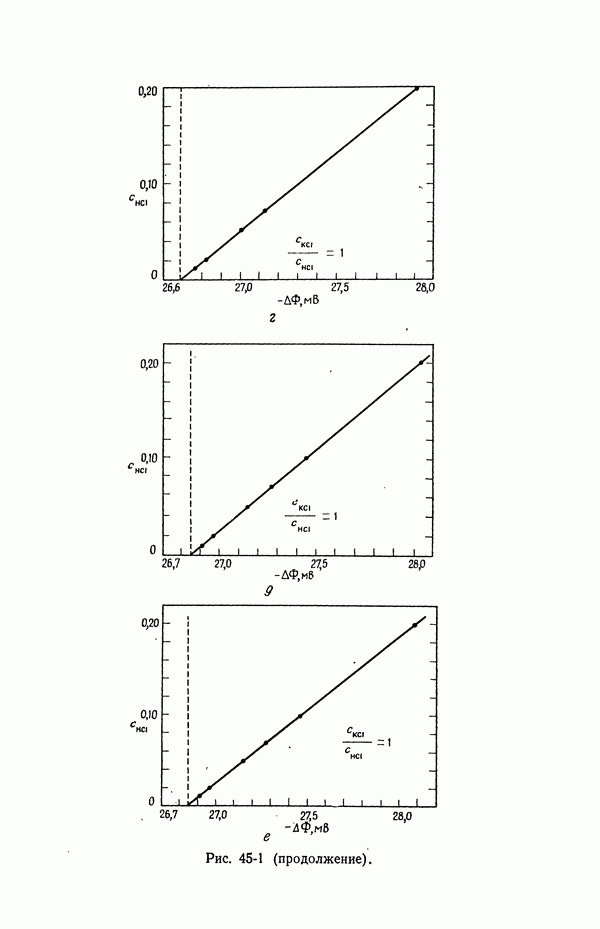
- 45. Численные результаты
- 46. Ячейки с жидкостным соединением
- 47. Поправки к уравнению Нернста
- 48. Мембранные потенциалы
- СПИСОК ОБОЗНАЧЕНИЙ
- СПИСОК ЛИТЕРАТУРЫ
- Часть Б. КИНЕТИКА ЭЛЕКТРОДНЫХ ПРОЦЕССОВ И ДРУГИЕ ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ
- Глава 7. СТРОЕНИЕ ЭЛЕКТРИЧЕСКОГО ДВОЙНОГО СЛОЯ
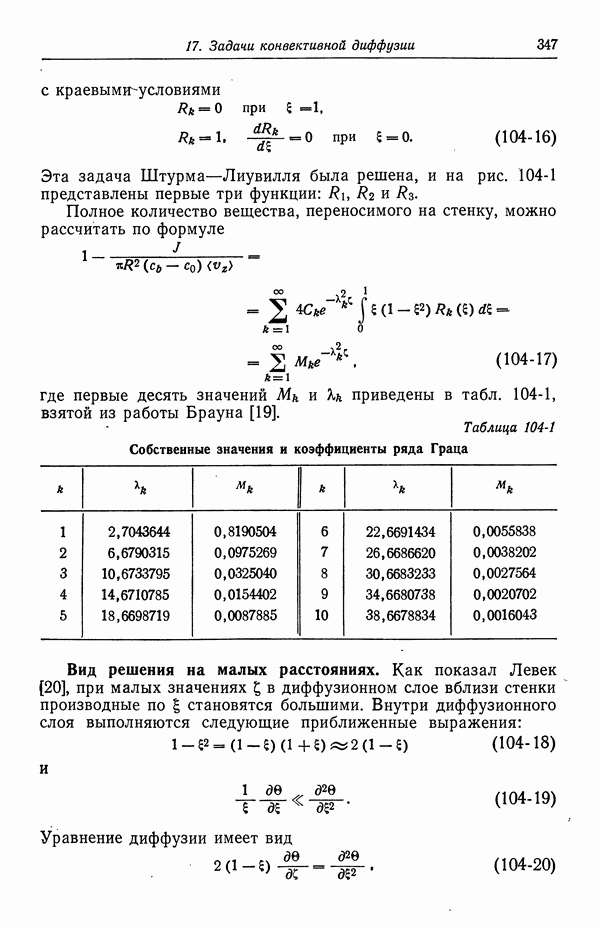
- 49. Качественное описание двойных слоев
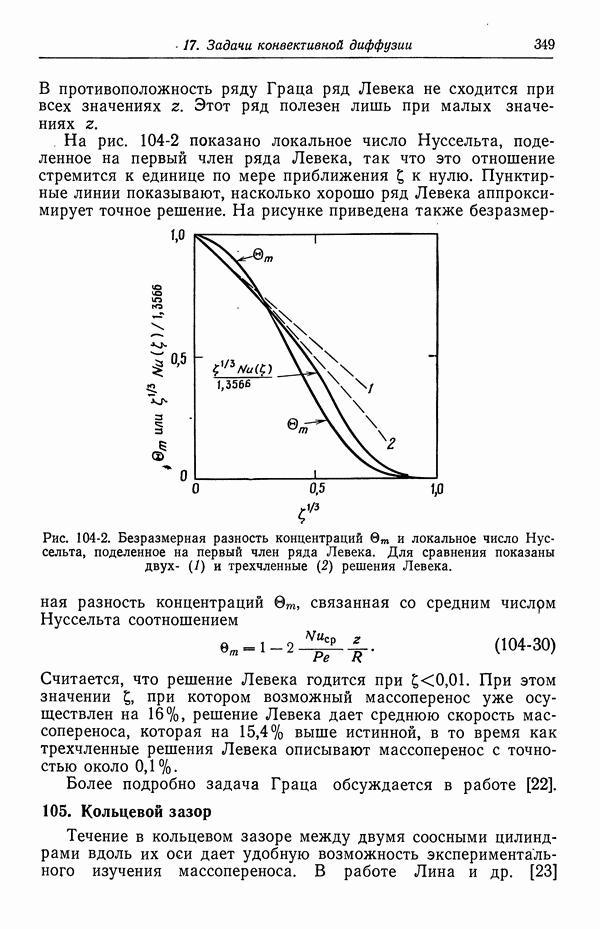
- 50. Изотерма адсорбции Гиббса
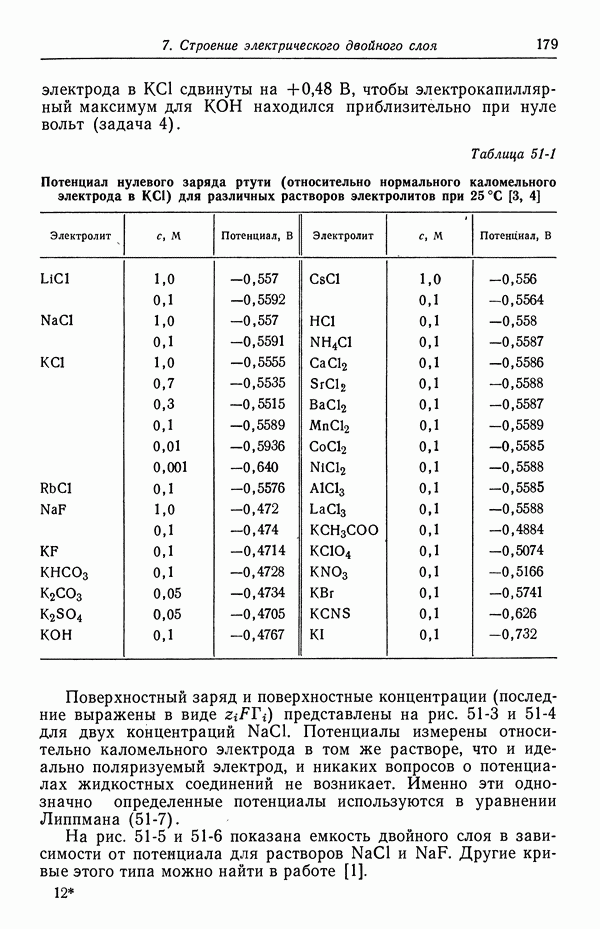
- 51. Уравнение Липпмана
- 52. Диффузная часть двойного слоя
- 53. Емкость двойного слоя в отсутствие специфической адсорбции
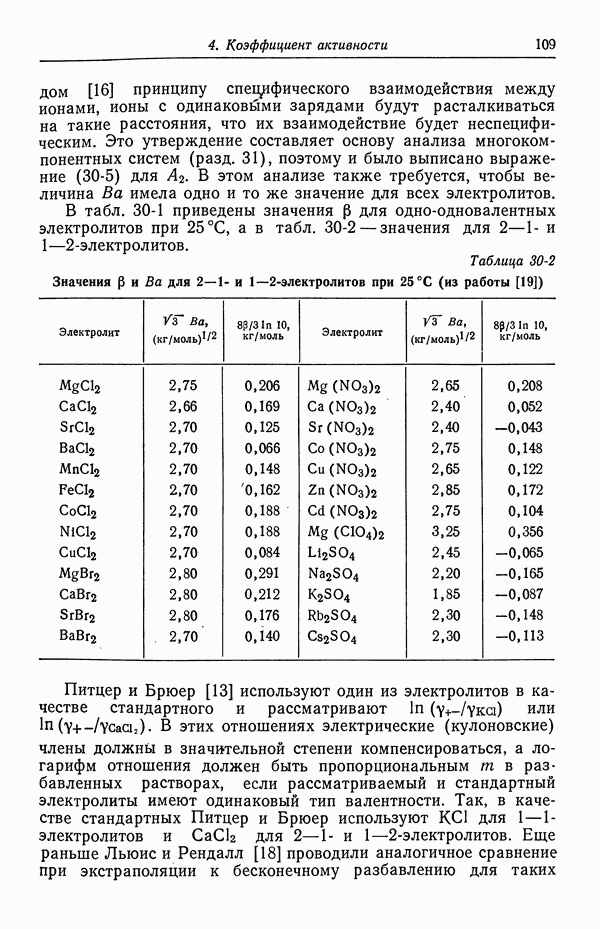
- 54. Специфическая адсорбция на границе раздела электрод — раствор
- ЗАДАЧИ
- СПИСОК ОБОЗНАЧЕНИЙ
- Глава 8. КИНЕТИКА ЭЛЕКТРОДНЫХ ПРОЦЕССОВ
- 55. Гетерогенные электродные реакции
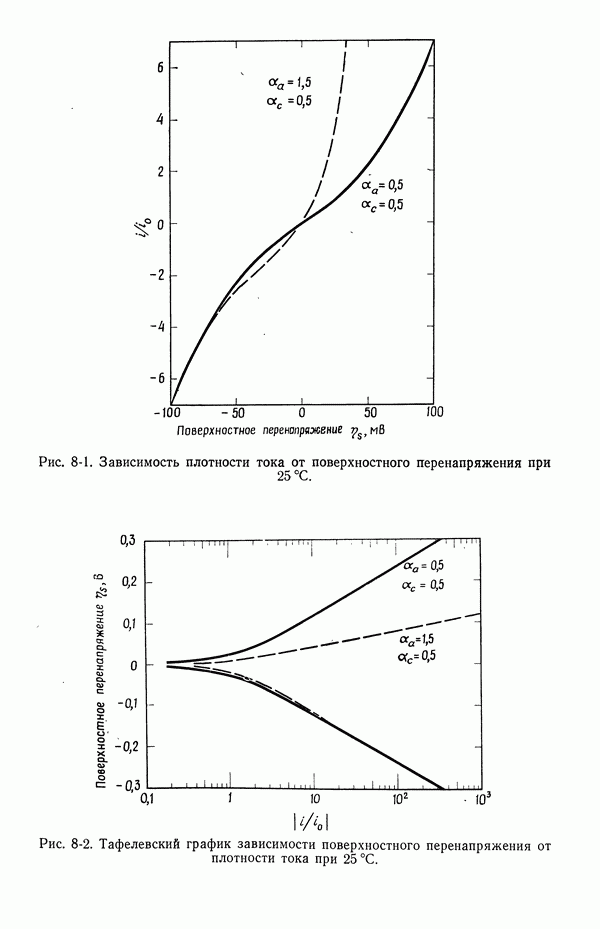
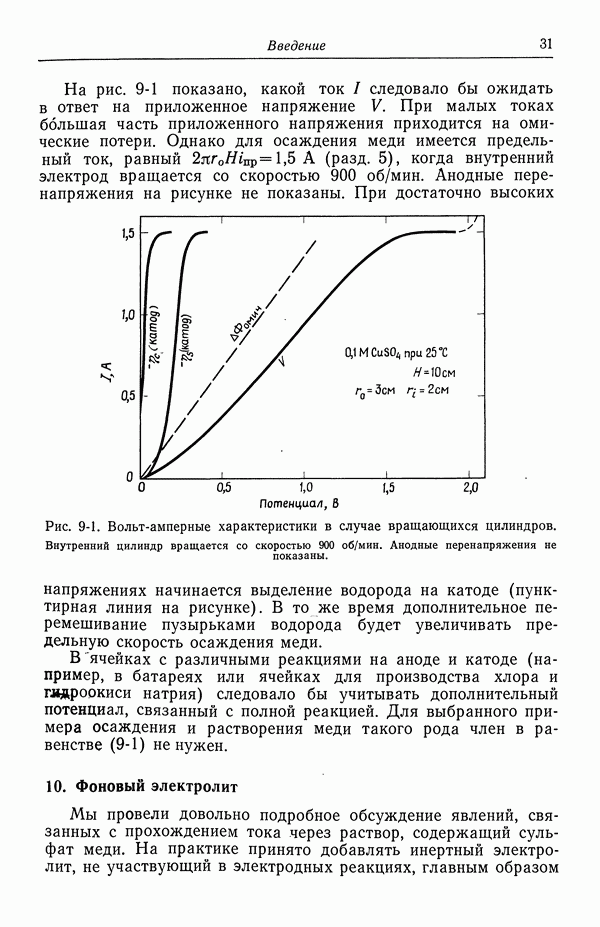
- 56. Зависимость плотности тока от поверхностного перенапряжения
- 57. Модели в кинетике электродных процессов
- 58. Влияние строения двойного слоя
- 59. Кислородный электрод
- 60. Методы измерения
- 61. Одновременно протекающие реакции
- ЗАДАЧИ
- СПИСОК ОБОЗНАЧЕНИЙ
- СПИСОК ЛИТЕРАТУРЫ
- Глава 9. ЭЛЕКТРОКИНЕТИЧЕСКИЕ ЯВЛЕНИЯ
- 62. Разрывная скорость на границе раздела
- 63. Электроосмос и потенциал течения
- 64. Электрофорез
- 65. Потенциал осаждения
- ЗАДАЧИ
- СПИСОК ОБОЗНАЧЕНИЙ
- Глава 10. ЭЛЕКТРОКАПИЛЛЯРНЫЕ ЯВЛЕНИЯ
- 66. Динамика границы раздела
- 67. Электрокапиллярное движение ртутных капель
- 68. Потенциалы осаждения для падающих ртутных капель
- СПИСОК ОБОЗНАЧЕНИЙ
- Часть В. ПРОЦЕССЫ ПЕРЕНОСА В РАСТВОРАХ ЭЛЕКТРОЛИТОВ
- Глава 11. БЕСКОНЕЧНО РАЗБАВЛЕННЫЕ РАСТВОРЫ
- 69. Законы переноса
- 70. Проводимость, диффузионные потенциалы и числа переноса
- 71. Сохранение заряда
- 72. Бинарный электролит
- 73. Фоновый электролит
- 74. Многокомпонентная диффузия, возникающая при исключении электрического поля
- 75. Подвижности и коэффициенты диффузии
- 76. Электронейтральность и уравнение Лапласа
- 77. Умеренно разбавленные растворы
- ЗАДАЧИ
- СПИСОК ОБОЗНАЧЕНИЙ
- Глава 12. КОНЦЕНТРИРОВАННЫЕ РАСТВОРЫ
- 78. Законы переноса
- 79. Бинарный электролит
- 80. Стандартные скорости
- 81. Потенциал
- 82. Связь с теорией разбавленных растворов
- 83. Многокомпонентный транспорт
- 84. Потенциалы жидкостного соединения
- ЗАДАЧИ
- СПИСОК ОБОЗНАЧЕНИЙ
- Глава 13. ТЕПЛОВЫЕ ЭФФЕКТЫ
- 85. Термодиффузия
- 86. Выделение и перенос тепла
- 87. Тепловыделение на границе раздела фаз
- 88. Термогальванические ячейки
- ЗАДАЧИ
- СПИСОК ОБОЗНАЧЕНИЙ
- Глава 14. ХАРАКТЕРИСТИКИ ПЕРЕНОСА
- 89. Бесконечно разбавленные растворы
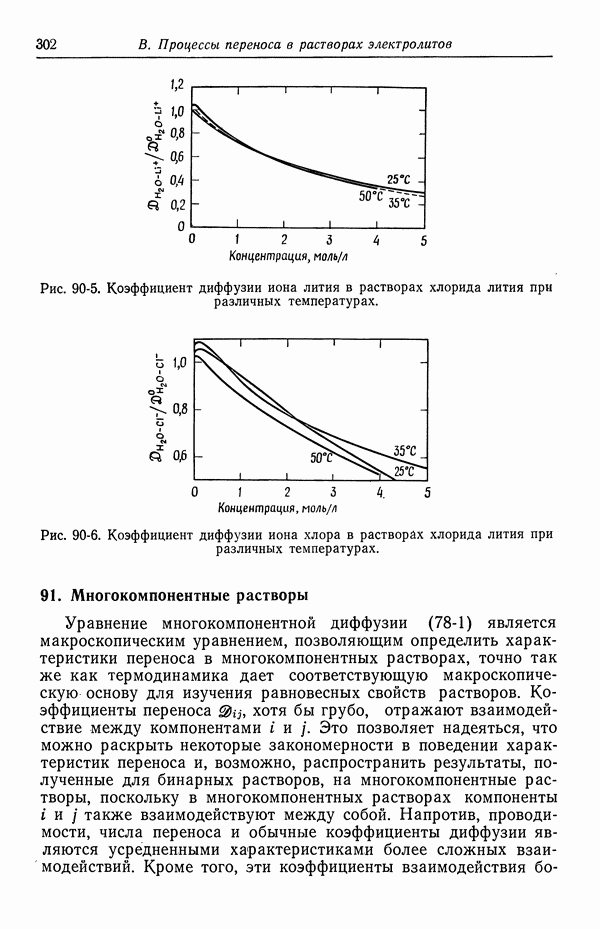
- 90. Растворы, содержащие одну соль
- 92. Интегральные коэффициенты диффузии
- ЗАДАЧА
- СПИСОК ОБОЗНАЧЕНИЙ
- Глава 15. МЕХАНИКА ЖИДКИХ СРЕД
- 94. Напряжение в ньютоновской жидкости
- 95. Граничные условия
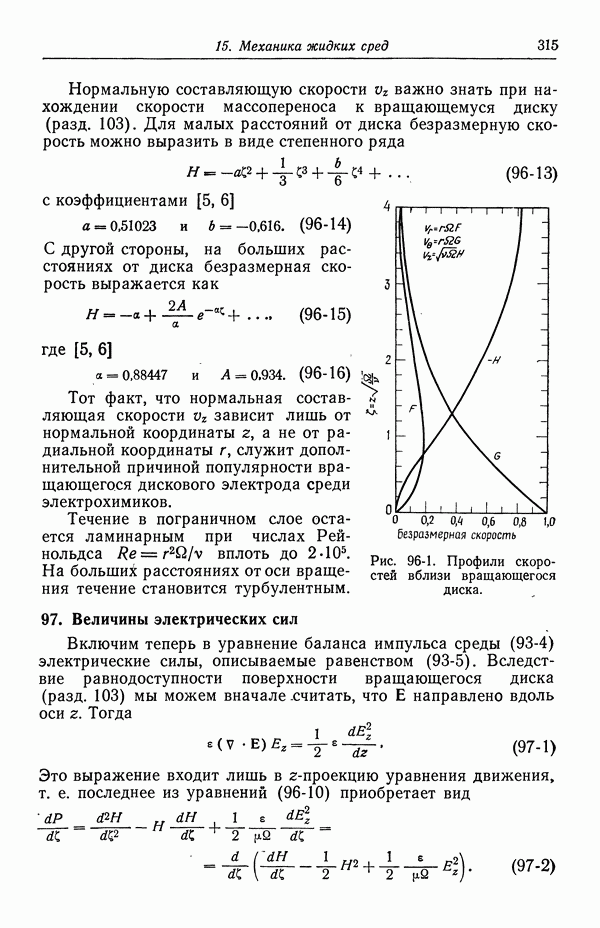
- 96. Течение жидкости к вращающемуся диску
- 97. Величины электрических сил
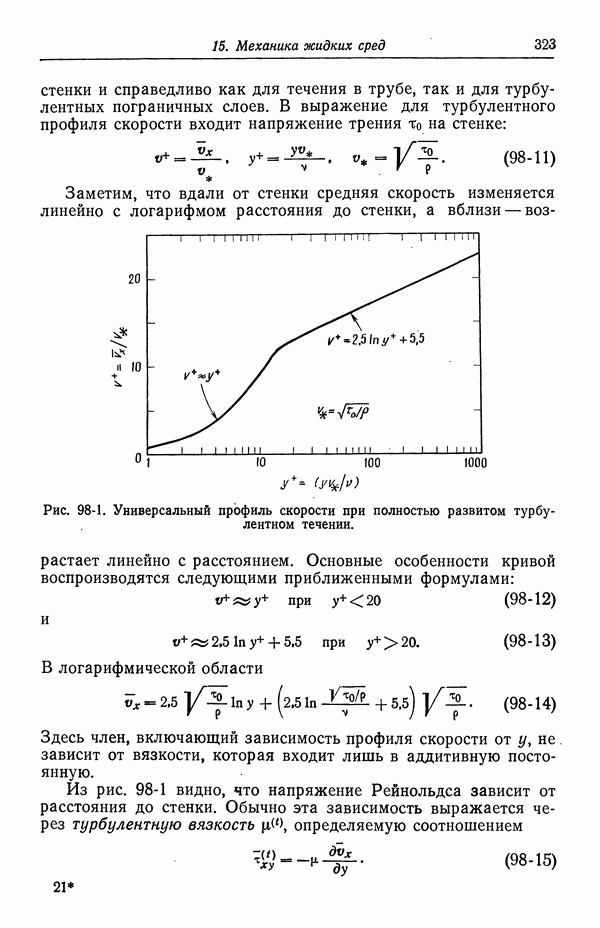
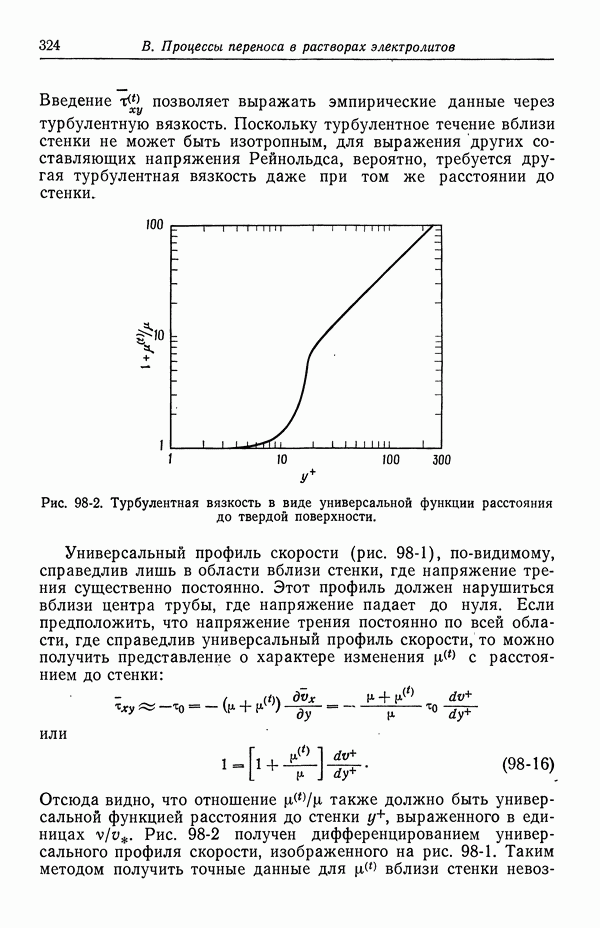
- 98. Турбулентное течение
- 99. Массоперенос в турбулентном потоке
- СПИСОК ОБОЗНАЧЕНИЙ
- СПИСОК ЛИТЕРАТУРЫ
- Часть Г. РАСПРЕДЕЛЕНИЕ ТОКА И МАССОПЕРЕНОС В ЭЛЕКТРОХИМИЧЕСКИХ СИСТЕМАХ
- Глава 16. ОСНОВНЫЕ УРАВНЕНИЯ
- 100. Перенос в разбавленных растворах
- 101. Кинетика электродных процессов
- СПИСОК ОБОЗНАЧЕНИЙ
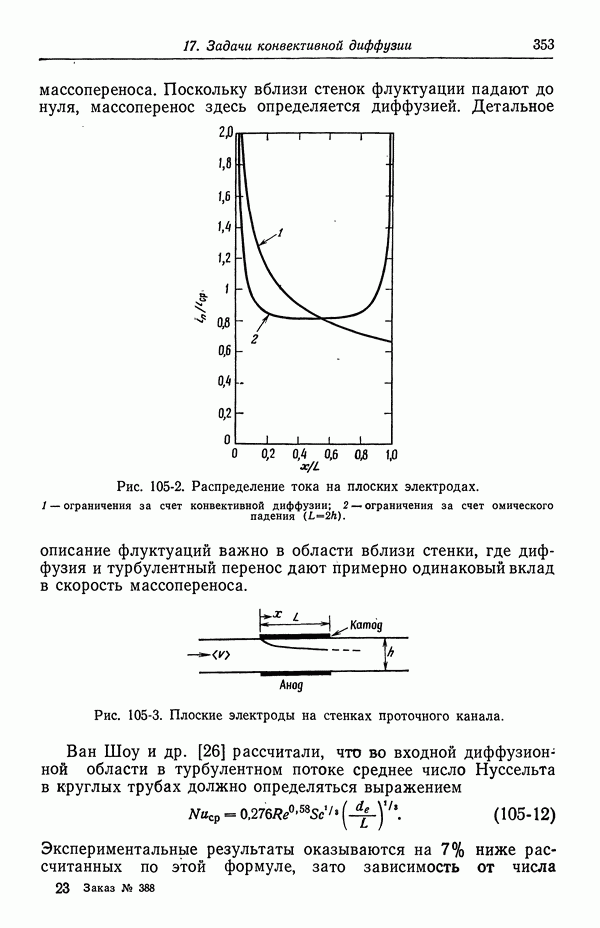
- Глава 17. ЗАДАЧИ КОНВЕКТИВНОЙ ДИФФУЗИИ
- 102. Упрощенное описание конвективной диффузии
- 103. Вращающийся диск
- 104. Задача Граца
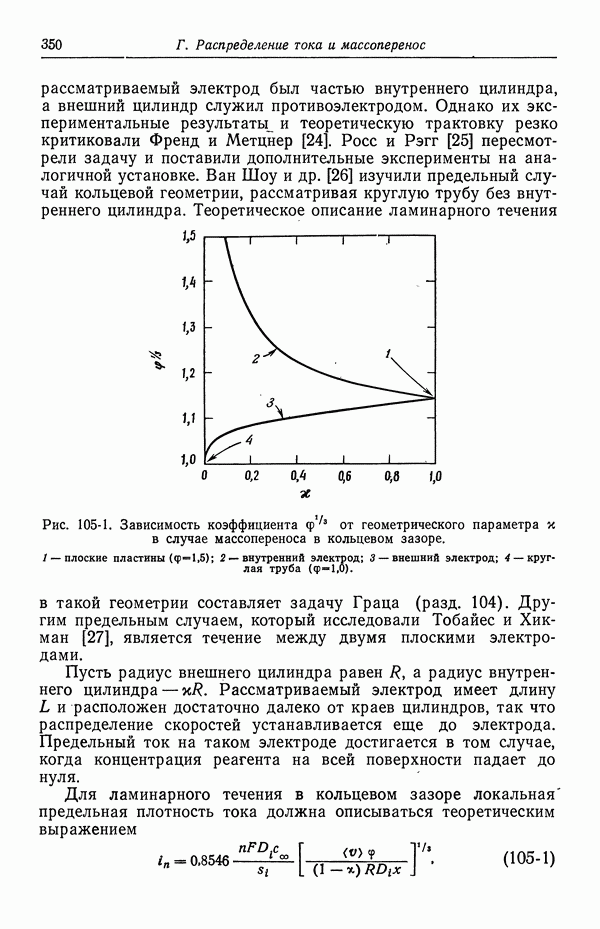
- 105. Кольцевой зазор
- 106. Двумерные диффузионные слои при вынужденной ламинарной конвекции
- 107. Осесимметричные диффузионные слои при вынужденной ламинарной конвекции
- 109. Вращающиеся цилиндры
- 110. Растущие ртутные капли
- 111. Свободная конвекция
- 112. Наложение свободной и вынужденной конвекции
- 113. Ограничения за счет поверхностных реакций
- 114. Бинарные и концентрированные растворы
- ЗАДАЧИ
- СПИСОК ОБОЗНАЧЕНИЙ
- Глава 18. ПРИЛОЖЕНИЯ ТЕОРИИ ПОТЕНЦИАЛА
- 115. Упрощения в задачах теории потенциала
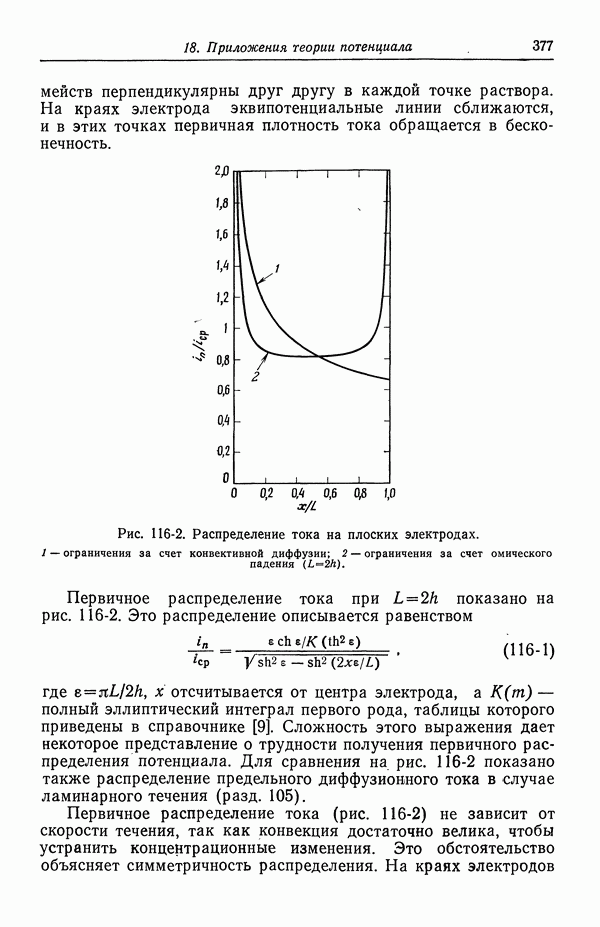
- 116. Первичное распределение тока
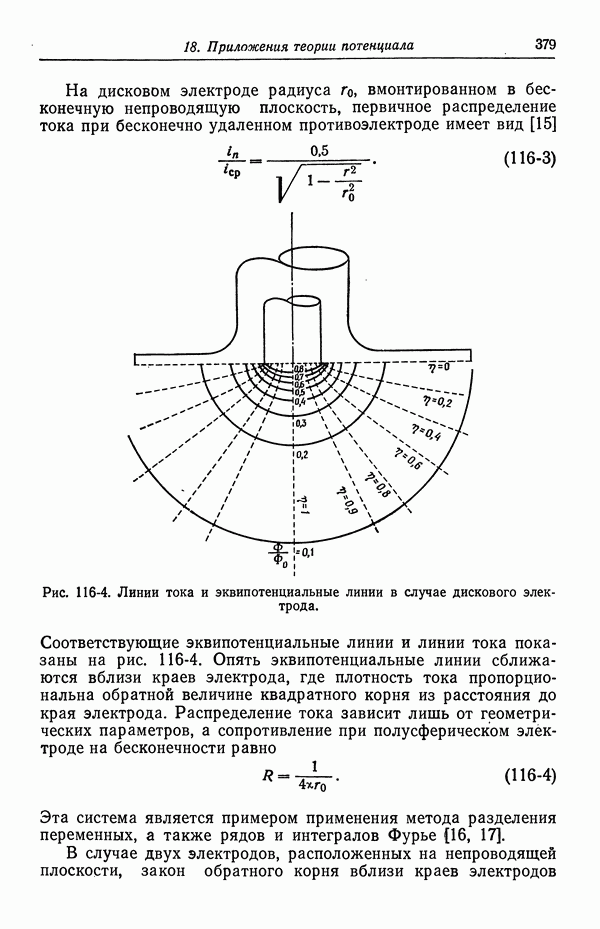
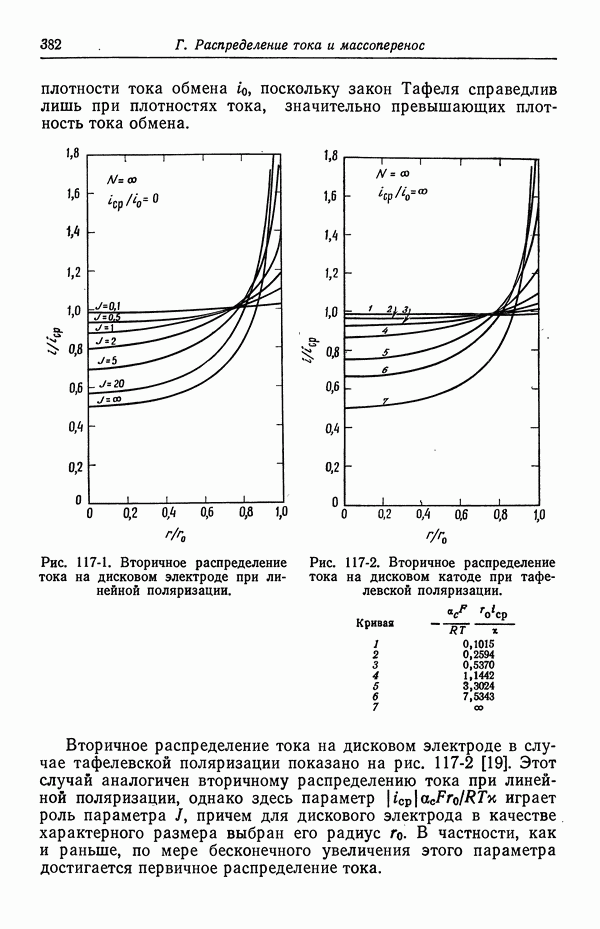
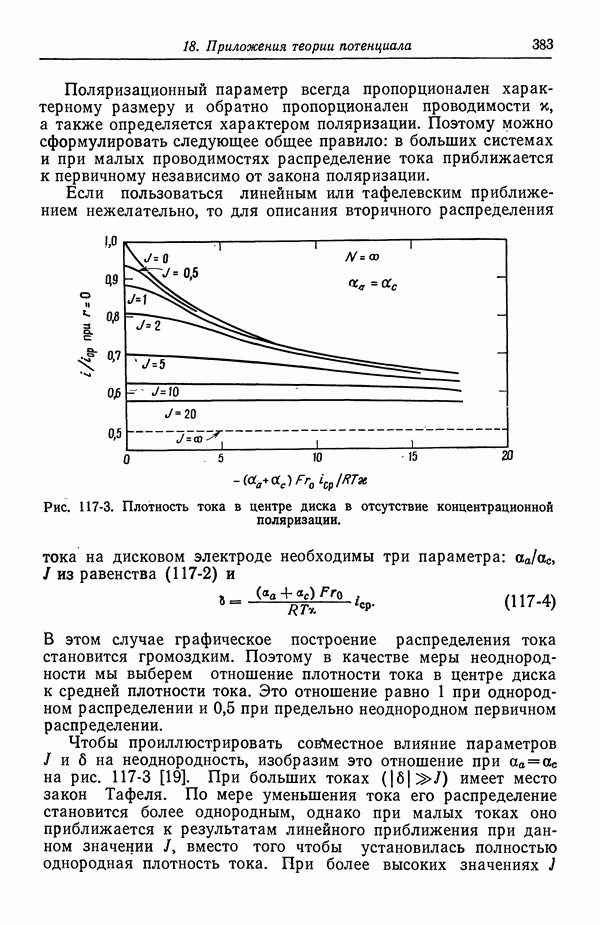
- 117. Вторичное распределение тока
- 118. Численное решение методом конечных разностей
- СПИСОК ОБОЗНАЧЕНИЙ
- ГЛАВА 19. ВЛИЯНИЕ МИГРАЦИИ НА ПРЕДЕЛЬНЫЕ ТОКИ
- 119. Решение задачи
- 120. Поправочный множитель в случае предельных токов
- 121. Изменение концентрации фонового электролита
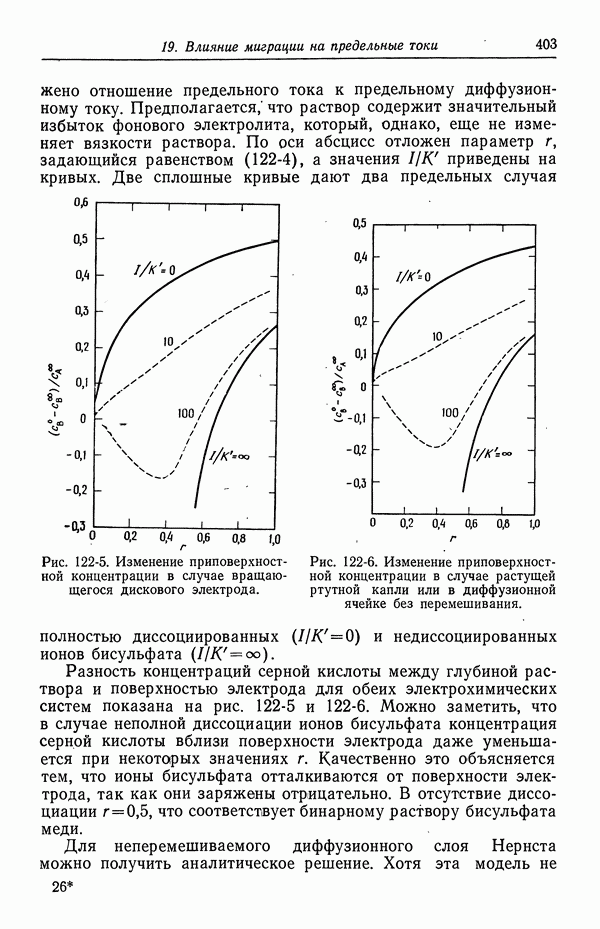
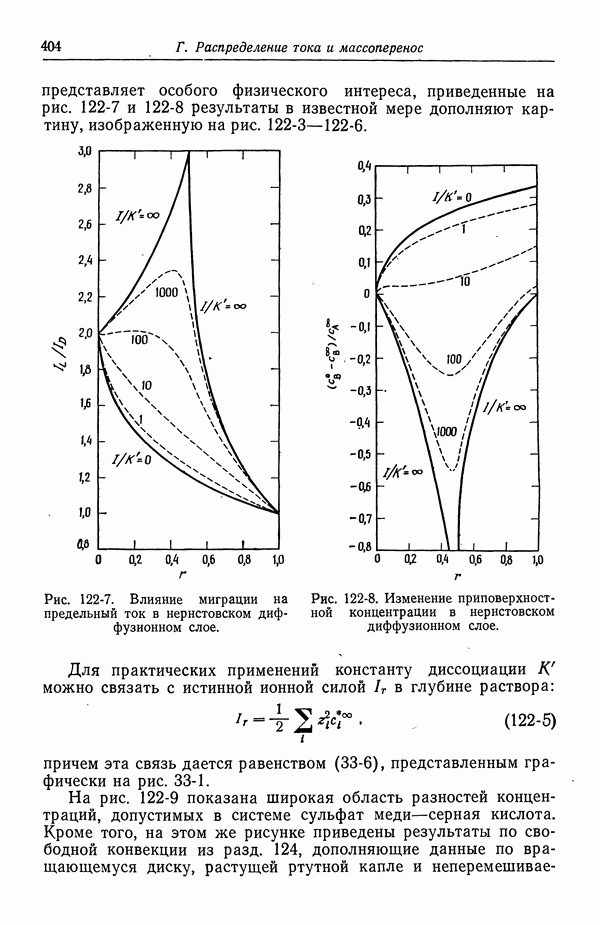
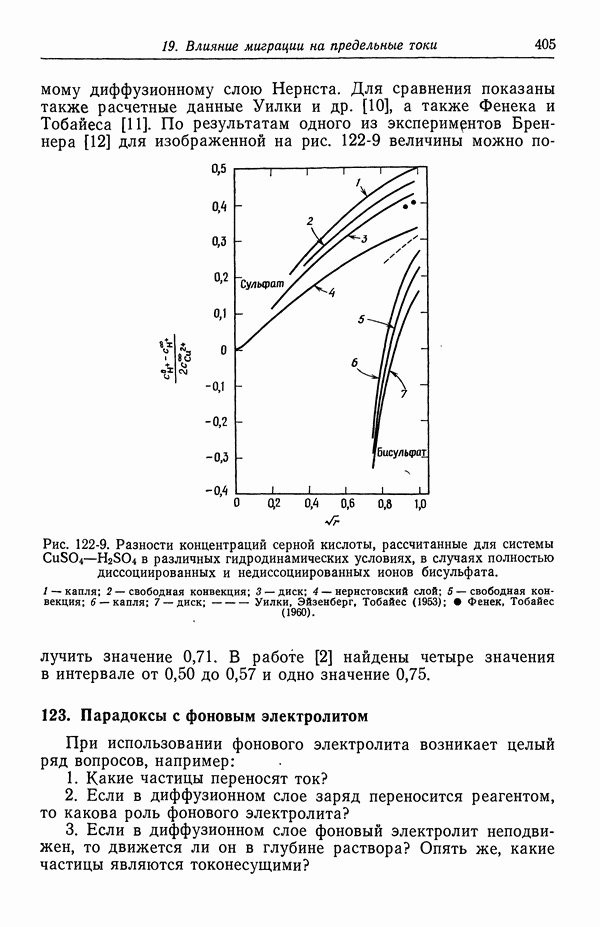
- 122. Роль ионов бисульфата
- 123. Парадоксы с фоновым электролитом
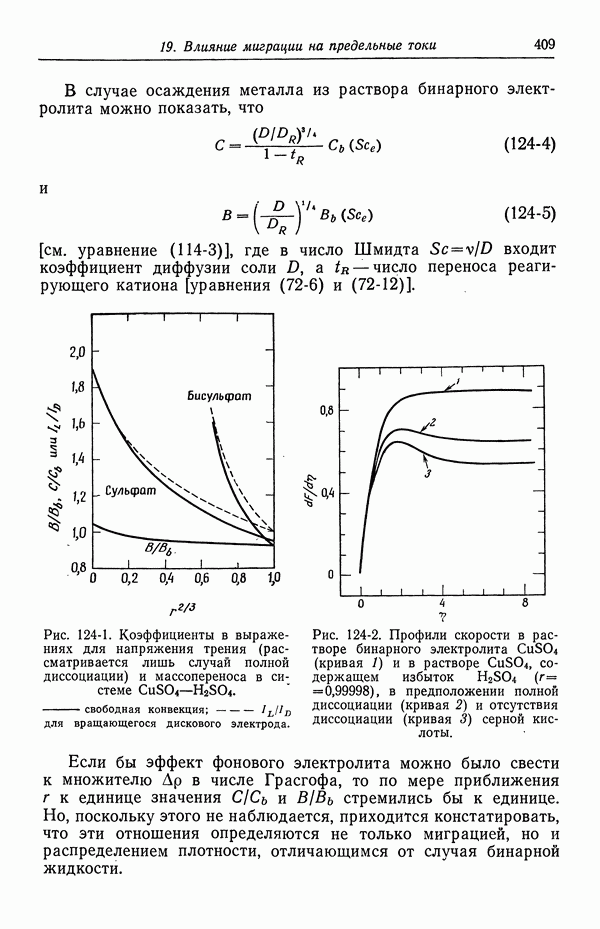
- 124. Предельные токи в случае свободной конвекции
- ЗАДАЧИ
- СПИСОК ОБОЗНАЧЕНИЙ
- Глава 20. КОНЦЕНТРАЦИОННОЕ ПЕРЕНАПРЯЖЕНИЕ
- 126. Бинарный электролит
- 127. Фоновый электролит
- 128. Численные расчеты
- ЗАДАЧИ
- СПИСОК ОБОЗНАЧЕНИЙ
- Глава 21. ДОПРЕДЕЛЬНЫЕ ТОКИ
- 129. Объем раствора
- 130. Диффузионные слои
- 131. Граничные условия и метод решения
- 132. Результаты для вращающегося диска
- ЗАДАЧИ
- СПИСОК ОБОЗНАЧЕНИЙ
- Приложение А. ПАРЦИАЛЬНЫЕ МОЛЯРНЫЕ ОБЪЕМЫ
- Приложение Б. ВЕКТОРЫ И ТЕНЗОРЫ
- Приложение В. ЧИСЛЕННОЕ РЕШЕНИЕ СИСТЕМЫ ОБЫКНОВЕННЫХ ДИФФЕРЕНЦИАЛЬНЫХ УРАВНЕНИЙ