| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
122. Кислородсодержащие соединения галогенов.
Галогены образуют ряд соединений с кислородом. Однако все эти соединения неустойчивы, не получаются при непосредственном взаимодействии галогенов с кислородом и могут быть получены только косвенным путем. Такие особенности кислородных соединений галогенов согласуются с тем, что почти все они характеризуются положительными значениями стандартной энергии Гиббса образования (см., например, в табл. 7 на стр. 194 значения для
для  ).
).
Из кислородсодержащих соединений галогенов наиболее устойчивы соли кислородных кислот, наименее— оксиды и кислоты. Во всех кислородсодержащих соединениях галогены, кроме фтора, проявляют положительную степень окисленности, достигающую семи.
Фторид кислорода  можно получить пропусканием фтора в охлажденный
можно получить пропусканием фтора в охлажденный  раствор
раствор  . Реакция идет согласно уравнению:
. Реакция идет согласно уравнению:

Помимо  при этом всегда образуются кислород, озон и пероксид водорода. При обычных условиях
при этом всегда образуются кислород, озон и пероксид водорода. При обычных условиях  — бесцветный газ с резким запахом озона. Фторид кислорода очень ядовит, проявляет сильные окислительные свойства и может служить одним из эффективных окислителей ракетных топлив.
— бесцветный газ с резким запахом озона. Фторид кислорода очень ядовит, проявляет сильные окислительные свойства и может служить одним из эффективных окислителей ракетных топлив.
Наиболее многочисленны и важны в практическом отношении кислородные соединения хлора, которые мы и рассмотрим несколько подробнее.
Как уже указывалось, кислородные соединения хлора могут быть получены только косвенными методами. Рассмотрение путей их образования начнем с процесса гидролиза хлора, т. е. с обратимой реакции между хлором и водой

в результате которой образуются соляная кислота и хлорноватстая кислота  .
.
Гидролиз хлора является реакцией самоокисления-самовосстановления, при которой один из атомов хлора, присоединяя к себе электрон от другого атома, восстанавливается, а другой атом хлора окисляется.
Получающиеся при гидролизе хлора  и
и  могут взаимодействовать друг с другом, снова образуя хлор и воду, поэтому реакция не идет до конца; равновесие устанавливается, когда прореагирует приблизительно
могут взаимодействовать друг с другом, снова образуя хлор и воду, поэтому реакция не идет до конца; равновесие устанавливается, когда прореагирует приблизительно  растворенного хлора. Таким образом, хлорная вода всегда содержит наряду с молекулами
растворенного хлора. Таким образом, хлорная вода всегда содержит наряду с молекулами  значительное количество соляной и хлорноватистой кислот.
значительное количество соляной и хлорноватистой кислот.
Хлорноватистая кислота  — очень слабая кислота (
— очень слабая кислота ( ), более слабая, чем угольная; соли ее называются гипохлоритами. Будучи весьма нестойким соединением, хлорноватистая кислота даже в разбавленном растворе постепенно распадается (см. ниже).
), более слабая, чем угольная; соли ее называются гипохлоритами. Будучи весьма нестойким соединением, хлорноватистая кислота даже в разбавленном растворе постепенно распадается (см. ниже).
Хлорноватистая кислота — очень сильный окислитель; ее образованием при взаимодействии хлора с водой объясняются белящие свойства хлора. Совершенно сухой хлор не белит, но в присутствии влаги происходит быстрое разрушение красящих веществ образующейся при гидролизе хлора хлорноватистой кислотой.
Если к хлорной воде прибавлять щелочь, то вследствие нейтрализации хлорноватистой и соляной кислот равновесие в системе

сдвигается вправо; реакция практически доходит до конца и получается раствор, содержащий соли хлорноватистой и соляной кислот:

Тот же результат получится, если непосредственно пропускать хлор в холодный раствор щелочи

или в ионно-молекулярной форме:

Полученный таким путем раствор солей хлорноватистой и соляной кислот применяется для беления; его белящие свойства обусловливаются тем, что гипохлорит калия легко разлагается уже при действии диоксида углерода, находящегося в воздухе, причем образуется хлорноватистая кислота:

Последняя и обесцвечивает красящие вещества, окисляя их.
Аналогичный раствор, содержащий гипохлорит натрия, получается при пропускании хлора в раствор гидроксида натрия. Оба раствора можно получить электролизом растворов хлоридов калия или натрия, если дать возможность выделяющемуся хлору реагировать с образующимися при электролизе щелочами (см, стр. 549).
При действии хлора на сухую гашеную известь получается так называемая белильная, или хлорная, известь. Главной ее составной частью является соль  , образующаяся согласно уравнению:
, образующаяся согласно уравнению:

Этой соли отвечает структурная формула  , согласно которой
, согласно которой  следует рассматривать как смешанную соль соляной и хлорноватистой кислот.
следует рассматривать как смешанную соль соляной и хлорноватистой кислот.
Хлорная известь представляет собой белый порошок с резким запахом и обладает сильными окислительными свойствами. Во влажном воздухе под действием диоксида углерода она постепенно разлагается, выделяя хлорноватистую кислоту:

При действии на хлорную известь соляной кислоты выделяется хлор:

Хлорная известь применяется для отбелки растительного волокна (тканей, бумаги) и для дезинфекции.
В растворе хлорноватистая кислота испытывает три различных типа превращений, которые протекают независимо друг от друга:

Изменяя условия, можно добиться того, что реакция пройдет практически нацело по какому-нибудь одному направлению.
Под действием прямого солнечного света и в присутствии некоторых катализаторов или восстановителей разложение хлорноватистой кислоты протекает согласно уравнению (1).
Реакция (2) идет в присутствии водоотнимающнх средств, например  . В результате реакции получается оксид
. В результате реакции получается оксид  (хлорноватистый ангидрид)
(хлорноватистый ангидрид)  , представляющий собой крайне неустойчивый желто-бурый газ с запахом, похожим на запах хлора.
, представляющий собой крайне неустойчивый желто-бурый газ с запахом, похожим на запах хлора.
Распад  согласно реакции (3) особенно легко идет при нагревании. Поэтому, если пропускать хлор в горячий раствор гидроксида калия, то вместо
согласно реакции (3) особенно легко идет при нагревании. Поэтому, если пропускать хлор в горячий раствор гидроксида калия, то вместо  сразу получается
сразу получается  :
:

Продуктами реакции являются хлорид калия и хлорит калия  — соль хлорноватой кислоты
— соль хлорноватой кислоты  . Поскольку хлорат калия (или бертолетова соль) мало растворим в холодной воде, то при охлаждении раствора он выпадает в осадок.
. Поскольку хлорат калия (или бертолетова соль) мало растворим в холодной воде, то при охлаждении раствора он выпадает в осадок.
Соответствующая хлоратам хлорноватая кислота известна только в виде водного раствора с концентрацией не выше  . Она проявляет свойства сильной кислоты (приблизительно равной по силе
. Она проявляет свойства сильной кислоты (приблизительно равной по силе  и
и  ) и сильного окислителя. Так, концентрированные ее растворы воспламеняют дерево.
) и сильного окислителя. Так, концентрированные ее растворы воспламеняют дерево.
В противоположность свободной  , у хлоратов окислительные свойства в растворе выражены слабо. Большинство из них хорошо растворимы в воде; все они ядовиты. Наибольшее применение из хлоратов находит
, у хлоратов окислительные свойства в растворе выражены слабо. Большинство из них хорошо растворимы в воде; все они ядовиты. Наибольшее применение из хлоратов находит  , который при нагревании легко разлагается. В присутствии
, который при нагревании легко разлагается. В присутствии  (в качестве катализатора) разложение в основном протекает согласно уравнению:
(в качестве катализатора) разложение в основном протекает согласно уравнению:

С различными горючими веществами (серой, углем, фосфором)  образует смеси, взрывающиеся при ударе. На этом основано его применение в артиллерийском деле для устройства запалов. Хлорат калия употребляется в пиротехнике для приготовления бенгальских огней и других легко воспламеняющихся смесей. Главный же потребитель хлората калия — спичечная промышленность. В головке обычной спички содержится около
образует смеси, взрывающиеся при ударе. На этом основано его применение в артиллерийском деле для устройства запалов. Хлорат калия употребляется в пиротехнике для приготовления бенгальских огней и других легко воспламеняющихся смесей. Главный же потребитель хлората калия — спичечная промышленность. В головке обычной спички содержится около  .
.
Ангидрид хлорноватой кислоты неизвестен. При действии концентрированной серной кислоты  вместо него выделяется желто-бурый газ с характерным запахом — диоксид (или двуокись) хлора
вместо него выделяется желто-бурый газ с характерным запахом — диоксид (или двуокись) хлора  . Это очень неустойчивое соединение, которое при нагревании, ударе или соприкосновении с прочими веществами легко разлагается со взрывом на хлор и кислород.
. Это очень неустойчивое соединение, которое при нагревании, ударе или соприкосновении с прочими веществами легко разлагается со взрывом на хлор и кислород.
Диоксид хлора применяют для отбелки или стерилизации различных материалов (бумажной массы, муки и  ).
).
При взаимодействии  с раствором щелочи медленно протекает реакция
с раствором щелочи медленно протекает реакция

с образованием солен двух кислот — хлорноватой  и хлористой
и хлористой  .
.
Хлористая кислота мало устойчива. По силе и окислительной активности она занимает промежуточное положение между  и
и  . Соли
. Соли  хлориты используются при отбелке тканей.
хлориты используются при отбелке тканей.
При осторожном нагревании хлората калия без катализатора его разложение протекает в основном согласно схеме:

Образующийся перхлорат калия  очень мало растворим в воде и поэтому может быть легко выделен.
очень мало растворим в воде и поэтому может быть легко выделен.
Действием концентрированной серной кислоты на  может быть получена свободная хлорная кислота
может быть получена свободная хлорная кислота  , представляющая собой бесцветную, дымящую на воздухе жидкость.
, представляющая собой бесцветную, дымящую на воздухе жидкость.
Безводная  малоустойчива и иногда взрывается при хранении, но ее водные растворы вполне устойчивы. Окислительные свойства
малоустойчива и иногда взрывается при хранении, но ее водные растворы вполне устойчивы. Окислительные свойства  выражены слабее, чем у
выражены слабее, чем у  , а кислотные свойства— сильнее. Хлорная кислота — самая сильная из всех известных кислот.
, а кислотные свойства— сильнее. Хлорная кислота — самая сильная из всех известных кислот.
Соли  , за немногими исключениями, к которым относится и
, за немногими исключениями, к которым относится и  , хорошо растворимы и в растворе окислительных свойств не проявляют.
, хорошо растворимы и в растворе окислительных свойств не проявляют.
Если нагревать хлорную кислоту с  , отнимающим от нее воду, то образуется оксид
, отнимающим от нее воду, то образуется оксид  , или хлорный ангидрид,
, или хлорный ангидрид, 

Оксид  - маслянистая жидкость, кипящая с разложением при
- маслянистая жидкость, кипящая с разложением при  . При ударе или при сильном нагревании
. При ударе или при сильном нагревании  взрывается.
взрывается.
Изменение свойств в ряду кислородных кислот хлора можно выразить следующей схемой:

С увеличением степени окисленности хлора устойчивость его кислородных кислот растет, а их окислительная способность уменьшается. Наиболее сильный окислитель — хлорноватистая кислота, наименее сильный — хлорная кислота.
Напротив, сила кислородных кислот хлора возрастает с увеличением его степени окисленности. Из всех гидроксидов хлора самая слабая кислота — хлорноватистая, самая сильная — хлорная. Такая закономерность — усиление кислотных свойств гидроксида  , соответственно, ослабление его основных свойств) с ростом степени окисленности элемента характерна не только для хлора, но и для других элементов. В первом приближении эту закономерность можно объяснить, рассматривая все химические связи в молекулах гидроксидов как чисто ионные.
, соответственно, ослабление его основных свойств) с ростом степени окисленности элемента характерна не только для хлора, но и для других элементов. В первом приближении эту закономерность можно объяснить, рассматривая все химические связи в молекулах гидроксидов как чисто ионные.
На рис. 108 схематически изображена часть молекулы гидроксида  , составленная из
, составленная из  -зарядного иона
-зарядного иона  , иона кислорода
, иона кислорода  и иона водорода (протона)
и иона водорода (протона)  . Диссоциация этой части молекулы на ионы может происходить либо с разрывом связи
. Диссоциация этой части молекулы на ионы может происходить либо с разрывом связи  (в результате чего отщепляется
(в результате чего отщепляется  ), либо с разрывом связи
), либо с разрывом связи  (что приводит к отщеплению иона
(что приводит к отщеплению иона  ); в первом случае гидроксид будет проявлять свойства основания, во втором — свойства кислоты.
); в первом случае гидроксид будет проявлять свойства основания, во втором — свойства кислоты.
Каждый из возможных путей диссоциации гидроксида будет осуществляться тем легче, чем слабее связь между соответствующими ионами. При возрастании степени окисленности элемента  увеличится заряд иона
увеличится заряд иона  , что усилит его притяжение к иону
, что усилит его притяжение к иону  и тем самым затруднит диссоциацию гидроксида по типу основания.
и тем самым затруднит диссоциацию гидроксида по типу основания.

Рис. 108. Ионная схема фрагмента молекулы гидроксида 
Вместе с тем усилится взаимное отталкивание одноименно заряженных ионов  и
и  , что облегчит диссоциацию по кислотному типу. Таким образом, с увеличением степени окисленности элемента усиливаются кислотные свойства и ослабевают основные свойства образуемого этим элементом гидроксида.
, что облегчит диссоциацию по кислотному типу. Таким образом, с увеличением степени окисленности элемента усиливаются кислотные свойства и ослабевают основные свойства образуемого этим элементом гидроксида.
Увеличение радиуса иона  при неизменном его заряде приведет к возрастанию расстояний между центром этого иона и центрами ионов
при неизменном его заряде приведет к возрастанию расстояний между центром этого иона и центрами ионов  и
и  . В результате взаимное электростатическое притяжение ионов
. В результате взаимное электростатическое притяжение ионов  и
и  станет более слабым, что облегчит диссоциацию по основному типу; одновременно уменьшится взаимное отталкивание ионов
станет более слабым, что облегчит диссоциацию по основному типу; одновременно уменьшится взаимное отталкивание ионов  и
и  , так что диссоциация по кислотному типу затруднится. Следовательно, с возрастанием радиуса иона элемента (при неизменном его заряде) усиливаются основные свойства и ослабляются кислотные свойства образуемого этим элементом гидроксида. Примером проявления этой закономерности может служить изменение констант кислотной диссоциации в ряду
, так что диссоциация по кислотному типу затруднится. Следовательно, с возрастанием радиуса иона элемента (при неизменном его заряде) усиливаются основные свойства и ослабляются кислотные свойства образуемого этим элементом гидроксида. Примером проявления этой закономерности может служить изменение констант кислотной диссоциации в ряду  .
.
Разумеется, предположение о чисто ионной природе химических связей в молекулах гидроксидов является весьма грубым. В действительности связь  имеет преимущественно ковалентный характер, а связь
имеет преимущественно ковалентный характер, а связь  можно считать близкой к ионной только для щелочных металлов. Кроме того, изложенная трактовка кислотно-основных свойств гидроксидов не учитывает особенностей взаимодействия ионов
можно считать близкой к ионной только для щелочных металлов. Кроме того, изложенная трактовка кислотно-основных свойств гидроксидов не учитывает особенностей взаимодействия ионов  и
и  с молекулами растворителя (воды). Поэтому рассмотренная схема влияния заряда и размеров иона
с молекулами растворителя (воды). Поэтому рассмотренная схема влияния заряда и размеров иона  на характер диссоциации молекулы
на характер диссоциации молекулы  не может служить основой для количественной оценки кислотноосновных свойств гидроксидов. Однако при сопоставлении кислотно-основных свойств различных гидроксидов, образуемых данным элементом в разных состояниях его окисленности, или при сопоставлении свойств аналогичных гидроксидов, образуемых элементами одной и той же подгруппы периодической системы, эта схема в большинстве случаев приводит к правильным качественным выводам.
не может служить основой для количественной оценки кислотноосновных свойств гидроксидов. Однако при сопоставлении кислотно-основных свойств различных гидроксидов, образуемых данным элементом в разных состояниях его окисленности, или при сопоставлении свойств аналогичных гидроксидов, образуемых элементами одной и той же подгруппы периодической системы, эта схема в большинстве случаев приводит к правильным качественным выводам.
Кислородные соединения брома и иода. Растворы бромноватистой (НОВг) и иодноватистой (HOI) кислот могут быть получены, подобно хлорноватистой кислоте, взаимодействием соответствующих галогенов с водой

причем в ряду  равновесие все в большей степени смещается влево.
равновесие все в большей степени смещается влево.
При переходе от  к НОВг и HOI устойчивость и окислительная активность кислот уменьшаются. По этому же ряду ослабляются и кислотные свойства (см. выше). Иодноватистая кислота HOI является уже амфотерным соединением, у которого основные свойства несколько преобладают
к НОВг и HOI устойчивость и окислительная активность кислот уменьшаются. По этому же ряду ослабляются и кислотные свойства (см. выше). Иодноватистая кислота HOI является уже амфотерным соединением, у которого основные свойства несколько преобладают  кислотными.
кислотными.
Бромноватую  и йодноватую
и йодноватую  кислоты можно получить путем окисления бромной или йодной воды хлором:
кислоты можно получить путем окисления бромной или йодной воды хлором:

Бромноватая кислота очень похожа по свойствам на  , а окислительные и кислотные свойства
, а окислительные и кислотные свойства  выражены значительно слабее.
выражены значительно слабее.
Иодноватая кислота представляет собой бесцветные кристаллы, вполне устойчивые при комнатной температуре. При осторожном нагревании ее до  можно получить порошок оксида
можно получить порошок оксида  , или йодноватого ангидрида —
, или йодноватого ангидрида —  :
:

Йодноватый ангидрид проявляет окислительные свойства, а при нагревании выше  распадается на
распадается на  и кислород.
и кислород.
До недавнего времени считали, что бром не образует соединений, в которых его степень окисленности равна семи. Однако в 1968 г. путем окисления  были получены перброматы и соответствующая им бромная кислота
были получены перброматы и соответствующая им бромная кислота  . Наилучшим окислителем оказался
. Наилучшим окислителем оказался  :
:

О свойствах бромной кислоты и ее солей пока известно мало. Напротив, йодная кислота  и ее соли (периодаты) хорошо изучены.
и ее соли (периодаты) хорошо изучены.
Сама кислота может быть получена действием иода на 

или электролизом раствора  :
:

Из раствора йодная кислота выделяется в виде бесцветных кристаллов, имеющих состав  . Этот гидрат следует рассматривать как пятиосновную кислоту
. Этот гидрат следует рассматривать как пятиосновную кислоту  (ортоиодную), так как в нем все пять атомов водорода могут замещаться металлами с образованием солей (например,
(ортоиодную), так как в нем все пять атомов водорода могут замещаться металлами с образованием солей (например,  ). Йодная кислота — слабая, но более сильный окислитель, чем
). Йодная кислота — слабая, но более сильный окислитель, чем  .
.
Оксид иода (VII)  не получен.
не получен.
| << Предыдущий параграф | Следующий параграф >> |
- ВВЕДЕНИЕ
- Глава I. АТОМНО-МОЛЕКУЛЯРНОЕ УЧЕНИЕ
- 4. Закон сохранения массы.
- 5. Основное содержание атомно-молекулярного учения.
- 6. Простое вещество и химический элемент.
- 7. Закон постоянства состава.
- 8. Закон объемных отношений.
- 9. Атомные и молекулярные массы. Моль.
- 10. Определение молекулярных масс веществ, находящихся в газообразном состоянии.
- 11. Парциальное давление газа.
- 12. Эквивалент. Закон эквивалентов.
- 13. Определение атомных масс. Валентность.
- 14. Химическая символика.
- 15. Важнейшие классы и номенклатура неорганических веществ.
- 16. Химические расчеты.
- Глава II ПЕРИОДИЧЕСКИЙ ЗАКОН Д. И. МЕНДЕЛЕЕВА
- 17. Периодический закон Д. И. Менделеева.
- 18. Периодическая система элементов.
- 19. Значение периодической системы.
- Глава III СТРОЕНИЕ АТОМА. РАЗВИТИЕ ПЕРИОДИЧЕСКОГО ЗАКОНА
- 20. Радиоктивность.
- 21. Ядерная модель атома.
- 22. Атомные спектры.
- 23. Квантовая теория света.
- 24. Строение электронной оболочки атома по Бору.
- 25. Исходные представления квантовой механики.
- 26. Волновая функция.
- 27. Энергетическое состояние электрона в атоме.
- 29. Орбитальное квантовое число. Формы электронных облаков.
- 30. Магнитное и спиновое квантовые числа.
- 31. Многоэлектронные атомы.
- 32. Принцип Паули. Электронная структура атомов и периодическая система элементов.
- 33. Размеры атомов и ионов.
- 34. Энергия ионизации и сродство к электрону.
- 35. Строение атомных ядер. Изотопы.
- 36. Радиоактивные элементы и их распад.
- 37. Искусственная радиоктивность. Ядерные реакции.
- Глава IV. ХИМИЧЕСКАЯ СВЯЗЬ И СТРОЕНИЕ МОЛЕКУЛ
- 38. Теория химического строения.
- 39. Ковалентная связь. Метод валентных связей.
- 40. Неполярная и полярная ковалентная связь.
- 41. Способы образования ковалентной связи.
- 42. Направленность ковалентной связи.
- 43. Гибридизация атомных электронных орбиталей.
- 44. Многоцентровые связи.
- 45. Метод молекулярных орбиталей.
- 46. Ионная связь.
- 47. Водородная связь.
- Глава V. СТРОЕНИЕ ТВЕРДОГО ТЕЛА И ЖИДКОСТИ
- 48. Межмолекулярное взаимодействие.
- 49. Кристаллическое состояние вещества.
- 50. Внутреннее строение кристаллов.
- 51. Реальные кристаллы.
- 52. Аморфное состояние вещества.
- 53. Жидкости.
- Глава VI. ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ПРОТЕКАНИЯ ХИМИЧЕСКИХ РЕАКЦИЙ
- 54. Превращения энергии при химических реакциях.
- 55. Термохимия.
- 56. Термохимические расчеты.
- 57. Скорость химической реакции.
- 59. Зависимость скорости реакции от температуры и от природы реагирующих веществ.
- 60. Катализ.
- 61. Скорость реакции в гетерогенных системах.
- 62. Цепные реакции.
- 63. Необратимые и обратимые реакции. Химическое равновесие.
- 64. Смещение химического равновесия. Принцип Ле Шателье.
- 65. Факторы, определяющие направление протекания химических реакций.
- 66. Термодинамические величины. Внутренняя энергия и энтальпия.
- 67. Термодинамические величины. Энтропия и энергия Гиббса.
- 68. Стандартные термодинамические величины. Химико-термодинамические расчеты.
- Глава VII. ВОДА, РАСТВОРЫ
- 69. Вода в природе.
- 70. Физические свойства воды.
- 71. Диаграмма состояния воды.
- 72. Химические свойства воды.
- 73. Характеристика растворов. Процесс растворения.
- 74. Способы выражения состава растворов.
- 75. Гидраты и кристаллогидраты.
- 76. Растворимость.
- 77. Пересыщенные растворы.
- 78. Осмос.
- 79. Давление пара растворов.
- 80. Замерзание и кипение растворов.
- Глава VIII. РАСТВОРЫ ЭЛЕКТРОЛИТОВ
- 81. Особенности растворов солей, кислот и оснований.
- 82. Теория электролитической диссоциации.
- 83. Процесс диссоциации.
- 84. Степень диссоциации. Сила электролитов.
- 85. Константа диссоциации.
- 86. Сильные электролиты.
- 87. Свойства кислот, оснований и солей с точки зрения теории электролитической диссоциации.
- 88. Ионно-молекулярные уравнения.
- 89. Произведение растворимости.
- 90. Диссоциация воды. Водородный показатель.
- 91. Смещение ионных равновесий.
- 92. Гидролиз солей.
- Глава IX. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ. ОСНОВЫ ЭЛЕКТРОХИМИИ
- 93. Окисленность элементов.
- 94. Окислительно-восстановительные реакции.
- 95. Составление уравнений окислительно-восстановительных реакций.
- 96. Важнейшие окислители и восстановители.
- 97. Окислительно-восстановительная двойственность.
- 98. Химические источники электрической энергии.
- 99. Электродные потенциалы.
- 100. Ряд напряжений металлов.
- 101. Электролиз.
- 102. Законы электролиза.
- 103. Электролиз в промышленности.
- 104. Электрохимическая поляризация.
- Глава X. ДИСПЕРСНЫЕ СИСТЕМЫ. КОЛЛОИДЫ
- 105. Дисперсное состояние вещества.
- 106. Состояние вещества на границе раздела фаз.
- 107. Коллоиды и коллоидные растворы.
- 108. Дисперсионный анализ.
- 109. Сорбция и сорбционные процессы.
- 110. Ионообменная адсорбция.
- 111. Хроматография.
- 112. Электрокинетические явления.
- 113. Устойчивость и коагуляция дисперсных систем.
- 114. Структурообразование в дисперсных системах.
- Глава XI. ВОДОРОД
- 115. Водород в природе. Получение водорода.
- 116. Свойства и применение водорода.
- 117. Пероксид водорода
- Глава XII. ГАЛОГЕНЫ
- 118. Галогены в природе. Физические свойства галогенов.
- 119. Химические свойства галогенов.
- 120. Получение и применение галогенов.
- 121. Соединения галогенов с водородом.
- 122. Кислородсодержащие соединения галогенов.
- Глава XIII. ГЛАВНАЯ ПОДГРУППА ШЕСТОЙ ГРУППЫ
- 123. Кислород в природе. Воздух.
- 124. Получение и свойства кислорода.
- 125. Озон.
- 126. Сера в природе. Получение серы.
- 127. Свойства и применение серы.
- 128. Сероводород. Сульфиды.
- 129. Диоксид серы. Сернистая кислота.
- 130. Триоксид серы. Серная кислота.
- 131. Получение и применение серной кислоты.
- 132. Пероксодвусерная кислота.
- 133. Тиосерная кислота.
- 134. Соединения серы с галогенами.
- 135. Селен (Selenium). Теллур (Tellurium).
- Глава XIV. ГЛАВНАЯ ПОДГРУППА ПЯТОЙ ГРУППЫ
- 136. Азот в природе. Получение и свойства азота.
- 137. Аммиак. Соли аммония.
- 138. Фиксация атмосферного азота. Получение аммиака.
- 139. Гидразин. Гидроксиламин. Азидоводород.
- 140. Оксиды азота.
- 141. Азотистая кислота.
- 142. Азотная кислота.
- 143. Промышленное получение азотной кислоты.
- 144. Круговорот азота в природе.
- 145. Фосфор в природе. Получение и свойства фосфора.
- 146. Соединения фосфора с водородом и галогенами.
- 147. Оксиды и кислоты фосфора.
- 148. Минеральные удобрения.
- 149. Мышьяк (Arsenicum).
- 150. Сурьма (Stibium).
- 151. Висмут (Bismuthum).
- Глава XV. ГЛАВНАЯ ПОДГРУППА ЧЕТВЕРТОЙ ГРУППЫ
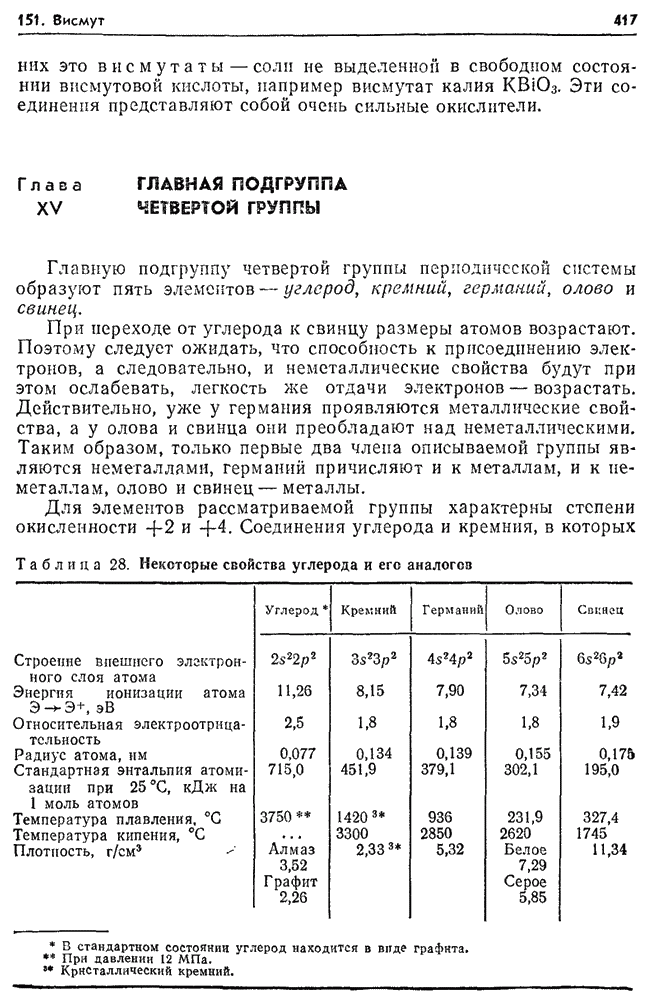
- 152. Углерод в природе.
- 153. Аллотропия углерода.
- 154. Химические свойства углерода. Карбиды.
- 155. Диоксид углерода. Угольная кислота.
- 156. Оксид углерода (II).
- 157. Соединения углерода с серой и азотом.
- 158. Топливо и его виды.
- 159. Газообразное топливо.
- 160. Общая характеристика органических соединений.
- 161. Отличительные особенности органических соединений.
- 162. Теория химического строения органических соединений.
- 163. Классификация органических соединений.
- 164. Предельные (насыщенные) углеводороды.
- 165. Непредельные (ненасыщенные) углеводороды.
- 166. Предельные циклические углеводороды.
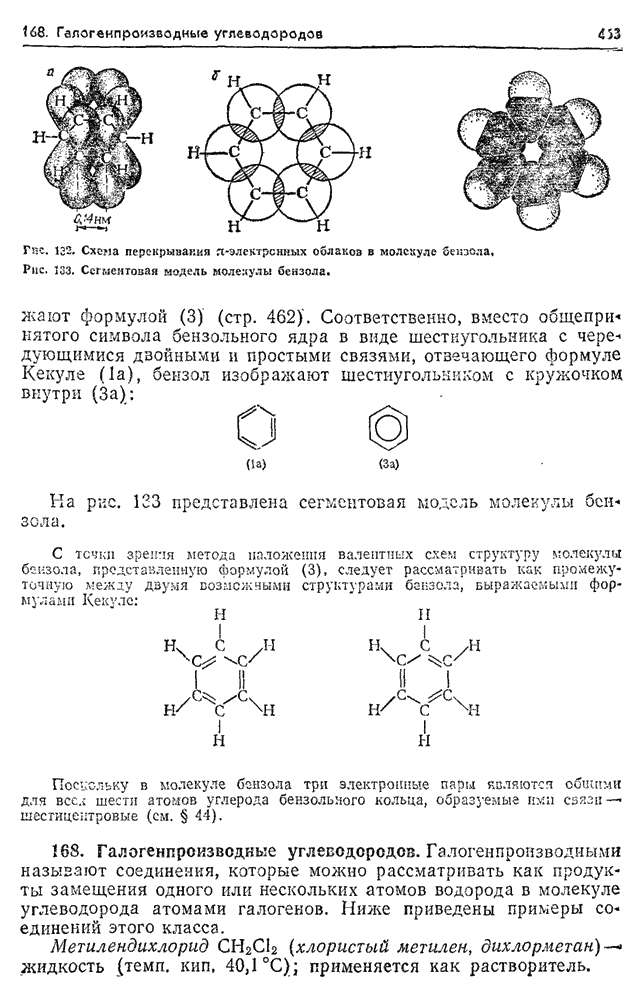
- 167. Ароматические углеводороды.
- 168. Галогенпроизводные углеводородов.
- 169. Спирты и фенолы.
- 170. Простые эфиры.
- 171. Альдегиды и кетоны.
- 172. Карбоновые кислоты.
- 173. Сложные эфиры карбоновых кислот. Жиры.
- 174. Углеводы.
- 175. Амины.
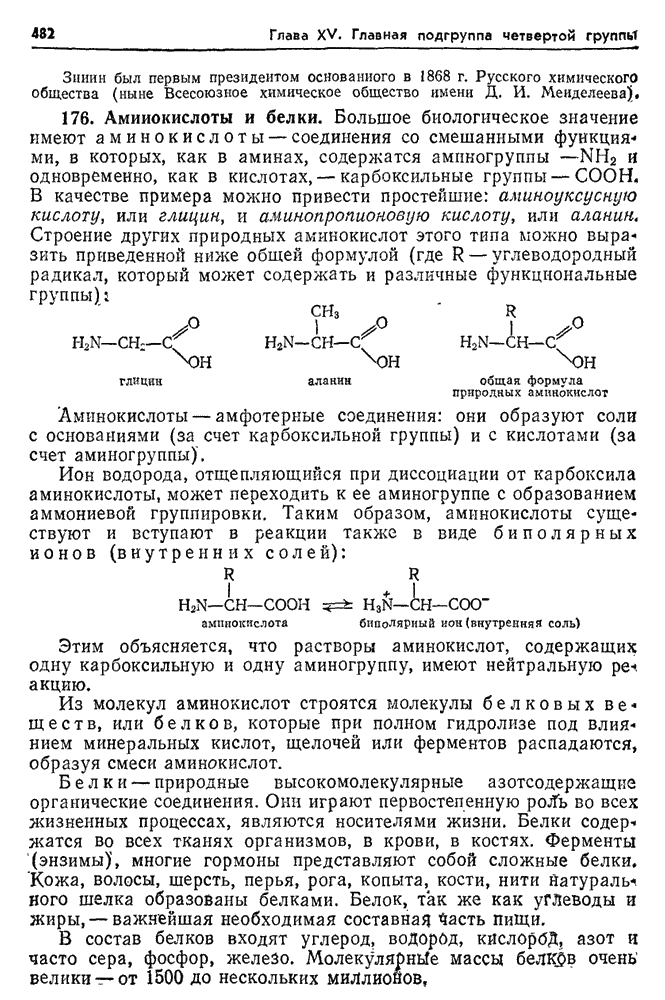
- 176. Аминокислоты и белки.
- 177. Природные и синтетические высокомолекулярные соединения (полимеры).
- 178. Кремний в природе. Получение и свойства кремния.
- 179. Соединения кремния с водородом и галогенами.
- 180. Диоксид кремния.
- 181. Кремниевые кислоты и их соли.
- 182. Стекло.
- 183. Керамика.
- 184. Цемент.
- 185. Кремнийорганические соединения.
- 186. Германий (Germanium).
- 187. Олово (Stannuin).
- 188. Свинец (Plumbum).
- 189. Свинцовый аккумулятор.
- Глава XVI. ОБЩИЕ СВОЙСТВА МЕТАЛЛОВ. СПЛАВЫ
- 190. Физические и химические свойства металлов. Электронное строение металлов, изоляторов и полупроводников.
- 191. Кристаллическое строение металлов.
- 192. Добывание металлов из руд.
- 193. Получение металлов высокой чистоты.
- 194. Сплавы.
- 195. Диаграммы состояния металлических систем.
- 196. Коррозия металлов.
- Глава XVII. ПЕРВАЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
- 197. Щелочные металлы в природе.
- 198. Натрий (Natrium).
- 199. Калий (Kalium).
- ПОДГРУППА МЕДИ
- 200. Медь. (Cuprum).
- 201. Серебро (Argentum).
- 202. Золото (Aurum).
- Глава XVIII. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
- 203. Основные положения координационной теории.
- 204. Основные типы и номенклатура комплексных соединений.
- 205. Пространственное строение и изомерия комплексных соединений.
- 206. Природа химической связи в комплексных соединениях.
- 207. Диссоциация комплексных соединений в растворах.
- 208. Влияние координации на свойства лигандов и центрального атома.
- Глава XIX. ВТОРАЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
- 209. Бериллий (Beryllium).
- 210. Магний (Magnesium).
- 211. Кальций (Calcium).
- 212. Жесткость природных вод и ее устранение.
- 213. Стронций (Strontium). Барий (Barium).
- 214. Цинк (Zincum).
- 215. Кадмий (Cadmium).
- 216. Ртуть (Hydrargyrum).
- Глава XX. ТРЕТЬЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
- 217. Бор (Borum).
- 218. Алюминий (Aluminium).
- 219. Галлий (Gallium). Иидий (Indium). Таллий (Thallium).
- ПОБОЧНАЯ ПОДГРУППА ТРЕТЬЕЙ ГРУППЫ. ЛАНТАНОИДЫ. АКТИНОИДЫ
- 220. Подгруппа скандия.
- 221. Лантаноиды.
- 222. Актиноиды.
- Глава XXI. ПОБОЧНЫЕ ПОДГРУППЫ ЧЕТВЕРТОЙ, ПЯТОЙ, ШЕСТОЙ И СЕДЬМОЙ ГРУПП
- ПОДГРУППА ТИТАНА
- 224. Титан (Titanium).
- 225. Цирконий (Zirconium). Гафний (Hafnium).
- ПОДГРУППА ВАНАДИЯ
- 226. Ванадий (Vanadium).
- 227. Ниобий (Niobium). Тантал (Tantalum).
- ПОДГРУППА ХРОМА
- 228. Хром (Chromium).
- 229. Молибден (Mollbdenium).
- 230. Вольфрам (Wolfram).
- ПОДГРУППА МАРГАНЦА
- 231. Марганец (Manganum).
- 232. Рений (Rhenium).
- Глава XXII. ВОСЬМАЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
- 233. Общая характеристика благородных газов.
- 234. Гелий (Helium).
- 235. Неон. Аргон.
- ПОБОЧНАЯ ПОДГРУППА ВОСЬМОЙ ГРУППЫ
- 236. Железо (Ferrum).
- 237. Значение железа и его сплавов в технике. Развитие металлургии в СССР.
- 238. Физические свойства железа. Диаграмма состояния системы железо — углерод.
- 239. Производство чугуна и стали.
- 240. Термическая обработка стали.
- 241. Сплавы железа.
- 242. Химические свойства железа. Соединения железа.
- 243. Кобальт (Cobaltum).
- 244. Никель (Niccolum).
- 245. Общая характеристика платиновых металлов.
- 246. Платина (Platinum).
- 247. Палладий (Palladium). Иридий (Iridium).
- ПРИЛОЖЕНИЕ
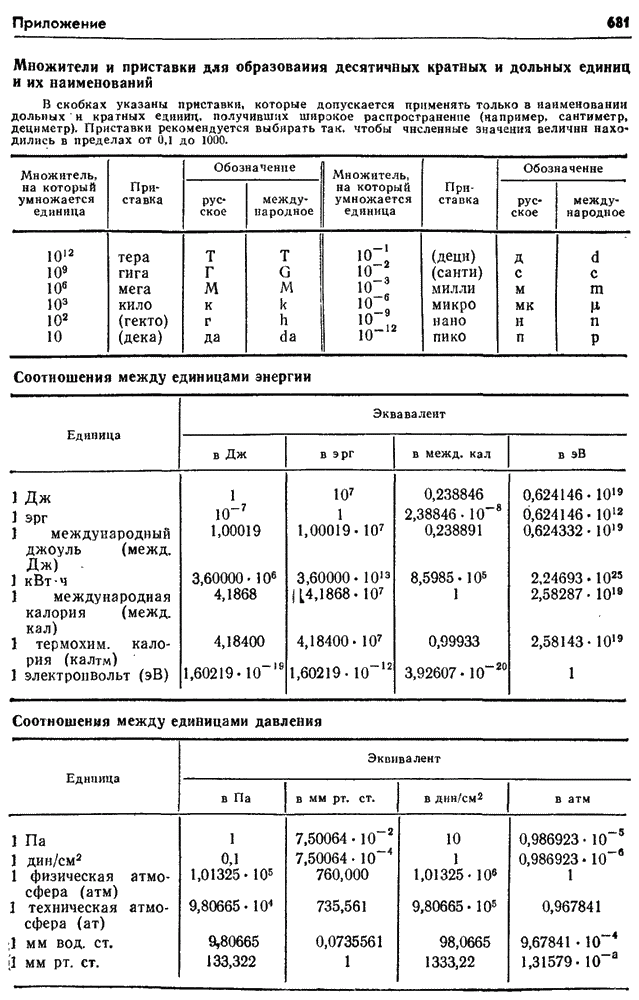
- Некоторые единицы СИ
- Множители и приставки для образования десятичных кратных и дольных единиц и их наименований
- Соотношения между некоторыми внесистемными единицами и единицами СИ
- Литература для углубленного изучения общей и неорганической химии