| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
196. Коррозия металлов.
Металлические материалы — металлы и сплавы на основе металлов, — приходя в соприкосновение с окружающей их средой (газообразной или жидкой), подвергаются с той или иной скоростью разрушению. Причина этого разрушения лежит в химическом взаимодействии: металлы вступают в окислительно-восстановительные реакции с веществами, находящимися в окружающей среде, и окисляются.Самопроизвольное разрушение металлических материалов, происходящее под химическим воздействием окружающей среды, называется коррозией (от латинского «corrodere» — разъедать).
Общая масса металлических материалов, используемых в виде различных изделий в мировом хозяйстве, очень велика. Поэтому, несмотря на то, что обычно скорость коррозии мала, ежегодно из-за коррозии безвозвратно теряются огромные количества металла. По ориентировочным подсчетам мировая потеря металла от коррозии выражается величиной 20 миллионов тонн в год. Но еще больший вред связан не с потерей металла, а с порчей изделии, вызываемой коррозией.
Затраты на ремонт или на замену деталей судов, автомобилей, аппаратуры химических производств, проборов во много раз превышают стоимость металла, из которого они изготовлены. Наконец, существенными бывают косвенные потери, вызванные коррозией. К ним можно отнести, например, утечку нефти или газа из подвергшихся коррозии трубопроводов, порчу продуктов питания, потерю здоровья, а иногда и жизни людей в тех случаях, когда это вызвано коррозией. Таким образом, борьба с коррозией представляет собой важную народнохозяйственную проблему. Поэтому на защиту от коррозии тратятся большие средства.
К важнейшим случаям коррозии относятся коррозия в газах (газовая коррозия) и коррозия в растворах электролитов (электрохимическая коррозия). Коррозия в газах происходит при повышенных температурах, когда конденсация влаги на поверхности металла невозможна. Газовой коррозии подвергаются арматура печей, детали двигателей внутреннего сгорания, лопатки газовых турбин и т. п. Газовую коррозию претерпевает также металл, подвергаемый термической обработке. В результате газовой коррозии на поверхности металла образуются соответствующие соединения: оксиды, сульфиды и др.
Для изготовления аппаратуры, подвергающейся действию коррозионноактивных газов, применяют жаростойкие сплавы. Для придания жаростойкости стали и чугуну в их состав вводят хром, кремний, алюминий; применяются также сплавы на основе никеля или кобальта. Защита от газовой коррозии осуществляется, кроме того, насыщением в горячем состоянии поверхности изделия некоторыми металлами, обладающими защитным действием. К таким металлам принадлежат алюминий и хром. Защитное действие этих металлов обусловлено образованием на их поверхности весьма тонкой, но прочной оксидной пленки, препятствующей взаимодействию металла с окружающей средой. В случае алюминия зтот метод носит название алитирования, в случае хрома — термохромирования.
К электрохимической коррозии относятся все случаи коррозии в водных растворах. Электрохимической коррозии подвергаются, например, подводные части судов, паровые котлы, проложенные в земле трубопроводы. Коррозия металла, находящегося во влажной атмосфере, также представляет собой электрохимическую коррозию. В результате электрохимической коррозии окисление металла может приводить как к образованию нерастворимых продуктов (например, ржавчины), так и к переходу металла в раствор в виде ионов.
В воде обычно содержится растворенный кислород, способный к восстановлению:

Кроме того, в воде присутствуют ионы водорода, также способные к восстановлению:

Растворенный кислород и ионы водорода — важнейшие окислители, вызывающие электрохимическую коррозию металлов.
Рассмотрим, какие металлы могут быть окислены растворенным в воде кислородом, и какие — ионами водорода. Потенциал, отвечающий электродному процессу

равен (см. табл. 18 на стр. 277):

В нейтральных средах  он будет иметь значение:
он будет иметь значение:

Следовательно, растворенный в воде или в нейтральном водном растворе кислород может окислить те металлы, потенциал которых меньше, чем 0,8 В; они расположены в ряду напряжений от его начала до серебра.
Потенциал, отвечающий электродному процессу

в нейтральной среде, равен приблизительно —0,41 В (см. стр. 282). Следовательно, ионы водорода, находящиеся в воде и в нейтральных водных средах, могут окислить только те металлы, потенциал которых меньше, чем —0,41 В, — это металлы от начала ряда напряжений до кадмия. При этом кадмий и металлы, близкие к нему в ряду напряжений, имеют на своей поверхности защитную пленку, препятствующую взаимодействию этих металлов с водой. Поэтому число металлов, которые могут быть окислены ионами водорода в нейтральных средах, еще меньше.
Таким образом, вода, содержащая растворенный кислород, значительно опаснее в коррозионном отношении, чем вода, не содержащая его и способная окислять металлы только ионами водорода.
При использовании металлических материалов очень важным является вопрос о скорости их коррозии. Кроме природы металла  окислителя и содержания последнего, на скорость коррозии могут влиять различные примеси, содержащиеся как в самом металле, так и в коррозионной среде—в атмосфере или в растворе.
окислителя и содержания последнего, на скорость коррозии могут влиять различные примеси, содержащиеся как в самом металле, так и в коррозионной среде—в атмосфере или в растворе.
При коррозии металла, содержащего включения другого металла, могут наблюдаться, в зависимости от размеров включений, два различных случая.
Включения инородного металла очень малы. Такие включения практически не изменяют величину потенциала основного металла в данном растворе.
В этом случае ускорение коррозии может наблюдаться, если перенапряжение окислительной полуреакдни на металле включения меньше, чем на основном металле.
В качестве примера можно указать на коррозию цинка, содержащего небольшие примеси железа или меди, в соляной или в разбавленной серной кислотах. При содержании в цинке сотых долей процента какого-либо из этих металлов скорость взаимодействия его с указанными кислотами в сотни раз выше, чем в случае цинка, подвергшегося специальной очистке. Это объясняется тем, что перенапряжение выделения водорода на меди и на железе ниже, чем на цинке, а лимитирующей стадией (см. § 61) реакции

является именно процесс восстановления ионов водорода.
Включения инородного металла не столь малы. Потенциал таких включений отличен от потенциала оснозного металла. В этом случае, помимо величины перенапряжения окислительной полуреакции на металле включения, на скорость коррозии может повлиять поляризующее действие (см. § 104) металла включения на основной металл. Если металл включения имеет больший потенциал, чем основной металл, то последний поляризуется анодно и скорость его коррозии возрастает. Например, алюминий, содержащий включения железа или меди, корродирует значительно быстрее, чем алюминий высокой чистоты.
Скорость коррозии металла повышается также при включений в него неметаллических примесей, потенциал которых выше потенциала основного металла. Так, включения оксидов или шлаков в стали сильно снижают ее коррозионную стойкость.
Примеси, находящиеся в окружающей среде, могут адсорбироваться на поверхности металла и также каталитически влиять на коррозию, ускоряя или замедляя ее. Например, большинство сплавов железа корродирует в морской воде гораздо быстрее, чем в воде с такой же концентрацией кислорода, не содержащей хлоридов. Это обусловлено тем, что хлорид-ионы, адсорбируясь на поверхности железа, препятствуют образованию на ней защитных слоев.
Как уже говорилось (см. § 100), некоторые металлы в определенных условиях переходят в пассивное состояние — на их поверхности образуются слои или пленки, состоящие из адсорбированного кислорода, из оксида данного металла, или из его соли. Присутствие таких слоев и их структура сильно влияют на скорость коррозии металла; в ряде случаев эти слои обладают защитным действием, вследствие чего металл корродирует лишь ничтожно медленно. В условиях атмосферного воздуха пассивирующие пленки образуются на хроме, никеле, алюминии, цинке.
К важным случаям электрохимической коррозии относятся коррозия в природных водах, в растворах, атмосферная коррозия, коррозия в грунте, коррозия при неравномерной аэрации, контактная коррозия.
Атмосферная коррозия — коррозия во влажном воздухе при обычных температурах. Поверхность металла, находящегося во влажном воздухе, бывает покрыта пленкой воды, содержащей различные газы, и в первую очередь — кислород. Скорость атмосферной коррозии зависит от условий. В частности, на нее влияет влажность воздуха и содержание в нем газов, образующих с водою кислоты  . Большое значение имеет также состояние поверхности металла: скорость атмосферной коррозии резко возрастает при наличии на поверхности шероховатостей, микрощелей, пор, зазоров и других мест, облегчающих конденсацию влаги.
. Большое значение имеет также состояние поверхности металла: скорость атмосферной коррозии резко возрастает при наличии на поверхности шероховатостей, микрощелей, пор, зазоров и других мест, облегчающих конденсацию влаги.
Коррозия в грунте приводит к разрушению проложенных под землей трубопроводов, оболочек кабелей, деталей строительных сооружений. Металл в этих условиях соприкасается с влагой грунта, содержащей растворенный воздух. В зависимости от состава грунтовых вод, а также от структуры и минералогического состава грунта, скорость этого вида коррозии может быть весьма различной.
Коррозия при неравномерной аэрации — наблюдается в тех случаях, когда деталь или конструкция находится в растворе, но доступ растворенного кислорода к различным ее частям неодинаков. При этом те части металла, доступ кислорода к которым минимален, корродируют значительно сильнее тех частей, доступ кислорода к которым больше. Такое неравномерное распределение коррозии объясняется следующим образом. При восстановлении кислорода

расходуются ионы водорода и раствор, следовательно, несколько подщелачивается. Металлы, и в частности железо, при подщелачивании раствора легче переходят в пассивное состояние. Поэтому аэрируемые участки металла переходят в пассивное состояние и скорость коррозии на них снижается. На неаэрируемых участках не происходит пассивирования — здесь протекает процесс окисления металла, приводящий к переходу его ионов в раствор:

Таким образом, при неравномерной аэрации металла осуществляется пространственное разделение окислительно-восстановительной реакции: восстановление кислорода протекает на более аэрируемых участках, а окисление металла — на менее аэрируемых участках поверхности.
Локализация процесса окисления приводит к местной коррозии — интенсивному разрушению металла на отдельных участках. Местная коррозия приводит к появлению на поверхности металла углублений  , которые со временем могут превращаться в сквозные отверстия. Иногда развитие
, которые со временем могут превращаться в сквозные отверстия. Иногда развитие  трудно обнаружить, например, из-за остатков окалины на поверхности металла. Этот вид коррозии особенно опасен для обшивки судов, для промышленной химической аппаратуры и в ряде других случаев.
трудно обнаружить, например, из-за остатков окалины на поверхности металла. Этот вид коррозии особенно опасен для обшивки судов, для промышленной химической аппаратуры и в ряде других случаев.
Контактная коррозия может протекать, когда два металла с различными потенциалами соприкасаются друг с другом либо в водной среде, либо при наличии влаги, конденсирующейся из воздуха. Так же, как и в рассмотренном выше случае значительных включении, металлы оказывают друг на друга поляризующее действие; металл с меньшим потенциалом поляризуется анодно, и скорость его коррозии вблизи места контакта резко возрастает.
Контактная коррозия наблюдается, например, в теплофикационных установках, когда медные нагревательные змеевики соединены с железными кипятильниками или трубами. Интенсивная коррозия железа протекает около мест соединения. Однако соотношение между потенциалами контактирующих металлов зависит не только от природы металлов, но также от природы растворенных в воде веществ, от температуры и от других условий и не всегда соответствует взаимному положению металлов в ряду напряжений. Так, в случае контакта железо — цинк последний интенсивно корродирует при комнатной температуре, но в горячей воде полярность металлов изменяется и растворяться начинает железо.
Для предупреждения коррозии и защиты от нее применяются разнообразные методы. К важнейшим из них относятся следующие:
1) применение химически стойких сплавов;
2) защита поверхности металла покрытиями;
3) обработка коррозионной среды;
4) электрохимические методы.
Из химически стойких сплавов наиболее широкое применение имеют нержавеющие стали, в состав которых входит до  хрома и до
хрома и до  никеля.
никеля.
Покрытия, применяемые для защиты металлов, подразделяются на металлические, неметаллические и образованные в результате химической или электрохимической обработки поверхности металла.
В качестве металлов для покрытия обычно применяют металлы, образующие на своей поверхности защитные пленки. Как уже говорилось, к таким металлам относятся хром, никель, цинк, кадмий, алюминий, олово и некоторые другие. Значительно реже применяются металлы, имеющие высокий электродный потенциал — серебро, золото.
Существуют различные способы нанесения металлических покрытий; наибольшие преимущества имеют методы гальванотехники (см. § 103).
К неметаллическим относятся покрытия лаками, красками, эмалями, феиолоформальдегидными и другими смолами. Для длительной защиты от атмосферной коррозии металлических сооружений, деталей, машин, приборов чаще всего применяются лакокрасочные покрытия.
Покрытия, создаваемые химической или электрохимической обработкой металла, представляют собой в основном защитные оксидные или солевые пленки. Примерами могут служить оксидирование алюминия (создание на его поверхности стойких оксидных пленок), фосфатирование стальных изделий (создание защитных пленок, состоящих из фосфатов).
Метод обработки внешней среды пригоден для случаез, когда защищаемое изделие эксплуатируется в ограниченном объеме жидкости. Метод состоит в удалении из раствора, в котором эксплуатируется защищаемая деталь, растворенного кислорода (деаэрация) или в добавлении к этому раствору веществ, замедляющих коррозию, — ингибиторов. В зависимости от природы металла и раствора применяются различные ингибиторы: нитрит натрия, хромат и дихромат калия, фосфаты натрия, некоторые высокомолекулярные органические соединения и другие. Защитное действие этих веществ обусловлено тем, что их молекулы или ионы адсорбируются на поверхности металла и каталитически снижают скорость коррозии, а некоторые из них (например, хроматы и дихроматы) переводят металл в пассивное состояние.
К электрохимическим методам защиты металлов относятся катодная защита и метод протекторов. При катодной защите защищаемая конструкция или деталь присоединяется к отрицательному полюсу источника электрической энергии и становится катодом. В качестве анодов используются куски железа. При надлежащей силе тока в цепи на защищаемом изделии происходит восстановление окислителя, процесс же окисления претерпевает вещество анода.
Метод протекторов осуществляется присоединением к защищаемому металлу большого листа, изготовленного из другого, более активного металла — протектора. В качестве протектора при защите стальных изделий обычно применяют цинк или сплавы  основе магния. При хорошем контакте между металлами защищаемый металл (железо) и металл протектора (например, цинк) оказывают друг на друга поляризующее действие. Согласно взаимному положению этих металлов в ряду напряжений, железо поляризуется катодно, а цинк — анодно. В результате этого на железе идет процесс восстановления того окслителя, который присутствует в воде (обычно растворенный кислород), а цинк окисляется.
основе магния. При хорошем контакте между металлами защищаемый металл (железо) и металл протектора (например, цинк) оказывают друг на друга поляризующее действие. Согласно взаимному положению этих металлов в ряду напряжений, железо поляризуется катодно, а цинк — анодно. В результате этого на железе идет процесс восстановления того окслителя, который присутствует в воде (обычно растворенный кислород), а цинк окисляется.
И протекторы, и катодная защита применимы в средах, хорошо проводящих электрический ток, например в морской воде. В частности, протекторы широко применяются для защиты подводных частей морских судов. Ясно, что убытки, вызванные коррозией корпуса морского судна и связанные с его простоем и ремонтом, очень велики и во много раз превышают стоимость протекторов,
| << Предыдущий параграф | Следующий параграф >> |
- ВВЕДЕНИЕ
- Глава I. АТОМНО-МОЛЕКУЛЯРНОЕ УЧЕНИЕ
- 4. Закон сохранения массы.
- 5. Основное содержание атомно-молекулярного учения.
- 6. Простое вещество и химический элемент.
- 7. Закон постоянства состава.
- 8. Закон объемных отношений.
- 9. Атомные и молекулярные массы. Моль.
- 10. Определение молекулярных масс веществ, находящихся в газообразном состоянии.
- 11. Парциальное давление газа.
- 12. Эквивалент. Закон эквивалентов.
- 13. Определение атомных масс. Валентность.
- 14. Химическая символика.
- 15. Важнейшие классы и номенклатура неорганических веществ.
- 16. Химические расчеты.
- Глава II ПЕРИОДИЧЕСКИЙ ЗАКОН Д. И. МЕНДЕЛЕЕВА
- 17. Периодический закон Д. И. Менделеева.
- 18. Периодическая система элементов.
- 19. Значение периодической системы.
- Глава III СТРОЕНИЕ АТОМА. РАЗВИТИЕ ПЕРИОДИЧЕСКОГО ЗАКОНА
- 20. Радиоктивность.
- 21. Ядерная модель атома.
- 22. Атомные спектры.
- 23. Квантовая теория света.
- 24. Строение электронной оболочки атома по Бору.
- 25. Исходные представления квантовой механики.
- 26. Волновая функция.
- 27. Энергетическое состояние электрона в атоме.
- 29. Орбитальное квантовое число. Формы электронных облаков.
- 30. Магнитное и спиновое квантовые числа.
- 31. Многоэлектронные атомы.
- 32. Принцип Паули. Электронная структура атомов и периодическая система элементов.
- 33. Размеры атомов и ионов.
- 34. Энергия ионизации и сродство к электрону.
- 35. Строение атомных ядер. Изотопы.
- 36. Радиоактивные элементы и их распад.
- 37. Искусственная радиоктивность. Ядерные реакции.
- Глава IV. ХИМИЧЕСКАЯ СВЯЗЬ И СТРОЕНИЕ МОЛЕКУЛ
- 38. Теория химического строения.
- 39. Ковалентная связь. Метод валентных связей.
- 40. Неполярная и полярная ковалентная связь.
- 41. Способы образования ковалентной связи.
- 42. Направленность ковалентной связи.
- 43. Гибридизация атомных электронных орбиталей.
- 44. Многоцентровые связи.
- 45. Метод молекулярных орбиталей.
- 46. Ионная связь.
- 47. Водородная связь.
- Глава V. СТРОЕНИЕ ТВЕРДОГО ТЕЛА И ЖИДКОСТИ
- 48. Межмолекулярное взаимодействие.
- 49. Кристаллическое состояние вещества.
- 50. Внутреннее строение кристаллов.
- 51. Реальные кристаллы.
- 52. Аморфное состояние вещества.
- 53. Жидкости.
- Глава VI. ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ПРОТЕКАНИЯ ХИМИЧЕСКИХ РЕАКЦИЙ
- 54. Превращения энергии при химических реакциях.
- 55. Термохимия.
- 56. Термохимические расчеты.
- 57. Скорость химической реакции.
- 59. Зависимость скорости реакции от температуры и от природы реагирующих веществ.
- 60. Катализ.
- 61. Скорость реакции в гетерогенных системах.
- 62. Цепные реакции.
- 63. Необратимые и обратимые реакции. Химическое равновесие.
- 64. Смещение химического равновесия. Принцип Ле Шателье.
- 65. Факторы, определяющие направление протекания химических реакций.
- 66. Термодинамические величины. Внутренняя энергия и энтальпия.
- 67. Термодинамические величины. Энтропия и энергия Гиббса.
- 68. Стандартные термодинамические величины. Химико-термодинамические расчеты.
- Глава VII. ВОДА, РАСТВОРЫ
- 69. Вода в природе.
- 70. Физические свойства воды.
- 71. Диаграмма состояния воды.
- 72. Химические свойства воды.
- 73. Характеристика растворов. Процесс растворения.
- 74. Способы выражения состава растворов.
- 75. Гидраты и кристаллогидраты.
- 76. Растворимость.
- 77. Пересыщенные растворы.
- 78. Осмос.
- 79. Давление пара растворов.
- 80. Замерзание и кипение растворов.
- Глава VIII. РАСТВОРЫ ЭЛЕКТРОЛИТОВ
- 81. Особенности растворов солей, кислот и оснований.
- 82. Теория электролитической диссоциации.
- 83. Процесс диссоциации.
- 84. Степень диссоциации. Сила электролитов.
- 85. Константа диссоциации.
- 86. Сильные электролиты.
- 87. Свойства кислот, оснований и солей с точки зрения теории электролитической диссоциации.
- 88. Ионно-молекулярные уравнения.
- 89. Произведение растворимости.
- 90. Диссоциация воды. Водородный показатель.
- 91. Смещение ионных равновесий.
- 92. Гидролиз солей.
- Глава IX. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ. ОСНОВЫ ЭЛЕКТРОХИМИИ
- 93. Окисленность элементов.
- 94. Окислительно-восстановительные реакции.
- 95. Составление уравнений окислительно-восстановительных реакций.
- 96. Важнейшие окислители и восстановители.
- 97. Окислительно-восстановительная двойственность.
- 98. Химические источники электрической энергии.
- 99. Электродные потенциалы.
- 100. Ряд напряжений металлов.
- 101. Электролиз.
- 102. Законы электролиза.
- 103. Электролиз в промышленности.
- 104. Электрохимическая поляризация.
- Глава X. ДИСПЕРСНЫЕ СИСТЕМЫ. КОЛЛОИДЫ
- 105. Дисперсное состояние вещества.
- 106. Состояние вещества на границе раздела фаз.
- 107. Коллоиды и коллоидные растворы.
- 108. Дисперсионный анализ.
- 109. Сорбция и сорбционные процессы.
- 110. Ионообменная адсорбция.
- 111. Хроматография.
- 112. Электрокинетические явления.
- 113. Устойчивость и коагуляция дисперсных систем.
- 114. Структурообразование в дисперсных системах.
- Глава XI. ВОДОРОД
- 115. Водород в природе. Получение водорода.
- 116. Свойства и применение водорода.
- 117. Пероксид водорода
- Глава XII. ГАЛОГЕНЫ
- 118. Галогены в природе. Физические свойства галогенов.
- 119. Химические свойства галогенов.
- 120. Получение и применение галогенов.
- 121. Соединения галогенов с водородом.
- 122. Кислородсодержащие соединения галогенов.
- Глава XIII. ГЛАВНАЯ ПОДГРУППА ШЕСТОЙ ГРУППЫ
- 123. Кислород в природе. Воздух.
- 124. Получение и свойства кислорода.
- 125. Озон.
- 126. Сера в природе. Получение серы.
- 127. Свойства и применение серы.
- 128. Сероводород. Сульфиды.
- 129. Диоксид серы. Сернистая кислота.
- 130. Триоксид серы. Серная кислота.
- 131. Получение и применение серной кислоты.
- 132. Пероксодвусерная кислота.
- 133. Тиосерная кислота.
- 134. Соединения серы с галогенами.
- 135. Селен (Selenium). Теллур (Tellurium).
- Глава XIV. ГЛАВНАЯ ПОДГРУППА ПЯТОЙ ГРУППЫ
- 136. Азот в природе. Получение и свойства азота.
- 137. Аммиак. Соли аммония.
- 138. Фиксация атмосферного азота. Получение аммиака.
- 139. Гидразин. Гидроксиламин. Азидоводород.
- 140. Оксиды азота.
- 141. Азотистая кислота.
- 142. Азотная кислота.
- 143. Промышленное получение азотной кислоты.
- 144. Круговорот азота в природе.
- 145. Фосфор в природе. Получение и свойства фосфора.
- 146. Соединения фосфора с водородом и галогенами.
- 147. Оксиды и кислоты фосфора.
- 148. Минеральные удобрения.
- 149. Мышьяк (Arsenicum).
- 150. Сурьма (Stibium).
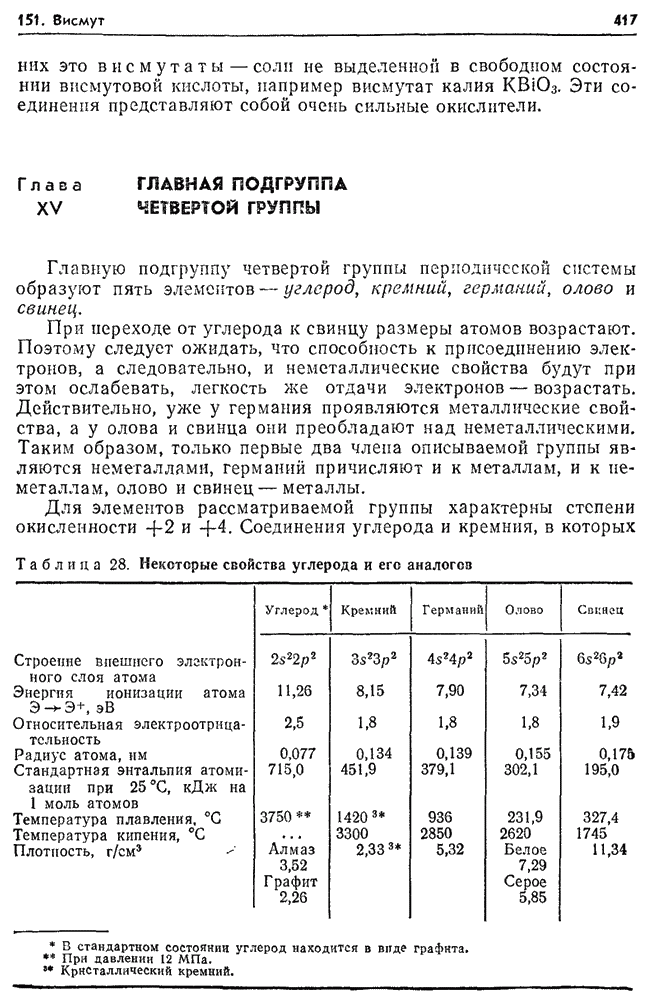
- 151. Висмут (Bismuthum).
- Глава XV. ГЛАВНАЯ ПОДГРУППА ЧЕТВЕРТОЙ ГРУППЫ
- 152. Углерод в природе.
- 153. Аллотропия углерода.
- 154. Химические свойства углерода. Карбиды.
- 155. Диоксид углерода. Угольная кислота.
- 156. Оксид углерода (II).
- 157. Соединения углерода с серой и азотом.
- 158. Топливо и его виды.
- 159. Газообразное топливо.
- 160. Общая характеристика органических соединений.
- 161. Отличительные особенности органических соединений.
- 162. Теория химического строения органических соединений.
- 163. Классификация органических соединений.
- 164. Предельные (насыщенные) углеводороды.
- 165. Непредельные (ненасыщенные) углеводороды.
- 166. Предельные циклические углеводороды.
- 167. Ароматические углеводороды.
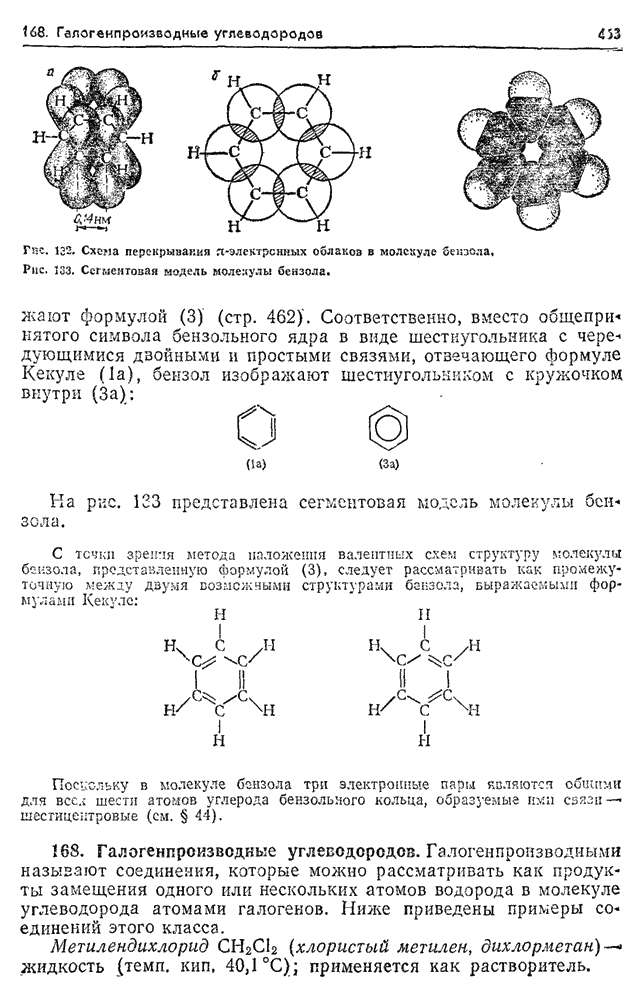
- 168. Галогенпроизводные углеводородов.
- 169. Спирты и фенолы.
- 170. Простые эфиры.
- 171. Альдегиды и кетоны.
- 172. Карбоновые кислоты.
- 173. Сложные эфиры карбоновых кислот. Жиры.
- 174. Углеводы.
- 175. Амины.
- 176. Аминокислоты и белки.
- 177. Природные и синтетические высокомолекулярные соединения (полимеры).
- 178. Кремний в природе. Получение и свойства кремния.
- 179. Соединения кремния с водородом и галогенами.
- 180. Диоксид кремния.
- 181. Кремниевые кислоты и их соли.
- 182. Стекло.
- 183. Керамика.
- 184. Цемент.
- 185. Кремнийорганические соединения.
- 186. Германий (Germanium).
- 187. Олово (Stannuin).
- 188. Свинец (Plumbum).
- 189. Свинцовый аккумулятор.
- Глава XVI. ОБЩИЕ СВОЙСТВА МЕТАЛЛОВ. СПЛАВЫ
- 190. Физические и химические свойства металлов. Электронное строение металлов, изоляторов и полупроводников.
- 191. Кристаллическое строение металлов.
- 192. Добывание металлов из руд.
- 193. Получение металлов высокой чистоты.
- 194. Сплавы.
- 195. Диаграммы состояния металлических систем.
- 196. Коррозия металлов.
- Глава XVII. ПЕРВАЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
- 197. Щелочные металлы в природе.
- 198. Натрий (Natrium).
- 199. Калий (Kalium).
- ПОДГРУППА МЕДИ
- 200. Медь. (Cuprum).
- 201. Серебро (Argentum).
- 202. Золото (Aurum).
- Глава XVIII. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
- 203. Основные положения координационной теории.
- 204. Основные типы и номенклатура комплексных соединений.
- 205. Пространственное строение и изомерия комплексных соединений.
- 206. Природа химической связи в комплексных соединениях.
- 207. Диссоциация комплексных соединений в растворах.
- 208. Влияние координации на свойства лигандов и центрального атома.
- Глава XIX. ВТОРАЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
- 209. Бериллий (Beryllium).
- 210. Магний (Magnesium).
- 211. Кальций (Calcium).
- 212. Жесткость природных вод и ее устранение.
- 213. Стронций (Strontium). Барий (Barium).
- 214. Цинк (Zincum).
- 215. Кадмий (Cadmium).
- 216. Ртуть (Hydrargyrum).
- Глава XX. ТРЕТЬЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
- 217. Бор (Borum).
- 218. Алюминий (Aluminium).
- 219. Галлий (Gallium). Иидий (Indium). Таллий (Thallium).
- ПОБОЧНАЯ ПОДГРУППА ТРЕТЬЕЙ ГРУППЫ. ЛАНТАНОИДЫ. АКТИНОИДЫ
- 220. Подгруппа скандия.
- 221. Лантаноиды.
- 222. Актиноиды.
- Глава XXI. ПОБОЧНЫЕ ПОДГРУППЫ ЧЕТВЕРТОЙ, ПЯТОЙ, ШЕСТОЙ И СЕДЬМОЙ ГРУПП
- ПОДГРУППА ТИТАНА
- 224. Титан (Titanium).
- 225. Цирконий (Zirconium). Гафний (Hafnium).
- ПОДГРУППА ВАНАДИЯ
- 226. Ванадий (Vanadium).
- 227. Ниобий (Niobium). Тантал (Tantalum).
- ПОДГРУППА ХРОМА
- 228. Хром (Chromium).
- 229. Молибден (Mollbdenium).
- 230. Вольфрам (Wolfram).
- ПОДГРУППА МАРГАНЦА
- 231. Марганец (Manganum).
- 232. Рений (Rhenium).
- Глава XXII. ВОСЬМАЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
- 233. Общая характеристика благородных газов.
- 234. Гелий (Helium).
- 235. Неон. Аргон.
- ПОБОЧНАЯ ПОДГРУППА ВОСЬМОЙ ГРУППЫ
- 236. Железо (Ferrum).
- 237. Значение железа и его сплавов в технике. Развитие металлургии в СССР.
- 238. Физические свойства железа. Диаграмма состояния системы железо — углерод.
- 239. Производство чугуна и стали.
- 240. Термическая обработка стали.
- 241. Сплавы железа.
- 242. Химические свойства железа. Соединения железа.
- 243. Кобальт (Cobaltum).
- 244. Никель (Niccolum).
- 245. Общая характеристика платиновых металлов.
- 246. Платина (Platinum).
- 247. Палладий (Palladium). Иридий (Iridium).
- ПРИЛОЖЕНИЕ
- Некоторые единицы СИ
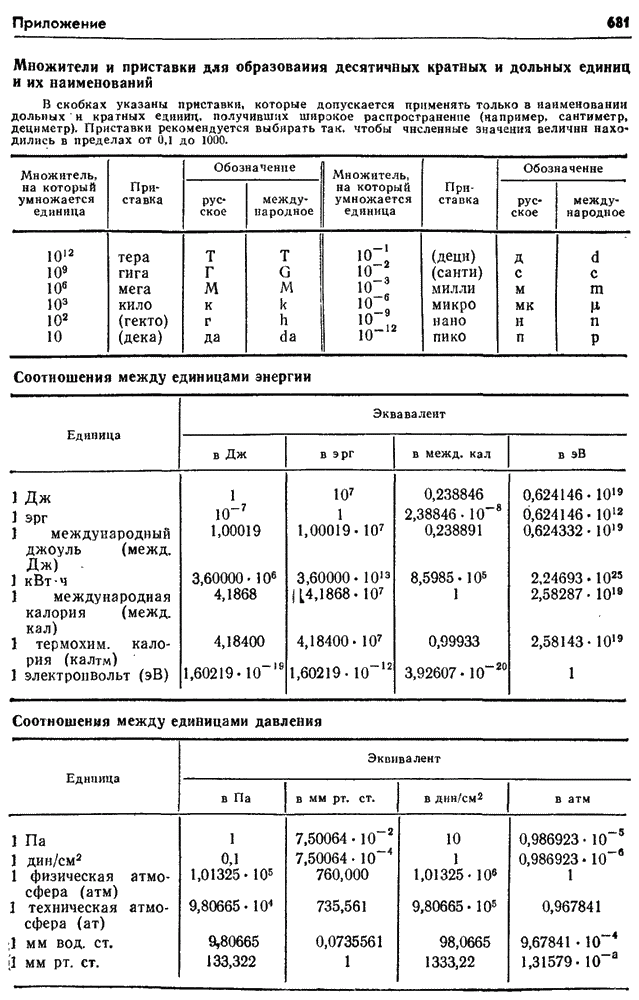
- Множители и приставки для образования десятичных кратных и дольных единиц и их наименований
- Соотношения между некоторыми внесистемными единицами и единицами СИ
- Литература для углубленного изучения общей и неорганической химии