| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
ПОДГРУППА ХРОМА
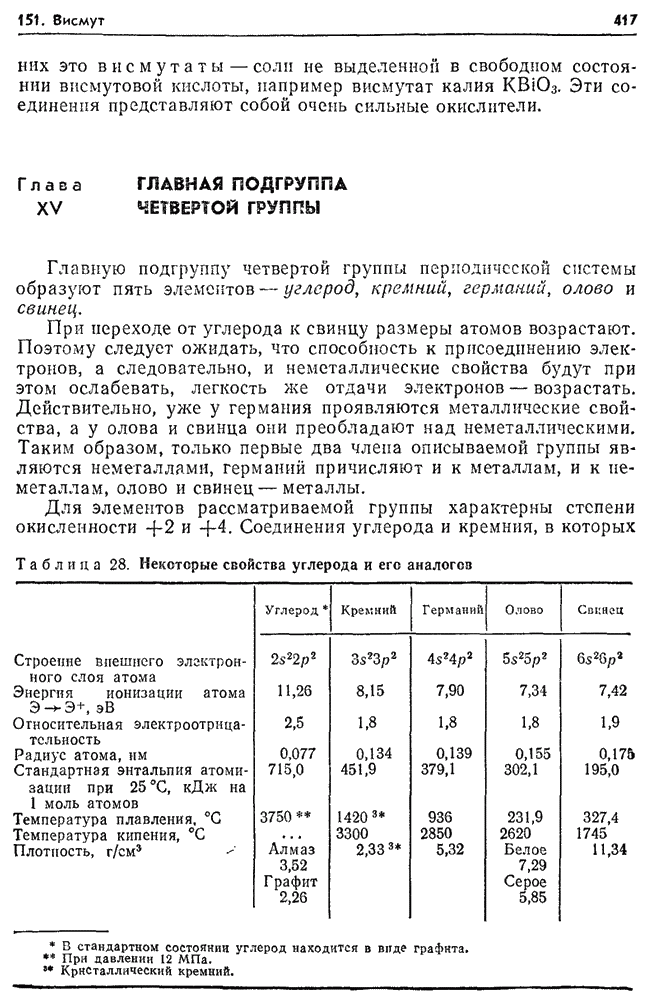
Подгруппу хрома образуют металлы побочной подгруппы шестой группы — хром, молибден и вольфрам.
Наружный электронный слой атомов элементов подгруппы хрома содержит один или два электрона, что обусловливает металлический характер этих элементов и их отличие от элементой главной подгруппы. Вместе с тем их максимальная степень  равна
равна  , так как, помимо наружных электронов, в образовании связей может участвовать еще соответствующее число электронов
, так как, помимо наружных электронов, в образовании связей может участвовать еще соответствующее число электронов  недостроенного предпоследнего слоя.
недостроенного предпоследнего слоя.
Для хрома и его аналогов наиболее типичны производные высшей степени окисленности, во многом сходные с соответствующими соединениями серы.
228. Хром (Chromium).
Хром содержится в земной коре в количестве . В природе он встречается главным образом в виде хромистого железняка
. В природе он встречается главным образом в виде хромистого железняка  , богатые месторожде»
, богатые месторожде»  которого имеются в Казахстане и на Урале.
которого имеются в Казахстане и на Урале.
При восстановлении хромистого железняка углем  сплав хрома с железом — феррохром, который непосредственно используется в металлургической промышленности при
сплав хрома с железом — феррохром, который непосредственно используется в металлургической промышленности при  стве хромистых сталей. Для получения чистого хрома сначала получают оксид хрома (III), а затем восстанавливают его алюминон термическим способом.
стве хромистых сталей. Для получения чистого хрома сначала получают оксид хрома (III), а затем восстанавливают его алюминон термическим способом.
Хром представляет собой твердый блестящий металл, плавящийся при  плотность его
плотность его  . При комнатной температуре хром стоек и к воде и к воздуху. Разбавленные серная и соляная кислоты растворяют хром с выделением водорода. В холодной концентрированной азотной кислоте хром нерастворим и после обработки
. При комнатной температуре хром стоек и к воде и к воздуху. Разбавленные серная и соляная кислоты растворяют хром с выделением водорода. В холодной концентрированной азотной кислоте хром нерастворим и после обработки  становится пассивным.
становится пассивным.
Металлический хром используется для хромирования, а также в качестве одного из важнейших компонентов легированных сталей. Введение хрома в сталь повышает ее устойчивость против коррозии как в водных средах при обычных температурах, так и в газах при повышенных температурах. Кроме того, хромистые стали обладают повышенной твердостью. Хром входит в состав нержавеющих кислотоупорных, жаропрочных сталей (см. также стр. 537, 665).
Хром образует три оксида: оксид  , или закись хрома,
, или закись хрома,  , имеющий основной характер, оксид хрома (III), или окись хрома,
, имеющий основной характер, оксид хрома (III), или окись хрома,  , проявляющий амфотерные свойства, и оксид хрома (VI), или хромовый ангидрид,
, проявляющий амфотерные свойства, и оксид хрома (VI), или хромовый ангидрид,  — кислотный оксид. Соответственно этим трем оксидам известны и три ряда соединений хрома.
— кислотный оксид. Соответственно этим трем оксидам известны и три ряда соединений хрома.
Соединения  . При растворении хрома в соляной кислоте получается раствор голубого цвета, содержащий хлорид
. При растворении хрома в соляной кислоте получается раствор голубого цвета, содержащий хлорид  . Если к этому раствору прилить щелочи, то выпадает желтый осадок — гидроксид
. Если к этому раствору прилить щелочи, то выпадает желтый осадок — гидроксид  . Соединения
. Соединения  неустойчивы и быстро окисляются кислородом воздуха в соединения
неустойчивы и быстро окисляются кислородом воздуха в соединения  .
.
Соединения хрома (III). Оксид  представляет собой тугоплавкое вещество зеленого цвета, применяемое род названием зеленого крона для приготовления клеевой и масляной красок. При сплавлении с силикатами оксид хрома (III) окрашивает их в зеленый цвет и поэтому служит для окраски стекла и фарфора,
представляет собой тугоплавкое вещество зеленого цвета, применяемое род названием зеленого крона для приготовления клеевой и масляной красок. При сплавлении с силикатами оксид хрома (III) окрашивает их в зеленый цвет и поэтому служит для окраски стекла и фарфора,  входит также в состав полирующих средств.
входит также в состав полирующих средств.
Гидроксид  выпадает в виде синевато-серого осадка при действии щелочей на соли
выпадает в виде синевато-серого осадка при действии щелочей на соли  :
:

Подобно гидроксидам алюминия и цинка, он имеет амфотерный характер и растворяется в кислотах с образованием солей хрома (III), а в щелочах — с образованием изумрудно-зеленых растворов хромитов, например:

или

Хромиты, полученные сплавлением  с оксидами других металлов и известные главным образом для двухвалентных металлов, имеют состав, отвечающий формуле
с оксидами других металлов и известные главным образом для двухвалентных металлов, имеют состав, отвечающий формуле  , и представляют собой соли метахромистой кислоты
, и представляют собой соли метахромистой кислоты  .
.
К ним относится и природный хромистый железняк  .
.
Из солей  самой распространенной является двойная соль хрома и калия — хромокалиевые квасцы
самой распространенной является двойная соль хрома и калия — хромокалиевые квасцы  , образующие сине-фиолетовые кристаллы. Хромокалиевые квасцы применяются в кожевенной промышленности для дубления
, образующие сине-фиолетовые кристаллы. Хромокалиевые квасцы применяются в кожевенной промышленности для дубления  и в текстильной промышленности в качестве протравы при крашении.
и в текстильной промышленности в качестве протравы при крашении.
Соли  во многом похожи на соли алюминия. В
во многом похожи на соли алюминия. В  растворах они сильно гидролизованы
растворах они сильно гидролизованы  легко превращаются в основные соли. Со слабыми кислотами
легко превращаются в основные соли. Со слабыми кислотами  , подобно алю-минию, солей не образует.
, подобно алю-минию, солей не образует.
Растворы солей хрома (III) обычно имеют сине-фиолетовый цвет, но при нагревании становятся зелеными, а спустя некоторое время после охлаждения снова приобретают прежнюю окраску. Это изменение окраски объясняется образованием изомерных гидратов солей, представляющих собой комплексные соединения, в которых все или часть молекул воды координационно связаны во внутренней сфере комплекса. В некоторых случаях такие гидраты удалось выделить в твердом виде. Так, кристаллогидрат хлорида  известен в трех изомерных формах: в виде сине-фиолетовых, темнозеленых и светло-зеленых кристаллов одинакового состава. Строение этих изомеров можно установить на основании различного отношения их свежеприготовленных растворов к нитрату серебра. При действии последнего на раствор сине-фиолетового гидрата осаждается весь хлор; из раствора темнозеленого гидрата осаждается
известен в трех изомерных формах: в виде сине-фиолетовых, темнозеленых и светло-зеленых кристаллов одинакового состава. Строение этих изомеров можно установить на основании различного отношения их свежеприготовленных растворов к нитрату серебра. При действии последнего на раствор сине-фиолетового гидрата осаждается весь хлор; из раствора темнозеленого гидрата осаждается  хлора, а из раствора светло-зеленого гидрата — только
хлора, а из раствора светло-зеленого гидрата — только  хлора. Принимая во внимание эти данные, а также координационное число хрома, равное шести, строение рассматриваемых кристаллогидратов можно выразить следующими формулами:
хлора. Принимая во внимание эти данные, а также координационное число хрома, равное шести, строение рассматриваемых кристаллогидратов можно выразить следующими формулами:

сине-фиолетовый темно-зеленый светло-зеленый
Таким образом, изомерия гидратов хлорида хрома (III) обусловлена различным распределением одних и тех же групп  и
и  между внутренней и внешней координационными сферами и может служить примером гидратной изомерии (стр. 574).
между внутренней и внешней координационными сферами и может служить примером гидратной изомерии (стр. 574).
Соединения  . Важнейшими соединениями хрома (VI) являются триоксид хрома, или хромовый ангидрид,
. Важнейшими соединениями хрома (VI) являются триоксид хрома, или хромовый ангидрид,  и соли отвечающих ему кислот — хромовой
и соли отвечающих ему кислот — хромовой  и двухромовой
и двухромовой  . Обе кислоты существуют только в водном растворе и при попытках выделить их из раствора распадаются на хромовый ангидрид и воду; но соли их достаточно стойки. Соли хромовой кислоты называются хроматами, а двухромовой — бихромата
. Обе кислоты существуют только в водном растворе и при попытках выделить их из раствора распадаются на хромовый ангидрид и воду; но соли их достаточно стойки. Соли хромовой кислоты называются хроматами, а двухромовой — бихромата  или дихроматами.
или дихроматами.
Почти все хроматы имеют желтую окраску. Некоторые из них применяются в качестве красок. Например, нерастворимый в воде хромат свинца  , под названием желтый крон, служит для приготовления желтой масляной краски.
, под названием желтый крон, служит для приготовления желтой масляной краски.
При подкислении раствора какого-нибудь хромата, например хромата калия  , чисто-желтая окраска раствора сменяется на оранжевую вследствие перехода ионов
, чисто-желтая окраска раствора сменяется на оранжевую вследствие перехода ионов  в ионы
в ионы  .
.
Из полученного раствора может быть выделена соль двухромовой кислоты — дихромат калия  — в виде оранжево-красных кристаллов. Реакция превращения хромата в дихромат выражается уравнением:
— в виде оранжево-красных кристаллов. Реакция превращения хромата в дихромат выражается уравнением:

Реакция обратима. Это значит, что при растворении дихромата в воде всегда образуется некоторое, хотя и незначительное, количество ионов  и
и  поэтому раствор дихромата имеет кислую реакцию. Если к раствору дихромата прибавлять щелочь, то гидроксид-ионы будут связывать находящиеся в растворе ионы водорода, равновесие смещается влево и в результате дихромат превращается в хромат. Таким образом, в присутствии избытка гидроксид-ионов в растворе практически существуют только ионы
поэтому раствор дихромата имеет кислую реакцию. Если к раствору дихромата прибавлять щелочь, то гидроксид-ионы будут связывать находящиеся в растворе ионы водорода, равновесие смещается влево и в результате дихромат превращается в хромат. Таким образом, в присутствии избытка гидроксид-ионов в растворе практически существуют только ионы  , т. е. хромат, а при избытке ионов водорода — ионы
, т. е. хромат, а при избытке ионов водорода — ионы  , т. е. дихромат.
, т. е. дихромат.
Хроматы щелочных металлов получаются путем окисления соединений  в присутствии щелочи. Так, при действии брома на раствор хромита калия образуется хромат калия:
в присутствии щелочи. Так, при действии брома на раствор хромита калия образуется хромат калия:

О происходящем окислении можно судить по тому, что изумрудно-зеленая окраска раствора хромита переходит в ярко-желтую.
Хроматы могут быть получены также сплавлением  со щелочью в присутствии какого-нибудь окислителя, например хлората калия:
со щелочью в присутствии какого-нибудь окислителя, например хлората калия:

Хроматы и дихроматы — сильные окислители. Поэтому ими широко пользуются для окисления различных веществ. Окисление производится в кислом растворе и обычно сопровождается резким изменением окраски (дихроматы окрашены в оранжевый цвет,  соли
соли  зеленый или зеленовато-фиолетовый).
зеленый или зеленовато-фиолетовый).
Мы видели, что в кислых и в щелочных растворах соединения  и
и  существуют в разных формах: в кислой среде в виде ионов
существуют в разных формах: в кислой среде в виде ионов  или
или  , а в щелочной — в виде ионов
, а в щелочной — в виде ионов  или
или  Поэтому взаимопревращение соединений хрома (III) и
Поэтому взаимопревращение соединений хрома (III) и  протекает по-разному в зависимости от реакции раствора. В кислой среде устанавливается равновесие
протекает по-разному в зависимости от реакции раствора. В кислой среде устанавливается равновесие

а в щелочной

Однако и в кислой, и в щелочной среде окисление  приводит к уменьшению
приводит к уменьшению  раствора; обратный же процесс — восстановление хрома
раствора; обратный же процесс — восстановление хрома  - сопровождается увеличением
- сопровождается увеличением  .
.
Поэтому, в соответствии с принципом Ле Шателье, при повышении кислотности среды равновесие смещается в направлении восстановления хрома (VI), а при уменьшении кислотности — в направлении окисления хрома (III). Иначе говоря, окислительные свойства соединений хрома (VI) наиболее сильно выражены в кислой среде, а восстановительные свойства соединений хрома  щелочной. Именно поэтому, как указывалось выше, окисление хромитов в хроматы осуществляют в присутствии щелочи, а соединения хрома (VI) применяют в качестве окислителей в кислых растворах.
щелочной. Именно поэтому, как указывалось выше, окисление хромитов в хроматы осуществляют в присутствии щелочи, а соединения хрома (VI) применяют в качестве окислителей в кислых растворах.
Приведем несколько примеров окислительно-восстановительных реакций, протекающих при участии дихроматов.
1. При пропускании сероводорода через подкисленный серной кислотой раствор дихромата оранжевая окраска раствора переходит в зеленую и одновременно жидкость становится мутной вследствие выделения серы:

2. При действии концентрированной соляной кислоты на дихромат калия выделяется хлор и получается зеленый раствор, содержащий хлорид хрома (III):

3. Если пропускать диоксид серы через концентрированный раствор дихромата калия, содержащий достаточное количество серной кислоты, то образуются эквимолекулярные количества сульфатов калия и хрома (III):

При выпаривании раствора из него выделяются хромокалиевые квасцы  . Этой реакцией пользуются для получения хромокалиевых квасцов в промышленности.
. Этой реакцией пользуются для получения хромокалиевых квасцов в промышленности.
Наиболее важными из дихроматов являются дихромат калия  и дихромат натрия
и дихромат натрия  , образующие оранжево-красные кристаллы. Обе соли, известные также под названием хромпиков, широко применяются в качестве окислителей при производстве многих органических соединений, в кожевенной промышленности при дублении
, образующие оранжево-красные кристаллы. Обе соли, известные также под названием хромпиков, широко применяются в качестве окислителей при производстве многих органических соединений, в кожевенной промышленности при дублении  , в спичечной и текстильной промышленности. Смесь концентрированной серной кислоты с водным раствором дихромата калия или натрия под названием «хромовой смеси» часто применяется для энергичного окисления и для очистки химической посуды.
, в спичечной и текстильной промышленности. Смесь концентрированной серной кислоты с водным раствором дихромата калия или натрия под названием «хромовой смеси» часто применяется для энергичного окисления и для очистки химической посуды.
Все соли хромовых кислот ядовиты.
Триоксид хрома, или хромовый ангидрид,  выпадает в виде темно-красных игольчатых кристаллов при действии концентрированной серной кислоты на насыщенный раствор дихромата калия или натрия:
выпадает в виде темно-красных игольчатых кристаллов при действии концентрированной серной кислоты на насыщенный раствор дихромата калия или натрия:

Хромовый ангидрид принадлежит к числу наиболее сильных окислителей. Например, этиловый спирт при соприкосновении с ним воспламеняется. Производя окисление, хромовый ангидрид превращается в оксид хрома (III)  .
.
Хромовый ангидрид легко растворяется в воде с образованием хромовой и двухромозой кислот.
| << Предыдущий параграф | Следующий параграф >> |
- ВВЕДЕНИЕ
- Глава I. АТОМНО-МОЛЕКУЛЯРНОЕ УЧЕНИЕ
- 4. Закон сохранения массы.
- 5. Основное содержание атомно-молекулярного учения.
- 6. Простое вещество и химический элемент.
- 7. Закон постоянства состава.
- 8. Закон объемных отношений.
- 9. Атомные и молекулярные массы. Моль.
- 10. Определение молекулярных масс веществ, находящихся в газообразном состоянии.
- 11. Парциальное давление газа.
- 12. Эквивалент. Закон эквивалентов.
- 13. Определение атомных масс. Валентность.
- 14. Химическая символика.
- 15. Важнейшие классы и номенклатура неорганических веществ.
- 16. Химические расчеты.
- Глава II ПЕРИОДИЧЕСКИЙ ЗАКОН Д. И. МЕНДЕЛЕЕВА
- 17. Периодический закон Д. И. Менделеева.
- 18. Периодическая система элементов.
- 19. Значение периодической системы.
- Глава III СТРОЕНИЕ АТОМА. РАЗВИТИЕ ПЕРИОДИЧЕСКОГО ЗАКОНА
- 20. Радиоктивность.
- 21. Ядерная модель атома.
- 22. Атомные спектры.
- 23. Квантовая теория света.
- 24. Строение электронной оболочки атома по Бору.
- 25. Исходные представления квантовой механики.
- 26. Волновая функция.
- 27. Энергетическое состояние электрона в атоме.
- 29. Орбитальное квантовое число. Формы электронных облаков.
- 30. Магнитное и спиновое квантовые числа.
- 31. Многоэлектронные атомы.
- 32. Принцип Паули. Электронная структура атомов и периодическая система элементов.
- 33. Размеры атомов и ионов.
- 34. Энергия ионизации и сродство к электрону.
- 35. Строение атомных ядер. Изотопы.
- 36. Радиоактивные элементы и их распад.
- 37. Искусственная радиоктивность. Ядерные реакции.
- Глава IV. ХИМИЧЕСКАЯ СВЯЗЬ И СТРОЕНИЕ МОЛЕКУЛ
- 38. Теория химического строения.
- 39. Ковалентная связь. Метод валентных связей.
- 40. Неполярная и полярная ковалентная связь.
- 41. Способы образования ковалентной связи.
- 42. Направленность ковалентной связи.
- 43. Гибридизация атомных электронных орбиталей.
- 44. Многоцентровые связи.
- 45. Метод молекулярных орбиталей.
- 46. Ионная связь.
- 47. Водородная связь.
- Глава V. СТРОЕНИЕ ТВЕРДОГО ТЕЛА И ЖИДКОСТИ
- 48. Межмолекулярное взаимодействие.
- 49. Кристаллическое состояние вещества.
- 50. Внутреннее строение кристаллов.
- 51. Реальные кристаллы.
- 52. Аморфное состояние вещества.
- 53. Жидкости.
- Глава VI. ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ПРОТЕКАНИЯ ХИМИЧЕСКИХ РЕАКЦИЙ
- 54. Превращения энергии при химических реакциях.
- 55. Термохимия.
- 56. Термохимические расчеты.
- 57. Скорость химической реакции.
- 59. Зависимость скорости реакции от температуры и от природы реагирующих веществ.
- 60. Катализ.
- 61. Скорость реакции в гетерогенных системах.
- 62. Цепные реакции.
- 63. Необратимые и обратимые реакции. Химическое равновесие.
- 64. Смещение химического равновесия. Принцип Ле Шателье.
- 65. Факторы, определяющие направление протекания химических реакций.
- 66. Термодинамические величины. Внутренняя энергия и энтальпия.
- 67. Термодинамические величины. Энтропия и энергия Гиббса.
- 68. Стандартные термодинамические величины. Химико-термодинамические расчеты.
- Глава VII. ВОДА, РАСТВОРЫ
- 69. Вода в природе.
- 70. Физические свойства воды.
- 71. Диаграмма состояния воды.
- 72. Химические свойства воды.
- 73. Характеристика растворов. Процесс растворения.
- 74. Способы выражения состава растворов.
- 75. Гидраты и кристаллогидраты.
- 76. Растворимость.
- 77. Пересыщенные растворы.
- 78. Осмос.
- 79. Давление пара растворов.
- 80. Замерзание и кипение растворов.
- Глава VIII. РАСТВОРЫ ЭЛЕКТРОЛИТОВ
- 81. Особенности растворов солей, кислот и оснований.
- 82. Теория электролитической диссоциации.
- 83. Процесс диссоциации.
- 84. Степень диссоциации. Сила электролитов.
- 85. Константа диссоциации.
- 86. Сильные электролиты.
- 87. Свойства кислот, оснований и солей с точки зрения теории электролитической диссоциации.
- 88. Ионно-молекулярные уравнения.
- 89. Произведение растворимости.
- 90. Диссоциация воды. Водородный показатель.
- 91. Смещение ионных равновесий.
- 92. Гидролиз солей.
- Глава IX. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ. ОСНОВЫ ЭЛЕКТРОХИМИИ
- 93. Окисленность элементов.
- 94. Окислительно-восстановительные реакции.
- 95. Составление уравнений окислительно-восстановительных реакций.
- 96. Важнейшие окислители и восстановители.
- 97. Окислительно-восстановительная двойственность.
- 98. Химические источники электрической энергии.
- 99. Электродные потенциалы.
- 100. Ряд напряжений металлов.
- 101. Электролиз.
- 102. Законы электролиза.
- 103. Электролиз в промышленности.
- 104. Электрохимическая поляризация.
- Глава X. ДИСПЕРСНЫЕ СИСТЕМЫ. КОЛЛОИДЫ
- 105. Дисперсное состояние вещества.
- 106. Состояние вещества на границе раздела фаз.
- 107. Коллоиды и коллоидные растворы.
- 108. Дисперсионный анализ.
- 109. Сорбция и сорбционные процессы.
- 110. Ионообменная адсорбция.
- 111. Хроматография.
- 112. Электрокинетические явления.
- 113. Устойчивость и коагуляция дисперсных систем.
- 114. Структурообразование в дисперсных системах.
- Глава XI. ВОДОРОД
- 115. Водород в природе. Получение водорода.
- 116. Свойства и применение водорода.
- 117. Пероксид водорода
- Глава XII. ГАЛОГЕНЫ
- 118. Галогены в природе. Физические свойства галогенов.
- 119. Химические свойства галогенов.
- 120. Получение и применение галогенов.
- 121. Соединения галогенов с водородом.
- 122. Кислородсодержащие соединения галогенов.
- Глава XIII. ГЛАВНАЯ ПОДГРУППА ШЕСТОЙ ГРУППЫ
- 123. Кислород в природе. Воздух.
- 124. Получение и свойства кислорода.
- 125. Озон.
- 126. Сера в природе. Получение серы.
- 127. Свойства и применение серы.
- 128. Сероводород. Сульфиды.
- 129. Диоксид серы. Сернистая кислота.
- 130. Триоксид серы. Серная кислота.
- 131. Получение и применение серной кислоты.
- 132. Пероксодвусерная кислота.
- 133. Тиосерная кислота.
- 134. Соединения серы с галогенами.
- 135. Селен (Selenium). Теллур (Tellurium).
- Глава XIV. ГЛАВНАЯ ПОДГРУППА ПЯТОЙ ГРУППЫ
- 136. Азот в природе. Получение и свойства азота.
- 137. Аммиак. Соли аммония.
- 138. Фиксация атмосферного азота. Получение аммиака.
- 139. Гидразин. Гидроксиламин. Азидоводород.
- 140. Оксиды азота.
- 141. Азотистая кислота.
- 142. Азотная кислота.
- 143. Промышленное получение азотной кислоты.
- 144. Круговорот азота в природе.
- 145. Фосфор в природе. Получение и свойства фосфора.
- 146. Соединения фосфора с водородом и галогенами.
- 147. Оксиды и кислоты фосфора.
- 148. Минеральные удобрения.
- 149. Мышьяк (Arsenicum).
- 150. Сурьма (Stibium).
- 151. Висмут (Bismuthum).
- Глава XV. ГЛАВНАЯ ПОДГРУППА ЧЕТВЕРТОЙ ГРУППЫ
- 152. Углерод в природе.
- 153. Аллотропия углерода.
- 154. Химические свойства углерода. Карбиды.
- 155. Диоксид углерода. Угольная кислота.
- 156. Оксид углерода (II).
- 157. Соединения углерода с серой и азотом.
- 158. Топливо и его виды.
- 159. Газообразное топливо.
- 160. Общая характеристика органических соединений.
- 161. Отличительные особенности органических соединений.
- 162. Теория химического строения органических соединений.
- 163. Классификация органических соединений.
- 164. Предельные (насыщенные) углеводороды.
- 165. Непредельные (ненасыщенные) углеводороды.
- 166. Предельные циклические углеводороды.
- 167. Ароматические углеводороды.
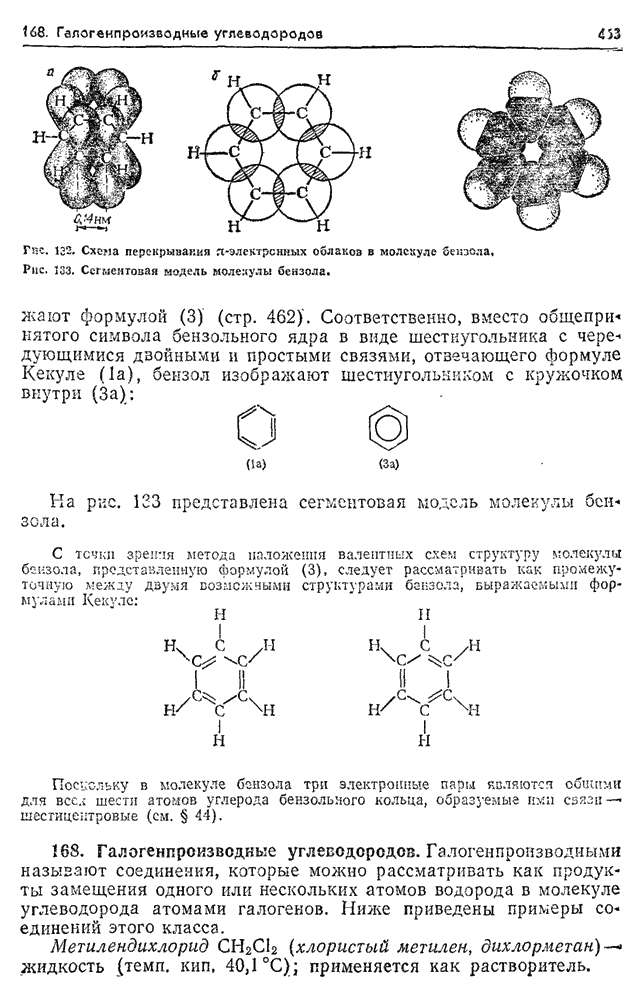
- 168. Галогенпроизводные углеводородов.
- 169. Спирты и фенолы.
- 170. Простые эфиры.
- 171. Альдегиды и кетоны.
- 172. Карбоновые кислоты.
- 173. Сложные эфиры карбоновых кислот. Жиры.
- 174. Углеводы.
- 175. Амины.
- 176. Аминокислоты и белки.
- 177. Природные и синтетические высокомолекулярные соединения (полимеры).
- 178. Кремний в природе. Получение и свойства кремния.
- 179. Соединения кремния с водородом и галогенами.
- 180. Диоксид кремния.
- 181. Кремниевые кислоты и их соли.
- 182. Стекло.
- 183. Керамика.
- 184. Цемент.
- 185. Кремнийорганические соединения.
- 186. Германий (Germanium).
- 187. Олово (Stannuin).
- 188. Свинец (Plumbum).
- 189. Свинцовый аккумулятор.
- Глава XVI. ОБЩИЕ СВОЙСТВА МЕТАЛЛОВ. СПЛАВЫ
- 190. Физические и химические свойства металлов. Электронное строение металлов, изоляторов и полупроводников.
- 191. Кристаллическое строение металлов.
- 192. Добывание металлов из руд.
- 193. Получение металлов высокой чистоты.
- 194. Сплавы.
- 195. Диаграммы состояния металлических систем.
- 196. Коррозия металлов.
- Глава XVII. ПЕРВАЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
- 197. Щелочные металлы в природе.
- 198. Натрий (Natrium).
- 199. Калий (Kalium).
- ПОДГРУППА МЕДИ
- 200. Медь. (Cuprum).
- 201. Серебро (Argentum).
- 202. Золото (Aurum).
- Глава XVIII. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
- 203. Основные положения координационной теории.
- 204. Основные типы и номенклатура комплексных соединений.
- 205. Пространственное строение и изомерия комплексных соединений.
- 206. Природа химической связи в комплексных соединениях.
- 207. Диссоциация комплексных соединений в растворах.
- 208. Влияние координации на свойства лигандов и центрального атома.
- Глава XIX. ВТОРАЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
- 209. Бериллий (Beryllium).
- 210. Магний (Magnesium).
- 211. Кальций (Calcium).
- 212. Жесткость природных вод и ее устранение.
- 213. Стронций (Strontium). Барий (Barium).
- 214. Цинк (Zincum).
- 215. Кадмий (Cadmium).
- 216. Ртуть (Hydrargyrum).
- Глава XX. ТРЕТЬЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
- 217. Бор (Borum).
- 218. Алюминий (Aluminium).
- 219. Галлий (Gallium). Иидий (Indium). Таллий (Thallium).
- ПОБОЧНАЯ ПОДГРУППА ТРЕТЬЕЙ ГРУППЫ. ЛАНТАНОИДЫ. АКТИНОИДЫ
- 220. Подгруппа скандия.
- 221. Лантаноиды.
- 222. Актиноиды.
- Глава XXI. ПОБОЧНЫЕ ПОДГРУППЫ ЧЕТВЕРТОЙ, ПЯТОЙ, ШЕСТОЙ И СЕДЬМОЙ ГРУПП
- ПОДГРУППА ТИТАНА
- 224. Титан (Titanium).
- 225. Цирконий (Zirconium). Гафний (Hafnium).
- ПОДГРУППА ВАНАДИЯ
- 226. Ванадий (Vanadium).
- 227. Ниобий (Niobium). Тантал (Tantalum).
- ПОДГРУППА ХРОМА
- 228. Хром (Chromium).
- 229. Молибден (Mollbdenium).
- 230. Вольфрам (Wolfram).
- ПОДГРУППА МАРГАНЦА
- 231. Марганец (Manganum).
- 232. Рений (Rhenium).
- Глава XXII. ВОСЬМАЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
- 233. Общая характеристика благородных газов.
- 234. Гелий (Helium).
- 235. Неон. Аргон.
- ПОБОЧНАЯ ПОДГРУППА ВОСЬМОЙ ГРУППЫ
- 236. Железо (Ferrum).
- 237. Значение железа и его сплавов в технике. Развитие металлургии в СССР.
- 238. Физические свойства железа. Диаграмма состояния системы железо — углерод.
- 239. Производство чугуна и стали.
- 240. Термическая обработка стали.
- 241. Сплавы железа.
- 242. Химические свойства железа. Соединения железа.
- 243. Кобальт (Cobaltum).
- 244. Никель (Niccolum).
- 245. Общая характеристика платиновых металлов.
- 246. Платина (Platinum).
- 247. Палладий (Palladium). Иридий (Iridium).
- ПРИЛОЖЕНИЕ
- Некоторые единицы СИ
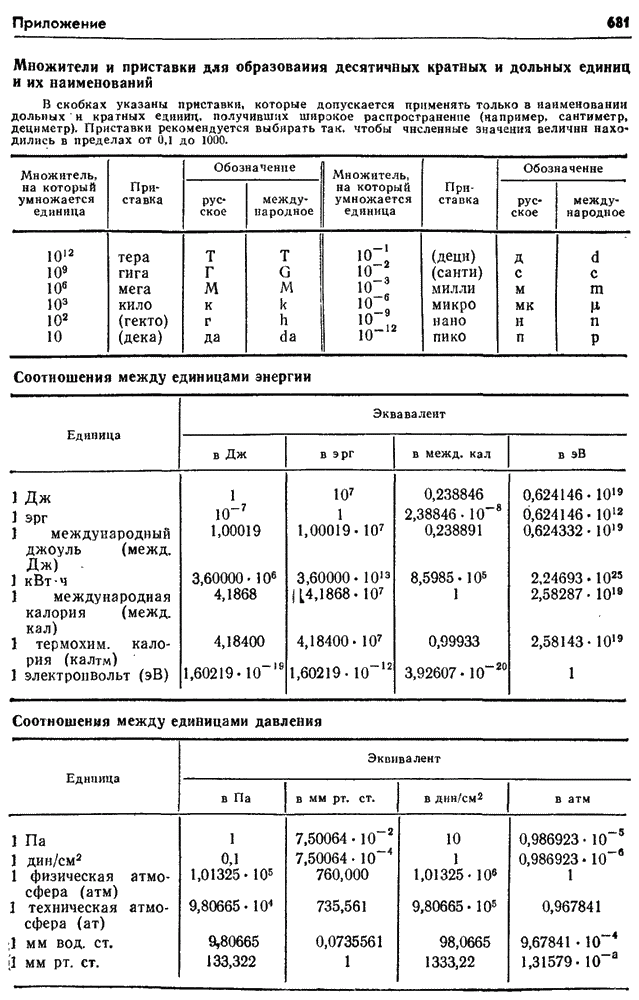
- Множители и приставки для образования десятичных кратных и дольных единиц и их наименований
- Соотношения между некоторыми внесистемными единицами и единицами СИ
- Литература для углубленного изучения общей и неорганической химии