| << Предыдущий параграф | Следующий параграф >> |
Пред.
След.
Макеты страниц
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
ДЛЯ СТУДЕНТОВ И ШКОЛЬНИКОВ ЕСТЬ
ZADANIA.TO
7. Закон постоянства состава.
Закон кратных отношений. Глубокие идеи Ломоносова о строении вещества не были поняты современниками. Кроме того, опытная проверка этих его взглядов была невозможна в то время. Поэтому разработка атомно-молекулярного учения во второй половине XVIII века не продвинулась вперед. Для окончательного формирования этого учения не хватало знания законов, определяющих отношения между количествами веществ, реагирующих друг с другом и образующихся при химических реакциях. Эти законы были открыты лишь в конце XVIII— начале XIX века.В результате установления закона сохранения массы с конца XVIII века в химии прочно утвердились количественные методы исследования. Был изучен количественный состав многих веществ. При этом был установлен закон постоянства состава:
Соотношения между массами элементов, входящих в состав данного соединения, постоянны и не зависят от способа получения этого соединения.
Многие элементы, соединяясь друг с другом, могут образовать разные вещества, каждое из которых характеризуется определенным соотношением между массами этих элементов. Так, углерод образует с кислородом два соединения. Одно из них — оксид углерода  , или окись углерода — содержит
, или окись углерода — содержит  (масс.) углерода и 57,12% (масс.) кислорода. Второе соединение — диоксид, или двуокись углерода — содержит
(масс.) углерода и 57,12% (масс.) кислорода. Второе соединение — диоксид, или двуокись углерода — содержит  (масс.) углерода и
(масс.) углерода и  (масс.) кислорода. Изучая подобные соединения, Дальтон в 1803 г. установил закон кратных отношений:
(масс.) кислорода. Изучая подобные соединения, Дальтон в 1803 г. установил закон кратных отношений:
Если два элемента образуют друг с другом несколько химических соединений, то массы одного из элементов, приходящиеся в этих соединениях на одну и ту же массу другого, относятся между собой как небольшие целые числа.
Дальтон придерживался атомной теории строения вещества. Открытие закона кратных отношений явилось подтверждением этой теории. Закон непосредственно свидетельствовал о том, что элементы входят в состав соединений лишь определенными порциями. Подсчитаем, например, массу кислорода, соединяющуюся с одним и тем же количеством углерода при образовании оксида  и диоксида углерода. Для этого разделим друг на друга величины, выражающие содержание кислорода и углерода в том и в другом оксидах. Мы получим, что на одну единицу массы углерода в диоксиде углерода приходится ровно в 2 раза больше кислорода, чем в оксиде углерода
и диоксида углерода. Для этого разделим друг на друга величины, выражающие содержание кислорода и углерода в том и в другом оксидах. Мы получим, что на одну единицу массы углерода в диоксиде углерода приходится ровно в 2 раза больше кислорода, чем в оксиде углерода  .
.

Способность элементов вступать в соединения лишь определенными порциями свидетельствовала о прерывном строении вещества. Развивая атомную теорию, Дальтон ввел близкое к современному представление об атомах и об относительных атомных массах элементов; за единицу атомной массы он принял массу атома водорода как самого легкого. Он впервые в истории химии составил таблицу атомных масс, которая включала 14 элементов.
Законы постоянства состава и кратных отношений вытекают из атомномолекулярного учения. Вещества с молекулярной структурой состоят из одинаковых молекул. Поэтому естественно, что состав таких веществ постоянен. При образовании из двух элементов нескольких соединений атомы этих элементов соединяются друг с другом в молекулы различного, по определенного состава. Например, молекула оксида углерода  построена из одного атома углерода и одного атома кислорода, а в состав молекулы диоксида углерода входит один атом углерода и два атома кислорода. Ясно, что масса кислорода, приходящаяся на одну и ту же массу углерода, во втором из этих соединений в 2 раза больше, чем в первом.
построена из одного атома углерода и одного атома кислорода, а в состав молекулы диоксида углерода входит один атом углерода и два атома кислорода. Ясно, что масса кислорода, приходящаяся на одну и ту же массу углерода, во втором из этих соединений в 2 раза больше, чем в первом.
В отличие от закона сохранения массы, справедливость которого полностью подтверждена открытиями, сделанными после его установления, законы постоянства состава и кратных отношений оказались не столь всеобщими. В связи с открытием изотопов (§ 35) выяснилось, что соотношение между массами элементов, входящих в состав данного вещества, постоянно лишь при условии постоянства изотопного состава этих элементов. При изменении изотопного состава элемента меняется и массовый состав соединения. Например, тяжелая вода (§ 72) содержит около  (масс.) водорода, а обычная вода лишь
(масс.) водорода, а обычная вода лишь  .
.
В начале XX века Н. С. Курнаков (см. стр. 536), изучая сплавы металлов, открыл соединения переменного состава. В этих соединениях на единицу массы данного элемента может приходиться различная масса другого элемента. Так, в соединении, которое висмут образует с таллием, на единицу массы таллия может приходиться от 1,24 до 1,82 единиц массы висмута.
В тридцатых годах XX века выяснилось, что соединения переменного состава встречаются не только среди соединений металлов друг с другом, но и среди других твердых тел, например, оксидов, соединений металлов с серой, азотом, углеродом, водородом.
Для многих соединений переменного состава установлены пределы, в которых может изменяться их состав. Так, в диоксиде титана  на единицу массы титана может приходиться от 0,65 до 0,67 единиц массы кислорода, что соответствует формуле
на единицу массы титана может приходиться от 0,65 до 0,67 единиц массы кислорода, что соответствует формуле  . Конечно, такого рода формулы указывают не состав молекулы — соединения переменного состава имеют не
. Конечно, такого рода формулы указывают не состав молекулы — соединения переменного состава имеют не  , а атомную структуру, — а лишь отражают границы состава вещества.
, а атомную структуру, — а лишь отражают границы состава вещества.
Пределы возможного изменения состава у различных соединений различны. Кроме того, они изменяются с изменением температуры.
Если два элемента образуют друг с другом несколько соединений переменного состава, то в этом случае будет неприменим и закон кратных отношений. Например, титан образует с кислородом несколько оксидов переменного состава, важнейшими из которых являются  и
и  . Ясно, что в этом и в подобных случаях закон кратных отношений не соблюдается.
. Ясно, что в этом и в подобных случаях закон кратных отношений не соблюдается.
Не соблюдается закон кратных отношений и в случае веществ, молекулы которых состоят из большого числа атомов. Например, известны углеводороды, имеющие формулы  и
и  . Числа единиц массы водорода, приходящихся в этих и подобных им соединениях на одну единицу массы углерода, относятся друг к другу как целые числа, но назвать эти числа небольшими нельзя.
. Числа единиц массы водорода, приходящихся в этих и подобных им соединениях на одну единицу массы углерода, относятся друг к другу как целые числа, но назвать эти числа небольшими нельзя.
| << Предыдущий параграф | Следующий параграф >> |
Оглавление
- ВВЕДЕНИЕ
- Глава I. АТОМНО-МОЛЕКУЛЯРНОЕ УЧЕНИЕ
- 4. Закон сохранения массы.
- 5. Основное содержание атомно-молекулярного учения.
- 6. Простое вещество и химический элемент.
- 7. Закон постоянства состава.
- 8. Закон объемных отношений.
- 9. Атомные и молекулярные массы. Моль.
- 10. Определение молекулярных масс веществ, находящихся в газообразном состоянии.
- 11. Парциальное давление газа.
- 12. Эквивалент. Закон эквивалентов.
- 13. Определение атомных масс. Валентность.
- 14. Химическая символика.
- 15. Важнейшие классы и номенклатура неорганических веществ.
- 16. Химические расчеты.
- Глава II ПЕРИОДИЧЕСКИЙ ЗАКОН Д. И. МЕНДЕЛЕЕВА
- 17. Периодический закон Д. И. Менделеева.
- 18. Периодическая система элементов.
- 19. Значение периодической системы.
- Глава III СТРОЕНИЕ АТОМА. РАЗВИТИЕ ПЕРИОДИЧЕСКОГО ЗАКОНА
- 20. Радиоктивность.
- 21. Ядерная модель атома.
- 22. Атомные спектры.
- 23. Квантовая теория света.
- 24. Строение электронной оболочки атома по Бору.
- 25. Исходные представления квантовой механики.
- 26. Волновая функция.
- 27. Энергетическое состояние электрона в атоме.
- 29. Орбитальное квантовое число. Формы электронных облаков.
- 30. Магнитное и спиновое квантовые числа.
- 31. Многоэлектронные атомы.
- 32. Принцип Паули. Электронная структура атомов и периодическая система элементов.
- 33. Размеры атомов и ионов.
- 34. Энергия ионизации и сродство к электрону.
- 35. Строение атомных ядер. Изотопы.
- 36. Радиоактивные элементы и их распад.
- 37. Искусственная радиоктивность. Ядерные реакции.
- Глава IV. ХИМИЧЕСКАЯ СВЯЗЬ И СТРОЕНИЕ МОЛЕКУЛ
- 38. Теория химического строения.
- 39. Ковалентная связь. Метод валентных связей.
- 40. Неполярная и полярная ковалентная связь.
- 41. Способы образования ковалентной связи.
- 42. Направленность ковалентной связи.
- 43. Гибридизация атомных электронных орбиталей.
- 44. Многоцентровые связи.
- 45. Метод молекулярных орбиталей.
- 46. Ионная связь.
- 47. Водородная связь.
- Глава V. СТРОЕНИЕ ТВЕРДОГО ТЕЛА И ЖИДКОСТИ
- 48. Межмолекулярное взаимодействие.
- 49. Кристаллическое состояние вещества.
- 50. Внутреннее строение кристаллов.
- 51. Реальные кристаллы.
- 52. Аморфное состояние вещества.
- 53. Жидкости.
- Глава VI. ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ПРОТЕКАНИЯ ХИМИЧЕСКИХ РЕАКЦИЙ
- 54. Превращения энергии при химических реакциях.
- 55. Термохимия.
- 56. Термохимические расчеты.
- 57. Скорость химической реакции.
- 59. Зависимость скорости реакции от температуры и от природы реагирующих веществ.
- 60. Катализ.
- 61. Скорость реакции в гетерогенных системах.
- 62. Цепные реакции.
- 63. Необратимые и обратимые реакции. Химическое равновесие.
- 64. Смещение химического равновесия. Принцип Ле Шателье.
- 65. Факторы, определяющие направление протекания химических реакций.
- 66. Термодинамические величины. Внутренняя энергия и энтальпия.
- 67. Термодинамические величины. Энтропия и энергия Гиббса.
- 68. Стандартные термодинамические величины. Химико-термодинамические расчеты.
- Глава VII. ВОДА, РАСТВОРЫ
- 69. Вода в природе.
- 70. Физические свойства воды.
- 71. Диаграмма состояния воды.
- 72. Химические свойства воды.
- 73. Характеристика растворов. Процесс растворения.
- 74. Способы выражения состава растворов.
- 75. Гидраты и кристаллогидраты.
- 76. Растворимость.
- 77. Пересыщенные растворы.
- 78. Осмос.
- 79. Давление пара растворов.
- 80. Замерзание и кипение растворов.
- Глава VIII. РАСТВОРЫ ЭЛЕКТРОЛИТОВ
- 81. Особенности растворов солей, кислот и оснований.
- 82. Теория электролитической диссоциации.
- 83. Процесс диссоциации.
- 84. Степень диссоциации. Сила электролитов.
- 85. Константа диссоциации.
- 86. Сильные электролиты.
- 87. Свойства кислот, оснований и солей с точки зрения теории электролитической диссоциации.
- 88. Ионно-молекулярные уравнения.
- 89. Произведение растворимости.
- 90. Диссоциация воды. Водородный показатель.
- 91. Смещение ионных равновесий.
- 92. Гидролиз солей.
- Глава IX. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ. ОСНОВЫ ЭЛЕКТРОХИМИИ
- 93. Окисленность элементов.
- 94. Окислительно-восстановительные реакции.
- 95. Составление уравнений окислительно-восстановительных реакций.
- 96. Важнейшие окислители и восстановители.
- 97. Окислительно-восстановительная двойственность.
- 98. Химические источники электрической энергии.
- 99. Электродные потенциалы.
- 100. Ряд напряжений металлов.
- 101. Электролиз.
- 102. Законы электролиза.
- 103. Электролиз в промышленности.
- 104. Электрохимическая поляризация.
- Глава X. ДИСПЕРСНЫЕ СИСТЕМЫ. КОЛЛОИДЫ
- 105. Дисперсное состояние вещества.
- 106. Состояние вещества на границе раздела фаз.
- 107. Коллоиды и коллоидные растворы.
- 108. Дисперсионный анализ.
- 109. Сорбция и сорбционные процессы.
- 110. Ионообменная адсорбция.
- 111. Хроматография.
- 112. Электрокинетические явления.
- 113. Устойчивость и коагуляция дисперсных систем.
- 114. Структурообразование в дисперсных системах.
- Глава XI. ВОДОРОД
- 115. Водород в природе. Получение водорода.
- 116. Свойства и применение водорода.
- 117. Пероксид водорода
- Глава XII. ГАЛОГЕНЫ
- 118. Галогены в природе. Физические свойства галогенов.
- 119. Химические свойства галогенов.
- 120. Получение и применение галогенов.
- 121. Соединения галогенов с водородом.
- 122. Кислородсодержащие соединения галогенов.
- Глава XIII. ГЛАВНАЯ ПОДГРУППА ШЕСТОЙ ГРУППЫ
- 123. Кислород в природе. Воздух.
- 124. Получение и свойства кислорода.
- 125. Озон.
- 126. Сера в природе. Получение серы.
- 127. Свойства и применение серы.
- 128. Сероводород. Сульфиды.
- 129. Диоксид серы. Сернистая кислота.
- 130. Триоксид серы. Серная кислота.
- 131. Получение и применение серной кислоты.
- 132. Пероксодвусерная кислота.
- 133. Тиосерная кислота.
- 134. Соединения серы с галогенами.
- 135. Селен (Selenium). Теллур (Tellurium).
- Глава XIV. ГЛАВНАЯ ПОДГРУППА ПЯТОЙ ГРУППЫ
- 136. Азот в природе. Получение и свойства азота.
- 137. Аммиак. Соли аммония.
- 138. Фиксация атмосферного азота. Получение аммиака.
- 139. Гидразин. Гидроксиламин. Азидоводород.
- 140. Оксиды азота.
- 141. Азотистая кислота.
- 142. Азотная кислота.
- 143. Промышленное получение азотной кислоты.
- 144. Круговорот азота в природе.
- 145. Фосфор в природе. Получение и свойства фосфора.
- 146. Соединения фосфора с водородом и галогенами.
- 147. Оксиды и кислоты фосфора.
- 148. Минеральные удобрения.
- 149. Мышьяк (Arsenicum).
- 150. Сурьма (Stibium).
- 151. Висмут (Bismuthum).
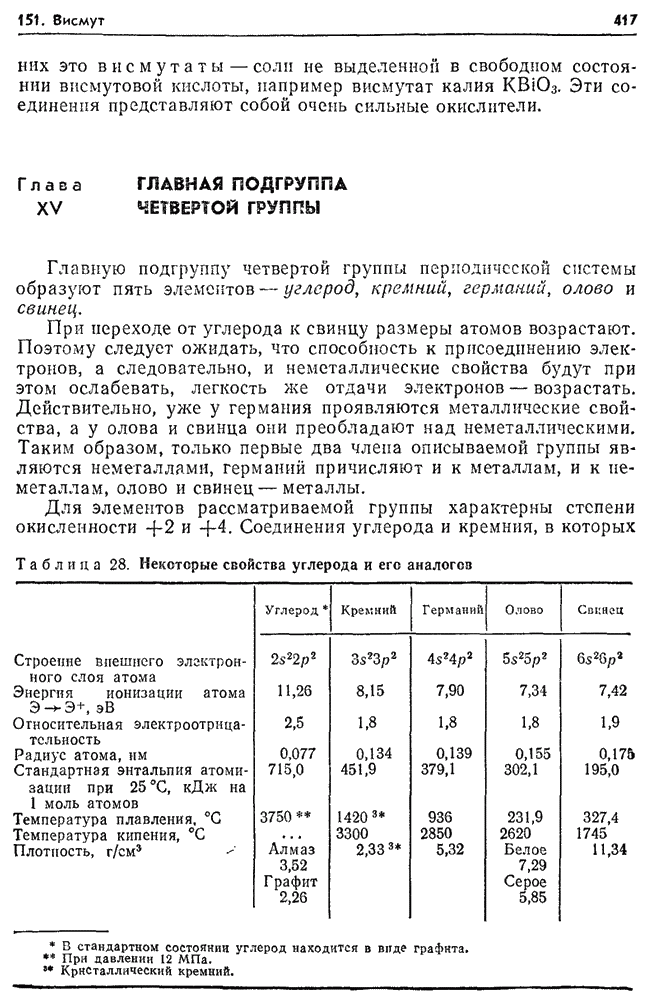
- Глава XV. ГЛАВНАЯ ПОДГРУППА ЧЕТВЕРТОЙ ГРУППЫ
- 152. Углерод в природе.
- 153. Аллотропия углерода.
- 154. Химические свойства углерода. Карбиды.
- 155. Диоксид углерода. Угольная кислота.
- 156. Оксид углерода (II).
- 157. Соединения углерода с серой и азотом.
- 158. Топливо и его виды.
- 159. Газообразное топливо.
- 160. Общая характеристика органических соединений.
- 161. Отличительные особенности органических соединений.
- 162. Теория химического строения органических соединений.
- 163. Классификация органических соединений.
- 164. Предельные (насыщенные) углеводороды.
- 165. Непредельные (ненасыщенные) углеводороды.
- 166. Предельные циклические углеводороды.
- 167. Ароматические углеводороды.
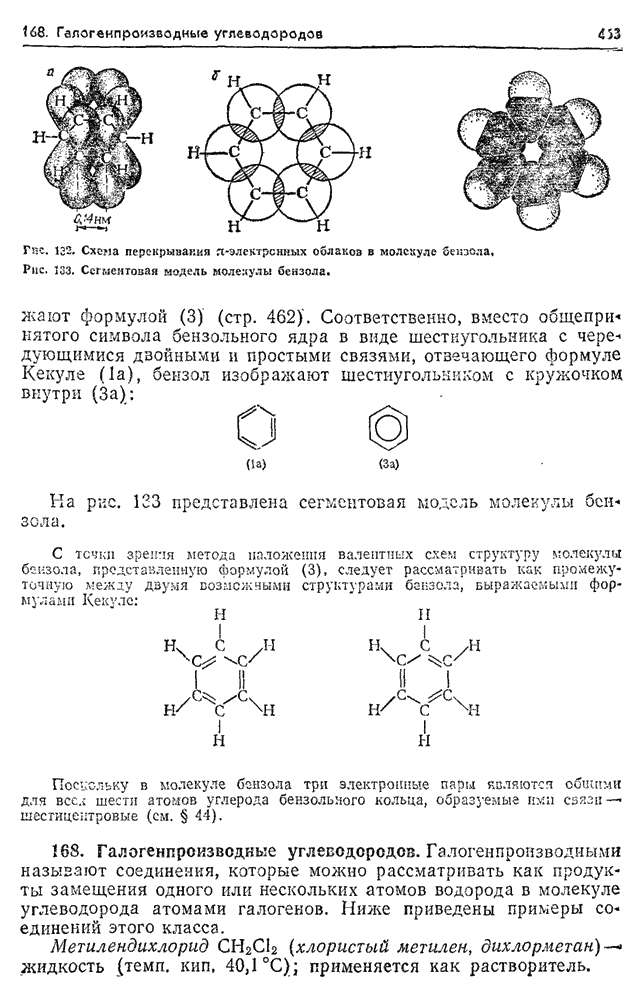
- 168. Галогенпроизводные углеводородов.
- 169. Спирты и фенолы.
- 170. Простые эфиры.
- 171. Альдегиды и кетоны.
- 172. Карбоновые кислоты.
- 173. Сложные эфиры карбоновых кислот. Жиры.
- 174. Углеводы.
- 175. Амины.
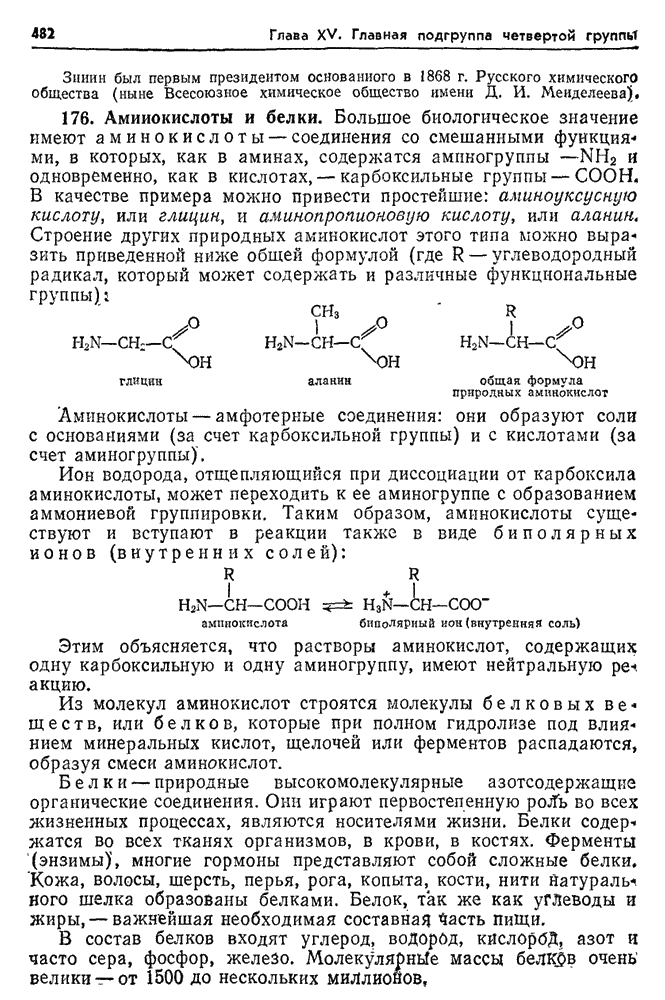
- 176. Аминокислоты и белки.
- 177. Природные и синтетические высокомолекулярные соединения (полимеры).
- 178. Кремний в природе. Получение и свойства кремния.
- 179. Соединения кремния с водородом и галогенами.
- 180. Диоксид кремния.
- 181. Кремниевые кислоты и их соли.
- 182. Стекло.
- 183. Керамика.
- 184. Цемент.
- 185. Кремнийорганические соединения.
- 186. Германий (Germanium).
- 187. Олово (Stannuin).
- 188. Свинец (Plumbum).
- 189. Свинцовый аккумулятор.
- Глава XVI. ОБЩИЕ СВОЙСТВА МЕТАЛЛОВ. СПЛАВЫ
- 190. Физические и химические свойства металлов. Электронное строение металлов, изоляторов и полупроводников.
- 191. Кристаллическое строение металлов.
- 192. Добывание металлов из руд.
- 193. Получение металлов высокой чистоты.
- 194. Сплавы.
- 195. Диаграммы состояния металлических систем.
- 196. Коррозия металлов.
- Глава XVII. ПЕРВАЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
- 197. Щелочные металлы в природе.
- 198. Натрий (Natrium).
- 199. Калий (Kalium).
- ПОДГРУППА МЕДИ
- 200. Медь. (Cuprum).
- 201. Серебро (Argentum).
- 202. Золото (Aurum).
- Глава XVIII. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
- 203. Основные положения координационной теории.
- 204. Основные типы и номенклатура комплексных соединений.
- 205. Пространственное строение и изомерия комплексных соединений.
- 206. Природа химической связи в комплексных соединениях.
- 207. Диссоциация комплексных соединений в растворах.
- 208. Влияние координации на свойства лигандов и центрального атома.
- Глава XIX. ВТОРАЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
- 209. Бериллий (Beryllium).
- 210. Магний (Magnesium).
- 211. Кальций (Calcium).
- 212. Жесткость природных вод и ее устранение.
- 213. Стронций (Strontium). Барий (Barium).
- 214. Цинк (Zincum).
- 215. Кадмий (Cadmium).
- 216. Ртуть (Hydrargyrum).
- Глава XX. ТРЕТЬЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
- 217. Бор (Borum).
- 218. Алюминий (Aluminium).
- 219. Галлий (Gallium). Иидий (Indium). Таллий (Thallium).
- ПОБОЧНАЯ ПОДГРУППА ТРЕТЬЕЙ ГРУППЫ. ЛАНТАНОИДЫ. АКТИНОИДЫ
- 220. Подгруппа скандия.
- 221. Лантаноиды.
- 222. Актиноиды.
- Глава XXI. ПОБОЧНЫЕ ПОДГРУППЫ ЧЕТВЕРТОЙ, ПЯТОЙ, ШЕСТОЙ И СЕДЬМОЙ ГРУПП
- ПОДГРУППА ТИТАНА
- 224. Титан (Titanium).
- 225. Цирконий (Zirconium). Гафний (Hafnium).
- ПОДГРУППА ВАНАДИЯ
- 226. Ванадий (Vanadium).
- 227. Ниобий (Niobium). Тантал (Tantalum).
- ПОДГРУППА ХРОМА
- 228. Хром (Chromium).
- 229. Молибден (Mollbdenium).
- 230. Вольфрам (Wolfram).
- ПОДГРУППА МАРГАНЦА
- 231. Марганец (Manganum).
- 232. Рений (Rhenium).
- Глава XXII. ВОСЬМАЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
- 233. Общая характеристика благородных газов.
- 234. Гелий (Helium).
- 235. Неон. Аргон.
- ПОБОЧНАЯ ПОДГРУППА ВОСЬМОЙ ГРУППЫ
- 236. Железо (Ferrum).
- 237. Значение железа и его сплавов в технике. Развитие металлургии в СССР.
- 238. Физические свойства железа. Диаграмма состояния системы железо — углерод.
- 239. Производство чугуна и стали.
- 240. Термическая обработка стали.
- 241. Сплавы железа.
- 242. Химические свойства железа. Соединения железа.
- 243. Кобальт (Cobaltum).
- 244. Никель (Niccolum).
- 245. Общая характеристика платиновых металлов.
- 246. Платина (Platinum).
- 247. Палладий (Palladium). Иридий (Iridium).
- ПРИЛОЖЕНИЕ
- Некоторые единицы СИ
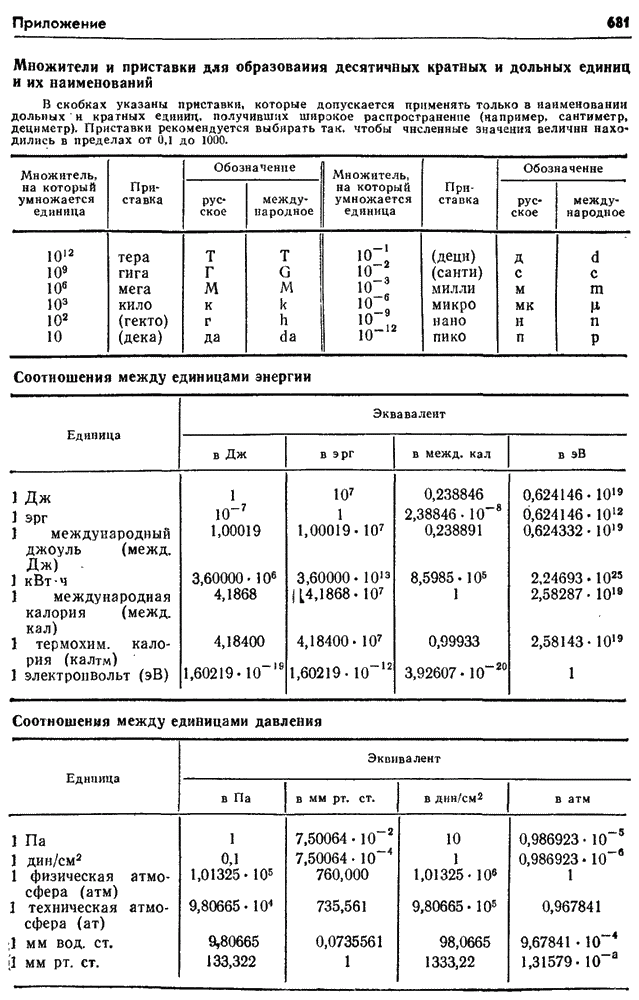
- Множители и приставки для образования десятичных кратных и дольных единиц и их наименований
- Соотношения между некоторыми внесистемными единицами и единицами СИ
- Литература для углубленного изучения общей и неорганической химии