| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
206. Природа химической связи в комплексных соединениях.
Образование многих комплексных соединений можно в первом приближении объяснить электростатическим притяжением между центральным катионом и анионами или полярными молекулами лигандов. Наряду с силами притяжения действуют и силы электростатического отталкивания между одноименно заряженными (или, в случае полярных молекул, одинаково ориентированными) лигандами. В результате образуется устойчивая группировка атомов (ионов), обладающая минимальной потенциальной энергией.Количественные расчеты на основе такой электростатической модели впервые были выполнены В. Косселем и А. Магнусом, которые принимали ионы за недеформируемые шары и учитывали их взаимодействие по закону Кулона. Результаты этих расчетов удовлетворительно передают зависимость координационного числа от заряда центрального иона. Однако простая электростатическая теория не в состоянии объяснить избирательность (специфичность) комплексообразования, поскольку она не принимает во внимание природу центрального атома и лигандов, особенности строения их электронных оболочек. Для учета этих факторов электростатическая теория была дополнена поляризационными представлениями (см. § 46), согласно которым комплексообразованию благоприятствует участие в качестве центральных атомов небольших многозарядных катионов  -элементов, обладающих сильным поляризующим действием, а в качестве лигандов — больших, легко поляризующихся ионов или молекул. В этом случае происходит деформация электронных оболочек центрального атома и лигандов, приводящая к их взаимопроникновению, что и вызывает упрочнение связей.
-элементов, обладающих сильным поляризующим действием, а в качестве лигандов — больших, легко поляризующихся ионов или молекул. В этом случае происходит деформация электронных оболочек центрального атома и лигандов, приводящая к их взаимопроникновению, что и вызывает упрочнение связей.
Поляризационные представления оказались полезными для объяснения устойчивости, кислотно-основных и окислительно-восстановительных свойств комплексных соединений, но многие другие их свойства остались необъясненными. Так, с позиций электростатической теории все комплексы с координационным числом 4 должны иметь тетраэдрическое строение, поскольку именно такой конфигурации соответствует наименьшее взаимное отталкивание лигандов. В действительности, как мы уже знаем, некоторые подобные комплексы, например, образованные платиной (II), построены в форме плоского квадрата. Электростатическая теория не в состоянии объяснить особенности реакционной способности комплексных соединений, их магнитные свойства и окраску. Более точное и полное описание свойств и строения комплексных соединений может быть получено только на основе квантовомеханических представлений о строении атомов и молекул.
В настоящее время существует несколько подходов к квантовомеханическому описанию строения комплексных соединений.
Теория кристаллического поля основана на представлении об электростатической природе взаимодействия между центральным ионом и лигандами. Однако, в отличие от простой ионной теории, здесь учитывается различное пространственное расположение  -орбиталей (см. рис. 20 на стр. 81) и связллное с этим различное изменение энергии
-орбиталей (см. рис. 20 на стр. 81) и связллное с этим различное изменение энергии  -электронов центрального атома, вызываемое их отталкиванием от электронных облаков лигандов.
-электронов центрального атома, вызываемое их отталкиванием от электронных облаков лигандов.
Рассмотрим состояние  -орбиталей центрального иона. В свободном ионе электроны, находящиеся на каждой из пяти
-орбиталей центрального иона. В свободном ионе электроны, находящиеся на каждой из пяти  -орбиталей, обладают одинаковой энергией (рис. 160, а). Представим себе, что лиганды создают равномерное сферическое электростатическое поле, в центре которого находится центральный
-орбиталей, обладают одинаковой энергией (рис. 160, а). Представим себе, что лиганды создают равномерное сферическое электростатическое поле, в центре которого находится центральный  . В этом гипотетическом случае энергия
. В этом гипотетическом случае энергия  -орбиталей за счет отталкивающего действия лигандов возрастает на одинаковую величину, т. е. все
-орбиталей за счет отталкивающего действия лигандов возрастает на одинаковую величину, т. е. все  -орбитали останутся энергетически равноценными (рис. 160,6). В действительности, однако, лиганды неодинаково действуют на различные
-орбитали останутся энергетически равноценными (рис. 160,6). В действительности, однако, лиганды неодинаково действуют на различные  -орбитали: если орбиталь расположена близко к лиганду, энергия занимающего ее электрона возрастает более значительно, чем в том случае, когда орбиталь удалена от лиганда. Например, при октаэдрическом расположении лигандов вокруг центрального иона наибольшее отталкивание испытывают электроны, находящиеся на орбиталях
-орбитали: если орбиталь расположена близко к лиганду, энергия занимающего ее электрона возрастает более значительно, чем в том случае, когда орбиталь удалена от лиганда. Например, при октаэдрическом расположении лигандов вокруг центрального иона наибольшее отталкивание испытывают электроны, находящиеся на орбиталях  и
и  направленных к лигандам (рис. 161, а и б); поэтому их энергия будет более высокой, чем в гипотетическом сферическом поле. Напротив,
направленных к лигандам (рис. 161, а и б); поэтому их энергия будет более высокой, чем в гипотетическом сферическом поле. Напротив,  и
и  -орбитали направлены между лигандами (рис. 161, в), так что энергия находящихся здесь электронов будет ниже, чем в сферическом поле. Таким образом, в октаэдрическом поле лигандов происходит расщепление
-орбитали направлены между лигандами (рис. 161, в), так что энергия находящихся здесь электронов будет ниже, чем в сферическом поле. Таким образом, в октаэдрическом поле лигандов происходит расщепление  -уровня центрального иона на два энергетических уровня (рис. 160, в): более высокий уровень, соответствующий орбиталям
-уровня центрального иона на два энергетических уровня (рис. 160, в): более высокий уровень, соответствующий орбиталям  и
и  (их принято обозначать
(их принято обозначать  или
или  ), и более низкий уровень, отвечающий орбиталям
), и более низкий уровень, отвечающий орбиталям  и
и  (эти орбитали обозначают
(эти орбитали обозначают  или
или  ).
).
Разница в энергиях уровней  и
и  , называемая энергией расщепления, обозначается буквой
, называемая энергией расщепления, обозначается буквой  ; ее можно экспериментально определить по спектрам поглощения комплексных соединений.
; ее можно экспериментально определить по спектрам поглощения комплексных соединений.

Рис. 160. Схема энергетических уровней  -орбиталей центрального иона: а — свободный ион; б — ион в гипотетическом сферическом поле; в — ион в октаэдрическом поле лигандов.
-орбиталей центрального иона: а — свободный ион; б — ион в гипотетическом сферическом поле; в — ион в октаэдрическом поле лигандов.

Рис. 161. Орбитали  и
и  в октаэдрическом поле лкгандоз (лиганды условно изображены в виде шариков).
в октаэдрическом поле лкгандоз (лиганды условно изображены в виде шариков).
Значение А зависит как от природы центрального атома, так и от природы лигандов: лиганды, создающие сильное поле, вызывают большее расщепление энергетических уровней, т. е. более высокое значение А.
По величине энергии расщепления лиганды располагаются в следующем порядке (так называемый спектрохимический ряд):

В начале этого ряда находятся лиганды, создающие наиболее сильное поле, в конце — создающие слабое поле.
Электроны центрального иона распределяются по  -орбиталям так, чтобы образовалась система с минимальной энергией. Это может быть достигнуто двумя способами: размещением электронов на
-орбиталям так, чтобы образовалась система с минимальной энергией. Это может быть достигнуто двумя способами: размещением электронов на  -орбиталях, отвечающих более низкой энергии, или равномерным распределением их по всем
-орбиталях, отвечающих более низкой энергии, или равномерным распределением их по всем  -орбиталям, в соответствии с правилом Хунда (см. § 32). Если общее число электронов, находящихся на
-орбиталям, в соответствии с правилом Хунда (см. § 32). Если общее число электронов, находящихся на  -орбиталях центрального иона, не превышает трех, то они размещаются на орбиталях более низкого энергетического уровня
-орбиталях центрального иона, не превышает трех, то они размещаются на орбиталях более низкого энергетического уровня  по правилу Хунда. Так, у иона
по правилу Хунда. Так, у иона  , имеющего электронную конфигурацию внешнего слоя
, имеющего электронную конфигурацию внешнего слоя  , каждый из трех
, каждый из трех  -электронов занимает одну из трех
-электронов занимает одну из трех  -орбиталей.
-орбиталей.
Иное положение складывается, когда на  -орбиталях центрального иона находится большее число электронов. Размещение их в соответствии с правилом Хунда требует затраты энергии для перевода некоторых электронов на
-орбиталях центрального иона находится большее число электронов. Размещение их в соответствии с правилом Хунда требует затраты энергии для перевода некоторых электронов на  -орбитали. С другой стороны, при размещении максимального числа электронов на
-орбитали. С другой стороны, при размещении максимального числа электронов на  -орбиталях нарушается правило Хунда и, следовательно, необходима затрата энергии для перевода некоторых электронов на орбитали, на которых уже имеется по одному электрону.
-орбиталях нарушается правило Хунда и, следовательно, необходима затрата энергии для перевода некоторых электронов на орбитали, на которых уже имеется по одному электрону.

Рис. 162. распределение электронов иона  по
по  -орбиталям: а — в гипотетическом сферическом поле; б — в слабом октаэдрическом поле лигандов (комплекс
-орбиталям: а — в гипотетическом сферическом поле; б — в слабом октаэдрическом поле лигандов (комплекс  ); в - в сильном октаэдрическом поле лигандов (комплекс
); в - в сильном октаэдрическом поле лигандов (комплекс  ).
).
Поэтому в случае слабого поля, т. е. небольшой величины энергии расщепления, энергетически более выгодным оказывается равномерное распределение  -электронов по всем
-электронов по всем  -орбиталям (в соответствии с правилом Хунда); при этом центральный
-орбиталям (в соответствии с правилом Хунда); при этом центральный  сохраняет высокое значение спина, так что образуется высокоспиновый парамагнитный комплекс. В случае же сильного поля (высокое значение энергии расщепления) энергетически более выгодным будет размещение максимального числа электронов на
сохраняет высокое значение спина, так что образуется высокоспиновый парамагнитный комплекс. В случае же сильного поля (высокое значение энергии расщепления) энергетически более выгодным будет размещение максимального числа электронов на  -орбиталях; при этом создается низкоспиновый диамагнитный комплекс.
-орбиталях; при этом создается низкоспиновый диамагнитный комплекс.
С этой точки зрения понятно, почему, например, комплекс  парамагнитен, а комплекс
парамагнитен, а комплекс  диамагнитен. Положение лигандов F- и CN- в спектрохимическом ряду (см. выше) показывает, что ионам CN- соответствует значительно более высокая энергия расщепления А, чем ионам
диамагнитен. Положение лигандов F- и CN- в спектрохимическом ряду (см. выше) показывает, что ионам CN- соответствует значительно более высокая энергия расщепления А, чем ионам  . Поэтому в рассматриваемых комплексах электроны центрального иона
. Поэтому в рассматриваемых комплексах электроны центрального иона  распределяются по
распределяются по  -орбиталям так, как это показано на рис. 162: комплекс
-орбиталям так, как это показано на рис. 162: комплекс  — высокоспиновый, а комплекс
— высокоспиновый, а комплекс  низкоспиновый.
низкоспиновый.
Мы рассмотрели теорию кристаллического поля в приложении к комплексам с октаэдрическим расположением (октаэдрической координацией) лигандов. С аналогичных позиций могут быть рассмотрены и свойства комплексов с иной, например тетраэдрической, координацией.
На основе теории кристаллического поля удается объяснить не только магнитные свойства комплексных соединений, но и их специфическую окраску. Так, в комплексе  имеет один
имеет один  -электрон (электронная конфигурация
-электрон (электронная конфигурация  ). В нормальном (невозбужденном) состоянии этот электрон находится на одной из
). В нормальном (невозбужденном) состоянии этот электрон находится на одной из  -орбиталей, но при затрате некоторой энергии (
-орбиталей, но при затрате некоторой энергии ( ) может возбуждаться и переходить на
) может возбуждаться и переходить на  -орбиталь. Длина волны света, поглощаемого при этом переходе и соответствующего указанной энергии, равна
-орбиталь. Длина волны света, поглощаемого при этом переходе и соответствующего указанной энергии, равна  : это и обусловливает фиолетовую окраску комплекса
: это и обусловливает фиолетовую окраску комплекса  . При таком рассмотрении становится понятным, почему комплексы, образованные ионами
. При таком рассмотрении становится понятным, почему комплексы, образованные ионами  и
и  , как правило, бесцветны; эти ионы имеют электронную конфигурацию
, как правило, бесцветны; эти ионы имеют электронную конфигурацию  , так что все
, так что все  -орбитали заполнены и переход электронов с на
-орбитали заполнены и переход электронов с на  -орбитали невозможен.
-орбитали невозможен.  же
же  образует окрашенные комплексы: он обладает электронной конфигурацией
образует окрашенные комплексы: он обладает электронной конфигурацией  , так что один из
, так что один из  -электронов может при возбуждении переходить на
-электронов может при возбуждении переходить на  -орбиталь.
-орбиталь.
Хотя теория кристаллического поля оказалась плодотворной с трактовке магнитных, оптических и некоторых других свойств комплексных соединений, она не смогла объяснить положения лигандов в спектрохимическом ряду, а также сам факт образования некоторых комплексов, например, так называемых «сэндвичевых» соединений — дибензолхрома  , ферроцена
, ферроцена  и их аналогов. Дело в том, что теория кристаллического поля, учитывая влияние лигандов на центральный
и их аналогов. Дело в том, что теория кристаллического поля, учитывая влияние лигандов на центральный  , не принимает во внимание участия электронов лигандов в образовании химических связей с центральным ионом. Поэтому применение теории кристаллического поля ограничено, главным образом, комплексными соединениями с преимущественно ионным характером связи между центральным атомом и лигандами.
, не принимает во внимание участия электронов лигандов в образовании химических связей с центральным ионом. Поэтому применение теории кристаллического поля ограничено, главным образом, комплексными соединениями с преимущественно ионным характером связи между центральным атомом и лигандами.
Метод валентных связей в приложении к комплексным соединениям базируется на тех же представлениях, что и в простых соединениях (см.  39—44). При этом принимается во внимание, что химические связи, возникающие при комплексооб-разовании имеют донорно-акцепторное происхождение, т. е. образуются за счет неподеленной электронной пары одного из взаимодействующих атомов и свободной орбитали другого атома. Рассмотрим с этих позиций строение некоторых комплексных соединений.
39—44). При этом принимается во внимание, что химические связи, возникающие при комплексооб-разовании имеют донорно-акцепторное происхождение, т. е. образуются за счет неподеленной электронной пары одного из взаимодействующих атомов и свободной орбитали другого атома. Рассмотрим с этих позиций строение некоторых комплексных соединений.
В молекуле аммиака атом азота находится в состоянии « -гибридизации, причем на одной из его гибридных орбиталей находится неподеленная электронная пара. Поэтому при донорно-акцепторном взаимодействии молекулы
-гибридизации, причем на одной из его гибридных орбиталей находится неподеленная электронная пара. Поэтому при донорно-акцепторном взаимодействии молекулы  с ионом
с ионом  образуется
образуется  имеющий тетраэдрическую конфигурацию. Аналогично построен комплексный
имеющий тетраэдрическую конфигурацию. Аналогично построен комплексный  : здесь донором электронной пары служит анион
: здесь донором электронной пары служит анион  , а акцептором — атом бора в молекуле
, а акцептором — атом бора в молекуле  , обладающий незанятой орбиталью внешнего электронного слоя и переходящий при комплексообразовании в состояние
, обладающий незанятой орбиталью внешнего электронного слоя и переходящий при комплексообразовании в состояние  -гибридизации.
-гибридизации.
Такую же геометрическую конфигурацию (тетраэдр) имеют некоторые комплексы элементов подгруппы цинка, например  . Так, в комплексе
. Так, в комплексе  цинка предоставляет для электронных пар лигандов (условно показанных на схеме точками) одну
цинка предоставляет для электронных пар лигандов (условно показанных на схеме точками) одну  и три
и три  -орбитали
-орбитали

причем осуществляется  -гибридизация, соответствующая размещению лигандов в вершинах тетраэдра (тетраэдрическая координация).
-гибридизация, соответствующая размещению лигандов в вершинах тетраэдра (тетраэдрическая координация).
Ионы  -элементов с четырьмя занятыми
-элементов с четырьмя занятыми  -орбиталямн
-орбиталямн  при координационном числе 4 предоставляют для электронных пар лигандов одну
при координационном числе 4 предоставляют для электронных пар лигандов одну  , одну
, одну  и две
и две  -орбитали, например, в комплексе
-орбитали, например, в комплексе  :
:

этом осуществляется гибридизация  , отвечающая размещению лигандов в вершинах квадрата (квадратная координация). Поэтому такие комплексы, как
, отвечающая размещению лигандов в вершинах квадрата (квадратная координация). Поэтому такие комплексы, как  , обладают структурой плоского квадрата.
, обладают структурой плоского квадрата.
Координационному числу 6 соответствует гибридизация  и октаэдрическое расположение лигандов. Такая координация имеет место, например, в комплексах платины (IV):
и октаэдрическое расположение лигандов. Такая координация имеет место, например, в комплексах платины (IV):

Такая же октаэдрическая координация осуществляется в комплексах  и др.
и др.
Координационному числу 2 отвечает гибридизация  -типа и линейная координация лигандов, например, в комплексе
-типа и линейная координация лигандов, например, в комплексе  :
:

примеры показывают, что метод ВС успешно объясняет определенные значения координационных чисел и геометрические формы комплексных частиц. Правильно описываются с позиций этого метода и различия в магнитных свойствах (диамагнитность или парамагнитность) комплексных соединений. Однако некоторые их свойства (например, спектры поглощения) не находят с позиций метода ВС удовлетворительного объяснения. Кроме того, взаймодействие между центральным атомом и лигандами в комплексных соединениях не сводится только к передаче электронов от лиганда. Существуют лиганды, которые способны принимать электроны металла  вакантные орбитали, например на свободные
вакантные орбитали, например на свободные  -орбитали (в молекуле
-орбитали (в молекуле  или в ионе
или в ионе  ), или на незаполненные разрыхляющие орбитали (в молекулах
), или на незаполненные разрыхляющие орбитали (в молекулах  ).
).
Такие лиганды называют  -акцепторами, а связь их с центральным атомом
-акцепторами, а связь их с центральным атомом  -дативной. Строение многих из открытых в последнее время комплексных соединений, например «сэндвичевых», нельзя объяснить с точки зрения метода ВС.
-дативной. Строение многих из открытых в последнее время комплексных соединений, например «сэндвичевых», нельзя объяснить с точки зрения метода ВС.
Метод молекулярных орбиталей. Молекулярные орбитали в комплексных соединениях образуются по тому  принципу и обладают теми же свойствами, что и молекулярные орбитали в двухатомных молекулах (см. § 45). Отличие заключается в том, что в комплексных соединениях МО являются многоцентровыми, делокализованными, подобно тому, что имеет место, например, в молекуле бензола (см. § 167).
принципу и обладают теми же свойствами, что и молекулярные орбитали в двухатомных молекулах (см. § 45). Отличие заключается в том, что в комплексных соединениях МО являются многоцентровыми, делокализованными, подобно тому, что имеет место, например, в молекуле бензола (см. § 167).
Метод МО стал в настоящее время ведущим, наиболее плодотворным в теории строения комплексных соединений. В частности, он успешно объясняет строение и свойства уже упоминавшихся «сэндвичевых» соединений, например  , в которых центральный атом находится между циклическими органическими молекулами и связан с ними делокализованными многоцентровыми связями. Приложение метода МО к объяснению строения комплексных соединений рассматривается в специальных руководствах.
, в которых центральный атом находится между циклическими органическими молекулами и связан с ними делокализованными многоцентровыми связями. Приложение метода МО к объяснению строения комплексных соединений рассматривается в специальных руководствах.
| << Предыдущий параграф | Следующий параграф >> |
- ВВЕДЕНИЕ
- Глава I. АТОМНО-МОЛЕКУЛЯРНОЕ УЧЕНИЕ
- 4. Закон сохранения массы.
- 5. Основное содержание атомно-молекулярного учения.
- 6. Простое вещество и химический элемент.
- 7. Закон постоянства состава.
- 8. Закон объемных отношений.
- 9. Атомные и молекулярные массы. Моль.
- 10. Определение молекулярных масс веществ, находящихся в газообразном состоянии.
- 11. Парциальное давление газа.
- 12. Эквивалент. Закон эквивалентов.
- 13. Определение атомных масс. Валентность.
- 14. Химическая символика.
- 15. Важнейшие классы и номенклатура неорганических веществ.
- 16. Химические расчеты.
- Глава II ПЕРИОДИЧЕСКИЙ ЗАКОН Д. И. МЕНДЕЛЕЕВА
- 17. Периодический закон Д. И. Менделеева.
- 18. Периодическая система элементов.
- 19. Значение периодической системы.
- Глава III СТРОЕНИЕ АТОМА. РАЗВИТИЕ ПЕРИОДИЧЕСКОГО ЗАКОНА
- 20. Радиоктивность.
- 21. Ядерная модель атома.
- 22. Атомные спектры.
- 23. Квантовая теория света.
- 24. Строение электронной оболочки атома по Бору.
- 25. Исходные представления квантовой механики.
- 26. Волновая функция.
- 27. Энергетическое состояние электрона в атоме.
- 29. Орбитальное квантовое число. Формы электронных облаков.
- 30. Магнитное и спиновое квантовые числа.
- 31. Многоэлектронные атомы.
- 32. Принцип Паули. Электронная структура атомов и периодическая система элементов.
- 33. Размеры атомов и ионов.
- 34. Энергия ионизации и сродство к электрону.
- 35. Строение атомных ядер. Изотопы.
- 36. Радиоактивные элементы и их распад.
- 37. Искусственная радиоктивность. Ядерные реакции.
- Глава IV. ХИМИЧЕСКАЯ СВЯЗЬ И СТРОЕНИЕ МОЛЕКУЛ
- 38. Теория химического строения.
- 39. Ковалентная связь. Метод валентных связей.
- 40. Неполярная и полярная ковалентная связь.
- 41. Способы образования ковалентной связи.
- 42. Направленность ковалентной связи.
- 43. Гибридизация атомных электронных орбиталей.
- 44. Многоцентровые связи.
- 45. Метод молекулярных орбиталей.
- 46. Ионная связь.
- 47. Водородная связь.
- Глава V. СТРОЕНИЕ ТВЕРДОГО ТЕЛА И ЖИДКОСТИ
- 48. Межмолекулярное взаимодействие.
- 49. Кристаллическое состояние вещества.
- 50. Внутреннее строение кристаллов.
- 51. Реальные кристаллы.
- 52. Аморфное состояние вещества.
- 53. Жидкости.
- Глава VI. ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ПРОТЕКАНИЯ ХИМИЧЕСКИХ РЕАКЦИЙ
- 54. Превращения энергии при химических реакциях.
- 55. Термохимия.
- 56. Термохимические расчеты.
- 57. Скорость химической реакции.
- 59. Зависимость скорости реакции от температуры и от природы реагирующих веществ.
- 60. Катализ.
- 61. Скорость реакции в гетерогенных системах.
- 62. Цепные реакции.
- 63. Необратимые и обратимые реакции. Химическое равновесие.
- 64. Смещение химического равновесия. Принцип Ле Шателье.
- 65. Факторы, определяющие направление протекания химических реакций.
- 66. Термодинамические величины. Внутренняя энергия и энтальпия.
- 67. Термодинамические величины. Энтропия и энергия Гиббса.
- 68. Стандартные термодинамические величины. Химико-термодинамические расчеты.
- Глава VII. ВОДА, РАСТВОРЫ
- 69. Вода в природе.
- 70. Физические свойства воды.
- 71. Диаграмма состояния воды.
- 72. Химические свойства воды.
- 73. Характеристика растворов. Процесс растворения.
- 74. Способы выражения состава растворов.
- 75. Гидраты и кристаллогидраты.
- 76. Растворимость.
- 77. Пересыщенные растворы.
- 78. Осмос.
- 79. Давление пара растворов.
- 80. Замерзание и кипение растворов.
- Глава VIII. РАСТВОРЫ ЭЛЕКТРОЛИТОВ
- 81. Особенности растворов солей, кислот и оснований.
- 82. Теория электролитической диссоциации.
- 83. Процесс диссоциации.
- 84. Степень диссоциации. Сила электролитов.
- 85. Константа диссоциации.
- 86. Сильные электролиты.
- 87. Свойства кислот, оснований и солей с точки зрения теории электролитической диссоциации.
- 88. Ионно-молекулярные уравнения.
- 89. Произведение растворимости.
- 90. Диссоциация воды. Водородный показатель.
- 91. Смещение ионных равновесий.
- 92. Гидролиз солей.
- Глава IX. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ. ОСНОВЫ ЭЛЕКТРОХИМИИ
- 93. Окисленность элементов.
- 94. Окислительно-восстановительные реакции.
- 95. Составление уравнений окислительно-восстановительных реакций.
- 96. Важнейшие окислители и восстановители.
- 97. Окислительно-восстановительная двойственность.
- 98. Химические источники электрической энергии.
- 99. Электродные потенциалы.
- 100. Ряд напряжений металлов.
- 101. Электролиз.
- 102. Законы электролиза.
- 103. Электролиз в промышленности.
- 104. Электрохимическая поляризация.
- Глава X. ДИСПЕРСНЫЕ СИСТЕМЫ. КОЛЛОИДЫ
- 105. Дисперсное состояние вещества.
- 106. Состояние вещества на границе раздела фаз.
- 107. Коллоиды и коллоидные растворы.
- 108. Дисперсионный анализ.
- 109. Сорбция и сорбционные процессы.
- 110. Ионообменная адсорбция.
- 111. Хроматография.
- 112. Электрокинетические явления.
- 113. Устойчивость и коагуляция дисперсных систем.
- 114. Структурообразование в дисперсных системах.
- Глава XI. ВОДОРОД
- 115. Водород в природе. Получение водорода.
- 116. Свойства и применение водорода.
- 117. Пероксид водорода
- Глава XII. ГАЛОГЕНЫ
- 118. Галогены в природе. Физические свойства галогенов.
- 119. Химические свойства галогенов.
- 120. Получение и применение галогенов.
- 121. Соединения галогенов с водородом.
- 122. Кислородсодержащие соединения галогенов.
- Глава XIII. ГЛАВНАЯ ПОДГРУППА ШЕСТОЙ ГРУППЫ
- 123. Кислород в природе. Воздух.
- 124. Получение и свойства кислорода.
- 125. Озон.
- 126. Сера в природе. Получение серы.
- 127. Свойства и применение серы.
- 128. Сероводород. Сульфиды.
- 129. Диоксид серы. Сернистая кислота.
- 130. Триоксид серы. Серная кислота.
- 131. Получение и применение серной кислоты.
- 132. Пероксодвусерная кислота.
- 133. Тиосерная кислота.
- 134. Соединения серы с галогенами.
- 135. Селен (Selenium). Теллур (Tellurium).
- Глава XIV. ГЛАВНАЯ ПОДГРУППА ПЯТОЙ ГРУППЫ
- 136. Азот в природе. Получение и свойства азота.
- 137. Аммиак. Соли аммония.
- 138. Фиксация атмосферного азота. Получение аммиака.
- 139. Гидразин. Гидроксиламин. Азидоводород.
- 140. Оксиды азота.
- 141. Азотистая кислота.
- 142. Азотная кислота.
- 143. Промышленное получение азотной кислоты.
- 144. Круговорот азота в природе.
- 145. Фосфор в природе. Получение и свойства фосфора.
- 146. Соединения фосфора с водородом и галогенами.
- 147. Оксиды и кислоты фосфора.
- 148. Минеральные удобрения.
- 149. Мышьяк (Arsenicum).
- 150. Сурьма (Stibium).
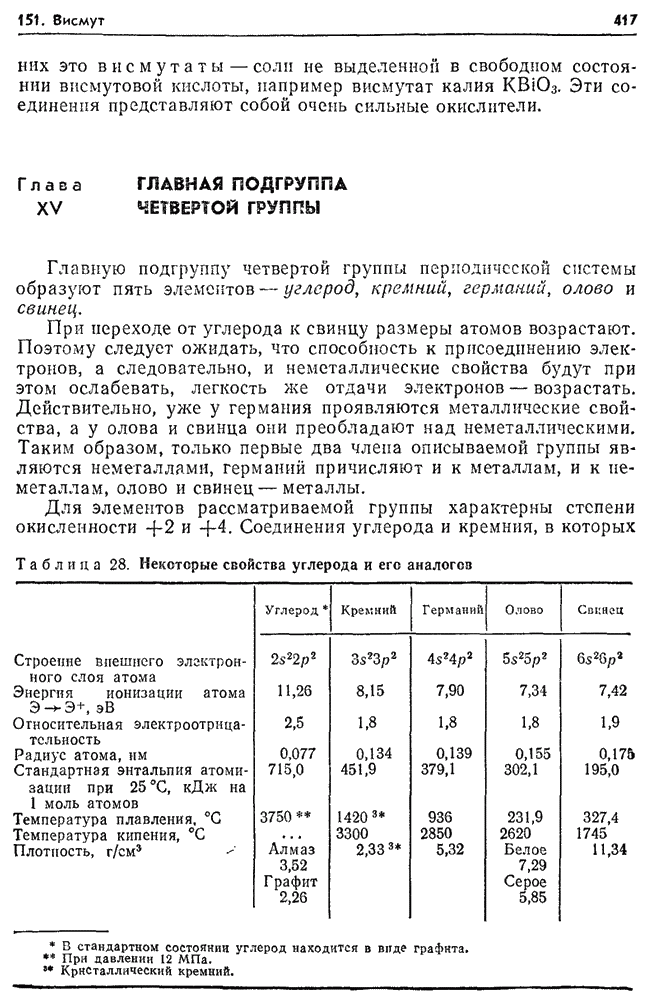
- 151. Висмут (Bismuthum).
- Глава XV. ГЛАВНАЯ ПОДГРУППА ЧЕТВЕРТОЙ ГРУППЫ
- 152. Углерод в природе.
- 153. Аллотропия углерода.
- 154. Химические свойства углерода. Карбиды.
- 155. Диоксид углерода. Угольная кислота.
- 156. Оксид углерода (II).
- 157. Соединения углерода с серой и азотом.
- 158. Топливо и его виды.
- 159. Газообразное топливо.
- 160. Общая характеристика органических соединений.
- 161. Отличительные особенности органических соединений.
- 162. Теория химического строения органических соединений.
- 163. Классификация органических соединений.
- 164. Предельные (насыщенные) углеводороды.
- 165. Непредельные (ненасыщенные) углеводороды.
- 166. Предельные циклические углеводороды.
- 167. Ароматические углеводороды.
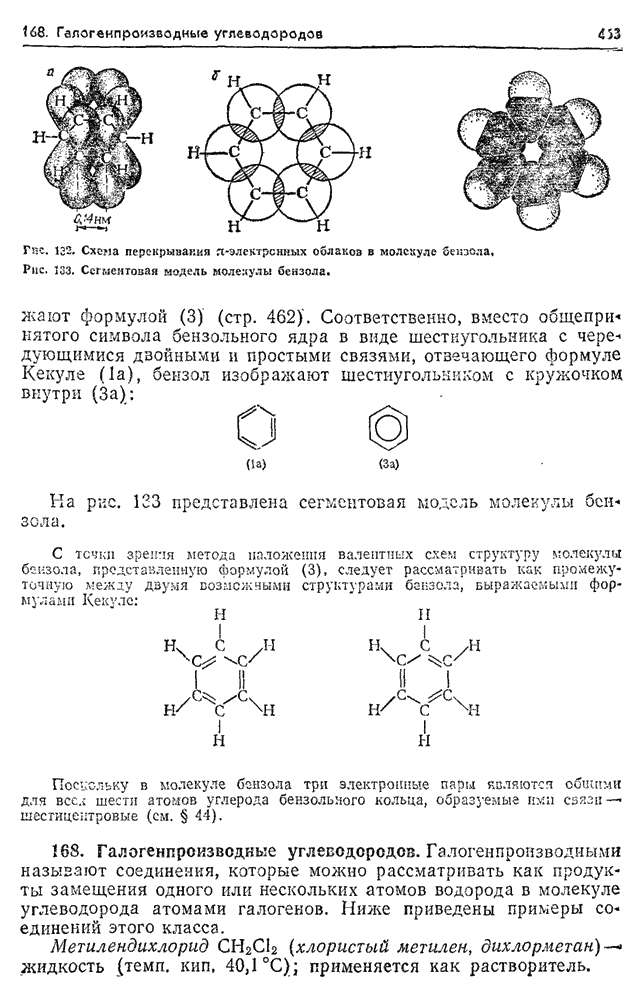
- 168. Галогенпроизводные углеводородов.
- 169. Спирты и фенолы.
- 170. Простые эфиры.
- 171. Альдегиды и кетоны.
- 172. Карбоновые кислоты.
- 173. Сложные эфиры карбоновых кислот. Жиры.
- 174. Углеводы.
- 175. Амины.
- 176. Аминокислоты и белки.
- 177. Природные и синтетические высокомолекулярные соединения (полимеры).
- 178. Кремний в природе. Получение и свойства кремния.
- 179. Соединения кремния с водородом и галогенами.
- 180. Диоксид кремния.
- 181. Кремниевые кислоты и их соли.
- 182. Стекло.
- 183. Керамика.
- 184. Цемент.
- 185. Кремнийорганические соединения.
- 186. Германий (Germanium).
- 187. Олово (Stannuin).
- 188. Свинец (Plumbum).
- 189. Свинцовый аккумулятор.
- Глава XVI. ОБЩИЕ СВОЙСТВА МЕТАЛЛОВ. СПЛАВЫ
- 190. Физические и химические свойства металлов. Электронное строение металлов, изоляторов и полупроводников.
- 191. Кристаллическое строение металлов.
- 192. Добывание металлов из руд.
- 193. Получение металлов высокой чистоты.
- 194. Сплавы.
- 195. Диаграммы состояния металлических систем.
- 196. Коррозия металлов.
- Глава XVII. ПЕРВАЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
- 197. Щелочные металлы в природе.
- 198. Натрий (Natrium).
- 199. Калий (Kalium).
- ПОДГРУППА МЕДИ
- 200. Медь. (Cuprum).
- 201. Серебро (Argentum).
- 202. Золото (Aurum).
- Глава XVIII. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
- 203. Основные положения координационной теории.
- 204. Основные типы и номенклатура комплексных соединений.
- 205. Пространственное строение и изомерия комплексных соединений.
- 206. Природа химической связи в комплексных соединениях.
- 207. Диссоциация комплексных соединений в растворах.
- 208. Влияние координации на свойства лигандов и центрального атома.
- Глава XIX. ВТОРАЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
- 209. Бериллий (Beryllium).
- 210. Магний (Magnesium).
- 211. Кальций (Calcium).
- 212. Жесткость природных вод и ее устранение.
- 213. Стронций (Strontium). Барий (Barium).
- 214. Цинк (Zincum).
- 215. Кадмий (Cadmium).
- 216. Ртуть (Hydrargyrum).
- Глава XX. ТРЕТЬЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
- 217. Бор (Borum).
- 218. Алюминий (Aluminium).
- 219. Галлий (Gallium). Иидий (Indium). Таллий (Thallium).
- ПОБОЧНАЯ ПОДГРУППА ТРЕТЬЕЙ ГРУППЫ. ЛАНТАНОИДЫ. АКТИНОИДЫ
- 220. Подгруппа скандия.
- 221. Лантаноиды.
- 222. Актиноиды.
- Глава XXI. ПОБОЧНЫЕ ПОДГРУППЫ ЧЕТВЕРТОЙ, ПЯТОЙ, ШЕСТОЙ И СЕДЬМОЙ ГРУПП
- ПОДГРУППА ТИТАНА
- 224. Титан (Titanium).
- 225. Цирконий (Zirconium). Гафний (Hafnium).
- ПОДГРУППА ВАНАДИЯ
- 226. Ванадий (Vanadium).
- 227. Ниобий (Niobium). Тантал (Tantalum).
- ПОДГРУППА ХРОМА
- 228. Хром (Chromium).
- 229. Молибден (Mollbdenium).
- 230. Вольфрам (Wolfram).
- ПОДГРУППА МАРГАНЦА
- 231. Марганец (Manganum).
- 232. Рений (Rhenium).
- Глава XXII. ВОСЬМАЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
- 233. Общая характеристика благородных газов.
- 234. Гелий (Helium).
- 235. Неон. Аргон.
- ПОБОЧНАЯ ПОДГРУППА ВОСЬМОЙ ГРУППЫ
- 236. Железо (Ferrum).
- 237. Значение железа и его сплавов в технике. Развитие металлургии в СССР.
- 238. Физические свойства железа. Диаграмма состояния системы железо — углерод.
- 239. Производство чугуна и стали.
- 240. Термическая обработка стали.
- 241. Сплавы железа.
- 242. Химические свойства железа. Соединения железа.
- 243. Кобальт (Cobaltum).
- 244. Никель (Niccolum).
- 245. Общая характеристика платиновых металлов.
- 246. Платина (Platinum).
- 247. Палладий (Palladium). Иридий (Iridium).
- ПРИЛОЖЕНИЕ
- Некоторые единицы СИ
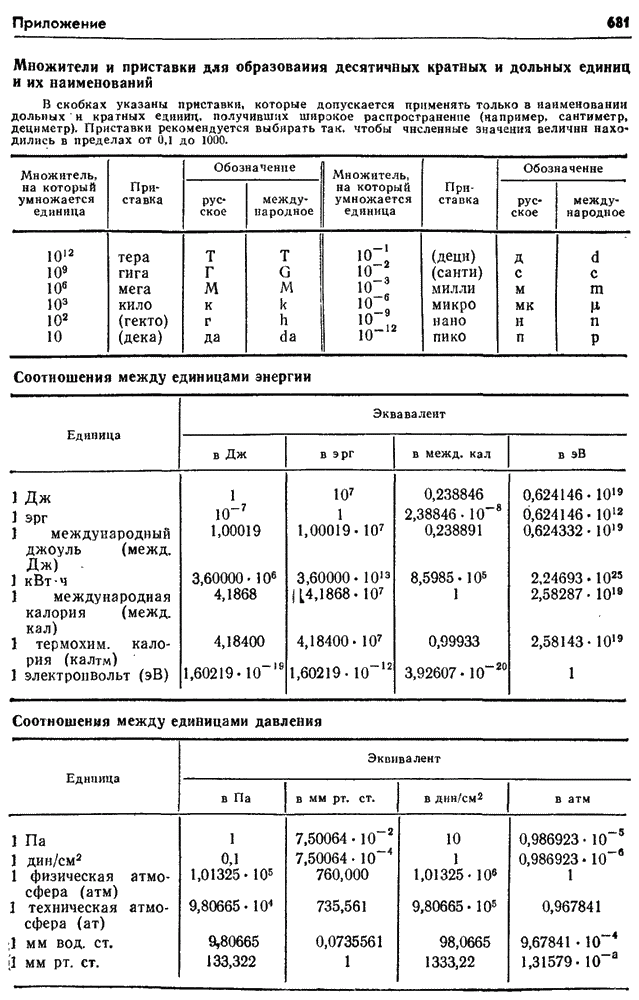
- Множители и приставки для образования десятичных кратных и дольных единиц и их наименований
- Соотношения между некоторыми внесистемными единицами и единицами СИ
- Литература для углубленного изучения общей и неорганической химии