| << Предыдущий параграф | Следующий параграф >> |
Пред.
След.
Макеты страниц
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
ДЛЯ СТУДЕНТОВ И ШКОЛЬНИКОВ ЕСТЬ
ZADANIA.TO
68. Стандартные термодинамические величины. Химико-термодинамические расчеты.
Величина изменения энергии Гиббса при реакции зависит от температуры, а также от природы и концентрации взятых и получающихся веществ. Для удобства сопоставления различных реакций принято сравнивать значения при стандартных условиях, т. е. при одинаковых концентрациях веществ (чистое состояние для индивидуальных веществ; концентрация, равная 1 моль в 1000 г растворителя, для растворов; парциальное давление, равное нормальному атмосферному давлению, для газов).
при стандартных условиях, т. е. при одинаковых концентрациях веществ (чистое состояние для индивидуальных веществ; концентрация, равная 1 моль в 1000 г растворителя, для растворов; парциальное давление, равное нормальному атмосферному давлению, для газов).
Состояние вещества, находящегося в стандартных условиях, называется стандартным состоянием.
Термодинамические величины, характеризующие вещество в его стандартном состоянии, называются стандартными величинами. Изменения термодинамических величин при реакции, в ходе которой исходные вещества в стандартном состоянии превращаются в продукты реакции, также находящиеся в стандартном состоянии, называются стандартными изменениями соответствующих величин. Стандартные величины и их изменения принято обозначать с помощью знака  . Например, стандартная энтропия обозначается символом
. Например, стандартная энтропия обозначается символом  , стандартное изменение энтальпии —
, стандартное изменение энтальпии —  , стандартное изменение энергии Гиббса -
, стандартное изменение энергии Гиббса -  .
.
Стандартное изменение энергии Гиббса реакции связано с константой равновесия реакции уравнением:

При подстановке значения  величина
величина  выразится формулой
выразится формулой

Это уравнение дает возможность, зная  , вычислять константу равновесия и, наоборот, по экспериментально найденному значению константы равновесия определять
, вычислять константу равновесия и, наоборот, по экспериментально найденному значению константы равновесия определять  реакции. Оно справедливо для любой температуры, но чаще применяется для
реакции. Оно справедливо для любой температуры, но чаще применяется для  ; эта температура принимается в качестве стандартной. Температура указывается при этом нижним индексом
; эта температура принимается в качестве стандартной. Температура указывается при этом нижним индексом

При вычислении стандартных изменений энтальпии и энергии Гиббса реакций обычно используют стандартные энтальпии и энергии Гиббса образования веществ. Эти величины представляют собой  и
и  реакций образования данного вещества из простых при стандартных условиях. При этом, если элемент образует несколько простых веществ, то берется наиболее устойчивое из них (при данных условиях). Энтальпия образования и энергия Гиббса образования наиболее устойчивых простых веществ принимаются равными нулю.
реакций образования данного вещества из простых при стандартных условиях. При этом, если элемент образует несколько простых веществ, то берется наиболее устойчивое из них (при данных условиях). Энтальпия образования и энергия Гиббса образования наиболее устойчивых простых веществ принимаются равными нулю.
Согласно закону Гесса, стандартное изменение энтальпии реакции (сокращенно: стандартная энтальпия реакции) равно сумме стандартных энтальпий образования продуктов реакции за вычетом суммы стандартных энтальпий образования исходных веществ.
Аналогично стандартное изменение энергии Гиббса реакции (сокращенно: стандартная энергия Гиббса реакции) равно сумме стандартных энергий Гиббса образования продуктов реакции за вычетом суммы стандартных энергий Гиббса образования исходных веществ. При этом все суммирования производятся с учетом числа молей участвующих в реакции веществ в соответствии с ее уравнением.
Таблица 7. Стандартная энтальпия образования и стандартная энергия Гиббса образования некоторых веществ при 298 К (25 °С)
Сокращенные обозначения агрегатного состояния веществ: г — газообразное, ж — жидкое, к — кристаллическое.

В табл. 7 приведены значения стандартных энтальпий и энергий Гиббса образования некоторых веществ при 25 °С (298 К). Более полные данные этого рода можно найти в справочниках, например, в «Кратком справочнике физико-химических величин» под редакцией А. А. Равделя и А. М. Пономаревой (издание восьмое, 1983 г.).
Пример 1. Вычислить  , тепловой эффект при 298 К и постоянном давлении и
, тепловой эффект при 298 К и постоянном давлении и  реакции:
реакции:

Вычисление  и теплового эффекта реакции. Находим в табл. 7
и теплового эффекта реакции. Находим в табл. 7  при 298 К и производим алгебраическое суммирование:
при 298 К и производим алгебраическое суммирование:

Поскольку изменение энтальпии реакции равно по величине, но обратно по знаку ее тепловому эффекту при постоянных температуре и давлении (см. стр. 189), то термохимическое уравнение ракции запишется следующим образом:

При низких температурах знак изменения энтальпии реакции может служить для ориентировочного определения возможного направления реакции. Полученное для рассматриваемой реакции отрицательное значение  указывает на возможность ее самопроизвольного протекания при достаточно низких температурах; при этом большое абсолютное значение
указывает на возможность ее самопроизвольного протекания при достаточно низких температурах; при этом большое абсолютное значение  позволяет с достаточной вероятностью предполагать, что в условиях,
позволяет с достаточной вероятностью предполагать, что в условиях,  очень сильно отличающихся от стандартных, эта реакция тоже может протекать в прямом направлении.
очень сильно отличающихся от стандартных, эта реакция тоже может протекать в прямом направлении.
Вычисление  реакции. Находим в табл.
реакции. Находим в табл.  и
и  при 298 К и производим суммирование:
при 298 К и производим суммирование:

Полученное отрицательное значение  подтверждает вывод, сделанный на основе оценки
подтверждает вывод, сделанный на основе оценки  реакции. Близость найденных значений
реакции. Близость найденных значений  и
и  связана, в частности, с тем, что при протекании рассматриваемой реакции не меняется число молекул газов (в нашем примере ни исходные вещества, ни продукты реакции не являются газами). При изменении же числа молекул Газов может существенно изменяться энтропия системы (переход в газообразное состояние сопровождается сильным возрастанием молекулярного
связана, в частности, с тем, что при протекании рассматриваемой реакции не меняется число молекул газов (в нашем примере ни исходные вещества, ни продукты реакции не являются газами). При изменении же числа молекул Газов может существенно изменяться энтропия системы (переход в газообразное состояние сопровождается сильным возрастанием молекулярного  ), вследствие чего значения
), вследствие чего значения  и
и  могут не только заметно различаться по величине, но даже иметь разные знаки (см. пример 2). Поэтому в подобных случаях знак
могут не только заметно различаться по величине, но даже иметь разные знаки (см. пример 2). Поэтому в подобных случаях знак  не может служить определенным критерием направления самопроизвольного протекания реакции.
не может служить определенным критерием направления самопроизвольного протекания реакции.
Большое абсолютное значение  , найденное для рассматриваемой реакции, позволяет с достаточной вероятностью говорить о возможности протекания этой реакции в прямом направлении не только при стандартной температуре (
, найденное для рассматриваемой реакции, позволяет с достаточной вероятностью говорить о возможности протекания этой реакции в прямом направлении не только при стандартной температуре ( ), но и при других температурах. В случае малых абсолютных значений
), но и при других температурах. В случае малых абсолютных значений  , а также для реакций, протекающих с изменением числа молекул уазов, такого заключения делать нельзя; в подобных случаях нужно знать зависимость
, а также для реакций, протекающих с изменением числа молекул уазов, такого заключения делать нельзя; в подобных случаях нужно знать зависимость  от температуры.
от температуры.
Пример 2. Вычислить  , тепловой эффект при 298 К и постоянном давлении
, тепловой эффект при 298 К и постоянном давлении  реакции:
реакции:

Вычисление  реакции. Находим в табл. 7
реакции. Находим в табл. 7  и СО
и СО  при 298 К
при 298 К  производим суммирование:
производим суммирование:

Таким образом

Полученное значение  положительно, но мало по абсолютной величине. Поэтому оно не может служить критерием направления протекания реакции даже при невысоких температурах, тем более, что в рассматриваемом случае в результате реакции изменяется число молекул газов.
положительно, но мало по абсолютной величине. Поэтому оно не может служить критерием направления протекания реакции даже при невысоких температурах, тем более, что в рассматриваемом случае в результате реакции изменяется число молекул газов.
Вычисление  реакции. Находим в табл. 7
реакции. Находим в табл. 7  и СО
и СО  при 298 К и производим суммирование:
при 298 К и производим суммирование:

Полученное значение  тоже мало по абсолютной величине, но отрицательно. Оно указывает на возможность протекания реакции в прямом направлении при стандартных условиях, по не дает оснований для выводов о ее направлении при условиях, отличающихся от стандартных.
тоже мало по абсолютной величине, но отрицательно. Оно указывает на возможность протекания реакции в прямом направлении при стандартных условиях, по не дает оснований для выводов о ее направлении при условиях, отличающихся от стандартных.
В данном примере разные знаки  и
и  объясняются возрастанием в ходе реакции числа молекул газов и связанным с этим увеличением энтропии. Именно поэтому оказывается возможным самопроизвольное протекание эндотермической реакции восстановления меди.
объясняются возрастанием в ходе реакции числа молекул газов и связанным с этим увеличением энтропии. Именно поэтому оказывается возможным самопроизвольное протекание эндотермической реакции восстановления меди.
Пример 3. Вычислить константу равновесия реакции:

Прежде всего определим  реакции. Для этого находим в табл. 7
реакции. Для этого находим в табл. 7  и
и  при 298 К и производим суммирование:
при 298 К и производим суммирование:

Теперь найденное значение  подставляем в уравнение (см. стр. 193)
подставляем в уравнение (см. стр. 193)

Получаем:

Отсюда

Большое значение найденной нами константы показывает, что при стандартной температуре равновесие

сильно смещено вправо; иначе говоря, при  хлорид аммония — устойчивое соединение.
хлорид аммония — устойчивое соединение.
| << Предыдущий параграф | Следующий параграф >> |
Оглавление
- ВВЕДЕНИЕ
- Глава I. АТОМНО-МОЛЕКУЛЯРНОЕ УЧЕНИЕ
- 4. Закон сохранения массы.
- 5. Основное содержание атомно-молекулярного учения.
- 6. Простое вещество и химический элемент.
- 7. Закон постоянства состава.
- 8. Закон объемных отношений.
- 9. Атомные и молекулярные массы. Моль.
- 10. Определение молекулярных масс веществ, находящихся в газообразном состоянии.
- 11. Парциальное давление газа.
- 12. Эквивалент. Закон эквивалентов.
- 13. Определение атомных масс. Валентность.
- 14. Химическая символика.
- 15. Важнейшие классы и номенклатура неорганических веществ.
- 16. Химические расчеты.
- Глава II ПЕРИОДИЧЕСКИЙ ЗАКОН Д. И. МЕНДЕЛЕЕВА
- 17. Периодический закон Д. И. Менделеева.
- 18. Периодическая система элементов.
- 19. Значение периодической системы.
- Глава III СТРОЕНИЕ АТОМА. РАЗВИТИЕ ПЕРИОДИЧЕСКОГО ЗАКОНА
- 20. Радиоктивность.
- 21. Ядерная модель атома.
- 22. Атомные спектры.
- 23. Квантовая теория света.
- 24. Строение электронной оболочки атома по Бору.
- 25. Исходные представления квантовой механики.
- 26. Волновая функция.
- 27. Энергетическое состояние электрона в атоме.
- 29. Орбитальное квантовое число. Формы электронных облаков.
- 30. Магнитное и спиновое квантовые числа.
- 31. Многоэлектронные атомы.
- 32. Принцип Паули. Электронная структура атомов и периодическая система элементов.
- 33. Размеры атомов и ионов.
- 34. Энергия ионизации и сродство к электрону.
- 35. Строение атомных ядер. Изотопы.
- 36. Радиоактивные элементы и их распад.
- 37. Искусственная радиоктивность. Ядерные реакции.
- Глава IV. ХИМИЧЕСКАЯ СВЯЗЬ И СТРОЕНИЕ МОЛЕКУЛ
- 38. Теория химического строения.
- 39. Ковалентная связь. Метод валентных связей.
- 40. Неполярная и полярная ковалентная связь.
- 41. Способы образования ковалентной связи.
- 42. Направленность ковалентной связи.
- 43. Гибридизация атомных электронных орбиталей.
- 44. Многоцентровые связи.
- 45. Метод молекулярных орбиталей.
- 46. Ионная связь.
- 47. Водородная связь.
- Глава V. СТРОЕНИЕ ТВЕРДОГО ТЕЛА И ЖИДКОСТИ
- 48. Межмолекулярное взаимодействие.
- 49. Кристаллическое состояние вещества.
- 50. Внутреннее строение кристаллов.
- 51. Реальные кристаллы.
- 52. Аморфное состояние вещества.
- 53. Жидкости.
- Глава VI. ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ПРОТЕКАНИЯ ХИМИЧЕСКИХ РЕАКЦИЙ
- 54. Превращения энергии при химических реакциях.
- 55. Термохимия.
- 56. Термохимические расчеты.
- 57. Скорость химической реакции.
- 59. Зависимость скорости реакции от температуры и от природы реагирующих веществ.
- 60. Катализ.
- 61. Скорость реакции в гетерогенных системах.
- 62. Цепные реакции.
- 63. Необратимые и обратимые реакции. Химическое равновесие.
- 64. Смещение химического равновесия. Принцип Ле Шателье.
- 65. Факторы, определяющие направление протекания химических реакций.
- 66. Термодинамические величины. Внутренняя энергия и энтальпия.
- 67. Термодинамические величины. Энтропия и энергия Гиббса.
- 68. Стандартные термодинамические величины. Химико-термодинамические расчеты.
- Глава VII. ВОДА, РАСТВОРЫ
- 69. Вода в природе.
- 70. Физические свойства воды.
- 71. Диаграмма состояния воды.
- 72. Химические свойства воды.
- 73. Характеристика растворов. Процесс растворения.
- 74. Способы выражения состава растворов.
- 75. Гидраты и кристаллогидраты.
- 76. Растворимость.
- 77. Пересыщенные растворы.
- 78. Осмос.
- 79. Давление пара растворов.
- 80. Замерзание и кипение растворов.
- Глава VIII. РАСТВОРЫ ЭЛЕКТРОЛИТОВ
- 81. Особенности растворов солей, кислот и оснований.
- 82. Теория электролитической диссоциации.
- 83. Процесс диссоциации.
- 84. Степень диссоциации. Сила электролитов.
- 85. Константа диссоциации.
- 86. Сильные электролиты.
- 87. Свойства кислот, оснований и солей с точки зрения теории электролитической диссоциации.
- 88. Ионно-молекулярные уравнения.
- 89. Произведение растворимости.
- 90. Диссоциация воды. Водородный показатель.
- 91. Смещение ионных равновесий.
- 92. Гидролиз солей.
- Глава IX. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ. ОСНОВЫ ЭЛЕКТРОХИМИИ
- 93. Окисленность элементов.
- 94. Окислительно-восстановительные реакции.
- 95. Составление уравнений окислительно-восстановительных реакций.
- 96. Важнейшие окислители и восстановители.
- 97. Окислительно-восстановительная двойственность.
- 98. Химические источники электрической энергии.
- 99. Электродные потенциалы.
- 100. Ряд напряжений металлов.
- 101. Электролиз.
- 102. Законы электролиза.
- 103. Электролиз в промышленности.
- 104. Электрохимическая поляризация.
- Глава X. ДИСПЕРСНЫЕ СИСТЕМЫ. КОЛЛОИДЫ
- 105. Дисперсное состояние вещества.
- 106. Состояние вещества на границе раздела фаз.
- 107. Коллоиды и коллоидные растворы.
- 108. Дисперсионный анализ.
- 109. Сорбция и сорбционные процессы.
- 110. Ионообменная адсорбция.
- 111. Хроматография.
- 112. Электрокинетические явления.
- 113. Устойчивость и коагуляция дисперсных систем.
- 114. Структурообразование в дисперсных системах.
- Глава XI. ВОДОРОД
- 115. Водород в природе. Получение водорода.
- 116. Свойства и применение водорода.
- 117. Пероксид водорода
- Глава XII. ГАЛОГЕНЫ
- 118. Галогены в природе. Физические свойства галогенов.
- 119. Химические свойства галогенов.
- 120. Получение и применение галогенов.
- 121. Соединения галогенов с водородом.
- 122. Кислородсодержащие соединения галогенов.
- Глава XIII. ГЛАВНАЯ ПОДГРУППА ШЕСТОЙ ГРУППЫ
- 123. Кислород в природе. Воздух.
- 124. Получение и свойства кислорода.
- 125. Озон.
- 126. Сера в природе. Получение серы.
- 127. Свойства и применение серы.
- 128. Сероводород. Сульфиды.
- 129. Диоксид серы. Сернистая кислота.
- 130. Триоксид серы. Серная кислота.
- 131. Получение и применение серной кислоты.
- 132. Пероксодвусерная кислота.
- 133. Тиосерная кислота.
- 134. Соединения серы с галогенами.
- 135. Селен (Selenium). Теллур (Tellurium).
- Глава XIV. ГЛАВНАЯ ПОДГРУППА ПЯТОЙ ГРУППЫ
- 136. Азот в природе. Получение и свойства азота.
- 137. Аммиак. Соли аммония.
- 138. Фиксация атмосферного азота. Получение аммиака.
- 139. Гидразин. Гидроксиламин. Азидоводород.
- 140. Оксиды азота.
- 141. Азотистая кислота.
- 142. Азотная кислота.
- 143. Промышленное получение азотной кислоты.
- 144. Круговорот азота в природе.
- 145. Фосфор в природе. Получение и свойства фосфора.
- 146. Соединения фосфора с водородом и галогенами.
- 147. Оксиды и кислоты фосфора.
- 148. Минеральные удобрения.
- 149. Мышьяк (Arsenicum).
- 150. Сурьма (Stibium).
- 151. Висмут (Bismuthum).
- Глава XV. ГЛАВНАЯ ПОДГРУППА ЧЕТВЕРТОЙ ГРУППЫ
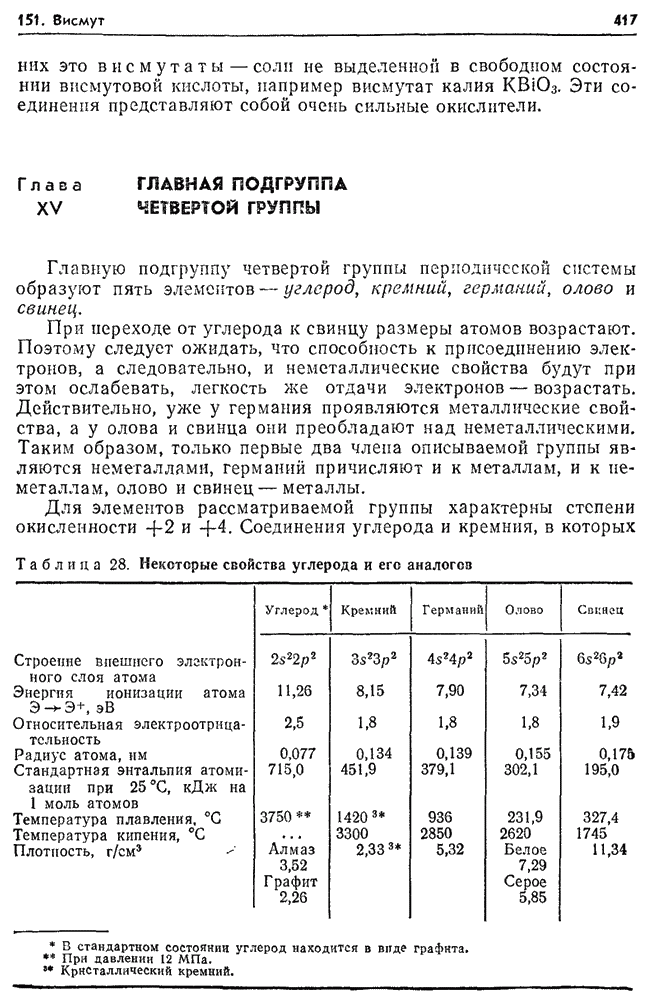
- 152. Углерод в природе.
- 153. Аллотропия углерода.
- 154. Химические свойства углерода. Карбиды.
- 155. Диоксид углерода. Угольная кислота.
- 156. Оксид углерода (II).
- 157. Соединения углерода с серой и азотом.
- 158. Топливо и его виды.
- 159. Газообразное топливо.
- 160. Общая характеристика органических соединений.
- 161. Отличительные особенности органических соединений.
- 162. Теория химического строения органических соединений.
- 163. Классификация органических соединений.
- 164. Предельные (насыщенные) углеводороды.
- 165. Непредельные (ненасыщенные) углеводороды.
- 166. Предельные циклические углеводороды.
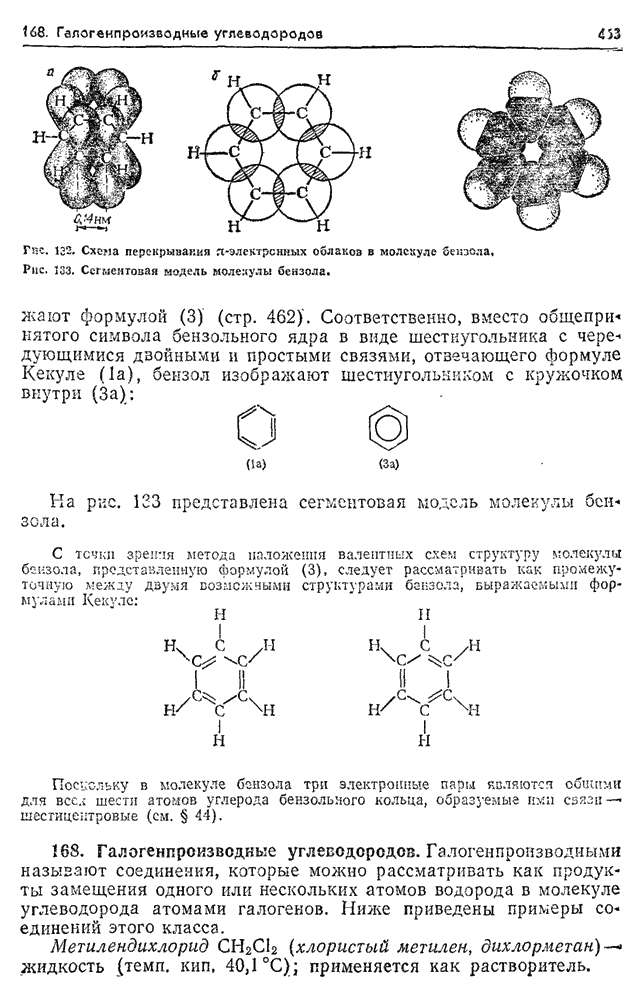
- 167. Ароматические углеводороды.
- 168. Галогенпроизводные углеводородов.
- 169. Спирты и фенолы.
- 170. Простые эфиры.
- 171. Альдегиды и кетоны.
- 172. Карбоновые кислоты.
- 173. Сложные эфиры карбоновых кислот. Жиры.
- 174. Углеводы.
- 175. Амины.
- 176. Аминокислоты и белки.
- 177. Природные и синтетические высокомолекулярные соединения (полимеры).
- 178. Кремний в природе. Получение и свойства кремния.
- 179. Соединения кремния с водородом и галогенами.
- 180. Диоксид кремния.
- 181. Кремниевые кислоты и их соли.
- 182. Стекло.
- 183. Керамика.
- 184. Цемент.
- 185. Кремнийорганические соединения.
- 186. Германий (Germanium).
- 187. Олово (Stannuin).
- 188. Свинец (Plumbum).
- 189. Свинцовый аккумулятор.
- Глава XVI. ОБЩИЕ СВОЙСТВА МЕТАЛЛОВ. СПЛАВЫ
- 190. Физические и химические свойства металлов. Электронное строение металлов, изоляторов и полупроводников.
- 191. Кристаллическое строение металлов.
- 192. Добывание металлов из руд.
- 193. Получение металлов высокой чистоты.
- 194. Сплавы.
- 195. Диаграммы состояния металлических систем.
- 196. Коррозия металлов.
- Глава XVII. ПЕРВАЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
- 197. Щелочные металлы в природе.
- 198. Натрий (Natrium).
- 199. Калий (Kalium).
- ПОДГРУППА МЕДИ
- 200. Медь. (Cuprum).
- 201. Серебро (Argentum).
- 202. Золото (Aurum).
- Глава XVIII. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
- 203. Основные положения координационной теории.
- 204. Основные типы и номенклатура комплексных соединений.
- 205. Пространственное строение и изомерия комплексных соединений.
- 206. Природа химической связи в комплексных соединениях.
- 207. Диссоциация комплексных соединений в растворах.
- 208. Влияние координации на свойства лигандов и центрального атома.
- Глава XIX. ВТОРАЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
- 209. Бериллий (Beryllium).
- 210. Магний (Magnesium).
- 211. Кальций (Calcium).
- 212. Жесткость природных вод и ее устранение.
- 213. Стронций (Strontium). Барий (Barium).
- 214. Цинк (Zincum).
- 215. Кадмий (Cadmium).
- 216. Ртуть (Hydrargyrum).
- Глава XX. ТРЕТЬЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
- 217. Бор (Borum).
- 218. Алюминий (Aluminium).
- 219. Галлий (Gallium). Иидий (Indium). Таллий (Thallium).
- ПОБОЧНАЯ ПОДГРУППА ТРЕТЬЕЙ ГРУППЫ. ЛАНТАНОИДЫ. АКТИНОИДЫ
- 220. Подгруппа скандия.
- 221. Лантаноиды.
- 222. Актиноиды.
- Глава XXI. ПОБОЧНЫЕ ПОДГРУППЫ ЧЕТВЕРТОЙ, ПЯТОЙ, ШЕСТОЙ И СЕДЬМОЙ ГРУПП
- ПОДГРУППА ТИТАНА
- 224. Титан (Titanium).
- 225. Цирконий (Zirconium). Гафний (Hafnium).
- ПОДГРУППА ВАНАДИЯ
- 226. Ванадий (Vanadium).
- 227. Ниобий (Niobium). Тантал (Tantalum).
- ПОДГРУППА ХРОМА
- 228. Хром (Chromium).
- 229. Молибден (Mollbdenium).
- 230. Вольфрам (Wolfram).
- ПОДГРУППА МАРГАНЦА
- 231. Марганец (Manganum).
- 232. Рений (Rhenium).
- Глава XXII. ВОСЬМАЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
- 233. Общая характеристика благородных газов.
- 234. Гелий (Helium).
- 235. Неон. Аргон.
- ПОБОЧНАЯ ПОДГРУППА ВОСЬМОЙ ГРУППЫ
- 236. Железо (Ferrum).
- 237. Значение железа и его сплавов в технике. Развитие металлургии в СССР.
- 238. Физические свойства железа. Диаграмма состояния системы железо — углерод.
- 239. Производство чугуна и стали.
- 240. Термическая обработка стали.
- 241. Сплавы железа.
- 242. Химические свойства железа. Соединения железа.
- 243. Кобальт (Cobaltum).
- 244. Никель (Niccolum).
- 245. Общая характеристика платиновых металлов.
- 246. Платина (Platinum).
- 247. Палладий (Palladium). Иридий (Iridium).
- ПРИЛОЖЕНИЕ
- Некоторые единицы СИ
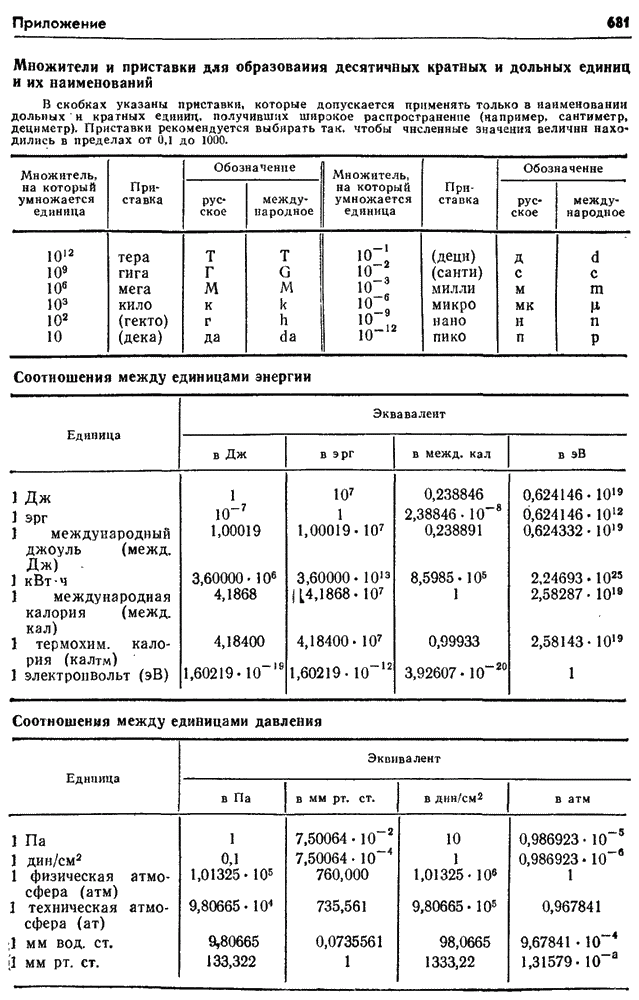
- Множители и приставки для образования десятичных кратных и дольных единиц и их наименований
- Соотношения между некоторыми внесистемными единицами и единицами СИ
- Литература для углубленного изучения общей и неорганической химии