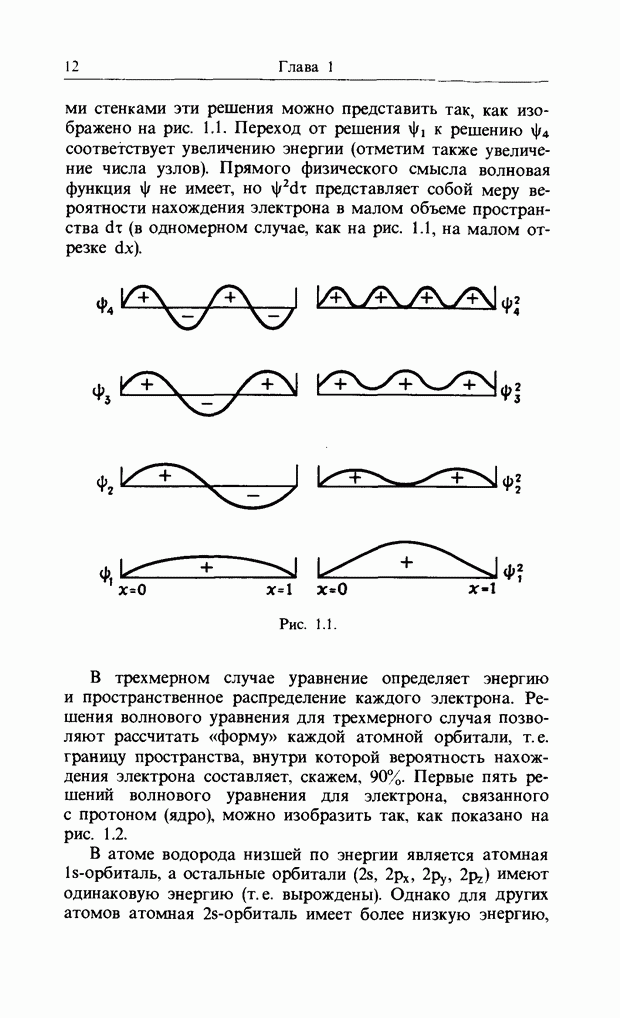
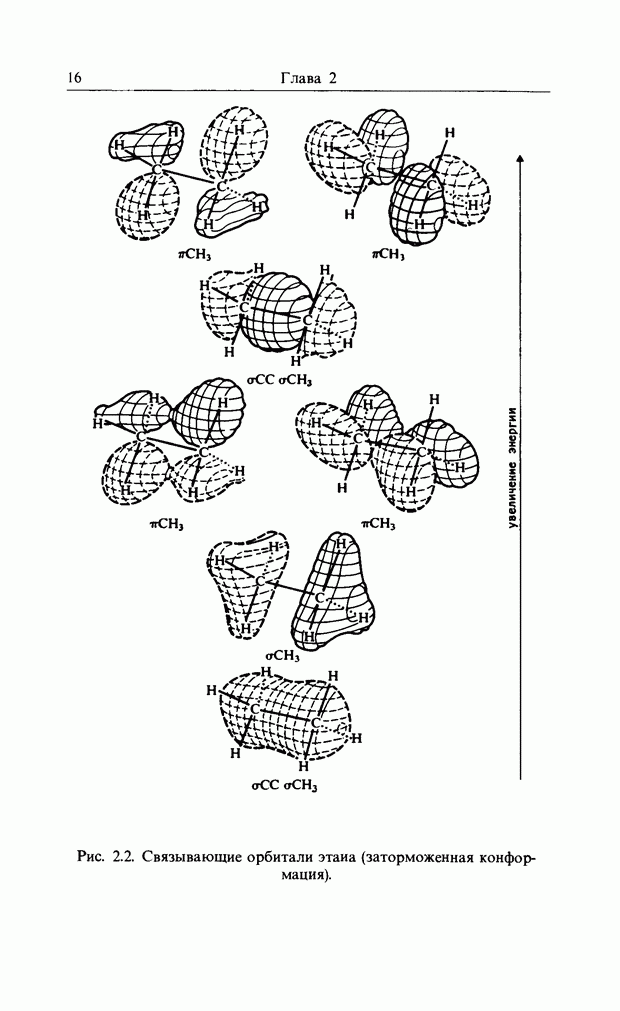
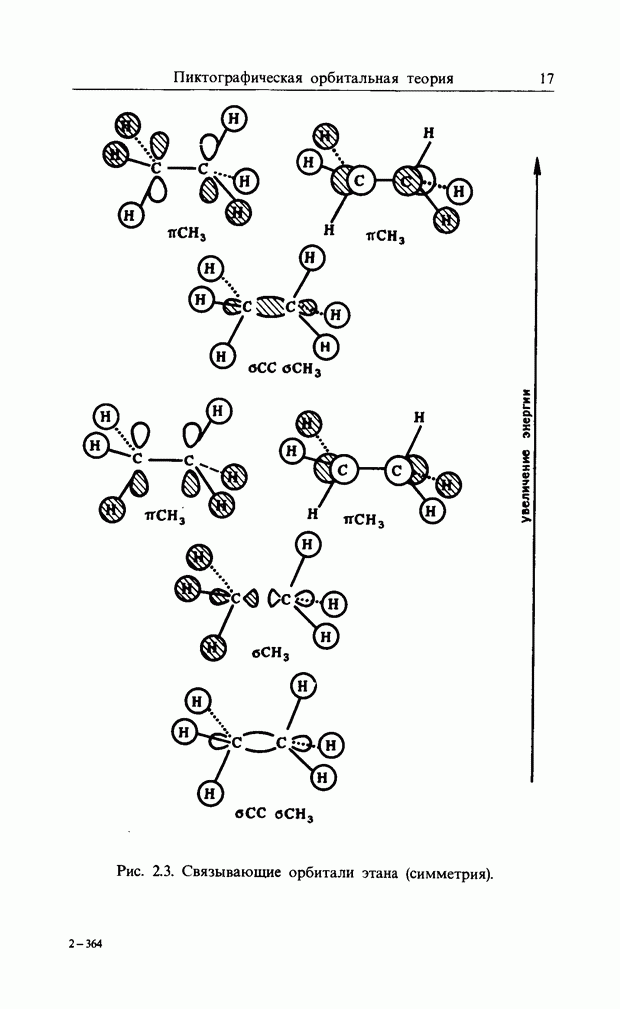
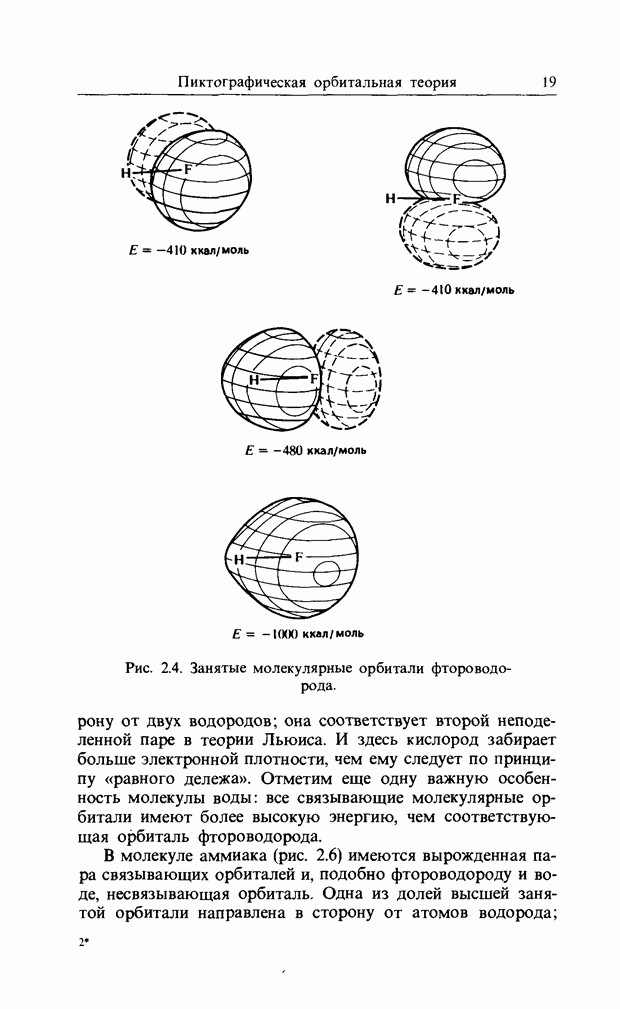
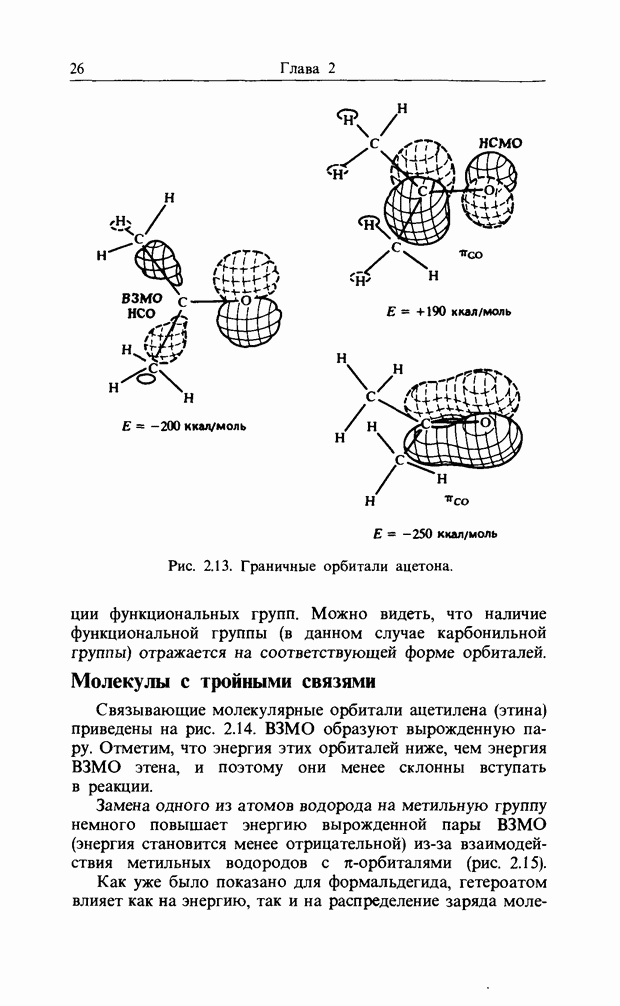
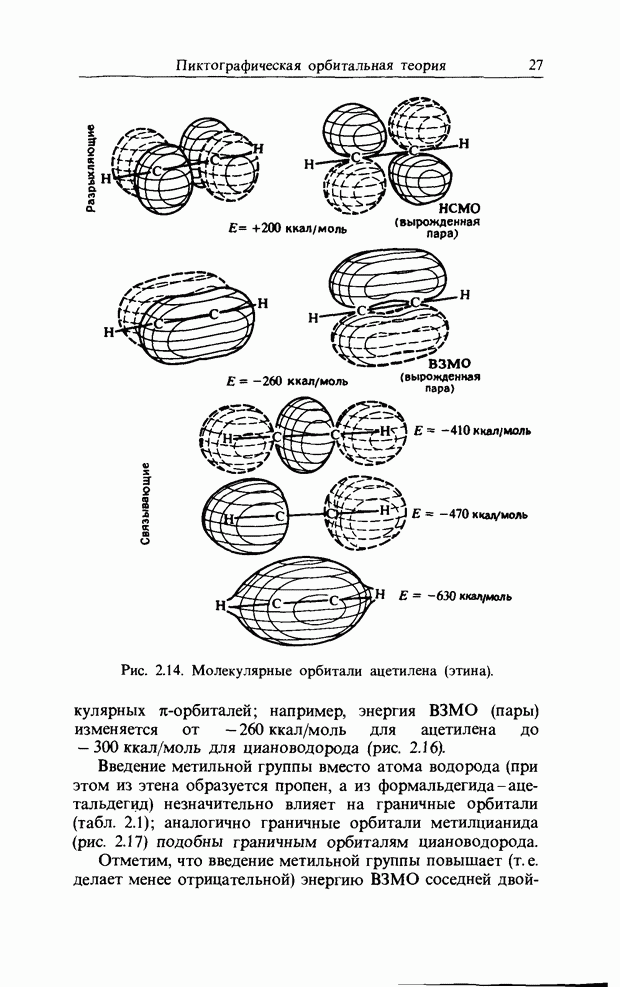
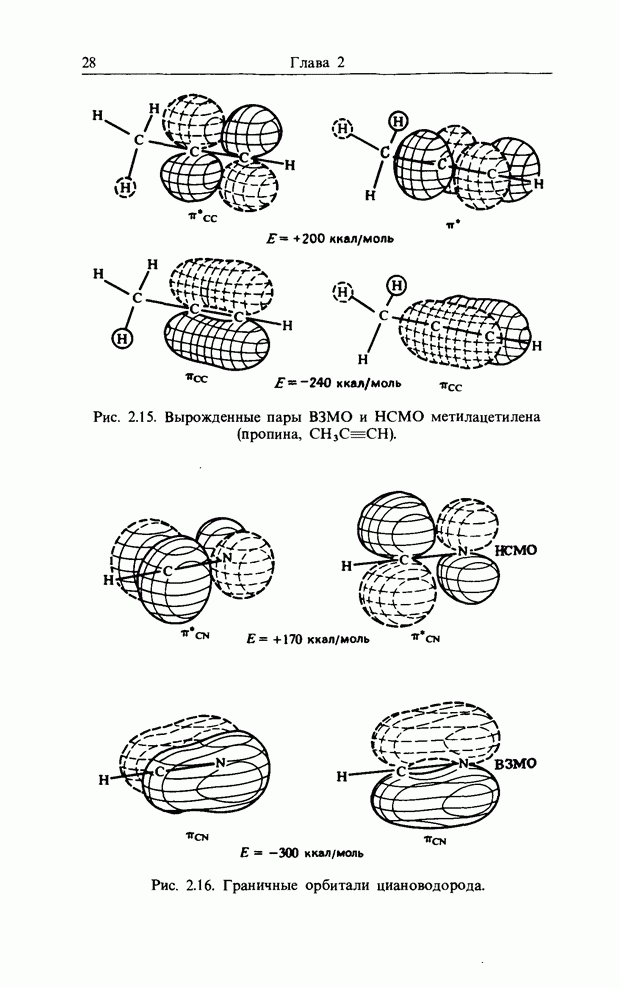
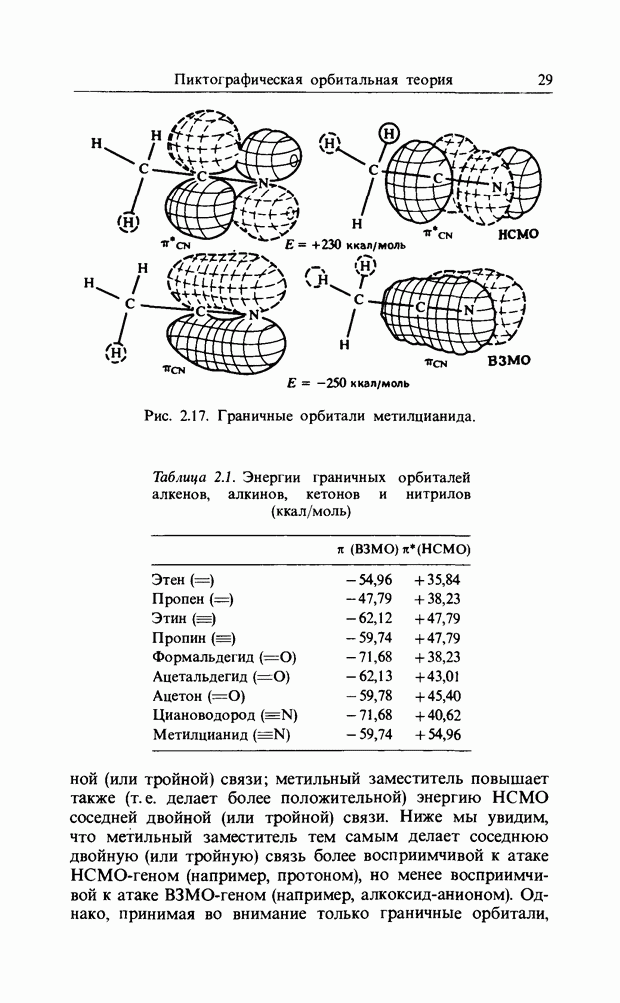
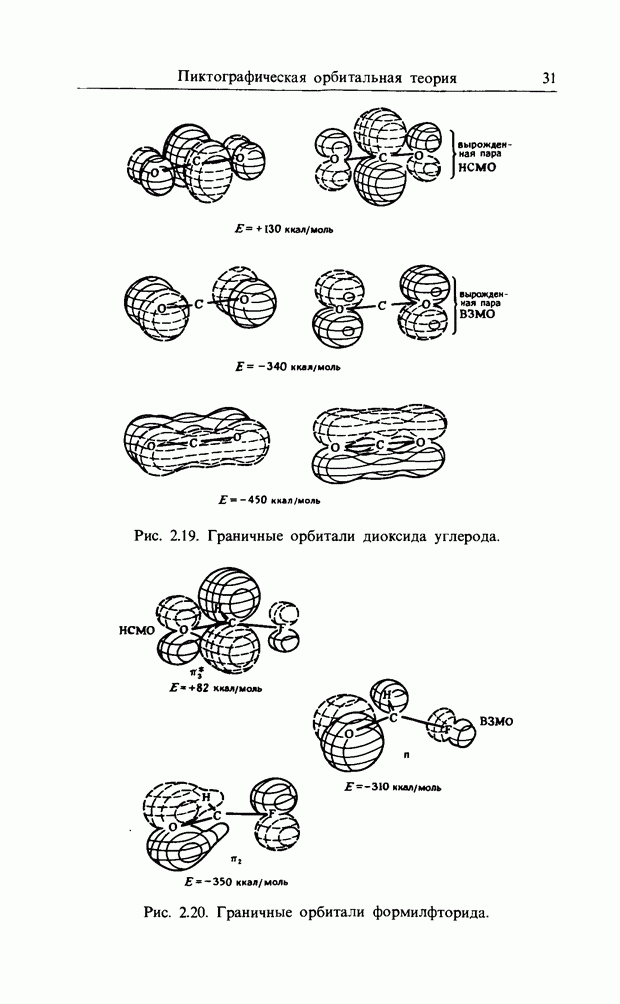
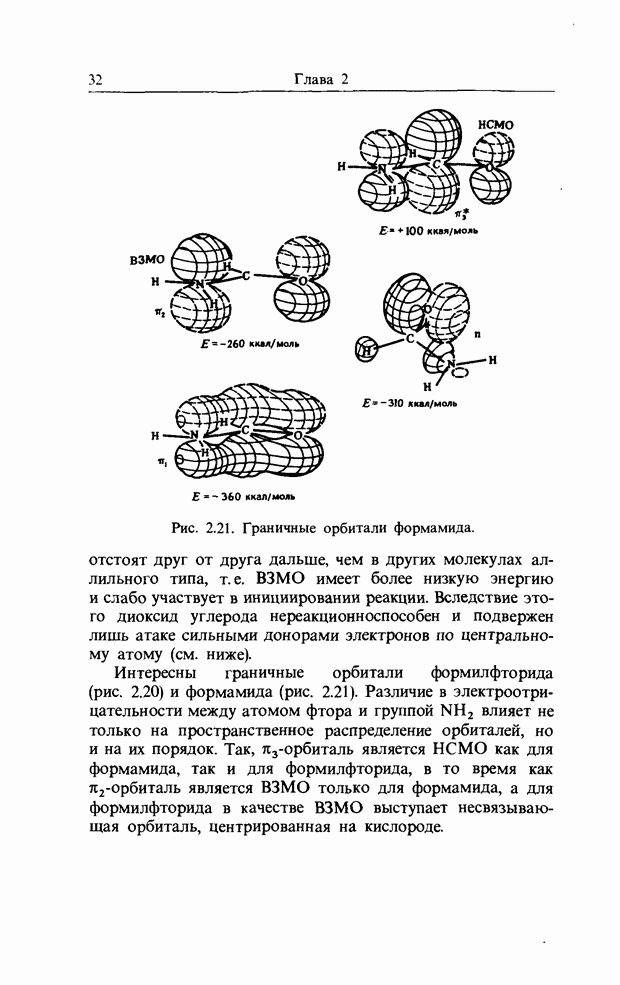
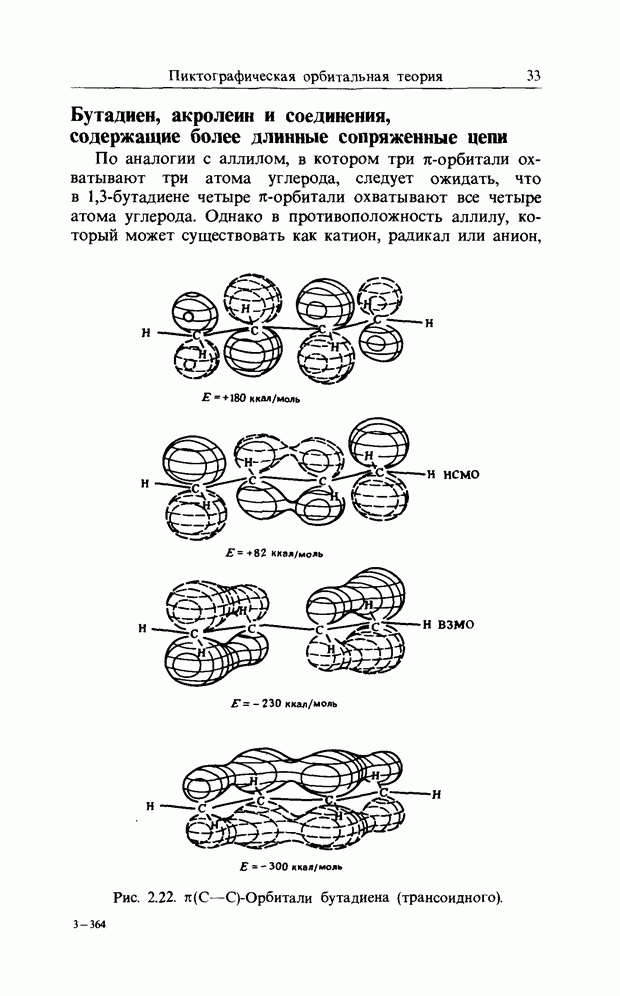
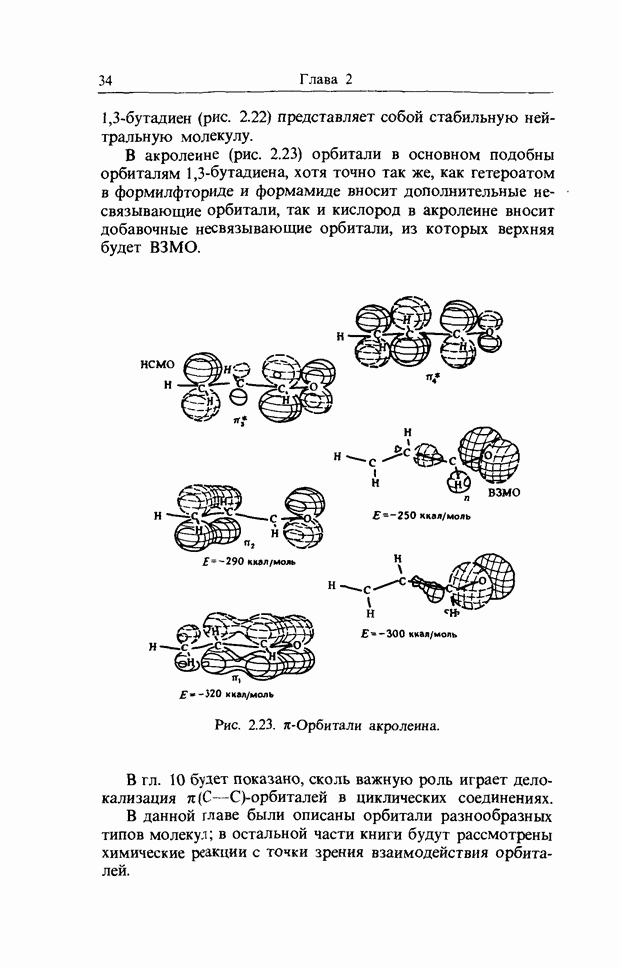
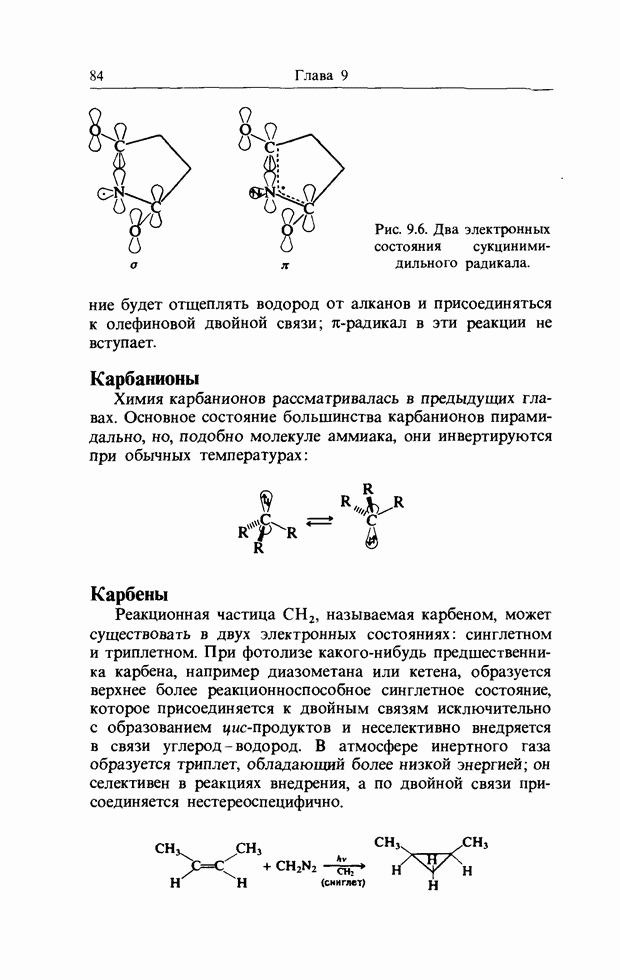
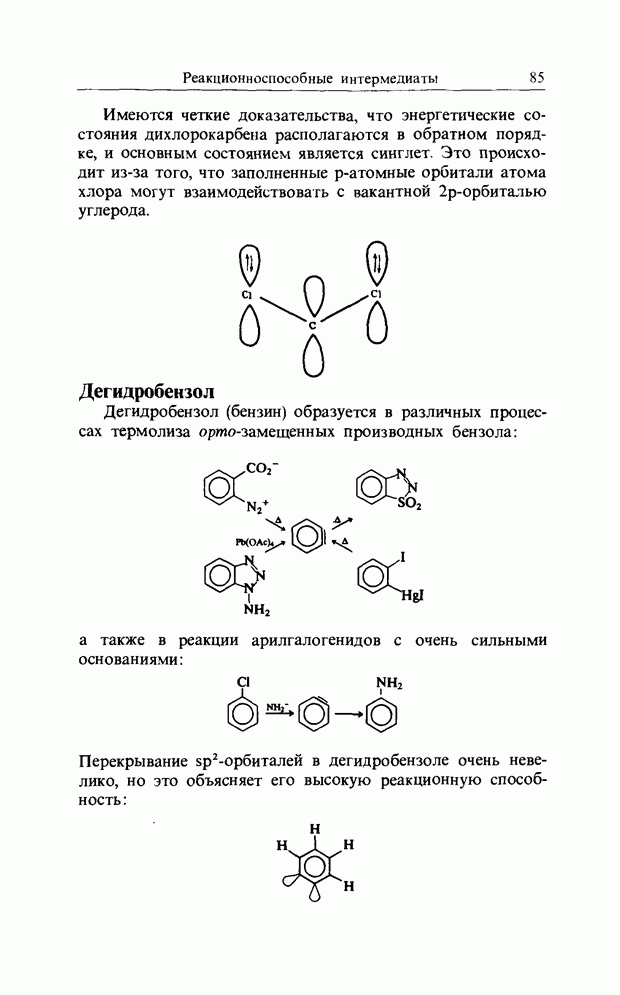
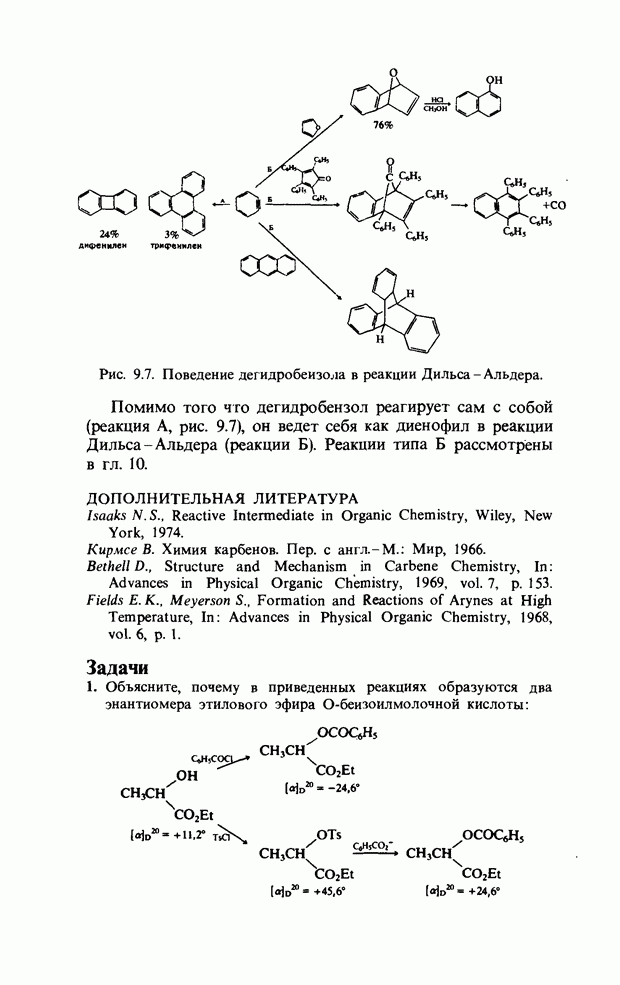
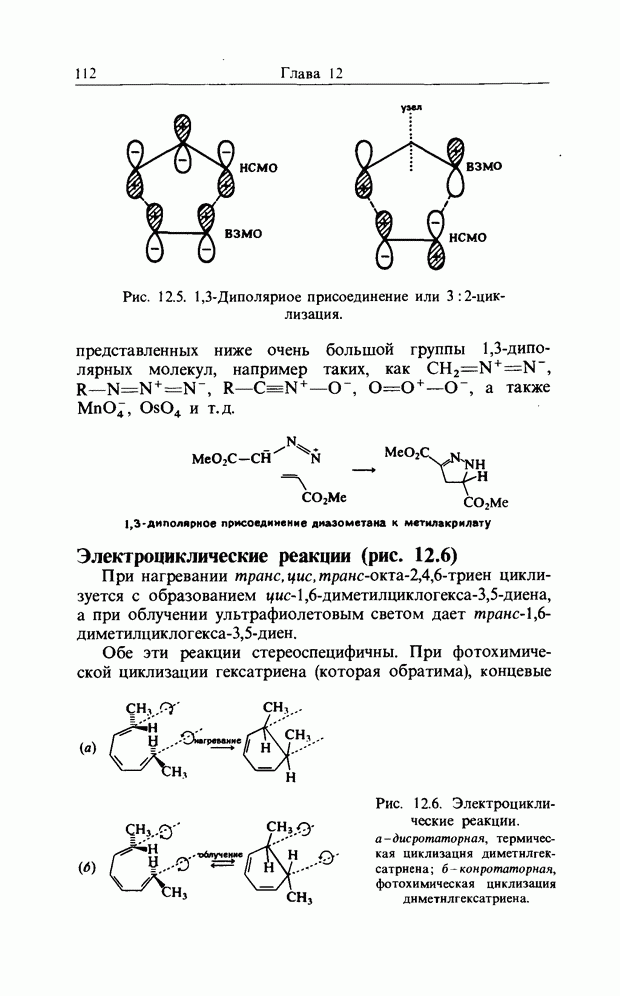
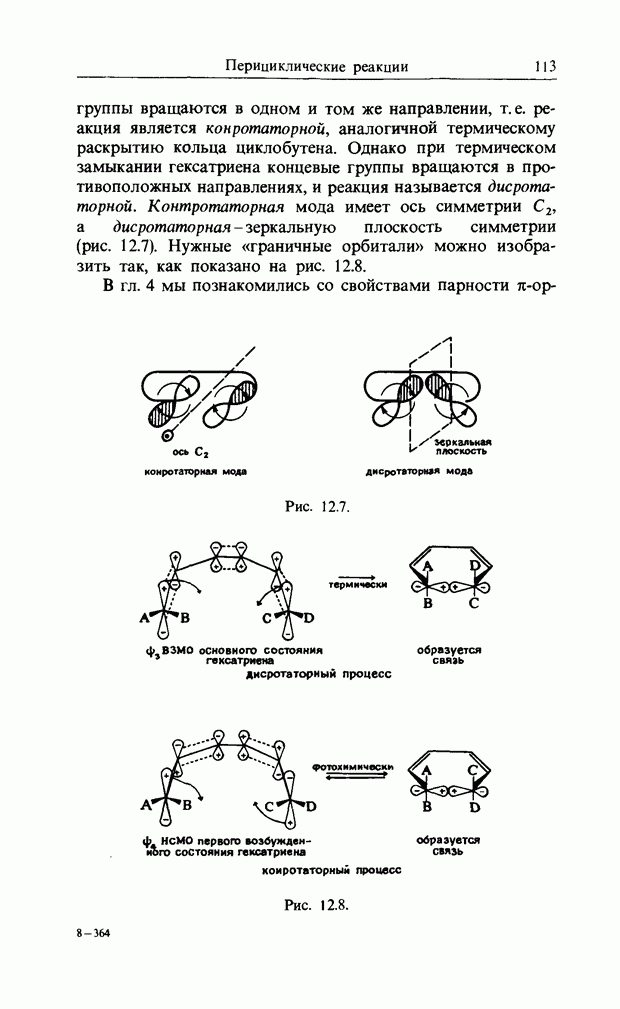
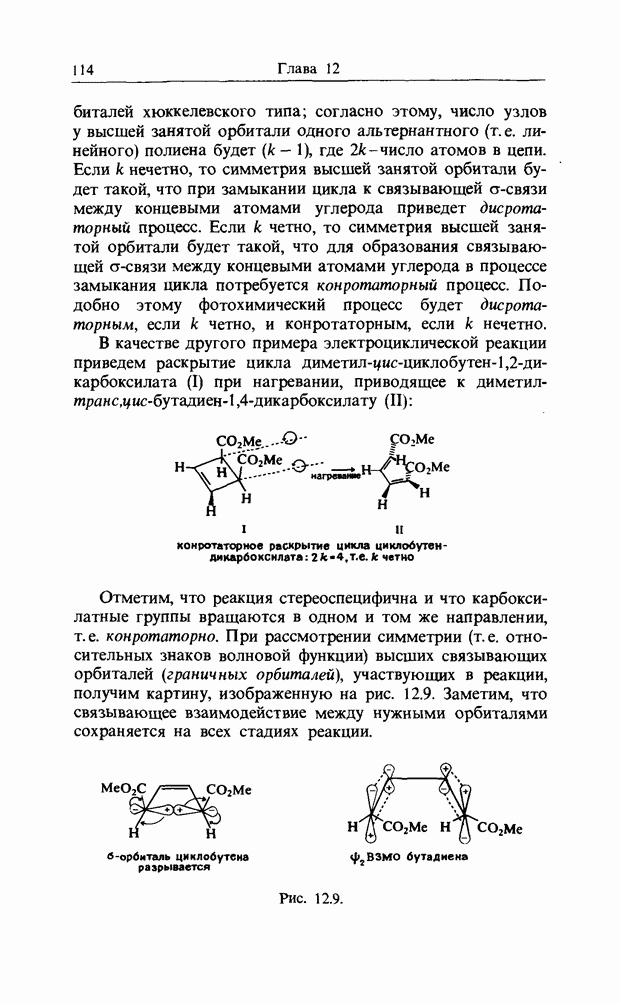
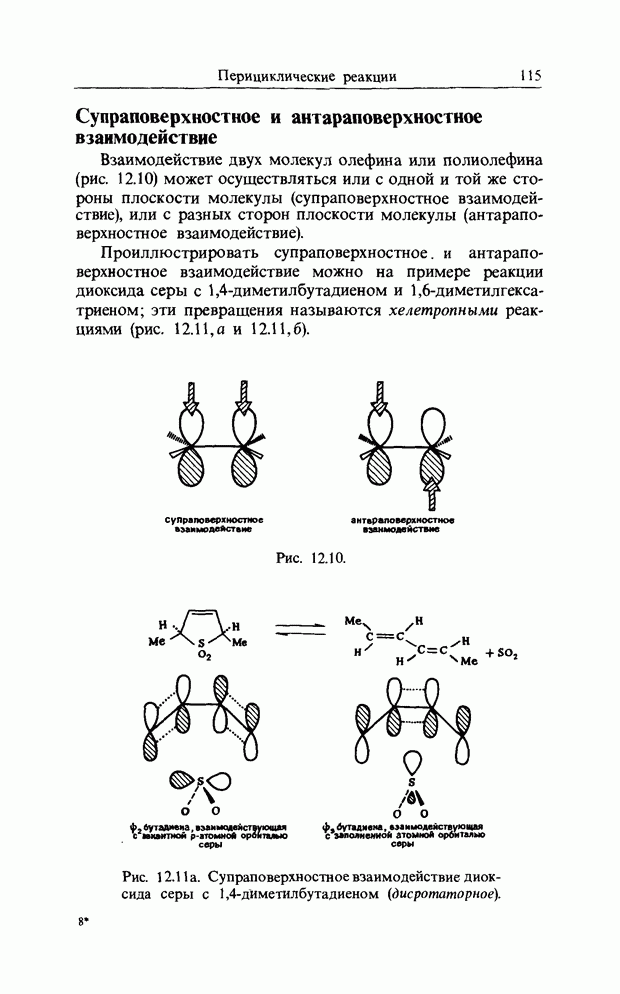
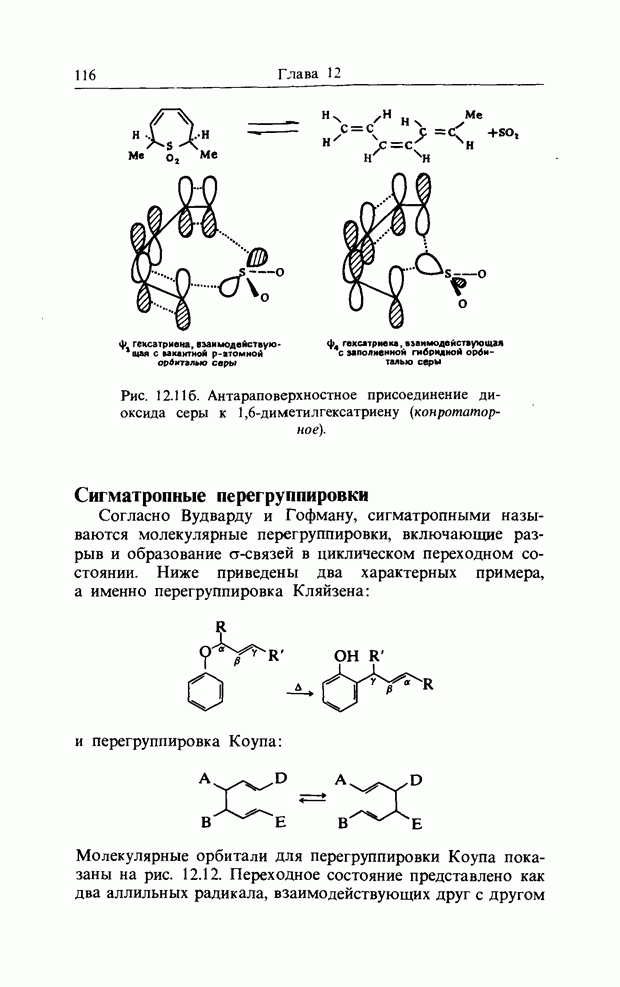
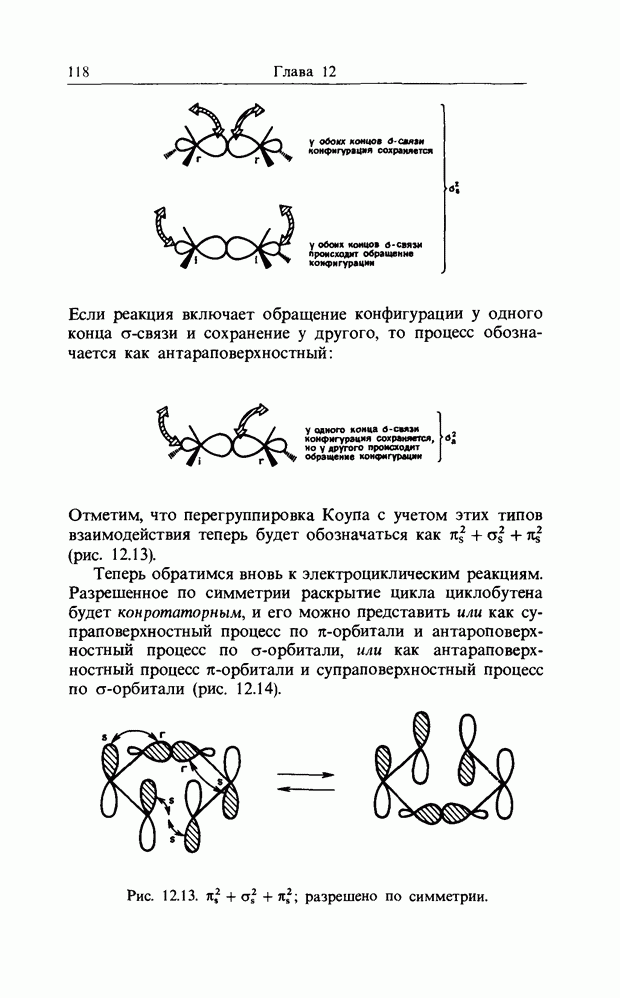
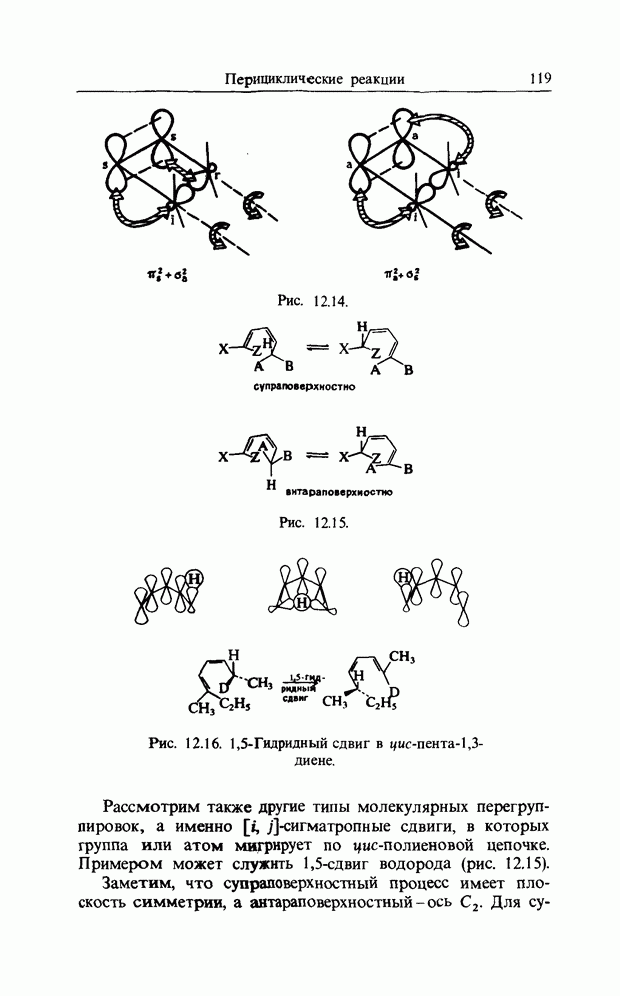
| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
11. РЕАКЦИИ БЕНЗОИДНЫХ СОЕДИНЕНИЙ
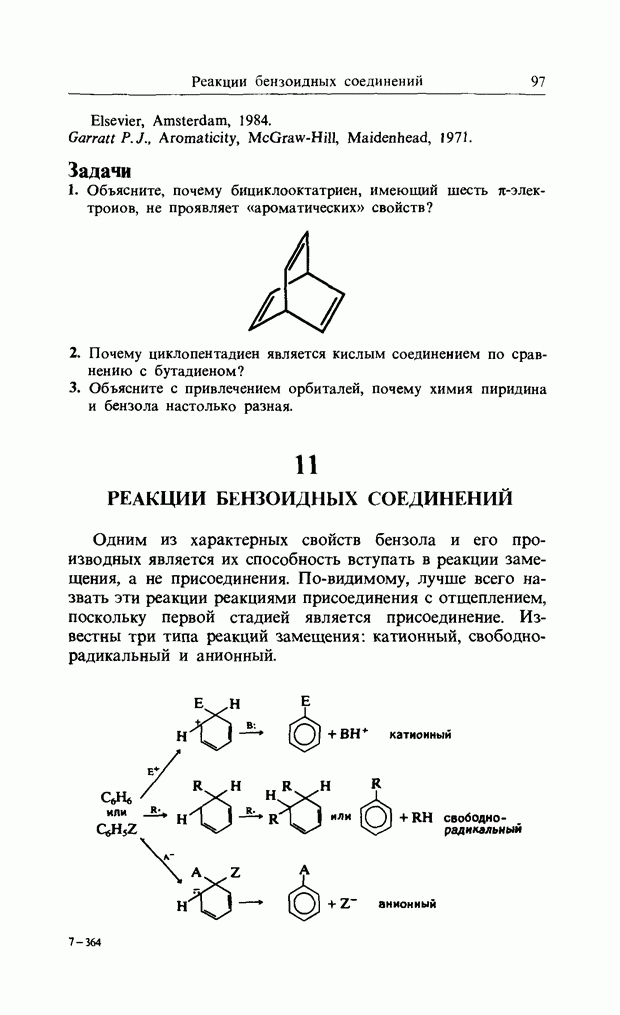
Одним из характерных свойств бензола и его производных является их способность вступать в реакции замещения, а не присоединения. По-видимому, лучше всего назвать эти реакции реакциями присоединения с отщеплением, поскольку первой стадией является присоединение. Известны три типа реакций замещения: катионный, свободно-радикальный и анионный.

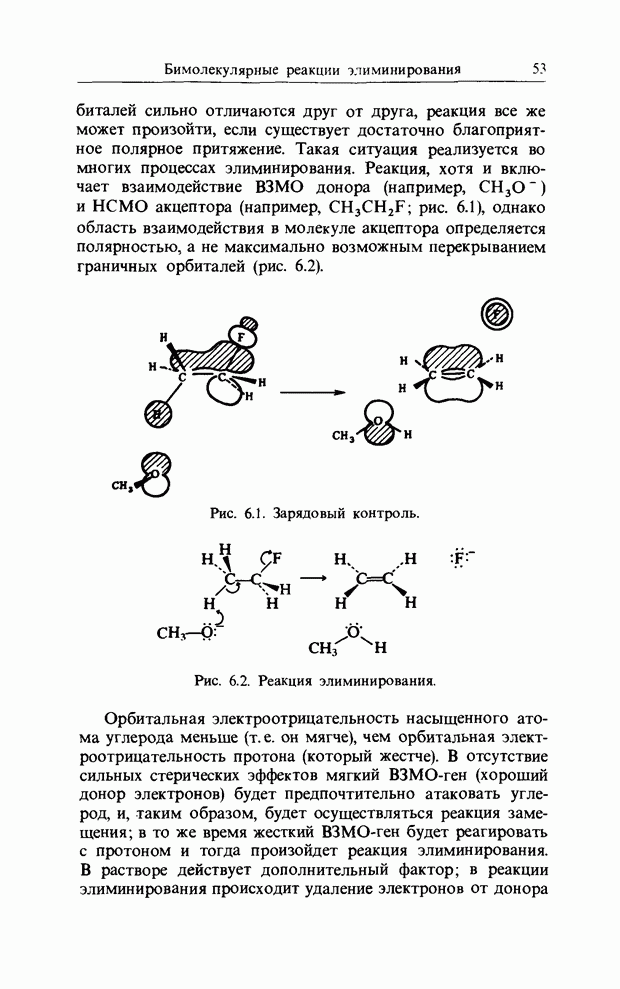
Наиболее важными из этих реакций присоединения с отщеплением являются катионные, в которых ароматическое соединение ведет себя как НСМО-ген.
Катионное замещение в ароматических соединениях
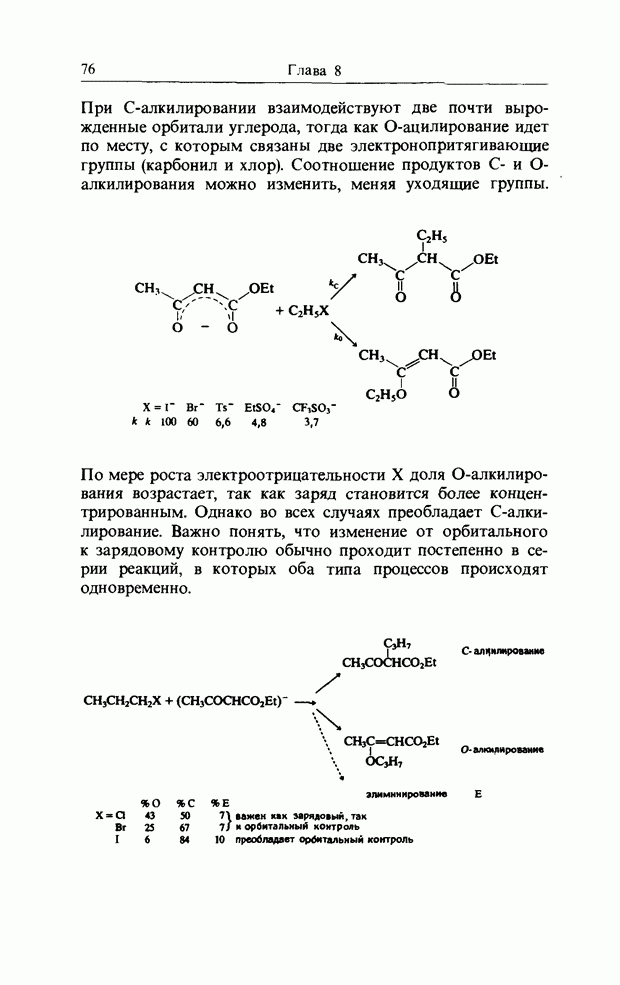
Нитрование ароматических соединений происходит при атаке ионом нитрония. Реакционная способность очень сильно зависит от природы субстрата (табл. 11.1).

Приведенные ниже данные по относительным скоростям представляют собой не более чем разумные оценки, поскольку нитробензол, например, нитруют в концентрированной серной кислоте, а анизол - в уксусном ангидриде, так что прямое сравнение нельзя провести.
Аналогичные данные получены для хлорирования тех же самых соединений.
Таблица 11.1. Ориентация и приблизительные относительные скорости нитрования монозамещенных бензолов 

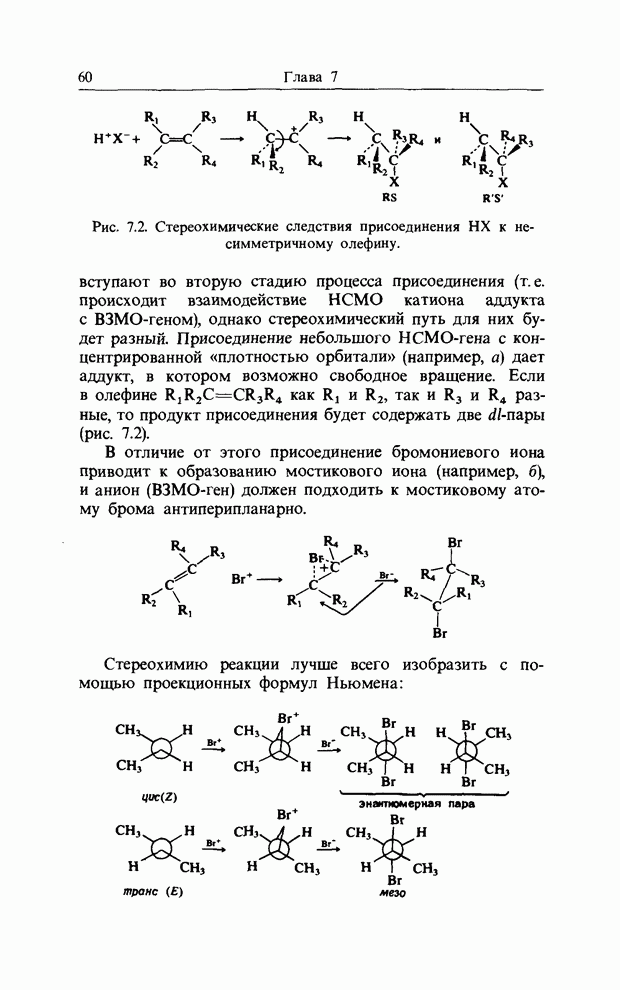
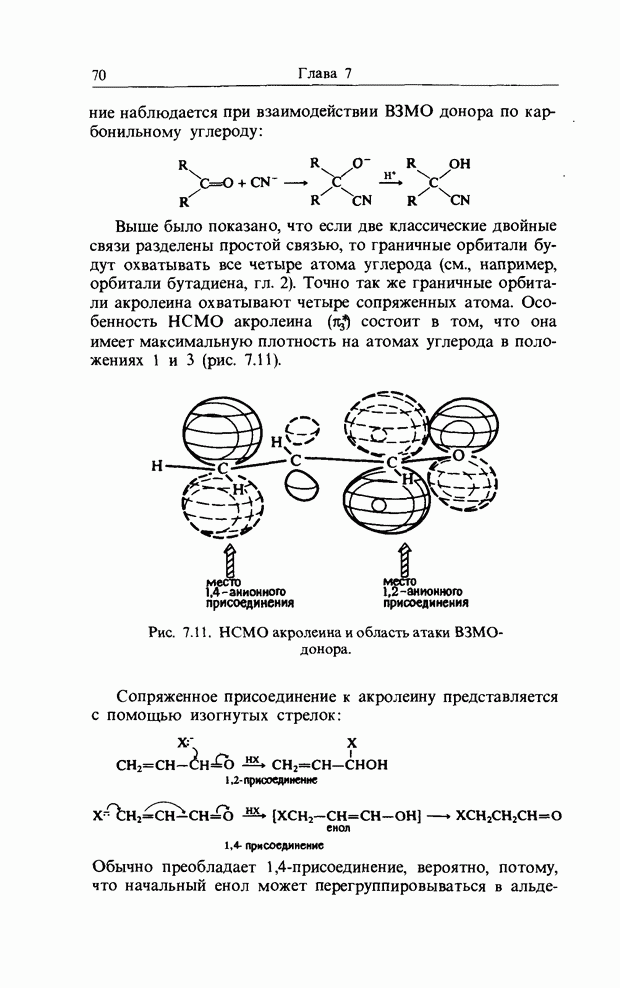
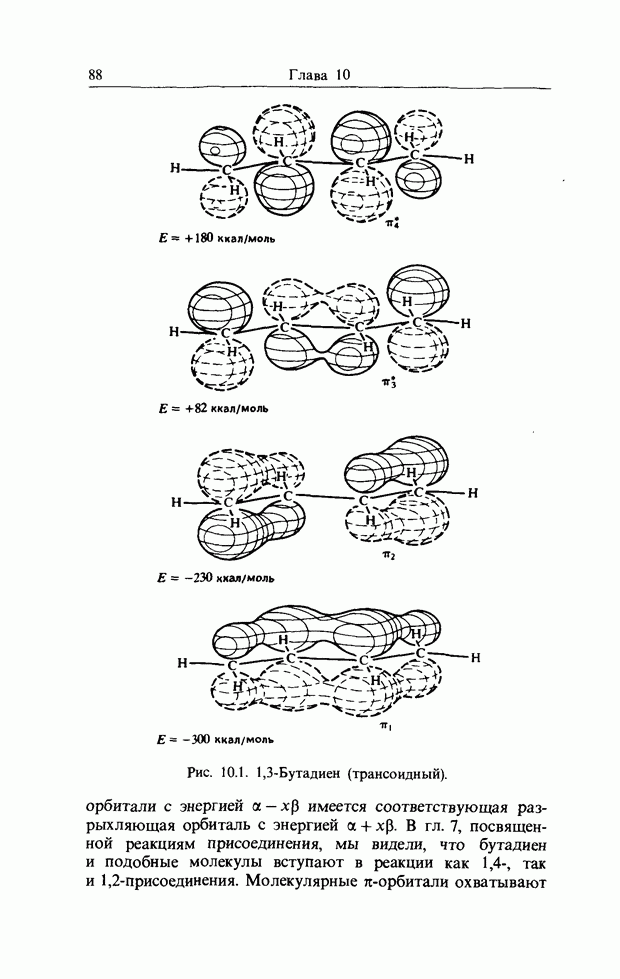
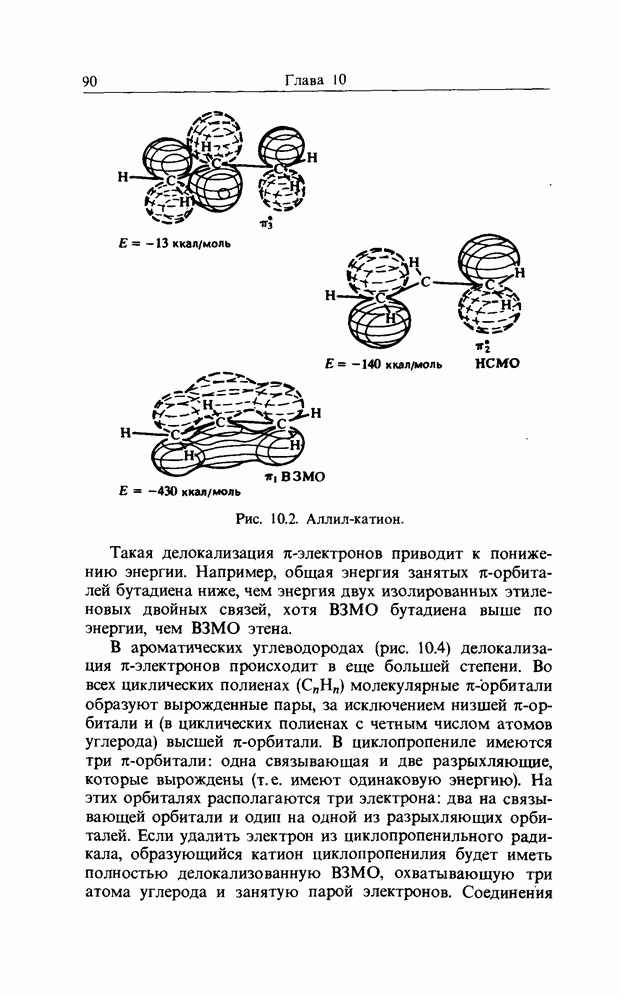
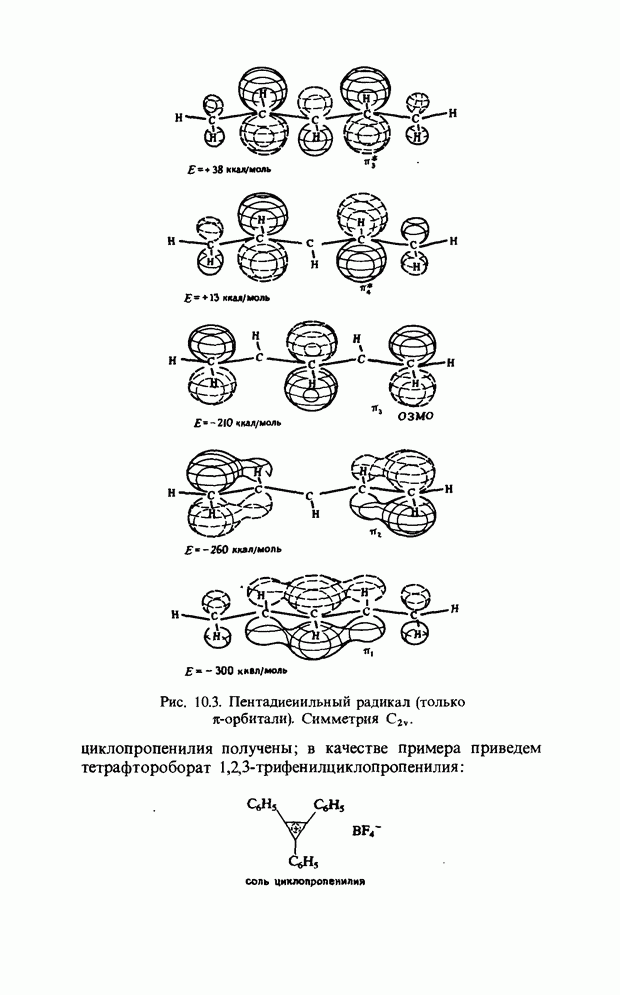
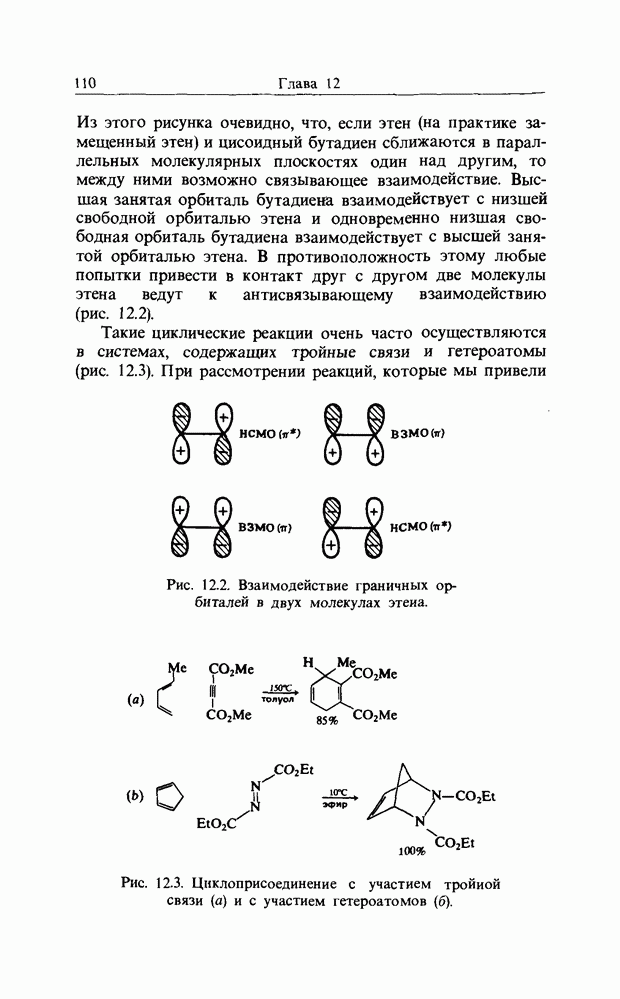
Точно так же как  -орбитали сопряженных двойных связей в линейных полиенах образуют пары
-орбитали сопряженных двойных связей в линейных полиенах образуют пары  из одной связывающей и одной разрыхляющей орбиталей, так и
из одной связывающей и одной разрыхляющей орбиталей, так и  -орбитали молекулы бензола можно рассматривать парами. Мы видели, что в линейном сопряженном ионе или радикале с нечетным числом атомов в сопряженной цепи, например
-орбитали молекулы бензола можно рассматривать парами. Мы видели, что в линейном сопряженном ионе или радикале с нечетным числом атомов в сопряженной цепи, например
в пентадиенильном радикале, имеется несвязывающая орбиталь (а) (гл. 10). Такие же аргументы применимы к бен-зильному радикалу, несвязывающую орбиталь которого можно представить следующим образом:

Если к бензильному радикалу добавить электрон, эта орбиталь будет В3МО (НСО) и общий отрицательный заряд будет находиться в двух орто-положениях, в пара-положении и, естественно, на экзоциклическом атоме углерода:

распределение заряда в бензил-анионе, рассчитанное по методу Хюккеля
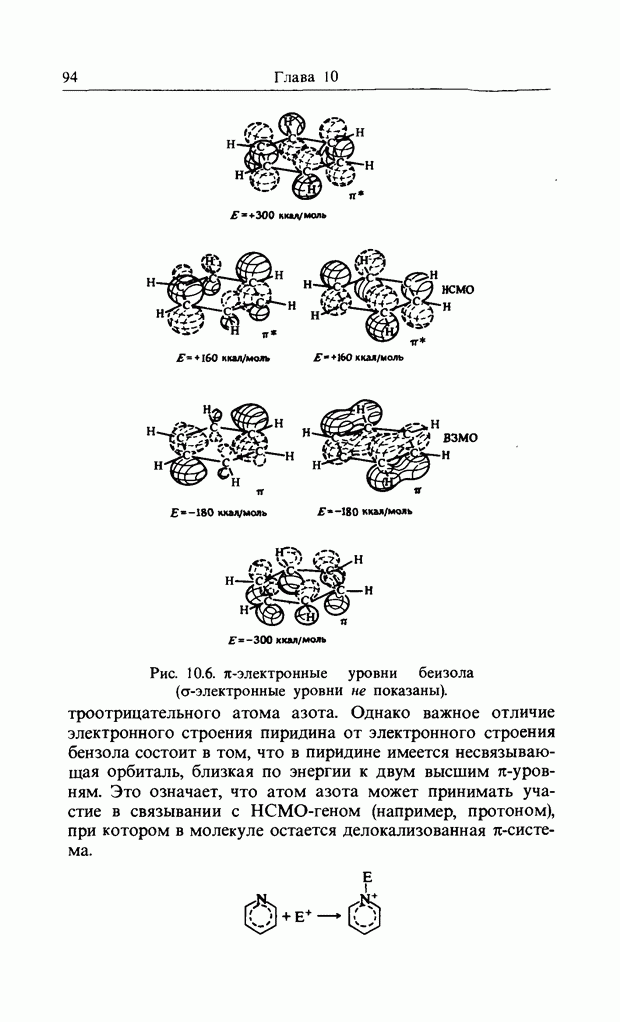
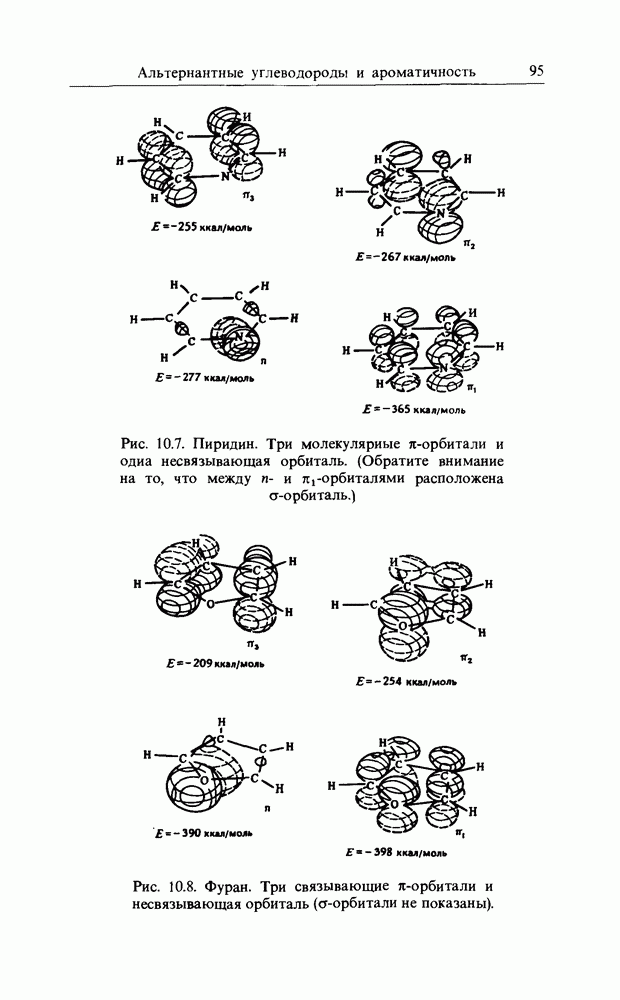
Распределение электронов в фенолят-ионе очень похоже на распределение в бензил-анионе. Однако любой заместитель с несвязанной электронной парой (например,  и т.д.) будет взаимодействовать с бензольным ядром аналогичным образом. Следовательно, несмотря на отсутствие общего заряда, электронная плотность на В3МО ароматического соединения (с заместителем, имеющим несвязанную электронную пару) будет наивысшей в орто- и пара-положениях к «донорному» заместителю, и обычно реакции идут быстрее, чем с бензолом. Атомы галогена имеют несвязанные электроны, которые могут взаимодействовать с соседними вакантными орбиталями, но они также намного более электроотрицательны, чем углерод. Суммарный эффект состоит в том, что галогены направляют реакцию в орто-пара-положения, но реакция протекает медленнее, чем с бензолом.
и т.д.) будет взаимодействовать с бензольным ядром аналогичным образом. Следовательно, несмотря на отсутствие общего заряда, электронная плотность на В3МО ароматического соединения (с заместителем, имеющим несвязанную электронную пару) будет наивысшей в орто- и пара-положениях к «донорному» заместителю, и обычно реакции идут быстрее, чем с бензолом. Атомы галогена имеют несвязанные электроны, которые могут взаимодействовать с соседними вакантными орбиталями, но они также намного более электроотрицательны, чем углерод. Суммарный эффект состоит в том, что галогены направляют реакцию в орто-пара-положения, но реакция протекает медленнее, чем с бензолом.
Если вместо несвязывающих электронных пар заместитель имеет низколежащие свободные орбитали, которые могут акцептировать электроны бензольного кольца (например,  и т.д.), эти электроны будут уходить в основном из орто- и пара-положений. Бензольное кольцо с акцепторной группой в качестве заместителя будет дезактивировано в реакциях присоединения с отщеплением типа нитрования, и атака предпочтительно будет осуществляться по .мета-положению к заместителю.
и т.д.), эти электроны будут уходить в основном из орто- и пара-положений. Бензольное кольцо с акцепторной группой в качестве заместителя будет дезактивировано в реакциях присоединения с отщеплением типа нитрования, и атака предпочтительно будет осуществляться по .мета-положению к заместителю.

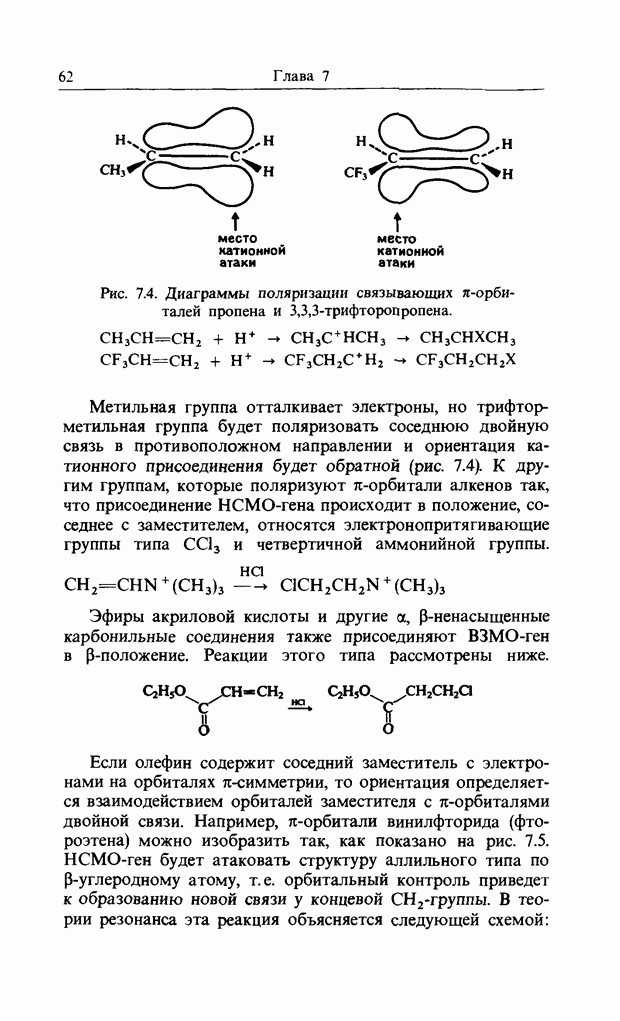
Заместители, не имеющие орбиталей  -симметрии и не способные поэтому взаимодействовать с
-симметрии и не способные поэтому взаимодействовать с  -орбиталями бензольного кольца, могут проявлять лишь индуктивный эффект. Граничная орбиталь толуола приведена ниже:
-орбиталями бензольного кольца, могут проявлять лишь индуктивный эффект. Граничная орбиталь толуола приведена ниже:

Атакующий электрофил, подходящий к В3МО толуола, будет взаимодействовать с атомами 1 и 2, или 3 и 4, или 4 и 5, или 1 и 6 (но не с атомами 2 и 3 или 5 и 6). Если метальный заместитель проявляет стерический эффект, ингибирующий атаку в положение 1, то ясно, что предпочтительней будет атака в орто- и пара-положения и в меньшей степени в мета-положение. Хотя (в основном состоянии) метальную группу можно рассматривать как  -электроноотталкиваю-щую, в реакции с отдачей электронов метальная группа может стать
-электроноотталкиваю-щую, в реакции с отдачей электронов метальная группа может стать  -донорной через гиперконъюгацию.
-донорной через гиперконъюгацию.
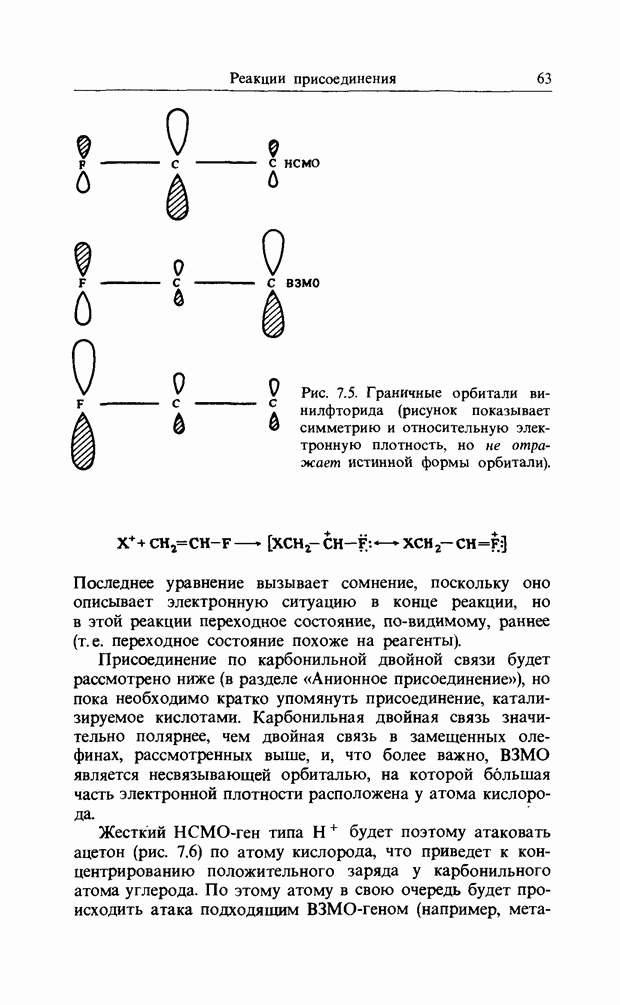
Гиперконъюгация-это процесс, в котором группа, подобная метальной, взаимодействует с ненасыщенной системой так, будто она обладает электронами  -симметрии. Для этого необходимо преобразовать орбитали
-симметрии. Для этого необходимо преобразовать орбитали  -группы таким образом, чтобы получить компоненты
-группы таким образом, чтобы получить компоненты  -симметрии. Если
-симметрии. Если
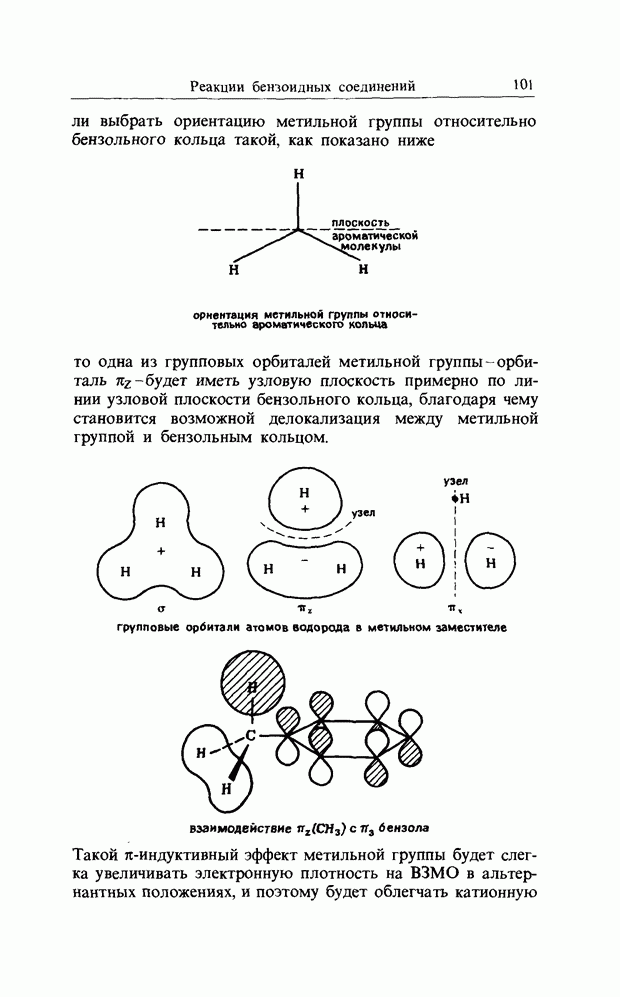
выбрать ориентацию метальной группы относительно бензольного кольца такой, как показано ниже

ориентация метильной группы относительно ароматического кольца
то одна из групповых орбиталей метильной группы - орбиталь  будет иметь узловую плоскость примерно по линии узловой плоскости бензольного кольца, благодаря чему становится возможной делокализация между метальной группой и бензольным кольцом.
будет иметь узловую плоскость примерно по линии узловой плоскости бензольного кольца, благодаря чему становится возможной делокализация между метальной группой и бензольным кольцом.

Такой  -индуктивный эффект метильной группы будет слегка увеличивать электронную плотность на В3МО в альтернантных положениях, и поэтому будет облегчать катионную
-индуктивный эффект метильной группы будет слегка увеличивать электронную плотность на В3МО в альтернантных положениях, и поэтому будет облегчать катионную
атаку в орто- и пара-положения. Подобно этому электронопритягивающие заместители (например,  ) будут слегка уменьшать электронную плотность В3МО в альтернантных положениях, и катионная атака будет происходить преимущественно в метаположение; при этом реакция будет идти медленнее, чем с бензолом.
) будут слегка уменьшать электронную плотность В3МО в альтернантных положениях, и катионная атака будет происходить преимущественно в метаположение; при этом реакция будет идти медленнее, чем с бензолом.
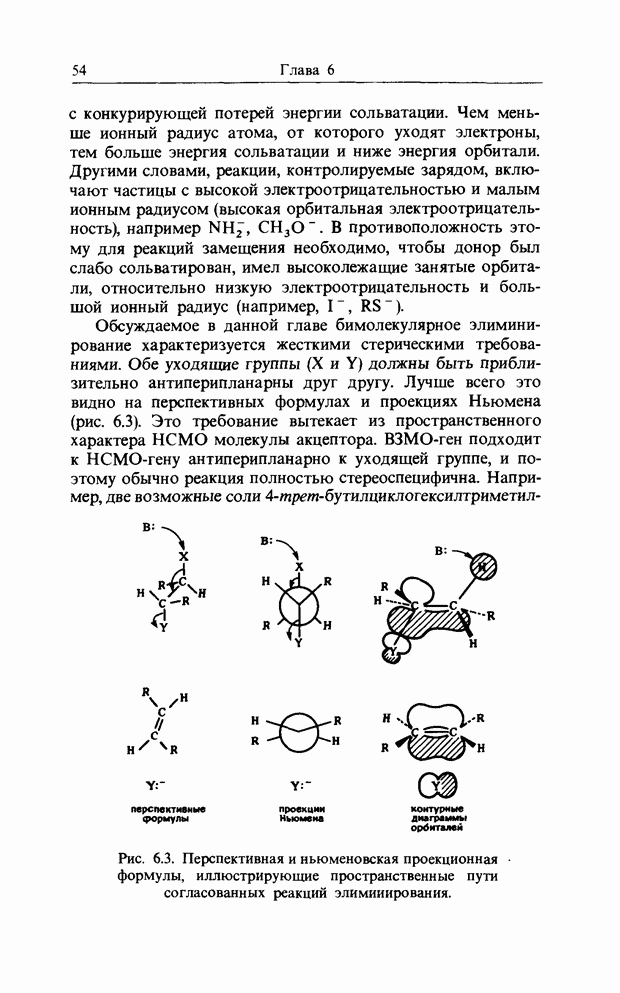
Хотя для большинства катионных реакций присоединения с элиминированием общепринятая теория резонанса дает удовлетворительные объяснения наблюдаемой общей ориентации (т. е. орто и пара или мета), она не может объяснить большие различия в соотношении атаки в орто- и пара-положения. Например, как показано в табл. 11.1, все три заместителя-метокси  метил
метил  и хлор (
и хлор ( -направляют нитрование в орто- и пара-положения, но относительные скорости атаки в орто- и пара- положения очень отличаются:
-направляют нитрование в орто- и пара-положения, но относительные скорости атаки в орто- и пара- положения очень отличаются:  (отметим, что этот ряд не соответствует ожидаемому по стерическим соображениям).
(отметим, что этот ряд не соответствует ожидаемому по стерическим соображениям).
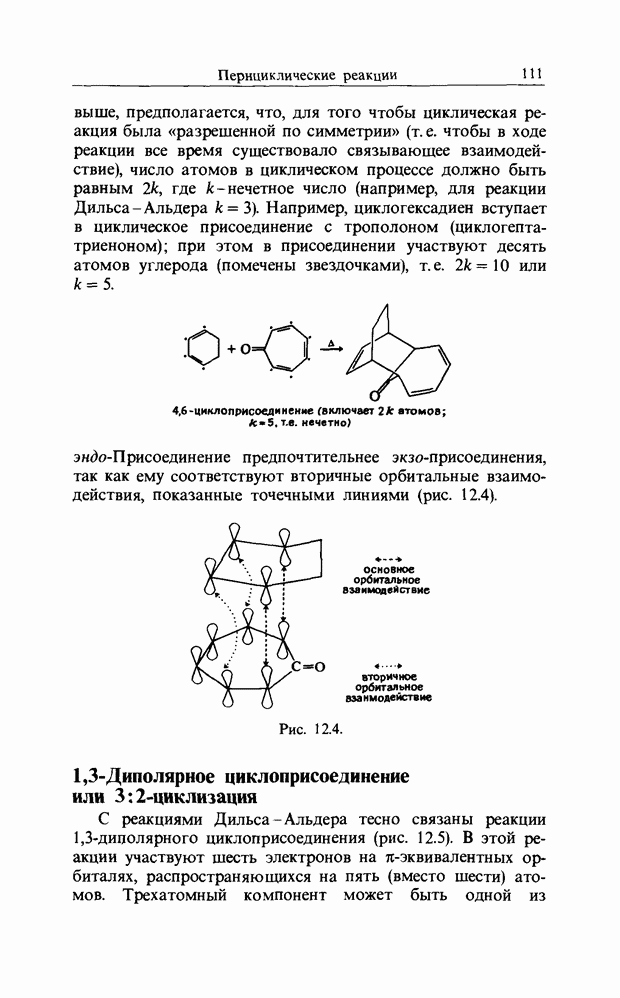
В табл. 11.2 показано, что соотношение орто-пара сильно варьирует  . Это нельзя приписать стерическим эффектам, поскольку первый и последний реагенты, а именно
. Это нельзя приписать стерическим эффектам, поскольку первый и последний реагенты, а именно  имеют очень сходные стерические требования. Повышение доли метапродукта снизу вверх в этой таблице (за исключением нитрования), вероятно, обусловлено увеличением реакционной способности катионных частиц (например,
имеют очень сходные стерические требования. Повышение доли метапродукта снизу вверх в этой таблице (за исключением нитрования), вероятно, обусловлено увеличением реакционной способности катионных частиц (например,  будет значительно более реакционноспособен и менее селективен, чем
будет значительно более реакционноспособен и менее селективен, чем  ). Ион
). Ион
Таблица 11.2. Ориентация катнонной атаки толуола разными реагентами

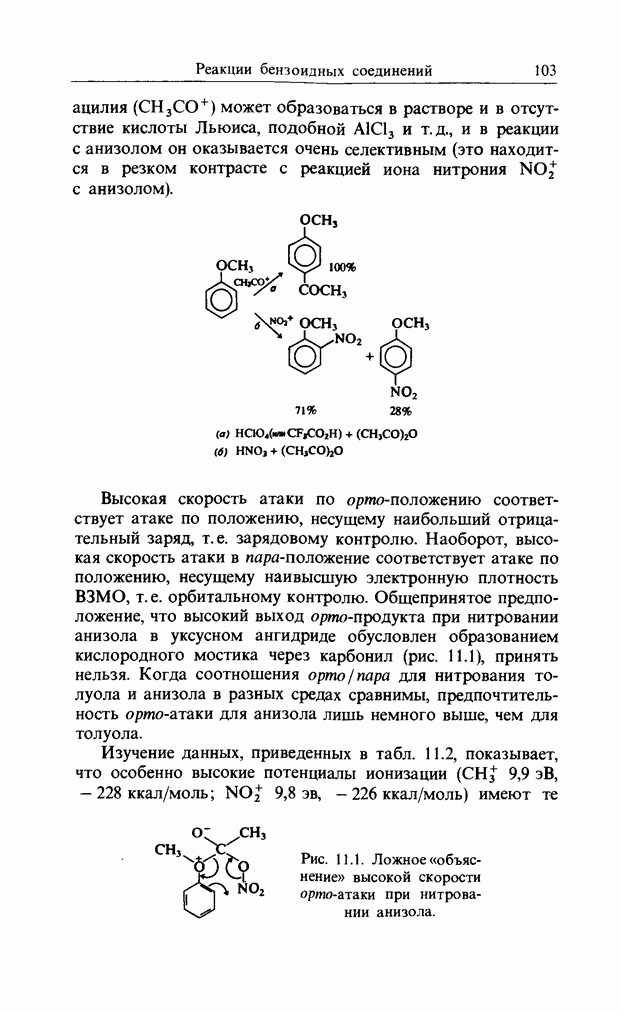
ацилия  может образоваться в растворе и в отсутствие кислоты Льюиса, подобной
может образоваться в растворе и в отсутствие кислоты Льюиса, подобной  и т.д., и в реакции с анизолом он оказывается очень селективным (это находится в резком контрасте с реакцией иона нитрония
и т.д., и в реакции с анизолом он оказывается очень селективным (это находится в резком контрасте с реакцией иона нитрония  с анизолом).
с анизолом).

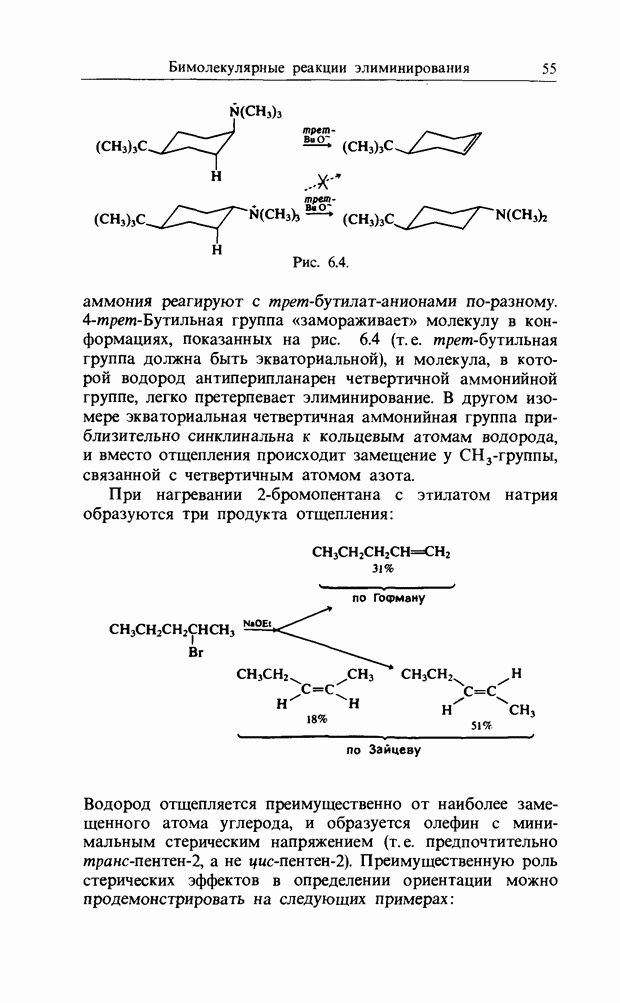
Высокая скорость атаки по орто-положению соответствует атаке по положению, несущему наибольший отрицательный заряд, т.е. зарядовому контролю. Наоборот, высокая скорость атаки в пара-положение соответствует атаке по положению, несущему наивысшую электронную плотность В3МО, т. е. орбитальному контролю. Общепринятое предположение, что высокий выход орто-продукта при нитровании анизола в уксусном ангидриде обусловлен образованием кислородного мостика через карбонил (рис. 11.1), принять нельзя. Когда соотношения орто/пара для нитрования толуола и анизола в разных средах сравнимы, предпочтительность  -атаки для анизола лишь немного выше, чем для толуола.
-атаки для анизола лишь немного выше, чем для толуола.
Изучение данных, приведенных в табл. 11.2, показывает, что особенно высокие потенциалы ионизации  эВ, — 228 ккал/моль;
эВ, — 228 ккал/моль;  ккал/моль) имеют те
ккал/моль) имеют те

Рис. 11.1. Ложное «объяснение» высокой скорости орто-атаки при нитровании анизола.
ионы, которые предпочитают орто-атаку, т.е. зарядовый контроль. В отличие от этого ион ацетилия, имеющий низкий потенциал ионизации ( ккал/моль), относительно нереакционноспособен и предпочитает исключительно пара-атаку, т. е. орбитальный контроль. Для толуола, по данным приближенных молекулярно-орбитальных расчетов, наибольший отрицательный заряд находится в положении 2, а наибольшая электронная плотность В3МО - в положении 4.
ккал/моль), относительно нереакционноспособен и предпочитает исключительно пара-атаку, т. е. орбитальный контроль. Для толуола, по данным приближенных молекулярно-орбитальных расчетов, наибольший отрицательный заряд находится в положении 2, а наибольшая электронная плотность В3МО - в положении 4.
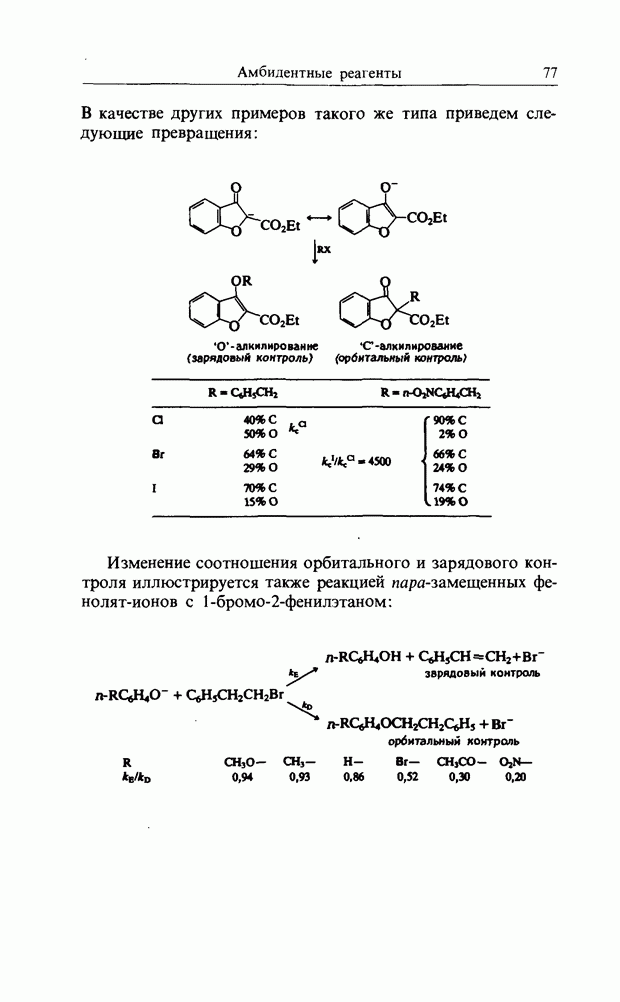
Другие известные примеры перехода от зарядового контроля к орбитальному контролю приведены ниже.
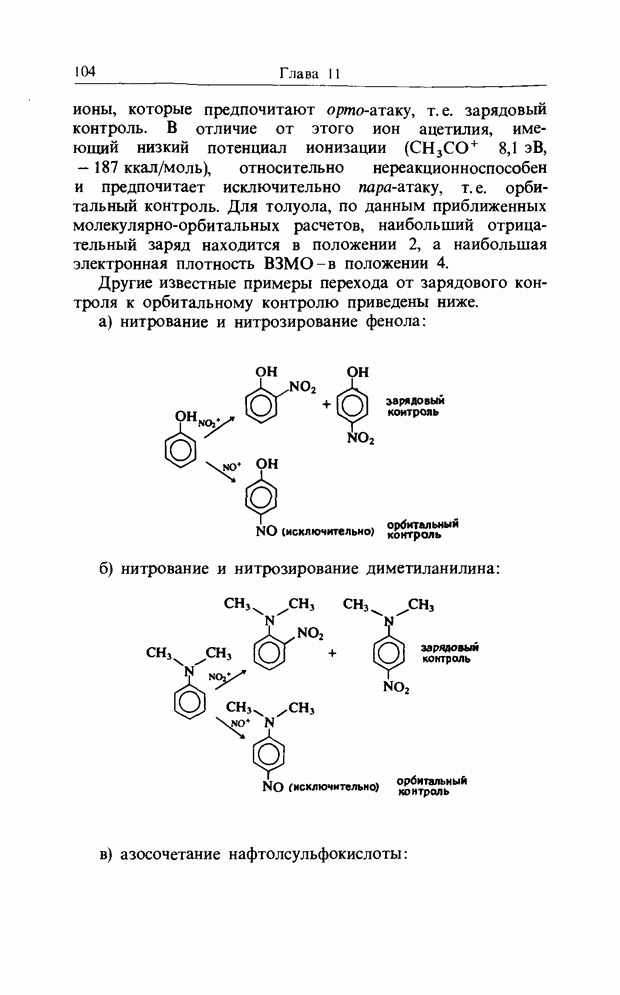
а) нитрование и нитрозирование фенола:

б) нитрование и нитрозирование диметиланилина:

в) азосочетание нафтолсульфокислоты:

г) ацилирование толуола ионами ацилия (при постепенно возрастающей электроотрицательности):

Увеличение числа атомов хлора в атакующем ионе ацилия могло бы уменьшить по стерическим причинам степень орто-атаки. Вместо этого увеличение полярности переходного состояния делает более важным зарядовый контроль. Стерические эффекты важны, но тот факт, что в данном случае реакция контролируется не увеличением объема хлоро- и ди-хлорометильных групп, а различием в зарядах, подчеркивает важную роль, которую играет орбитальный контроль в катионных реакциях присоединения с элиминированием.
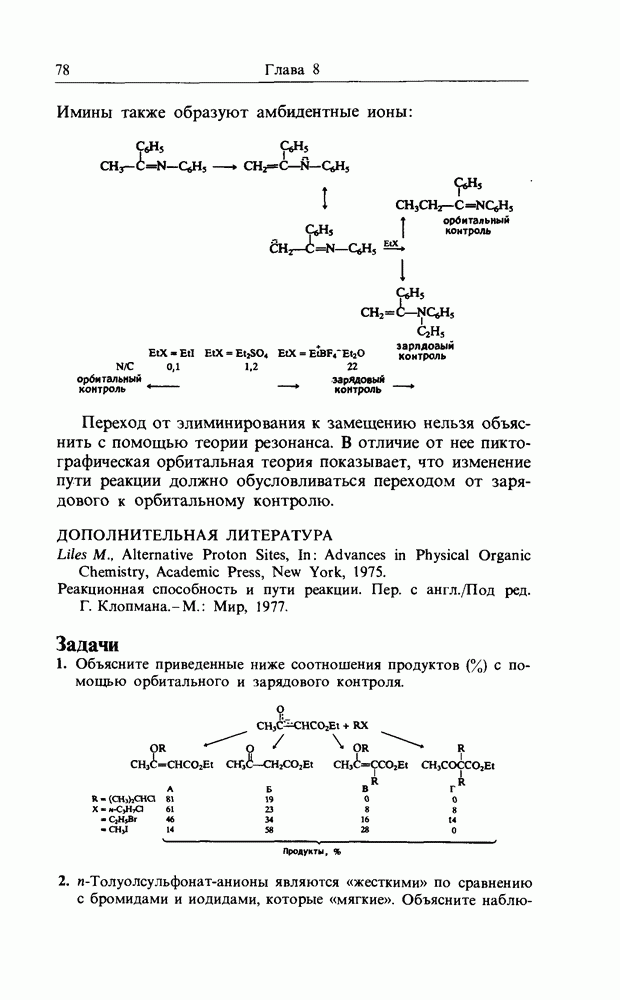
Другой пример изменения от зарядового контроля к орбитальному найден при бензилировании толуола и бензола. Наибольшая величина отношения  пара связывается с зарядовым контролем и низкой селективностью
пара связывается с зарядовым контролем и низкой селективностью  бензол), тогда как низкая величина отношения
бензол), тогда как низкая величина отношения  пара связывается с увеличением степени орбитального контроля и высокой селективностью.
пара связывается с увеличением степени орбитального контроля и высокой селективностью.

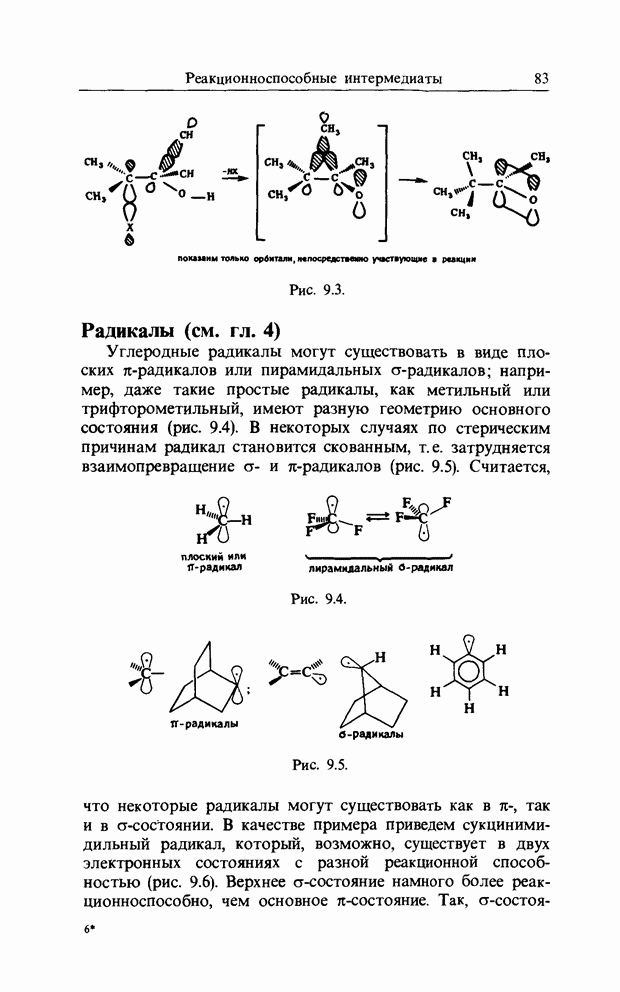
Свободнорадикальное замещение в ароматических соединениях
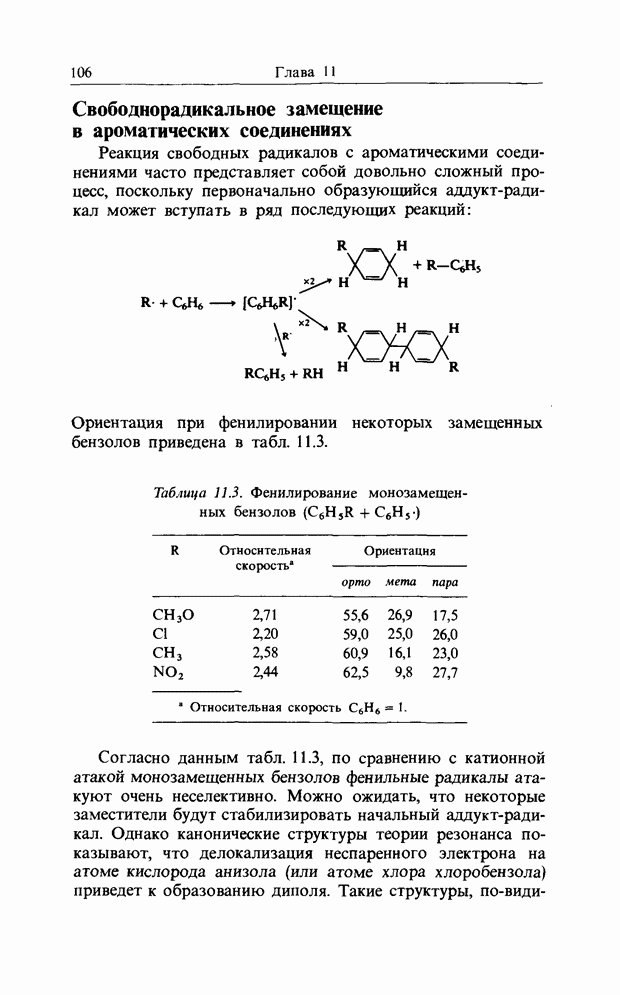
Реакция свободных радикалов с ароматическими соединениями часто представляет собой довольно сложный процесс, поскольку первоначально образующийся аддукт-радикал может вступать в ряд последующих реакций:

Ориентация при фенилировании некоторых замещенных бензолов приведена в табл. 11.3.
Таблица 11.3. Фенилирование монозамещенных бензолов 

Согласно данным табл. 11.3, по сравнению с катионной атакой монозамещенных бензолов фенильные радикалы атакуют очень неселективно. Можно ожидать, что некоторые заместители будут стабилизировать начальный аддукт-радикал. Однако канонические структуры теории резонанса показывают, что делокализация неспаренного электрона на атоме кислорода анизола (или атоме хлора хлоробензола) приведет к образованию диполя. Такие структуры, по-видимому,

вследствие разделения заряда в них дают пренебрежимо малый вклад в основное состояние аддукт-радикала.
Анионное замещение в ароматических соединениях
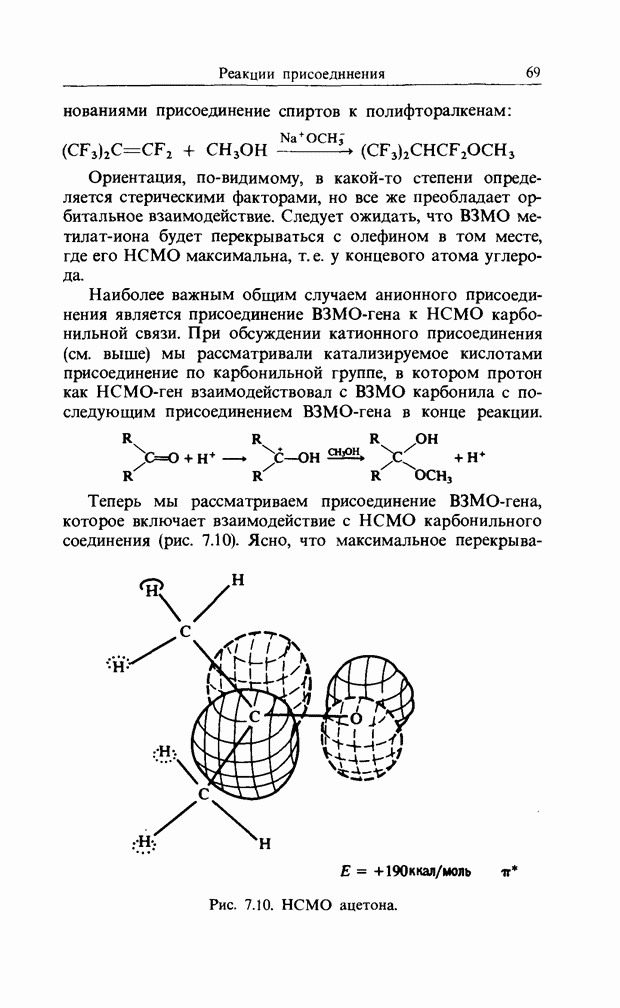
В то время как в наиболее распространенном катионном замещении ароматических соединений участвует В3МО арена, в анионном замещении участвует НСМО. Тем не менее монозамещенные бензолы можно рассмотреть аналогичным образом, т. е. найти коэффициенты несвязывающей орбитали бензил-катиона. Если заменить группу  на нитрогруппу, то следует ожидать некоторого увеличения заряда в орто- и пара-положениях:
на нитрогруппу, то следует ожидать некоторого увеличения заряда в орто- и пара-положениях:

распределение заряда в бензил-катионе
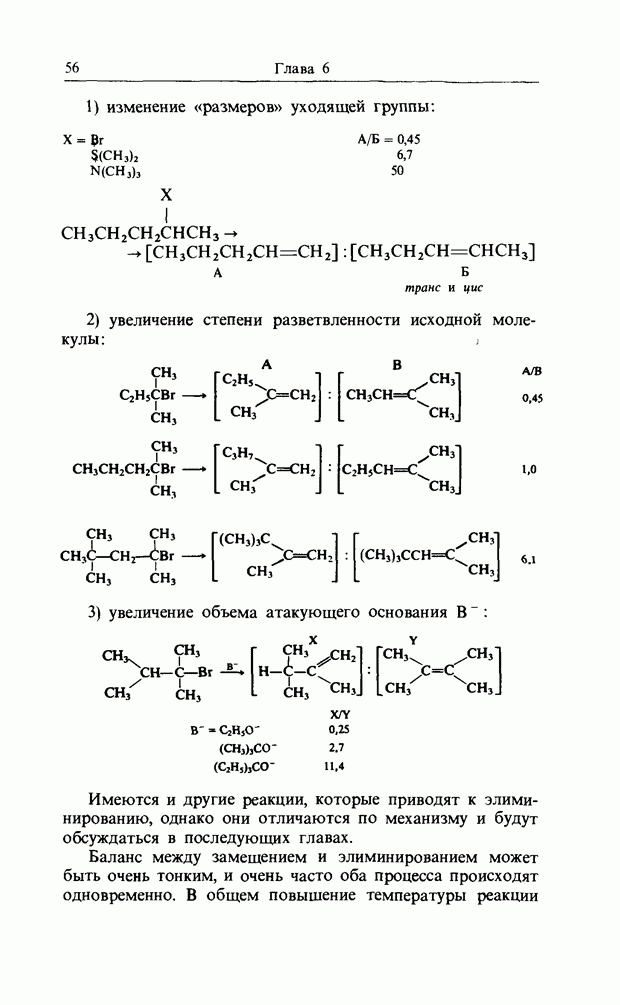
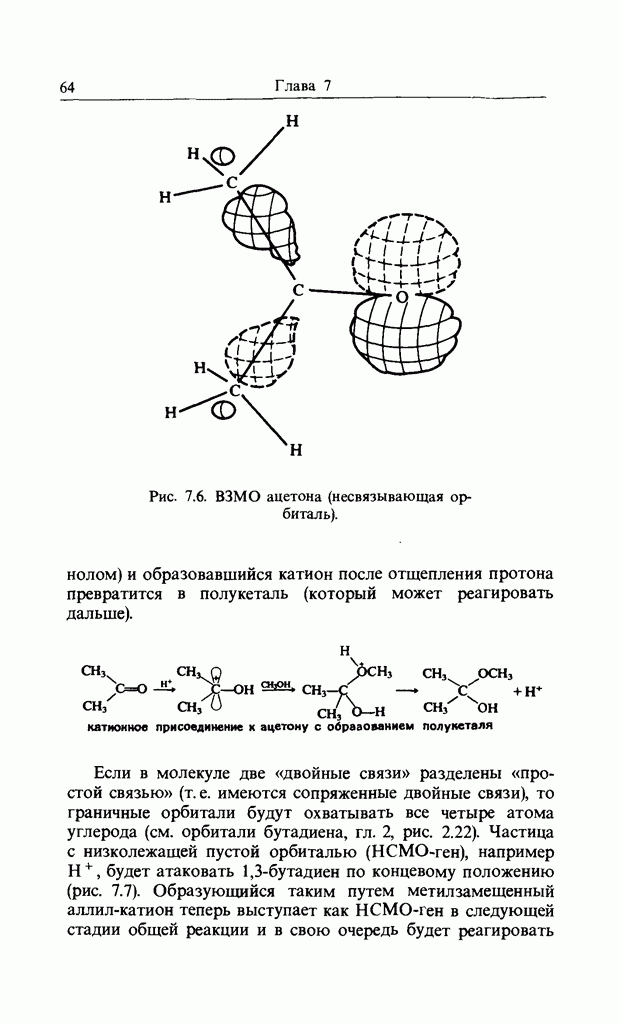
На рис. 11.2 приведены относительные скорости замещения при действии  в метаноле для четырех пара-замещенных
в метаноле для четырех пара-замещенных  -нитрохлоробензолов. Согласно этим данным, метальная группа, которая отталкивает электроны, затрудняет
-нитрохлоробензолов. Согласно этим данным, метальная группа, которая отталкивает электроны, затрудняет

Рис. 11.2. Относительные скорости замещения  на
на  в замещенных
в замещенных  -нитрохлоро-бензолах.
-нитрохлоро-бензолах.
реакцию, а трифторометильная группа, которая сильно притягивает электроны, сильно увеличивает скорость замещения.
Заключение
Пиктографическая орбитальная теория, таким образом, позволяет объяснить ориентацию замещения в реакциях присоединения с отщеплением в аренах более исчерпывающе, чем простая теория резонанса. В частности, она позволяет объяснить изменение отношения орто: пара при катионном замещении тем, что происходит изменение от зарядового контроля к орбитальному. Свободнорадикальное замещение в ароматических соединениях легче всего объясняется с помощью теории резонанса, но для анионного замещения снова необходимо применять орбитальную теорию.
ДОПОЛНИТЕЛЬНАЯ ЛИТЕРАТУРА
(см. скан)
Задачи
1. Нарисуйте В3МО фенолят-аниона.
2. Обсудите следующие наблюдения:

3. Объясните приведенные ниже данные по гемолитическому арилированию на основании полярных эффектов в арильном радикале.

| << Предыдущий параграф | Следующий параграф >> |
- ПРЕДИСЛОВИЕ ПЕРЕВОДЧИКА
- ПРЕДИСЛОВИЕ АВТОРОВ К РУССКОМУ ИЗДАНИЮ
- ВВЕДЕНИЕ
- НОМЕНКЛАТУРА
- 1. АТОМНЫЕ И МОЛЕКУЛЯРНЫЕ ОРБИТАЛИ
- 2. ПИКТОГРАФИЧЕСКАЯ ОРБИТАЛЬНАЯ ТЕОРИЯ
- 3. ГИБРИДИЗАЦИЯ И ОРБИТАЛИ ФУНКЦИОНАЛЬНЫХ ГРУПП
- 4. СВЯЗЬ УГЛЕРОД ВОДОРОД И РЕАКЦИИ ПЕРЕНОСА РАДИКАЛОВ
- 5. РЕАКЦИИ ЗАМЕЩЕНИЯ И СВЯЗЬ УГЛЕРОД ГАЛОГЕН
- 6. БИМОЛЕКУЛЯРНЫЕ РЕАКЦИИ ЭЛИМИНИРОВАНИЯ
- 7. РЕАКЦИИ ПРИСОЕДИНЕНИЯ
- 8. АМБИДЕНТНЫЕ РЕАГЕНТЫ
- 9. РЕАКЦИОННОСПОСОБНЫЕ ИНТЕРМЕДИАТЫ
- 10. АЛЬТЕРНАНТНЫЕ УГЛЕВОДОРОДЫ И АРОМАТИЧНОСТЬ
- 11. РЕАКЦИИ БЕНЗОИДНЫХ СОЕДИНЕНИЙ
- 12. ПЕРИЦИКЛИЧЕСКИЕ РЕАКЦИИ