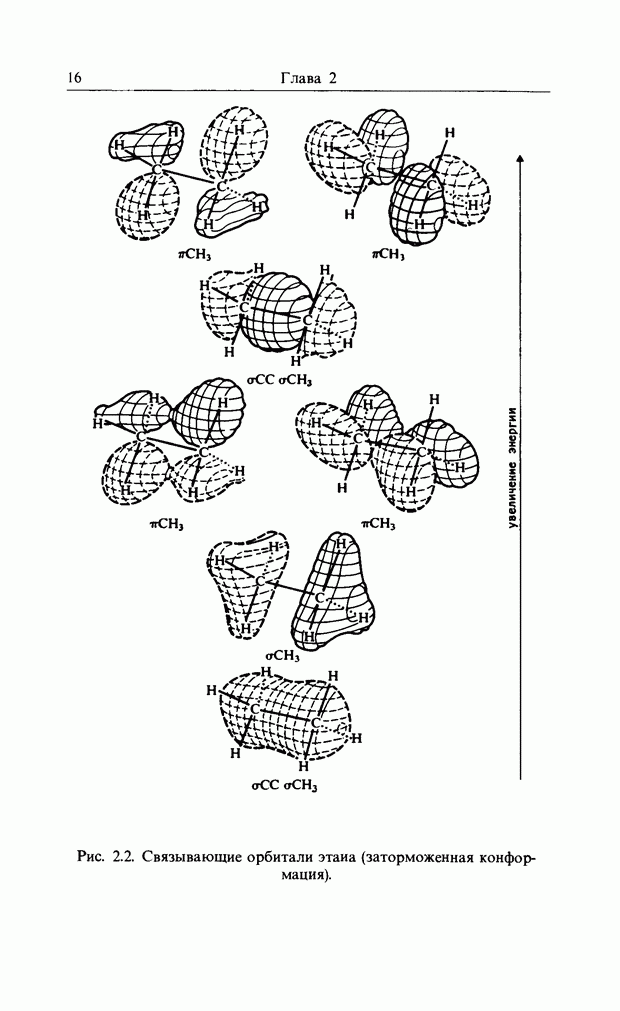
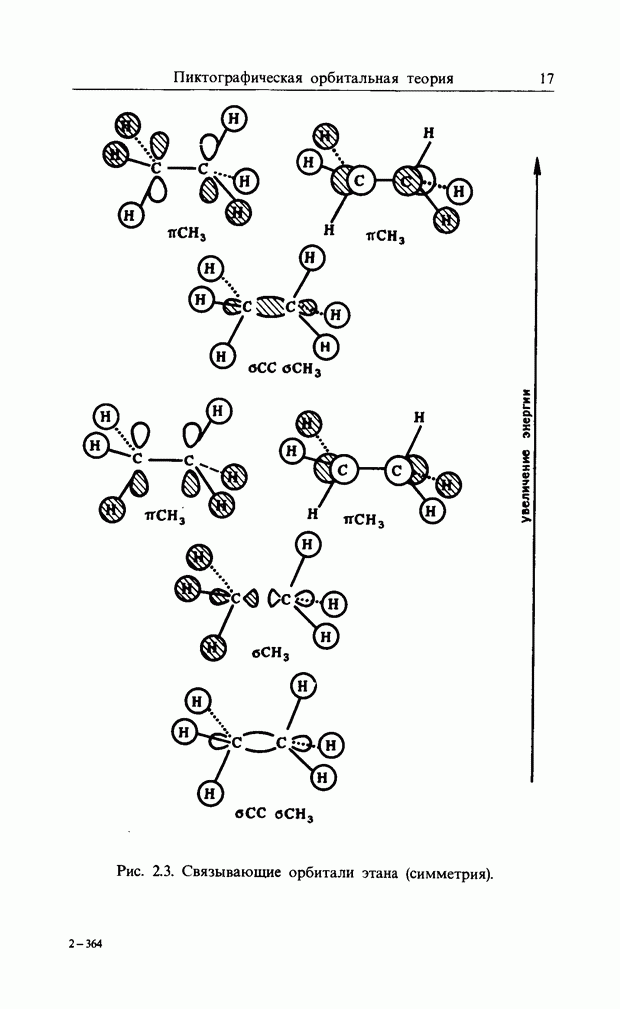
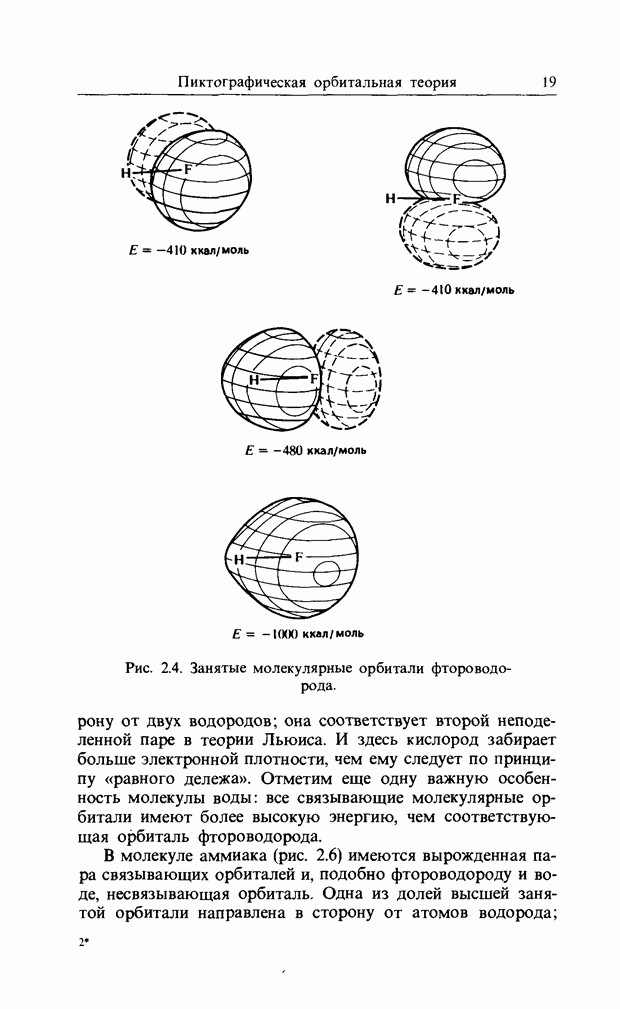
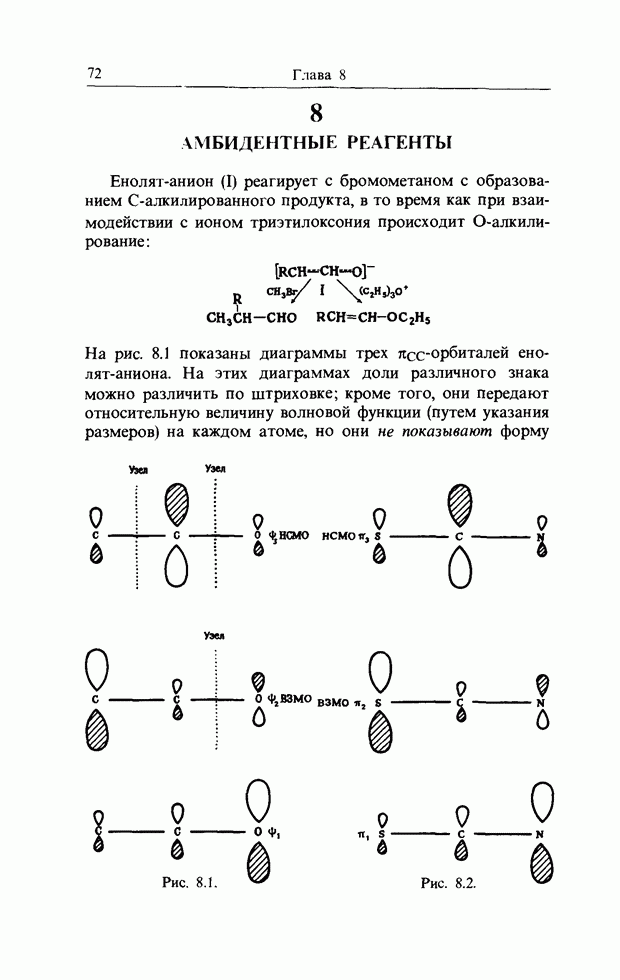
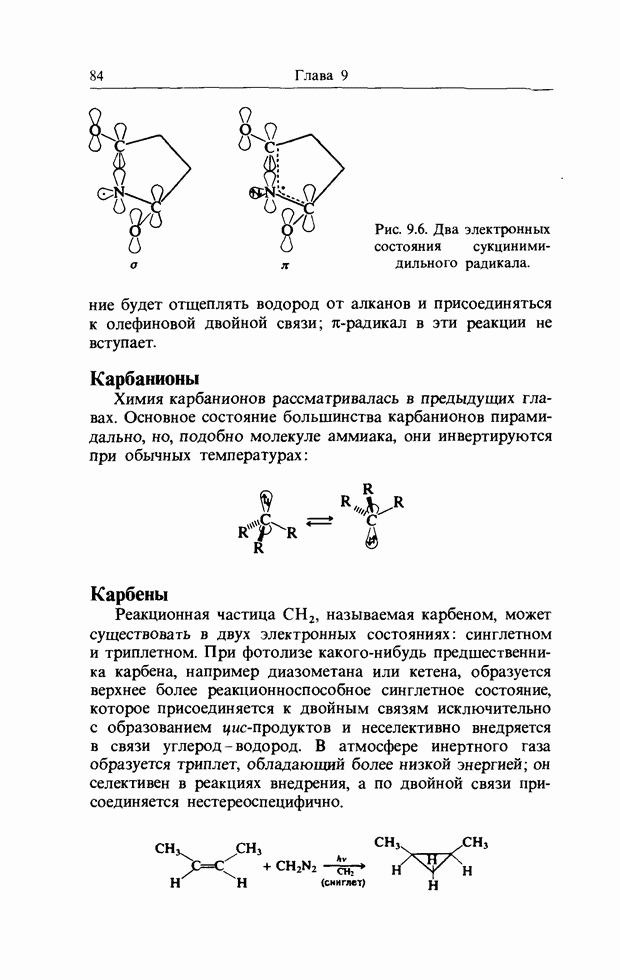
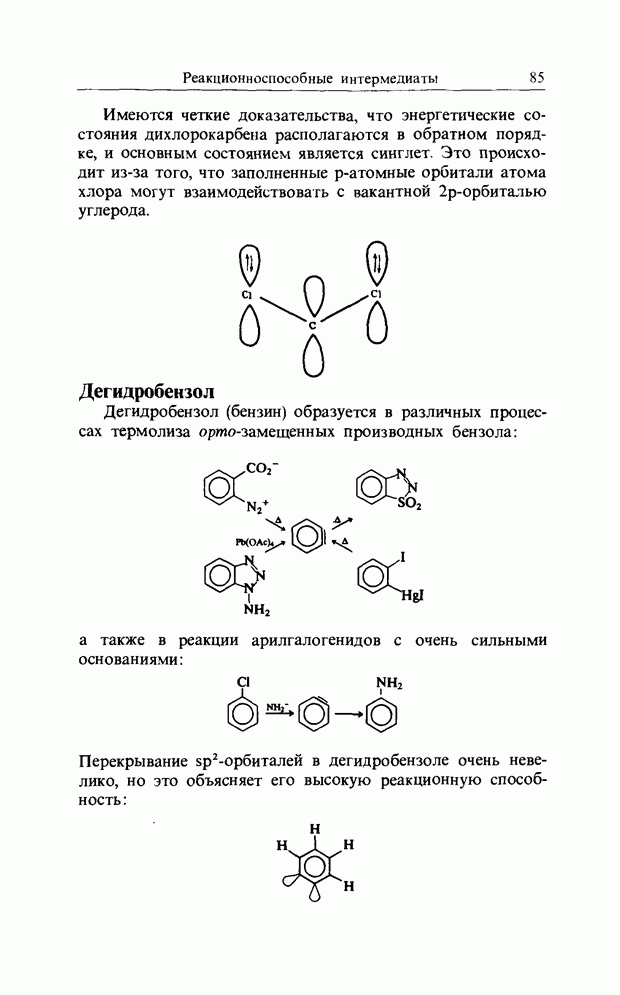
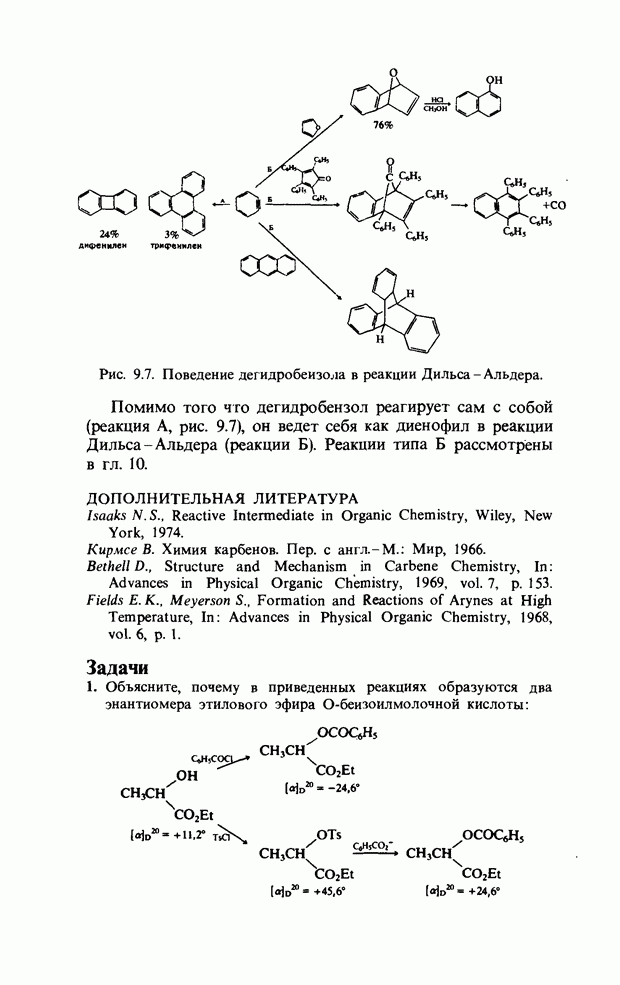
| << Предыдущий параграф |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
12. ПЕРИЦИКЛИЧЕСКИЕ РЕАКЦИИ
Реакция Дильса-Альдера
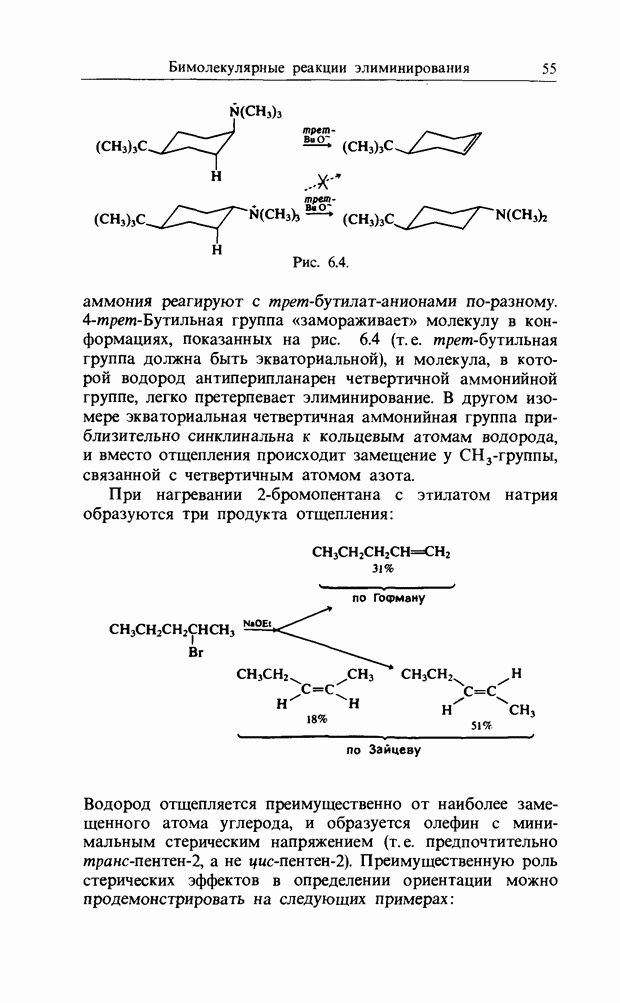
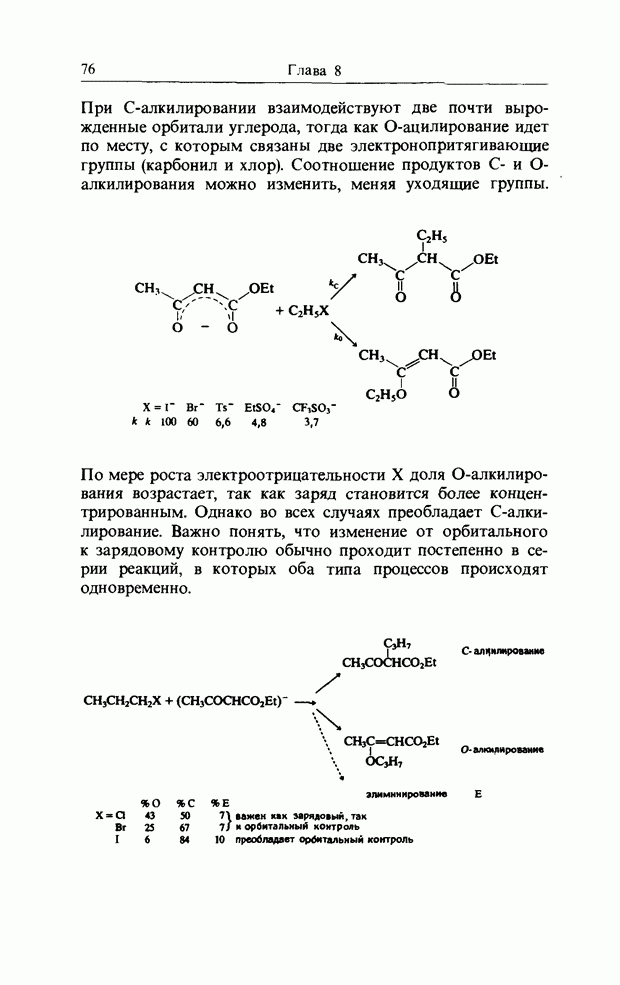
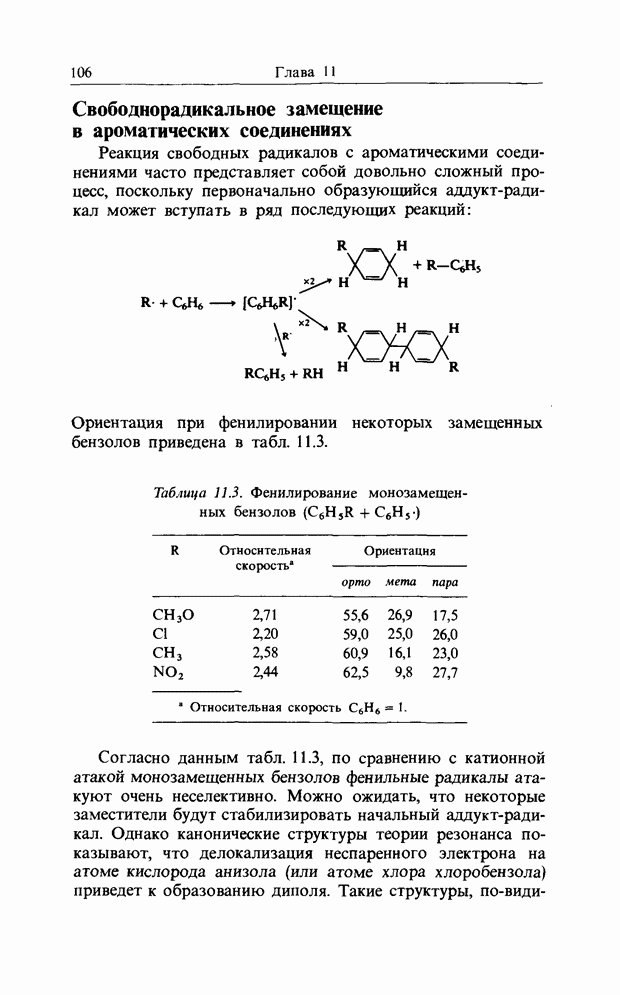
В гл. 7 при описании присоединения аниона по карбонильной двойной связи было рассмотрено взаимодействие В3МО аниона с НСМО  карбонильной связи. Аналогично было описано присоединение катиона к олефиновой двойной связи как взаимодействие НСМО катиона с В3МО
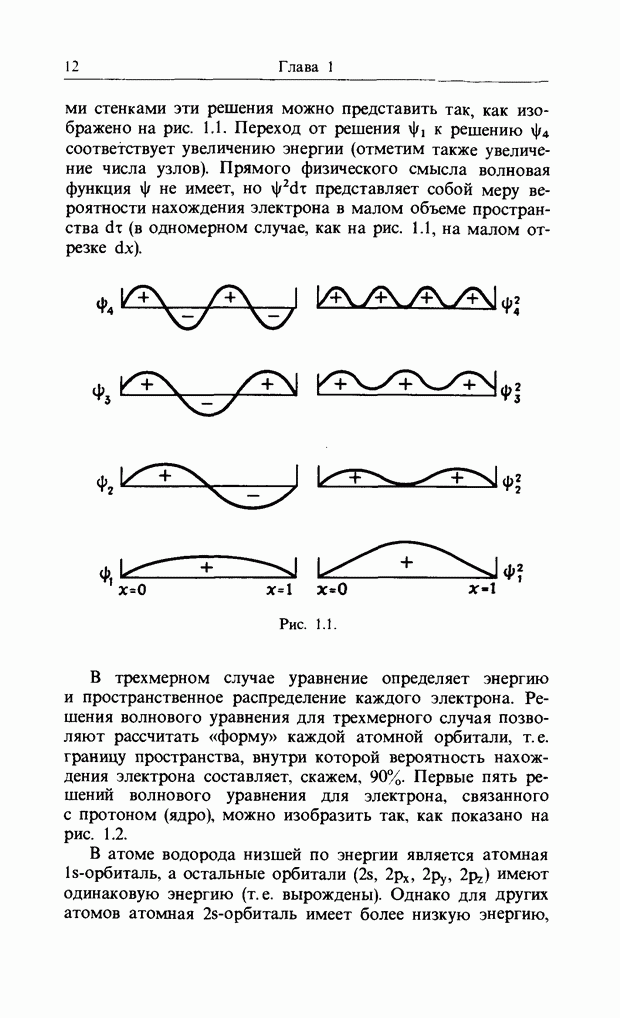
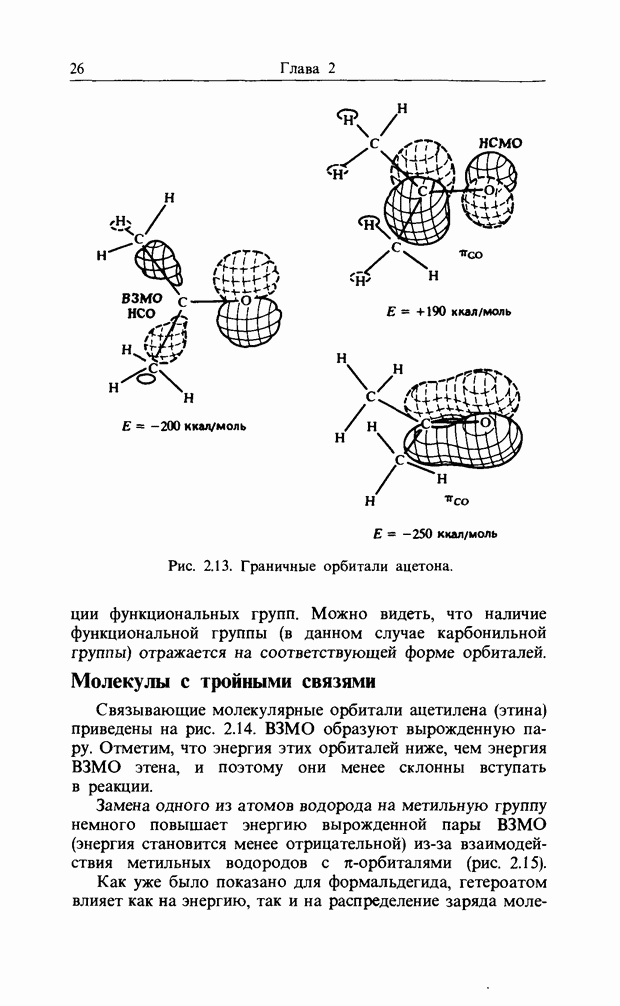
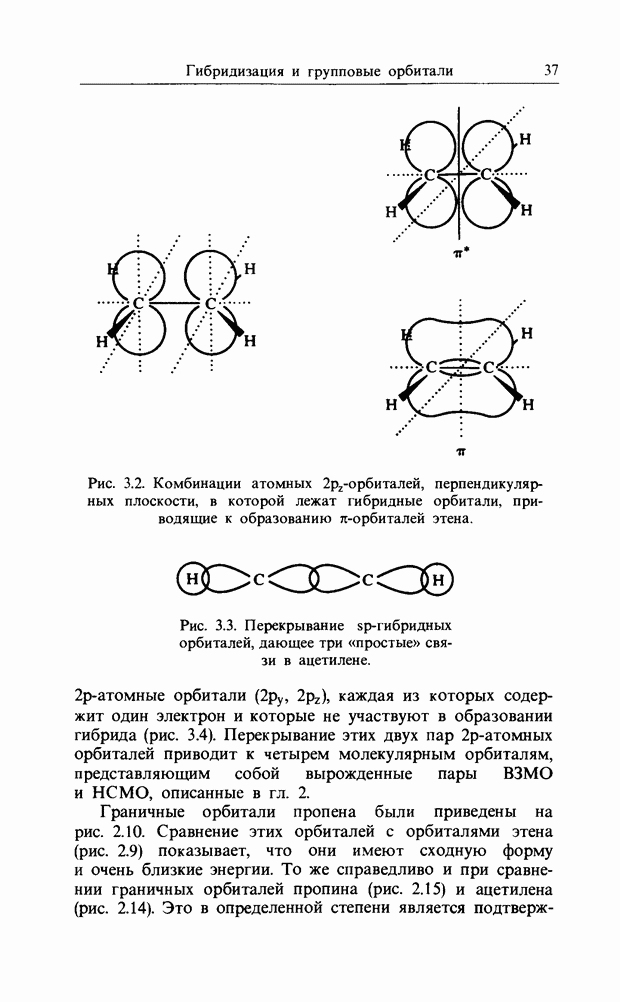
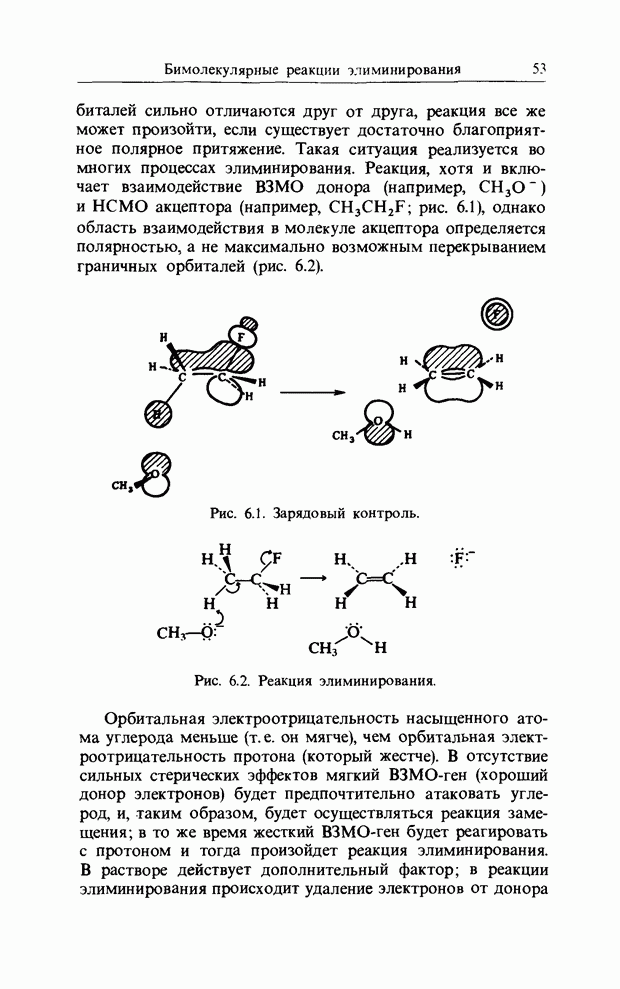
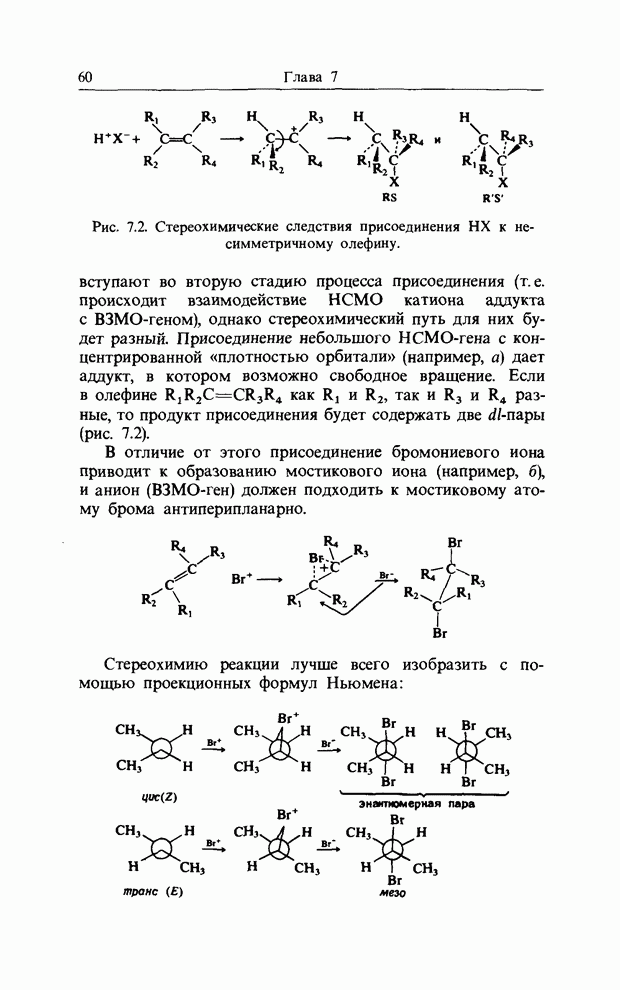
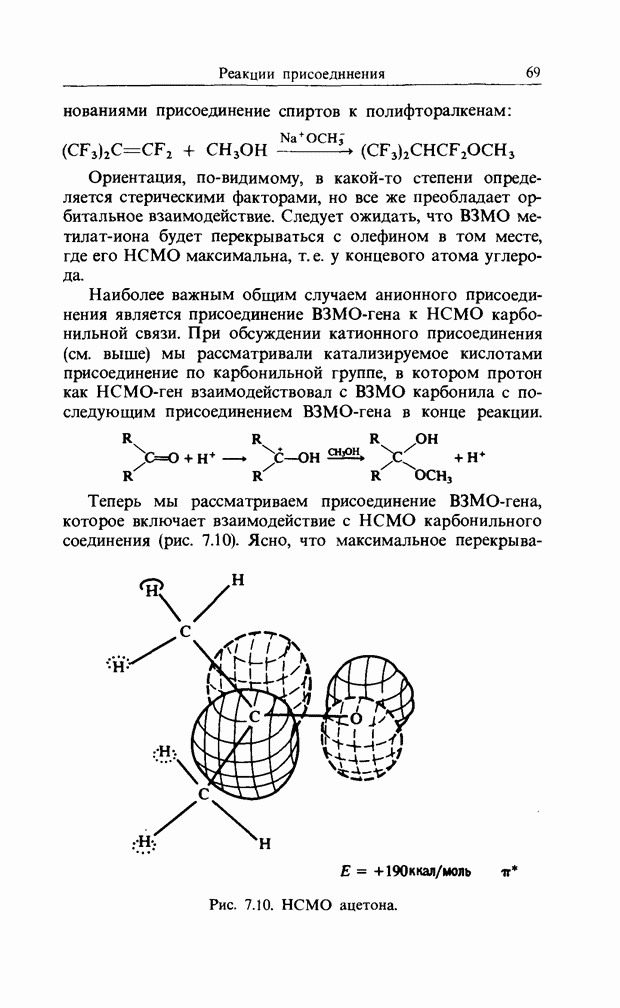
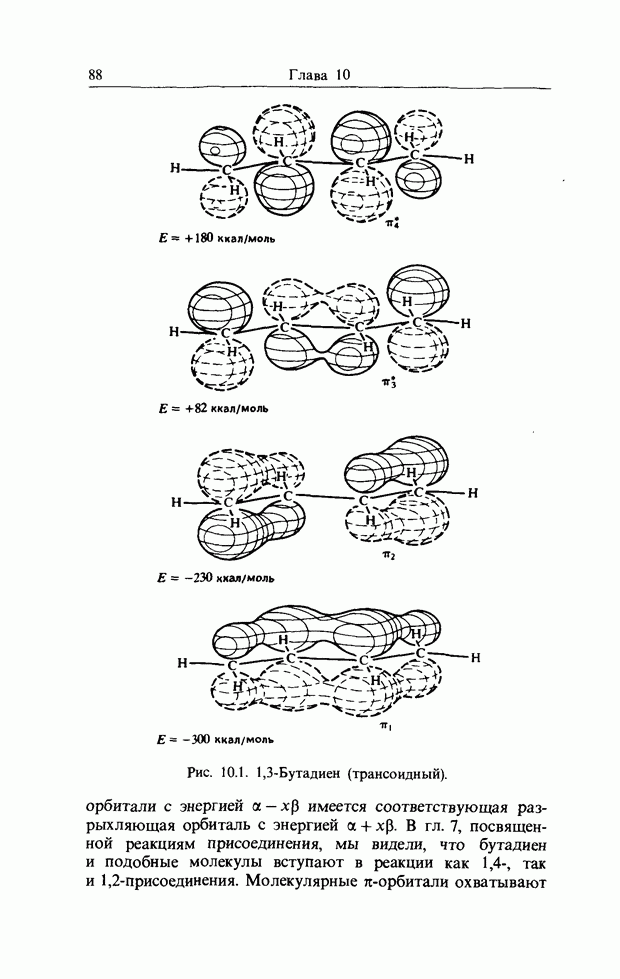
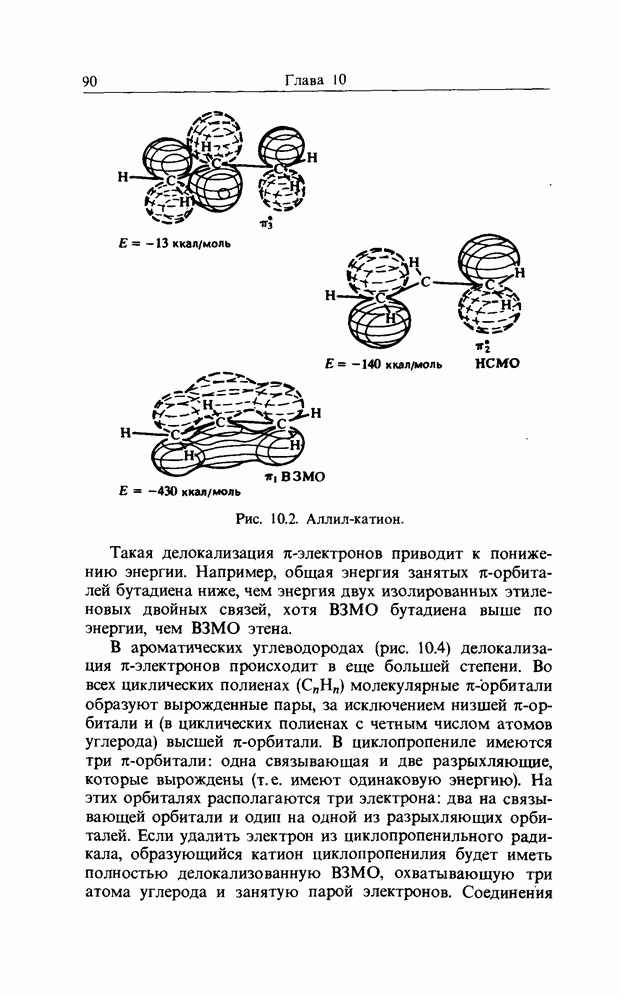
карбонильной связи. Аналогично было описано присоединение катиона к олефиновой двойной связи как взаимодействие НСМО катиона с В3МО  двойной связи. В простых реакциях присоединения этого типа затрагиваются одновременно три атомных центра. В этой главе будут рассмотрены процессы, представляющие собой согласованные реакции с циклическим переходным состоянием. Наиболее известным примером является реакция Дильса-Альдера; одно время ее называли «реакцией без механизма», однако Вудвард и Гофман показали, что стереохимию таких реакций можно выяснить, если рассмотреть взаимодействие между граничными орбиталями. Так, на рис. 12.1 изображено взаимодействие этена и бутадиена.
двойной связи. В простых реакциях присоединения этого типа затрагиваются одновременно три атомных центра. В этой главе будут рассмотрены процессы, представляющие собой согласованные реакции с циклическим переходным состоянием. Наиболее известным примером является реакция Дильса-Альдера; одно время ее называли «реакцией без механизма», однако Вудвард и Гофман показали, что стереохимию таких реакций можно выяснить, если рассмотреть взаимодействие между граничными орбиталями. Так, на рис. 12.1 изображено взаимодействие этена и бутадиена.

Рис. 12.1. Взаимодействие граничных орбиталей в этене и цыс-1,3-бутадиене.
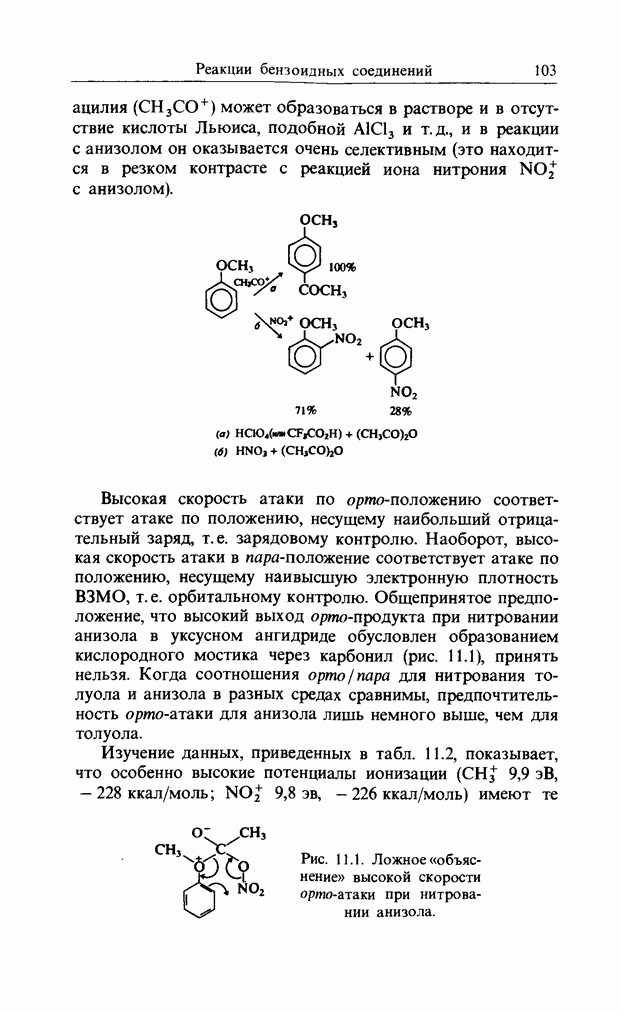
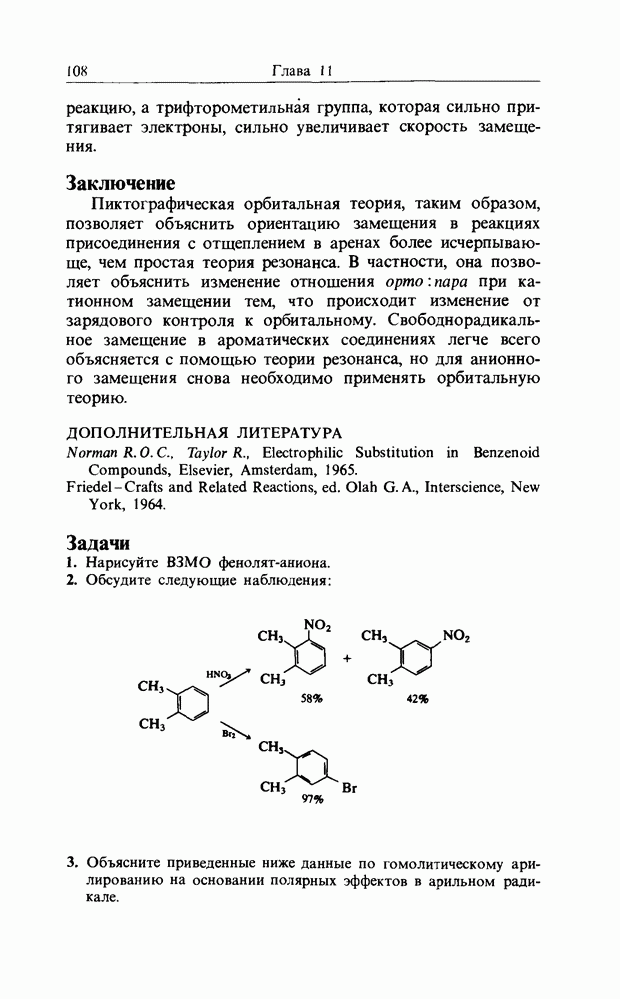
Из этого рисунка очевидно, что, если этен (на практике замещенный этен) и цисоидный бутадиен сближаются в параллельных молекулярных плоскостях один над другим, то между ними возможно связывающее взаимодействие. Высшая занятая орбиталь бутадиена взаимодействует с низшей свободной орбиталью этена и одновременно низшая свободная орбиталь бутадиена взаимодействует с высшей занятой орбиталью этена. В противоположность этому любые попытки привести в контакт друг с другом две молекулы этена ведут к антисвязывающему взаимодействию (рис. 12.2).
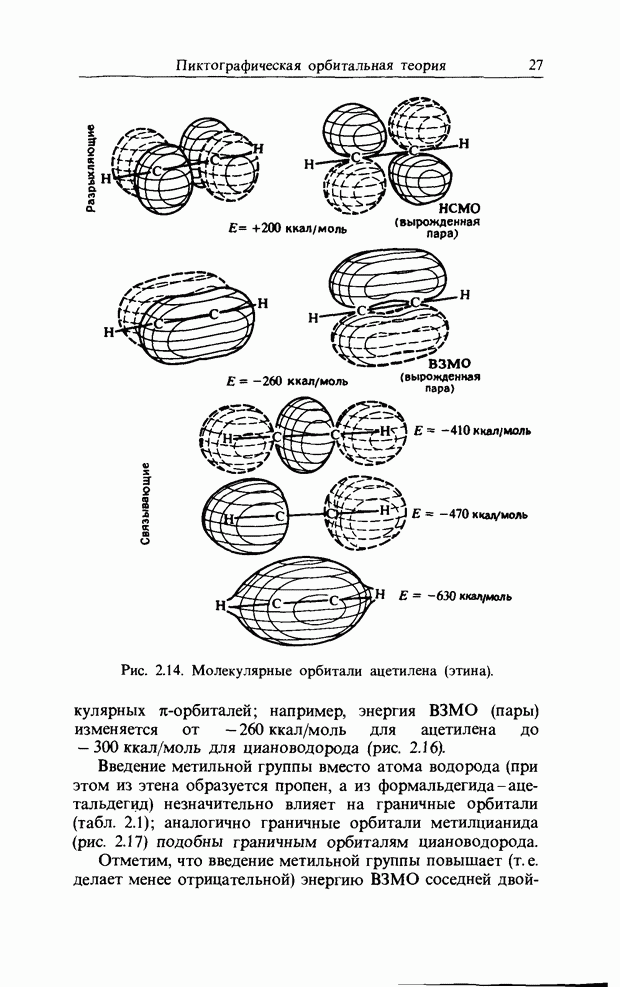
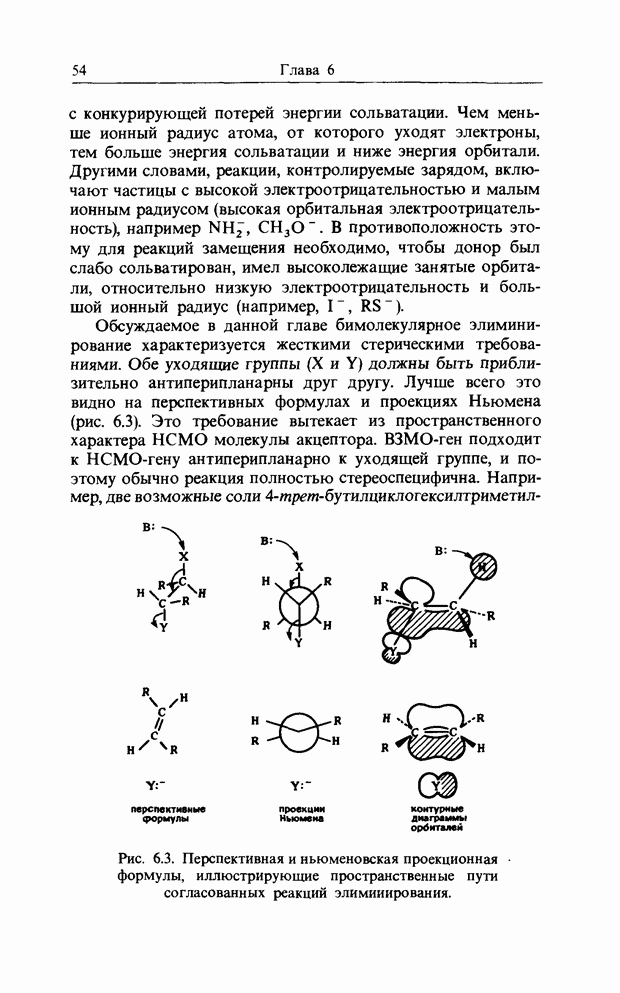
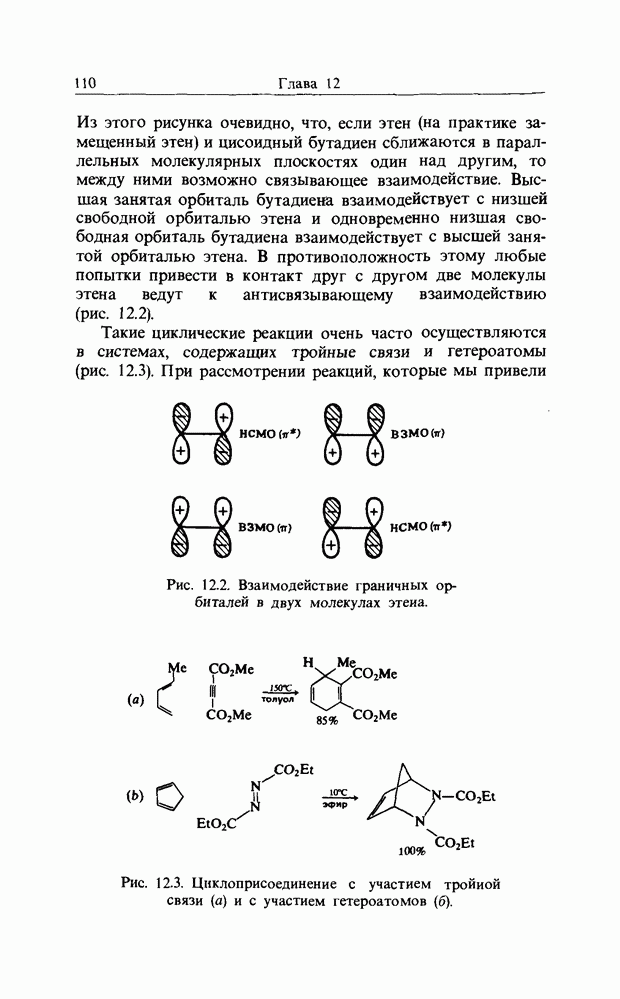
Такие циклические реакции очень часто осуществляются в системах, содержащих тройные связи и гетероатомы (рис. 12.3). При рассмотрении реакций, которые мы привели

Рис. 12.2. Взаимодействие граничных орбиталей в двух молекулах этеиа.

Рис. 12.3. Циклоприсоединение с участием тройной связи (а) и с участием гетероатомов (б).
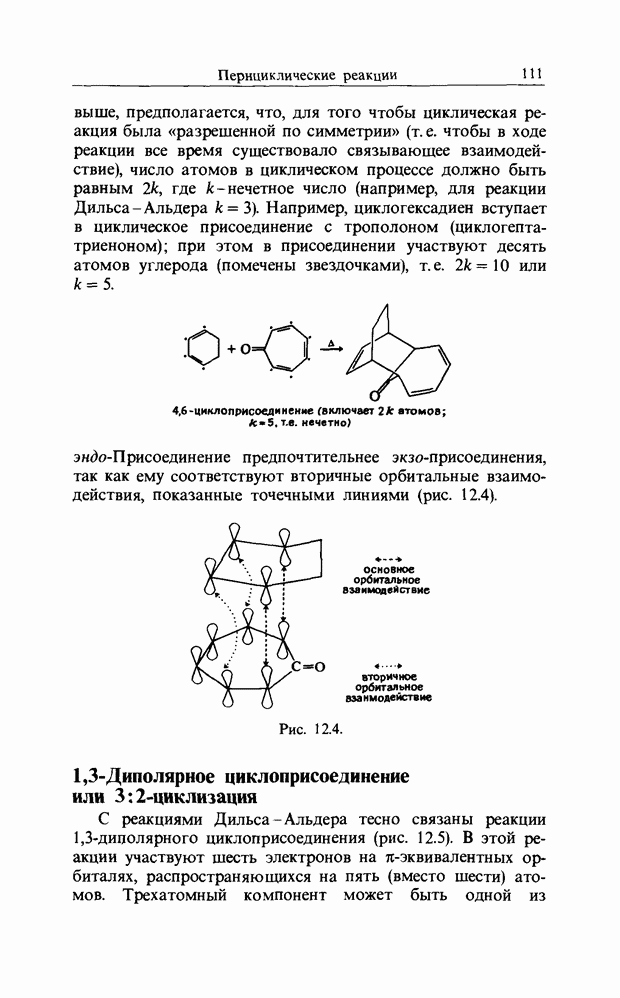
выше, предполагается, что, для того чтобы циклическая реакция была «разрешенной по симметрии» (т. е. чтобы в ходе реакции все время существовало связывающее взаимодействие), число атомов в циклическом процессе должно быть равным  , где k - нечетное число (например, для реакции Дильса-Альдера
, где k - нечетное число (например, для реакции Дильса-Альдера  Например, циклогексадиен вступает в циклическое присоединение с трополоном (циклогепта-триеноном); при этом в присоединении участвуют десять атомов углерода (помечены звездочками), т.е.
Например, циклогексадиен вступает в циклическое присоединение с трополоном (циклогепта-триеноном); при этом в присоединении участвуют десять атомов углерода (помечены звездочками), т.е.  или
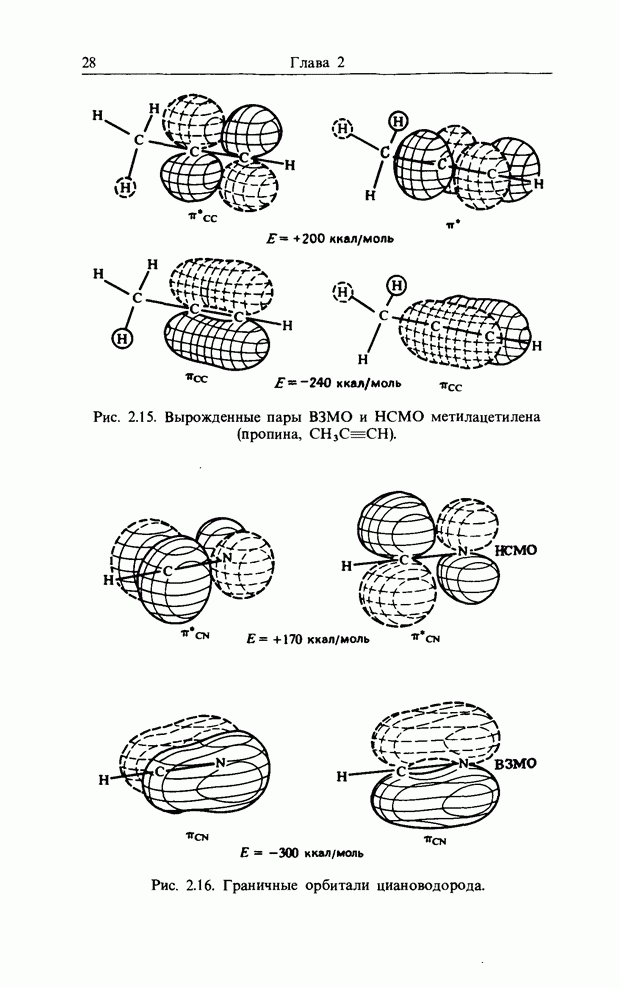
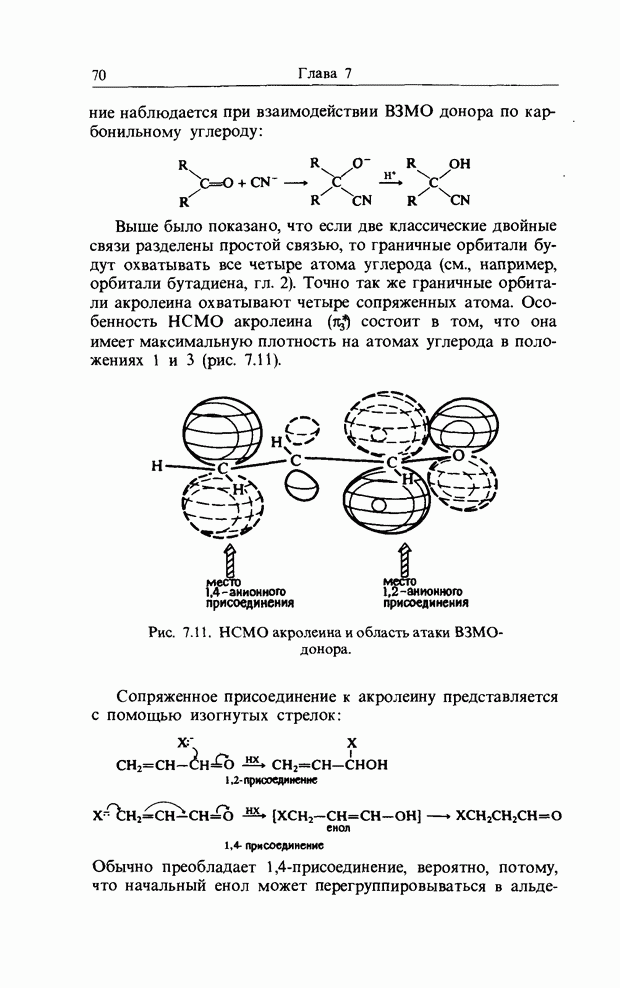
или  эндо-Присоединение предпочтительнее экзо-присоединения, так как ему соответствуют вторичные орбитальные взаимодействия, показанные точечными линиями (рис. 12.4).
эндо-Присоединение предпочтительнее экзо-присоединения, так как ему соответствуют вторичные орбитальные взаимодействия, показанные точечными линиями (рис. 12.4).

4,6-циклолрисоединение (включает  атомов;
атомов;  , т.е. нечетно)
, т.е. нечетно)

Рис. 12.4.
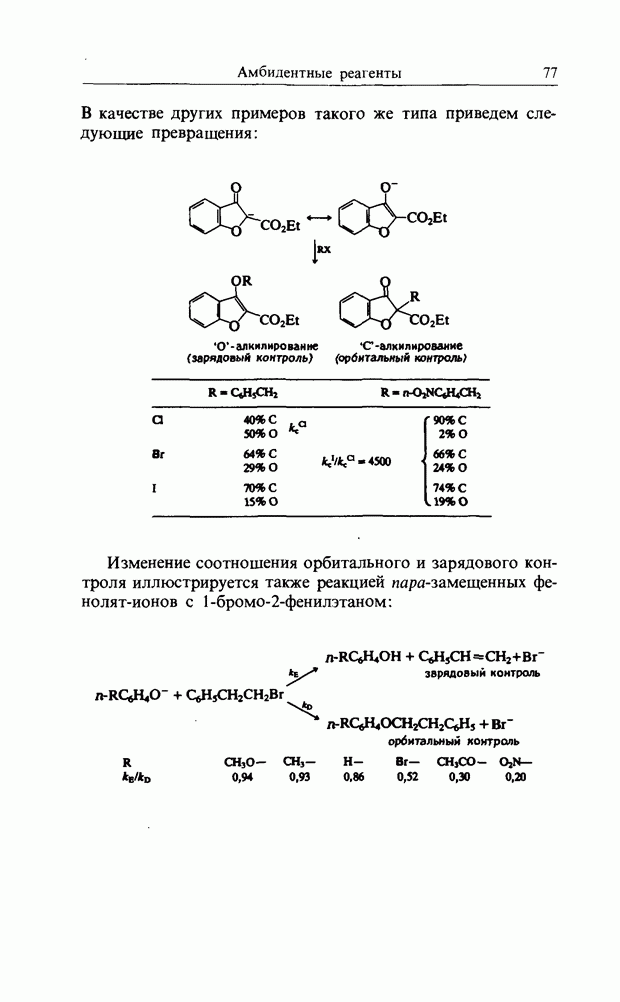
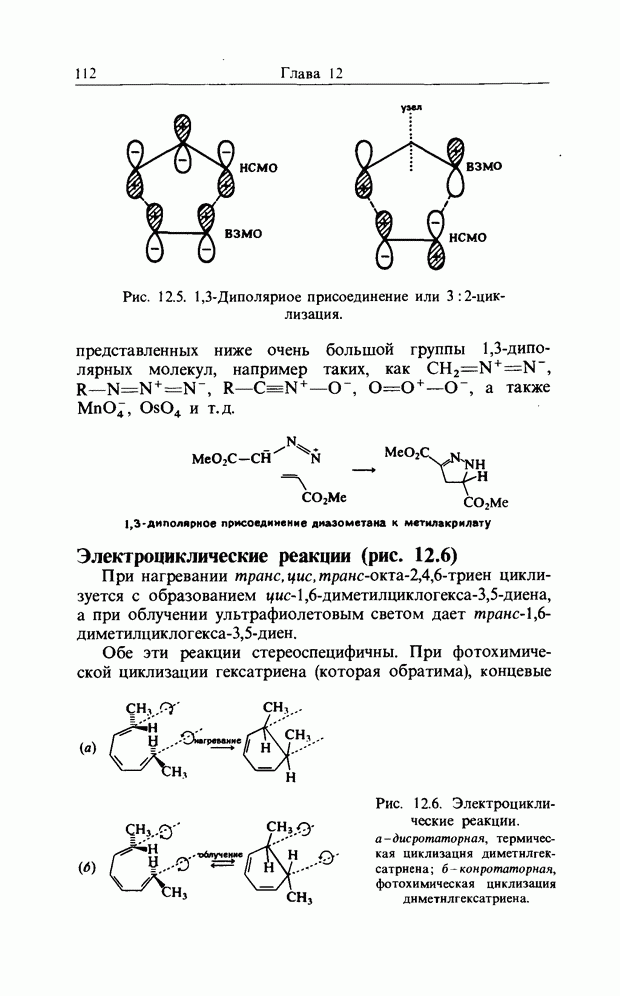
1,3-Диполяриое циклоприсоединение или 3:2-циклизация
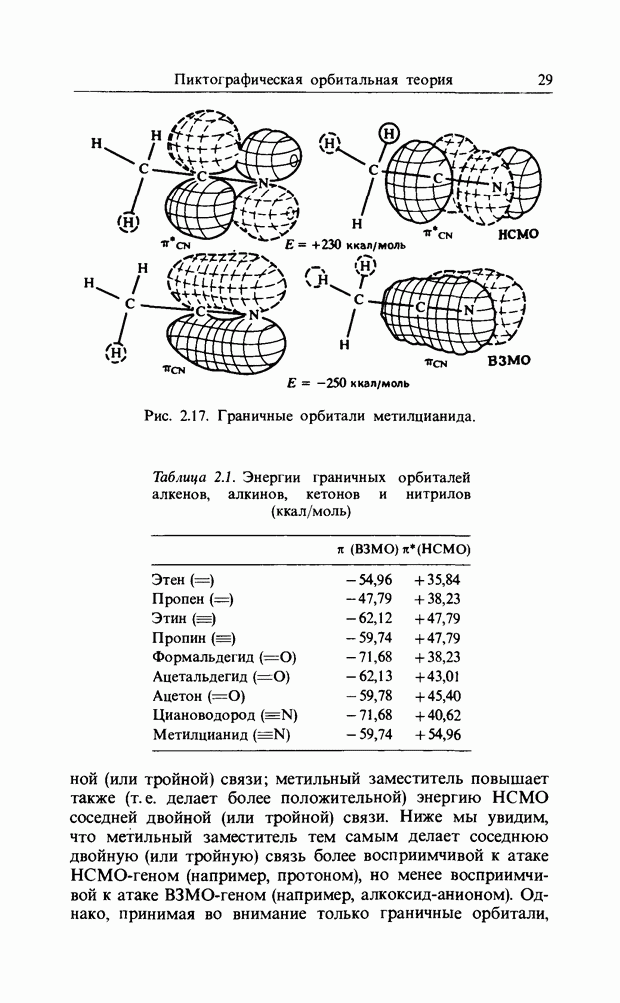
С реакциями Дильса-Альдера тесно связаны реакции 1,3-дицолярного циклоприсоединения (рис. 12.5). В этой реакции участвуют шесть электронов на  -эквивалентных орбиталях, распространяющихся на пять (вместо шести) атомов. Трехатомный компонент может быть одной из
-эквивалентных орбиталях, распространяющихся на пять (вместо шести) атомов. Трехатомный компонент может быть одной из

Рис. 12.5. 1,3-Диполярное присоединение или 3:2-циклизация.
представленных ниже очень большой группы  -дипо-лярных молекул, например таких, как
-дипо-лярных молекул, например таких, как  а также
а также  и т.д.
и т.д.

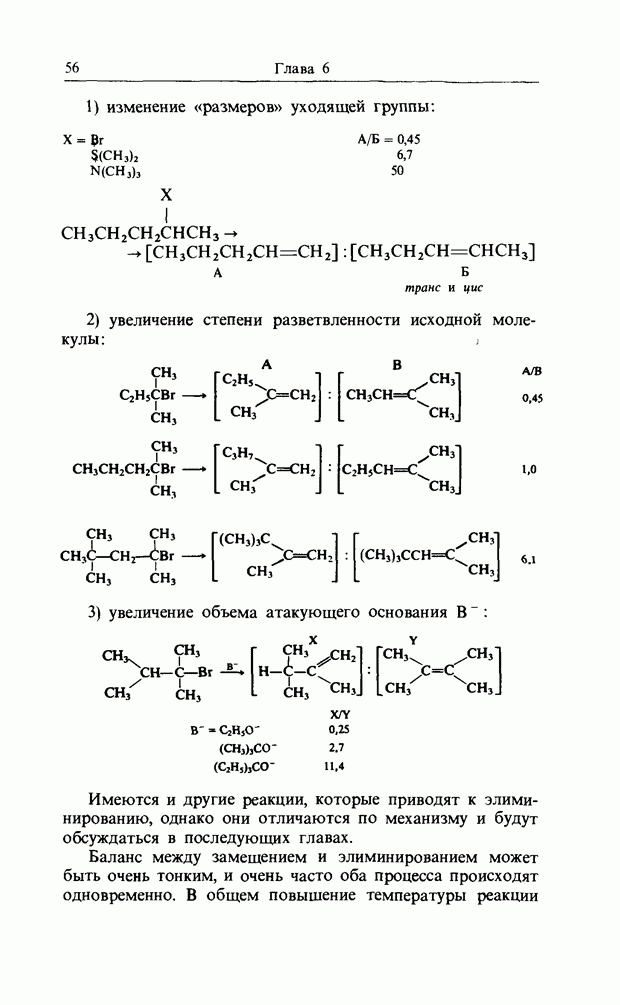
1,3-диполярное присоединение диазометана к метилакрилату
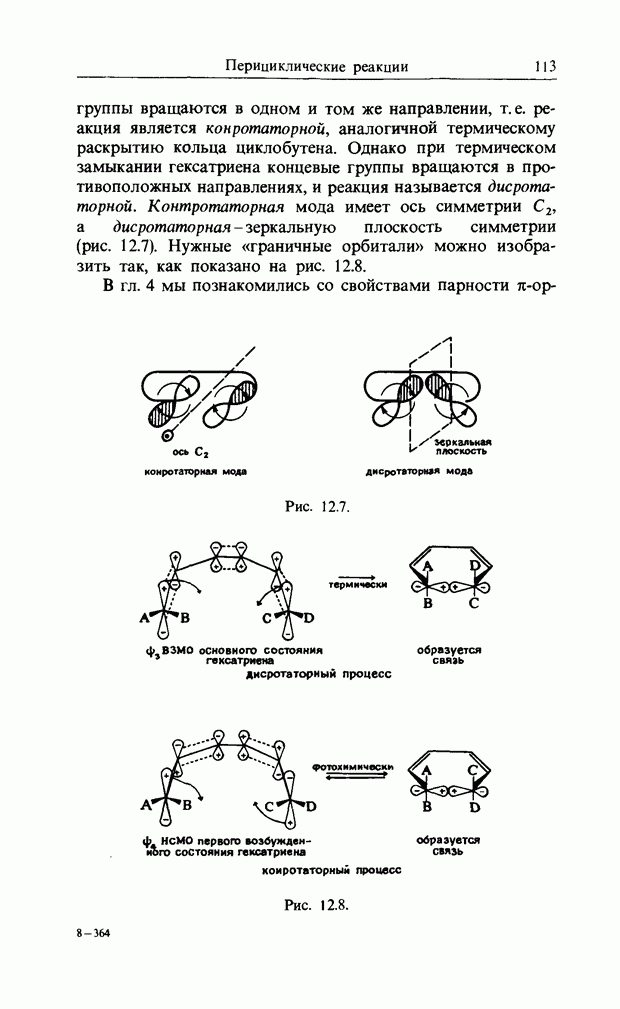
Электроциклические реакции (рис. 12.6)
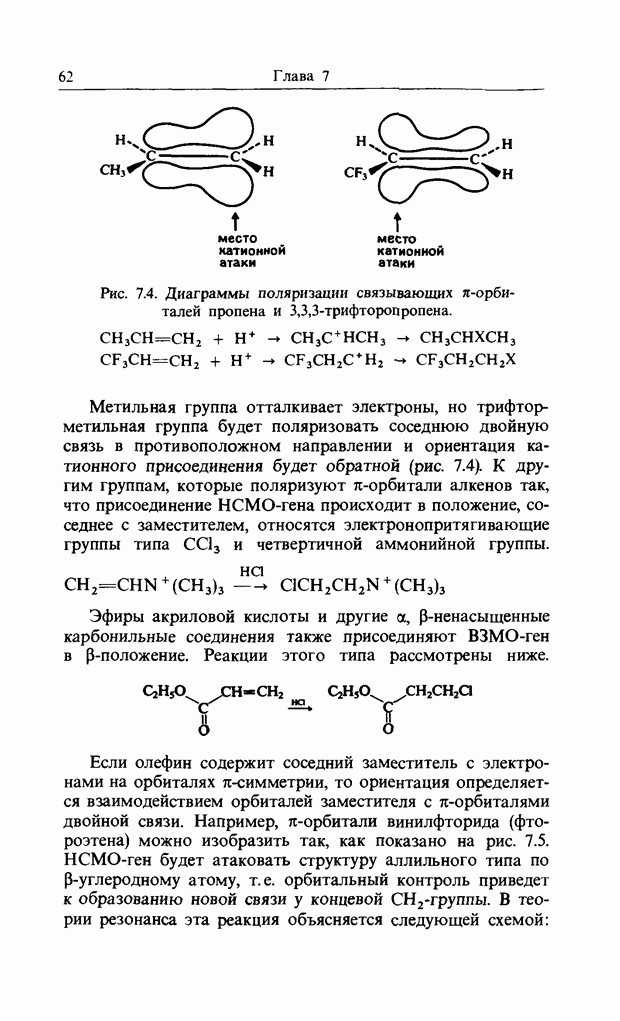
При нагревании транс, цис, транс-окта-2,4,6-триен циклизуется с образованием цис-1,6-диметилциклогекса-3,5-диена, а при облучении ультрафиолетовым светом дает транс-1,6-диметилциклогекса-3,5-диен.
Обе эти реакции стереоспецифичны. При фотохимической циклизации гексатриена (которая обратима), концевые

Рис. 12.6. Электроциклические реакции. а - дисротаторная, термическая циклизация диметилгексатрнена; б - конротаторная, фотохимическая циклизация днметнлгексатриена.
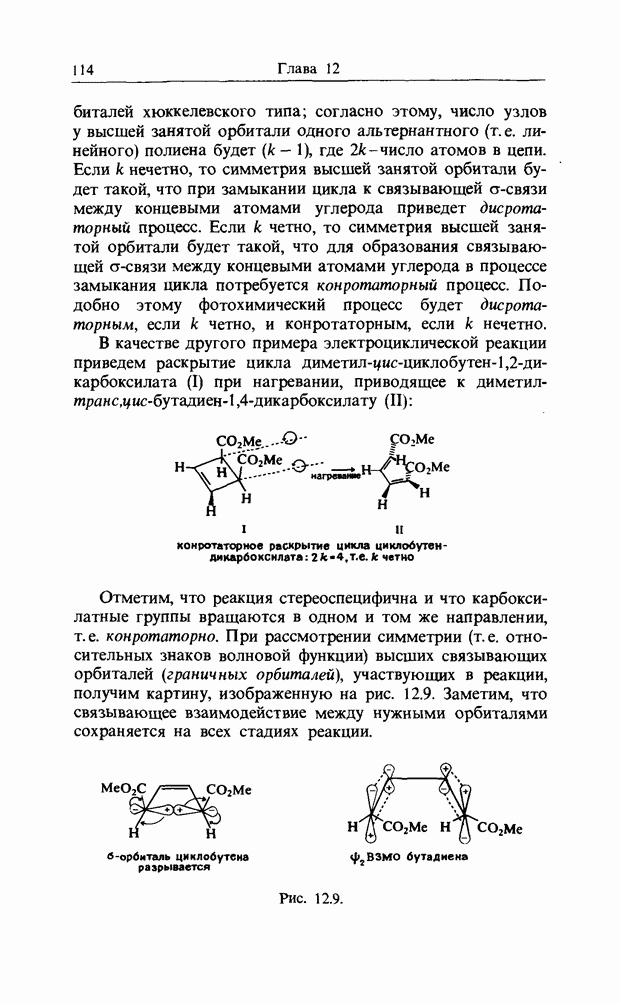
группы вращаются в одном и том же направлении, т.е. реакция является конротаторной, аналогичной термическому раскрытию кольца циклобутена. Однако при термическом замыкании гексатриена концевые группы вращаются в противоположных направлениях, и реакция называется дисротаторной. Контротаторная мода имеет ось симметрии  а дисротаторная - зеркальную плоскость симметрии (рис. 12.7). Нужные «граничные орбитали» можно изобразить так, как показано на рис. 12.8.
а дисротаторная - зеркальную плоскость симметрии (рис. 12.7). Нужные «граничные орбитали» можно изобразить так, как показано на рис. 12.8.
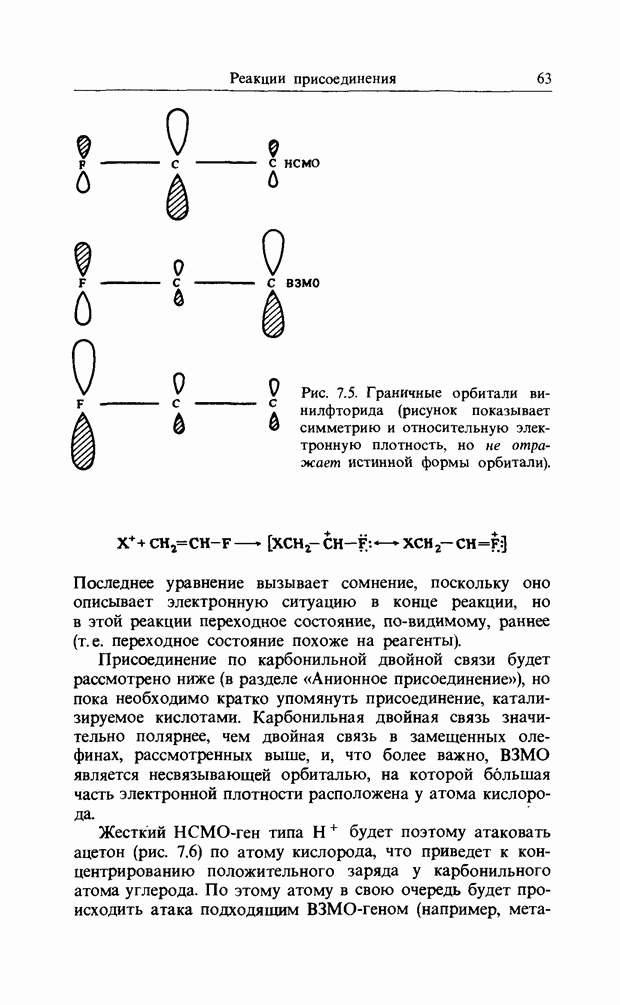
В гл. 4 мы познакомились со свойствами парности  -орбиталей
-орбиталей

Рис. 12.8.
хюккелевского типа; согласно этому, число узлов у высшей занятой орбитали одного альтернантного (т. е. линейного) полиена будет (к — 1), где  - число атомов в цепи. Если к нечетно, то симметрия высшей занятой орбитали будет такой, что при замыкании цикла к связывающей
- число атомов в цепи. Если к нечетно, то симметрия высшей занятой орбитали будет такой, что при замыкании цикла к связывающей  -связи между концевыми атомами углерода приведет дисротаторный процесс. Если к четно, то симметрия высшей занятой орбитали будет такой, что для образования связывающей
-связи между концевыми атомами углерода приведет дисротаторный процесс. Если к четно, то симметрия высшей занятой орбитали будет такой, что для образования связывающей  -связи между концевыми атомами углерода в процессе замыкания цикла потребуется конротаторный процесс. Подобно этому фотохимический процесс будет дисротаторным, если к четно, и конротаторным, если к нечетно.
-связи между концевыми атомами углерода в процессе замыкания цикла потребуется конротаторный процесс. Подобно этому фотохимический процесс будет дисротаторным, если к четно, и конротаторным, если к нечетно.
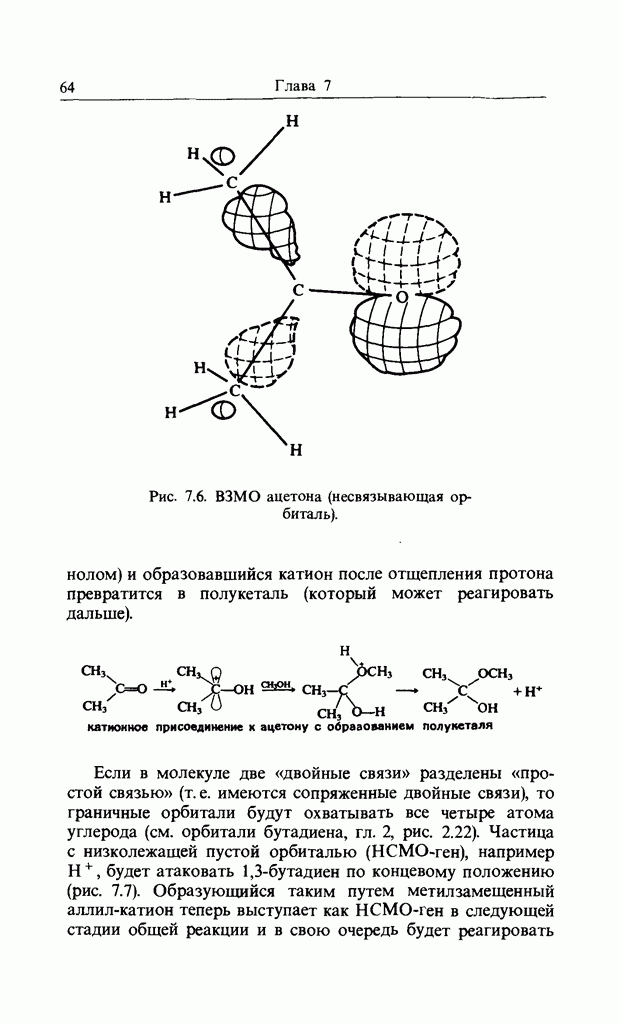
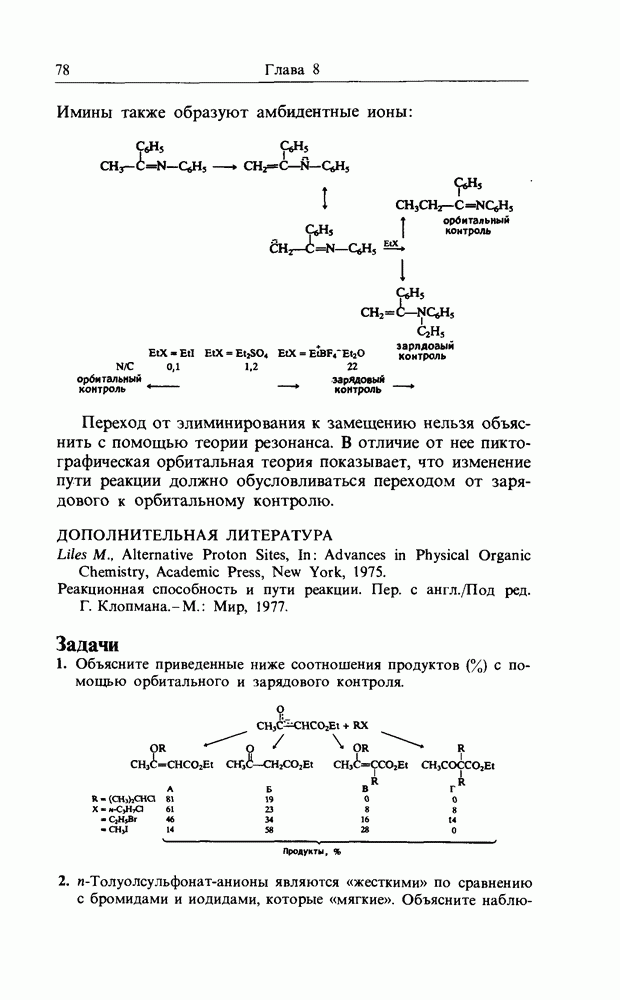
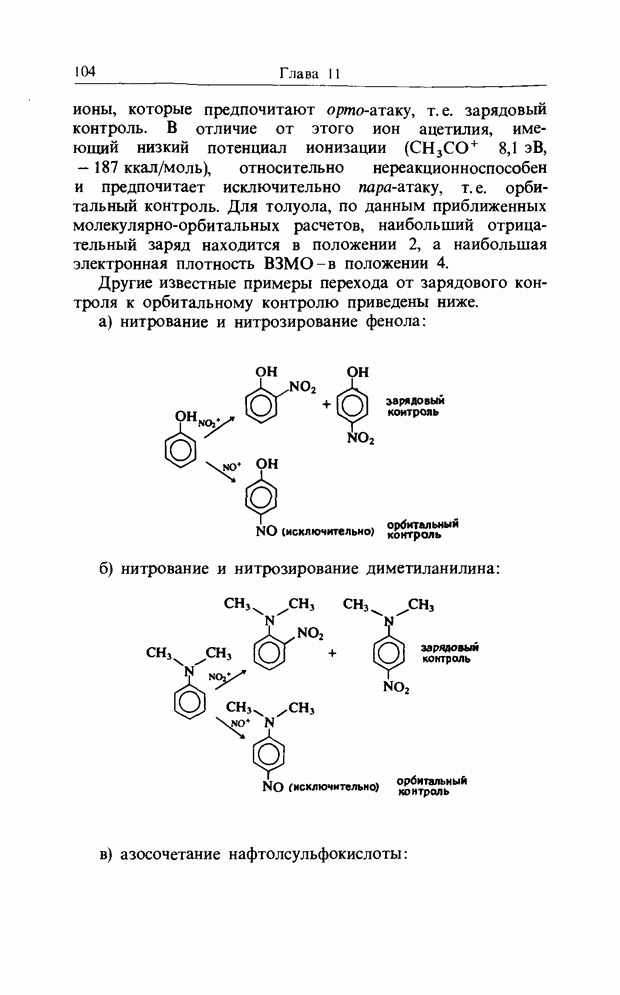
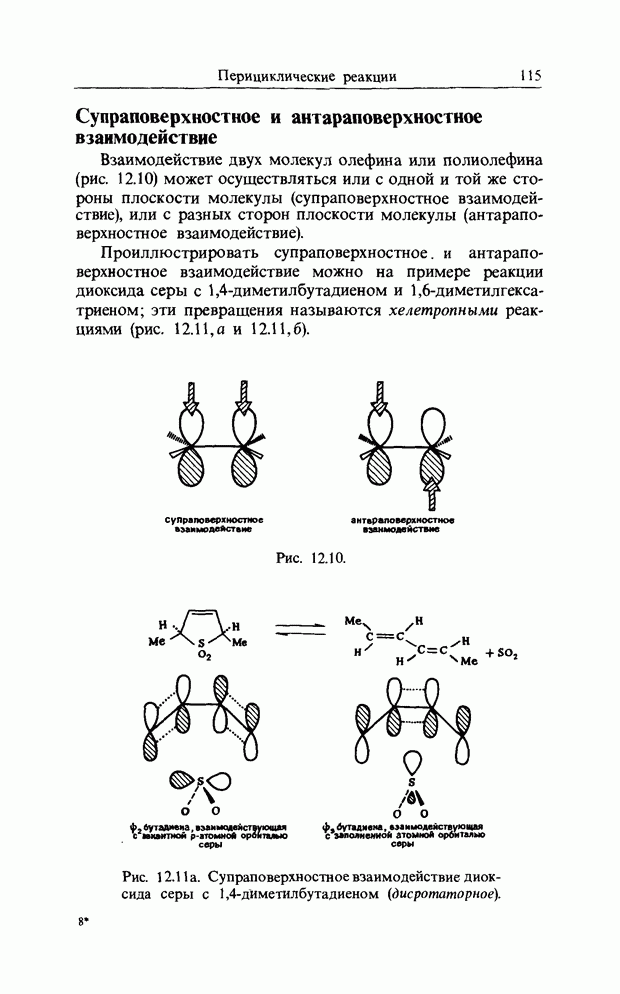
В качестве другого примера электроциклической реакции приведем раскрытие цикла диметил-цис-циклобутен-1,2-ди-карбоксилата (I) при нагревании, приводящее к диметил-транс,цис-бутадиен-1,4-дикарбоксилату (II):

конротаторное раскрытие цикла циклобутен-дикарбоксилата
Отметим, что реакция стереоспецифична и что карбоксилатные группы вращаются в одном и том же направлении, т.е. конротаторно. При рассмотрении симметрии (т.е. относительных знаков волновой функции) высших связывающих орбиталей (граничных орбиталей), участвующих в реакции, получим картину, изображенную на рис. 12.9. Заметим, что связывающее взаимодействие между нужными орбиталями сохраняется на всех стадиях пеакиии.

Рис. 12.9.
Супраповерхностное и антараповерхностное взаимодействие
Взаимодействие двух молекул олефина или полиолефина (рис. 12.10) может осуществляться или с одной и той же стороны плоскости молекулы (супраповерхностное взаимодействие), или с разных сторон плоскости молекулы (антараповерхностное взаимодействие).
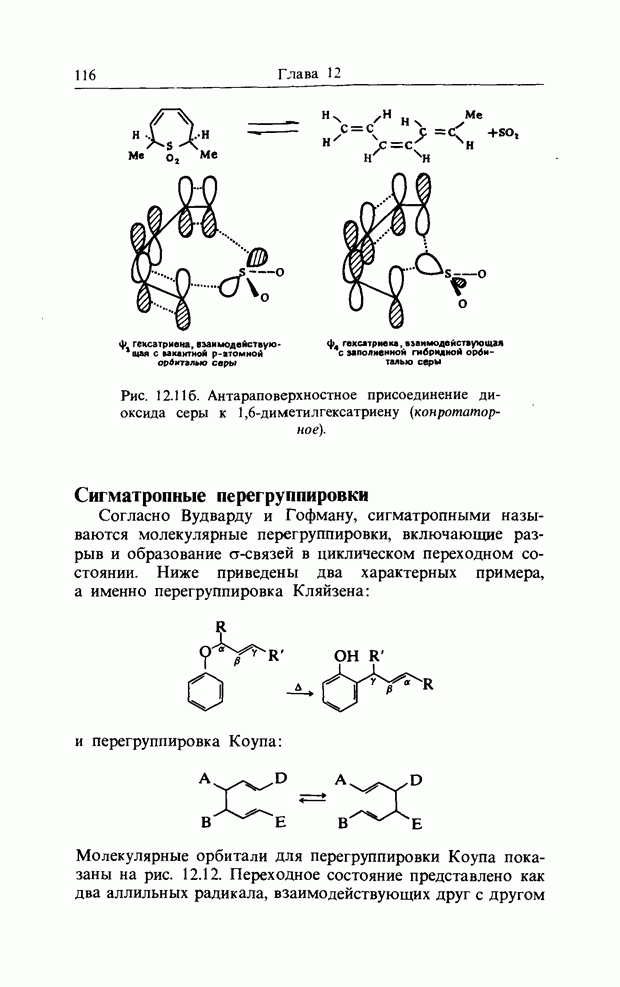
Проиллюстрировать супраповерхностное. и антараповерхностное взаимодействие можно на примере реакции диоксида серы с 1,4-диметилбутадиеном и 1,6-диметилгекса-триеном; эти превращения называются хелетропными реакциями (рис. 12.11, а и 12.11,б).

Рис. 12.11 a. Супраповерхностное взаимодействие диоксида серы с 1,4-диметилбутадиеном (дисротаторное).

Рис. 12.116. Антараповерхностное присоединение диоксида серы к 1,6-диметилгексатриену (конротатор-ное).
Сигматропные перегруппировки
Согласно Вудварду и Гофману, сигматропными называются молекулярные перегруппировки, включающие разрыв и образование  -связей в циклическом переходном состоянии. Ниже приведены два характерных примера, а именно перегруппировка Кляйзена:
-связей в циклическом переходном состоянии. Ниже приведены два характерных примера, а именно перегруппировка Кляйзена:

и перегруппировка Коупа:

Молекулярные орбитали для перегруппировки Коупа показаны на рис. 12.12. Переходное состояние представлено как два аллильных радикала, взаимодействующих друг с другом

Рис. 12.12. Граничные орбитали для перегруппировки Коупа (супраповерхностно-супраповерхностной).
супраповерхностно. Реакция, идущая из основного состояния реагента в основное состояние продукта, разрешена по симметрии. Совершенно ясно, как можно представить реакции такого типа, включающие более длинные цепи. Если будем рассматривать перегруппировку Коупа как  -сигма-тропный процесс, где [3,3] означает, что три центра одного реагента реагируют с тремя центрами другого, то возможными будут также и
-сигма-тропный процесс, где [3,3] означает, что три центра одного реагента реагируют с тремя центрами другого, то возможными будут также и  и
и  -процессы. Общее правило заключается в том, что если определить порядок сигматропного процесса как
-процессы. Общее правило заключается в том, что если определить порядок сигматропного процесса как  , когда
, когда  -связь мигрирует через одну или большее число
-связь мигрирует через одну или большее число  -связей в новое положение i, j из первоначального положения
-связей в новое положение i, j из первоначального положения  , то при
, то при  если k нечетно, по симметрии разрешен термический супра-супра-поверхностный процесс, а если к четно, по симметрии разрешен супра-антара (или антара-супра) поверхностный процесс. Фотохимический процесс, наоборот, разрешен по симметрии как супра-антара (или антара-супра Поверхностный процесс, если к нечетно, или как супра-супра-процесс, если к четно.
если k нечетно, по симметрии разрешен термический супра-супра-поверхностный процесс, а если к четно, по симметрии разрешен супра-антара (или антара-супра) поверхностный процесс. Фотохимический процесс, наоборот, разрешен по симметрии как супра-антара (или антара-супра Поверхностный процесс, если к нечетно, или как супра-супра-процесс, если к четно.
Переходное состояние перегруппировки Коупа представлено в виде «кресла» с двумя аллильными фрагментами, реагирующими супра-супра-способом (т. е.  ). В действительности процесс описывается как
). В действительности процесс описывается как  Чтобы точно определить стереохимию, необходимо классифицировать способы реагирования
Чтобы точно определить стереохимию, необходимо классифицировать способы реагирования  -связи. Это можно сделать. следующим способом: если реакция включает или сохранение конфигурации
-связи. Это можно сделать. следующим способом: если реакция включает или сохранение конфигурации  у каждого конца
у каждого конца  -связи, или обращение конфигурации
-связи, или обращение конфигурации  у каждого конца этой связи, то процесс будет обозначаться как супраповерхностный:
у каждого конца этой связи, то процесс будет обозначаться как супраповерхностный:

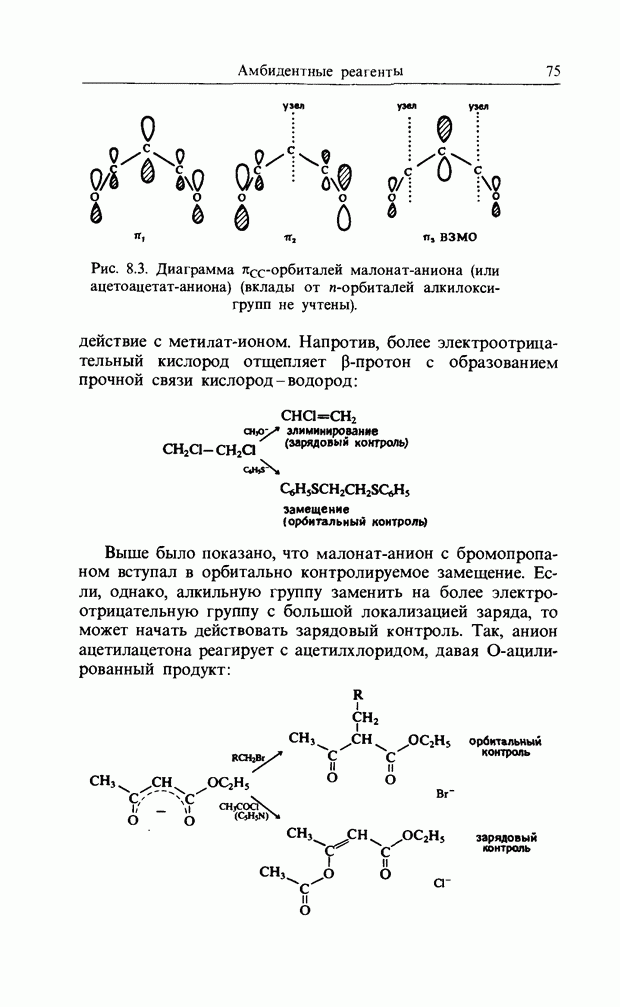
Если реакция включает обращение конфигурации у одного конца  -связи и сохранение у другого, то процесс обозначается как антараповерхностный:
-связи и сохранение у другого, то процесс обозначается как антараповерхностный:

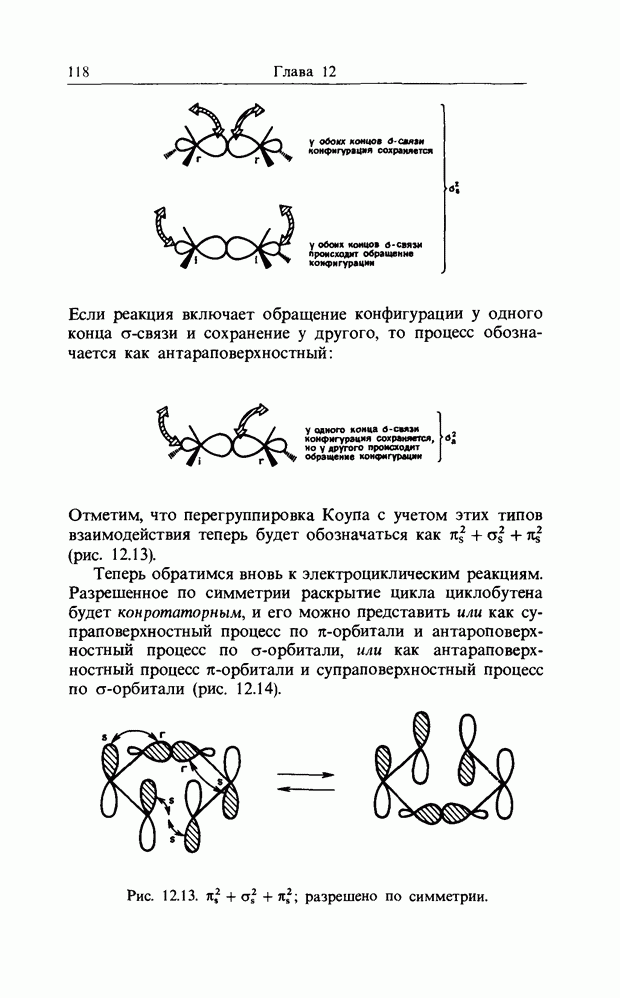
Отметим, что перегруппировка Коупа с учетом этих типов взаимодействия теперь будет обозначаться как  (рис. 12.13).
(рис. 12.13).
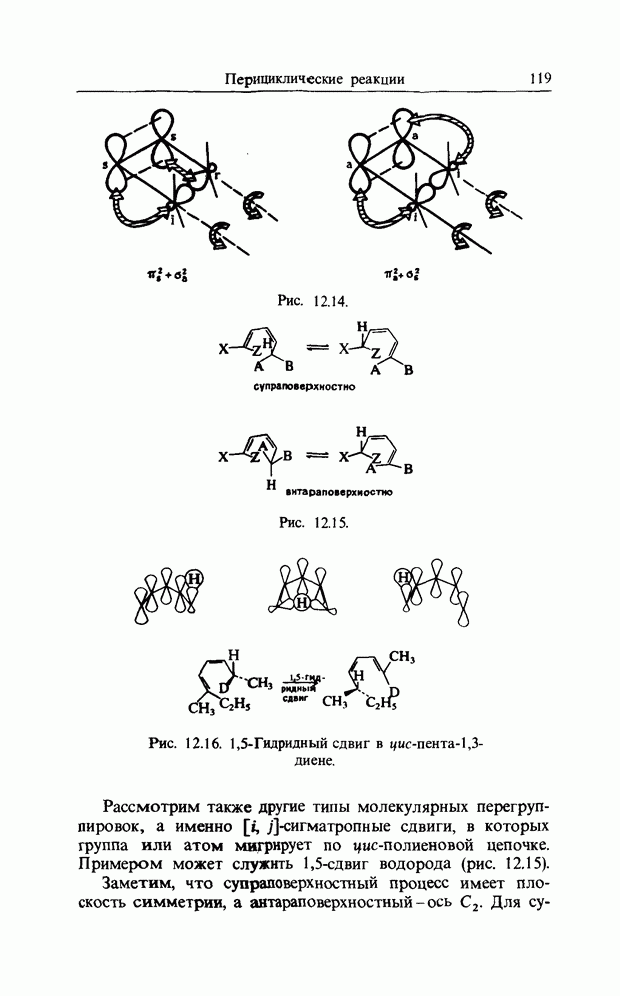
Теперь обратимся вновь к электроциклическим реакциям. Разрешенное по симметрии раскрытие цикла циклобутена будет конротаторным, и его можно представить или как супраповерхностный процесс по  -орбитали и антароповерх-ностный процесс по
-орбитали и антароповерх-ностный процесс по  -орбитали, или как антараповерхностный процесс
-орбитали, или как антараповерхностный процесс  -орбитали и супраповерхностный процесс по
-орбитали и супраповерхностный процесс по  -орбитали (рис. 12.14).
-орбитали (рис. 12.14).

Рис. 12.13.  разрешено по симметрии.
разрешено по симметрии.
(см. скан)
Рис. 12.16. 1,5-Гидридный сдвиг в цис-пента-1,3-диене.
Рассмотрим также другие типы молекулярных перегруппировок, а именно  -сигматропные сдвиги, в которых группа или атом мигрирует по цис-полиеновой цепочке. Примером может служить 1,5-сдвиг водорода (рис. 12.15).
-сигматропные сдвиги, в которых группа или атом мигрирует по цис-полиеновой цепочке. Примером может служить 1,5-сдвиг водорода (рис. 12.15).
Заметим, что супраловерхностный процесс имеет плоскость симметрии, а антараповерхностный-ось  . Для супраповерхностного
. Для супраповерхностного
процесса орбитальное взаимодействие можно представить так, как изображено на рис. 12.16.
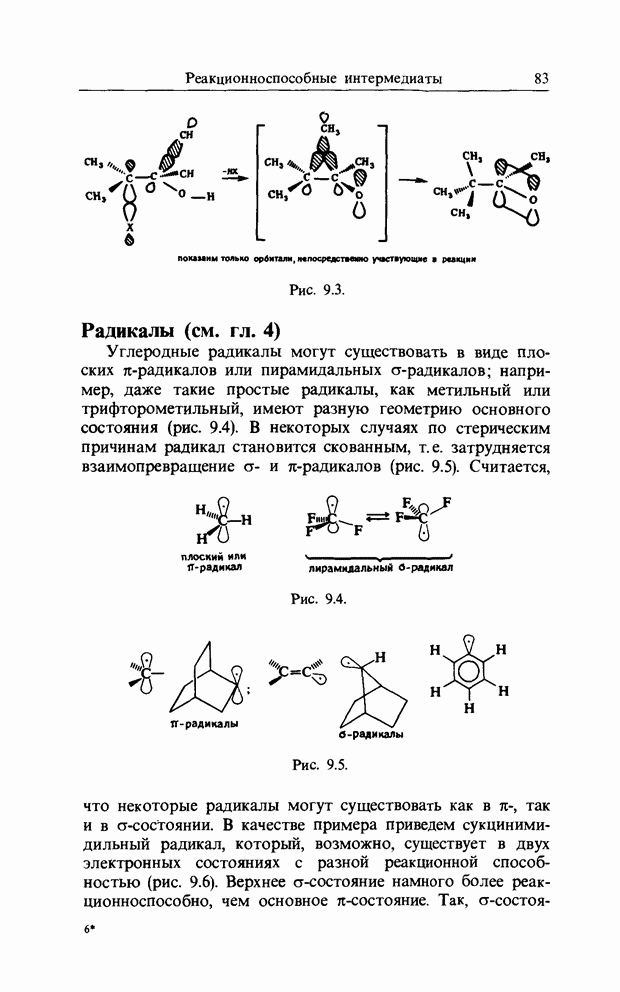
Реакции такого типа широко распространены и очень важны для органической химии. Декарбоксилирование малоновой кислоты и ацетоуксусного эфира уже давно используется в синтезе. Они представляют собой типичные примеры 1,5-гидридного сдвига:

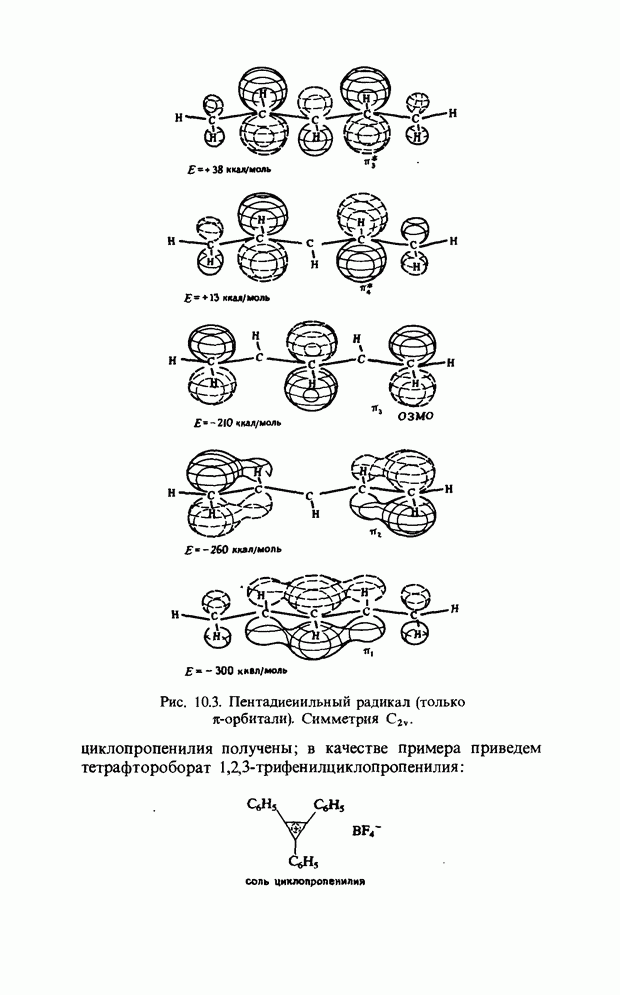
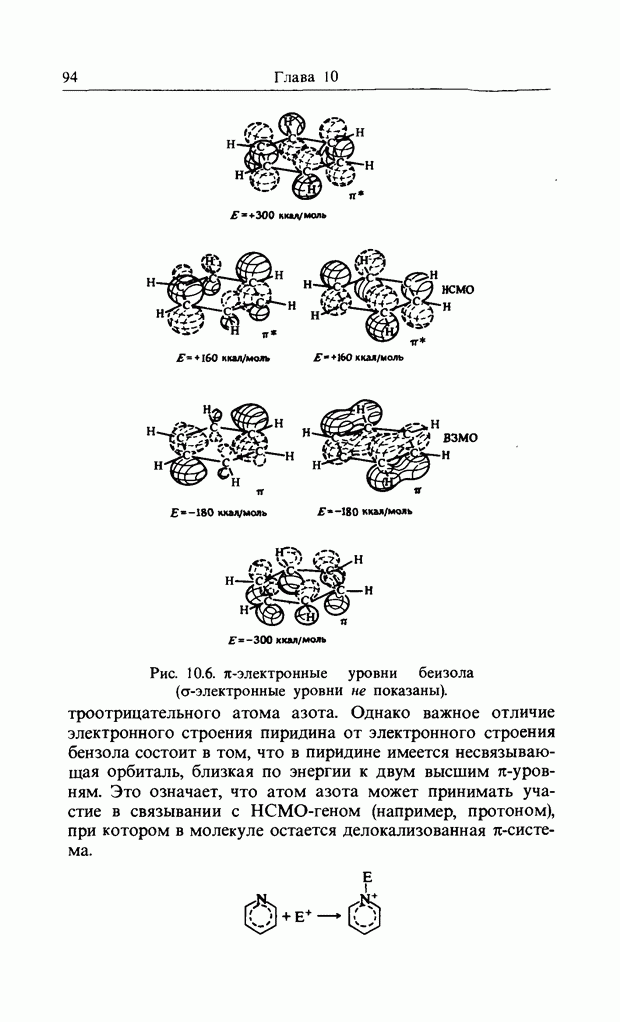
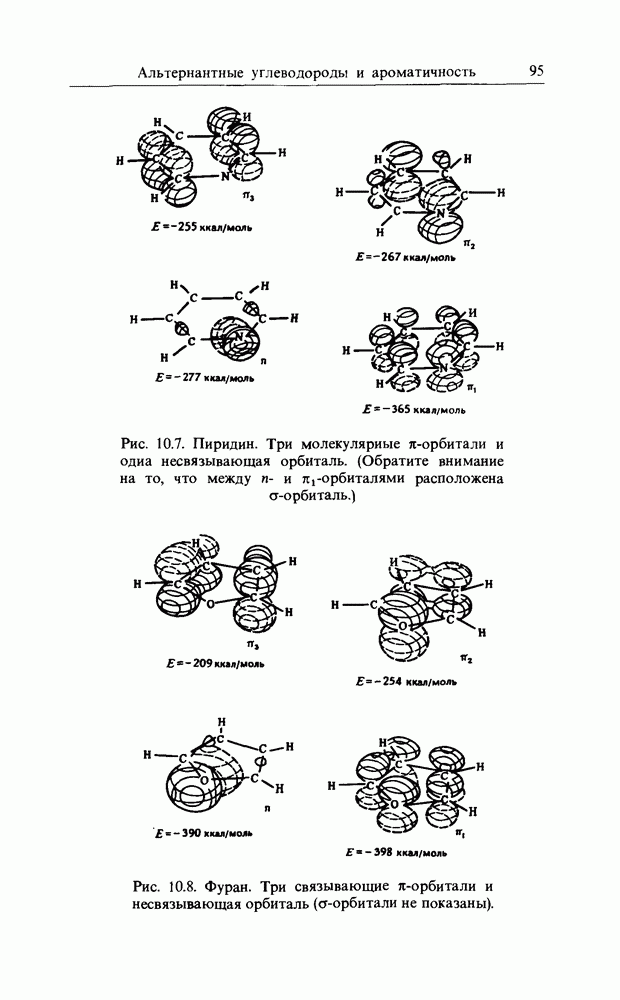
Очень близки к ним реакции образования олефинов из сложных эфиров и виниловых простых эфиров и образования кетена из уксусного ангидрида:

Все реакции, описанные в гл. 12, подчиняются общему правилу. Если  общее число атомов в супра-супраповерх-
общее число атомов в супра-супраповерх-
ностном циклическом процессе, то когда к нечетно, реакция осуществляется в основном состоянии, а когда к четно, супра-супраповерхностная реакция протекает через возбужденное состояние, но супра-антараповерхностный процесс может происходить в основном состоянии.
ДОПОЛНИТЕЛЬНАЯ ЛИТЕРАТУРА
Вудворд Р., Хоффман Р. Сохранение орбитальной симметрии. Пер. с англ.-М.: Мир, 1971. Цжилкрист Т., Сторр Р. Органические реакции и орбитальная симметрия. Пер. с аигл.-М.: Мир, 1976. Gill G. В., Wilkie М. R., Pericyclic Reactions, Chapman and Hall, London, 1974.
Задачи
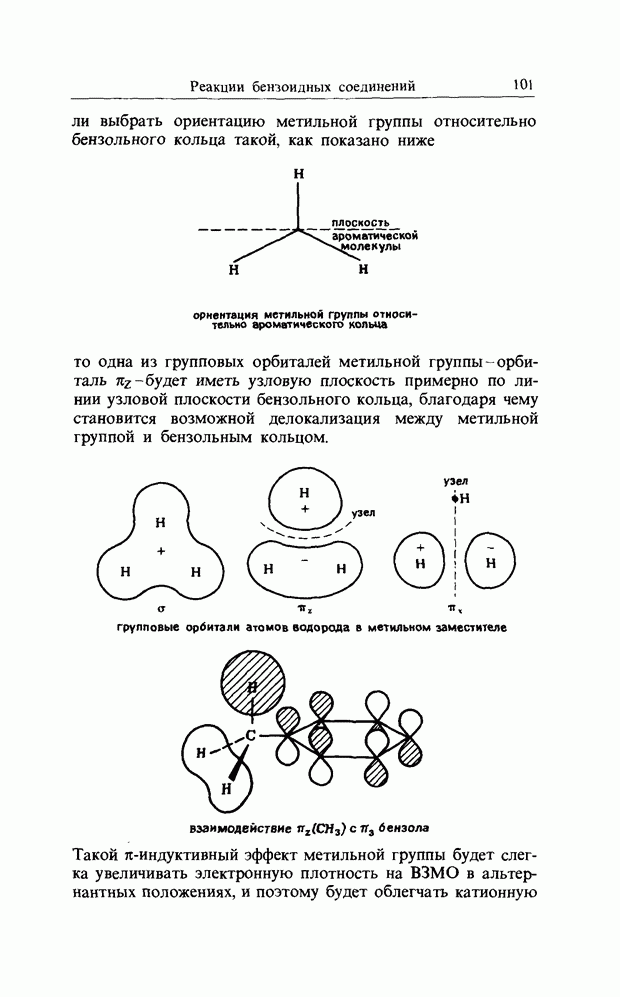
1. Напишите, какие продукты образуются в результате следующих реакций:

2. Используйте рассмотрение граничных орбиталей, чтобы решить, термически или фотохимически будут осуществляться следующие согласованные реакции:

3. Объясните следующую реакцию:

| << Предыдущий параграф |
- ПРЕДИСЛОВИЕ ПЕРЕВОДЧИКА
- ПРЕДИСЛОВИЕ АВТОРОВ К РУССКОМУ ИЗДАНИЮ
- ВВЕДЕНИЕ
- НОМЕНКЛАТУРА
- 1. АТОМНЫЕ И МОЛЕКУЛЯРНЫЕ ОРБИТАЛИ
- 2. ПИКТОГРАФИЧЕСКАЯ ОРБИТАЛЬНАЯ ТЕОРИЯ
- 3. ГИБРИДИЗАЦИЯ И ОРБИТАЛИ ФУНКЦИОНАЛЬНЫХ ГРУПП
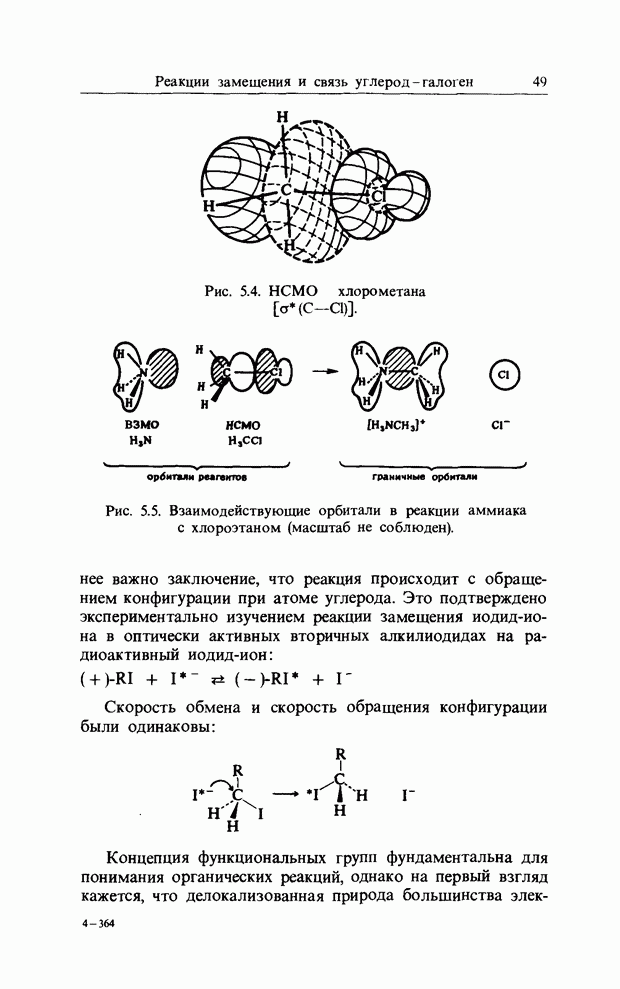
- 4. СВЯЗЬ УГЛЕРОД ВОДОРОД И РЕАКЦИИ ПЕРЕНОСА РАДИКАЛОВ
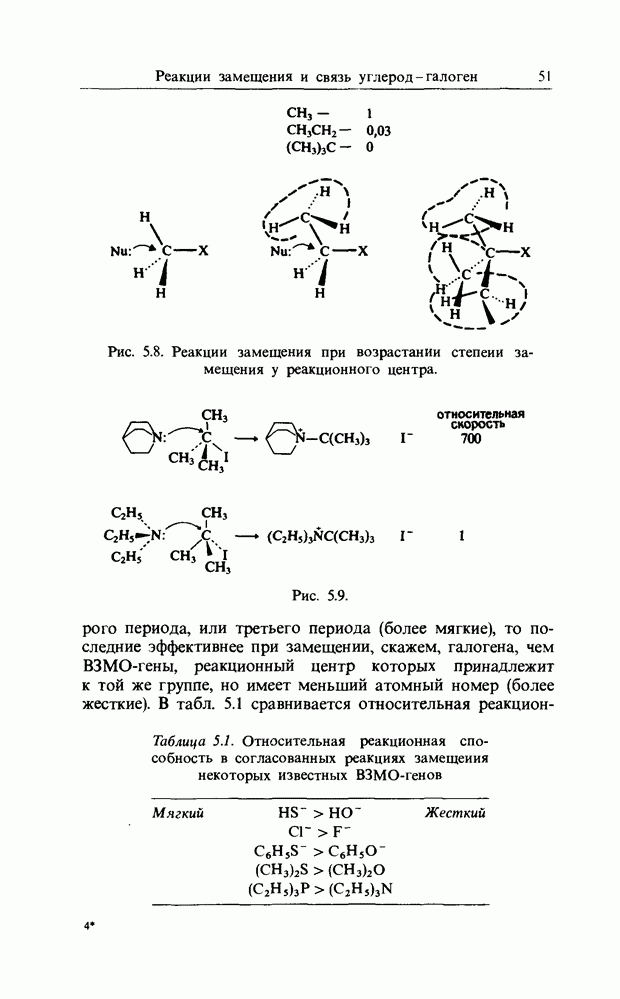
- 5. РЕАКЦИИ ЗАМЕЩЕНИЯ И СВЯЗЬ УГЛЕРОД ГАЛОГЕН
- 6. БИМОЛЕКУЛЯРНЫЕ РЕАКЦИИ ЭЛИМИНИРОВАНИЯ
- 7. РЕАКЦИИ ПРИСОЕДИНЕНИЯ
- 8. АМБИДЕНТНЫЕ РЕАГЕНТЫ
- 9. РЕАКЦИОННОСПОСОБНЫЕ ИНТЕРМЕДИАТЫ
- 10. АЛЬТЕРНАНТНЫЕ УГЛЕВОДОРОДЫ И АРОМАТИЧНОСТЬ
- 11. РЕАКЦИИ БЕНЗОИДНЫХ СОЕДИНЕНИЙ
- 12. ПЕРИЦИКЛИЧЕСКИЕ РЕАКЦИИ