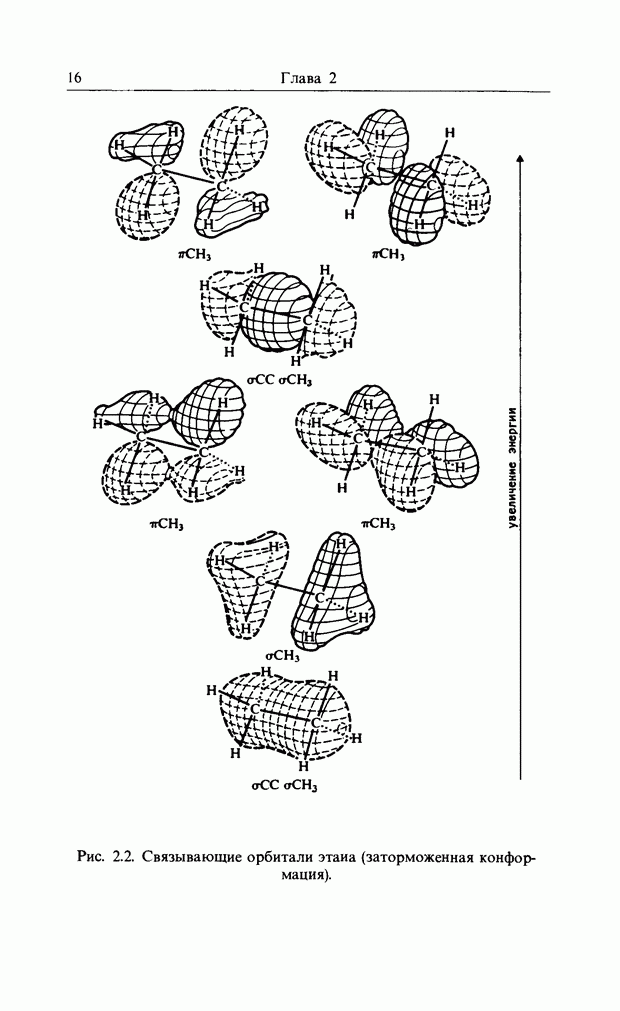
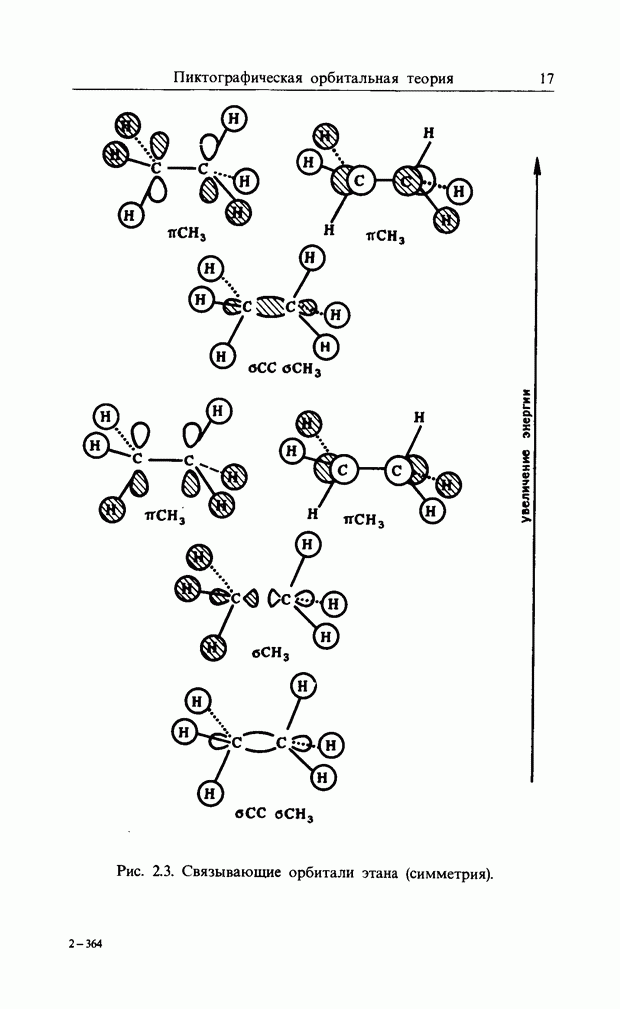
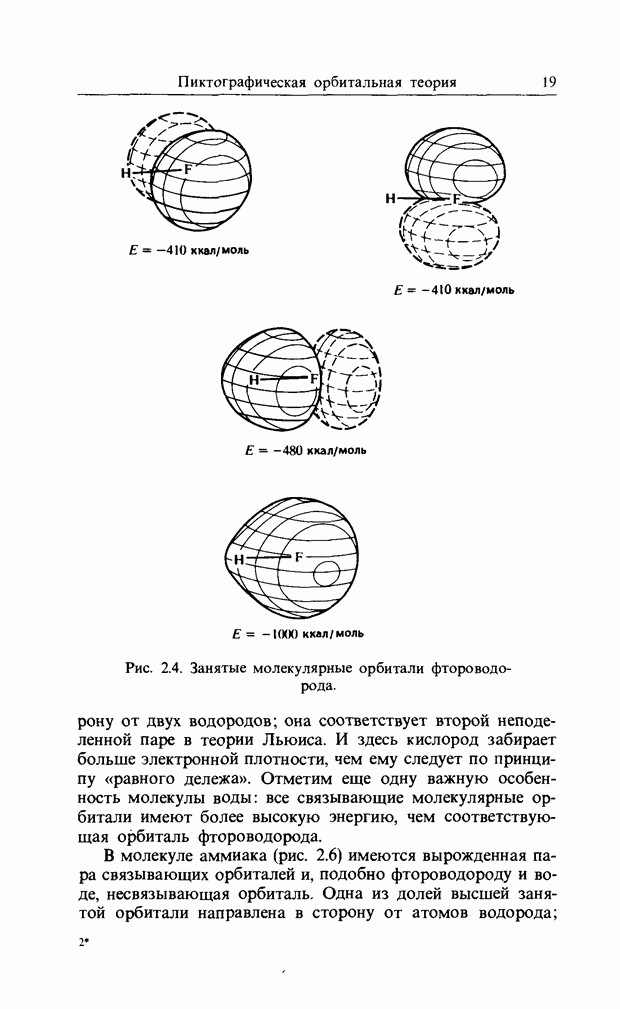
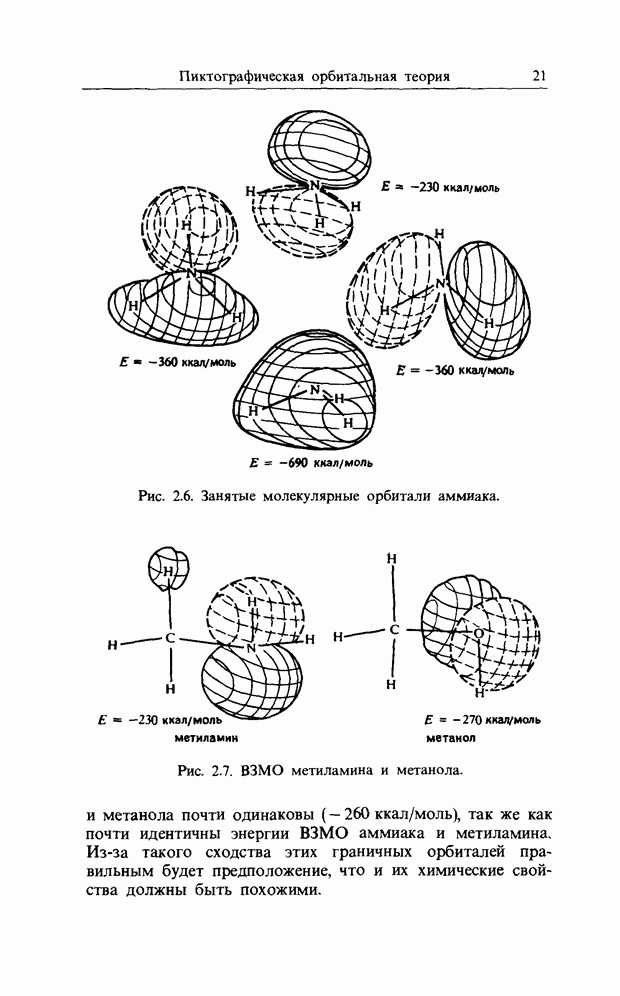
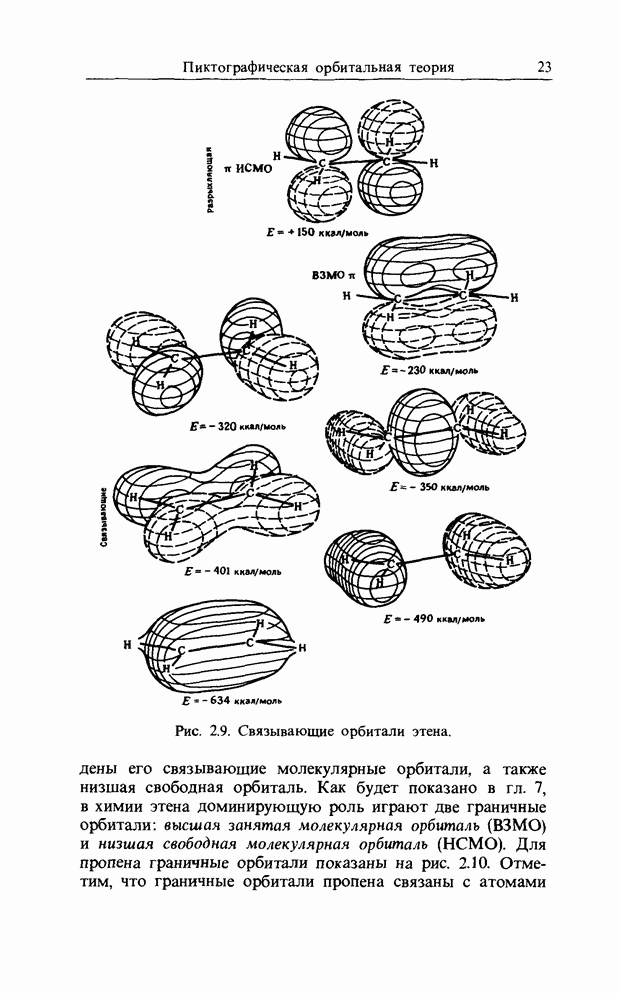
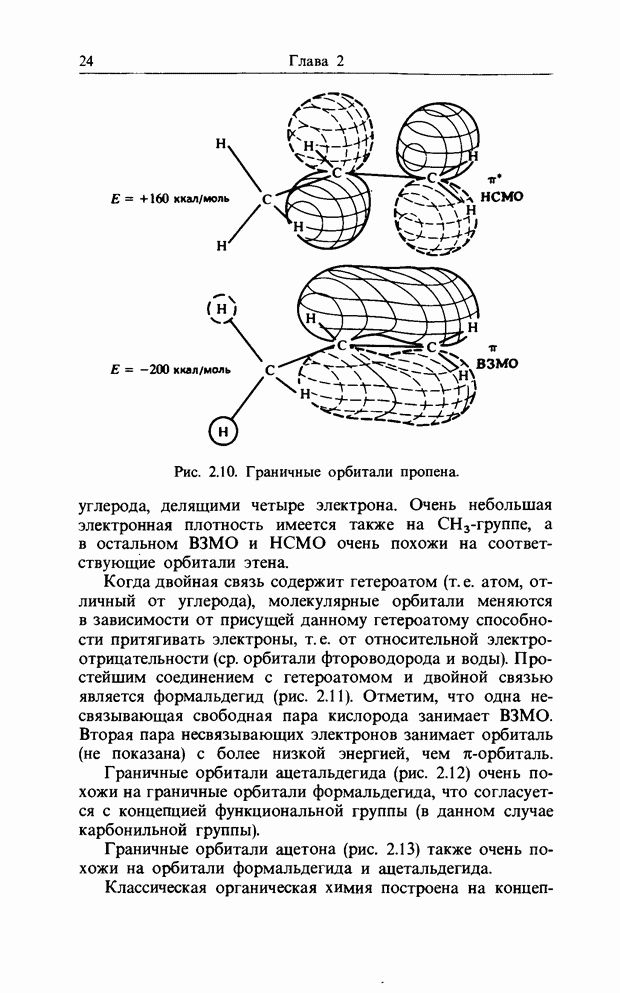
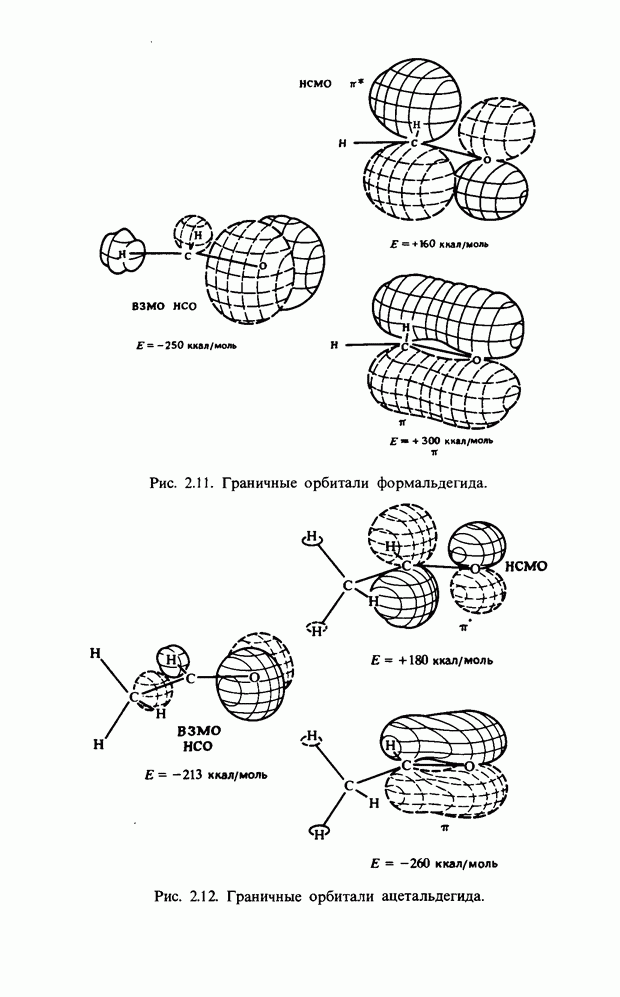
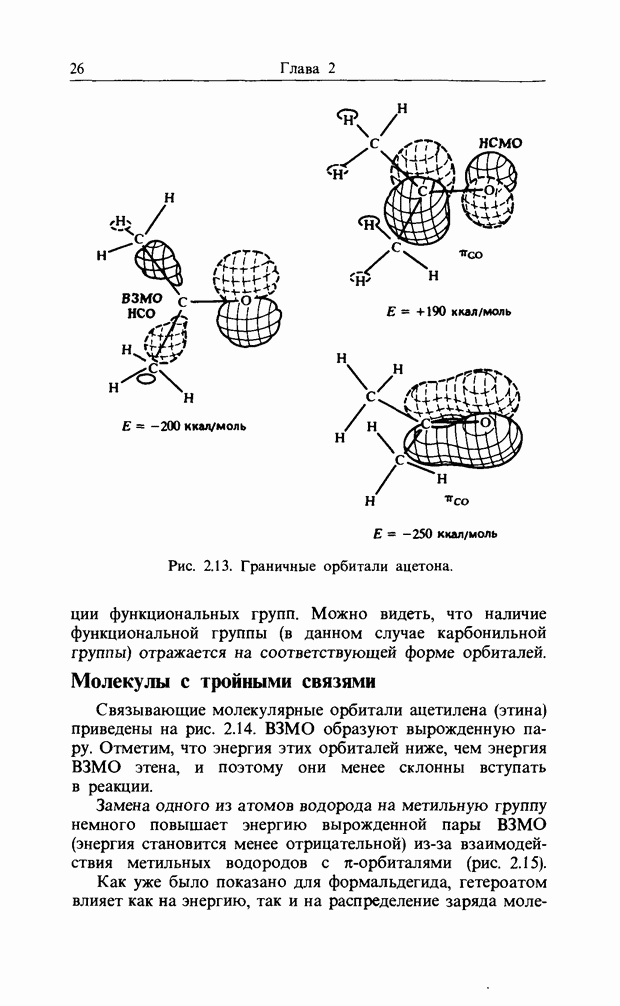
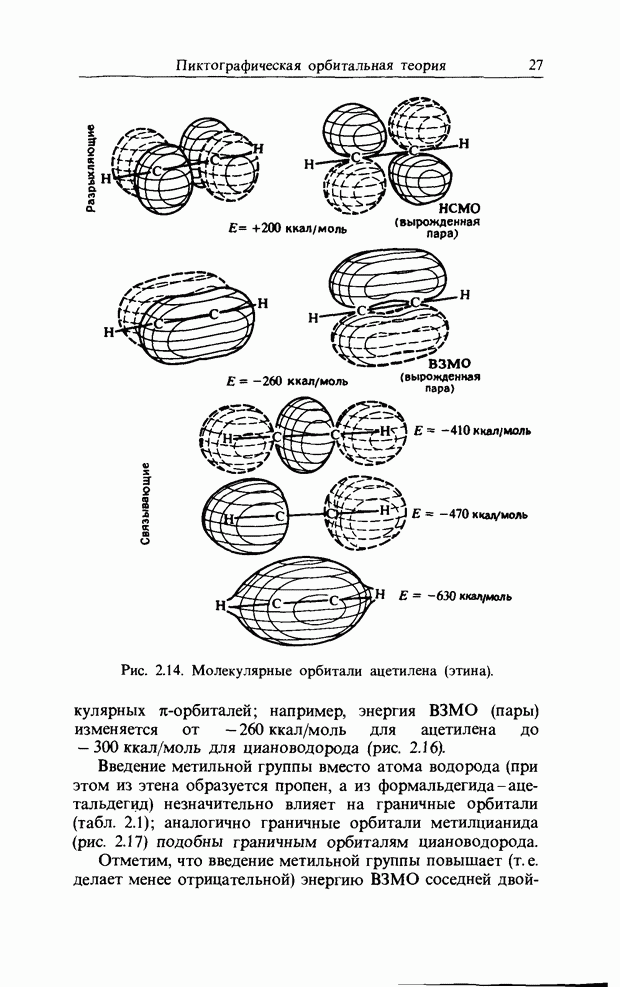
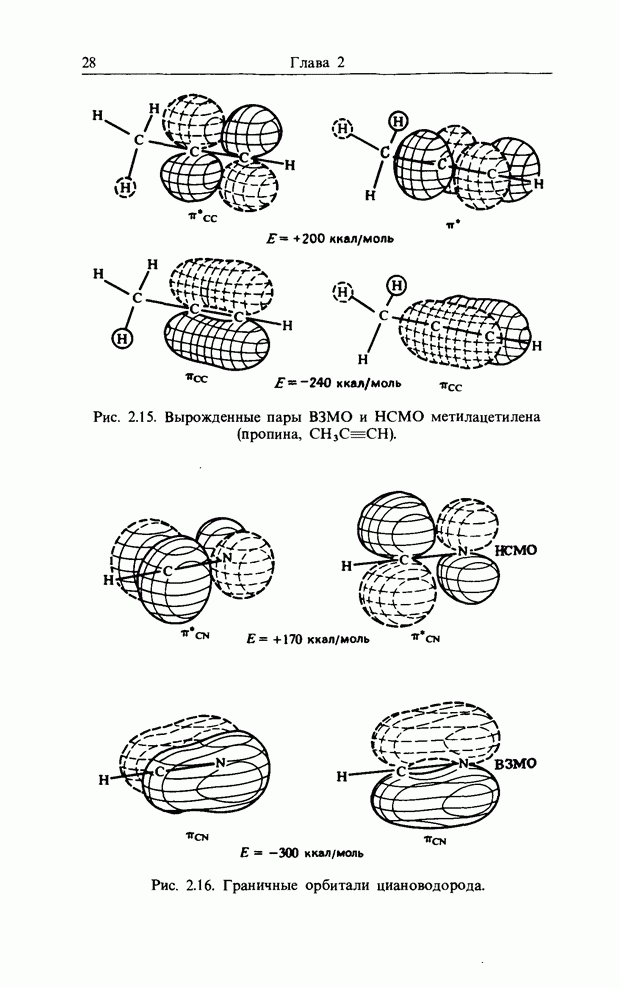
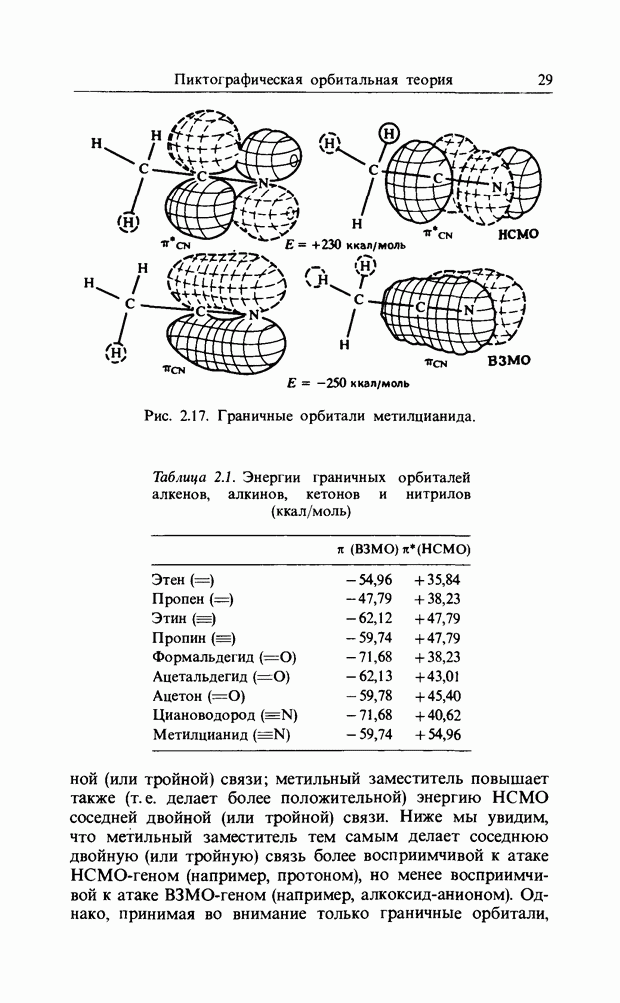
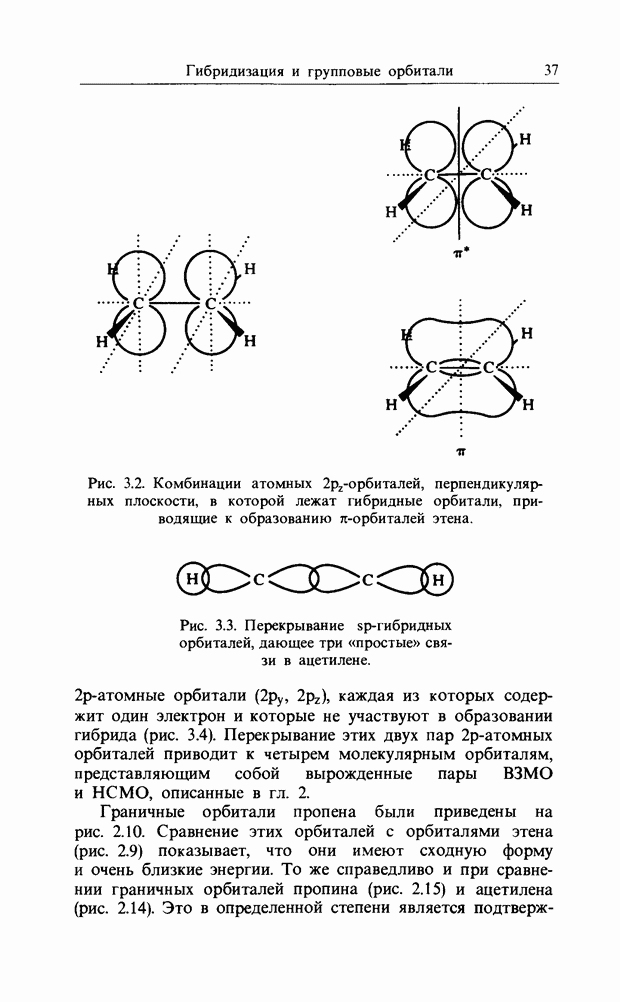
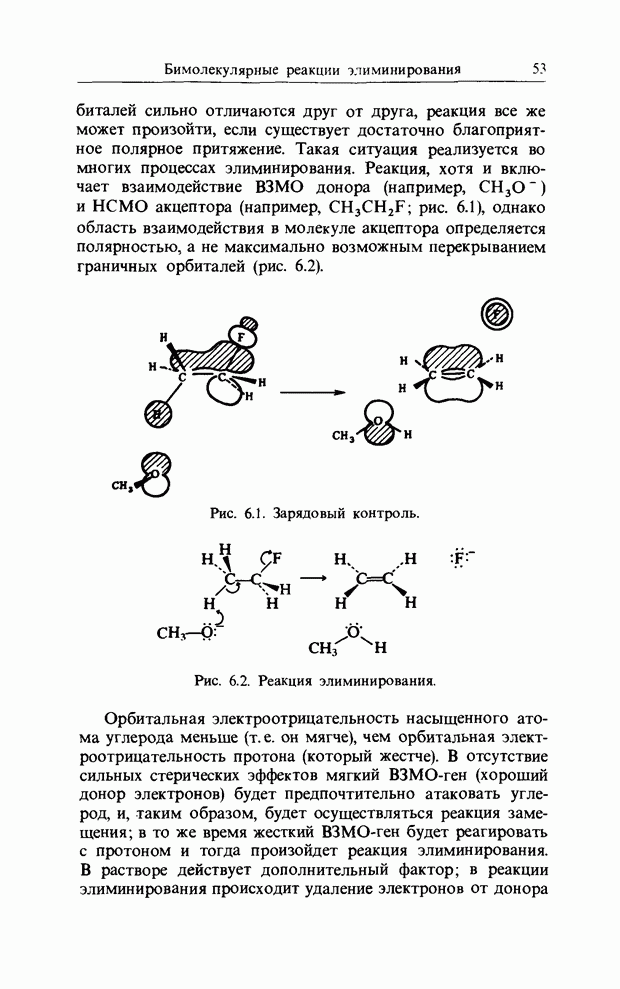
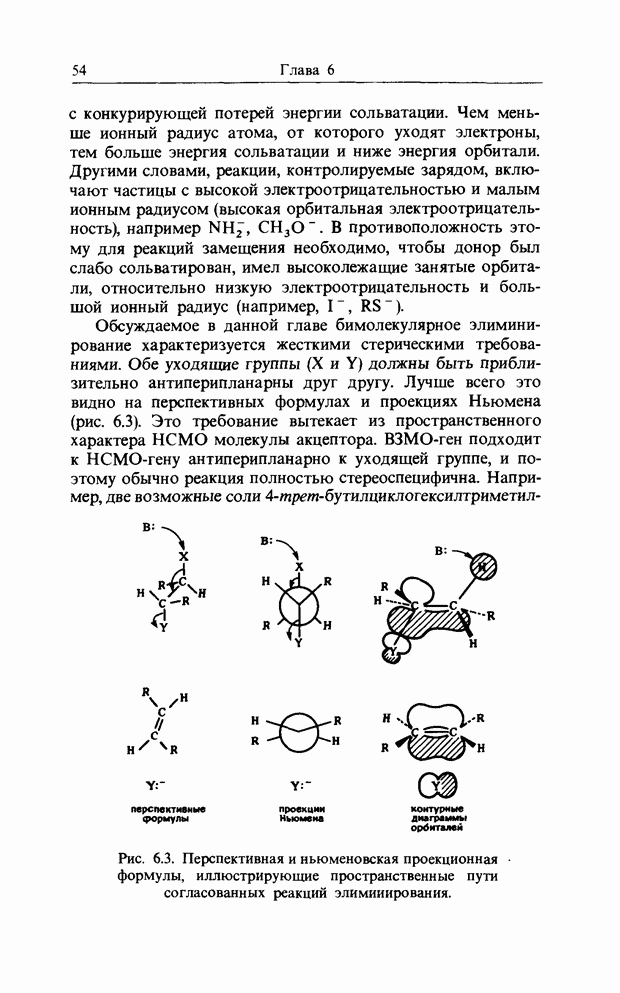
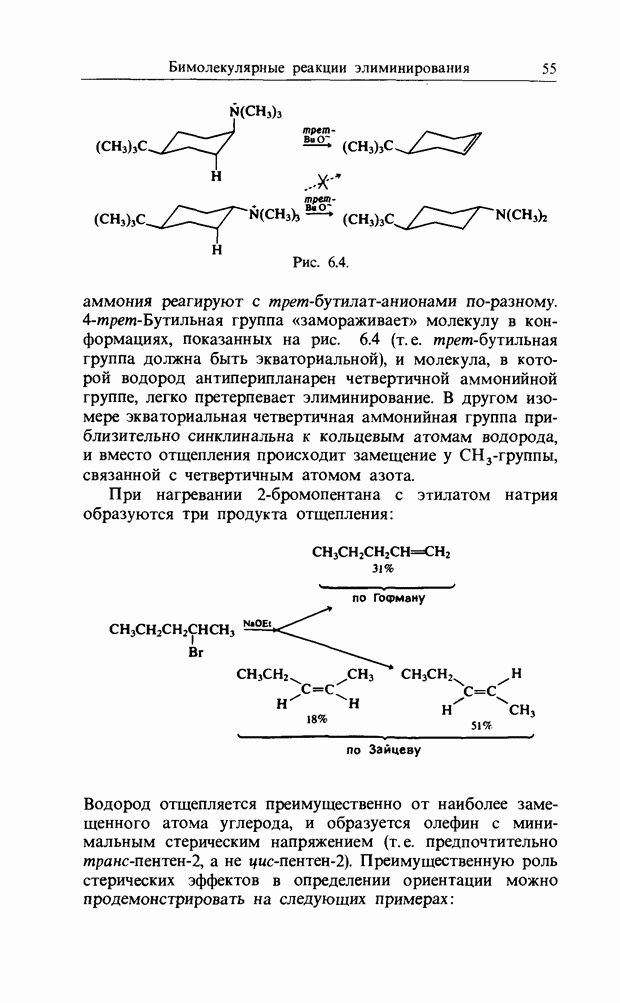
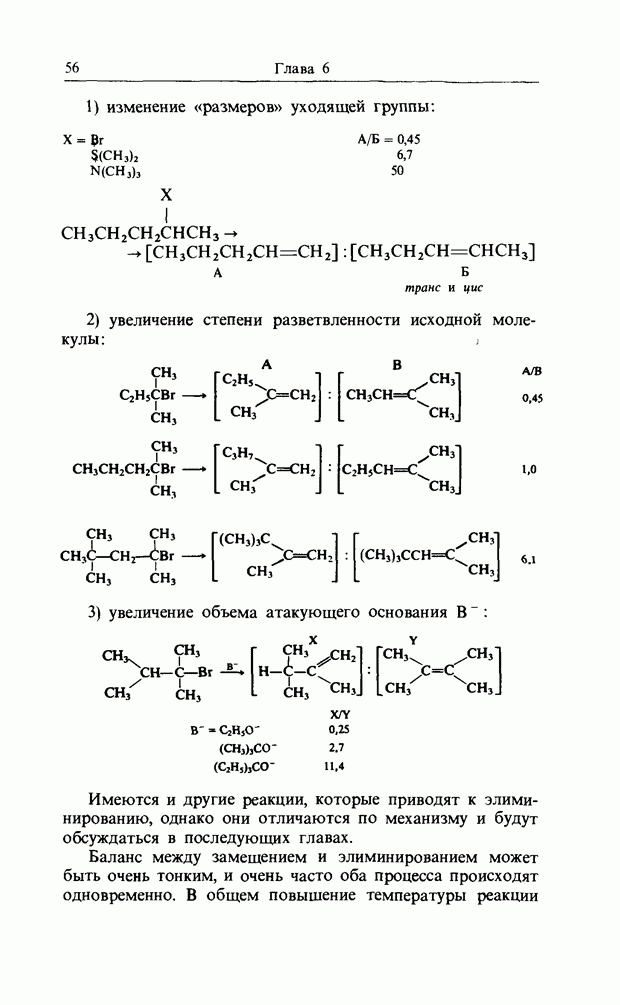
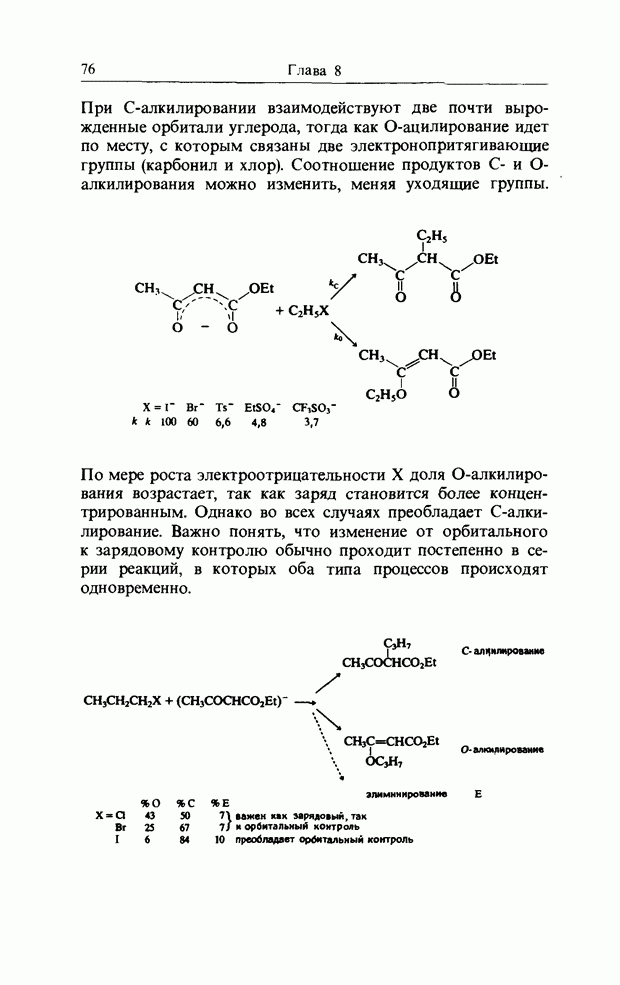
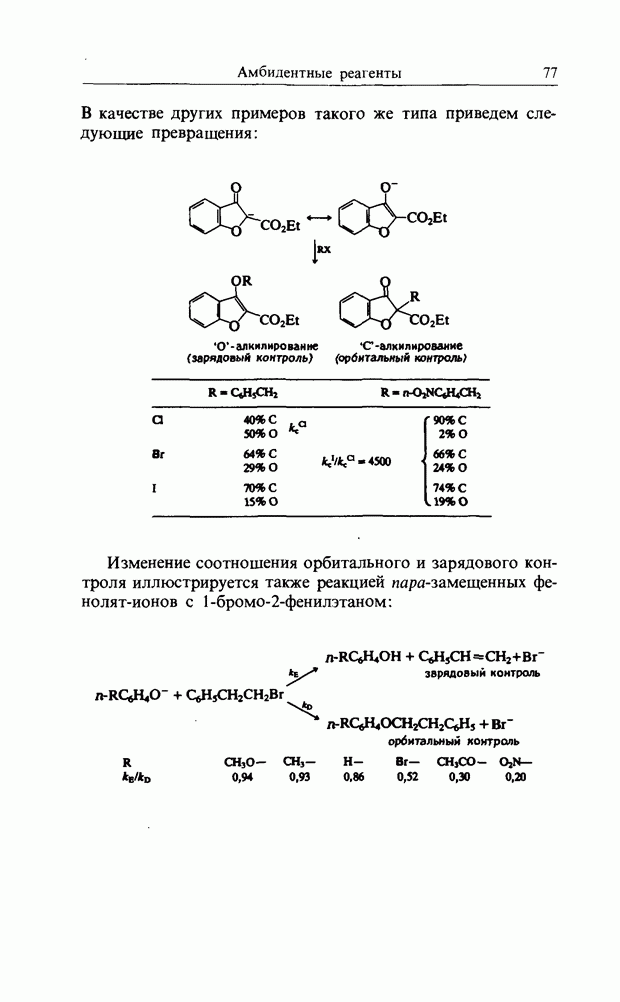
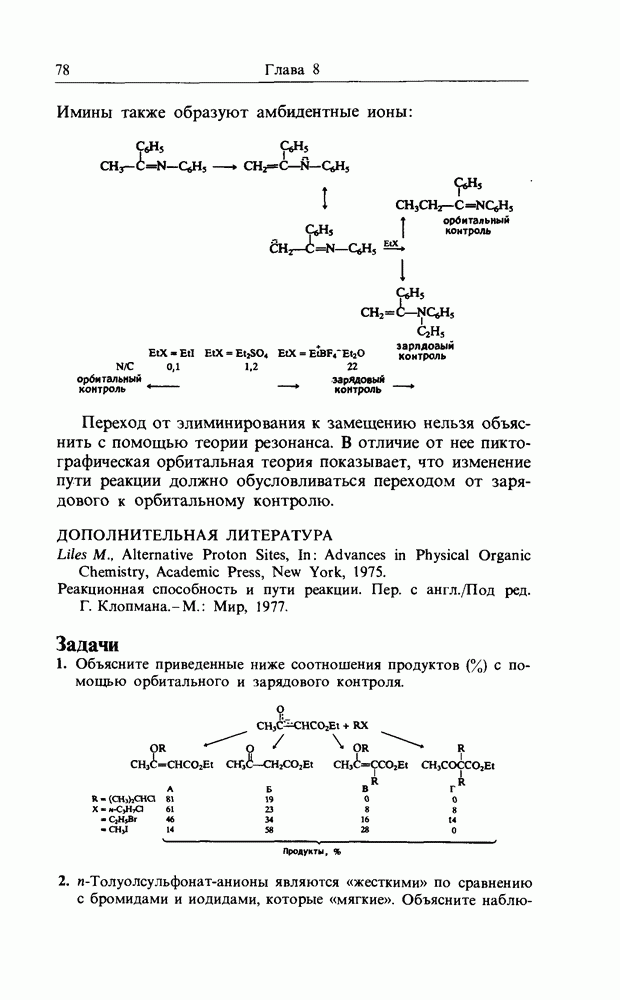
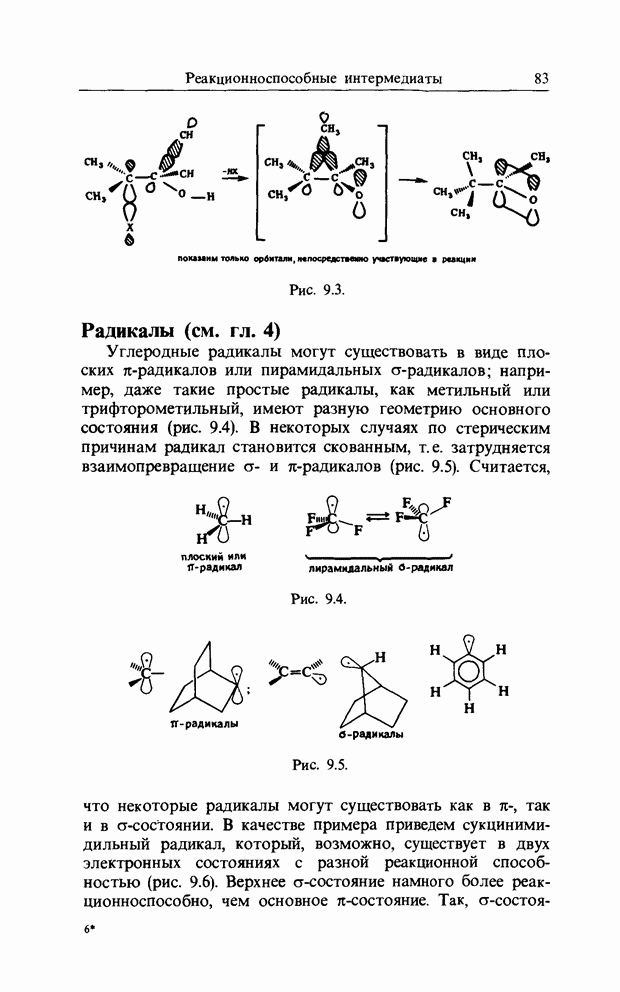
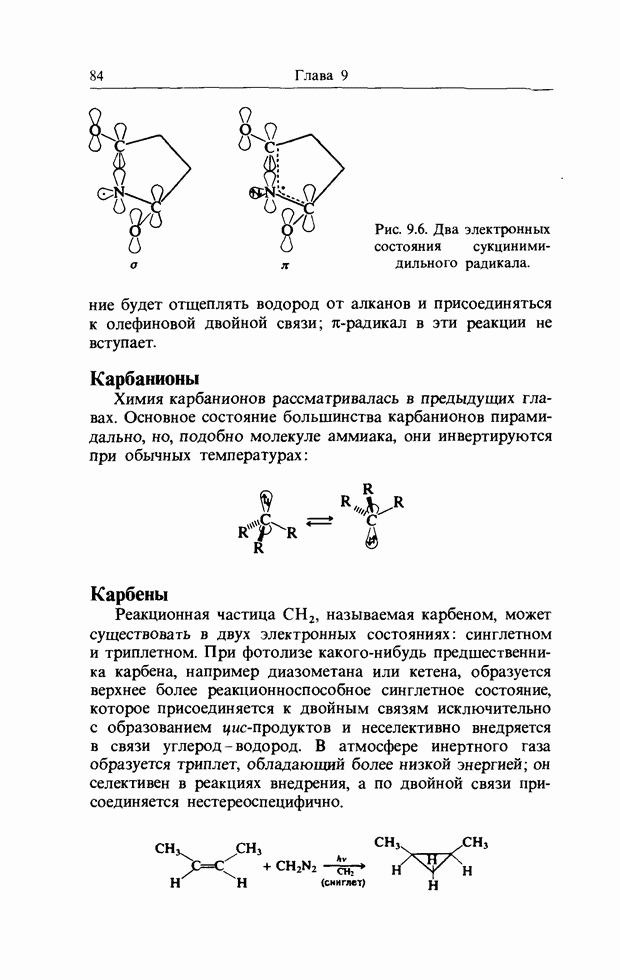
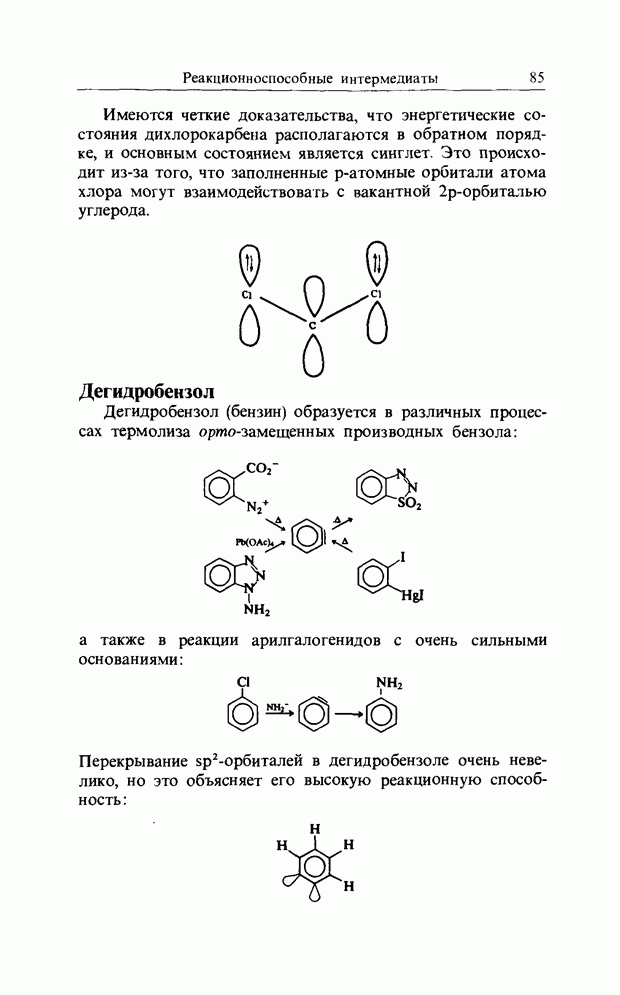
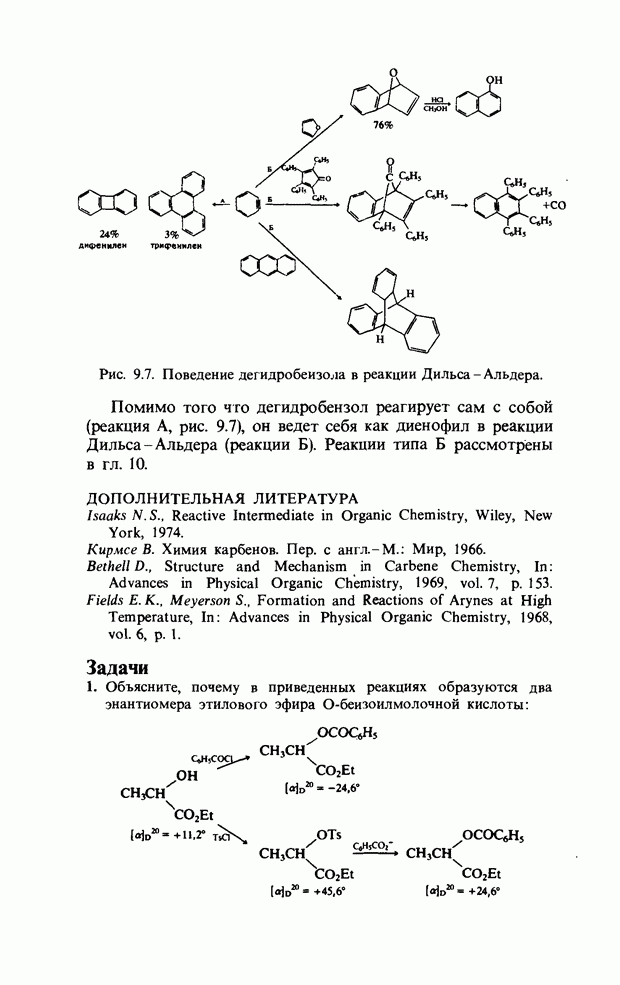
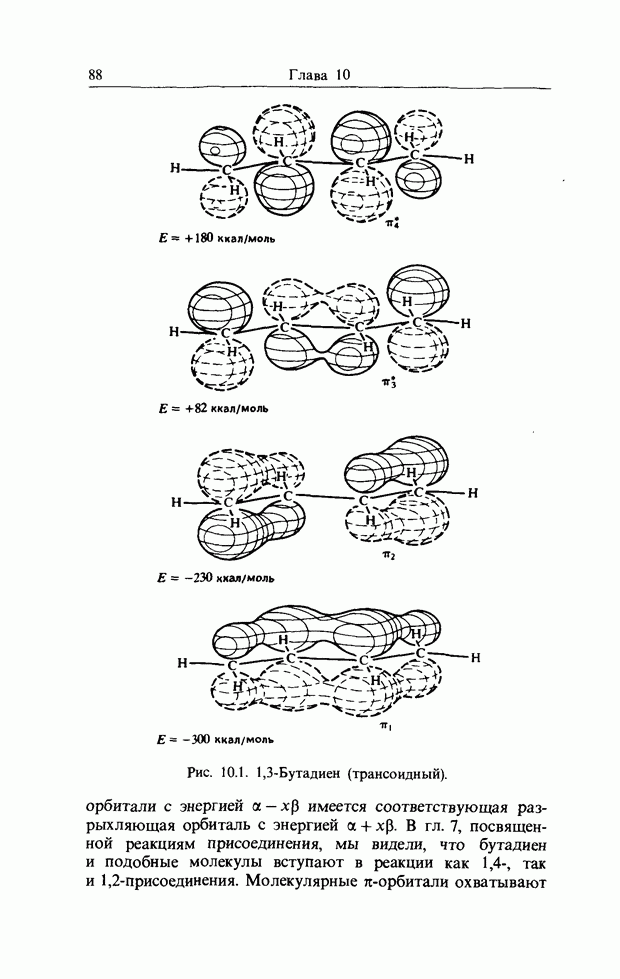
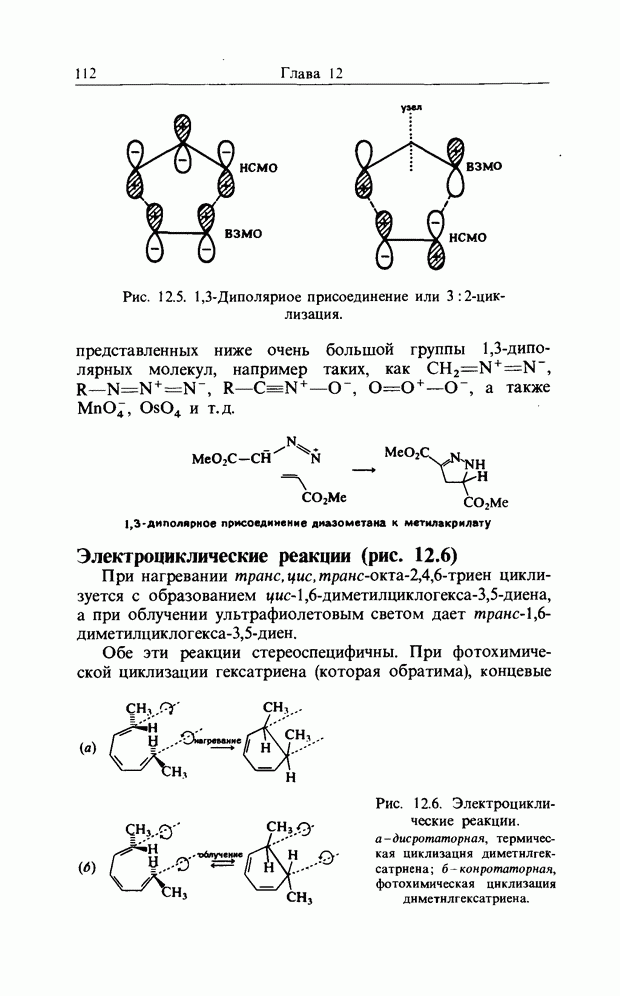
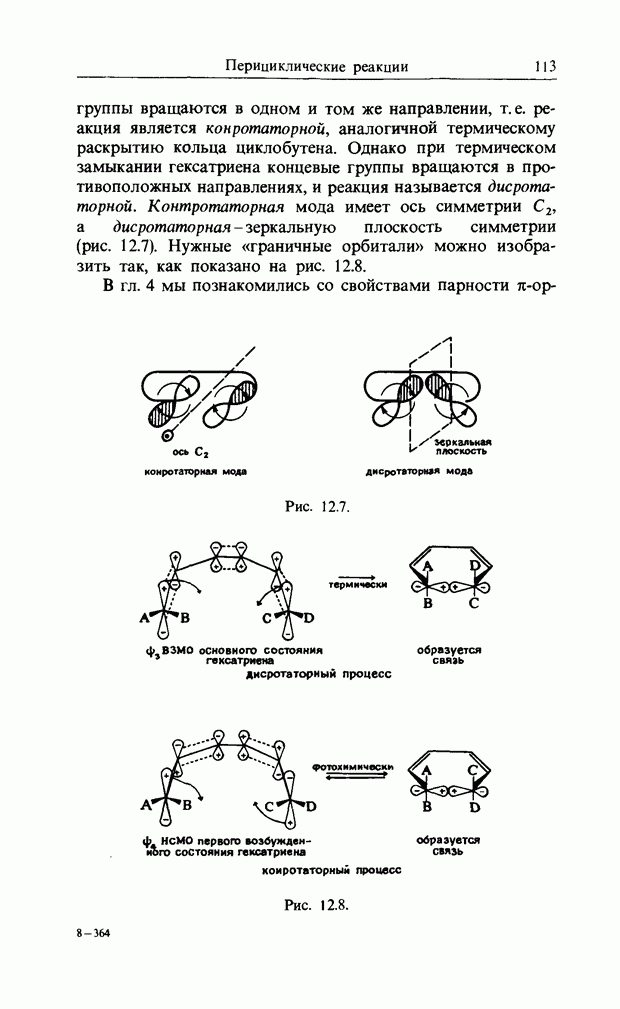
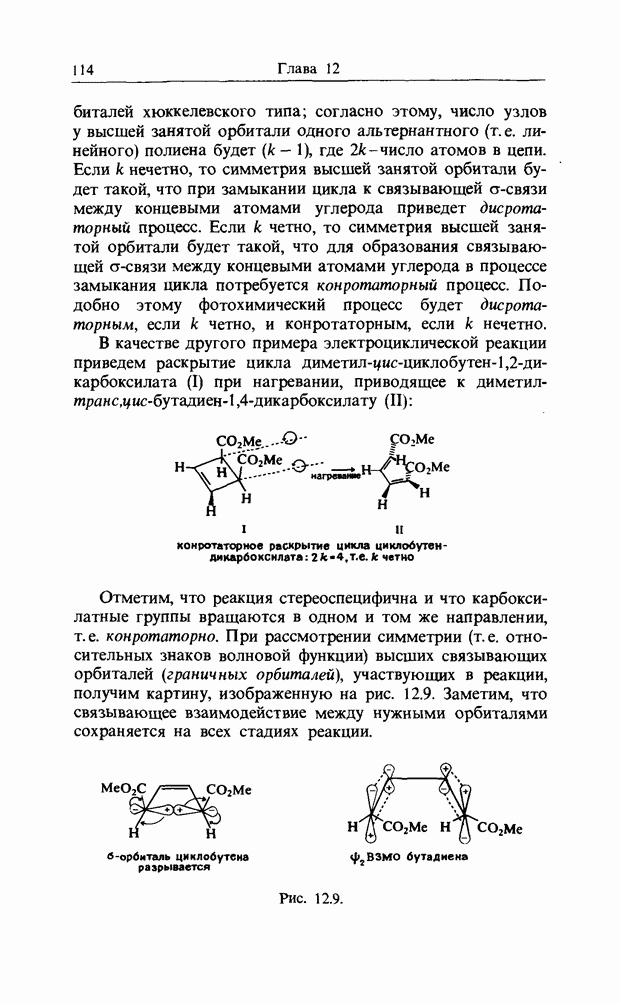
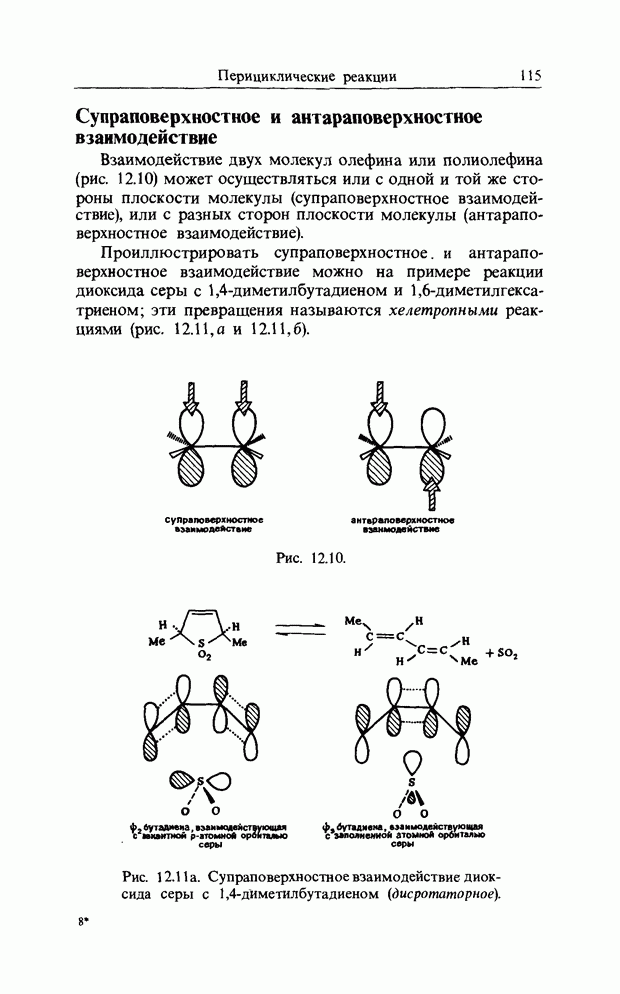
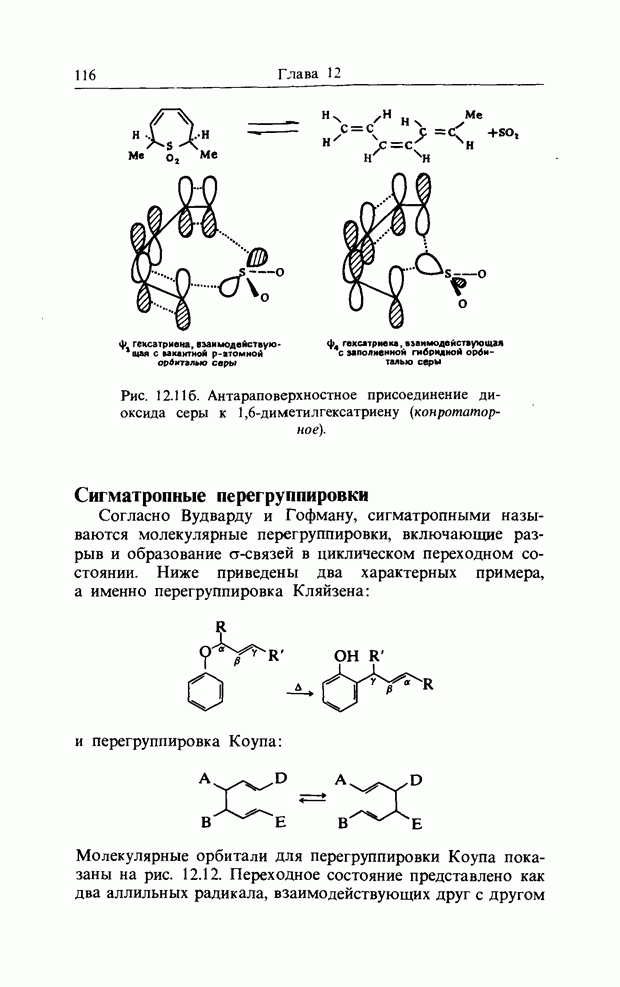
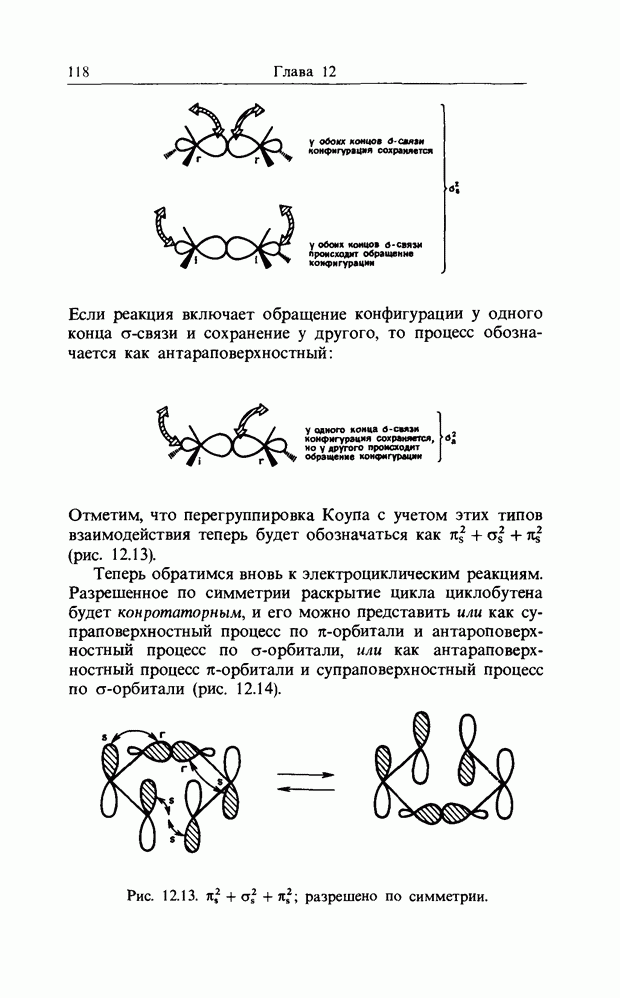
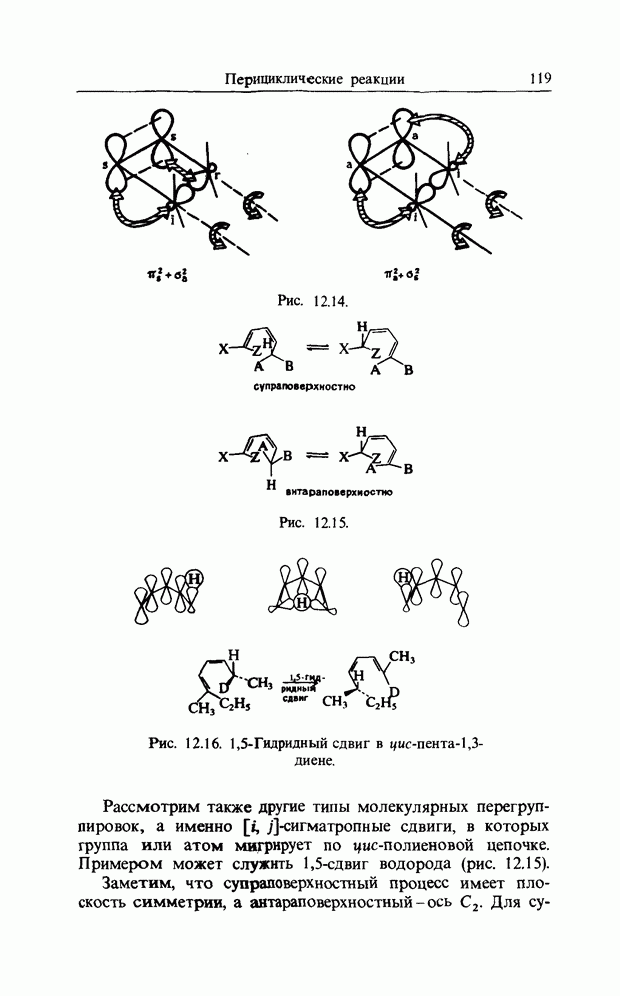
| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
1. АТОМНЫЕ И МОЛЕКУЛЯРНЫЕ ОРБИТАЛИ
Атомы образуют молекулы за счет дележа электронов, и такое разделение двух электронов между двумя атомами рассматривается как образование химической связи. При этом между двумя атомами могут быть поделены одна, две или три электронные пары (в классической теории валентностей это соответствует простой, двойной и тройной связям). Чтобы осмысленно обсуждать электроны в молекулах, сначала нужно вспомнить некоторые качественные идеи об электронном строении атомов.
Атом водорода состоит из ядра (протона), с которым связан электрон. Точное положение электрона определить нельзя, можно лишь определить вероятность нахождения электрона в любой заданной точке пространства. Для основного состояния атома водорода распределение этой вероятности вокруг ядра симметрично, и можно нарисовать сферическую граничную поверхность, внутри которой вероятность найти электрон составляет, например, 95%. Электрон имеет фиксированную энергию и определенное пространственное распределение, называемое орбиталью. В атоме гелия с ядром связаны два электрона, которые имеют точно одинаковое пространственное распределение и вследствие этого точно одинаковую энергию (т.е. они занимают одну и ту же орбиталь), но различаются по спину (принцип запрета Паули). Общее правило гласит: электроны, связанные с атомными ядрами, занимают орбитали с фиксированной энергией и определенным пространственным распределением, и на каждой орбитали может находиться максимально только два электрона с антипараллельными спинами.
В физике явления, характеризующиеся периодичностью, часто связывают с волновым уравнением; в теории атома соответствующее уравнение называют уравнением Шрёдингера. Волновое уравнение имеет дискретные решения; в одномерном случае для частицы в ящике с непроницаемыми
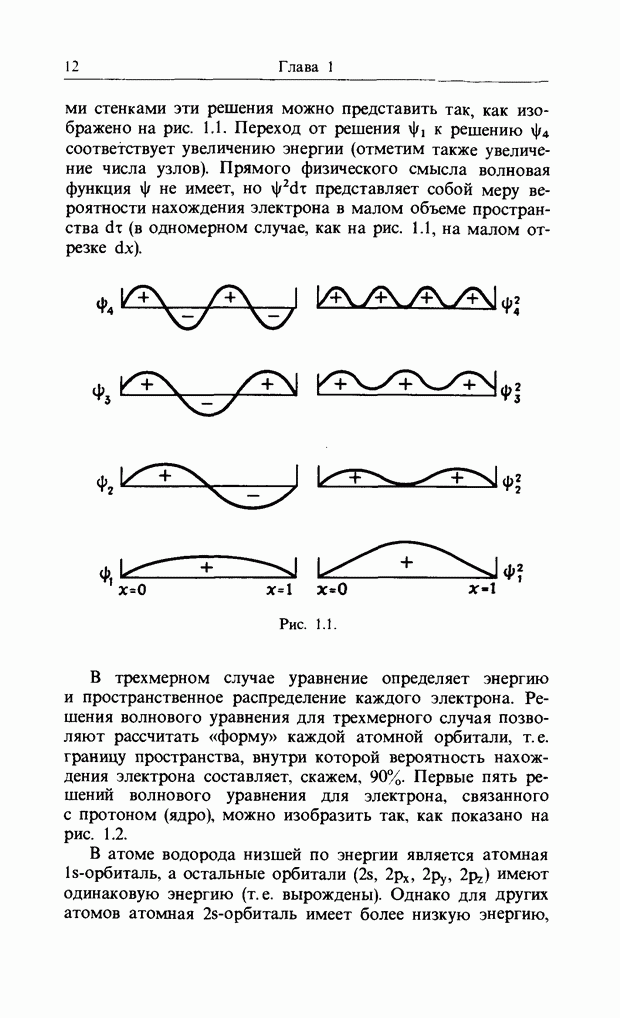
стенками эти решения можно представить так, как изображено на рис. 1.1. Переход от решения  к решению
к решению  соответствует увеличению энергии (отметим также увеличение числа узлов). Прямого физического смысла волновая функция не имеет, но
соответствует увеличению энергии (отметим также увеличение числа узлов). Прямого физического смысла волновая функция не имеет, но  представляет собой меру вероятности нахождения электрона в малом объеме пространства
представляет собой меру вероятности нахождения электрона в малом объеме пространства  (в одномерном случае, как на рис. 1.1, на малом отрезке
(в одномерном случае, как на рис. 1.1, на малом отрезке  ).
).

Рис. 1.1.
В трехмерном случае уравнение определяет энергию  пространственное распределение каждого электрона. Решения волнового уравнения для трехмерного случая позволяют рассчитать «форму» каждой атомной орбитали, т.е. границу пространства, внутри которой вероятность нахождения электрона составляет, скажем, 90%. Первые пять решений волнового уравнения для электрона, связанного с протоном (ядро), можно изобразить так, как показано на рис. 1.2.
пространственное распределение каждого электрона. Решения волнового уравнения для трехмерного случая позволяют рассчитать «форму» каждой атомной орбитали, т.е. границу пространства, внутри которой вероятность нахождения электрона составляет, скажем, 90%. Первые пять решений волнового уравнения для электрона, связанного с протоном (ядро), можно изобразить так, как показано на рис. 1.2.
В атоме водорода низшей по энергии является атомная  -орбиталь, а остальные орбитали
-орбиталь, а остальные орбитали  имеют здинаковую энергию (т.е. вырождены). Однако для других атомов атомная 2s-орбиталь имеет более низкую энергию,
имеют здинаковую энергию (т.е. вырождены). Однако для других атомов атомная 2s-орбиталь имеет более низкую энергию,

Рис. 1.2. Первые пять решений  волнового уравнения. Знаки « + » и « -» имеют тот же смысл, что и на рис. 1.1.
волнового уравнения. Знаки « + » и « -» имеют тот же смысл, что и на рис. 1.1.

Рис. 1.3.
чем  и
и  -орбитали, которые являются вырожденными. На рисунке вместо
-орбитали, которые являются вырожденными. На рисунке вместо  даны
даны  , поскольку, как мы увидим при рассмотрении валентности, чрезвычайно важен знак волновой функции. Рассматривать теорию атома подробнее нет необходимости.
, поскольку, как мы увидим при рассмотрении валентности, чрезвычайно важен знак волновой функции. Рассматривать теорию атома подробнее нет необходимости.
В атомах электроны занимают атомные орбитали с определенной энергией и пространственным распределением. В молекулах электроны занимают аналогичные молекулярные орбитали, которые охватывают всю молекулу. Простейшей молекулой является водород; его можно рассматривать как состоящий из двух раздельных протонов и двух электронов. В водороде имеются две молекулярные орбитали, которые можно представить так, как показано на рис. 1.3. Орбиталь более низкой энергии характеризуется тем, что наивысшая электронная плотность находится между двумя ядрами, и качественно ее можно описать как два ядра, удерживающиеся около друг друга электронами (подобно
джему в сэндвиче). Связывающая молекулярная орбиталь имеет более низкую энергию, чем атомная  -орбиталь водорода, поэтому она называется связывающей орбиталъю; она более стабильна, чем две отдельные атомные орбитали водорода. В противоположность этому верхняя молекулярная орбиталь характеризуется наличием узла в электронной волновой функции, а электронная плотность между двумя положительно заряженными ядрами понижена (т. е. здесь недостаточно джема, чтобы предотвратить взаимное отталкивание атомов и удерживать сэндвич как единое целое). Энергия верхней молекулярной орбитали выше, чем энергия атомной
-орбиталь водорода, поэтому она называется связывающей орбиталъю; она более стабильна, чем две отдельные атомные орбитали водорода. В противоположность этому верхняя молекулярная орбиталь характеризуется наличием узла в электронной волновой функции, а электронная плотность между двумя положительно заряженными ядрами понижена (т. е. здесь недостаточно джема, чтобы предотвратить взаимное отталкивание атомов и удерживать сэндвич как единое целое). Энергия верхней молекулярной орбитали выше, чем энергия атомной  -орбитали. Такие молекулярные орбитали описываются как разрыхляющие (антисвязывающие).
-орбитали. Такие молекулярные орбитали описываются как разрыхляющие (антисвязывающие).

Рис. 1.4. Связывающие и разрыхляющие орбитали молекулы водорода.
Обычно оба электрона в молекуле водорода занимают связывающую молекулярную орбиталь и их спины антипараллельны (т.е. принцип Паули применим не только к атомам, но и к молекулам). Если молекулярный водород облучить светом далекой ультрафиолетовой области, то молекула может поглотить свет и один из двух электронов будет промотироваться на разрыхляющую орбиталь  . В первом приближении энергия электрона на разрыхляющей орбитали компенсирует эффект электрона на связывающей орбитали
. В первом приближении энергия электрона на разрыхляющей орбитали компенсирует эффект электрона на связывающей орбитали  и атомы разлетятся друг от друга. Подобная диссоциация молекулярного водорода не имеет практической ценности, но она очень важна для диссоциации других молекул (например, молекулярного хлора и молекулярного брома, которые легко диссоциируют при облучении). Энергетические уровни молекулы водорода можно представить диаграммой (рис. 1.4), согласно которой две атомные
и атомы разлетятся друг от друга. Подобная диссоциация молекулярного водорода не имеет практической ценности, но она очень важна для диссоциации других молекул (например, молекулярного хлора и молекулярного брома, которые легко диссоциируют при облучении). Энергетические уровни молекулы водорода можно представить диаграммой (рис. 1.4), согласно которой две атомные  -орбитали рекомбинируют с образованием молекулярных орбиталей - одной связывающей
-орбитали рекомбинируют с образованием молекулярных орбиталей - одной связывающей  и одной разрыхляющей
и одной разрыхляющей  .
.
ДОПОЛНИТЕЛЬНАЯ ЛИТЕРАТУРА
Маррел Дж., Кеттл С., Теддер Дж. Химическая связь-М.: Мир, 1980.
| << Предыдущий параграф | Следующий параграф >> |
- ПРЕДИСЛОВИЕ ПЕРЕВОДЧИКА
- ПРЕДИСЛОВИЕ АВТОРОВ К РУССКОМУ ИЗДАНИЮ
- ВВЕДЕНИЕ
- НОМЕНКЛАТУРА
- 1. АТОМНЫЕ И МОЛЕКУЛЯРНЫЕ ОРБИТАЛИ
- 2. ПИКТОГРАФИЧЕСКАЯ ОРБИТАЛЬНАЯ ТЕОРИЯ
- 3. ГИБРИДИЗАЦИЯ И ОРБИТАЛИ ФУНКЦИОНАЛЬНЫХ ГРУПП
- 4. СВЯЗЬ УГЛЕРОД ВОДОРОД И РЕАКЦИИ ПЕРЕНОСА РАДИКАЛОВ
- 5. РЕАКЦИИ ЗАМЕЩЕНИЯ И СВЯЗЬ УГЛЕРОД ГАЛОГЕН
- 6. БИМОЛЕКУЛЯРНЫЕ РЕАКЦИИ ЭЛИМИНИРОВАНИЯ
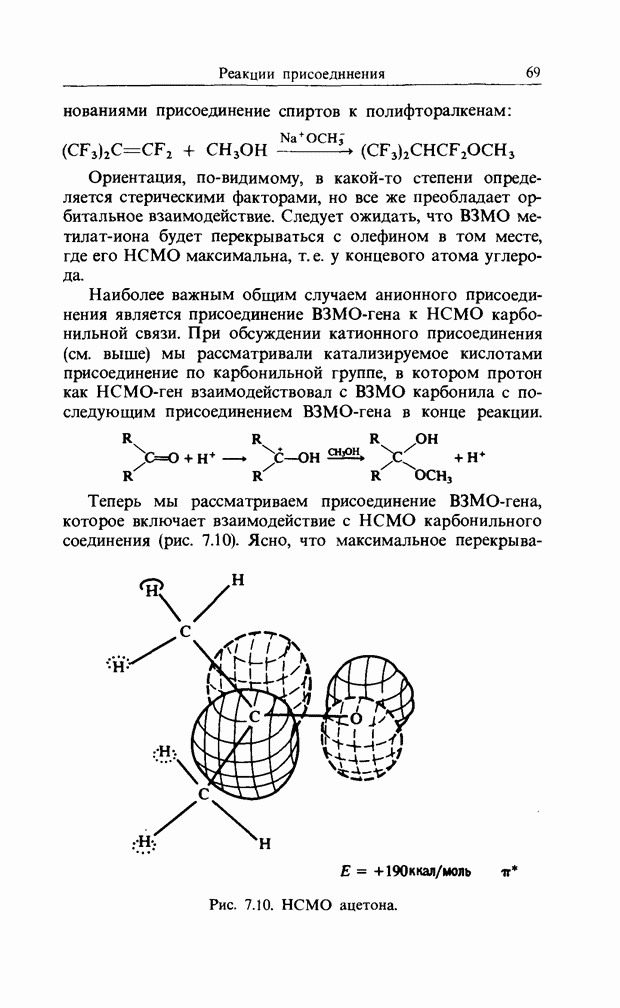
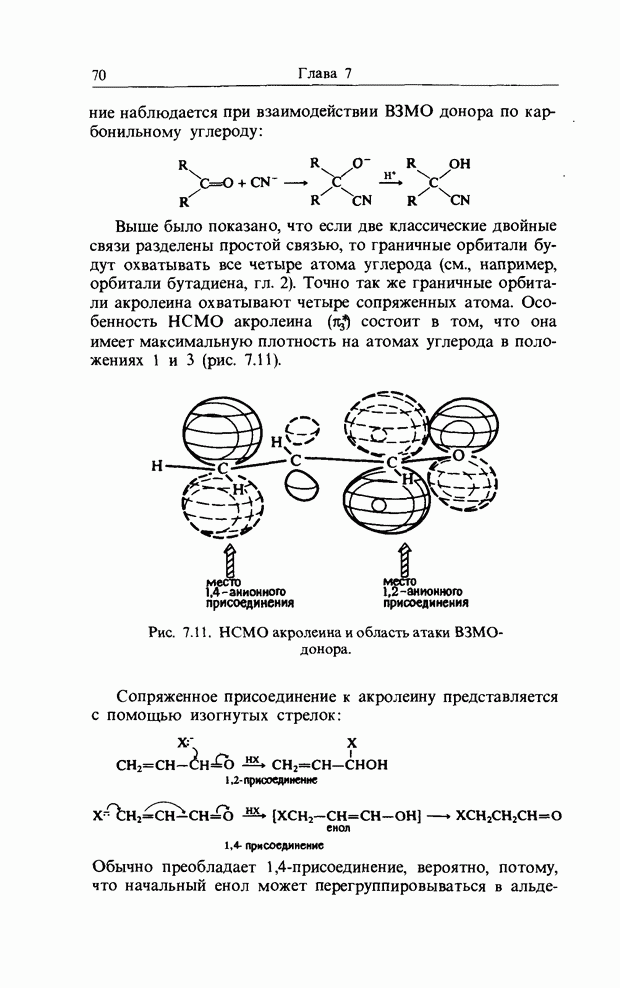
- 7. РЕАКЦИИ ПРИСОЕДИНЕНИЯ
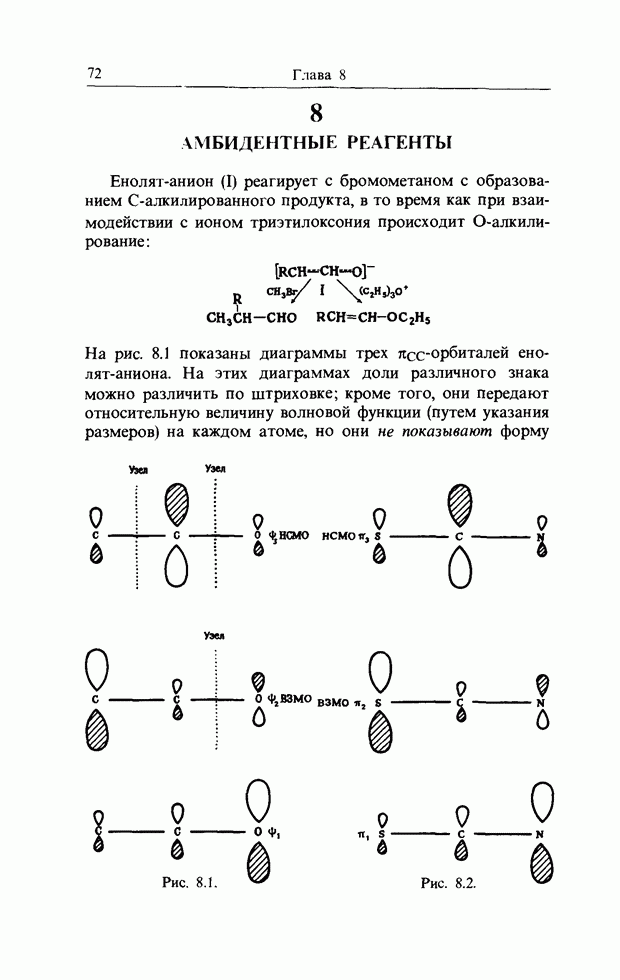
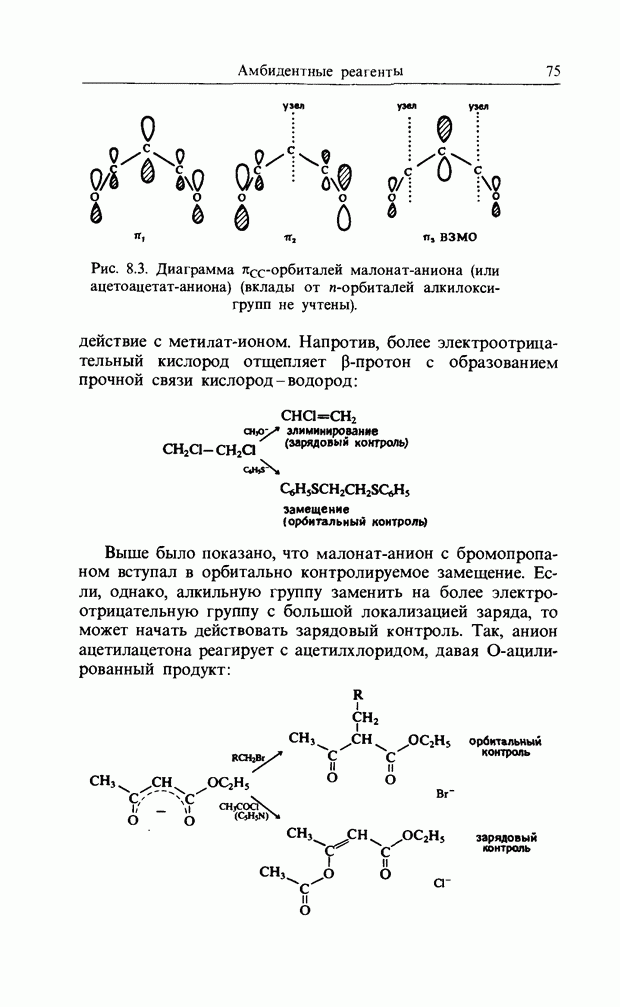
- 8. АМБИДЕНТНЫЕ РЕАГЕНТЫ
- 9. РЕАКЦИОННОСПОСОБНЫЕ ИНТЕРМЕДИАТЫ
- 10. АЛЬТЕРНАНТНЫЕ УГЛЕВОДОРОДЫ И АРОМАТИЧНОСТЬ
- 11. РЕАКЦИИ БЕНЗОИДНЫХ СОЕДИНЕНИЙ
- 12. ПЕРИЦИКЛИЧЕСКИЕ РЕАКЦИИ