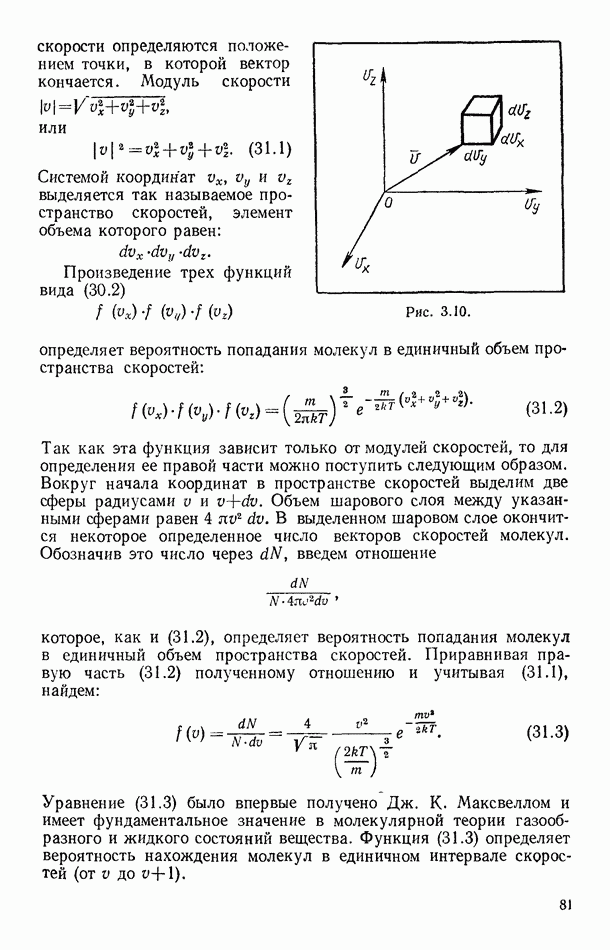
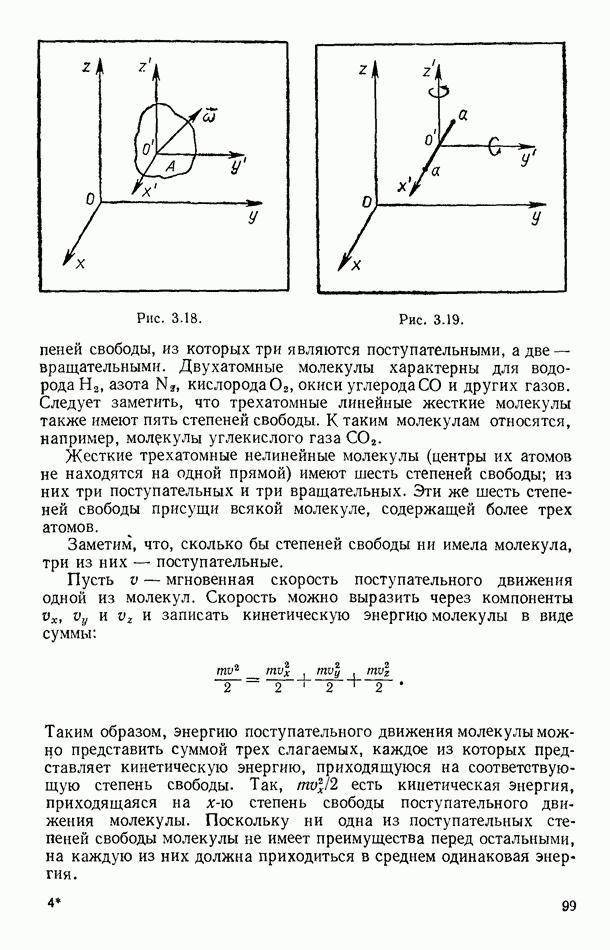
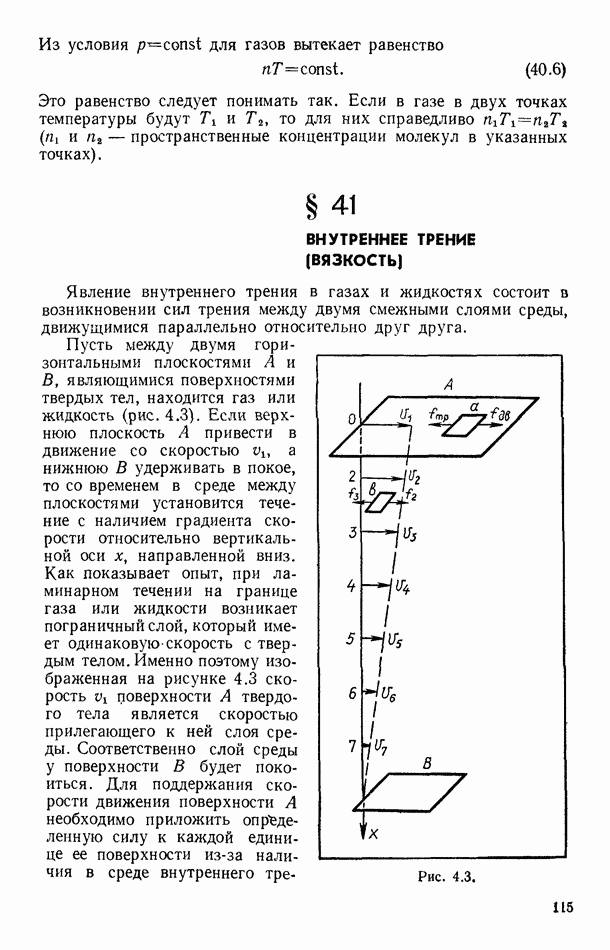
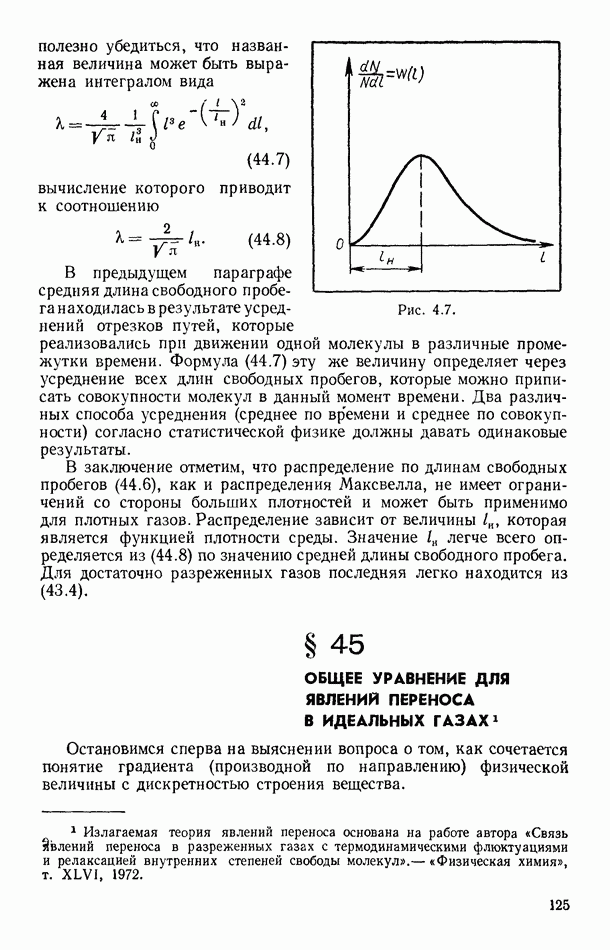
| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
§ 17. ФОРМУЛИРОВКА ПЕРВОГО НАЧАЛА ТЕРМОДИНАМИКИ
Одна из характерных черт термодинамического рассмотрения явлений заключается в выделении из множества тел, находящихся во взаимодействии, одного тела, которое называют исследуемой системой, остальные же тела называют внешней средой или внешними телами. В таком методе все внимание уделяется выделенной системе, ее геометрические границы часто выбираются условными и такими, чтобы они были удобными для решения рассматриваемой задачи. Система принимается покоящейся, поэтому энергетические изменения в ней сводятся полностью к изменению ее внутренней энергии. Взаимодействие с внешними телами устанавливается в наиболее общей форме: между системой и внешними телами возможна передача энергии в форме теплоты и работы.
На рисунке 2.5 схематически изображена исследуемая система  и внешние тела II и III. Система помещена в цилиндр с дном
и внешние тела II и III. Система помещена в цилиндр с дном  и подвижным поршнем А А. Пусть стенки и поршень цилиндра адиабатические, дно же цилиндра теплопроницаемо. Тогда, очевидно, выбранная система I находится с телом II в тепловом контакте (с этим телом возможен теплообмен), с телом же III — в механическом контакте (с этим телом возможен энергообмен через работу, совершаемую при перемещениях поршня). На рисунке стрелками показано, что от тела II элементарное количество теплоты
и подвижным поршнем А А. Пусть стенки и поршень цилиндра адиабатические, дно же цилиндра теплопроницаемо. Тогда, очевидно, выбранная система I находится с телом II в тепловом контакте (с этим телом возможен теплообмен), с телом же III — в механическом контакте (с этим телом возможен энергообмен через работу, совершаемую при перемещениях поршня). На рисунке стрелками показано, что от тела II элементарное количество теплоты  поступает в систему, система же, производя элементарную работу
поступает в систему, система же, производя элементарную работу  над телом III, передает ему энергию. В результате происходит изменение
над телом III, передает ему энергию. В результате происходит изменение

Рис. 1.1.
внутренней энергии системы  Согласно схеме, изображенной на рисунке 2.5,
Согласно схеме, изображенной на рисунке 2.5,

Записанное уравнение выражает собой первое начало термодинамики: количество теплоты, полученное системой от окружающих тел, идет на изменение ее внутренней энергии и на совершение ею работы над внешними телами.
Нужно иметь в виду, что величины  являются алгебраическими, принято считать, что
являются алгебраическими, принято считать, что  если система получает эту теплоту, и
если система получает эту теплоту, и  если система совершает работу над внешними телами, передавая им энергию. При истолковании уравнения (17.1) для простоты говорилось, что
если система совершает работу над внешними телами, передавая им энергию. При истолковании уравнения (17.1) для простоты говорилось, что  это полученная теплота
это полученная теплота  совершенная работа
совершенная работа  Но в общем случае тело может отдавать теплоту, тогда
Но в общем случае тело может отдавать теплоту, тогда  или получать энергию через работу
или получать энергию через работу 
В системе, заключенной в адиабатическую оболочку, процессы не сопровождаются теплообменом с окружающими телами; такие процессы называются адиабатическими. Для адиабатических процессов  и согласно
и согласно  Последнее выражение означает следующее: работа в адиабатическом процессе происходит за счет убыли внутренней энергии. Если
Последнее выражение означает следующее: работа в адиабатическом процессе происходит за счет убыли внутренней энергии. Если  (внешние тела совершают работу над системой), то
(внешние тела совершают работу над системой), то  (внутренняя энергия системы увеличивается).
(внутренняя энергия системы увеличивается).
Если оболочка системы жесткая (механическая изоляция), то механическая работа при всяких изменениях в системе равна нулю. Такие процессы называются изохорическими (изохорными), для них  Таким образом, при изохорических изменениях системы ее внутренняя энергия изменяется только за счет подводимой или отводимой теплоты.
Таким образом, при изохорических изменениях системы ее внутренняя энергия изменяется только за счет подводимой или отводимой теплоты.
Следует отметить еще одну особенность уравнения (17.1):  есть дифференциал внутренней энергии исследуемого тела, величины же
есть дифференциал внутренней энергии исследуемого тела, величины же  представляют собой элементарные (малые) значения теплоты и работы;
представляют собой элементарные (малые) значения теплоты и работы;  (см. рис. 2.5) — элементарное количество теплоты, переданное от тела II телу
(см. рис. 2.5) — элементарное количество теплоты, переданное от тела II телу  работа тела I над телом III. Тело II при этом может обмениваться энергией еще с рядом других тел, именно поэтому
работа тела I над телом III. Тело II при этом может обмениваться энергией еще с рядом других тел, именно поэтому  не может в общем случае быть дифференциалом энергии второго тела. Для исследуемой системы
не может в общем случае быть дифференциалом энергии второго тела. Для исследуемой системы  есть часть
есть часть  и поэтому также не может быть полным дифференциалом какой-либо функции состояния исследуемой системы. Не является полным дифференциалом и элементарная работа
и поэтому также не может быть полным дифференциалом какой-либо функции состояния исследуемой системы. Не является полным дифференциалом и элементарная работа  определяющая обмен энергией между системой и третьим телом.
определяющая обмен энергией между системой и третьим телом.
При определении конечного изменения состояния системы, обусловленного ее переходом из состояния 1 в состояние 2, выражение
(17.1) интегрируют по линии перехода  или, что то же самое:
или, что то же самое:

Последним равенством выражают первое начало термодинамики для конечных изменений системы. Согласно изложенному выше  — это конечные значения теплоты и работы (но не приращения чего-либо), величина же
— это конечные значения теплоты и работы (но не приращения чего-либо), величина же  есть приращение внутренней энергии.
есть приращение внутренней энергии.
Как указывалось ранее (§ 16, 13),  не зависит, а
не зависит, а  зависит от вида процесса (от пути перехода системы из начального состояния в конечное). В связи с этим из уравнения (17.2) следует, что
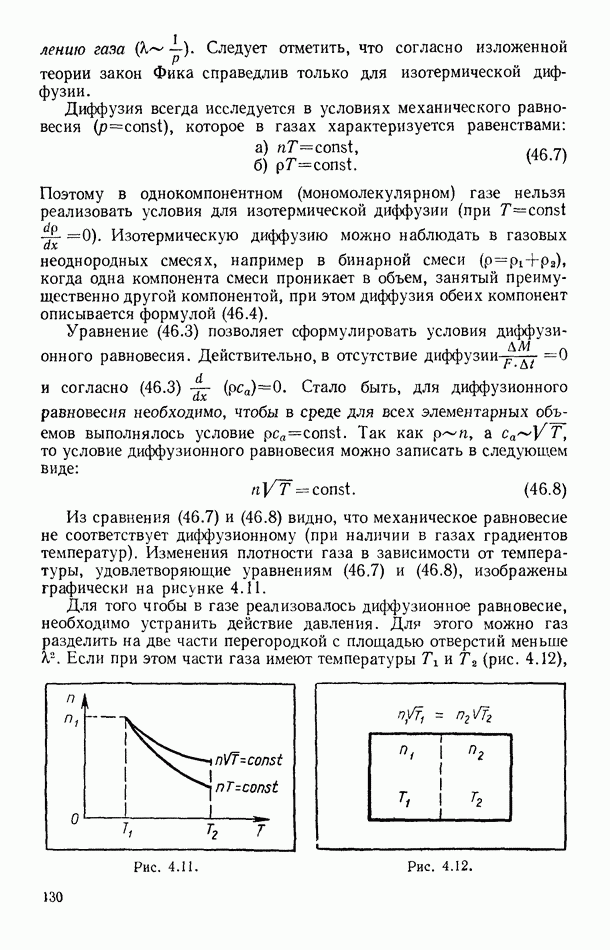
зависит от вида процесса (от пути перехода системы из начального состояния в конечное). В связи с этим из уравнения (17.2) следует, что  также зависит от вида процесса.
также зависит от вида процесса.
Если при изменении состояния системы происходит изменение ее температуры на  то, деля (17.2) на
то, деля (17.2) на  получим:
получим:

Отношение —  определяет теплоемкость системы. Переходы между двумя состояниями могут происходить так, что изменение температуры
определяет теплоемкость системы. Переходы между двумя состояниями могут происходить так, что изменение температуры  будет одним и тем же, однако величины
будет одним и тем же, однако величины  для различных переходов будут различными (при различных работах
для различных переходов будут различными (при различных работах  Отсюда следует, что теплоемкость системы (17.3) также будет зависеть от вида процесса.
Отсюда следует, что теплоемкость системы (17.3) также будет зависеть от вида процесса.
Когда система совершает лишь механическую работу  выражение (17.1) записывается в виде
выражение (17.1) записывается в виде

Уравнение (17.4) выражает первое начало термодинамики для элементарных равновесных изменений состояния произвольной системы с учетом только механической работы (например, работы расширения против сил внешнего давления).
Остановимся на механизме теплообмена. При контакте двух тел, например термостата и рассматриваемой системы, обладающих разной температурой  возникает теплопередача от тела с
возникает теплопередача от тела с  к телу с
к телу с  Она обусловлена различием интенсивностей теплового движения молекул рассматриваемого тела и термостата — теплота передается от тела с более интенсивным движением молекул к телу с менее интенсивным движением. Для реализации равновесных изменений состояния тела необходимо, чтобы его температура отличалась на бесконечно малую величину от температуры термостата, с которым происходит теплообмен:
Она обусловлена различием интенсивностей теплового движения молекул рассматриваемого тела и термостата — теплота передается от тела с более интенсивным движением молекул к телу с менее интенсивным движением. Для реализации равновесных изменений состояния тела необходимо, чтобы его температура отличалась на бесконечно малую величину от температуры термостата, с которым происходит теплообмен:  При этом для описания свойств системы можно положить
При этом для описания свойств системы можно положить 
| << Предыдущий параграф | Следующий параграф >> |
- ПРЕДИСЛОВИЕ
- Глава I. ОСНОВНЫЕ ТЕРМОДИНАМИЧЕСКИЕ ПОНЯТИЯ И СВОЙСТВА ИДЕАЛЬНЫХ ГАЗОВ
- § 1 О ДВУХ МЕТОДАХ ИССЛЕДОВАНИЯ ФИЗИЧЕСКИХ ЯВЛЕНИЙ
- § 2. ОСНОВНЫЕ ПОНЯТИЯ И ПРЕДСТАВЛЕНИЯ ТЕРМОДИНАМИЧЕСКОГО ОПИСАНИЯ СИСТЕМ
- § 3 ТЕРМИЧЕСКОЕ УРАВНЕНИЕ СОСТОЯНИЯ. РАВНОВЕСНЫЕ ПРОЦЕССЫ
- § 4. ИЗОПРОЦЕССЫ
- § 5. МЕЖДУНАРОДНАЯ ПРАКТИЧЕСКАЯ ТЕМПЕРАТУРНАЯ ШКАЛА
- § 6. МЕТОДЫ ИЗМЕРЕНИЯ ТЕМПЕРАТУРЫ
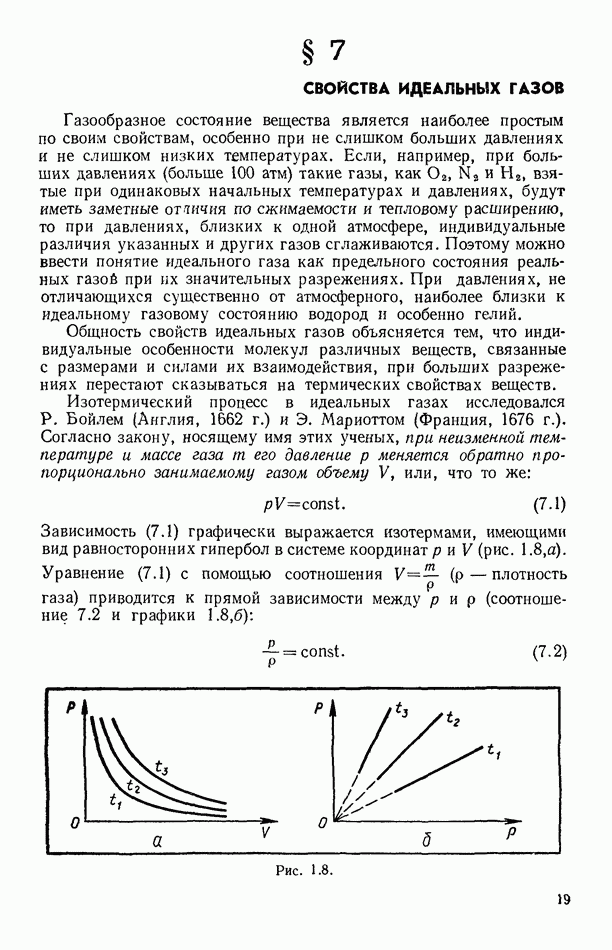
- § 7. СВОЙСТВА ИДЕАЛЬНЫХ ГАЗОВ
- § 8. РАБОТА РАСШИРЕНИЯ СИСТЕМЫ И ФИЗИЧЕСКИЙ СМЫСЛ УНИВЕРСАЛЬНОЙ ГАЗОВОЙ ПОСТОЯННОЙ
- § 9. УРАВНЕНИЕ СОСТОЯНИЯ СМЕСИ ИДЕАЛЬНЫХ ГАЗОВ
- § 10. ИЗМЕРЕНИЕ ДАВЛЕНИЙ
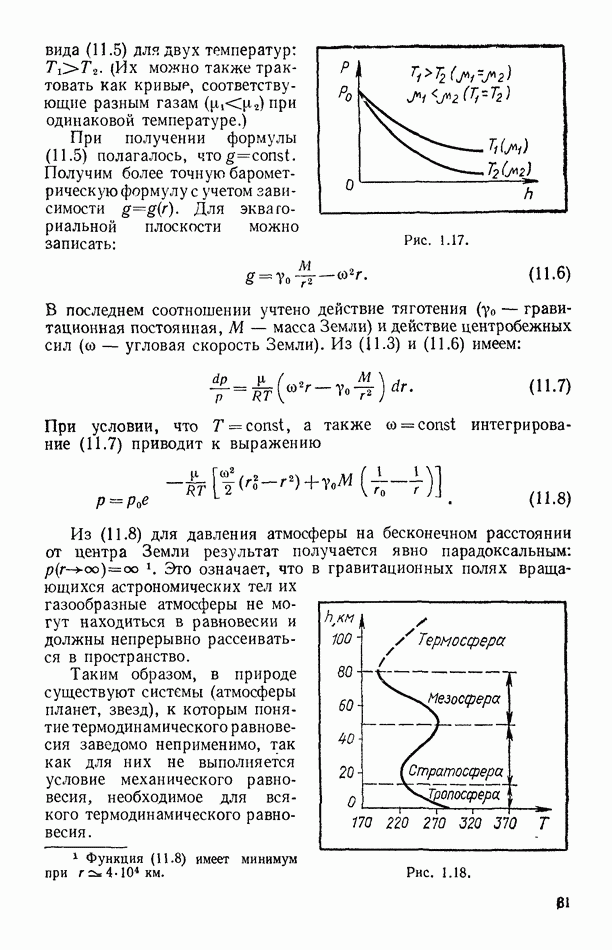
- § 11. БАРОМЕТРИЧЕСКАЯ ФОРМУЛА
- Глава II. ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
- § 12. О ЗАКОНЕ СОХРАНЕНИЯ И ПРЕВРАЩЕНИЯ ЭНЕРГИИ
- § 13. РАБОТА КАК МАКРОСКОПИЧЕСКИЙ СПОСОБ ПЕРЕДАЧИ ЭНЕРГИИ
- § 14. ТЕПЛОТА КАК МИКРОФИЗИЧЕСКИЙ СПОСОБ ПЕРЕДАЧИ ЭНЕРГИИ. ТЕПЛОЕМКОСТЬ
- § 15. ИЗМЕРЕНИЕ ТЕПЛОЕМКОСТИ
- § 16. ВНУТРЕННЯЯ ЭНЕРГИЯ КАК ФУНКЦИЯ СОСТОЯНИЯ СИСТЕМЫ
- § 17. ФОРМУЛИРОВКА ПЕРВОГО НАЧАЛА ТЕРМОДИНАМИКИ
- § 18. ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ ДЛЯ ИДЕАЛЬНЫХ ГАЗОВ
- § 19. ИЗОБАРИЧЕСКИЙ ПРОЦЕСС В ИДЕАЛЬНОМ ГАЗЕ
- § 20. ИЗОТЕРМИЧЕСКИЙ ПРОЦЕСС В ИДЕАЛЬНОМ ГАЗЕ
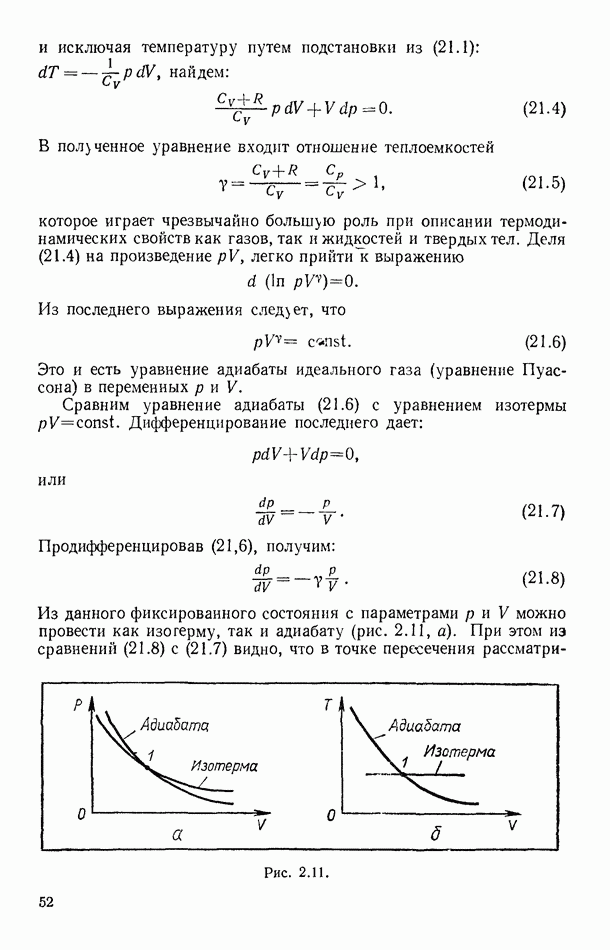
- § 21. АДИАБАТИЧЕСКИЙ ПРОЦЕСС В ИДЕАЛЬНОМ ГАЗЕ
- § 22. ПОЛИТРОПИЧЕСКИЕ ПРОЦЕССЫ В ИДЕАЛЬНОМ ГАЗЕ
- § 23. ЭКСПЕРИМЕНТАЛЬНОЕ ОПРЕДЕЛЕНИЕ ОТНОШЕНИЯ ТЕПЛОЕМКОСТЕЙ Cp/Cv
- § 24. ТЕПЛОЕМКОСТЬ СМЕСИ ГАЗОВ
- § 18. ЭНТАЛЬПИЯ КАК ФУНКЦИЯ СОСТОЯНИЯ СИСТЕМЫ
- Глава III. МОЛЕКУЛЯРНО-КИНЕТИЧЕСКАЯ ТЕОРИЯ И ЕЕ ПРИМЕНЕНИЕ К ИДЕАЛЬНЫМ ГАЗАМ
- § 26. ИСХОДНЫЕ ПОЛОЖЕНИЯ МОЛЕКУЛЯРНОЙ ТЕОРИИ
- § 27. СРЕДНИЕ ВЕЛИЧИНЫ В ОПИСАНИИ МОЛЕКУЛЯРНЫХ СИСТЕМ
- § 28. ОСНОВНЫЕ ПОНЯТИЯ ТЕОРИИ ВЕРОЯТНОСТЕЙ
- § 29. РАСПРЕДЕЛЕНИЕ ЧАСТИЦ ПО ЭНЕРГИЯМ (РАСПРЕДЕЛЕНИЕ БОЛЬЦМАНА)
- § 30. РАСПРЕДЕЛЕНИЕ МОЛЕКУЛ ПО КОМПОНЕНТАМ СКОРОСТЕЙ ИХ ТЕПЛОВОГО ДВИЖЕНИЯ (РАСПРЕДЕЛЕНИЕ МАКСВЕЛЛА)
- § 31. РАСПРЕДЕЛЕНИЕ МОЛЕКУЛ ПО СКОРОСТЯМ ИХ ТЕПЛОВОГО ДВИЖЕНИЯ (РАСПРЕДЕЛЕНИЕ МАКСВЕЛЛА)
- § 32. ОПЫТНАЯ ПРОВЕРКА РАСПРЕДЕЛЕНИЯ МАКСВЕЛЛА
- § 33. УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗА ПО КИНЕТИЧЕСКОЙ ТЕОРИИ
- § 34. ПЛОТНОСТЬ ПОТОКА МОЛЕКУЛ В ИДЕАЛЬНОМ ГАЗЕ
- § 35. РАСПРЕДЕЛЕНИЕ МОЛЕКУЛ ИДЕАЛЬНОГО ГАЗА В ПОЛВ СИЛЫ ТЯЖЕСТИ
- § 36. БРОУНОВСКОЕ ДВИЖЕНИЕ. ОПРЕДЕЛЕНИЕ ПЕРРЕНОМ ЧИСЛА АВОГАДРО
- § 37. ТЕОРЕМА О РАВНОРАСПРЕДЕЛЕНИИ И ВНУТРЕННЯЯ ЭНЕРГИЯ ИДЕАЛЬНЫХ ГАЗОВ
- § 38. КВАНТОВАЯ ТЕОРИЯ ТЕПЛОЕМКОСТИ ГАЗОВ
- § 39. ТЕРМОДИНАМИЧЕСКАЯ ВЕРОЯТНОСТЬ И РАСПРЕДЕЛЕНИЕ МОЛЕКУЛ ИДЕАЛЬНОГО ГАЗА В ПРОСТРАНСТВЕ
- Глава IV. ЯВЛЕНИЯ ПЕРЕНОСА И ИХ ТЕОРИЯ ДЛЯ ИДЕАЛЬНЫХ ГАЗОВ
- § 40. ТЕПЛОПРОВОДНОСТЬ
- § 41. ВНУТРЕННЕЕ ТРЕНИЕ (ВЯЗКОСТЬ)
- § 42. ДИФФУЗИЯ
- § 43. СРЕДНЯЯ ДЛИНА СВОБОДНОГО ПРОБЕГА МОЛЕКУЛ
- § 44. РАСПРЕДЕЛЕНИЕ МОЛЕКУЛ ПО ДЛИНАМ ИХ СВОБОДНЫХ ПРОБЕГОВ
- § 45. ОБЩЕЕ УРАВНЕНИЕ ДЛЯ ЯВЛЕНИИ ПЕРЕНОСА В ИДЕАЛЬНЫХ ГАЗАХ
- § 46. ДИФФУЗИЯ В ИДЕАЛЬНЫХ ГАЗАХ
- § 47. ВНУТРЕННЕЕ ТРЕНИЕ В ИДЕАЛЬНЫХ ГАЗАХ
- § 48. ТЕПЛОПРОВОДНОСТЬ ИДЕАЛЬНЫХ ГАЗОВ
- § 49. СВЯЗЬ МЕЖДУ КОЭФФИЦИЕНТАМИ ПЕРЕНОСА
- Глава V. СИЛЬНО РАЗРЕЖЕННЫЕ ГАЗЫ
- § 50. ПОЛУЧЕНИЕ И ИЗМЕРЕНИЕ ВАКУУМА
- § 51. СИЛЫ ТРЕНИЯ в ВАКУУМЕ
- § 52. ТЕПЛОПЕРЕДАЧА В ВАКУУМЕ
- § 53. ДИФФУЗИЯ В ВАКУУМЕ
- Глава VI. РЕАЛЬНЫЕ ГАЗЫ
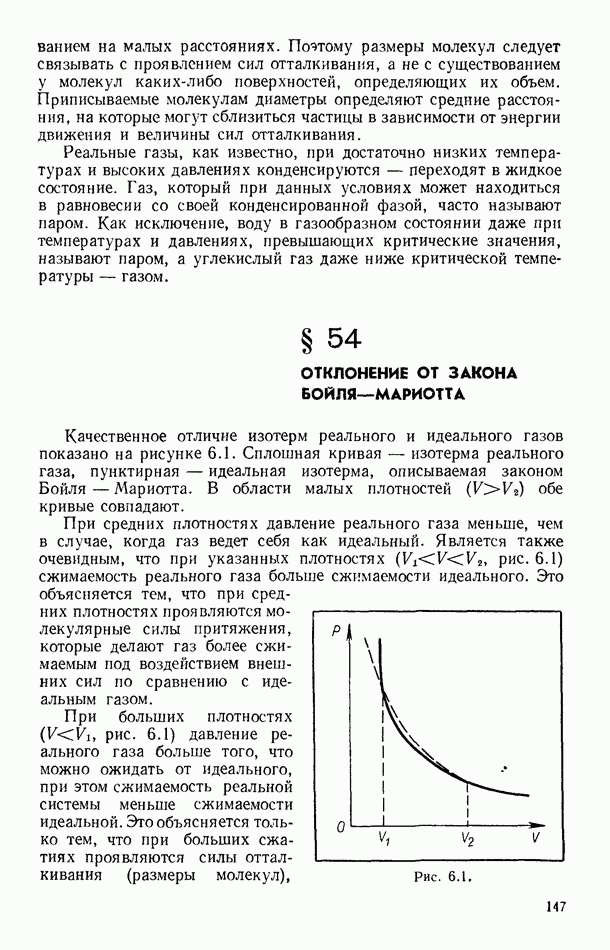
- § 54. ОТКЛОНЕНИЕ ОТ ЗАКОНА БОЙЛЯ—МАРИОТТА
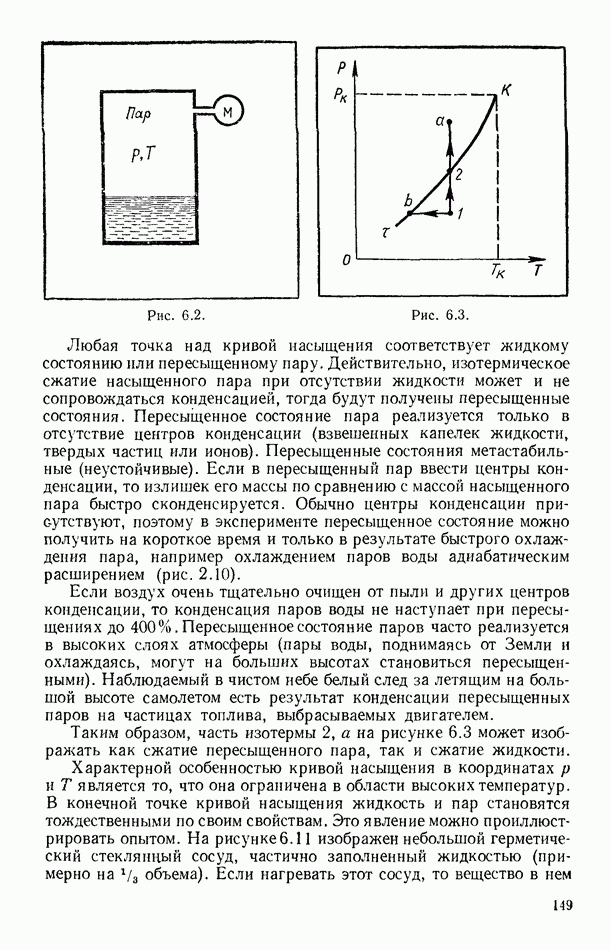
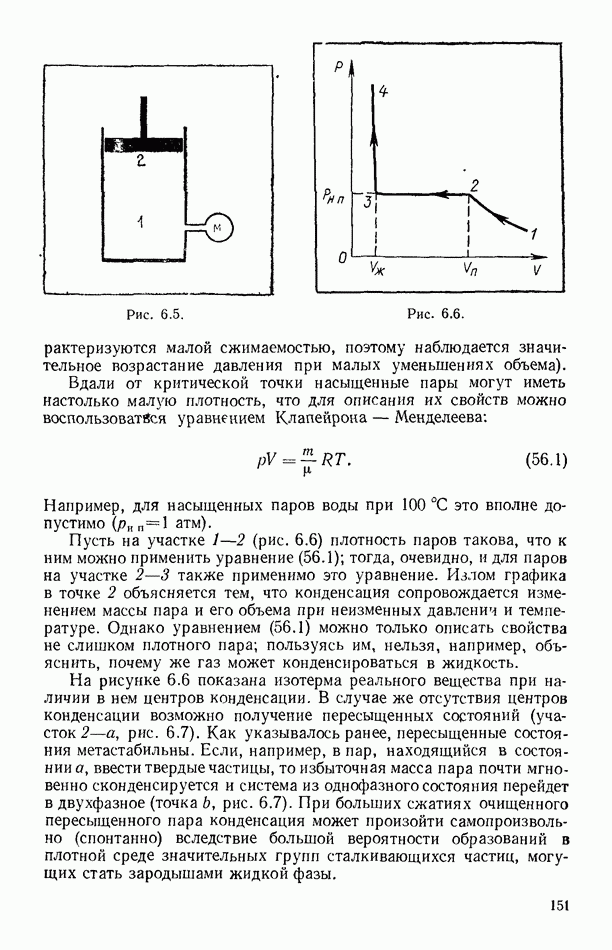
- § 55. РАВНОВЕСИЕ СИСТЕМЫ ЖИДКОСТЬ — ПАР
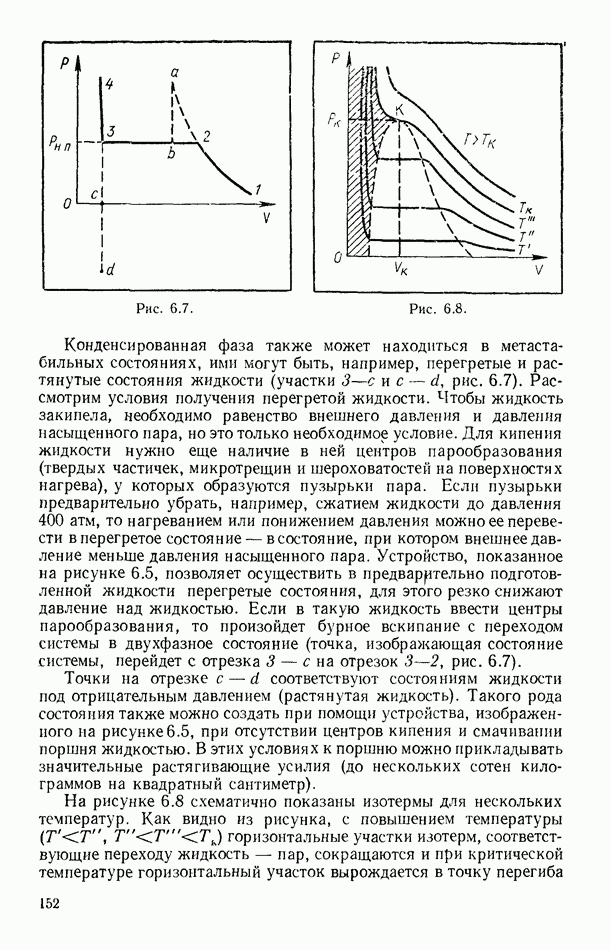
- § 56. ЭКСПЕРИМЕНТАЛЬНЫЕ ИЗОТЕРМЫ. КРИТИЧЕСКОЕ СОСТОЯНИЕ ВЕЩЕСТВА
- § 57. ПОТЕНЦИАЛ ПАРНОГО ВЗАИМОДЕЙСТВИЯ МОЛЕКУЛ
- § 58. УРАВНЕНИЕ ВАН-ДЕР-ВААЛЬСА
- § 59. ИЗОТЕРМЫ ВАН-ДЕР-ВААЛЬСА. КРИТИЧЕСКИЕ ПАРАМЕТРЫ И ПОСТОЯННЫЕ ВАН-ДЕР-ВААЛЬСА
- § 60. ВНУТРЕННЯЯ ЭНЕРГИЯ РЕАЛЬНОГО ГАЗА. ЭФФЕКТ ДЖОУЛЯ — ТОМСОНА
- § 61. СЖИЖЕНИЕ ГАЗОВ
- § 62. УРАВНЕНИЕ СОСТОЯНИЯ РЕАЛЬНЫХ ГАЗОВ В ВИРИАЛЬНОЙ ФОРМЕ
- Глава VII. ВТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ
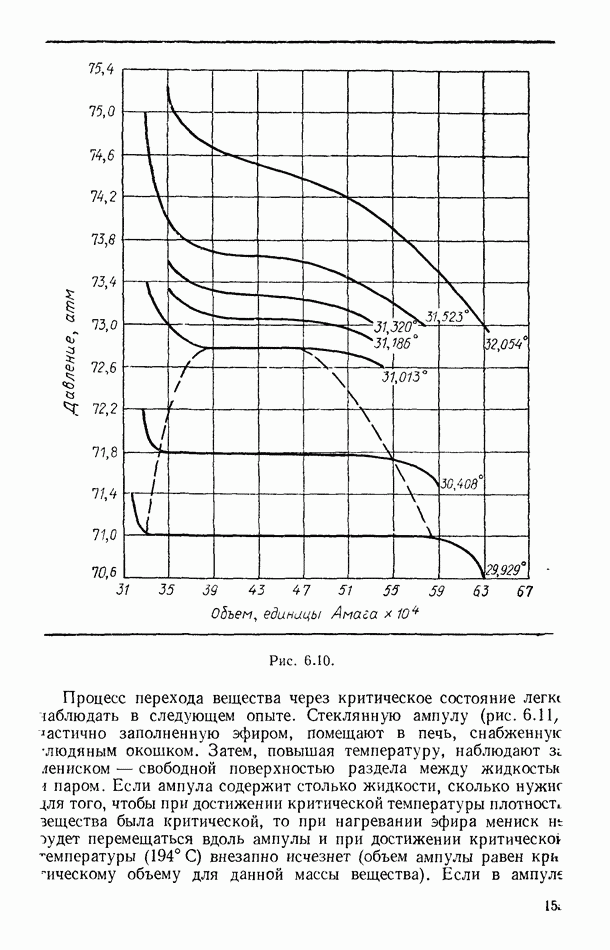
- § 63. РАВНОВЕСНЫЕ И НЕРАВНОВЕСНЫЕ ПРОЦЕССЫ
- § 64. ОБРАТИМЫЕ И НЕОБРАТИМЫЕ ПРОЦЕССЫ
- § 65. ЦИКЛИЧЕСКИЕ (КРУГОВЫЕ) ПРОЦЕССЫ
- § 66. ЦИКЛ КАРНО
- § 67. ВТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ ДЛЯ ОБРАТИМЫХ ПРОЦЕССОВ
- § 68. ЭНТРОПИЯ КАК ФУНКЦИЯ СОСТОЯНИЯ СИСТЕМЫ
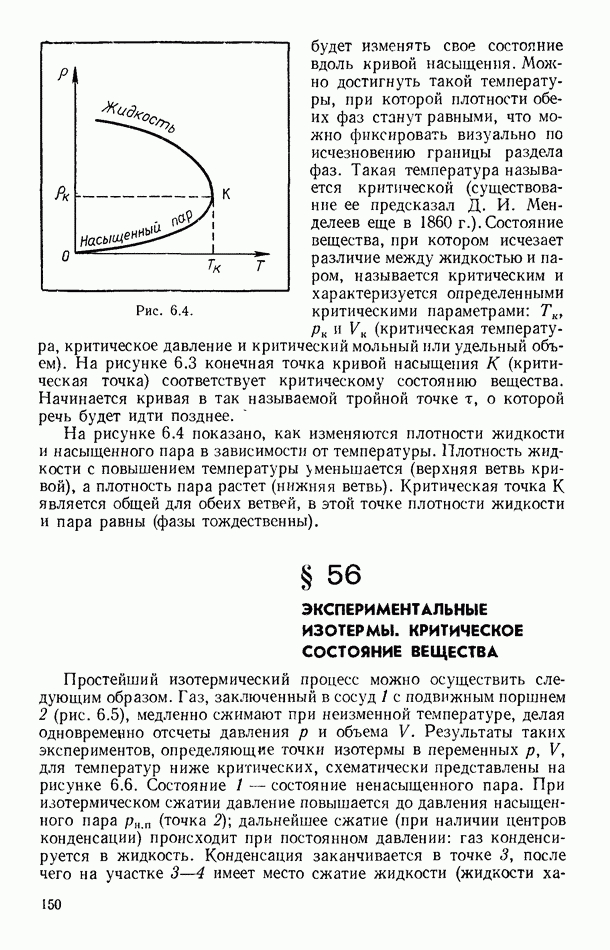
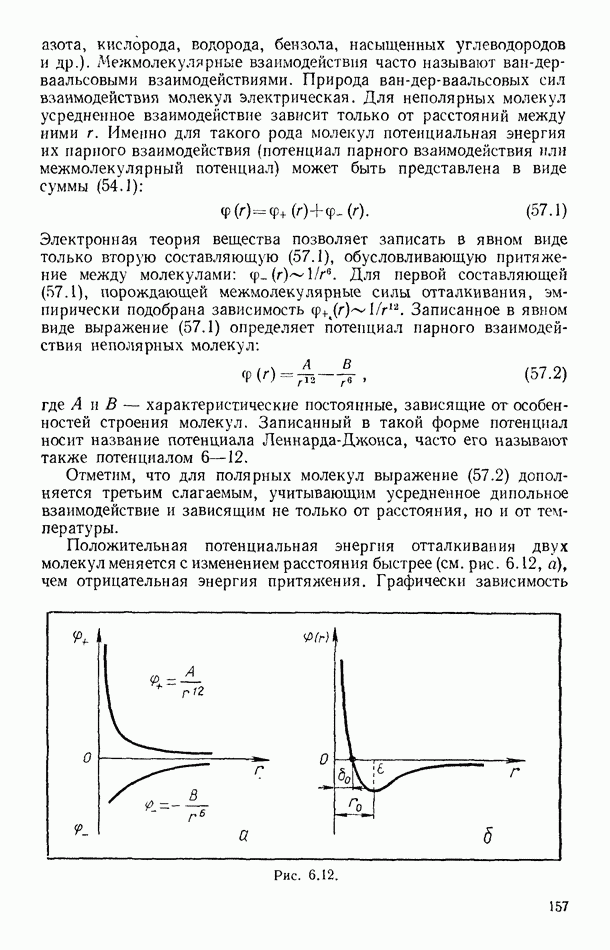
- § 69. ВТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ ДЛЯ НЕОБРАТИМЫХ ПРОЦЕССОВ
- § 70. НЕРАВЕНСТВО КЛАУЗИУСА. ПРИНЦИП ВОЗРАСТАНИЯ ЭНТРОПИИ
- § 71. ЭНТРОПИЯ И ВЕРОЯТНОСТЬ СОСТОЯНИЯ СИСТЕМЫ
- § 72. О ТАК НАЗЫВАЕМОЙ «ТЕПЛОВОЙ СМЕРТИ ВСЕЛЕННОЙ»
- § 73. ИЗОЭНТРОПИЧЕСКОЕ СОСТОЯНИЕ ТРОПОСФЕРЫ ЗЕМЛИ
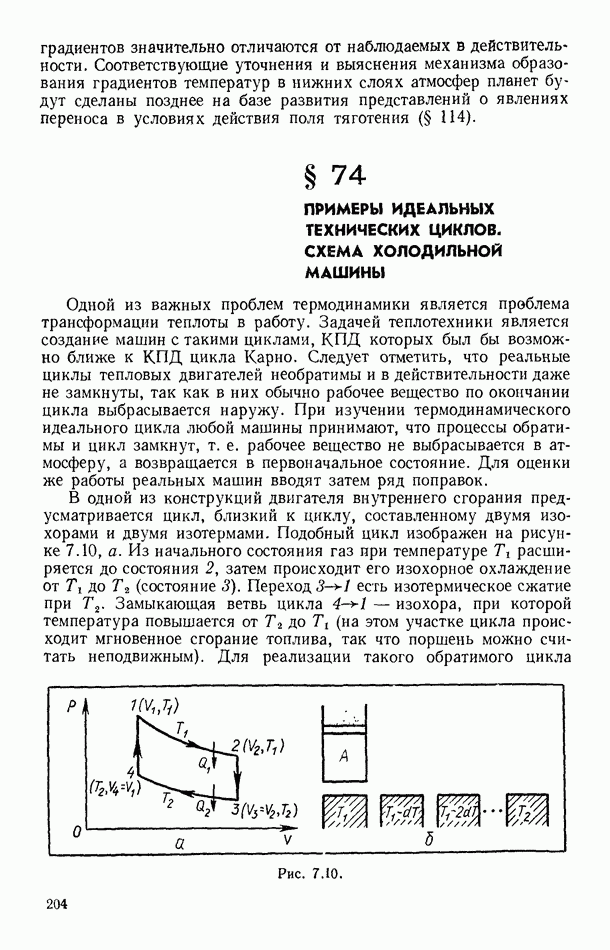
- § 74. ПРИМЕРЫ ИДЕАЛЬНЫХ ТЕХНИЧЕСКИХ ЦИКЛОВ. СХЕМА ХОЛОДИЛЬНОЙ МАШИНЫ
- Глава VIII. ЖИДКОСТИ
- § 75. ТЕПЛОВОЕ ДВИЖЕНИЕ И СТРУКТУРА ЖИДКОСТЕЙ
- § 76. ОСНОВНЫЕ СВОЙСТВА ЖИДКОСТЕЙ
- § 77. ПОВЕРХНОСТНОЕ НАТЯЖЕНИЕ ЖИДКОСТЕЙ
- § 78. МОЛЕКУЛЯРНОЕ ДАВЛЕНИЕ ПОВЕРХНОСТНОГО СЛОЯ ЖИДКОСТИ
- § 79. СИЛЫ, ВОЗНИКАЮЩИЕ НА КРИВОЙ ПОВЕРХНОСТИ ЖИДКОСТЕЙ
- § 80. КРАЕВОЙ УГОЛ. КАПИЛЛЯРНЫЕ ЯВЛЕНИЯ
- § 81. КИПЕНИЕ ЖИДКОСТЕЙ
- § 82. ТЕПЛОТА ПАРООБРАЗОВАНИЯ ЖИДКОСТЕЙ
- § 83. УРАВНЕНИЕ КЛАПЕЙРОНА — КЛАУЗИУСА
- § 84. ВЯЗКОСТЬ ЖИДКОСТЕЙ
- § 85. ЖИДКИЕ РАСТВОРЫ. ОСМОТИЧЕСКОЕ ДАВЛЕНИЕ. ЗАКОН РАУЛЯ
- § 86. ЖИДКИЙ ГЕЛИЙ. СВЕРХТЕКУЧЕСТЬ
- Глава IX. ТВЕРДЫЕ ТЕЛА
- § 87. ОСНОВНЫЕ ОСОБЕННОСТИ ТВЕРДЫХ ТЕЛ
- § 88. СТРУКТУРА КРИСТАЛЛОВ
- § 89. ФИЗИЧЕСКИЕ ТИПЫ КРИСТАЛЛИЧЕСКИХ РЕШЕТОК
- § 90. ТЕПЛОВОЕ ДВИЖЕНИЕ В КРИСТАЛЛАХ
- § 91. МЕХАНИЧЕСКИЕ СВОЙСТВА КРИСТАЛЛОВ
- § 92. ДЕФЕКТЫ В ТВЕРДЫХ ТЕЛАХ
- § 93. ТЕПЛОВОЕ РАСШИРЕНИЕ ТВЕРДЫХ ТЕЛ
- § 94. ТЕПЛОЕМКОСТЬ ТВЕРДЫХ ТЕЛ
- § 95. ПЛАВЛЕНИЕ И КРИСТАЛЛИЗАЦИЯ
- § 96. ДИАГРАММЫ СОСТОЯНИЙ. ТРОЙНАЯ ТОЧКА
- § 97. ТЕПЛОТА ПЛАВЛЕНИЯ ПРОСТЫХ КРИСТАЛЛИЧЕСКИХ СТРУКТУР
- Глава X. ПОЛИМЕРЫ
- § 98. ОБЩИЕ ПРЕДСТАВЛЕНИЯ
- § 99. ПОЛУЧЕНИЕ ПОЛИМЕРОВ
- § 100. НЕКОТОРЫЕ ТИПЫ ПОЛИМЕРОВ. РОЛЬ МЕЖМОЛЕКУЛЯРНЫХ ВЗАИМОДЕЙСТВИЙ
- § 101. ТРИ СОСТОЯНИЯ АМОРФНЫХ ПОЛИМЕРОВ И ТЕПЛОВОЕ ДВИЖЕНИЕ В НИХ
- § 102. ЭЛАСТИЧНОСТЬ ПОЛИМЕРОВ
- § 103. КРИСТАЛЛИЧЕСКИЕ ПОЛИМЕРЫ
- § 104. ПРИМЕНЕНИЕ ПОЛИМЕРНЫХ МАТЕРИАЛОВ
- Глава XI. ЭЛЕМЕНТЫ ТЕРМОДИНАМИКИ ТЕКУЧИХ СРЕД И РАКЕТНОЙ ТЕХНИКИ
- § 105. РАБОТА ПЕРЕМЕЩЕНИЯ В ТЕКУЧИХ СРЕДАХ
- § 106. ЗАКОН СОХРАНЕНИЯ ЭНЕРГИИ ДЛЯ ПОТОКОВ ГАЗОВ И ЖИДКОСТЕЙ
- § 107. ЧАСТНЫЕ СЛУЧАИ ТЕЧЕНИЯ СРЕД
- § 108. ИСТЕЧЕНИЕ ГАЗОВ ИЗ СОПЕЛ. КРИТИЧЕСКАЯ СКОРОСТЬ
- § 109. ПРИНЦИП ДВИЖЕНИЯ РАКЕТ
- § 110. ЭЛЕМЕНТАРНАЯ ТЕРМОДИНАМИКА РАКЕТНОГО ДВИГАТЕЛЯ
- § 111. СХЕМЫ РАКЕТНЫХ ДВИГАТЕЛЕЙ
- § 112. МНОГОСТУПЕНЧАТЫЕ РАКЕТЫ
- § 113. ДВИЖЕНИЕ СО СВЕРХЗВУКОВОЙ СКОРОСТЬЮ. УДАРНЫЕ ВОЛНЫ
- § 114. О ГРАДИЕНТЕ ТЕМПЕРАТУРЫ В ТРОПОСФЕРЕ ЗЕМЛИ