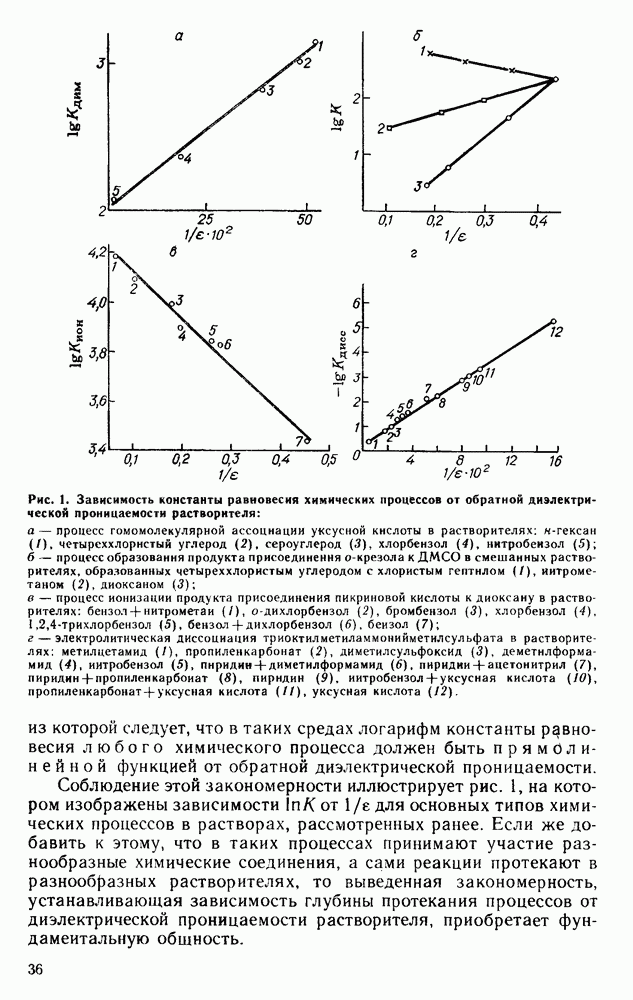
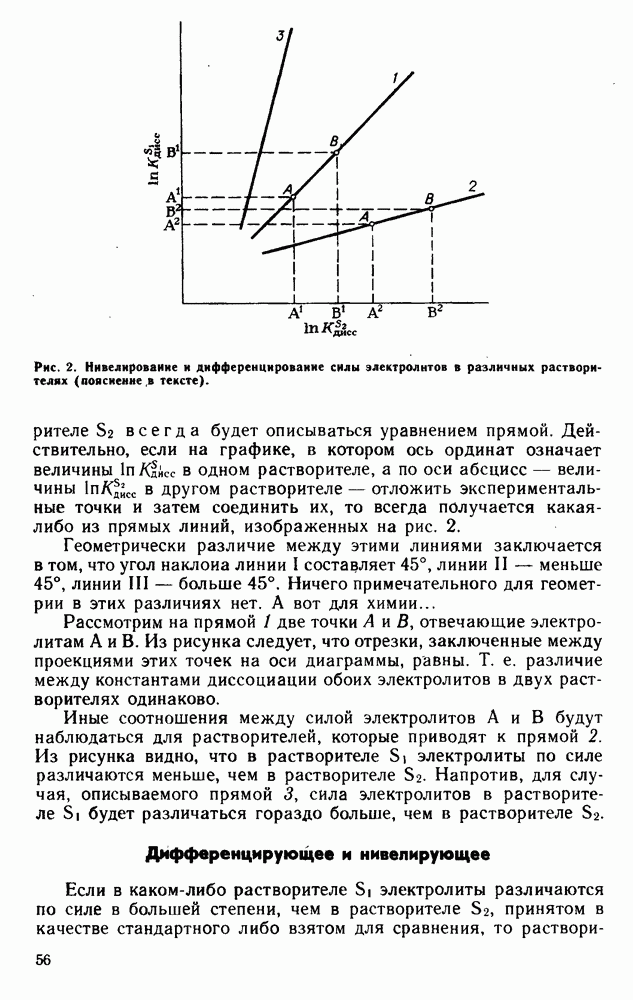
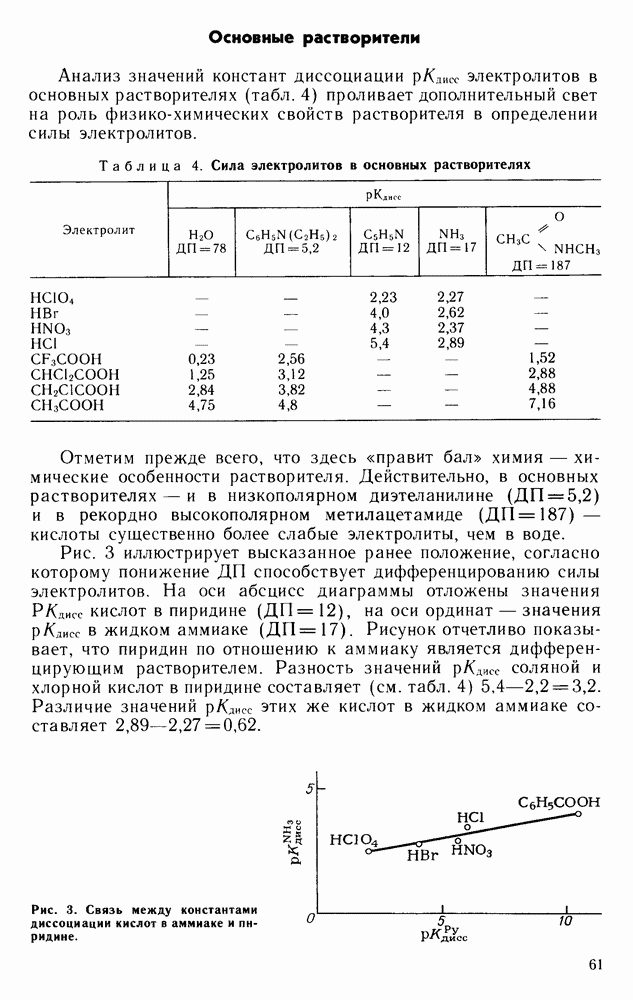
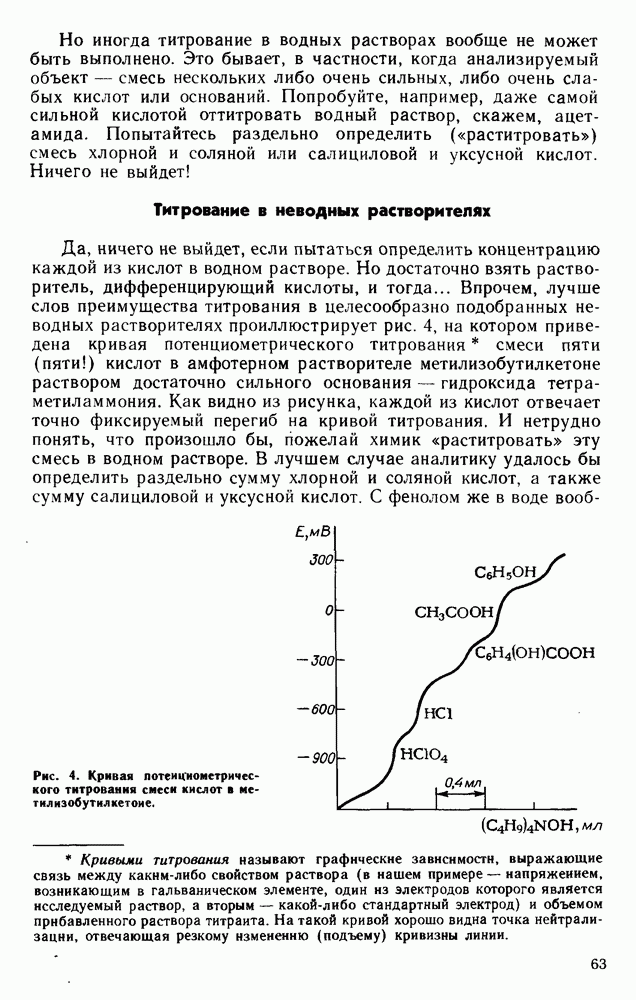
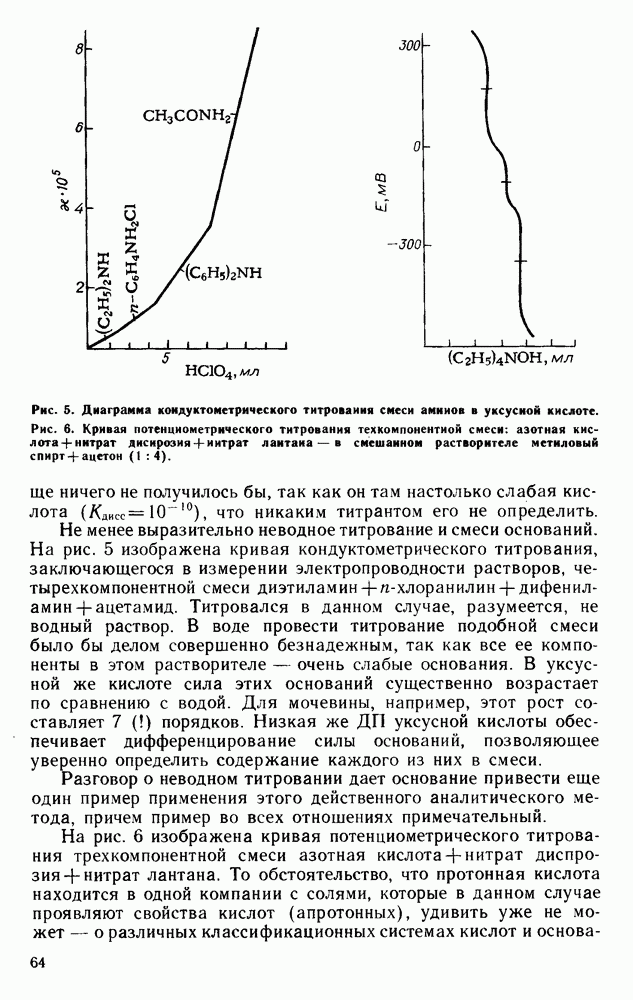
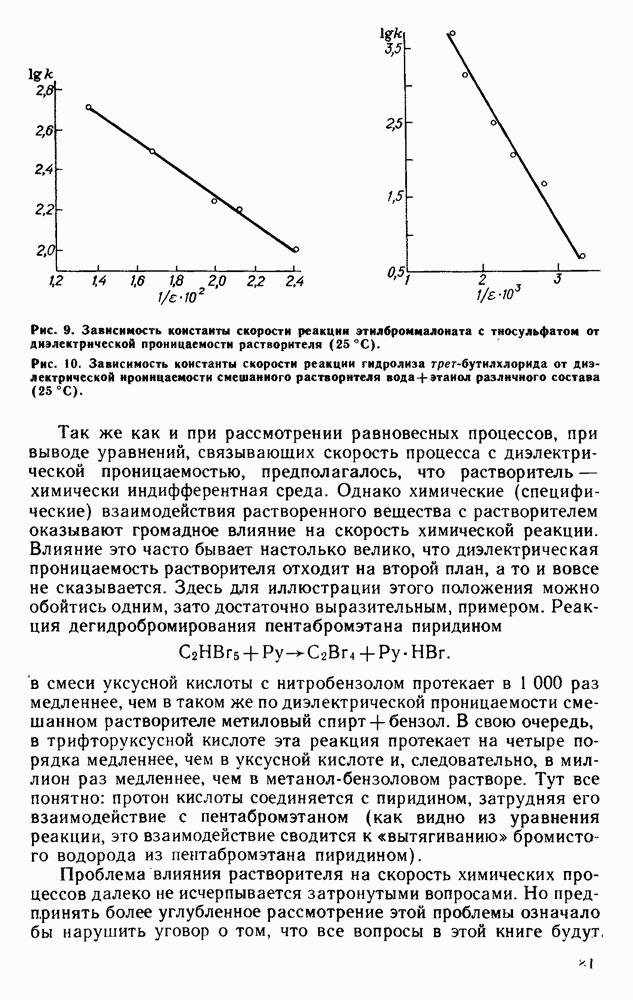
| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
КЛАССИФИКАЦИЯ РАСТВОРИТЕЛЕЙ
— звучит суховато, но без нее, как без компаса, легко заблудиться в лесу растворителей, тем более, что «сосен» там куда больше трех.
Систем классифицирования растворителей существует много, очень много, и ни одна из них не лишняя. Сопоставляют растворители по летучести и вязкости, по температуре замерзания и по цвету, по электропроводности и по запаху, по растворяющей способности и по цене... Но нас, химиков, в первую очередь интересует расстановка растворителей...
...По химическому ранжиру
Внимание, которое на предыдущих страницах было уделено кислотам и основаниям, побуждает в основу первого признака классификации положить кислотно-основные свойства растворителя. Признак убедительный и простой. Чего уж проще: кислоты следует отнести к кислотным растворителям, а основания — к основным.
«Проще»... К сожалению (а, быть может, к счастью) в науке никогда не бывает «проще», но всегда — «сложнее».
Разумеется, не вызывает сомнений, что абсолютные (безводные) серная, уксусная и все иные водородные кислоты должны быть отнесены к классу кислотных растворителей. Прочтя вступительную главу о кислотах и основаниях, каждый согласится с тем, что к кислотным растворителям должны быть отнесены и жидкие либо легкоплавкие апротонные кислоты, например, четыреххлористое олово или трехбромистая сурьма. Но этими представителями типичных кислот класс кислотных растворителей не исчерпывается.
Водород может проявлять кислотную функцию (например, замещаться на мёталл, вступать в реакцию с ионом гидроксила и т. д.) не только у типичных кислот и их собратьев (сестер?). В этом плане, например, фенол  или его родственник крезол
или его родственник крезол  такие же равноправные кислоты, как
такие же равноправные кислоты, как 
или  Растворы фенолов в воде дают отчетливую кислую реакцию, водород в группе
Растворы фенолов в воде дают отчетливую кислую реакцию, водород в группе  может замещаться на металл (образуя, например, фенолят натрия). Впрочем, удивляться этому не приходится. В конце-концов, протон, который в растворах отщепляет традиционные водородные кислоты, также происходит из групп
может замещаться на металл (образуя, например, фенолят натрия). Впрочем, удивляться этому не приходится. В конце-концов, протон, который в растворах отщепляет традиционные водородные кислоты, также происходит из групп  что легко увидеть из простейших структурных формул этих кислот. Однако кислотами, водородными кислотами, могут быть и соединения, в молекулах которых группа
что легко увидеть из простейших структурных формул этих кислот. Однако кислотами, водородными кислотами, могут быть и соединения, в молекулах которых группа  безусловно и категорически отсутствует.
безусловно и категорически отсутствует.
Безусловно и категорически отсутствует эта группа, к примеру, в пентахлорэтане  Однако, если прилить к этому соединению какое-либо сильное основание, скажем, пиридин, то почти сразу образуется солянокислый пиридин
Однако, если прилить к этому соединению какое-либо сильное основание, скажем, пиридин, то почти сразу образуется солянокислый пиридин  (или
(или  Здесь протекает реакция
Здесь протекает реакция  Проще говоря, пиридин «вытягивает» хлористый водород из пентахлорэтана, и таким образом, последний по отношению к основанию-пиридину выступает в роли водородной кислоты.
Проще говоря, пиридин «вытягивает» хлористый водород из пентахлорэтана, и таким образом, последний по отношению к основанию-пиридину выступает в роли водородной кислоты.
Ничего необычного в поведении пентахлорэтана нет. Столь внушительное число атомов хлора в этом соединении, оттягивающих на себя электроны, приводит к тому, что единственный атом водорода становится таким же подвижным, как водород в «типичных» водородных кислотах. И, следовательно, имеются веские причины отнести пентахлорэтан к кислотам.
Приливая пиридин к хлорэтану  содержащему лишь один атом хлора в молекуле, мы не обнаружим ни видимых изменений, ни образования даже следов солянокислого пиридина. Однако, исследуя этот раствор различными физико-химическими методами, мы без труда установим, что ингредиенты раствора вступили в химическое взаимодействие, образуя гетеромолекулярный ассоциат
содержащему лишь один атом хлора в молекуле, мы не обнаружим ни видимых изменений, ни образования даже следов солянокислого пиридина. Однако, исследуя этот раствор различными физико-химическими методами, мы без труда установим, что ингредиенты раствора вступили в химическое взаимодействие, образуя гетеромолекулярный ассоциат  Ионы при этом не образуются и, следовательно, общая схема равновесий в растворах (см. с. 32) обрывается на первой стадии. Но компоненты раствора-то провзаимодействовали, и это в данном случае самое главное.
Ионы при этом не образуются и, следовательно, общая схема равновесий в растворах (см. с. 32) обрывается на первой стадии. Но компоненты раствора-то провзаимодействовали, и это в данном случае самое главное.
Конечно, один-единственный атом хлора сделать подвижными все пять атомов водорода в хлорэтане не может, но характер электронного окружения атомов водорода по сравнению с этаном изменяет. И этого искажения достаточно, чтобы атомы водорода в  могли проявлять способность к химическому взаимодействию, точнее, к образованию водородной связи
могли проявлять способность к химическому взаимодействию, точнее, к образованию водородной связи  Именно поэтому имеются основания относить галоидные производные алифатических углеводородов — особенно в тех случаях, когда речь идет о растворах в них сильных оснований, — к кислотным растворителям.
Именно поэтому имеются основания относить галоидные производные алифатических углеводородов — особенно в тех случаях, когда речь идет о растворах в них сильных оснований, — к кислотным растворителям.
Все, что было сказано о галоидных соединениях предельных углеводородов (галоидалканах), с полным основанием может
быть перенесено и на нитроалканы, например, нитрометан  Нитрогруппа, как и атомы галогенов, оттягивает на себя электроны, и поэтому нитроалканы могут быть отнесены к кислотным растворителям, для чего имеются причины, даже более весомые, чем в случае галоидных производных углеводородов. Нитроалканы могут существовать в двух таутомерных формах, строение которых (в первом приближении) может быть представлено структурными формулами:
Нитрогруппа, как и атомы галогенов, оттягивает на себя электроны, и поэтому нитроалканы могут быть отнесены к кислотным растворителям, для чего имеются причины, даже более весомые, чем в случае галоидных производных углеводородов. Нитроалканы могут существовать в двух таутомерных формах, строение которых (в первом приближении) может быть представлено структурными формулами:

Как видим, форма II имеет все основания претендовать на роль водородной кислоты.
Итак, можно заключить, что наличие в молекуле растворителя атома или группы атомов, притягивающих к себе электроны, позволяет отнести такой растворитель к кислотным. Для усиления этой логики упомянем еще об одной группе апротонных кислот-растворителей, о которых не было повода поговорить в разделе, посвященном кислотам и основаниям.
В многообразии химических соединений встречается немало таких, которые содержат в своем составе водород, но тем не менее их относят к апротонным веществам. Иными словами, индивидуальность водорода в этих соединениях не проявляется. Действительно, изучая свойства, например, уксусной кислоты  можно поначалу прийти к выводу, что в ее составе — только один атом водорода — тот самый, что входит в состав гидроксильной группы —
можно поначалу прийти к выводу, что в ее составе — только один атом водорода — тот самый, что входит в состав гидроксильной группы —  Группировка же
Группировка же  выступает как одно целое.
выступает как одно целое.
Вот почему такие растворители, содержащие водород, как например, хлористый ацетил  или уксусный ангидрид
или уксусный ангидрид  называют апротонными. Кислотными же они являются потому что содержат электроноакцепторные группировки — атом хлора у хлористого ацетила и атомы кислорода в карбоксильной группе
называют апротонными. Кислотными же они являются потому что содержат электроноакцепторные группировки — атом хлора у хлористого ацетила и атомы кислорода в карбоксильной группе  у уксусного ангидрида. Причем кислотность этих соединений обусловлена участием в реакциях электроноакцепторных групп, но не водорода, как у «типичных» кислот.
у уксусного ангидрида. Причем кислотность этих соединений обусловлена участием в реакциях электроноакцепторных групп, но не водорода, как у «типичных» кислот.
Все сказанное предопределяет отбор тех признаков, по которым классифицируют кислотные растворители: протолитические и апротонные.
К протолитическим относят те растворители, кислотные свойства которых обусловлены участием в реакциях с основаниями атома водорода, входящего в состав молекулы растворителя. Это прежде всего жидкие кислоты, определяемые этим термином в традиционной химической номенклатуре:  и т. д. По праву в это подразделение включают и
и т. д. По праву в это подразделение включают и
жидкие фенолы, принадлежность которых к кислотным растворителям обосновывалась ранее.
На первый взгляд, быть может, неожиданно, что в подраздел протолитических кислотных растворителей входят спирты. Но неожиданного здесь ничего нет. Встречаются реакции, в которых спирты ведут себя как самые что ни на есть типичные водородные кислоты. Так, щелочные или щелочноземельные металлы вытесняют из спиртов водород, образуя соли, называемые алгоколятами, например: 
Апротонные кислотные растворители подразделяют на подгруппы, каждая из которых объединяет жидкости, достаточно сильно различающиеся по отношению к растворенным в них веществам.
В первой подгруппе весьма распространены растворители, которые, вступая с растворенным основанием (еще раз напоминаем, что коль скоро растворитель кислотный, то все, что в нем растворено — по необходимости основание) в кислотно-основное взаимодействие, отдают ему протон лишь в частичное владение. При этом образуется гетеромолекулярный ассоциат, партнеры в котором соединены друг с другом через водородную связь, не переходящую однако в ионную. При таком делении в группу апротонных растворителей попадает хлористый этилен (вспомним раствор пиридина в этом растворителе), хлороформ, который, к примеру, с ацетоном образует гетеромолекулярный ассоциат  и т. д.
и т. д.
Вторую подгруппу апротонных растворителей составляют жидкости, кислотно-основное взаимодействие которых с растворенным соединением происходит не вследствие «дележа» протона с основанием, а в результате притягивания электронной пары от основания электроноакцепторными атомами или группами в молекулах растворителя. Здесь мы встречаем уксусный ангидрид  и хлористый ацетил
и хлористый ацетил  кислотная природа которых обосновывалась выше. В эту подгруппу входят разнообразные нитросоединения, среди которых главный — нитрометан — один из самых распространенных в исследовательской и технологической практике растворителей.
кислотная природа которых обосновывалась выше. В эту подгруппу входят разнообразные нитросоединения, среди которых главный — нитрометан — один из самых распространенных в исследовательской и технологической практике растворителей.
Третья подгруппа апротонных кислотных растворителей включает жидкие либо легкоплавкие галогениды элементов III— V групп периодической системы Д. И. Менделеева — бора, алюминия, галлия, германия, олова, сурьмы и некоторых других. Об этих апротонных соединениях уже говорилось достаточно много, чтобы безоговорочно признать за ними право входить в класс кислот и, следовательно, кислотных растворителей.
Расставив по группам кислотные растворители, займемся основными растворителями. Способность химического соединения выступать в роли основания определяют его стремлением передавать партнеру — кислотному соединению в полное либо частичное владение электронную пару. Вот почему
вместо термина «основный растворитель» часто применяют понятный синоним «донорный».
Разнообразие основных растворителей определяется относительно большим числом элементов, атомы которых могут выступать в роли доноров электронов. Поэтому целесообразнее всего в основу классификации донорных растворителей положить привычную номенклатуру органических соединений. Вот почему подразделения основных растворителей будут обозначаться знакомыми терминами: «амины», «эфиры» и т. д.
Самым характерным электронодонором является, пожалуй, атом азота в аминах: первичных  вторичных
вторичных  третичных
третичных  углеводородные группы, часто называемые по старинке радикалами), а также в гетероциклических, например, пиридине. Схематически электронное строение молекул аминов может быть изображено следующим образом:
углеводородные группы, часто называемые по старинке радикалами), а также в гетероциклических, например, пиридине. Схематически электронное строение молекул аминов может быть изображено следующим образом:

Силу донорных растворителей определяют энергией, с которой их молекулы взаимодействуют с электроноакцептором-кислотой. Чаще всего в роли последнего выступает, разумеется, протон, так как водородные кислоты, заметим это еще раз, все же — самые распространенные представители этого класса.
Сила растворителей-аминов зависит от числа и природы заместителей у атома азота. Если эти заместители алифатические (предельные, насыщенные) группы, то в общем случае сила аминов растет от первичных к третичным аминам. Поэтому, например, этиламин  уступает по силе диэтиламину
уступает по силе диэтиламину  а оба они пасуют перед триэтиламином
а оба они пасуют перед триэтиламином  Однако поскольку фенильная группировка
Однако поскольку фенильная группировка  будучи электроноакцептором, сама непрочь полакомиться электронами, то, оттягивая на себя электронную пару, она ослабляет плотность электронов на атоме азота и поэтому анилин
будучи электроноакцептором, сама непрочь полакомиться электронами, то, оттягивая на себя электронную пару, она ослабляет плотность электронов на атоме азота и поэтому анилин  как основание уступает по силе этиламину. Если же с атомом азота соединены сразу два фенильных радикала, то сила амина как основания падает настолько, что такой вторичный амин, как например, дифениламин, может по отношению к достаточно высокодонорному партнеру, скажем, триэтиламину, выступать в роли... кислоты. Действительно, растворяя дифениламин в этом растворителе, можно установить образование соединения
как основание уступает по силе этиламину. Если же с атомом азота соединены сразу два фенильных радикала, то сила амина как основания падает настолько, что такой вторичный амин, как например, дифениламин, может по отношению к достаточно высокодонорному партнеру, скажем, триэтиламину, выступать в роли... кислоты. Действительно, растворяя дифениламин в этом растворителе, можно установить образование соединения  которое пусть и не распадается на ионы, но в котором атом водорода, принадлежавший дифениламину, в значительной степени отошел от своего прежнего владельца, а правами
которое пусть и не распадается на ионы, но в котором атом водорода, принадлежавший дифениламину, в значительной степени отошел от своего прежнего владельца, а правами
на него почти полностью завладел триэтиламин. Функции партнеров — кислотная у дифениламина и основная у триэтиламина — здесь очевидны. А приведенный пример дает еще один и отнюдь нелишний повод вспомнить об амфотерности как общем свойстве химических соединений.
В семейство азотсодержащих основных растворителей входят нитрилы — соединения, содержащие группировку  Представители нитрилов — ацетонитрил
Представители нитрилов — ацетонитрил  и бензонитрил
и бензонитрил  одни из излюбленных растворителей в лабораторной и технологической практике.
одни из излюбленных растворителей в лабораторной и технологической практике.
Вторая подгруппа донорных растворителей объединяет жидкости, основность которых обусловлена атомом кислорода. Впрочем, далеко не каждый атом кислорода, входящий в молекулу органического соединения, может проявлять электронодонорные свойства. Все зависит от того, в какой химической связи находится этот элемент.
Самый основный кислород — эфирный, т. е. кислород, находящийся в химической связи  Эту группировку содержат прежде всего разнообразные простые эфиры. А многообразие их и впрямь велико. Здесь и диалкильные эфиры
Эту группировку содержат прежде всего разнообразные простые эфиры. А многообразие их и впрямь велико. Здесь и диалкильные эфиры  например, хорошо знакомый каждому диэтиловый эфир. Здесь и диоксан, высокая основность которого обусловлена присутствием в его молекуле сразу двух эфирных атомов кислорода. И гетероциклический эфир тетрагидрофуран, и пропиленкарбонат — едва ли не самый популярный растворитель 70—80-х гг. (и среди растворителей бывают «звезды»!):
например, хорошо знакомый каждому диэтиловый эфир. Здесь и диоксан, высокая основность которого обусловлена присутствием в его молекуле сразу двух эфирных атомов кислорода. И гетероциклический эфир тетрагидрофуран, и пропиленкарбонат — едва ли не самый популярный растворитель 70—80-х гг. (и среди растворителей бывают «звезды»!):

Электронодонорным может быть и карбонильный кислород — атом кислорода в кетонах либо альдегидах. Поэтому молекулы этих соединений обнаруживают тенденцию, подчас достаточно четкую, к взаимодействию с кислотами.
Встретив в перечне основных растворителей спирты, которые страницей ранее размещались среди кислотных растворителей, читатель, вспомнив неоднократные призывы не забывать об амфотерности, уже не удивится. Действительно, спирты по отношению к растворенным в них кислотам проявляют свойства оснований, что связано именно с электронодонорностью кислорода. Так, например, при растворении  в этаноле вначале образуется водородная связь между атомом кислорода в спирте и атомом водорода в
в этаноле вначале образуется водородная связь между атомом кислорода в спирте и атомом водорода в  энергия взаимодействия между компонентами этого раствора столь значительна, что в результате взаимодействия образуются ионы:
энергия взаимодействия между компонентами этого раствора столь значительна, что в результате взаимодействия образуются ионы:

Электронодонорной может быть и сера. Об этом необходимо упомянуть хотя бы потому, что серусодержащим является один из самых распространенных растворителей диметилсульфоксид:

Очень широкое распространение диметилсульфоксида в химии и химической промышленности обусловлено его высокой донорностью, растворяющей способностью и нетоксичностью.
К серусодержащим относят и сульфолан, который по растворяющей способности, пожалуй, не уступает диметилсульфоксиду, но существенно менее основен.
Наконец, упомянем один фосфорсодержащий растворитель — гексаметилфосфортриамид, или гексаметанол.
Характеризуя силу растворителей как кислот либо оснований, мы неоднократно прибегали к определениям «больше — меньше» или «выше — ниже». Не приходится говорить, что в данном случае эти почти лирические понятия желательно заменить прозаическими числами, которые характеризовали бы меру кислотности либо основности жидкостей. Но прежде, чем перейти к числам, автор, рискуя заработать обвинение в редкой непоследовательности, должен сделать
Почти лирическое отступление
Собственно, отступлений будет два. Первое из них — замешанные на досаде, обиде и признании (весьма относительном) собственной виды сетование химиков относительно трудностей
создания шкал кислотности либо основности растворителей. Признавая всю эмоциональную несокрушимость закона «оправдывающийся всегда неправ», попытаюсь тем не менее выстроить цепочку проблем, которые необходимо решить для того, чтобы найти подходящую меру кислотности либо основности растворителей.
Существует немало количественных характеристик, указывающих на степень кислотности или основности молекулы. Одна из самых распространенных — энергия сродства к протону, т. е. та энергия, которая выделяется при присоединении в газовой фазе одного грамм-атома несольватированных протонов к одной грамм-молекуле растворителя. Эта выражаемая в джоулях либо в электрон-вольтах величина могла бы служить превосходной мерой основности, если бы все это относилось не к газовой фазе, а к жидкости, где протон, конечно же, сольватирован, и уже хотя бы поэтому реальная энергия его взаимодействия с растворителем будет иной, чем в газе. Но это далеко не самое главное.
Самое же главное то, что каждая жидкость характеризуется более или менее значительной величиной диэлектрической проницаемости — свойства, которому на предыдущих страницах было отведено достаточно много внимания, в то время как газ (если он только не находится под высоким давлением), подобно вакууму, имеет ДП, равную всего единице. Вот почему электростатические взаимодействия в жидком растворителе протекают совсем по-иному, чем в газовой фазе. А поскольку вклад электростатических взаимодействий в общую энергетику процесса в растворе может быть значительным, нередко преобладающим, то суждения об основности молекул растворителя, установленные в газовой фазе, оказываются непригодными для жидкого растворителя.
Все сказанное об энергии сродства к протону как не очень удачной мере основности растворителя в полном объеме относится и к энергии сродства молекулы растворителя к электрону как мере кислотности. Сопоставляя значение энергии, с какой электрон присоединяется к молекулам различных растворителей в газовой фазе, мы можем переносить сделанные при этом заключения об относительной кислотности растворителей на жидкую фазу лишь с величайшей осторожностью и с длинным рядом оговорок. Настолько длинным, что нередко прогноз о кислотности жидкого растворителя, выданный на основании значения энергии сродства к электрону, оказывается обескураживающе неверным.
Имеется еще одна причина, которая не позволяет переносить суждения о реакционной способности, установленные для отдельной молекулы, на поведение этих молекул в жидкости. Очень часто молекулы различных индивидуальных растворителей находятся в ассоциированном состоянии, образуя гомомолекулярные ассоциаты, о которых рассказывалось на с. 25. Химические же свойства молекул в ассоциатах отличаются, и нередко очень сильно, от свойств мономерных молекул.
Для подтверждения справедливости этого тезиса сопоставим формулы уксусной кислоты в мономерной и димерной формах:

мономер димер
Отчетливо видно, что гидроксильные протоны в димере уже вступили в химическое взаимодействие с донорными атомами кислорода партнера. Вот почему их стремление вступить во взаимодействие с «посторонними» основаниями в значительной степени уменьшено.
Можно утверждать, что если бы произошло нечто такое (что именно не могу и придумать), что заставило бы ассоциированные молекулы уксусной кислоты находиться в жидкой фазе в мономерном состоянии, то это соединение по силе сравнилось бы с серной либо хлорной кислотами, а то и превзошло бы их.
Все сказанное призвано подвести читателя к выводу о том, что создание рациональных шкал кислотности либо основности, шкал, в которых растворители были бы выстроены по ранжиру в строгом и бесспорном порядке, дело сложное. Настолько сложное, что удовлетворительных решений нет и поныне. Но это не означает, что их нет вообще.
| << Предыдущий параграф | Следующий параграф >> |
- ВВЕДЕНИЕ
- ЧТО ТАКОЕ КИСЛОТЫ И ОСНОВАНИЯ?
- Кислота — еще одно определение
- Без растворителя
- Отступление (нелирическое)
- «Ониевые соли»
- Отступление (нелирическое)
- Сольвосистемы
- Отступление очередное, почти лирическое
- Сановный протон
- Кислоты, основания, заряды…
- Теория ЖМКО
- Отступления, лирическое и нелирическое
- РАВНОВЕСИЯ В РАСТВОРАХ
- Распад и объединение молекул
- Продукты присоединения
- «Химические привидения»
- Дискуссии, споры…
- Посолить суп…
- Откуда берутся ионы?
- Общая схема равновесий в растворах
- ВЛИЯНИЕ РАСТВОРИТЕЛЯ НА ОТДЕЛЬНЫЕ СТАДИИ РАВНОВЕСИЯ В РАСТВОРАХ
- Константы равновесия
- КЛАССИФИКАЦИЯ РАСТВОРИТЕЛЕЙ
- Донорные и акцепторные числа растворителей
- Управлять растворителем…
- РАСТВОРИТЕЛЬ КАК СРЕДСТВО УПРАВЛЕНИЯ ХИМИЧЕСКИМИ ПРОЦЕССАМИ
- Управление молекулярным состоянием веществ в растворах
- Управление гетеромолекулярной ассоциацией
- И активисты, и лентяи
- Управление ионизацией
- Управление электролитической диссоциацией
- ДИФФЕРЕНЦИРУЮЩЕЕ И НИВЕЛИРУЮЩЕЕ ДЕЙСТВИЯ РАСТВОРИТЕЛЕЙ НА СИЛУ ЭЛЕКТРОЛИТОВ
- Дифференцирующее и нивелирующее
- Отступление — кислотно-основное
- И физика, и химия
- Небольшое отступление, или как следует сравнивать силу электролитов
- Кислотные растворители
- Основные растворители
- Амфотерные растворители
- Отступление о достоинствах и недостатках объемного анализа
- Титрование в неводных растворителях
- РАСТВОРИМОСТЬ В НЕВОДНЫХ РАСТВОРИТЕЛЯХ
- Некоторые количественные закономерности
- О ХИМИЧЕСКИХ ФОРМАХ СУЩЕСТВОВАНИЯ ЖИВОГО ВЕЩЕСТВА ВО ВСЕЛЕННОЙ
- «Подходящий растворитель»
- ЭЛЕКТРОЛИЗ НЕВОДНЫХ РАСТВОРОВ
- Ряды напряжений в неводных растворах
- Только не из воды
- КИНЕТИКА РЕАКЦИЙ В НЕВОДНЫХ РАСТВОРИТЕЛЯХ
- Типы взаимодействий и их скорость в растворе
- СИНТЕЗЫ В НЕВОДНЫХ РАСТВОРАХ
- БИБЛИОГРАФИЧЕСКИЙ СПИСОК РЕКОМЕНДАТЕЛЬНОЙ ЛИТЁРАТУРЫ