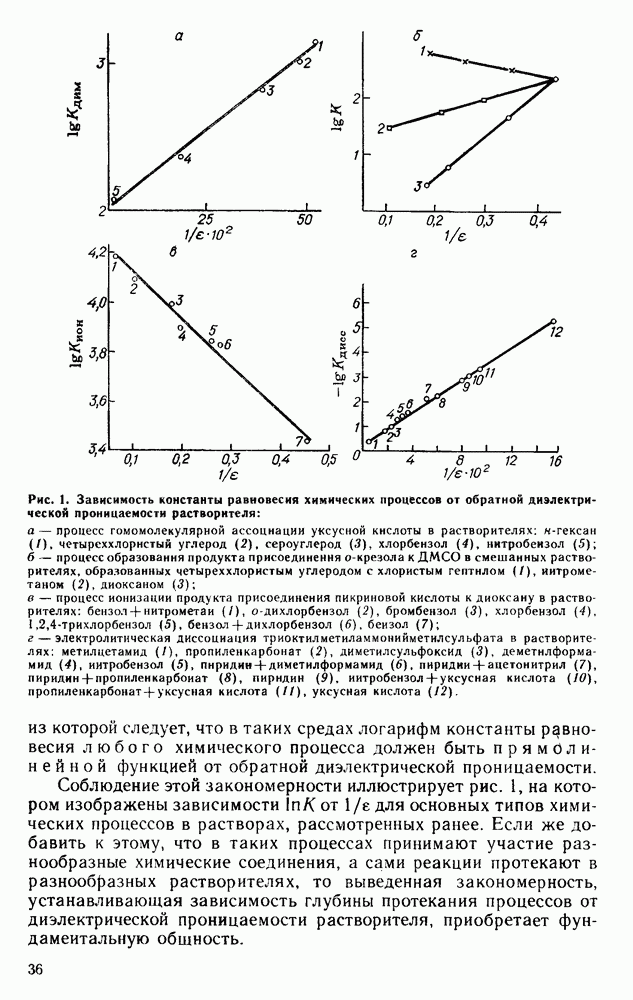
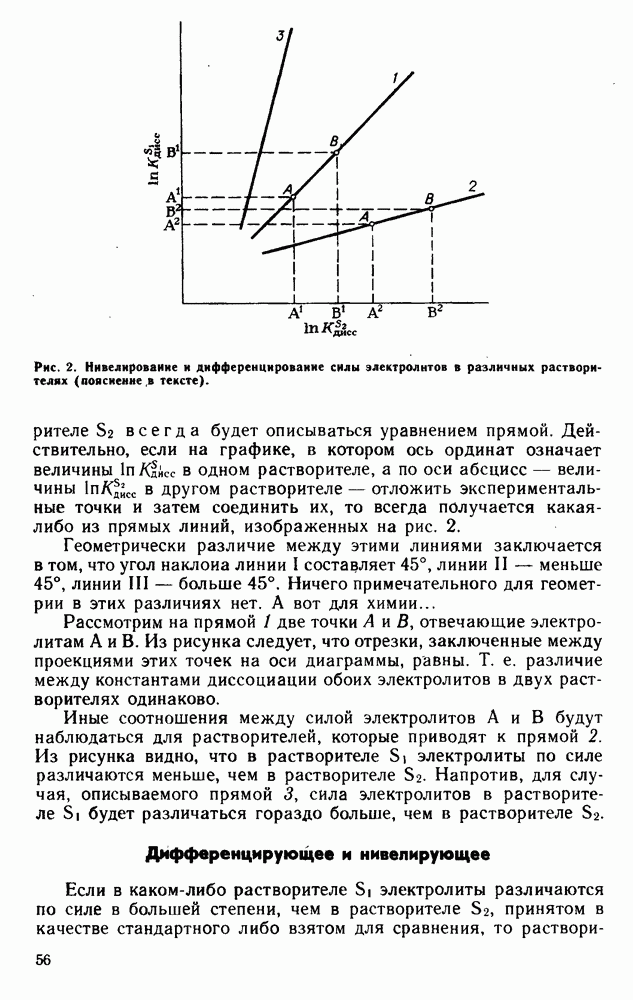
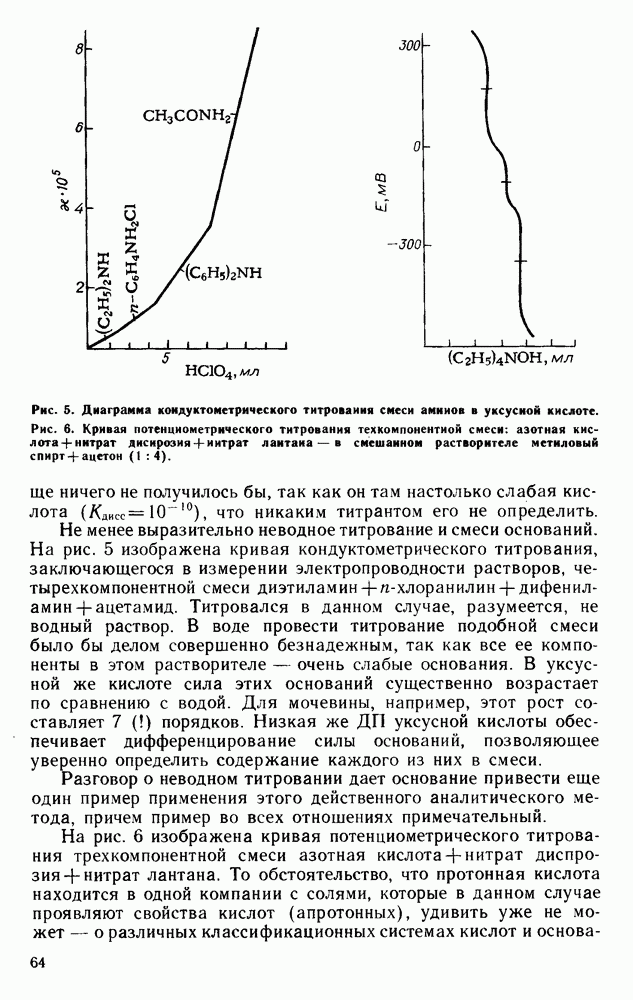
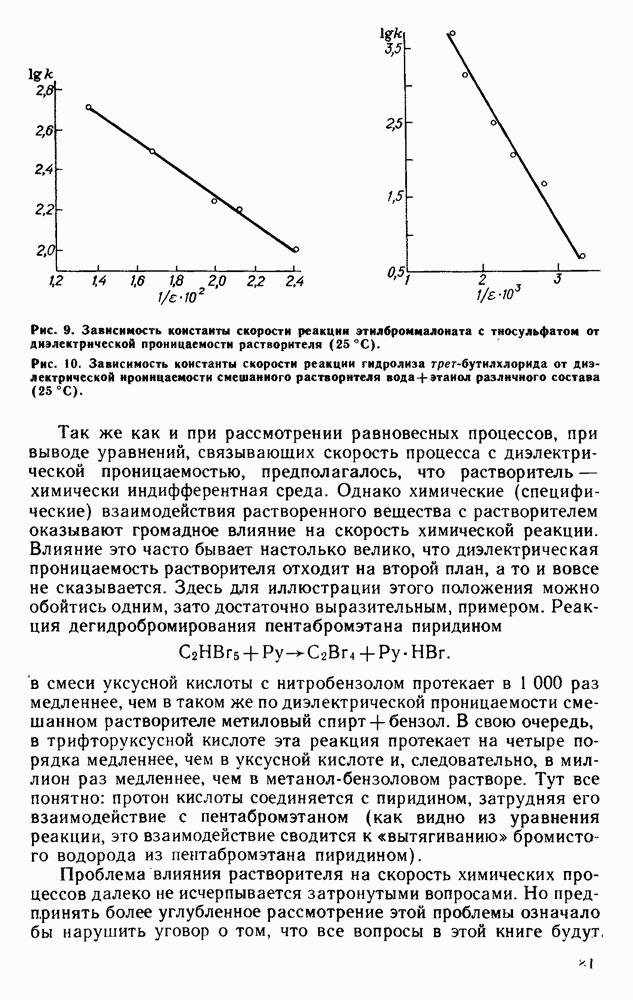
| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
КИНЕТИКА РЕАКЦИЙ В НЕВОДНЫХ РАСТВОРИТЕЛЯХ
относится к числу наиболее актуальных и наиболее изученных и в то же время практически весьма важных разделов химии неводных растворов.
Молекулы в «клетке»
Легко представить себе, да в общем и нетрудно провести такой эксперимент: изучить скорость, с какой протекает реакция между двумя веществами в газовой фазе и в растворе. Например, скорость реакции между  . В подавляющем большинстве случаев оказывается, что перенос газов в растворитель приводит к весьма существенному повышению скорости реакции. Однако это обстоятельство, на первый взгляд, вступает в противоречие с вводными положениями химической кинетики.
. В подавляющем большинстве случаев оказывается, что перенос газов в растворитель приводит к весьма существенному повышению скорости реакции. Однако это обстоятельство, на первый взгляд, вступает в противоречие с вводными положениями химической кинетики.
В самом деле, если учесть, что скорость химической реакции определяется частотой, с какой сталкиваются молекулы, то перенос участников реакции из газовой фазы в растворитель должен сдерживать развитие реакции, так как молекулы растворителя будут препятствовать столкновениям молекул реагирующих веществ.
Однако молекулы реагирующих веществ в растворителе движутся далеко не так хаотично, как в газовой фазе. Во всяком случае, на расстояниях, соизмеримых с диаметром молекул («ближний порядок»), эта упорядоченность проявляется весьма отчетливо даже в тех жидкостях, молекулы которых неассоциированы.
Каждый элемент структуры жидкости называют «клеткой». Попадая в такую «клетку», молекулы реагирующих веществ могут вырваться из нее, лишь затратив определенную энергию. Поэтому время пребывания друг около друга молекул реагирующих веществ в такой «клетке» больше, чем в случае реакций в газовой фазе. А раз больше время пребывания, то выше и вероятность столкновения, а следовательно, и скорость реакции. Подобное явление получило название «клеточного эффекта» и объясняет многие закономерности кинетики химических реакций в растворах.
Эксперименты и теории
Как это бывает почти всегда, проблема влияния растворителя на скорость химической реакции была исследована вначале качественно, а затем уже установленные закономерности получили количественную интерпретацию. Здесь прежде всего следует вспомнить классические исследования Н. А. Меншуткина о влиянии растворителя на скорость реакций кватернизации триалкил-аминов галогеналкилами  Еще в 1890 г. Меншуткин изучил скорость образования иодистого тетраэтиламмония в 22 различных растворителях и установил, что скорость может различаться почти в 750 раз. Описание этих исследований и поныне приводится, пожалуй, во всех учебниках физической химии.
Еще в 1890 г. Меншуткин изучил скорость образования иодистого тетраэтиламмония в 22 различных растворителях и установил, что скорость может различаться почти в 750 раз. Описание этих исследований и поныне приводится, пожалуй, во всех учебниках физической химии.
Век, который отделяет нас от экспериментов Меншуткина, приводит еще более выразительные примеры влияния растворителя на скорость химических реакций. Упомянем лишь один из многих: реакция превращения йодистого метила в хлористый метил  в диметилацетамиде протекает в семь с половиной миллионов раз быстрее чем в метаноле!
в диметилацетамиде протекает в семь с половиной миллионов раз быстрее чем в метаноле!
Следующий этап в познании закономерностей влияния растворителей на скорость химических реакций связан с учетом процессов сольватации реагентов.
При объяснении закономерностей влияния растворителя на скорость реакций нуклеофильного замещения Хьюз и Инголд исходили из элементарных представлений об электростатическом взаимодействии между ионом и полярной молекулой растворителя (см. с. 34). Несмотря на первую степень приближенности, им удалось достичь хорошей предсказательности, а это, как известно, является отличительным признаком плодотворной теории.
Для реакций нуклеофильного замещения, механизм которых связан с распределением зарядов в реагирующей молекуле в момент активации, скорость реакции повышается с ростом диэлектрической проницаемости растворителя, что способствует ионизации связи. Так, в реакциях сольволиза трет-бутилхлорида  являющегося излюбленным объектом в исследованиях влияния среды на кинетику химических процессов, протекание процесса связано с промежуточным образованием ионный пары
являющегося излюбленным объектом в исследованиях влияния среды на кинетику химических процессов, протекание процесса связано с промежуточным образованием ионный пары  вследствие чего в ряду растворителей этиловый спирт (ДП = 24,3) - метиловый спирт (ДП = 32,6) — формамид (ДП= 109,5) соотношение скорости реакций равно 1:9:430. Интересно, что в воде, которая из-за своей исключительно высокой сольватирующей способности обеспечивает ионизацию, скорость реакции в 335 000 раз выше, чем в этаноле.
вследствие чего в ряду растворителей этиловый спирт (ДП = 24,3) - метиловый спирт (ДП = 32,6) — формамид (ДП= 109,5) соотношение скорости реакций равно 1:9:430. Интересно, что в воде, которая из-за своей исключительно высокой сольватирующей способности обеспечивает ионизацию, скорость реакции в 335 000 раз выше, чем в этаноле.
В уже упоминавшихся реакциях кватернизации (реакции Меншуткина), также приводящих к образованию ионной пары
 повышение диэлектрической проницаемости растворителя ведет к существенному повышению скорости реакции. Так, скорость реакции алкилирования
повышение диэлектрической проницаемости растворителя ведет к существенному повышению скорости реакции. Так, скорость реакции алкилирования  -пиколина бромацетофеноном при переходе от толуола (ДП = 2,3) к нитробензолу (ДП = 34,8) увеличивается в 25 раз.
-пиколина бромацетофеноном при переходе от толуола (ДП = 2,3) к нитробензолу (ДП = 34,8) увеличивается в 25 раз.
Напротив, реакции, при которых происходит распределение (уничтожение) заряда, уменьшают свою скорость при повышении диэлектрической проницаемости растворителя. Так, реакция распада триэтилсульфонийбромида  в хлороформе
в хлороформе  проходит в 230 раз быстрее, чем в бензиловом спирте
проходит в 230 раз быстрее, чем в бензиловом спирте 
Естественно, что нейтрализация зарядов при реакции нуклеофильного замещения также ведет к тому, что повышение диэлектрической проницаемости растворителя понижает скорость процесса. Так, скорость гидролиза солей триметилсульфония  при переходе от этилового спирта к воде уменьшается в
при переходе от этилового спирта к воде уменьшается в  раз.
раз.
| << Предыдущий параграф | Следующий параграф >> |
- ВВЕДЕНИЕ
- ЧТО ТАКОЕ КИСЛОТЫ И ОСНОВАНИЯ?
- Кислота — еще одно определение
- Без растворителя
- Отступление (нелирическое)
- «Ониевые соли»
- Отступление (нелирическое)
- Сольвосистемы
- Отступление очередное, почти лирическое
- Сановный протон
- Кислоты, основания, заряды…
- Теория ЖМКО
- Отступления, лирическое и нелирическое
- РАВНОВЕСИЯ В РАСТВОРАХ
- Распад и объединение молекул
- Продукты присоединения
- «Химические привидения»
- Дискуссии, споры…
- Посолить суп…
- Откуда берутся ионы?
- Общая схема равновесий в растворах
- ВЛИЯНИЕ РАСТВОРИТЕЛЯ НА ОТДЕЛЬНЫЕ СТАДИИ РАВНОВЕСИЯ В РАСТВОРАХ
- Константы равновесия
- КЛАССИФИКАЦИЯ РАСТВОРИТЕЛЕЙ
- Донорные и акцепторные числа растворителей
- Управлять растворителем…
- РАСТВОРИТЕЛЬ КАК СРЕДСТВО УПРАВЛЕНИЯ ХИМИЧЕСКИМИ ПРОЦЕССАМИ
- Управление молекулярным состоянием веществ в растворах
- Управление гетеромолекулярной ассоциацией
- И активисты, и лентяи
- Управление ионизацией
- Управление электролитической диссоциацией
- ДИФФЕРЕНЦИРУЮЩЕЕ И НИВЕЛИРУЮЩЕЕ ДЕЙСТВИЯ РАСТВОРИТЕЛЕЙ НА СИЛУ ЭЛЕКТРОЛИТОВ
- Дифференцирующее и нивелирующее
- Отступление — кислотно-основное
- И физика, и химия
- Небольшое отступление, или как следует сравнивать силу электролитов
- Кислотные растворители
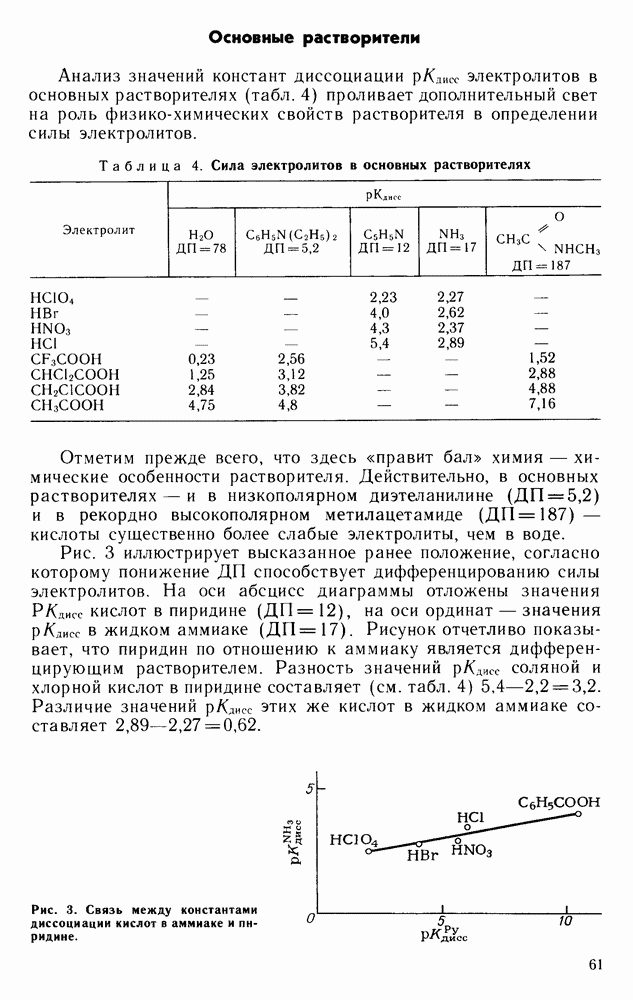
- Основные растворители
- Амфотерные растворители
- Отступление о достоинствах и недостатках объемного анализа
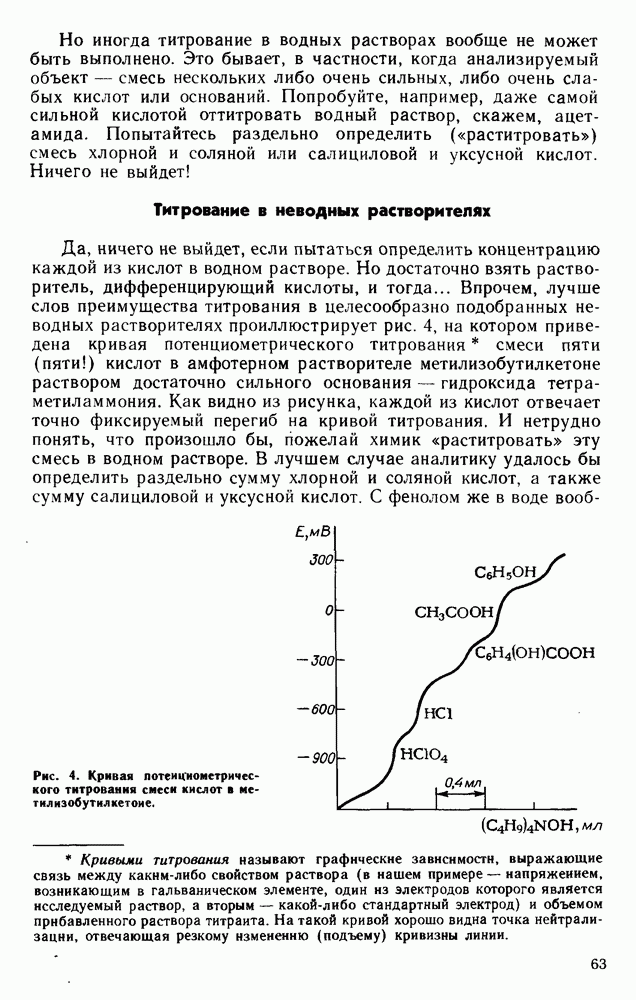
- Титрование в неводных растворителях
- РАСТВОРИМОСТЬ В НЕВОДНЫХ РАСТВОРИТЕЛЯХ
- Некоторые количественные закономерности
- О ХИМИЧЕСКИХ ФОРМАХ СУЩЕСТВОВАНИЯ ЖИВОГО ВЕЩЕСТВА ВО ВСЕЛЕННОЙ
- «Подходящий растворитель»
- ЭЛЕКТРОЛИЗ НЕВОДНЫХ РАСТВОРОВ
- Ряды напряжений в неводных растворах
- Только не из воды
- КИНЕТИКА РЕАКЦИЙ В НЕВОДНЫХ РАСТВОРИТЕЛЯХ
- Типы взаимодействий и их скорость в растворе
- СИНТЕЗЫ В НЕВОДНЫХ РАСТВОРАХ
- БИБЛИОГРАФИЧЕСКИЙ СПИСОК РЕКОМЕНДАТЕЛЬНОЙ ЛИТЁРАТУРЫ