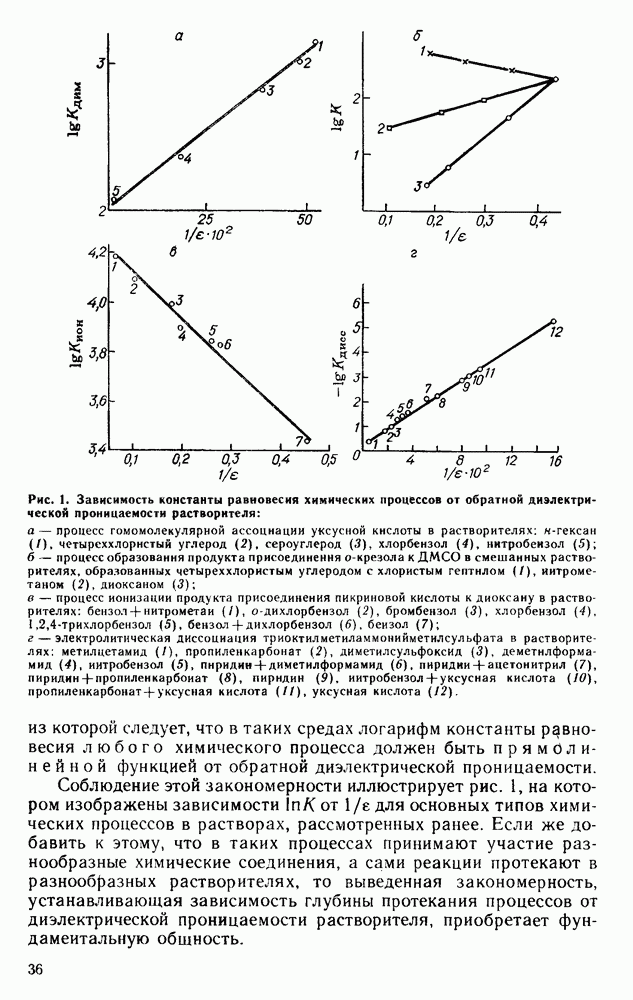
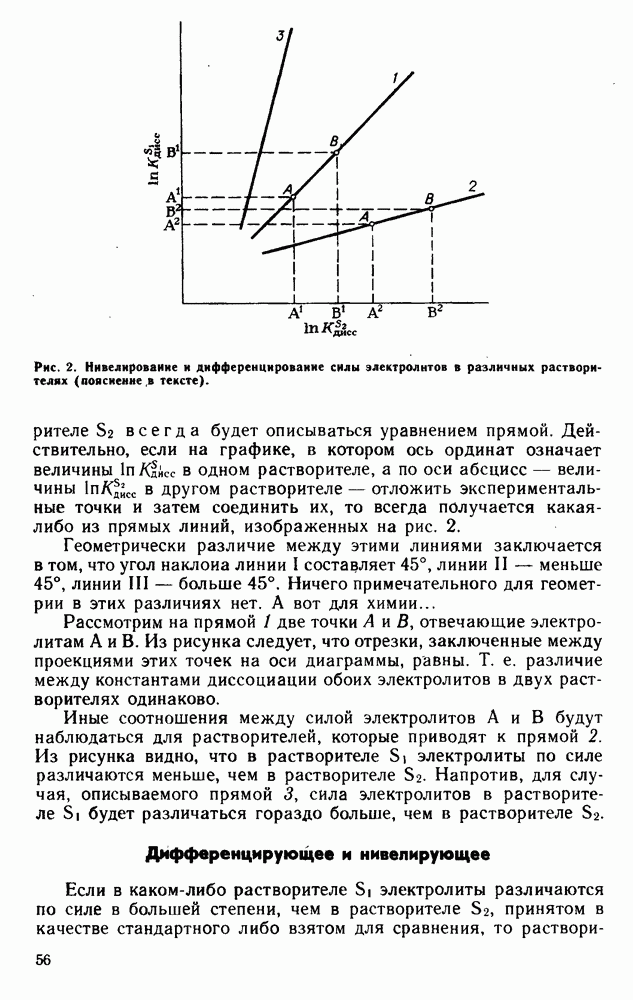
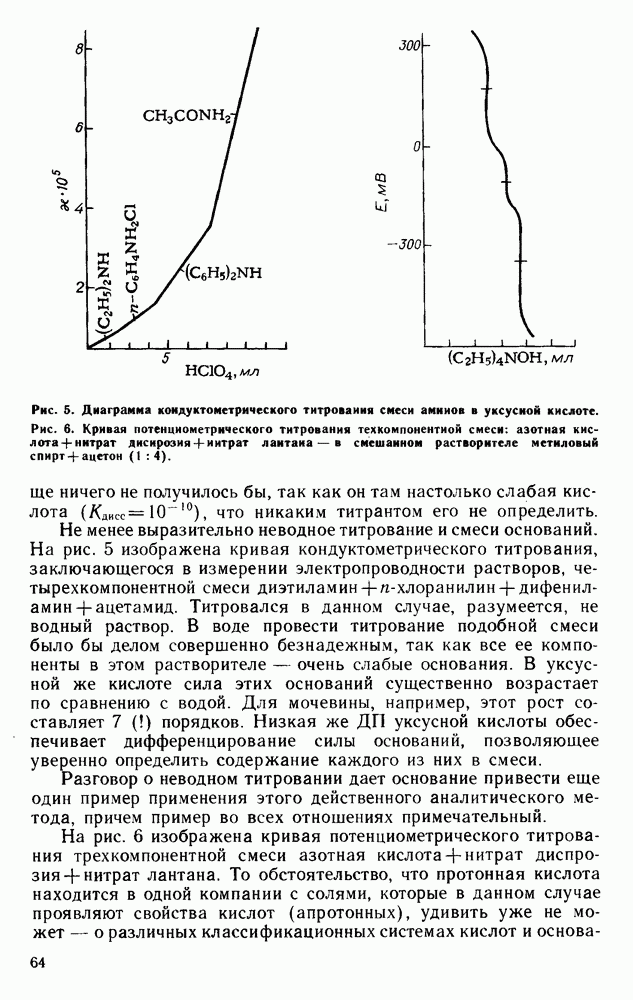
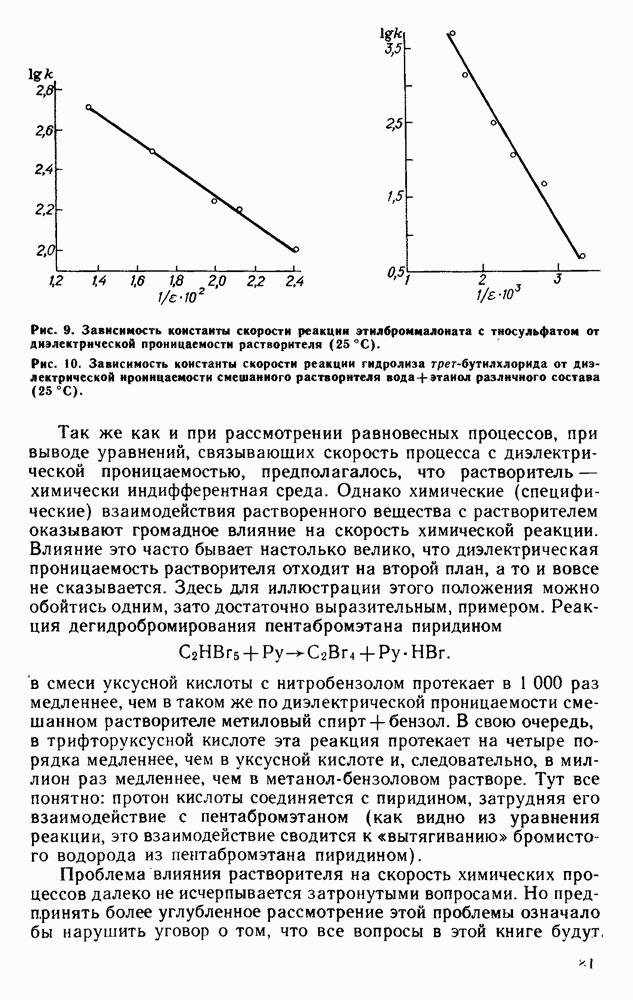
| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
Ряды напряжений в неводных растворах
Вначале приведем одну простенькую реакцию  которая, разумеется, вызовет протест у каждого, кто знаком хотя бы поверхностно с основами химии (в объеме примерно
которая, разумеется, вызовет протест у каждого, кто знаком хотя бы поверхностно с основами химии (в объеме примерно  класса общеобразовательной школы). Как известно, медь менее химически активна, чем водород, и поэтому никак не может вытеснять водород из растворов кислот. Утверждение, справедливое на
класса общеобразовательной школы). Как известно, медь менее химически активна, чем водород, и поэтому никак не может вытеснять водород из растворов кислот. Утверждение, справедливое на  Справедливым на
Справедливым на  оно станет в том случае, если слово «раствор» предворить эпитетом «водный». Да, в водном растворе стандартный электродный потенциал меди превышает потенциал водорода. А приведенная реакция взаимодействия меди с
оно станет в том случае, если слово «раствор» предворить эпитетом «водный». Да, в водном растворе стандартный электродный потенциал меди превышает потенциал водорода. А приведенная реакция взаимодействия меди с  идет в ацетонитриле, в растворах которого стандартный электродный потенциал меди равен — 0,28 по отношению к водороду.
идет в ацетонитриле, в растворах которого стандартный электродный потенциал меди равен — 0,28 по отношению к водороду.
Уже этот пример показывает, что растворитель самым решительным образом влияет на относительную активность металлов.
Причины этого влияния заключаются прежде всего в сольватации ионов. Учтем, что в действительности процесс электровосстановления металла, частные случаи которого приводились выше, в общем виде можно записать как  (напоминаем, что
(напоминаем, что  это молекула растворителя). Тогда становится очевидным, что электровосстановление иона какого-либо металла в разных растворителях каждый раз сводится к восстановлению разных частиц, в которых центральный ион металла с различной прочностью связан с молекулой растворителя.
это молекула растворителя). Тогда становится очевидным, что электровосстановление иона какого-либо металла в разных растворителях каждый раз сводится к восстановлению разных частиц, в которых центральный ион металла с различной прочностью связан с молекулой растворителя.
Вот почему ряды напряжений металлов в неводных растворителях нередко выглядят совсем по иному, чем в «привычной» воде. Растворитель может сжимать либо растягивать шкалы стандартных электродных потенциалов, может сдвигать их в ту или иную сторону. Так, кислотный растворитель, муравьиная кислота, сдвигает величины потенциалов в отрицательную область; основные растворители, гидразин или аммиак, сдвигают шкалу в положительную сторону.
Более того, растворитель может изменять привычный для водных растворов порядок расположения металлов в электрохимическом ряду напряжений. Медь, вытесняющая водород из кислот в ацетонитриловом растворе, — красноречивый тому пример.
| << Предыдущий параграф | Следующий параграф >> |
- ВВЕДЕНИЕ
- ЧТО ТАКОЕ КИСЛОТЫ И ОСНОВАНИЯ?
- Кислота — еще одно определение
- Без растворителя
- Отступление (нелирическое)
- «Ониевые соли»
- Отступление (нелирическое)
- Сольвосистемы
- Отступление очередное, почти лирическое
- Сановный протон
- Кислоты, основания, заряды…
- Теория ЖМКО
- Отступления, лирическое и нелирическое
- РАВНОВЕСИЯ В РАСТВОРАХ
- Распад и объединение молекул
- Продукты присоединения
- «Химические привидения»
- Дискуссии, споры…
- Посолить суп…
- Откуда берутся ионы?
- Общая схема равновесий в растворах
- ВЛИЯНИЕ РАСТВОРИТЕЛЯ НА ОТДЕЛЬНЫЕ СТАДИИ РАВНОВЕСИЯ В РАСТВОРАХ
- Константы равновесия
- КЛАССИФИКАЦИЯ РАСТВОРИТЕЛЕЙ
- Донорные и акцепторные числа растворителей
- Управлять растворителем…
- РАСТВОРИТЕЛЬ КАК СРЕДСТВО УПРАВЛЕНИЯ ХИМИЧЕСКИМИ ПРОЦЕССАМИ
- Управление молекулярным состоянием веществ в растворах
- Управление гетеромолекулярной ассоциацией
- И активисты, и лентяи
- Управление ионизацией
- Управление электролитической диссоциацией
- ДИФФЕРЕНЦИРУЮЩЕЕ И НИВЕЛИРУЮЩЕЕ ДЕЙСТВИЯ РАСТВОРИТЕЛЕЙ НА СИЛУ ЭЛЕКТРОЛИТОВ
- Дифференцирующее и нивелирующее
- Отступление — кислотно-основное
- И физика, и химия
- Небольшое отступление, или как следует сравнивать силу электролитов
- Кислотные растворители
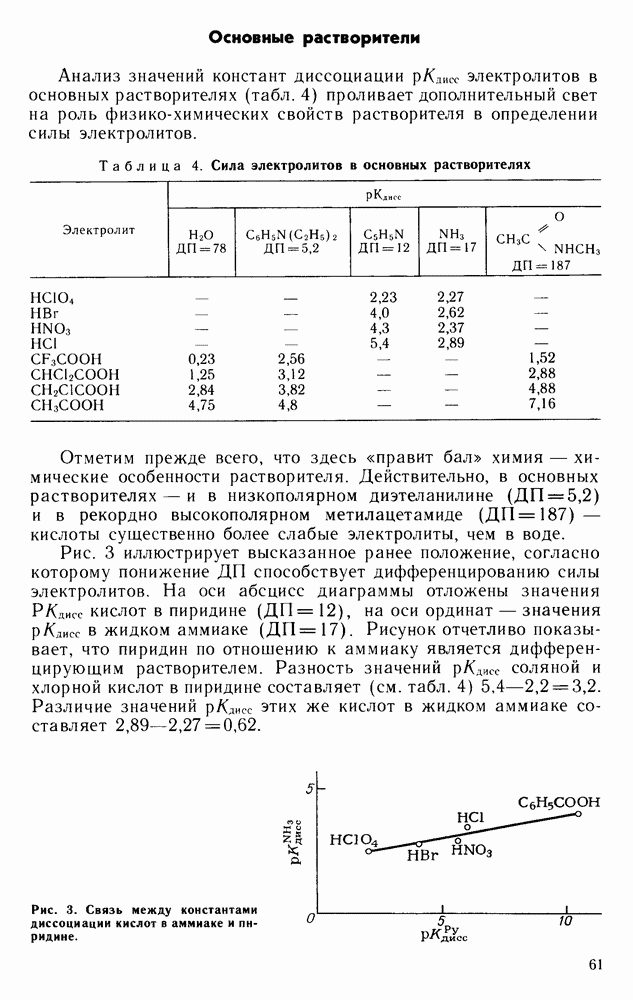
- Основные растворители
- Амфотерные растворители
- Отступление о достоинствах и недостатках объемного анализа
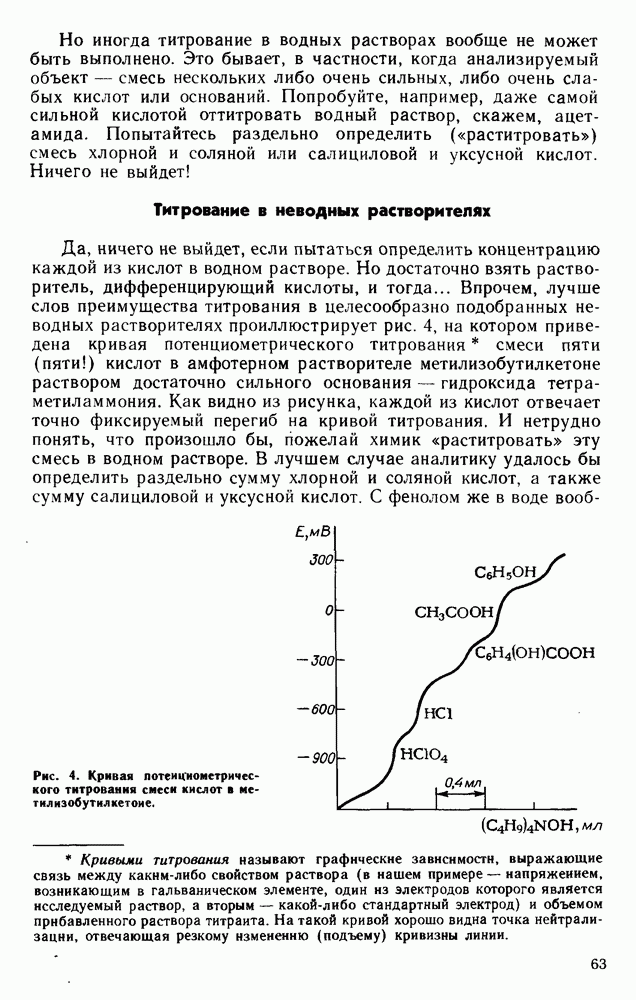
- Титрование в неводных растворителях
- РАСТВОРИМОСТЬ В НЕВОДНЫХ РАСТВОРИТЕЛЯХ
- Некоторые количественные закономерности
- О ХИМИЧЕСКИХ ФОРМАХ СУЩЕСТВОВАНИЯ ЖИВОГО ВЕЩЕСТВА ВО ВСЕЛЕННОЙ
- «Подходящий растворитель»
- ЭЛЕКТРОЛИЗ НЕВОДНЫХ РАСТВОРОВ
- Ряды напряжений в неводных растворах
- Только не из воды
- КИНЕТИКА РЕАКЦИЙ В НЕВОДНЫХ РАСТВОРИТЕЛЯХ
- Типы взаимодействий и их скорость в растворе
- СИНТЕЗЫ В НЕВОДНЫХ РАСТВОРАХ
- БИБЛИОГРАФИЧЕСКИЙ СПИСОК РЕКОМЕНДАТЕЛЬНОЙ ЛИТЁРАТУРЫ