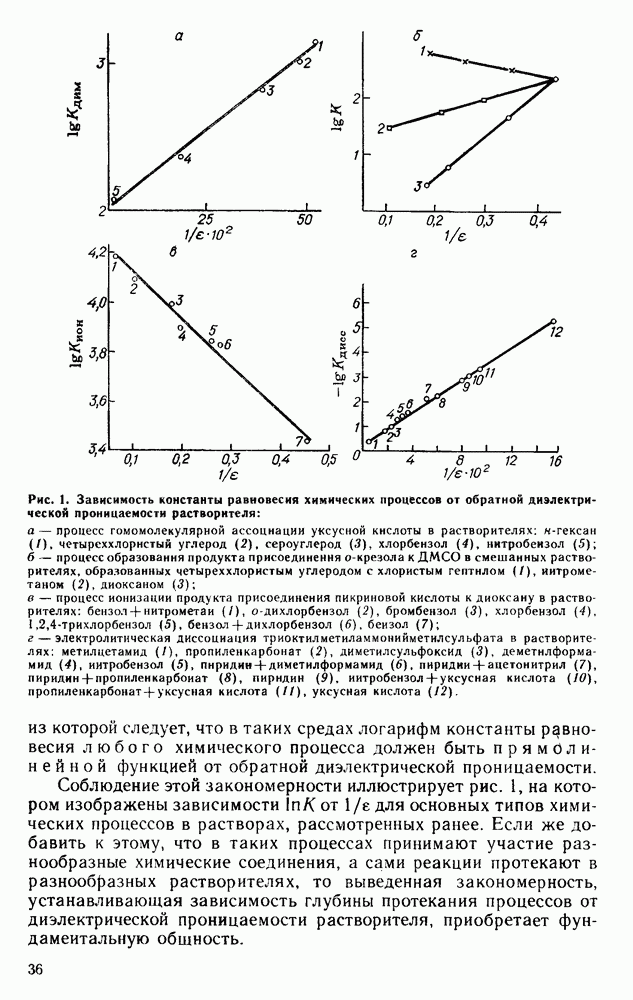
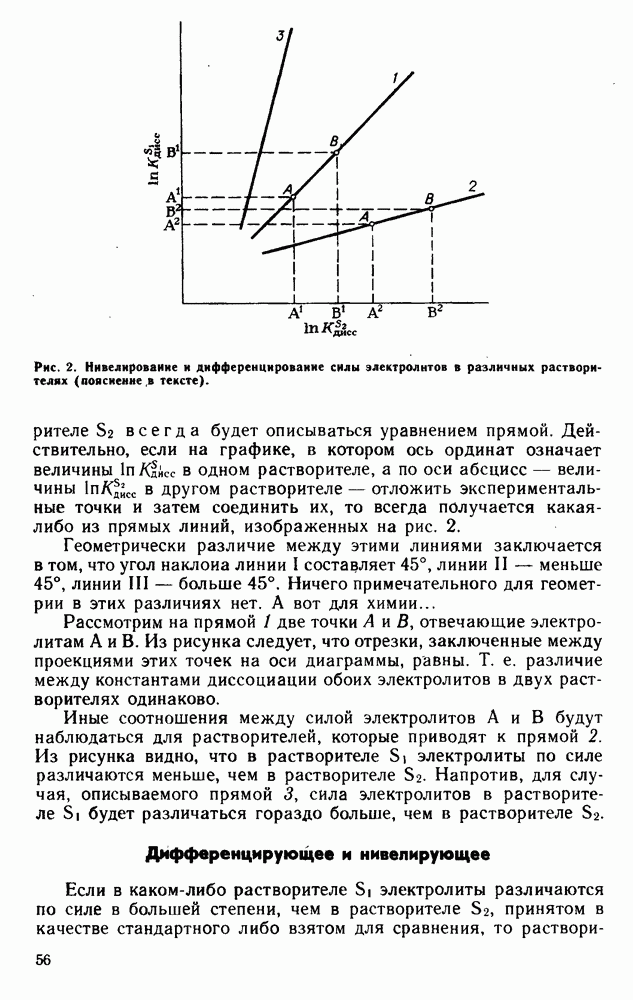
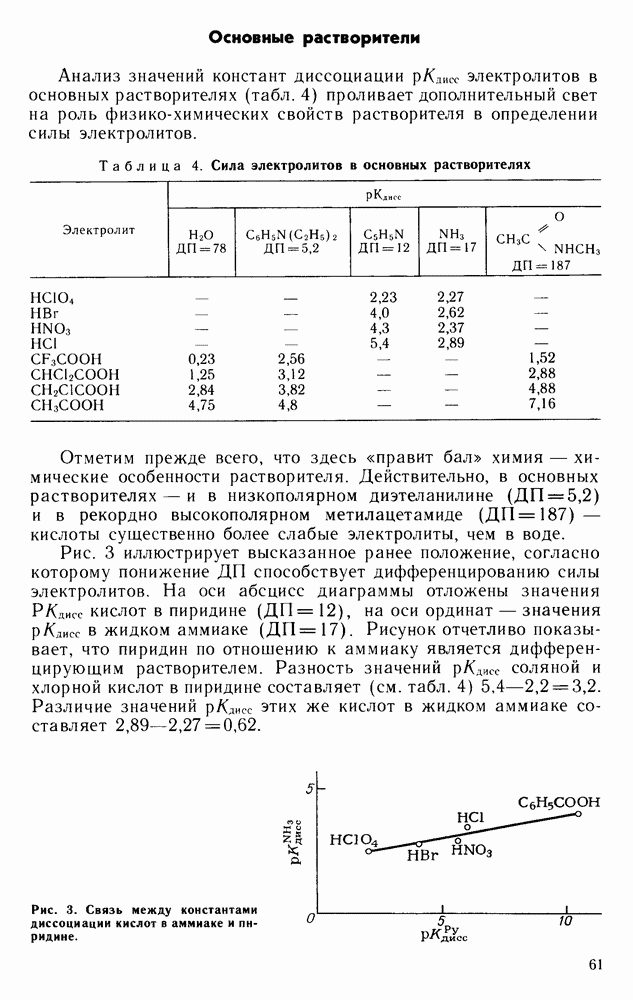
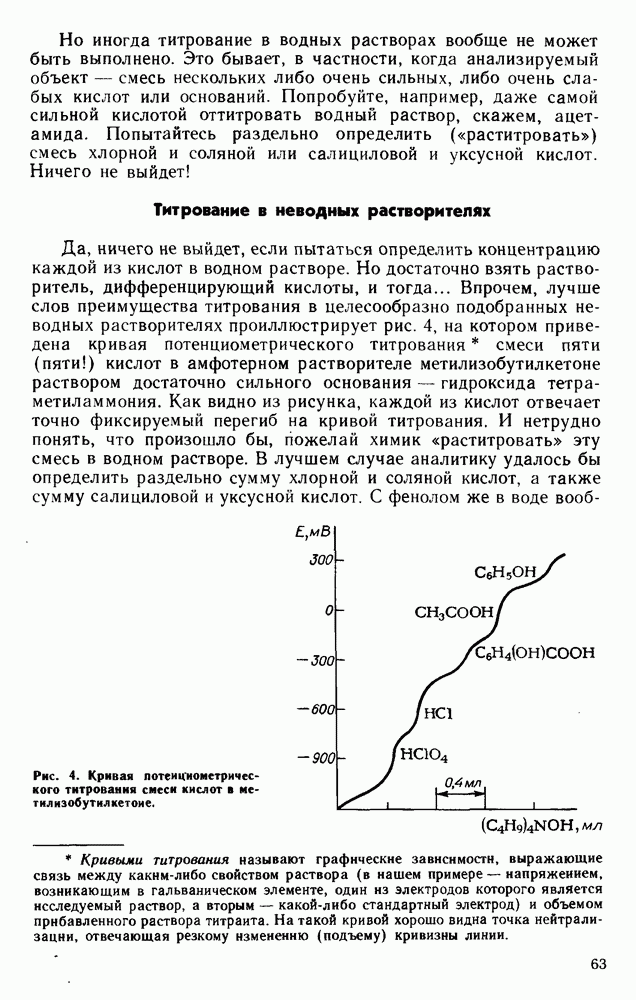
| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
Амфотерные растворители
Речь пойдет о силе электролитов в растворителях, которые в зависимости от растворенного вещества одинаково охотно проявляют либо кислотную, либо основную функции.
Классический пример амфотерного растворителя — вода. Но поскольку еще будет повод поговорить об амфотерности воды, а также потому, что книга эта все же посвящена неводным растворителям, в качестве примера амфотерных растворителей назовем спирты. Известно, что, замещая атом водорода в гидроксильной группе на металл, например, на натрий, спирты проявляют свойства кислот. Основные же свойства спиртов выражаются в том, что они взаимодействуют с кислотами, образуя сложные эфиры.
И кислоты, и основания в амфотерных растворителях заметно более слабые электролиты по сравнению с водными растворами. Так, трихлоруксусная кислота, совсем неплохо диссоциирующая в воде  , в этиловом спирте — совсем слабый электролит (Кдисс
, в этиловом спирте — совсем слабый электролит (Кдисс  . Вспомним также и один из тех примеров, с которых начиналась книга: сопоставление силы серной кислоты в воде и бутиловом спирте.
. Вспомним также и один из тех примеров, с которых начиналась книга: сопоставление силы серной кислоты в воде и бутиловом спирте.
Причину понижения силы электролитов в амфотерных растворителях по сравнению с водой можно назвать уверенно: более низкая, чем в воде, диэлектрическая проницаемость. Тяга к протону, т. е. степень основности, у большинства амфотерных растворителей выражена более отчетливо, чем у воды. Так, энергия сродства к протону у воды равна 707, а у метанола  Но поскольку ДП метанола почти в 2,5 раза меньше, чем у воды, кислоты в нем существенно ослаблены по сравнению с водой.
Но поскольку ДП метанола почти в 2,5 раза меньше, чем у воды, кислоты в нем существенно ослаблены по сравнению с водой.
| << Предыдущий параграф | Следующий параграф >> |
- ВВЕДЕНИЕ
- ЧТО ТАКОЕ КИСЛОТЫ И ОСНОВАНИЯ?
- Кислота — еще одно определение
- Без растворителя
- Отступление (нелирическое)
- «Ониевые соли»
- Отступление (нелирическое)
- Сольвосистемы
- Отступление очередное, почти лирическое
- Сановный протон
- Кислоты, основания, заряды…
- Теория ЖМКО
- Отступления, лирическое и нелирическое
- РАВНОВЕСИЯ В РАСТВОРАХ
- Распад и объединение молекул
- Продукты присоединения
- «Химические привидения»
- Дискуссии, споры…
- Посолить суп…
- Откуда берутся ионы?
- Общая схема равновесий в растворах
- ВЛИЯНИЕ РАСТВОРИТЕЛЯ НА ОТДЕЛЬНЫЕ СТАДИИ РАВНОВЕСИЯ В РАСТВОРАХ
- Константы равновесия
- КЛАССИФИКАЦИЯ РАСТВОРИТЕЛЕЙ
- Донорные и акцепторные числа растворителей
- Управлять растворителем…
- РАСТВОРИТЕЛЬ КАК СРЕДСТВО УПРАВЛЕНИЯ ХИМИЧЕСКИМИ ПРОЦЕССАМИ
- Управление молекулярным состоянием веществ в растворах
- Управление гетеромолекулярной ассоциацией
- И активисты, и лентяи
- Управление ионизацией
- Управление электролитической диссоциацией
- ДИФФЕРЕНЦИРУЮЩЕЕ И НИВЕЛИРУЮЩЕЕ ДЕЙСТВИЯ РАСТВОРИТЕЛЕЙ НА СИЛУ ЭЛЕКТРОЛИТОВ
- Дифференцирующее и нивелирующее
- Отступление — кислотно-основное
- И физика, и химия
- Небольшое отступление, или как следует сравнивать силу электролитов
- Кислотные растворители
- Основные растворители
- Амфотерные растворители
- Отступление о достоинствах и недостатках объемного анализа
- Титрование в неводных растворителях
- РАСТВОРИМОСТЬ В НЕВОДНЫХ РАСТВОРИТЕЛЯХ
- Некоторые количественные закономерности
- О ХИМИЧЕСКИХ ФОРМАХ СУЩЕСТВОВАНИЯ ЖИВОГО ВЕЩЕСТВА ВО ВСЕЛЕННОЙ
- «Подходящий растворитель»
- ЭЛЕКТРОЛИЗ НЕВОДНЫХ РАСТВОРОВ
- Ряды напряжений в неводных растворах
- Только не из воды
- КИНЕТИКА РЕАКЦИЙ В НЕВОДНЫХ РАСТВОРИТЕЛЯХ
- Типы взаимодействий и их скорость в растворе
- СИНТЕЗЫ В НЕВОДНЫХ РАСТВОРАХ
- БИБЛИОГРАФИЧЕСКИЙ СПИСОК РЕКОМЕНДАТЕЛЬНОЙ ЛИТЁРАТУРЫ