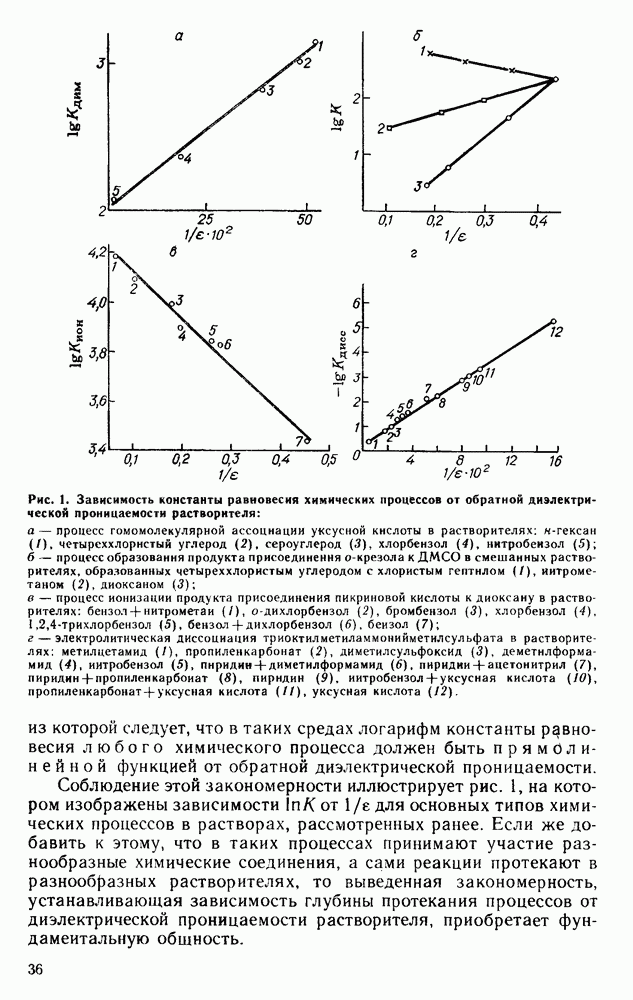
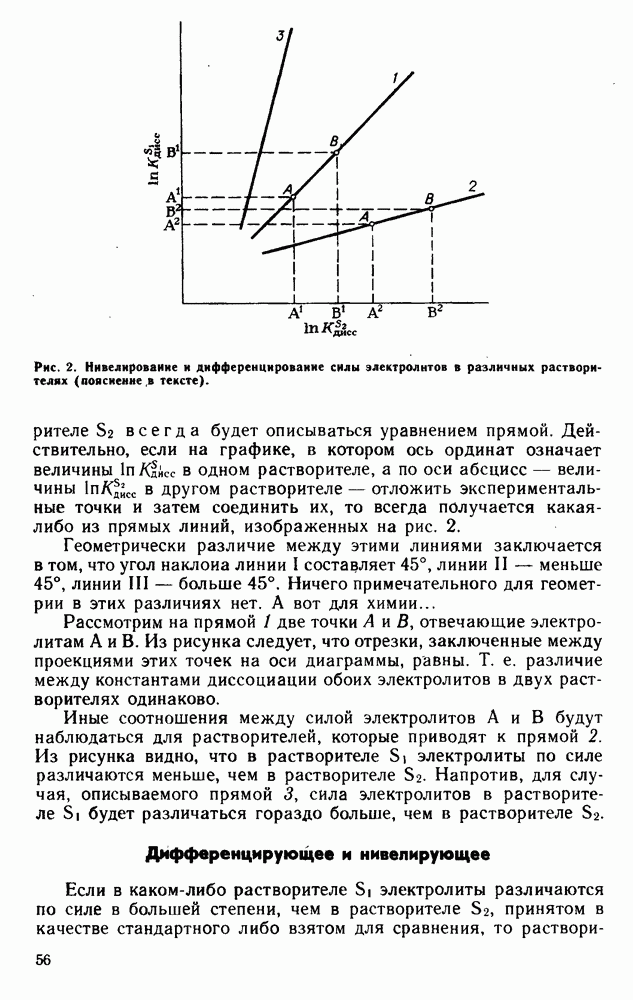
| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
Кислотные растворители
Значения  электролитов в некоторых кислых растворителях приведены в табл. 3. Полагаем, что читателя не смутит то обстоятельство, что в графе «Электролит» среди прочих помещены соединения, которые, на первый взгляд, к электролитам
электролитов в некоторых кислых растворителях приведены в табл. 3. Полагаем, что читателя не смутит то обстоятельство, что в графе «Электролит» среди прочих помещены соединения, которые, на первый взгляд, к электролитам
Таблица 3. Сила электролитов в кислых растворителях

отношения не имеют — например, пиридин. Достаточно сослаться на схему взаимодействий растворенного вещества с растворителем (см. с. 33), чтобы стало очевидным, что под константой диссоциации оснований В в кислых растворителях понимают константу равновесия реакции 
В табл. 3 представлены также сведения о силе электролитов в воде. Во-первых, вода такой же равноправный растворитель, как любой иной, неводный. А во-вторых, и это самое главное, сопоставление силы электролитов в различных растворителях с водой — излюбленный прием в химии неводных и растворов, поскольку водные растворы были и продолжают (пока) оставаться наиболее обстоятельно изученными и (пока) наиболее распространенными в практической деятельности.
Значения  приведенные в таблице, подтверждают многое из того, о чем шла речь выше. Сила кислот в кислотных растворителях действительно меньше, чем в воде. Это обстоятельство позволяет уверенно связать ослабление кислот с химическими свойствами растворителей, поскольку даже в муравьиной кислоте, характеризующейся диэлектрической проницаемостью (ДП = 56), не намного уступающей воде (ДП = 78), те из кислот, которые в воде являются сильными, переходят в разряд слабых. Так,
приведенные в таблице, подтверждают многое из того, о чем шла речь выше. Сила кислот в кислотных растворителях действительно меньше, чем в воде. Это обстоятельство позволяет уверенно связать ослабление кислот с химическими свойствами растворителей, поскольку даже в муравьиной кислоте, характеризующейся диэлектрической проницаемостью (ДП = 56), не намного уступающей воде (ДП = 78), те из кислот, которые в воде являются сильными, переходят в разряд слабых. Так,  равна
равна 
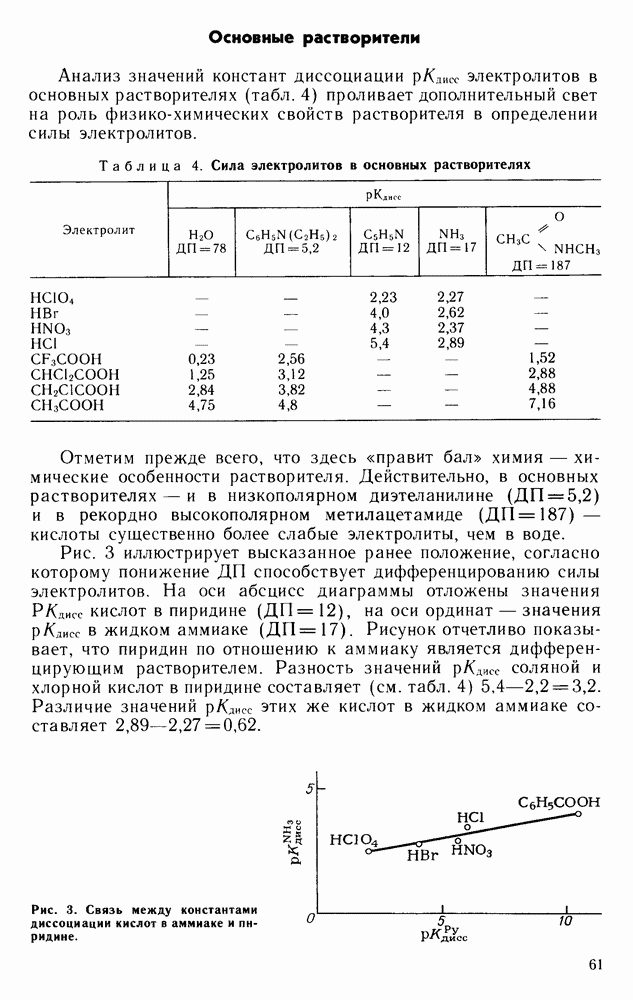
В уксусной кислоте, кислотном растворителе с весьма малой диэлектрической проницаемостью (ДП = 6,2), сила кислот по сравнению с водой уже значительно уменьшена (см. с. 57) и в полном соответствии с приведенным выше прогнозом существенно дифференцирована.
Соотносительное влияние энергии химического взаимодействия растворенного вещества с растворителем и ДП последнего на силу электролитов иллюстрируют данные по константам диссоциации редисе оснований (аминов). Оба кислотных растворителя — и муравьиная, и уксусная кислоты — нивелируют силу аминов, так как степень их взаимодействия с растворителем весьма высока. Но в то же время в растворителе с высокой ДП, в муравьиной кислоте амины почти в десять тысяч раз более сильные электролиты, чем в уксусной кислоте.
Завершающим штрихом в вопросе о соотносительном влиянии химического и физического факторов на силу электролитов может служить сопоставление силы аминов в воде с силой электролитов в низкополярном (уксусная кислота) и высокополярном (муравьиная кислота) кислотных растворителях. Хотя по отношению к аминам вода — намного более слабая кислота, чем перечисленные неводные растворители, но благодаря ее высокой ДП, амины в воде более сильные электролиты, чем в уксусной кислоте. Но в муравьиной кислоте действие ДП преобладает: в этом растворителе амины намного более сильные основания, чем в воде.
| << Предыдущий параграф | Следующий параграф >> |
- ВВЕДЕНИЕ
- ЧТО ТАКОЕ КИСЛОТЫ И ОСНОВАНИЯ?
- Кислота — еще одно определение
- Без растворителя
- Отступление (нелирическое)
- «Ониевые соли»
- Отступление (нелирическое)
- Сольвосистемы
- Отступление очередное, почти лирическое
- Сановный протон
- Кислоты, основания, заряды…
- Теория ЖМКО
- Отступления, лирическое и нелирическое
- РАВНОВЕСИЯ В РАСТВОРАХ
- Распад и объединение молекул
- Продукты присоединения
- «Химические привидения»
- Дискуссии, споры…
- Посолить суп…
- Откуда берутся ионы?
- Общая схема равновесий в растворах
- ВЛИЯНИЕ РАСТВОРИТЕЛЯ НА ОТДЕЛЬНЫЕ СТАДИИ РАВНОВЕСИЯ В РАСТВОРАХ
- Константы равновесия
- КЛАССИФИКАЦИЯ РАСТВОРИТЕЛЕЙ
- Донорные и акцепторные числа растворителей
- Управлять растворителем…
- РАСТВОРИТЕЛЬ КАК СРЕДСТВО УПРАВЛЕНИЯ ХИМИЧЕСКИМИ ПРОЦЕССАМИ
- Управление молекулярным состоянием веществ в растворах
- Управление гетеромолекулярной ассоциацией
- И активисты, и лентяи
- Управление ионизацией
- Управление электролитической диссоциацией
- ДИФФЕРЕНЦИРУЮЩЕЕ И НИВЕЛИРУЮЩЕЕ ДЕЙСТВИЯ РАСТВОРИТЕЛЕЙ НА СИЛУ ЭЛЕКТРОЛИТОВ
- Дифференцирующее и нивелирующее
- Отступление — кислотно-основное
- И физика, и химия
- Небольшое отступление, или как следует сравнивать силу электролитов
- Кислотные растворители
- Основные растворители
- Амфотерные растворители
- Отступление о достоинствах и недостатках объемного анализа
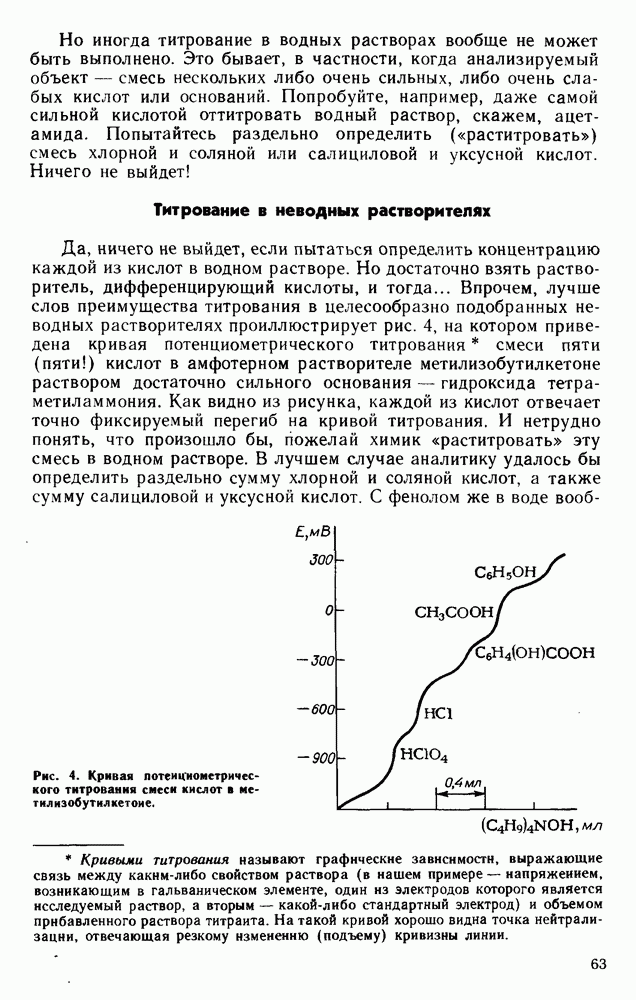
- Титрование в неводных растворителях
- РАСТВОРИМОСТЬ В НЕВОДНЫХ РАСТВОРИТЕЛЯХ
- Некоторые количественные закономерности
- О ХИМИЧЕСКИХ ФОРМАХ СУЩЕСТВОВАНИЯ ЖИВОГО ВЕЩЕСТВА ВО ВСЕЛЕННОЙ
- «Подходящий растворитель»
- ЭЛЕКТРОЛИЗ НЕВОДНЫХ РАСТВОРОВ
- Ряды напряжений в неводных растворах
- Только не из воды
- КИНЕТИКА РЕАКЦИЙ В НЕВОДНЫХ РАСТВОРИТЕЛЯХ
- Типы взаимодействий и их скорость в растворе
- СИНТЕЗЫ В НЕВОДНЫХ РАСТВОРАХ
- БИБЛИОГРАФИЧЕСКИЙ СПИСОК РЕКОМЕНДАТЕЛЬНОЙ ЛИТЁРАТУРЫ