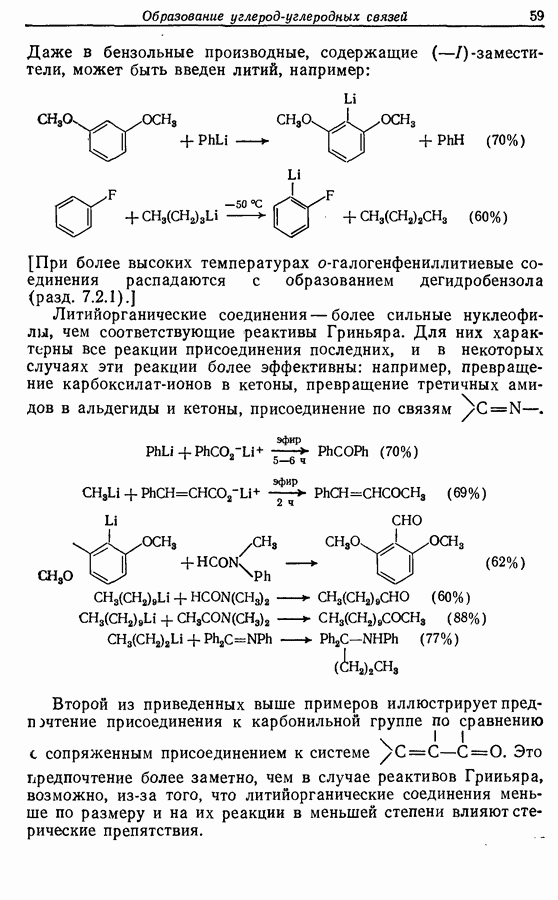
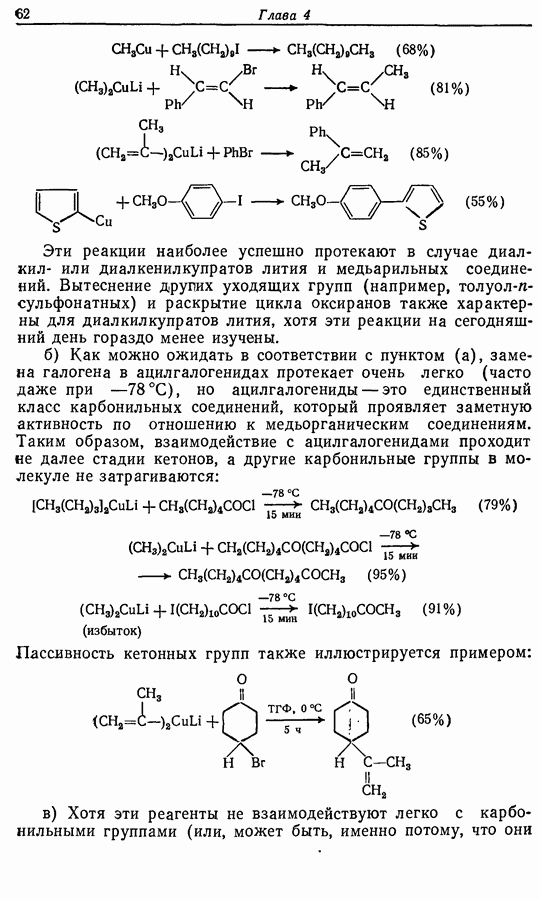
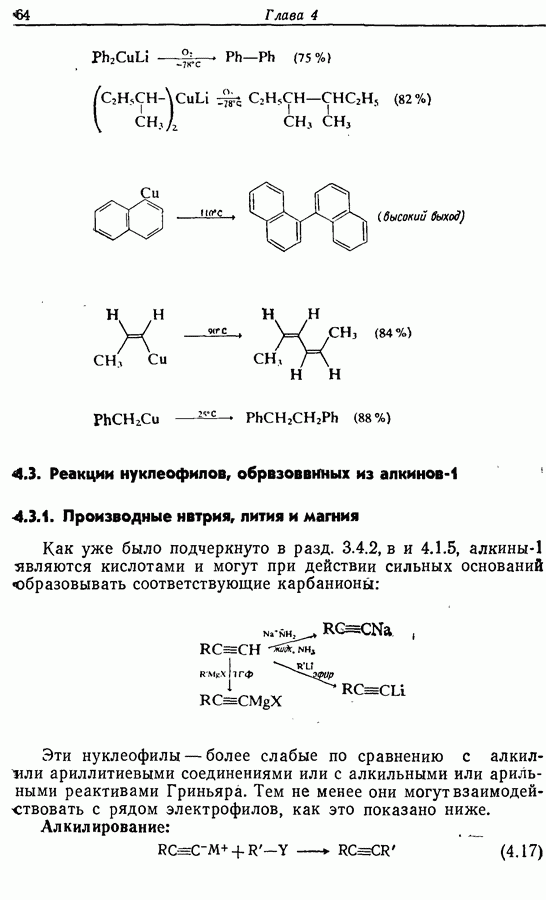
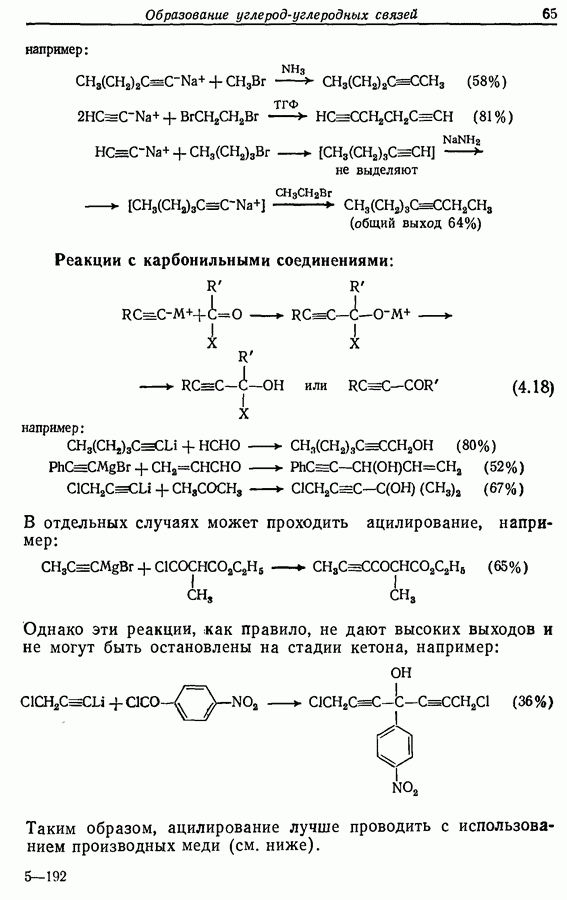
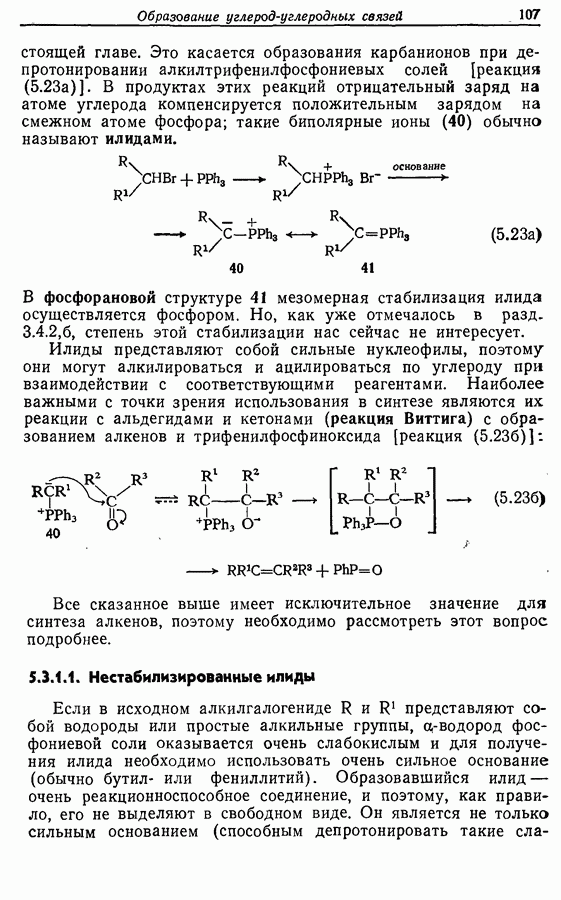
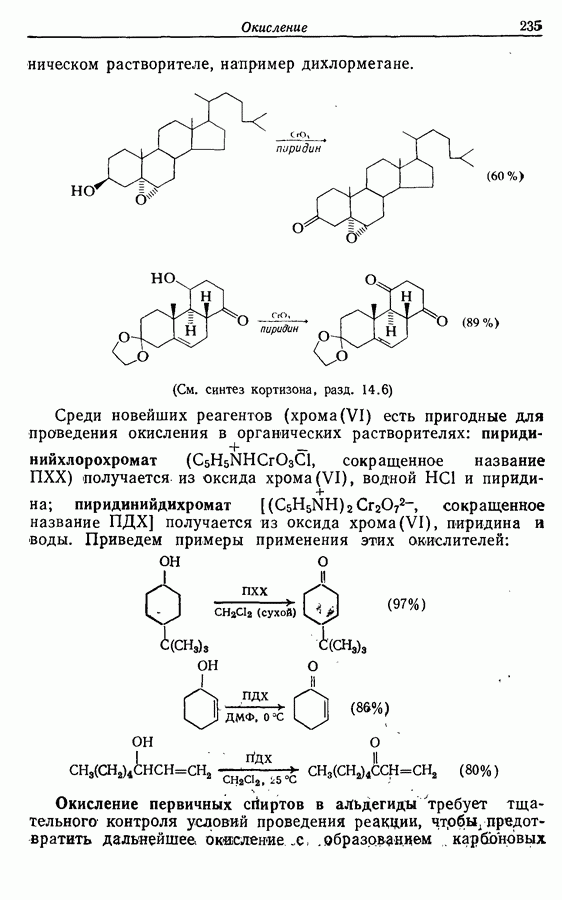
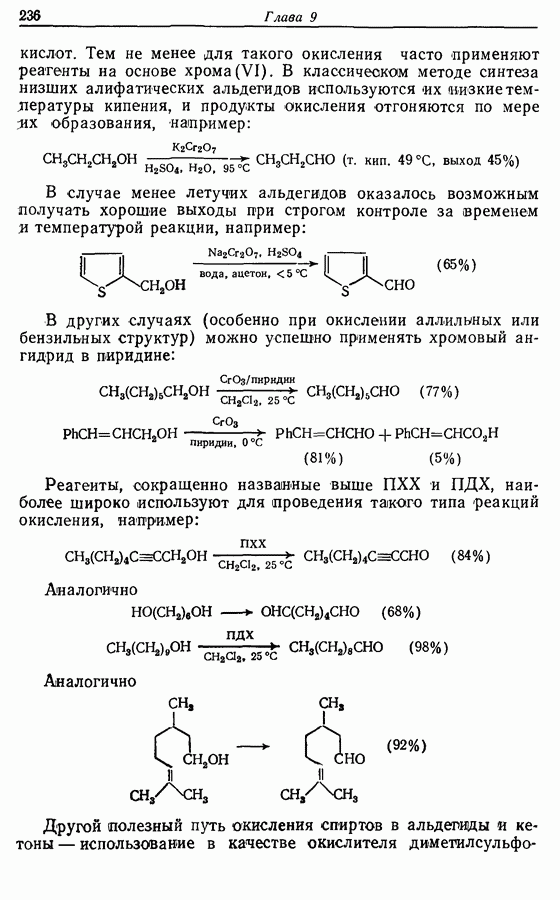
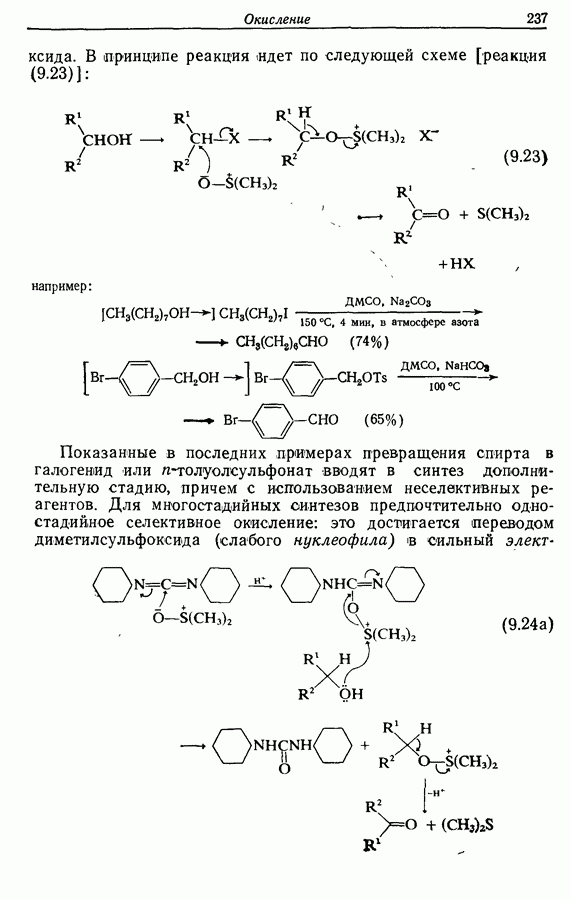
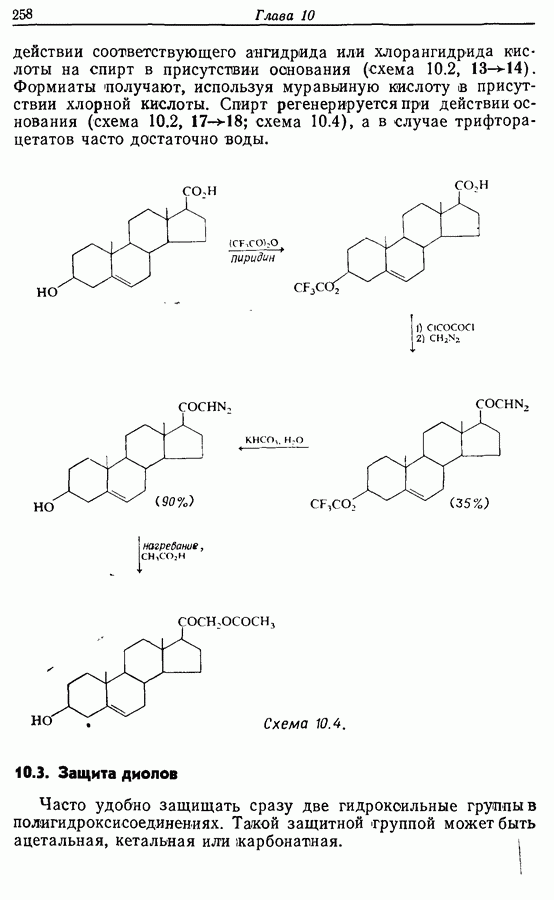
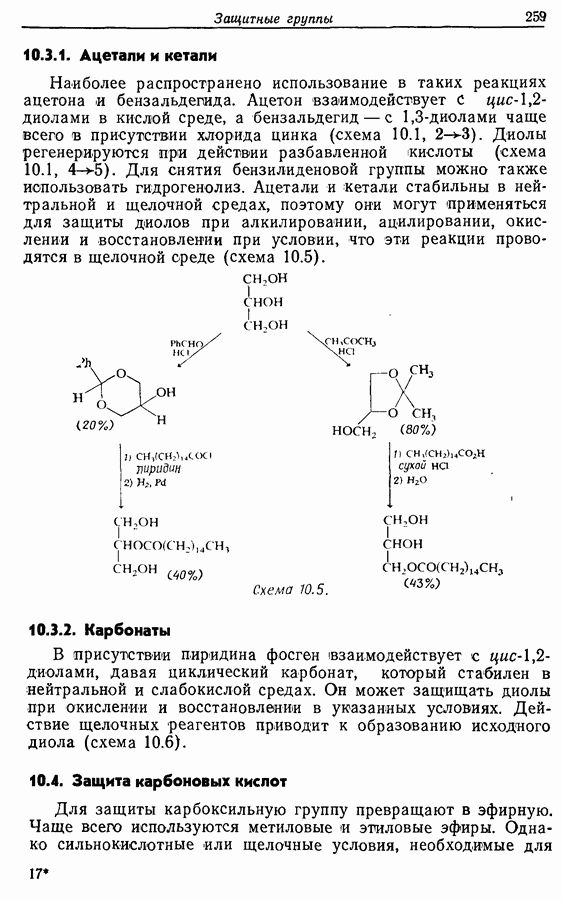
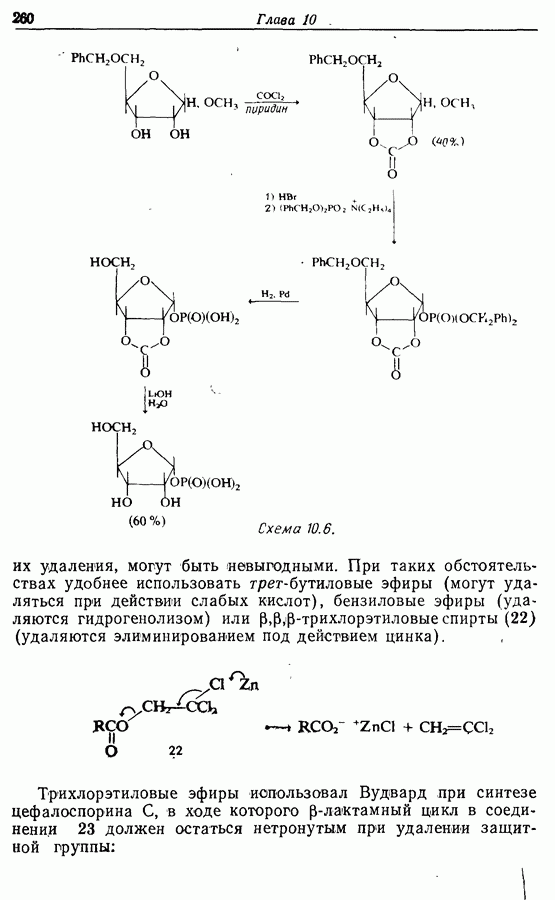
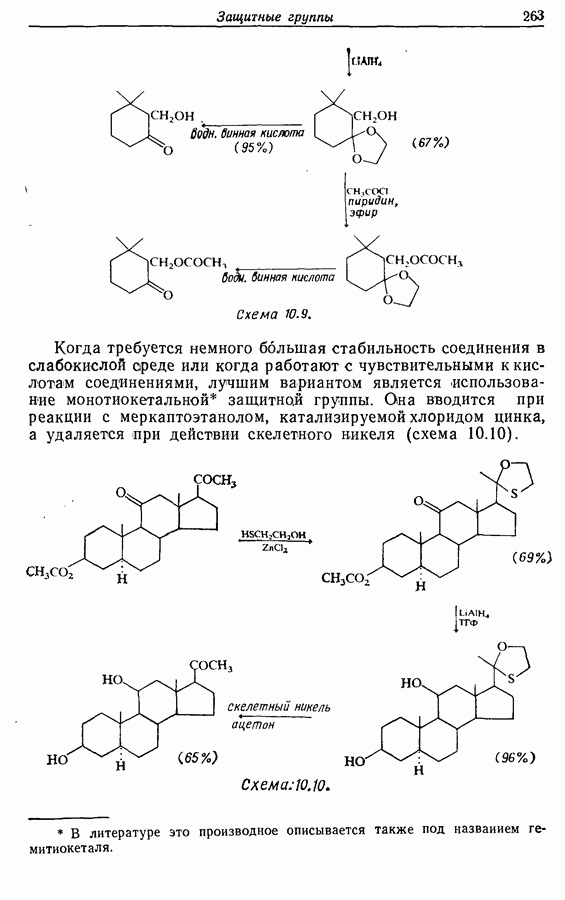
| << Предыдущий параграф | Следующий параграф >> |
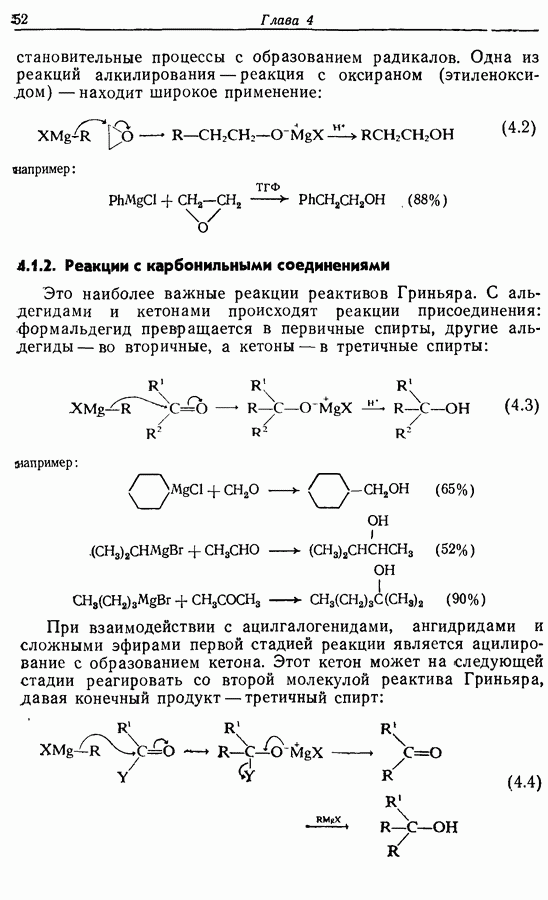
Пред.
След.
Макеты страниц
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
ДЛЯ СТУДЕНТОВ И ШКОЛЬНИКОВ ЕСТЬ
ZADANIA.TO
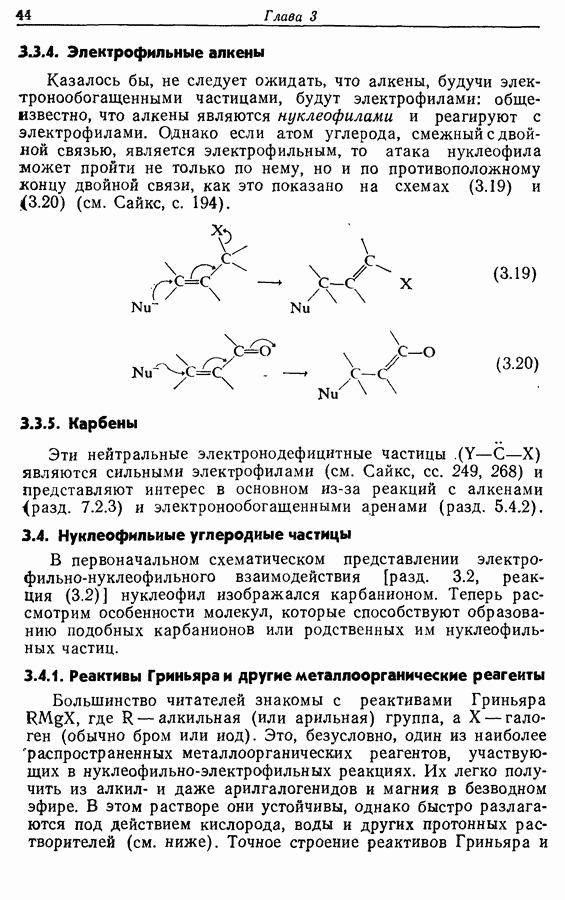
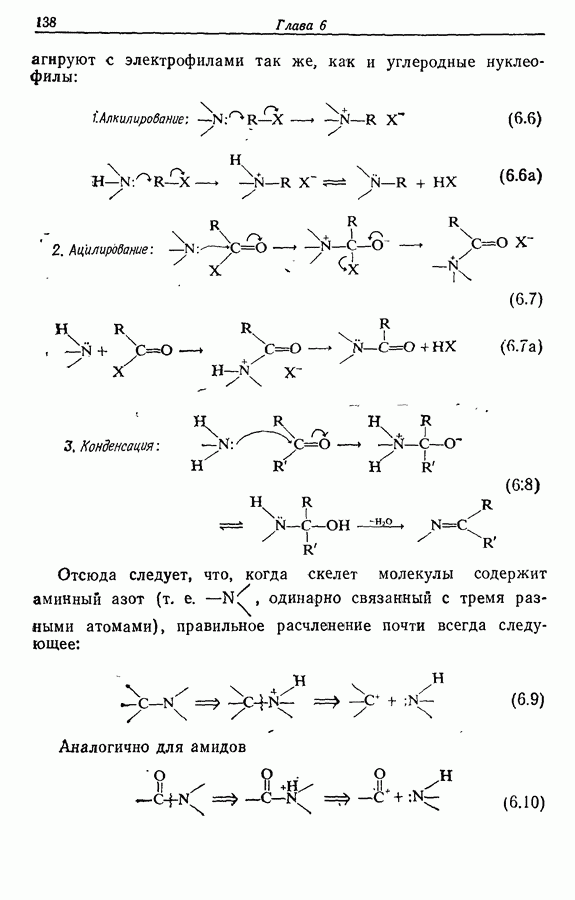
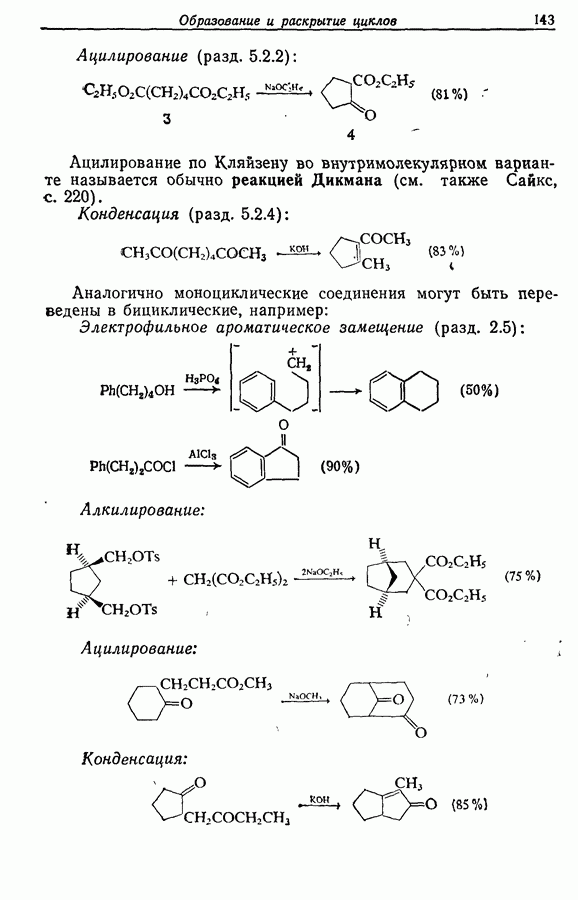
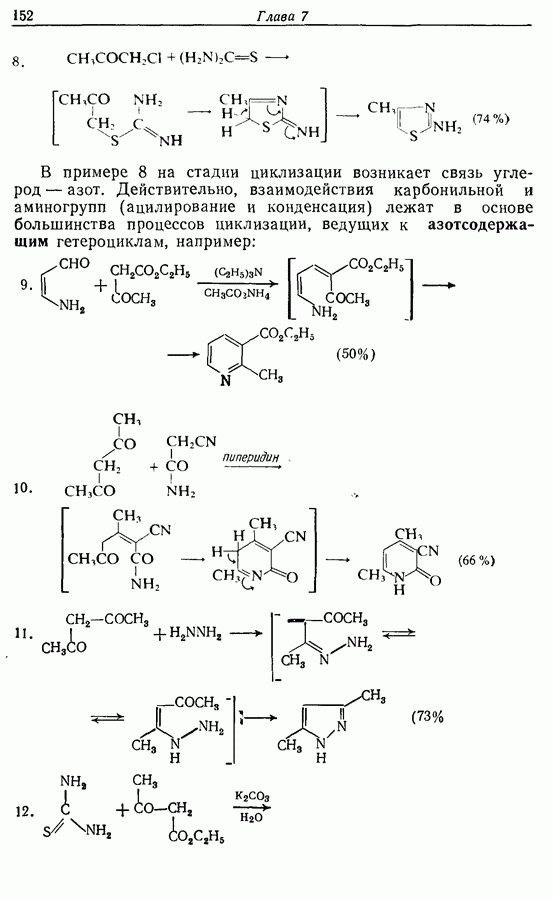
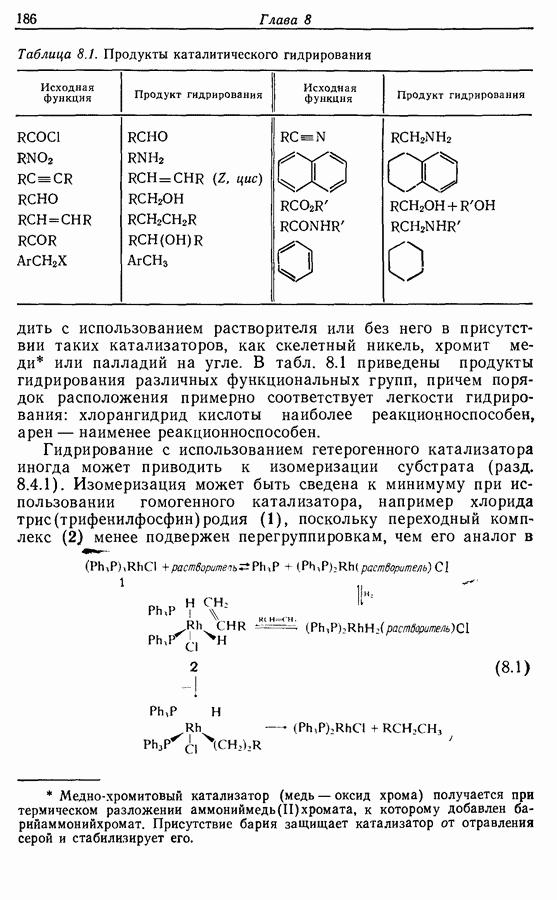
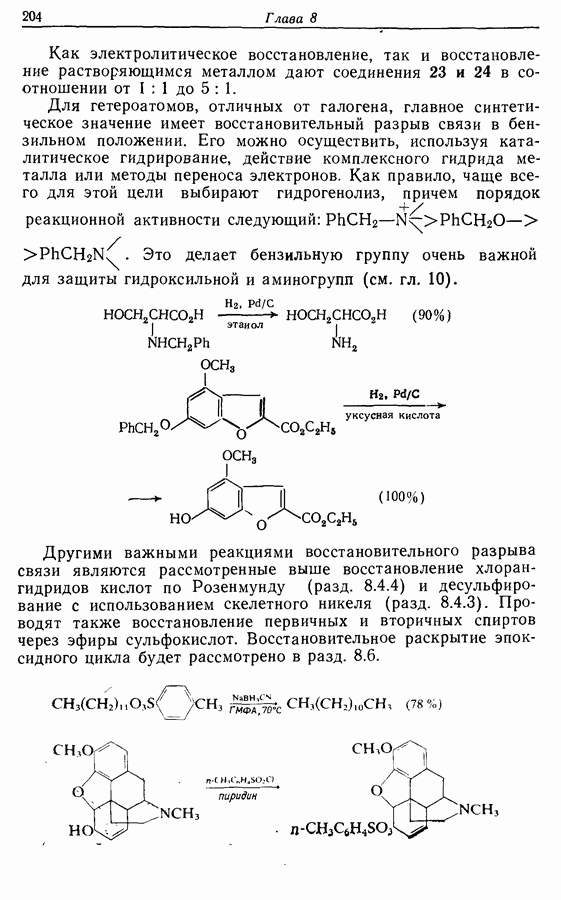
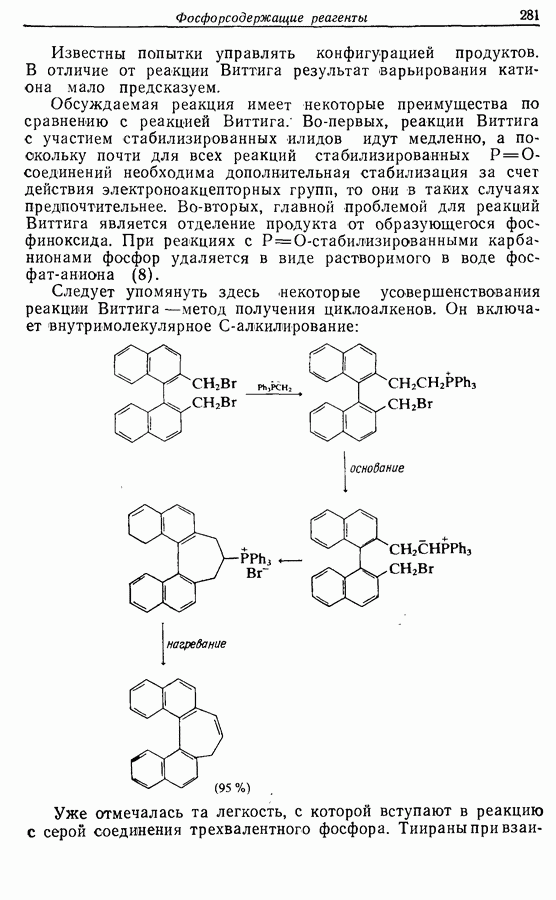
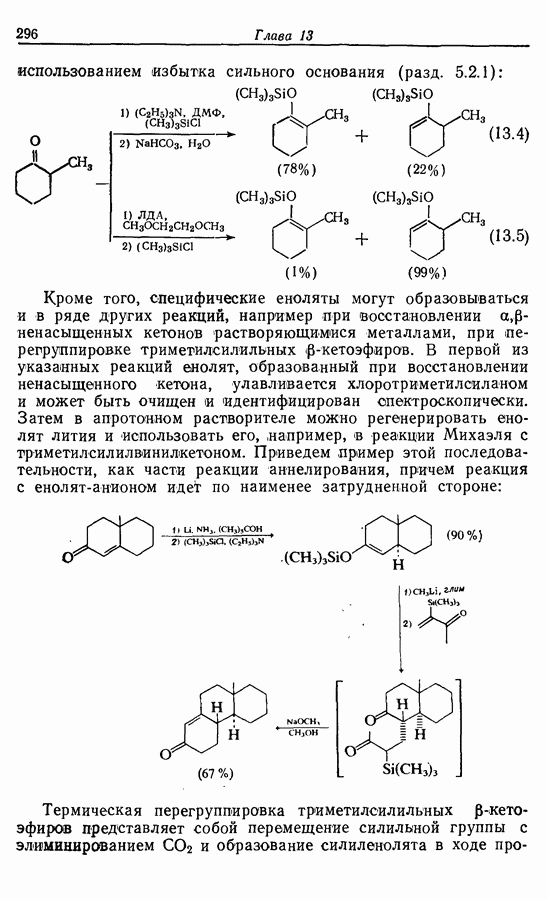
7.3. Электроциклическое циклообразование
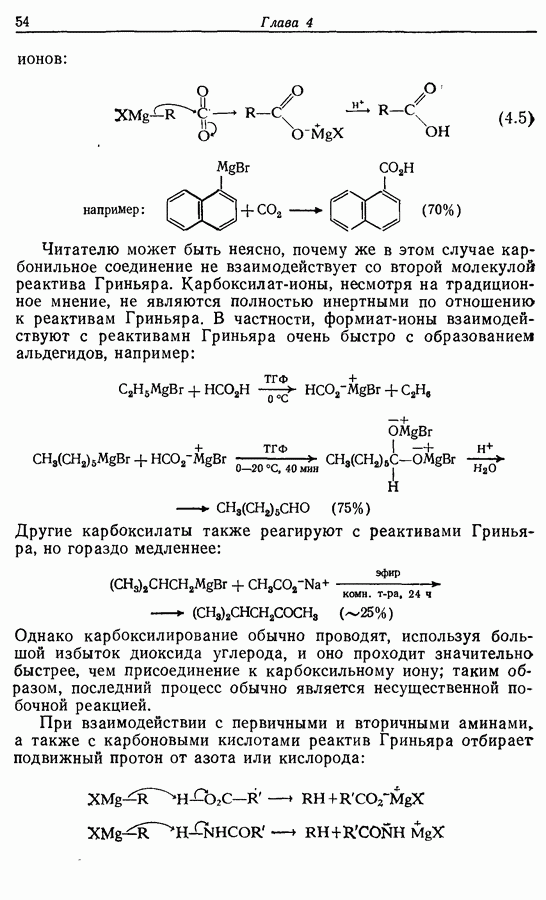
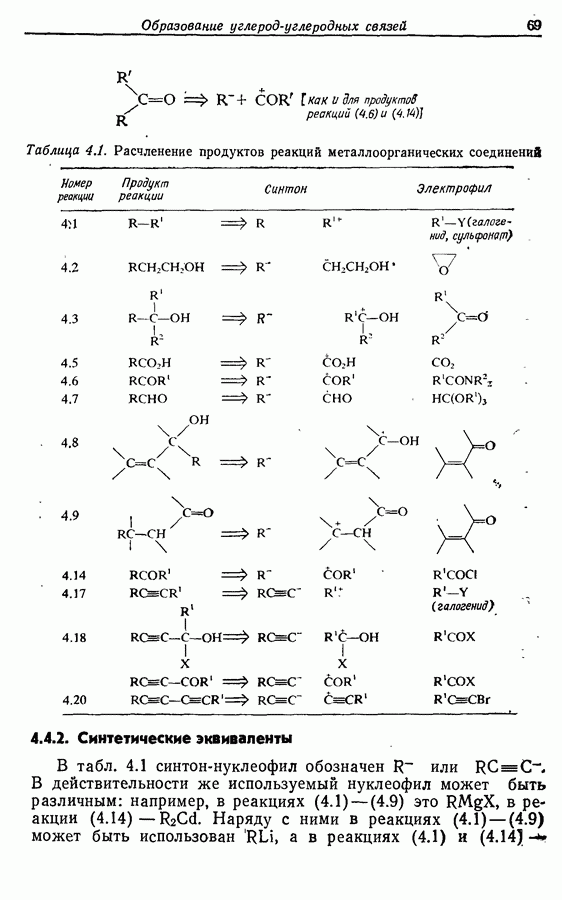
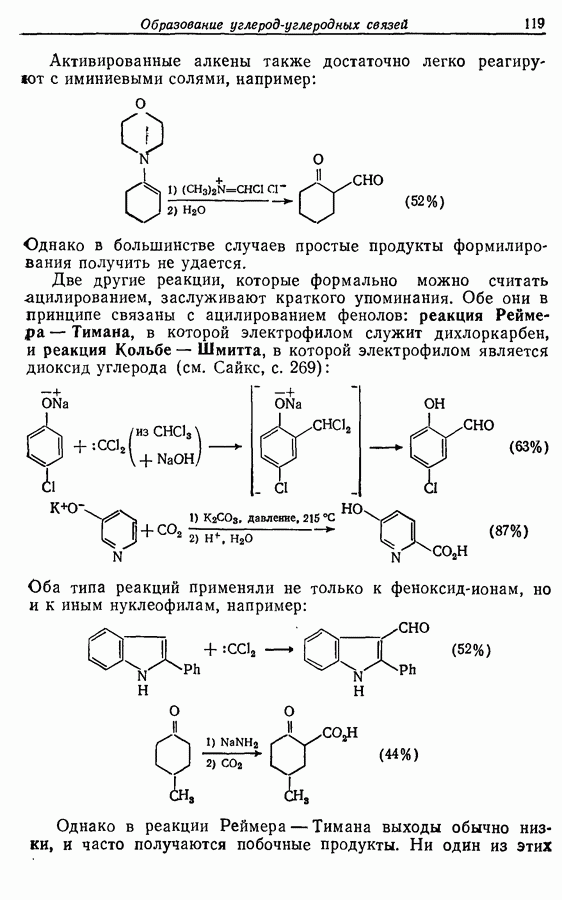
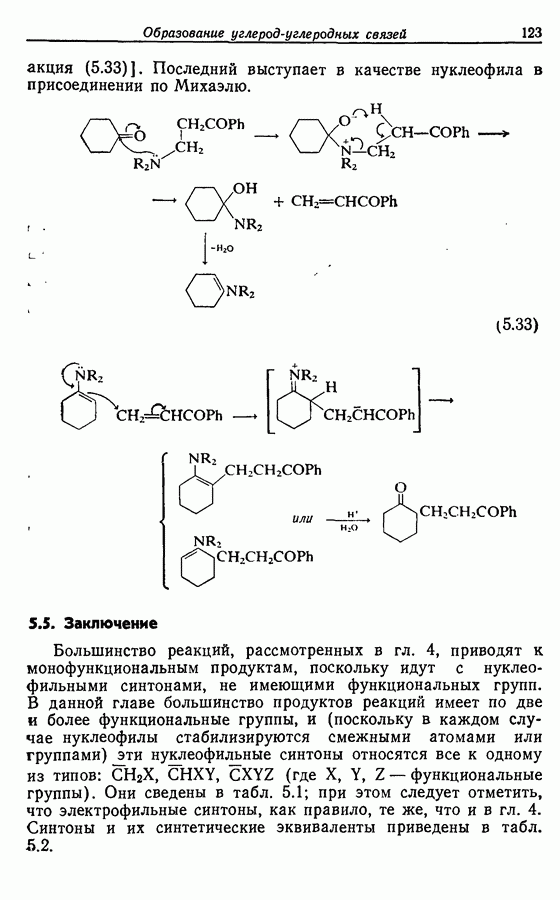
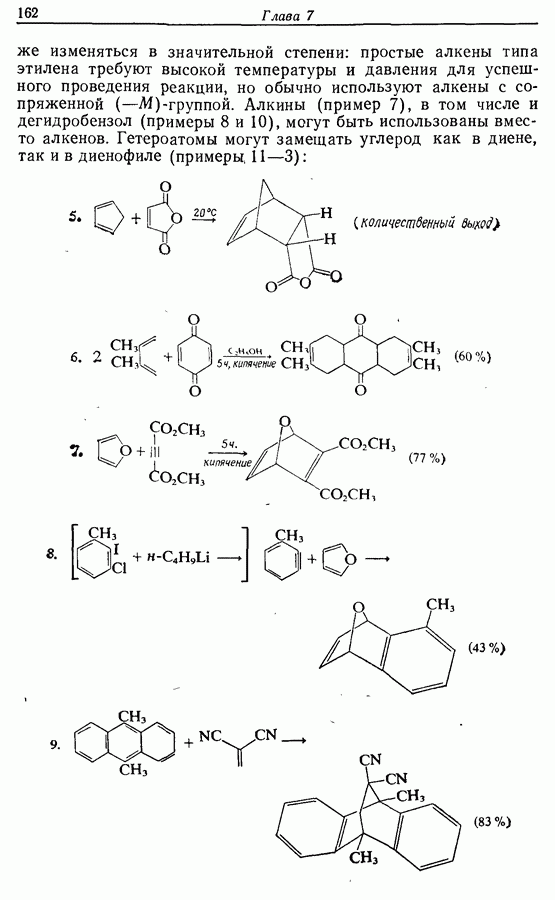
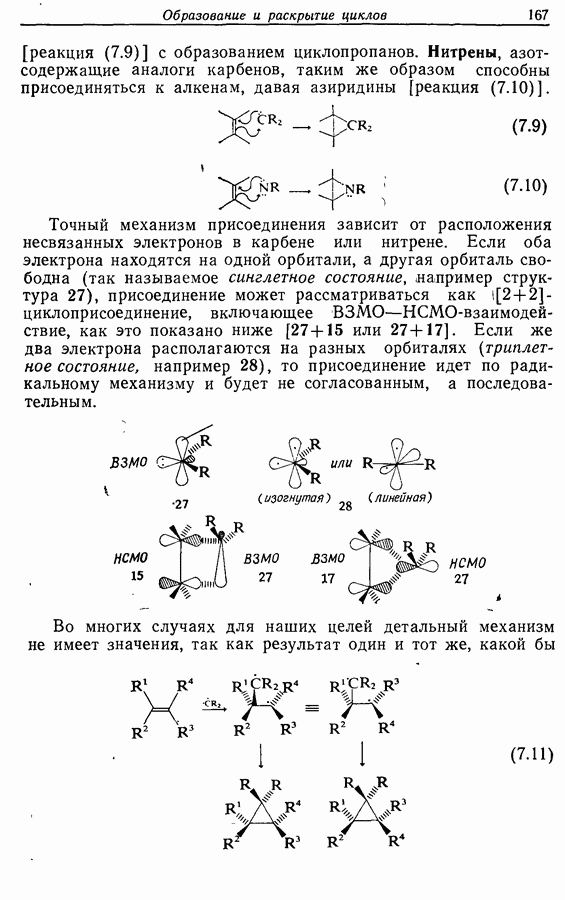
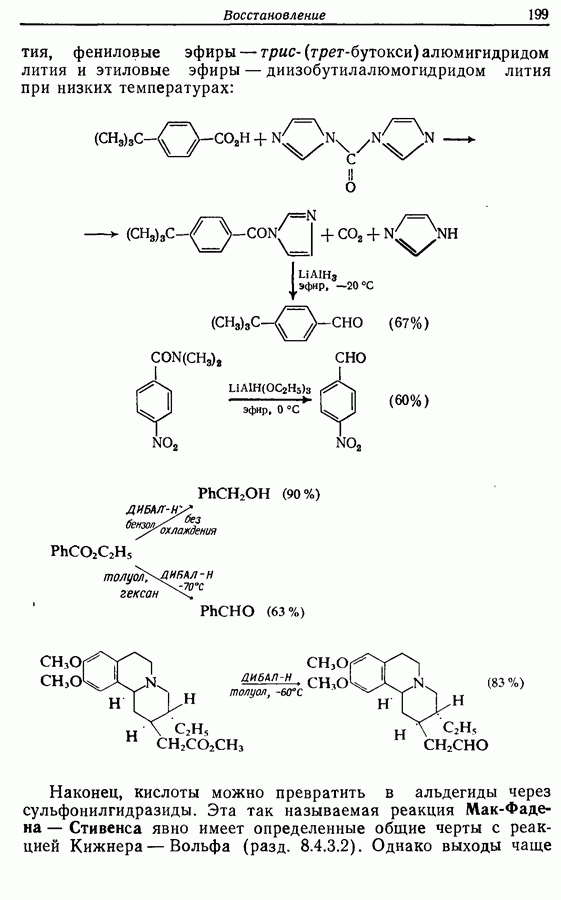
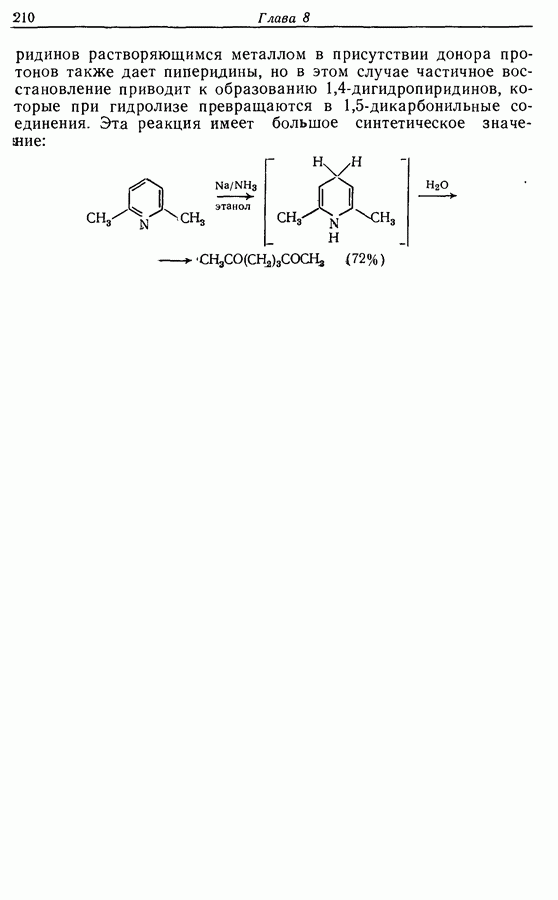
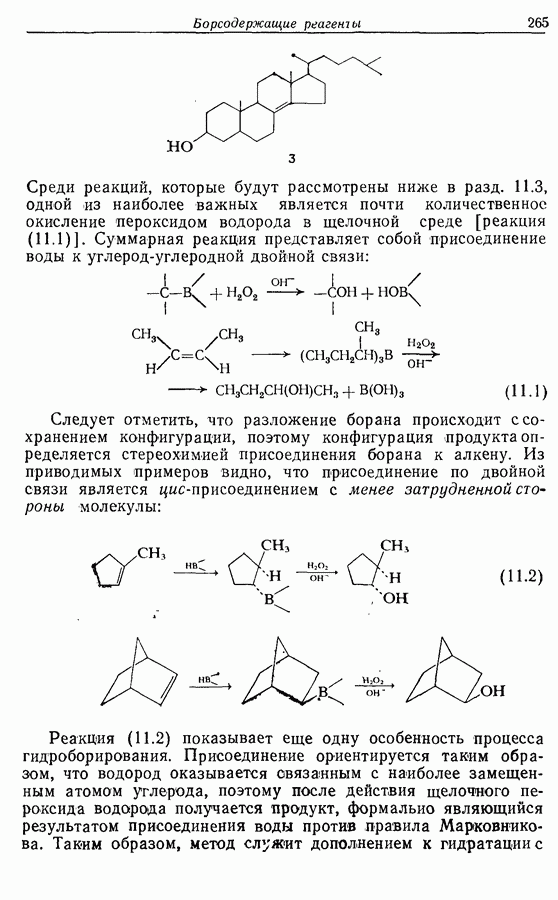
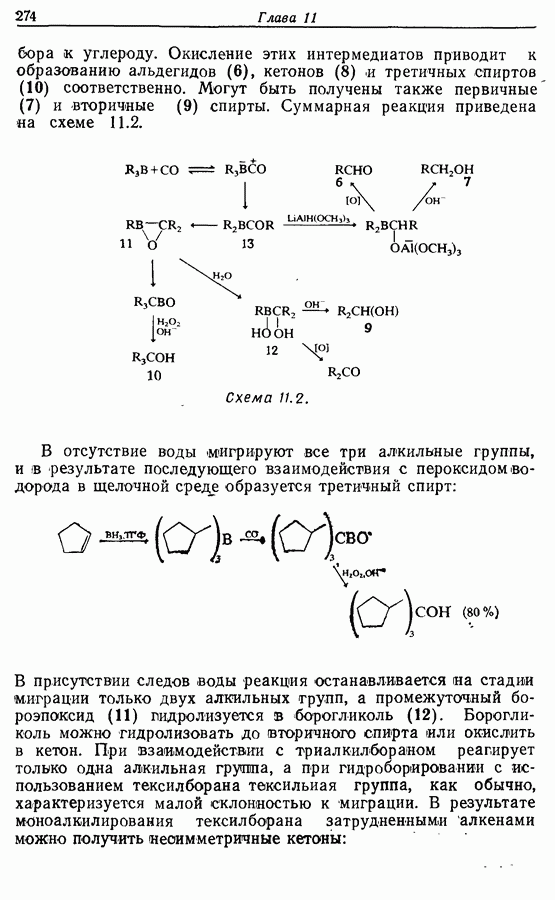
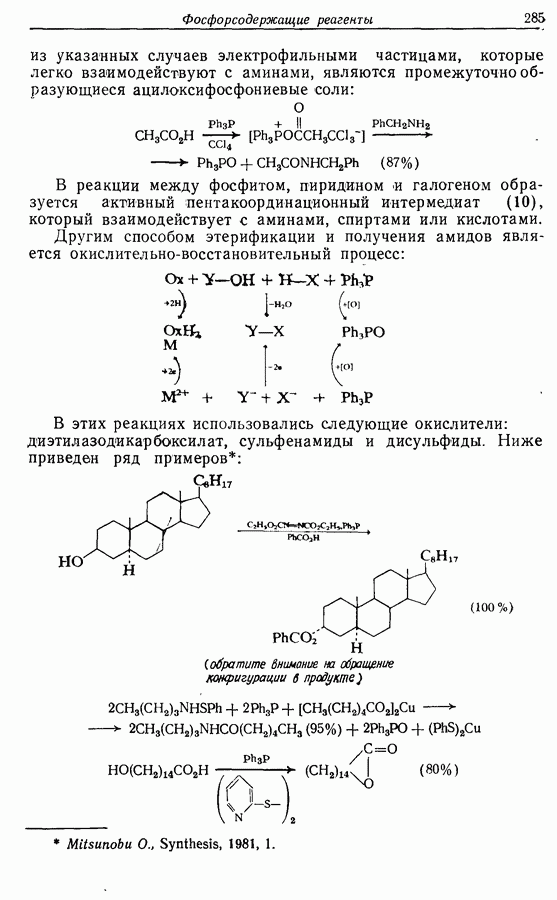
Реакция Дильса — Альдера и 1,3-диполярное циклоприсоединение, которые описаны в предыдущем параграфе, включают стадию перераспределения шести  -электронов через циклическое переходное состояние. Если же эти шесть
-электронов через циклическое переходное состояние. Если же эти шесть  -электронов располагаются в одной молекуле, может иметь место аналогичное внутримолекулярное перициклическое перераспределение. Такой внутримолекулярный перициклический процесс называют электроциклической реакцией:
-электронов располагаются в одной молекуле, может иметь место аналогичное внутримолекулярное перициклическое перераспределение. Такой внутримолекулярный перициклический процесс называют электроциклической реакцией:

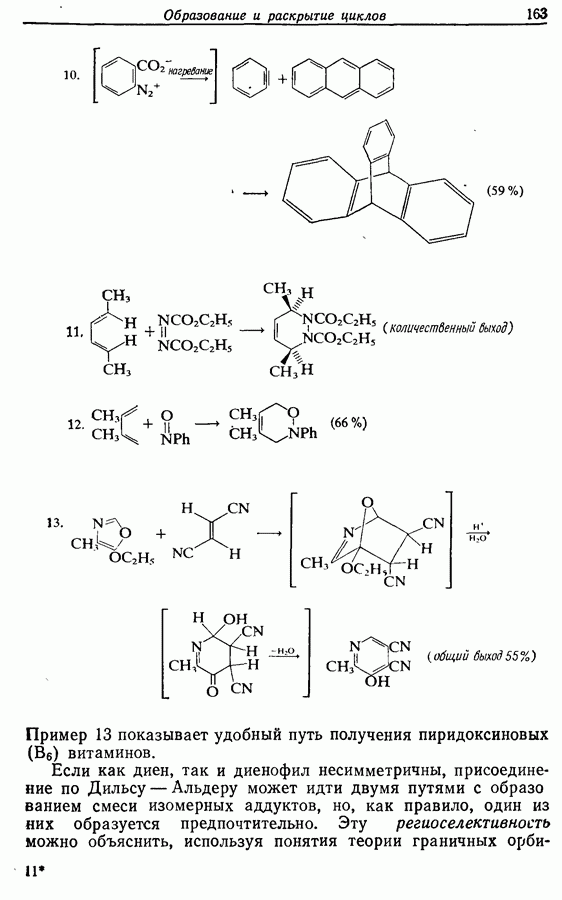
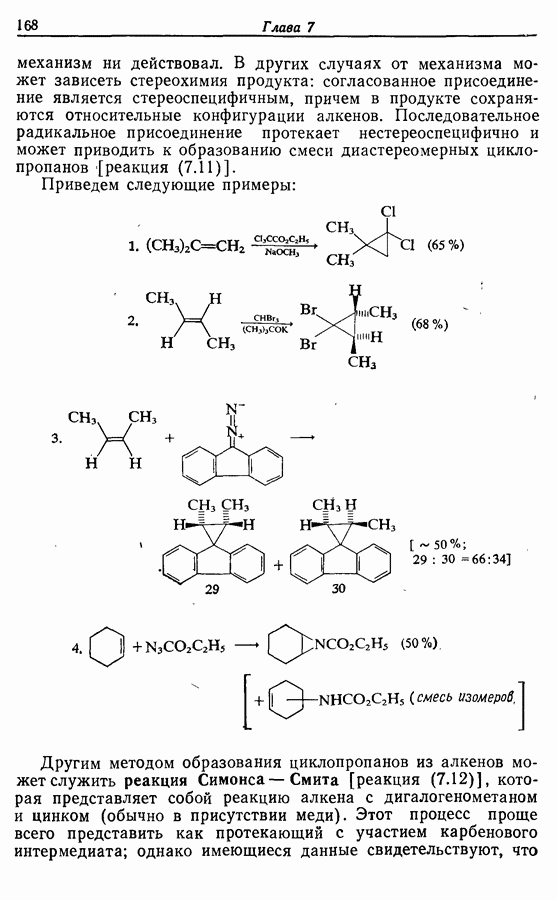
Реакция является стереоспецифичной, подобно реакции Дильса — Альдера и 1,3-диполярному циклоприсоединению, например:


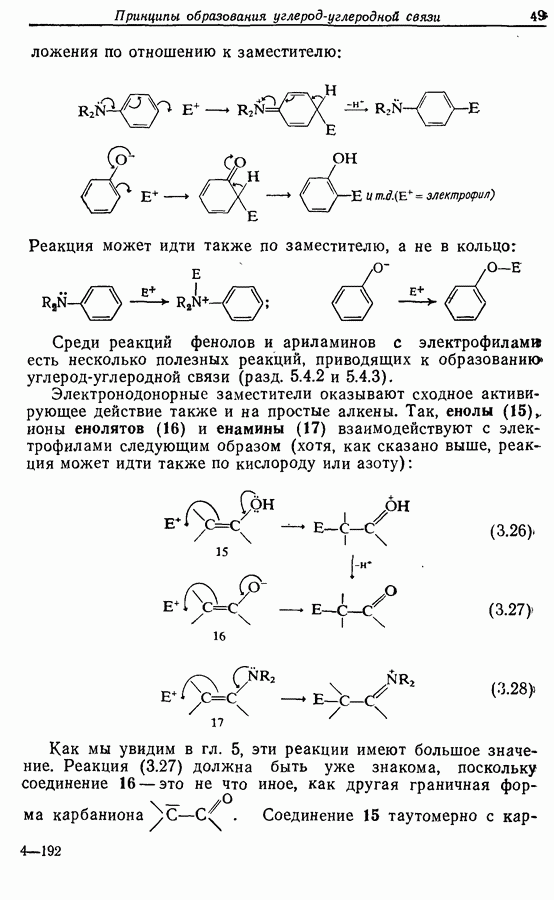
Аналогично

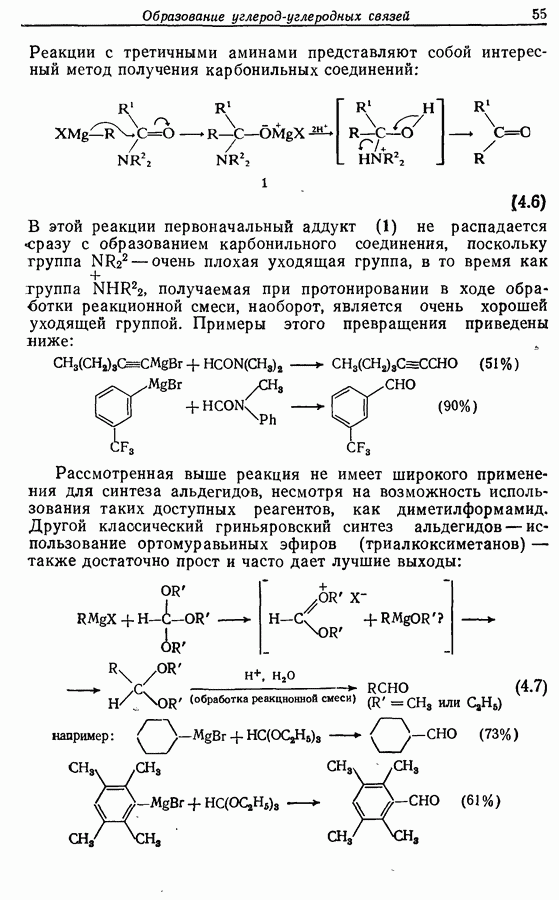
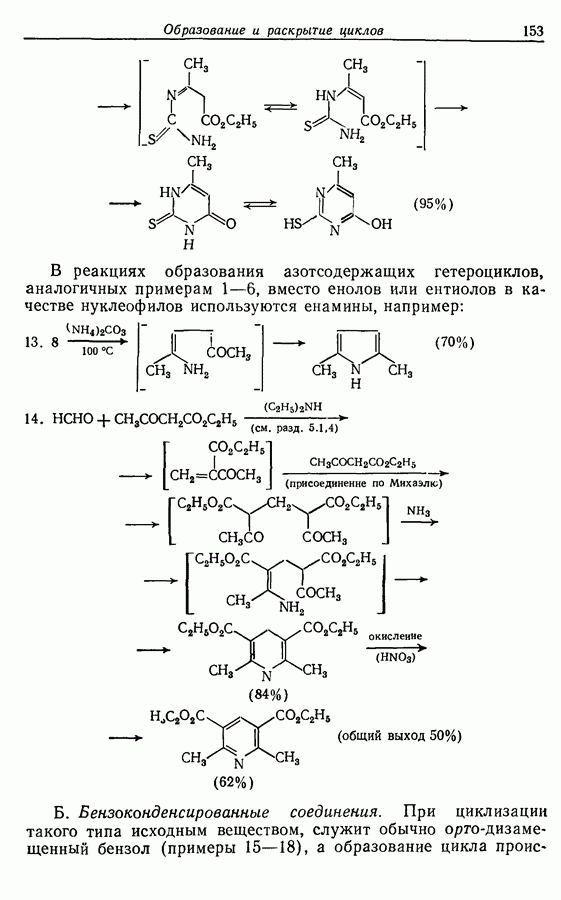
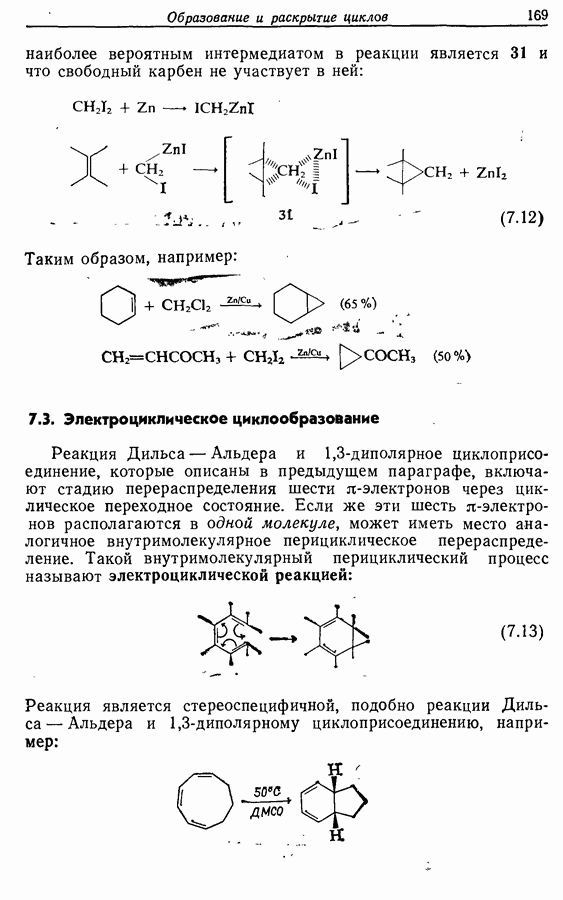
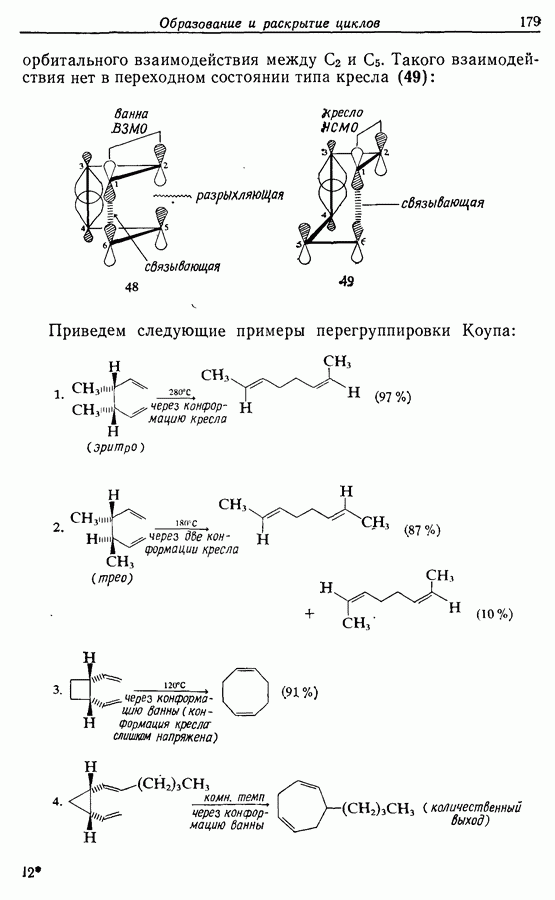
Стереохимию продуктов можно объяснить с точки зрения теории граничных орбиталей (см. Sykes, pp. 332-334). Для сопряженного триена высшей заполненной молекулярной орбиталью  является 33, а поэтому циклообразование — дисротаторный процесс:
является 33, а поэтому циклообразование — дисротаторный процесс:

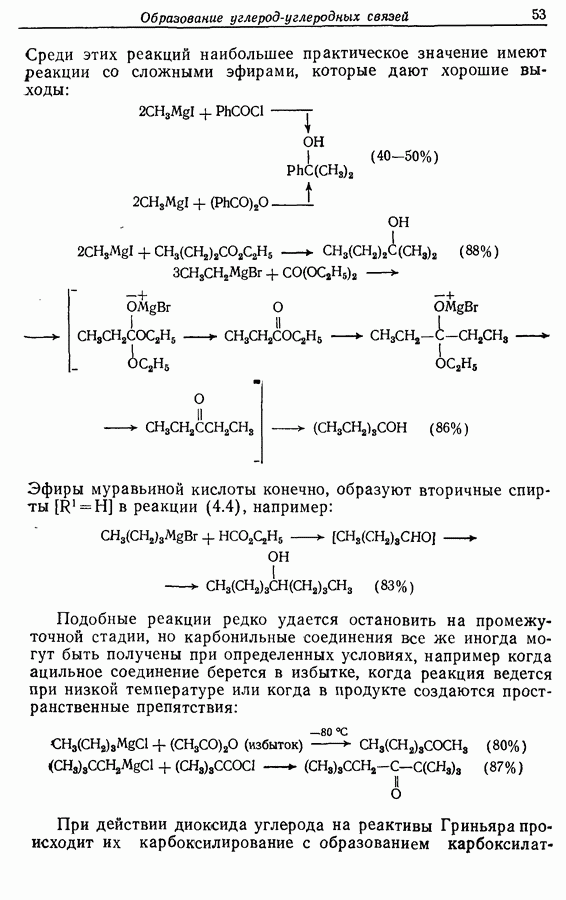
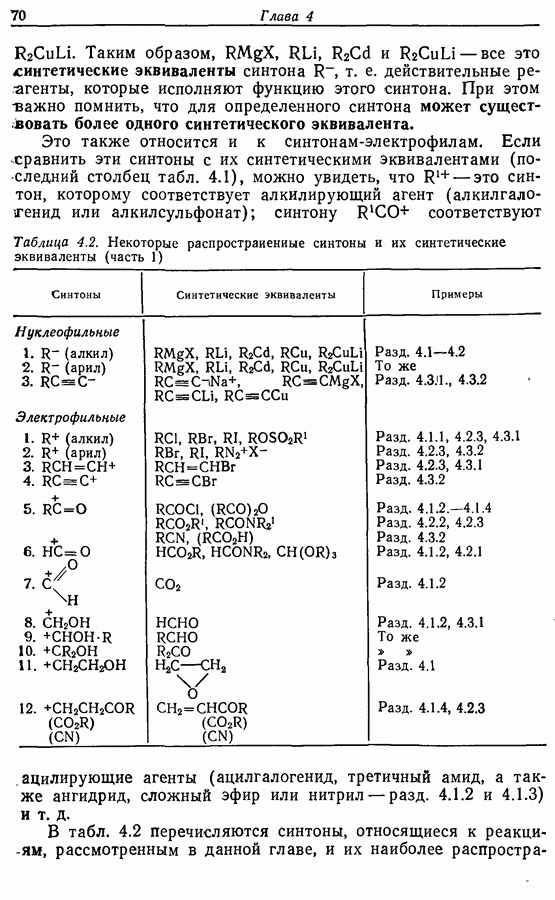
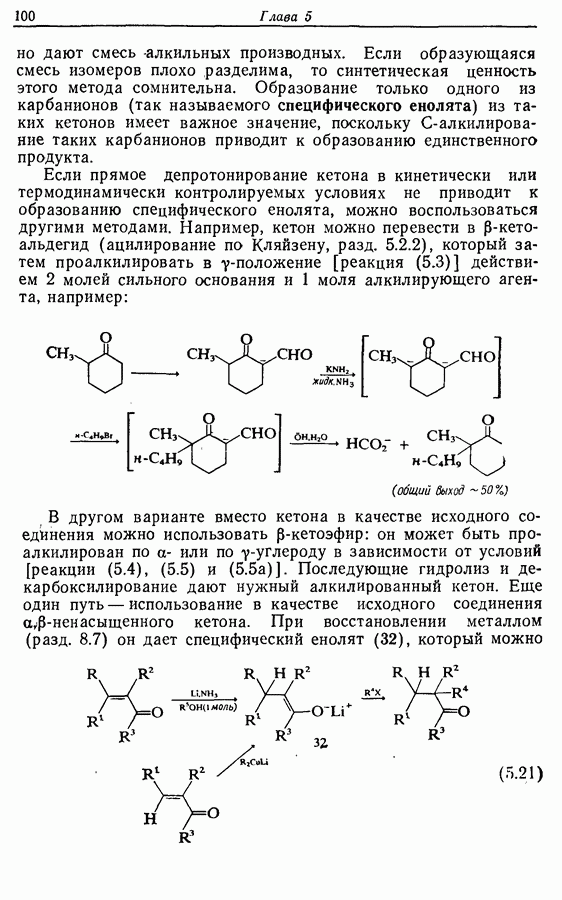
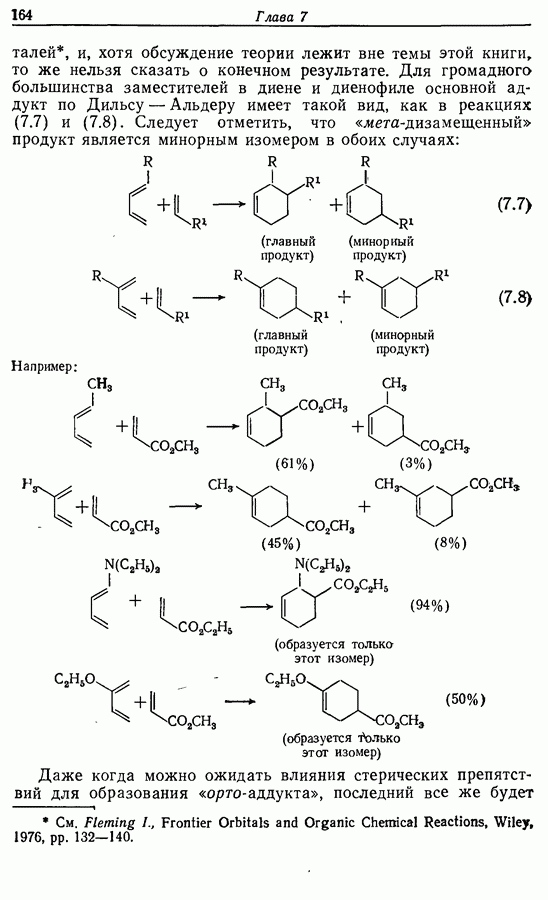
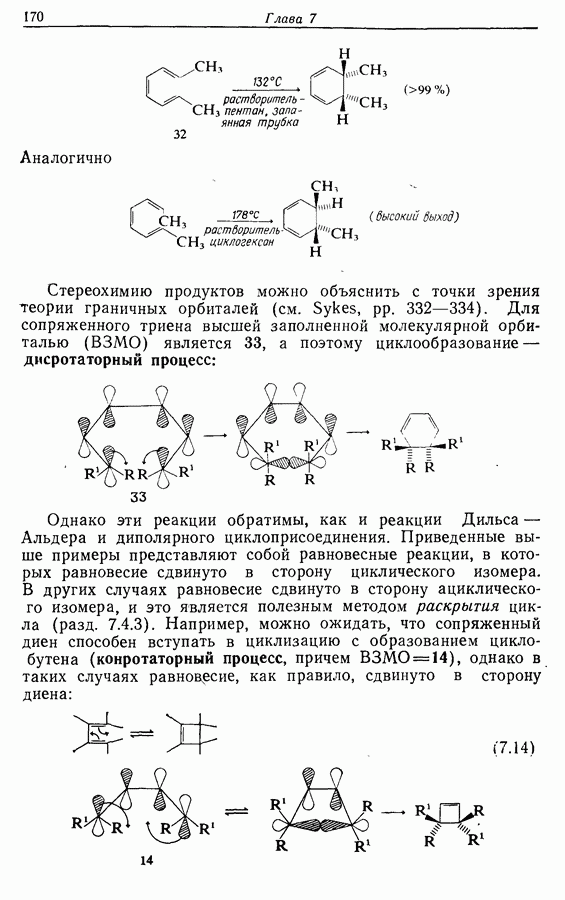
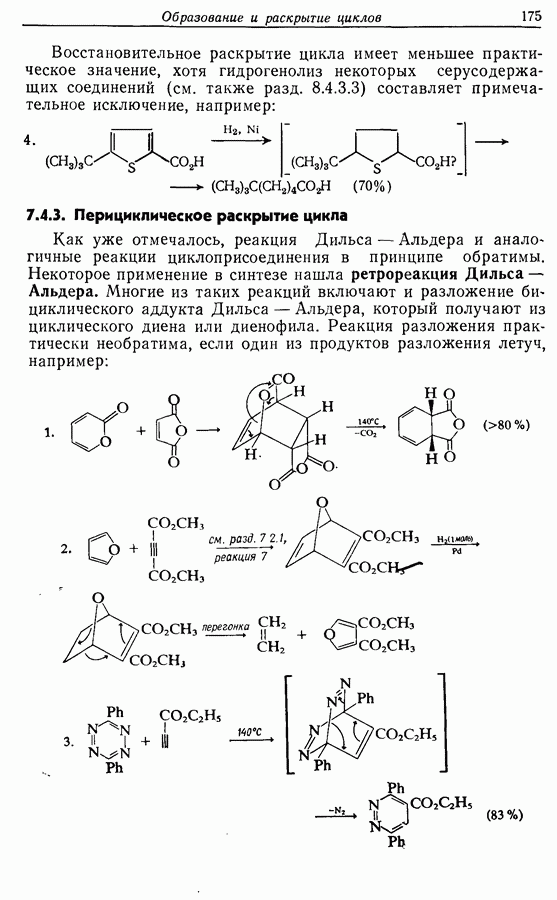
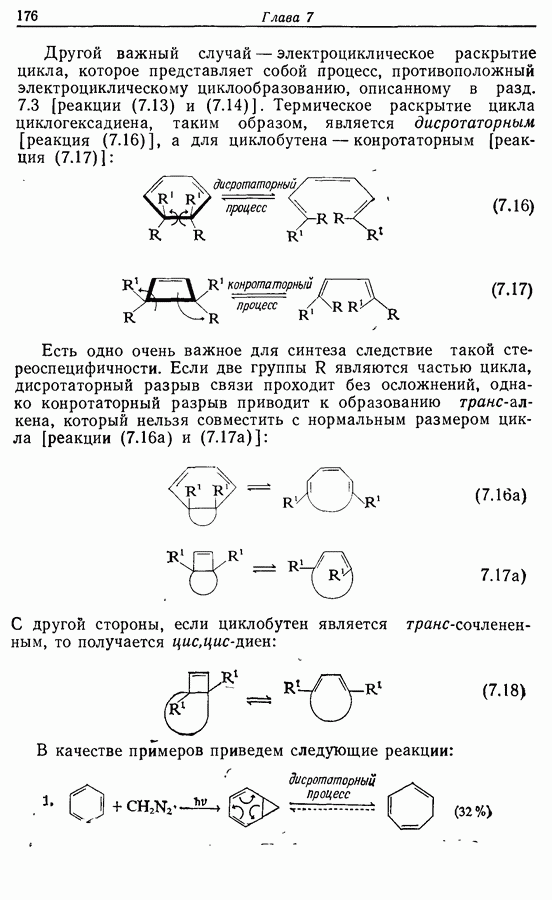
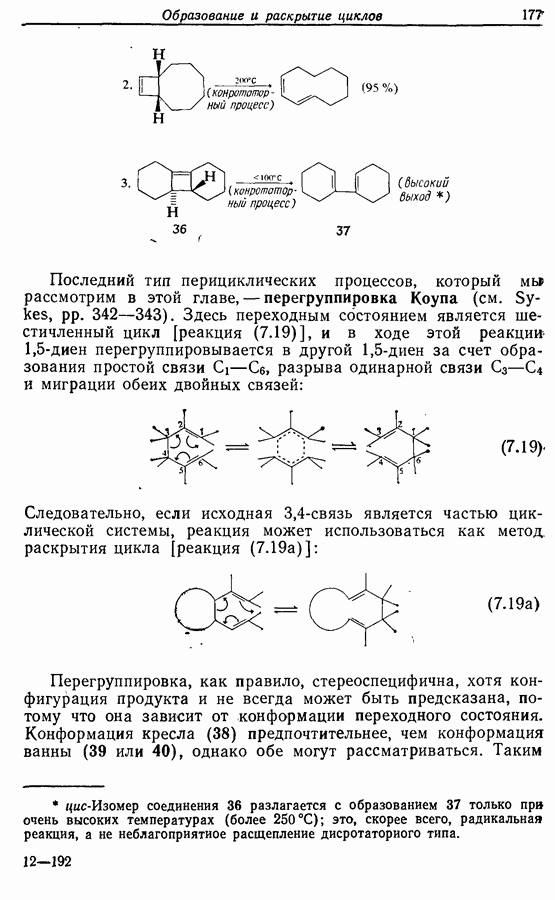
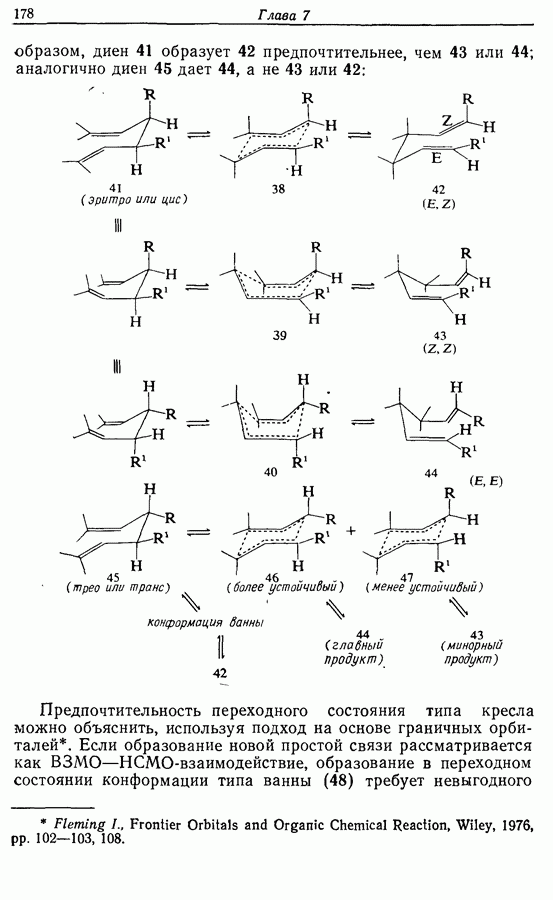
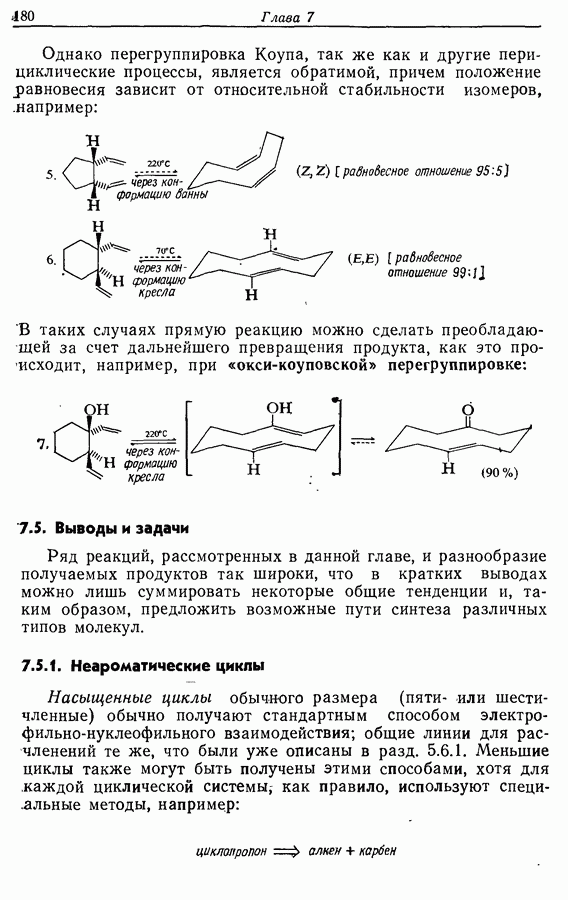
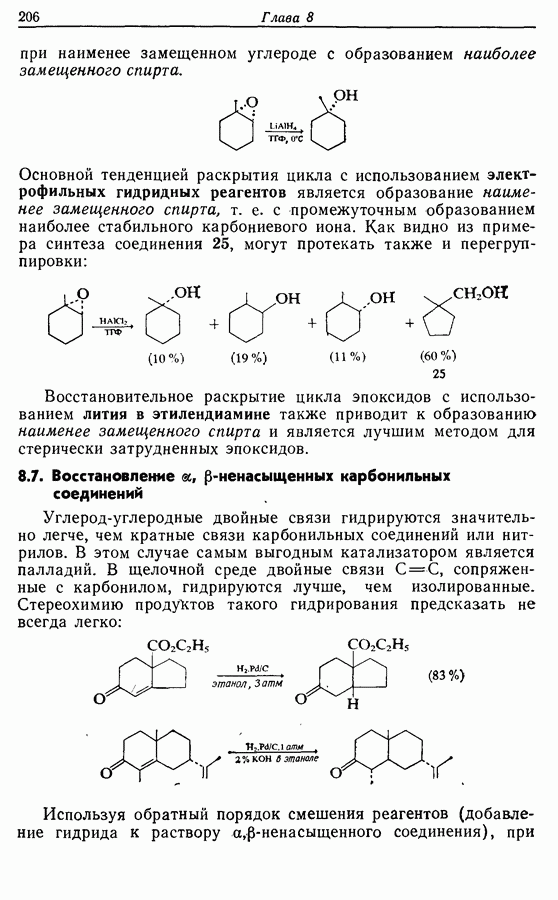
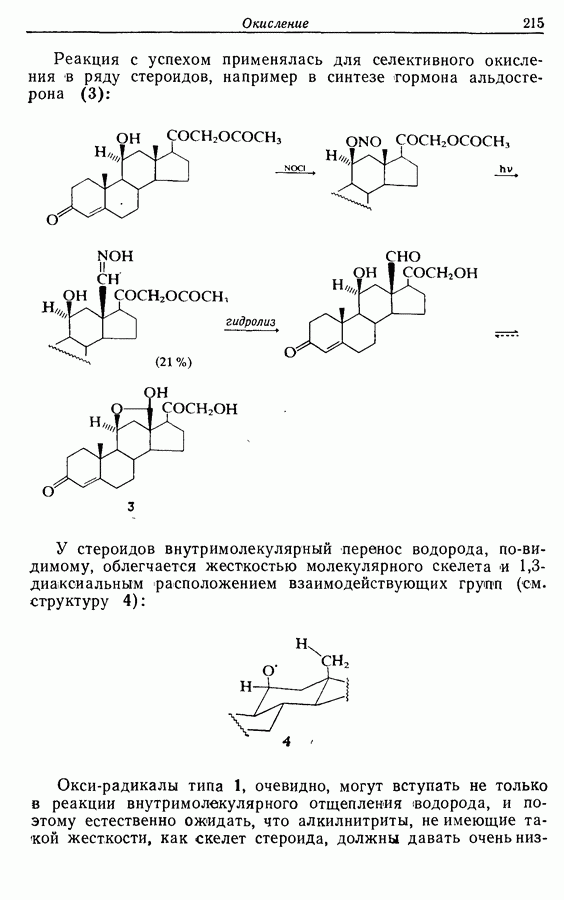
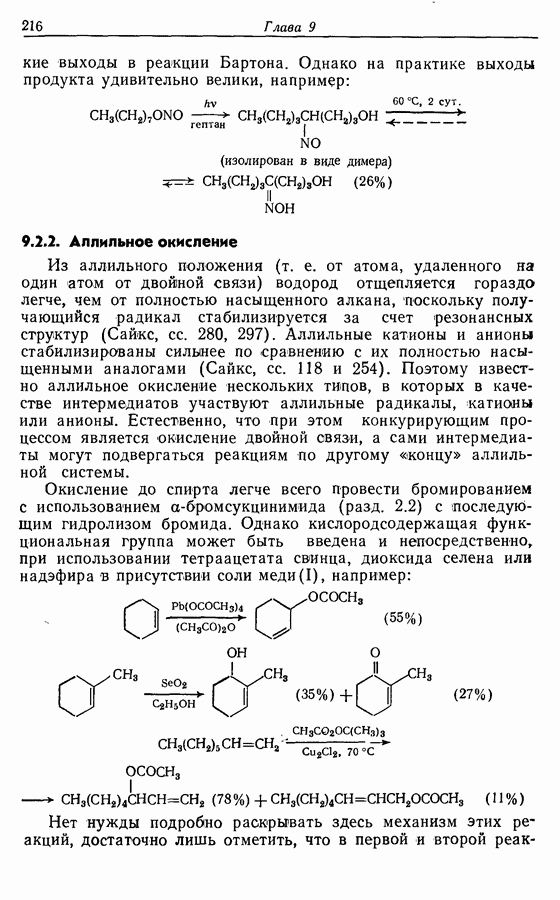
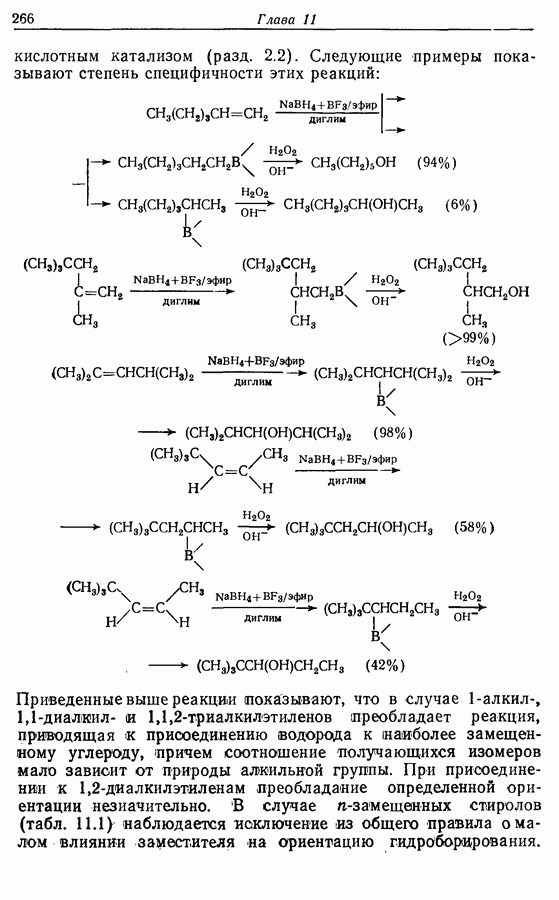
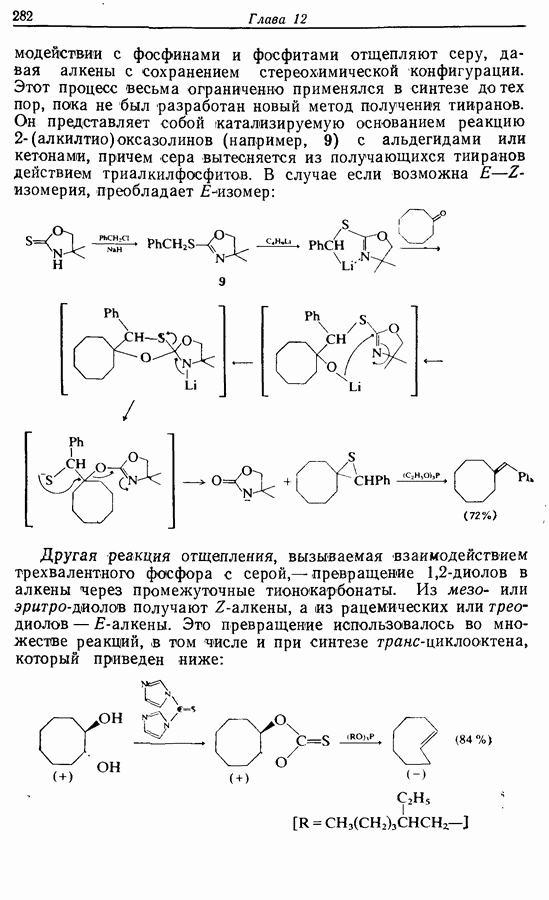
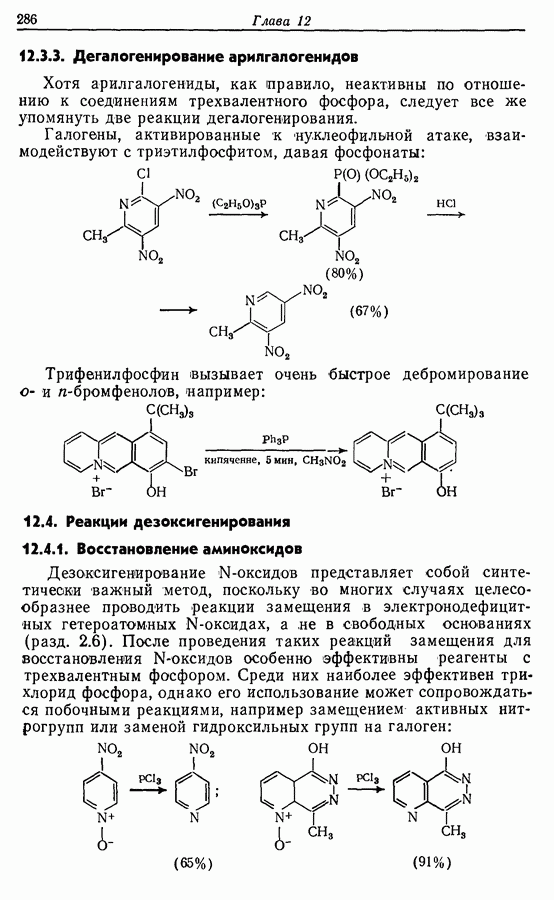
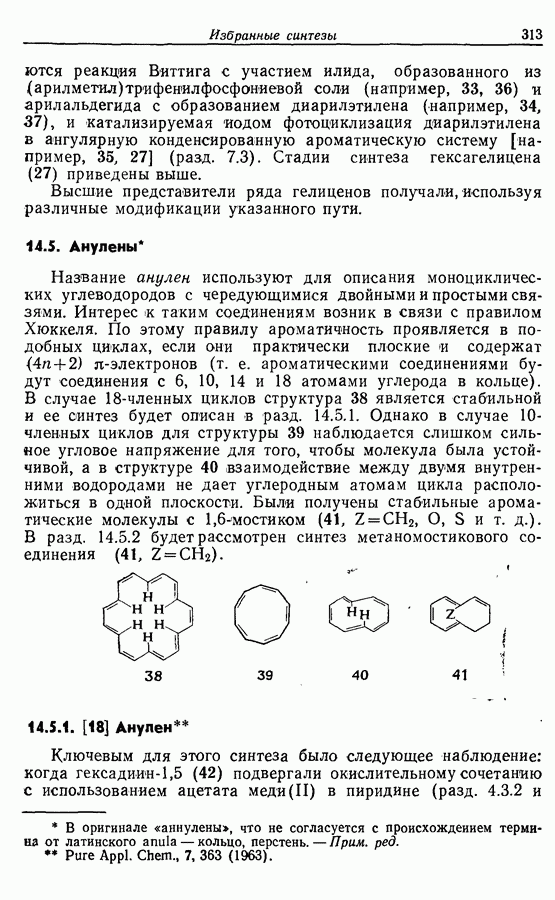
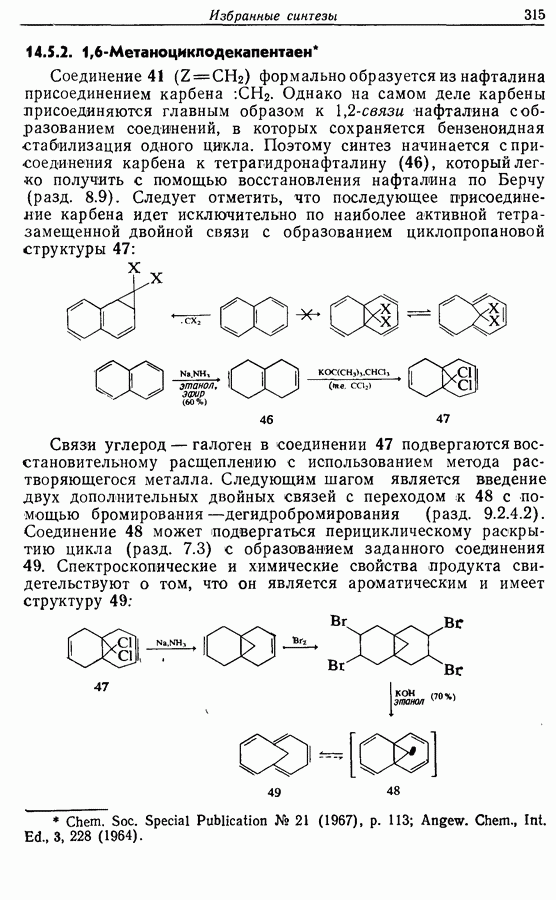
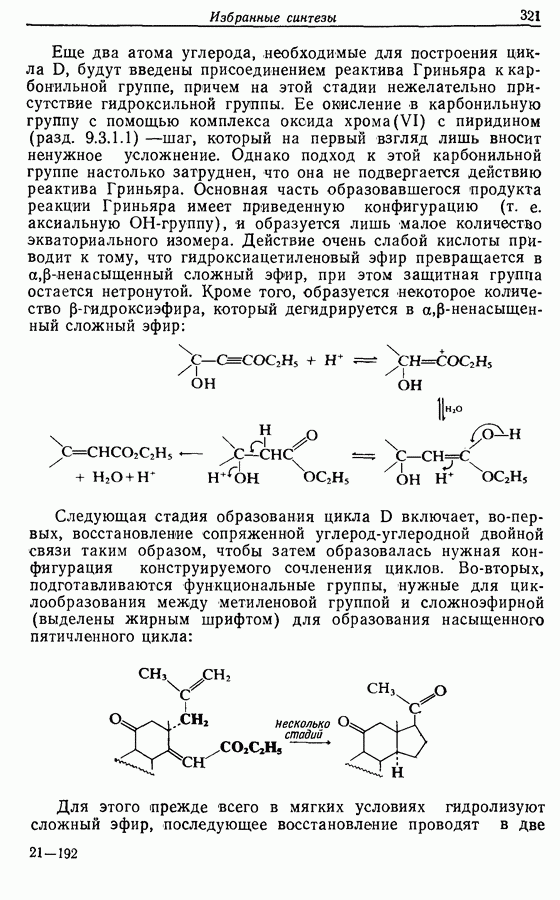
Однако эти реакции обратимы, как и реакции Дильса — Альдера и диполярного циклоприсоединения. Приведенные выше примеры представляют собой равновесные реакции, в которых равновесие сдвинуто в сторону циклического изомера. В других случаях равновесие сдвинуто в сторону ациклического изомера, и это является полезным методом раскрытия цикла (разд. 7.4.3). Например, можно ожидать, что сопряженный диен способен вступать в циклизацию с образованием циклобутена (конротаторный процесс, причем  однако в таких случаях равновесие, как правило, сдвинуто в сторону диена:
однако в таких случаях равновесие, как правило, сдвинуто в сторону диена:

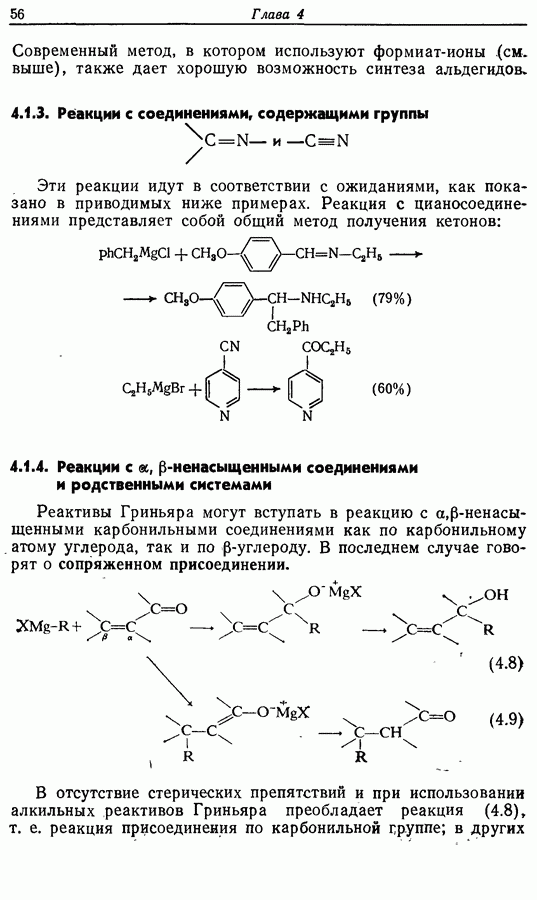
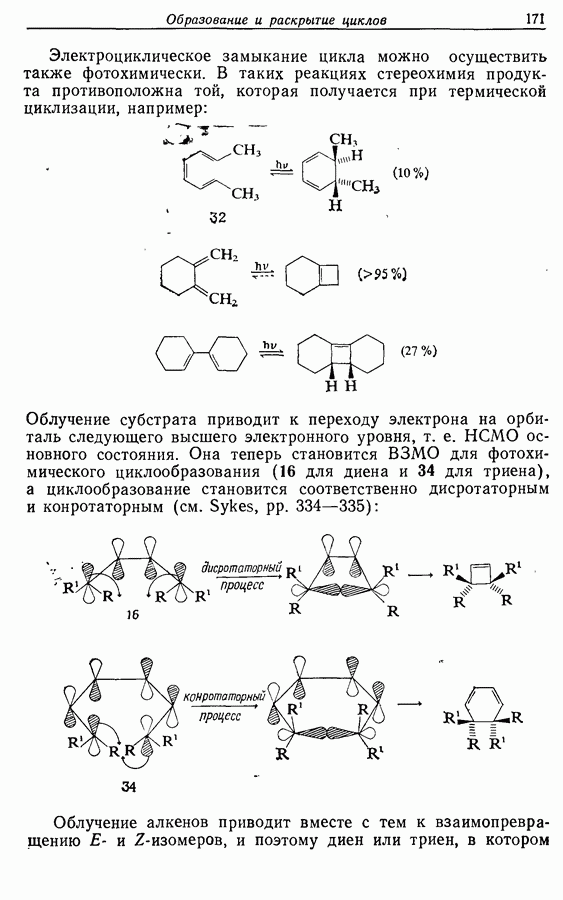
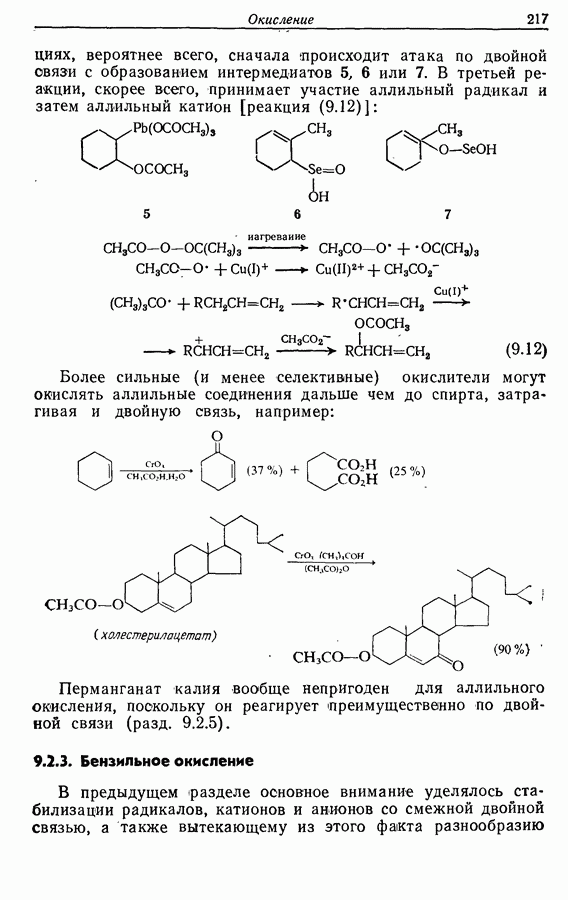
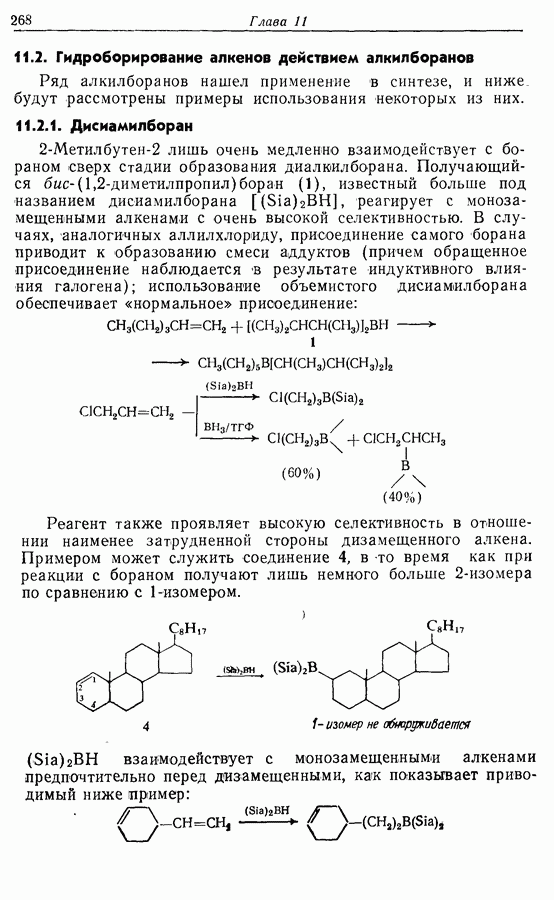
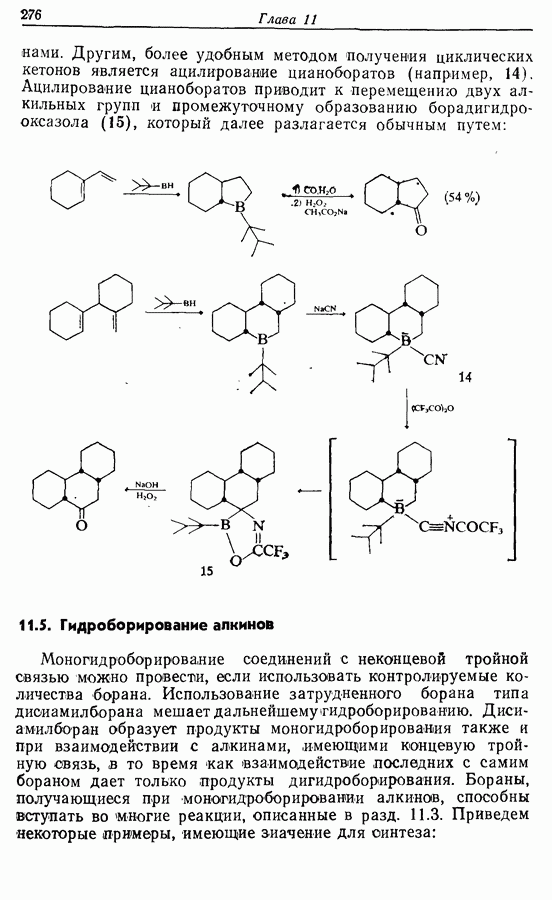
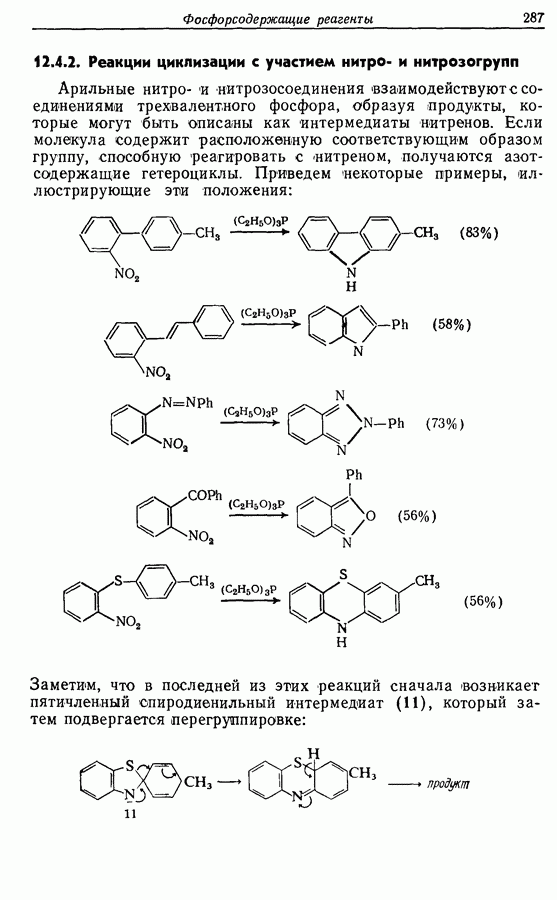
Электроциклическое замыкание цикла можно осуществить также фотохимически. В таких реакциях стереохимия продукта противоположна той, которая получается при термической циклизации, например:

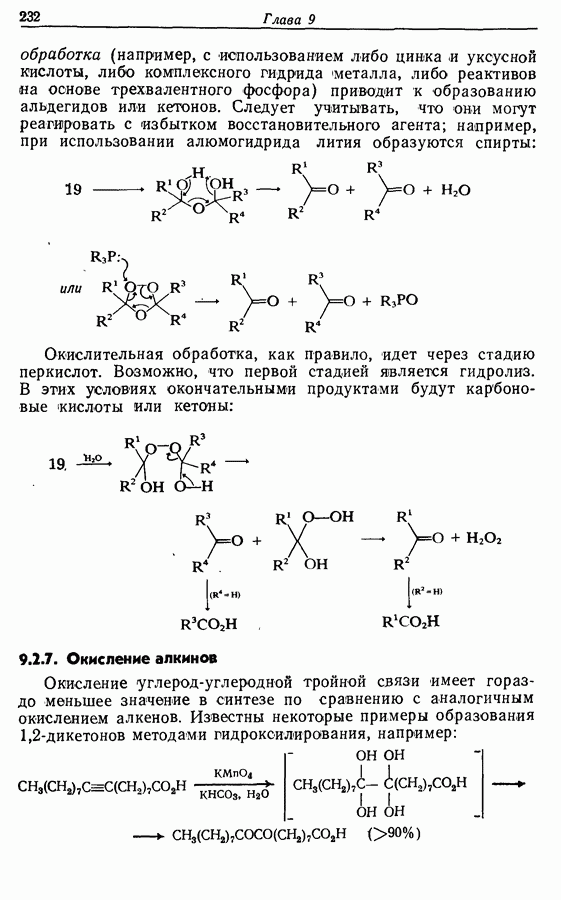
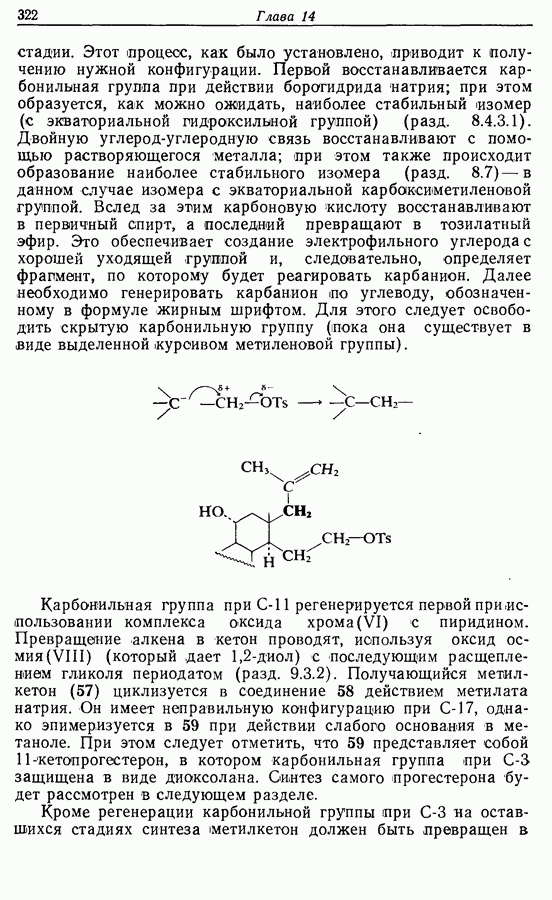
Облучение субстрата приводит к переходу электрона на орбиталь следующего высшего электронного уровня, т. е.  основного состояния. Она теперь становится
основного состояния. Она теперь становится  для фотохимического циклообразования (16 для диена и 34 для триена), а циклообразование становится соответственно дисротаторным и конротаторным (см. Sykes, pp. 334-335):
для фотохимического циклообразования (16 для диена и 34 для триена), а циклообразование становится соответственно дисротаторным и конротаторным (см. Sykes, pp. 334-335):

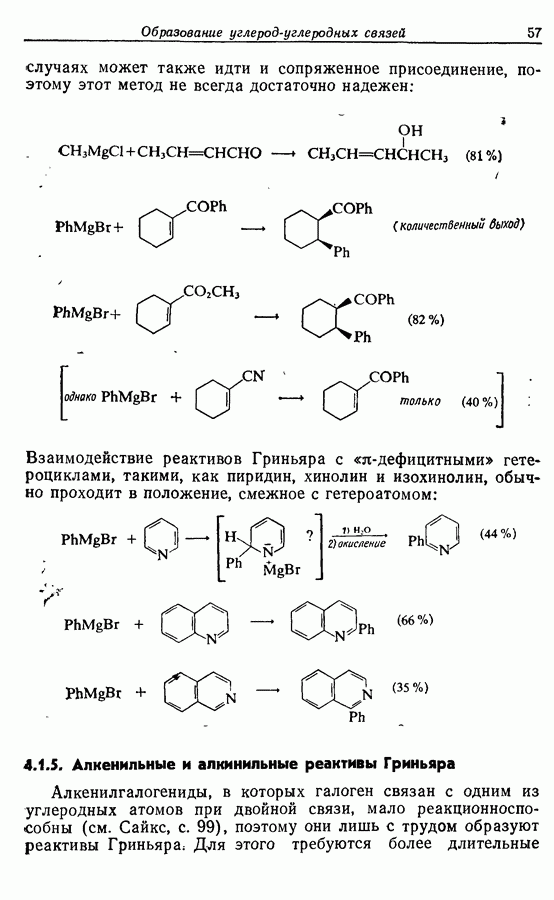
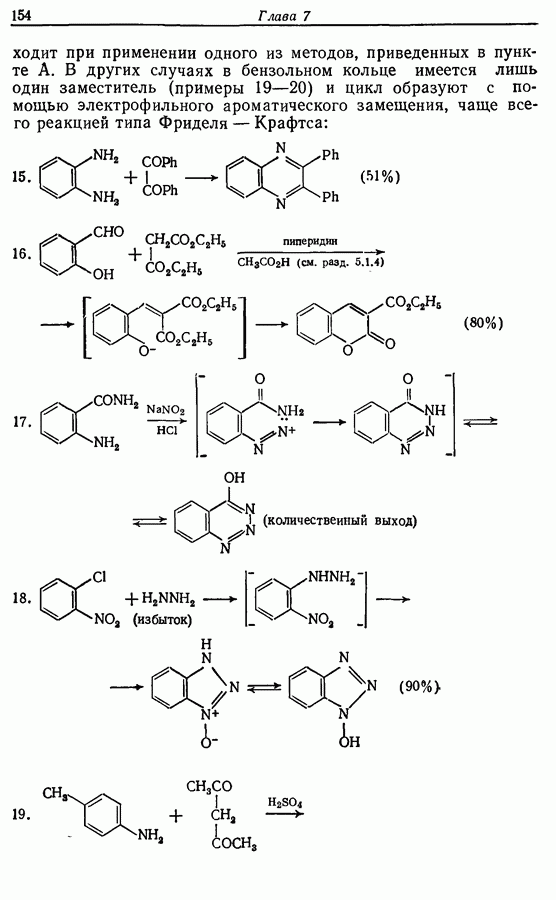
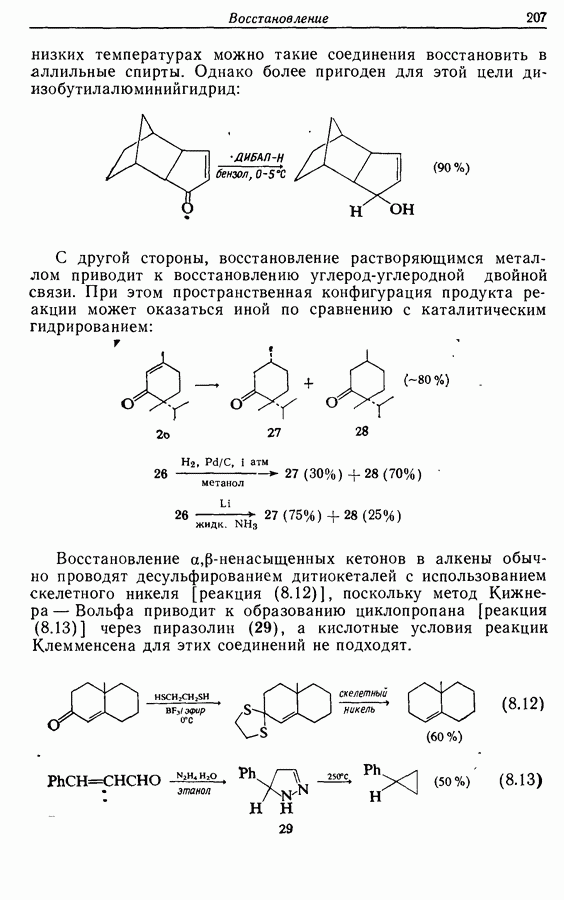
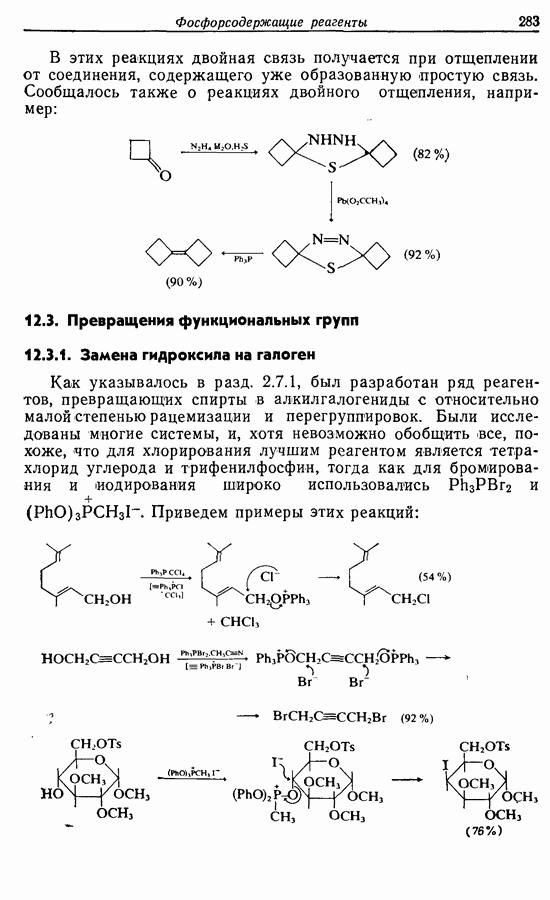
Облучение алкенов приводит вместе с тем к взаимопревращению  и
и  -изомеров, и поэтому диен или триен, в котором
-изомеров, и поэтому диен или триен, в котором
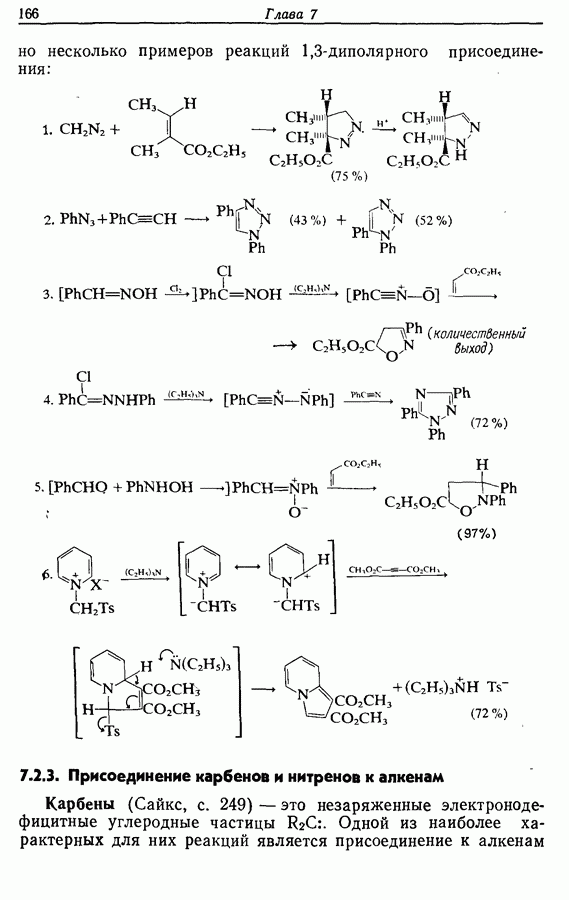
конфигурации двойных связей не являются фиксированными (например, в циклической системе), может подвергаться не только циклообразованию, но и изомеризации этого типа, например:

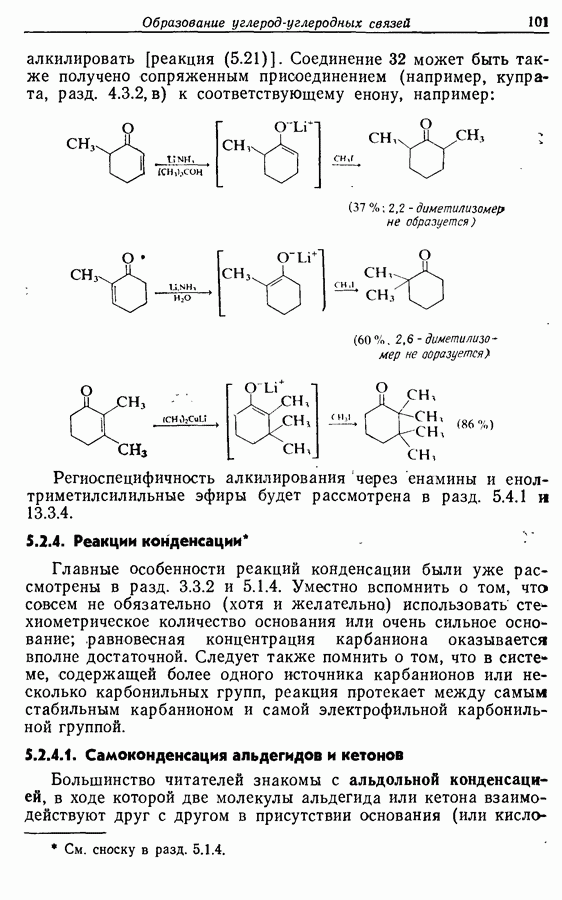
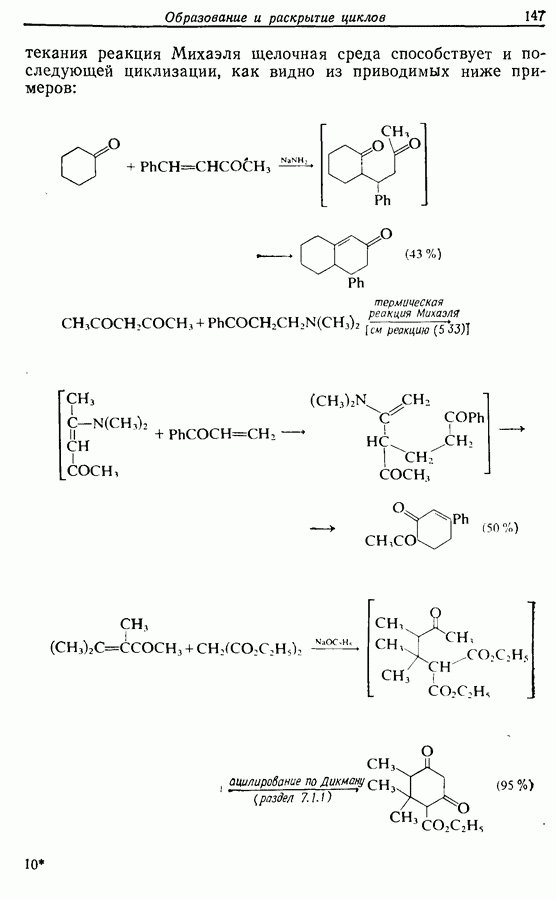
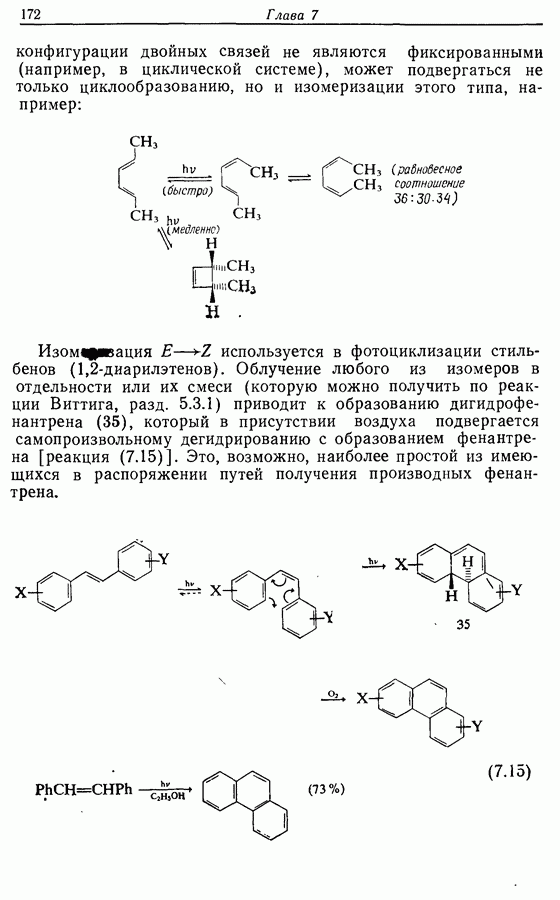
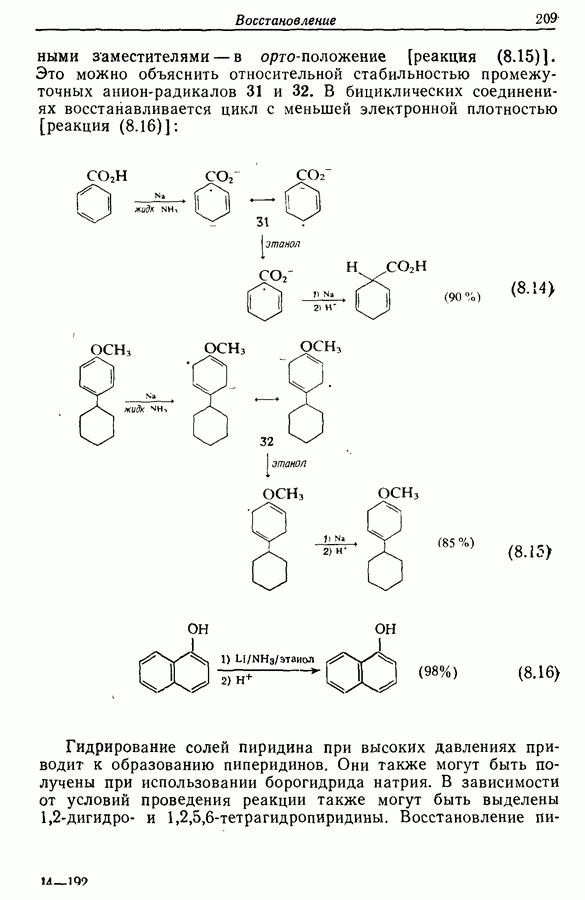
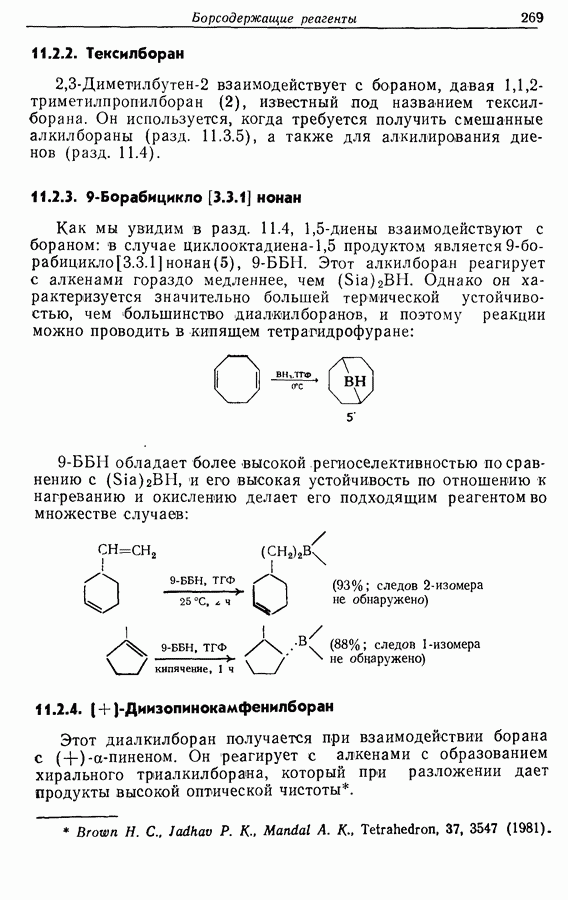
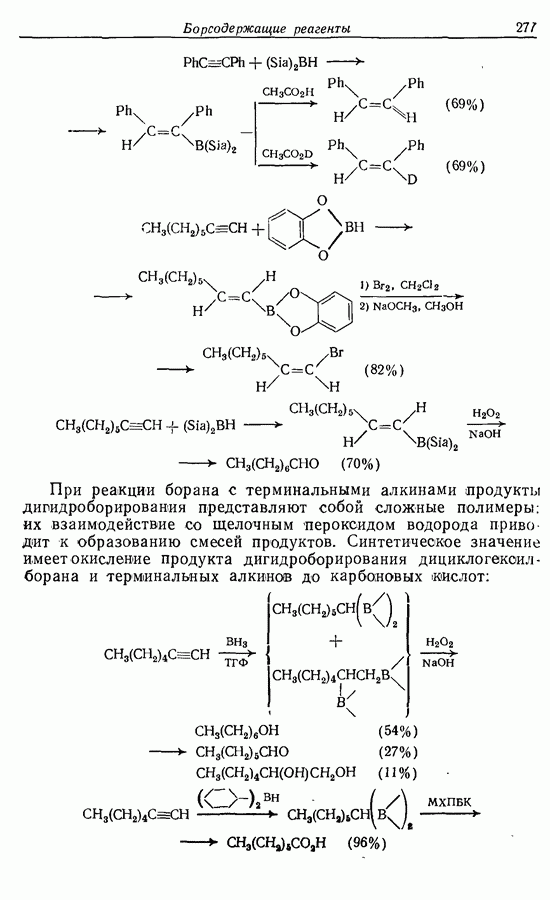
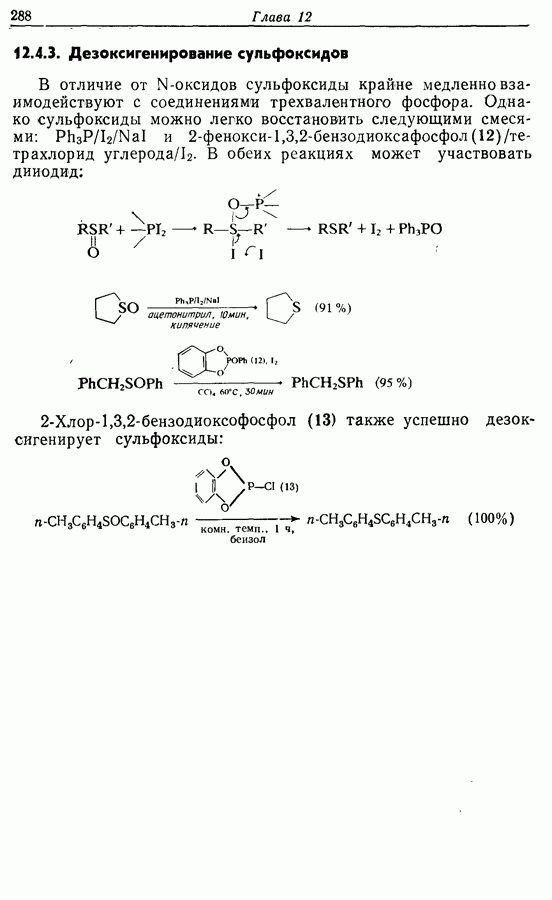
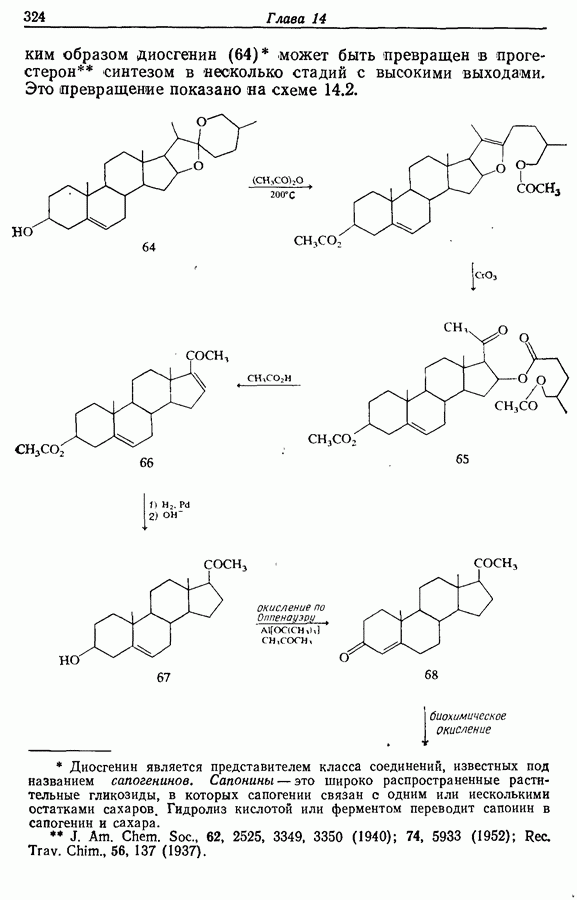
Изомрвация  —используется в фотоциклизации стильбенов
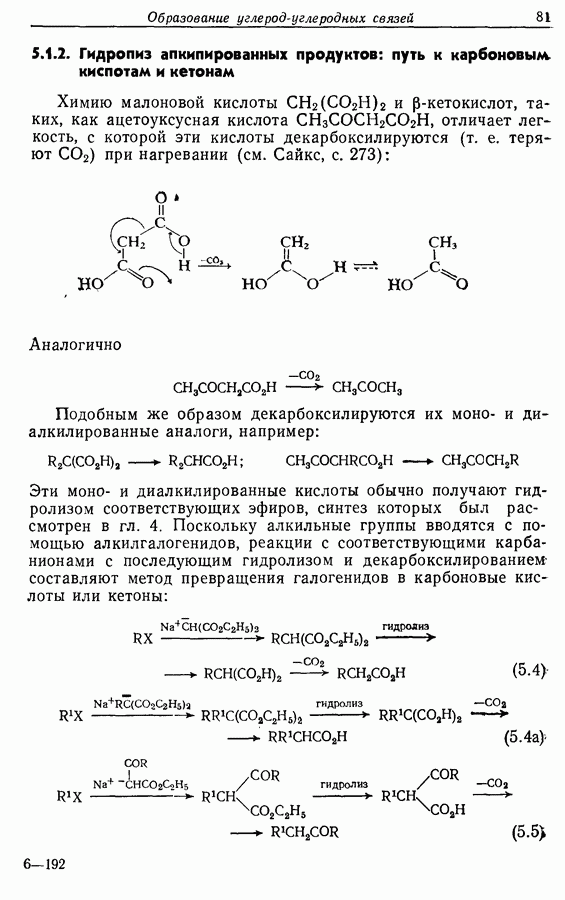
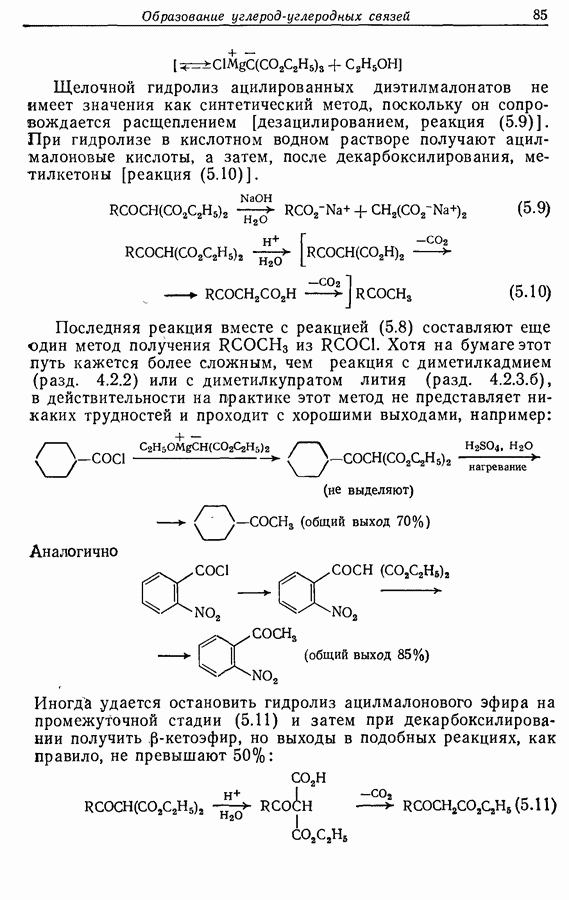
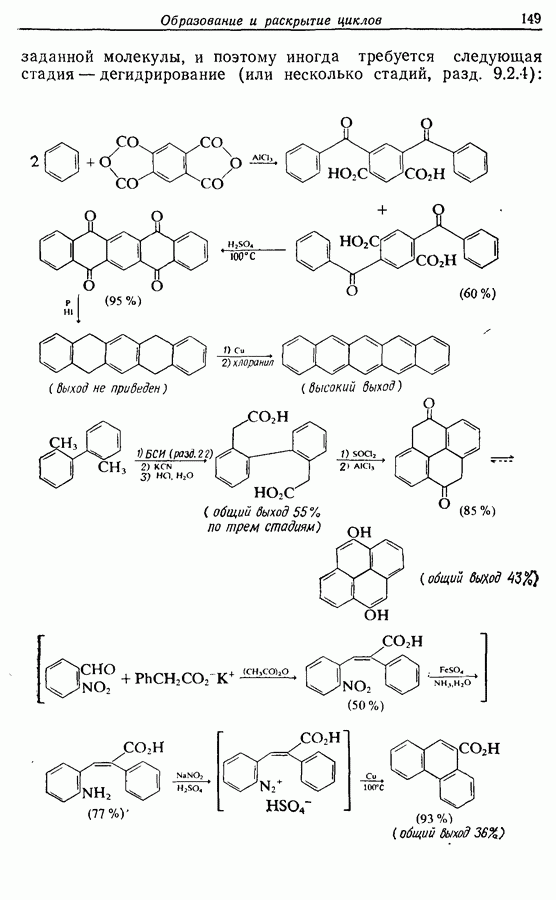
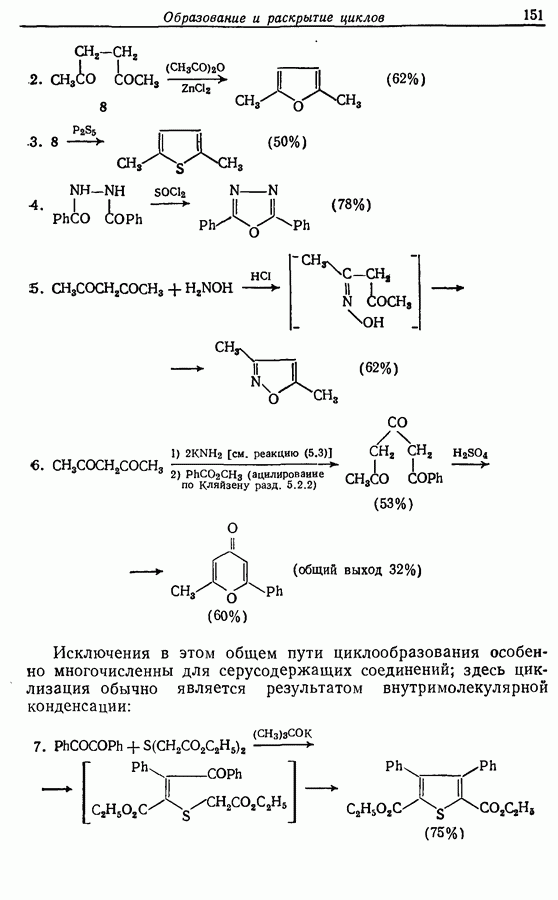
—используется в фотоциклизации стильбенов  -диарилэтенов). Облучение любого из изомеров в отдельности или их смеси (которую можно получить по реакции Виттига, разд. 5.3.1) приводит к образованию дигидрофенантрена (35), который в присутствии воздуха подвергается самопроизвольному дегидрированию с образованием фенантрена [реакция (7.15)]. Это, возможно, наиболее простой из имеющихся в распоряжении путей получения производных фенан-трена.
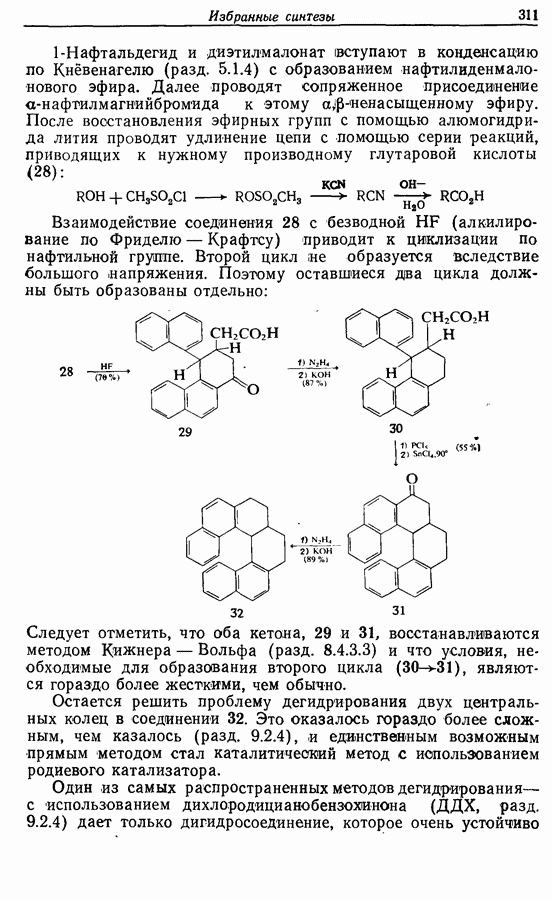
-диарилэтенов). Облучение любого из изомеров в отдельности или их смеси (которую можно получить по реакции Виттига, разд. 5.3.1) приводит к образованию дигидрофенантрена (35), который в присутствии воздуха подвергается самопроизвольному дегидрированию с образованием фенантрена [реакция (7.15)]. Это, возможно, наиболее простой из имеющихся в распоряжении путей получения производных фенан-трена.

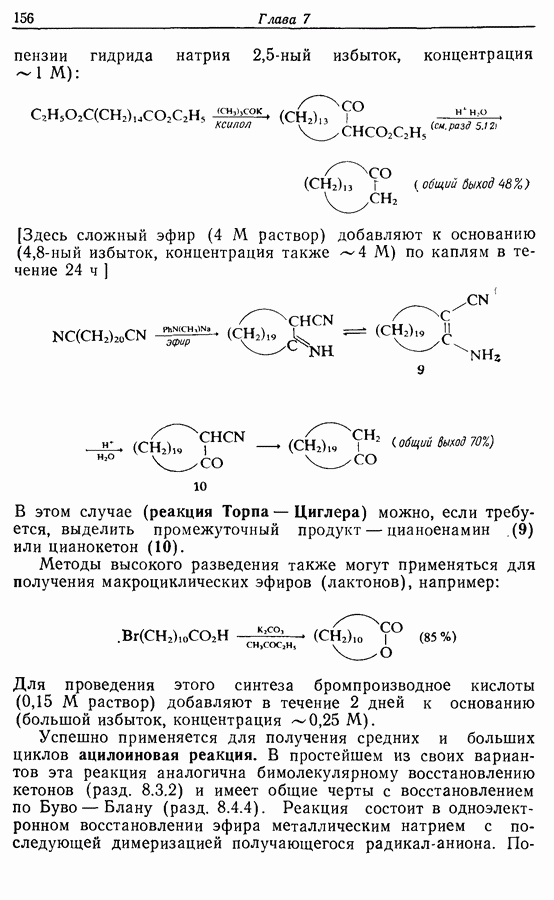
Аналогично

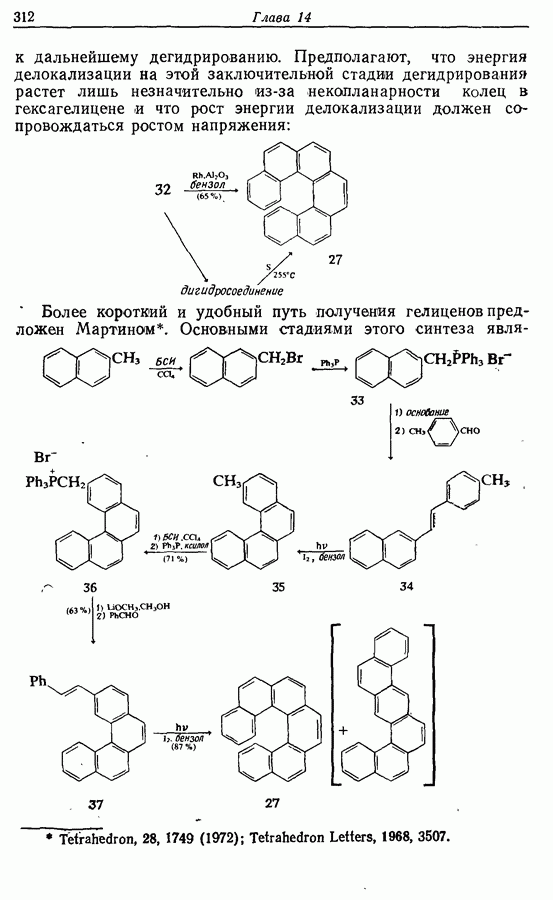
Этот метод также с успехом применяется в синтезе гелиценов 
| << Предыдущий параграф | Следующий параграф >> |
Оглавление
- ПРЕДИСЛОВИЕ РЕДАКТОРА ПЕРЕВОДА
- 1. ВВЕДЕНИЕ
- 2. ВВЕДЕНИЕ И ВЗАИМОПРЕВРАЩЕНИЯ ФУНКЦИОНАЛЬНЫХ ГРУПП
- 2.1. Введение функциональных групп в апканы
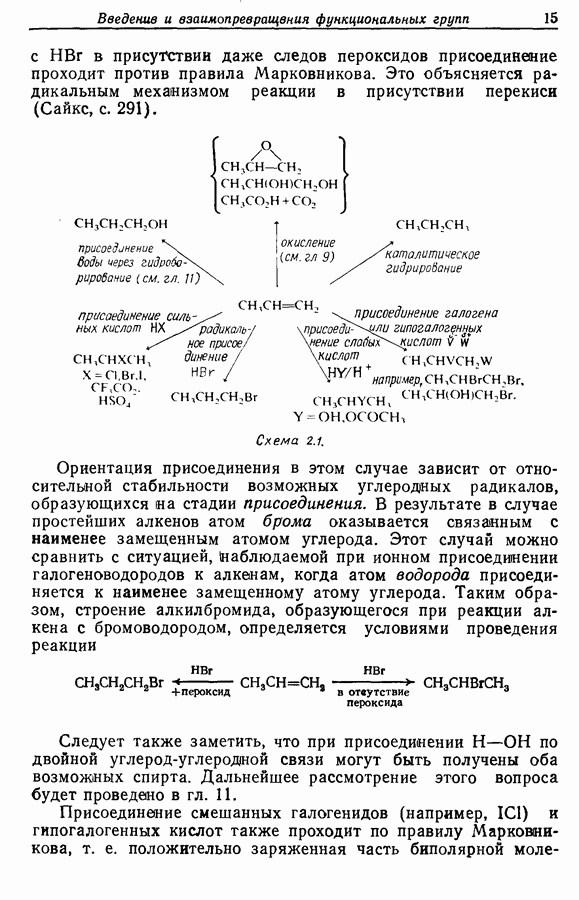
- 2.2. Введение функциональных групп в алкены
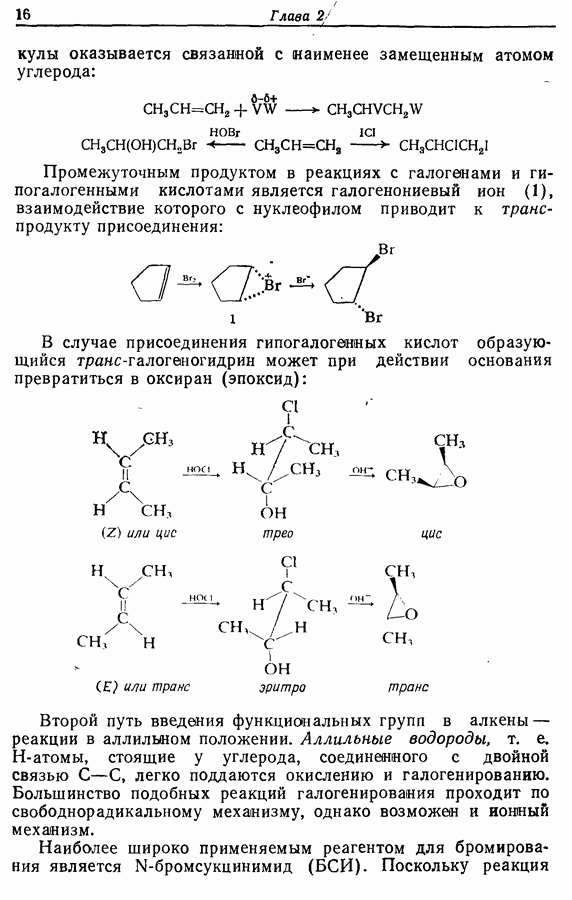
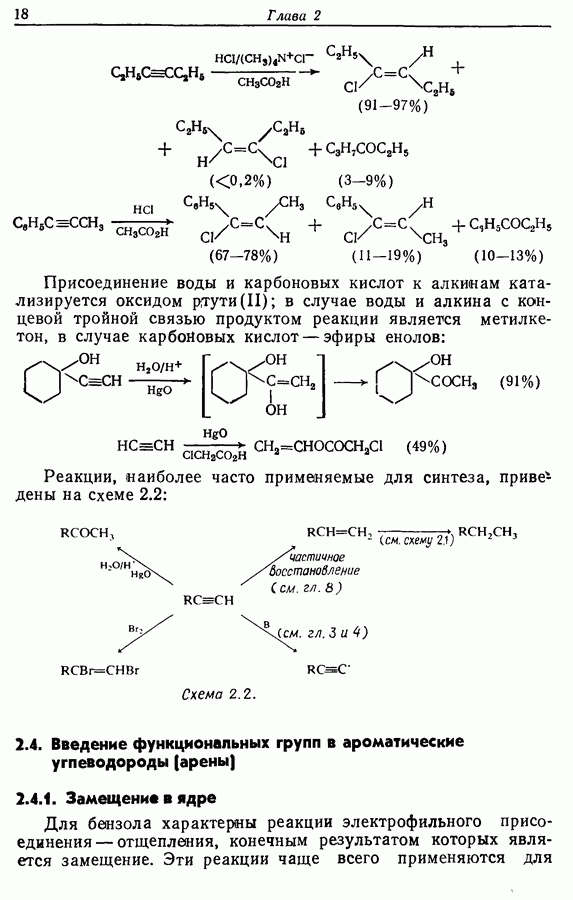
- 2.3. Введение функциональных групп в апкины
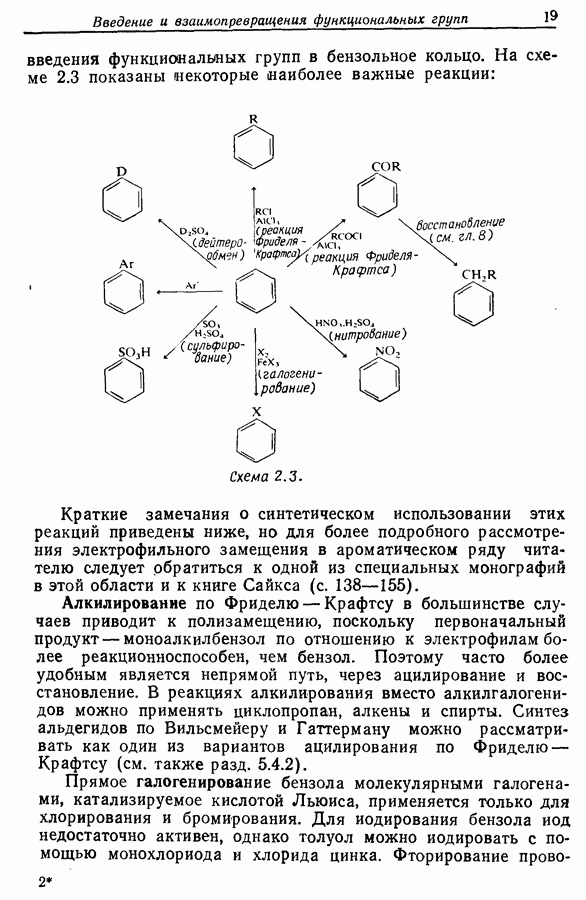
- 2.4. Введение функциональных групп в ароматические углеводороды (арены)
- 2.5. Введение функциональных групп в производные бензола
- 2.6. Введение функциональных групп в простые гетероциклические соединения
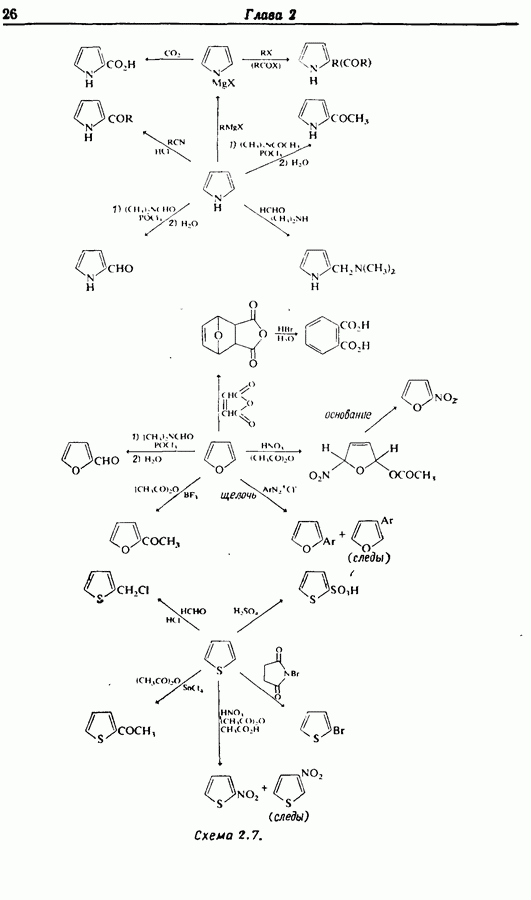
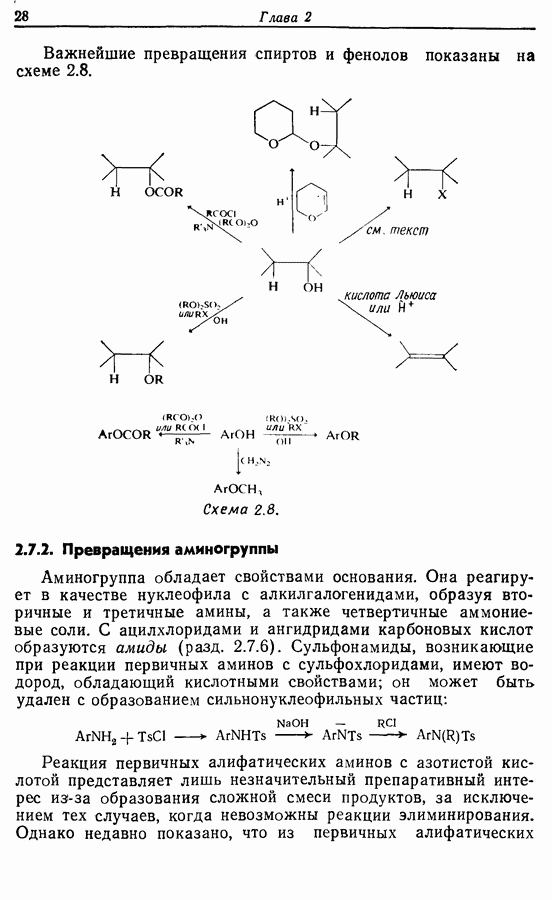
- 2.7. Взаимопревращения функциональных групп
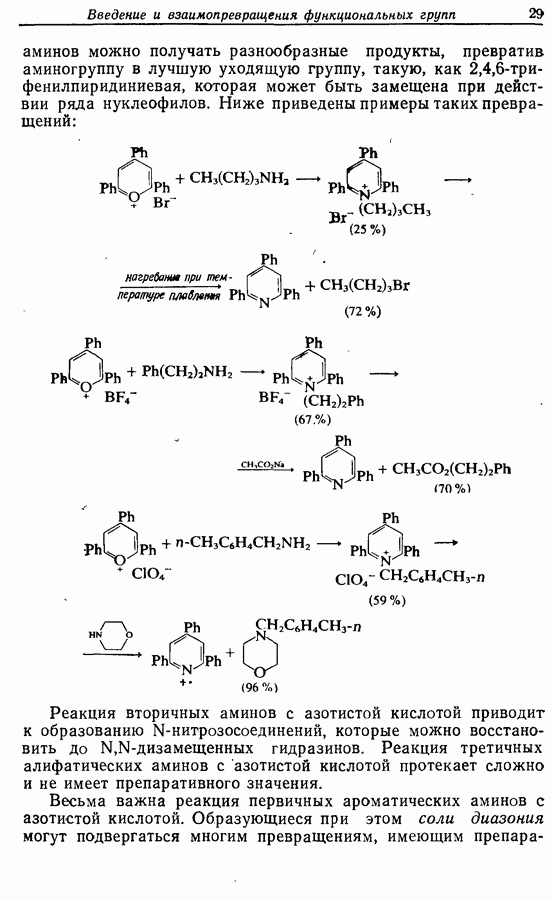
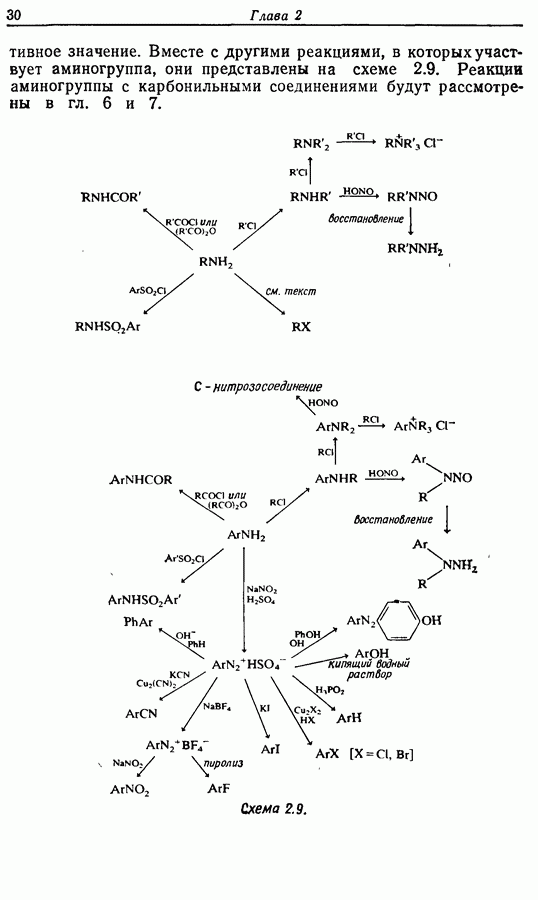
- 2.7.2. Превращения аминогруппы
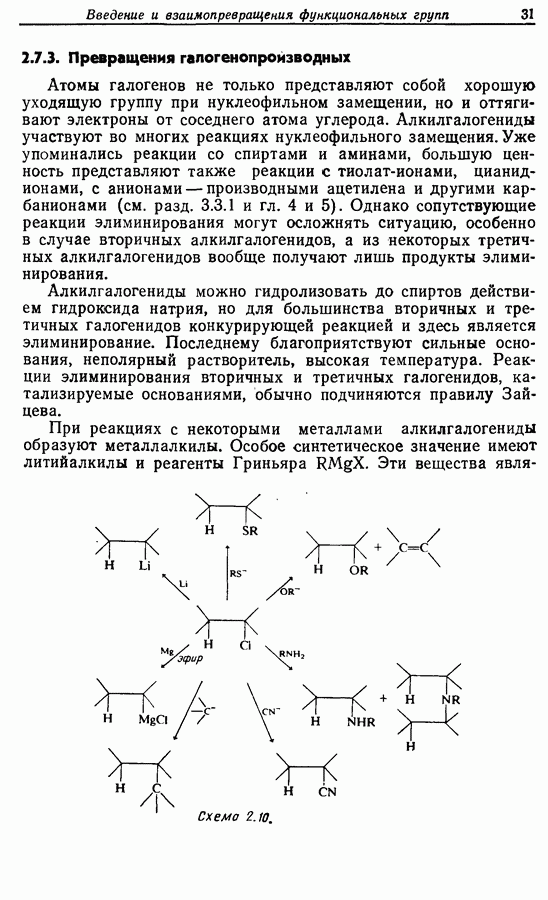
- 2.7.3. Превращения галогенопроизводных
- 2.7.4. Превращения нитросоединений
- 2.7.5. Превращения альдегидов и кетонов
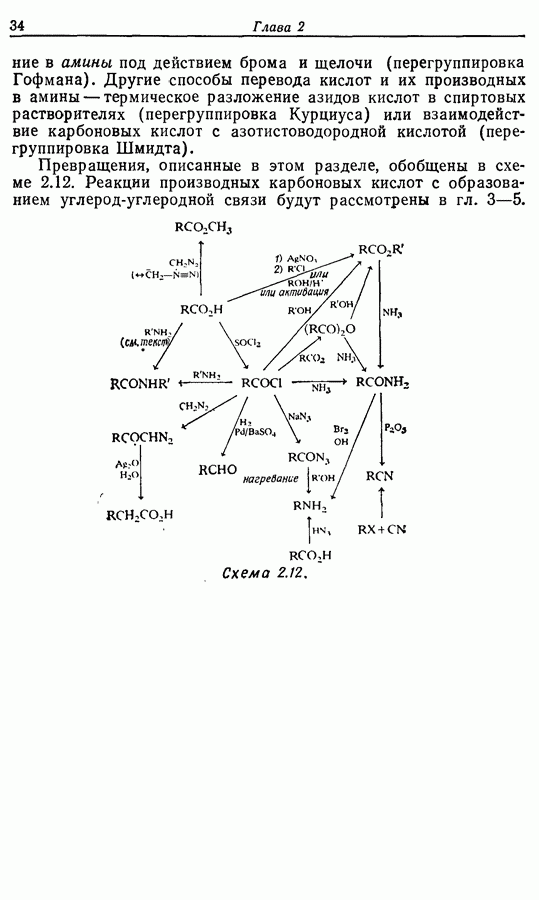
- 2.7.6. Превращения кислот и их производных
- 3. ПРИНЦИПЫ ОБРАЗОВАНИЯ УГЛЕРОД-УГЛЕРОДНОЙ СВЯЗИ
- 3.2. Расчленение и синтоны
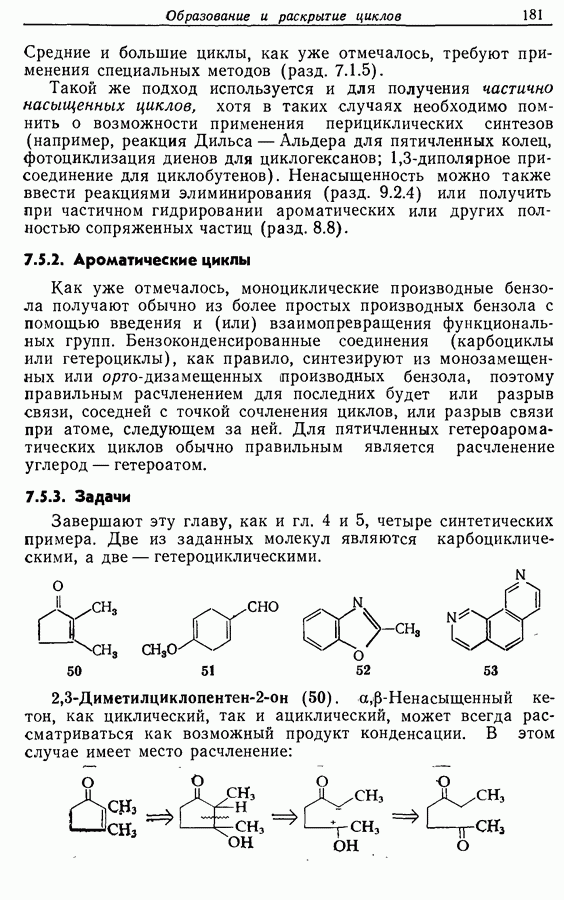
- 3.3. Электрофильные углеродные частицы
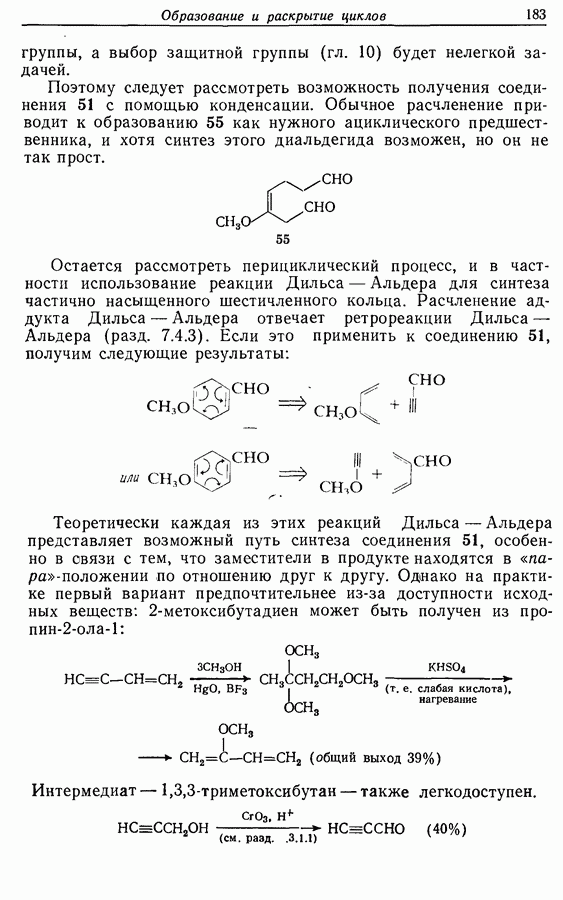
- 3.4. Нуклеофильиые углеродные частицы
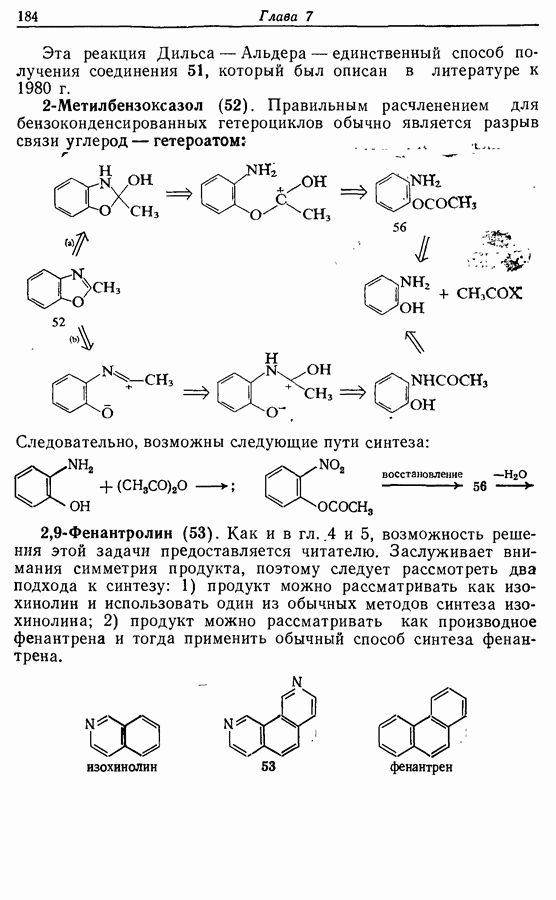
- 3.4.2. Стабилизированные карбанионы
- 3.4.3. Алкены, арены и гетероарены
- 4. ОБРАЗОВАНИЕ УГЛЕРОД-УГЛЕРОДНЫХ СВЯЗЕЙ: РЕАКЦИИ МЕТАЛЛООРГАНИЧЕСКИХ СОЕДИНЕНИЙ
- 4.1. Реактивы Гриньяра и электрофилы
- 4.2. Другие металлоорганические реактивы и электрофилы
- 4.2.2. Цинк- и кадмийорганические соединения
- 4.2.3. Органические соединения меди (I)
- 4.3. Реакции нуклеофилов, образованных из алкинов-1
- 4.3.2. Алкинильные соединения меди (I)
- 4.4. Выводы
- 4.5. Примеры
- 5. ОБРАЗОВАНИЕ УГЛЕРОД-УГЛЕРОДНЫХ СВЯЗЕЙ: ИСПОЛЬЗОВАНИЕ СТАБИЛИЗИРОВАННЫХ КАРБАНИОНОВ И РОДСТВЕННЫХ НУКЛЕОФИЛОВ
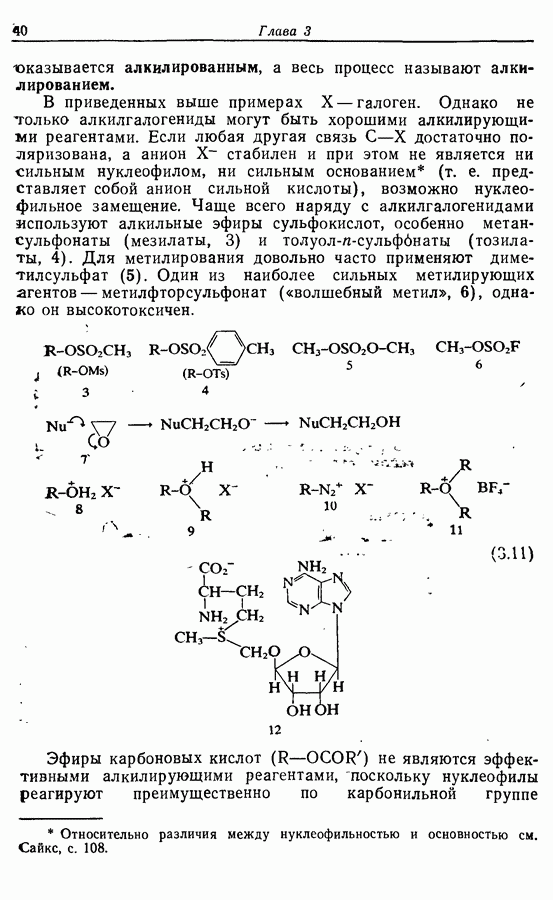
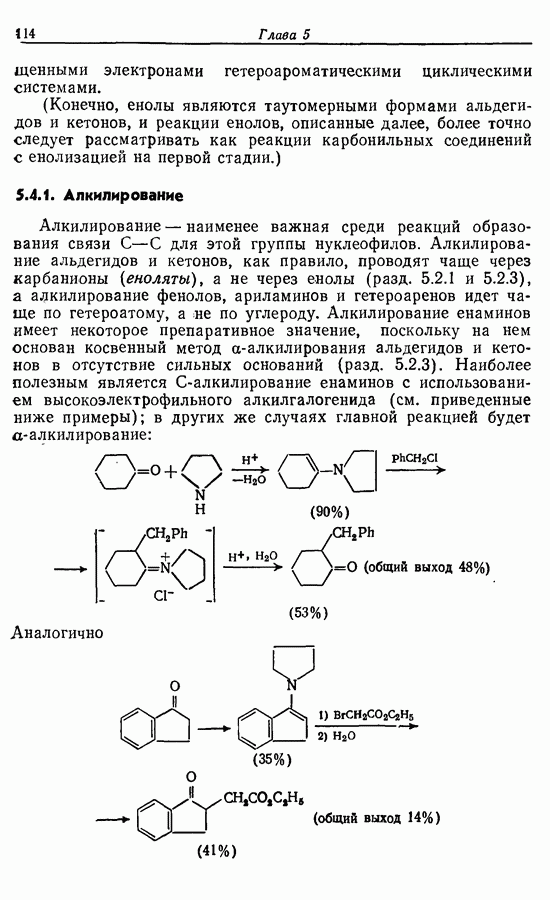
- 5.1.1. Алкилирование
- 5.1.2. Гидролиз алкинированных продуктов: путь к карбоновым кислотам и кетонам
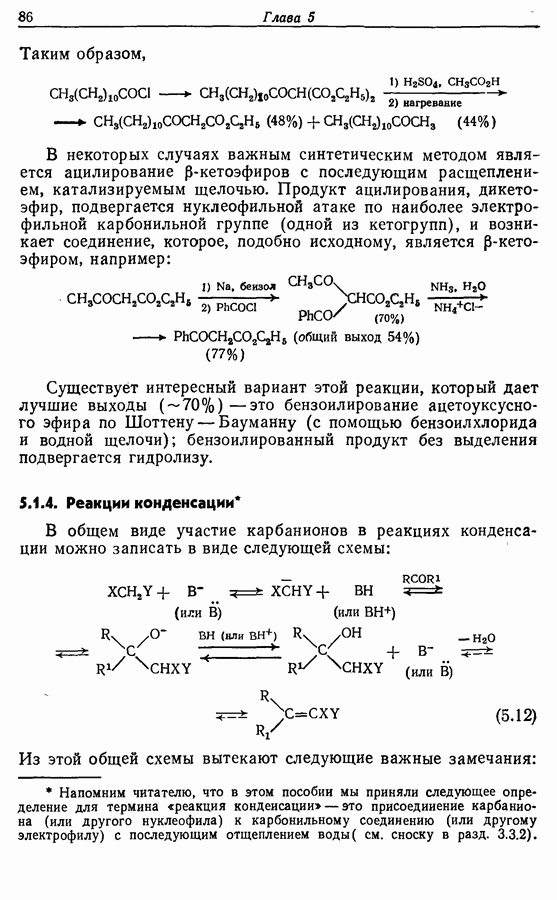
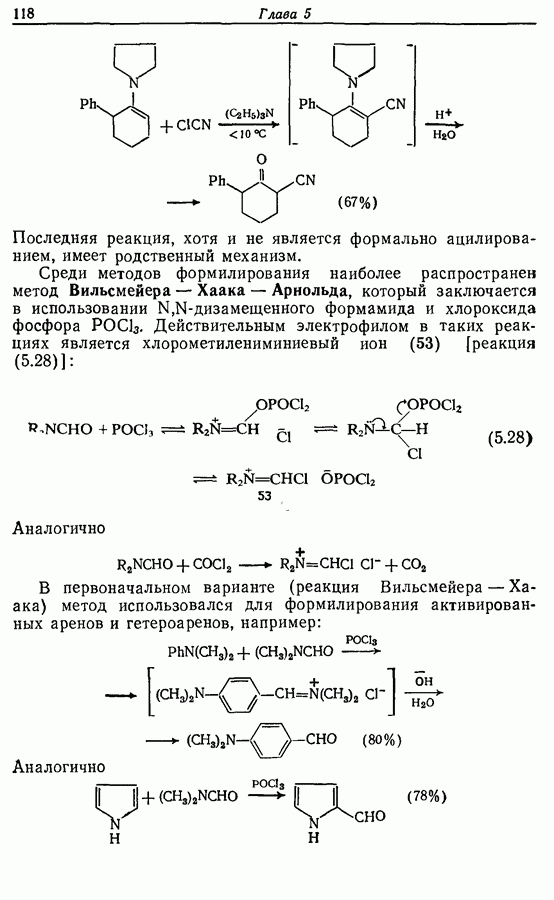
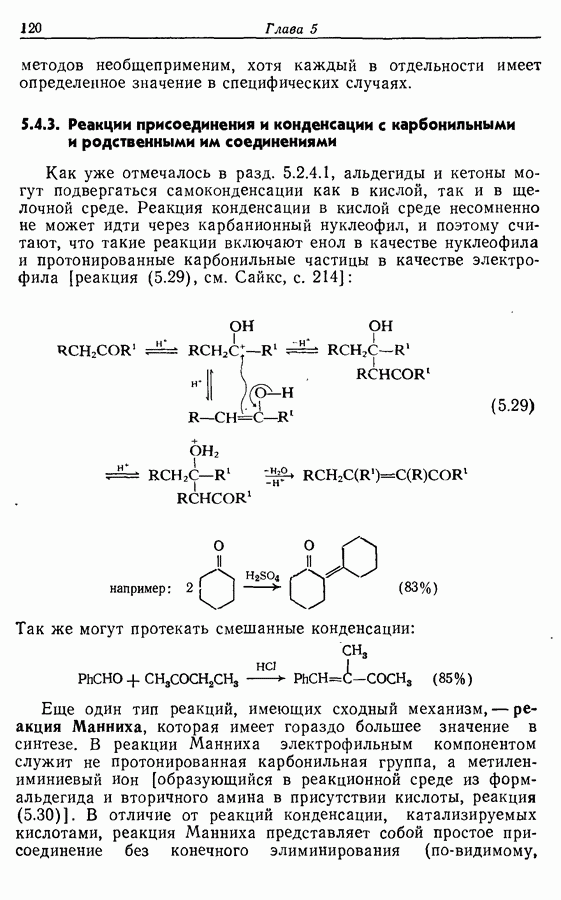
- 5.1.3. Ацилирование
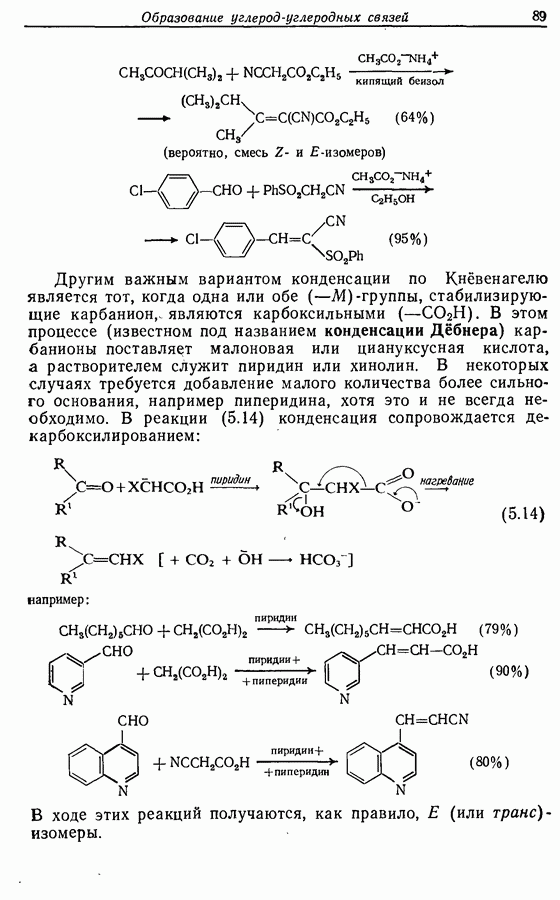
- 5.1.4. Реакции конденсации
- 5.1.5. Реакции с соединениями типа … и родственными системами: реакция Михаэля
- 5.2. Карбанионы, стабилизированные одной (-М)-группой
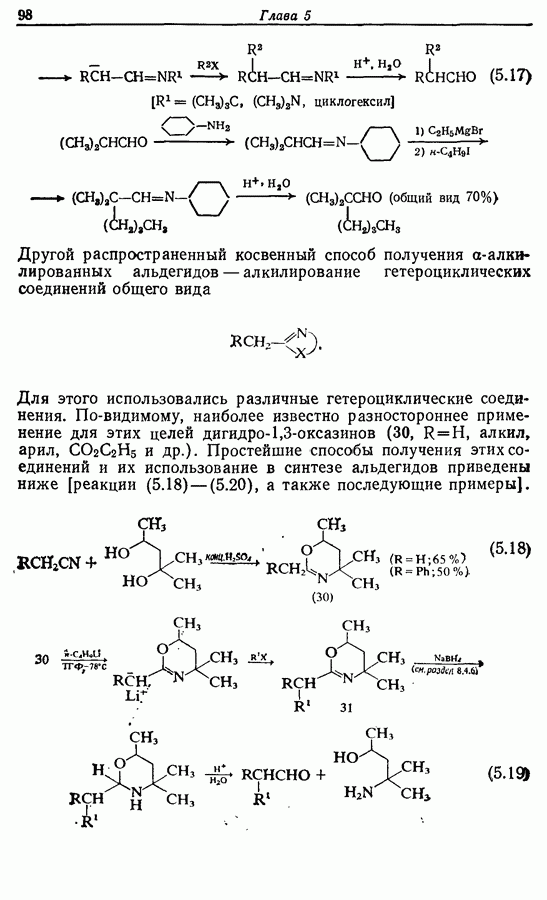
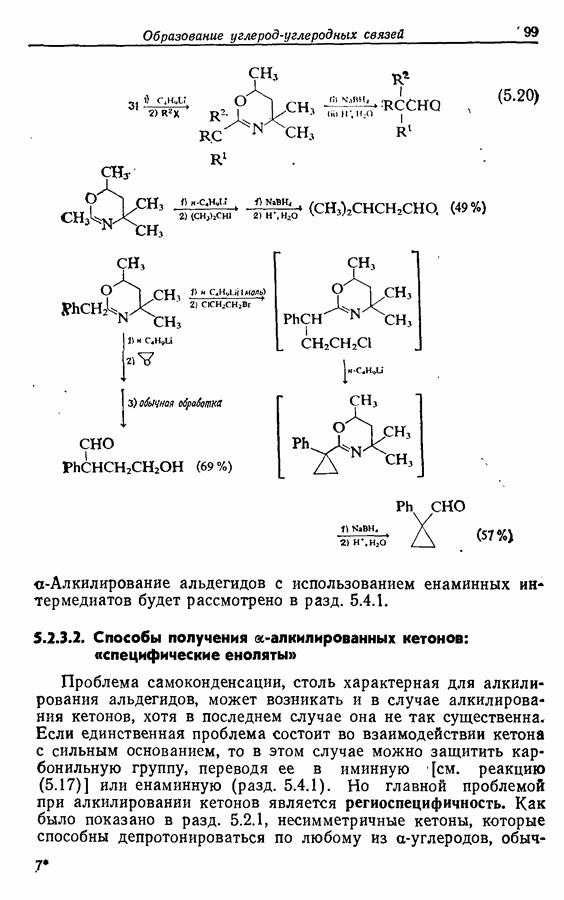
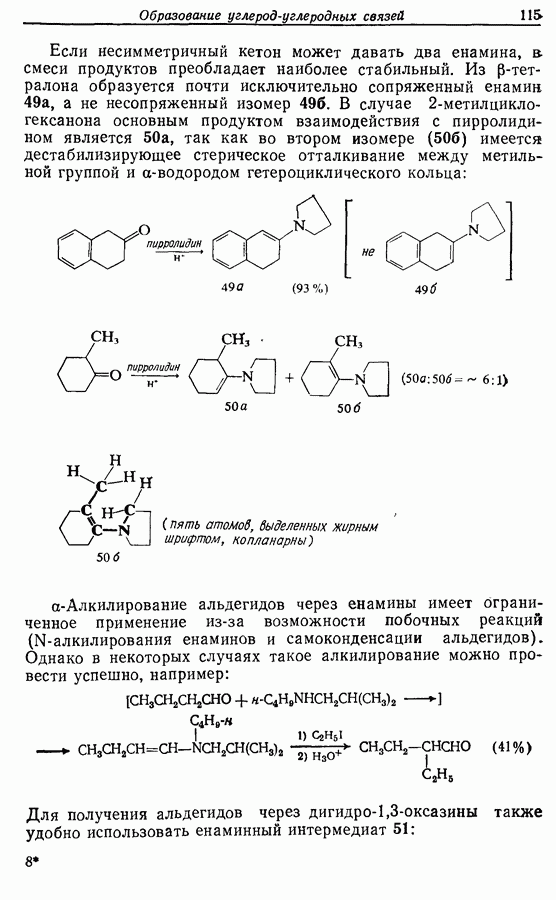
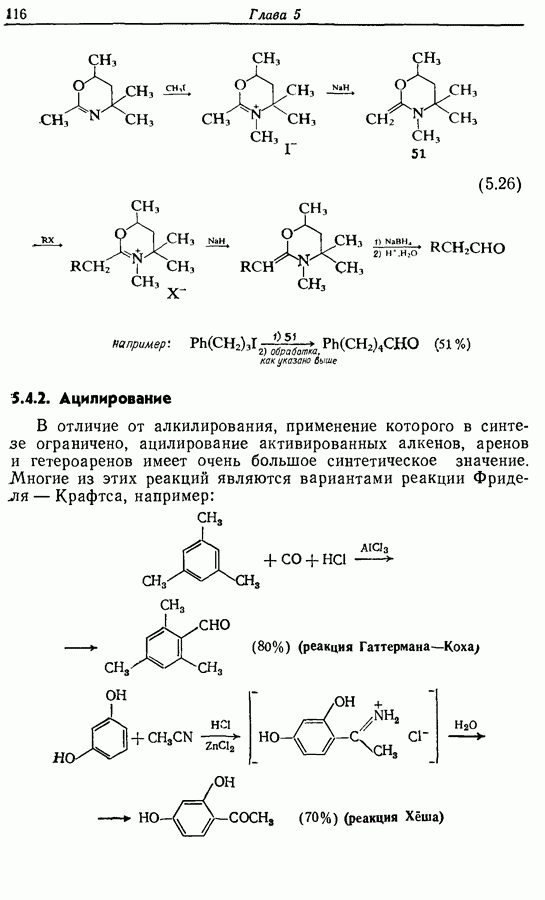
- 5.2.3. Косвенные пути получения a-алкилированных альдегидов и кетонов
- 5.2.4. Реакции конденсации
- 5.2.5. Реакция Михаэля
- 5.3. Карбанионы, стабилизированные соседними атомами фосфора или серы
- 5.3.2. Карбанионы, стабилизированные двумя атомами серы
- 5.4. Алкены, арены и гетероарены как нуклеофилы
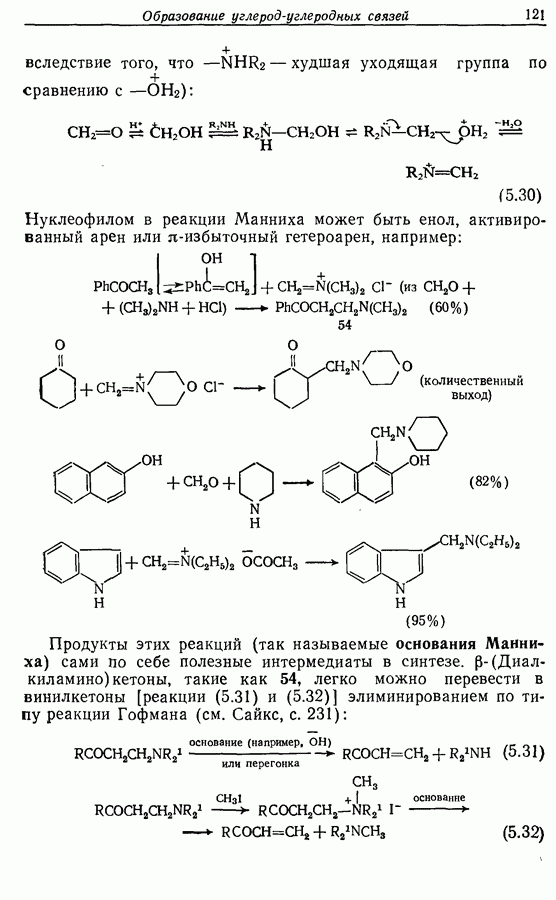
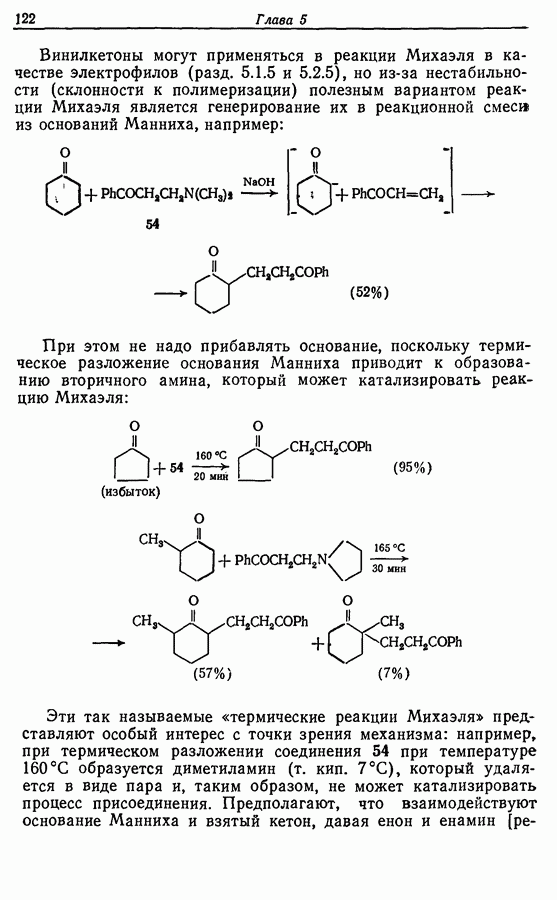
- 5.4.3. Реакции присоединения и конденсации с карбонильными и родственными им соединениями
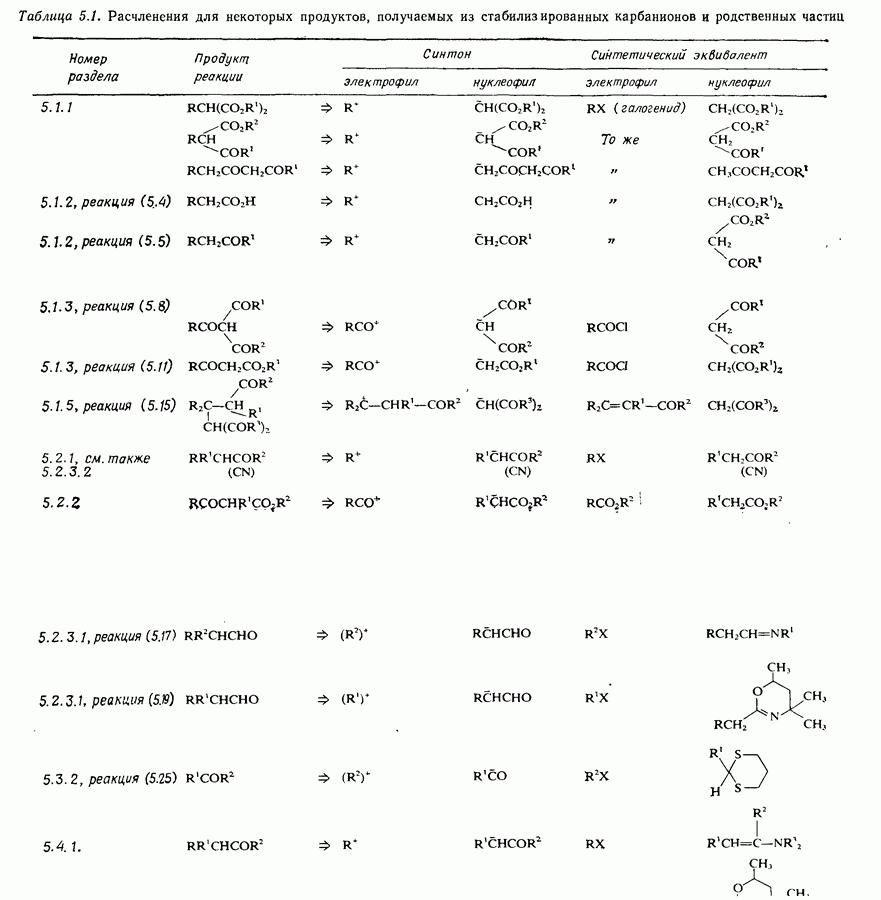
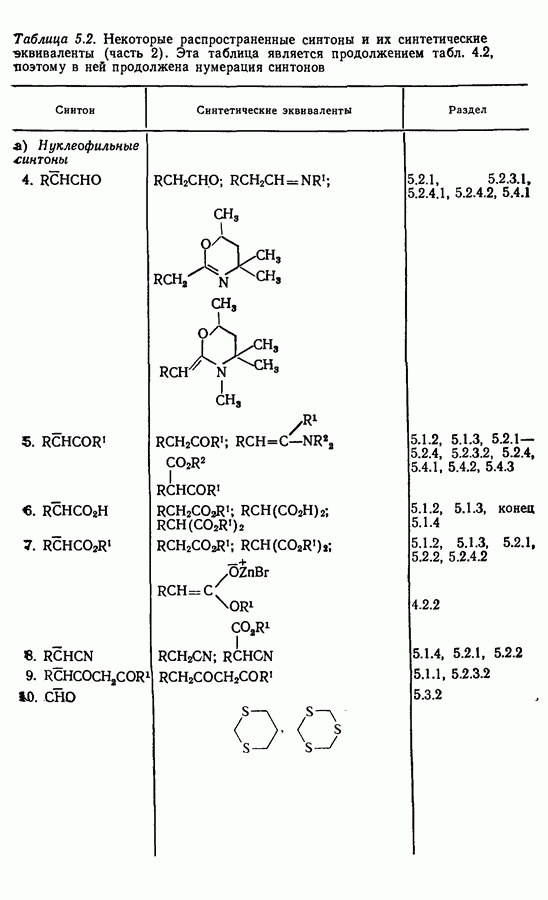
- 5.5. Заключение
- 5.6. Задачи
- 6. ОБРАЗОВАНИЕ СВЯЗЕЙ УГЛЕРОДА С ГЕТЕРОАТОМОМ: ОСНОВНЫЕ ПРИНЦИПЫ
- 6.1. Связи углерод — галоген
- 6.2. Связи углерод — кислород и углерод — сера
- 6.3. Связи углерод — азот
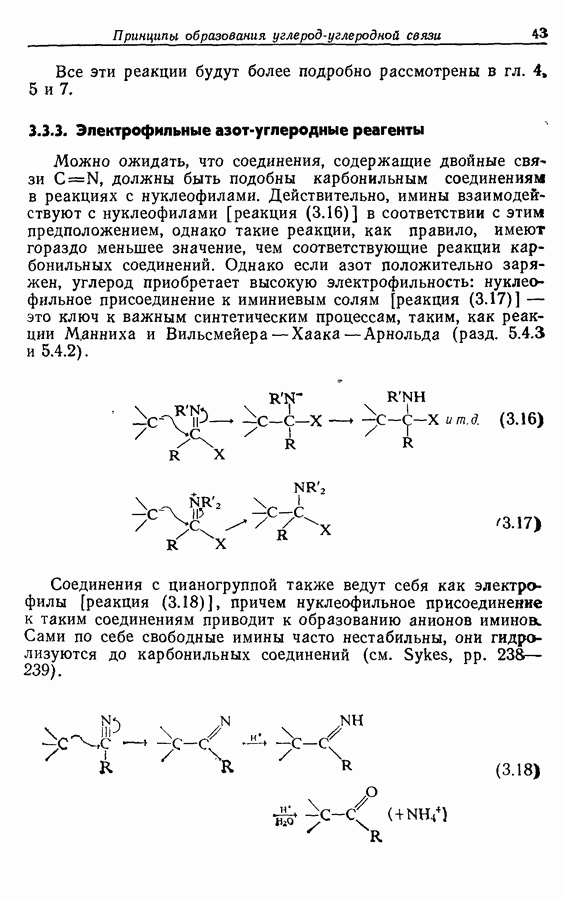
- 6.3.2. Электрофильный азот и нуклеофильный углерод
- 6.3.3. Нитрозосоединения, включая нитриты
- 7. ОБРАЗОВАНИЕ И РАСКРЫТИЕ ЦИКЛОВ
- 7.1. Внутримолекулярная циклизация в результате электрофильно-нуклеофильного взаимодействия
- 7.1.2. Условия внутримолекулярного циклообразования. Правила Болдуина
- 7.1.3. Присоединение по Михаэлю в процессах циклизации
- 7.1.4. Образование ароматических и гетероароматических циклов
- 7.2. Циклоприсоединение
- 7.2.2. 1,3-Диполярное циклоприсоединение
- 7.2.3. Присоединение карбенов и нитренов к алкенам
- 7.3. Электроциклическое циклообразование
- 7.4. Раскрытие цикла
- 7.5. Выводы и задачи
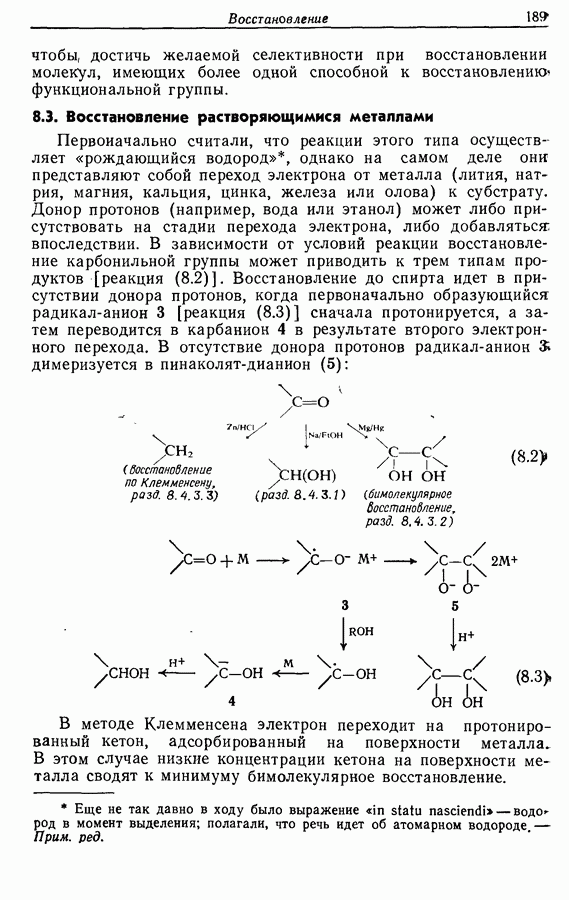
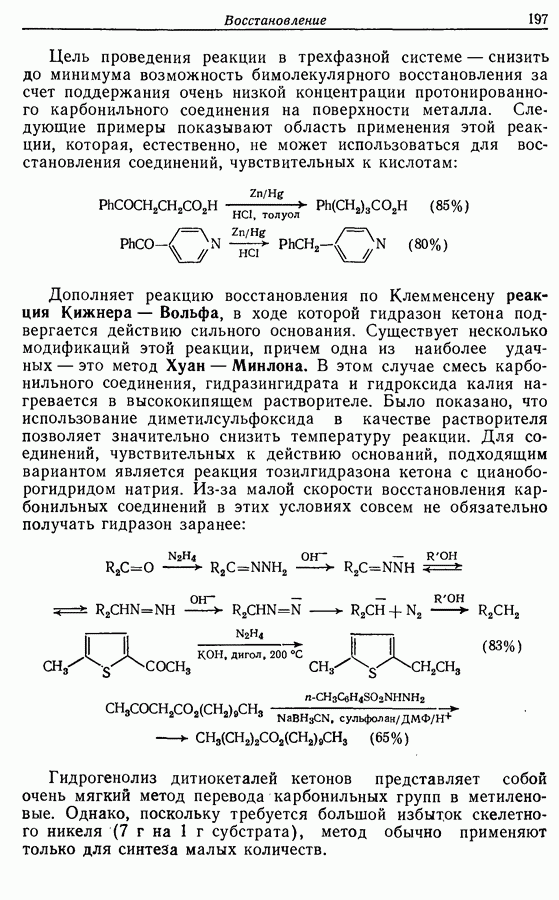
- 8. ВОССТАНОВЛЕНИЕ
- 8.1. Каталитическое гидрирование
- 8.2. Восстановление гидридами металлов
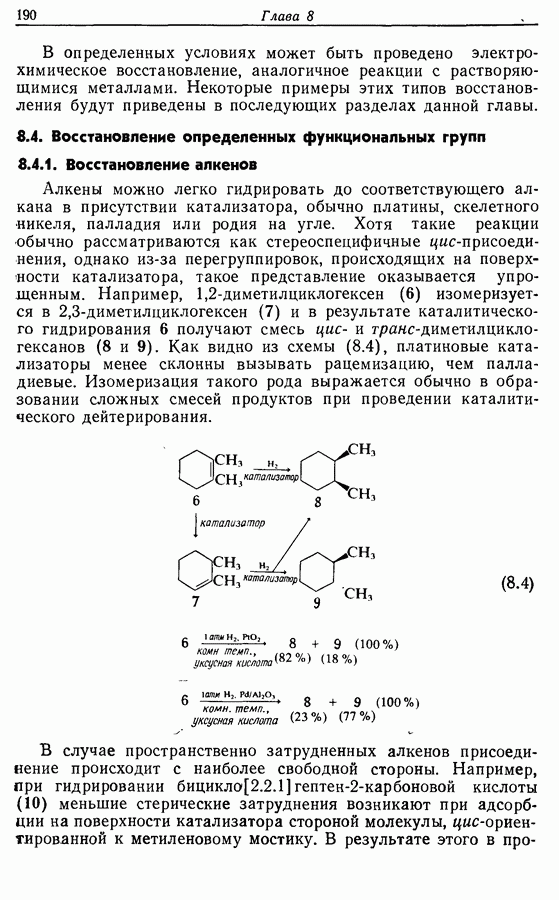
- 8.3. Восстановление растворяющимися металлами
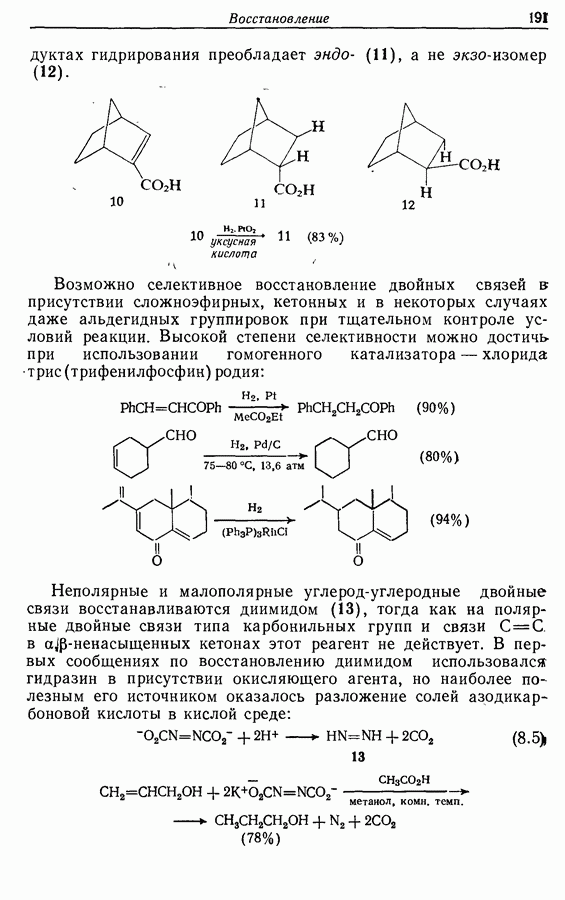
- 8.4. Восстановление определенных функциональных групп
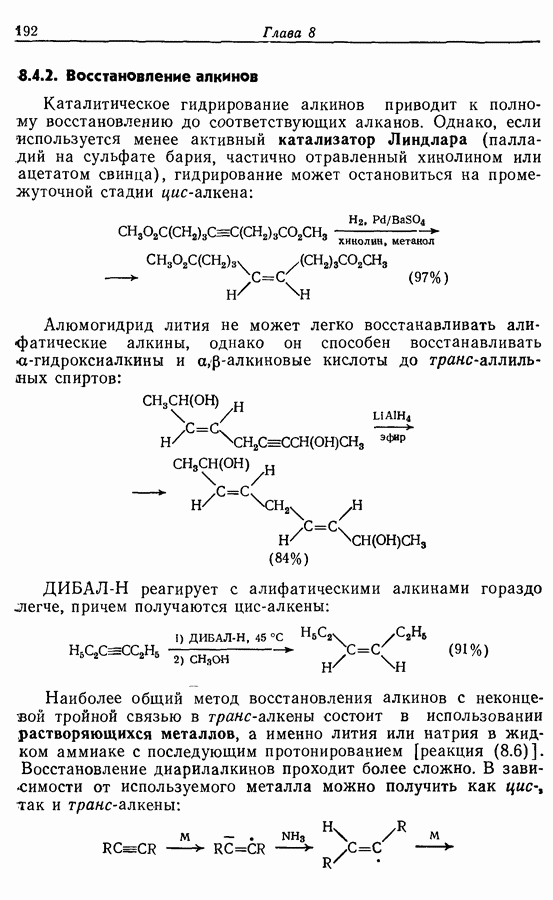
- 8.4.2. Восстановление алкинов
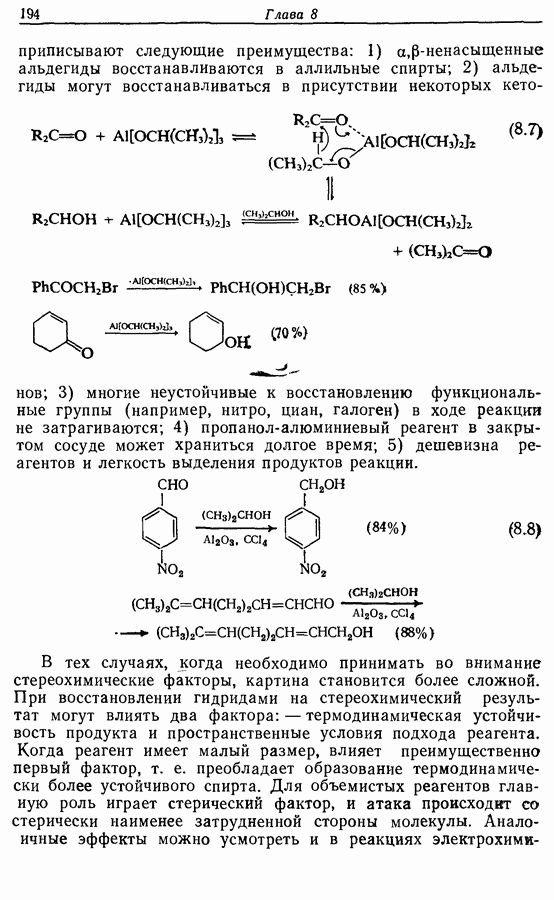
- 8.4.3. Восстановление альдегидов и кетонов
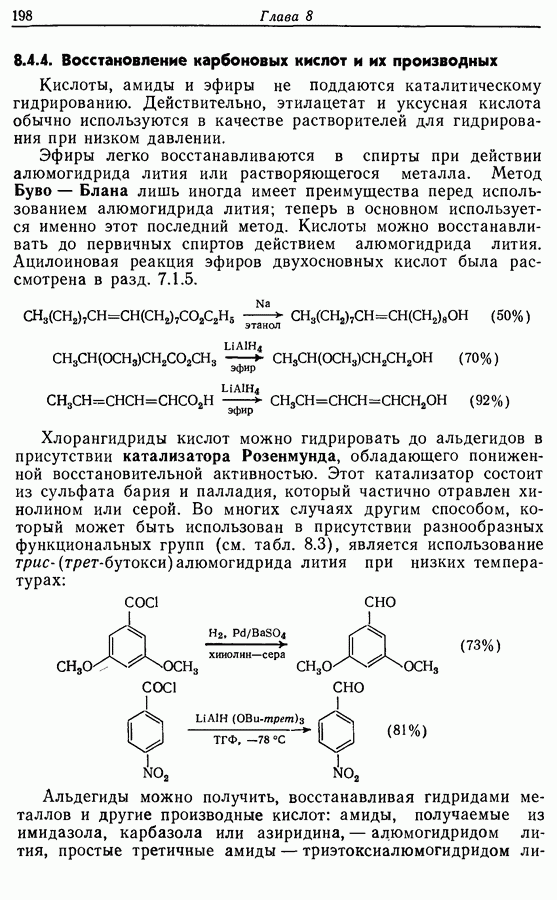
- 8.4.4. Восстановление карбоновых кислот и их производных
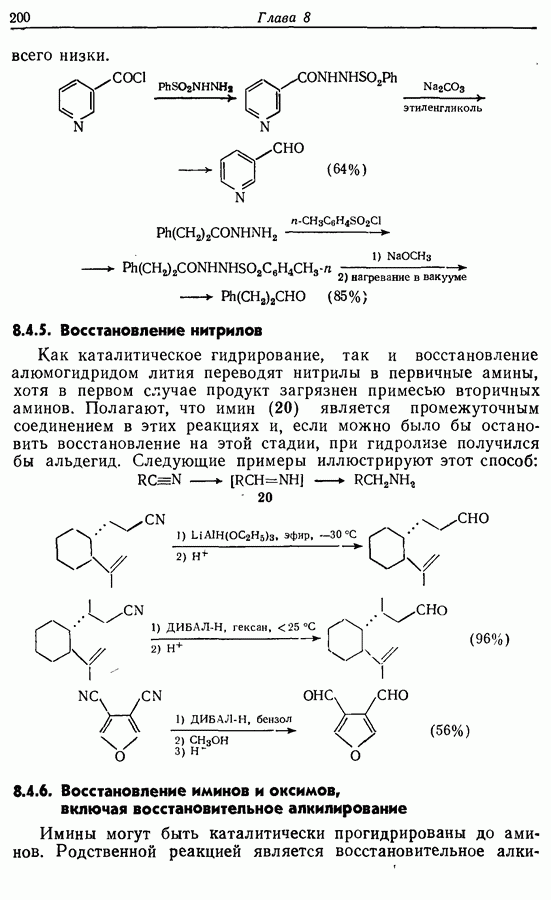
- 8.4.5. Восстановление нитрилов
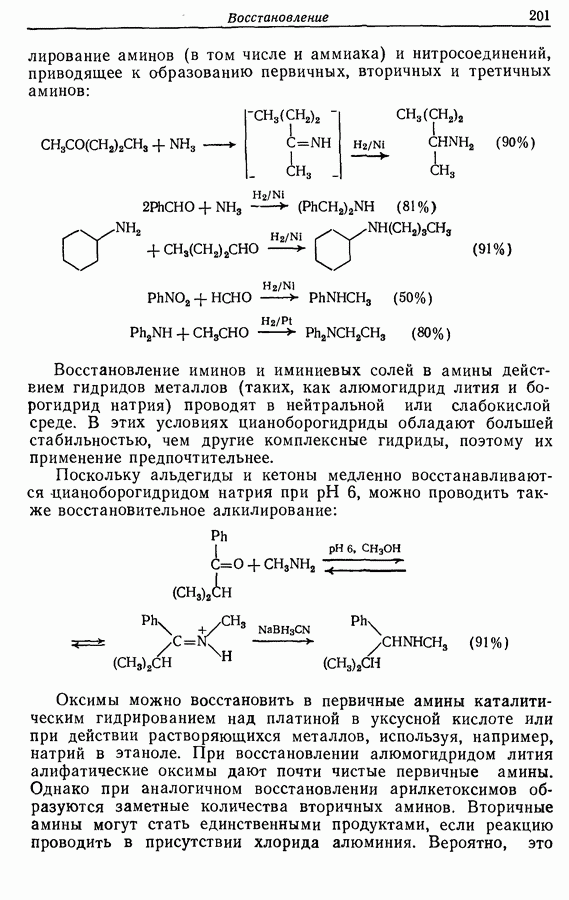
- 8.4.6. Восстановление иминов и оксимов, включая восстановительное алкилирование
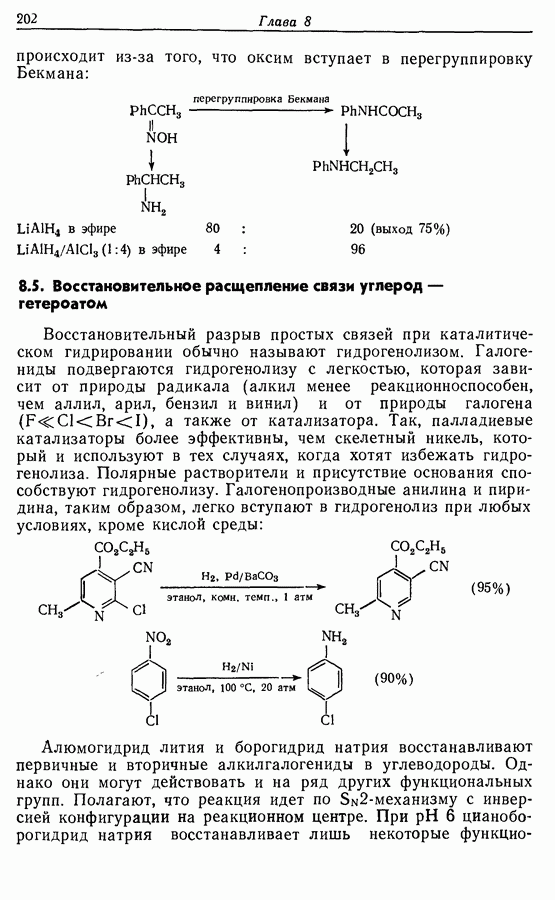
- 8.5. Восстановительное расщепление связи углерод — гетероатом
- 8.6. Восстановительное раскрытие цикла в эпоксидах
- 8.7. Восстановление a,b-ненасыщенных карбонильных соединений
- 8.8. Восстановление сопряженных диенов
- 8.9. Восстановление ароматических и гетероароматических соединений
- 9. ОКИСЛЕНИЕ
- 9.2. Окисление углеводородов
- 9.2.2. Аллильное окисление
- 9.2.3. Бензильное окисление
- 9.2.4. Дегидрирование алканов, алкильных групп и алкенов
- 9.2.5. Окислительное присоединение к алкенам
- 9.2.6. Окислительная деструкция алкенов
- 9.2.7. Окисление алкинов
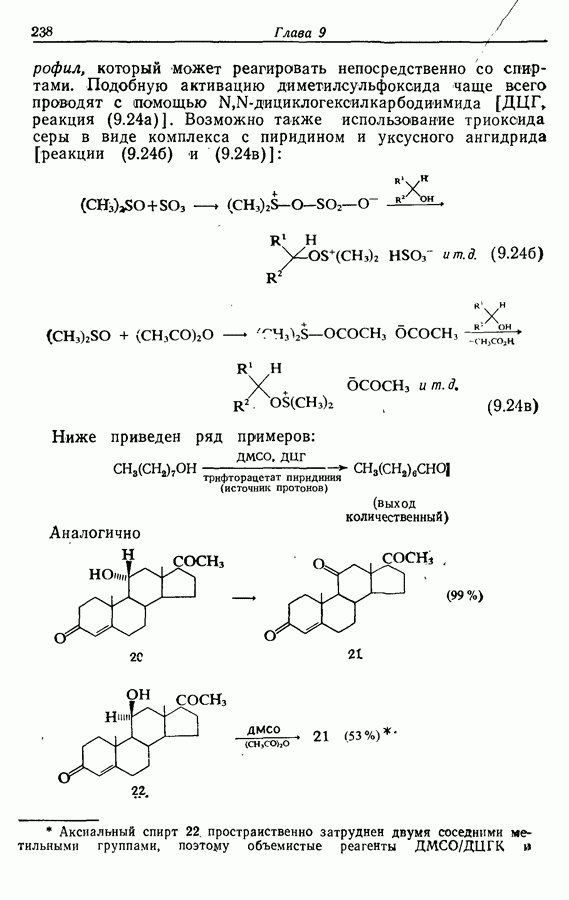
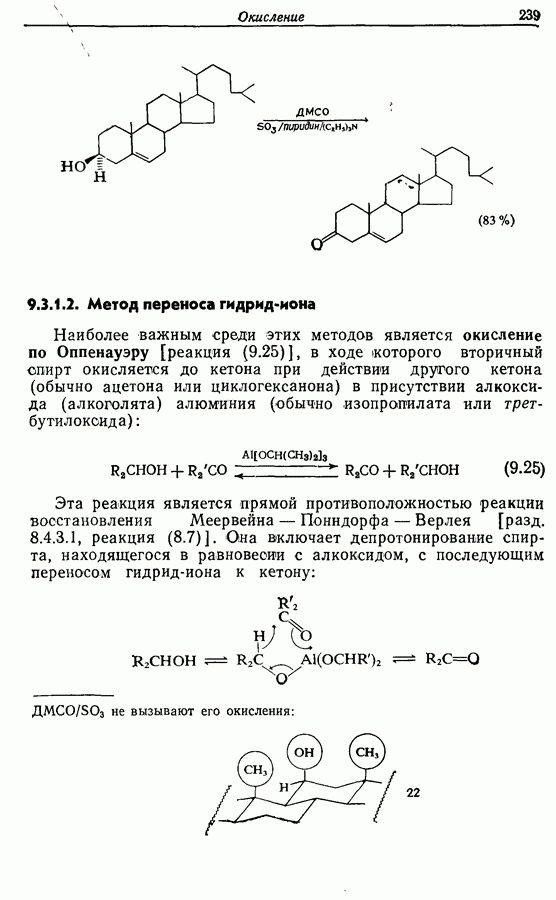
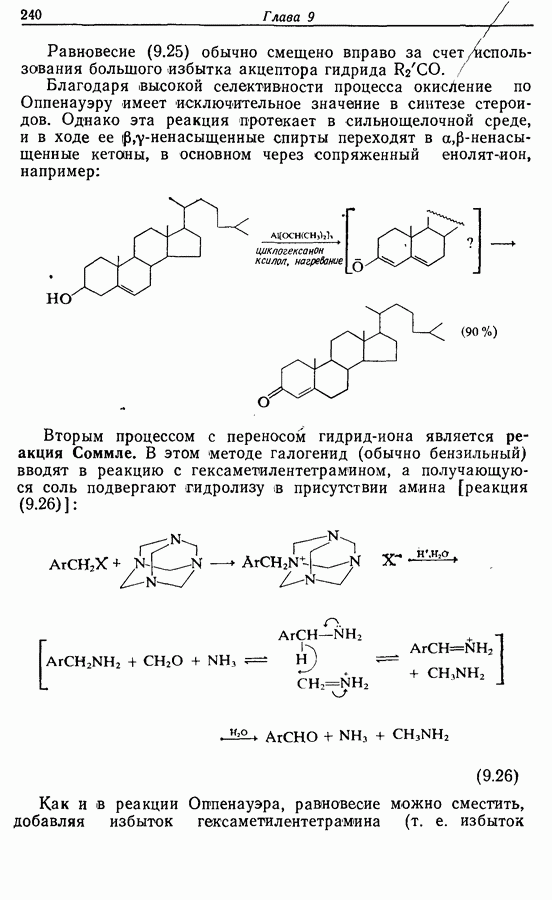
- 9.3. Окисление спиртов и их производных
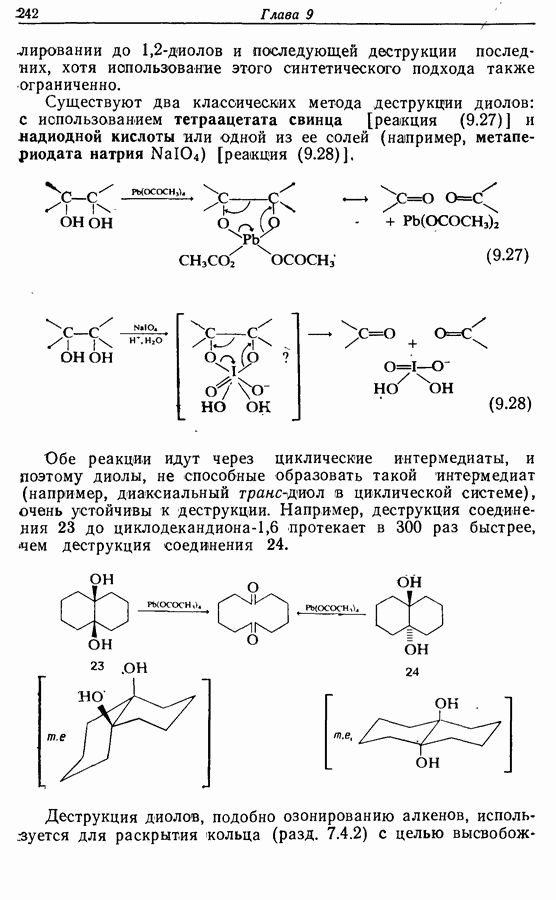
- 9.3.2. Окислительная деструкция 1,2-диолов
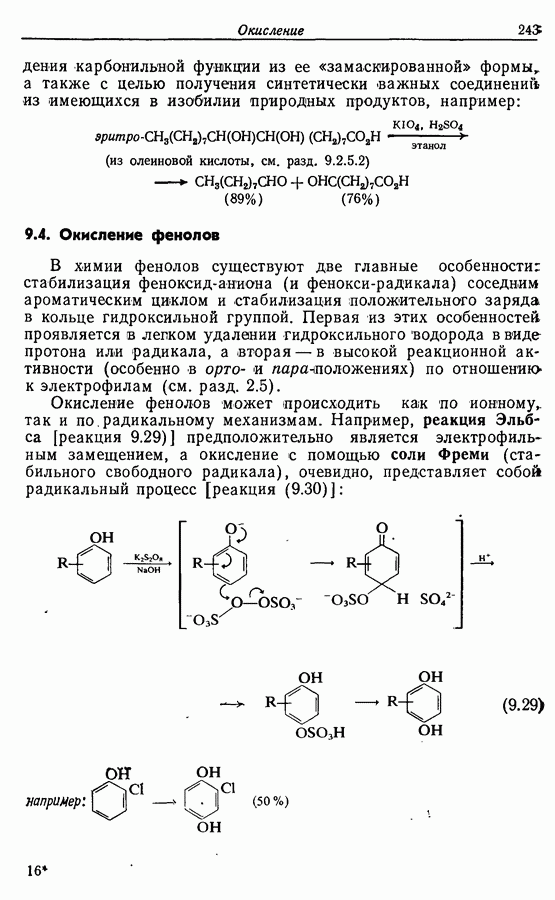
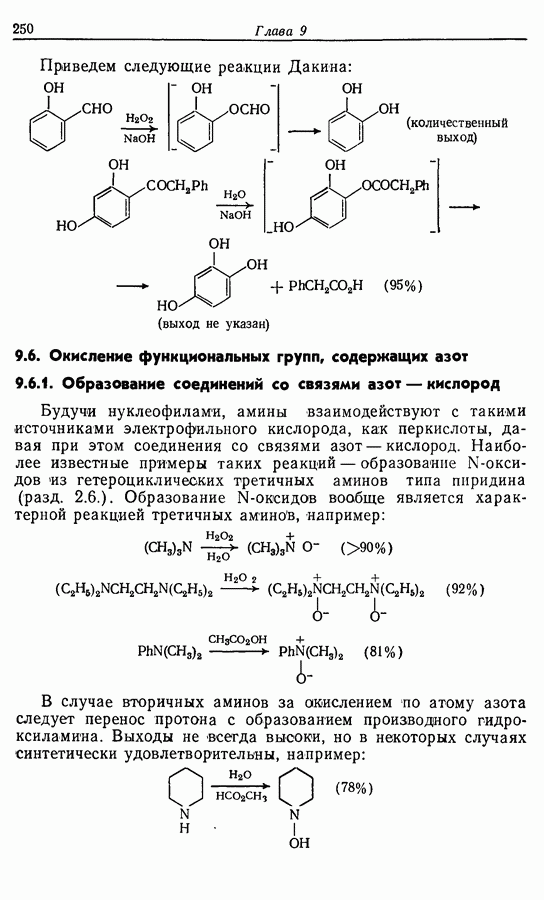
- 9.4. Окисление фенолов
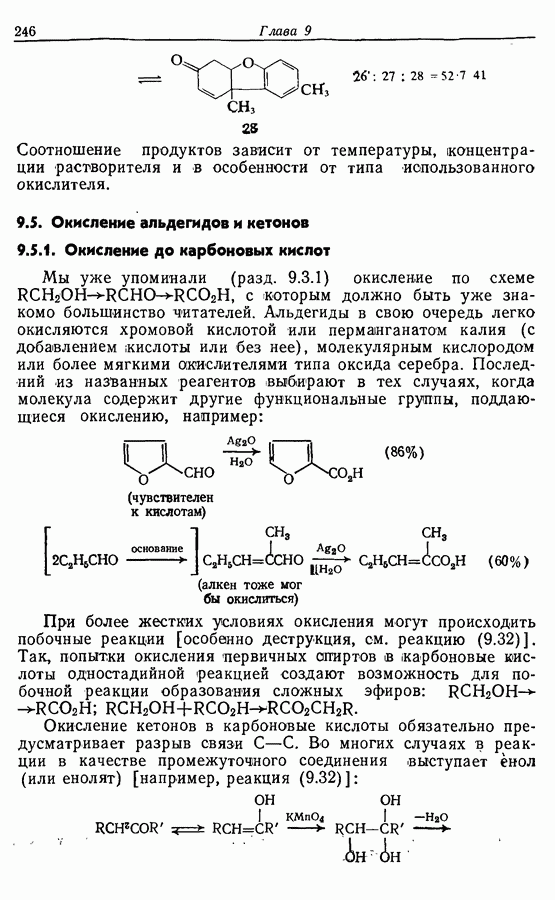
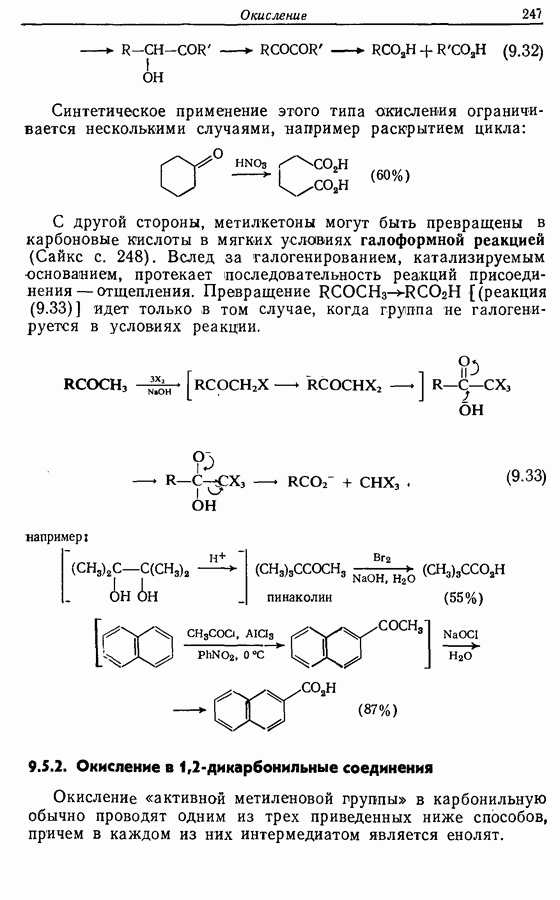
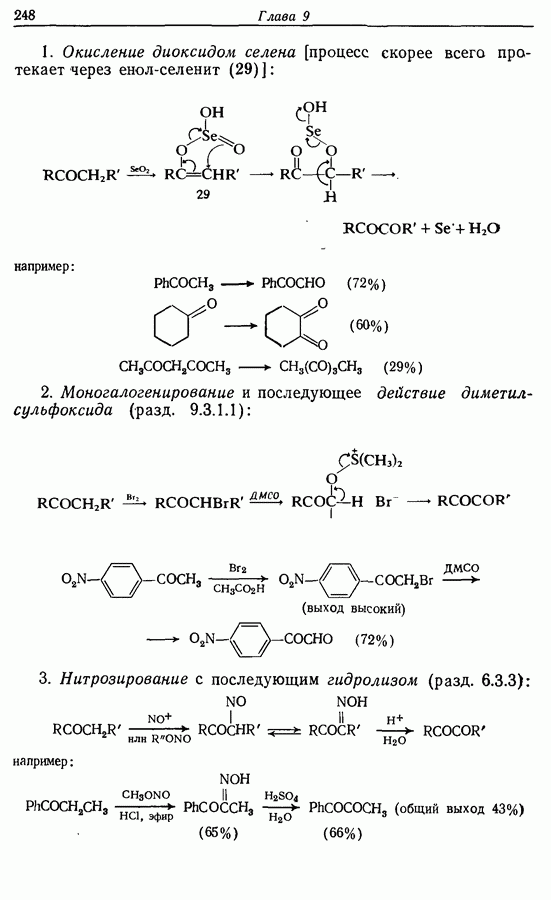
- 9.5. Окисление альдегидов и кетонов
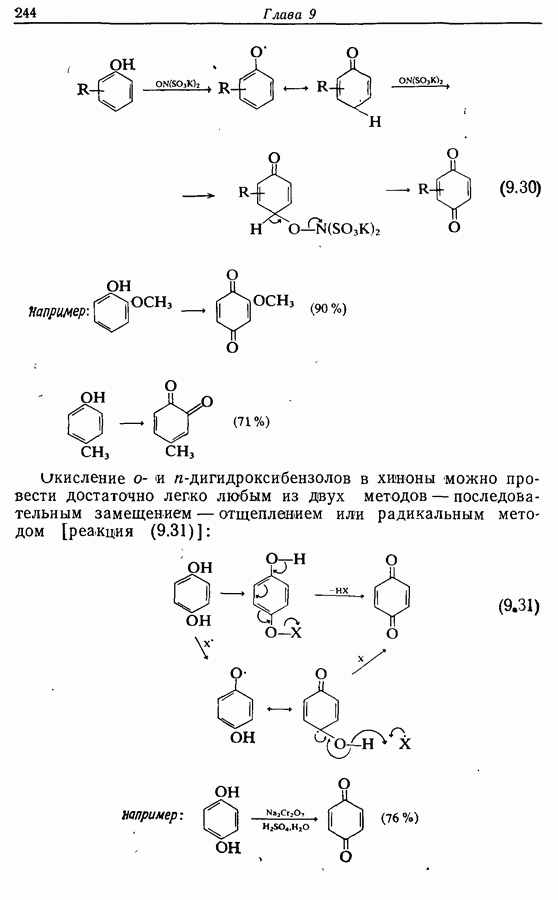
- 9.5.2. Окисление в 1,2-дикарбонильные соединения
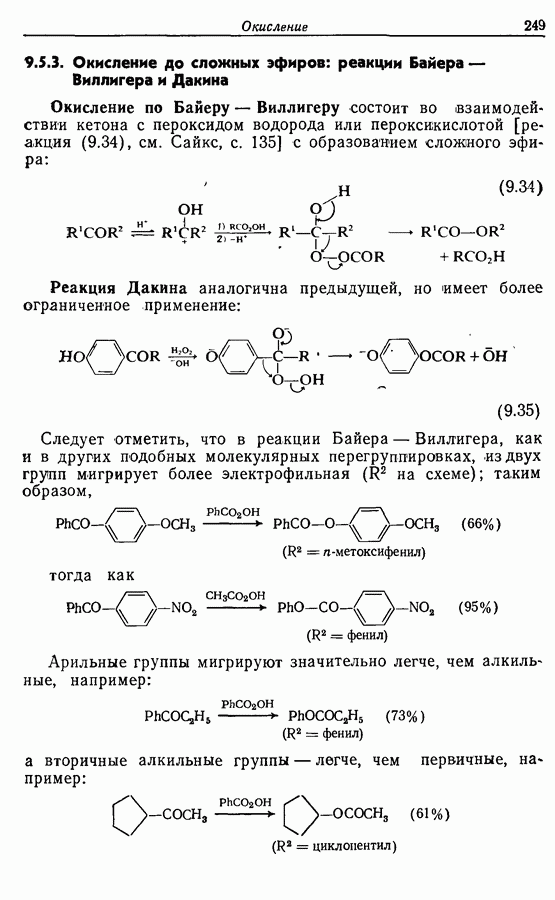
- 9.5.3. Окисление до сложных эфиров: реакции Байера — Виллигера и Дакина
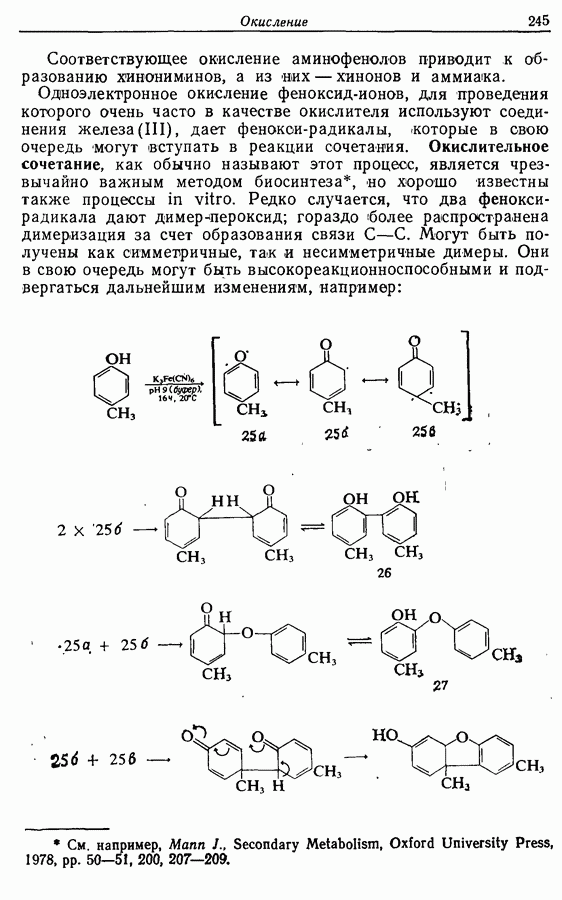
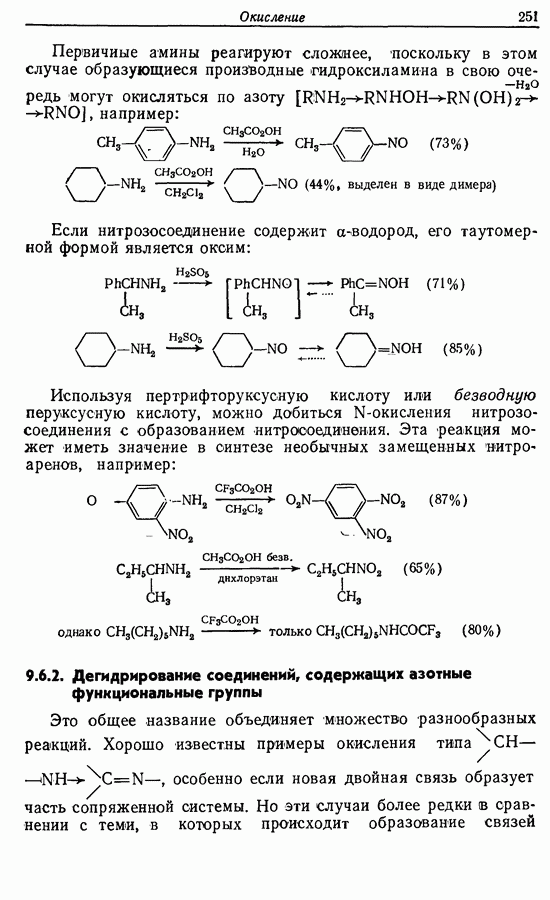
- 9.6. Окисление функциональных групп, содержащих азот
- 9.6.2. Дегидрирование соединений, содержащих азотные функциональные группы
- 9.7. Окисление серусодержащих функциональных групп
- 10. ЗАЩИТНЫЕ ГРУППЫ
- 10.2. Защита спиртов
- 10.3. Защита диолов
- 10.4. Защита карбоновых кислот
- 10.5. Защита аминогрупп
- 10.6. Защита карбонильных групп
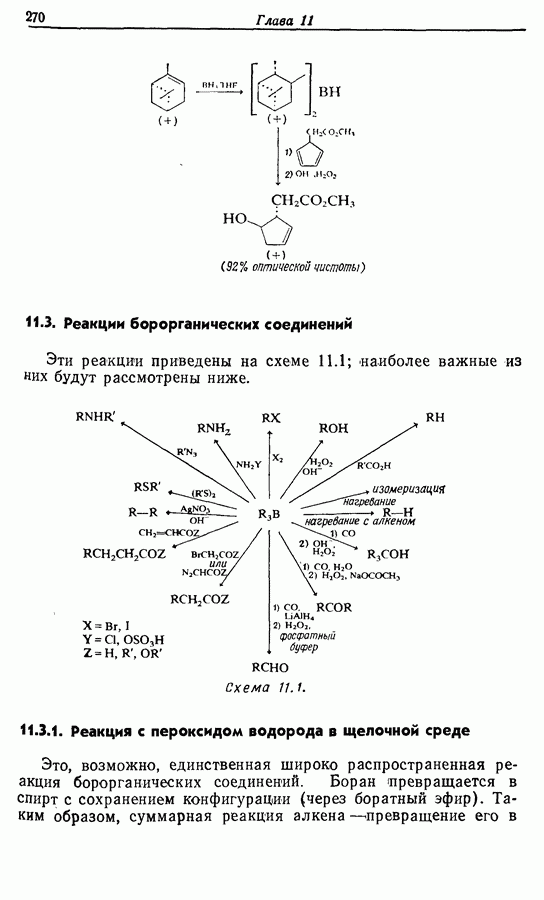
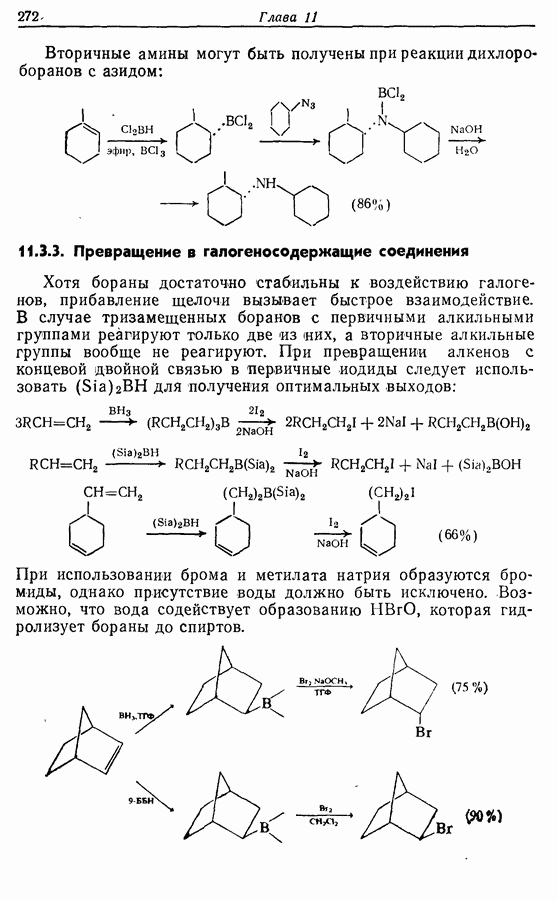
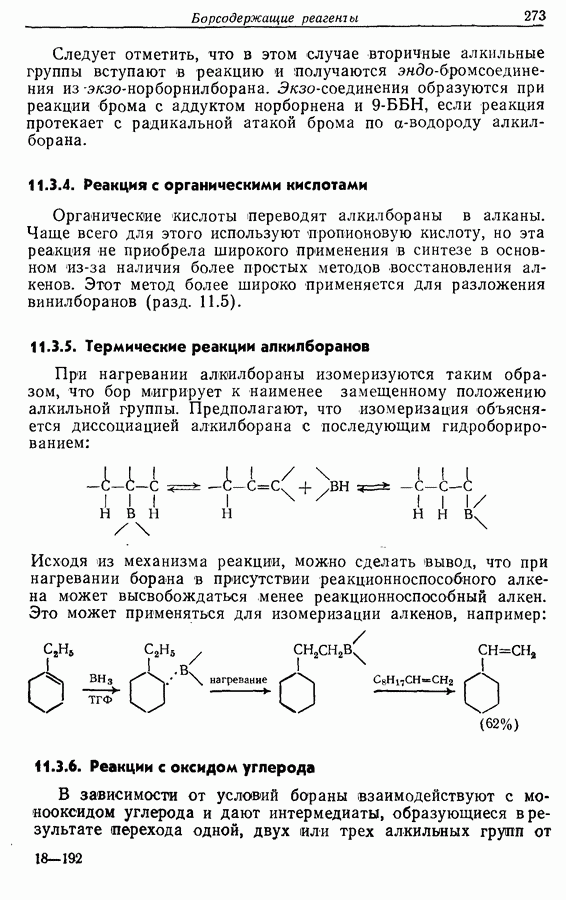
- 11. БОРСОДЕРЖАЩИЕ РЕАГЕНТЫ
- 11.1. Гидроборирование алкенов при действии борана
- 11.2. Гидроборирование алкенов действием алкилборанов
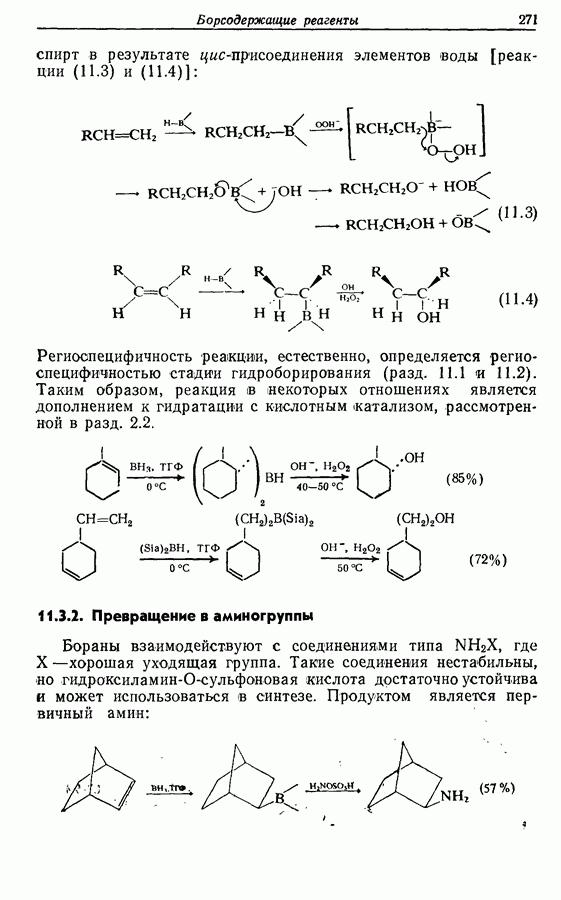
- 11.3. Реакции борорганических соединений
- 11.4. Гидроборирование диенов
- 11.5. Гидроборирование алкинов
- 12. ФОСФОРСОДЕРЖАЩИЕ РЕАГЕНТЫ
- 12.1. Введение в химию фосфорорганических соединений
- 12.2. Образование углерод-углеродных двойных связей
- 12.3. Превращения функциональных групп
- 12.4. Реакции дезоксигенирования
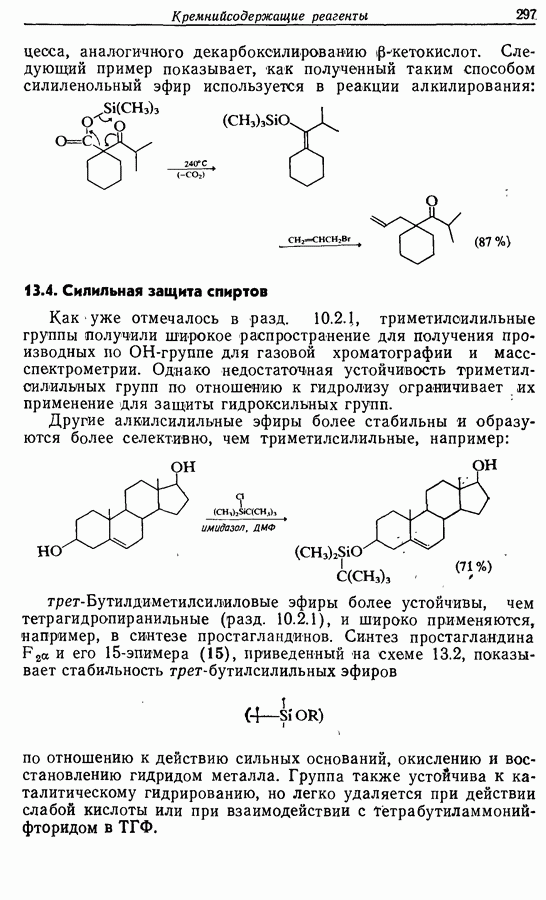
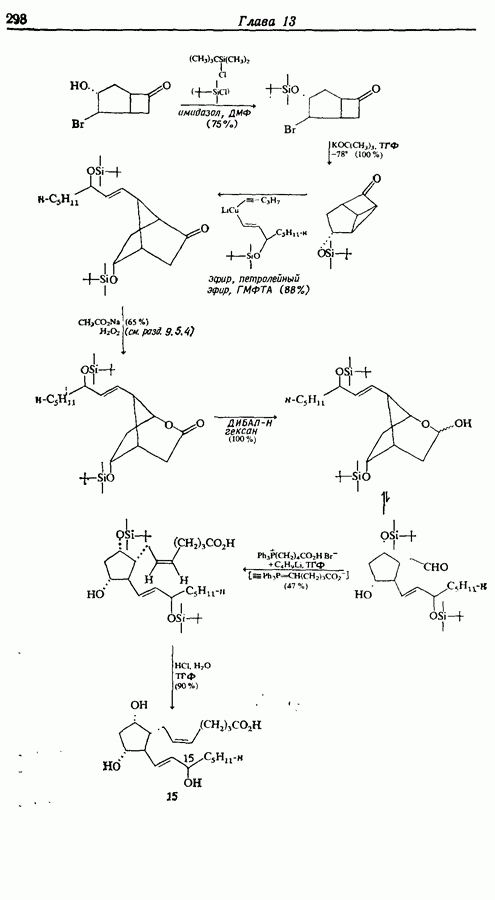
- 13. КРЕМНИЙСОДЕРЖАЩИЕ РЕАГЕНТЫ
- 13.1. Введение в химию кремнийорганических соединений
- 13.2. Синтез кремнийорганических соединений
- 13.3. Реакции с образованием углерод-углеродных связей
- 13.4. Синильная защита спиртов
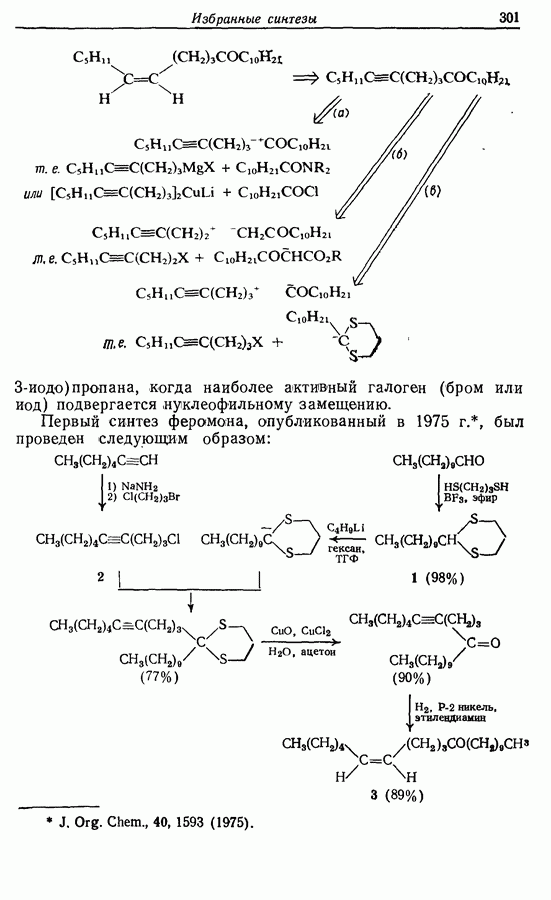
- 14. ИЗБРАННЫЕ СИНТЕЗЫ
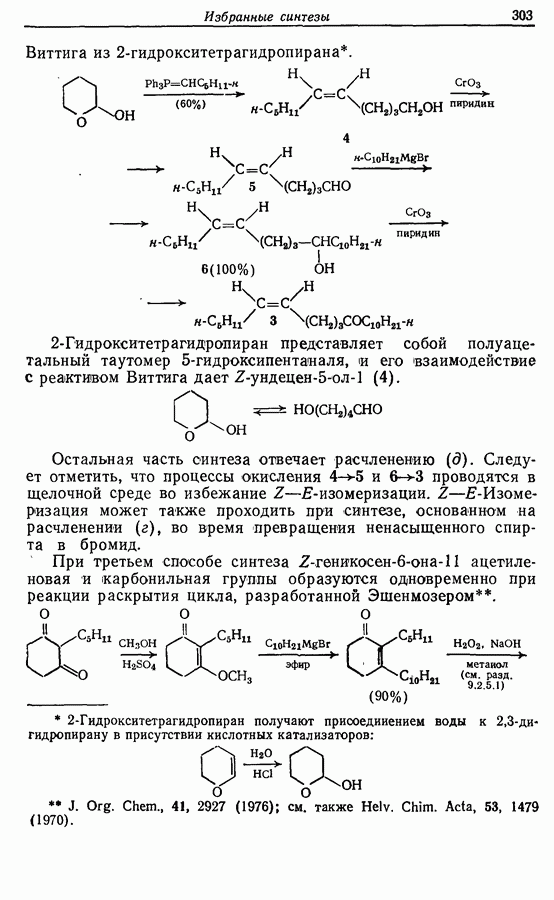
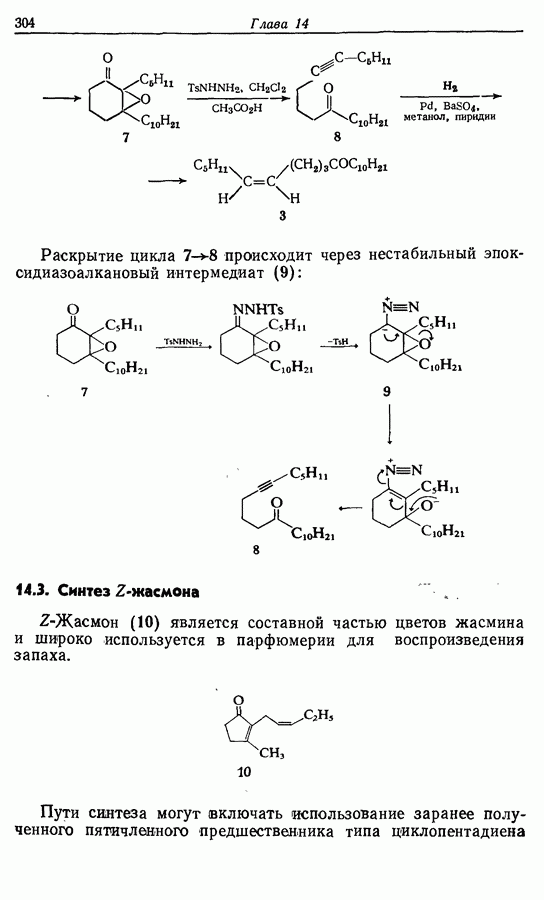
- 14.2. Z-Геникосен-6-он-11
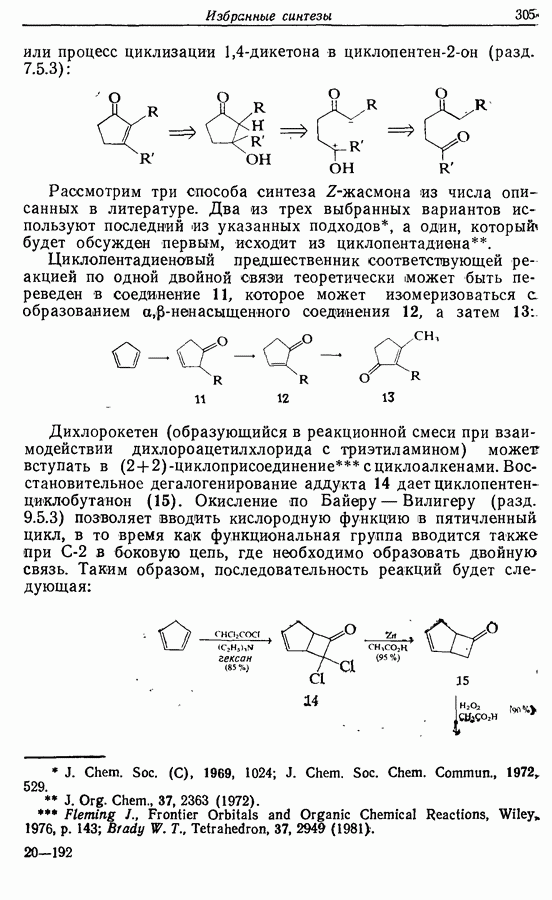
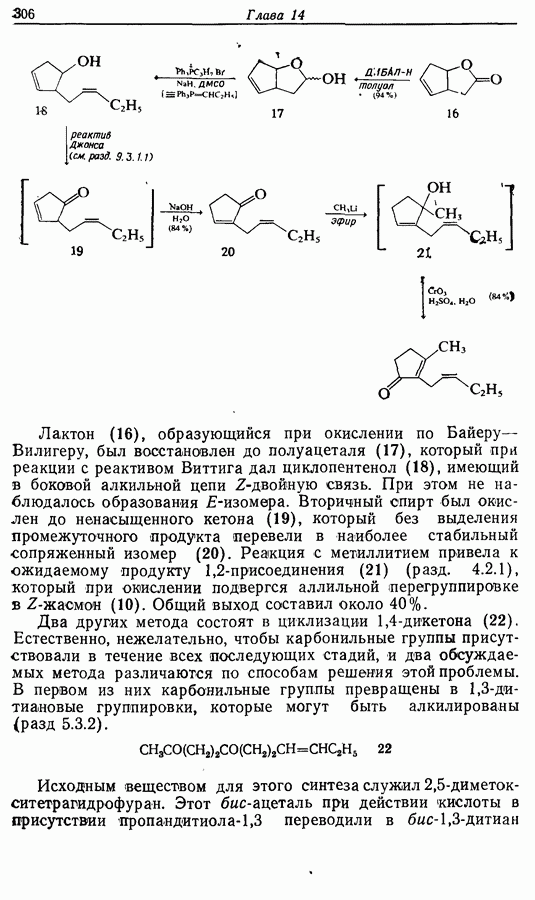
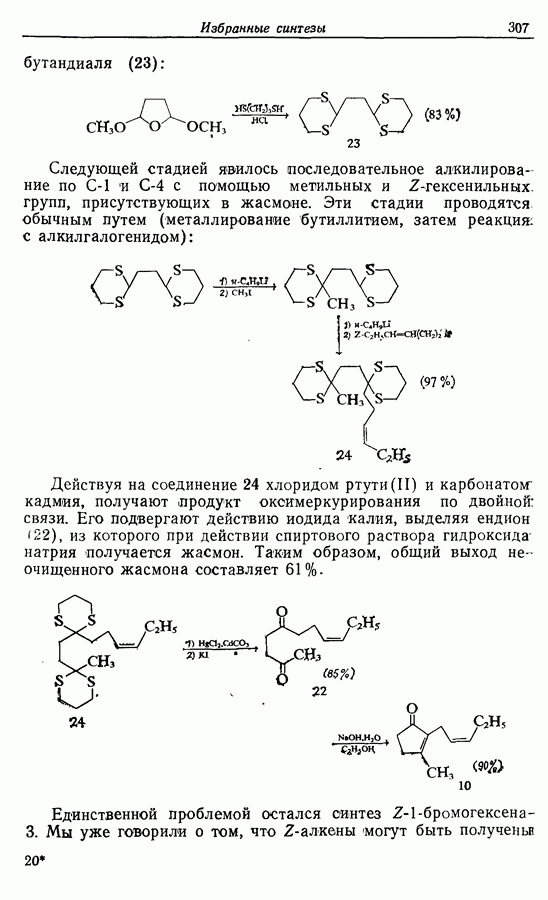
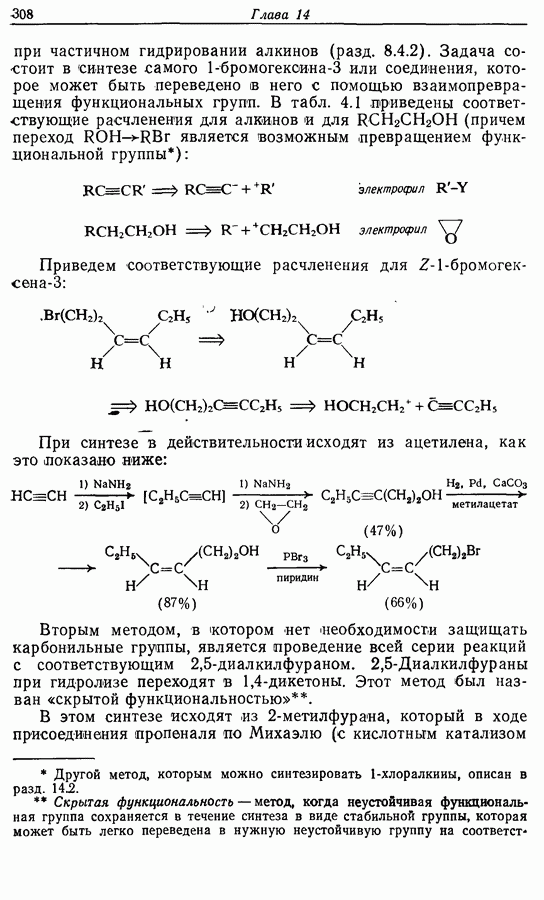
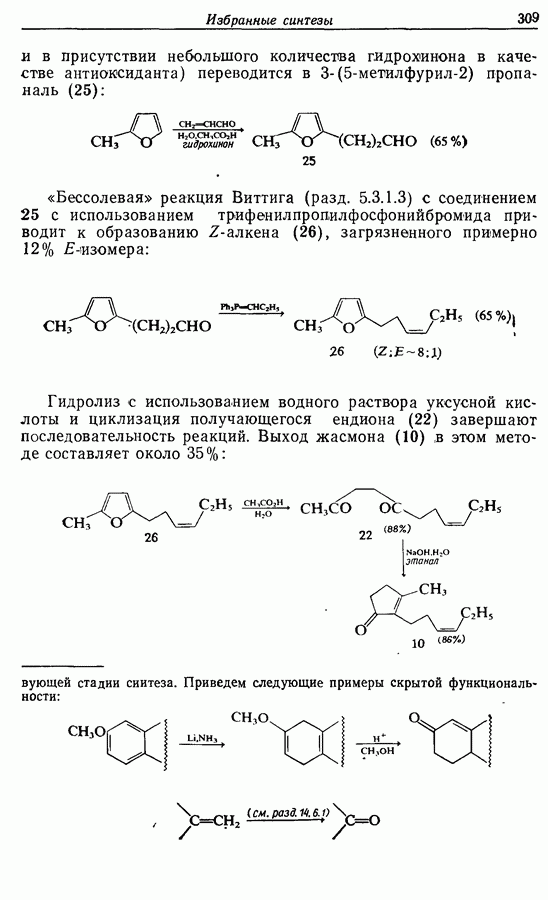
- 14.3. Синтез Z-жасмона
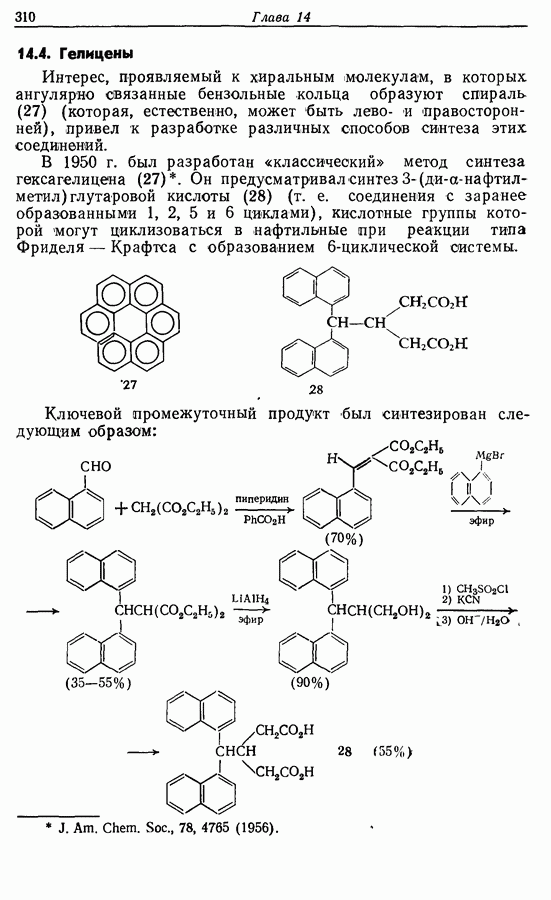
- 14.4. Гелицены
- 14.5. Анулены
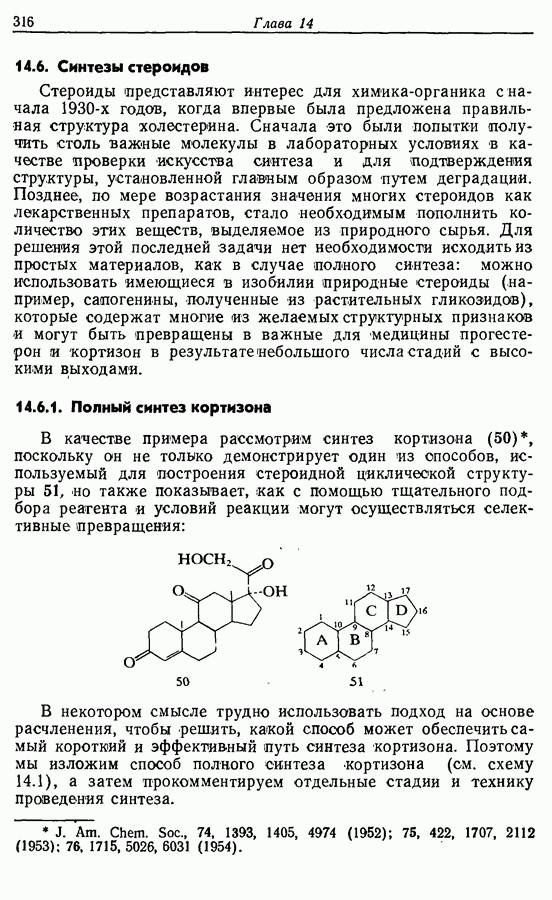
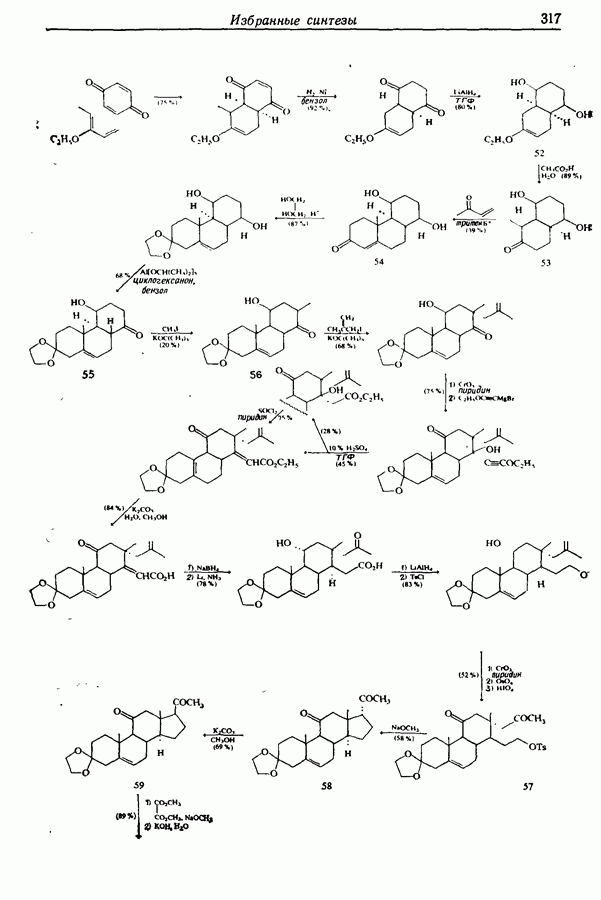
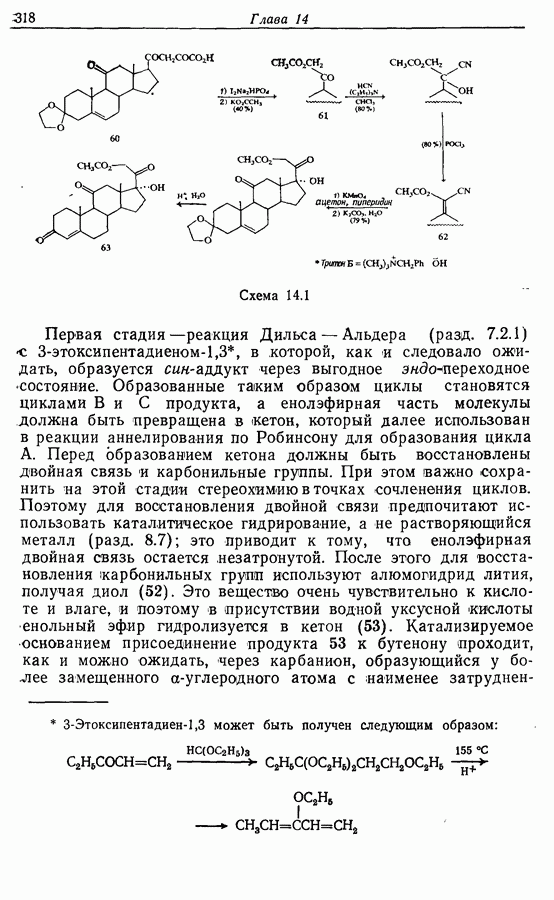
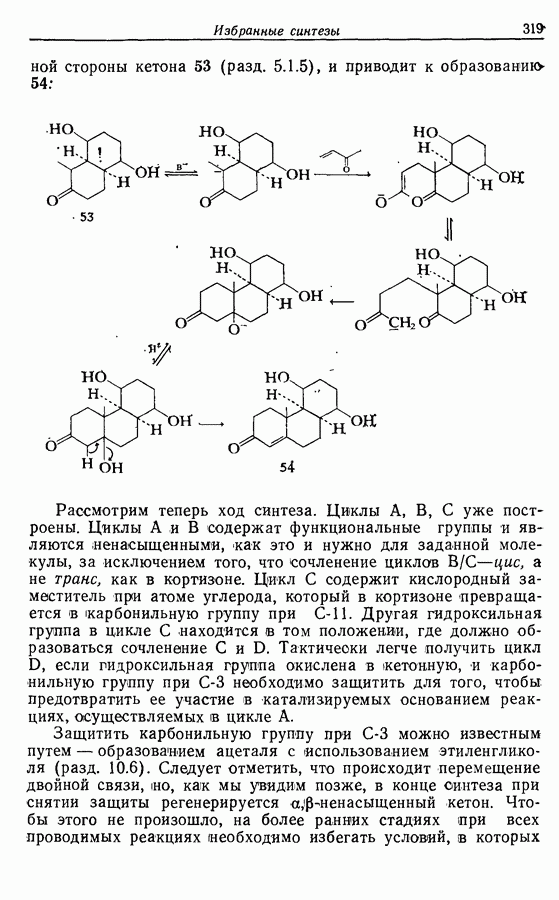
- 14.6. Синтезы стероидов
- 14.6.2. Превращение растительных стероидов в стероидные гормоны
- 14.7. Синтез пептидов
- 14.7.2. Техника синтеза пептидов
- ЛИТЕРАТУРА