| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
Глава V. ВЗАИМНЫЕ ПРЕВРАЩЕНИЯ ЖИДКОСТЕЙ И ГАЗОВ
23. НАСЫЩЕННЫЙ ПАР
Молекулярно-кинетическая теория позволяет не только понять, почему вещество может находиться в газообразном, жидком и твердом состояниях, но и объяснить процесс перехода вещества из одного состояния в другое.
Испарение и конденсация. Количество воды или любой другой жидкости в открытом сосуде постепенно уменьшается. Происходит испарение жидкости, механизм которого был описан в курсе физики VII класса. При хаотическом движении некоторые молекулы приобретают столь большую кинетическую энергию, что покидают жидкость, преодолевая силы притяжения со стороны остальных молекул.
Одновременно с испарением происходит обратный процесс — переход части хаотически движущихся молекул пара в жидкость. Этот процесс называют конденсацией. Если сосуд открытый, то покинувшие жидкость молекулы могут и не возвратиться в
жидкость. В этих случаях испарение не компенсируется конденсацией и количество жидкости уменьшается. Когда поток воздуха над сосудом уносит образовавшиеся пары, жидкость испаряется быстрее, так как у молекулы пара уменьшается возможность вновь вернуться в жидкость.
Насыщенный пар. Если сосуд с жидкостью плотно закрыть, то убыль ее вскоре прекратится. При неизменной температуре система «жидкость — пар» придет в состояние теплового равновесия и будет находиться в нем сколь угодно долго.
В первый момент, после того как жидкость нальют в сосуд и закроют его, она будет испаряться и плотность пара над жидкостью — увеличиваться. Однако одновременно с этим будет расти число молекул, возвращающихся в жидкость. Чем больше плотность пара, тем большее число молекул пара возвращается в жидкость. В результате в закрытом сосуде при постоянной температуре в конце концов установится динамическое (подвижное) равновесие между жидкостью и паром. Число молекул, покидающих поверхность жидкости, будет равно числу молекул пара, возвращающихся за то же время в жидкость. Одновременно с процессом испарения происходит конденсация, и оба процесса в среднем компенсируют друг друга.
Пар, находящийся в динамическом равновесии со своей жидкостью, называют насыщенным паром. Это название подчеркивает, что в данном объеме при данной температуре не может находиться большее количество пара.
Если воздух из сосуда с жидкостью предварительно откачан, то над поверхностью жидкости будет находиться только насыщенный пар.
Давление насыщенного пара. Что будет происходить с насыщенным паром, если уменьшать занимаемый им объем, например сжимать пар, находящийся в равновесии с жидкостью в цилиндре под поршнем, поддерживая температуру содержимого цилиндра постоянной?
При сжатии пара равновесие начнет нарушаться. Плотность пара в первый момент немного увеличивается, и из газа в жидкость начинает переходить большее число молекул, чем из жидкости в газ. Это продолжается до тех пор, пока вновь не установится равновесие и плотность, а значит, и концентрация молекул не примет прежнее значение. Концентрация молекул насыщенного пара, следовательно, не зависит от объема при постоянной температуре.
Так как давление пропорционально концентрации в соответствии с формулой  то из независимости концентрации (или плотности) насыщенных паров от объема следует независимость давления насыщенного пара от занимаемого им объема.
то из независимости концентрации (или плотности) насыщенных паров от объема следует независимость давления насыщенного пара от занимаемого им объема.
Независимое от объема давление пара  при котором жидкость находится в равновесии со своим паром, называют давлением насыщенного пара.
при котором жидкость находится в равновесии со своим паром, называют давлением насыщенного пара.
При сжатии насыщенного пара все большая часть его переходит в жидкое состояние. Жидкость данной массы занимает меньший объем, чем пар той же массы. В результате обьем пара при неизменной его плотности уменьшается.
Мы много раз употребляли слова «газ» и «пар». Никакой принципиальной разницы между газом и паром нет, и эти слова в общем-то равноправны. Но мы привыкли к определенному, относительно небольшому интервалу температуры окружающей среды. Слово «газ» обычно применяют к тем веществам, давление насыщенного пара которых при обычных температурах выше атмосферного (например, углекислый газ). Напротив, о паре говорят тогда, когда при комнатной температуре давление насыщенного пара меньше атмосферного и вещество более устойчиво в жидком состоянии (например, водяной пар).
Независимость давления насыщенного пара от объема установлена на многочисленных экспериментах по изотермическому сжатию пара, находящегося в равновесии со своей жидкостью. Пусть вещество при больших объемах находится в газообразном состоянии. По мере изотермического сжатия плотность и давление его увеличиваются (участок изотермы АВ на рисунке 51). При достижении давления  начинается конденсация пара. В дальнейшем при сжатии насыщенного пара давление не меняется до тех пор, пока весь пар не обратится в жидкость (прямая ВС на рисунке 51). После этого давление при сжатии начинает резко возрастать (отрезок кривой
начинается конденсация пара. В дальнейшем при сжатии насыщенного пара давление не меняется до тех пор, пока весь пар не обратится в жидкость (прямая ВС на рисунке 51). После этого давление при сжатии начинает резко возрастать (отрезок кривой  так как жидкости мало сжимаемы.
так как жидкости мало сжимаемы.
Изображенная на рисунке 51 кривая носит название изотермы реального газа.
| << Предыдущий параграф | Следующий параграф >> |
- ТЕПЛОВЫЕ ЯВЛЕНИЯ. МОЛЕКУЛЯРНАЯ ФИЗИКА
- Глава I. ОСНОВЫ МОЛЕКУЛЯРНО-КИНЕТИЧЕСКОЙ ТЕОРИИ
- 1. ОСНОВНЫЕ ПОЛОЖЕНИЯ МОЛЕКУЛЯРНО-КИНЕТИЧЕСКОЙ ТЕОРИИ. РАЗМЕРЫ МОЛЕКУЛ
- 2. МАССА МОЛЕКУЛ. ПОСТОЯННАЯ АВОГАДРО
- 3. БРОУНОВСКОЕ ДВИЖЕНИЕ.
- 4. СИЛЫ ВЗАИМОДЕЙСТВИЯ МОЛЕКУЛ
- 5. СТРОЕНИЕ ГАЗООБРАЗНЫХ, ЖИДКИХ И ТВЕРДЫХ ТЕЛ
- 6. ИДЕАЛЬНЫЙ ГАЗ В МОЛЕКУЛЯРНО-КИНЕТИЧЕСКОЙ ТЕОРИИ
- 7. ОСНОВНОЕ УРАВНЕНИЕ МОЛЕКУЛЯРНО-КИНЕТИЧЕСКОЙ ТЕОРИИ ГАЗОВ
- ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
- КРАТКИЕ ИТОГИ ГЛАВЫ I
- Глава II. ТЕМПЕРАТУРА. ЭНЕРГИЯ ТЕПЛОВОГО ДВИЖЕНИЯ МОЛЕКУЛ
- 8. ТЕПЛОВОЕ РАВНОВЕСИЕ. ТЕМПЕРАТУРА
- 9. ИЗМЕРЕНИЕ ТЕМПЕРАТУРЫ
- 10. АБСОЛЮТНАЯ ТЕМПЕРАТУРА. ТЕМПЕРАТУРА — МЕРА СРЕДНЕЙ КИНЕТИЧЕСКОЙ ЭНЕРГИИ МОЛЕКУЛ
- 11. ИЗМЕРЕНИЕ СКОРОСТЕЙ МОЛЕКУЛ ГАЗА
- ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
- КРАТКИЕ ИТОГИ ГЛАВЫ II
- Глава III. УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗА. ГАЗОВЫЕ ЗАКОНЫ
- 12. УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗА
- 13. ПРИМЕНЕНИЕ УРАВНЕНИЯ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗА К РАЗЛИЧНЫМ ПРОЦЕССАМ
- 14. ПРИМЕНЕНИЕ ГАЗОВ В ТЕХНИКЕ
- ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
- КРАТКИЕ ИТОГИ ГЛАВЫ III
- Глава IV. ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ
- 16. РАБОТА В ТЕРМОДИНАМИКЕ
- 17. КОЛИЧЕСТВО ТЕПЛОТЫ
- 18. ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ
- 19. ПРИМЕНЕНИЕ ПЕРВОГО ЗАКОНА ТЕРМОДИНАМИКИ К РАЗЛИЧНЫМ ПРОЦЕССАМ
- 20. НЕОБРАТИМОСТЬ ПРОЦЕССОВ В ПРИРОДЕ
- 21. ПРИНЦИПЫ ДЕЙСТВИЯ ТЕПЛОВЫХ ДВИГАТЕЛЕЙ
- 22. КОЭФФИЦИЕНТ ПОЛЕЗНОГО ДЕЙСТВИЯ (КПД) ТЕПЛОВОГО ДВИГАТЕЛЯ. ТЕПЛОВЫЕ ДВИГАТЕЛИ И ОХРАНА ПРИРОДЫ
- ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
- КРАТКИЕ ИТОГИ ГЛАВЫ IV
- Глава V. ВЗАИМНЫЕ ПРЕВРАЩЕНИЯ ЖИДКОСТЕЙ И ГАЗОВ
- 23. НАСЫЩЕННЫЙ ПАР
- 24. ЗАВИСИМОСТЬ ДАВЛЕНИЯ НАСЫЩЕННОГО ПАРА ОТ ТЕМПЕРАТУРЫ. КИПЕНИЕ. КРИТИЧЕСКАЯ ТЕМПЕРАТУРА
- 25. ВЛАЖНОСТЬ ВОЗДУХА
- ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
- КРАТКИЕ ИТОГИ ГЛАВЫ V
- Глава VI. ПОВЕРХНОСТНОЕ НАТЯЖЕНИЕ ЖИДКОСТЕЙ
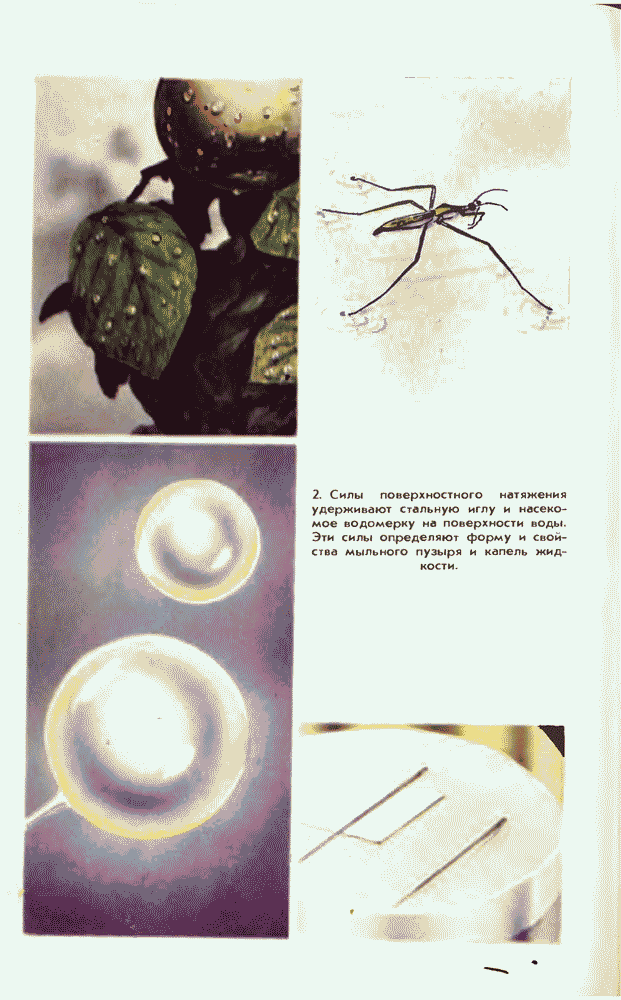
- 27. СИЛА ПОВЕРХНОСТНОГО НАТЯЖЕНИЯ
- 28. КАПИЛЛЯРНЫЕ ЯВЛЕНИЯ
- ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
- КРАТКИЕ ИТОГИ ГЛАВЫ VI
- Глава VII. ТВЕРДЫЕ ТЕЛА
- 29. КРИСТАЛЛИЧЕСКИЕ ТЕЛА
- 30. АМОРФНЫЕ ТЕЛА
- 31. ДЕФОРМАЦИЯ. ВИДЫ ДЕФОРМАЦИИ ТВЕРДЫХ ТЕЛ
- 32. МЕХАНИЧЕСКИЕ СВОЙСТВА ТВЕРДЫХ ТЕЛ. ДИАГРАММА РАСТЯЖЕНИЯ
- 33. ПЛАСТИЧНОСТЬ И ХРУПКОСТЬ
- ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
- КРАТКИЕ ИТОГИ ГЛАВЫ VII
- ОСНОВЫ ЭЛЕКТРОДИНАМИКИ
- 34. ЧТО ТАКОЕ ЭЛЕКТРОДИНАМИКА?
- Глава VIII. ЭЛЕКТРОСТАТИКА
- 35. ЭЛЕКТРИЧЕСКИЙ ЗАРЯД И ЭЛЕМЕНТАРНЫЕ ЧАСТИЦЫ
- 36. ЗАРЯЖЕННЫЕ ТЕЛА. ЭЛЕКТРИЗАЦИЯ ТЕЛ
- 37. ЗАКОН СОХРАНЕНИЯ ЭЛЕКТРИЧЕСКОГО ЗАРЯДА
- 38. ОСНОВНОЙ ЗАКОН ЭЛЕКТРОСТАТИКИ — ЗАКОН КУЛОНА
- 39. ЕДИНИЦА ЭЛЕКТРИЧЕСКОГО ЗАРЯДА
- ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
- 40. БЛИЗКОДЕЙСТВИЕ И ДЕЙСТВИЕ НА РАССТОЯНИИ
- 41. ЭЛЕКТРИЧЕСКОЕ ПОЛЕ
- 42. НАПРЯЖЕННОСТЬ ЭЛЕКТРИЧЕСКОГО ПОЛЯ. ПРИНЦИП СУПЕРПОЗИЦИИ ПОЛЕЙ
- 43. СИЛОВЫЕ ЛИНИИ ЭЛЕКТРИЧЕСКОГО ПОЛЯ
- 44. ПРОВОДНИКИ В ЭЛЕКТРОСТАТИЧЕСКОМ ПОЛЕ
- 45. НАПРЯЖЕННОСТЬ ЭЛЕКТРИЧЕСКОГО ПОЛЯ РАВНОМЕРНО ЗАРЯЖЕННОГО ПРОВОДЯЩЕГО ШАРА И БЕСКОНЕЧНОЙ ПЛОСКОСТИ
- 46. ДИЭЛЕКТРИКИ В ЭЛЕКТРОСТАТИЧЕСКОМ ПОЛЕ. ДВА ВИДА ДИЭЛЕКТРИКОВ
- 47. ПОЛЯРИЗАЦИЯ ДИЭЛЕКТРИКОВ. ДИЭЛЕКТРИЧЕСКАЯ ПРОНИЦАЕМОСТЬ
- 48. ПОТЕНЦИАЛЬНАЯ ЭНЕРГИЯ ЗАРЯЖЕННОГО ТЕЛА В ОДНОРОДНОМ ЭЛЕКТРОСТАТИЧЕСКОМ ПОЛЕ
- 49. ПОТЕНЦИАЛ ЭЛЕКТРОСТАТИЧЕСКОГО ПОЛЯ И РАЗНОСТЬ ПОТЕНЦИАЛОВ
- 50. ПОТЕНЦИАЛ ЭЛЕКТРИЧЕСКОГО ПОЛЯ ТОЧЕЧНОГО ЗАРЯДА
- 51. СВЯЗЬ МЕЖДУ НАПРЯЖЕННОСТЬЮ ЭЛЕКТРИЧЕСКОГО ПОЛЯ И РАЗНОСТЬЮ ПОТЕНЦИАЛОВ. ЭКВИПОТЕНЦИАЛЬНЫЕ ПОВЕРХНОСТИ
- 52. ИЗМЕРЕНИЕ РАЗНОСТИ ПОТЕНЦИАЛОВ
- ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
- 53. ЭЛЕКТРОЕМКОСТЬ. ЕДИНИЦЫ ЭЛЕКТРОЕМКОСТИ
- 54. КОНДЕНСАТОРЫ. ЭЛЕКТРОЕМКОСТЬ ПЛОСКОГО КОНДЕНСАТОРА
- 55. ЭНЕРГИЯ ЗАРЯЖЕННОГО КОНДЕНСАТОРА. ПРИМЕНЕНИЯ КОНДЕНСАТОРОВ
- ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
- КРАТКИЕ ИТОГИ ГЛАВЫ X
- Глава IX. ПОСТОЯННЫЙ ЭЛЕКТРИЧЕСКИЙ ТОК
- 56. ЭЛЕКТРИЧЕСКИЙ ТОК. СИЛА ТОКА
- 57. УСЛОВИЯ, НЕОБХОДИМЫЕ ДЛЯ СУЩЕСТВОВАНИЯ ЭЛЕКТРИЧЕСКОГО ТОКА
- 58. ЗАКОН ОМА ДЛЯ УЧАСТКА ЦЕПИ. СОПРОТИВЛЕНИЕ
- 59. ЗАВИСИМОСТЬ СОПРОТИВЛЕНИЯ ПРОВОДНИКА ОТ ТЕМПЕРАТУРЫ
- 60. СВЕРХПРОВОДИМОСТЬ
- 61. ЭЛЕКТРИЧЕСКИЕ ЦЕПИ. ПОСЛЕДОВАТЕЛЬНОЕ И ПАРАЛЛЕЛЬНОЕ СОЕДИНЕНИЯ ПРОВОДНИКОВ
- 62. ИЗМЕРЕНИЕ СИЛЫ ТОКА И НАПРЯЖЕНИЯ
- 63. РАБОТА И МОЩНОСТЬ ПОСТОЯННОГО ТОКА
- ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
- 64. ЭЛЕКТРОДВИЖУЩАЯ СИЛА
- 65. ЗАКОН ОМА ДЛЯ ЗАМКНУТОЙ ЦЕПИ
- ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
- КРАТКИЕ ИТОГИ ГЛАВЫ IX
- Глава X. ЭЛЕКТРИЧЕСКИЙ ТОК В РАЗЛИЧНЫХ СРЕДАХ
- 66. ЭЛЕКТРИЧЕСКАЯ ПРОВОДИМОСТЬ РАЗЛИЧНЫХ ВЕЩЕСТВ
- 67. ЭЛЕКТРОННАЯ ПРОВОДИМОСТЬ МЕТАЛЛОВ
- 68. ЭЛЕКТРИЧЕСКИЙ ТОК В ЖИДКОСТЯХ
- 69. ЗАКОН ЭЛЕКТРОЛИЗА
- 70. ЭЛЕКТРИЧЕСКИЙ ТОК В ГАЗАХ
- 71. НЕСАМОСТОЯТЕЛЬНЫЙ И САМОСТОЯТЕЛЬНЫЙ РАЗРЯДЫ
- 72. РАЗЛИЧНЫЕ ТИПЫ САМОСТОЯТЕЛЬНОГО РАЗРЯДА И ИХ ТЕХНИЧЕСКИЕ ПРИМЕНЕНИЯ
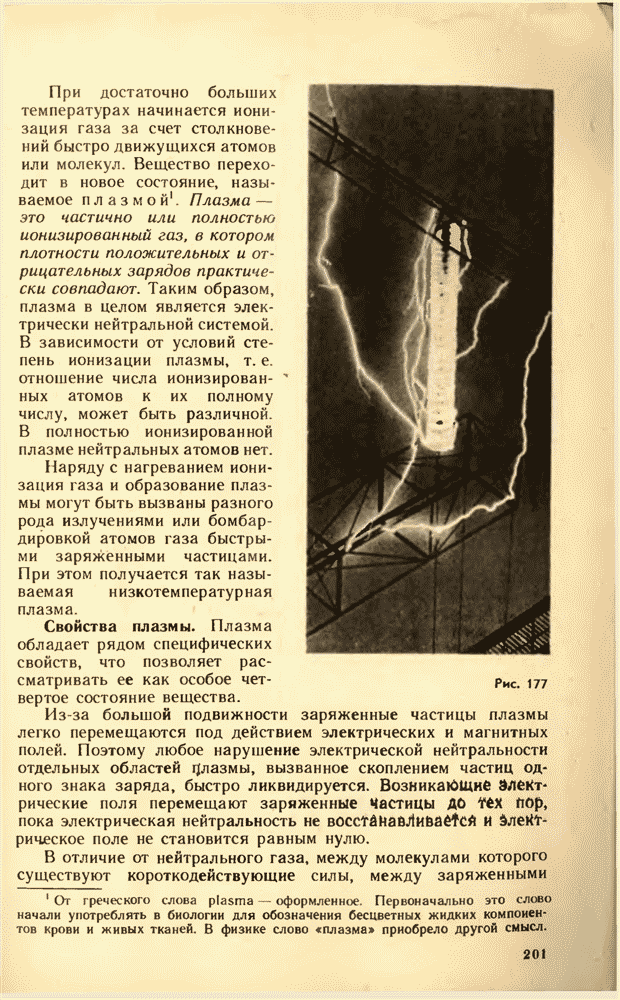
- 73. ПЛАЗМА
- 74. ЭЛЕКТРИЧЕСКИЙ ТОК В ВАКУУМЕ
- 75. ДВУХЭЛЕКТРОДНАЯ ЭЛЕКТРОННАЯ ЛАМПА-ДИОД
- 76. ЭЛЕКТРОННЫЕ ПУЧКИ. ЭЛЕКТРОННОЛУЧЕВАЯ ТРУБКА
- 77. ЭЛЕКТРИЧЕСКИЙ ТОК В ПОЛУПРОВОДНИКАХ
- 78. ЭЛЕКТРИЧЕСКАЯ ПРОВОДИМОСТЬ ПОЛУПРОВОДНИКОВ ПРИ НАЛИЧИИ ПРИМЕСЕЙ
- 79. ЭЛЕКТРИЧЕСКИЙ ТОК ЧЕРЕЗ КОНТАКТ ПОЛУПРОВОДНИКОВ p- И n- ТИПОВ
- 80. ПОЛУПРОВОДНИКОВЫЙ ДИОД
- 81. ТРАНЗИСТОР
- 82. ТЕРМИСТОРЫ И ФОТОРЕЗИСТОРЫ
- ПРИМЕР РЕШЕНИЯ ЗАДАЧИ
- КРАТКИЕ ИТОГИ ГЛАВЫ X
- Глава XI. МАГНИТНОЕ ПОЛЕ
- 83. ВЗАИМОДЕЙСТВИЕ ТОКОВ. МАГНИТНОЕ ПОЛЕ
- 84. ВЕКТОР МАГНИТНОЙ ИНДУКЦИИ
- 85. ЛИНИИ МАГНИТНОЙ ИНДУКЦИИ
- 86. ЭЛЕКТРОИЗМЕРИТЕЛЬНЫЕ ПРИБОРЫ
- 87. МОДУЛЬ ВЕКТОРА МАГНИТНОЙ ИНДУКЦИИ. МАГНИТНЫЙ ПОТОК
- 88. ЗАКОН АМПЕРА
- 89. ДЕЙСТВИЕ МАГНИТНОГО ПОЛЯ НА ДВИЖУЩИЙСЯ ЗАРЯД. СИЛА ЛОРЕНЦА
- 90. МАГНИТНЫЕ СВОЙСТВА ВЕЩЕСТВА
- ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
- КРАТКИЕ ИТОГИ ГЛАВЫ XI
- Глава XII. ЭЛЕКТРОМАГНИТНАЯ ИНДУКЦИЯ
- 91. ОТКРЫТИЕ ЭЛЕКТРОМАГНИТНОЙ ИНДУКЦИИ
- 92. НАПРАВЛЕНИЕ ИНДУКЦИОННОГО ТОКА. ПРАВИЛО ЛЕНЦА
- 93. ЗАКОН ЭЛЕКТРОМАГНИТНОЙ ИНДУКЦИИ
- 94. ВИХРЕВОЕ ЭЛЕКТРИЧЕСКОЕ ПОЛЕ
- 95. ЭДС ИНДУКЦИИ В ДВИЖУЩИХСЯ ПРОВОДНИКАХ
- 96. САМОИНДУКЦИЯ. ИНДУКТИВНОСТЬ
- 97. ЭНЕРГИЯ МАГНИТНОГО ПОЛЯ ТОКА
- 98. ОСНОВНЫЕ ЗАКОНЫ ЭЛЕКТРОДИНАМИКИ И ИХ ТЕХНИЧЕСКОЕ ПРИМЕНЕНИЕ
- ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
- КРАТКИЕ ИТОГИ ГЛАВЫ XII
- ЗАКЛЮЧЕНИЕ
- ЛАБОРАТОРНЫЕ РАБОТЫ
- ОТВЕТЫ К УПРАЖНЕНИЯМ