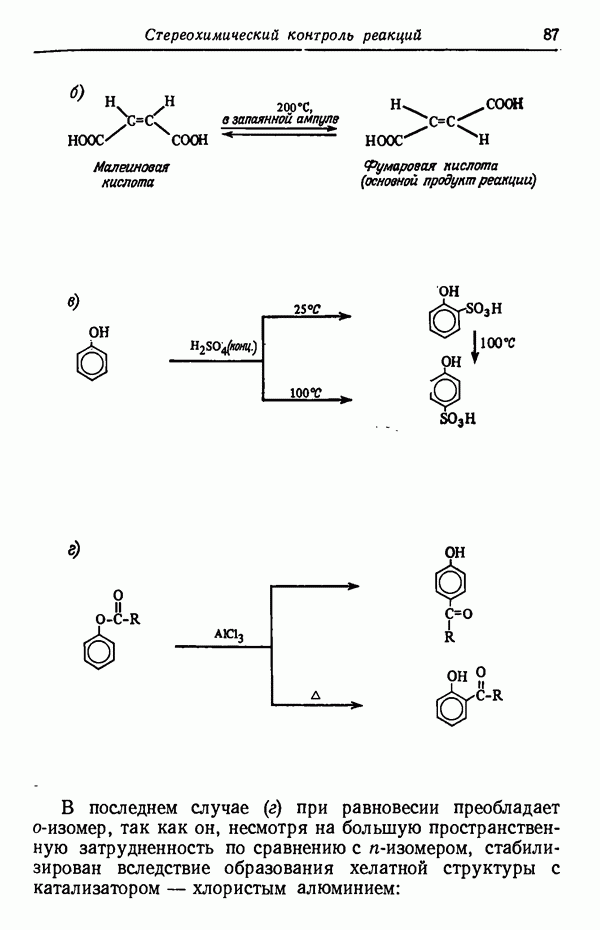
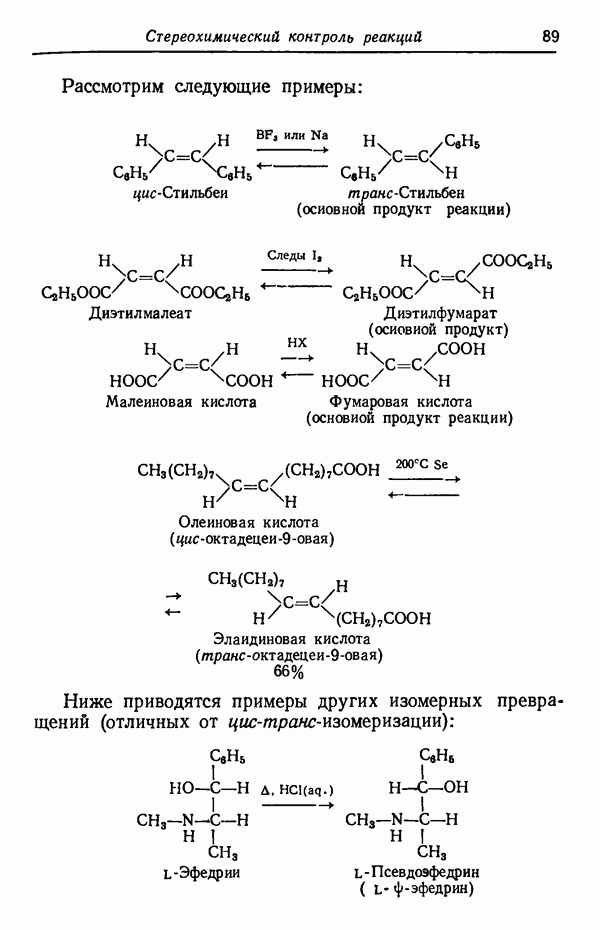
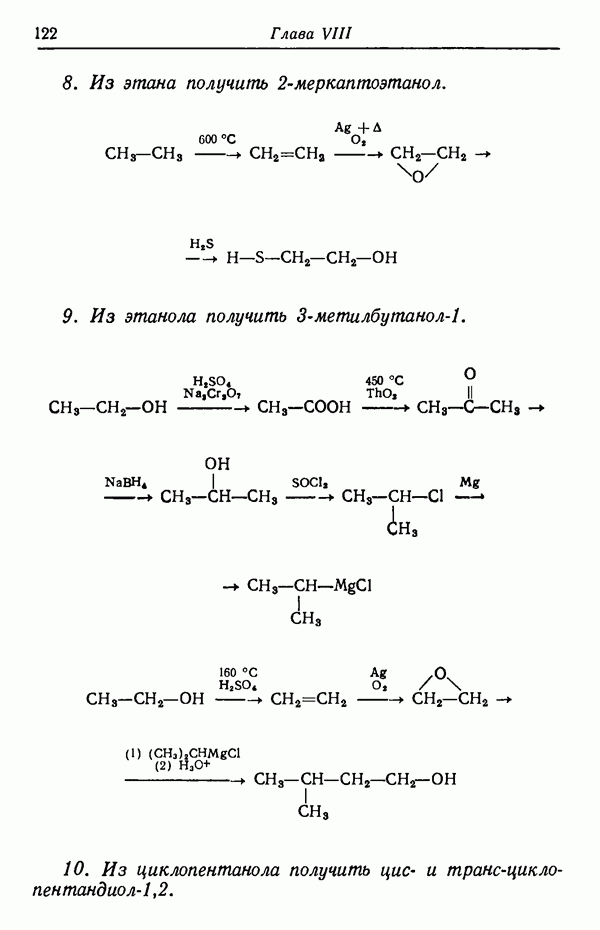
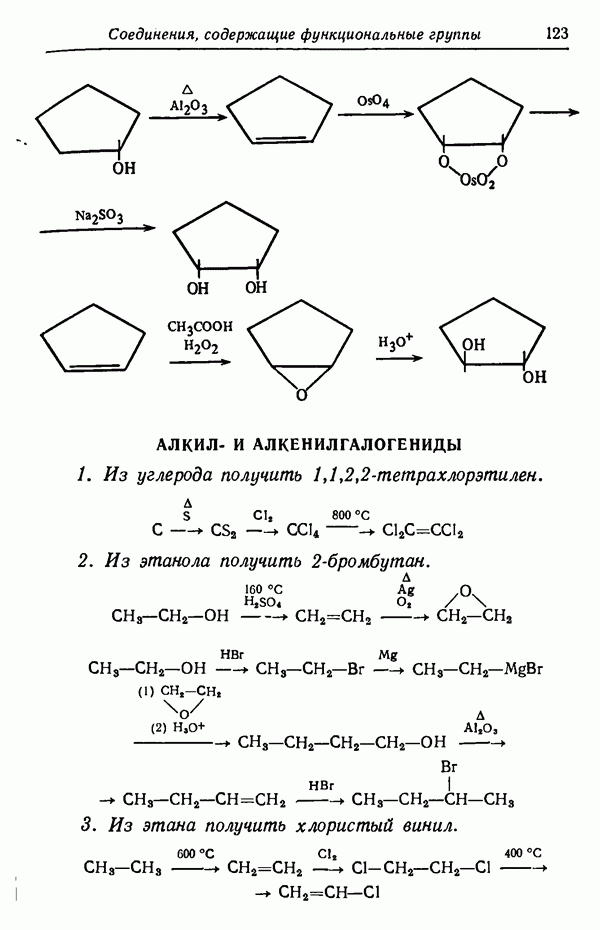
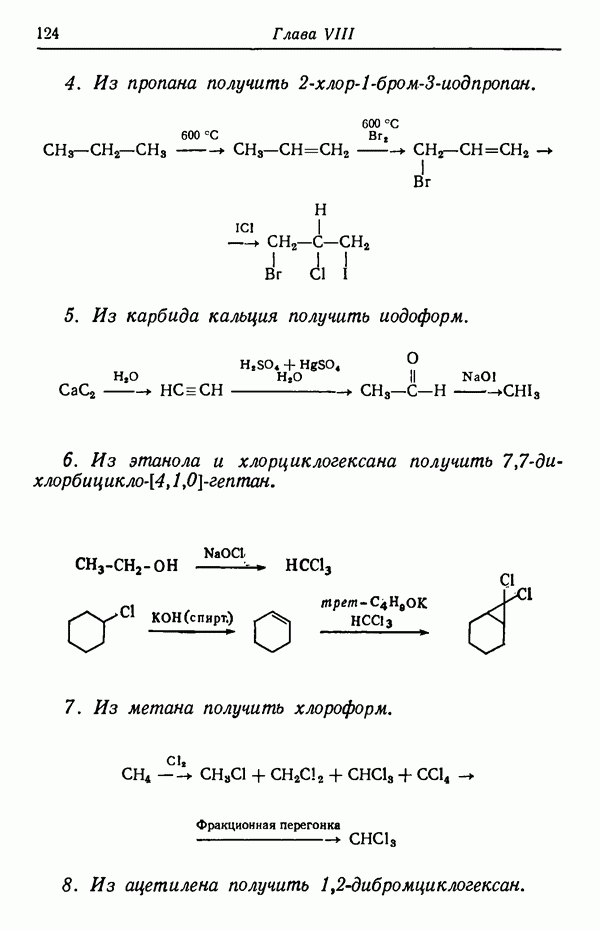
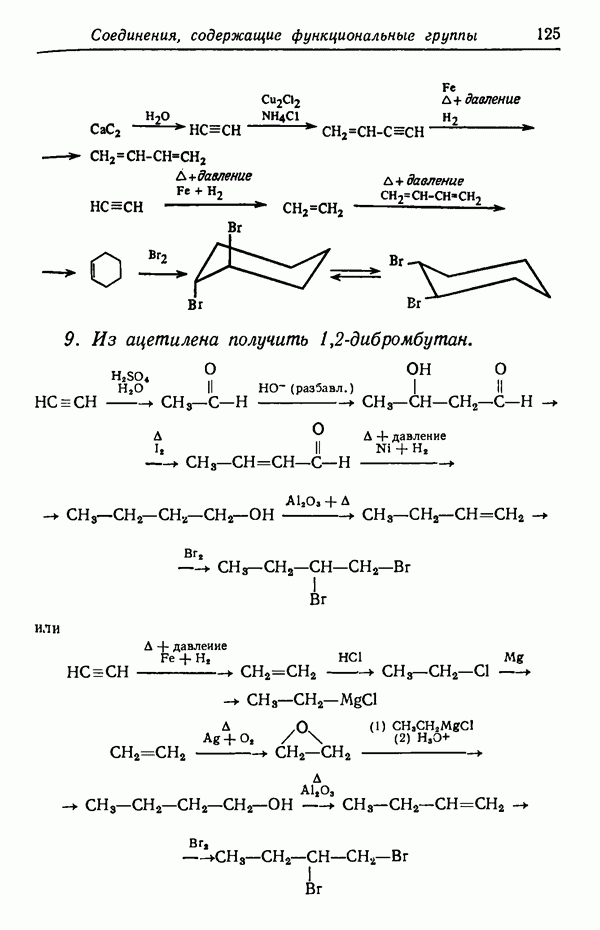
| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
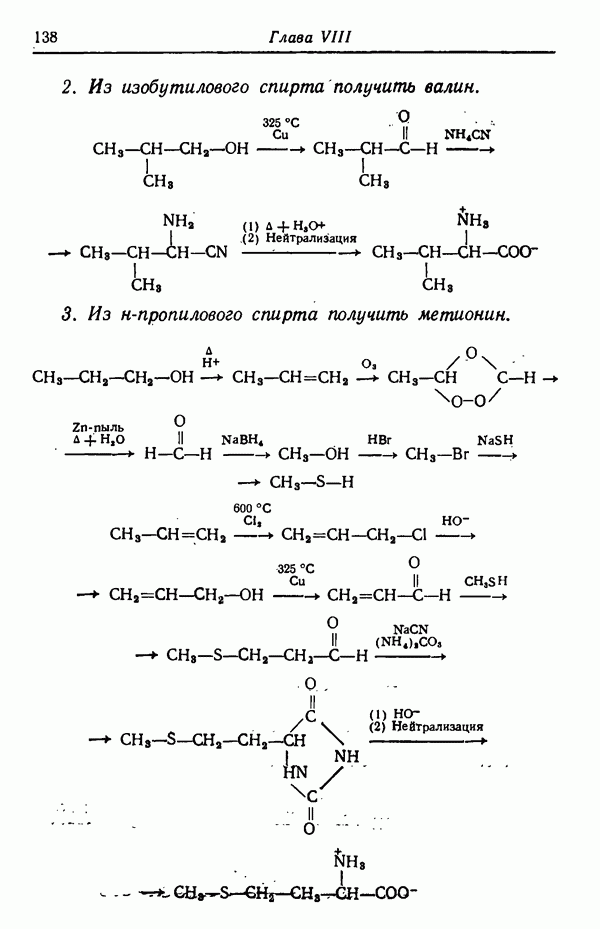
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
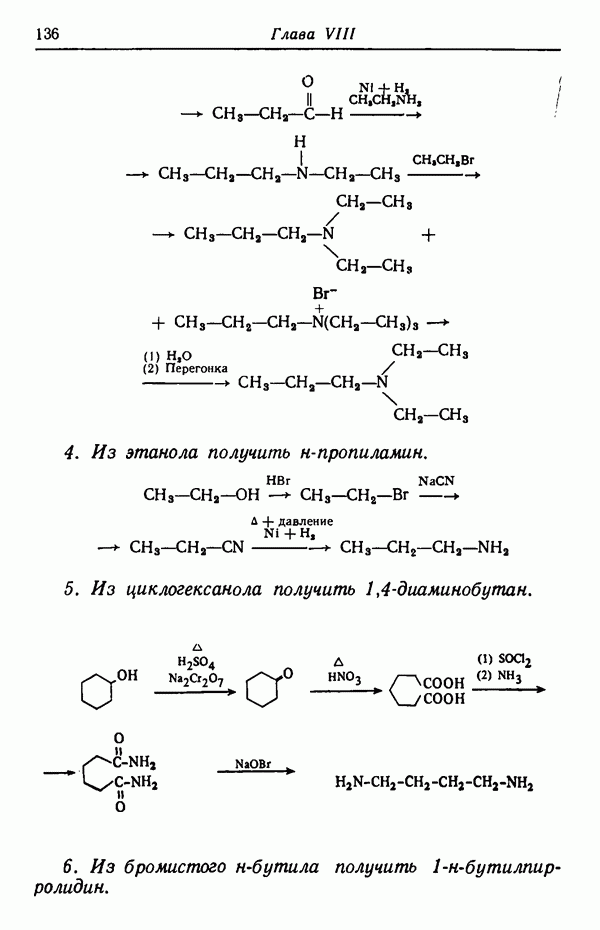
ОДНОВРЕМЕННАЯ ЗАЩИТА НЕСКОЛЬКИХ ГРУПП
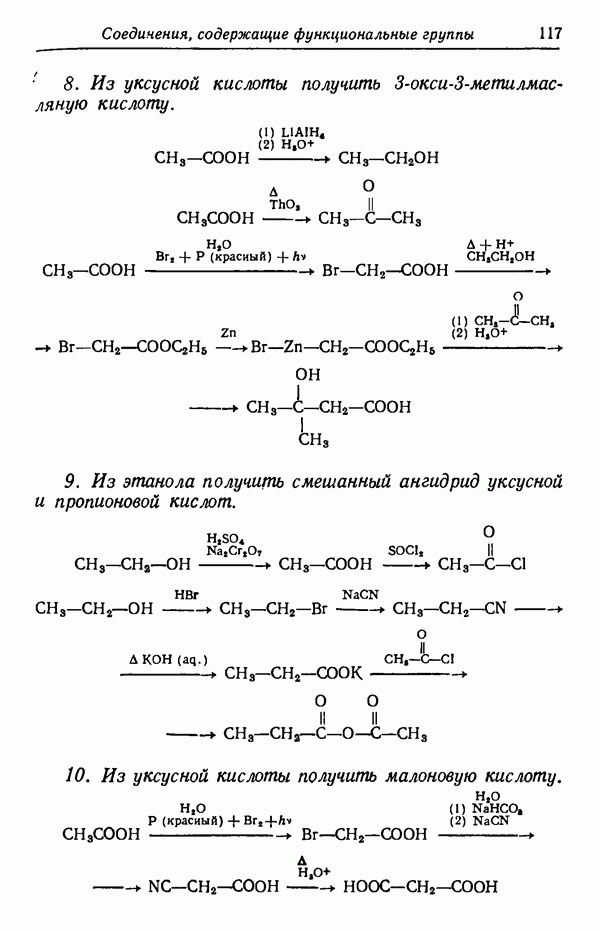
В некоторых синтезах требуется одновременно защитить две или более лабильные группы. Удобным объектом для изучения одновременной защиты нескольких функциональных групп являются углеводы. Разнообразие изомеров, присущее этому классу соединений, позволяет выбрать определенный из них для иллюстрации конкретного метода защиты. Кроме того, имеется возможность показать избирательность действия различных блокирующих агентов в зависимости от конфигурации данного углевода. В синтезе  -треозы из
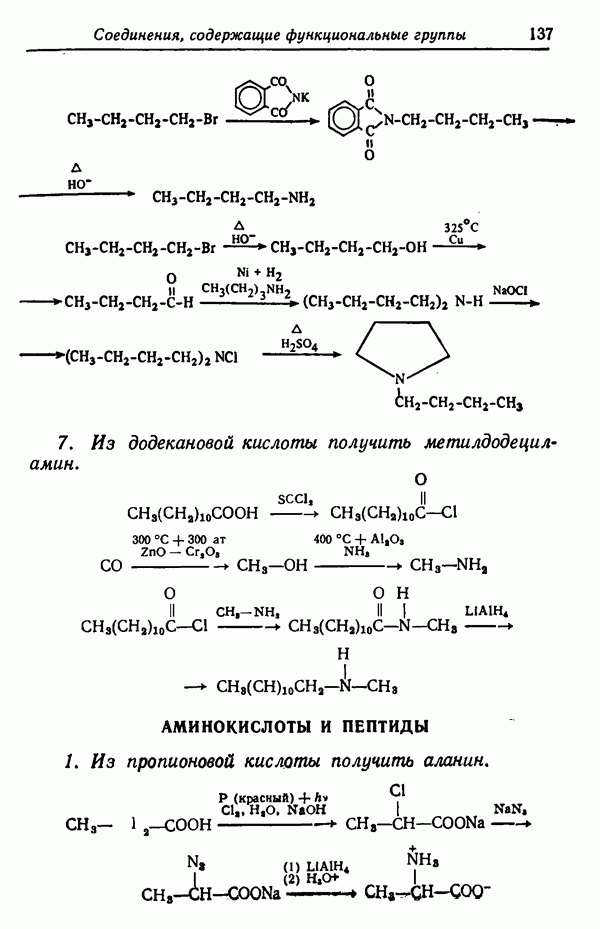
-треозы из  -арабита в качестве защитной группы используется бензилиденовая.
-арабита в качестве защитной группы используется бензилиденовая.

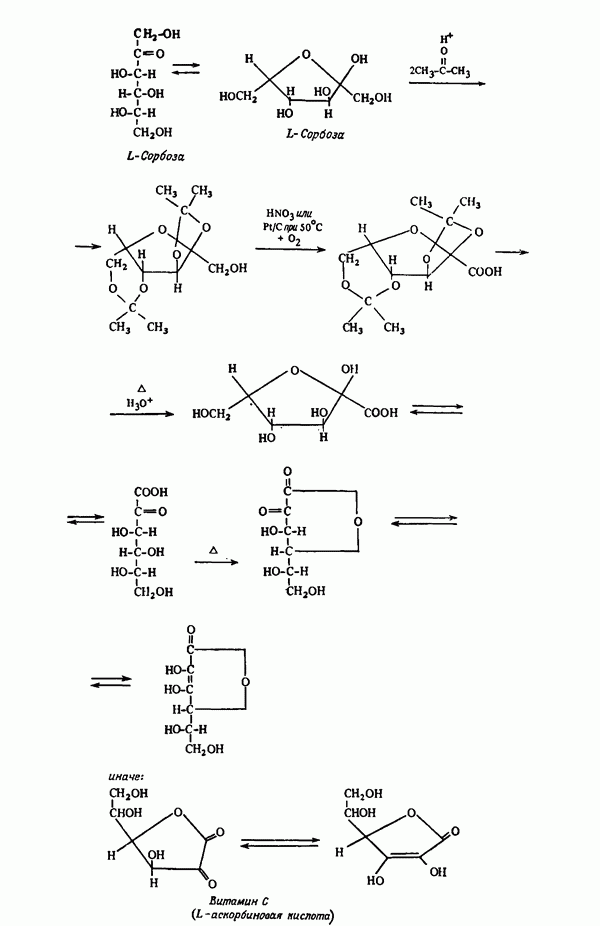
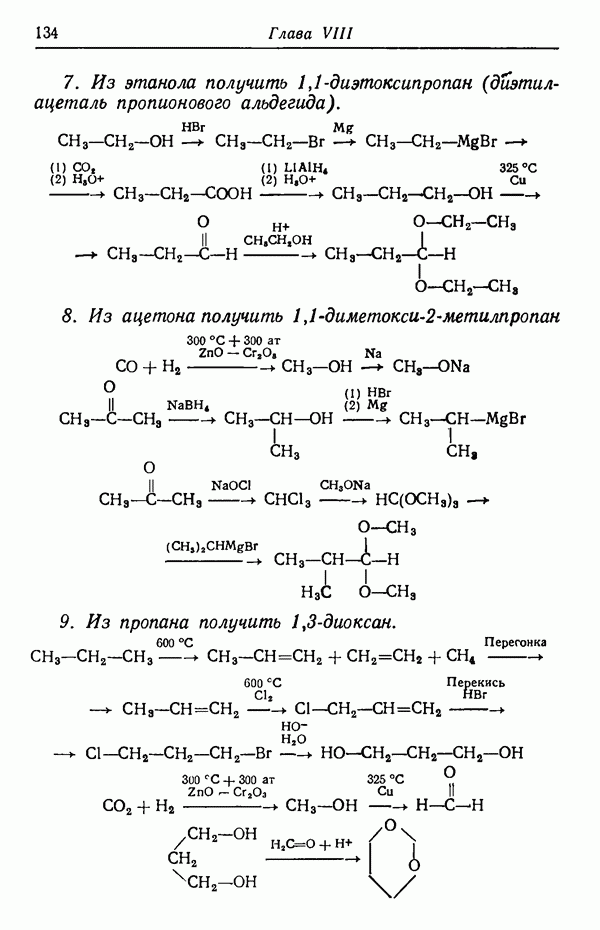
Синтез  -аскорбиновой кислоты (витамина С) из
-аскорбиновой кислоты (витамина С) из  -сорбо-зы иллюстрирует применение кетальной защиты.
-сорбо-зы иллюстрирует применение кетальной защиты.
В синтезе для блокирования гидроксильных групп, расположенных у соседних атомов углерода, используется получение циклического кеталя (изопропилиденовая группа или, иначе, замещенный диоксалан):
(см. скан)
(см. скан)
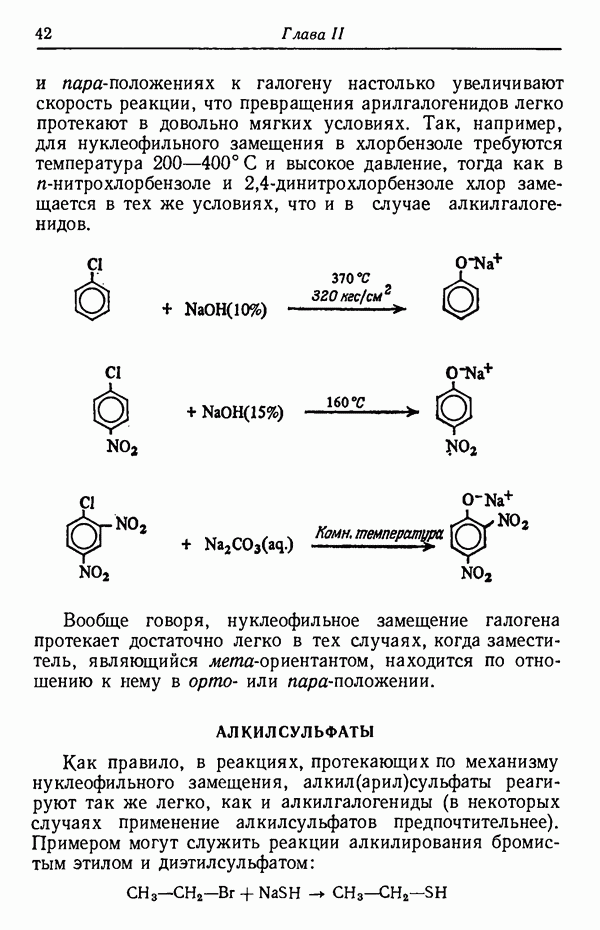
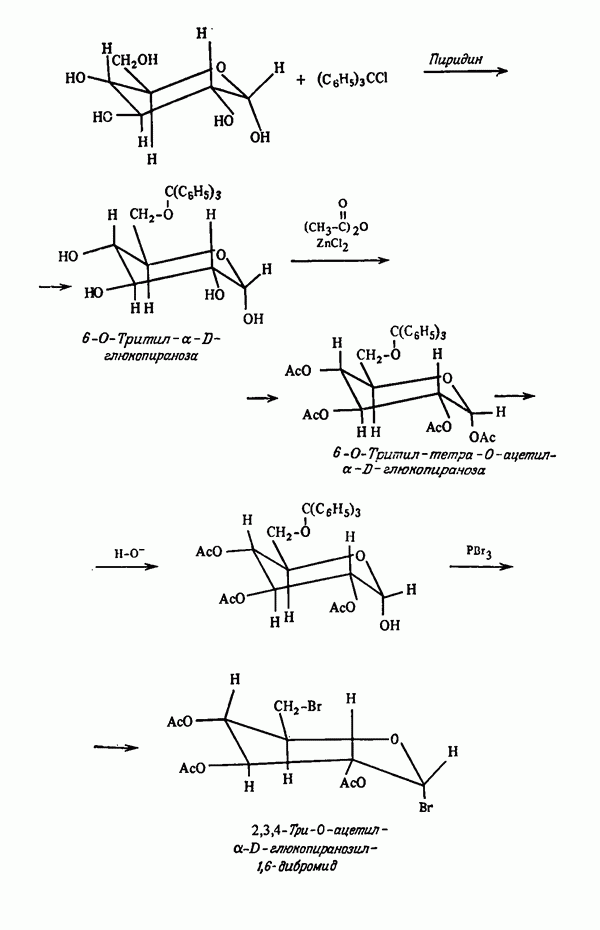
В примере, иллюстрируемом схемой на стр. 63, показано использование двух различных защитных групп. Чтобы защитить гидроксильную группу в положении  -глюкопиранозу вводят в реакцию с тритилхлоридом, а оставшиеся гидроксильные группы блокируют ацетилированием.
-глюкопиранозу вводят в реакцию с тритилхлоридом, а оставшиеся гидроксильные группы блокируют ацетилированием.
Следует отметить, что в реакции ацилирования тритильная группа успешно защищает первичный спиртовый гидроксил в положении 6, но при обработке трехбромистым фосфором она неустойчива, и в результате происходит замещение гидроксила на бром.
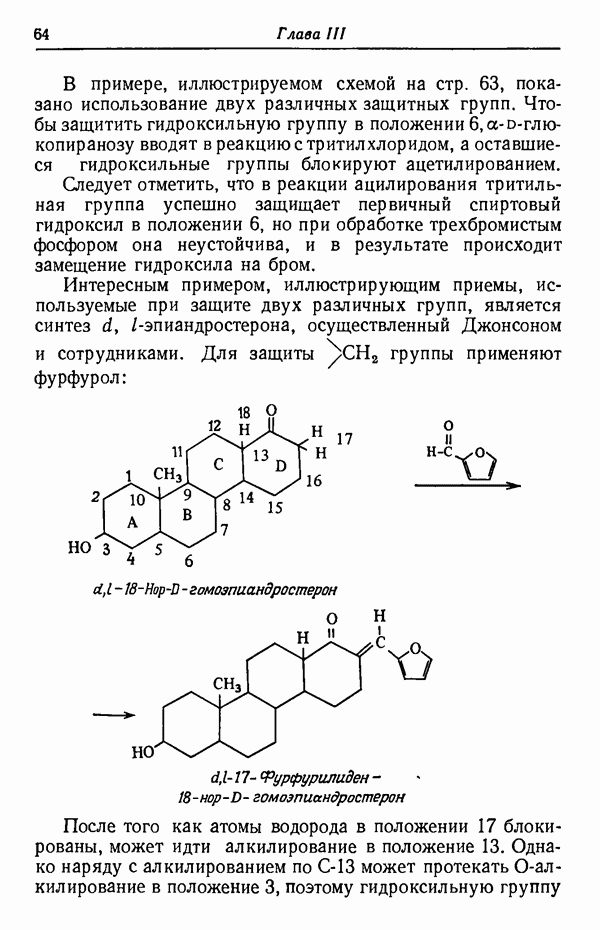
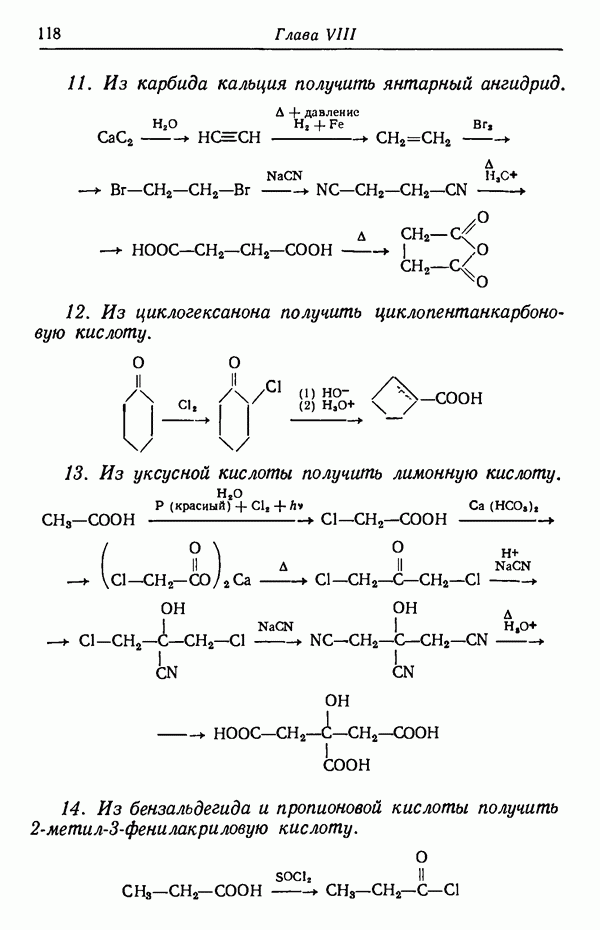
Интересным примером, иллюстрирующим приемы, используемые при защите двух различных групп, является синтез  -эпиандростерона, осуществленный Джонсоном и сотрудниками. Для защиты
-эпиандростерона, осуществленный Джонсоном и сотрудниками. Для защиты  группы применяют фурфурол:
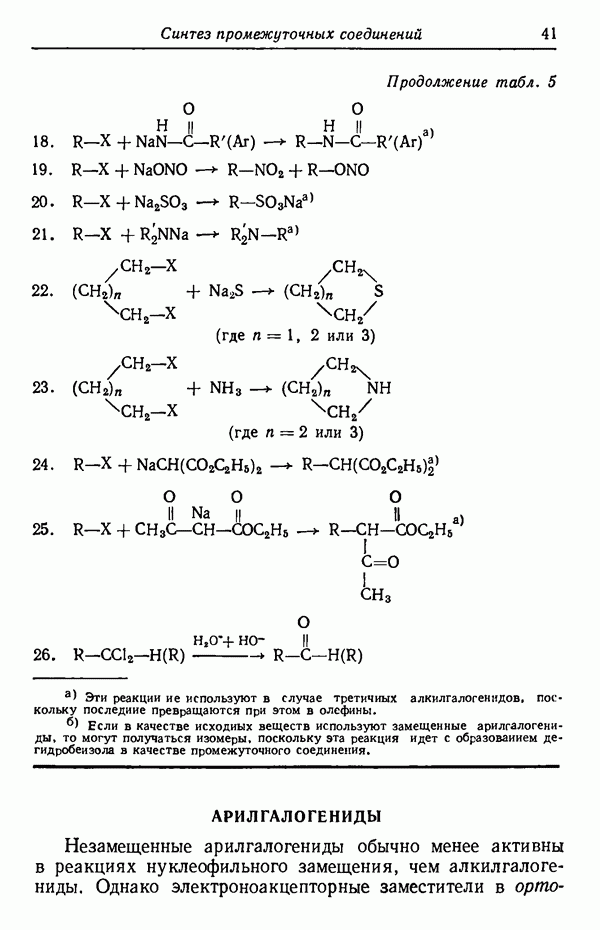
группы применяют фурфурол:
(см. скан)
После того как атомы водорода в положении 17 блокированы, может идти алкилирование в положение 13. Однако наряду с алкилированием по  может протекать О-ал-килирование в положение 3, поэтому гидроксильную группу
может протекать О-ал-килирование в положение 3, поэтому гидроксильную группу
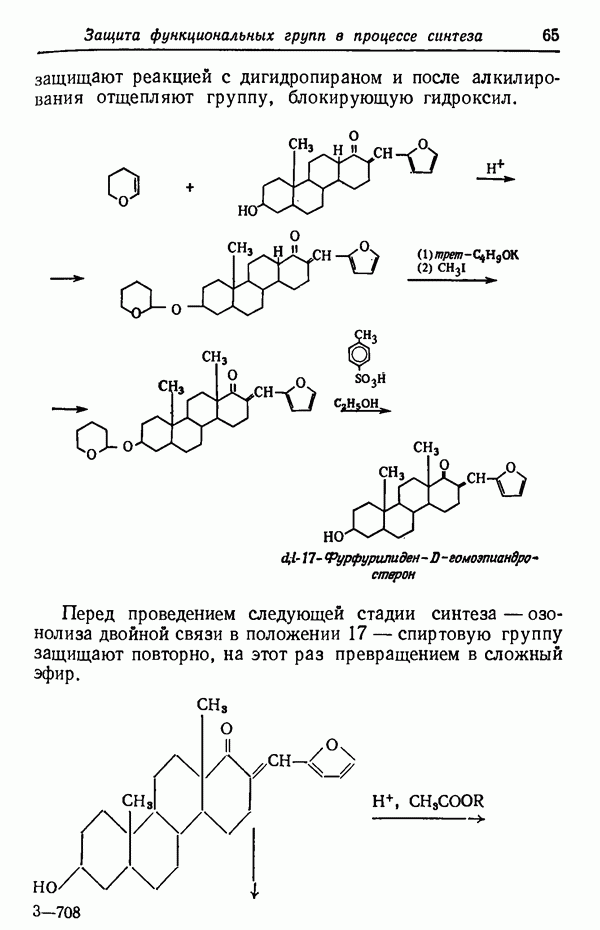
защищают реакцией с дигидропираном и после алкилирования отщепляют группу, блокирующую гидроксил.
(см. скан)
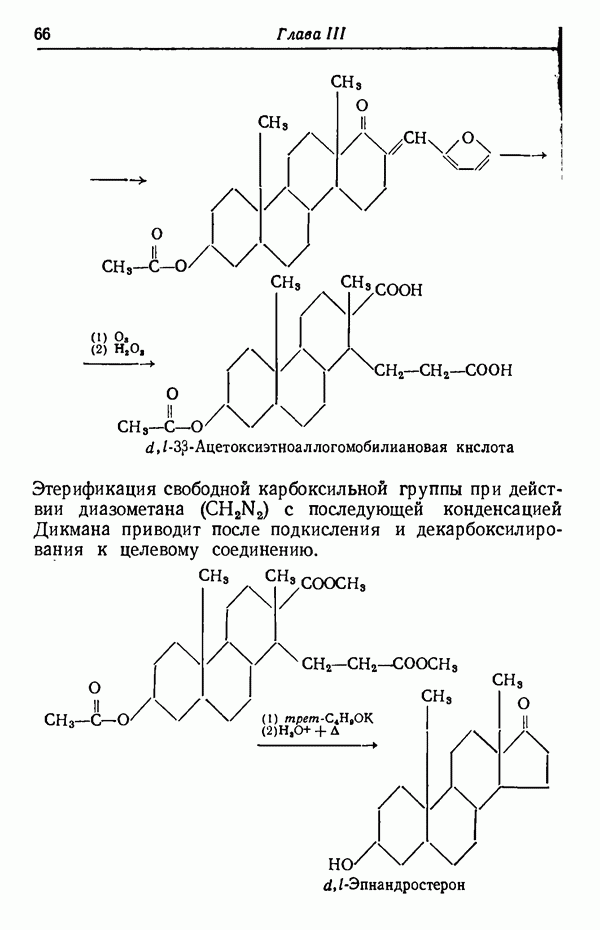
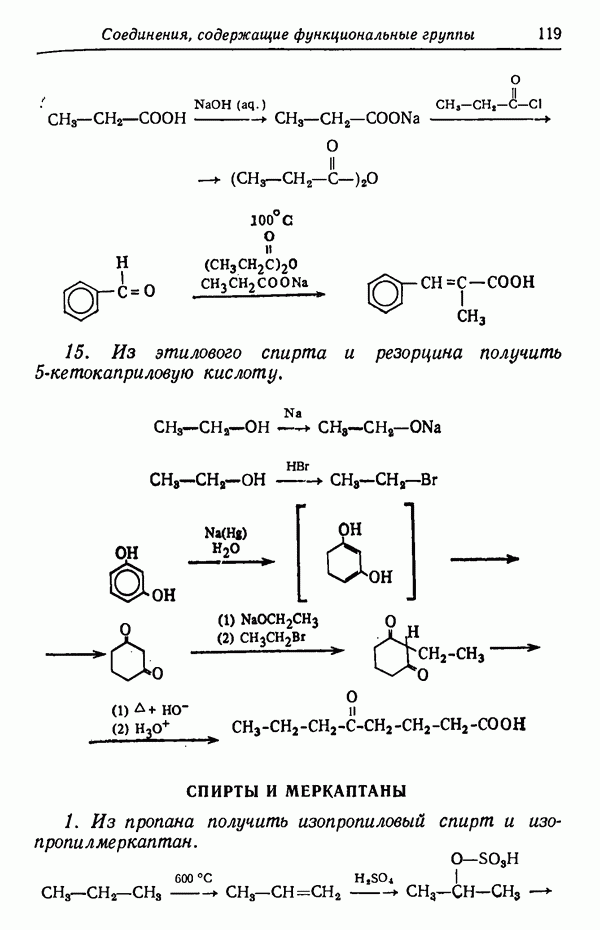
Перед проведением следующей стадии синтеза — озонолиза двойной связи в положении 17 — спиртовую группу защищают повторно, на этот раз превращением в сложный эфир.

(см. скан)
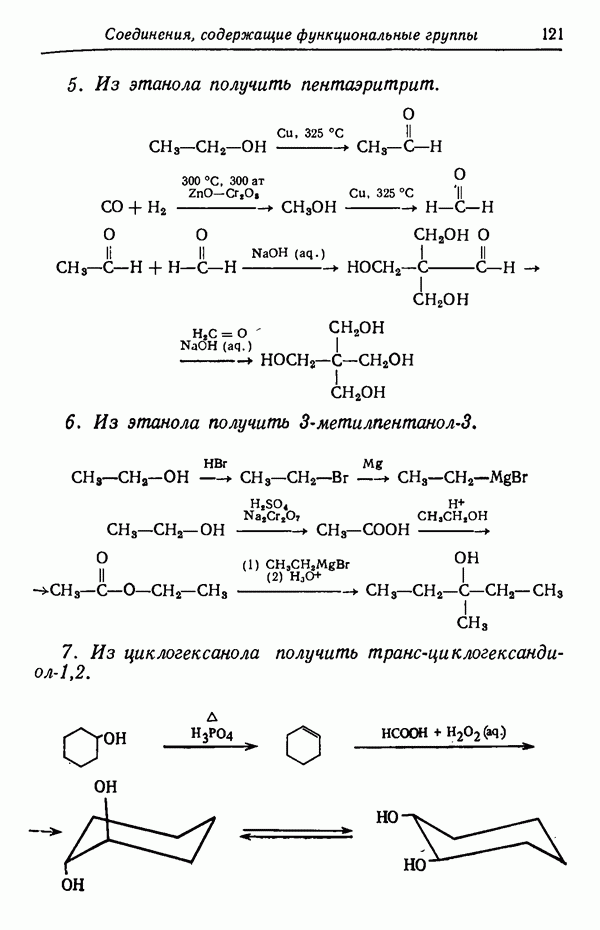
Этерификация свободной карбоксильной группы при действии диазометана  с последующей конденсацией Дикмана приводит после подкисления и декарбоксилирования к целевому соединению.
с последующей конденсацией Дикмана приводит после подкисления и декарбоксилирования к целевому соединению.
(см. скан)
| << Предыдущий параграф | Следующий параграф >> |
- ПРЕДИСЛОВИЕ
- Глава I. О МЕТОДАХ СОСТАВЛЕНИЯ СХЕМ МНОГОСТАДИЙНЫХ СИНТЕЗОВ
- СОСТАВЛЕНИЕ СХЕМЫ СИНТЕЗА, ИСХОДЯ ИЗ КОНЕЧНОГО СОЕДИНЕНИЯ
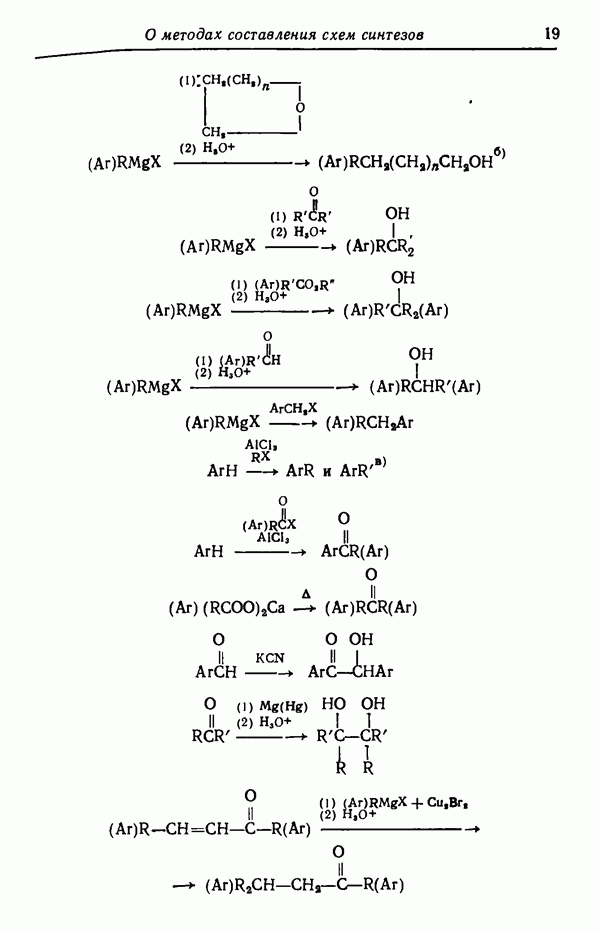
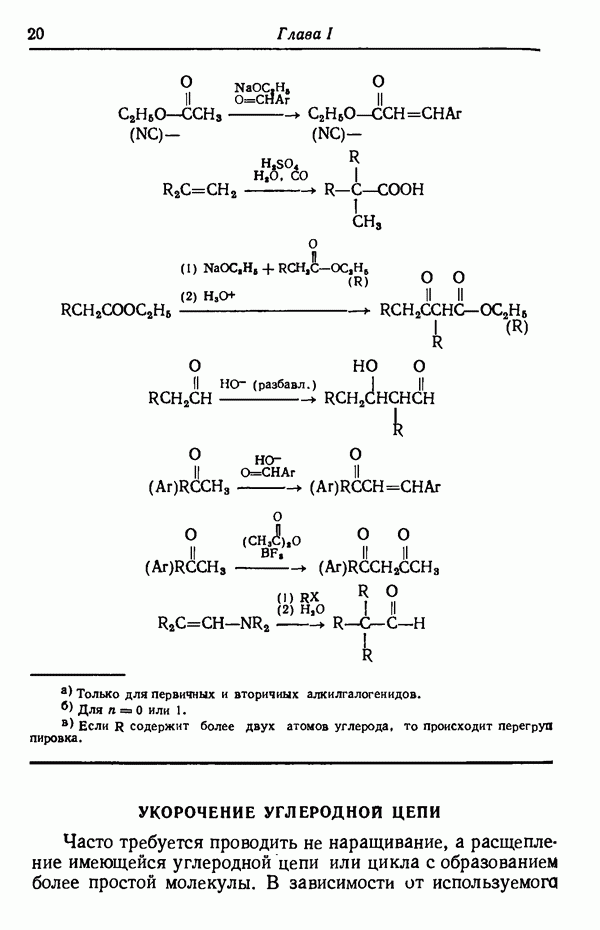
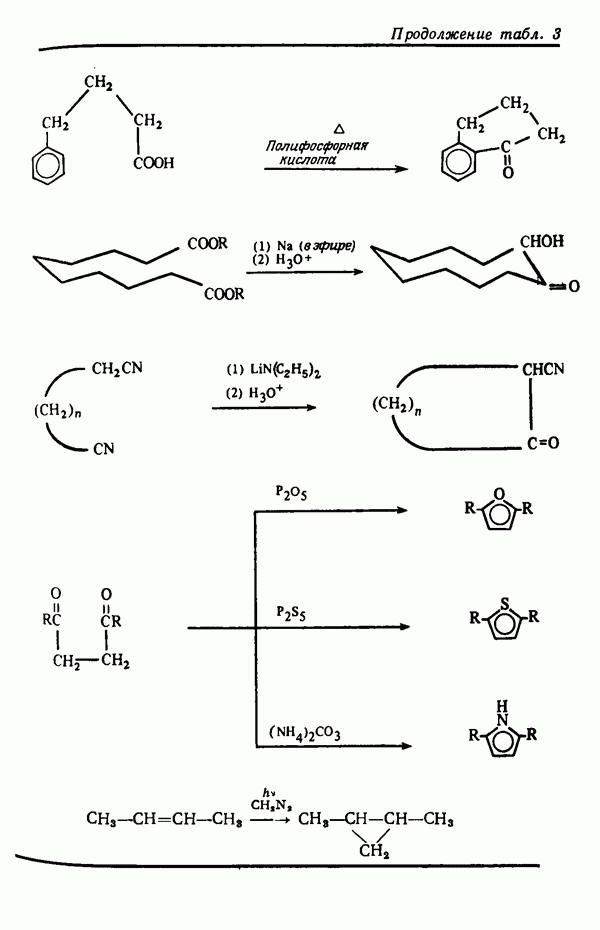
- НАРАЩИВАНИЕ УГЛЕРОДНОЙ ЦЕПИ
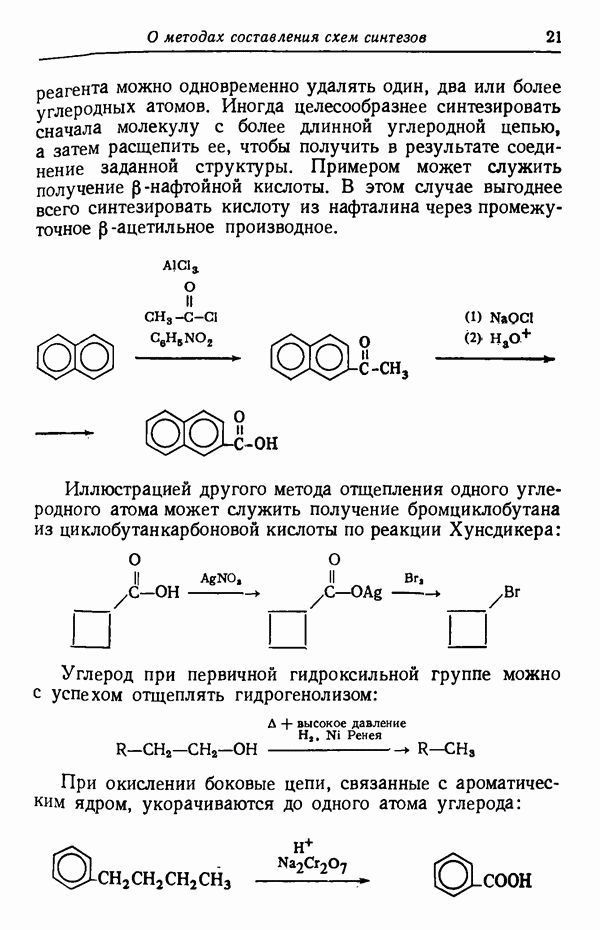
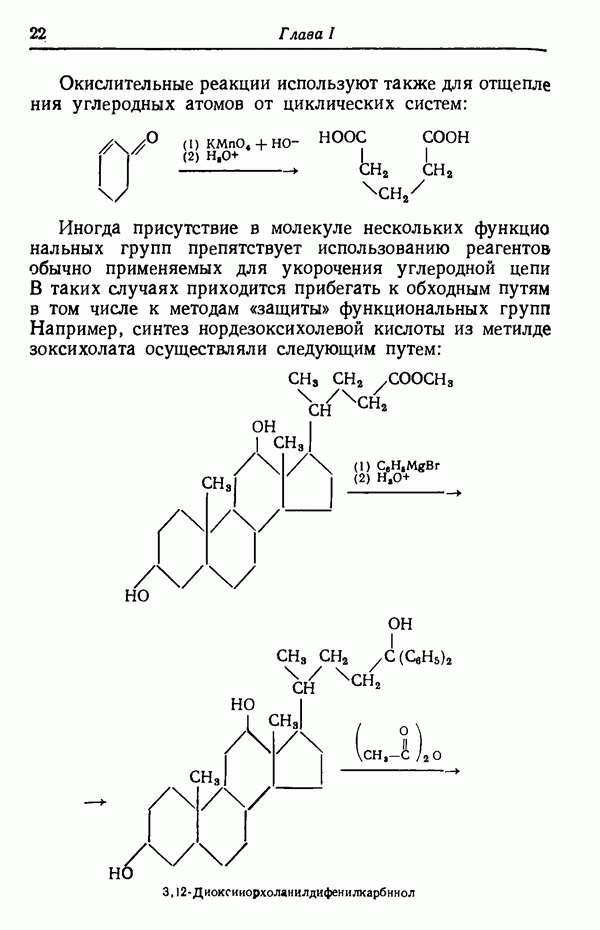
- УКОРОЧЕНИЕ УГЛЕРОДНОЙ ЦЕПИ
- РЕАКЦИИ ЦИКЛИЗАЦИИ
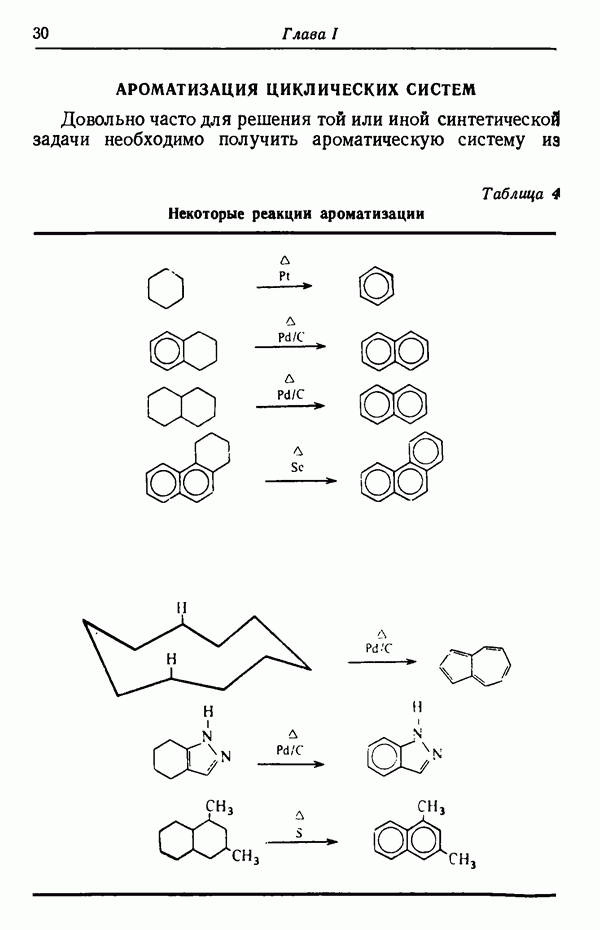
- АРОМАТИЗАЦИЯ ЦИКЛИЧЕСКИХ СИСТЕМ
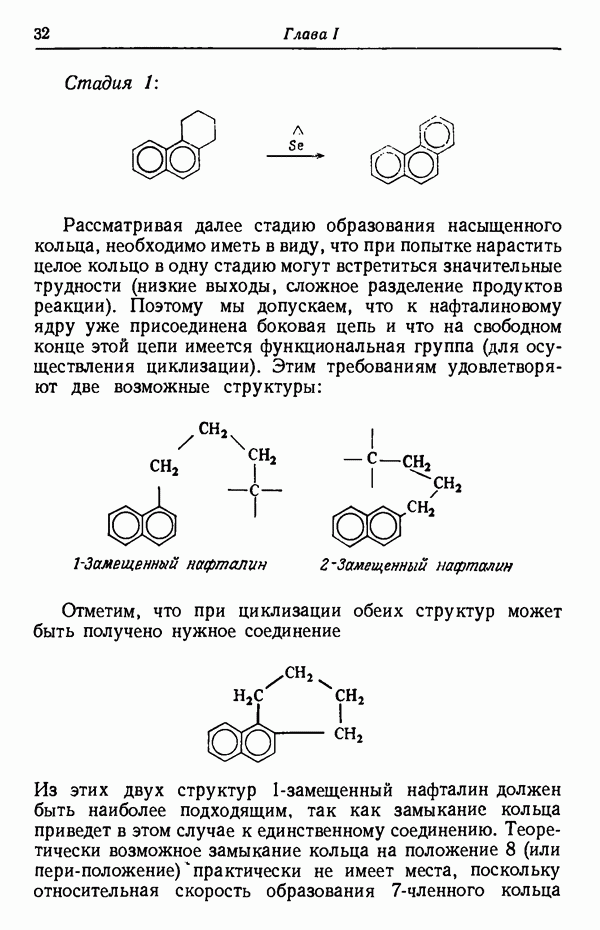
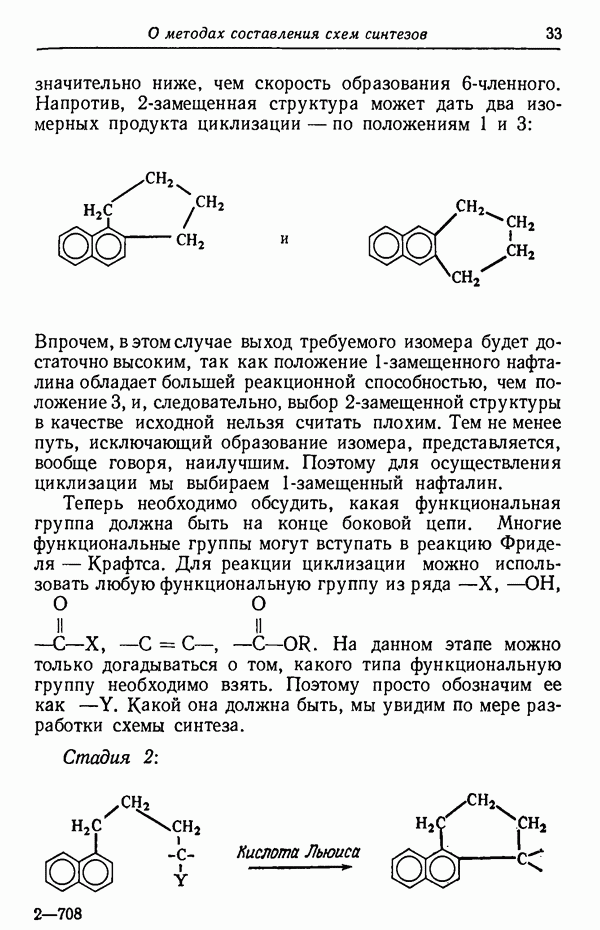
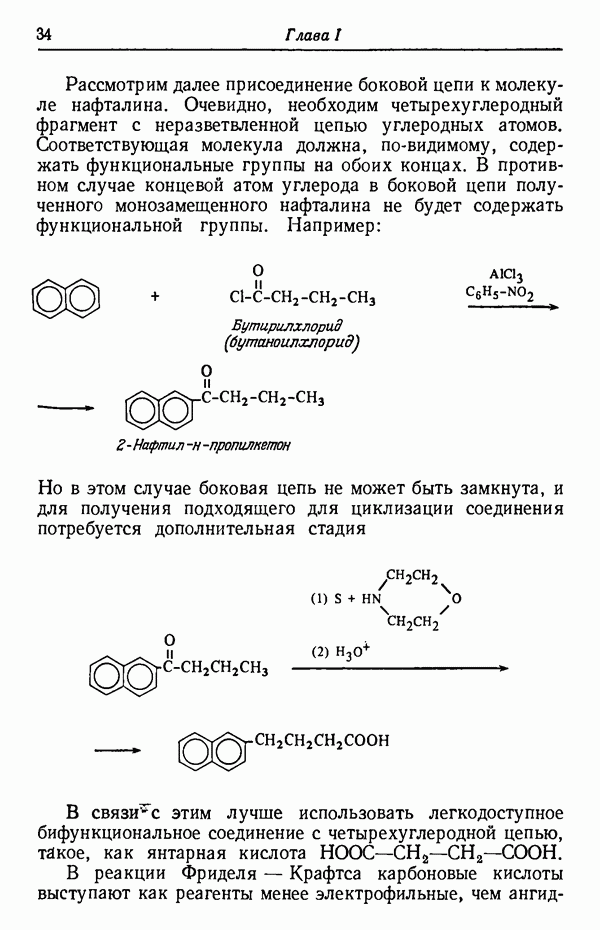
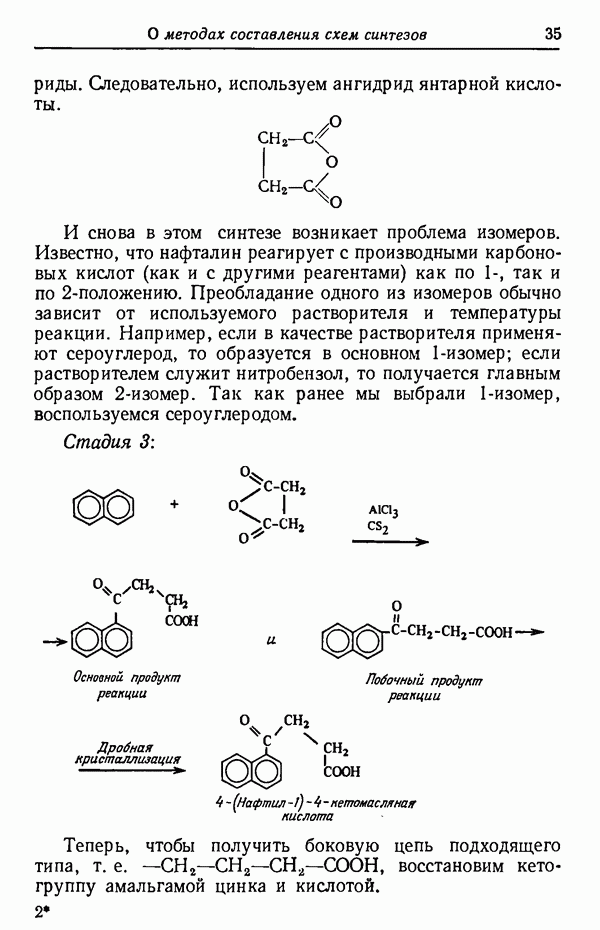
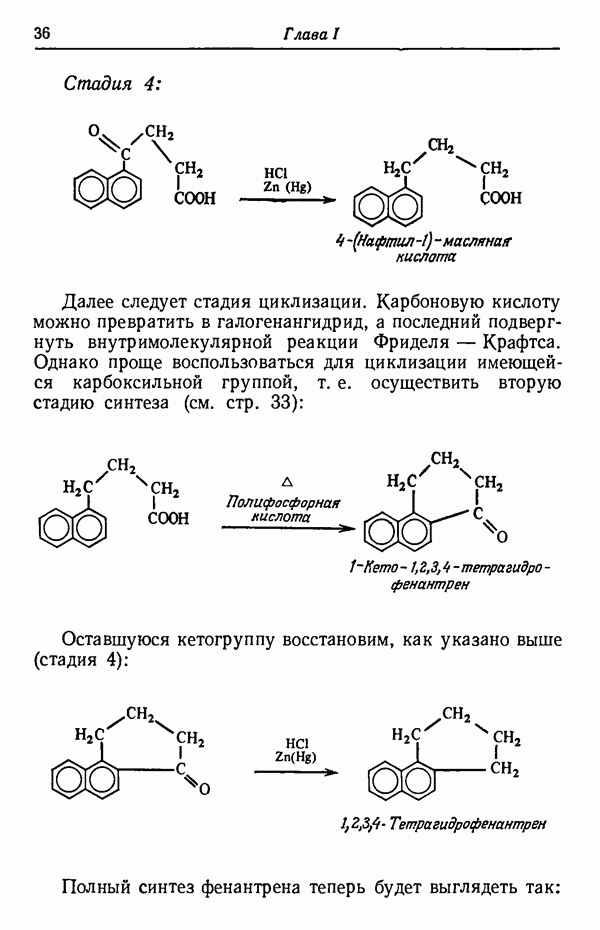
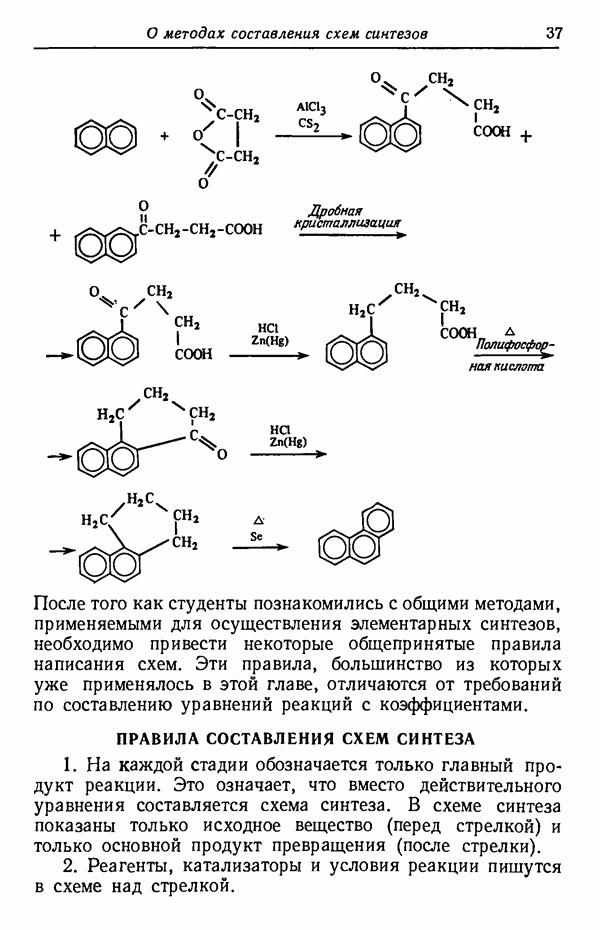
- СИНТЕЗ ФЕНАНТРЕНА ИЗ НАФТАЛИНА
- ПРАВИЛА СОСТАВЛЕНИЯ СХЕМ СИНТЕЗА
- Глава II. СИНТЕЗ НЕКОТОРЫХ НАИБОЛЕЕ ЧАСТО ИСПОЛЬЗУЕМЫХ ПРОМЕЖУТОЧНЫХ СОЕДИНЕНИЙ
- РЕАКТИВЫ ГРИНЬЯРА
- СОЛИ ДИАЗОНИЯ
- ПОЛУЧЕНИЕ ВАЖНЕЙШИХ ПРОМЕЖУТОЧНЫХ СОЕДИНЕНИЙ
- Глава III. ЗАЩИТА ФУНКЦИОНАЛЬНЫХ ГРУПП В ПРОЦЕССЕ СИНТЕЗА
- ГРУППЫ —О —Н
- ГРУППЫ -NH2 И — NHR
- ГРУППЫ C=O
- ГРУППЫ C-H
- ОДНОВРЕМЕННАЯ ЗАЩИТА НЕСКОЛЬКИХ ГРУПП
- Глава IV. СПЕЦИФИЧЕСКИЕ МЕТОДЫ, ПРИМЕНЯЕМЫЕ В АРОМАТИЧЕСКОМ РЯДУ
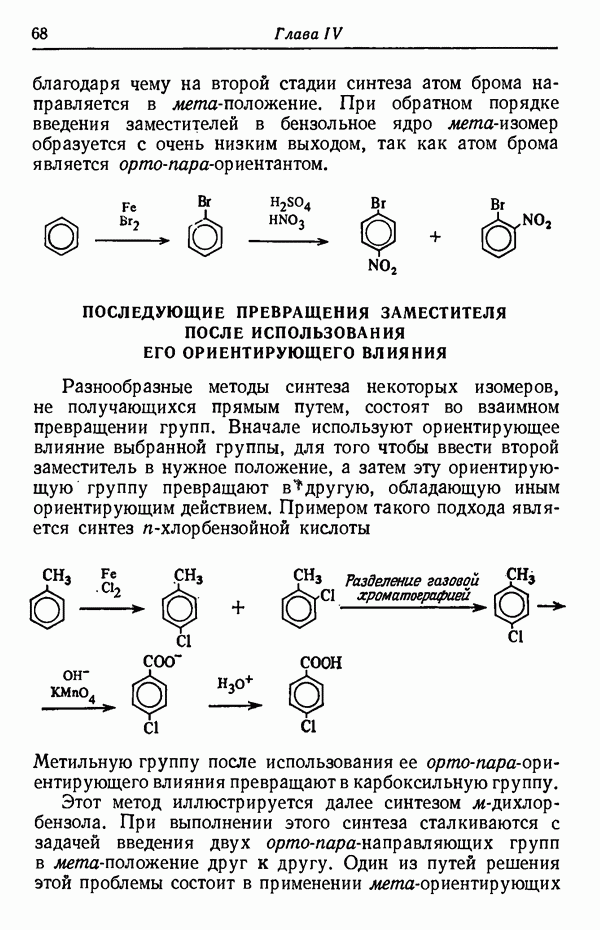
- ПОСЛЕДУЮЩИЕ ПРЕВРАЩЕНИЯ ЗАМЕСТИТЕЛЯ ПОСЛЕ ИСПОЛЬЗОВАНИЯ ЕГО ОРИЕНТИРУЮЩЕГО ВЛИЯНИЯ
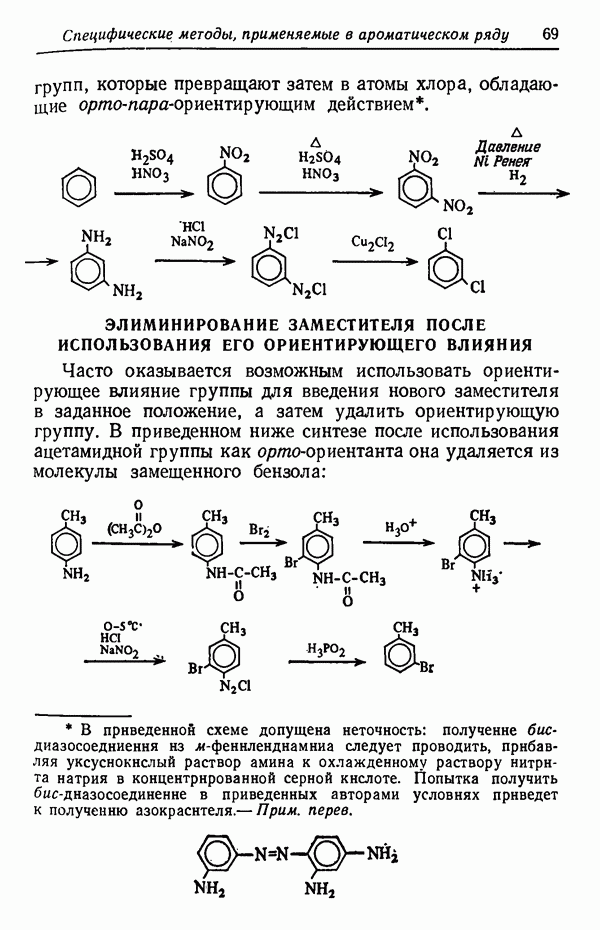
- ЭЛИМИНИРОВАНИЕ ЗАМЕСТИТЕЛЯ ПОСЛЕ ИСПОЛЬЗОВАНИЯ ЕГО ОРИЕНТИРУЮЩЕГО ВЛИЯНИЯ
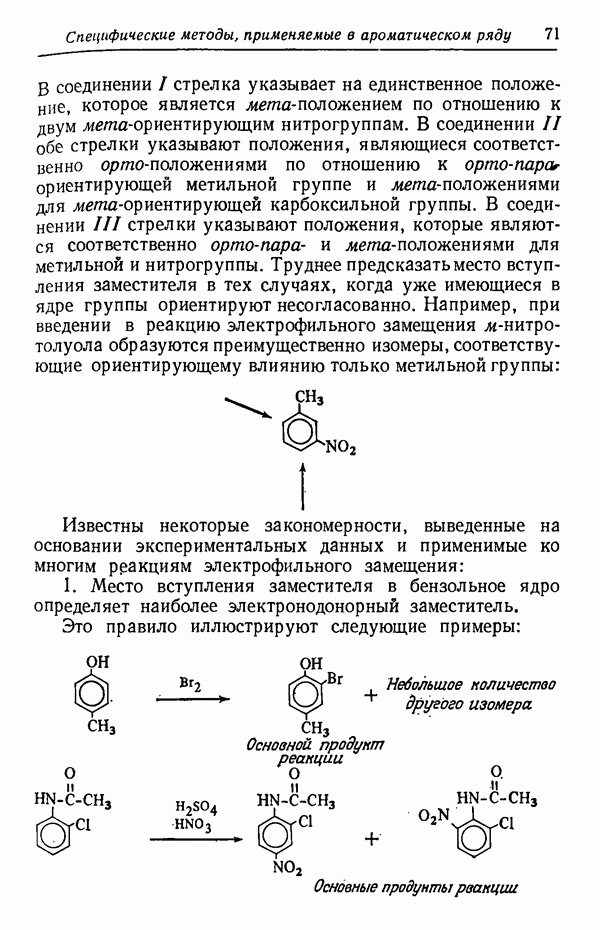
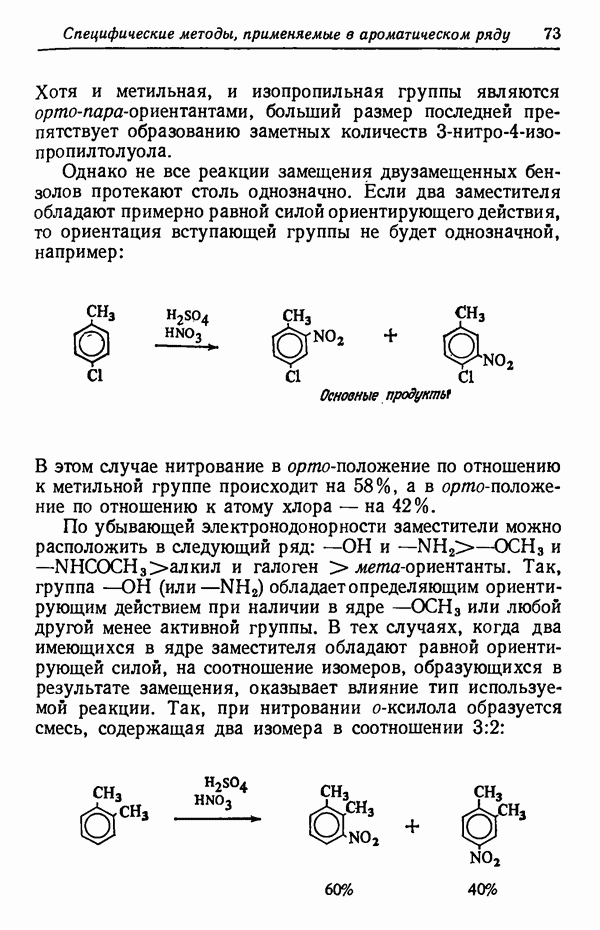
- ОРИЕНТАЦИЯ В ПОЛИЗАМЕЩЕННЫХ БЕНЗОЛАХ
- ВЛИЯНИЕ РАСТВОРИТЕЛЕЙ НА СООТНОШЕНИЕ ИЗОМЕРОВ
- Глава V. СТЕРЕОХИМИЧЕСКИЙ КОНТРОЛЬ РЕАКЦИЙ
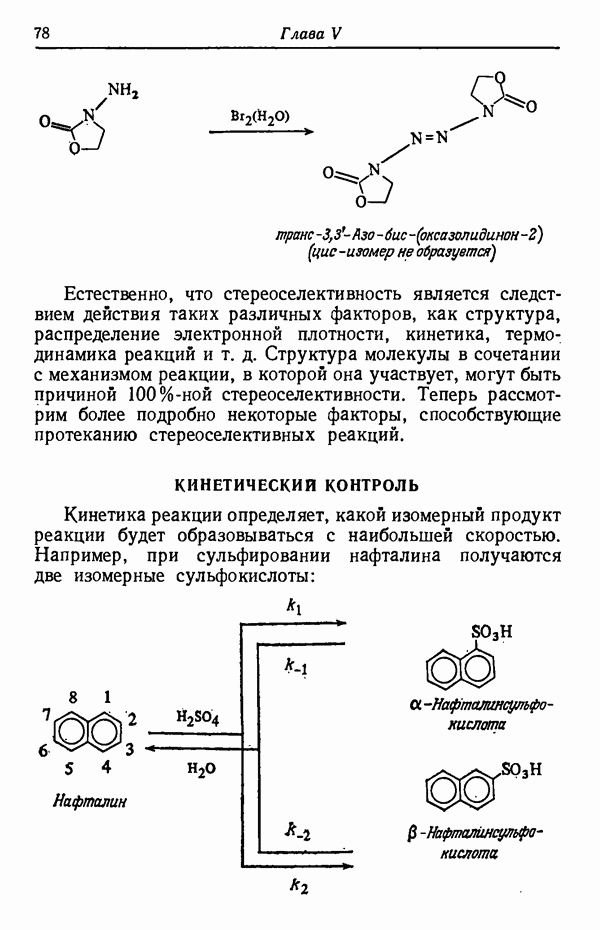
- КИНЕТИЧЕСКИЙ КОНТРОЛЬ
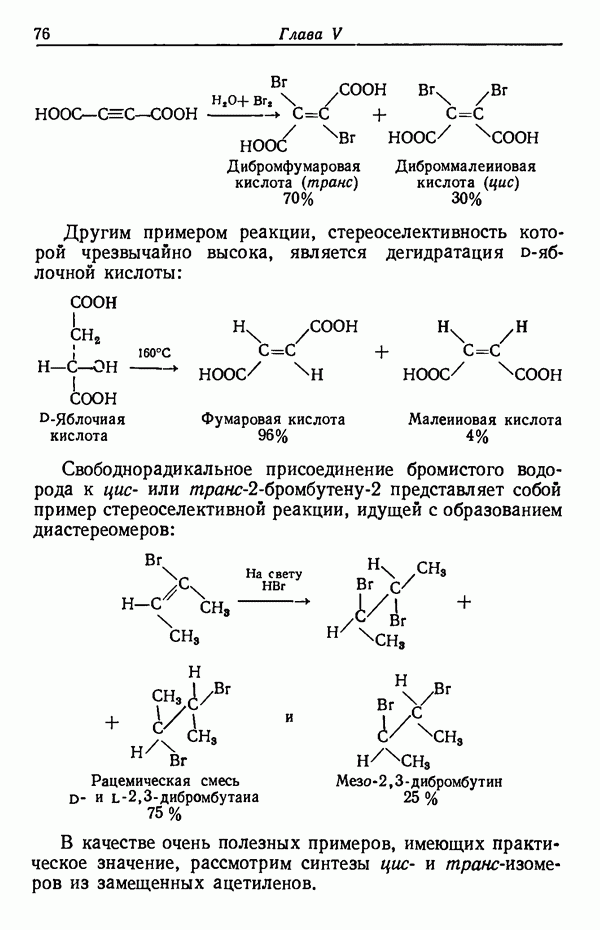
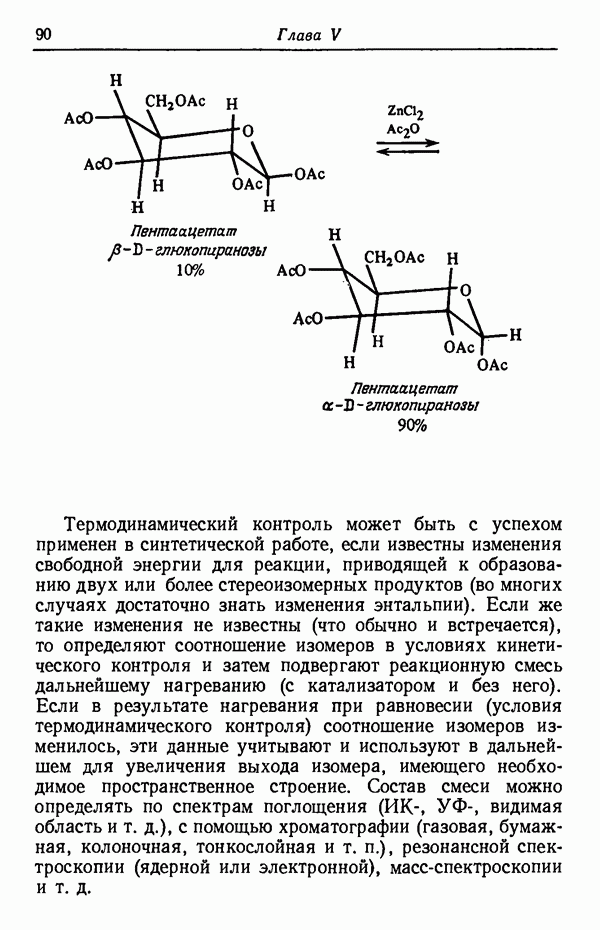
- ТЕРМОДИНАМИЧЕСКИЙ КОНТРОЛЬ
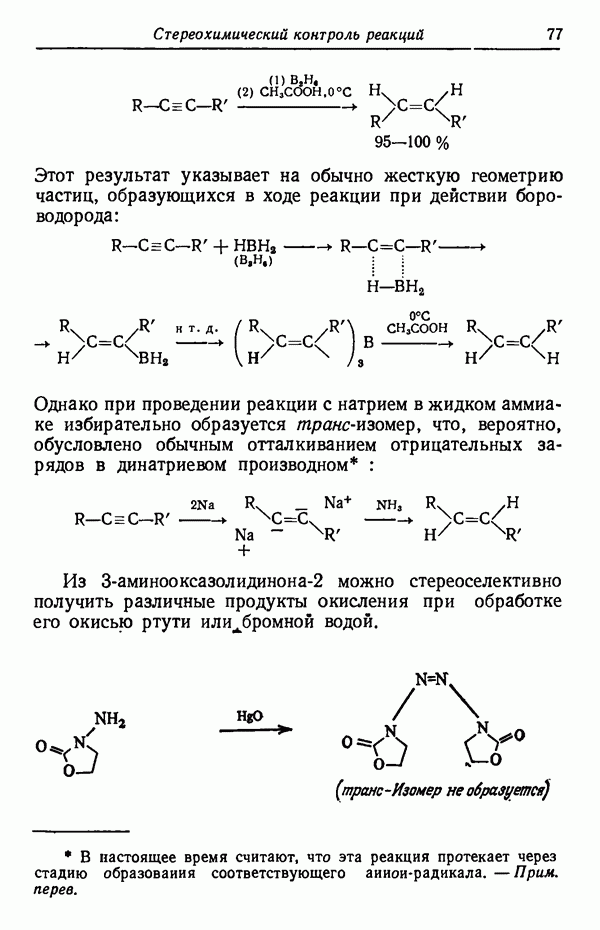
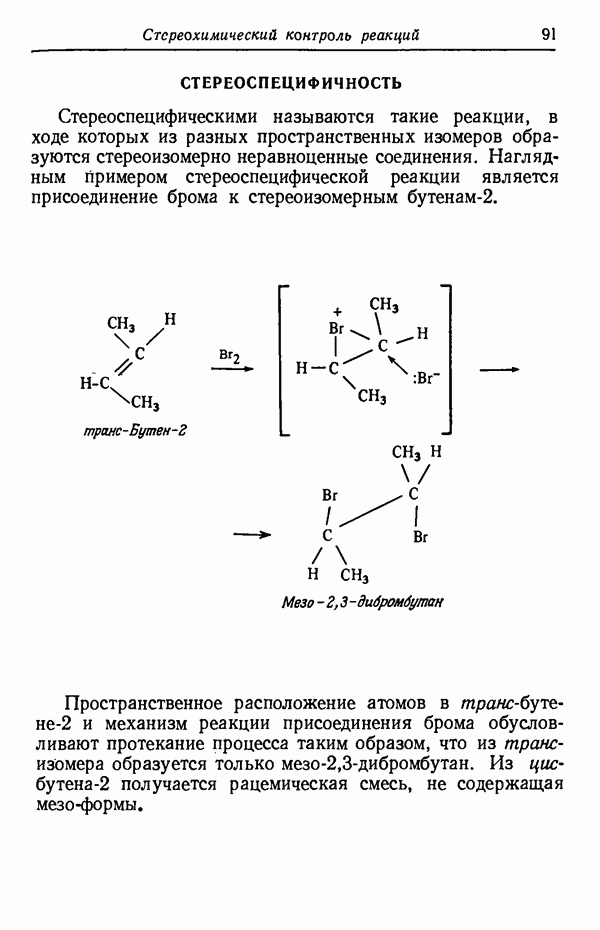
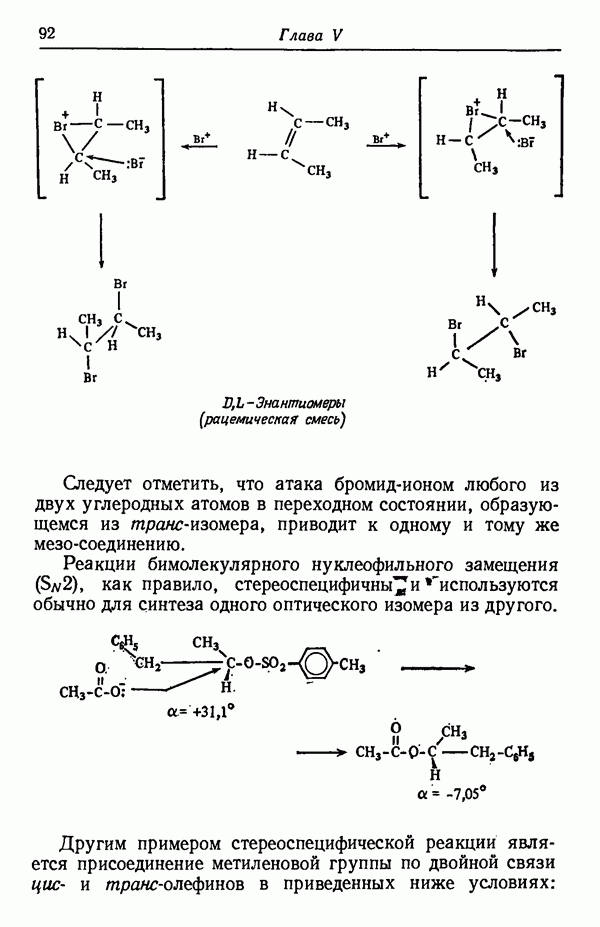
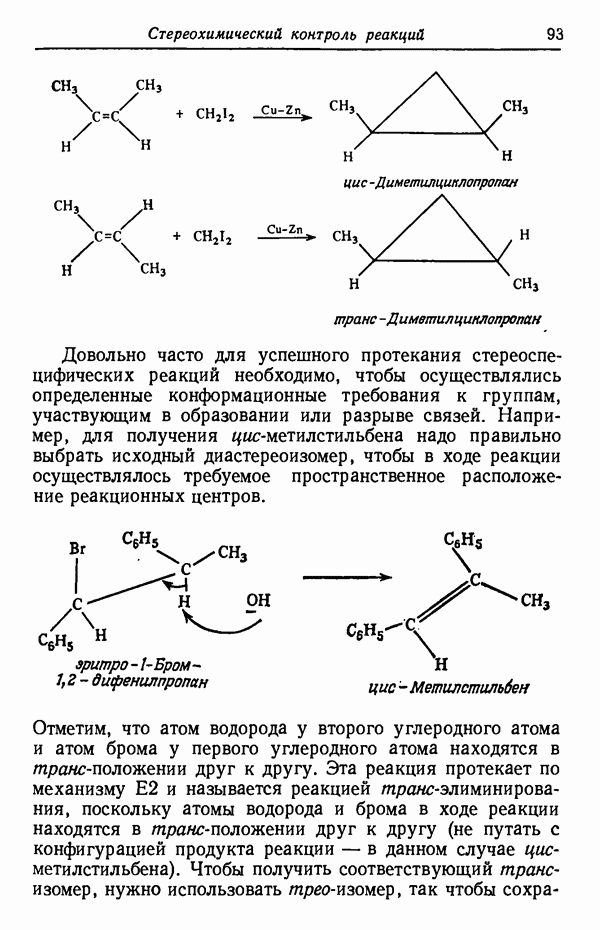
- СТЕРЕОСПЕЦИФИЧНОСТЬ
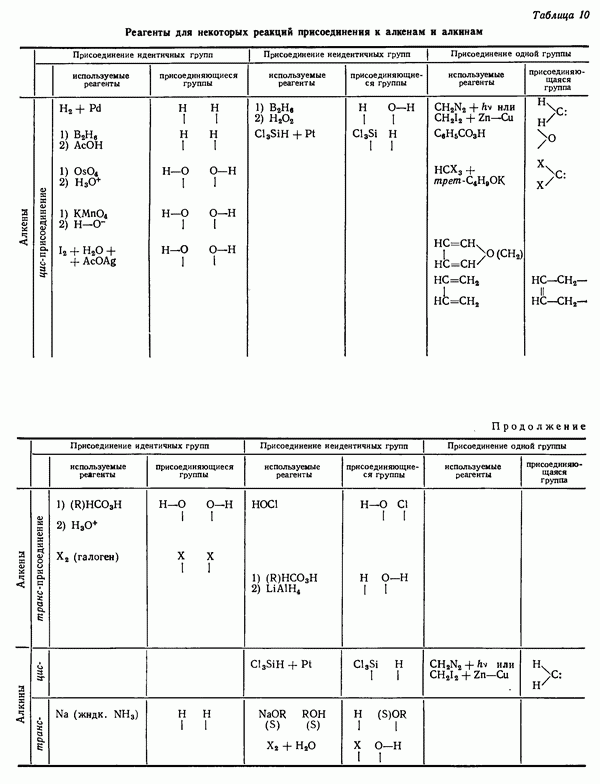
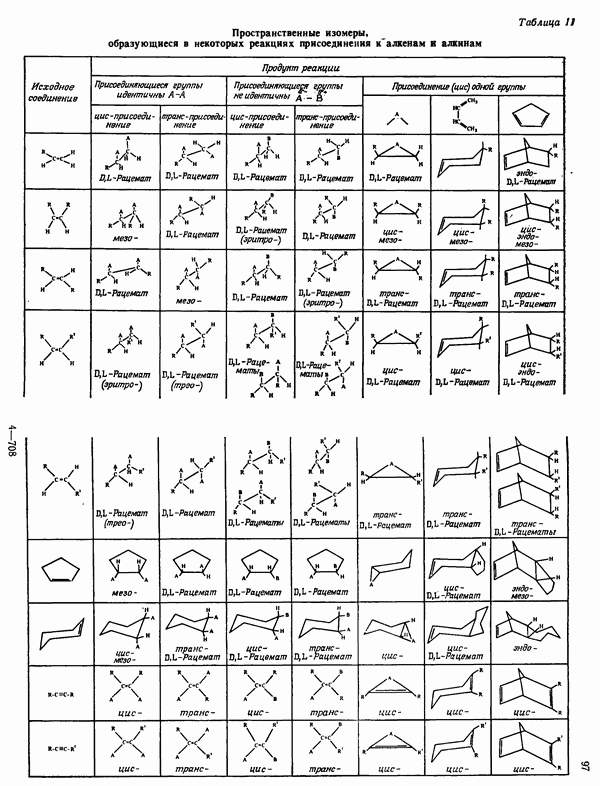
- СТЕРЕОИЗОМЕРНЫЕ ПРОДУКТЫ НЕКОТОРЫХ РЕАКЦИЙ ПРИСОЕДИНЕНИЯ
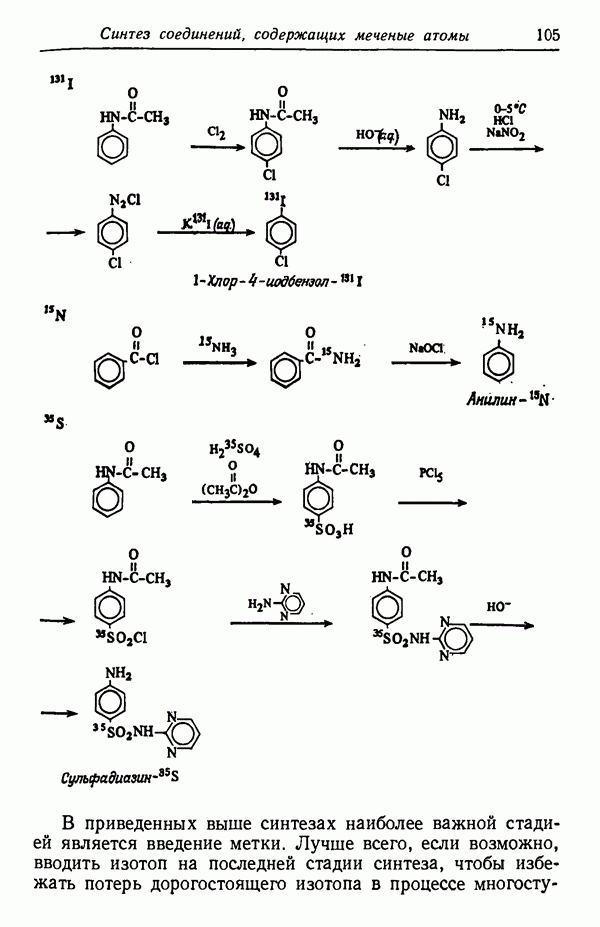
- Глава VI. СИНТЕЗ СОЕДИНЕНИЙ, СОДЕРЖАЩИХ МЕЧЕНЫЕ АТОМЫ (ИЗОТОПЫ)
- СИНТЕЗ МЕЧЕНЫХ СОЕДИНЕНИЙ
- МОЛЕКУЛЫ, СОДЕРЖАЩИЕ НЕСКОЛЬКО МЕТОК
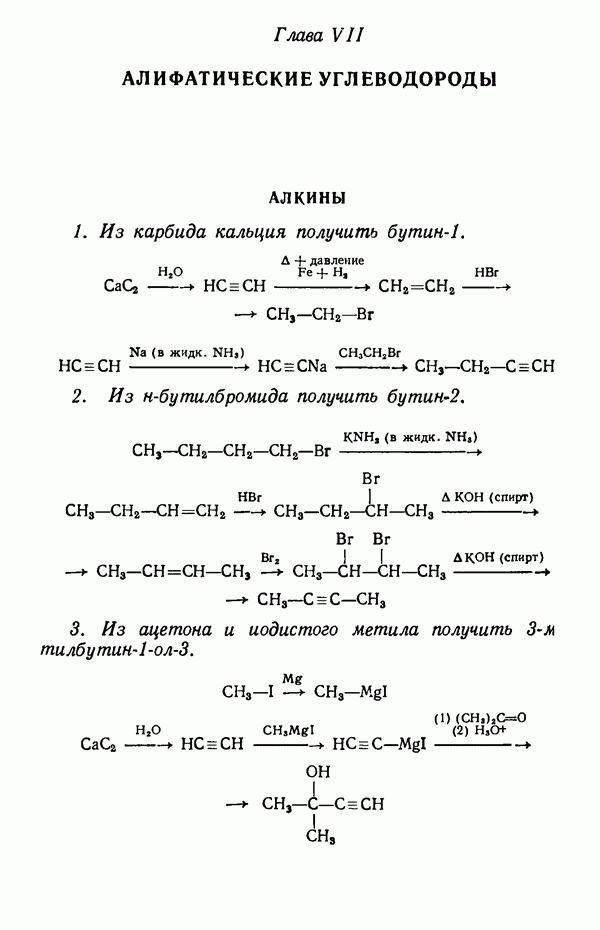
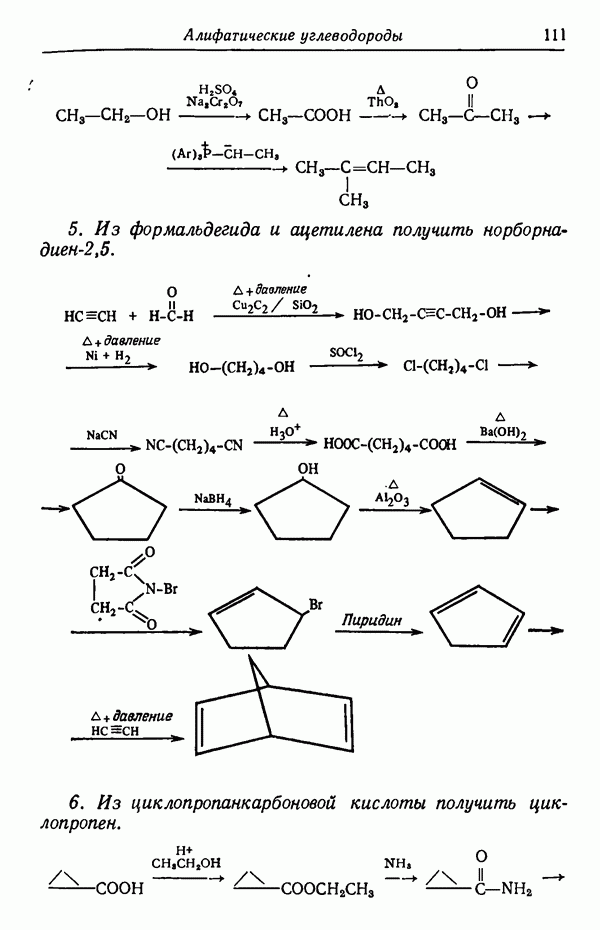
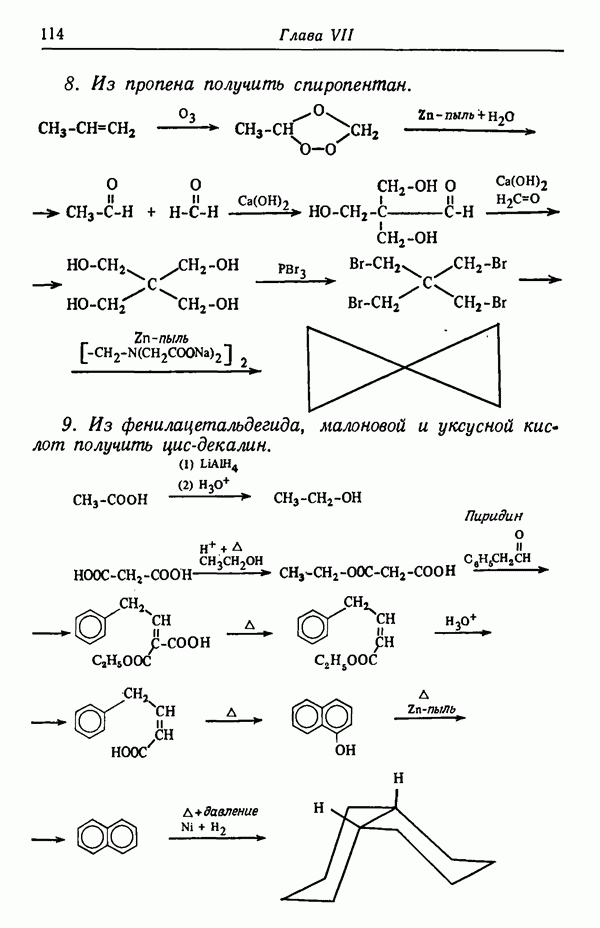
- Глава VII. АЛИФАТИЧЕСКИЕ УГЛЕВОДОРОДЫ
- Глава VIII. СОЕДИНЕНИЯ, СОДЕРЖАЩИЕ ФУНКЦИОНАЛЬНЫЕ ГРУППЫ
- Глава IX. ОДНОЯДЕРНЫЕ АРОМАТИЧЕСКИЕ СИСТЕМЫ