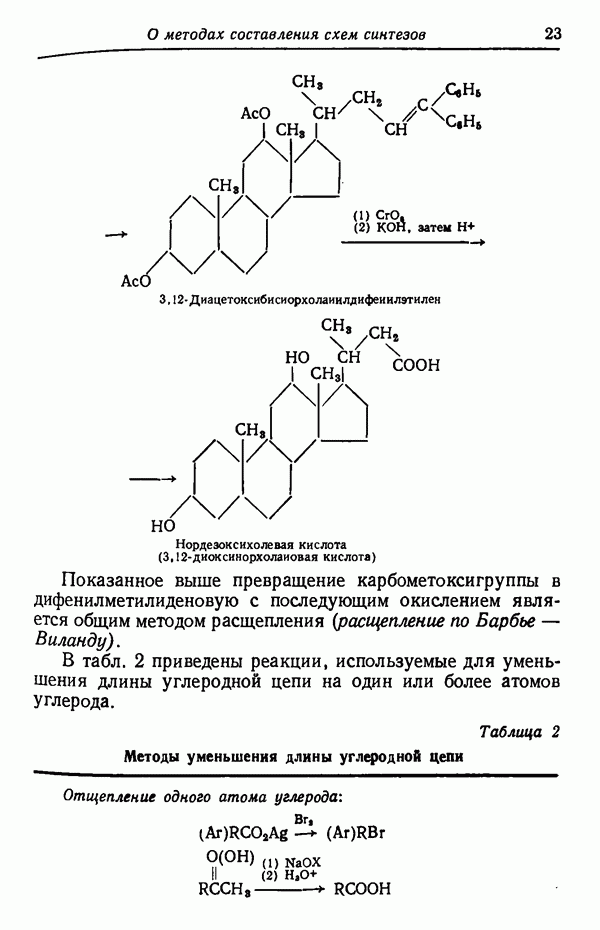
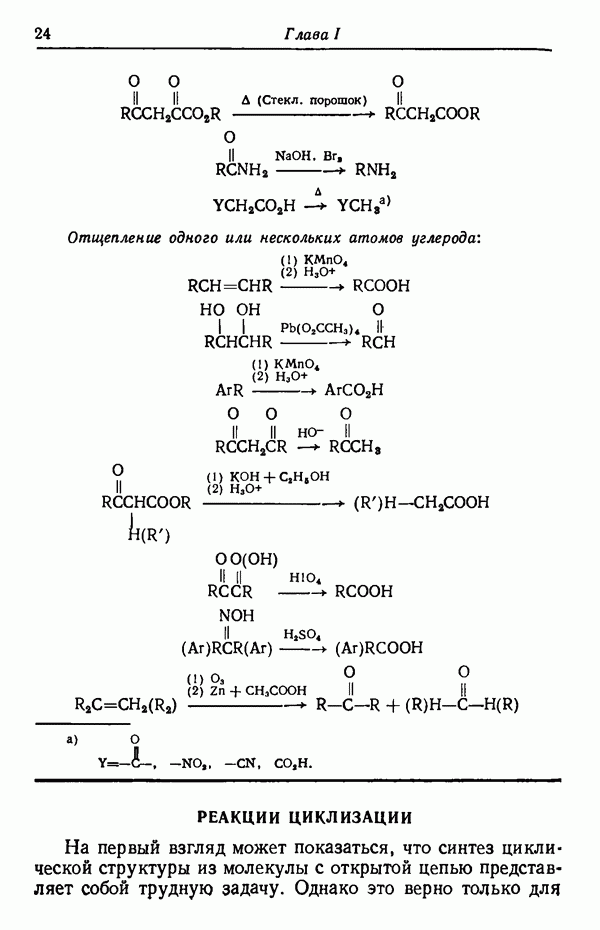
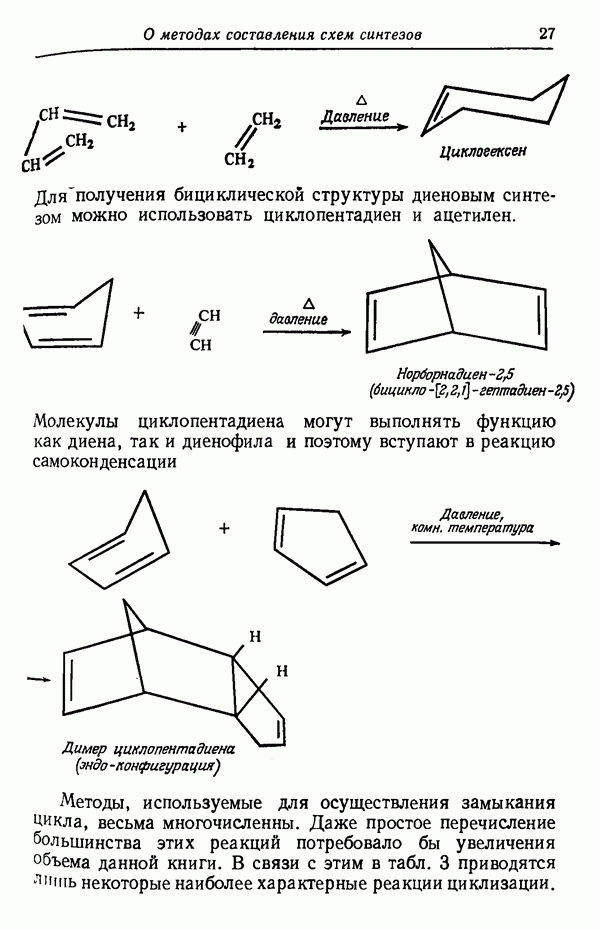
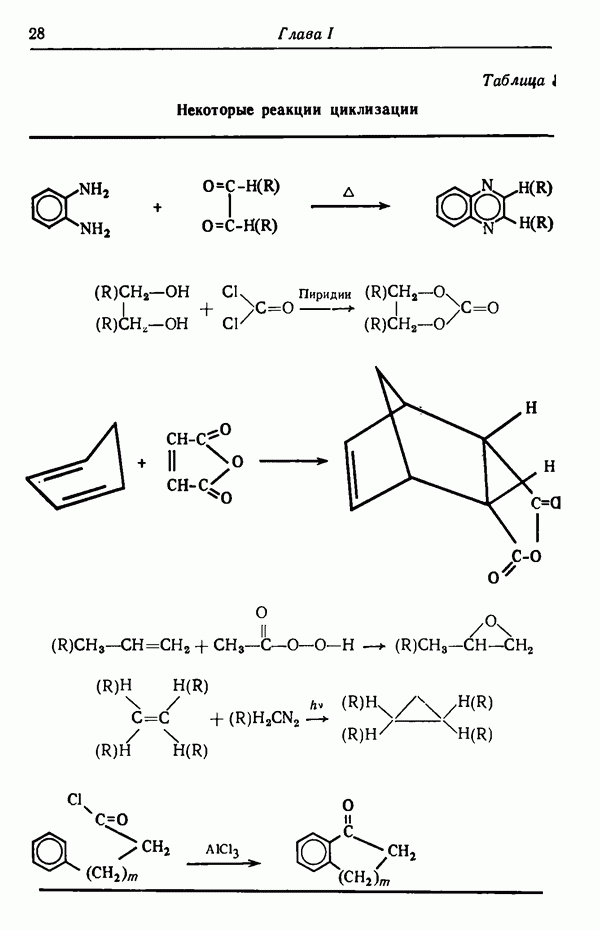
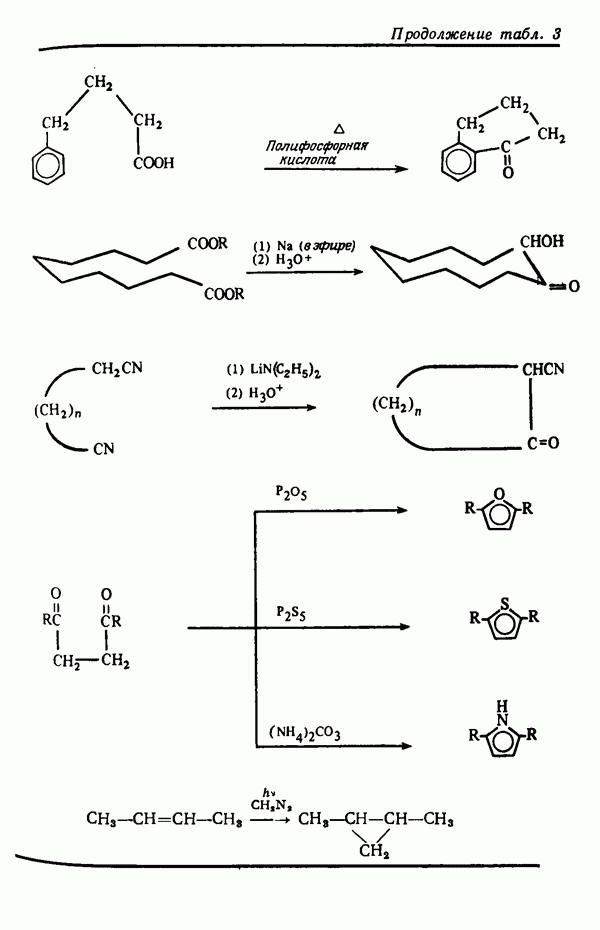
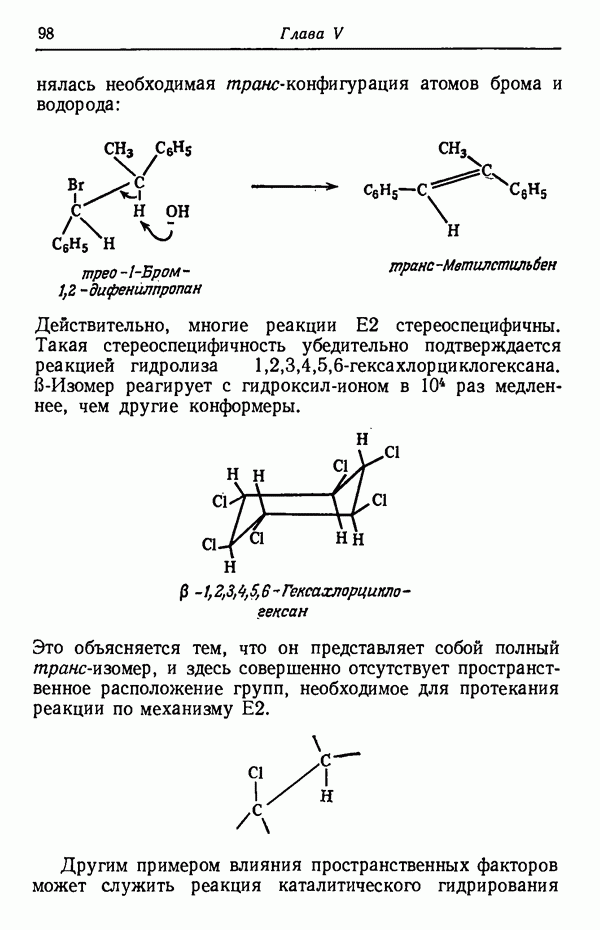
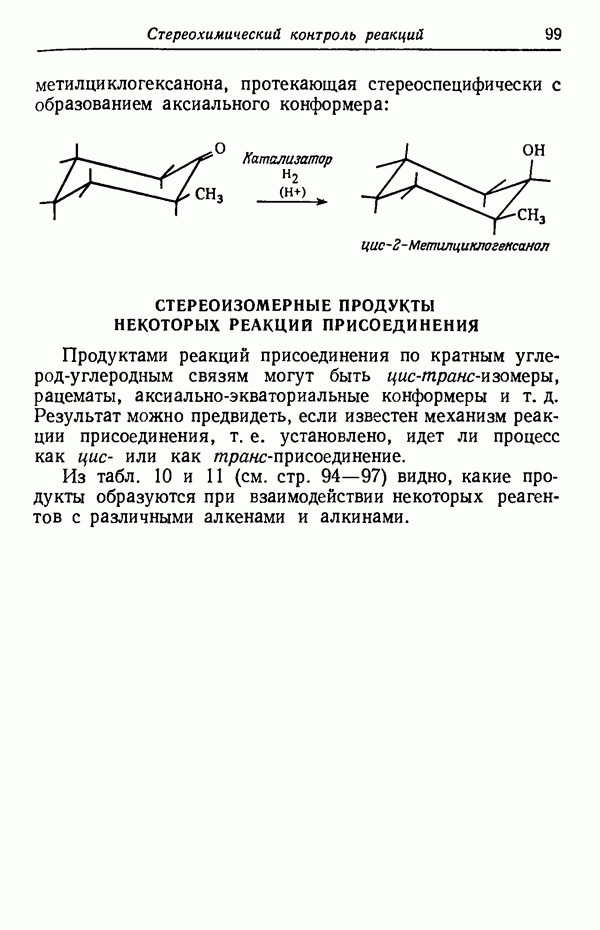
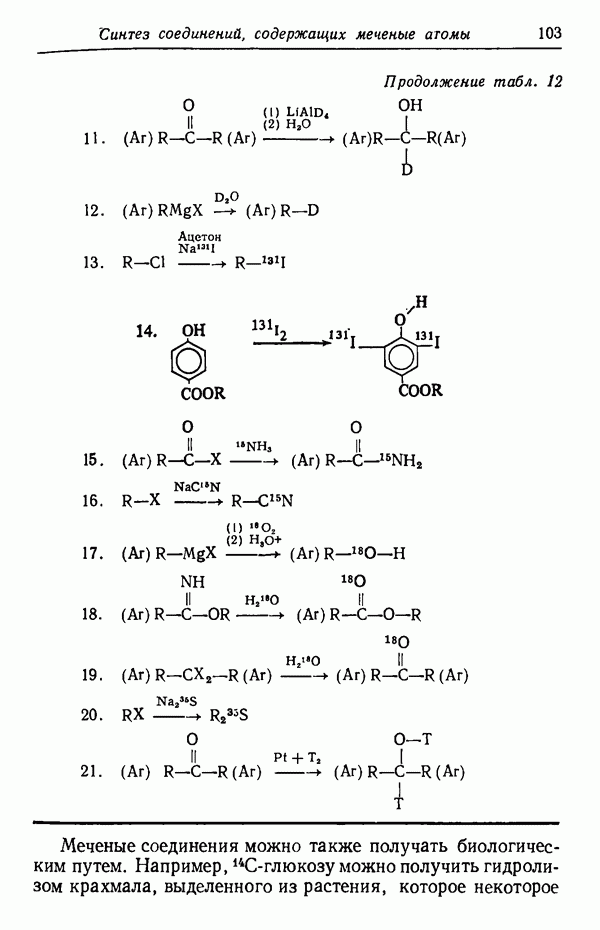
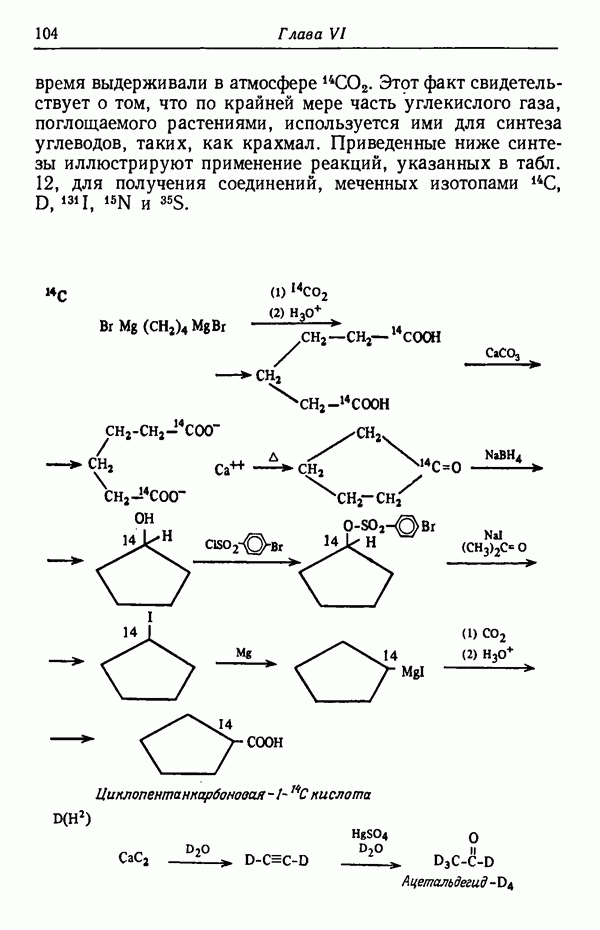
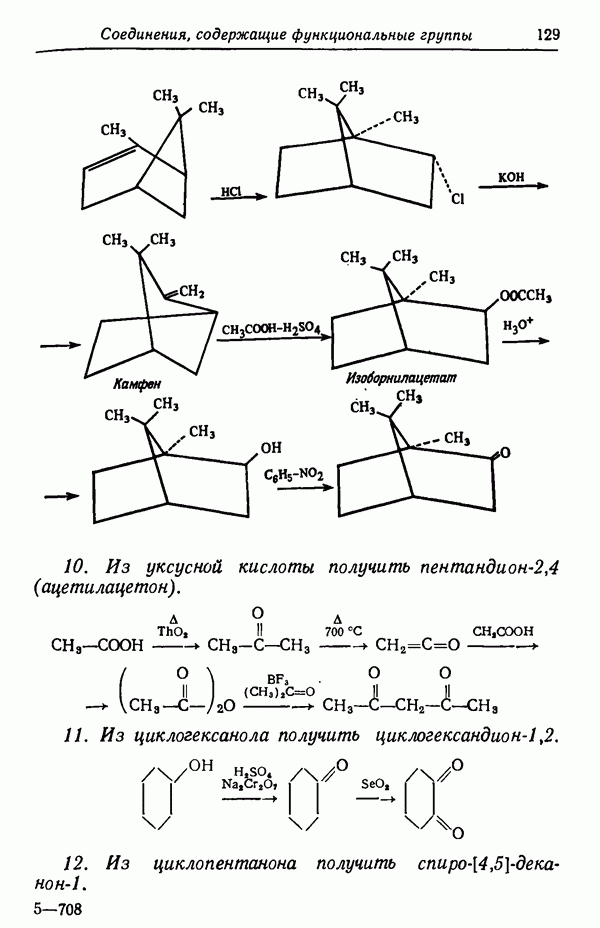
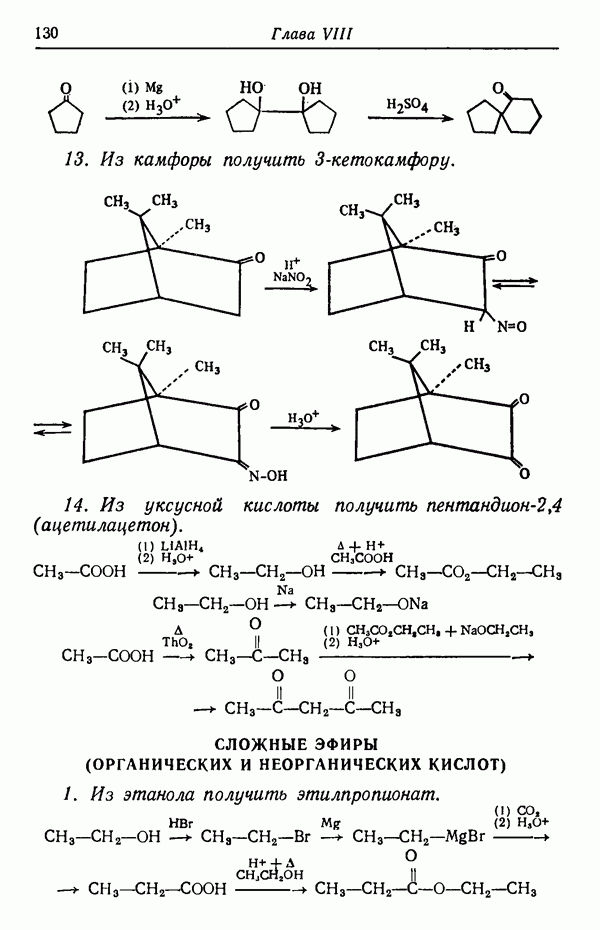
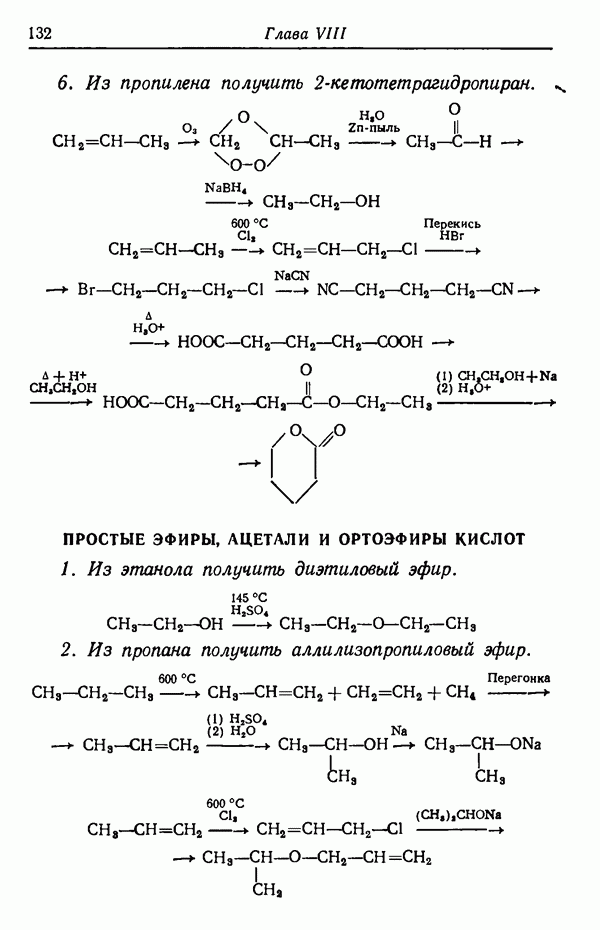
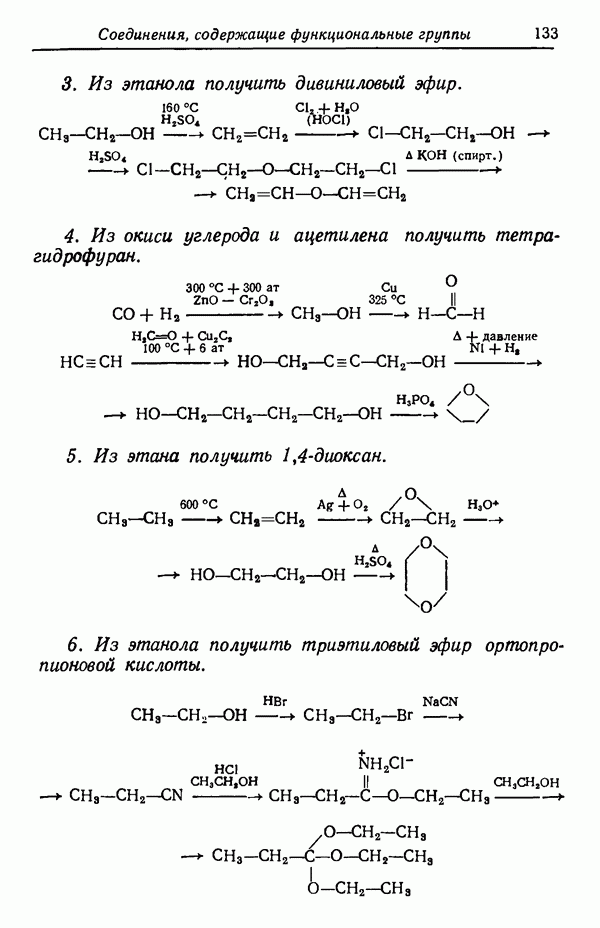
| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
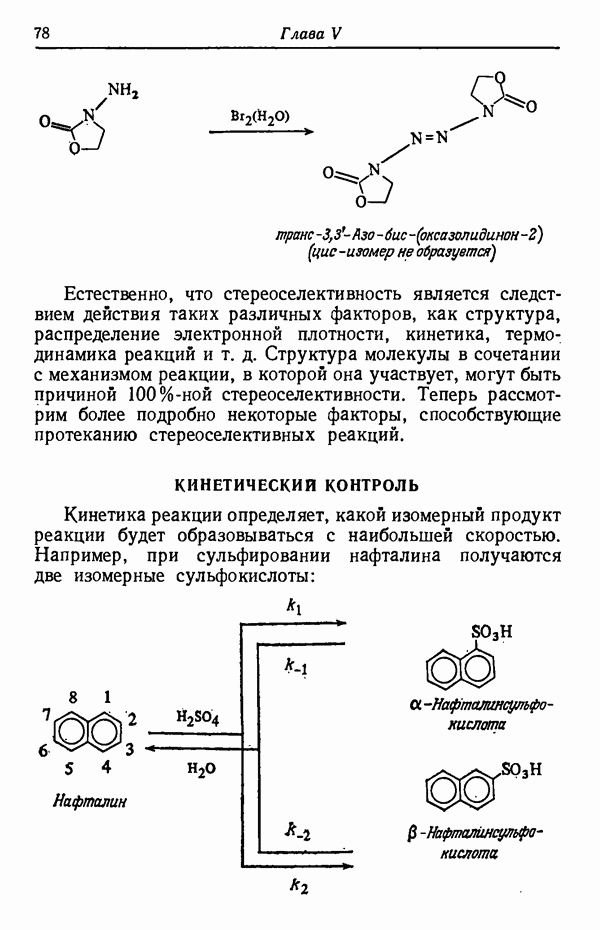
КИНЕТИЧЕСКИЙ КОНТРОЛЬ
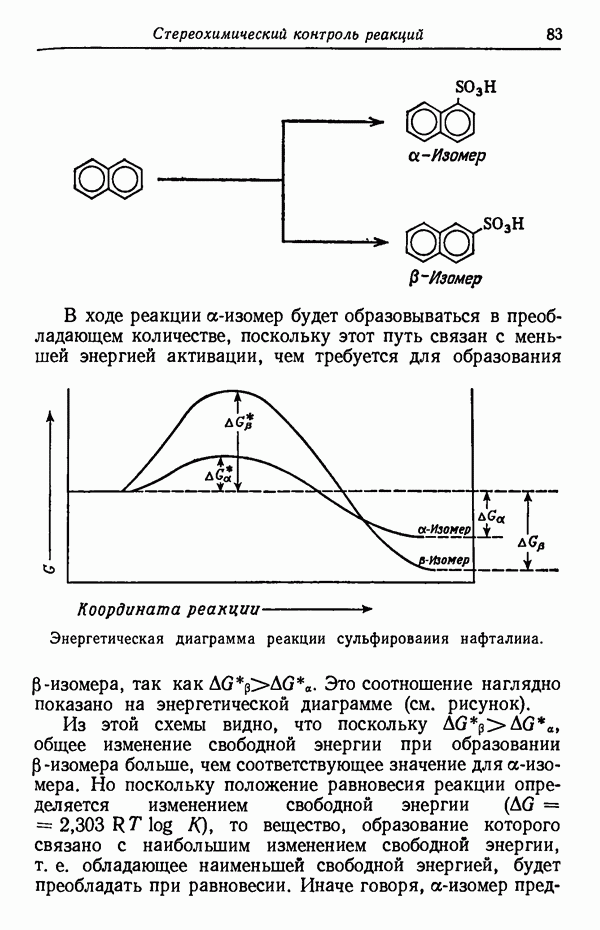
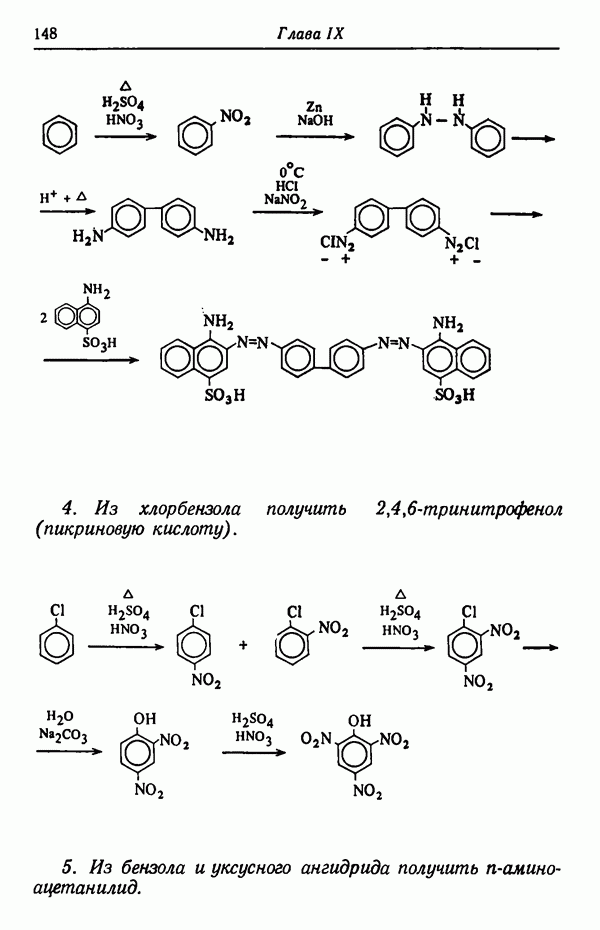
Кинетика реакции определяет, какой изомерный продукт реакции будет образовываться с наибольшей скоростью. Например, при сульфировании нафталина получаются две изомерные сульфокислоты:

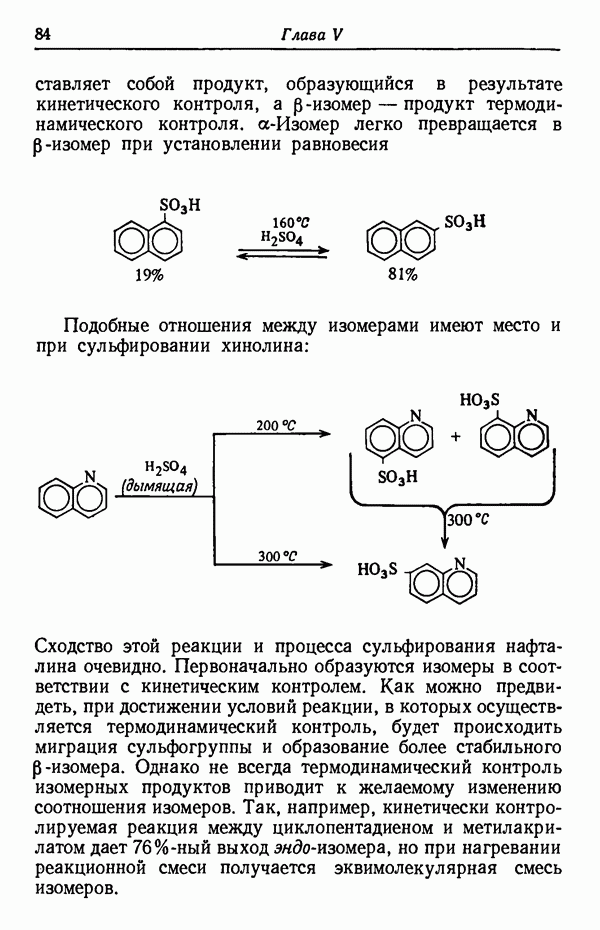
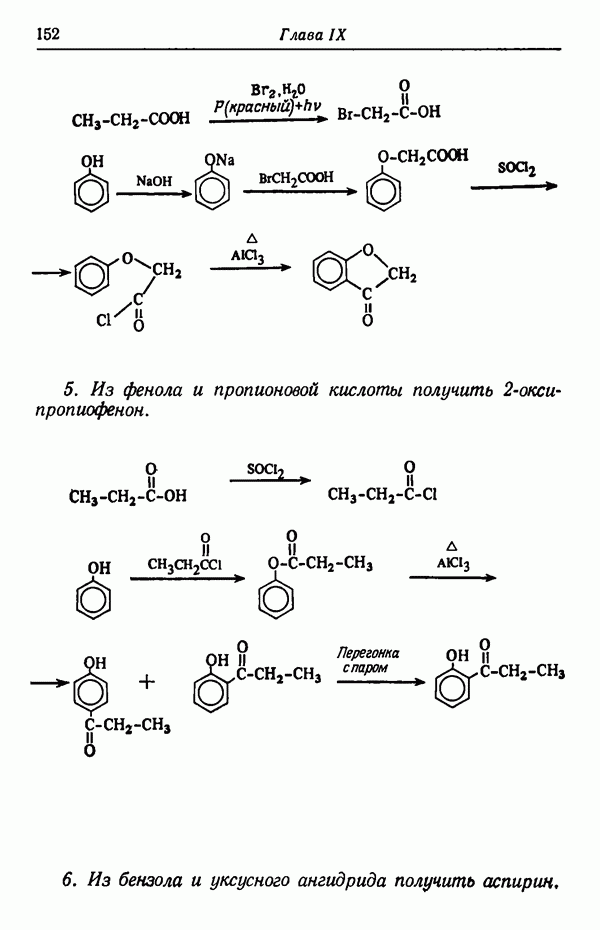
До тех пор пока реакция не достигла равновесия (реакция проводится при 80° С), скорость образования  -изомера намного больше, чем
-изомера намного больше, чем  Следовательно, основным продуктом реакции в условиях кинетического контроля является
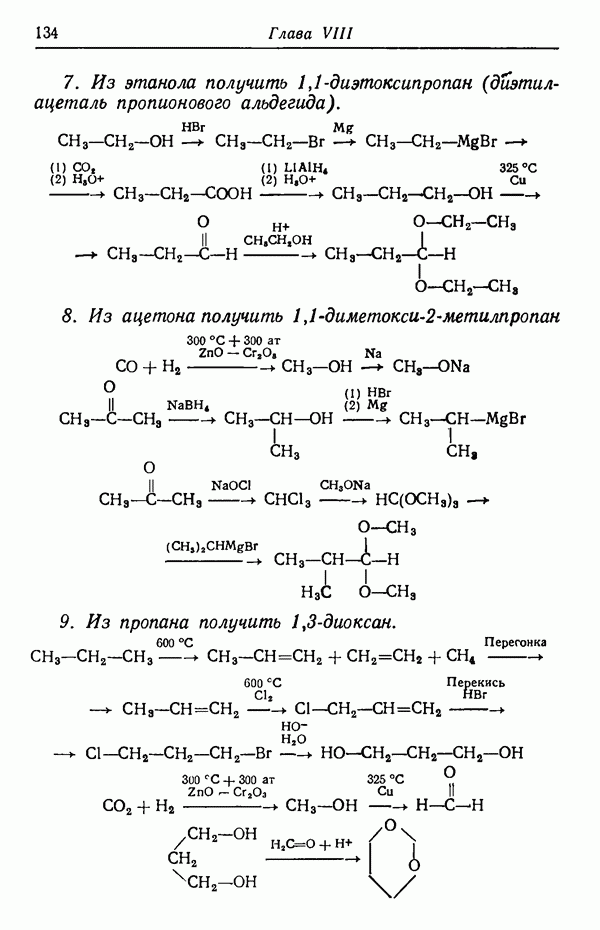
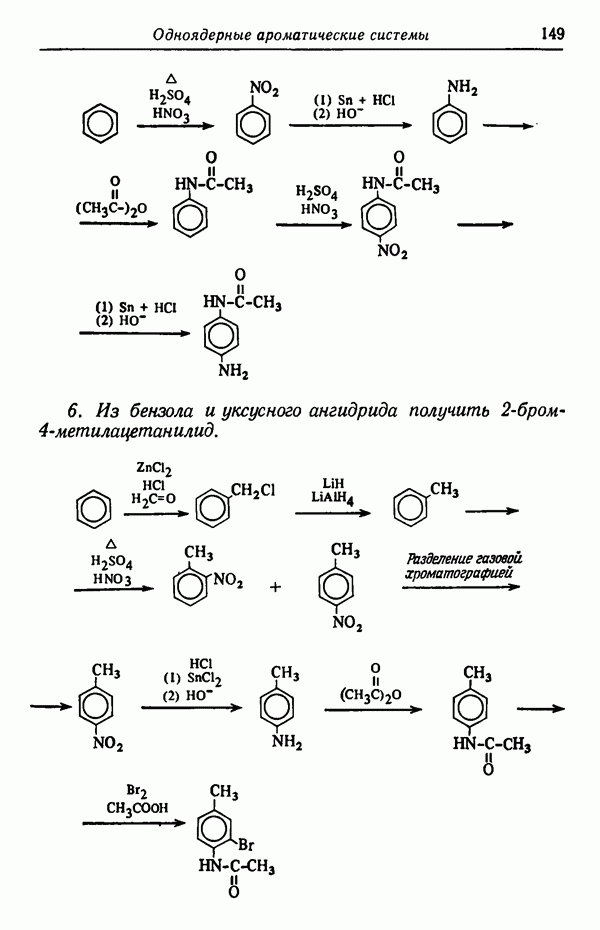
Следовательно, основным продуктом реакции в условиях кинетического контроля является  -изомер, так как данная температура реакции способствует наиболее быстрому его образованию. Интересно отметить, что
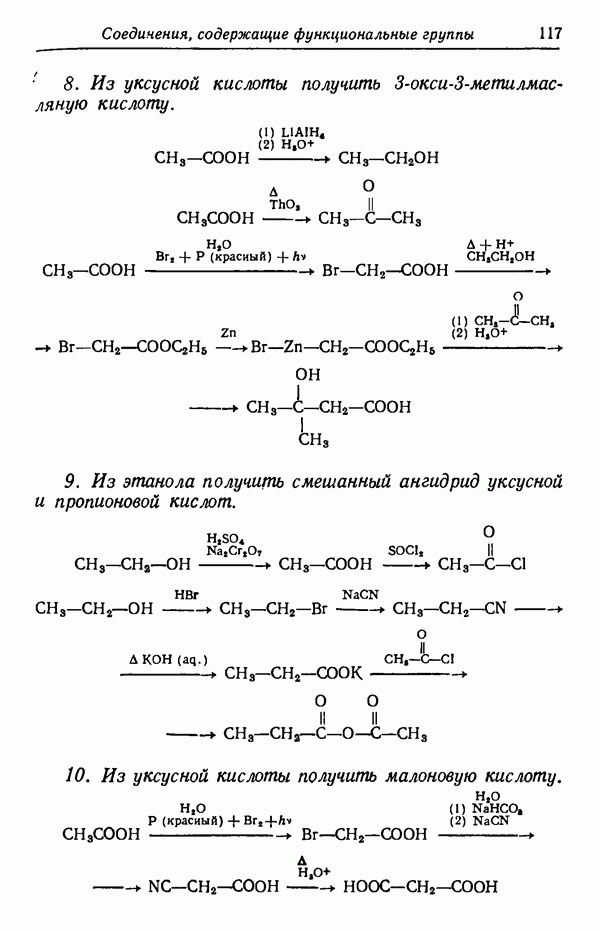
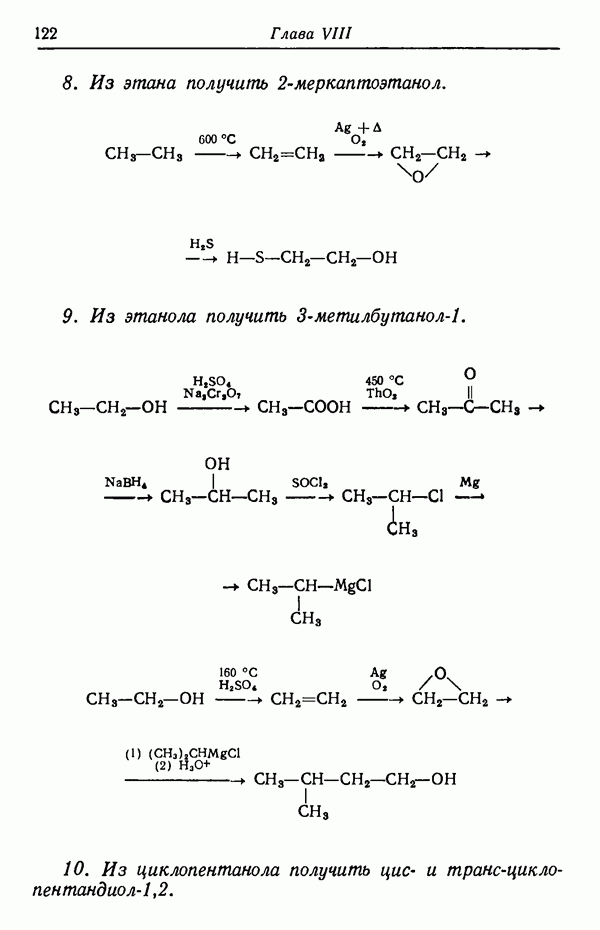
-изомер, так как данная температура реакции способствует наиболее быстрому его образованию. Интересно отметить, что  -изомер не обладает достаточной устойчивостью, так как из-за наличия атома водорода в
-изомер не обладает достаточной устойчивостью, так как из-за наличия атома водорода в  положении к сульфогруппе последняя находится в пространственно затрудненном состоянии. Действительно, кинетически контролируемые процессы довольно часто приводят к образованию термодинамически менее стабильных изомеров,
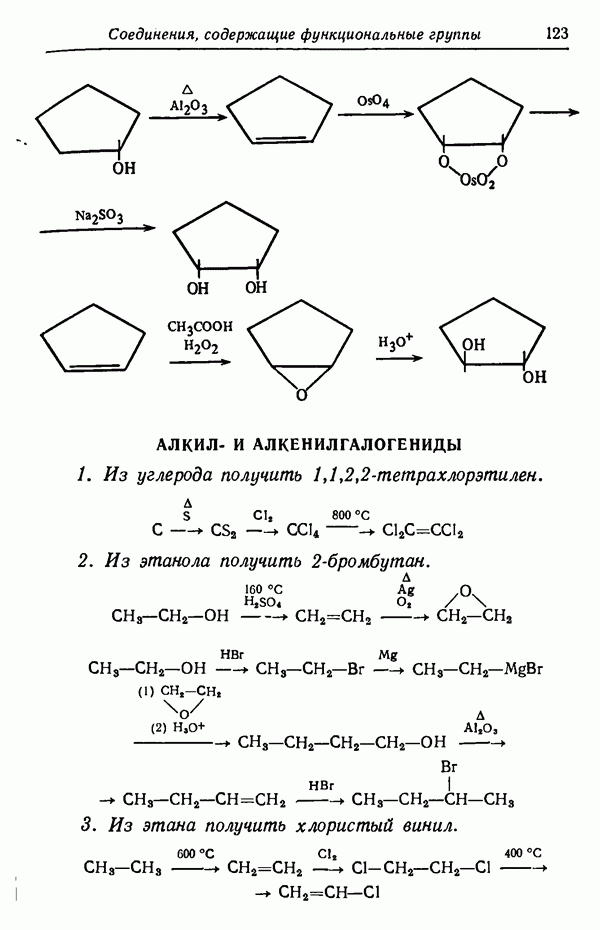
положении к сульфогруппе последняя находится в пространственно затрудненном состоянии. Действительно, кинетически контролируемые процессы довольно часто приводят к образованию термодинамически менее стабильных изомеров,  -Изомер пространственно не затруднен и потому более стабилен. При более высоких температурах (порядка 160° С) образуется почти исключительно
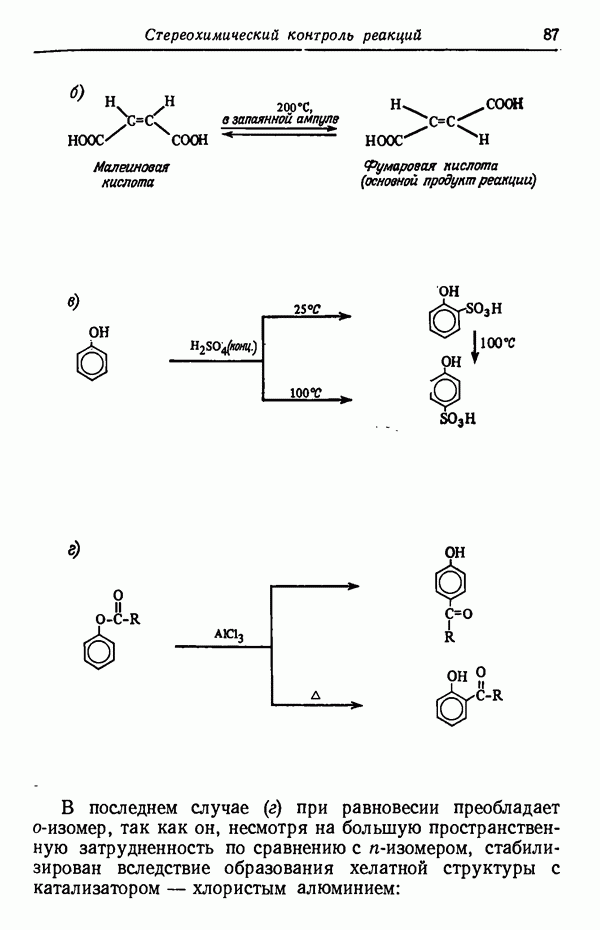
-Изомер пространственно не затруднен и потому более стабилен. При более высоких температурах (порядка 160° С) образуется почти исключительно  -изомер. Причины предпочтительности образования изомеров будут обсуждены в разделе, посвященном термодинамическому контролю (стр. 82). Температурный режим реакции имеет обычно существенное значение и может оказать определяющее влияние на течение реакции. Считается, что при повышении температуры на 10 ° С скорость реакции увеличивается примерно вдвое. Однако при изменении температуры на 10 ° С скорости различных реакций изменяются не совсем одинаково.
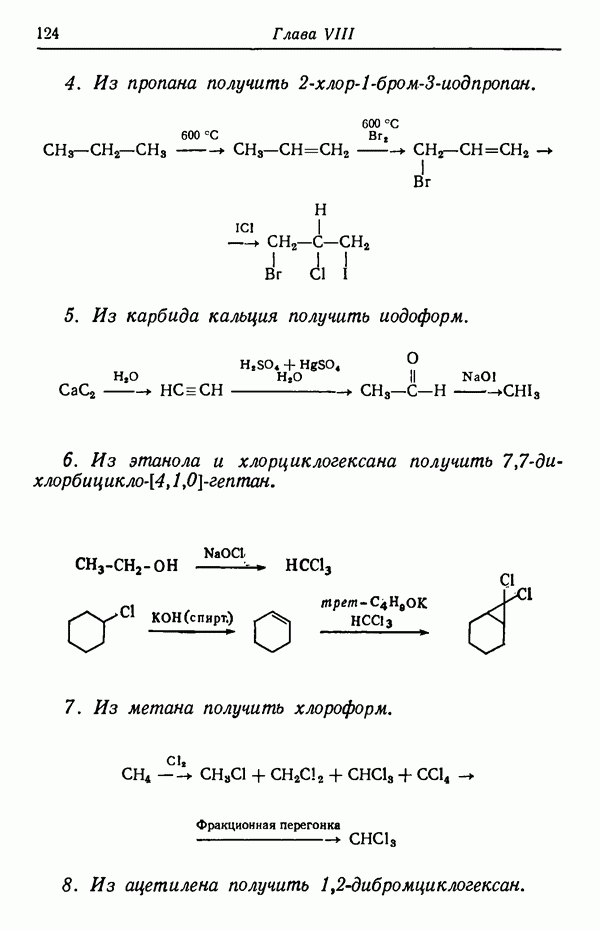
-изомер. Причины предпочтительности образования изомеров будут обсуждены в разделе, посвященном термодинамическому контролю (стр. 82). Температурный режим реакции имеет обычно существенное значение и может оказать определяющее влияние на течение реакции. Считается, что при повышении температуры на 10 ° С скорость реакции увеличивается примерно вдвое. Однако при изменении температуры на 10 ° С скорости различных реакций изменяются не совсем одинаково.
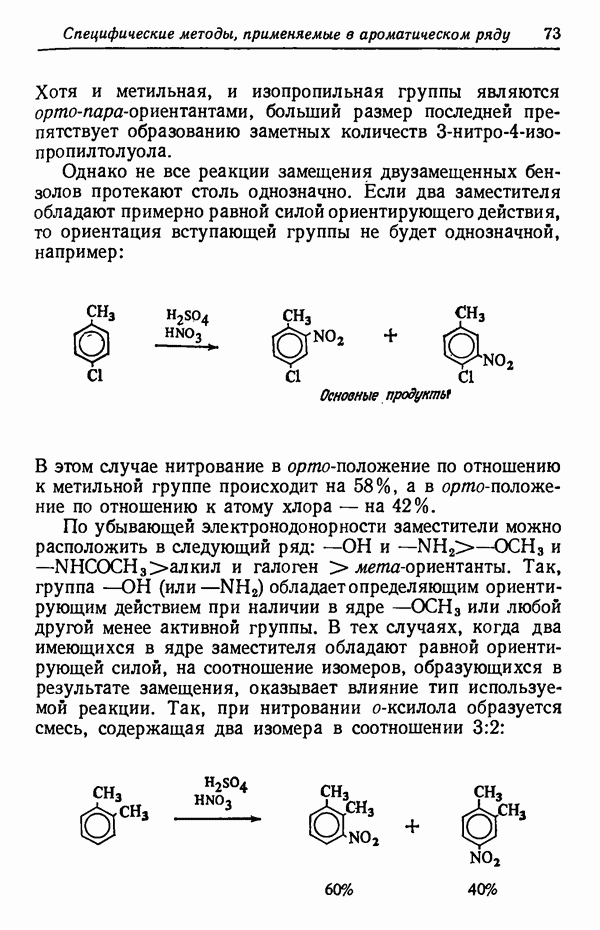
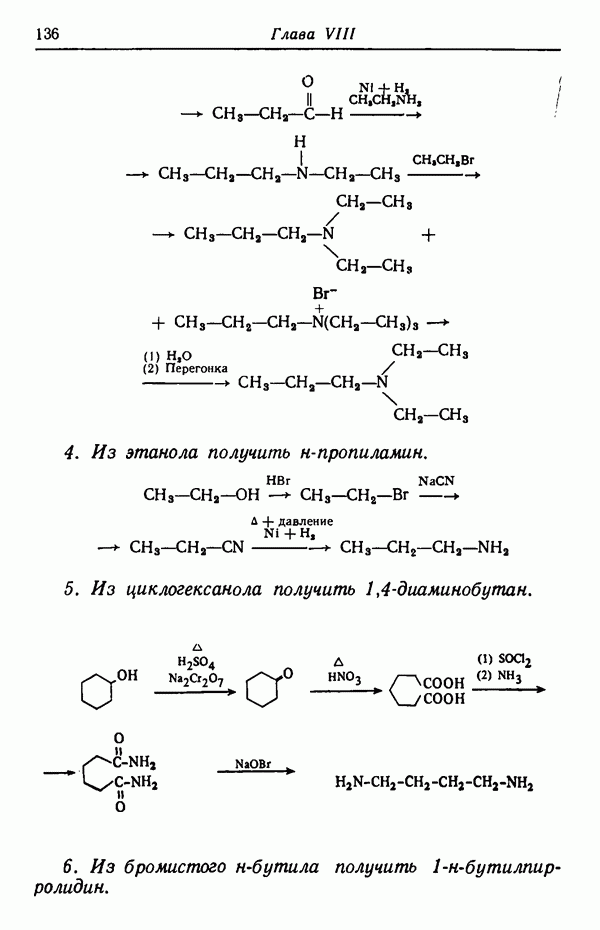
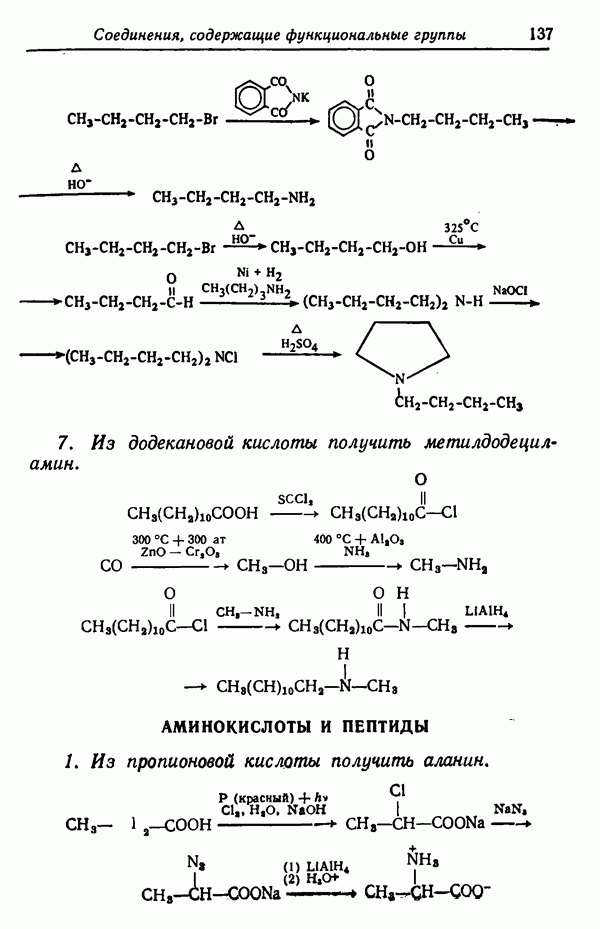
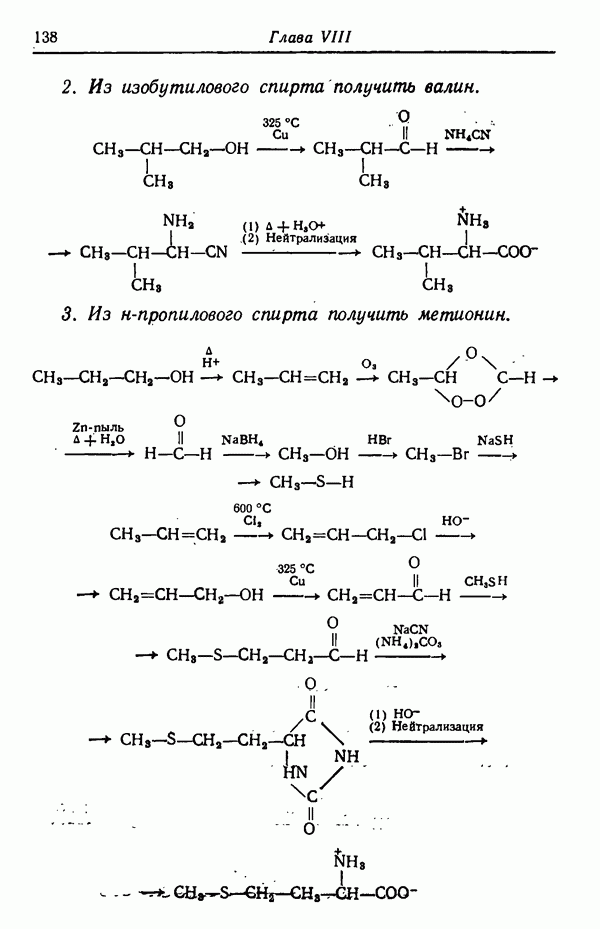
Различие в изменении скорости при изменении температуры может обусловливать значительное изменение соотношения изомеров, получаемых в некоторых реакциях. Рассмотрим случай, когда вещество  взаимодействуя с реагентами, дает соединения
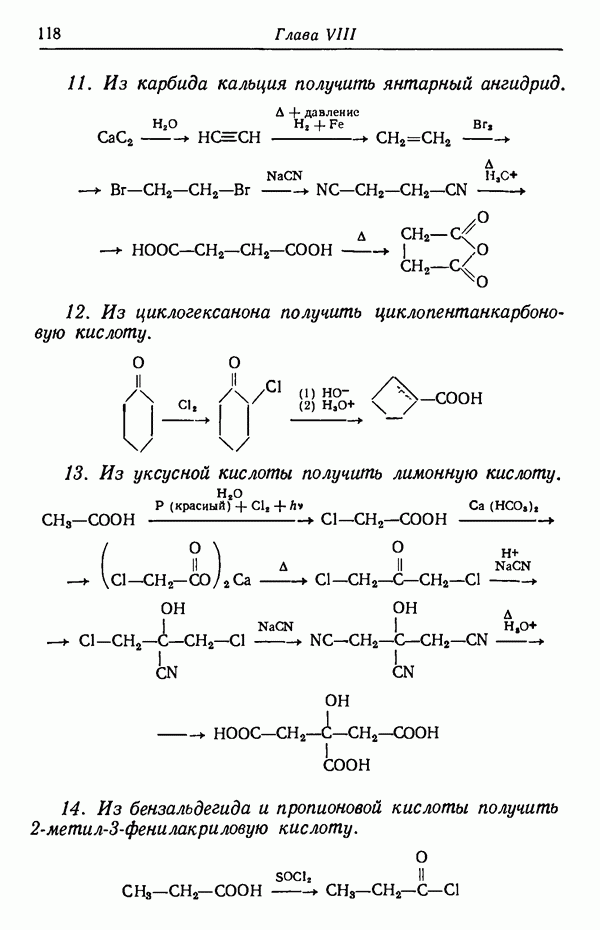
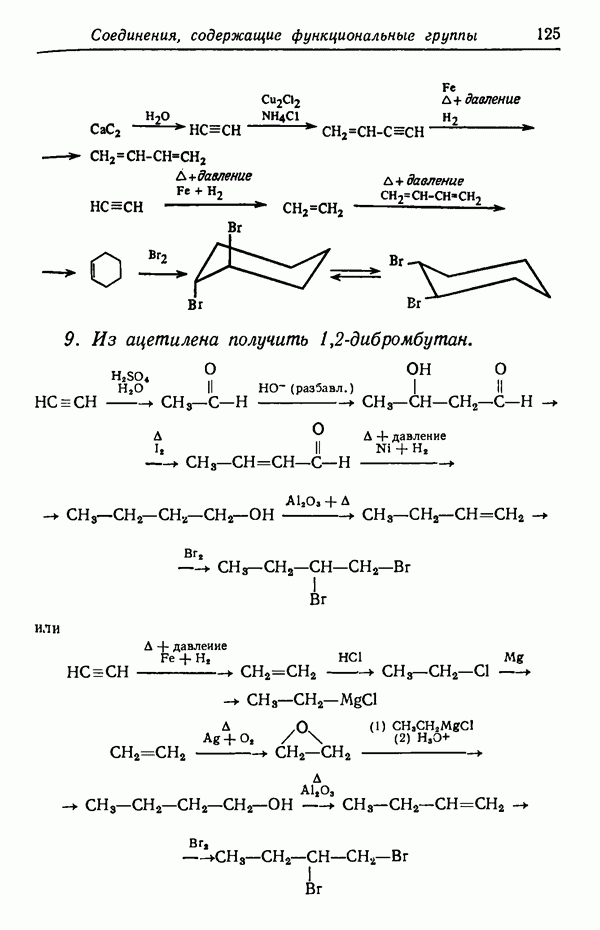
взаимодействуя с реагентами, дает соединения 

Предположим, что скорость реакции  увеличивается в два раза при повышении температуры на 10° С, а скорость
увеличивается в два раза при повышении температуры на 10° С, а скорость
реакции возрастает при этом в три раза. Допустим, что при 30° С скорости этих двух реакций равны  т. е. образуется смесь равных количеств
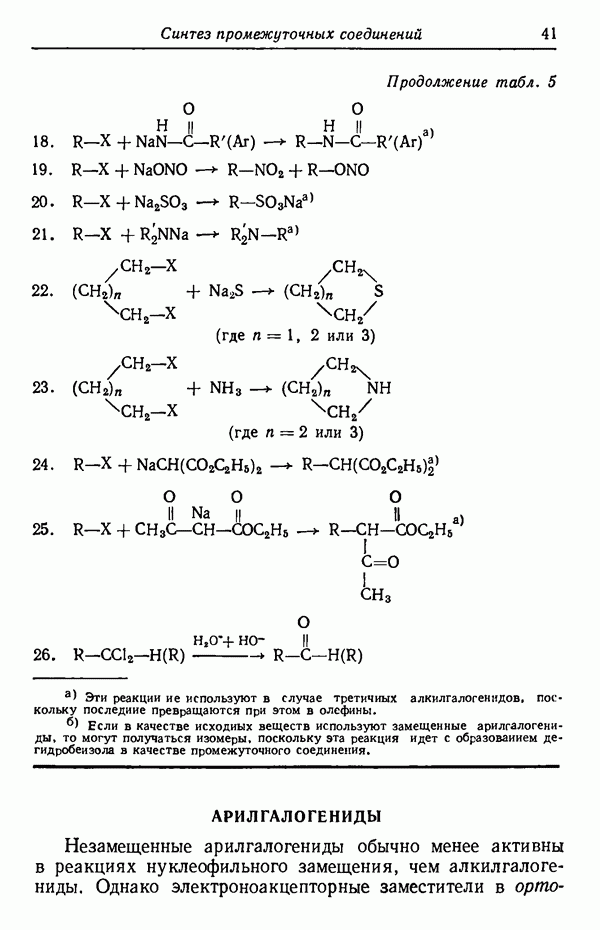
т. е. образуется смесь равных количеств  Если теперь повысить температуру реакции до 80° С (увеличить на 50° С), т. е. увеличить пять раз по 10° С, то скорость реакции удвоится пять раз, т. е. возрастет в 25, или в 32 раза. Скорость же реакции
Если теперь повысить температуру реакции до 80° С (увеличить на 50° С), т. е. увеличить пять раз по 10° С, то скорость реакции удвоится пять раз, т. е. возрастет в 25, или в 32 раза. Скорость же реакции  утроится пять раз и, следовательно, увеличится в
утроится пять раз и, следовательно, увеличится в  или в 243 раза. Скорости образования
или в 243 раза. Скорости образования  станут соответственно равны:
станут соответственно равны:

что соответствует соотношению  Выходы
Выходы  составят
составят

При температуре 130° С выход  будет равен соответственно 2 и 98%. Если температуру понизить до —20°С (на 50° С), то соотношение
будет равен соответственно 2 и 98%. Если температуру понизить до —20°С (на 50° С), то соотношение  станет равным
станет равным  т. е. будет обратным соотношению их при
т. е. будет обратным соотношению их при  Это приведет к тому, что продукты реакции будут содержать 88%
Это приведет к тому, что продукты реакции будут содержать 88% 
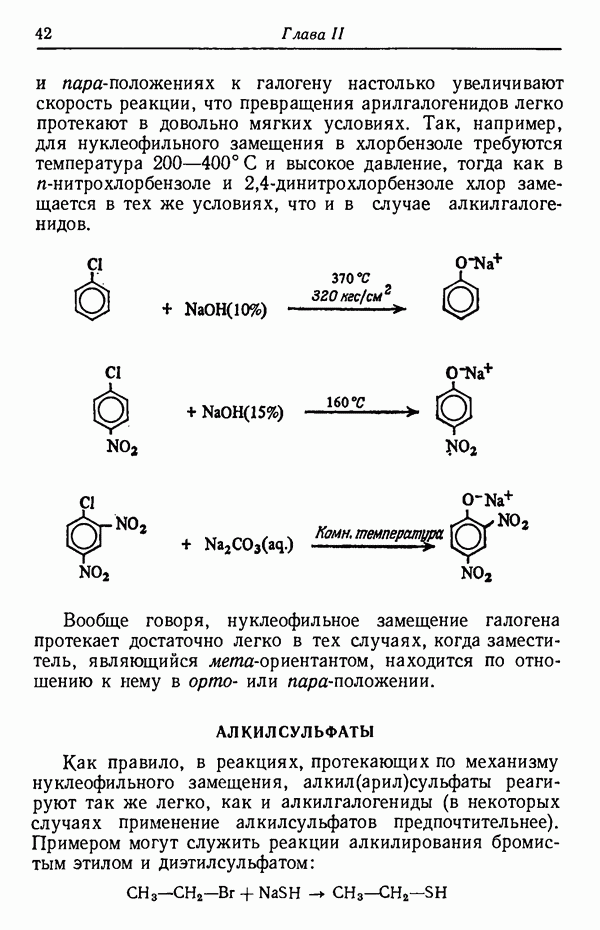
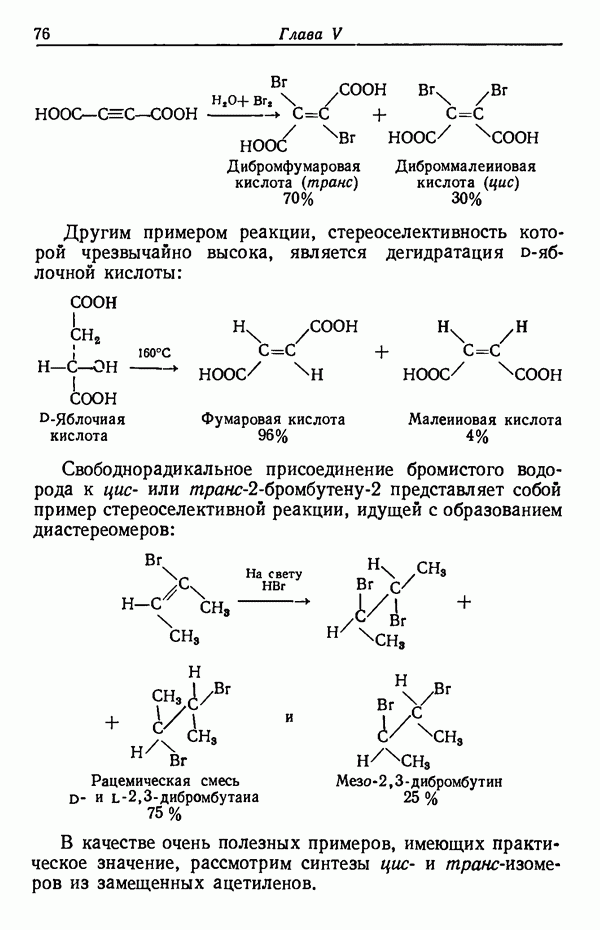
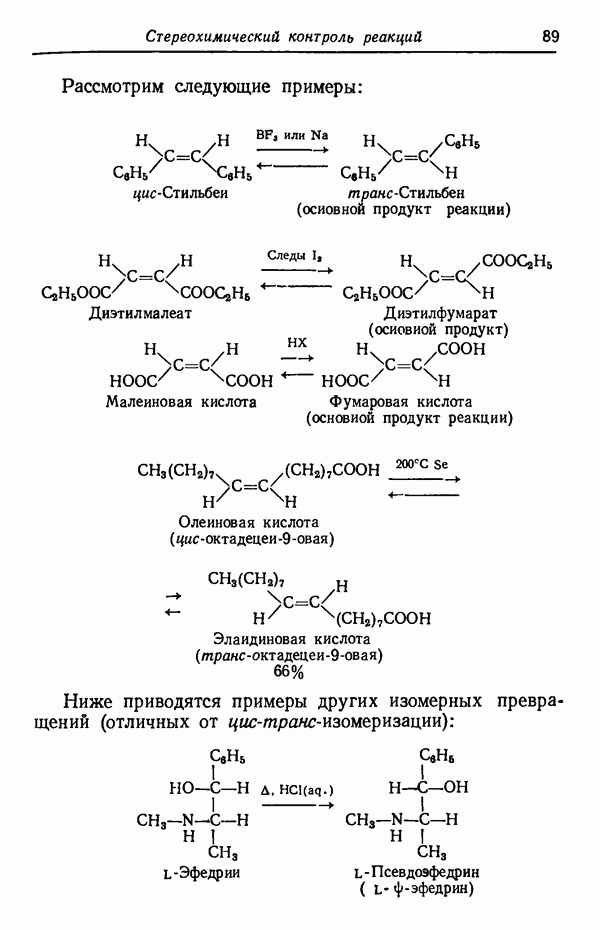
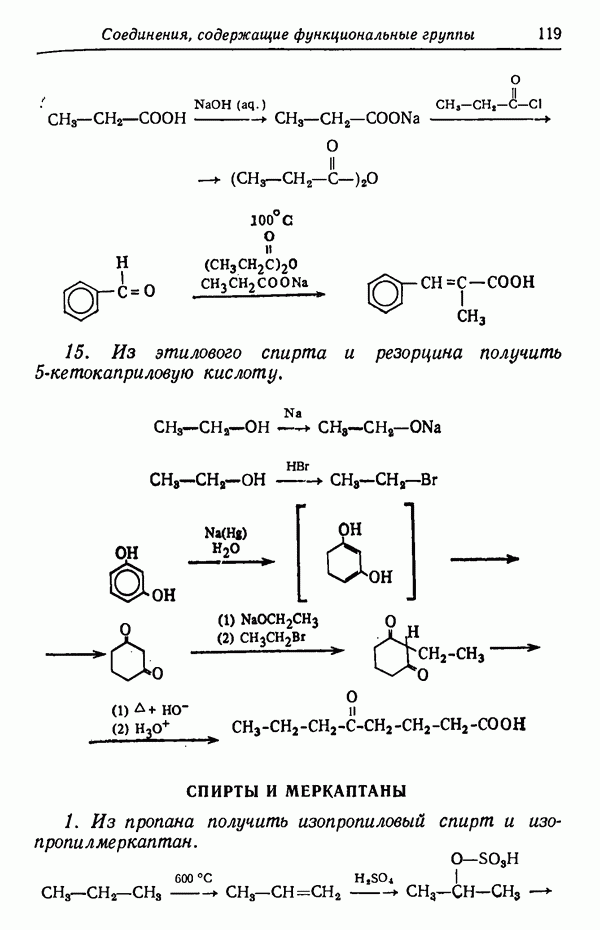
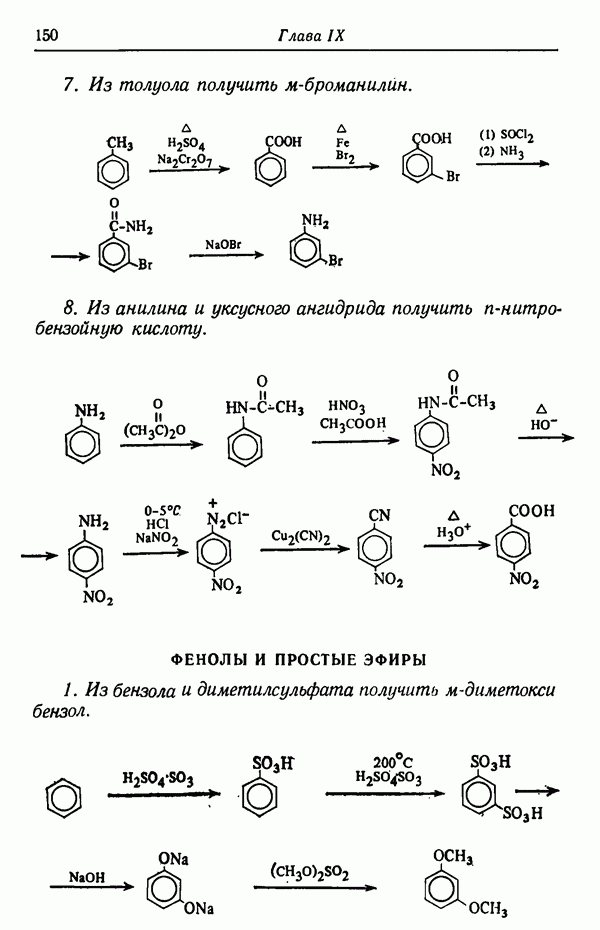
Менее контрастным, но вполне наглядным примером влияния температуры реакции на соотношение получающихся изомеров служит реакция сульфирования толуола.

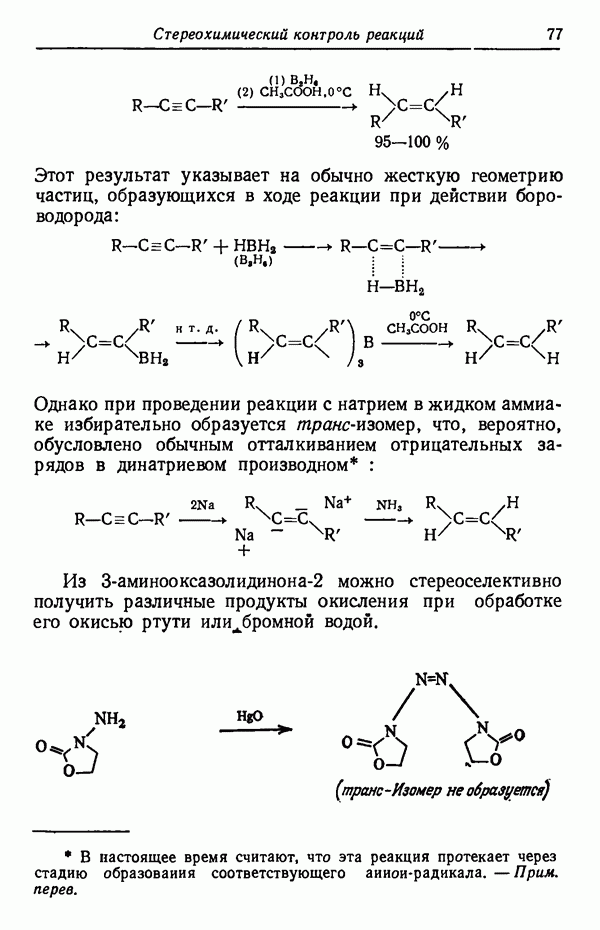
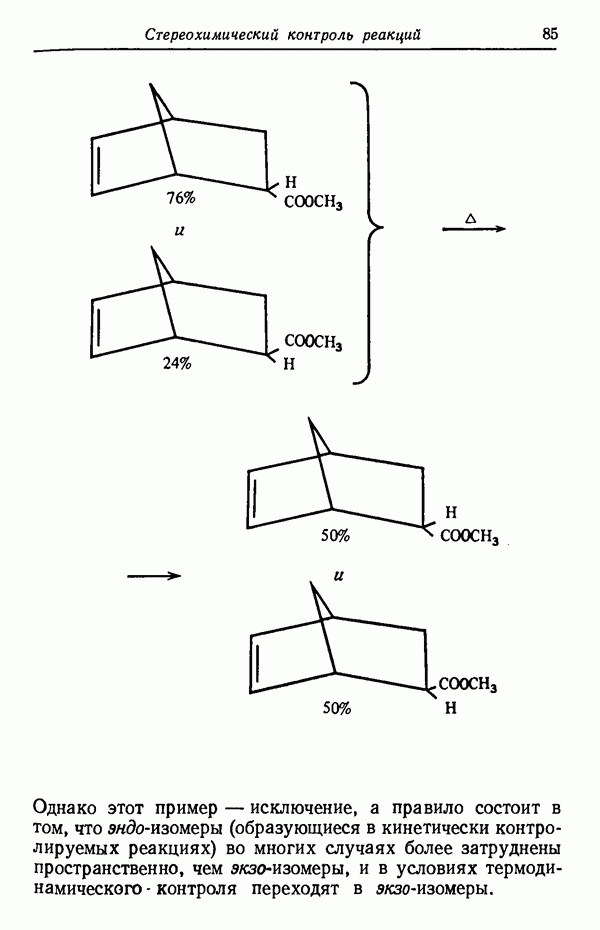
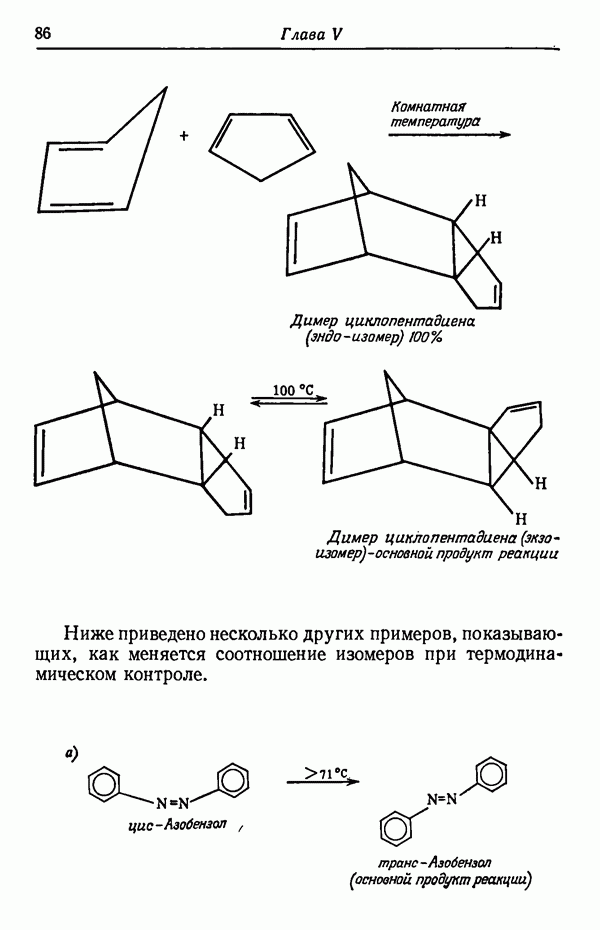
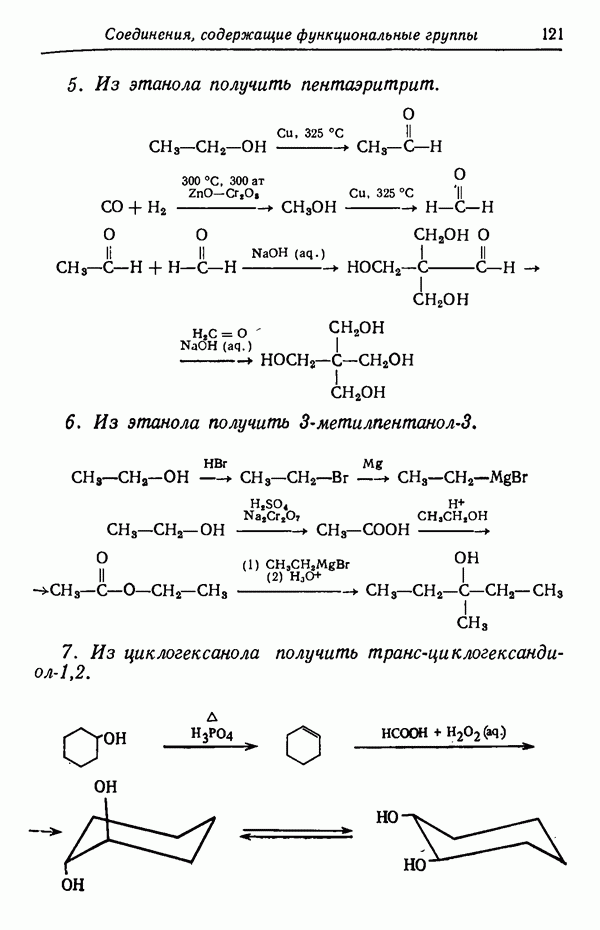
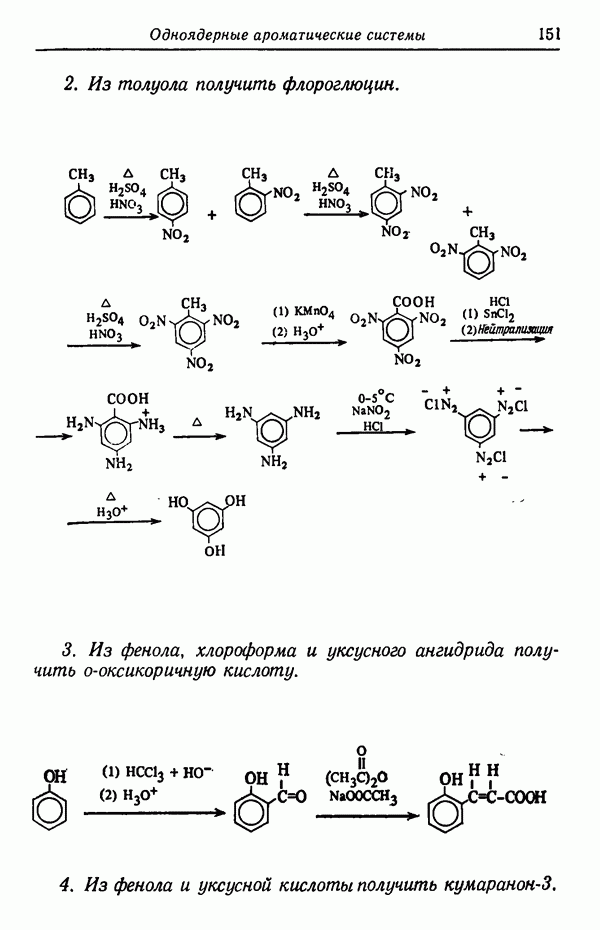
Влияние кинетических факторов на выход изомерных продуктов можно проиллюстрировать также синтезом эндо-и экзо-изомеров замещенного норборнена.

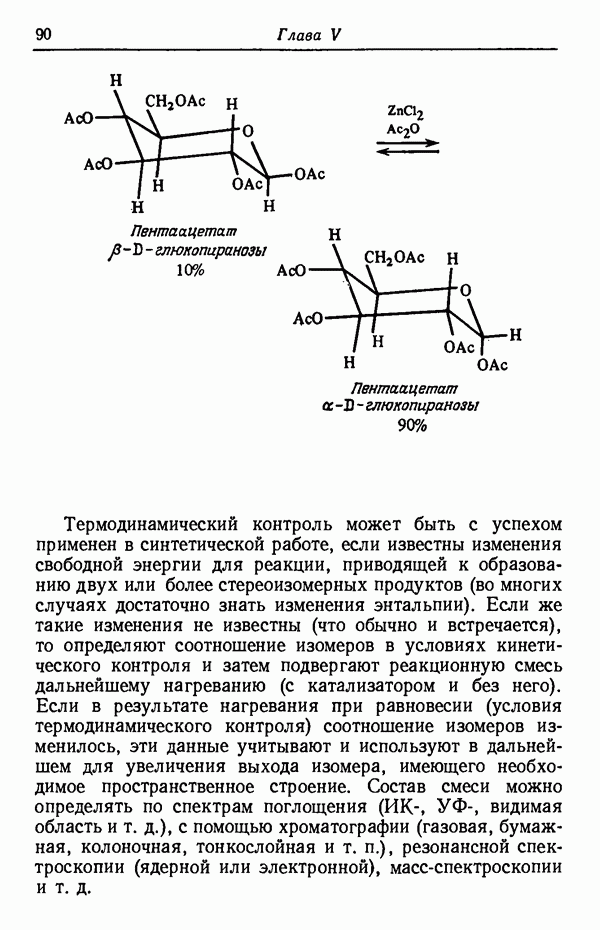
эндо-Форма образуется с большей скоростью. Очевидно, что если цель синтеза в получении лишь одного из двух возможных стереоизомеров, то она должна быть достигнута проведением реакции при такой температуре (низкой или высокой), когда соотношение скоростей образования обоих изомеров наиболее благоприятствует преимущественному получению того из них, который необходим. Если кинетика реакции неизвестна, то потребуется поставить несколько опытов при различных температурах и изучить изменение соотношения количества образующихся изомеров. Напомним, что если реакционную смесь выдерживать в течение длительного времени после того, как получено основное количество продукта реакции, то начинает осуществляться термодинамический контроль, и первоначальные результаты могут существенно измениться.
| << Предыдущий параграф | Следующий параграф >> |
- ПРЕДИСЛОВИЕ
- Глава I. О МЕТОДАХ СОСТАВЛЕНИЯ СХЕМ МНОГОСТАДИЙНЫХ СИНТЕЗОВ
- СОСТАВЛЕНИЕ СХЕМЫ СИНТЕЗА, ИСХОДЯ ИЗ КОНЕЧНОГО СОЕДИНЕНИЯ
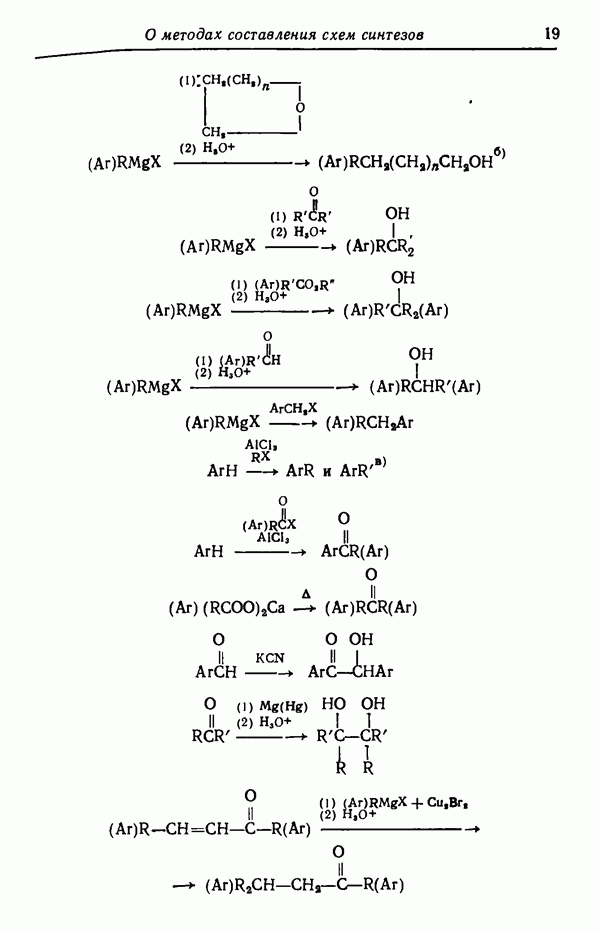
- НАРАЩИВАНИЕ УГЛЕРОДНОЙ ЦЕПИ
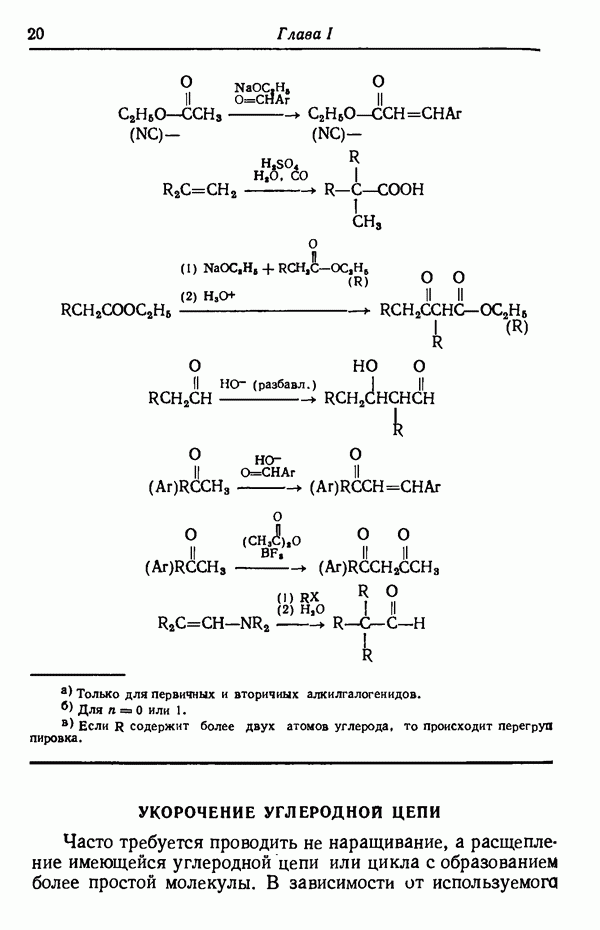
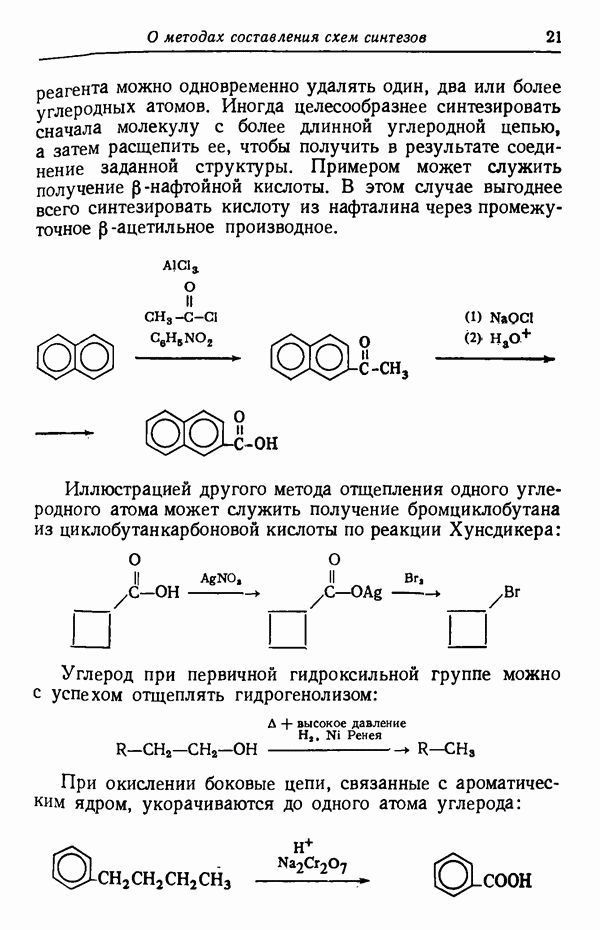
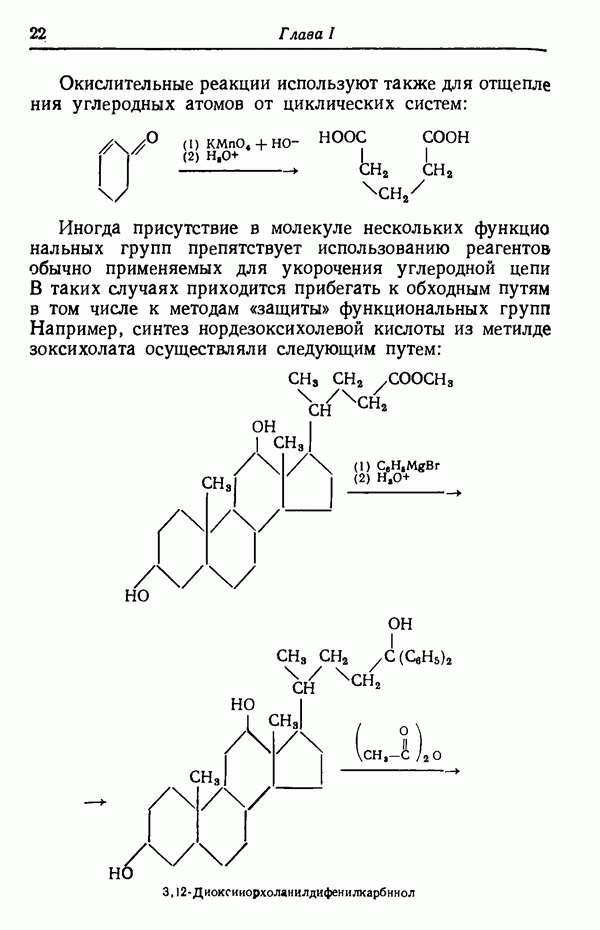
- УКОРОЧЕНИЕ УГЛЕРОДНОЙ ЦЕПИ
- РЕАКЦИИ ЦИКЛИЗАЦИИ
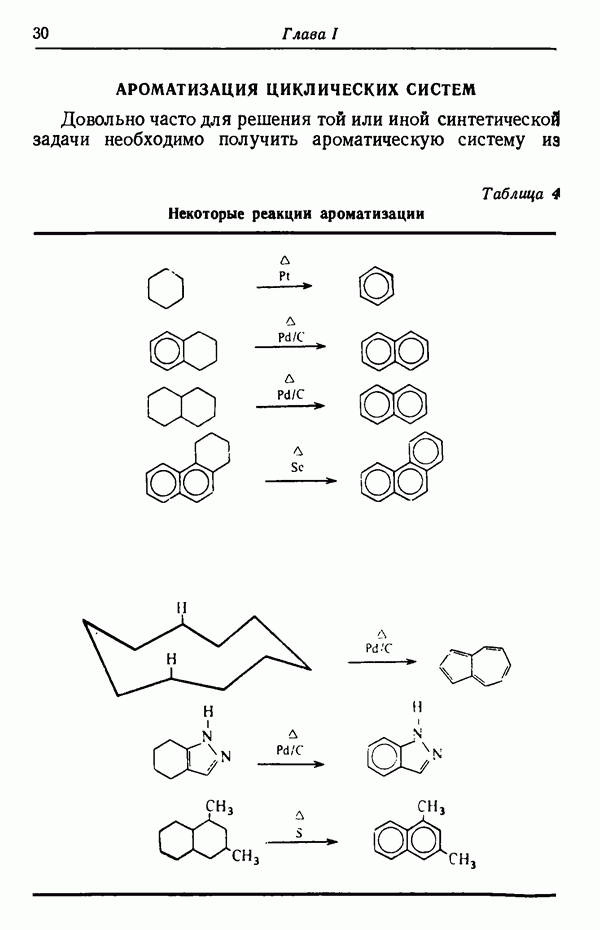
- АРОМАТИЗАЦИЯ ЦИКЛИЧЕСКИХ СИСТЕМ
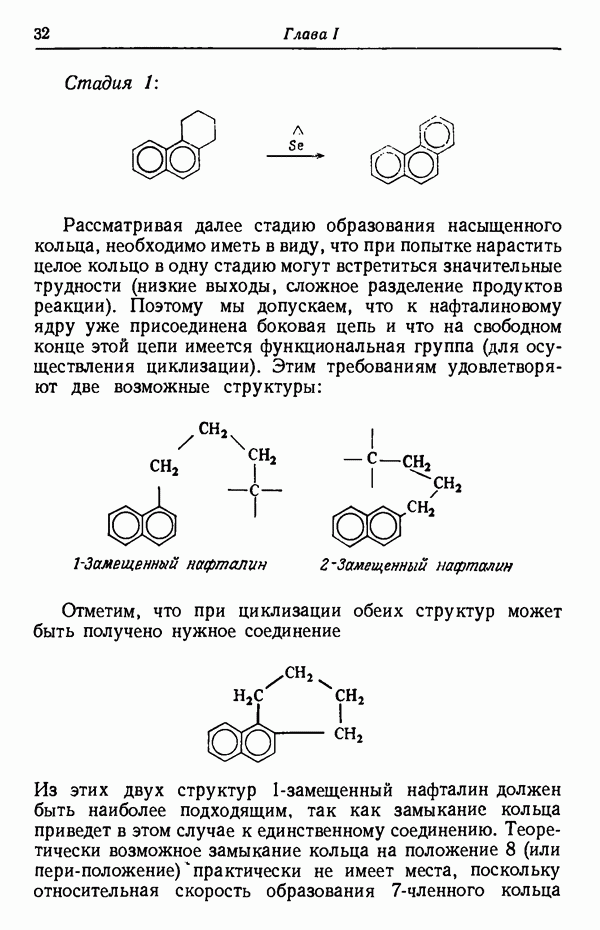
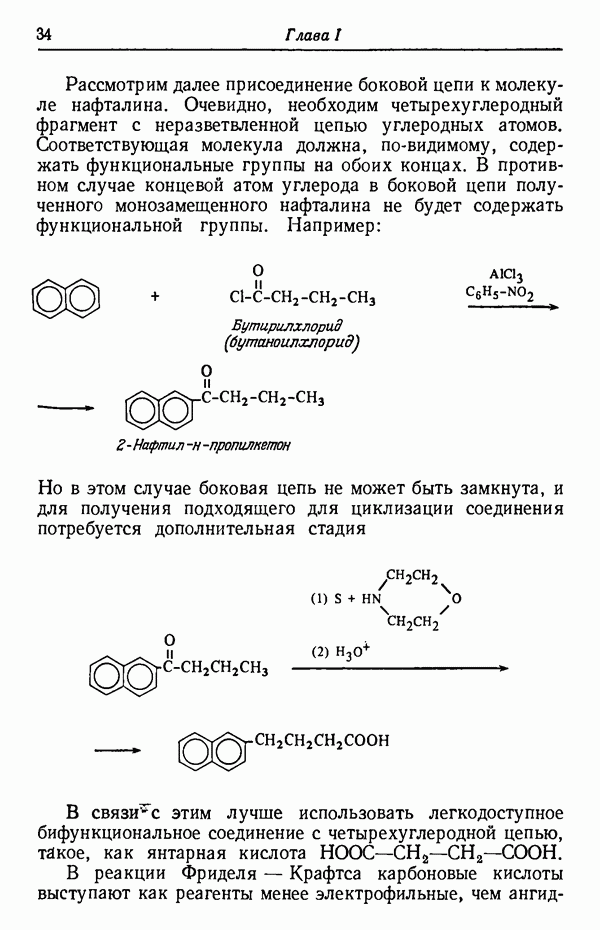
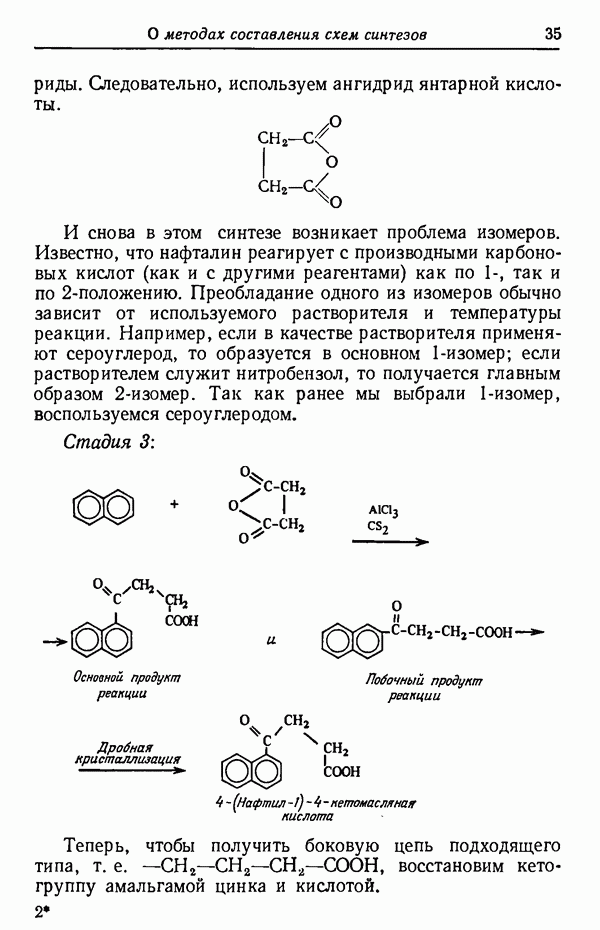
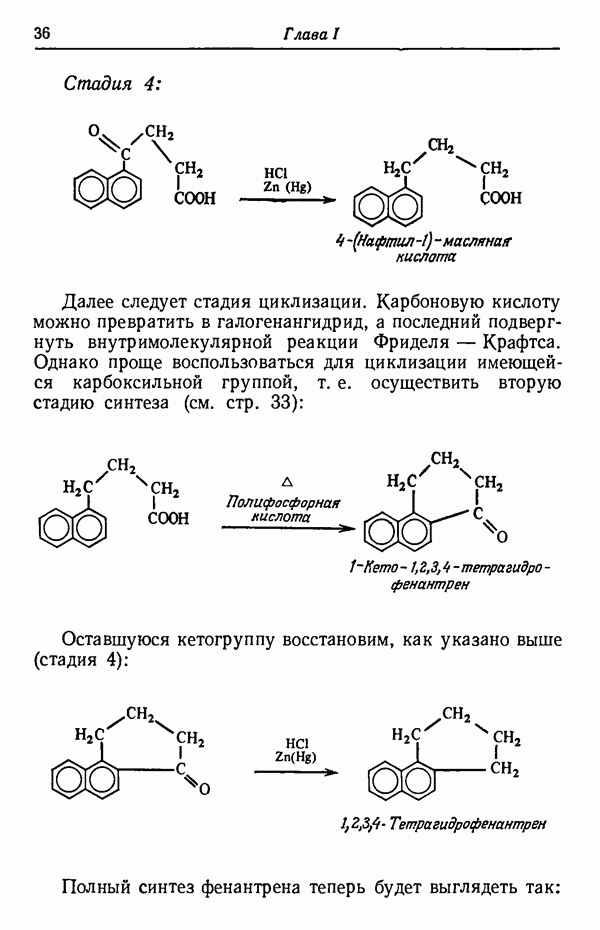
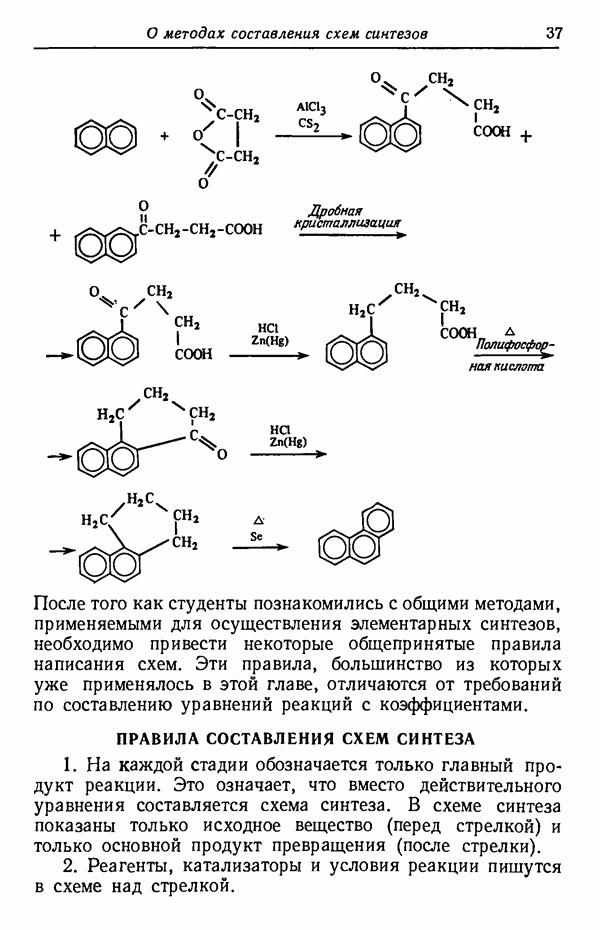
- СИНТЕЗ ФЕНАНТРЕНА ИЗ НАФТАЛИНА
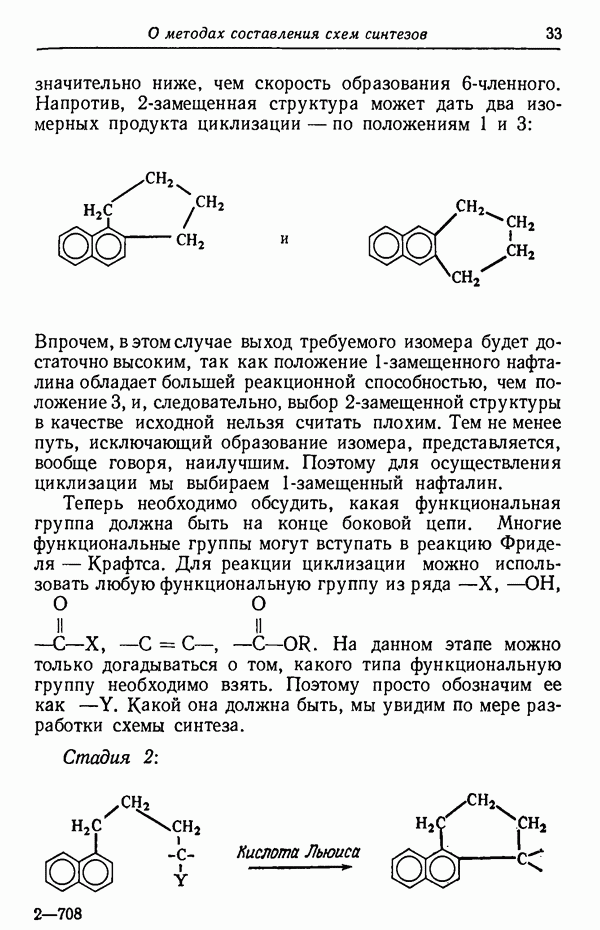
- ПРАВИЛА СОСТАВЛЕНИЯ СХЕМ СИНТЕЗА
- Глава II. СИНТЕЗ НЕКОТОРЫХ НАИБОЛЕЕ ЧАСТО ИСПОЛЬЗУЕМЫХ ПРОМЕЖУТОЧНЫХ СОЕДИНЕНИЙ
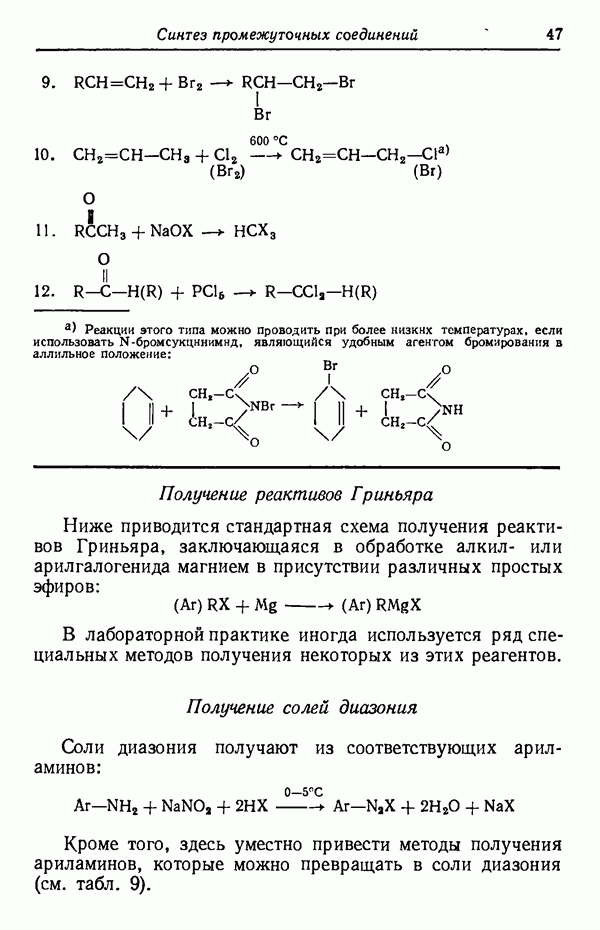
- РЕАКТИВЫ ГРИНЬЯРА
- СОЛИ ДИАЗОНИЯ
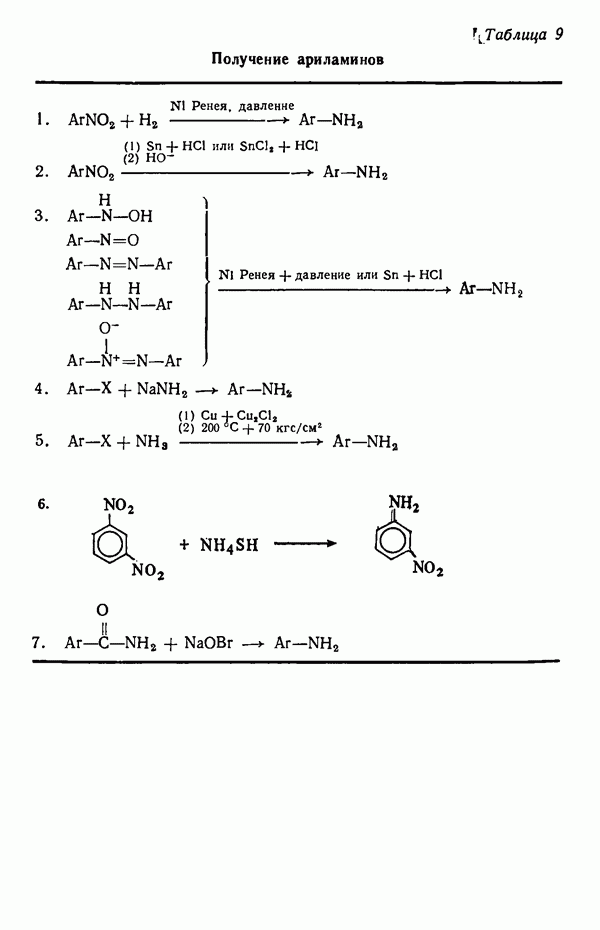
- ПОЛУЧЕНИЕ ВАЖНЕЙШИХ ПРОМЕЖУТОЧНЫХ СОЕДИНЕНИЙ
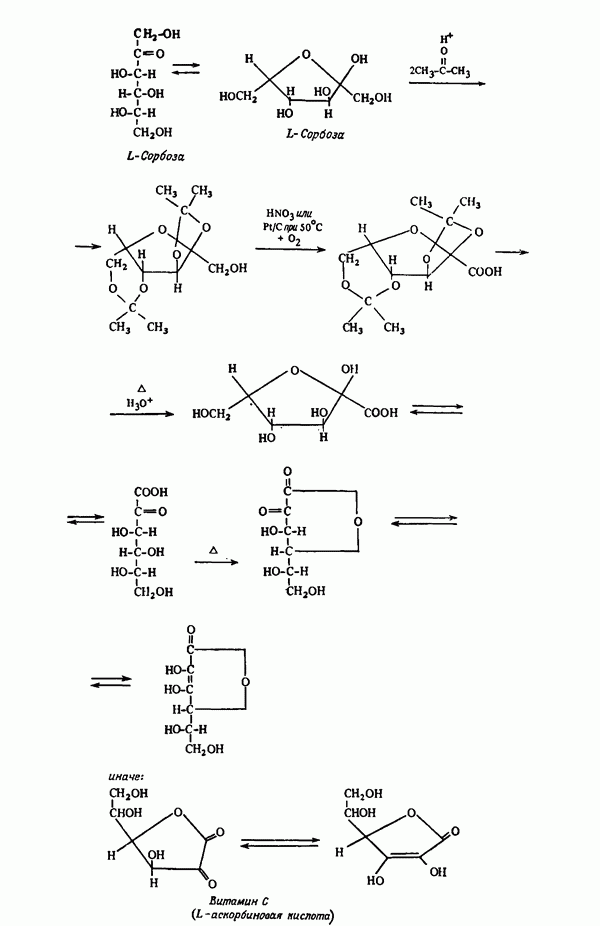
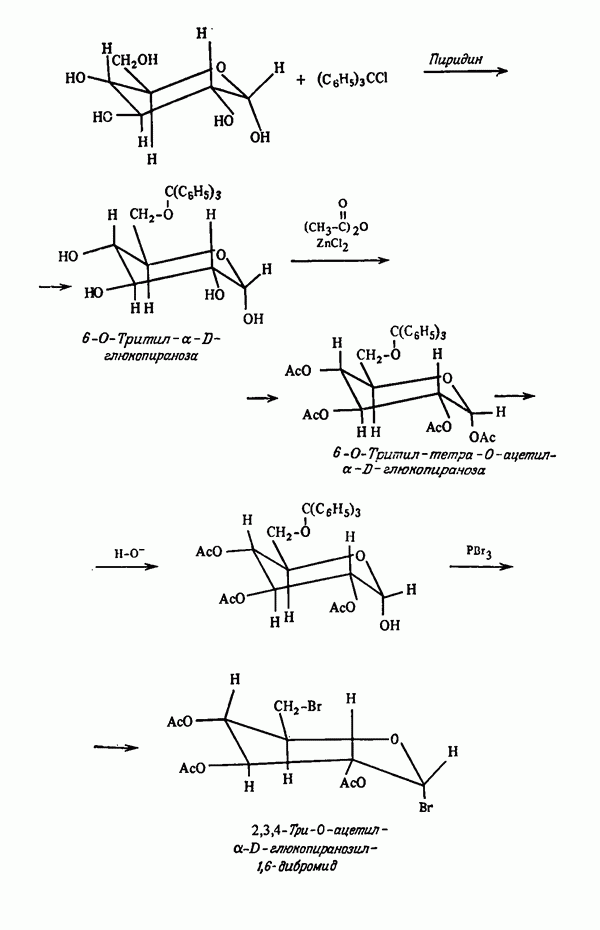
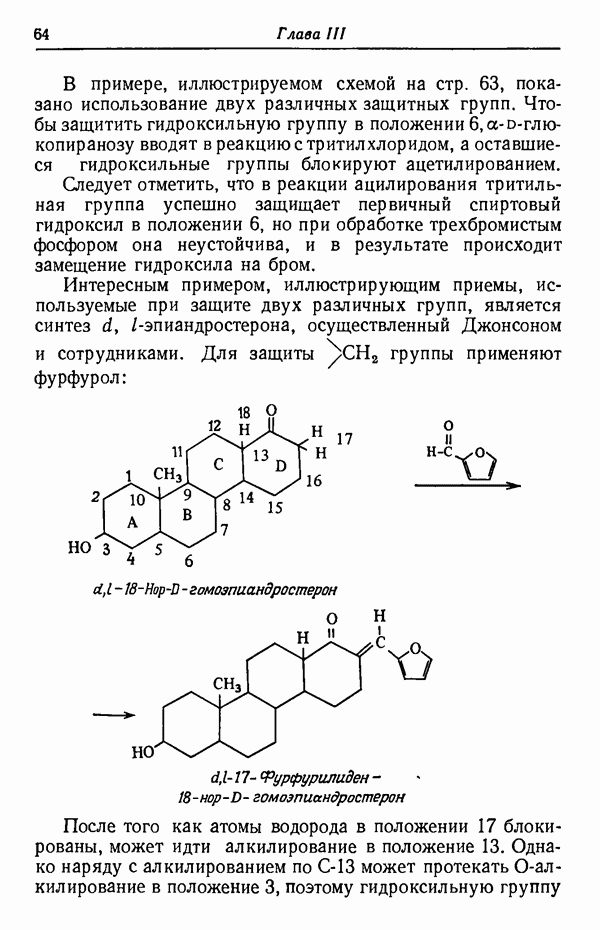
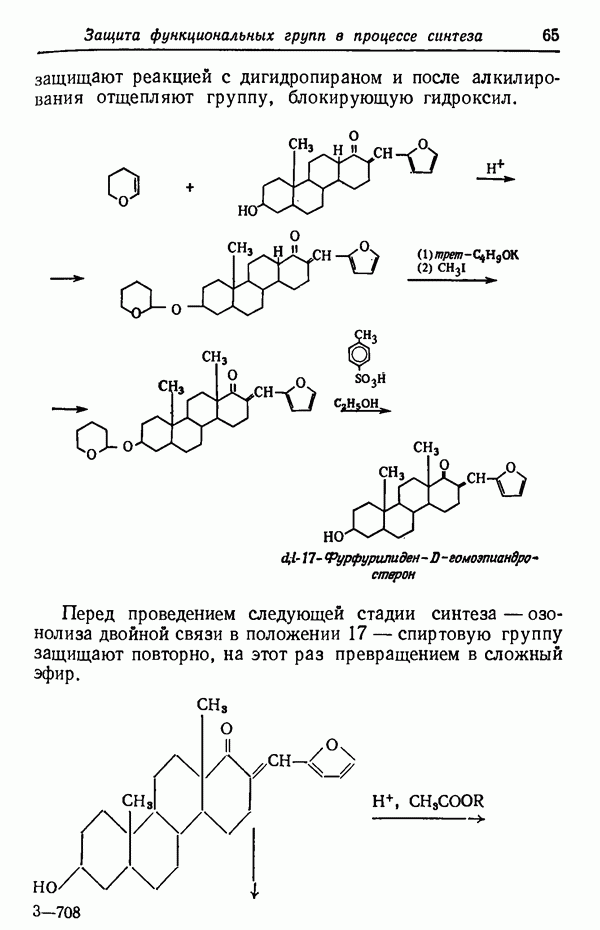
- Глава III. ЗАЩИТА ФУНКЦИОНАЛЬНЫХ ГРУПП В ПРОЦЕССЕ СИНТЕЗА
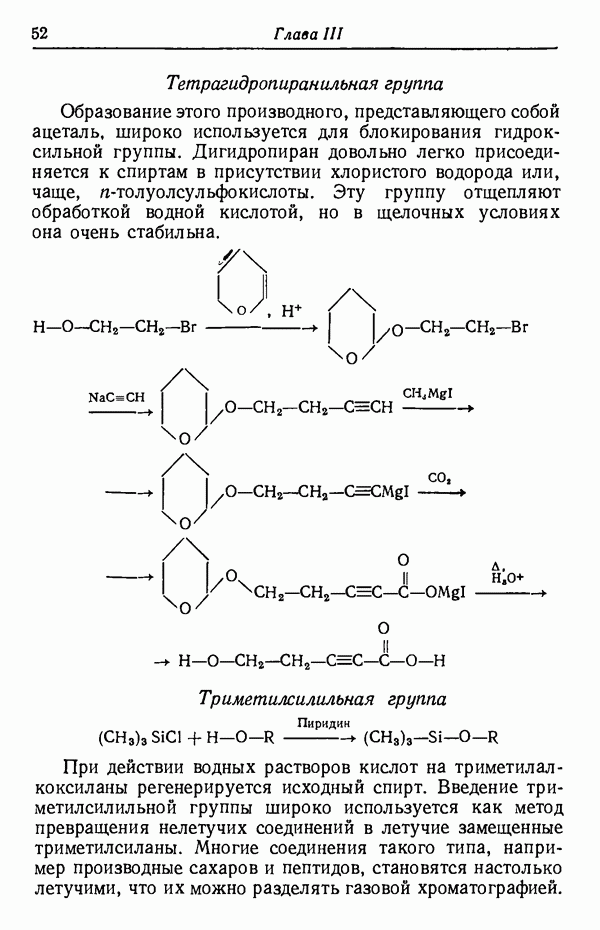
- ГРУППЫ —О —Н
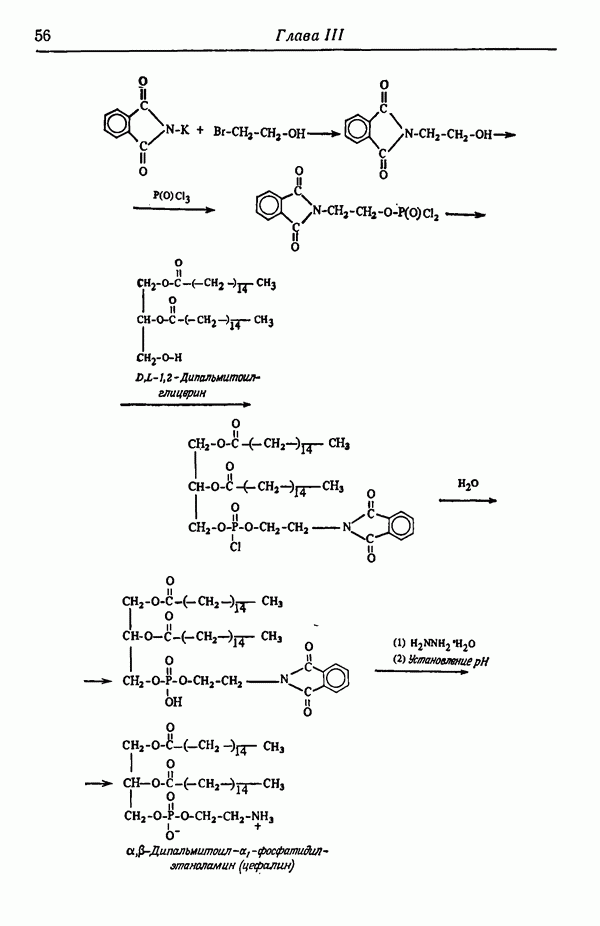
- ГРУППЫ -NH2 И — NHR
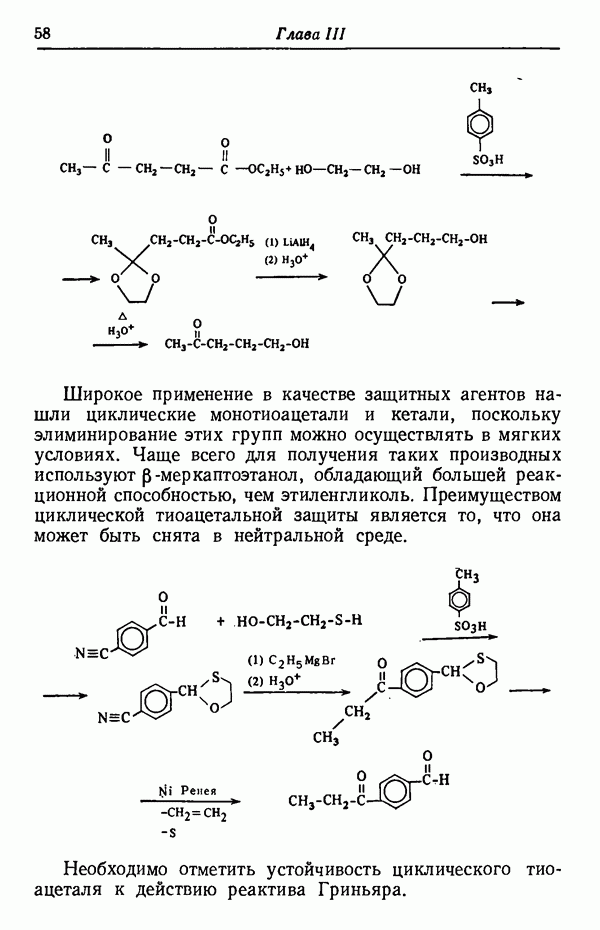
- ГРУППЫ C=O
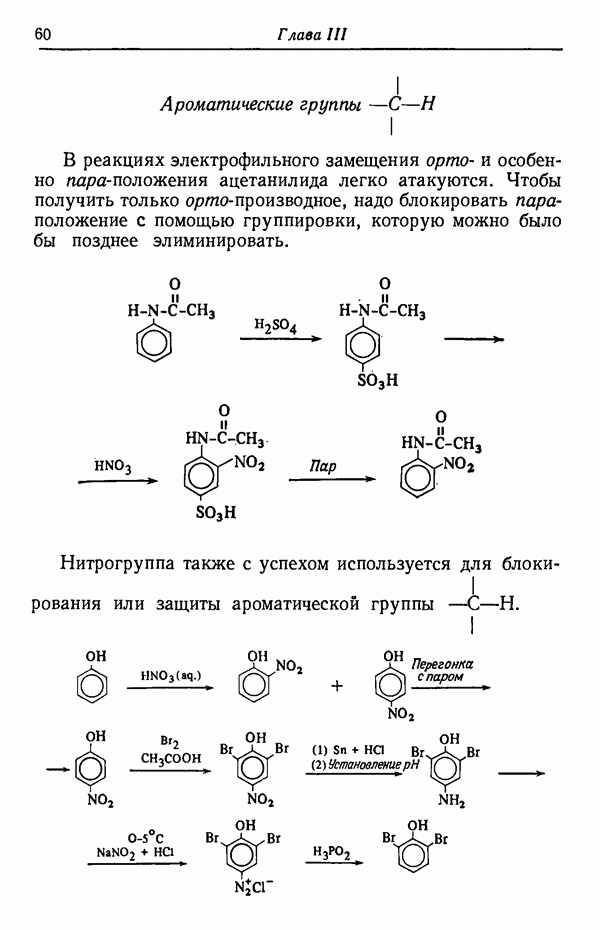
- ГРУППЫ C-H
- ОДНОВРЕМЕННАЯ ЗАЩИТА НЕСКОЛЬКИХ ГРУПП
- Глава IV. СПЕЦИФИЧЕСКИЕ МЕТОДЫ, ПРИМЕНЯЕМЫЕ В АРОМАТИЧЕСКОМ РЯДУ
- ПОСЛЕДУЮЩИЕ ПРЕВРАЩЕНИЯ ЗАМЕСТИТЕЛЯ ПОСЛЕ ИСПОЛЬЗОВАНИЯ ЕГО ОРИЕНТИРУЮЩЕГО ВЛИЯНИЯ
- ЭЛИМИНИРОВАНИЕ ЗАМЕСТИТЕЛЯ ПОСЛЕ ИСПОЛЬЗОВАНИЯ ЕГО ОРИЕНТИРУЮЩЕГО ВЛИЯНИЯ
- ОРИЕНТАЦИЯ В ПОЛИЗАМЕЩЕННЫХ БЕНЗОЛАХ
- ВЛИЯНИЕ РАСТВОРИТЕЛЕЙ НА СООТНОШЕНИЕ ИЗОМЕРОВ
- Глава V. СТЕРЕОХИМИЧЕСКИЙ КОНТРОЛЬ РЕАКЦИЙ
- КИНЕТИЧЕСКИЙ КОНТРОЛЬ
- ТЕРМОДИНАМИЧЕСКИЙ КОНТРОЛЬ
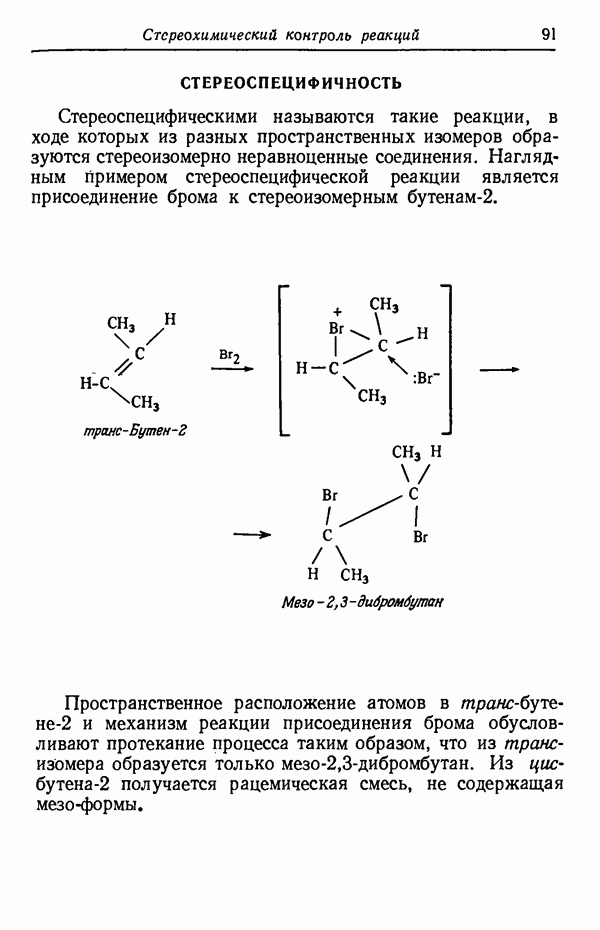
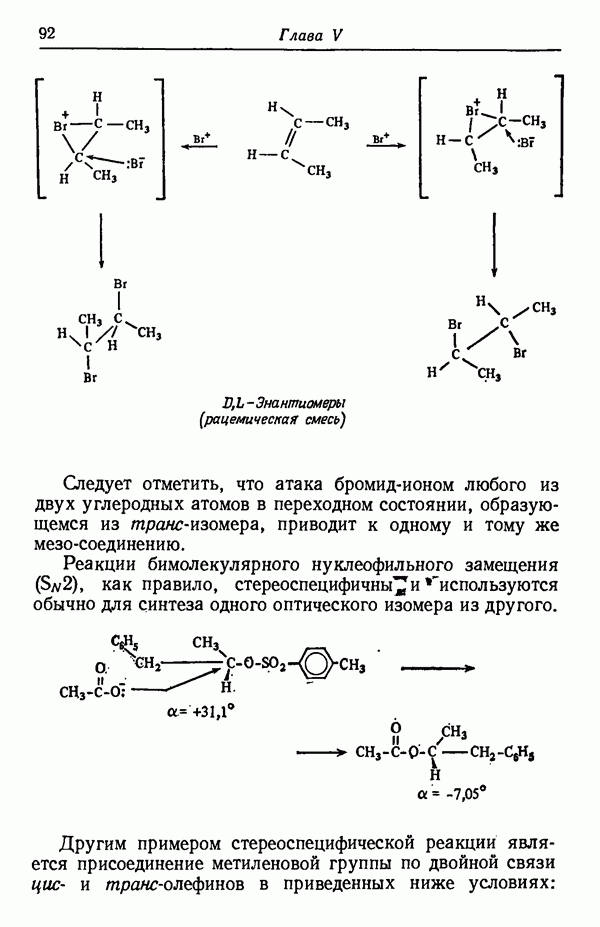
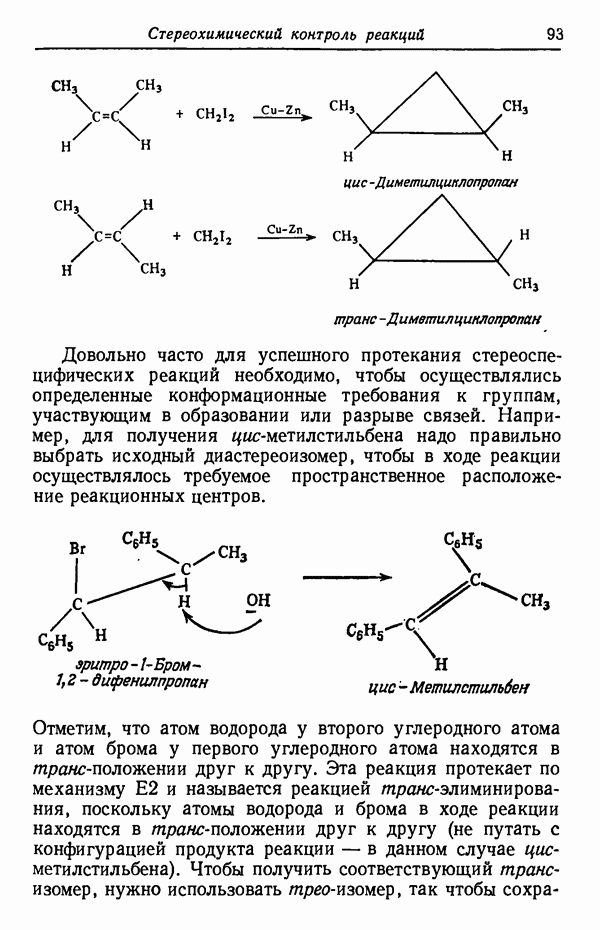
- СТЕРЕОСПЕЦИФИЧНОСТЬ
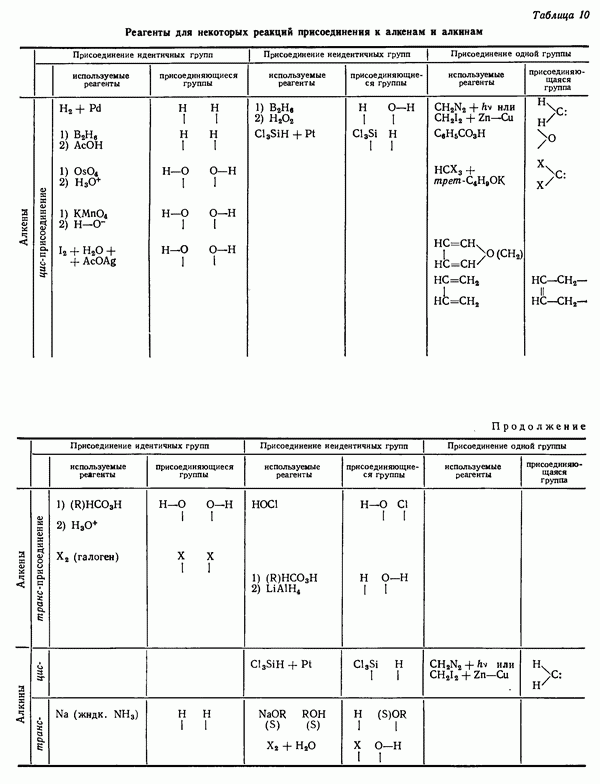
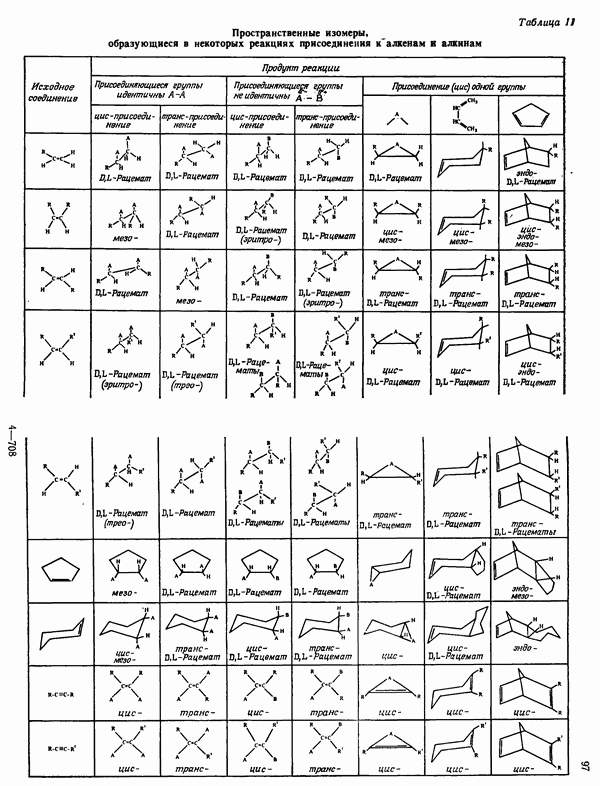
- СТЕРЕОИЗОМЕРНЫЕ ПРОДУКТЫ НЕКОТОРЫХ РЕАКЦИЙ ПРИСОЕДИНЕНИЯ
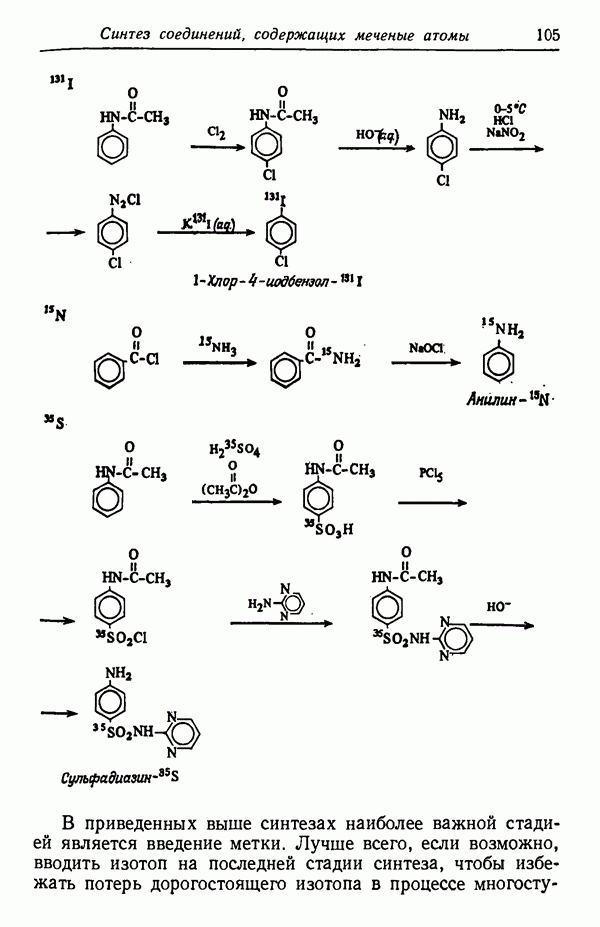
- Глава VI. СИНТЕЗ СОЕДИНЕНИЙ, СОДЕРЖАЩИХ МЕЧЕНЫЕ АТОМЫ (ИЗОТОПЫ)
- СИНТЕЗ МЕЧЕНЫХ СОЕДИНЕНИЙ
- МОЛЕКУЛЫ, СОДЕРЖАЩИЕ НЕСКОЛЬКО МЕТОК
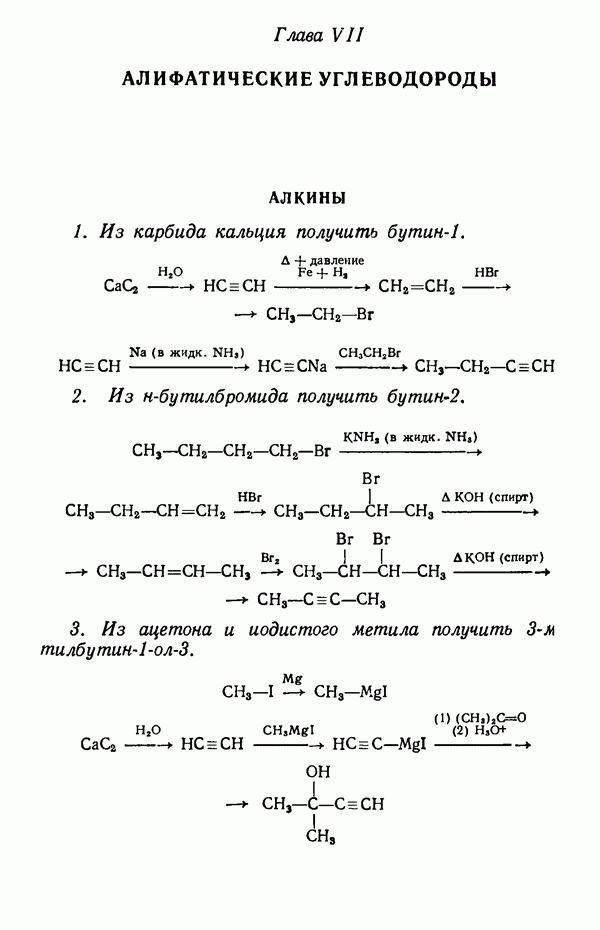
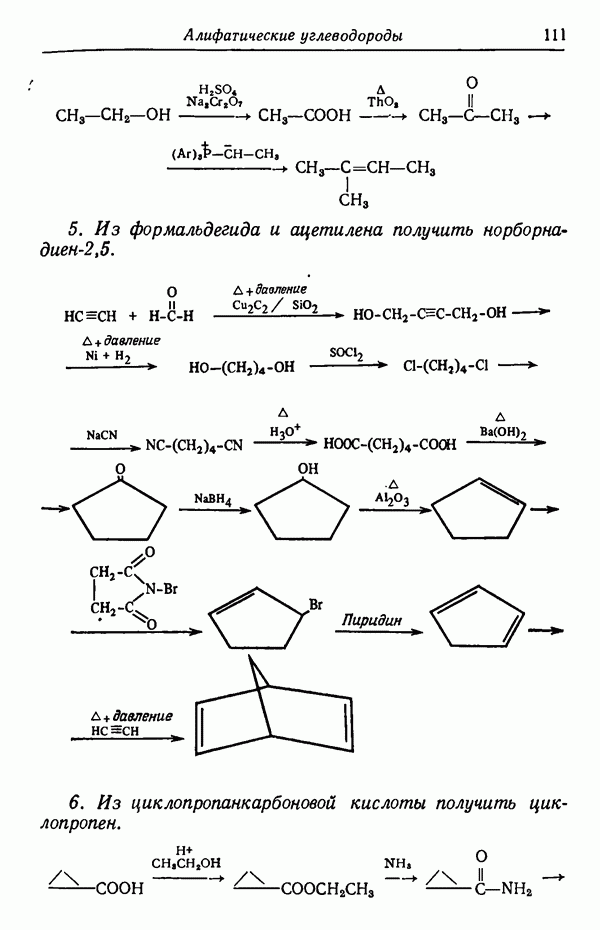
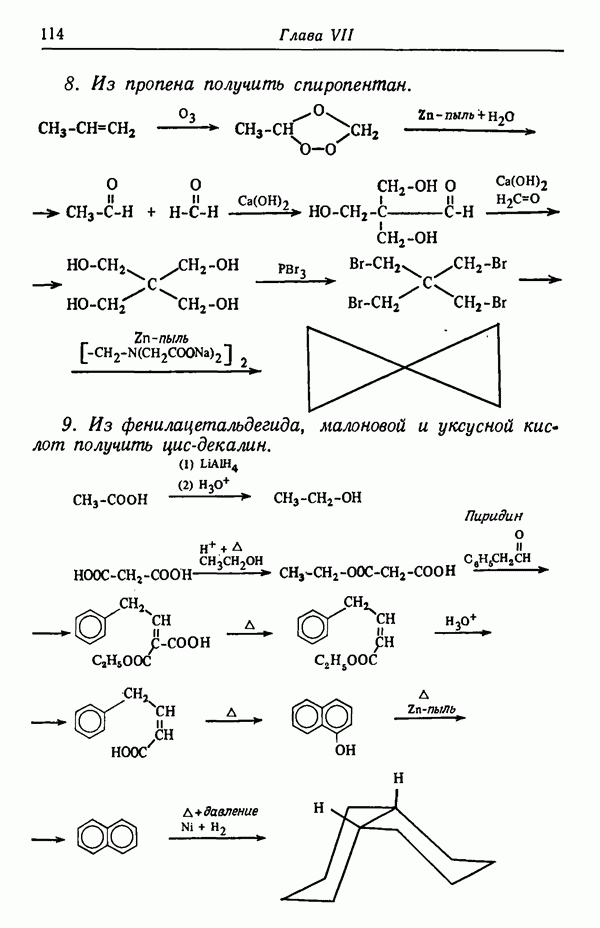
- Глава VII. АЛИФАТИЧЕСКИЕ УГЛЕВОДОРОДЫ
- Глава VIII. СОЕДИНЕНИЯ, СОДЕРЖАЩИЕ ФУНКЦИОНАЛЬНЫЕ ГРУППЫ
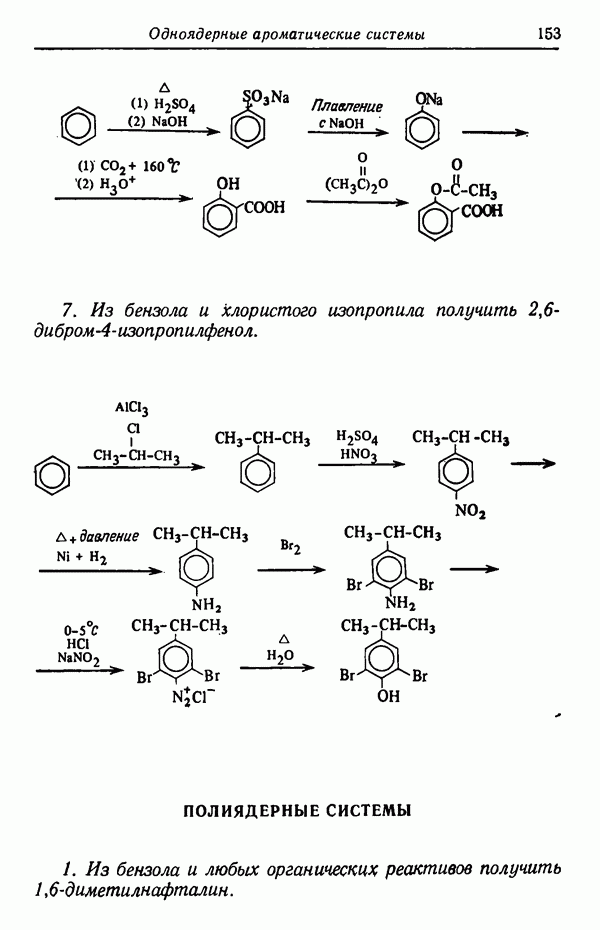
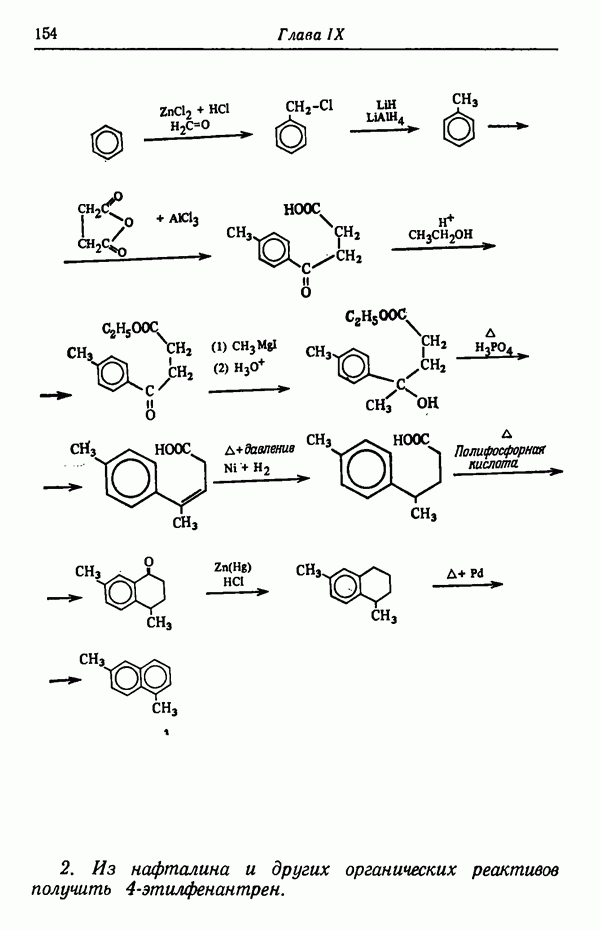
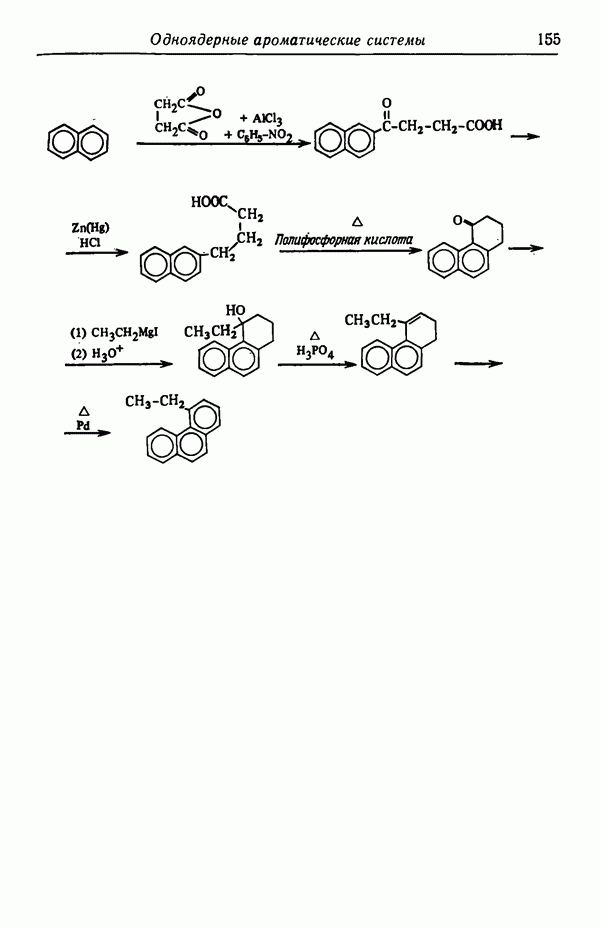
- Глава IX. ОДНОЯДЕРНЫЕ АРОМАТИЧЕСКИЕ СИСТЕМЫ