| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
22. ОСНОВНЫЕ ПОЛОЖЕНИЯ МОЛЕКУЛЯРНО-КИНЕТИЧЕСКОИ ТЕОРИИ И ИХ ОПЫТНОЕ ОБОСНОВАНИЕ
Развитие представлении о строении вещества.
Предположение о том, что любое вещество состоит из мельчайших неделимых частиц — атомов, было высказано около 2500 лет назад древнегреческими философами Левкиппом и Демокритом. По их представлениям все тела образуются в результате соединения атомов. Различия в свойствах тел объясняются тем, что тела состоят из различных атомов или одинаковые атомы по-разному соединены между собой в пространстве.
Работы М. В. Ломоносова.
Существенный вклад в развитие молекулярно-кинетических представлений сделал в середине XVIII в. великий русский ученый Михаил Васильевич Ломоносов (1711—1765). Он объяснил основные свойства газа, предположив, что все молекулы газа движутся беспорядочно, хаотично и при столкновениях отталкиваются друг от друга. Беспорядочным движением молекул М. В. Ломоносов впервые объяснил природу теплоты. Так как скорости теплового движения молекул могут быть сколько угодно велики, температура вещества по его представлениям не имеет ограничения сверху. При уменьшении скорости молекул до нуля должно быть достигнуто минимальное возможное значение температуры вещества. Объяснение природы теплоты движением молекул и вывод о существовании абсолютного нуля температуры, сделанный М. В. Ломоносовым, получили теоретическое и экспериментальное подтверждение в конце XIX в.
Основные положения молекулярно-кинетической теории.
Молекулярно-кинетической теорией называется учение о строении и свойствах вещества, использующее представления о существовании атомов и молекул как наименьших частиц химического вещества.
Способность газов неограниченно расширяться, упругость газов, жидкостей и твердых тел, способность к взаимному проникновению тел путем диффузии можно объяснить, если принять следующие положения молекулярно-кинетической теории строения вещества: вещество состоит из частиц — атомов и молекул; эти частицы хаотически движутся; частицы взаимодействуют друг с другом.
Движение атомов и молекул, их взаимодействия подчиняются законам механики. Это позволяет использовать законы механики для выяснения свойств тел, состоящих из большого числа хаотически движущихся малых частиц.


Взаимодействие атомов и молекул.
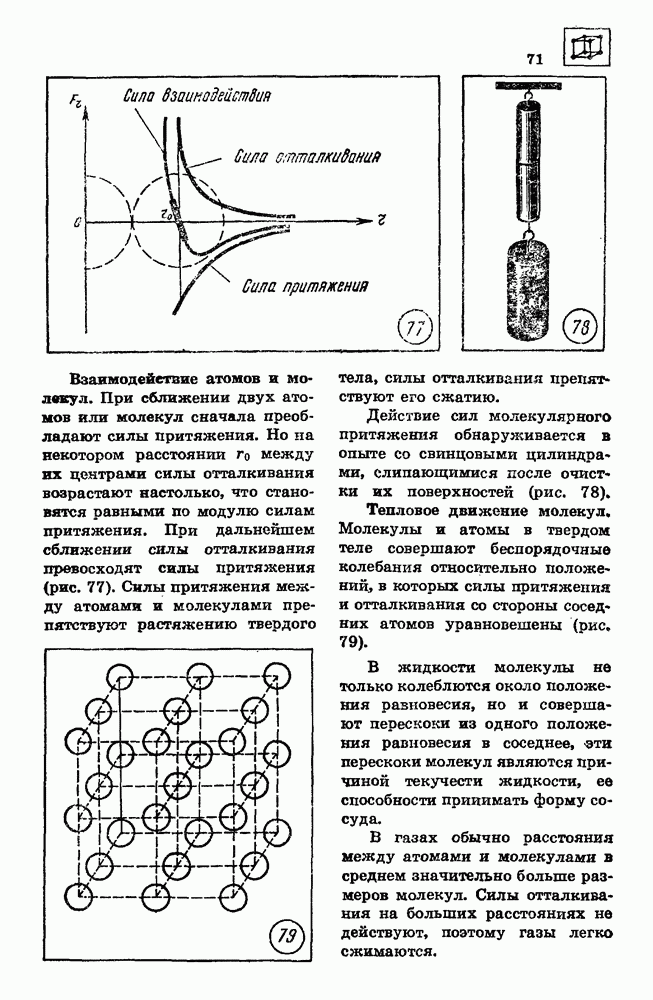
При сближении двух атомов или молекул сначала преобладают силы притяжения. Но на некотором расстоянии  между их центрами силы отталкивания возрастают настолько, что становятся равными по модулю силам притяжения. При дальнейшем сближении силы отталкивания превосходят силы притяжения (рис. 77). Силы притяжения между атомами и молекулами препятствуют растяжению твердого тела, силы отталкивания препятствуют его сжатию.
между их центрами силы отталкивания возрастают настолько, что становятся равными по модулю силам притяжения. При дальнейшем сближении силы отталкивания превосходят силы притяжения (рис. 77). Силы притяжения между атомами и молекулами препятствуют растяжению твердого тела, силы отталкивания препятствуют его сжатию.
Действие сил молекулярного притяжения обнаруживается в опыте со свинцовыми цилиндрами, слипающимися после очистки их поверхностей (рис. 78).
Тепловое движение молекул.
Молекулы и атомы в твердом теле совершают беспорядочные колебания относительно положений, в которых силы притяжения и отталкивания со стороны соседних атомов уравновешены (рис, 79).
В жидкости молекулы не только колеблются около положения равновесия, но и совершают перескоки из одного положения равновесия в соседнее, эти перескоки молекул являются причиной текучести жидкости, ее способности принимать форму сосуда.
В газах обычно расстояния между атомами и молекулами в среднем значительно больше размеров молекул. Силы отталкивания на больших расстояниях не действуют, поэтому газы легко сжимаются.

Практически отсутствуют между молекулами газа и силы притяжения, поэтому газы обладают свойством неограниченно расширяться.
Закономерности броуновского движения.
Большое значение в обосновании молекулярно-кинетической теории имело открытие английского ботаника Роберта Броуна (1773—1858). В 1827 г. он обнаружил беспорядочное движение видимых в микроскоп твердых частиц, находящихся в жидкости. Это явление, названное броуновским движением, смогла объяснить лишь молекулярнокинетическая теория на основе использования представлений о существовании молекул. Беспорядочно движущиеся молекулы жидкости или газа сталкиваются с твердой частицей и изменяют направление и модуль скорости ее движения. Число молекул, ударяющих частицу с различных сторон, и направление передаваемого ими импульса непостоянны. Чем меньше размеры и масса частицы, тем более заметными становятся изменения ее импульса во времени.
Французский ученый Жан Пер  выполнил серию экспериментов по изучению броуновского движения. Пример результатов одного из наблюдений за движением броуновской частицы представлен на рисунке 80. Закономерности броуновского движения, предсказанные на основе молекулярно-кинетической теории, полностью подтвердились этими экспериментами.
выполнил серию экспериментов по изучению броуновского движения. Пример результатов одного из наблюдений за движением броуновской частицы представлен на рисунке 80. Закономерности броуновского движения, предсказанные на основе молекулярно-кинетической теории, полностью подтвердились этими экспериментами.
Измерение скорости молекул.
Одним из первых экспериментов, в котором были непосредственно измерены скорости движения отдельных молекул газа, был опыт, выполненный немецким физиком Отто Штерном (1888—1969) в 1920 г.

В опыте использовался прибор, состоящий из двух цилиндров с общей осью вращения. По оси цилиндра была расположена платиновая проволока, покрытая серебром. Воздух из пространства между цилиндрами откачивался.
При пропускании электрического тока через проволоку в результате ее нагревания происходило испарение атомов серебра с поверхности проволоки. Во внутреннем цилиндре имелась щель, атомы серебра пролетали через нее и оседали на внутренней стенке второго цилиндра, образуя на ней заметную полоску.
Когда цилиндры приводились во вращение с одинаковой частотой, полоска оказывалась в другом месте. По углу  между этими двумя положениями полоски (рис. 81), расстоянию
между этими двумя положениями полоски (рис. 81), расстоянию  и частоте
и частоте  вращения цилиндров можно было определить скорость атомов серебра:
вращения цилиндров можно было определить скорость атомов серебра:


Полоска серебра, получившаяся при вращении цилиндров, оказалась размытой. Это свидетельствовало о том, что атомы серебра, испаряющиеся с проволоки, имеют различные скорости. Найденные из таких измерений значения скорости движения атомов серебра оказались совпадающими со значениями, полученными на основе молекулярно-кинетической теории. Это совпадение является одним из важнейших прямых доказательств справедливости молекулярно-кинетической теории газов.
Наблюдения отдельных атомов.
В настоящее время основные положения молекулярно-кинетической теории подтверждаются многочисленными опытами с использованием достижений современной экспериментальной техники. С помощью ионного проектора получают изображения кристаллов, по которым можно представить их строение. Электронные микроскопы позволили получить изображения, по которым оказалось возможным определение расстояния между отдельными атомами в молекуле.
| << Предыдущий параграф | Следующий параграф >> |
- 1. МЕХАНИЧЕСКОЕ ДВИЖЕНИЕ
- 2. РАВНОУСКОРЕННОЕ ДВИЖЕНИЕ
- 3. РАВНОМЕРНОЕ ДВИЖЕНИЕ ПО ОКРУЖНОСТИ
- 4. ПЕРВЫЙ ЗАКОН НЬЮТОНА
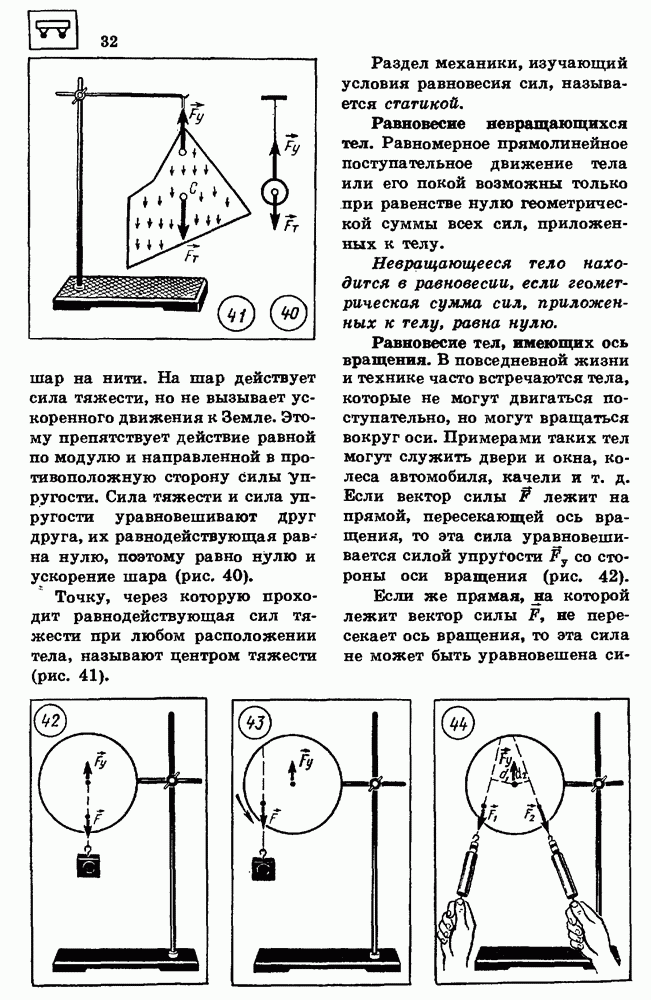
- 5. МАССА ТЕЛА
- 6. СИЛА
- 7. ВТОРОЙ ЗАКОН НЬЮТОНА
- 8. ТРЕТИЙ ЗАКОН НЬЮТОНА
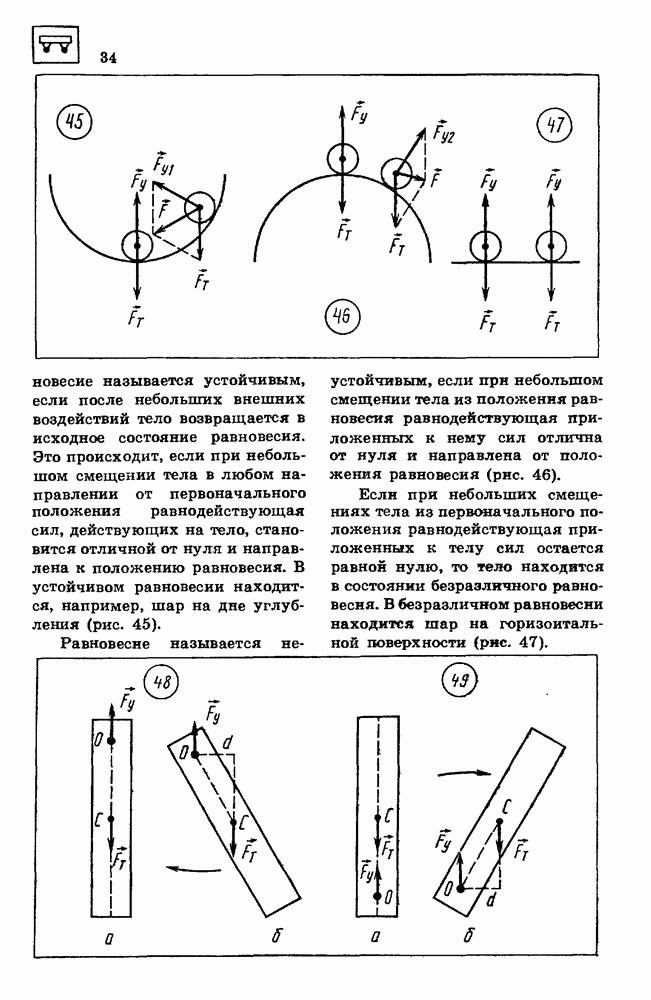
- 9. ЗАКОН ВСЕМИРНОГО ТЯГОТЕНИЯ
- 10. ВЕС И НЕВЕСОМОСТЬ
- 11. ДВИЖЕНИЕ ТЕЛ ПОД ДЕЙСТВИЕМ СИЛЫ ТЯЖЕСТИ
- 12. СИЛА УПРУГОСТИ
- 13. СИЛЫ ТРЕНИЯ
- 14. УСЛОВИЯ РАВНОВЕСИЯ ТЕЛ
- 15. ЭЛЕМЕНТЫ ГИДРОСТАТИКИ
- 16. ЗАКОН СОХРАНЕНИЯ ИМПУЛЬСА
- 17. РЕАКТИВНОЕ ДВИЖЕНИЕ
- 18. МЕХАНИЧЕСКАЯ РАБОТА
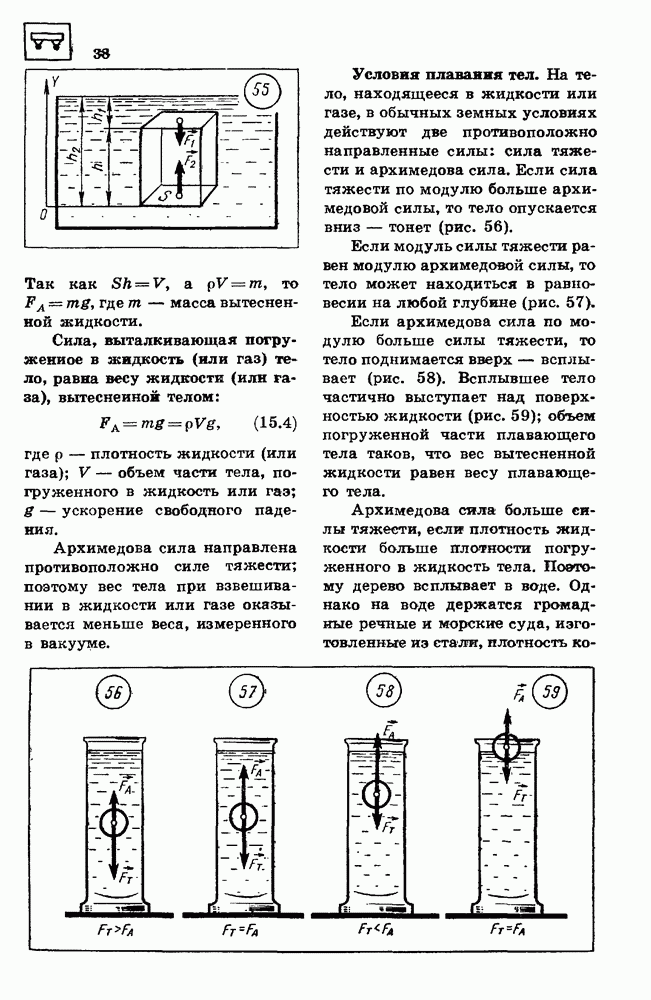
- 19. КИНЕТИЧЕСКАЯ ЭНЕРГИЯ
- 20. ПОТЕНЦИАЛЬНАЯ ЭНЕРГИЯ
- 21. ЗАКОН СОХРАНЕНИЯ ЭНЕРГИИ В МЕХАНИЧЕСКИХ ПРОЦЕССАХ
- ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
- 22. ОСНОВНЫЕ ПОЛОЖЕНИЯ МОЛЕКУЛЯРНО-КИНЕТИЧЕСКОИ ТЕОРИИ И ИХ ОПЫТНОЕ ОБОСНОВАНИЕ
- 23. МАССА МОЛЕКУЛ
- 24. ОСНОВНОЕ УРАВНЕНИЕ МОЛЕКУЛЯРНО-КИНЕТИЧЕСКОИ ТЕОРИИ ИДЕАЛЬНОГО ГАЗА
- 25. ТЕМПЕРАТУРА — МЕРА СРЕДНЕЙ КИНЕТИЧЕСКОЙ ЭНЕРГИИ МОЛЕКУЛ
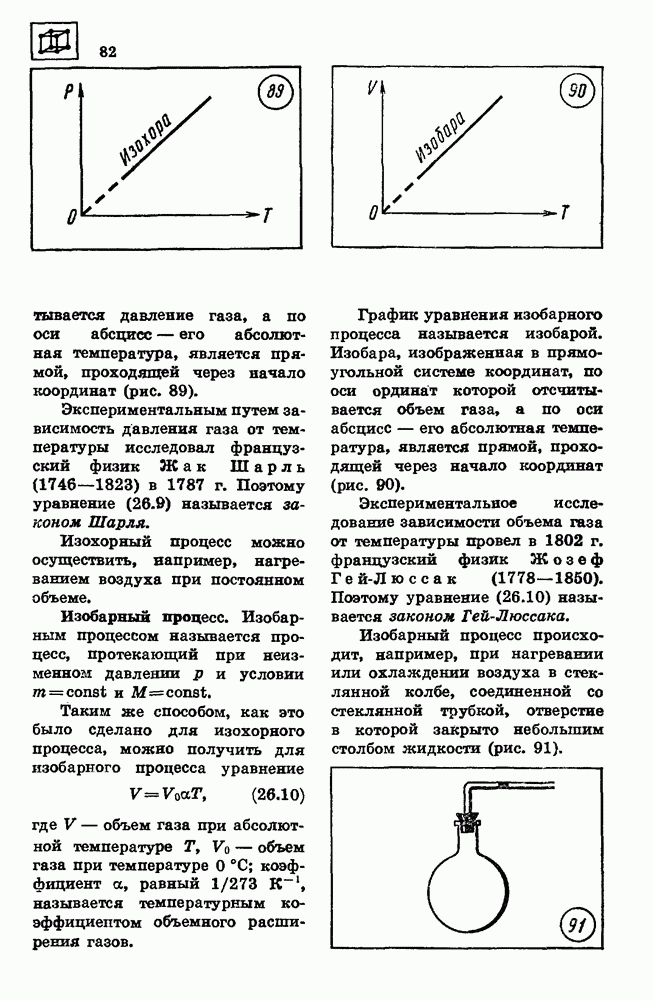
- 28. УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗА
- 27. СВОЙСТВА ЖИДКОСТЕЙ
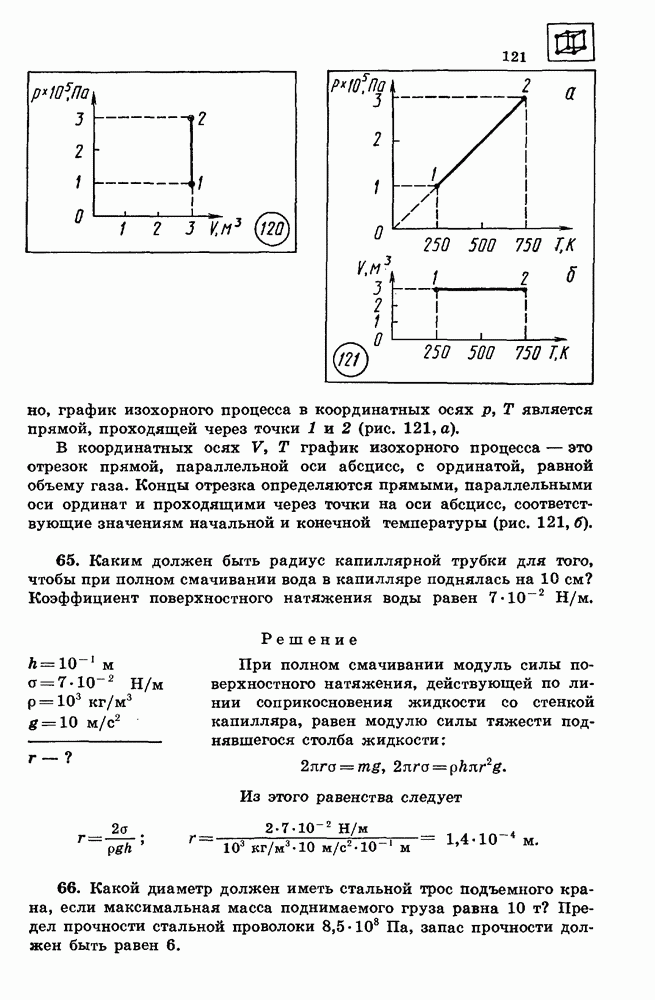
- 28. ИСПАРЕНИЕ И КОНДЕНСАЦИЯ
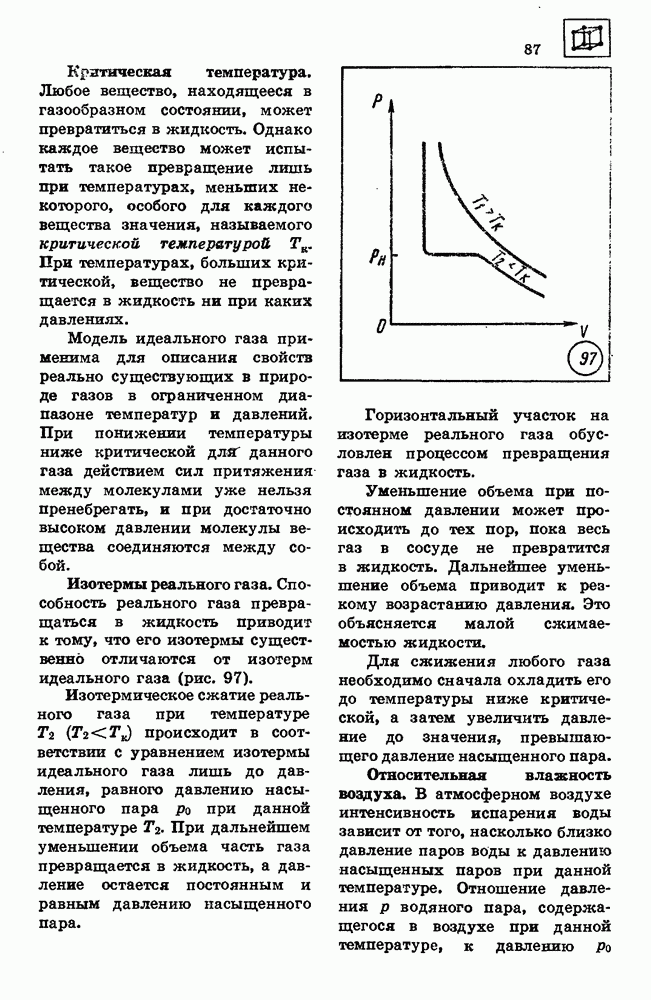
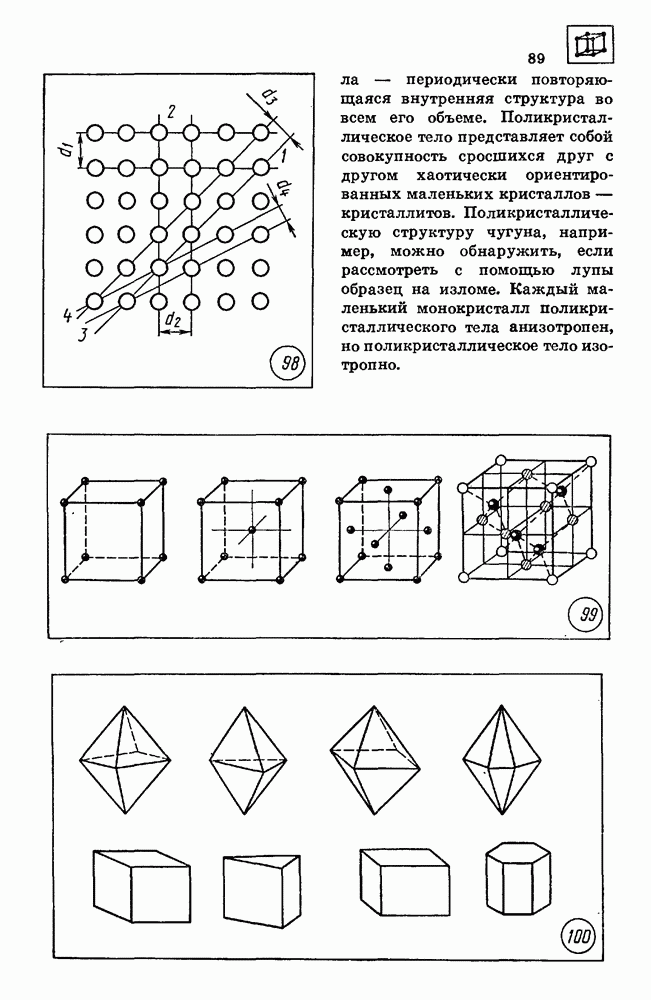
- 29. КРИСТАЛЛИЧЕСКИЕ И АМОРФНЫЕ ТЕЛА
- 30. МЕХАНИЧЕСКИЕ СВОЙСТВА ТВЕРДЫХ ЦЕЛ
- 31. ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ
- 32. КОЛИЧЕСТВО ТЕПЛОТЫ
- 33. РАБОТА ПРИ ИЗМЕНЕНИИ ОБЪЕМА ГАЗА
- 34. ПРИНЦИПЫ ДЕЙСТВИЯ ТЕПЛОВЫХ ДБИГАТЕЛЕЙ
- 35. ТЕПЛОВЫЕ МАШИНЫ
- ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
- 36. ЗАКОН СОХРАНЕНИЯ ЭЛЕКТРИЧЕСКОГО ЗАРЯДА
- 37. ЗАКОН КУЛОНА
- 38. ЭЛЕКТРИЧЕСКОЕ ПОЛЕ
- 39. РАБОТА ПРИ ПЕРЕМЕЩЕНИИ ЭЛЕКТРИЧЕСКОГО ЗАРЯДА В ЭЛЕКТРИЧЕСКОМ ПОЛЕ
- 40. ПОТЕНЦИАЛ
- 41. ВЕЩЕСТВО В ЭЛЕКТРИЧЕСКОМ ПОЛЕ
- 42. ЭЛЕКТРОЕМКОСТЬ
- 43. ЗАКОН ОМА
- 44. ЭЛЕКТРИЧЕСКИЙ ТОК В МЕТАЛЛАХ
- 45. ЭЛЕКТРИЧЕСКИЙ ТОК В ПОЛУПРОВОДНИКАХ
- 46. ПОЛУПРОВОДНИКОВЫЕ ПРИБОРЫ
- 47. ЭЛЕКТРИЧЕСКИЙ ТОК В ЭЛЕКТРОЛИТАХ
- 48. ОТКРЫТИЕ ЭЛЕКТРОНА
- 49. ЭЛЕКТРИЧЕСКИЙ ТОК В ГАЗАХ
- 50. ЭЛЕКТРИЧЕСКИИ ТОК В ВАКУУМЕ
- 51. МАГНИТНОЕ ПОЛЕ
- 52. СИЛА ЛОРЕНЦА
- 53. ВЕЩЕСТВО В МАГНИТНОМ ПОЛЕ
- 54. ЭЛЕКТРОМАГНИТНАЯ ИНДУКЦИЯ
- 55. САМОИНДУКЦИЯ
- 56. МАГНИТНАЯ ЗАПИСЬ ИНФОРМАЦИИ
- 57. МАШИНА ПОСТОЯННОГО ТОКА
- 58. ЭЛЕКТРОИЗМЕРИТЕЛЬНЫЕ ПРИБОРЫ
- ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
- 59. МЕХАНИЧЕСКИЕ КОЛЕБАНИЯ
- 60. ГАРМОНИЧЕСКИЕ КОЛЕБАНИЯ
- 61. ПРЕВРАЩЕНИЯ ЭНЕРГИИ ПРИ МЕХАНИЧЕСКИХ КОЛЕБАНИЯХ
- 62. РАСПРОСТРАНЕНИЕ КОЛЕБАНИИ В УПРУГОЙ СРЕДЕ
- 63. ЗВУКОВЫЕ ВОЛНЫ
- 64. ОТРАЖЕНИЕ И ПРЕЛОМЛЕНИЕ ВОЛН
- 65. ИНТЕРФЕРЕНЦИЯ, ДИФРАКЦИЯ И ПОЛЯРИЗАЦИЯ ВОЛН
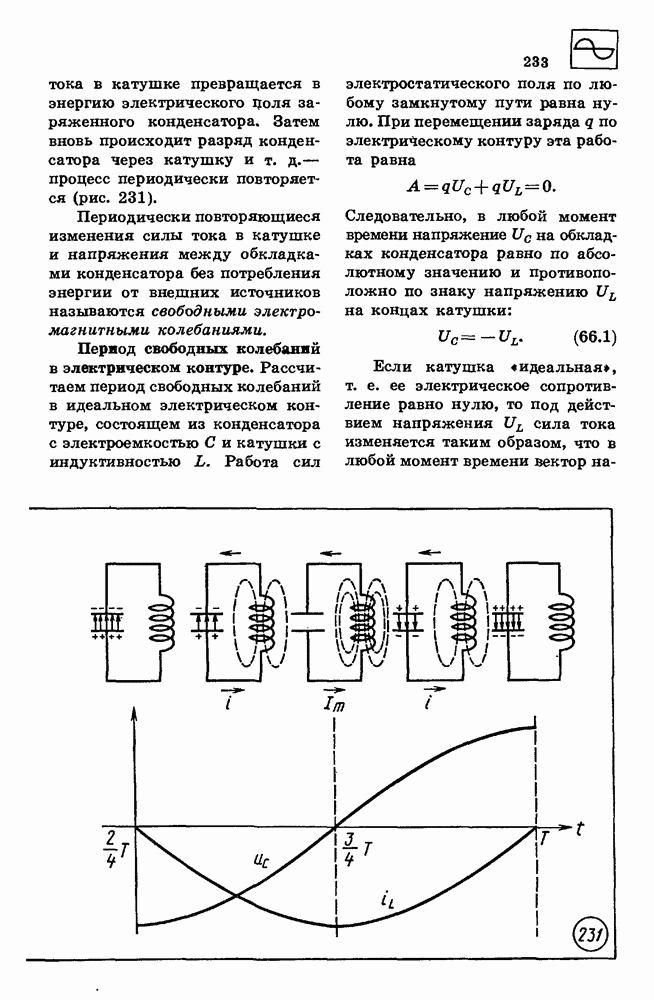
- 66. СВОБОДНЫЕ ЭЛЕКТРОМАГНИТНЫЕ КОЛЕБАНИЯ
- 67. АВТОКОЛЕБАТЕЛЬНЫЙ ГЕНЕРАТОР НЕЗАТУХАЮЩИХ ЭЛЕКТРОМАГНИТНЫХ КОЛЕБАНИИ
- 68. ПЕРЕМЕННЫЙ ЭЛЕКТРИЧЕСКИЙ ТОК
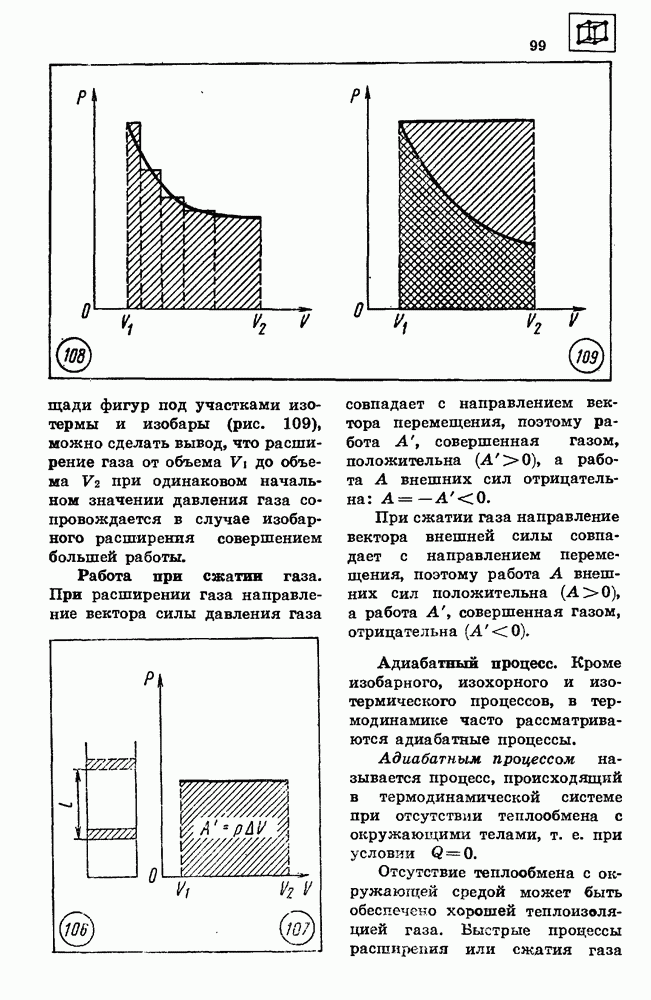
- 69. АКТИВНОЕ СОПРОТИВЛЕНИЕ В ЦЕПИ ПЕРЕМЕННОГО ТОКА
- 70. ИНДУКТИВНОСТЬ И ЕМКОСТЬ В ЦКТТИ ПЕРЕМЕННОГО ТОКА
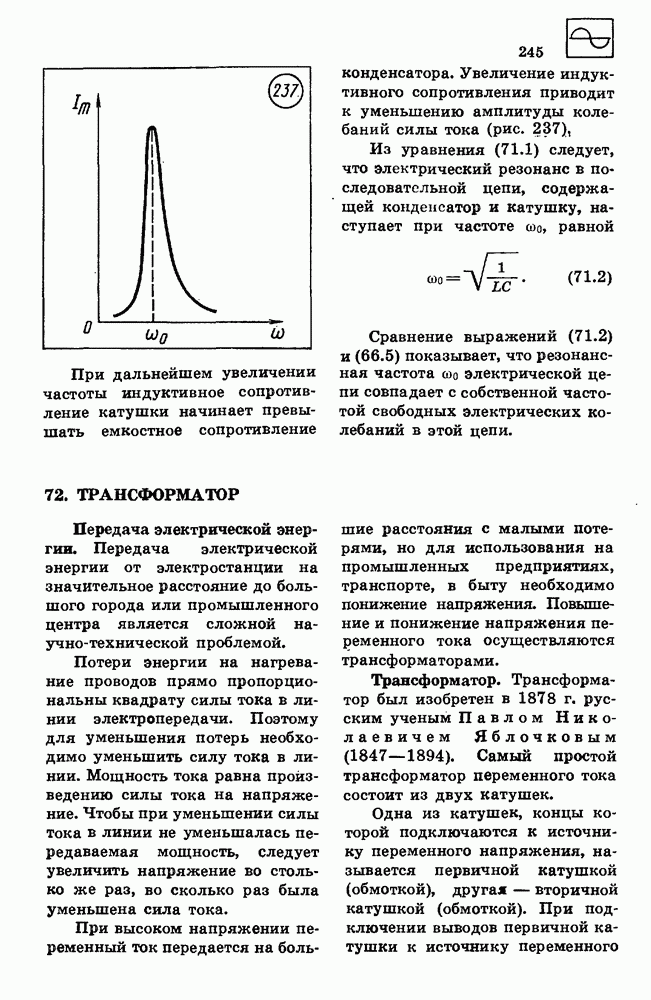
- 71. РЕЗОНАНС В ЭЛЕКТРИЧЕСКОЙ ЦЕПИ
- 72. ТРАНСФОРМАТОР
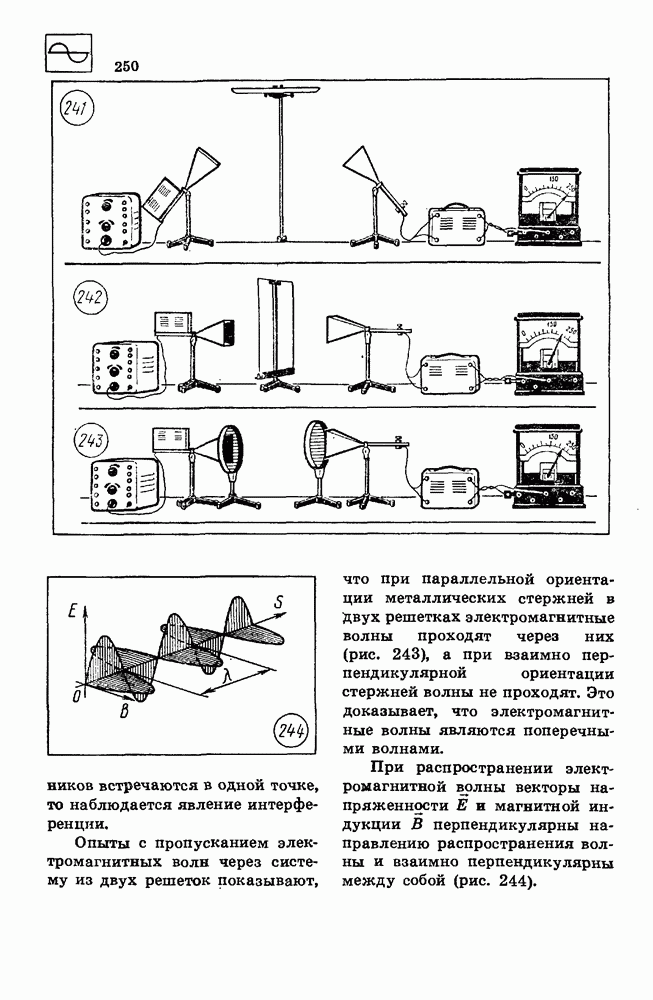
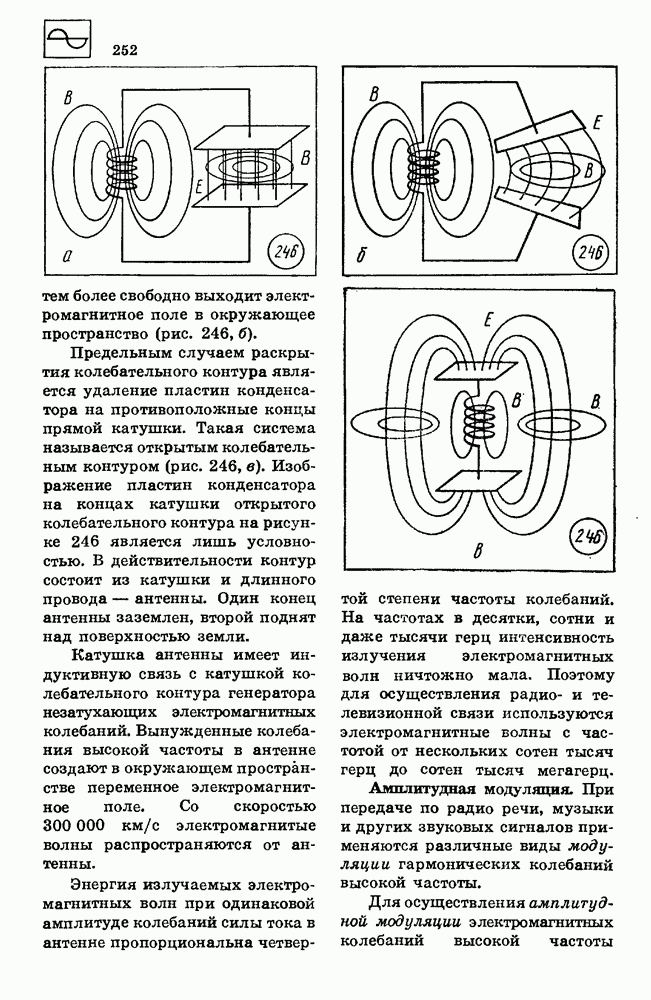
- 73. ЭЛЕКТРОМАГНИТНЫЕ ВОЛНЫ
- 74. ПРИНЦИПЫ РАДИОСВЯЗИ
- 75. ЭНЕРГИЯ ЭЛЕКТРОМАГНИТНЫХ ВОЛН
- 76. РАЗВИТОЕ ПРЕДСТАВЛЕНИИ О ПРИРОДЕ СВЕТА
- 77. ОТРАЖЕНИЕ И ПРЕЛОМЛЕНИЕ СВЕТА
- 78. ВОЛНОВЫЕ СВОЙСТВА СВЕТА
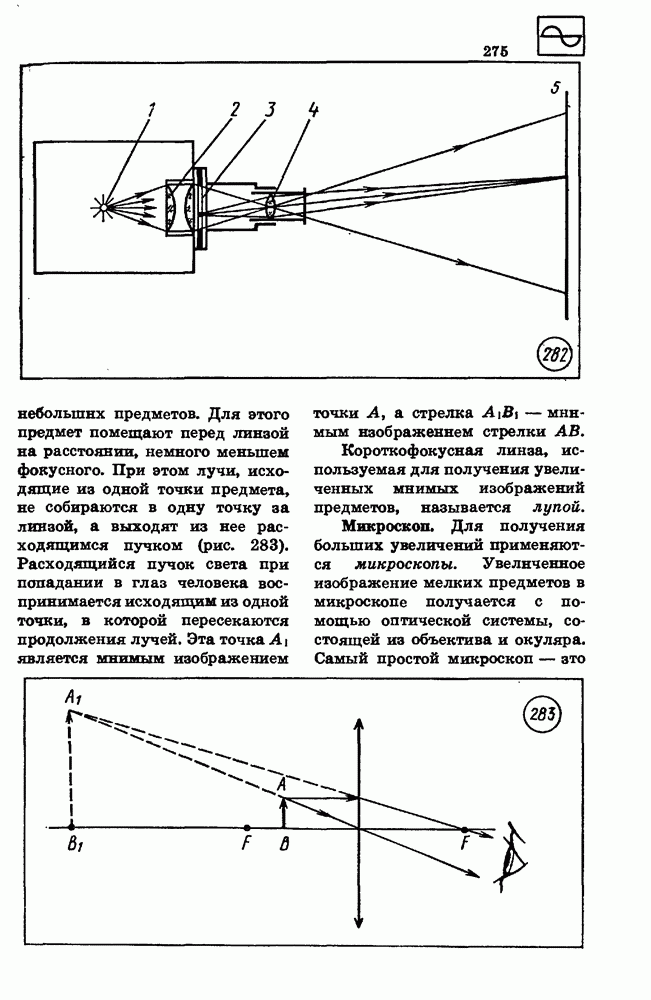
- 79. ОПТИЧЕСКИЕ ПРИБОРЫ
- 80. СПЕКТР ЭЛЕКТРОМАГНИТНЫХ ИЗЛУЧЕНИЙ
- 81. ЭЛЕМЕНТЫ ТЕОРИИ ОТНОСИТЕЛЬНОСТИ
- ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
- 82. КВАНТОВЫЕ СВОЙСТВА СВЕТА
- 83. ДОКАЗАТЕЛЬСТВА СЛОЖНОЙ СТРУКТУРЫ АТОМОВ
- 84. КВАНТОВЫЕ ПОСТУЛАТЫ БОРА
- 86. АТОМНОЕ ЯДРО
- 87. РАДИОАКТИВНОСТЬ
- 88. СВОЙСТВА ЯДЕРНЫХ ИЗЛУЧЕНИЙ
- 89. ЭКСПЕРИМЕНТАЛЬНЫЕ МЕТОДЫ РЕГИСТРАЦИИ ЗАРЯЖЕННЫХ ЧАСТИЦ
- 90. ЦЕПНАЯ РЕАКЦИЯ ДЕЛЕНИЯ ЯДЕР УРАНА
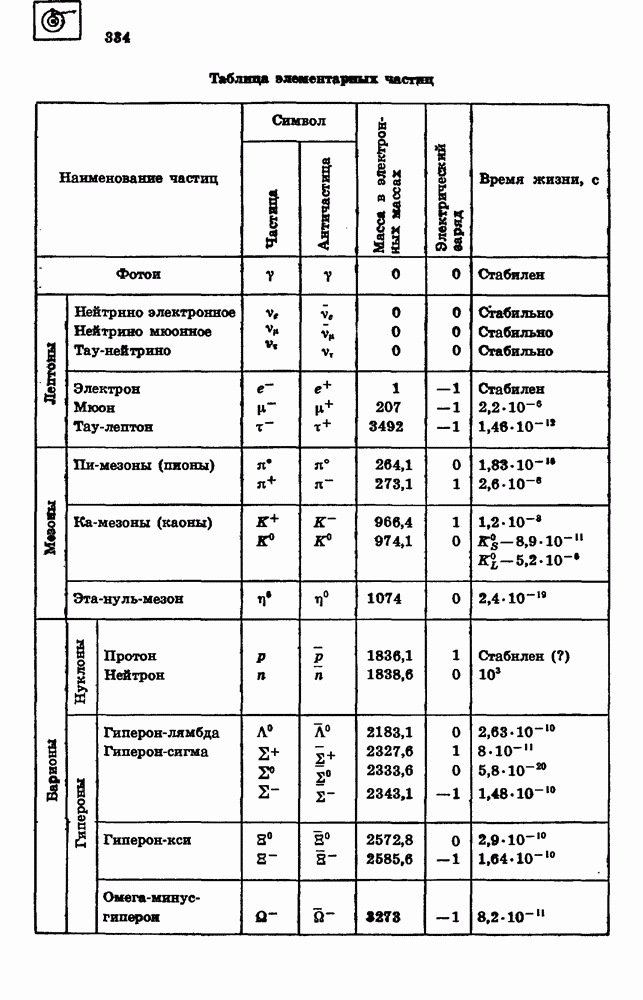
- 91. ЭЛЕМЕНТАРНЫЕ ЧАСТИЦЫ
- ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
- ПРИЛОЖЕНИЯ