| << Предыдущий параграф | Следующий параграф >> |
Пред.
След.
Макеты страниц
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
ДЛЯ СТУДЕНТОВ И ШКОЛЬНИКОВ ЕСТЬ
ZADANIA.TO
Краткое содержание главы
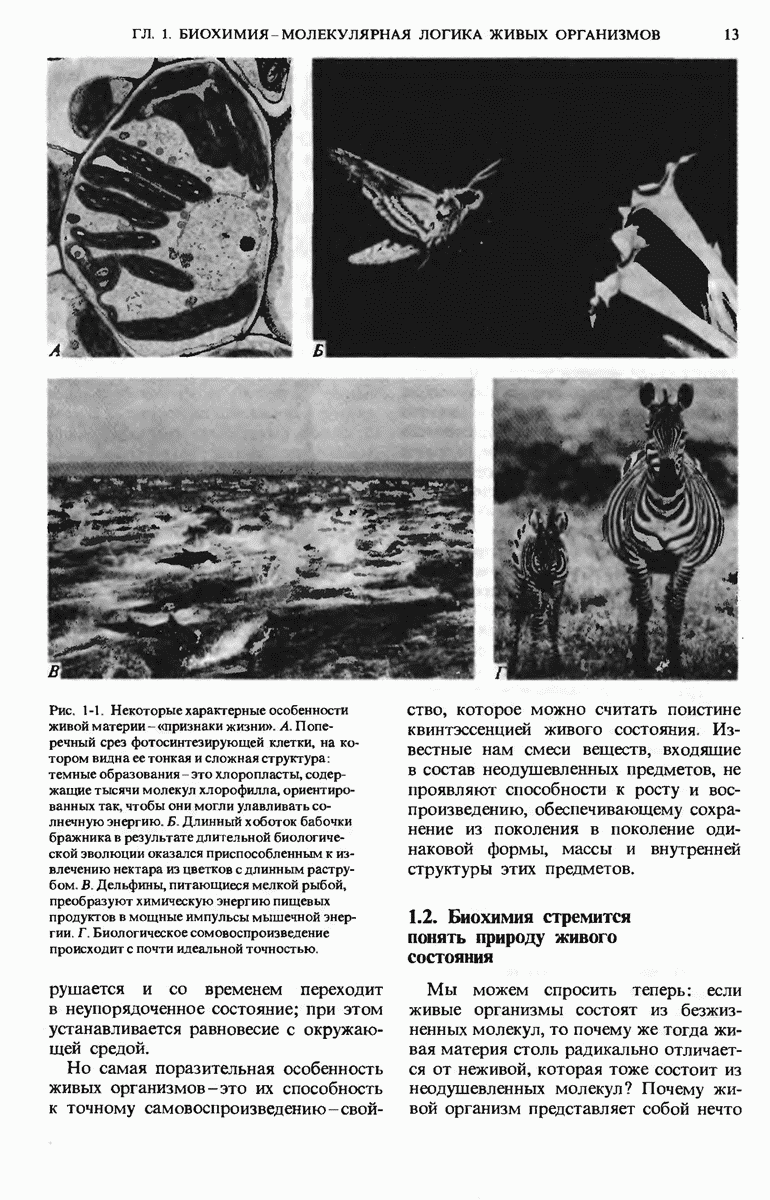
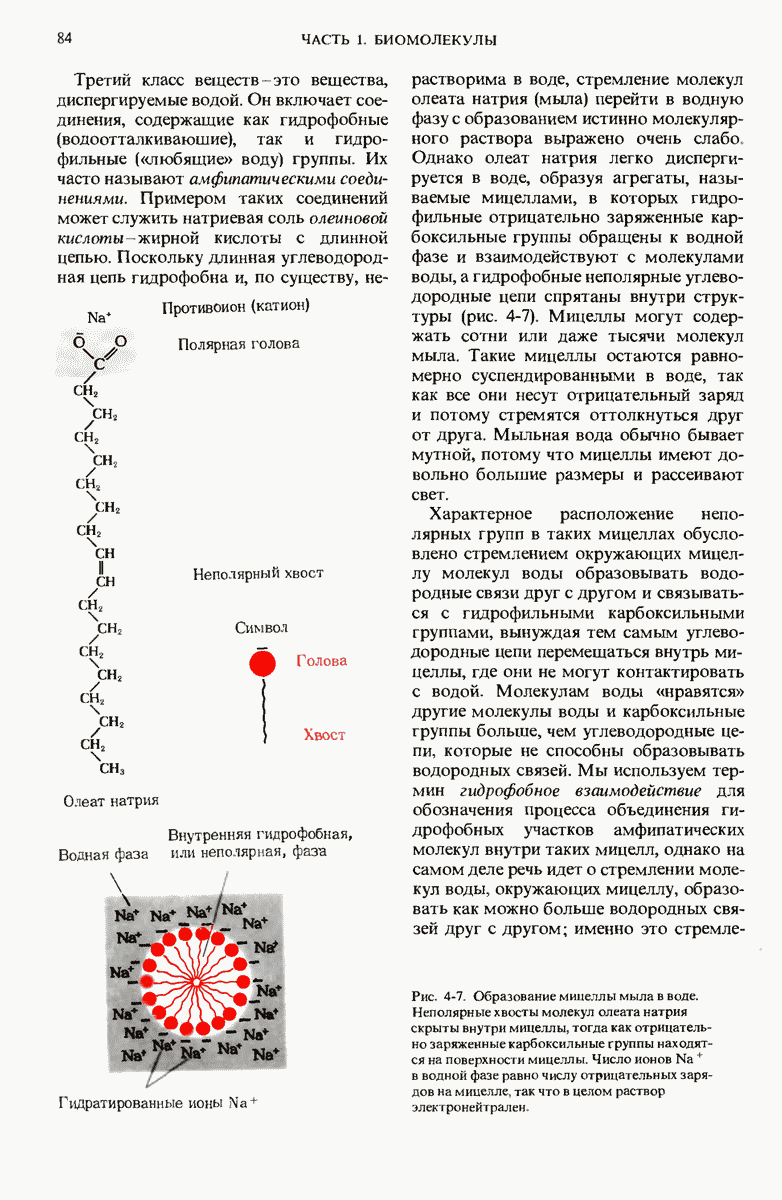
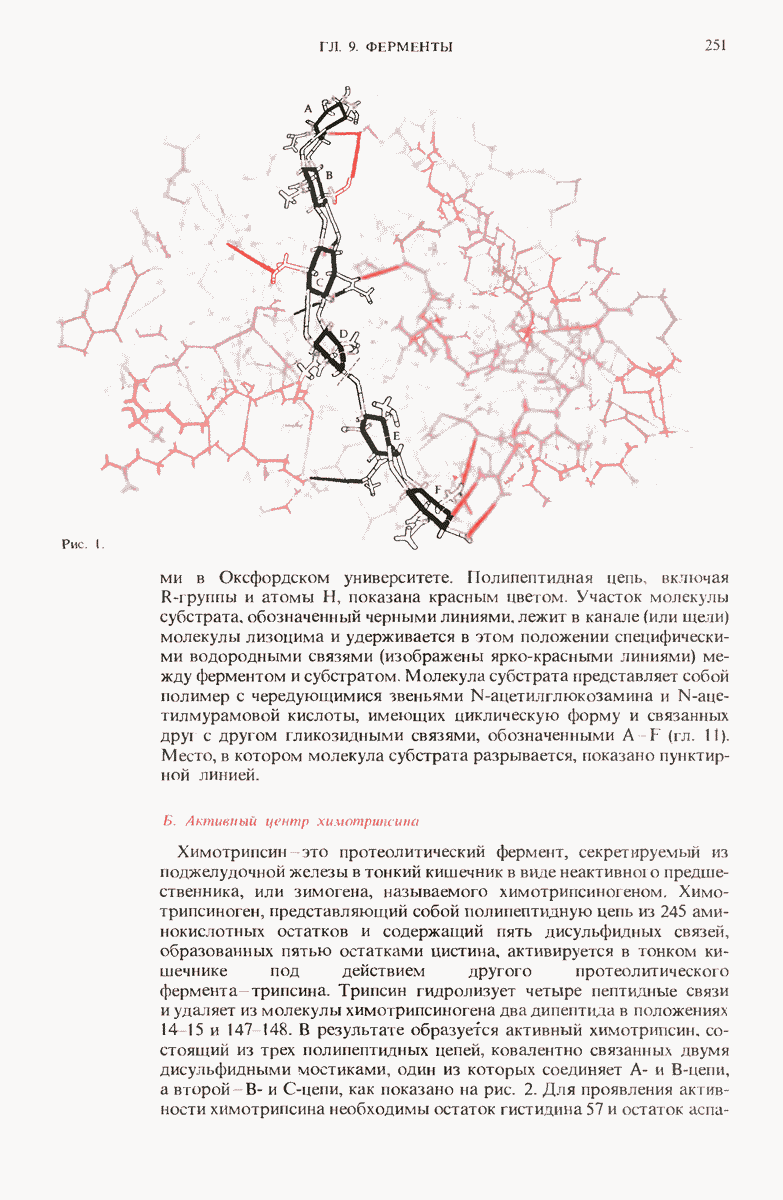
Вода это самое распространенное соединение в живых организмах. Относительно высокие значения температуры замерзания, температуры кипения и теплоты испарения воды обусловлены сильными межмолекулярными взаимодействиями, проявляющимися в форме многочисленных водородных связей между соседними молекулами воды. Жидкая вода состоит из короткоживущих скоплений (кластеров) молекул, связанных друг с другом водородными связями. Полярность воды и сильно выраженная способность ее молекул образовывать водородные связи делает воду прекрасным растворителем для многих ионных соединений и других веществ, имеющих полярные молекулы. Вода диспергирует также амфипатические вещества, например мыла, с образованием агрегатов молекул, называемых мицеллами. в которых гидрофобные группы спрятаны внутри и не контактируют с водой, тогда как заряженные группы расположены на внешней поверхности.
Вода очень слабо диссоциирует, образуя ионы Н+ и ОН-. В разбавленных водных растворах концентрации ионов Н+ и ОН- связаны между собой обратной зависимостью:  Концентрацию ионов водорода в биологических системах обычно выражают в виде pH, величина которого численно равна отрицательному логарифму концентрации ионов
Концентрацию ионов водорода в биологических системах обычно выражают в виде pH, величина которого численно равна отрицательному логарифму концентрации ионов  Величину pH водных растворов измеряют при помощи стеклянных электродов, чувствительных к концентрации ионов
Величину pH водных растворов измеряют при помощи стеклянных электродов, чувствительных к концентрации ионов  .
.
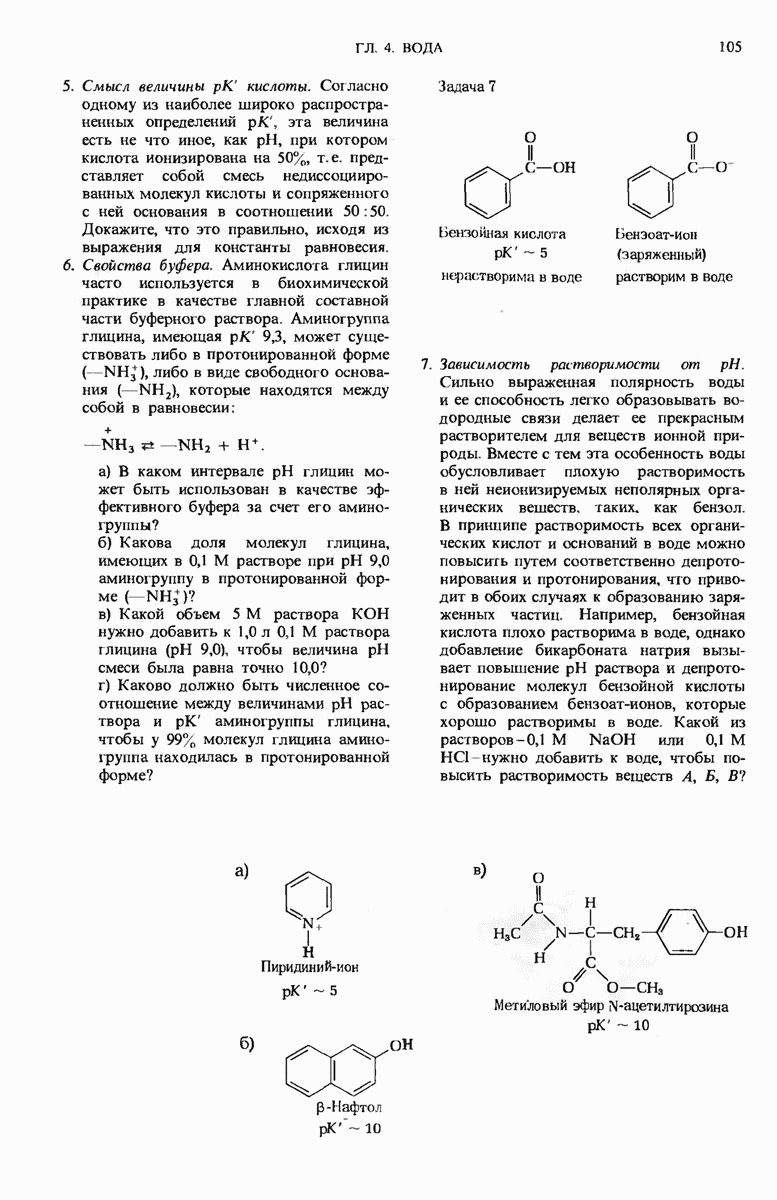
Кислоты можно определить как доноры протонов, а основания - как акцепторы протонов. Сопряженная кислотно-основная пара состоит из донора протона НА и соответствующего ему акцептора протона  . Способность кислоты НА отдавать свой протон характеризуется ее константой диссоциации
. Способность кислоты НА отдавать свой протон характеризуется ее константой диссоциации

или величиной  определяемой как —
определяемой как —  . Величина pH водного раствора слабой кислоты количественно связана со значением ее
. Величина pH водного раствора слабой кислоты количественно связана со значением ее  и с отношением концентраций ее протонно-донорной и протонно-акцепторной форм.
и с отношением концентраций ее протонно-донорной и протонно-акцепторной форм.
Сопряженная кислотно-основная пара может функционировать в качестве буфера, препятствующего изменениям pH при добавлении к раствору щелочи или кислоты; ее буферная емкость максимальна при значении pH, численно равном ее  . Наиболее важными в биологическом отношении буферными парами являются
. Наиболее важными в биологическом отношении буферными парами являются  и
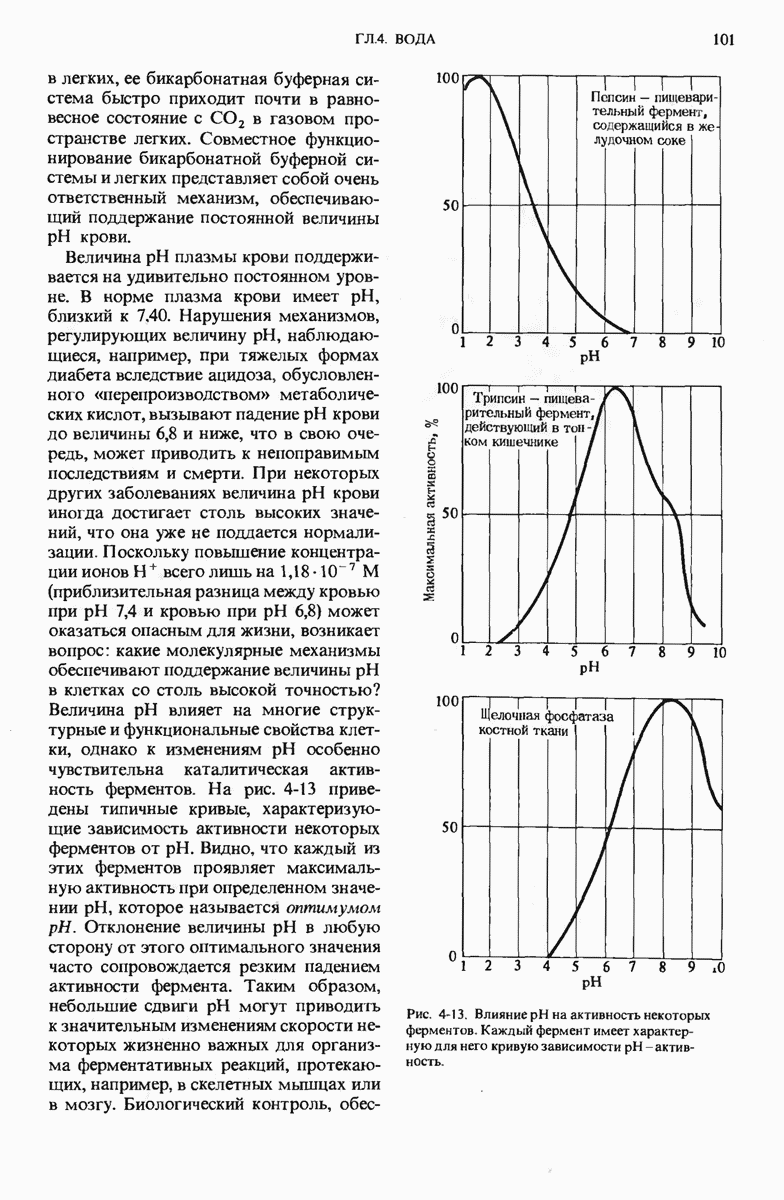
и  . Каталитическая активность ферментов сильно зависит от pH.
. Каталитическая активность ферментов сильно зависит от pH.
| << Предыдущий параграф | Следующий параграф >> |
Оглавление
- ПРЕДИСЛОВИЕ РЕДАКТОРОВ ПЕРЕВОДА
- ПРЕДИСЛОВИЕ
- Благодарности
- ЧАСТЬ I. БИОМОЛЕКУЛЫ
- ГЛАВА 1. БИОХИМИЯ-МОЛЕКУЛЯРНАЯ ЛОГИКА ЖИВЫХ ОРГАНИЗМОВ
- 1.1. Для живой материи характерны некоторые отличительные особенности
- 1.2. Биохимия стремится понять природу живого состояния
- 1.3. Все живые организмы содержат органические макромолекулы, построенные по общему плану
- 1.4. Обмен веществ и энергии в живых организмах
- 1.5. Ферменты, играющие роль катализаторов в живых клетках, управляют сложно организованной сетью химических реакций
- 1.6. Клетки используют энергию в химической форме
- 1.7. Процессы клеточного метаболизма находятся под постоянным контролем
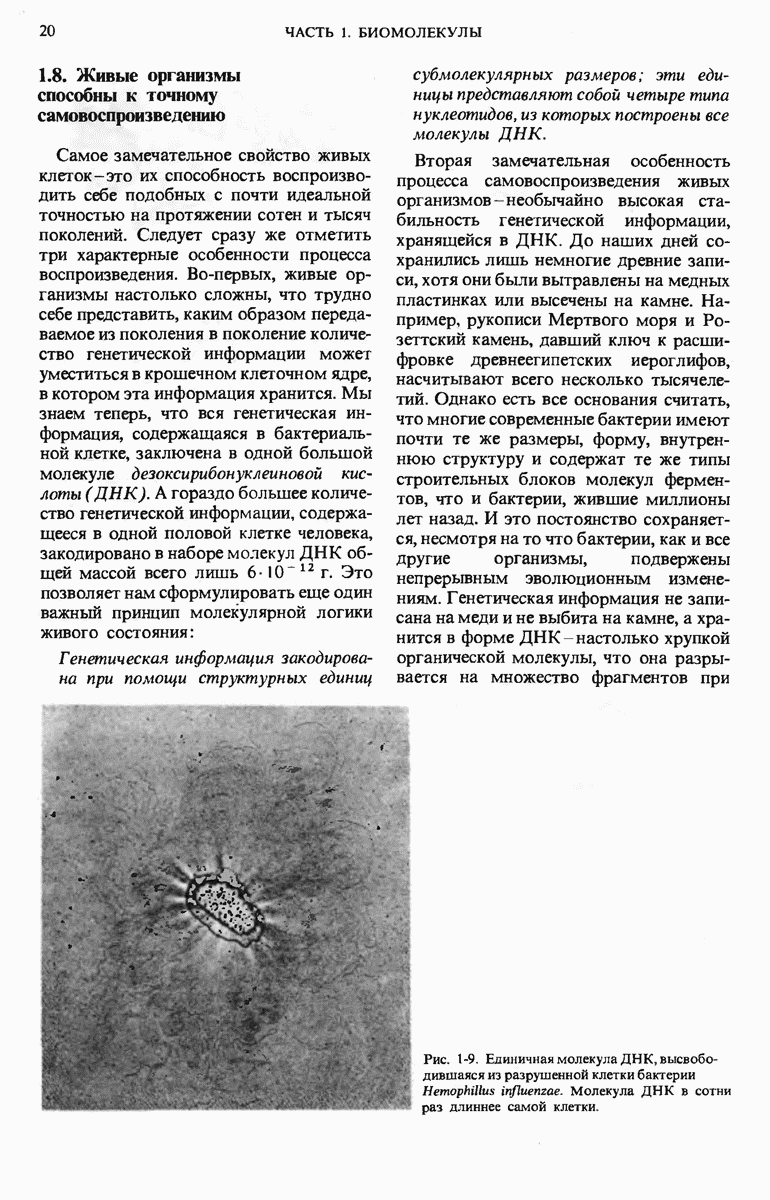
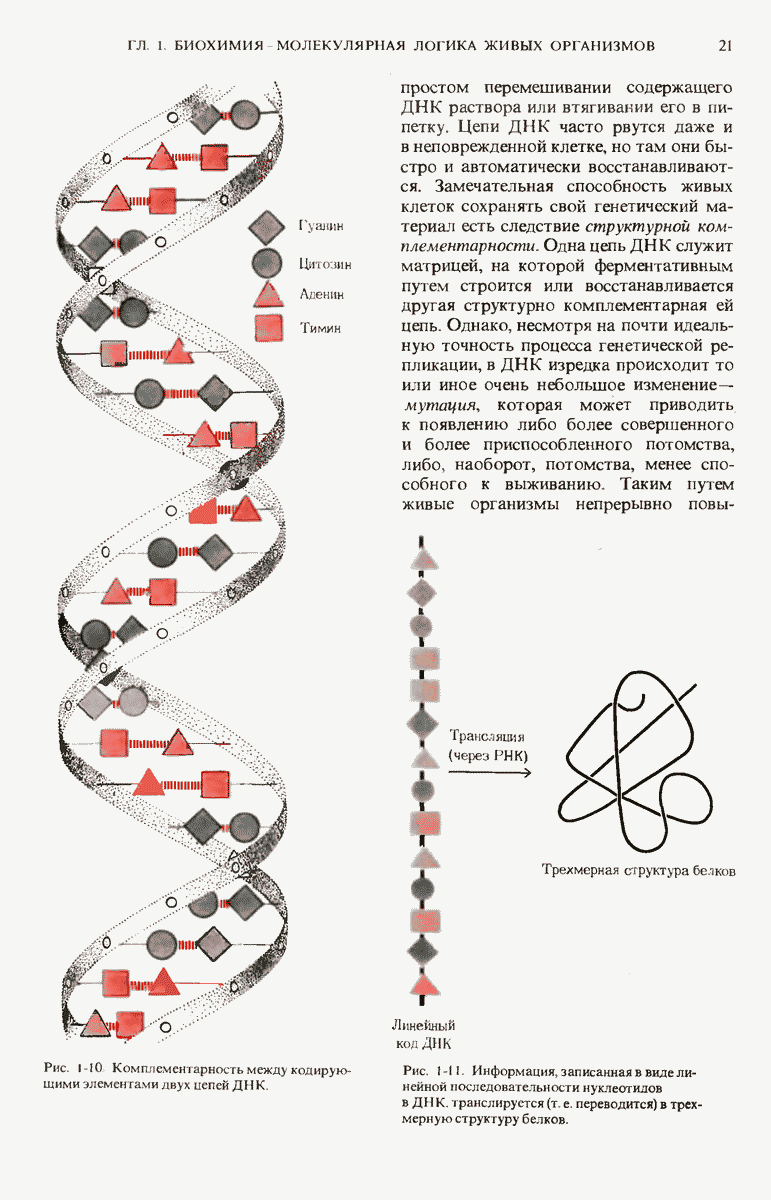
- 1.8. Живые организмы способны к точному самовоспроизведению
- ГЛАВА 2. КЛЕТКИ
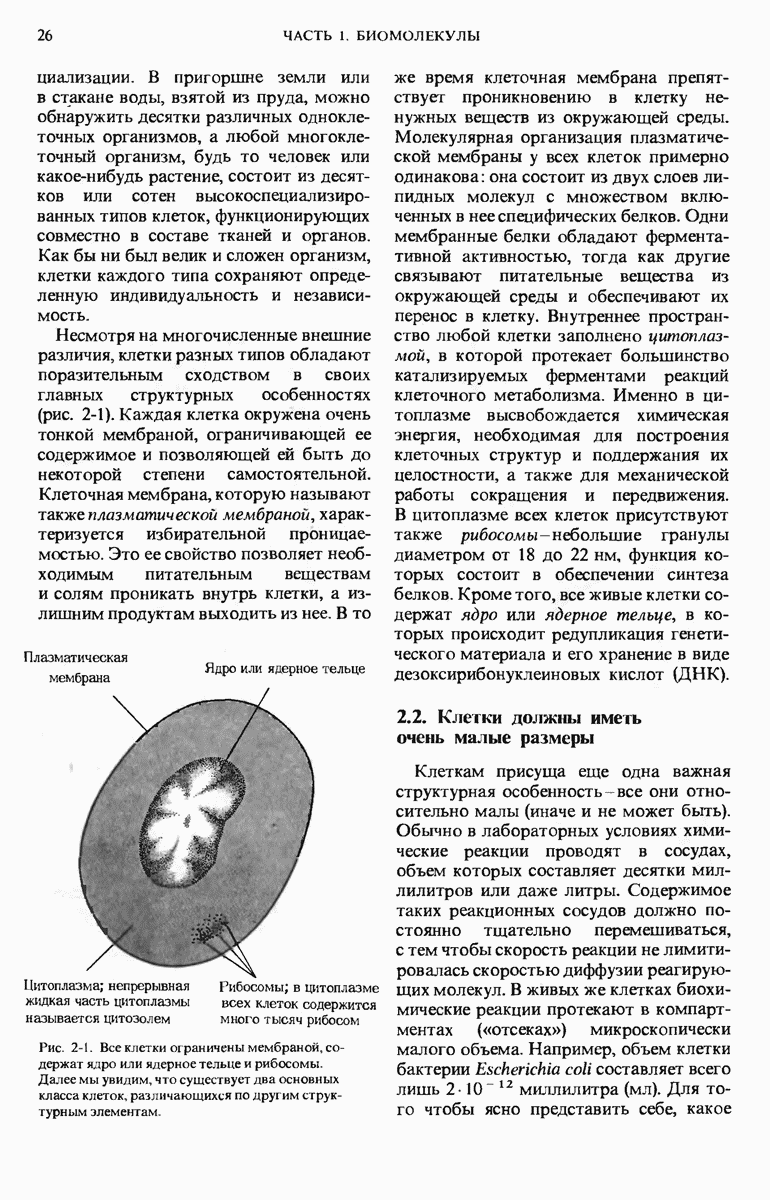
- 2.1. Все клетки обладают некоторыми общими структурными характеристиками
- 2.2. Клетки должны иметь очень малые размеры
- 2.3. Существуют два больших класса клеток — прокариотические и эукариотические
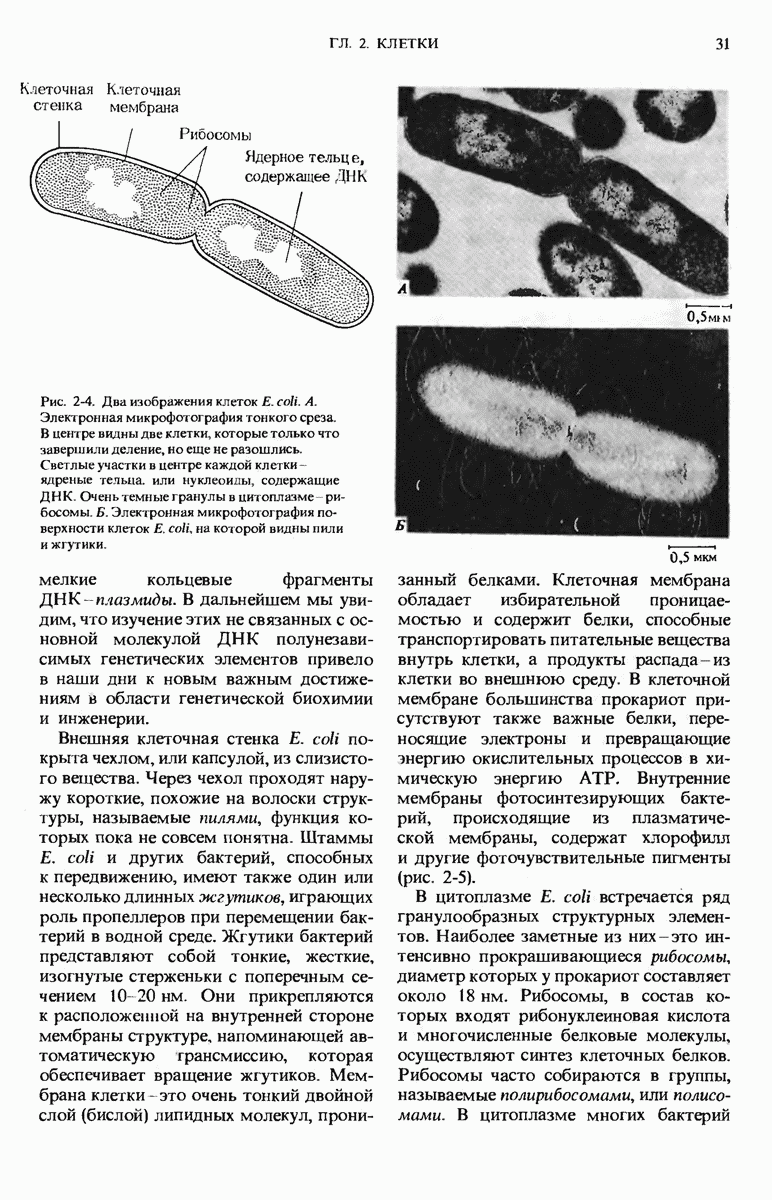
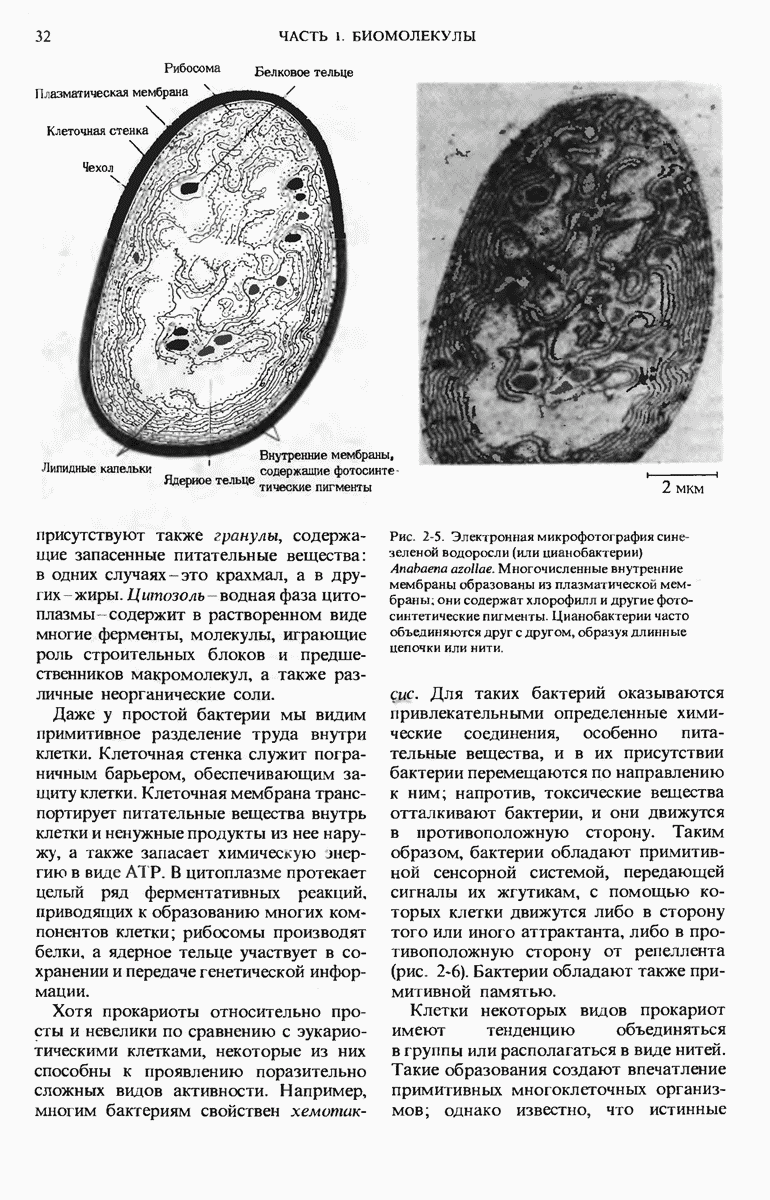
- 2.4. Прокариоты — самые простые и самые мелкие клетки
- 2.5. Escherichia coli — самая известная из прокариотических клеток
- 2.6. Эукариотические клетки крупнее и сложнее прокариотических
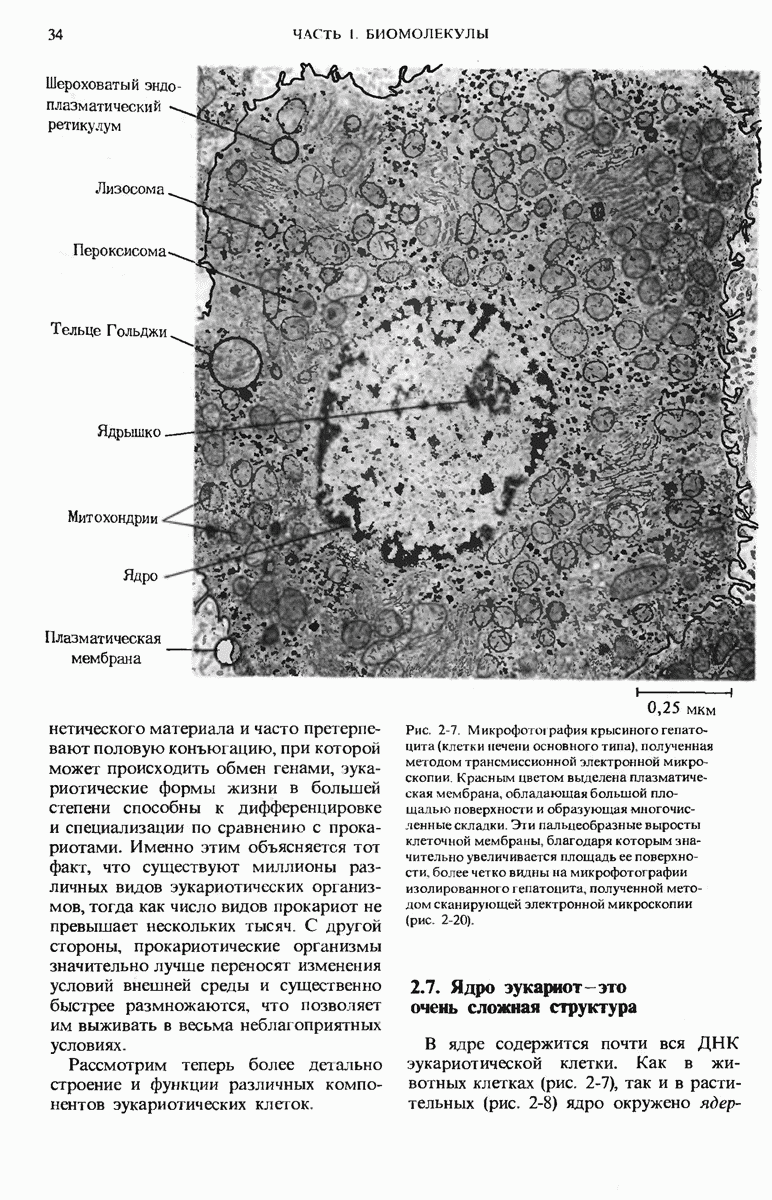
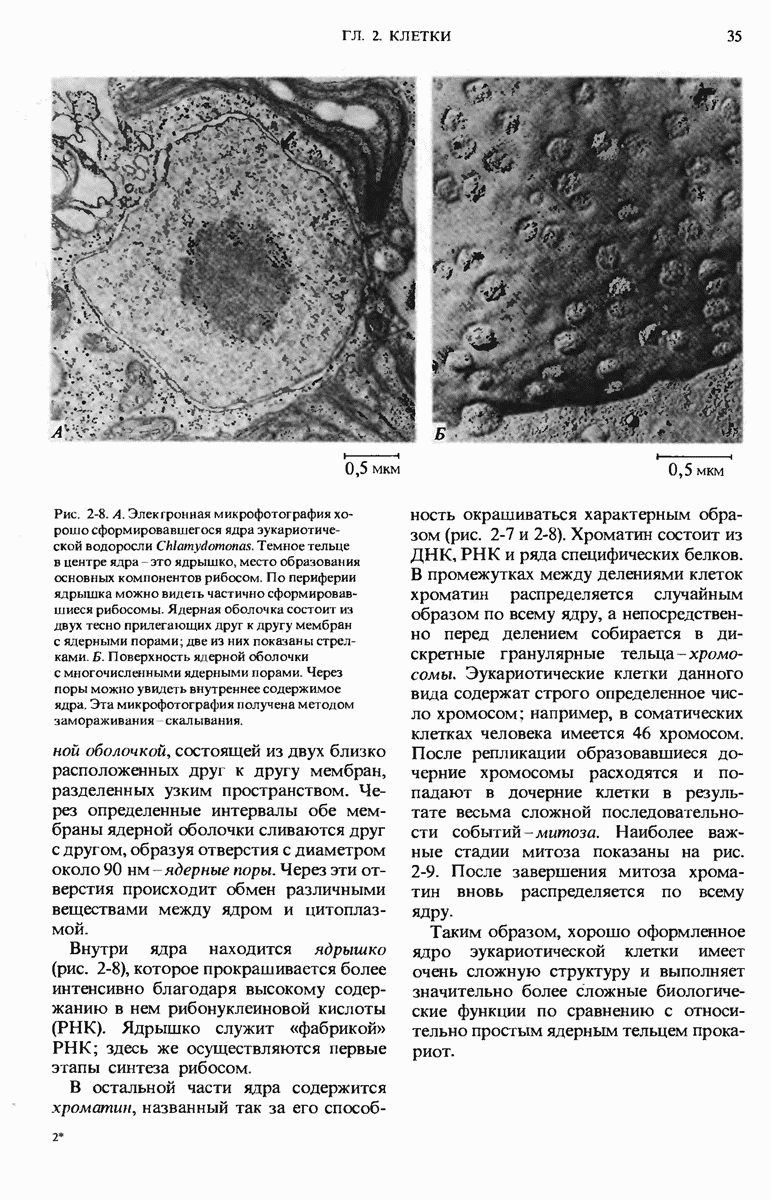
- 2.7. Ядро эукариот — это очень сложная структура
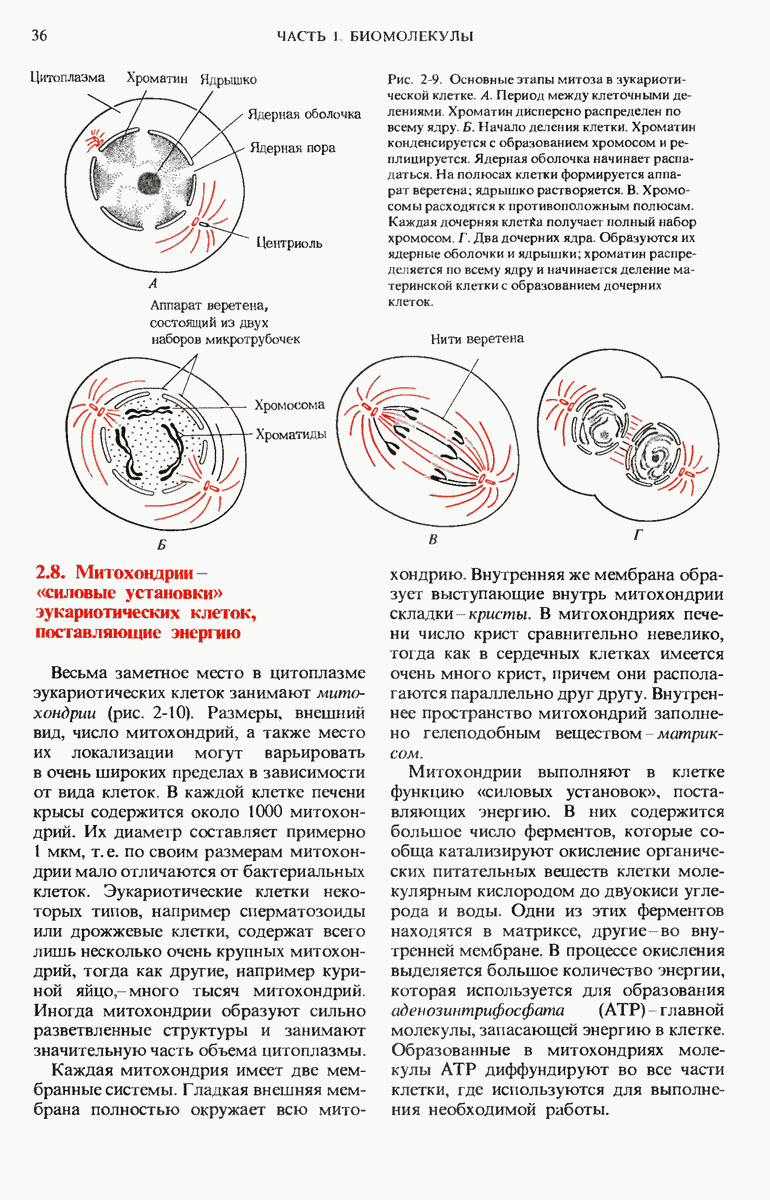
- 2.8. Митохондрии — «силовые установки» эукариотических клеток, поставляющие энергию
- 2.9. Эндоплазматический ретикулум образует каналы в цитоплазме
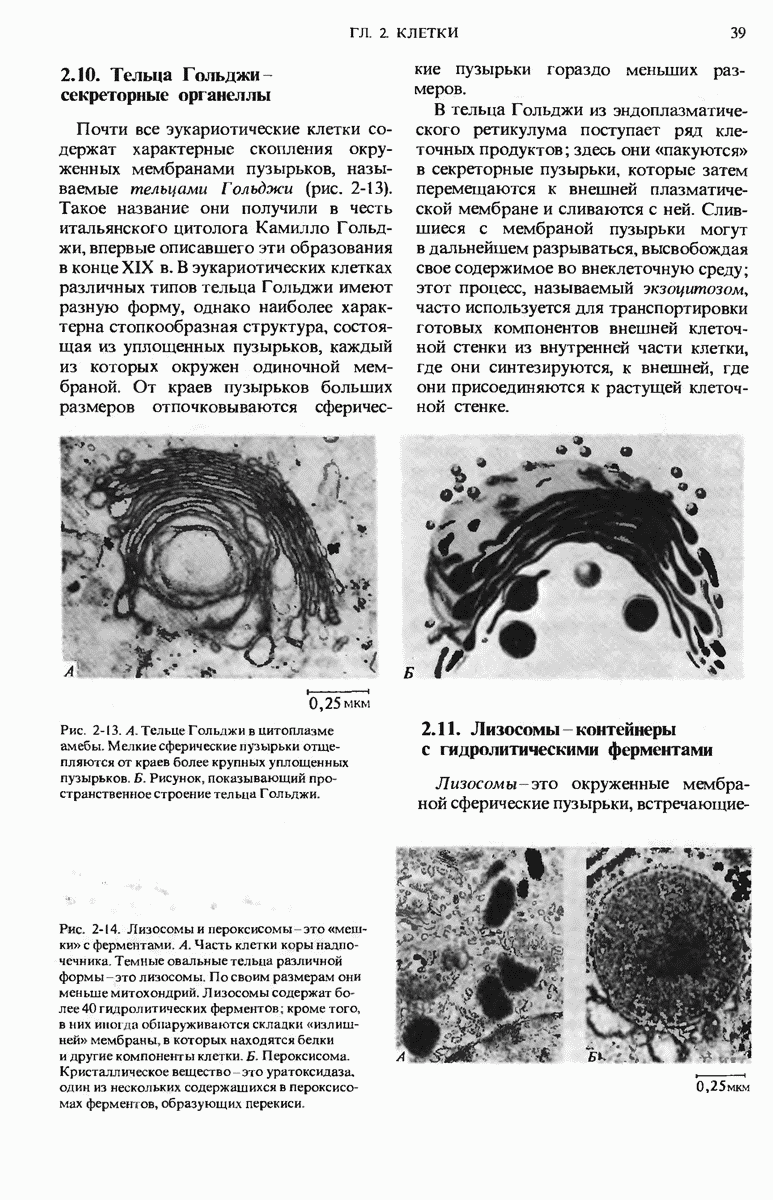
- 2.10. Тельца Гольджи — секреторные органеллы
- 2.11. Лизосомы — контейнеры с гидролитическими ферментами
- 2.12. Пероксисомы — пузырьки, разрушающие перекись водорода
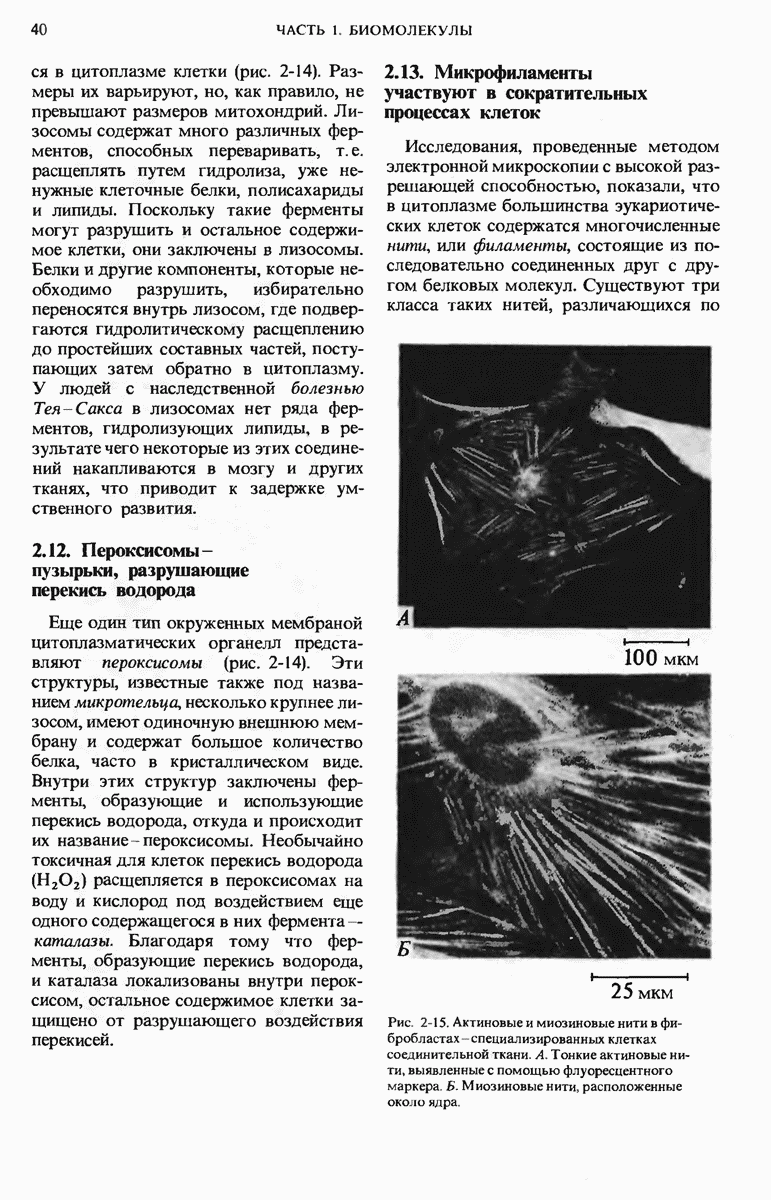
- 2.13. Микрофиламенты участвуют в сократительных процессах клеток
- 2.14. Микротрубочки также связаны с клеточными движениями
- 2.15. Микрофиламенты, микротрубочки и микротрабекулярная сеть образуют цитоскелет
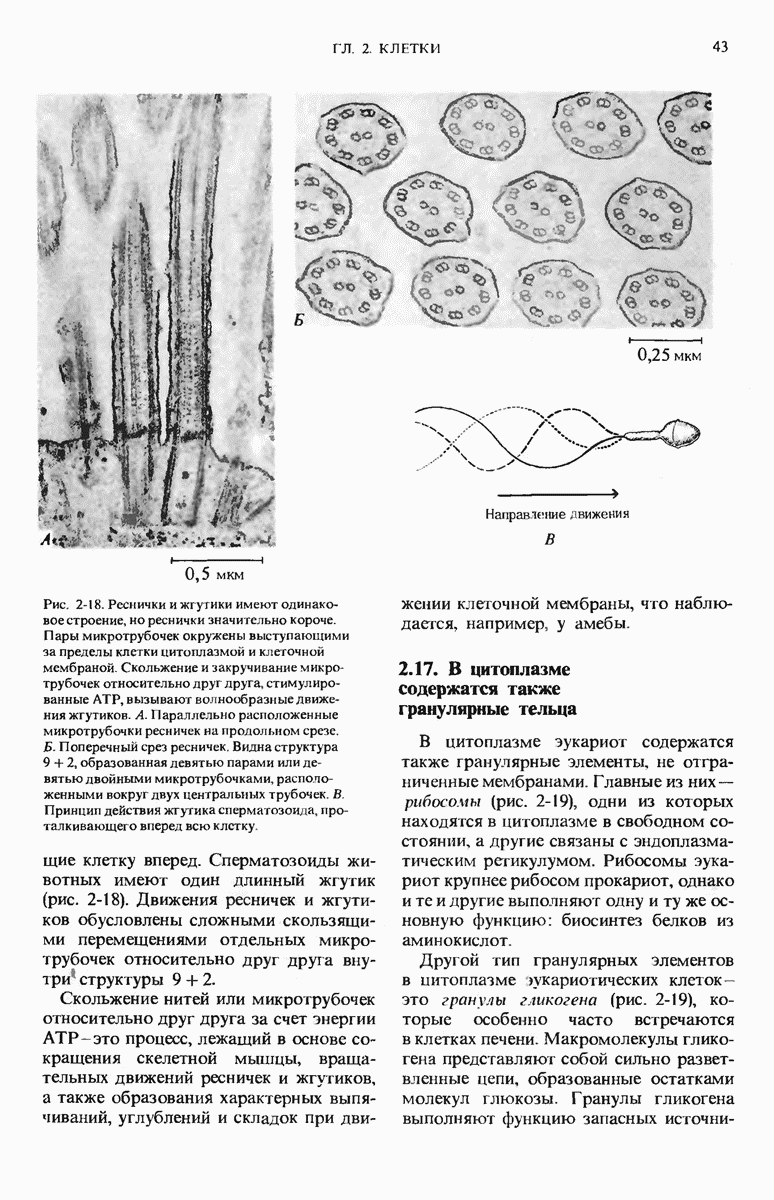
- 2.16. Реснички и жгутики позволяют клеткам передвигаться
- 2.17. В цитоплазме содержатся также гранулярные тельца
- 2.18. Цитозоль — непрерывная водная фаза цитоплазмы
- 2.19. Клеточная мембрана имеет большую площадь поверхности
- 2.20. На поверхности многих животных клеток имеются также «антенны»
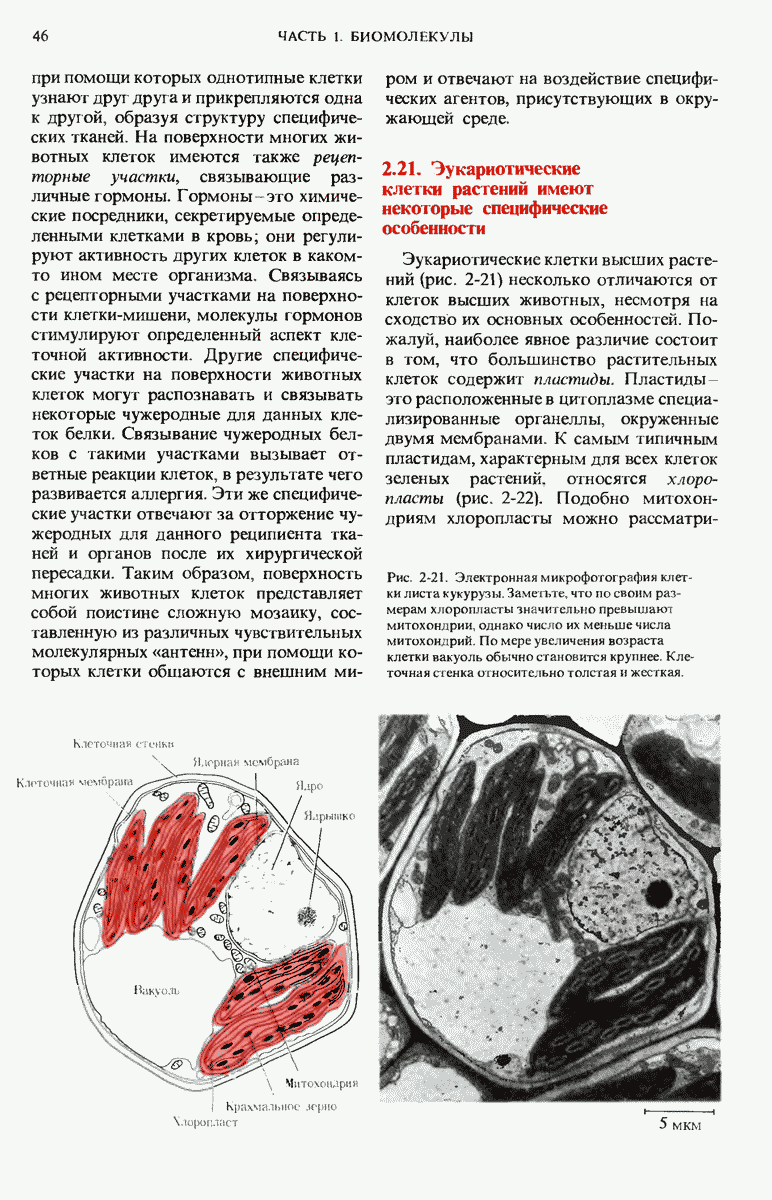
- 2.21. Эукариотические клетки растений имеют некоторые специфические особенности
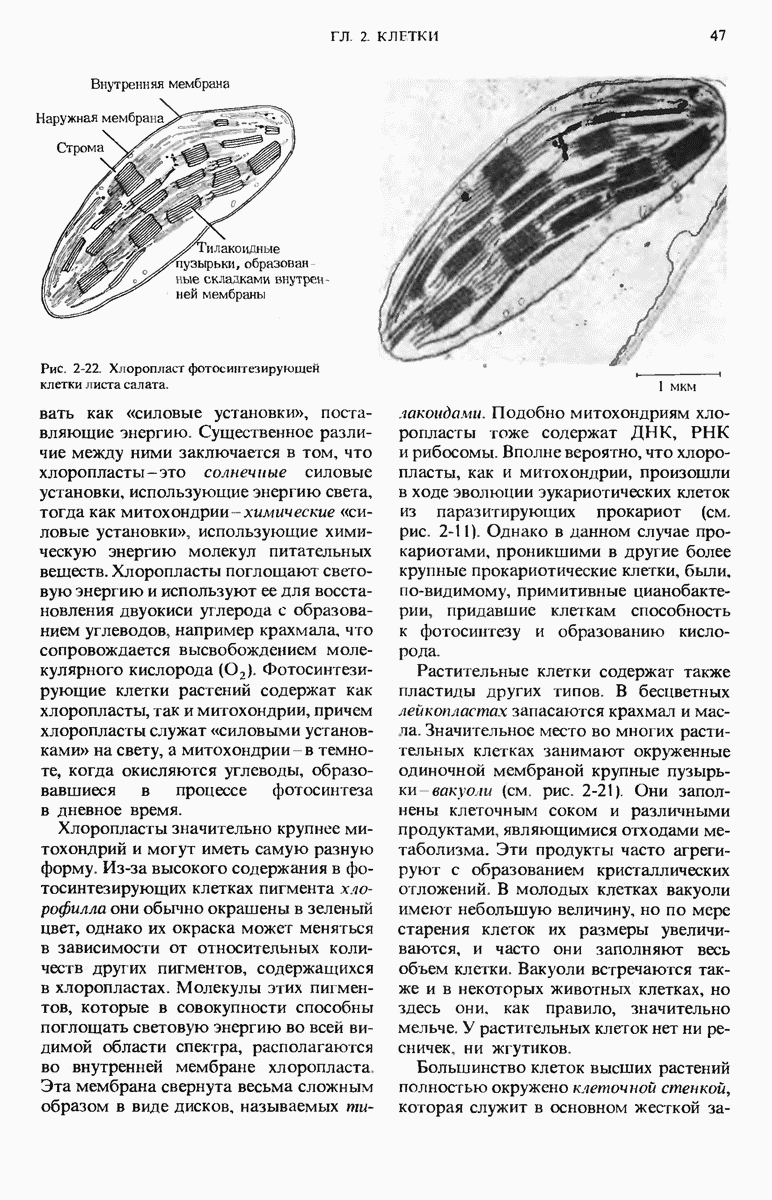
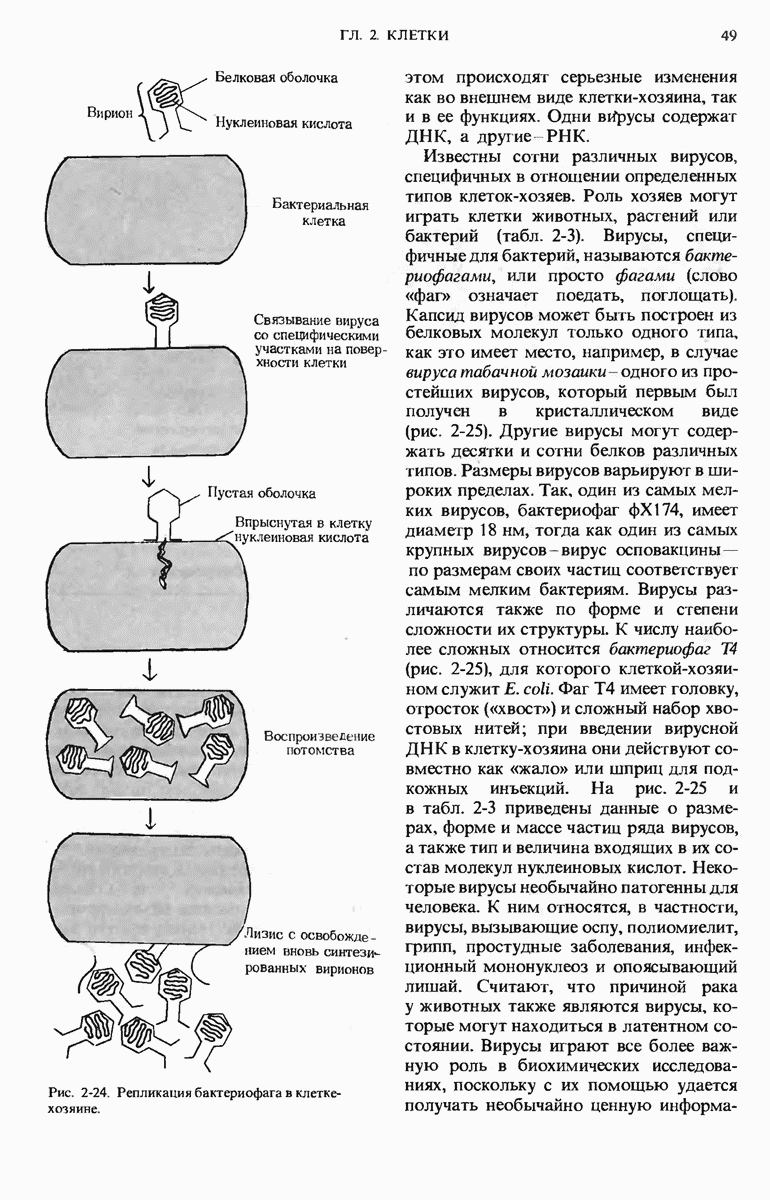
- 2.22. Вирусы — надмолекулярные паразиты
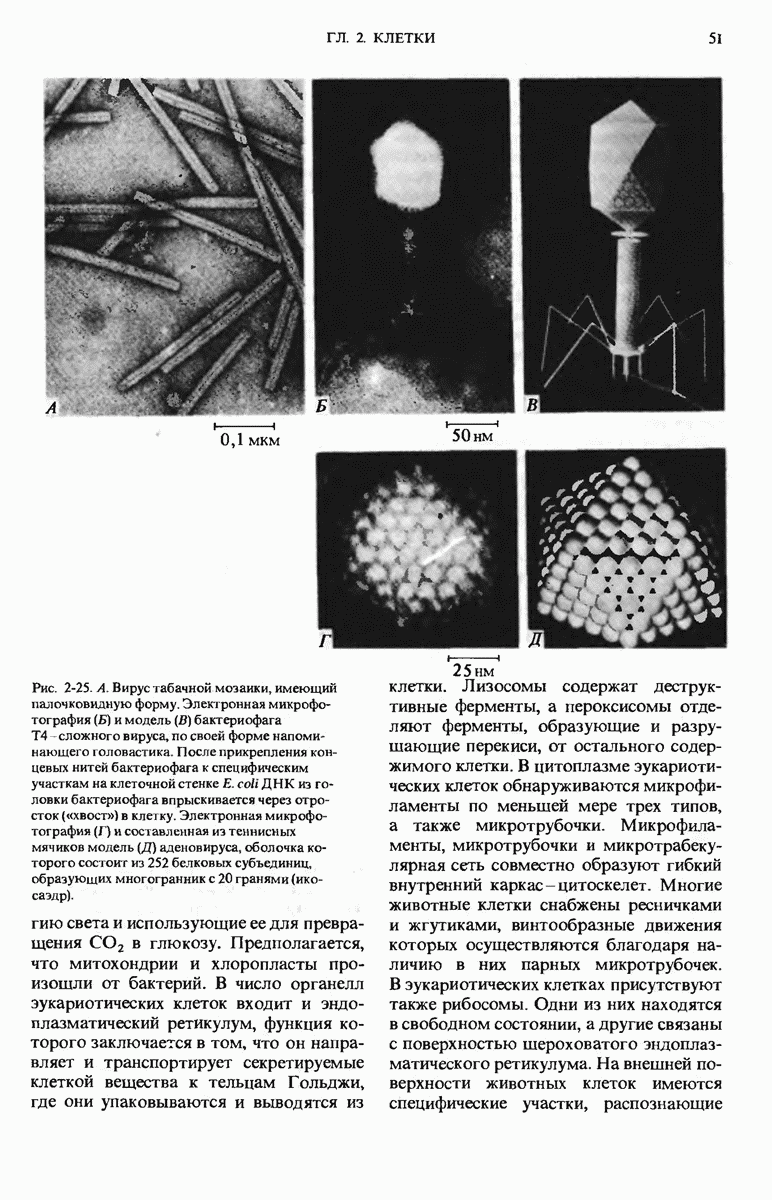
- Краткое содержание главы
- ЛИТЕРАТУРА
- Вопросы и задачи
- ГЛАВА 3. СОСТАВ ЖИВОЙ МАТЕРИИ: БИОМОЛЕКУЛЫ
- 3.1. Химический состав живой материи отличается от химического состава земной коры
- 3.2. Большинство биомолекул содержит углерод
- 3.3. Биомолекулы имеют специфическую форму и определенные размеры
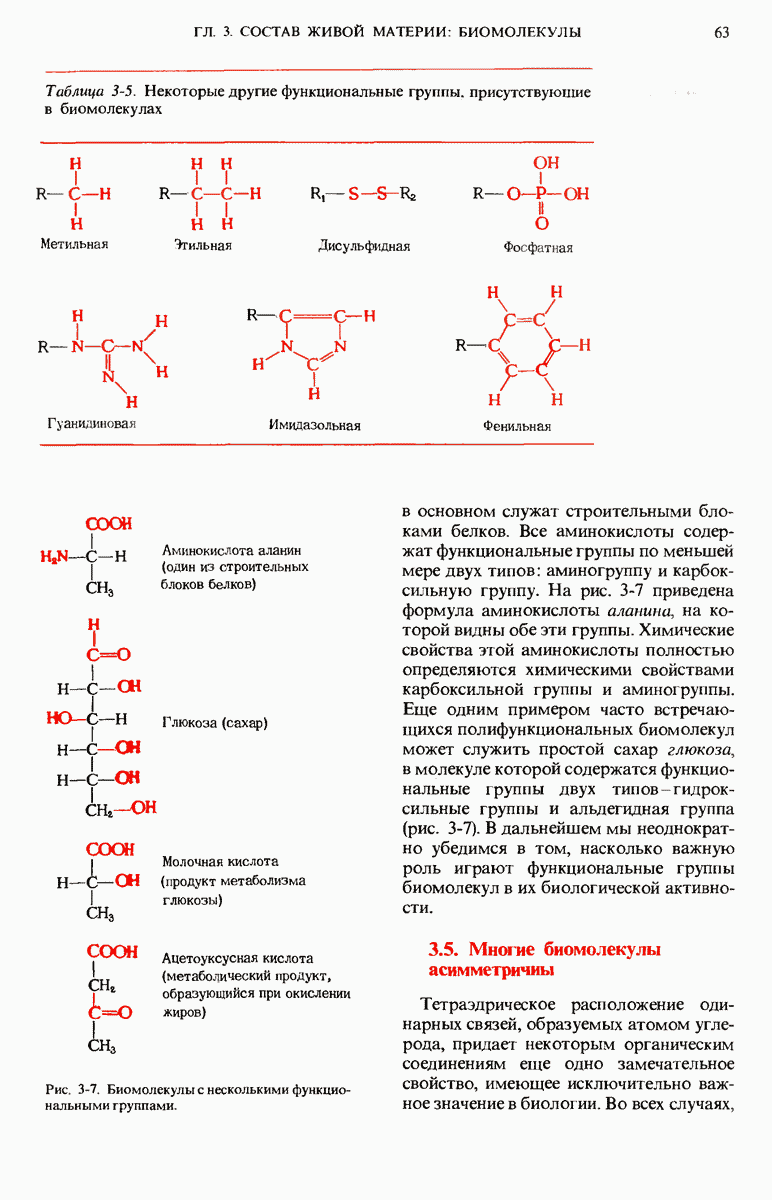
- 3.4. Функциональные группы органических биомолекул определяют их химические свойства
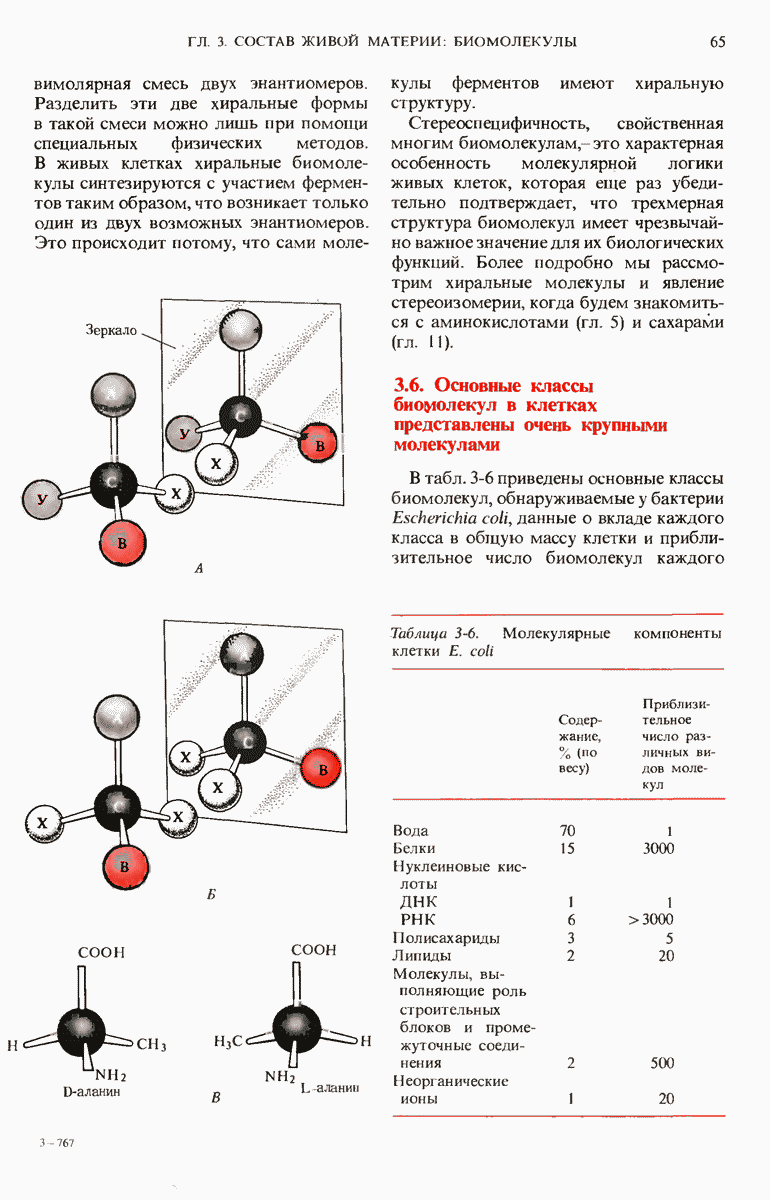
- 3.5. Многие биомолекулы асимметричны
- 3.6. Основные классы биомолекул в клетках представлены очень крупными молекулами
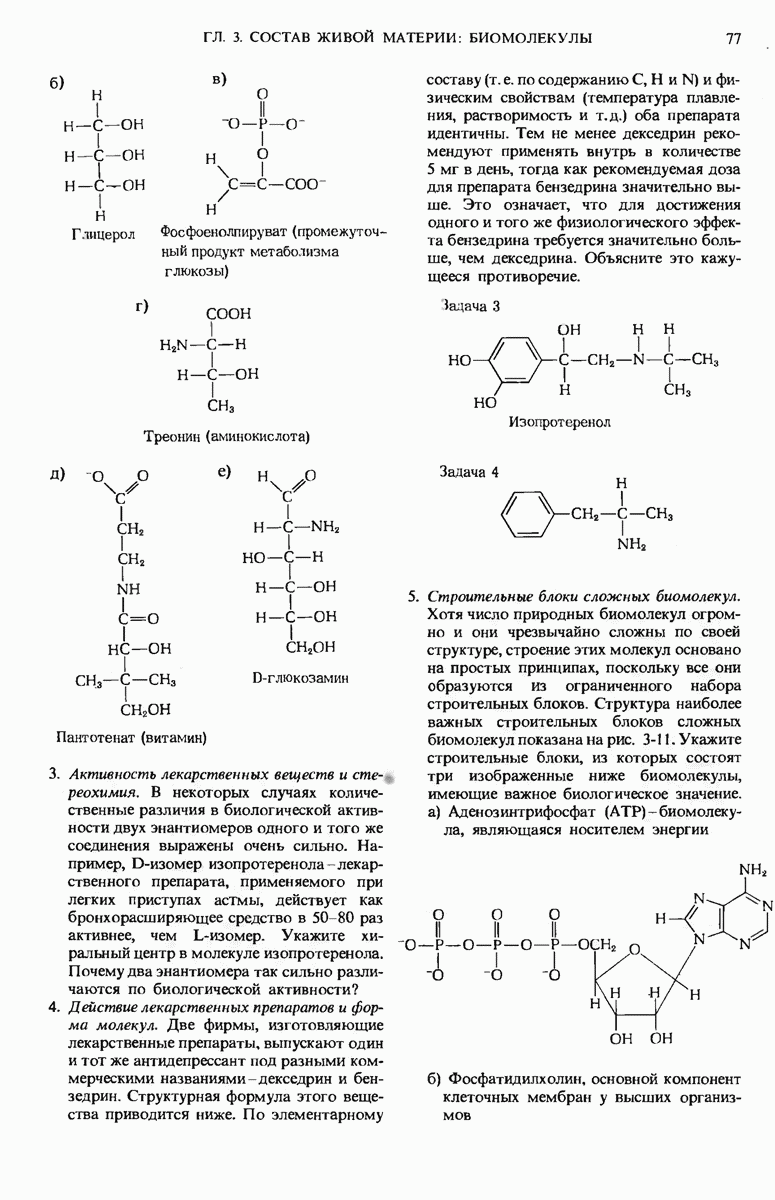
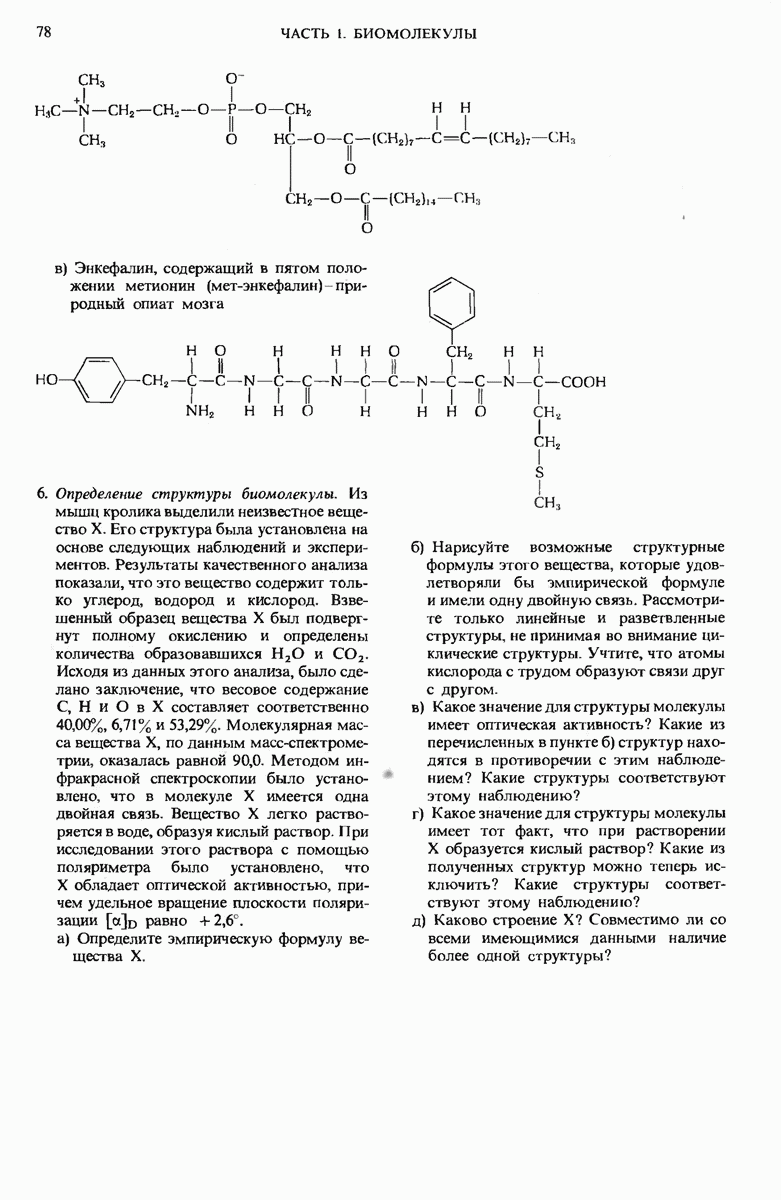
- 3.7. Макромолекулы образуются из небольших молекул, играющих роль строительных блоков
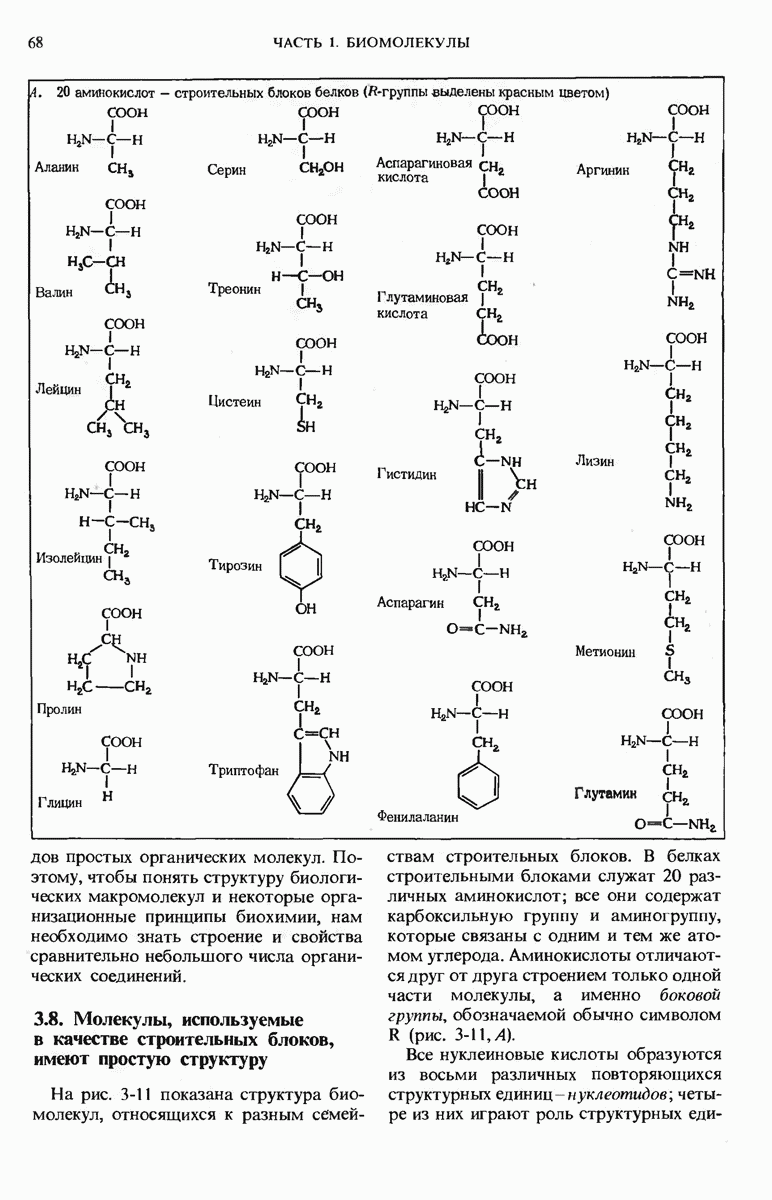
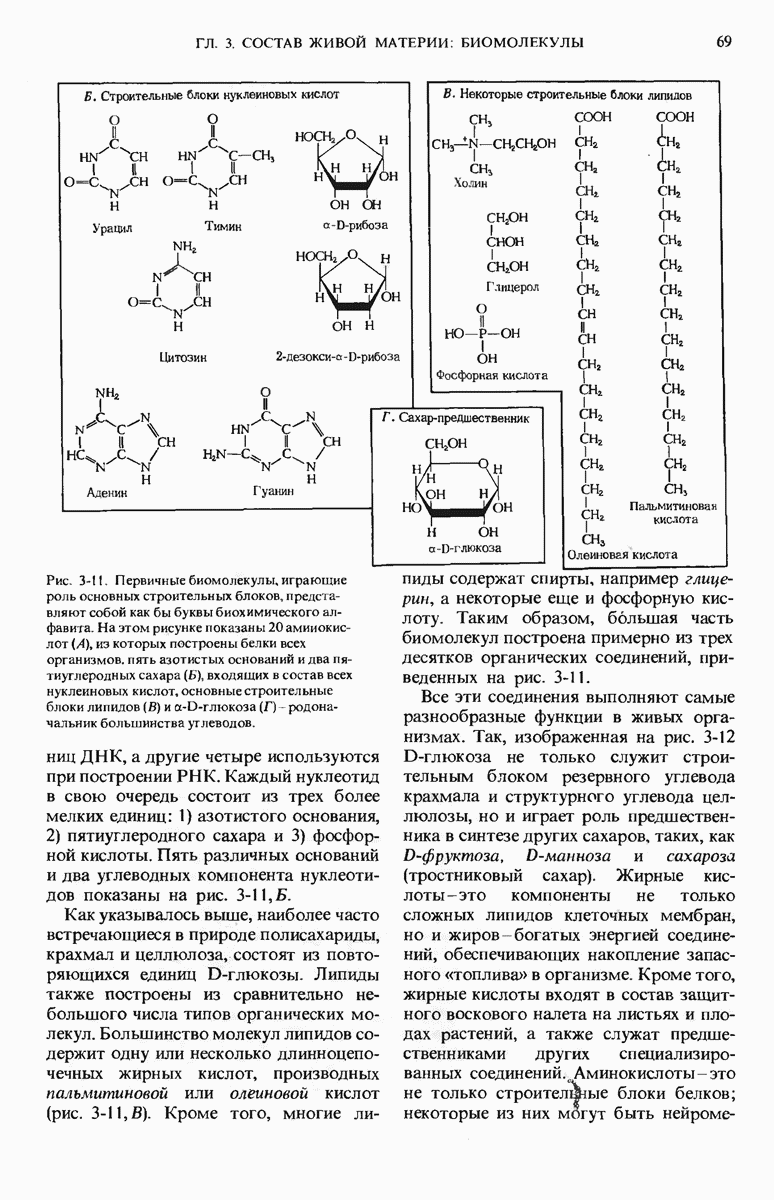
- 3.8. Молекулы, используемые в качестве строительных блоков, имеют простую структуру
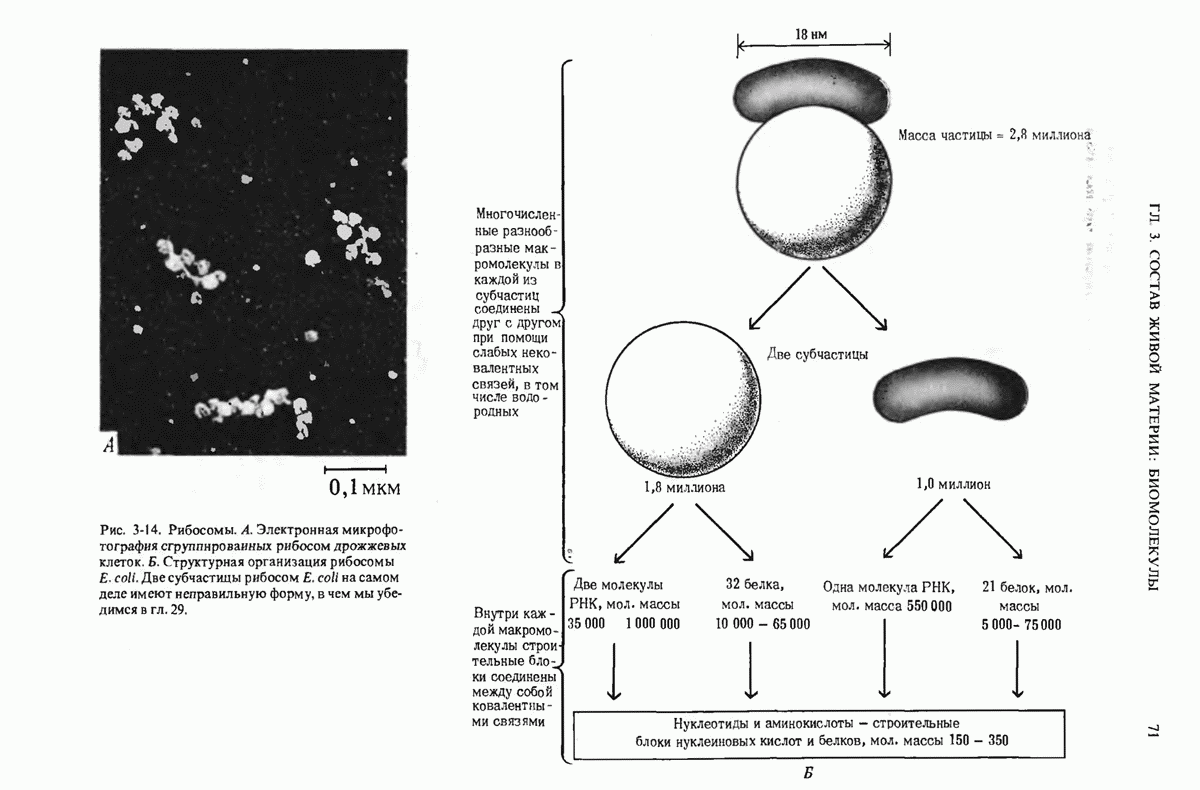
- 3.9. Структурная иерархия в молекулярной организации клеток
- 3.10. Биомолекулы первыми возникли в процессе химической эволюции
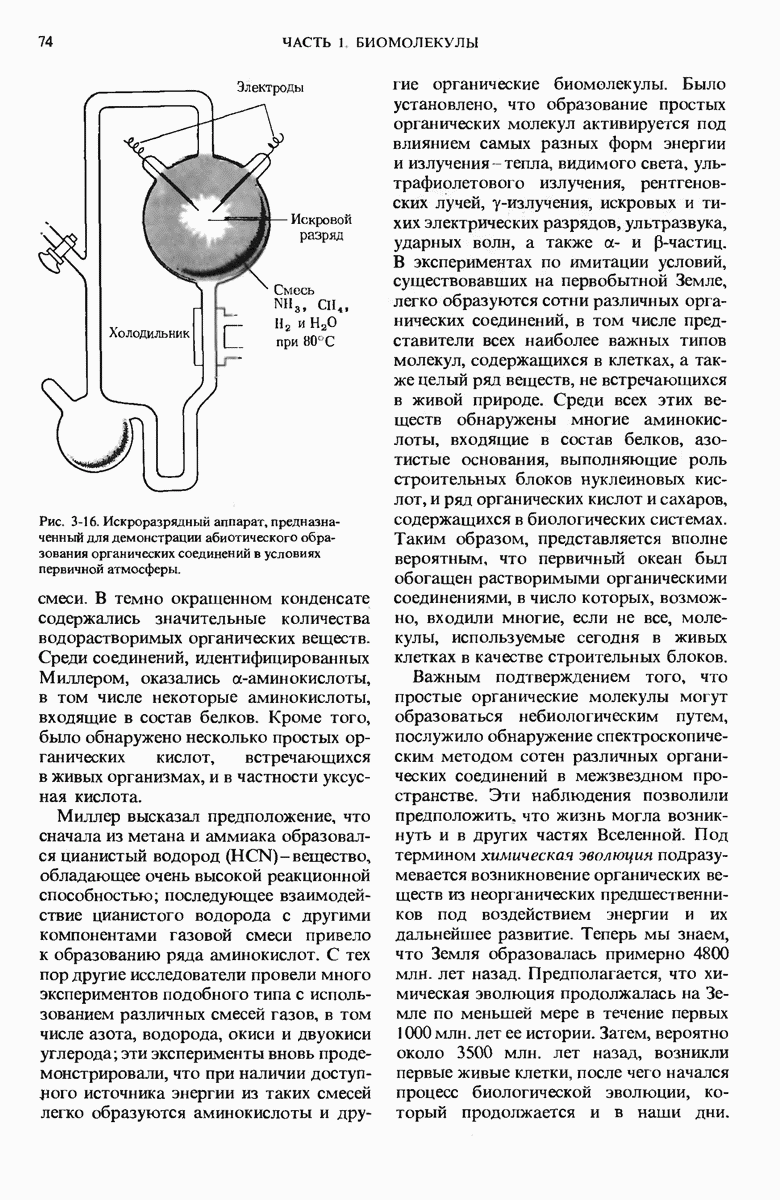
- 3.11. Химическую эволюцию можно воспроизвести в лабораторных условиях
- Краткое содержание главы
- ЛИТЕРАТУРА
- Вопросы и задачи
- ГЛАВА 4. ВОДА
- 4.1. Необычные физические свойства воды обусловлены ее способностью участвовать в образовании водородных связей
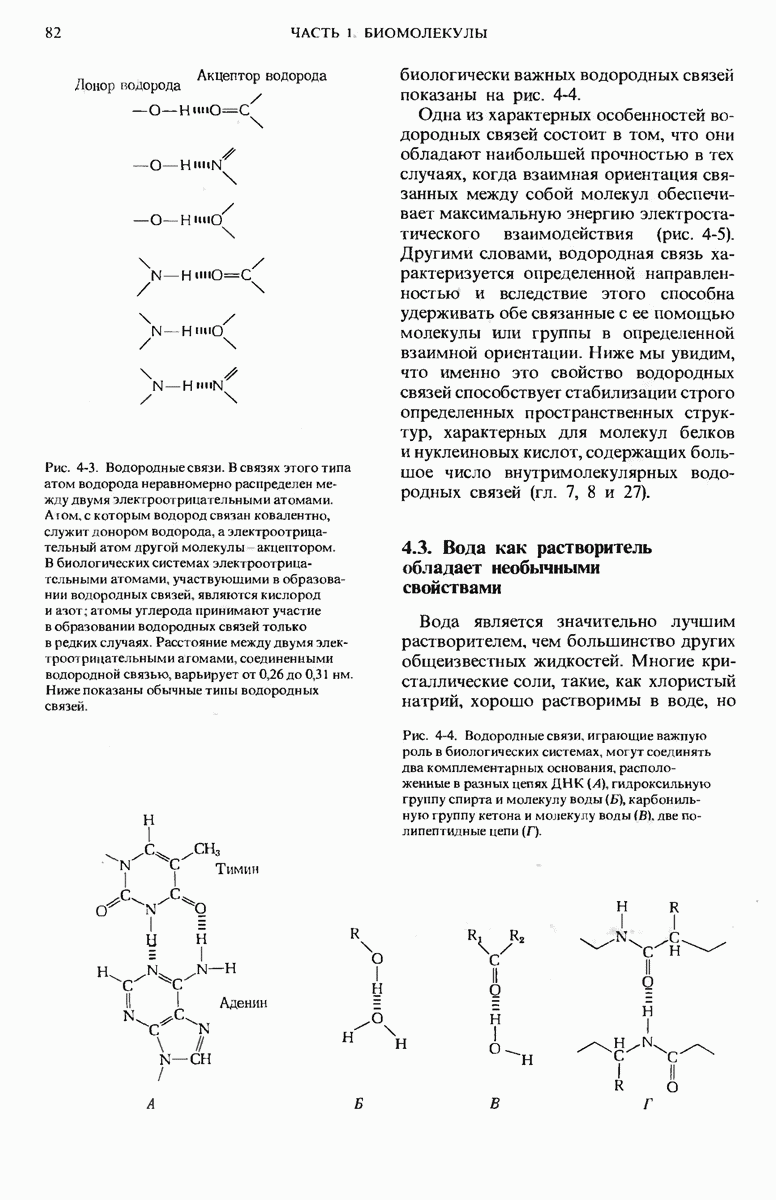
- 4.2. Водородные связи широко распространены в биологических системах и играют в них важную роль
- 4.3. Вода как растворитель обладает необычными свойствами
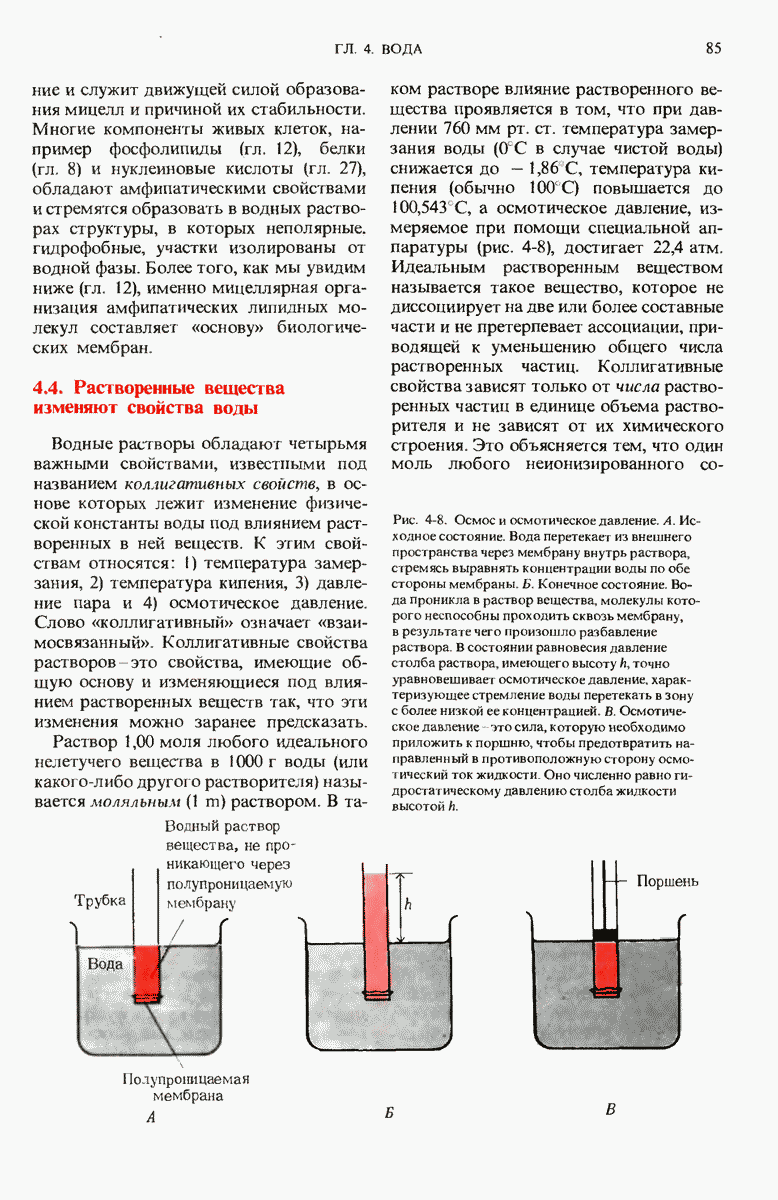
- 4.4. Растворенные вещества изменяют свойства воды
- 4.5. Состояние равновесия обратимых реакций характеризуется константой равновесия
- 4.6. Ионизацию воды можно охарактеризовать величиной константы равновесия
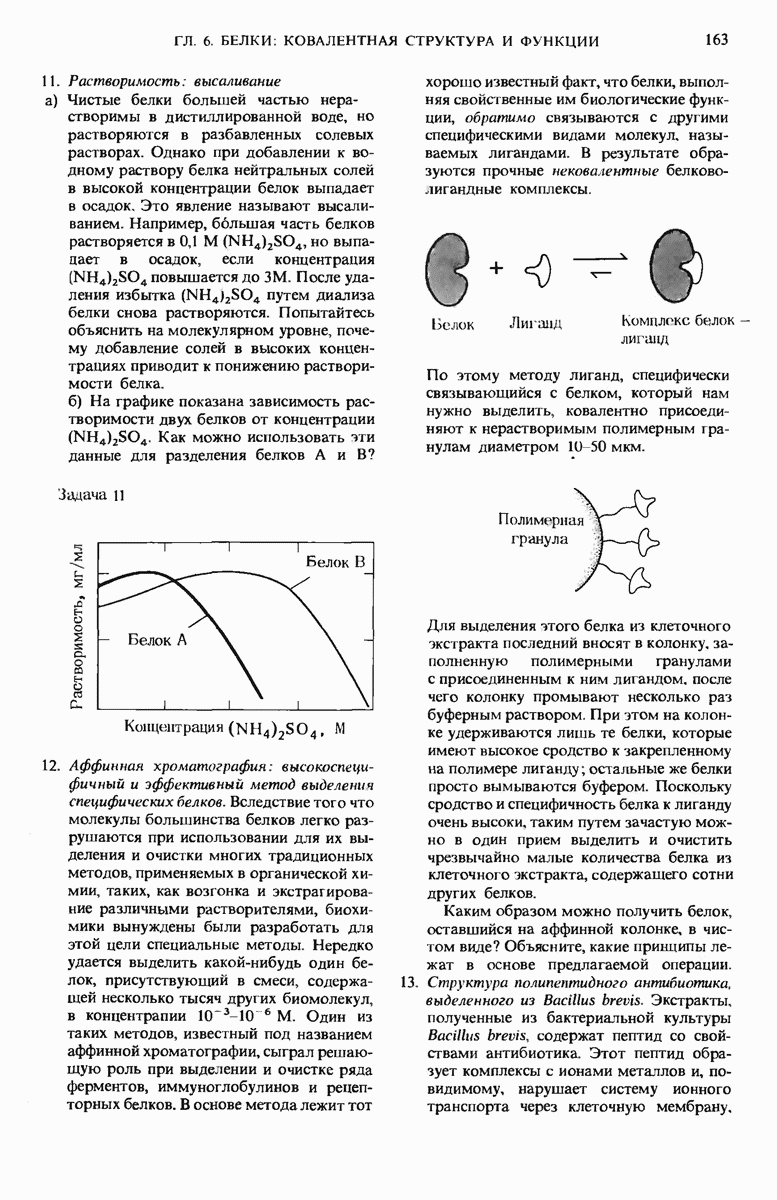
- 4.7. Шкала pH: обозначения концентраций ионов Н+ и ОН-
- 4.8. Свойства кислот и оснований тесно связаны со свойствами воды
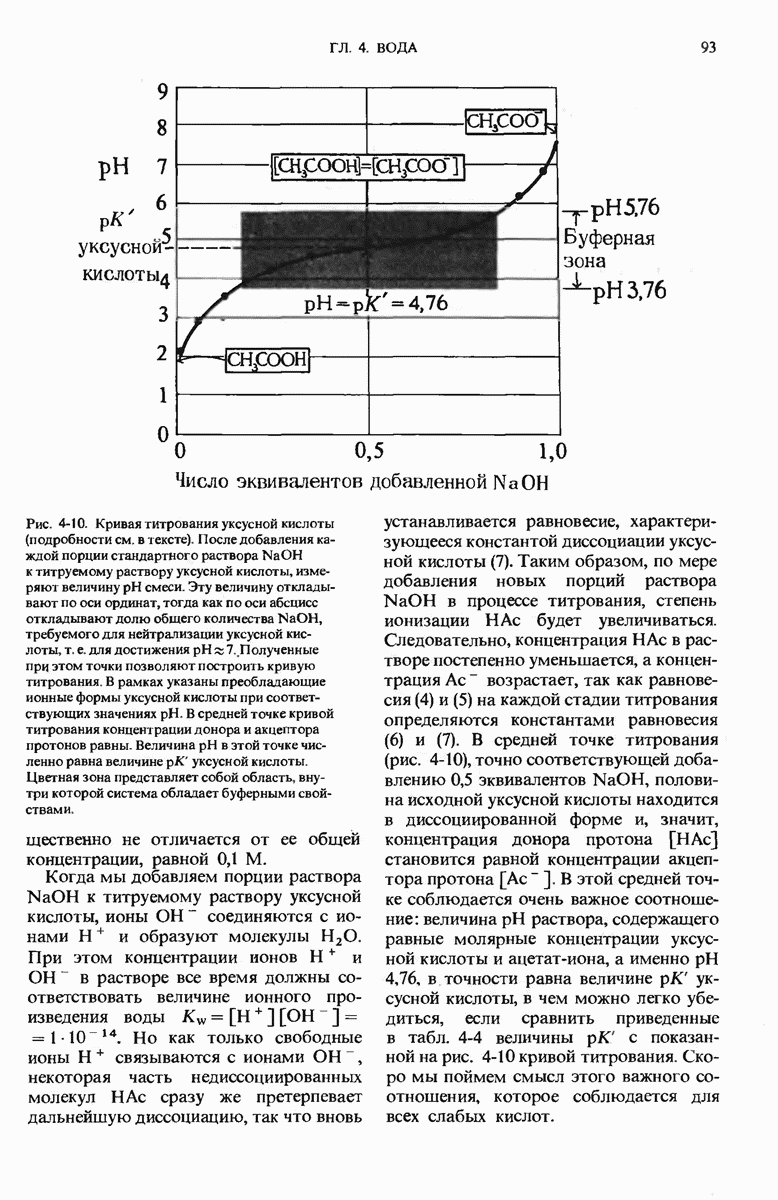
- 4.9. Слабые кислоты имеют характерные кривые титрования
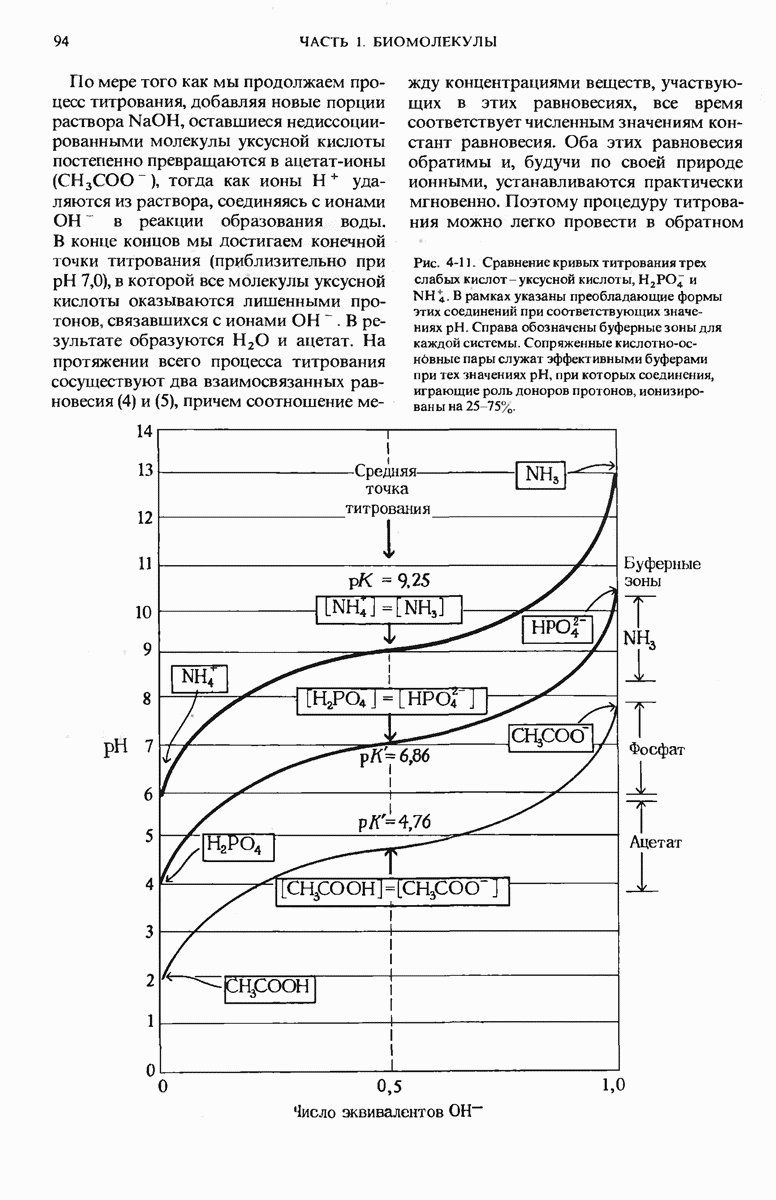
- 4.10. Буферы — это смеси слабых кислот и сопряженных с ними оснований
- 4.11. Фосфат и бикарбонат — важные биологические буферные системы
- 4.12. Приспособленность живых организмов к водной среде
- 4.13. «Кислые» дожди загрязняют наши озера и реки
- Краткое содержание главы
- ЛИТЕРАТУРА
- Вопросы и задачи
- ГЛАВА 5. АМИНОКИСЛОТЫ И ПЕПТИДЫ
- 5.1. Общие структурные свойства аминокислот
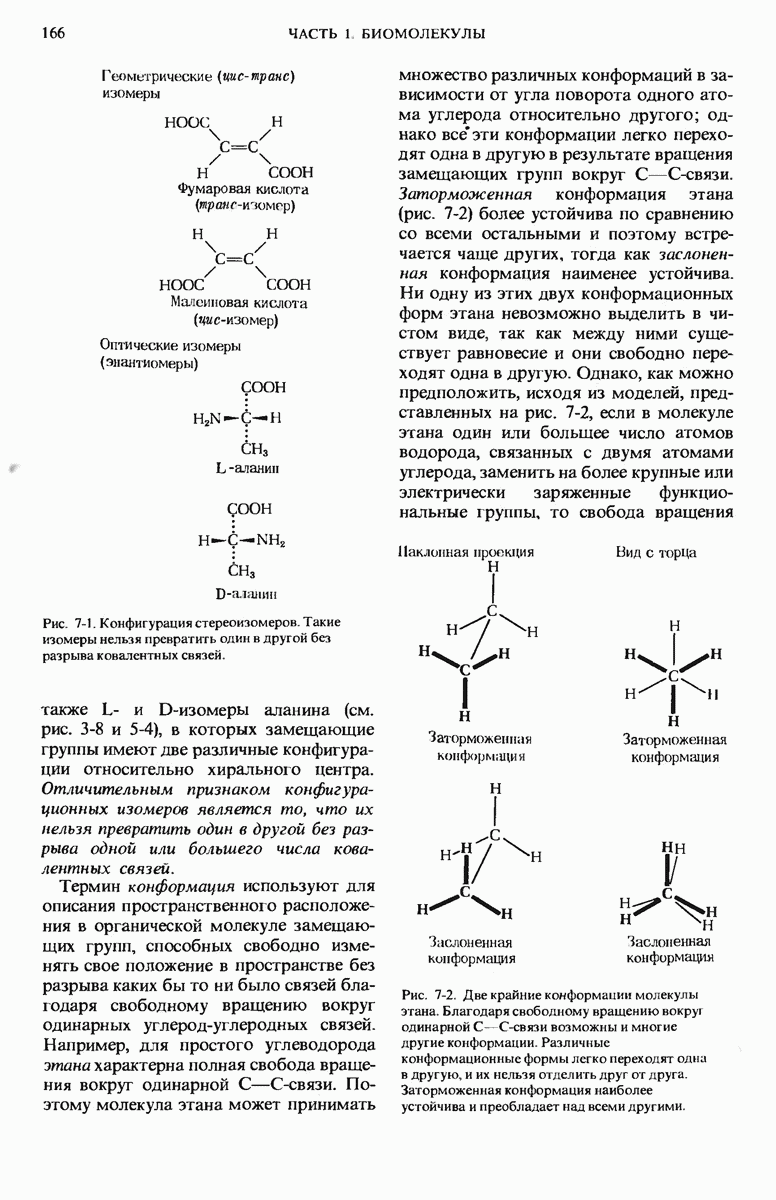
- 5.2. Почти все аминокислоты содержат асимметрический атом углерода
- 5.3. Стереоизомеры обозначаются в соответствии с их абсолютной конфигурацией
- 5.4. Оптически активные аминокислоты в белках представляют собой L-стереоизомеры
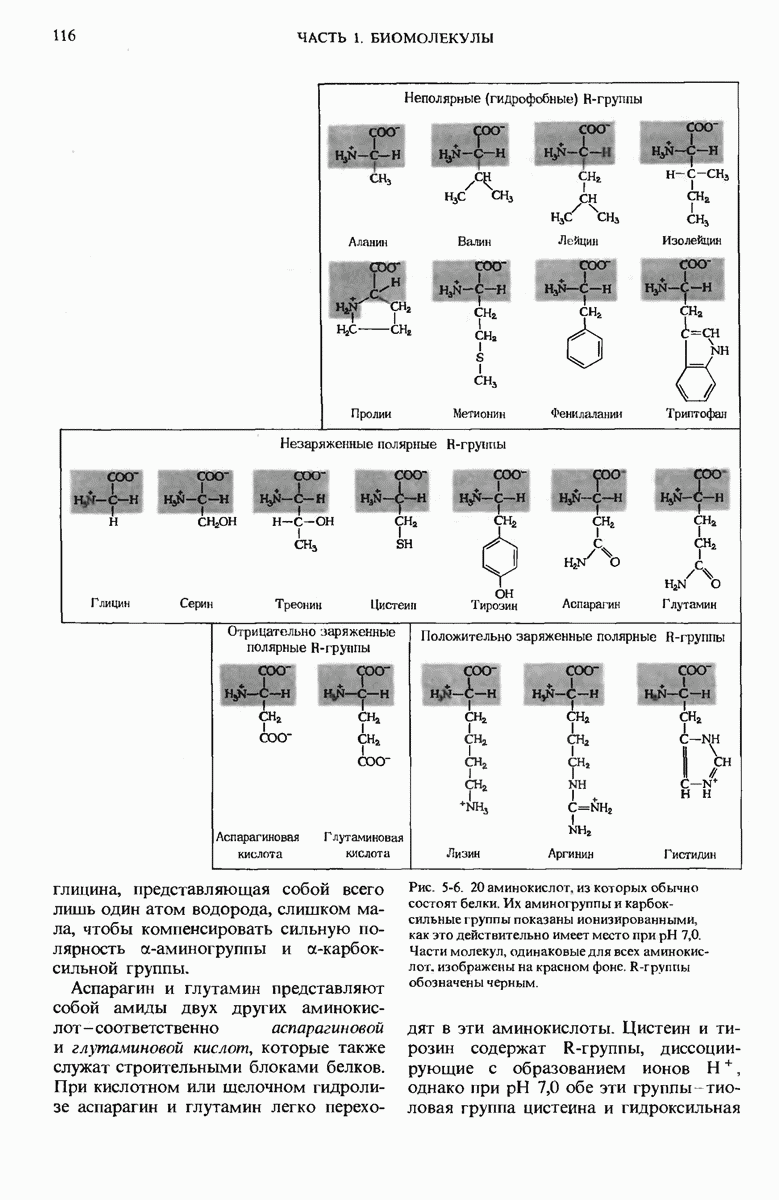
- 5.5. Классификация аминокислот на основе их R-групп
- 5.6. Восемь аминокислот содержат неполярные R-группы
- 5.7. Семь аминокислот содержат незаряженные полярные R-группы
- 5.8. Две аминокислоты содержат отрицательно заряженные (кислые) R-группы
- 5.9. Три аминокислоты содержат положительно заряженные (основные) R-группы
- 5.10. В некоторых белках присутствуют нестандартные аминокислоты
- 5.11. В водных растворах аминокислоты ионизированы
- 5.12. Аминокислоты могут вести себя и как кислоты, и как основания
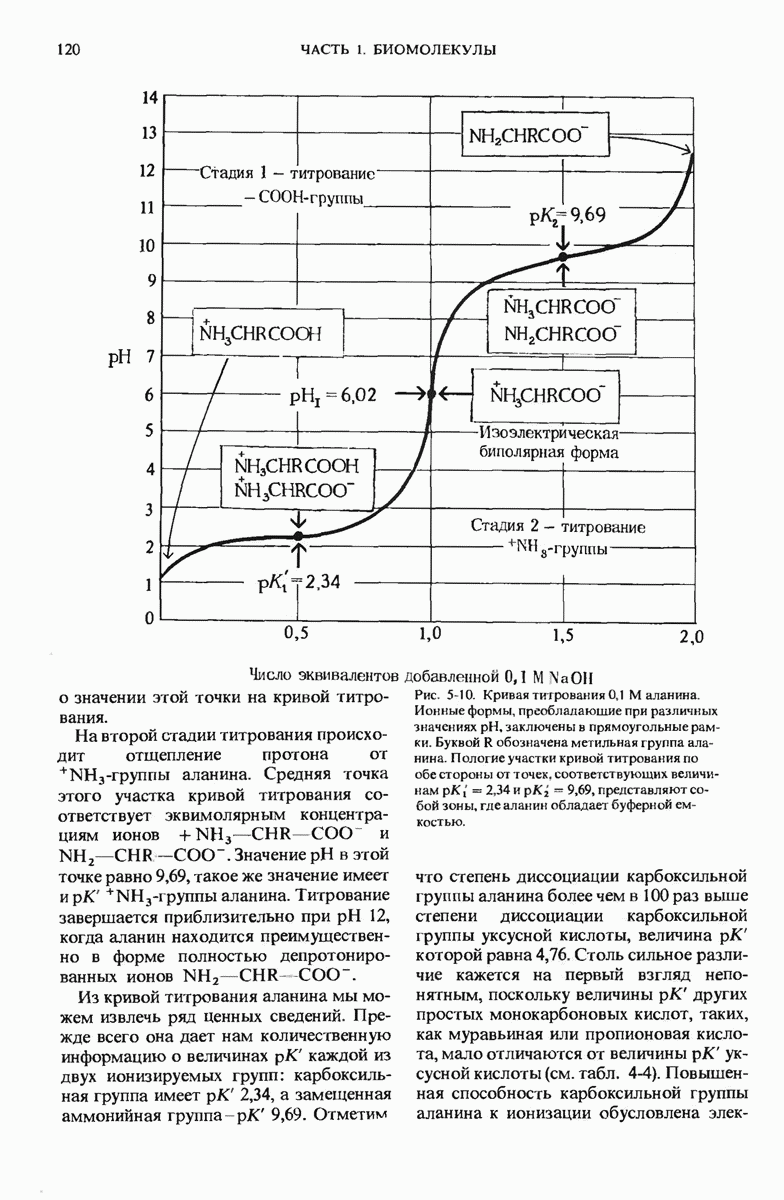
- 5.13. Аминокислоты имеют характерные кривые титрования
- 5.14. По кривой титрования можно предсказать, какой электрический заряд несет данная аминокислота
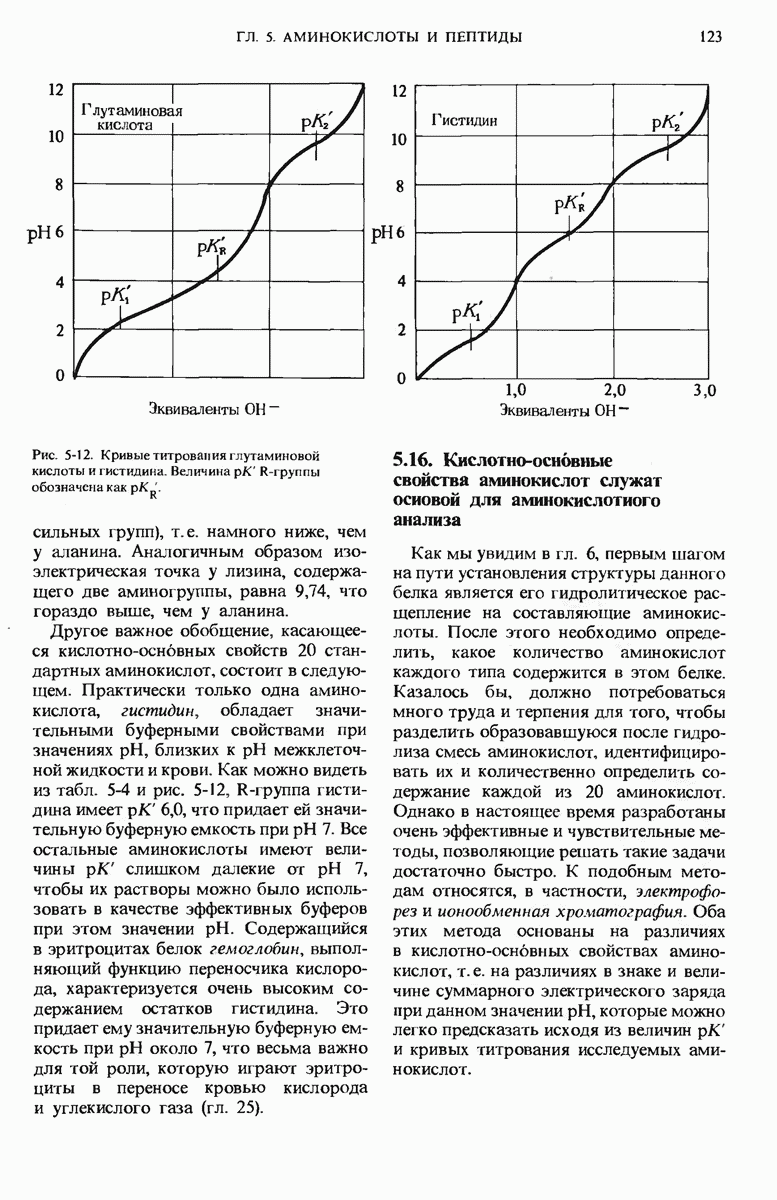
- 5.15. Аминокислоты различаются по своим кислотно-основным свойствам
- 5.16. Кислотно-основные свойства аминокислот служат основой для аминокислотного анализа
- 5.17. Электрофорез на бумаге позволяет разделять аминокислоты в соответствии с их электрическим зарядом
- 5.18. Ионообменная хроматография служит более эффективным способом разделения аминокислот
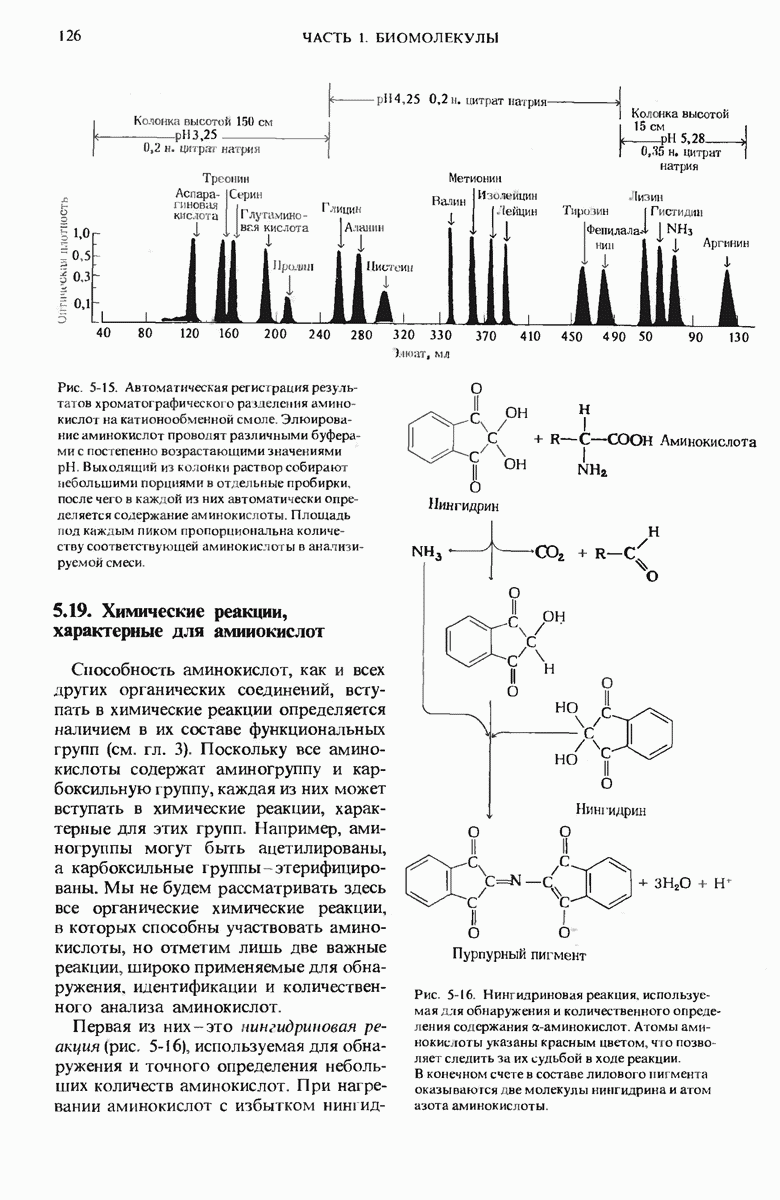
- 5.19. Химические реакции, характерные для аминокислот
- 5.20. Пептиды — это цепочки аминокислот
- 5.21. Разделение пептидов может быть основано на различиях в их ионизационных свойствах
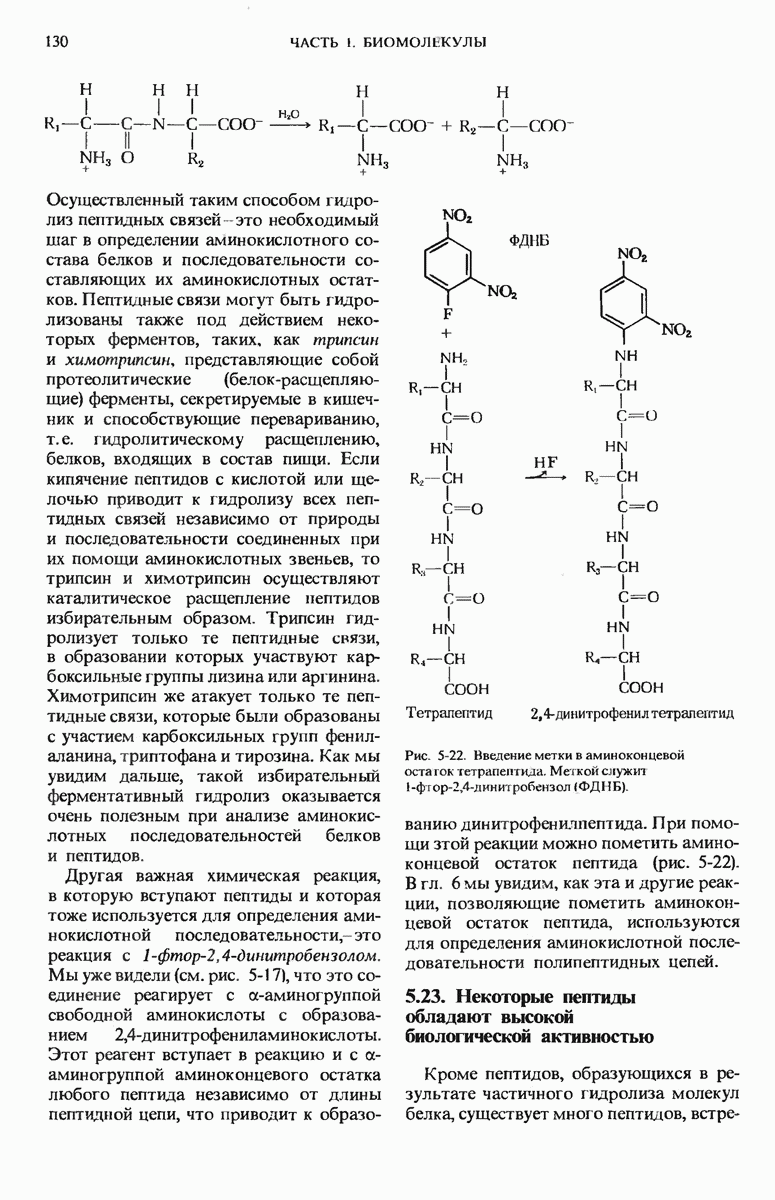
- 5.22. Химические реакции, характерные для пептидов
- 5.23. Некоторые пептиды обладают высокой биологической активностью
- Краткое содержание главы
- ЛИТЕРАТУРА
- Вопросы и задачи
- ГЛАВА 6. БЕЛКИ: КОВАЛЕНТНАЯ СТРУКТУРА И БИОЛОГИЧЕСКИЕ ФУНКЦИИ
- 6.1. Белки обладают множеством различных биологических функций
- 6.2. Белки можно классифицировать также по форме их молекул
- 6.3. В ходе гидролиза брлки распадаются на аминокислоты
- 6.4. Некоторые белки имеют в своем составе не только аминокислоты, но и другие химические группы
- 6.5. Белки — это очень крупные молекулы
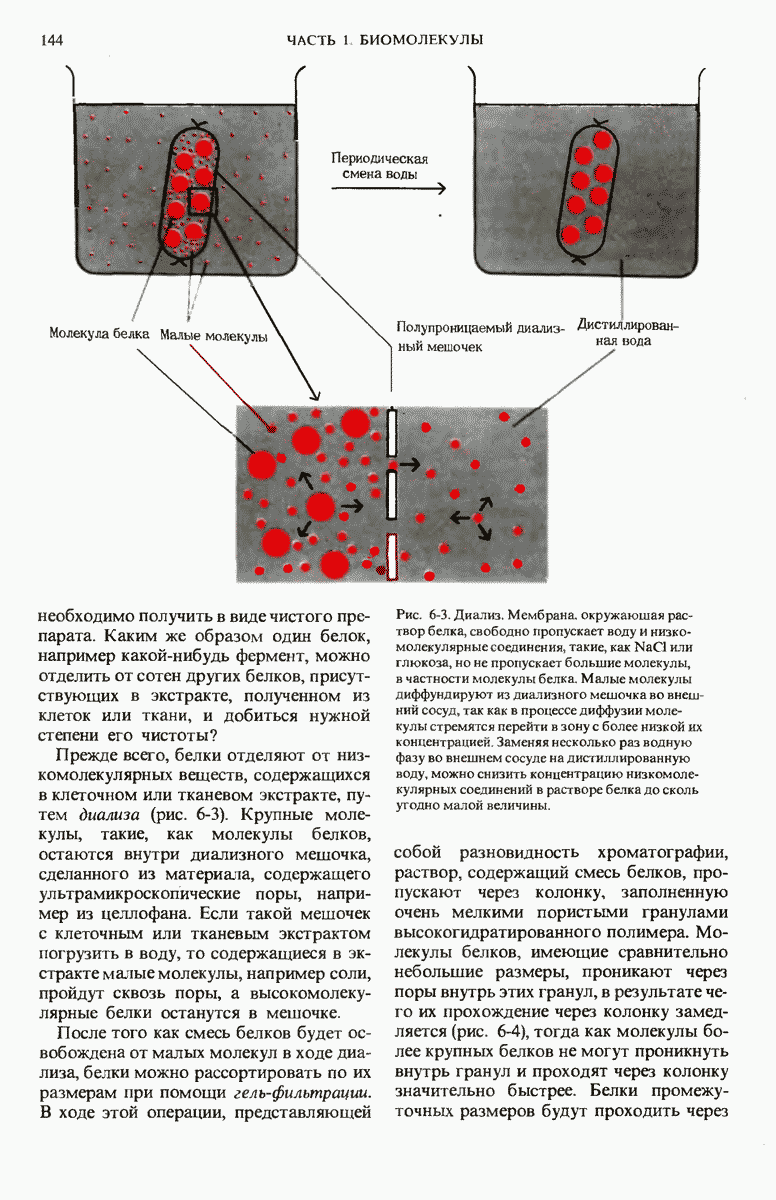
- 6.6. Белки можно выделить и подвергнуть очистке
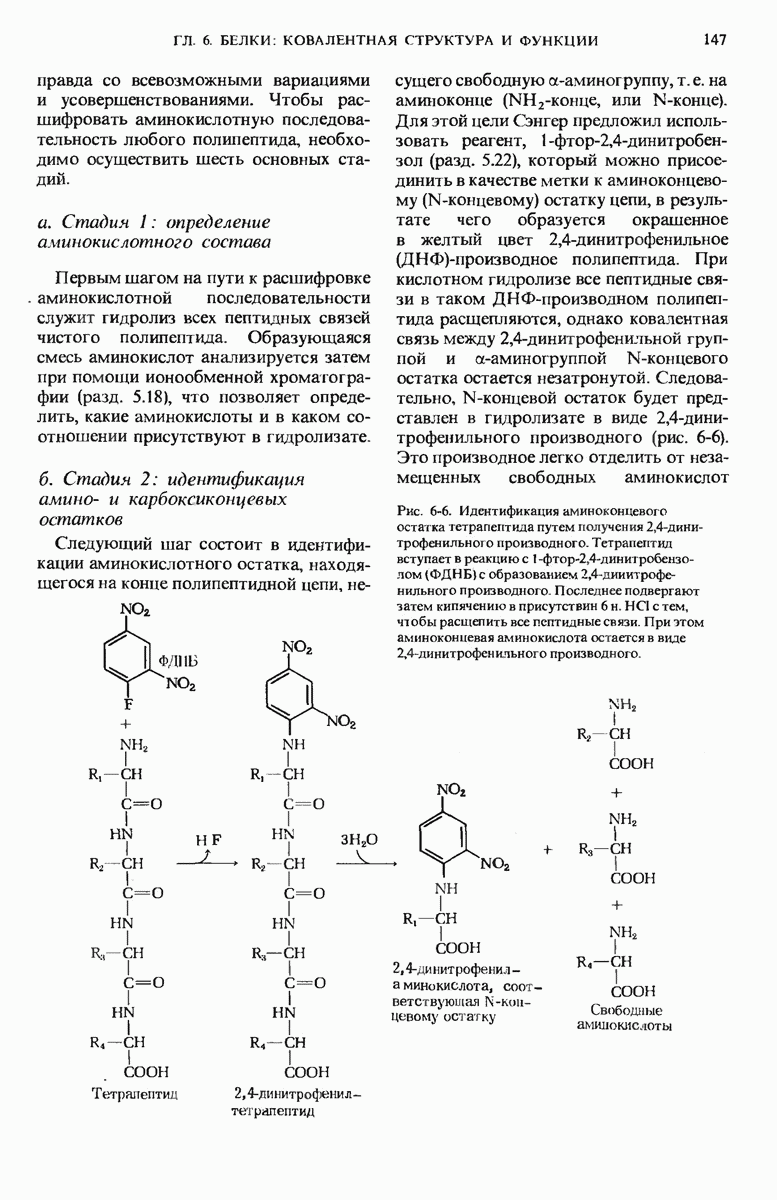
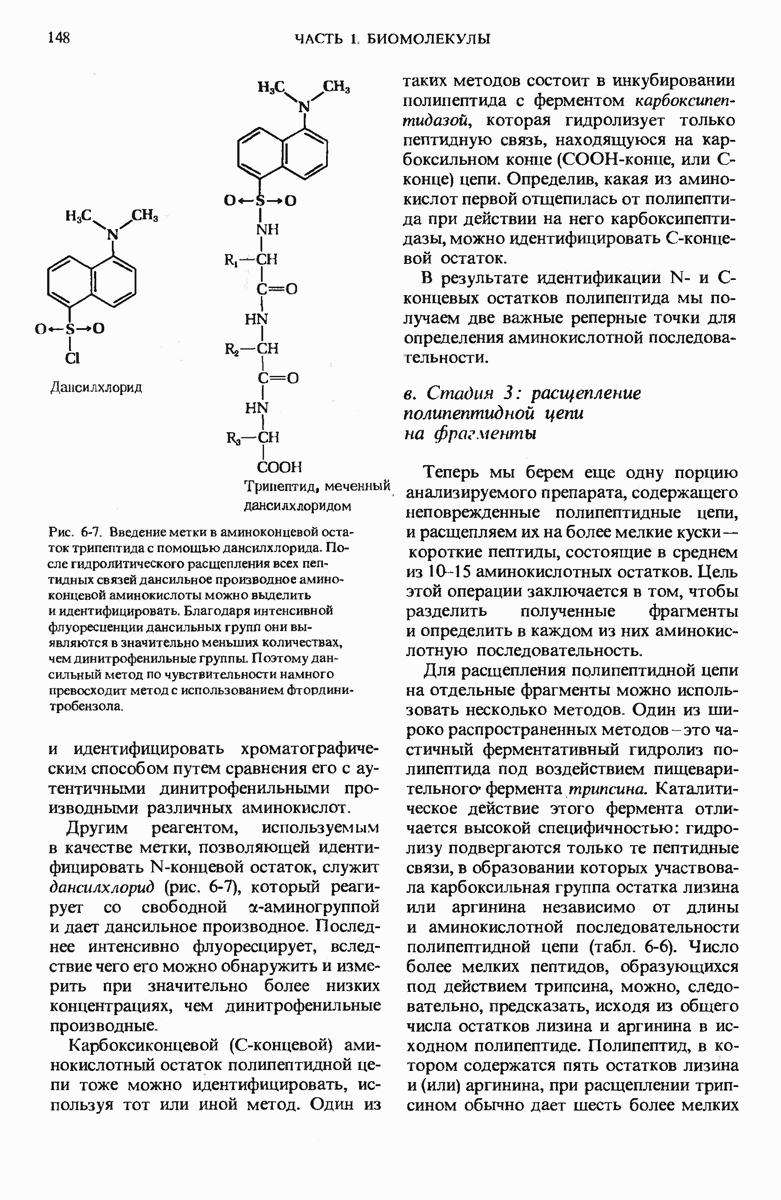
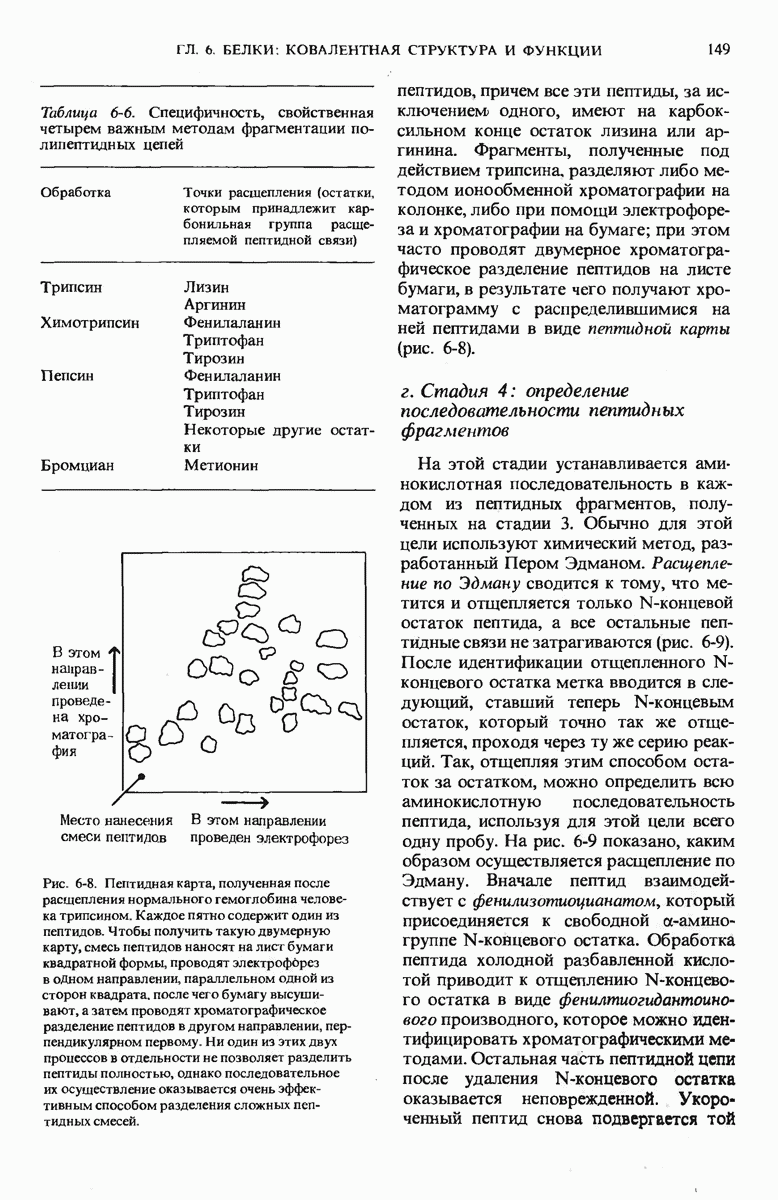
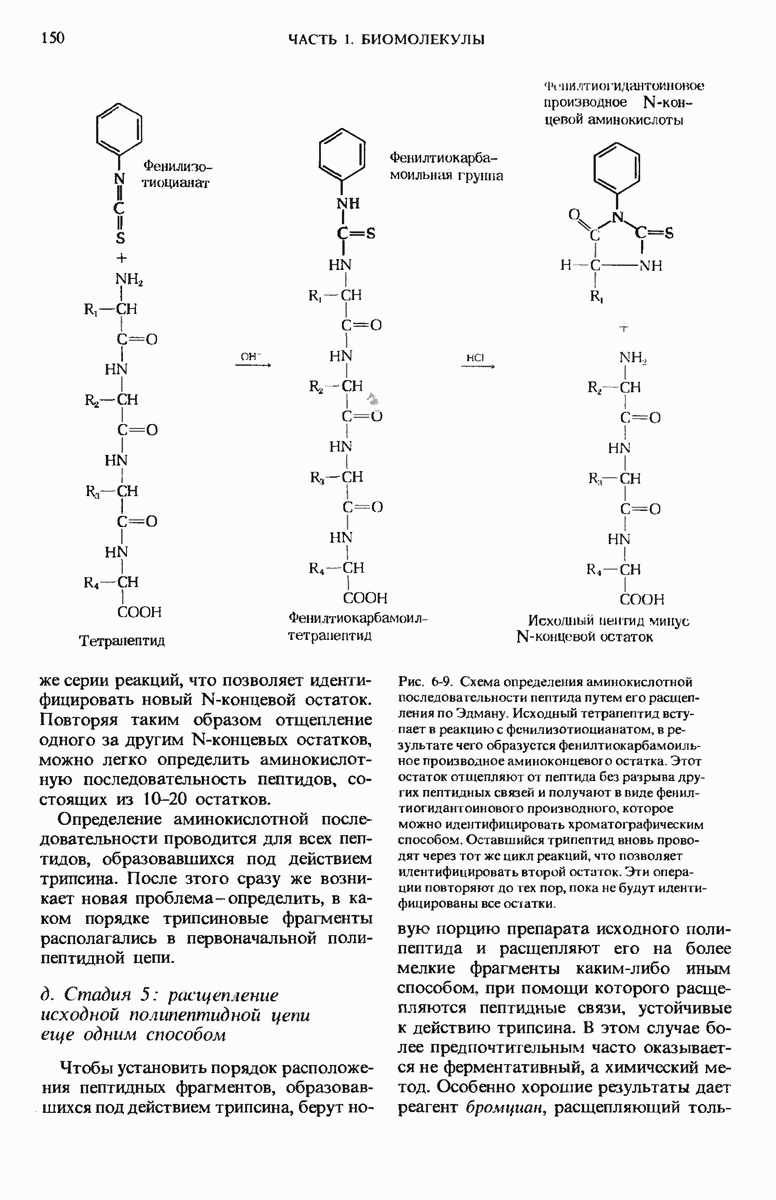
- 6.7. Определение аминокислотной последовательности полипептидных цепей
- 6.8. Инсулин — это первый белок, для которого была установлена аминокислотная последовательность
- 6.9. В настоящее время известны последовательности многих других белков
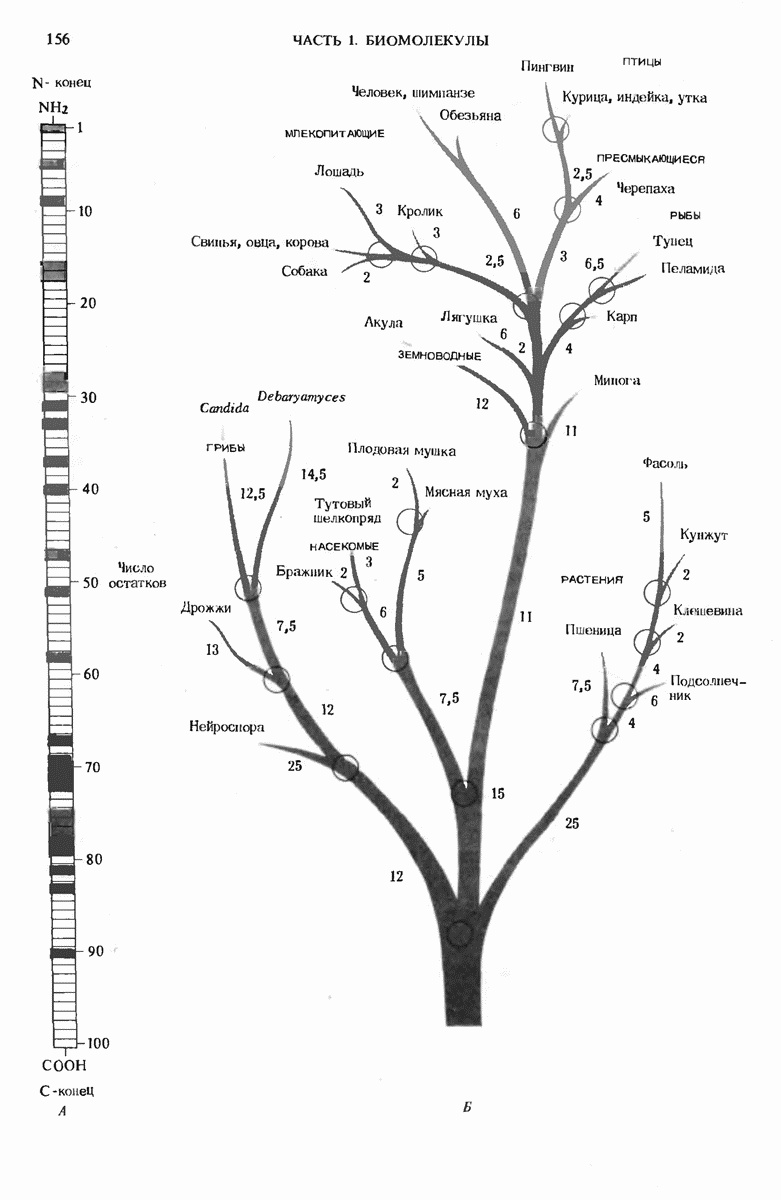
- 6.10. Гомологичные белки разных видов имеют гомологичные последовательности
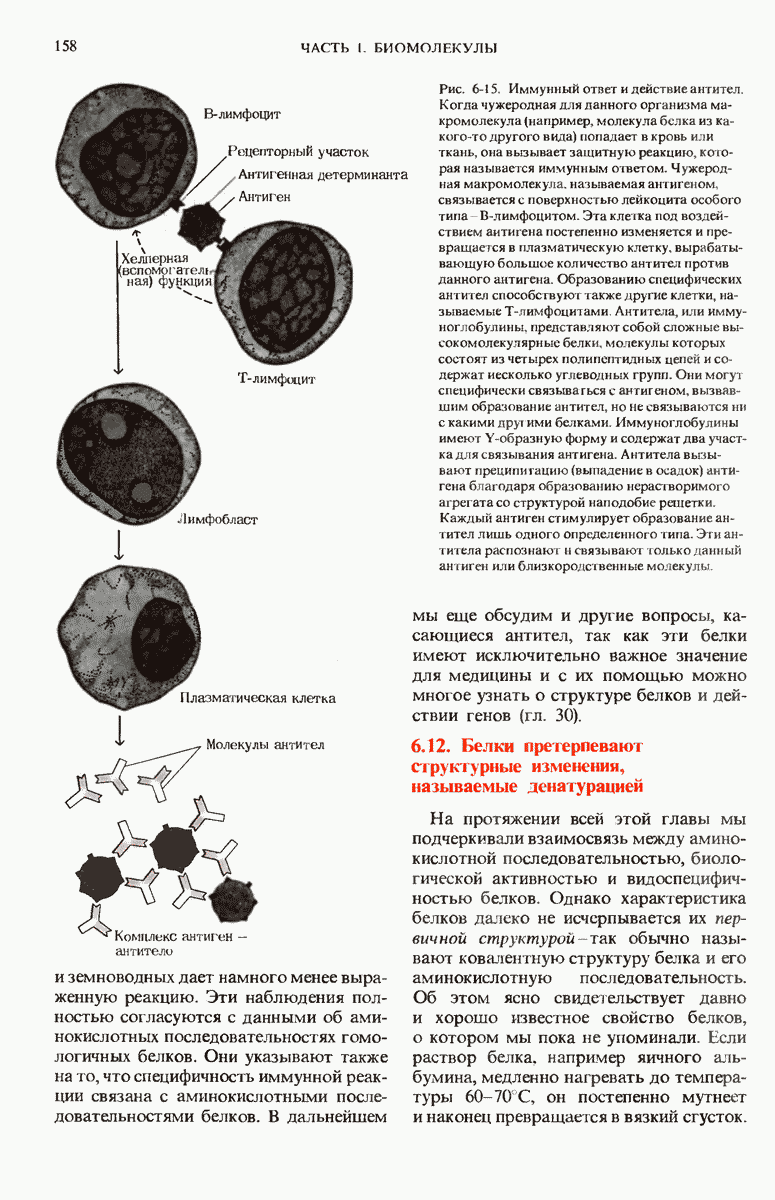
- 6.11. Различия между гомологичными белками можно выявить по иммунной реакции
- 6.12. Белки претерпевают структурные изменения, называемые денатурацией
- Краткое содержание главы
- ЛИТЕРАТУРА
- Вопросы и задачи
- ГЛАВА 7. ФИБРИЛЛЯРНЫЕ БЕЛКИ
- 7.1. Термины «конфигурация» и «конформация» имеют разный смысл
- 7.2. Как это ни парадоксально, нативные белки имеют только одну или всего лишь несколько конформаций
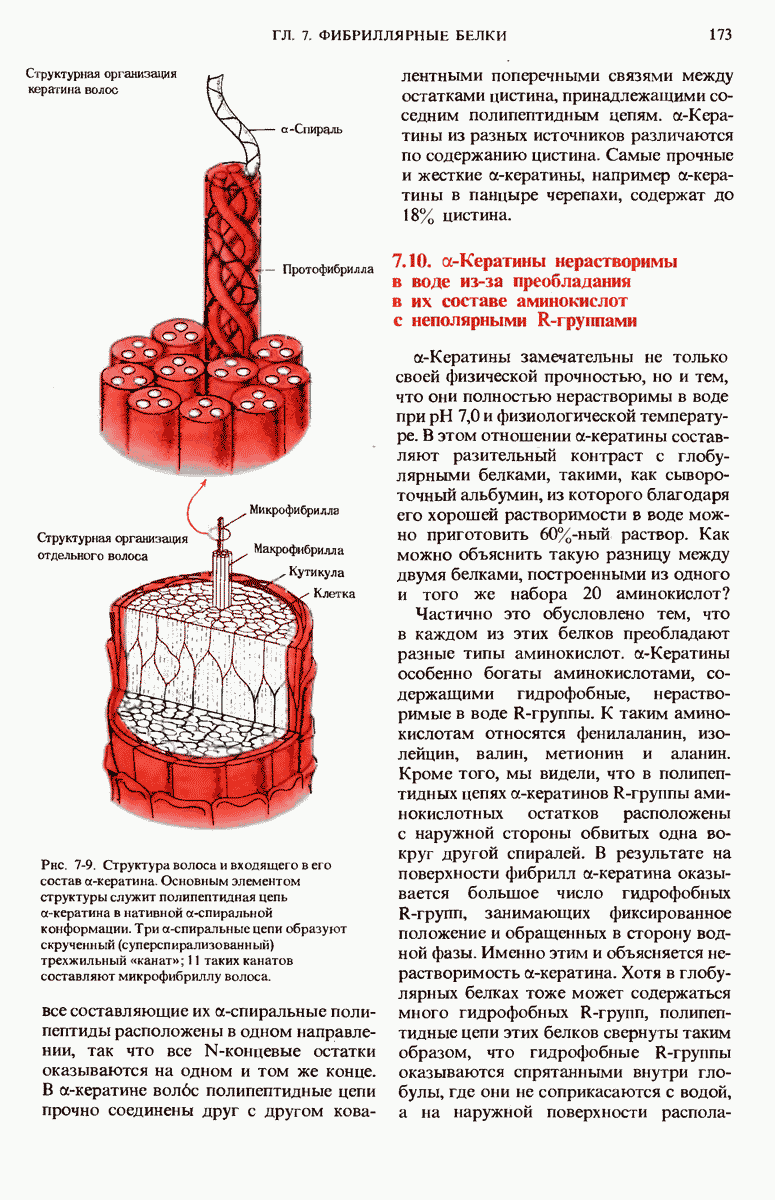
- 7.3. a-Кератины — фибриллярные белки, синтезируемые клетками эпидермиса
- 7.4. Рентгеноструктурный анализ показывает, что в кератинах имеются повторяющиеся структурные единицы
- 7.5. Рентгеноструктурные исследования пептидов свидетельствуют о жесткости и плоской конфигурации пептидных групп
- 7.6. В a-кератине полипептидные цепи имеют форму a-спирали
- 7.7. Некоторые аминокислотные остатки препятствуют образованию a-спирали
- 7.8. В a-кератинах содержится много аминокислот, способствующих образованию a-спиральной структуры
- 7.9. В нативных a-кератинах a-спиральные полипептидные цепи скручены наподобие каната
- 7.10. a-Кератины нерастворимы в воде из-за преобладания в их составе аминокислот с неполярными R-группами
- 7.11. b-Кератины имеют другую конформацию полипептидной цепи, называемую b-структурой
- 7.12. Перманентная завивка волос — пример биохимической технологии
- 7.13. Коллаген и эластин — главные фибриллярные белки соединительных тканей
- 7.14. Коллаген — самый распространенный белок у высших животных
- 7.15. Коллаген обладает как обычными, так и необычными свойствами
- 7.16. Полипептиды в коллагене представляют собой трехцепочечные спиральные структуры
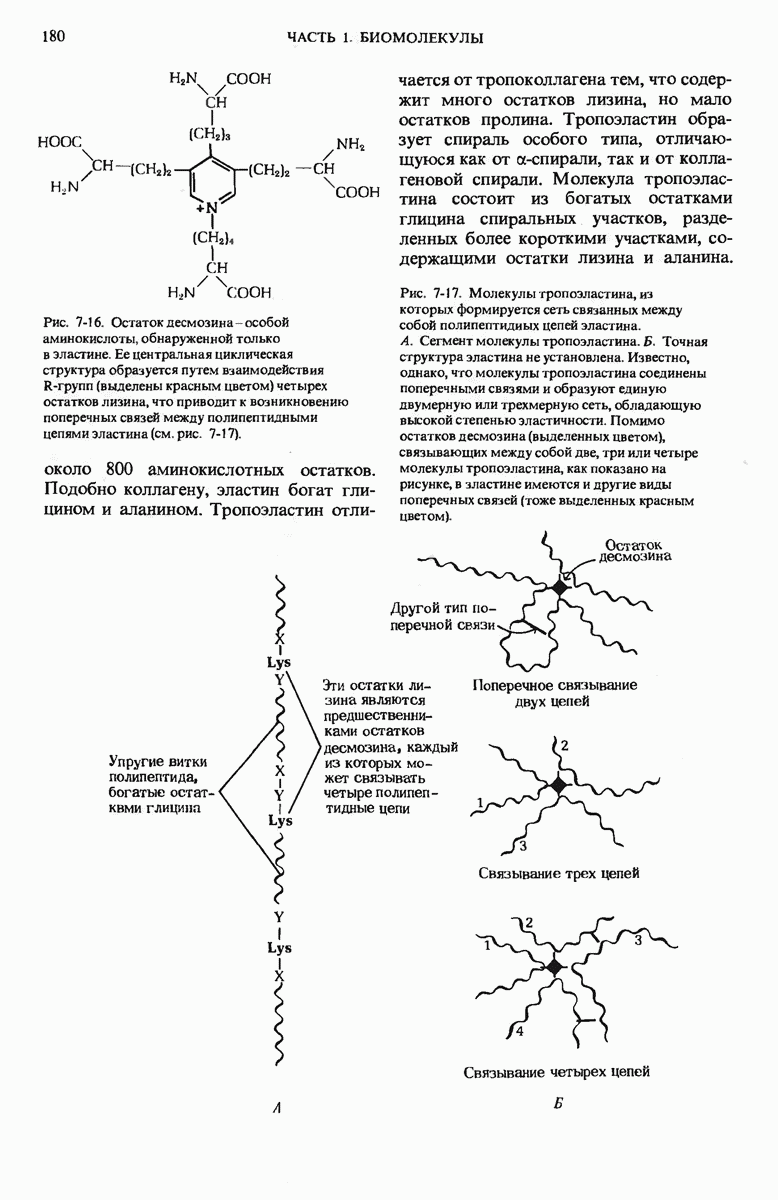
- 7.17. Структура эластина придает особые свойства эластической ткани
- 7.18. Что говорят нам фибриллярные белки о структуре белков?
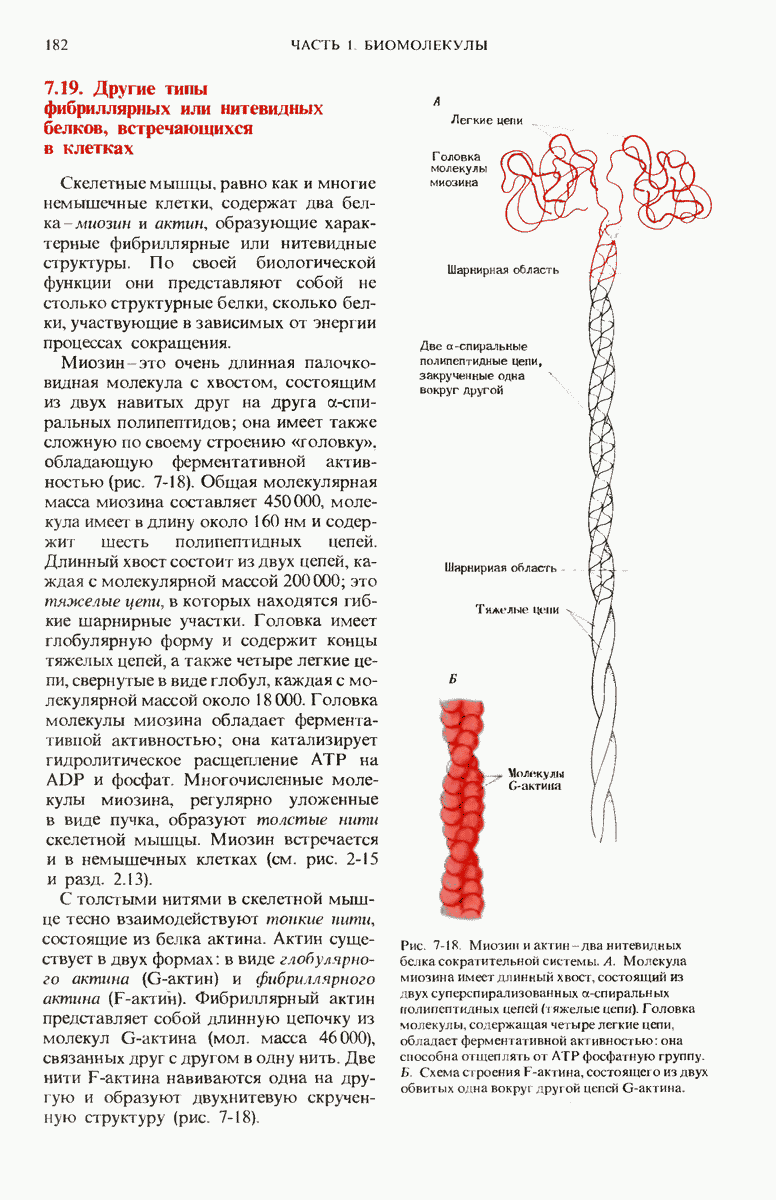
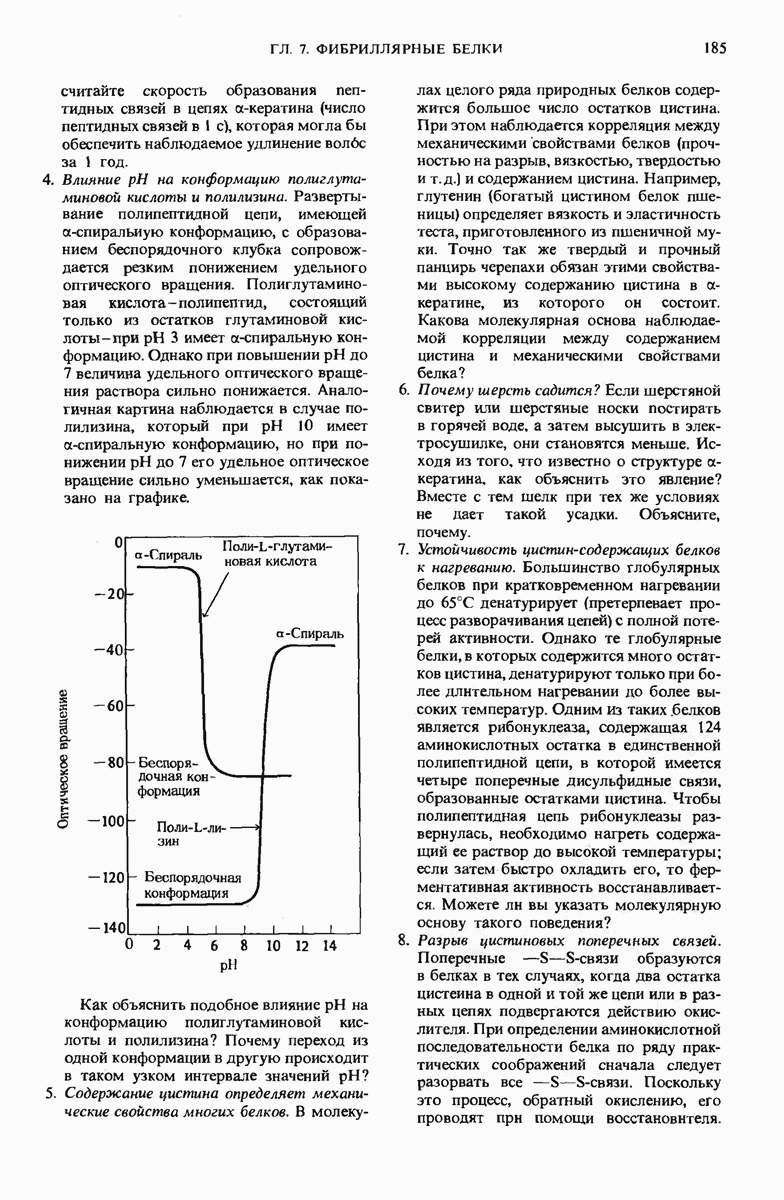
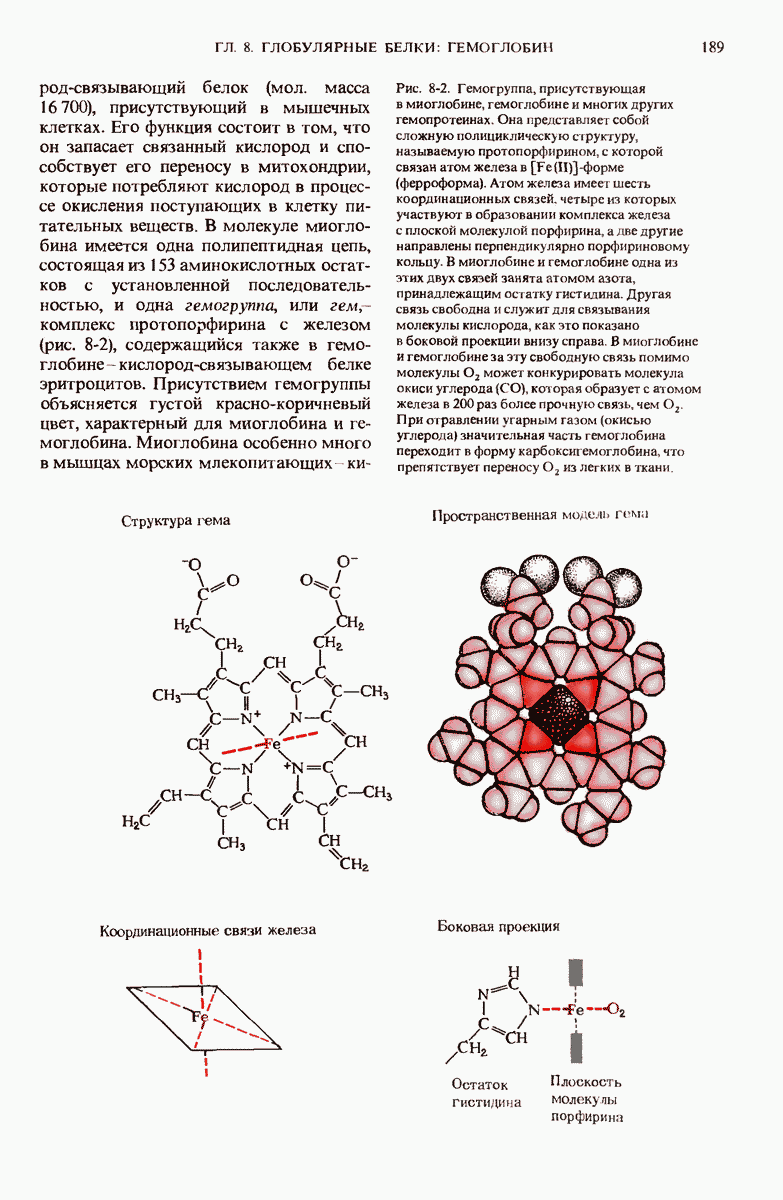
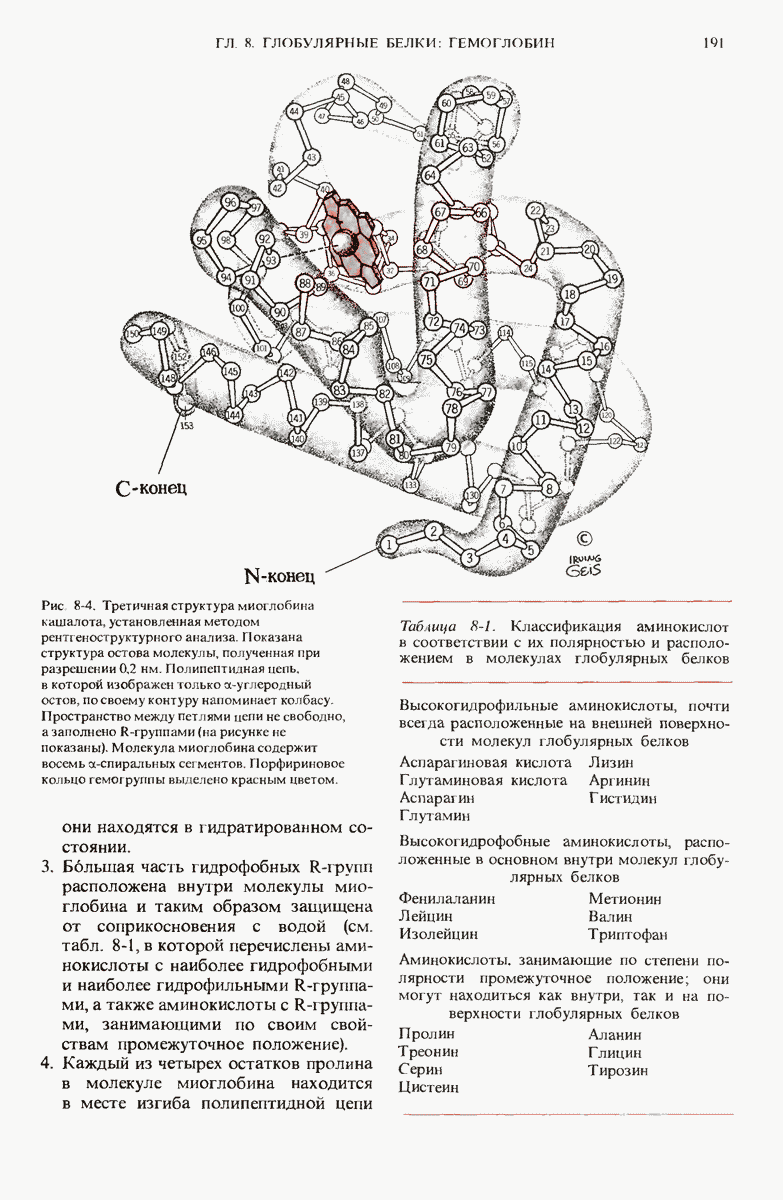
- 7.19. Другие типы фибриллярных или нитевидных белков встречающихся в клетках
- Краткое содержание главы
- ЛИТЕРАТУРА
- Вопросы и задачи
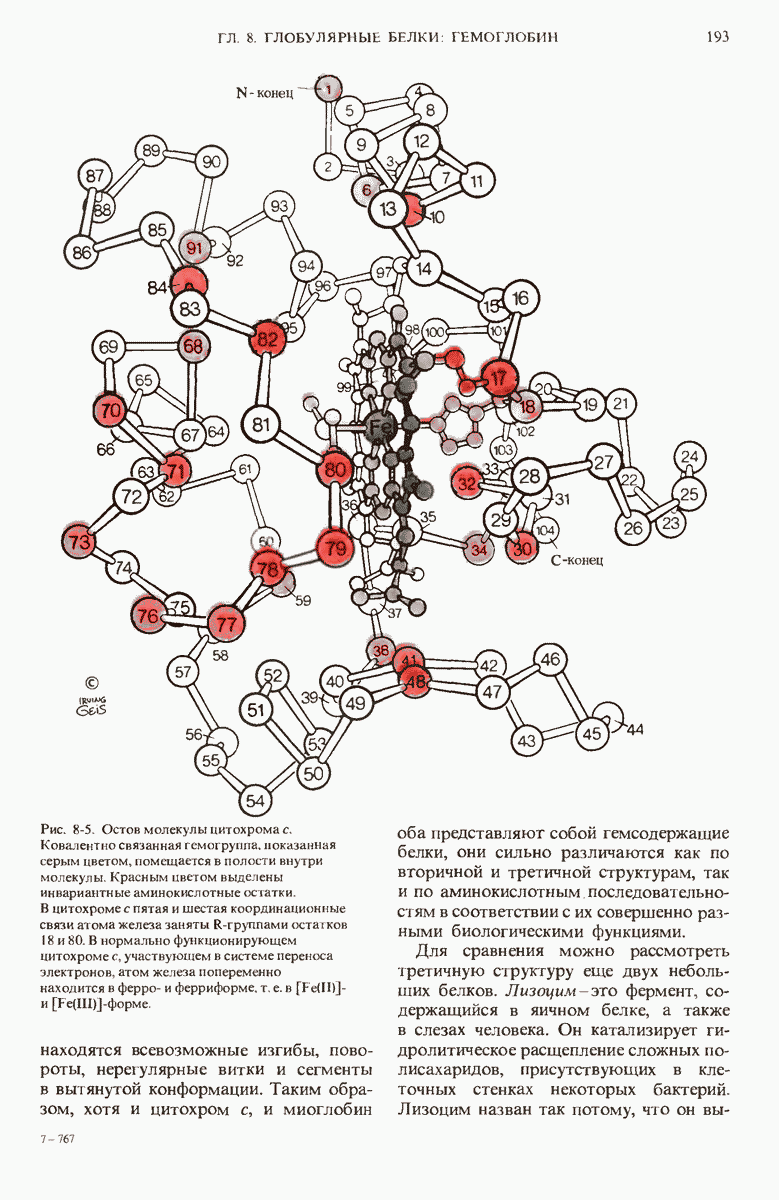
- ГЛАВА 8. ГЛОБУЛЯРНЫЕ БЕЛКИ: СТРУКТУРА И ФУНКЦИЯ ГЕМОГЛОБИНА
- 8.1. Полипептидные цепи глобулярных белков свернуты в плотную компактную структуру
- 8.2. Рентгеноструктурный анализ миоглобина — выдающееся достижение в исследовании белков
- 8.3. Миоглобины, выделенные из разных видов, имеют сходную конформацию
- 8.4. Глобулярные белки различных типов имеют неодинаковую структуру
- 8.5. Аминокислотная последовательность белка определяет его третичную структуру
- 8.6. Силы, стабилизирующие третичную структуру глобулярных белков
- 8.7. Свертывание полипептидных цепей происходит с очень высокой скоростью
- 8.8. Олигомерные белки имеют как третичную, так и четвертичную структуру
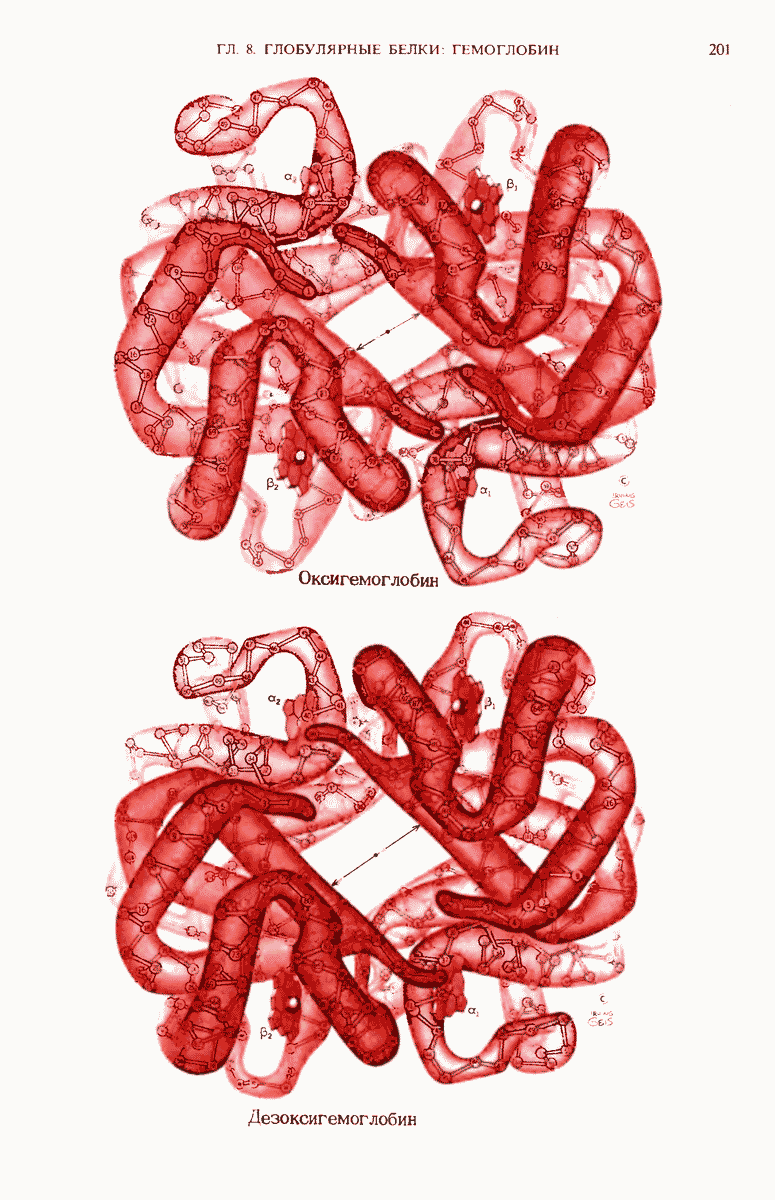
- 8.9. Метод рентгеноструктурного анализа позволил установить как третичную, так и четвертичную структуру гемоглобина
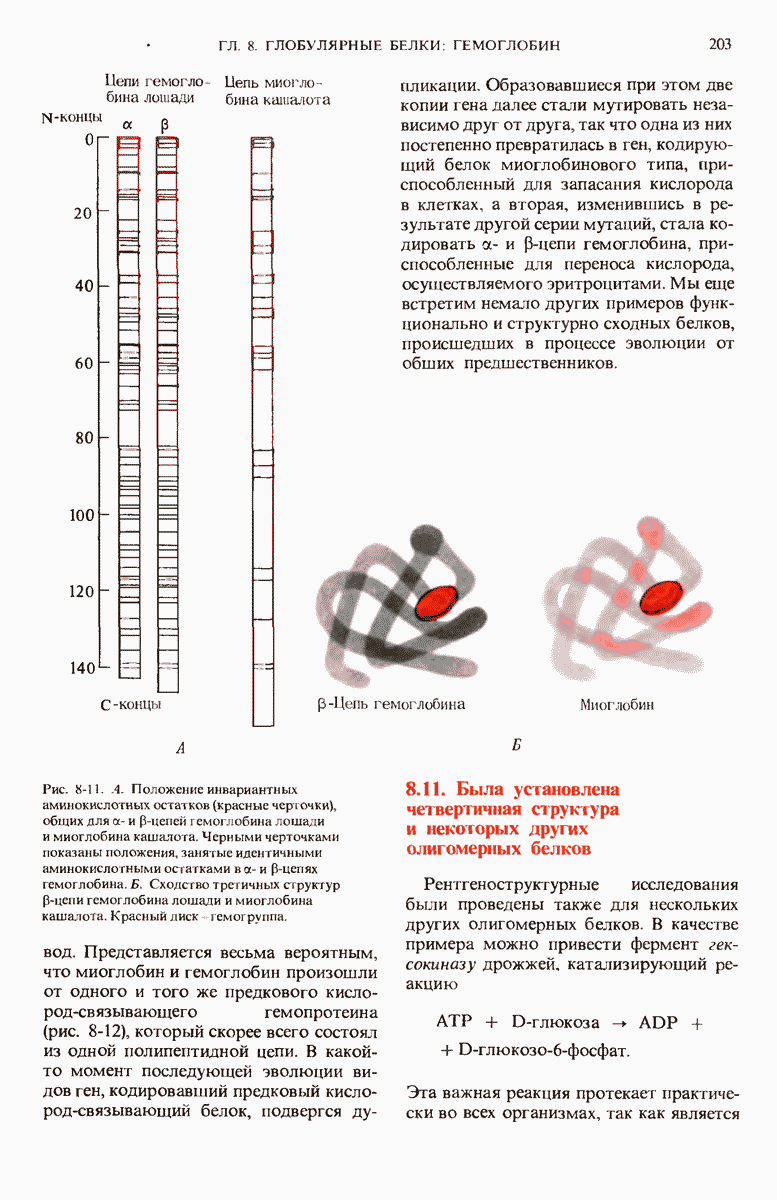
- 8.10. По своей третичной структуре a- и b-цепи гемоглобина очень сходны с миоглобином
- 8.11. Была установлена четвертичная структура и некоторых других олигомерных белков
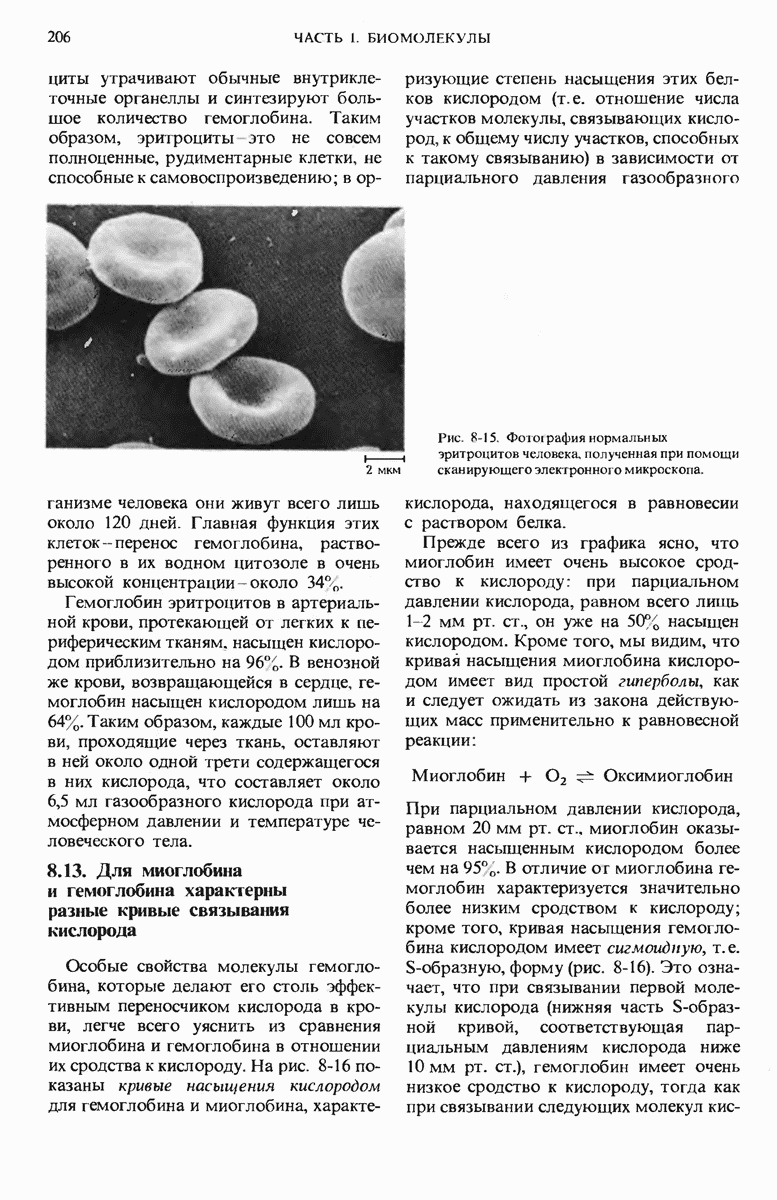
- 8.12. Эритроциты — специализированные клетки, переносящие кислород
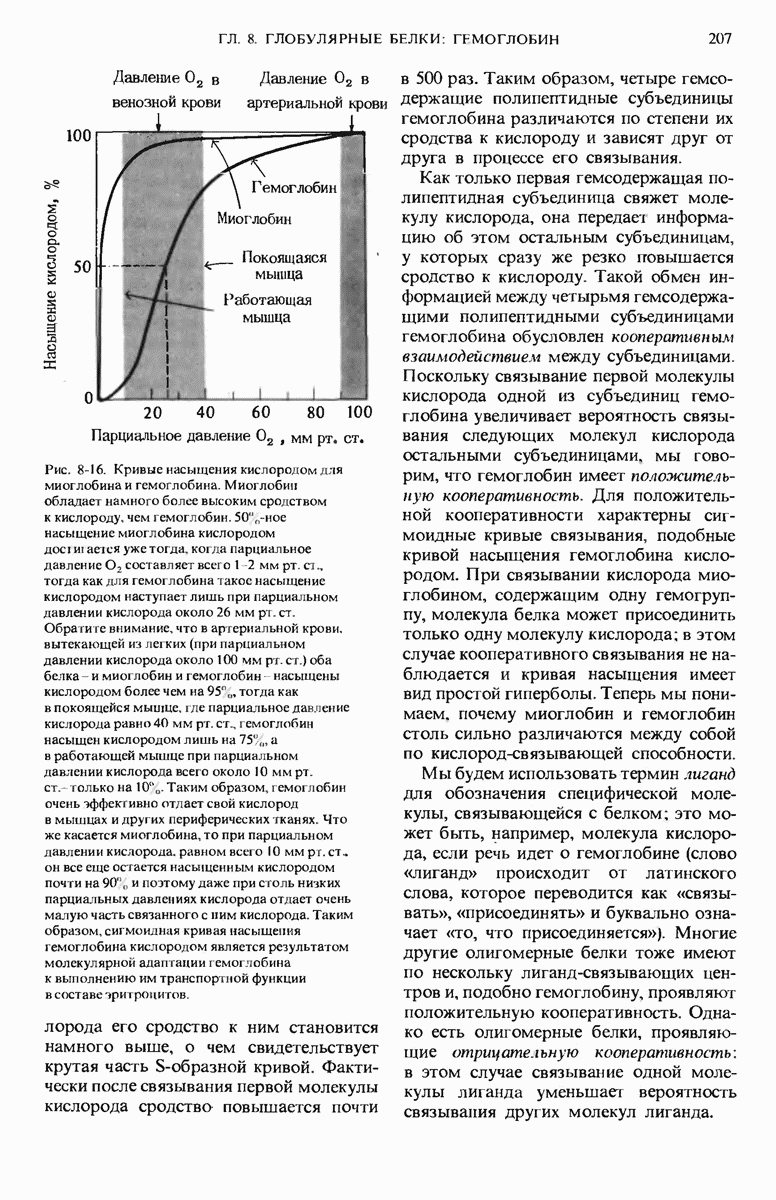
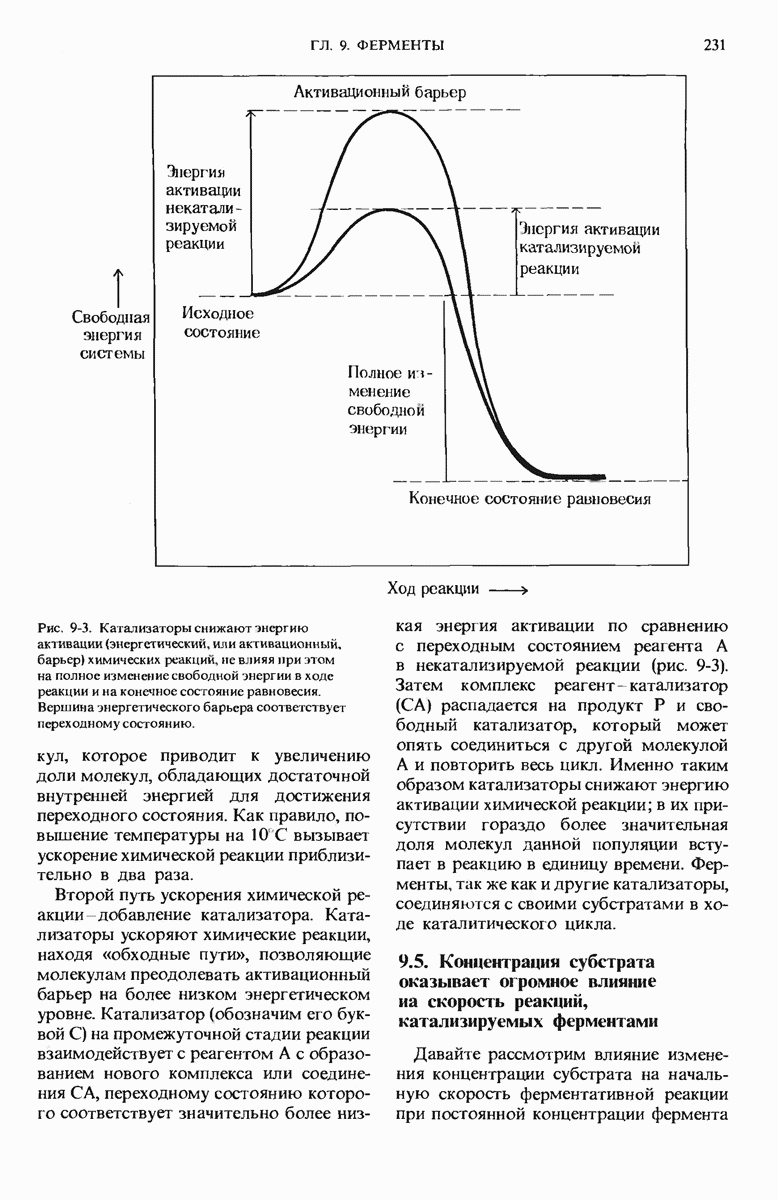
- 8.13. Для миоглобина и гемоглобина характерны разные кривые связывания кислорода
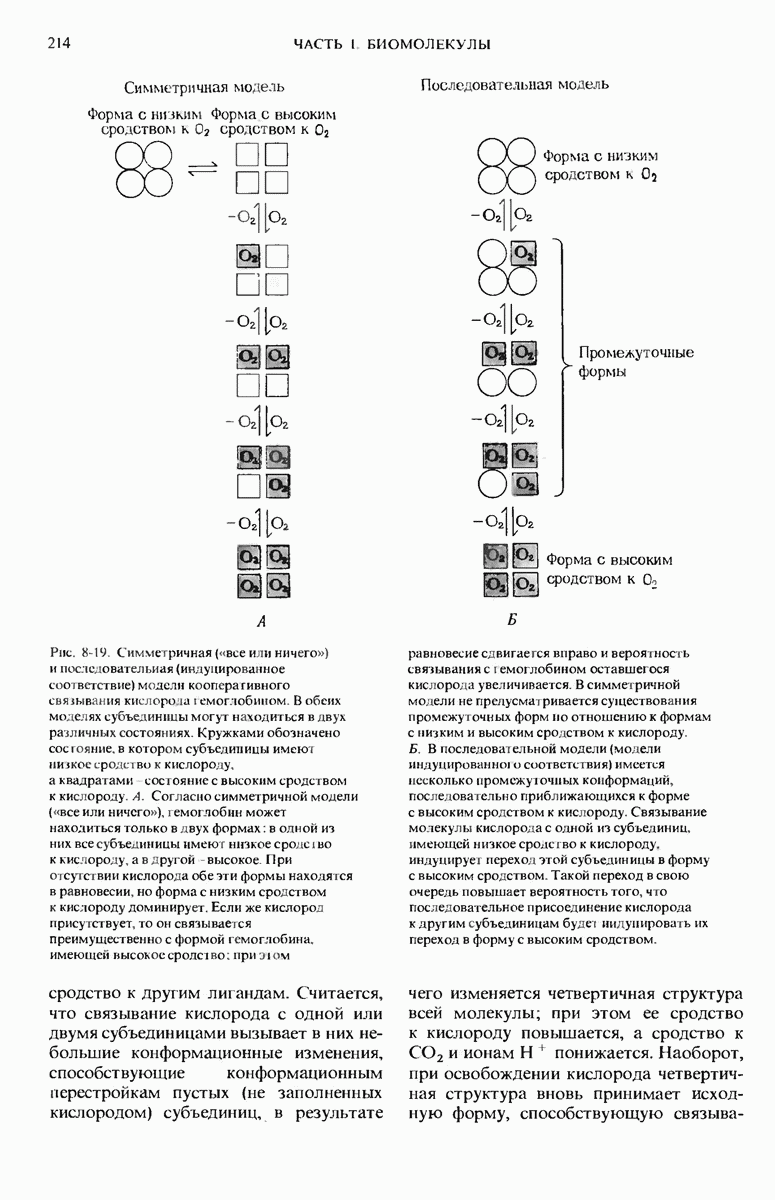
- 8.14. Кооперативное связывание кислорода делает гемоглобин более эффективным переносчиком кислорода
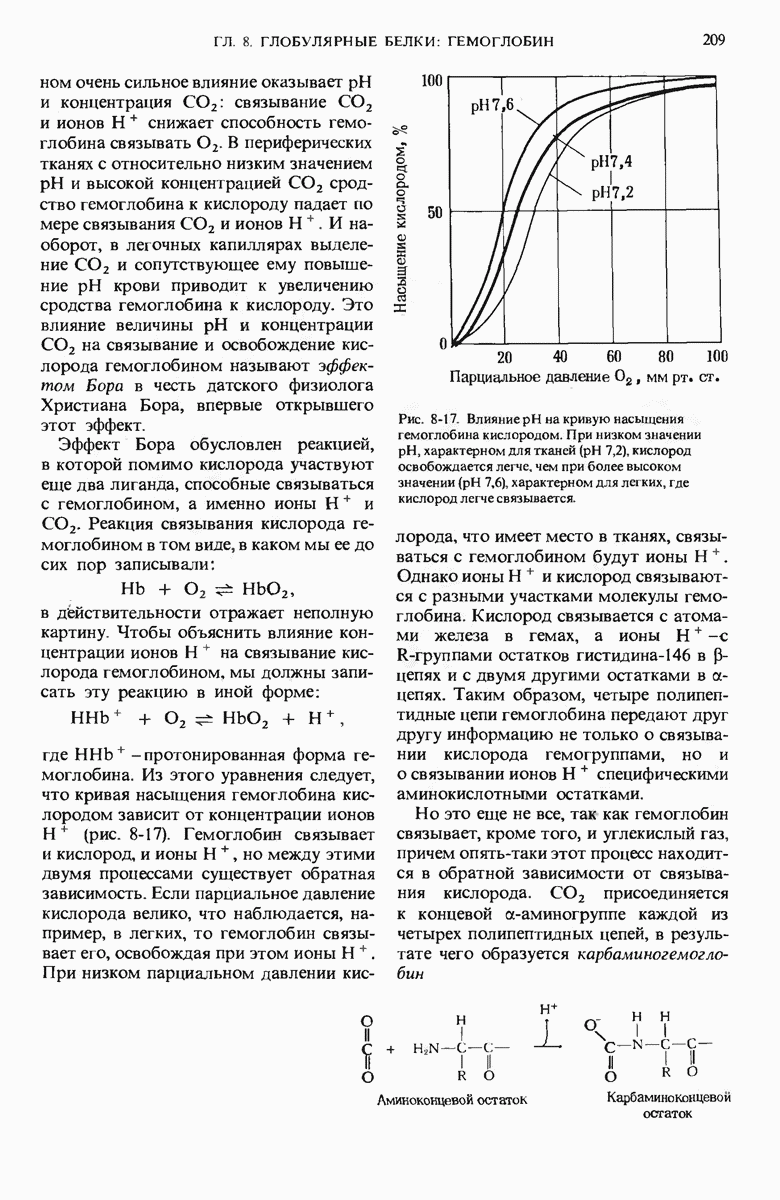
- 8.15. Гемоглобин служит также переносчиком С02 и ионов H+
- 8.16. Оксигенация гемоглобина вызывает изменение его пространственной конформации
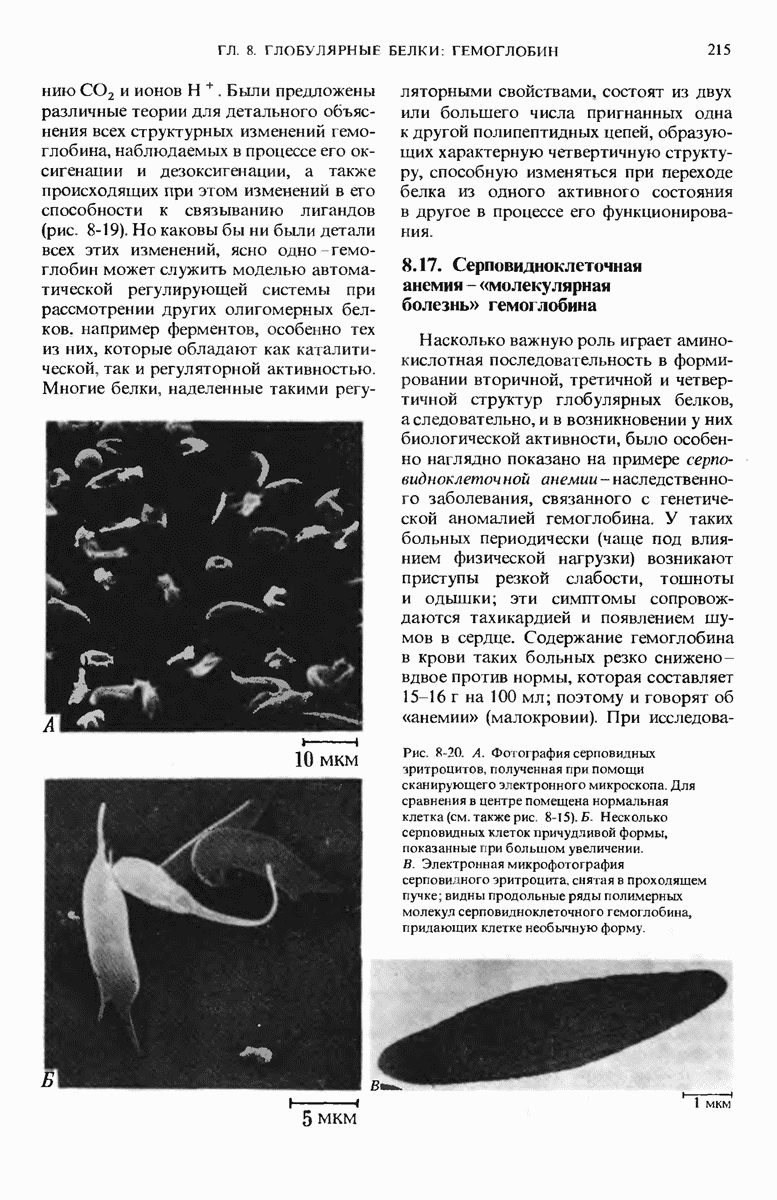
- 8.17. Серповидноклеточная анемия — «молекулярная болезнь» гемоглобина
- 8.18. Гемоглобин больных серповидноклеточной анемиеи имеет измененную аминокислотную последовательность
- 8.19. Серповидная форма эритроцитов обусловлена склонностью молекул гемоглобина S к агрегации
- 8.20. «Неправильные» аминокислоты появляются в белках в результате генных мутаций
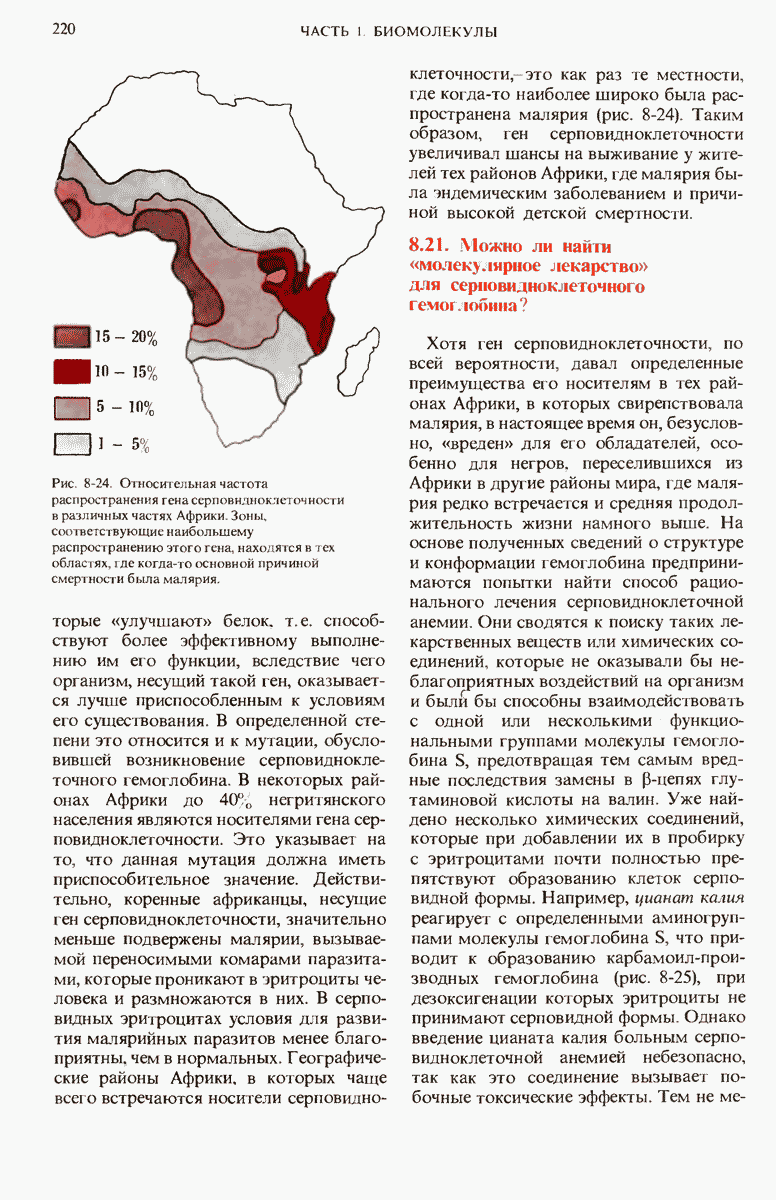
- 8.21. Можно ли найти «молекулярное лекарство» для серновидноклеточного гемоглобина?
- Краткое содержание главы
- ЛИТЕРАТУРА
- Вопросы и задачи
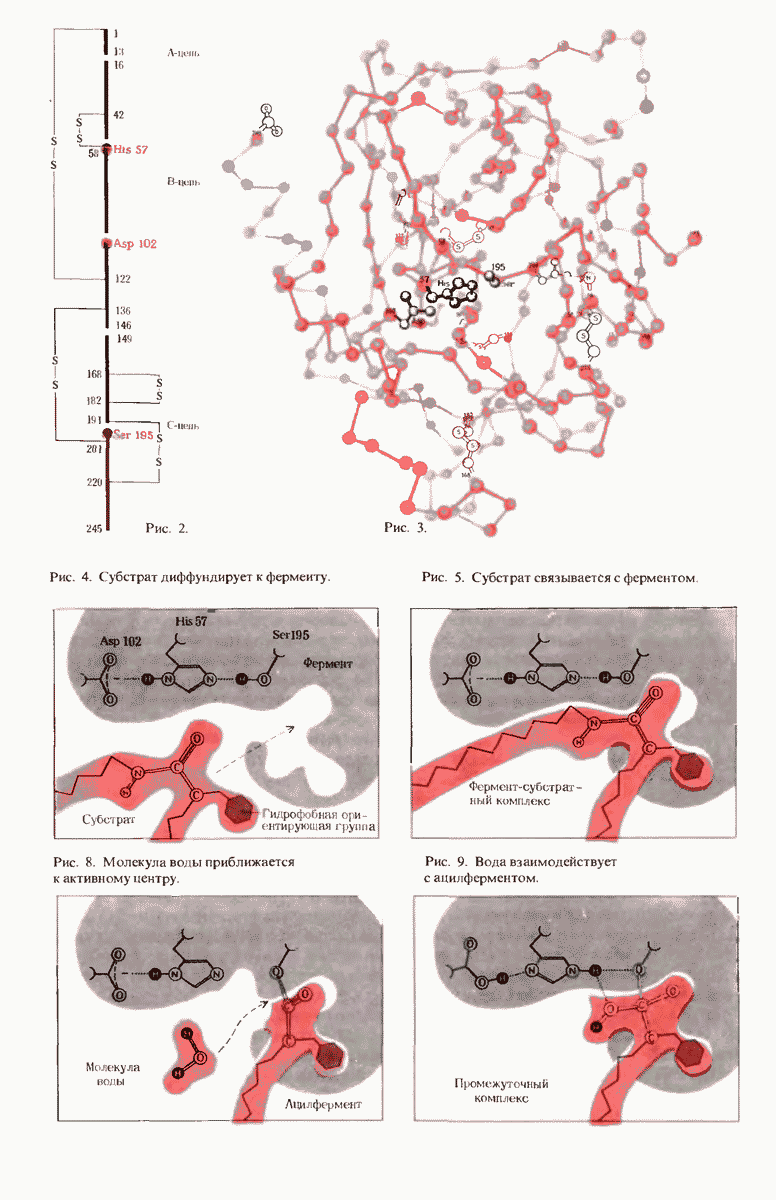
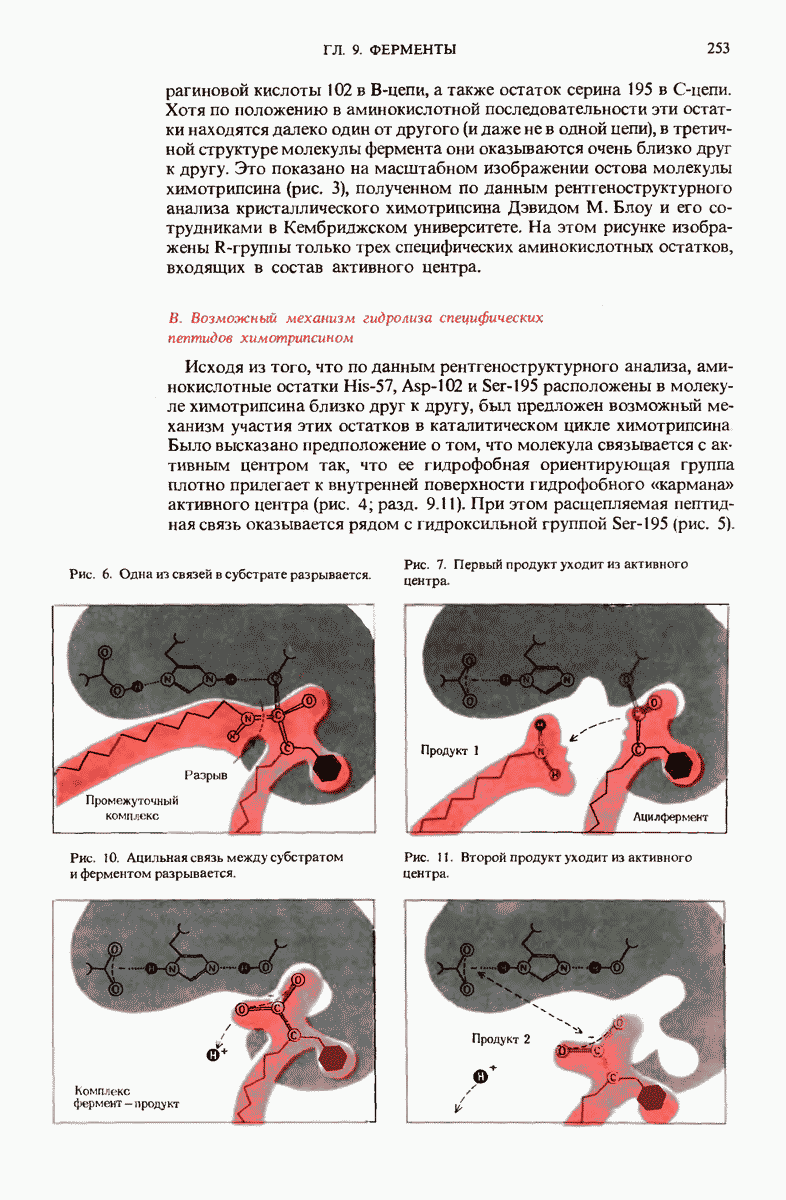
- ГЛАВА 9. ФЕРМЕНТЫ
- 9.1. История биохимии — это в значительной мере история исследования ферментов
- 9.2. Ферменты обнаруживают все свойства белков
- 9.3. Ферменты классифицируются на основе реакций, которые они катализируют
- 9.4. Ферменты ускоряют химические реакции, снижая энергию активации
- 9.5. Концентрация субстрата оказывает огромное влияние на скорость реакций, катализируемых ферментами
- 9.6. Существует количественная связь между концентрацией субстрата и скоростью ферментативной реакции
- 9.7. Каждый фермент имеет характерную величину Км для данного субстрата
- 9.8. Многие ферменты катализируют реакции с участием двух субстратов
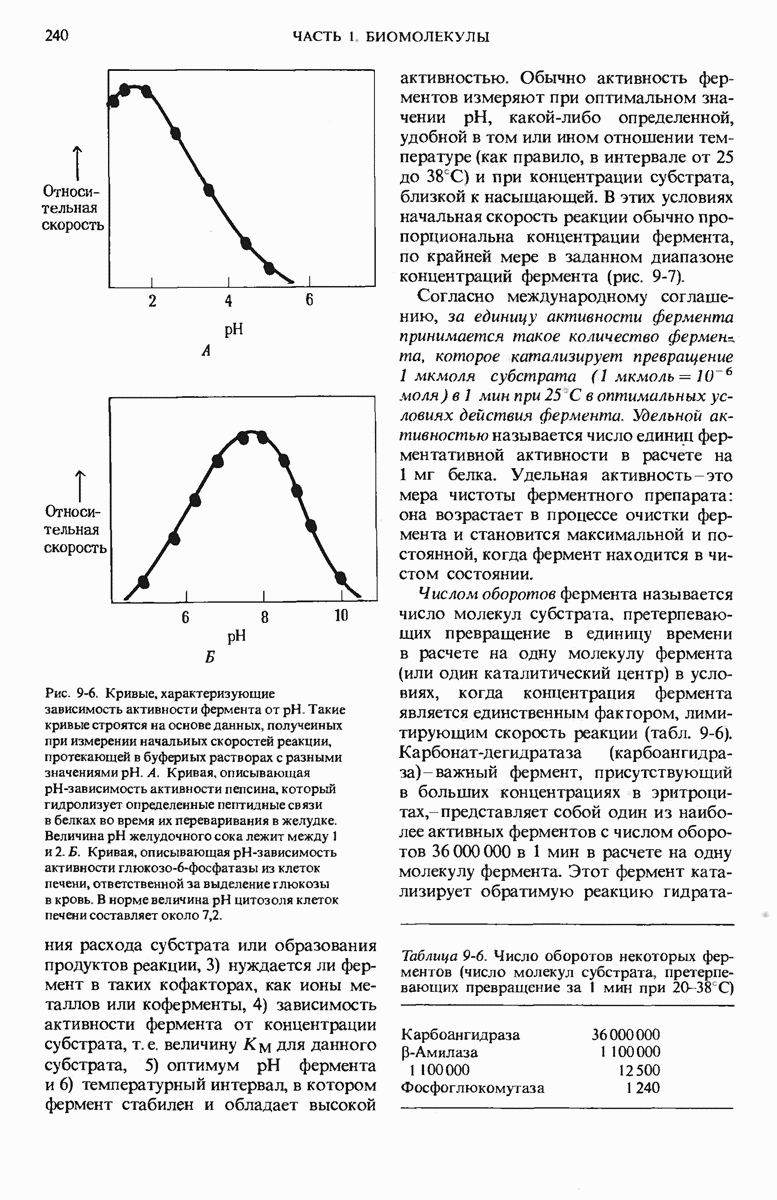
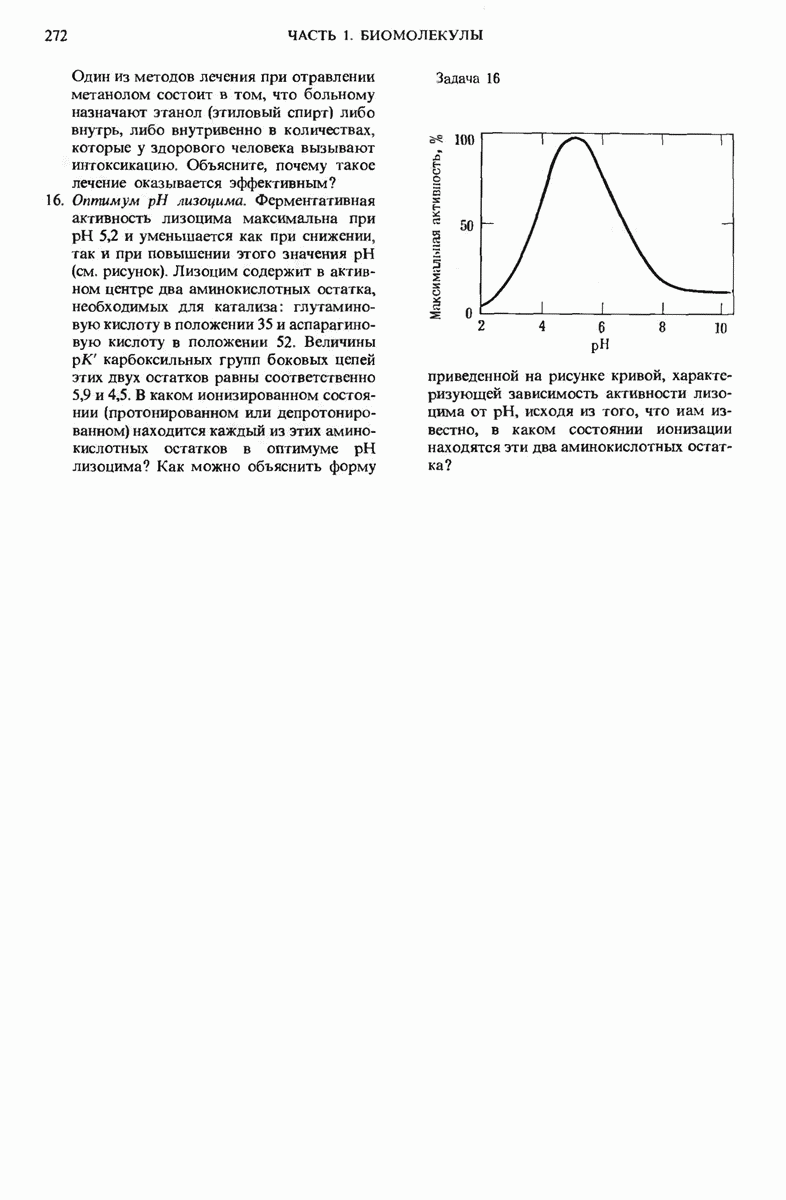
- 9.9. Каждый фермент имеет определенный оптимум pH
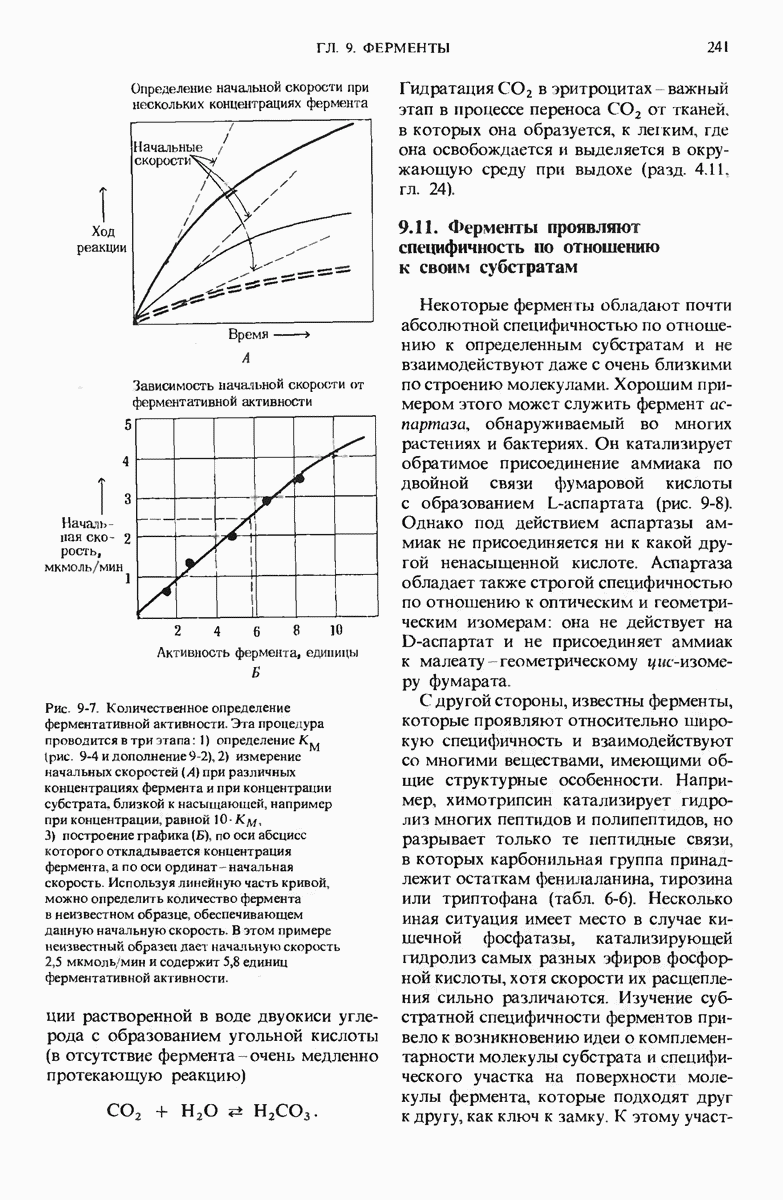
- 9.10. Количество фермента можно определить по его активности
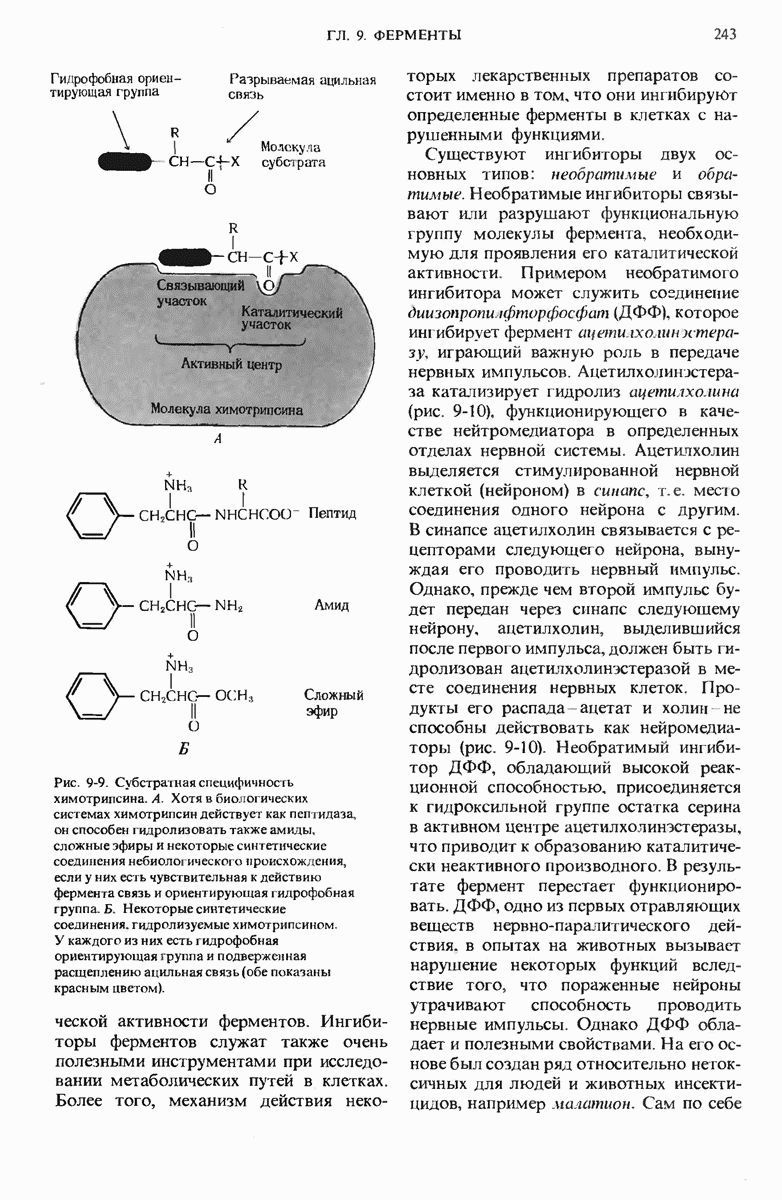
- 9.11. Ферменты проявляют специфичность по отношению к своим субстратам
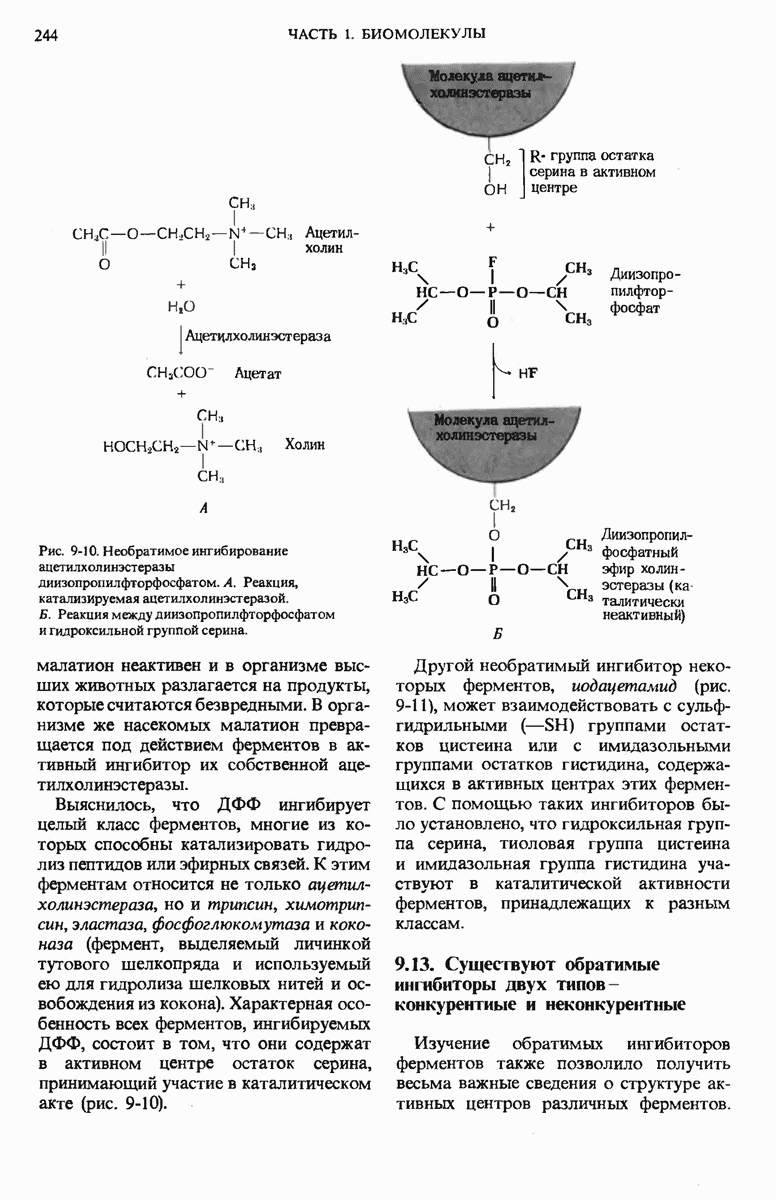
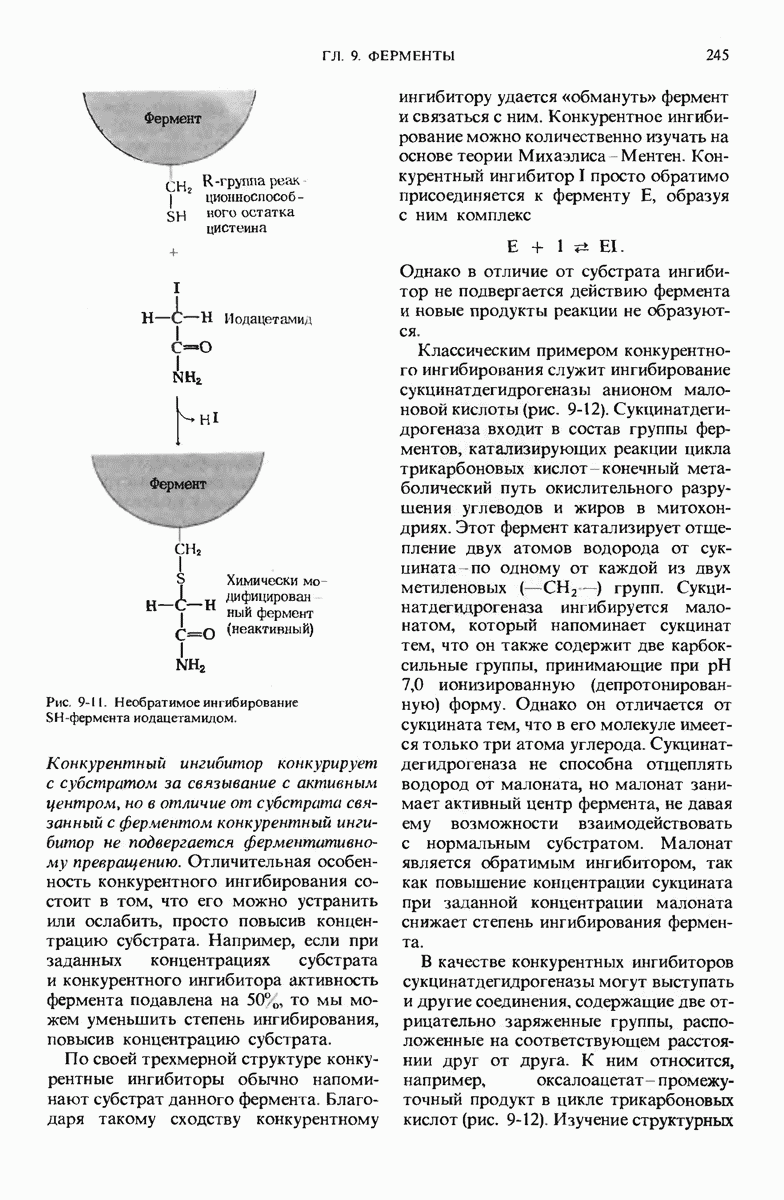
- 9.12. Ферменты можно ингибировать определенными химическими соединениями
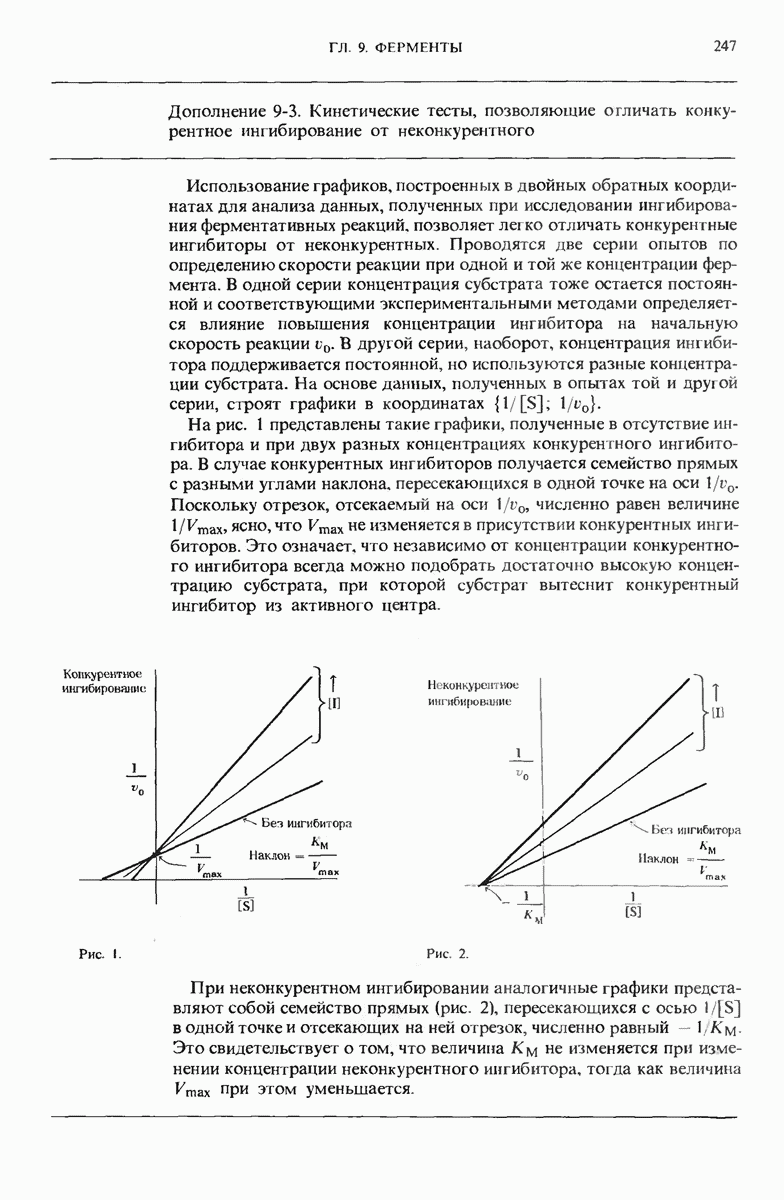
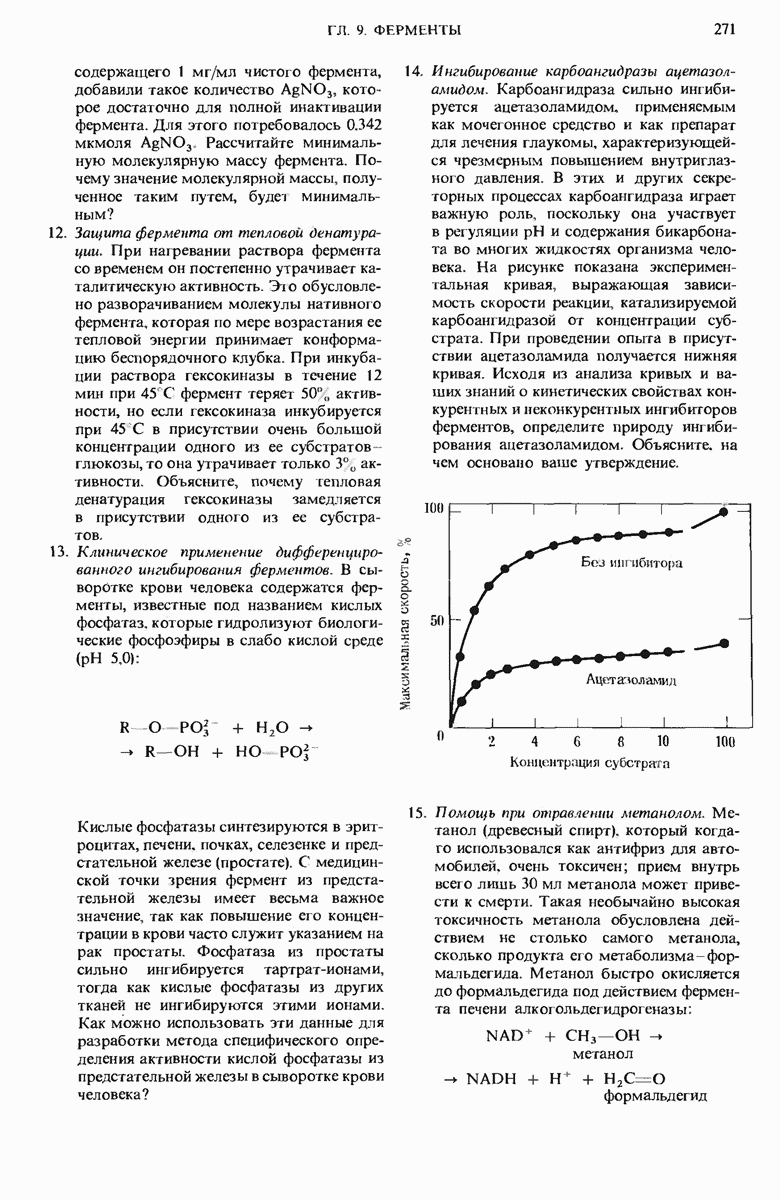
- 9.13. Существуют обратимые ингибиторы двух типов — конкурентные и неконкурентные
- 9.14. Неконкурентное ингибирование тоже обратимо, но не может быть ослаблено или устранено повышением концентрации субстрата
- 9.15. Факторы, определяющие каталитическую эффективность ферментов
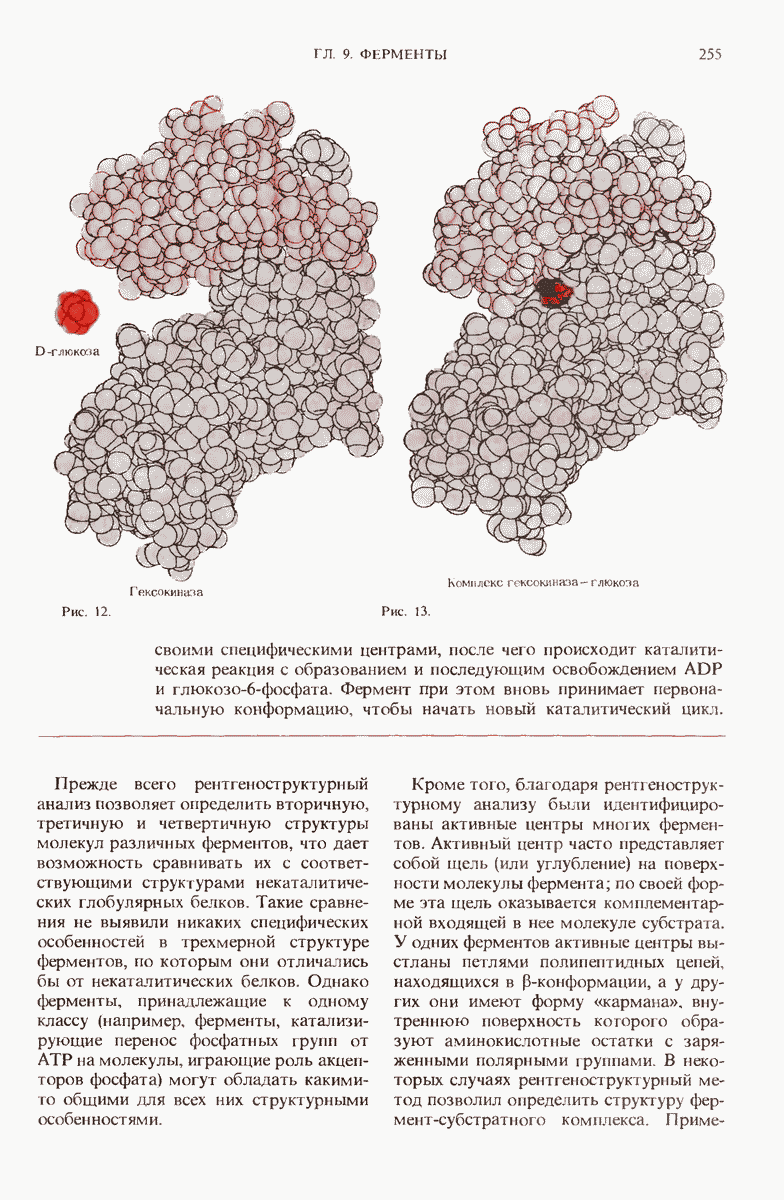
- 9.16. Рентгеноструктурный анализ выявил важные структурные особенности ферментов
- 9.17. В ферментных системах есть «дирижер», роль которого выполняет регуляторный фермент
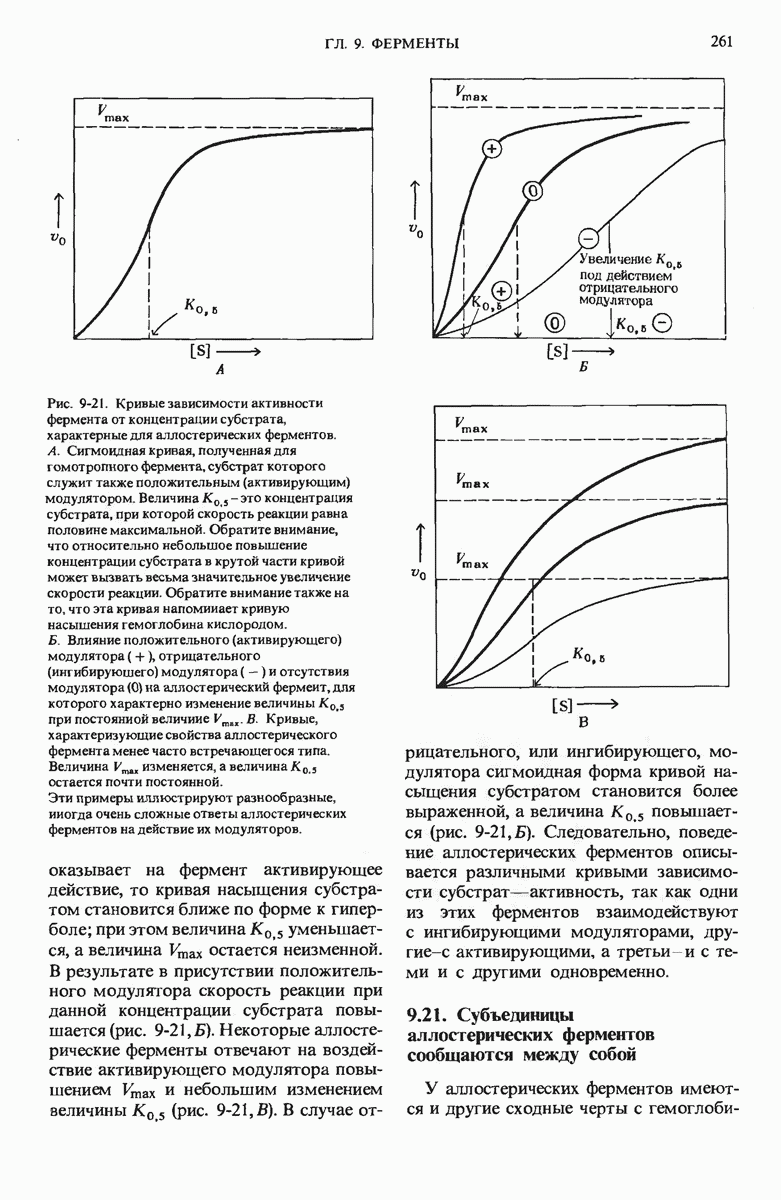
- 9.18. Аллостерические ферменты регулируются путем нековалентного присоединения к ним молекул модуляторов
- 9.19. Аллостерические ферменты ингибируются или активируются их модуляторами
- 9.20. Поведение аллостерических ферментов не описывается уравнением Михаэлиса — Ментеи
- 9.21. Субъединицы аллостерических ферментов сообщаются между собой
- 9.22. Некоторые ферменты регулируются путем обратной ковалентной модификации
- 9.23. Многие ферменты существуют в нескольких формах
- 9.24. Нарушение каталитической активности ферментов может быть обусловлено мутациями
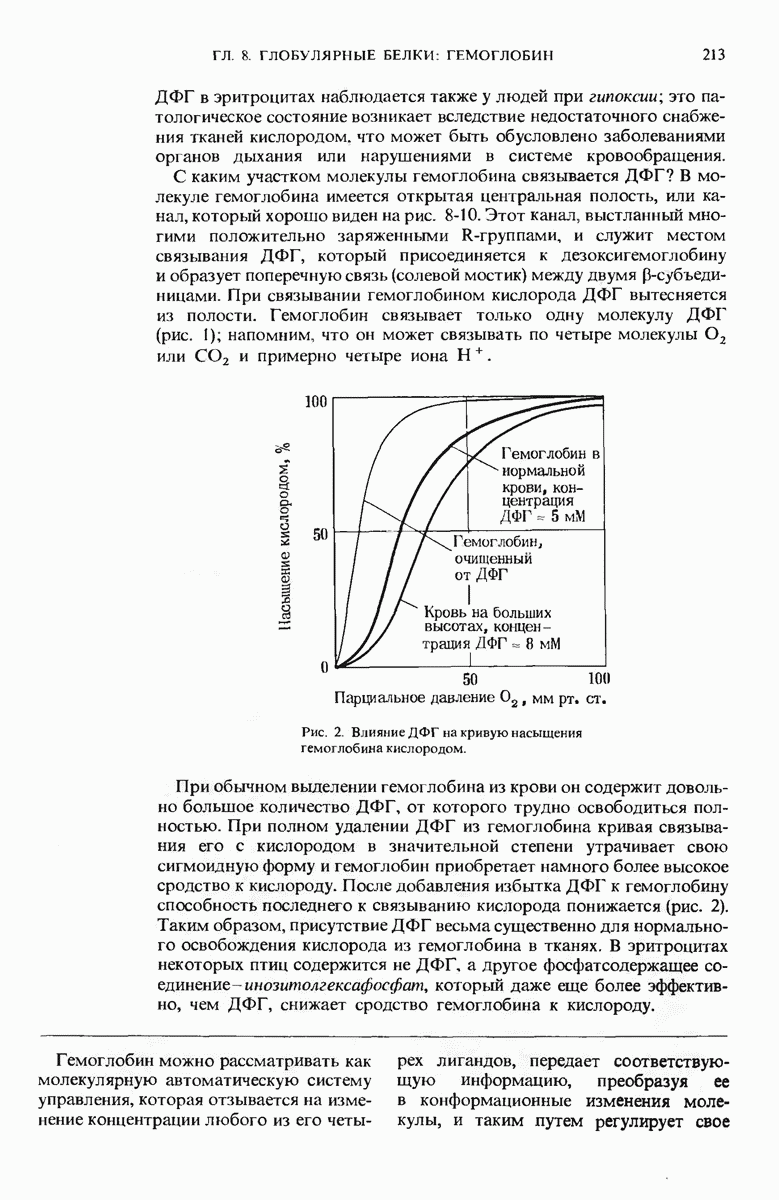
- Краткое содержание главы
- ЛИТЕРАТУРА
- Вопросы и задачи
- ГЛАВА 10. ВИТАМИНЫ И МИКРОЭЛЕМЕНТЫ: ИХ РОЛЬ В ФУНКЦИОНИРОВАНИИ ФЕРМЕНТОВ
- 10.1. Витамины — незаменимые органические микрокомпоненты пищи
- 10.2. Витамины являются важными компонентами коферментов и простетических групп ферментов
- 10.3. Витамины можно разделить на два класса
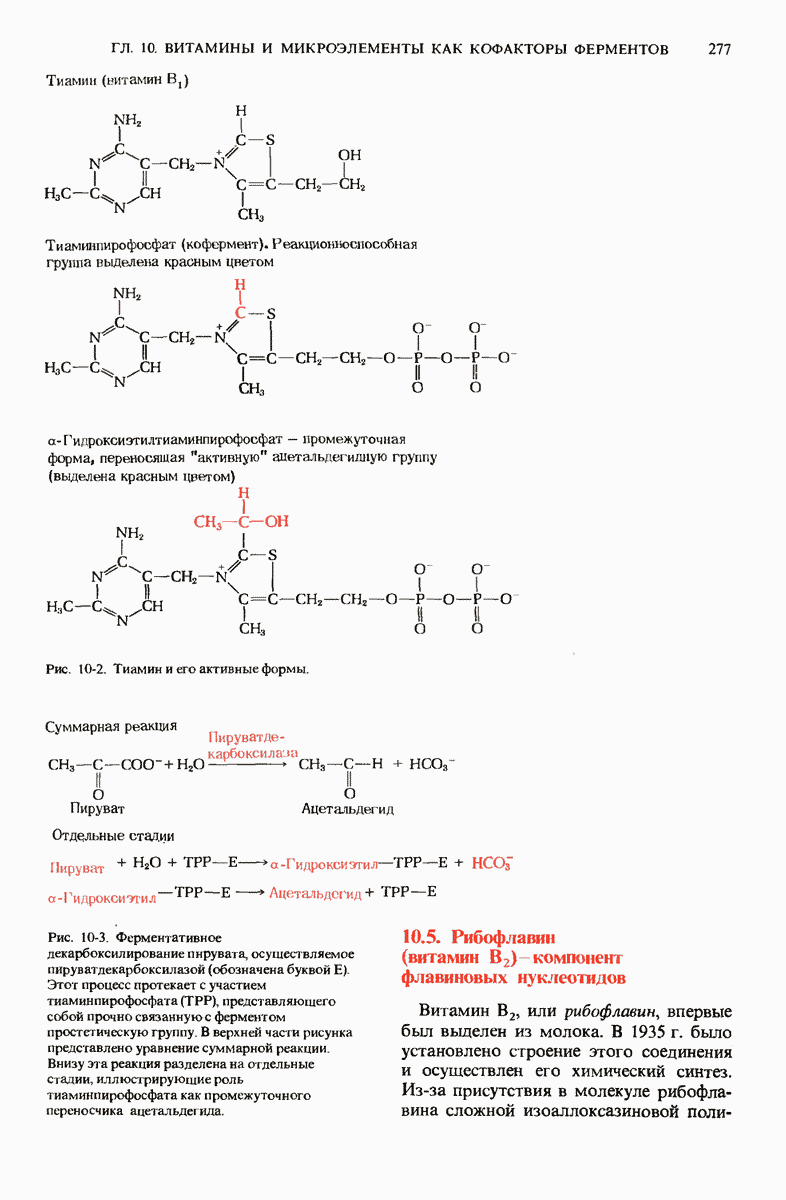
- 10.4. Тиамин (витамин B1) функционирует в форме тиаминпирофосфата
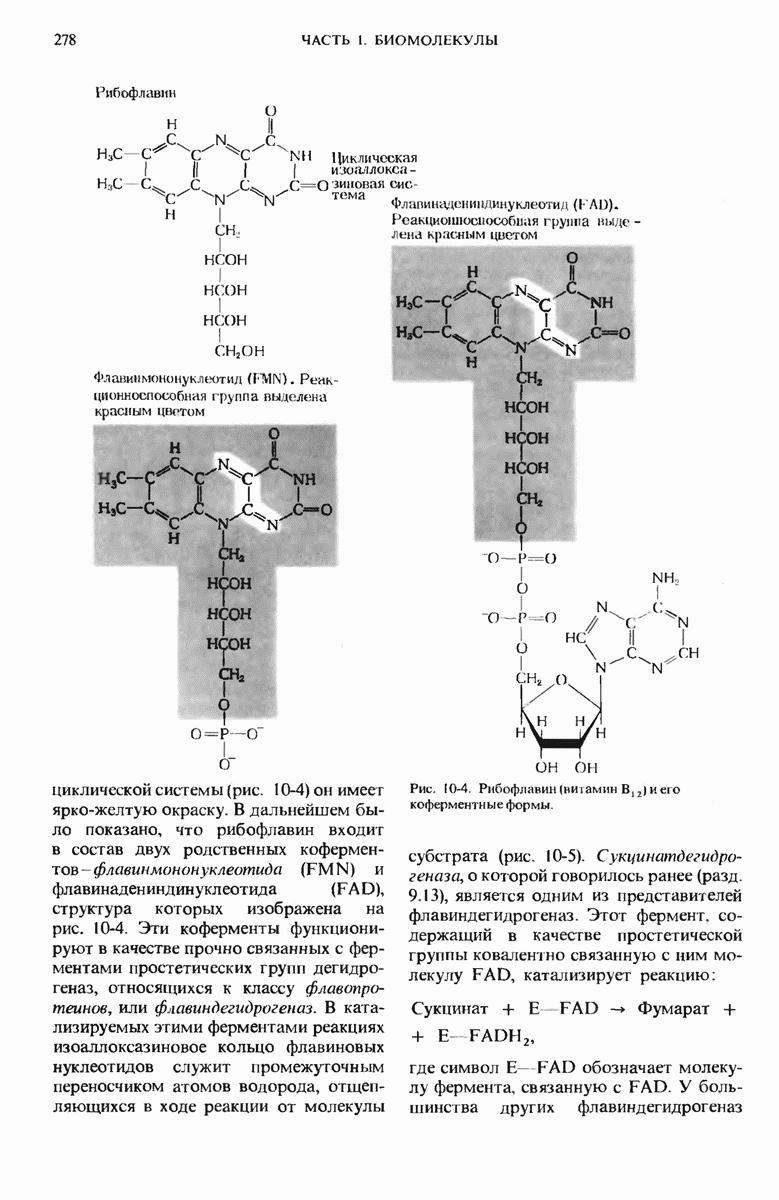
- 10.5. Рибофлавин (витамин В2) — компонент флавиновых нуклеотидов
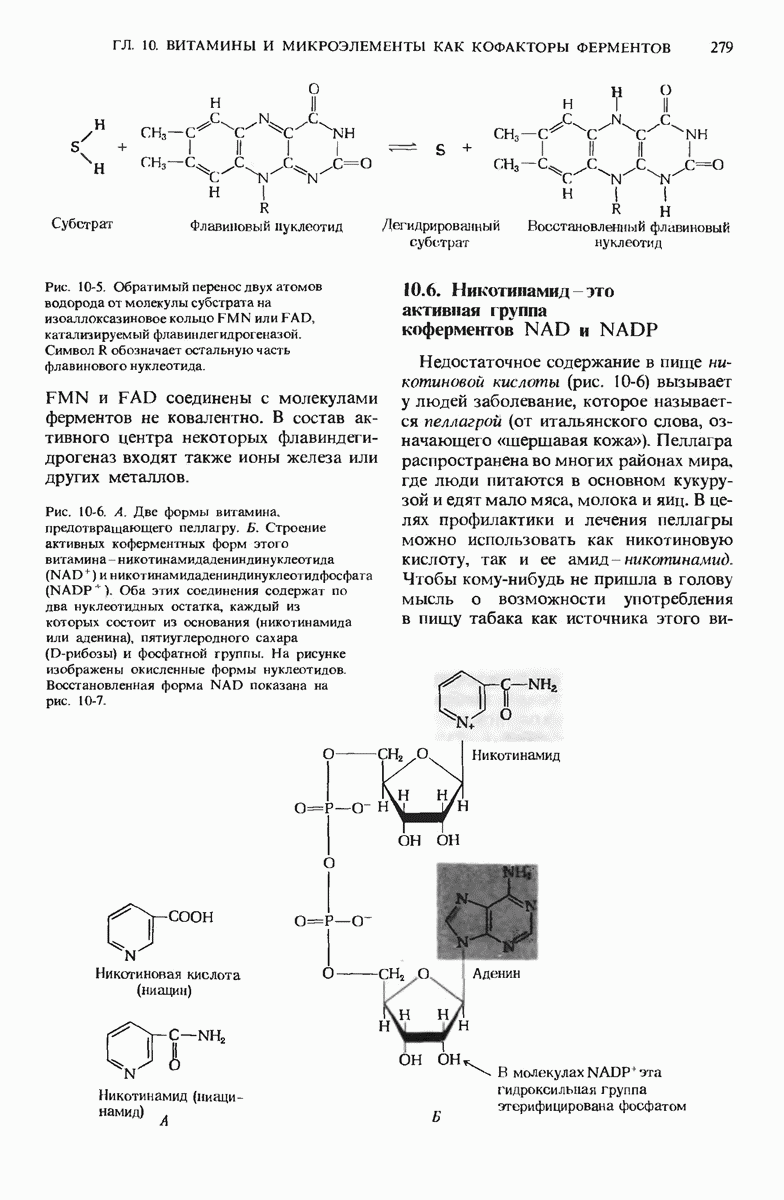
- 10.6. Никотинамид — это активная группа коферментов NAD и NADP
- 10.7. Пантотеновая кислота — компонент кофермента А
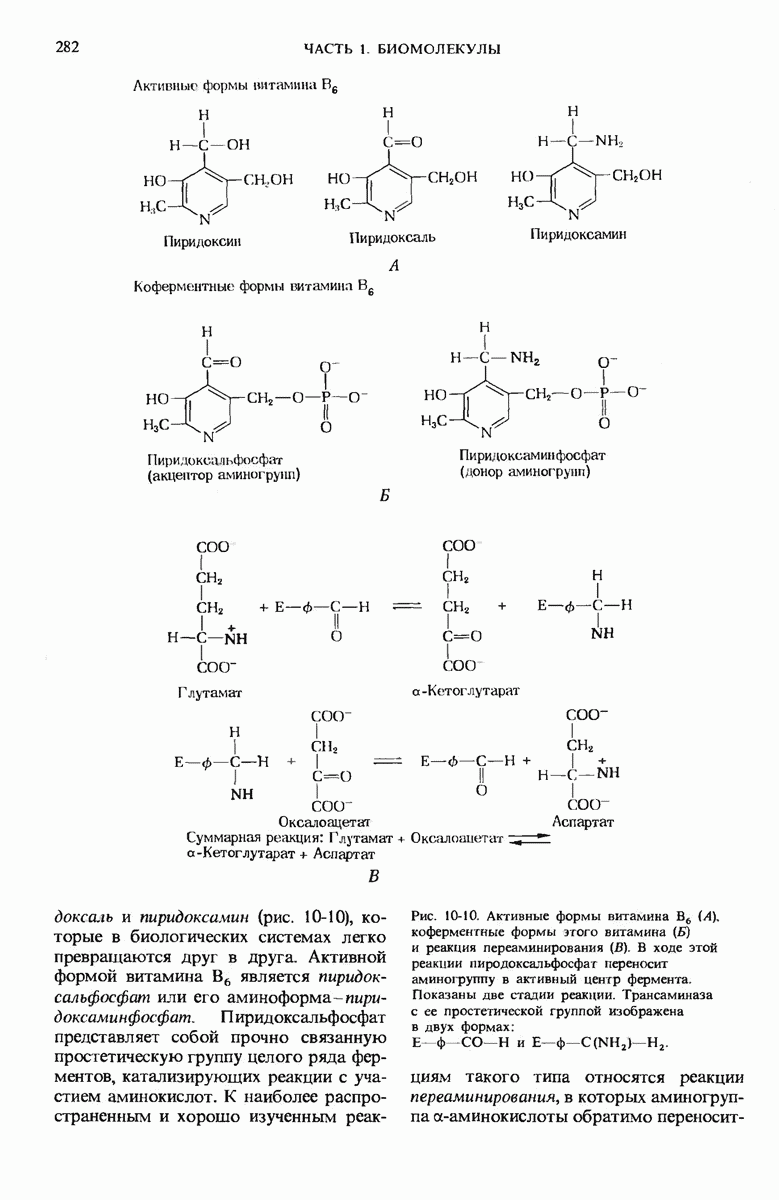
- 10.8. Пиридоксин (витамин В6) играет важную роль в метаболизме аминокислот
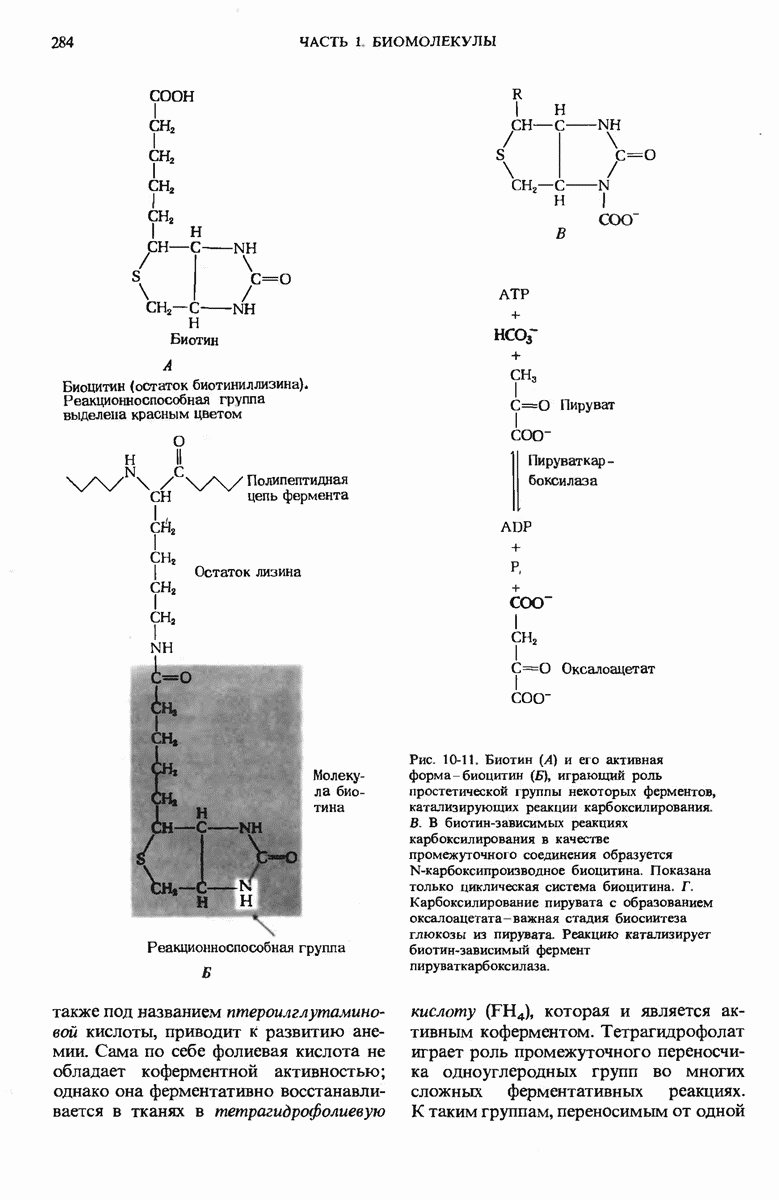
- 10.9. Биотин является активным компонентом биоцитина — простетической группы некоторых ферментов, катализирующих реакции карбоксилирования
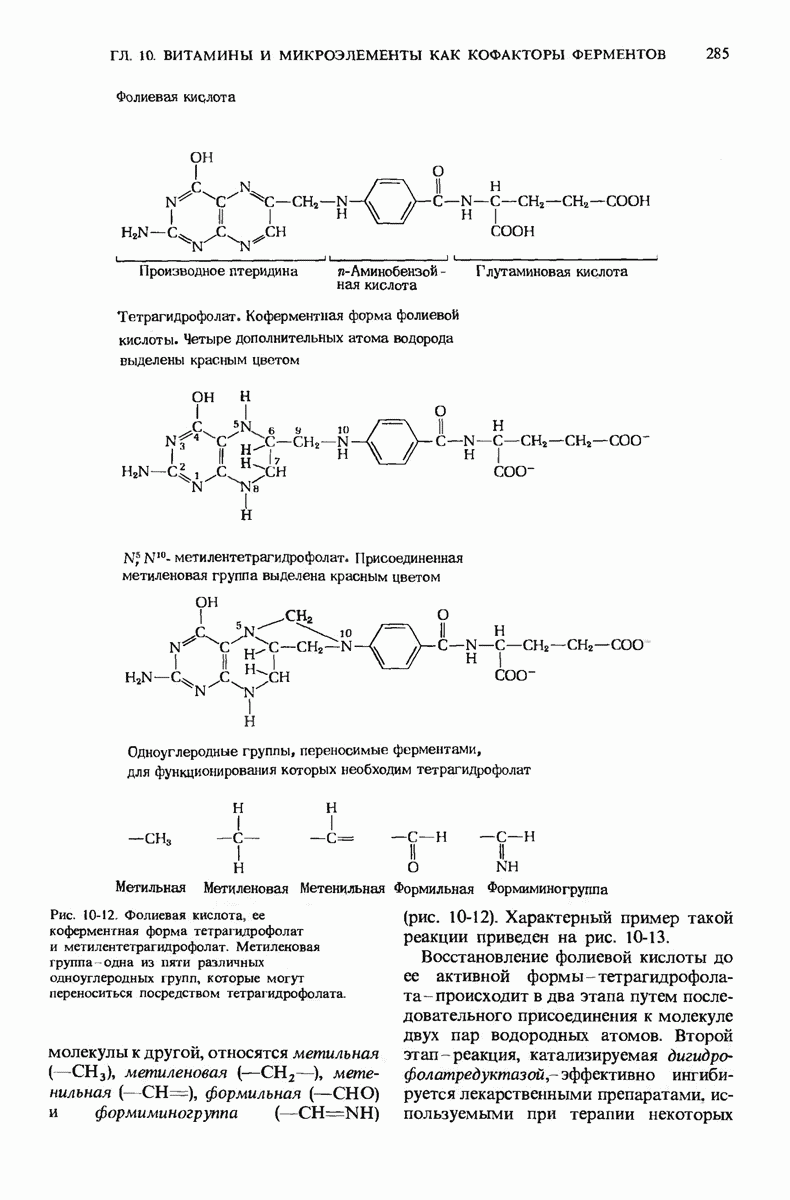
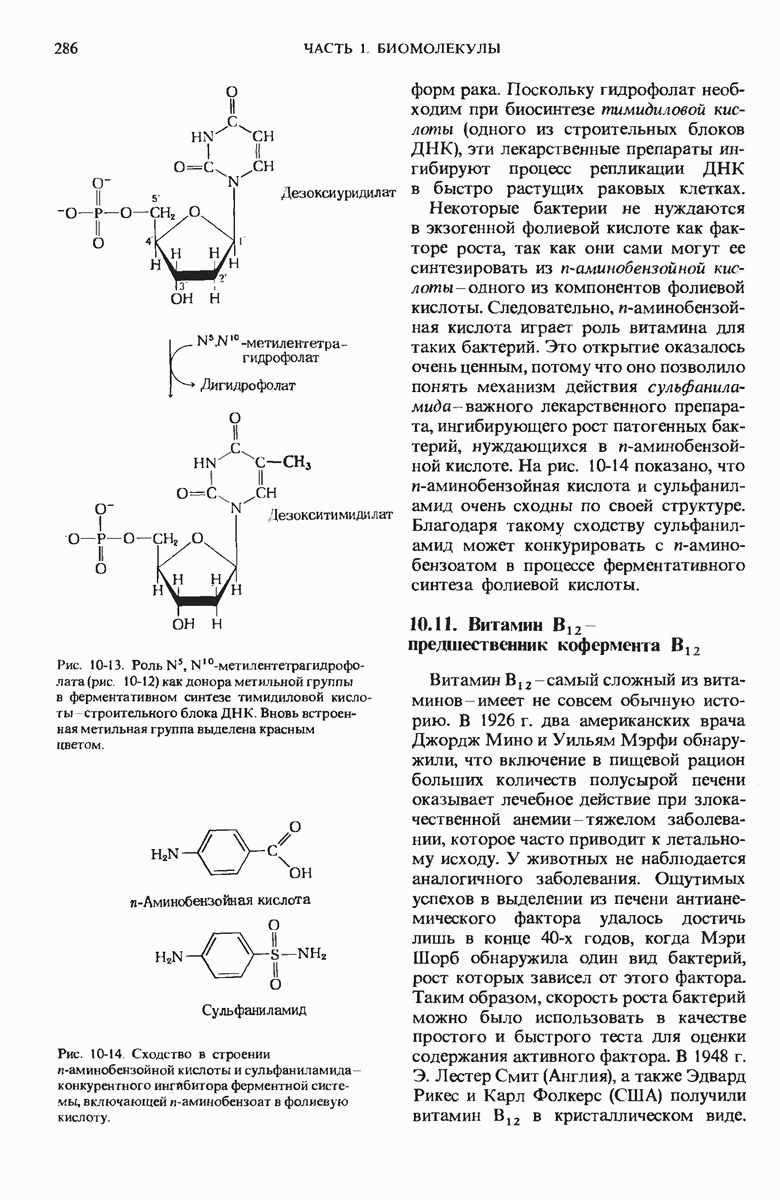
- 10.10. Фолиевая кислота служит предшественником кофермента тетрагидрофолиевой кислоты
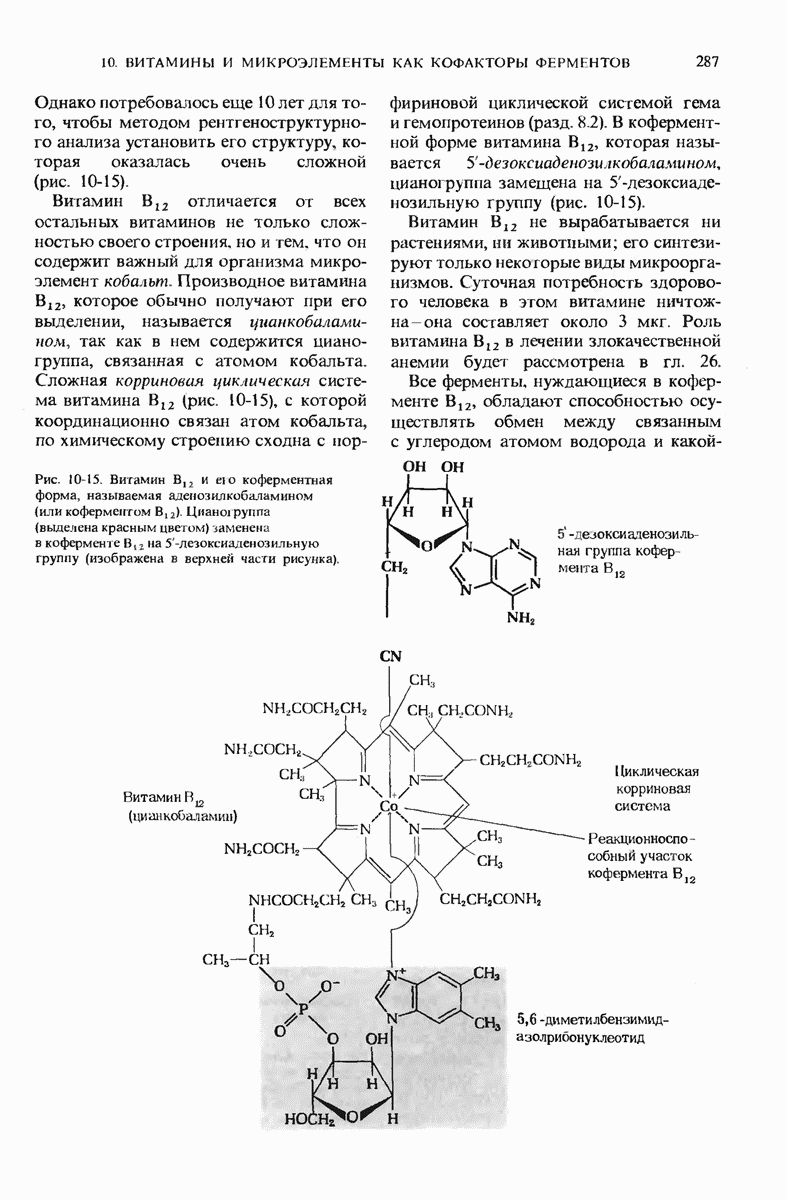
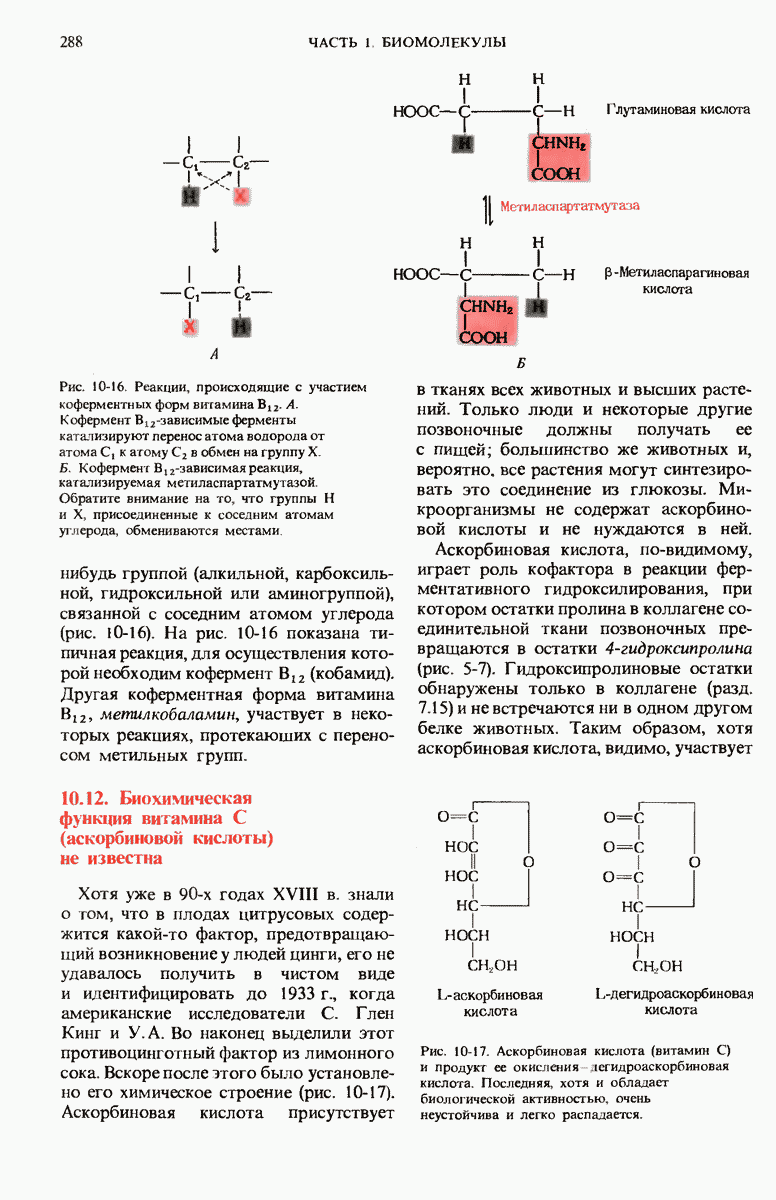
- 10.11. Витамин B12 — предшественник кофермента В12
- 10.12. Биохимическая функция витамина С (аскорбиновой кислоты) не известна
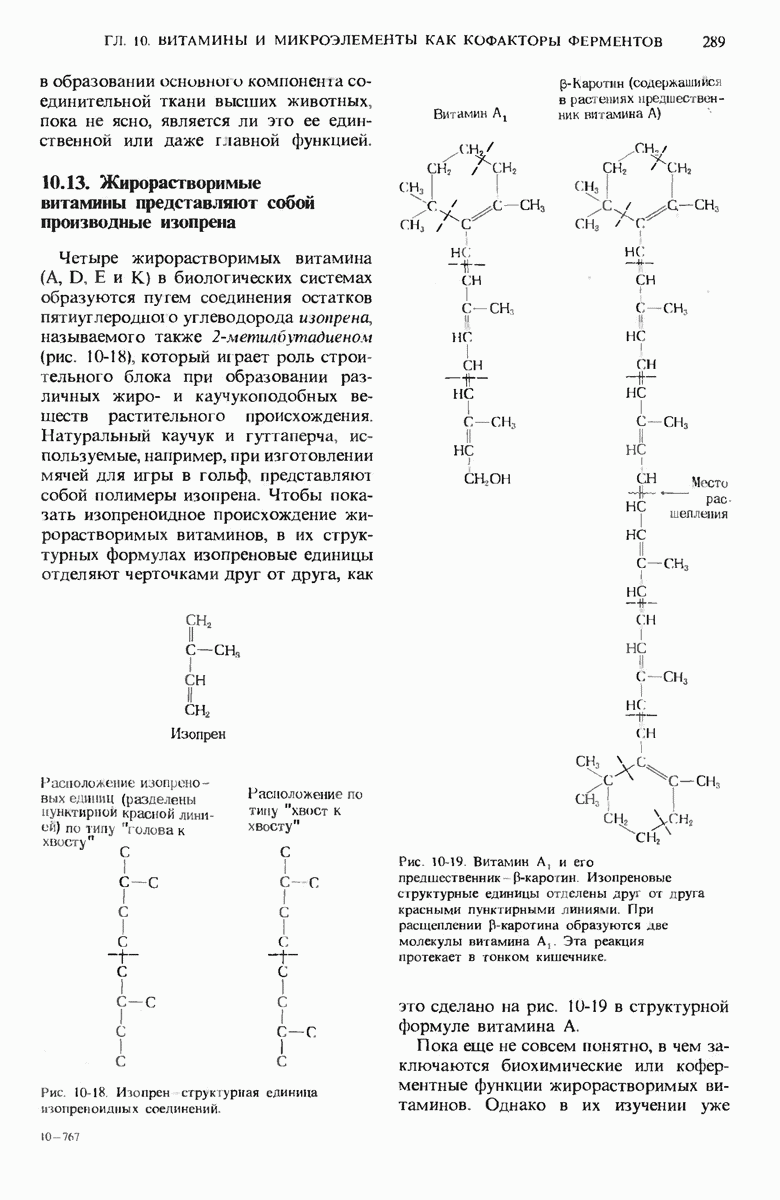
- 10.13. Жирорастворимые витамины представляют собой производные изопрена
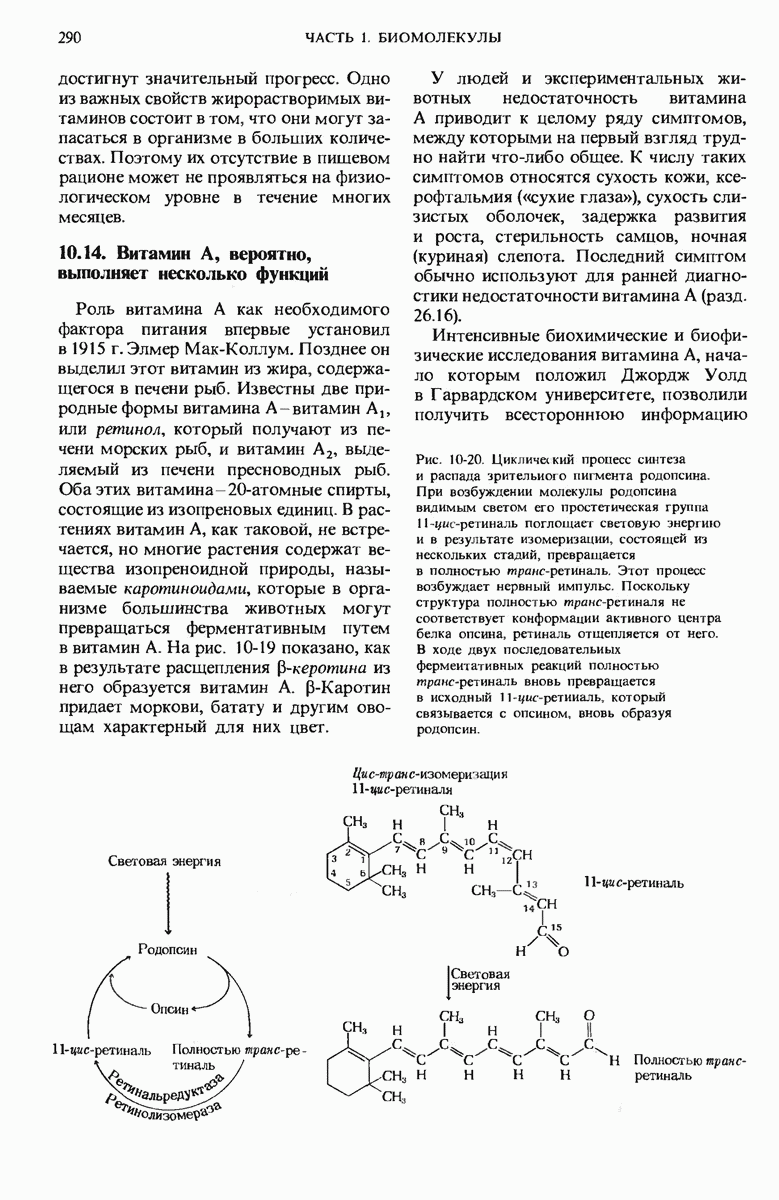
- 10.14. Витамин А, вероятно, выполняет несколько функций
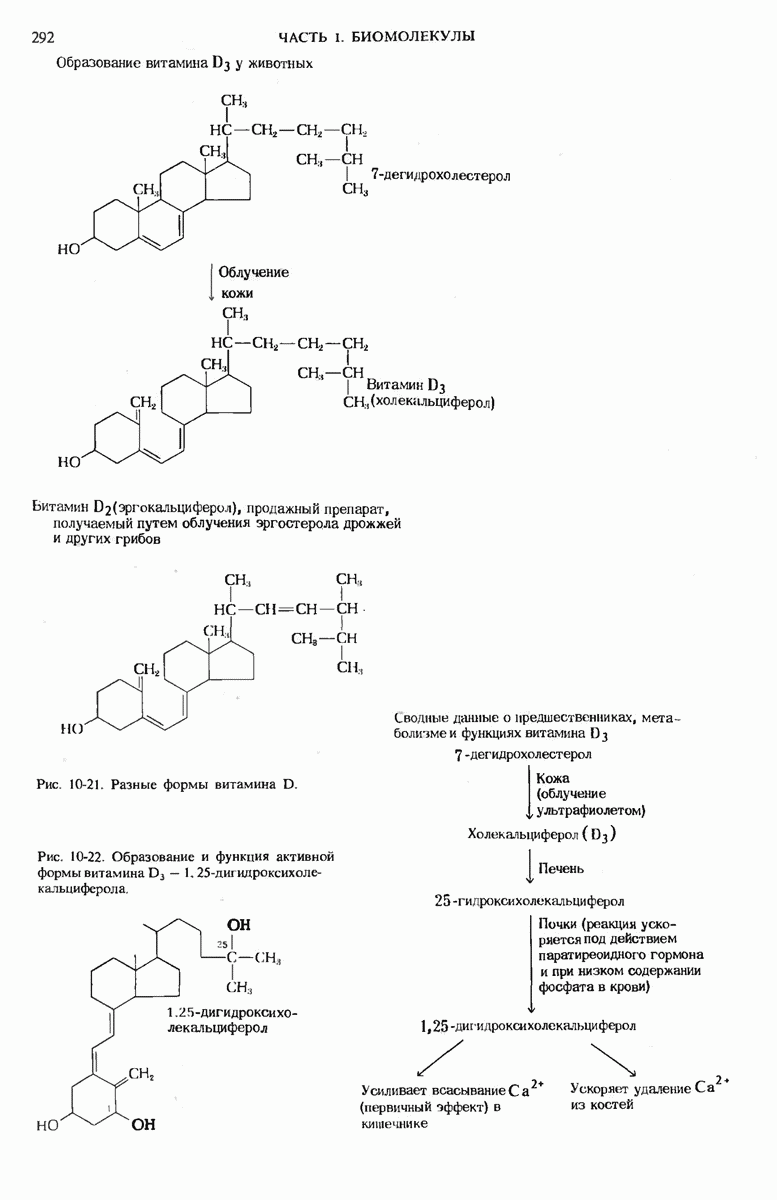
- 10.15. Витамин D — предшественник гормона
- 10.16. Витамин Е защищает клеточные мембраны от кислорода
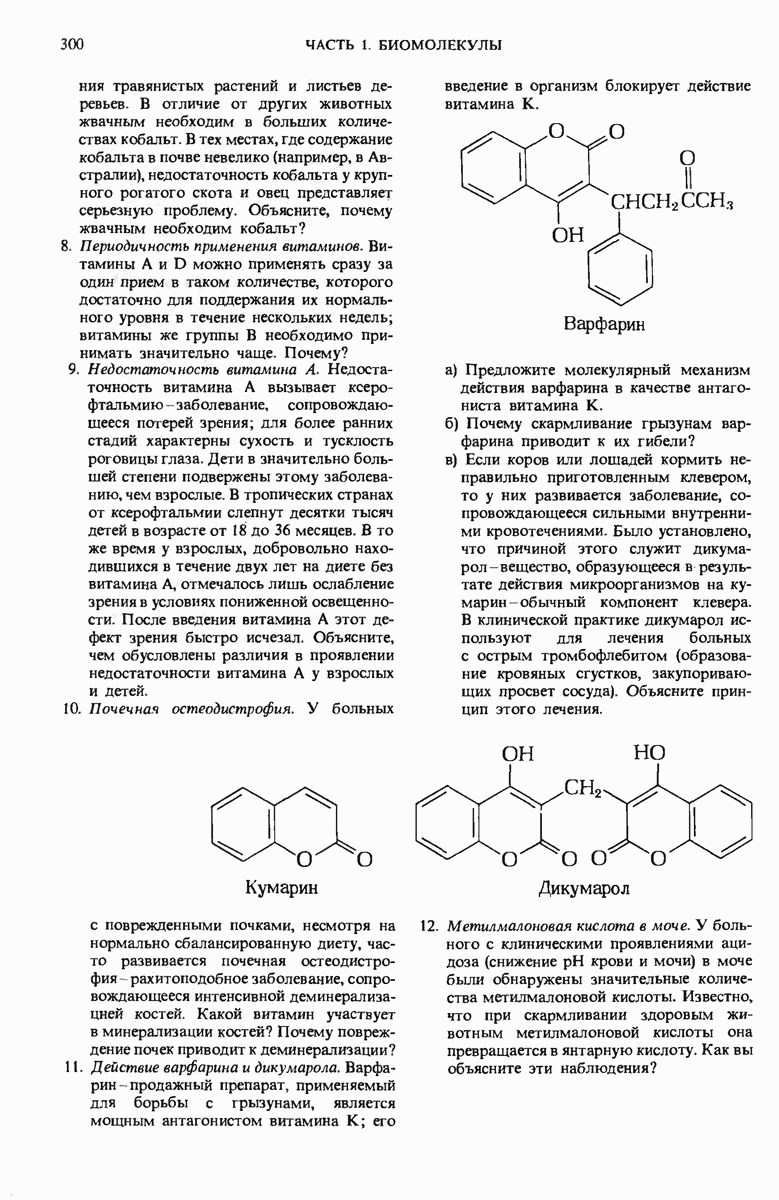
- 10.17. Витамин К-компонент карбокснлнрукнцего фермента
- 10.18. В пище животных должны содержаться многочисленные неорганические вещества
- 10.19. Для действия многих ферментов требуется железо
- 10.20. В некоторых окислительных ферментах содержится также медь
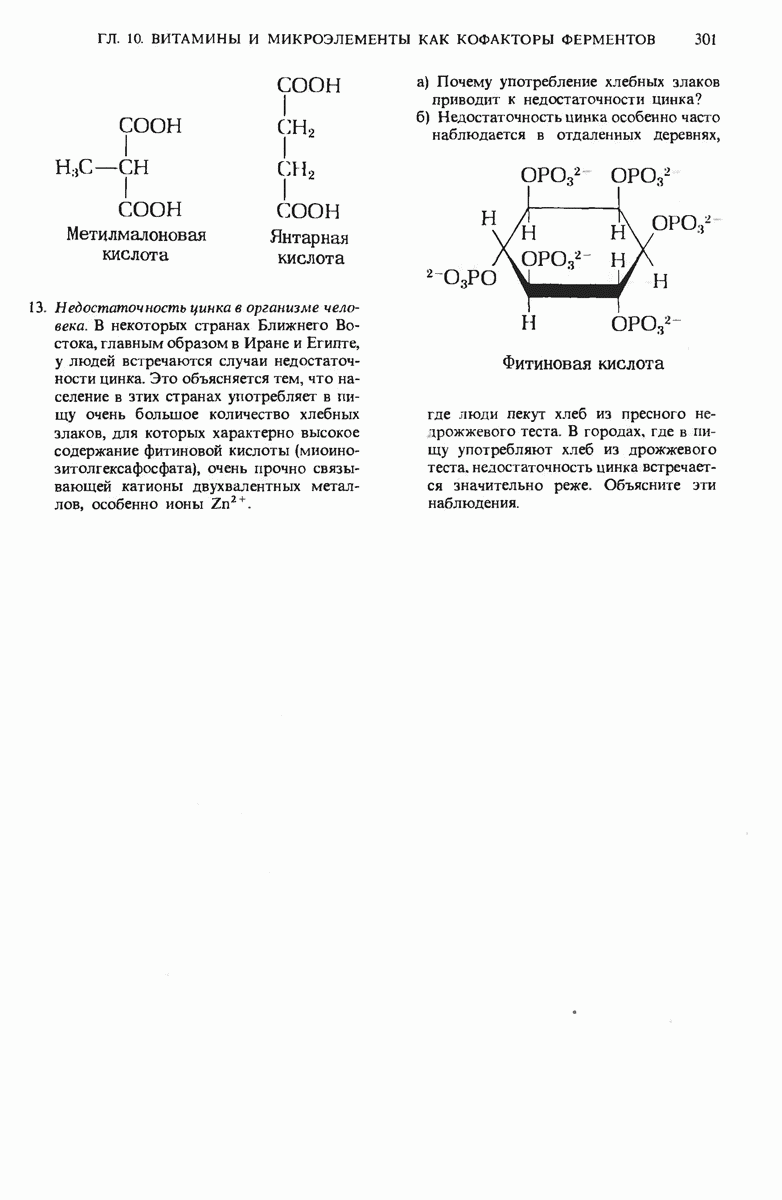
- 10.21. Для действия многих ферментов необходим цинк
- 10.22. Некоторым ферментам требуются ионы марганца
- 10.23. В состав витамина В12 входит кобальт
- 10.24. Селен является и незаменимым микроэлементом, и ядом
- 10.25. Для некоторых ферментов требуются другие микроэлементы
- Краткое содержание главы
- ЛИТЕРАТУРА
- Вопросы и залами
- ГЛАВА 11. УГЛЕВОДЫ: СТРОЕНИЕ И БИОЛОГИЧЕСКИЕ ФУНКЦИИ
- 11.1. Углеводы делятся на три класса в зависимости от числа остатков сахаров
- 11.2. Существует два семейства моносахаридов: альдозы и кетозы
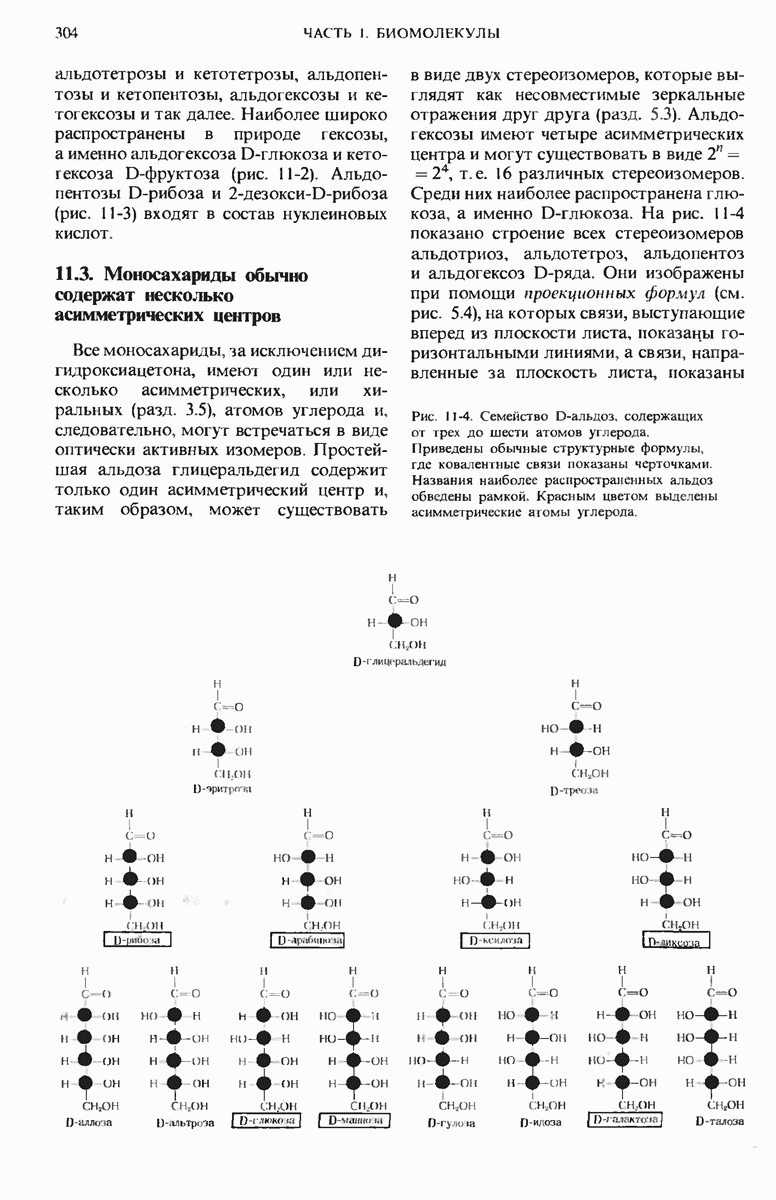
- 11.3. Моносахариды обычно содержат несколько асимметрических центров
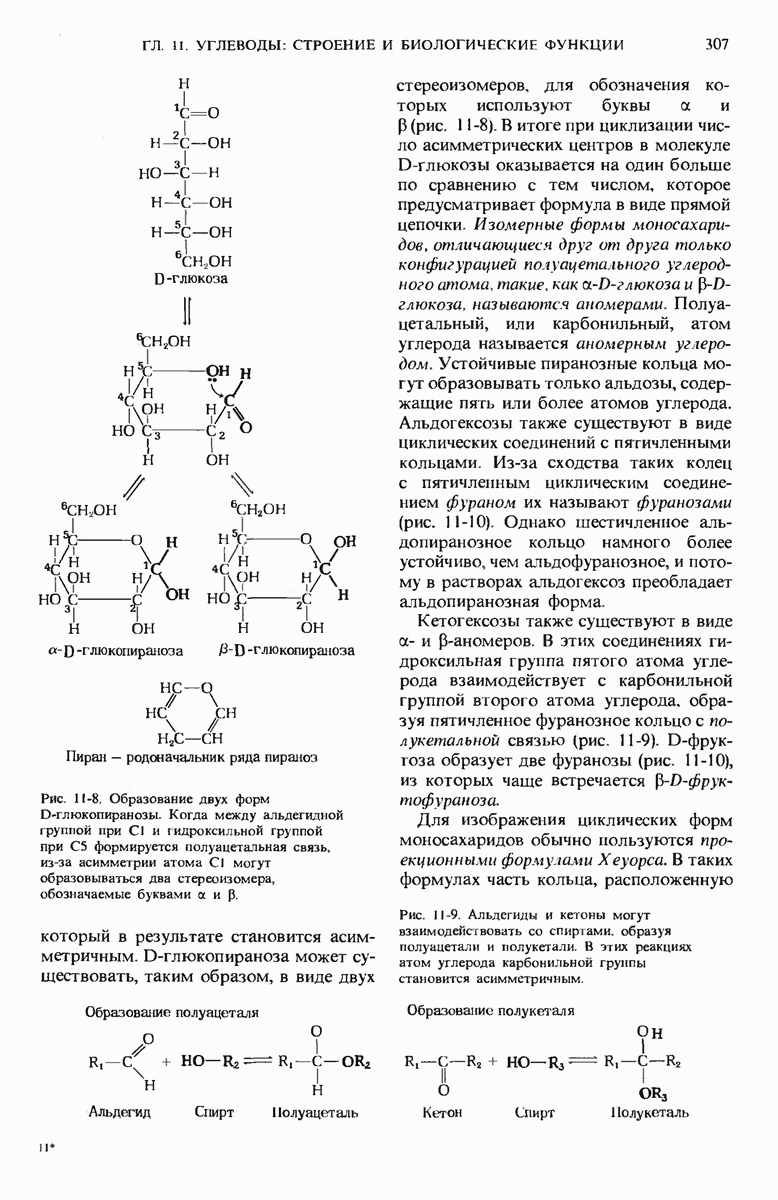
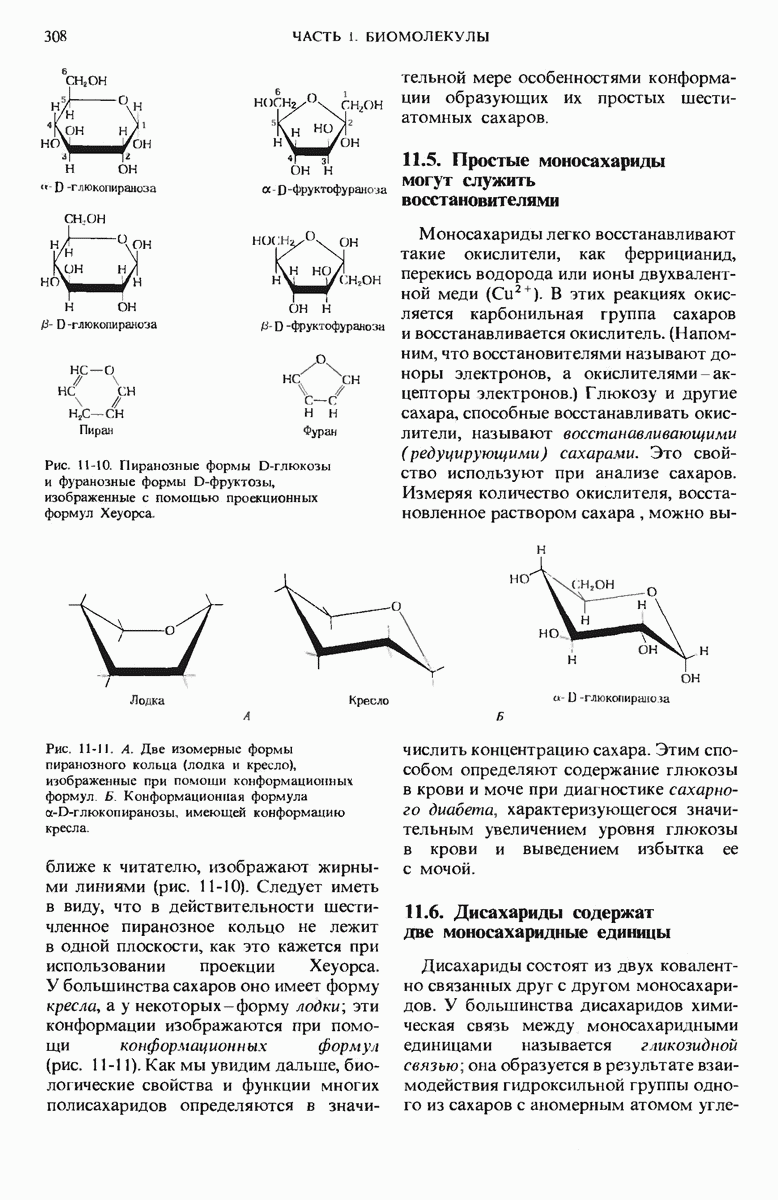
- 11.4. Типичные моносахариды имеют циклическую структуру
- 11.5. Простые моносахариды могут служить восстановителями
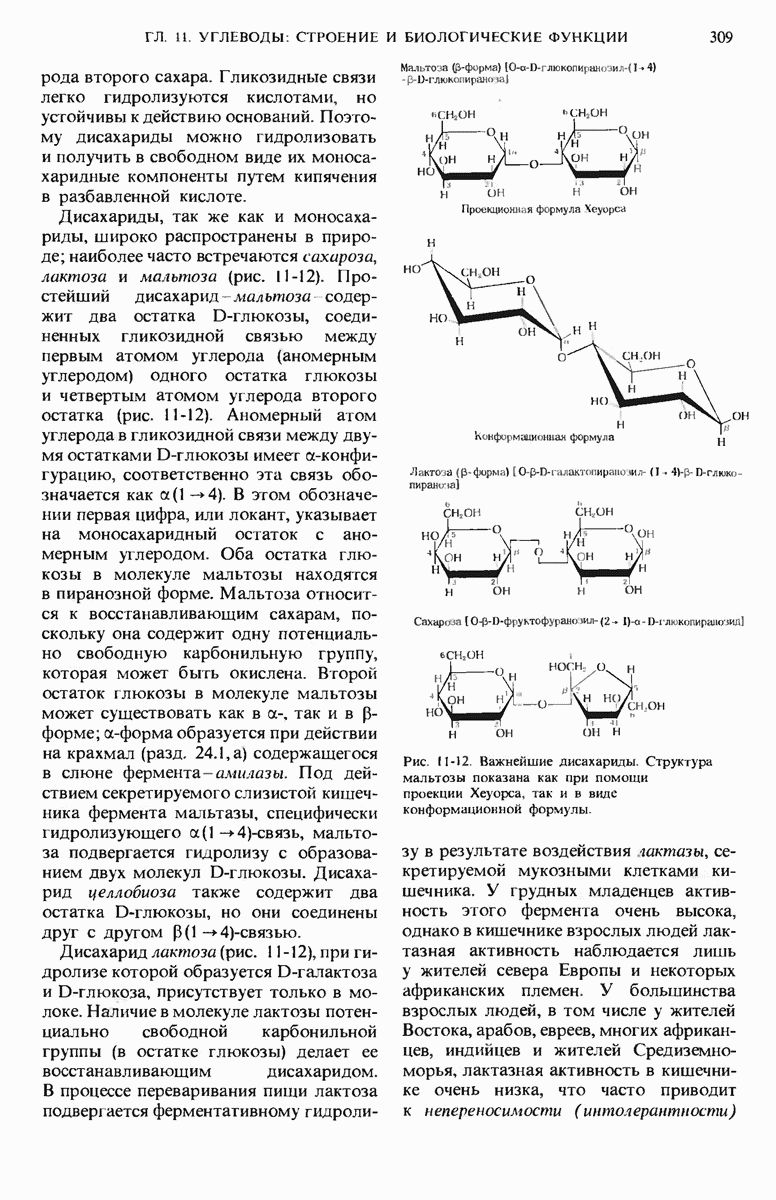
- 11.6. Дисахариды содержат две моносахаридные единицы
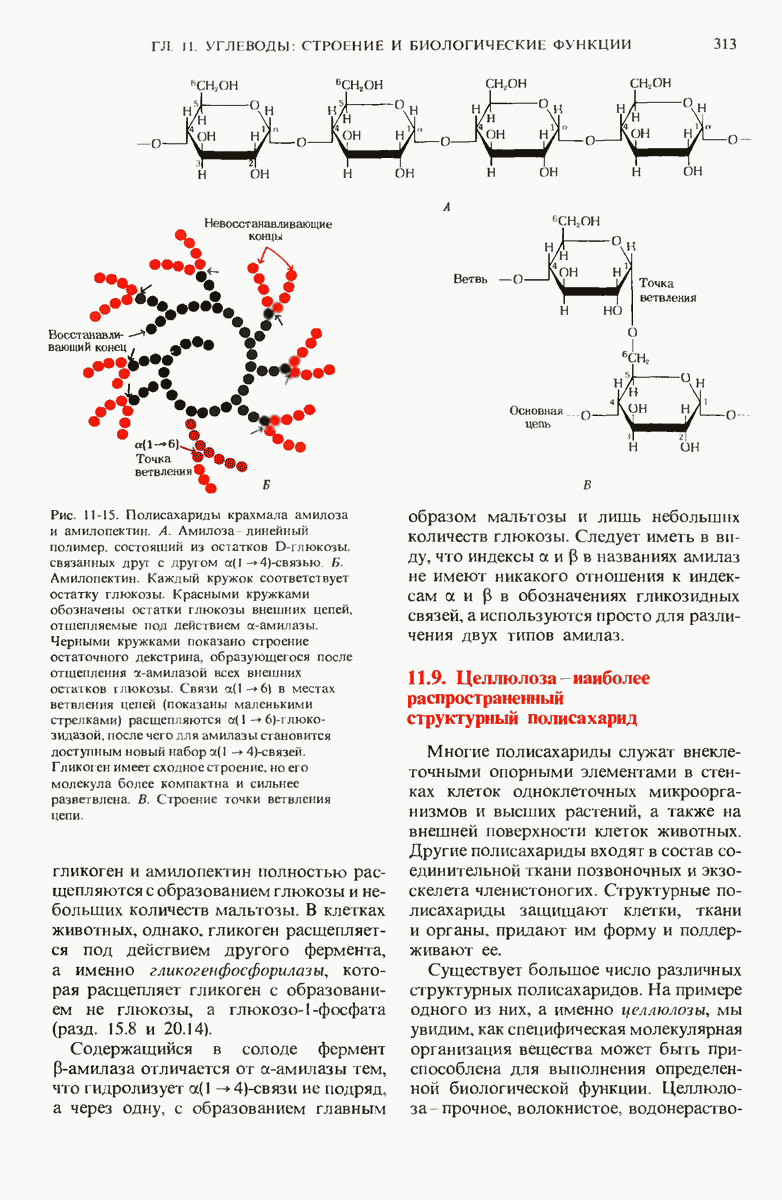
- 11.7. Полисахариды содержат большое число моносахаридных остатков
- 11.8. Некоторые полисахариды представляют собой форму запасания «клеточного топлива»
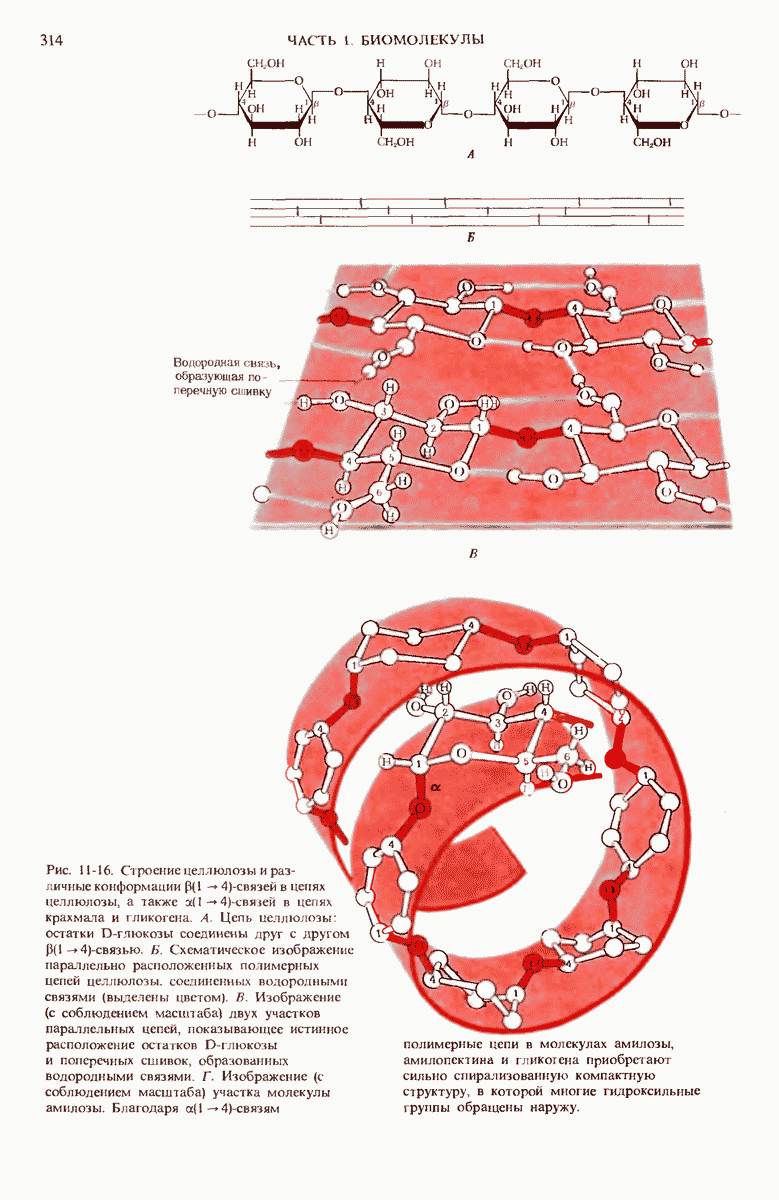
- 11.9. Целлюлоза — наиболее распространенный структурный полисахарид
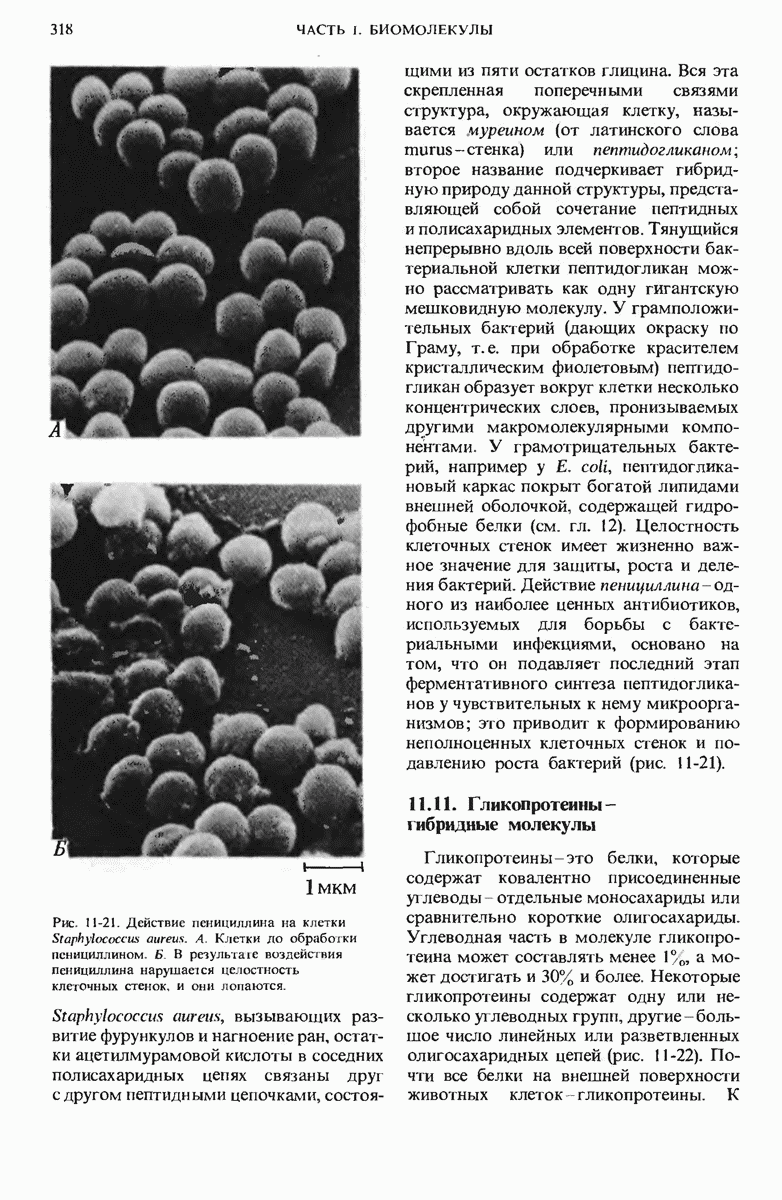
- 11.10. Клеточные стенки содержат в больших количествах структурные и защитные полисахариды
- 11.11. Гликопротеины — гибридные молекулы
- 11.12. На поверхности клеток животных присутствуют гликопротеины
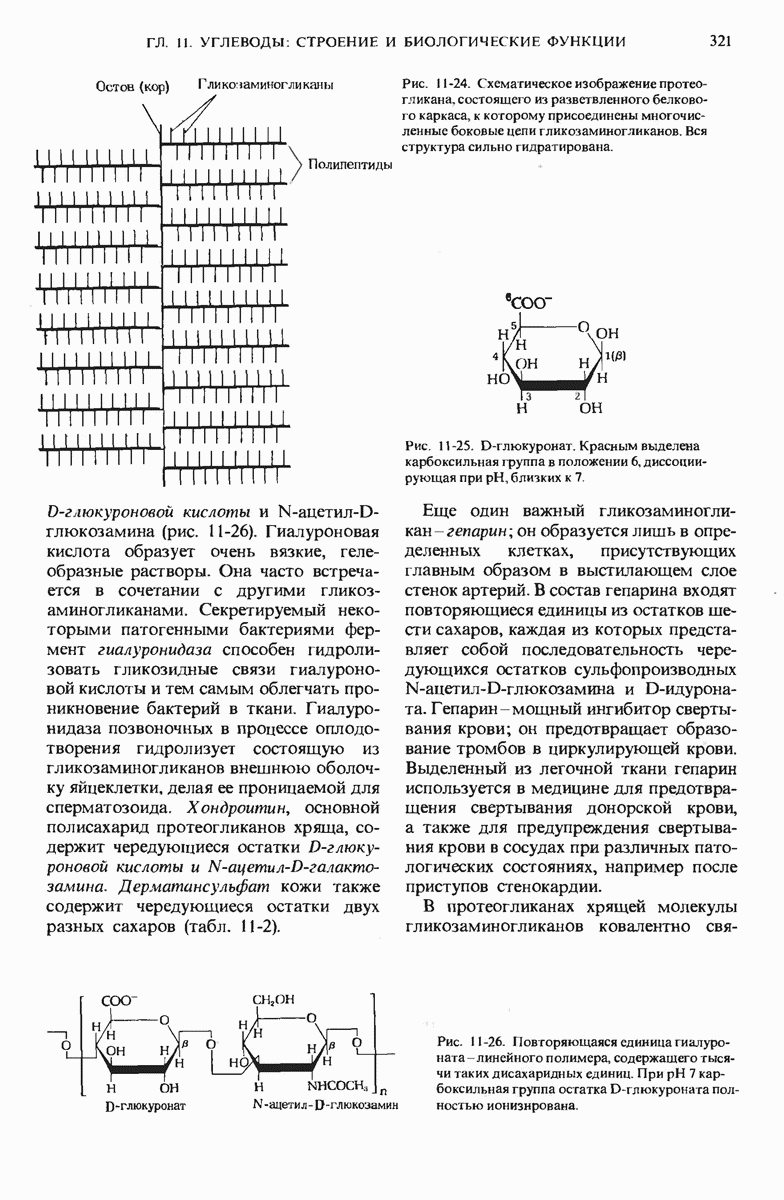
- 11.13. Гликозаминогликаны и протеогликаны — важные компоненты соединительной ткани
- Краткое содержание главы
- ЛИТЕРАТУРА
- Вопросы и задачи
- ГЛАВА 12. ЛИПИДЫ И МЕМБРАНЫ
- 12.1. Жирные кислоты — структурные компоненты большинства липидов
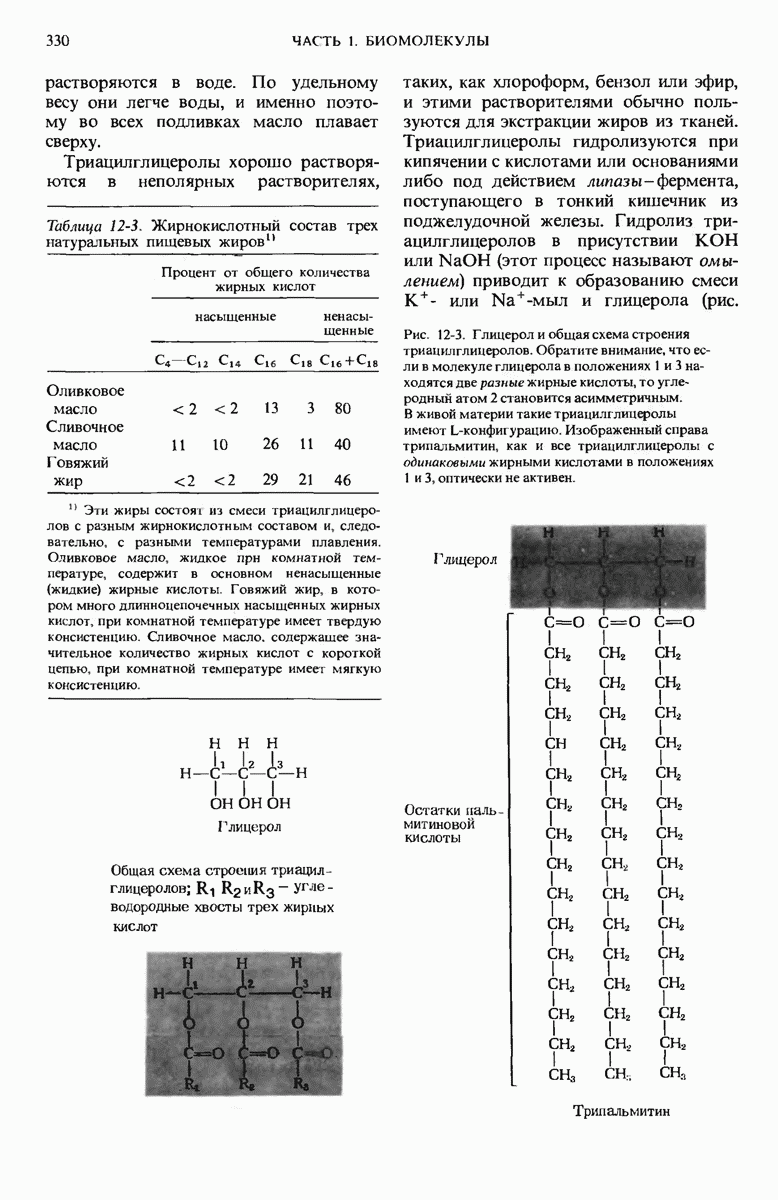
- 12.2. Триацилглицеролы — это глицероловые эфиры жирных кислот
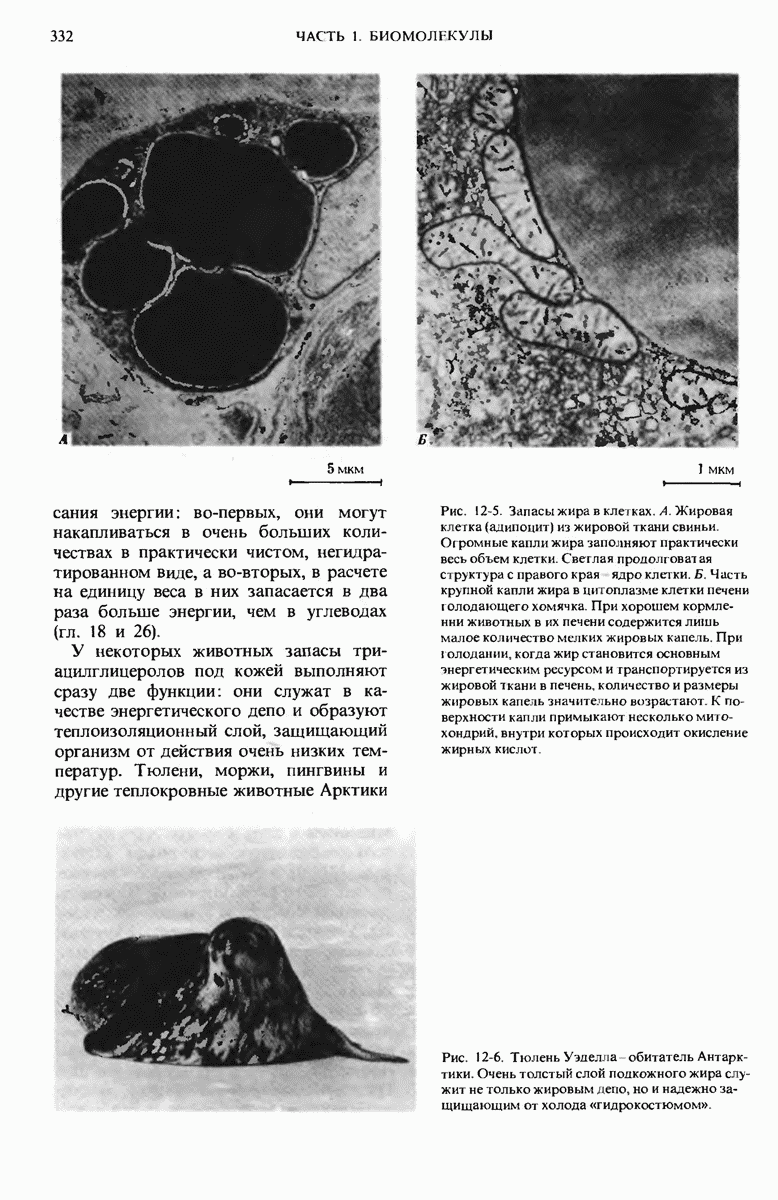
- 12.3. Триацилглицеролы — форма запасания липидов
- 12.4. Воска — эфиры жирных кислот и длинноцепочечных спиртов
- 12.5. Фосфолипиды — основные липидные компоненты мембран
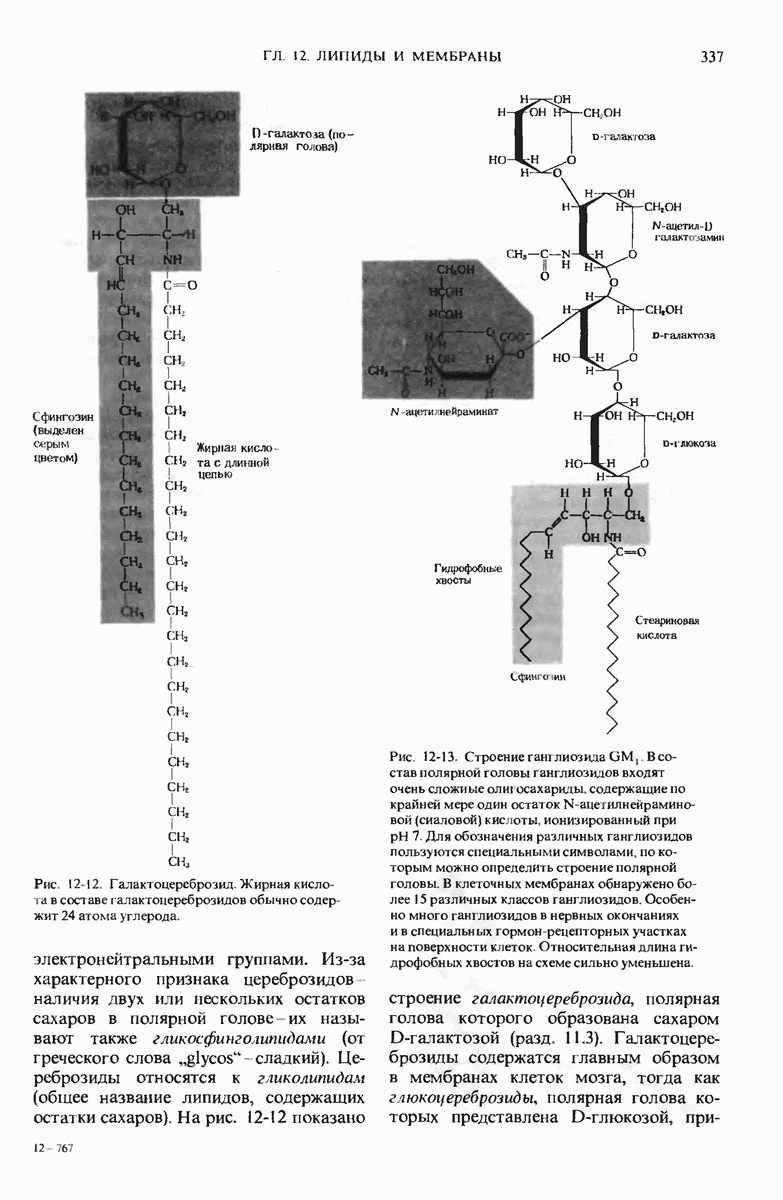
- 12.6. Сфинголипиды — также важные компоненты мембран
- 12.7. Стероиды — неомыляемые липиды, обладающие специфическими функциями
- 12.8. Липопротеины сочетают свойства липидов и белков
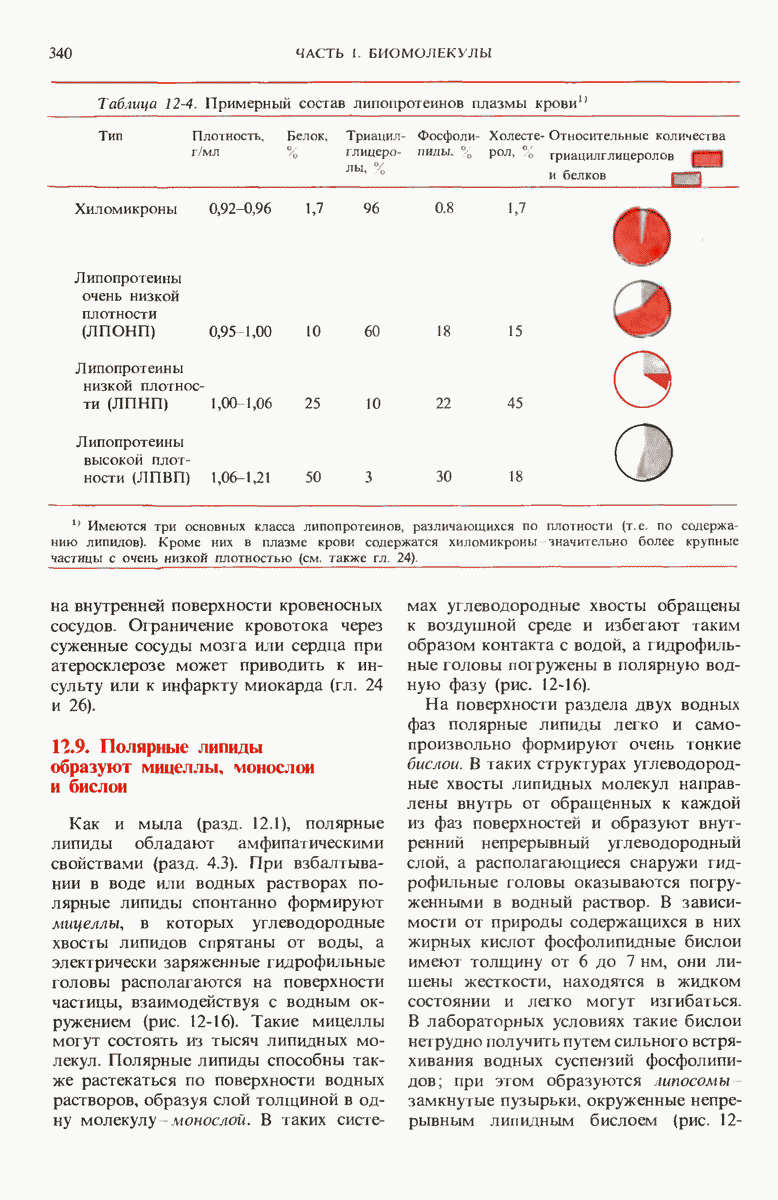
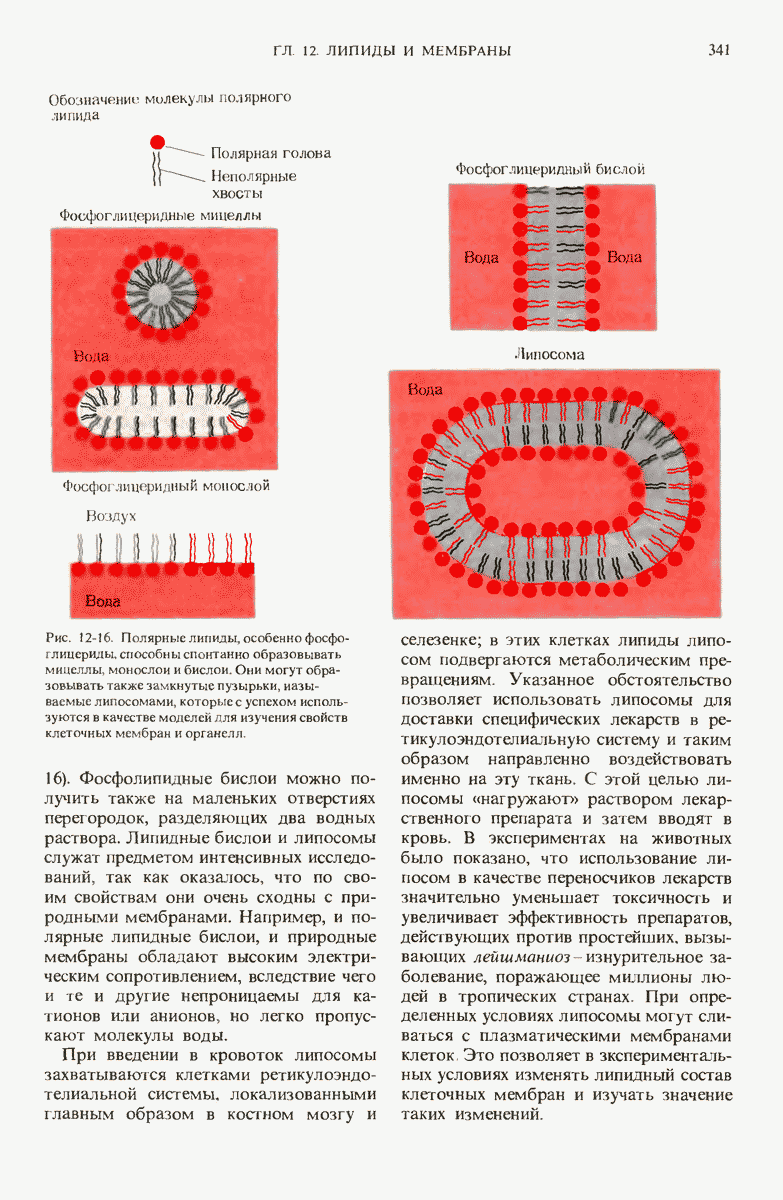
- 12.9. Полярные липиды образуют мицеллы, монослои и бислои
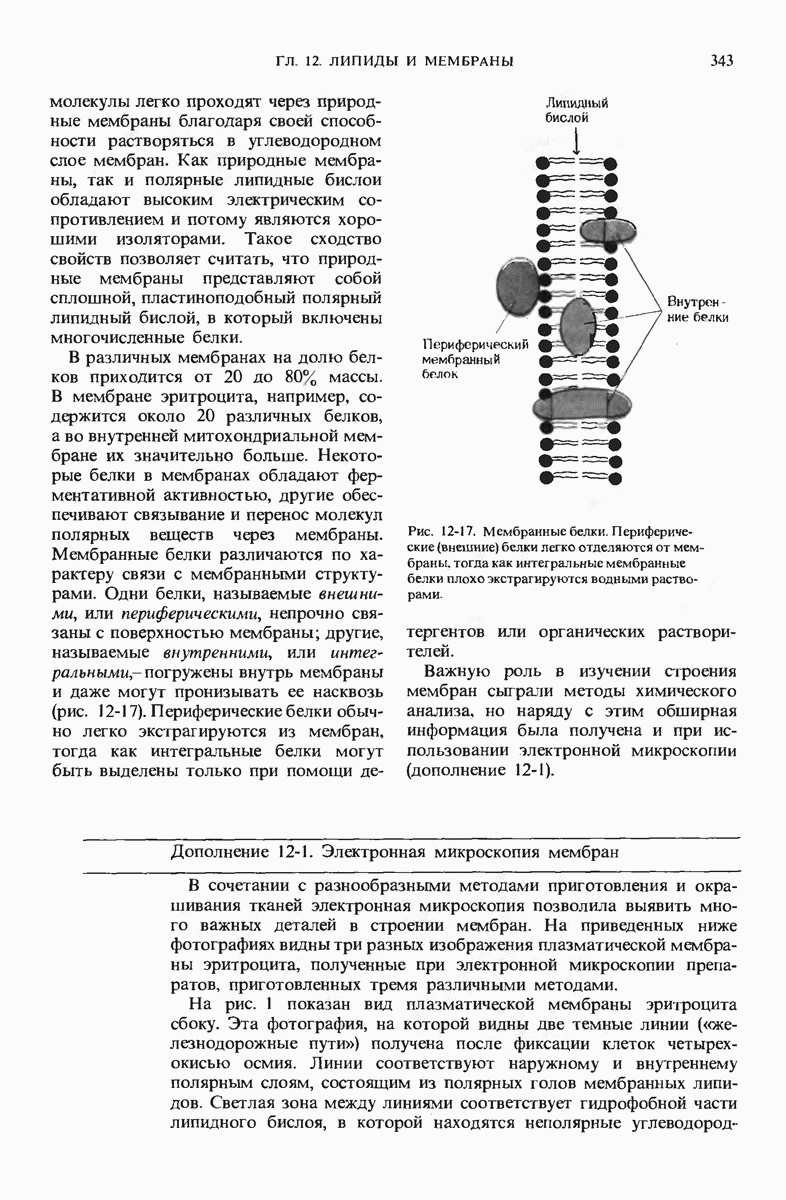
- 12.10. Полярные липиды и белки — основные компоненты мембран
- 12.11. Мембраны имеют жидкостно-мозаичную структуру
- 12.12. Мембраны асимметричны, т.е. имеют неравноценные стороны
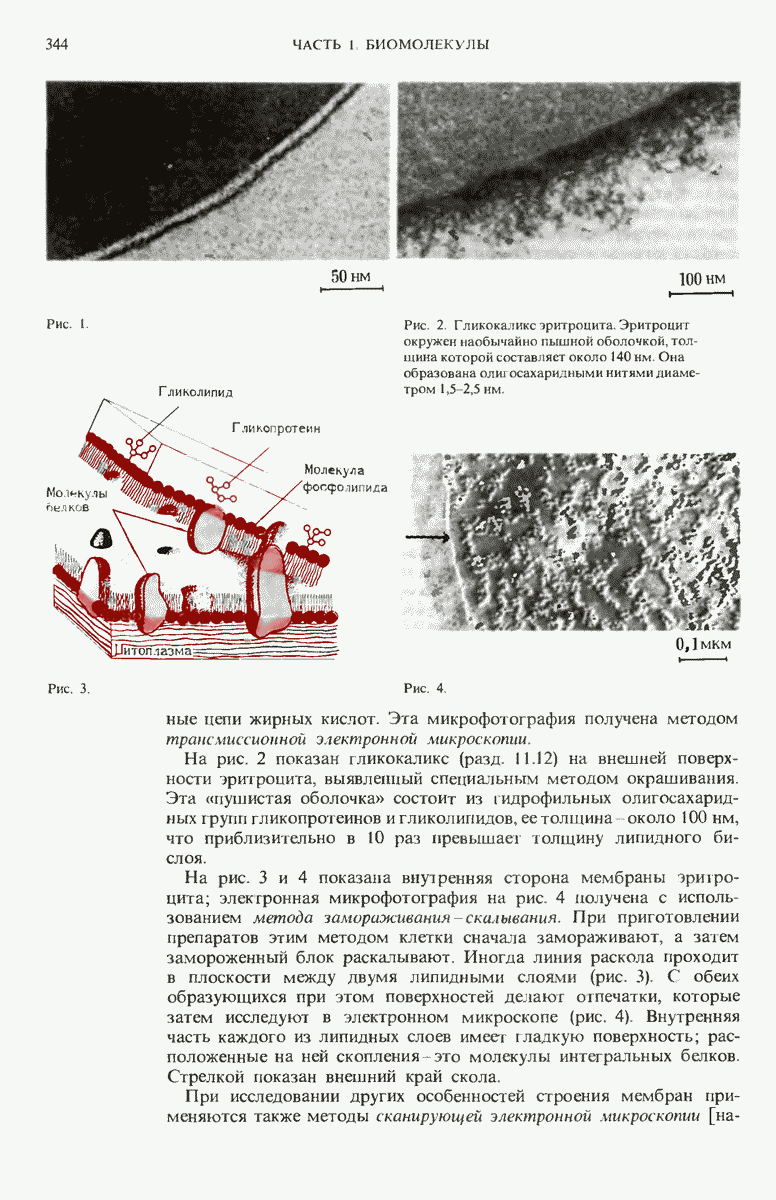
- 12.13. Мембраны эритроцитов исследованы очень подробно
- 12.14. Лектины — специфические белки, способные связываться с определенными клетками и вызывать их агглютинацию
- 12.15. Мембраны имеют очень сложные функции
- Краткое содержание главы
- ЛИТЕРАТУРА
- Вопросы и задачи
- ПРИЛОЖЕНИЕ ОТВЕТЫ