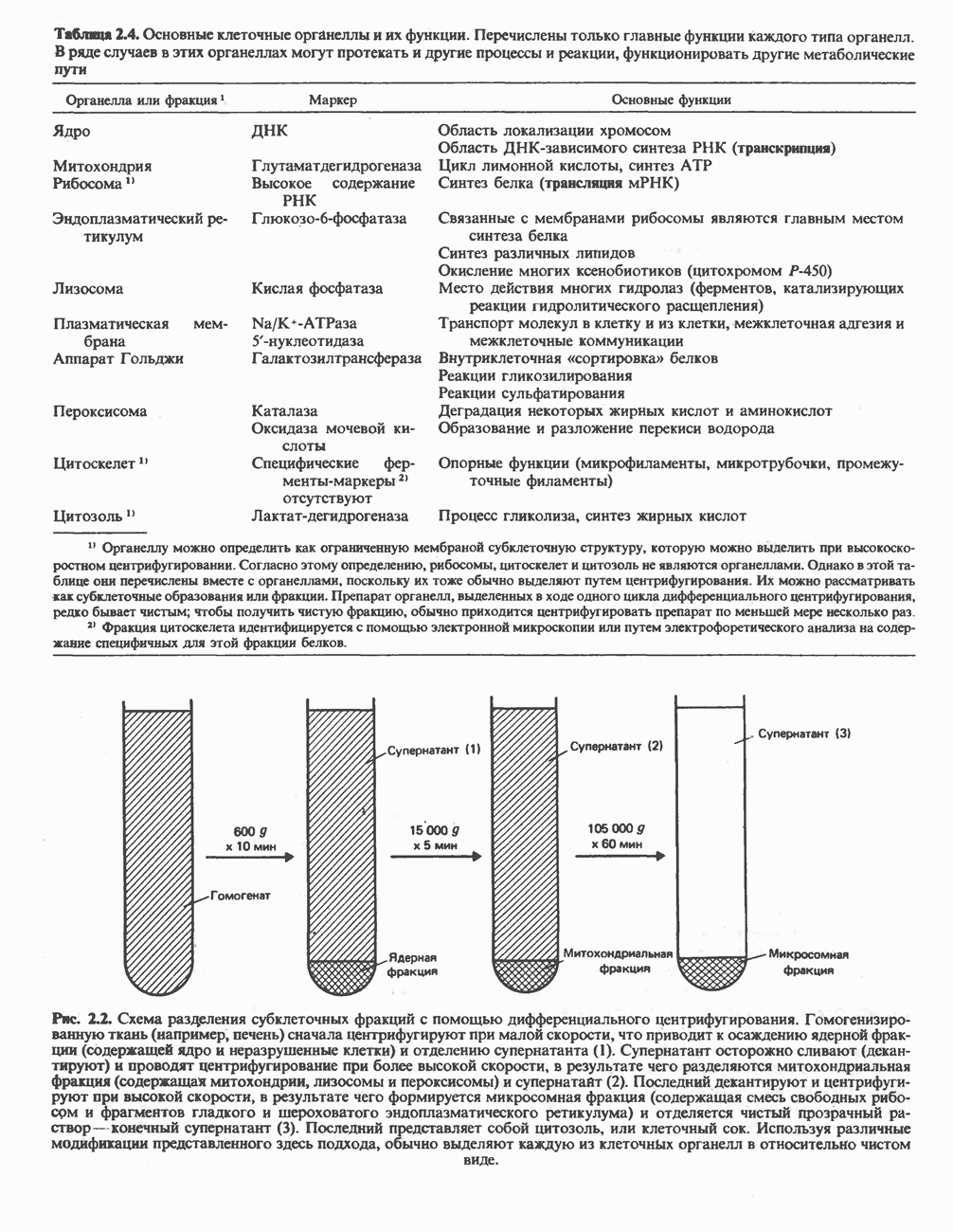
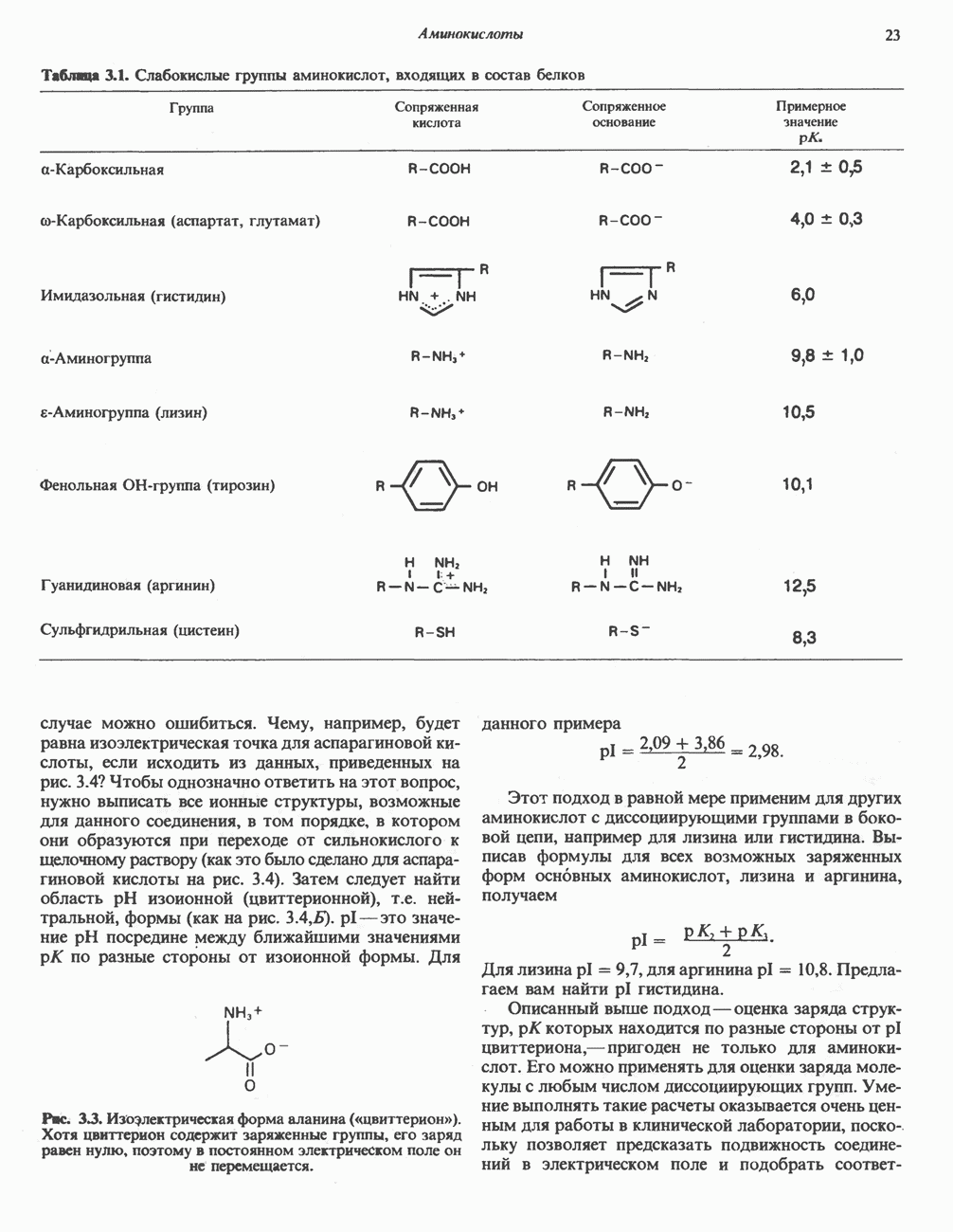
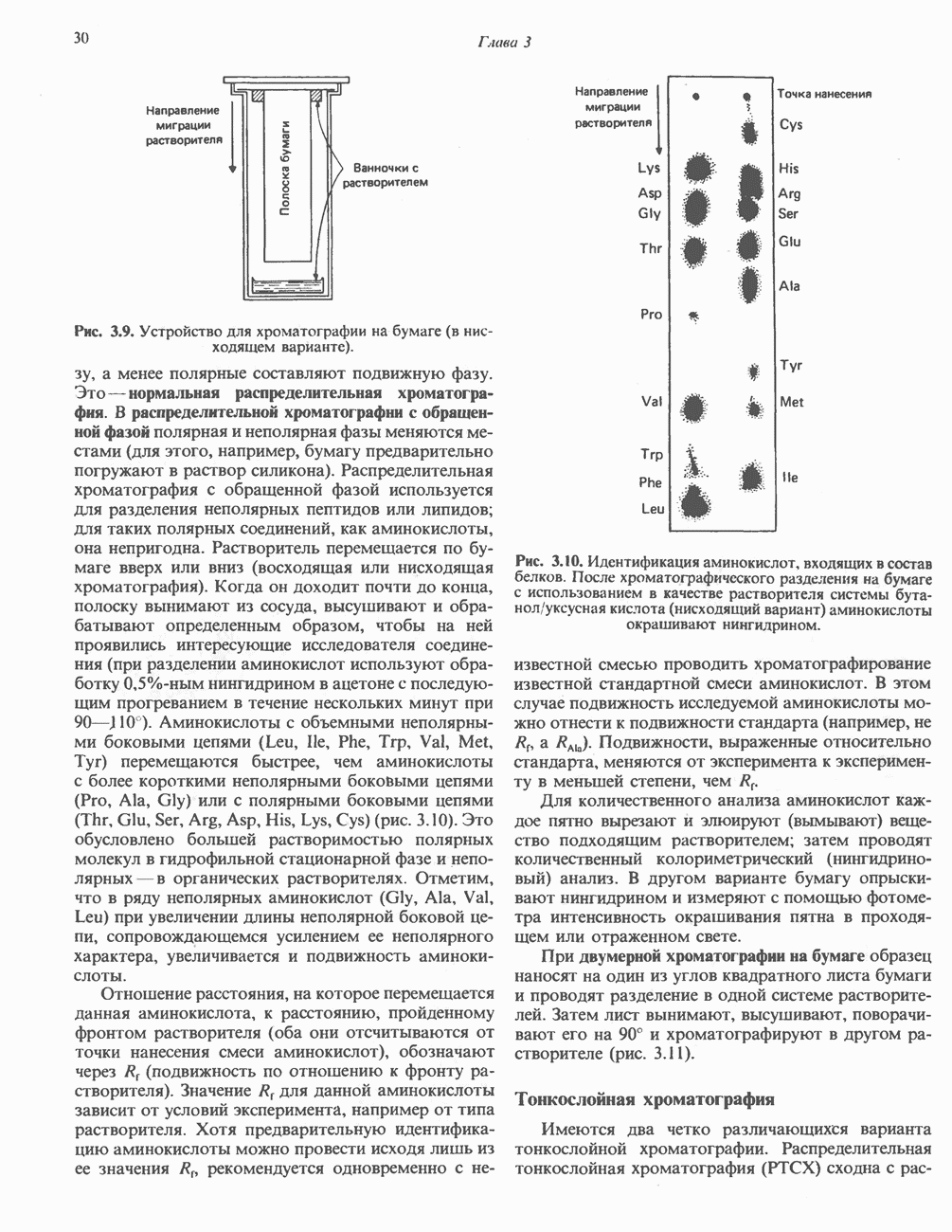
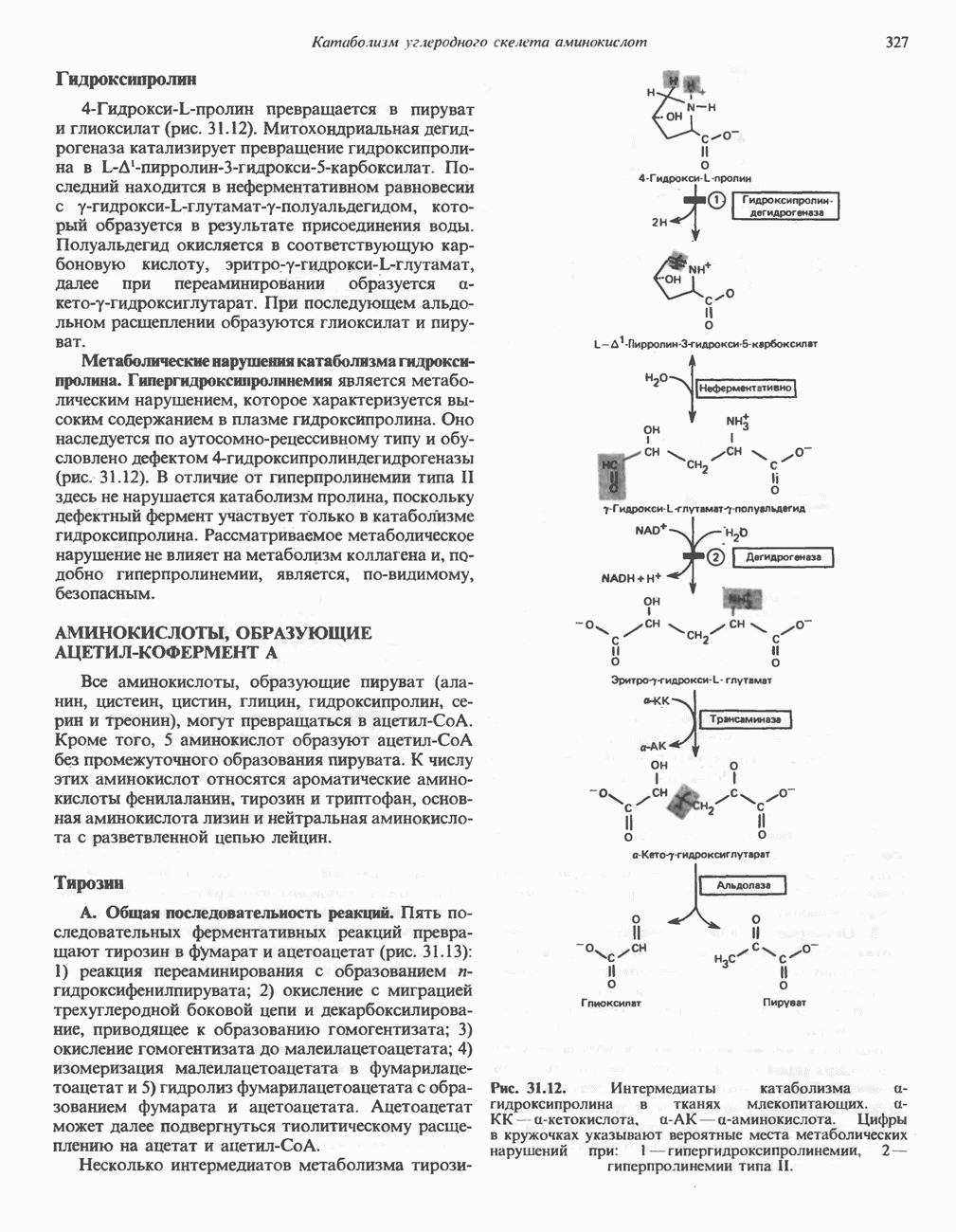
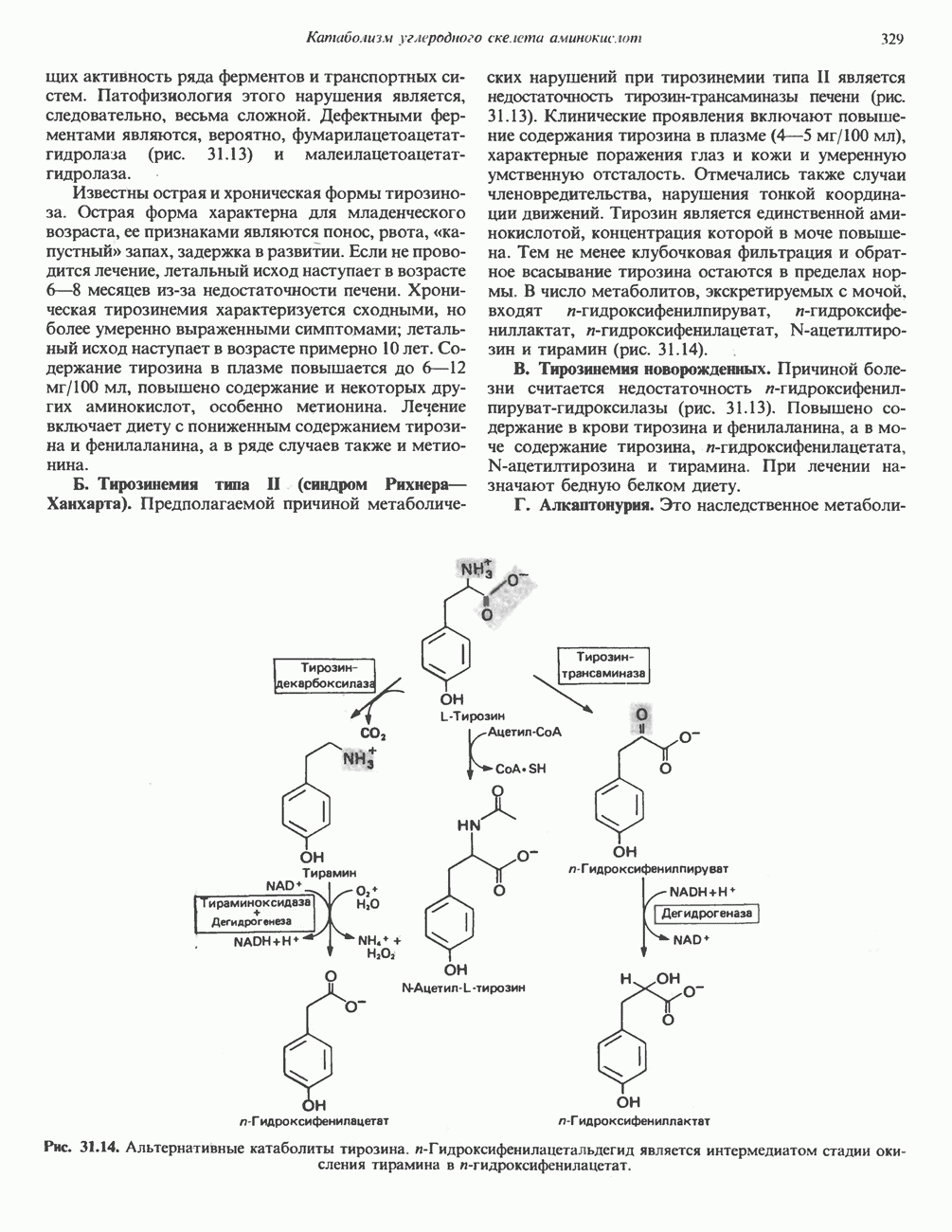
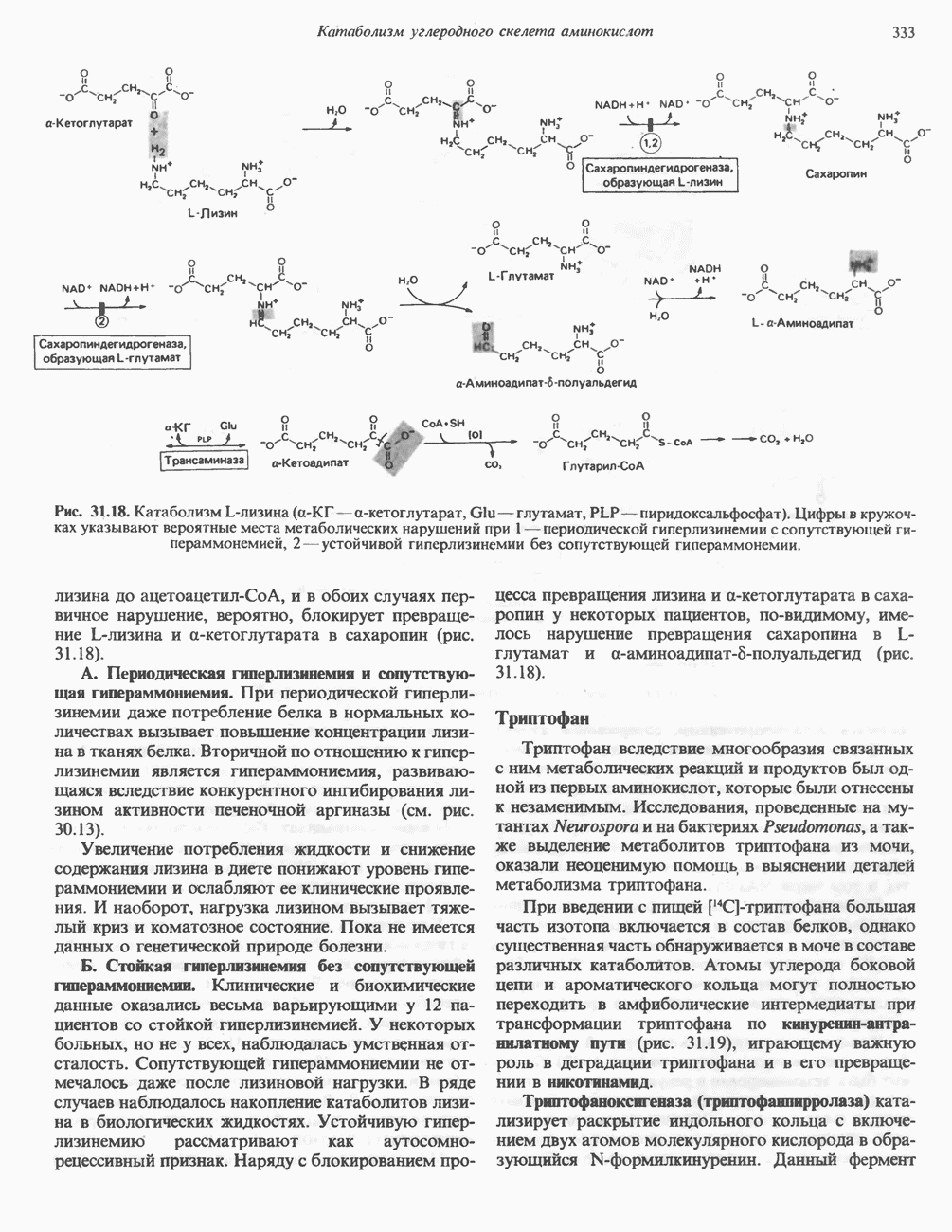
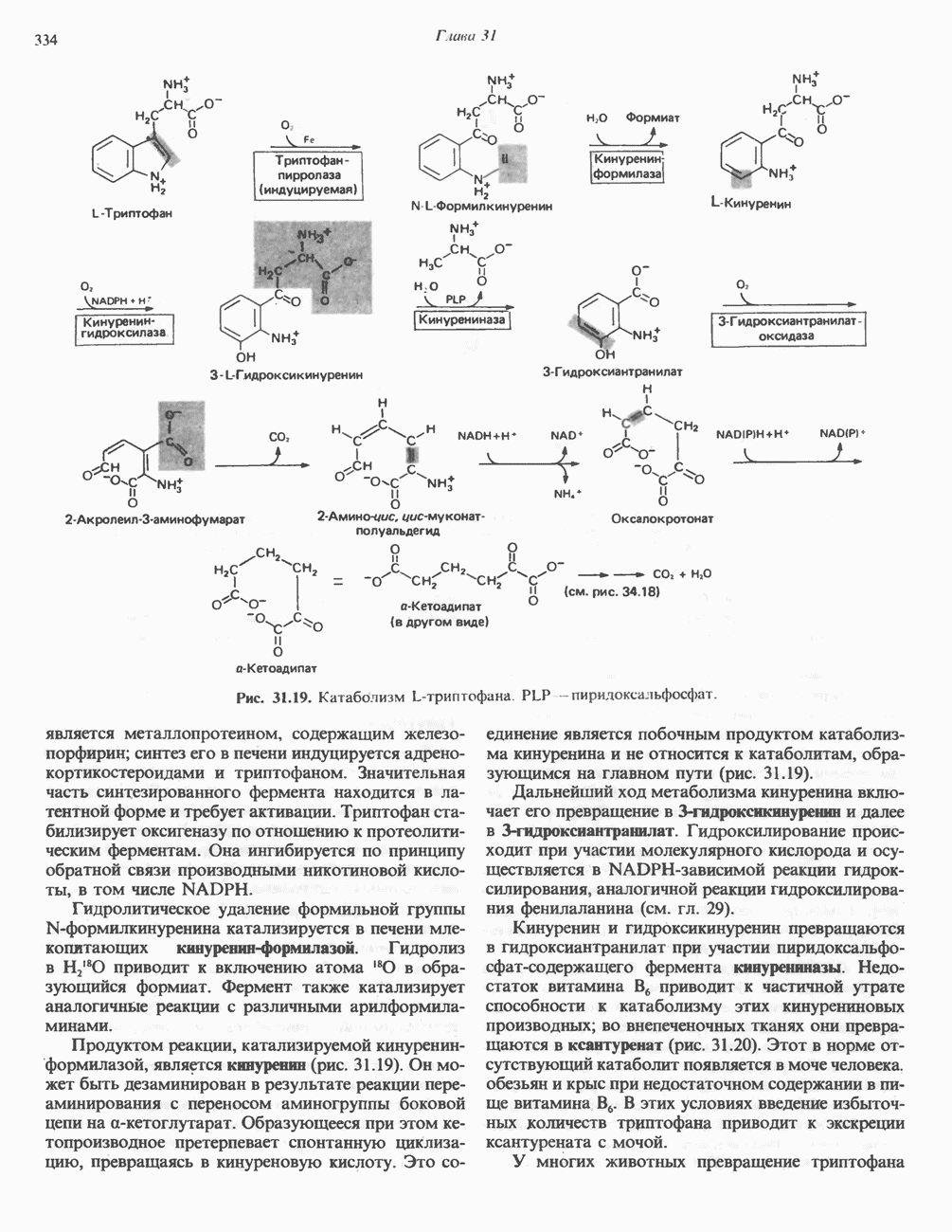
| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
ПОСЛЕДОВАТЕЛЬНЫЕ СТАДИИ ГЛИКОЛИЗА
Суммарное уравнение гликолиза, завершающегося образованием лактата, следующее:

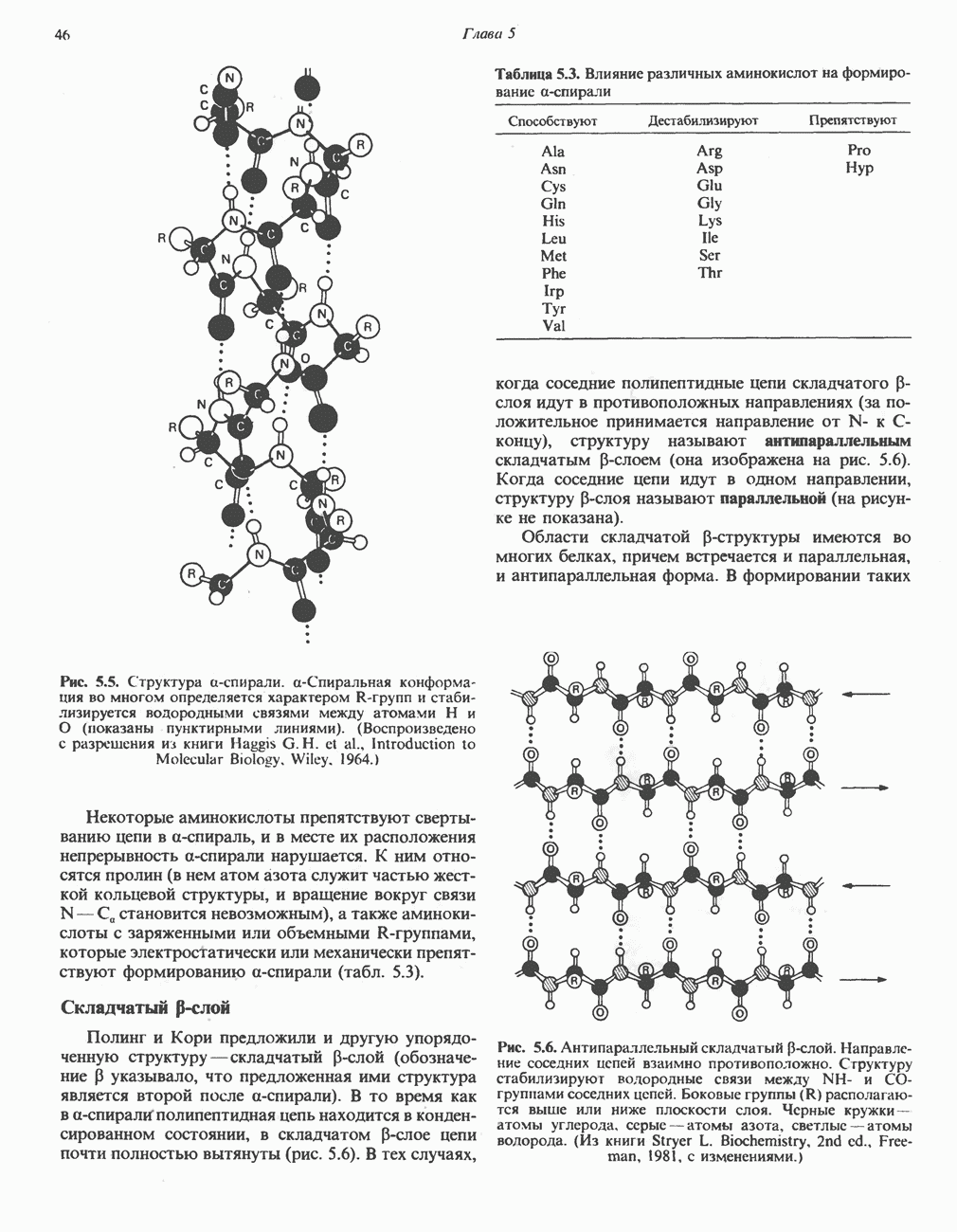
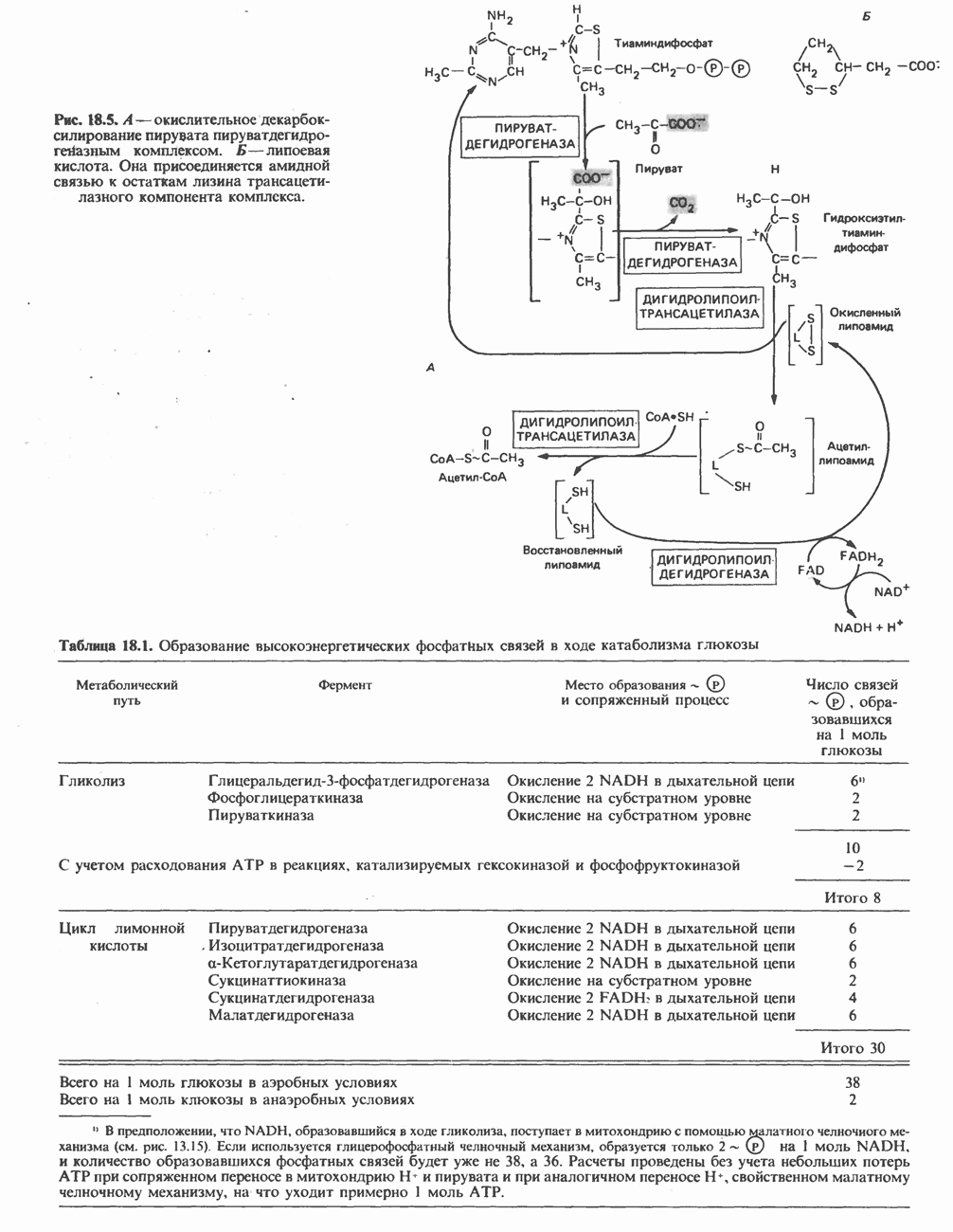
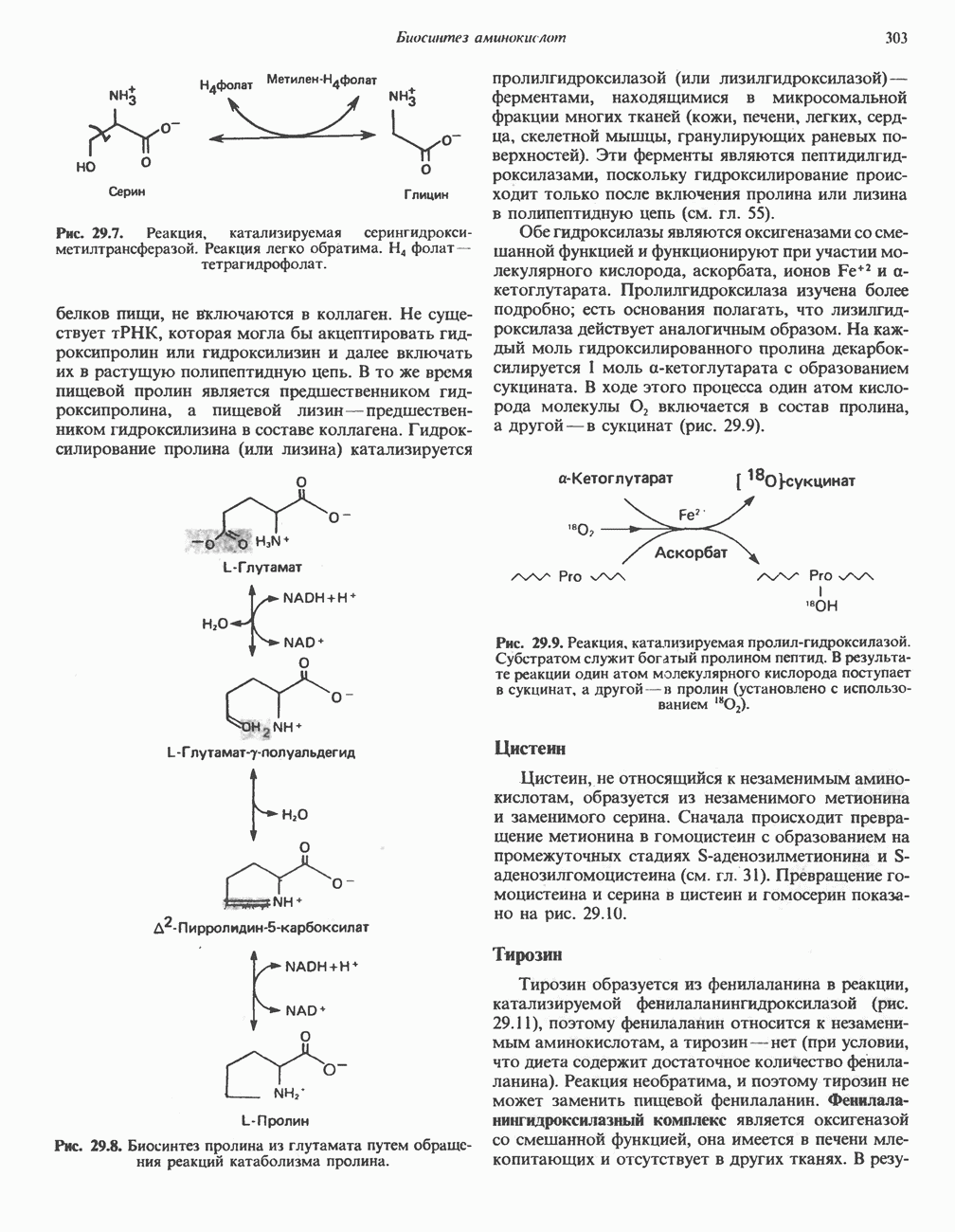
Все ферменты гликолитического пути (рис. 18.2) находятся во внемитохондриальной растворимой клеточной фракции (цитозоле). Они катализируют реакции превращения глюкозы в пируват и лактат, которые протекают в следующей последовательности.
Гликолитический путь превращения глюкозы начинается с ее фосфорилирования в глюкозоб-фосфат. Эта реакция катализируется ферментом гексокиназой; в паренхиматозных клетках печени эту функцию выполняет индуцируемый фермент глюкокиназа, активность которого зависит от характера питания. Донором фосфата служит АТР в виде комплекса Mg - АТР, что характерно и для многих других реакций фосфорилирования. При этом расходуется одна высокоэнергетическая фосфатная связь АТР и образуется ADP. Реакция сопровождается значительными потерями свободной энергии в форме теплоты. Поэтому при физиологических условиях эта реакция является необратимой. Продукт реакции глюкозо-6-фосфат является аллостерическим ингибитором гексокиназы:

Гексокиназа, присутствующая во всех тканях, за исключением паренхимы печени, имеет высокое сродство (низкое  ) к своему субстрату, глюкозе; ее функция состоит в том, чтобы обеспечить захват тканью глюкозы даже при низких концентрациях последней в крови. Фосфорилируя практически всю поступающую в клетку глюкозу, гексокиназа поддерживает значительный градиент концентрации глюкозы между кровью и внутриклеточной средой. Фермент действует как на
) к своему субстрату, глюкозе; ее функция состоит в том, чтобы обеспечить захват тканью глюкозы даже при низких концентрациях последней в крови. Фосфорилируя практически всю поступающую в клетку глюкозу, гексокиназа поддерживает значительный градиент концентрации глюкозы между кровью и внутриклеточной средой. Фермент действует как на  так и на
так и на  -аномеры глюкозы; он фосфорилирует также и другие гексозы, но со значительно меньшей скоростью.
-аномеры глюкозы; он фосфорилирует также и другие гексозы, но со значительно меньшей скоростью.
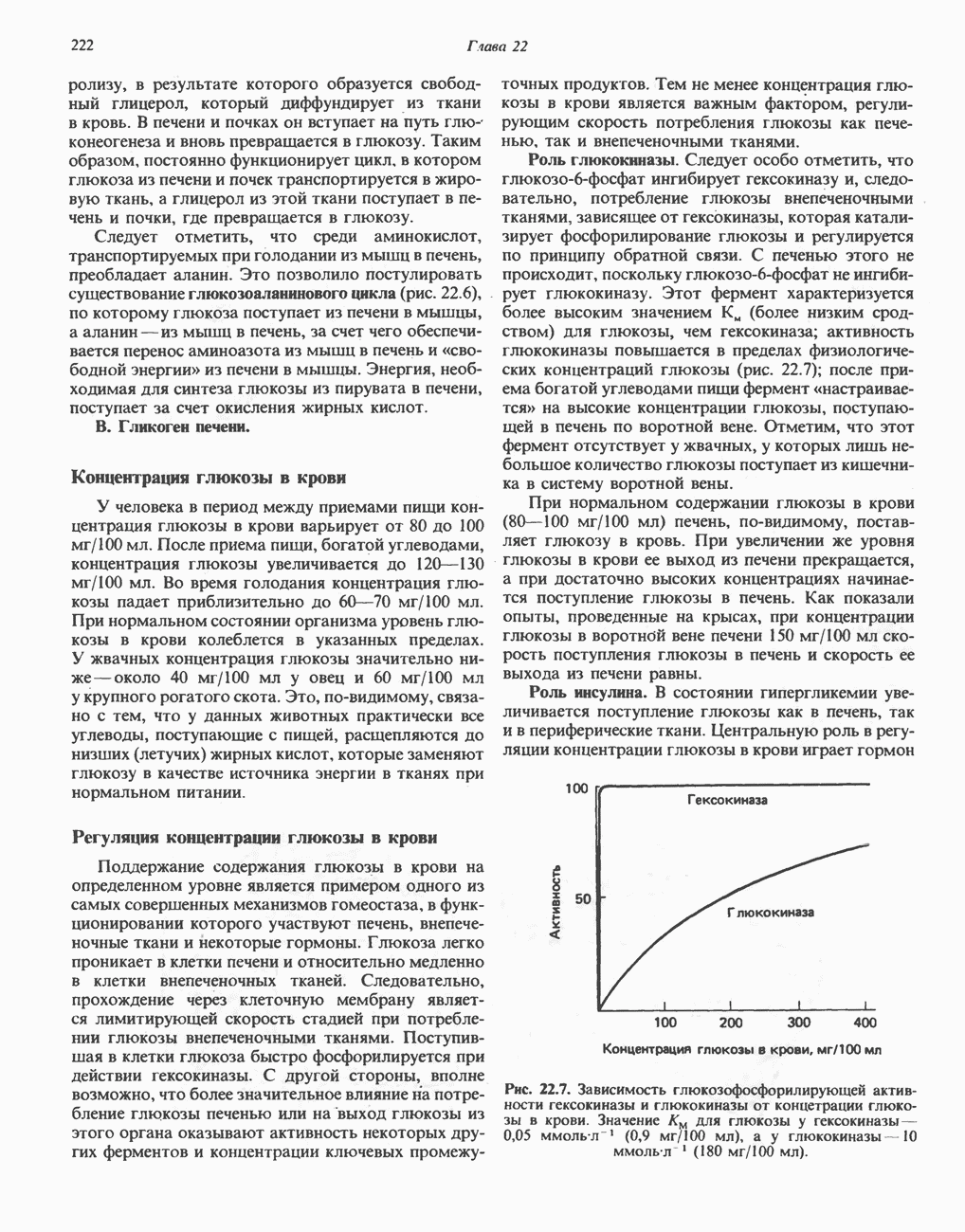
Функция глюкокиназы состоит в «захватывании» глюкозы из кровотока после приема пищи (когда концентрация глюкозы в крови повышается). В отличие от гексокиназы она имеет высокое значение  для глюкозы и эффективно функционирует при концентрации глюкозы в крови выше
для глюкозы и эффективно функционирует при концентрации глюкозы в крови выше  рис. 22.7). Глюкокиназа специфична к глюкозе.
рис. 22.7). Глюкокиназа специфична к глюкозе.
Глюкозо-6-фосфат занимает важное положение в области стыковки ряда метаболических путей (гликолиз, глюконеогенез, пентозофосфатный путь, гликогенез и гликогенолиз) (рис. 18.2). В ходе гликолиза он превращается во фруктозо-6-фосфат при участии фосфогексозонзомеразы, при этом происходит альдокето-изомеризация. Фермент действует только на а-аномер глюкозо-6-фосфата:

Далее следует еще одно фосфорилирование, осуществляемое АТР; оно катализируется фосфофруктокиназой (фосфофруктокиназа-1) с образованием фруктозо-1,6-бисфосфата. Фосфофруктокиназа также является индуцируемым ферментом; считается, что она играет главную роль в регуляции скорости гликолиза. Реакция, катализируемая фосфофруктокиназой, также является необратимой при физиологических условиях:

Фруктозо-1,6-бисфосфат расщепляется альдолазой (фруктозо-1,6-бисфосфат-альдолазой) на два триозофосфата: глицеральдегид-3-фосфат и дигидроксиацетонфосфат:

Описано несколько различных альдолаз, и все они состоят из четырех субъединиц. В большинстве тканей находится альдолаза А, в печени и почках имеется такке альдолаза В. В клетке фруктозофосфаты
(см. скан)
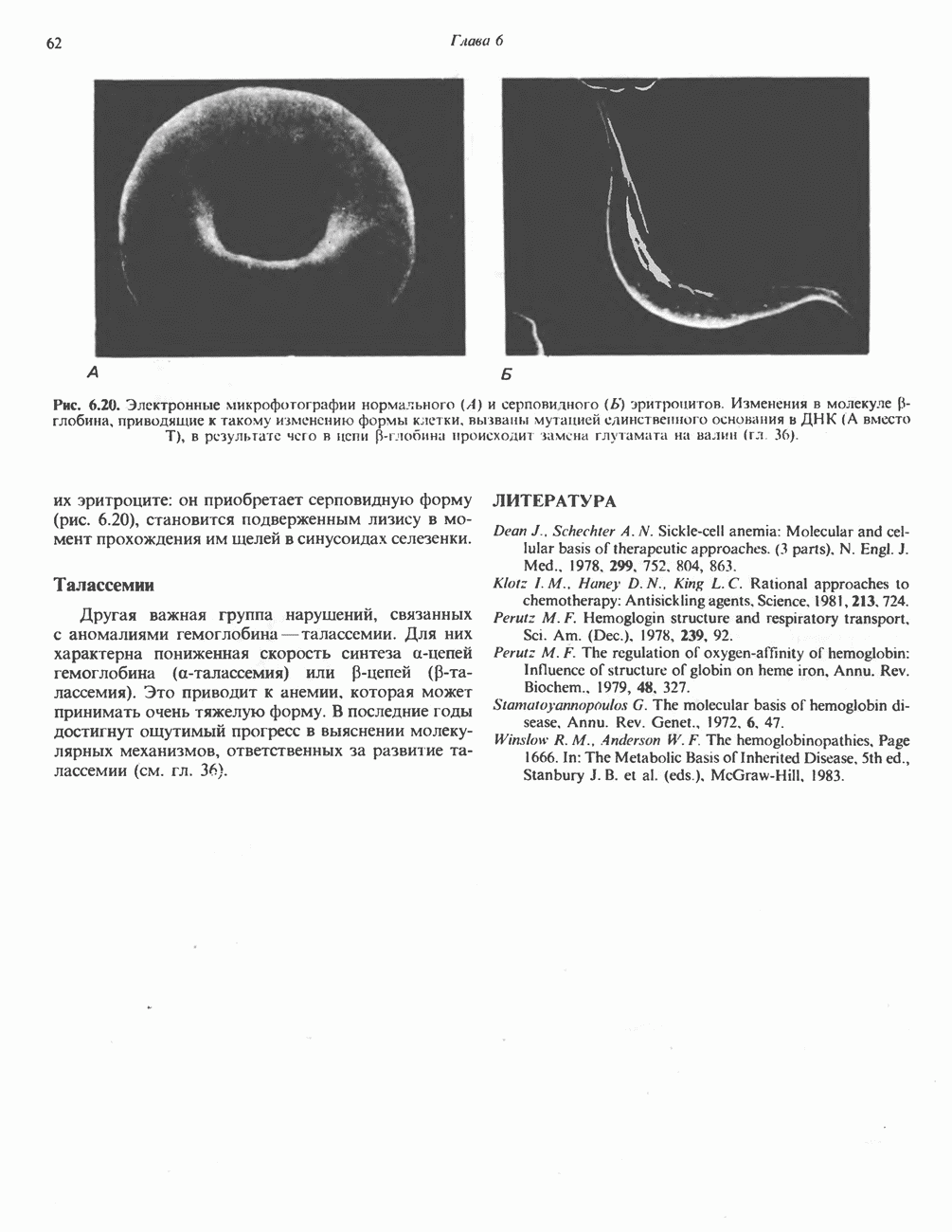
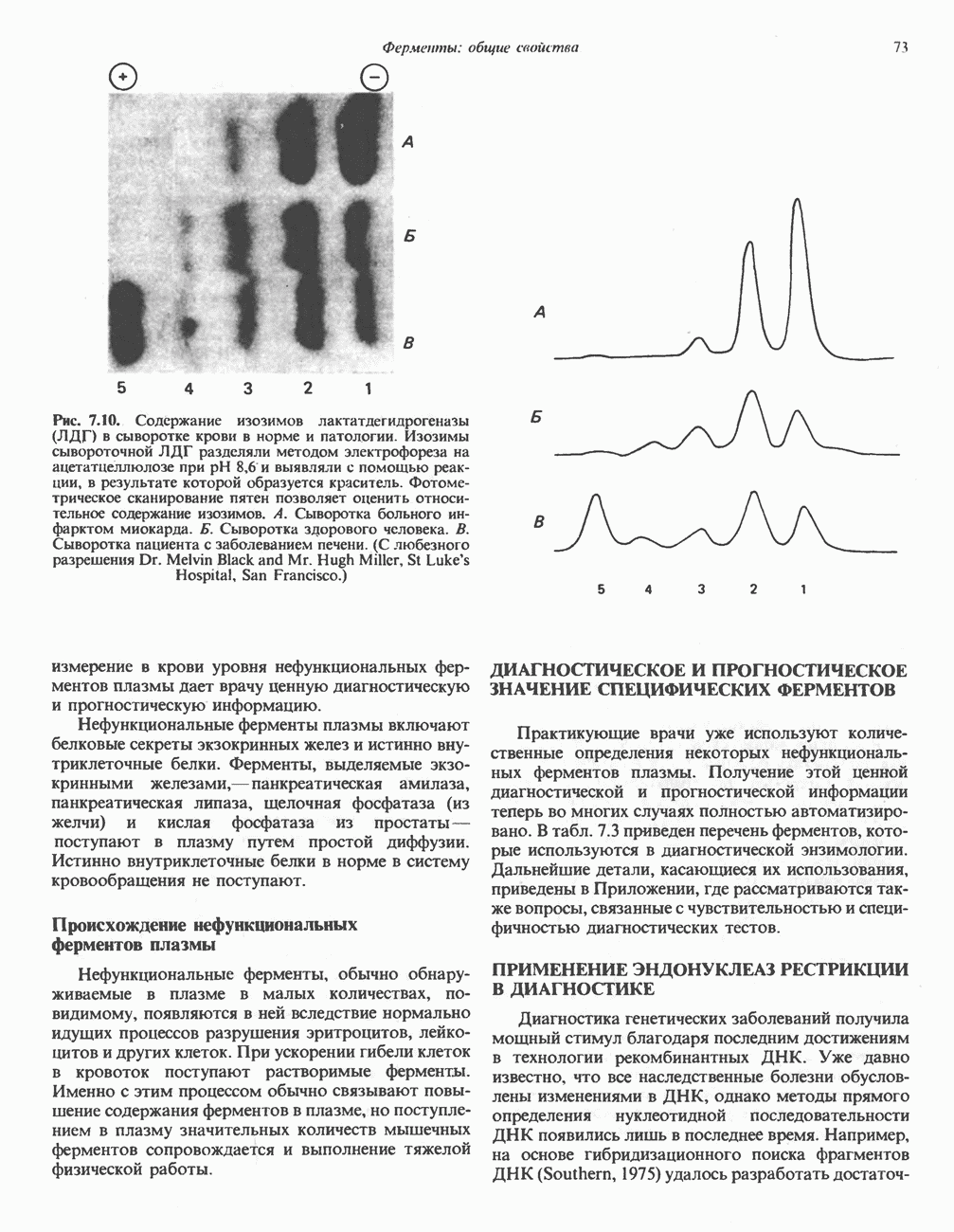
Рис. 18.2. Последовательность реакций гликолиза. Обозначения:  ингибирование. Атомы углерода 1—3 в молекуле фруктозобисфосфата участвуют в образовании дигидроксиацетонфосфата, а атомы углерода 4—6—в образовании глицеральдегид-3-фосфата.
ингибирование. Атомы углерода 1—3 в молекуле фруктозобисфосфата участвуют в образовании дигидроксиацетонфосфата, а атомы углерода 4—6—в образовании глицеральдегид-3-фосфата.
находятся преимущественно в фуранозной форме, но фосфогексозоизомераза, фосфофруктокиназа и альдолаза действуют на молекулы, имеющие «открытую» линейную конфигурацию.
Глицеральдегид-3-фосфат и дигидроксиацетон-фосфат превращаются друг в друга при участии фермента фосфотриозоизомеразы:

Следующей стадией гликолиза является окисление глицеральдегид-3-фосфата с образованием 1,3-бисфосфоглицерата; дигидроксиацетонфосфат при участии фосфотриозоизомеразы также окисляется в 1,3-бисфосфоглицерат, проходя через стадию образования глицеральдегид-3-фосфата:

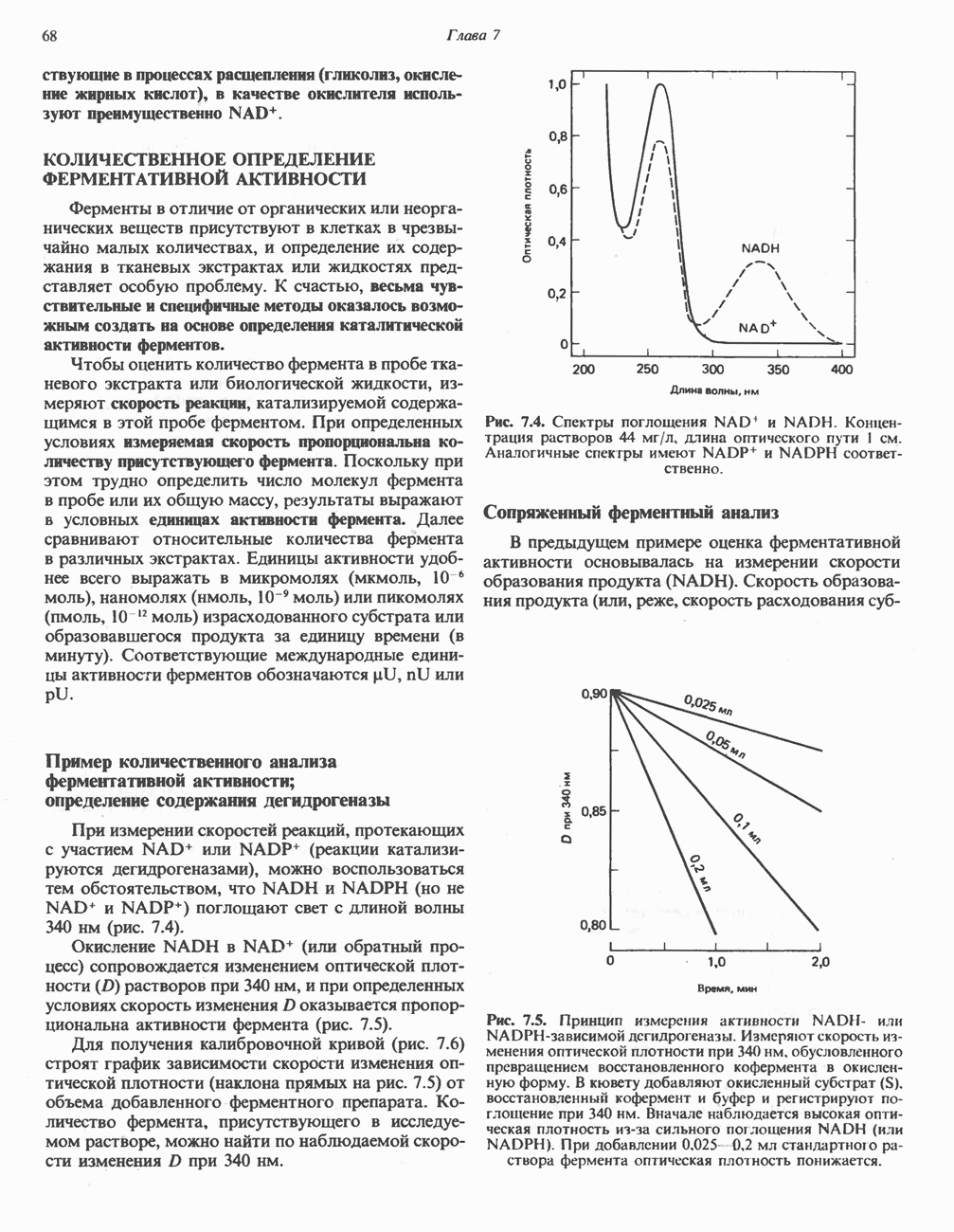
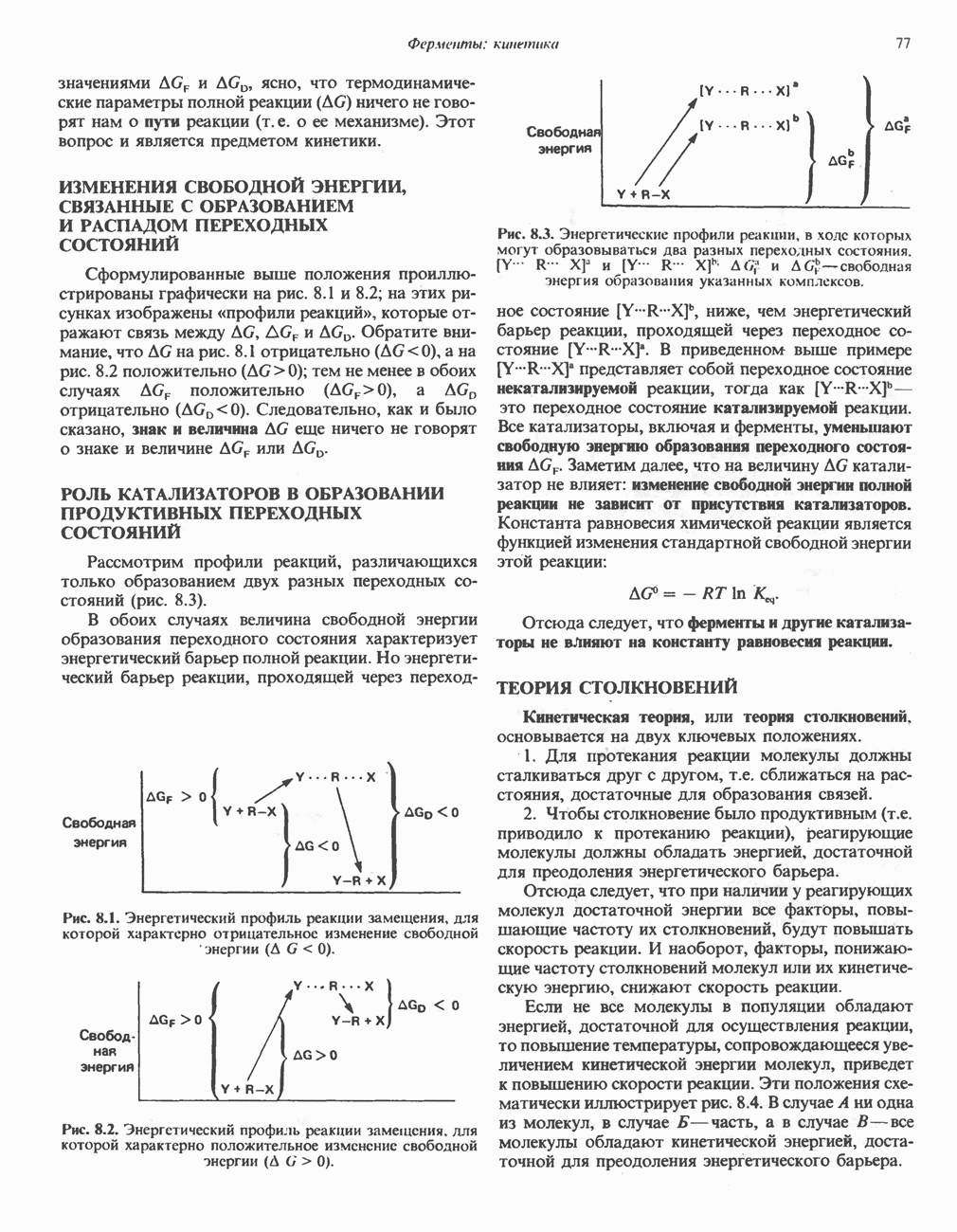
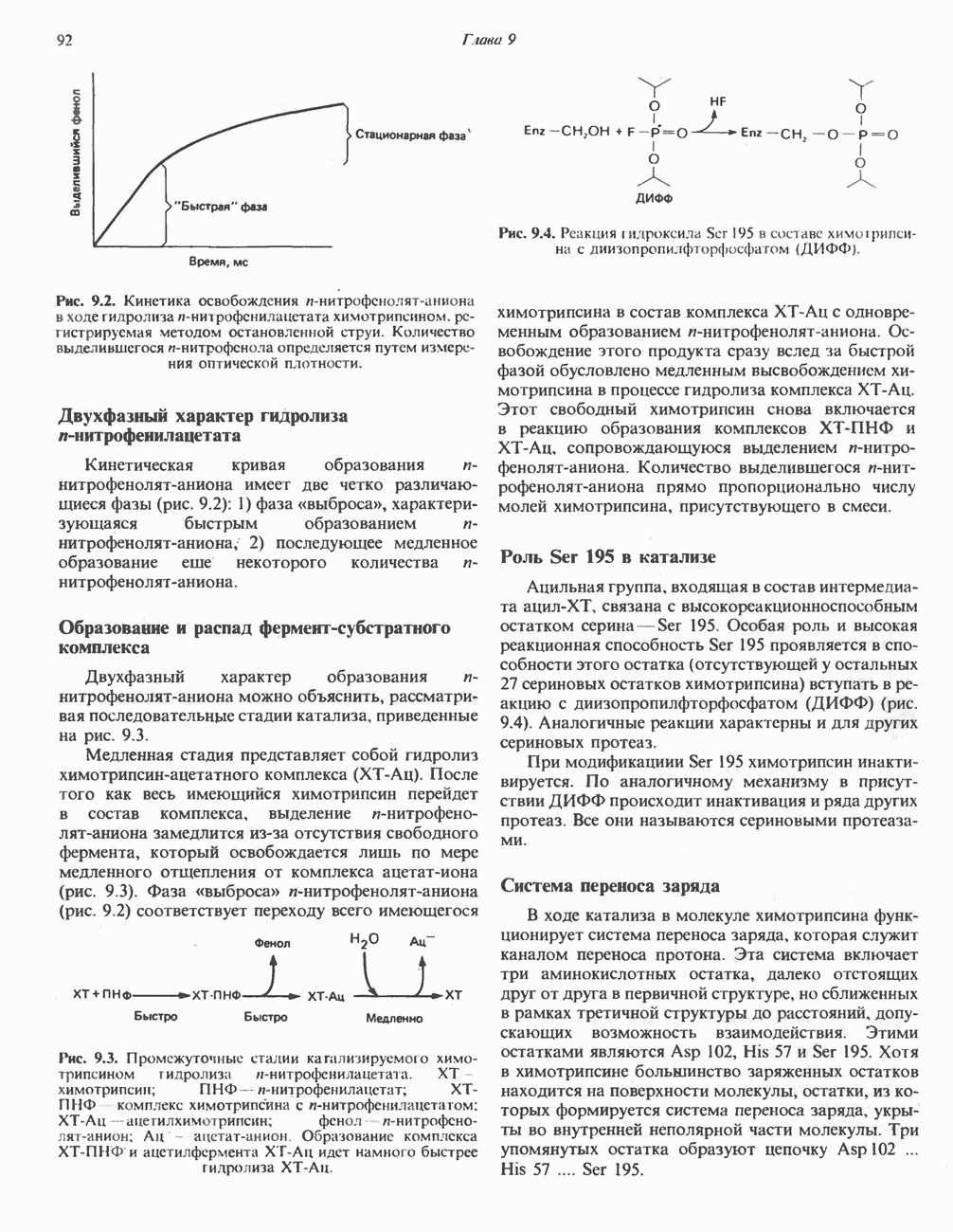
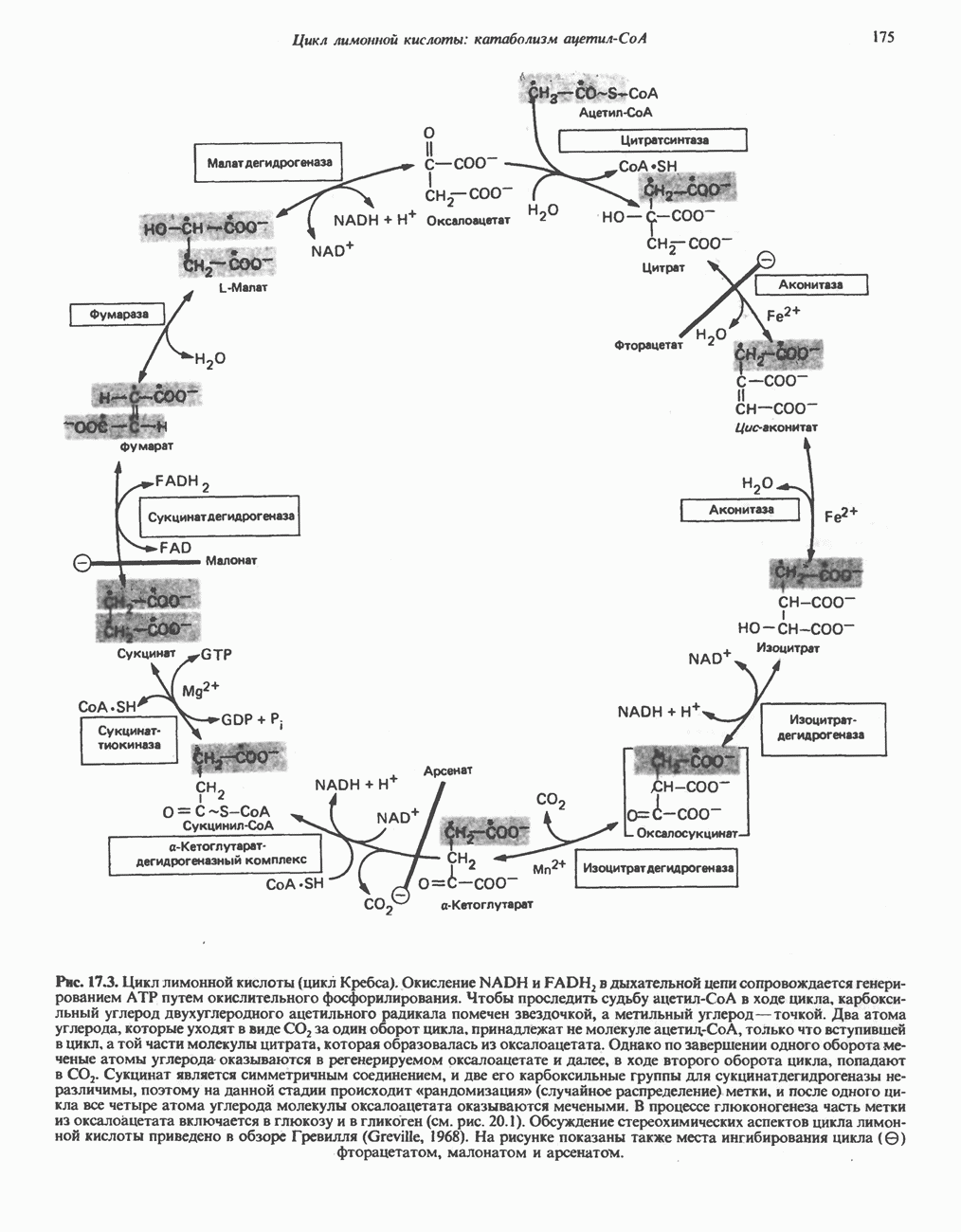
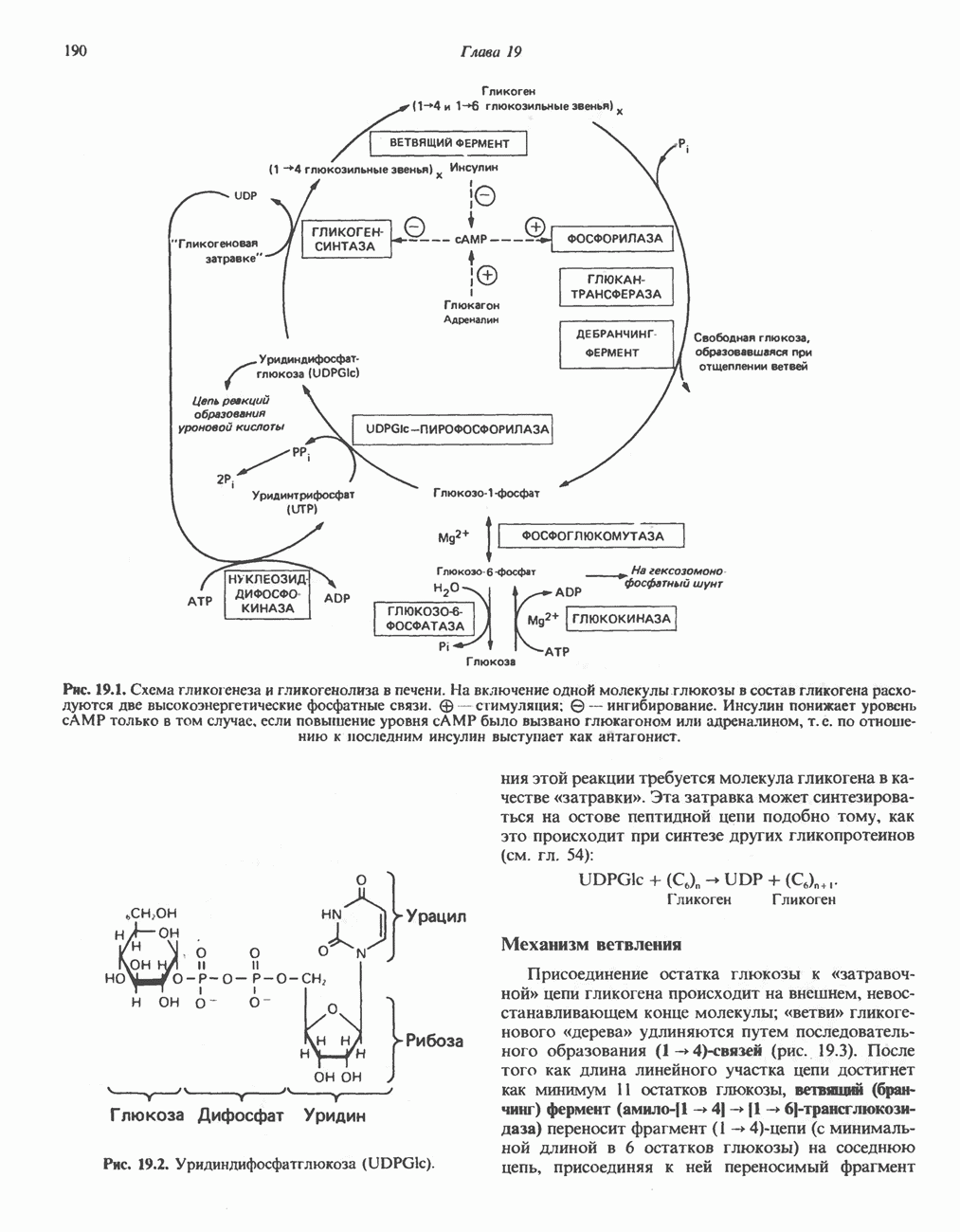
Фермент, катализирующий эту реакцию, — NAD-зависимая глицеральдегид-З-фосфатдегидро-геназа. В структурном плане она состоит из четырех идентичных полипептидов, образующих тетрамер. Каждый полипептид содержит по  принадлежащие остаткам цистеина. Одна из них находится в активном центре фермента. Полагают, что она принимает участие в окислении глицеральдегид-3-фосфата. Сначала субстрат соединяется с остатком цистеина дегидрогеназы, образуя тиополуацеталь, который окисляется в тиоловый эфир; атомы водорода, отщепленные при этом окислении, переносятся на связанный с ферментом NAD. Образующийся NADH связан с ферментом менее прочно, чем NAD, и поэтому легко замещается другой молекулой NAD. Реакция завершается фосфоролизом тиоэфирной связи с присоединением неорганического фосфата
принадлежащие остаткам цистеина. Одна из них находится в активном центре фермента. Полагают, что она принимает участие в окислении глицеральдегид-3-фосфата. Сначала субстрат соединяется с остатком цистеина дегидрогеназы, образуя тиополуацеталь, который окисляется в тиоловый эфир; атомы водорода, отщепленные при этом окислении, переносятся на связанный с ферментом NAD. Образующийся NADH связан с ферментом менее прочно, чем NAD, и поэтому легко замещается другой молекулой NAD. Реакция завершается фосфоролизом тиоэфирной связи с присоединением неорганического фосфата  при этом образуются
при этом образуются  -бисфосфоглицерат и свободный фермент с —
-бисфосфоглицерат и свободный фермент с — -группой (рис. 18.3). Потенциальная энергия процесса окисления резервируется сначала в высокоэнергетической тиоэфирной связи, а после фосфоролиза — в высокоэнергетической фосфатной связи
-группой (рис. 18.3). Потенциальная энергия процесса окисления резервируется сначала в высокоэнергетической тиоэфирной связи, а после фосфоролиза — в высокоэнергетической фосфатной связи  -бисфосфоглицерата, находящейся в положении 1. Высокоэнергетический фосфат переходит далее в состав АТР при участии фермента фосфоглицераткиназы, при этом образуется
-бисфосфоглицерата, находящейся в положении 1. Высокоэнергетический фосфат переходит далее в состав АТР при участии фермента фосфоглицераткиназы, при этом образуется  -фосфоглицерат:
-фосфоглицерат:

Поскольку на каждую молекулу глюкозы, участвующую в гликолизе, образуются две молекулы триозы, то на рассмотренной стадии образуются две молекулы АТР на молекулу глюкозы. Здесь мы имеем пример фосфорилирования «на субстратном уровне».
В присутствии арсената, который конкурирует

Рис. 183. Окисление глицеральдегид-3-фосфата. Ф-глицеральдегид-3-фосфатдегидрогеназа. Фермент ингибируется реагентом на -  -группы иодацетатом, который, следовательно, способен подавлять гликолиз.
-группы иодацетатом, который, следовательно, способен подавлять гликолиз.
с неорганическим фосфатом  образуется 1-арсено-3-фосфоглицерат, самопроизвольно гидролизующийся до 3-фосфоглицерата с выделением теплоты, но без образования АТР. Это важный пример способности арсената разобщать процессы окисления и фосфорилирования.
образуется 1-арсено-3-фосфоглицерат, самопроизвольно гидролизующийся до 3-фосфоглицерата с выделением теплоты, но без образования АТР. Это важный пример способности арсената разобщать процессы окисления и фосфорилирования.
Образовавшийся на предыдущей стадии 3-фосфоглицерат превращается в 2-фосфоглицерат при участии фермента фосфоглицератмутазы. Полагают, что на промежуточной стадии реакции образуется 2,3-бисфосфоглицерат (DPG):

На следующей стадии, катализируемой енолазой, происходит отщепление молекулы воды и перераспределение энергии внутри молекулы, при этом фосфат в положении 2 переходит в высокоэнергетическое состояние; продуктом реакции является фосфоенолпируват. Енолаза ингибируется ионами фторида; этим пользуются в тех случаях, когда необходимо остановить гликолиз, например перед определением содержания глюкозы в крови. Енолаза нуждается в ионах  или
или  :
:

Высокоэнергетический фосфат фосфоенолпирувата переносится на ADP ферментом пируваткиназой; на этой стадии образуются еще две молекулы АТР на молекулу глюкозы. Образующийся в ходе реакции енолпируват самопроизвольно переходит в кетоформу, т. е. пируват. Это-еще одна неравновесная реакция, сопровождающаяся значительной потерей свободной энергии в форме теплоты; она является физиологически необратимой:

Высокоэнергетический фосфат фосфоенолпирувата переносится на ADP ферментом пируваткиназой; на этой стадии образуются еще две молекулы АТР на молекулу глюкозы. Образующийся в ходе реакции енолпируват самопроизвольно переходит в кетоформу, т. е. пируват. Это — еще одна неравновесная реакция, сопровождающаяся значительной потерей свободной энергии в форме теплоты; она является физиологически необратимой:

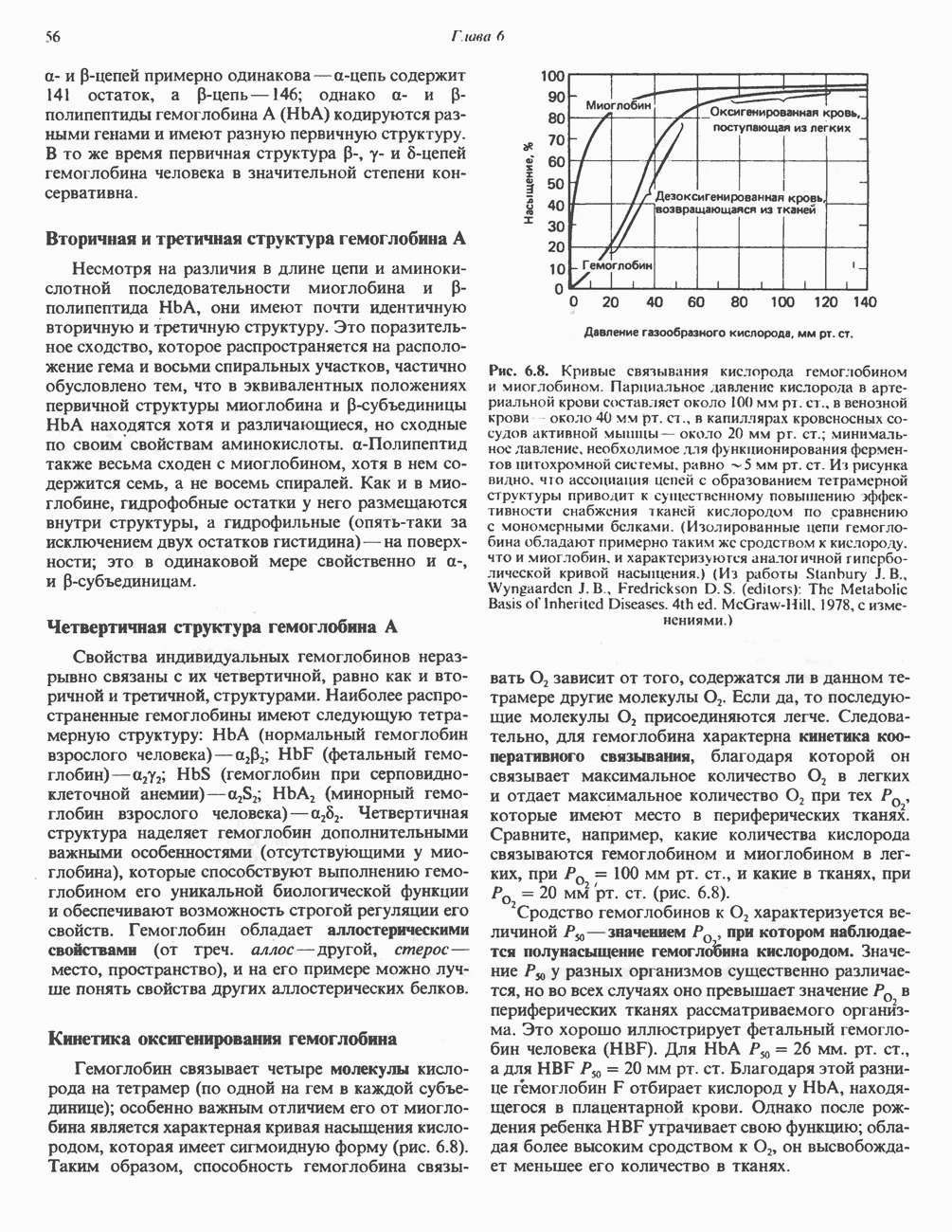
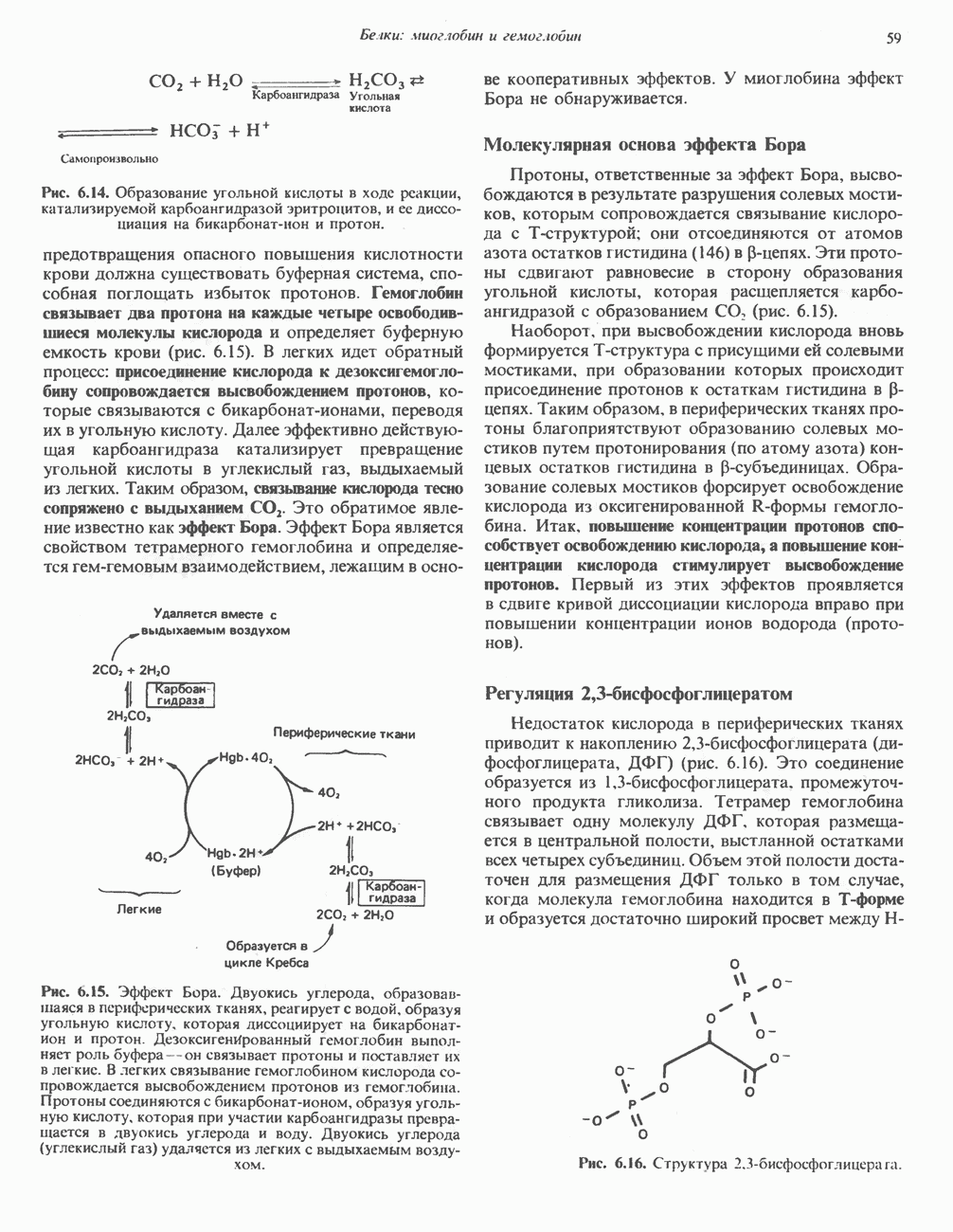
В зависимости от окислительно-восстановительного состояния ткани дальнейший процесс может идти по одному из двух путей. В анаэробных условиях реокисление NADH путем переноса восстановительных эквивалентов на дыхательную цепь и далее на кислород происходить не может. Поэтому NADH восстанавливает пируват в лактат, эта реакция катализируется лактатдегидрогеназой. Описано несколько изозимов этого фермента, определение их имеет клиническое значение.
Реокисление NADH путем образования лактата обеспечивает возможность протекания гликолиза в отсутствие кислорода, поскольку поставляется  необходимый для
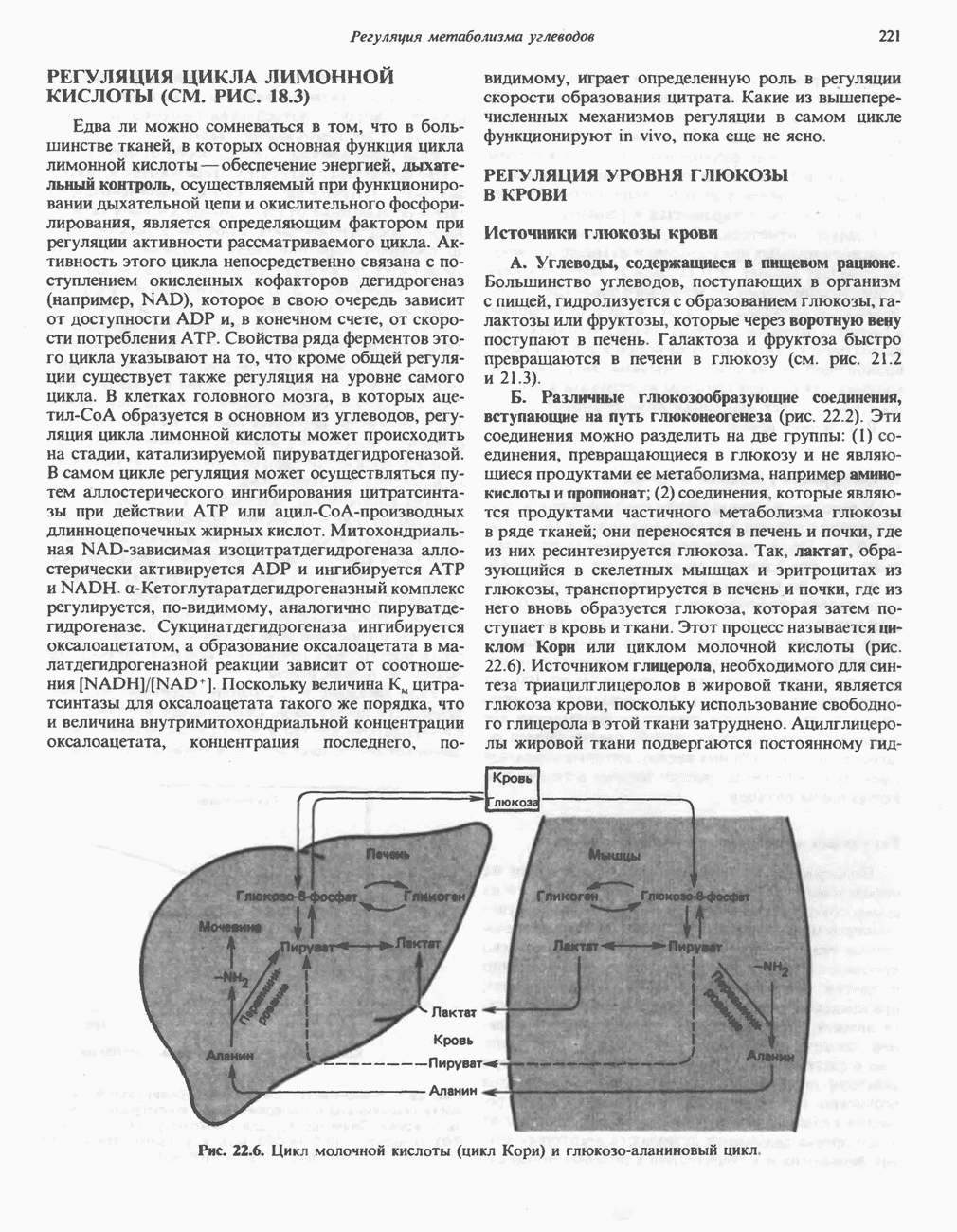
необходимый для  реакции. Таким образом, в тканях, функционирующих в условиях гипоксии, наблюдается образование лактата (рис. 18.2). Это в особенности справедливо в отношении скелетной мышцы, интенсивность работы которой в определенных пределах не зависит от поступления кислорода. Образующийся лактат может быть обнаружен в тканях, крови и моче. Гликолиз в эритроцитах даже в аэробных условиях всегда завершается образованием лактата, поскольку в этих клетках отсутствуют митохондрии, содержащие ферментные системы аэробного окисления пирувата. Эритроциты млекопитающих уникальны в том отношении, что около 90% их потребностей в энергии обеспечивается гликолизом. Помимо скелетной мышцы и эритроцитов ряд других тканей (мозг, желудочно-кишечный тракт, мозговой слой почек, сетчатка и кожа) в норме частично используют энергию гликолиза и образуют молочную кислоту. Печень, почки и сердце обычно утилизируют лактат, но в условиях гипоксии образуют его.
реакции. Таким образом, в тканях, функционирующих в условиях гипоксии, наблюдается образование лактата (рис. 18.2). Это в особенности справедливо в отношении скелетной мышцы, интенсивность работы которой в определенных пределах не зависит от поступления кислорода. Образующийся лактат может быть обнаружен в тканях, крови и моче. Гликолиз в эритроцитах даже в аэробных условиях всегда завершается образованием лактата, поскольку в этих клетках отсутствуют митохондрии, содержащие ферментные системы аэробного окисления пирувата. Эритроциты млекопитающих уникальны в том отношении, что около 90% их потребностей в энергии обеспечивается гликолизом. Помимо скелетной мышцы и эритроцитов ряд других тканей (мозг, желудочно-кишечный тракт, мозговой слой почек, сетчатка и кожа) в норме частично используют энергию гликолиза и образуют молочную кислоту. Печень, почки и сердце обычно утилизируют лактат, но в условиях гипоксии образуют его.
Хотя большая часть гликолитических реакций обратима, три из них носят ярко выраженный экзергонический характер и поэтому могут рассматриваться как физиологически необратимые. Это реакции, катализируемые гексокиназой (и глюкокиназой), фосфофруктокиназой и пируваткиназой; они служат главными участками, на которых происходит регуляция гликолиза. Клетки, способные направить движение метаболитов гликолитического пути в направлении синтеза (глюконеогенез), используют различные ферментные системы, обеспечивающие протекание процесса в обход упомянутых выше необратимых стадий. Об этом будет подробнее сказано ниже, когда будут обсуждаться процессы глюконеогенеза.
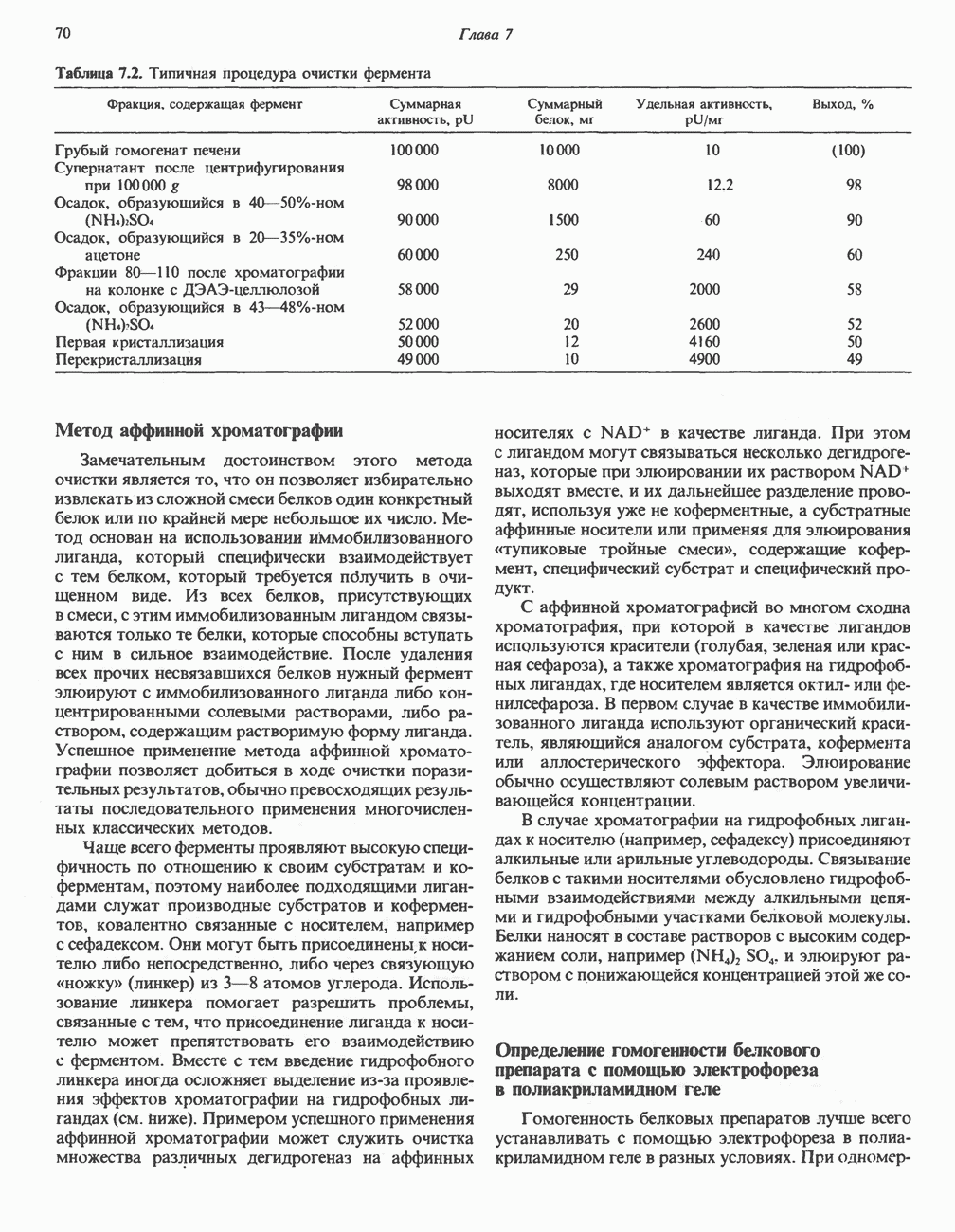
2,3-Бисфосфоглицератный цикл
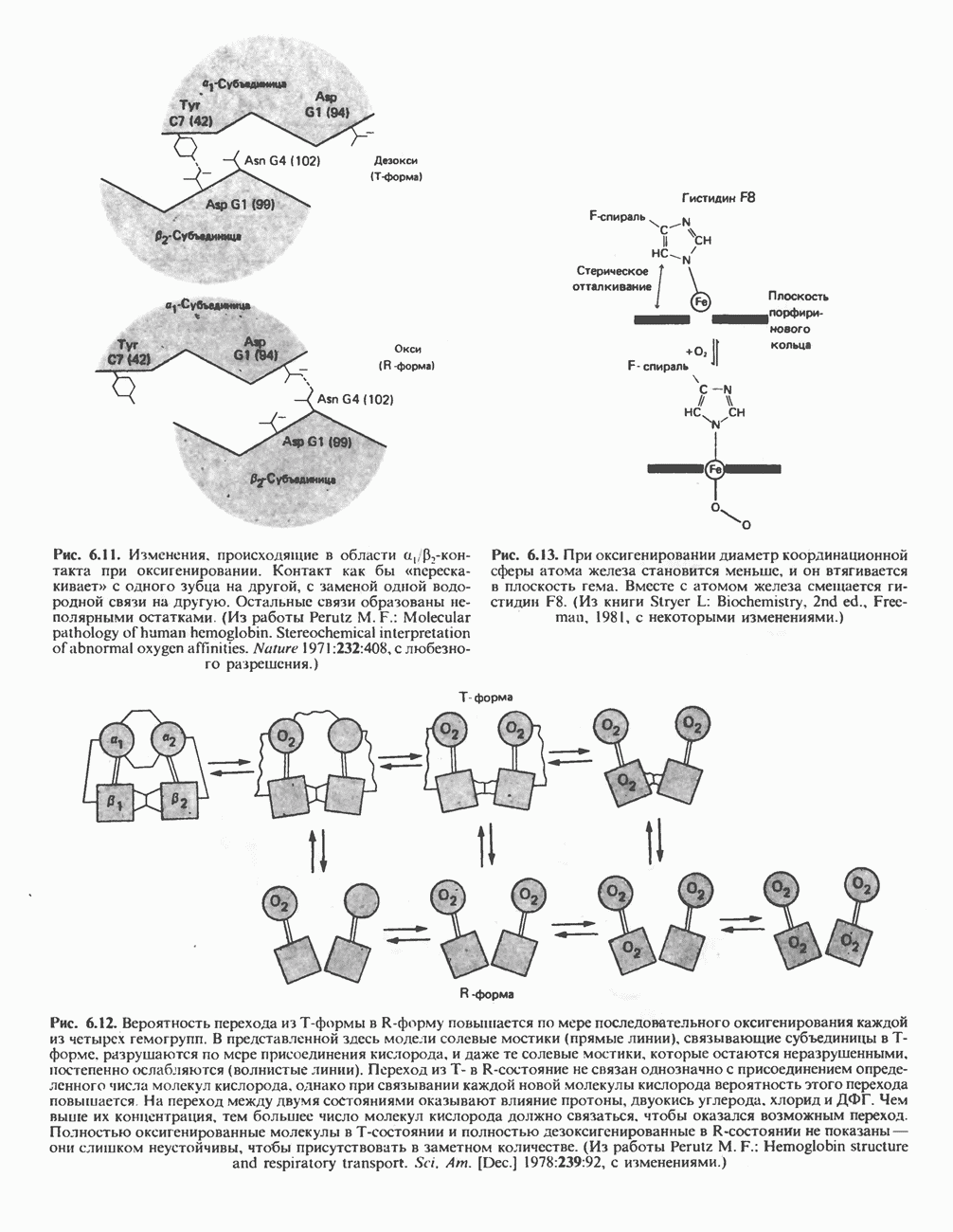
В эритроцитах многих млекопитающих имеется фермент, позволяющий направить процесс в обход стадии, катализируемой фосфоглицераткиназой; при этом свободная энергия, обусловленная присутствием высокоэнергетического фосфата в молекуле  рассеивается в форме теплоты (рис. 18.4). Дополнительный фермент бисфосфоглицератмутаза катализирует превращение
рассеивается в форме теплоты (рис. 18.4). Дополнительный фермент бисфосфоглицератмутаза катализирует превращение  -бисфосфоглицерата в
-бисфосфоглицерата в  -бисфосфоглицерат, последний далее превращается в
-бисфосфоглицерат, последний далее превращается в  -фосфоглицерат при участии
-фосфоглицерат при участии  -бисфосфоглицератфосфатазы (принято считать, что этой активностью обладает фосфоглицератмутаза). Потеря на этой стадии высокоэнергетического фосфата означает, что процесс гликолиза более не сопровождается производством АТР. В этом может заключаться определенное преимущество, поскольку даже в тех случаях, когда потребности в АТР минимальны, гликолиз может продолжаться. Образующийся
-бисфосфоглицератфосфатазы (принято считать, что этой активностью обладает фосфоглицератмутаза). Потеря на этой стадии высокоэнергетического фосфата означает, что процесс гликолиза более не сопровождается производством АТР. В этом может заключаться определенное преимущество, поскольку даже в тех случаях, когда потребности в АТР минимальны, гликолиз может продолжаться. Образующийся  -бисфосфоглицерат связывается с гемоглобином, понижая сродство последнего к кислороду, т.е. сдвигает кривую диссоциации оксигемоглобина вправо. Таким образом, присутствие
-бисфосфоглицерат связывается с гемоглобином, понижая сродство последнего к кислороду, т.е. сдвигает кривую диссоциации оксигемоглобина вправо. Таким образом, присутствие  -дифосфоглицерата в эритроцитах способствует диссоциации кислорода из оксигемоглобина и переходу его в ткани (см. гл. 6).
-дифосфоглицерата в эритроцитах способствует диссоциации кислорода из оксигемоглобина и переходу его в ткани (см. гл. 6).

Рис. 18.4. 2,3-Бисфосфоглицератный цикл в эритроцитах
| << Предыдущий параграф | Следующий параграф >> |
- Предисловие к русскому изданию
- Предисловие
- Глава 1. Биохимия и медицина
- Глава 2. Биомолекулы и биохимические методы
- КЛЕТКА
- ОБЩИЙ ЭКСПЕРИМЕНТАЛЬНЫЙ ПОДХОД, ИСПОЛЬЗУЕМЫЙ В БИОХИМИИ
- ОСНОВНЫЕ ДОСТИЖЕНИЯ БИОХИМИИ
- Раздел I. Структура и функции белков и ферментов
- Глава 3. Аминокислоты
- АМИНОКИСЛОТЫ
- ИОННЫЕ ФОРМЫ АМИНОКИСЛОТ
- СТРУКТУРА АМИНОКИСЛОТ
- РАСТВОРИМОСТЬ АМИНОКИСЛОТ
- ОБЩИЕ ХИМИЧЕСКИЕ РЕАКЦИИ
- СВОЙСТВА ИНДИВИДУАЛЬНЫХ АМИНОКИСЛОТ
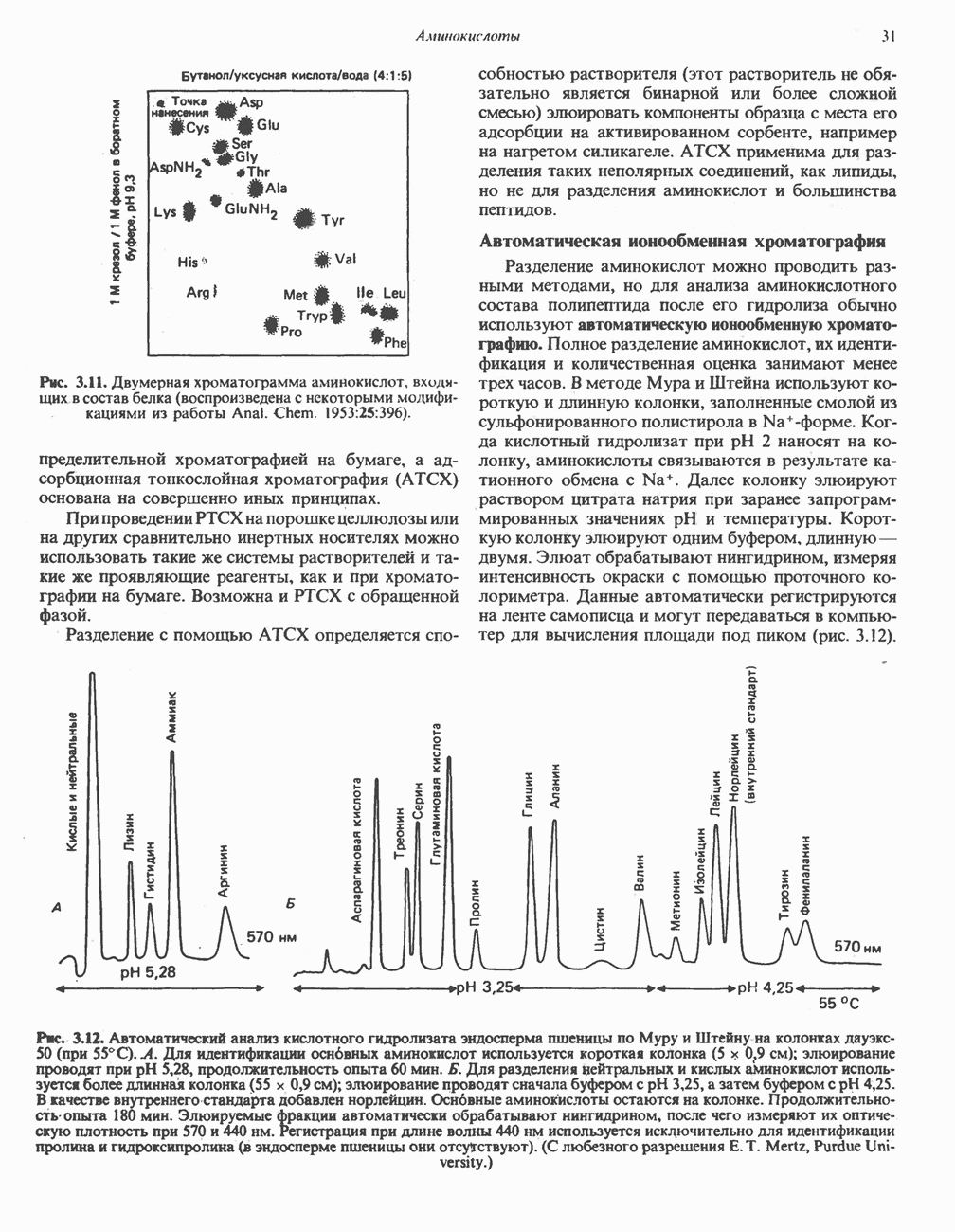
- МЕТОДЫ РАЗДЕЛЕНИЯ АМИНОКИСЛОТ
- Глава 4. Пептиды
- СТРУКТУРА ПЕПТИДОВ
- ИОННЫЕ ФОРМЫ ПЕПТИДОВ
- КОНФОРМАЦИЯ ПЕПТИДОВ В РАСТВОРЕ
- МЕТОДЫ РАЗДЕЛЕНИЯ ПЕПТИДОВ
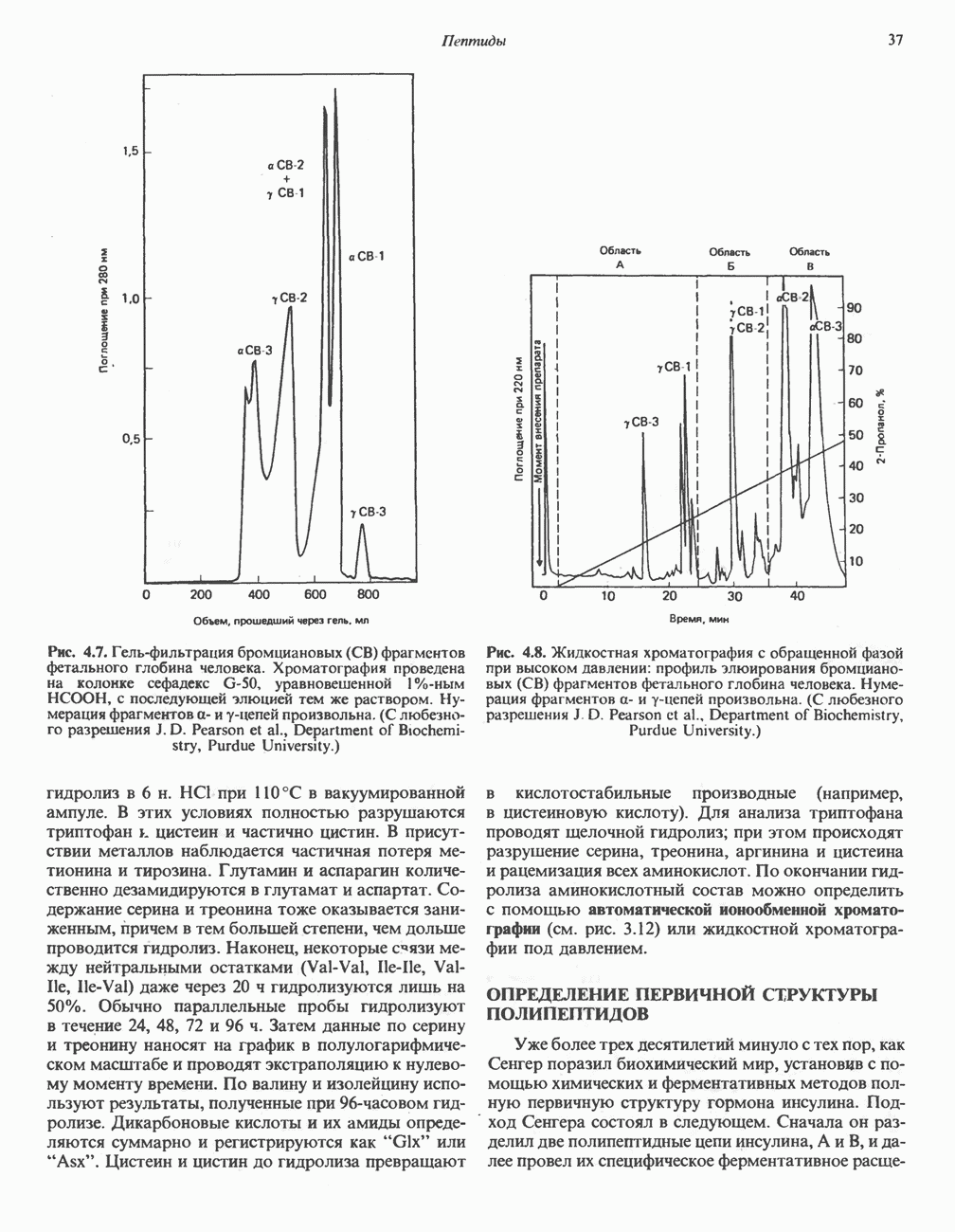
- ОПРЕДЕЛЕНИЕ АМИНОКИСЛОТНОГО СОСТАВА ПЕПТИДОВ
- ОПРЕДЕЛЕНИЕ ПЕРВИЧНОЙ СТРУКТУРЫ ПОЛИПЕПТИДОВ
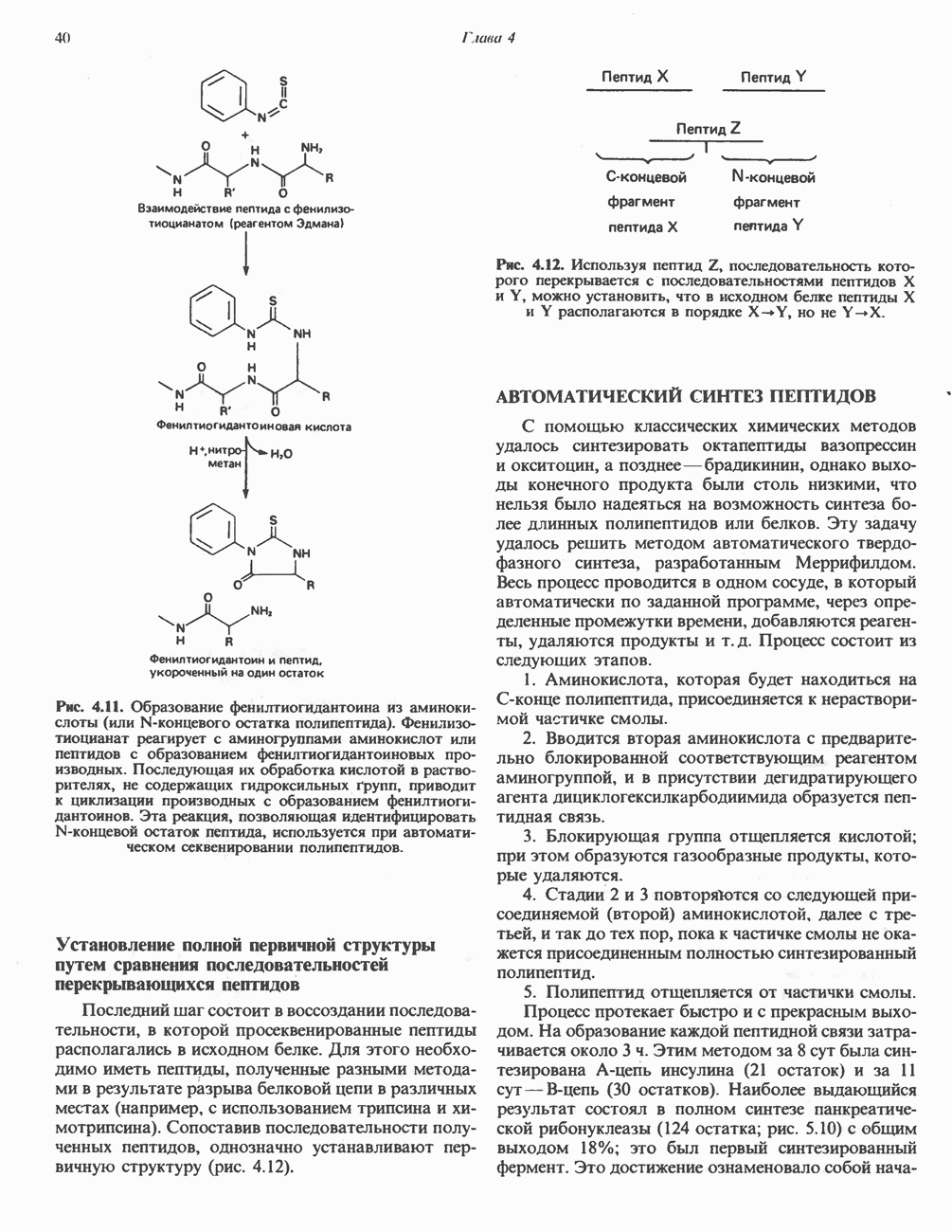
- АВТОМАТИЧЕСКОЕ ОПРЕДЕЛЕНИЕ АМИНОКИСЛОТНОЙ ПОСЛЕДОВАТЕЛЬНОСТИ ПОЛИПЕПТИДОВ МЕТОДОМ ЭДМАНА
- АВТОМАТИЧЕСКИЙ СИНТЕЗ ПЕПТИДОВ
- ЛИТЕРАТУРА
- Глава 5. Белки: структура и свойства
- КЛАССИФИКАЦИЯ БЕЛКОВ
- СВЯЗИ, ОТВЕТСТВЕННЫЕ ЗА ФОРМИРОВАНИЕ СТРУКТУРЫ БЕЛКА
- УПОРЯДОЧЕННЫЕ КОНФОРМАЦИИ ПОЛИПЕПТИДОВ
- УРОВНИ СТРУКТУРНОЙ ОРГАНИЗАЦИИ БЕЛКА
- ДЕНАТУРАЦИЯ
- МЕТОДЫ ОПРЕДЕЛЕНИЯ ПЕРВИЧНОЙ СТРУКТУРЫ
- ОПРЕДЕЛЕНИЕ ВТОРИЧНОЙ И ТРЕТИЧНОЙ СТРУКТУРЫ МЕТОДОМ РЕНТГЕНОВСКОЙ КРИСТАЛЛОГРАФИИ
- ОПРЕДЕЛЕНИЕ ЧЕТВЕРТИЧНОЙ СТРУКТУРЫ
- ГЛАВА 6. Белки: миоглобин и гемоглобин
- ГЕМОПРОТЕИНЫ — МИОГЛОБИН И ГЕМОГЛОБИН
- МИОГЛОБИН
- ГЕМОГЛОБИНЫ
- Глава 7. Ферменты: общие свойства
- КОФЕРМЕНТЫ
- «ТРЕХТОЧЕЧНАЯ ФИКСАЦИЯ» СУБСТРАТОВ НА ФЕРМЕНТАХ
- СПЕЦИФИЧНОСТЬ ФЕРМЕНТОВ
- КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ ФЕРМЕНТАТИВНОЙ АКТИВНОСТИ
- ВЫДЕЛЕНИЕ ФЕРМЕНТОВ
- ИЗОФЕРМЕНТЫ (ИЗОЗИМЫ)
- ФЕРМЕНТЫ В КЛИНИЧЕСКОЙ ДИАГНОСТИКЕ
- ДИАГНОСТИЧЕСКОЕ И ПРОГНОСТИЧЕСКОЕ ЗНАЧЕНИЕ СПЕЦИФИЧЕСКИХ ФЕРМЕНТОВ
- ПРИМЕНЕНИЕ ЭНДОНУКЛЕАЗ РЕСТРИКЦИИ В ДИАГНОСТИКЕ
- ЛИТЕРАТУРА
- Глава 8. ФЕРМЕНТЫ: КИНЕТИКА
- ОБРАЗОВАНИЕ И РАСПАД ПЕРЕХОДНЫХ СОСТОЯНИЙ
- ИЗМЕНЕНИЯ СВОБОДНОЙ ЭНЕРГИИ, СВЯЗАННЫЕ С ОБРАЗОВАНИЕМ И РАСПАДОМ ПЕРЕХОДНЫХ СОСТОЯНИЙ
- РОЛЬ КАТАЛИЗАТОРОВ В ОБРАЗОВАНИИ ПРОДУКТИВНЫХ ПЕРЕХОДНЫХ СОСТОЯНИЙ
- ТЕОРИЯ СТОЛКНОВЕНИЙ
- РОЛЬ ФЕРМЕНТОВ В РАЗРЫВЕ И ОБРАЗОВАНИИ КОВАЛЕНТНЫХ СВЯЗЕЙ
- КАТАЛИТИЧЕСКИЙ ЦЕНТР
- ФАКТОРЫ, ВЛИЯЮЩИЕ НА АКТИВНОСТЬ ФЕРМЕНТОВ
- КОНСТАНТА РАВНОВЕСИЯ
- КОНЦЕНТРАЦИЯ ФЕРМЕНТА
- КОНЦЕНТРАЦИЯ СУБСТРАТА
- УРАВНЕНИЕ МИХАЭЛИСА—МЕНТЕН
- ОГРАНИЧЕНИЯ, ПРИСУЩИЕ УРАВНЕНИЮ МИХАЭЛИСА — МЕНТЕН
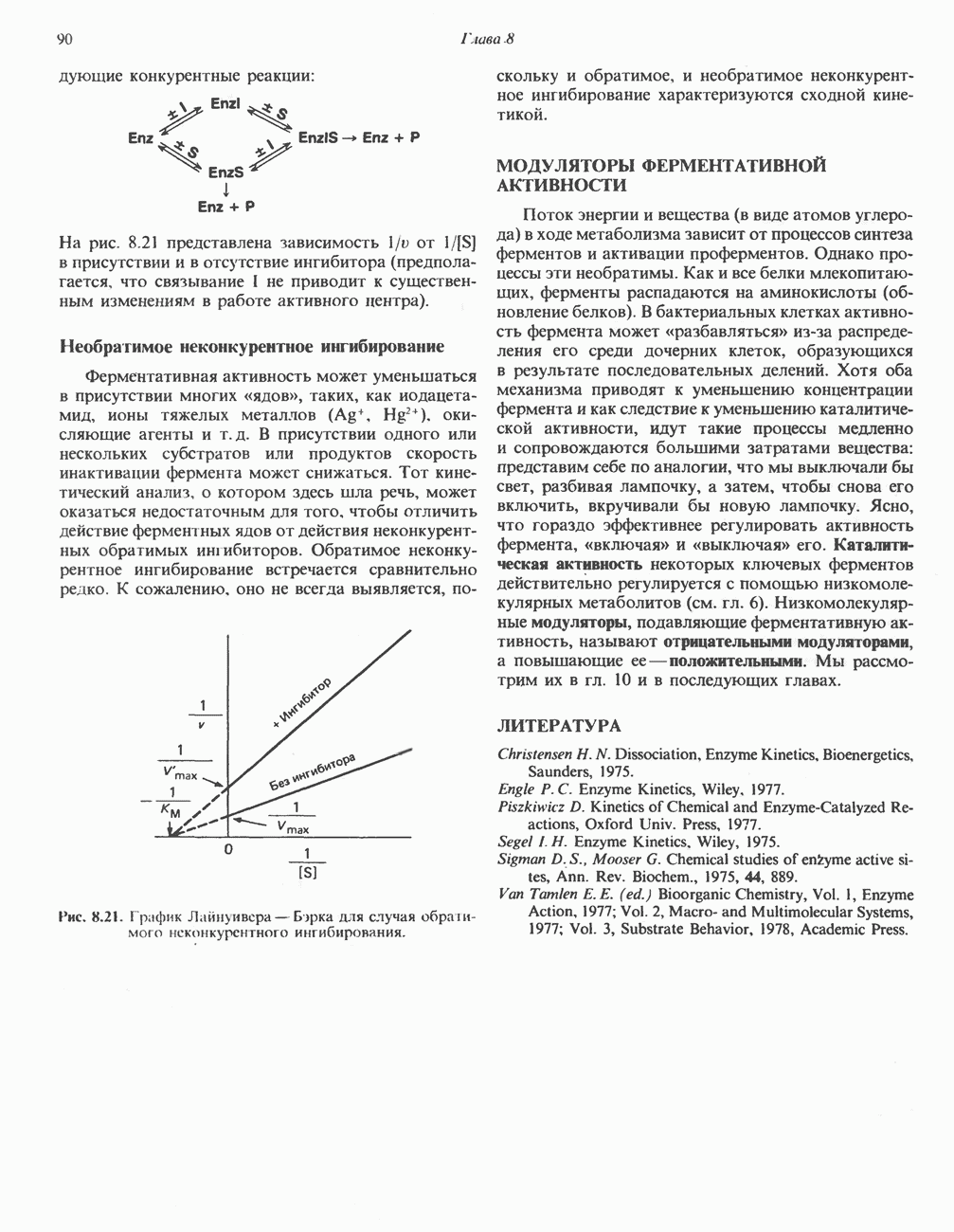
- ИНГИБИРОВАНИЕ АКТИВНОСТИ ФЕРМЕНТОВ
- МОДУЛЯТОРЫ ФЕРМЕНТАТИВНОЙ АКТИВНОСТИ
- Глава 9. Ферменты: механизм действия
- МЕХАНИЗМ КАТАЛИТИЧЕСКОГО ДЕЙСТВИЯ ХИМОТРИПСИНА
- РОЛЬ ИЗБИРАТЕЛЬНОГО ПРОТЕОЛИЗА В ФОРМИРОВАНИИ АКТИВНЫХ ЦЕНТРОВ ФЕРМЕНТОВ
- УПОРЯДОЧЕННОЕ И НЕУПОРЯДОЧЕННОЕ СВЯЗЫВАНИЕ СУБСТРАТОВ
- ФЕРМЕНТЫ КАК КАТАЛИЗАТОРЫ ОБЩЕГО КИСЛОТНОГО И ОБЩЕГО ОСНОВНОГО ТИПА
- ИОНЫ МЕТАЛЛОВ
- Глава 10. Ферменты: регуляция активности
- РЕГУЛЯЦИЯ МЕТАБОЛИЗМА
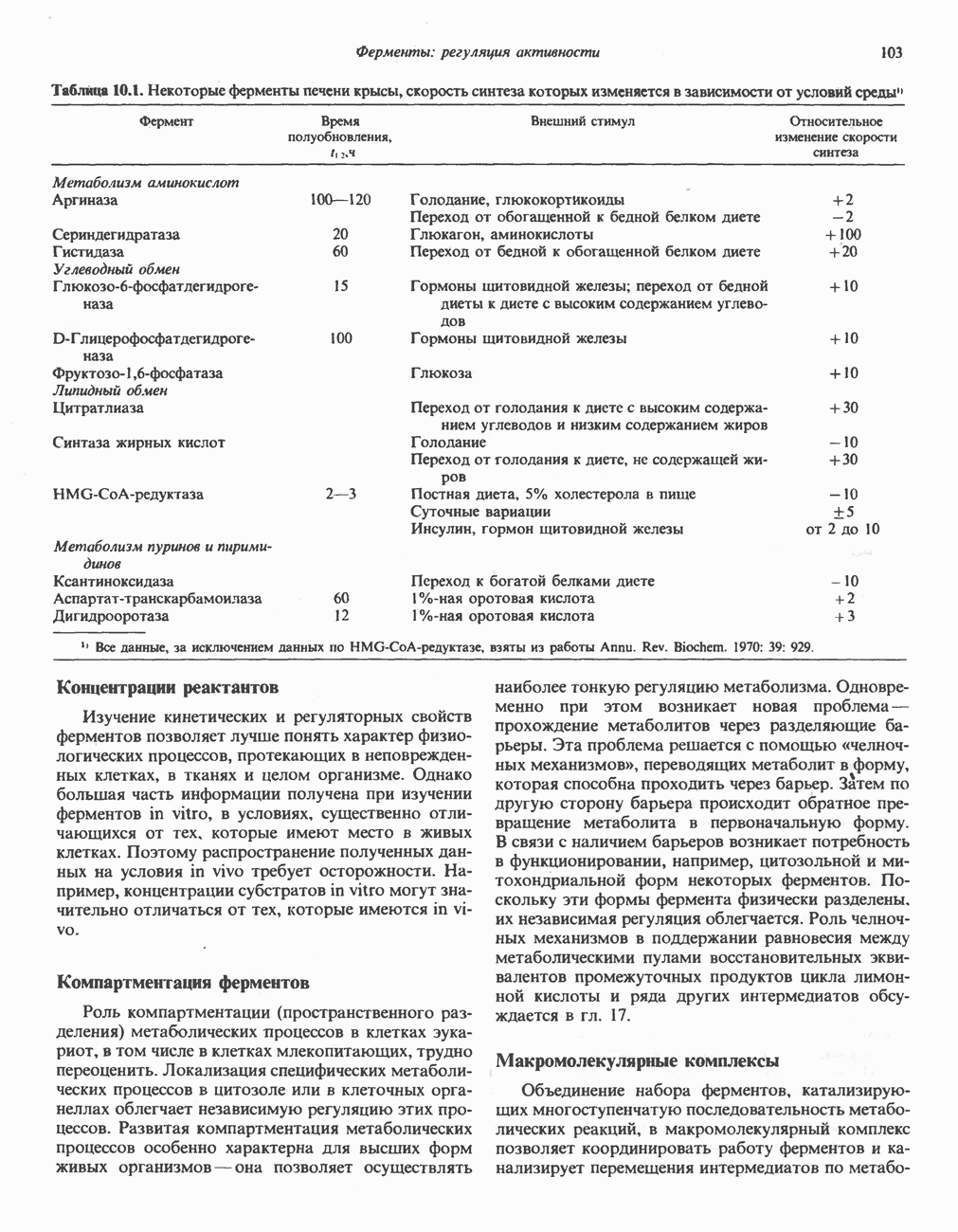
- РЕГУЛЯЦИЯ КОЛИЧЕСТВА ФЕРМЕНТА ПУТЕМ РЕГУЛЯЦИИ СКОРОСТИ ЕГО СИНТЕЗА И РАСПАДА
- РЕГУЛЯЦИЯ КАТАЛИТИЧЕСКОЙ АКТИВНОСТИ ФЕРМЕНТОВ
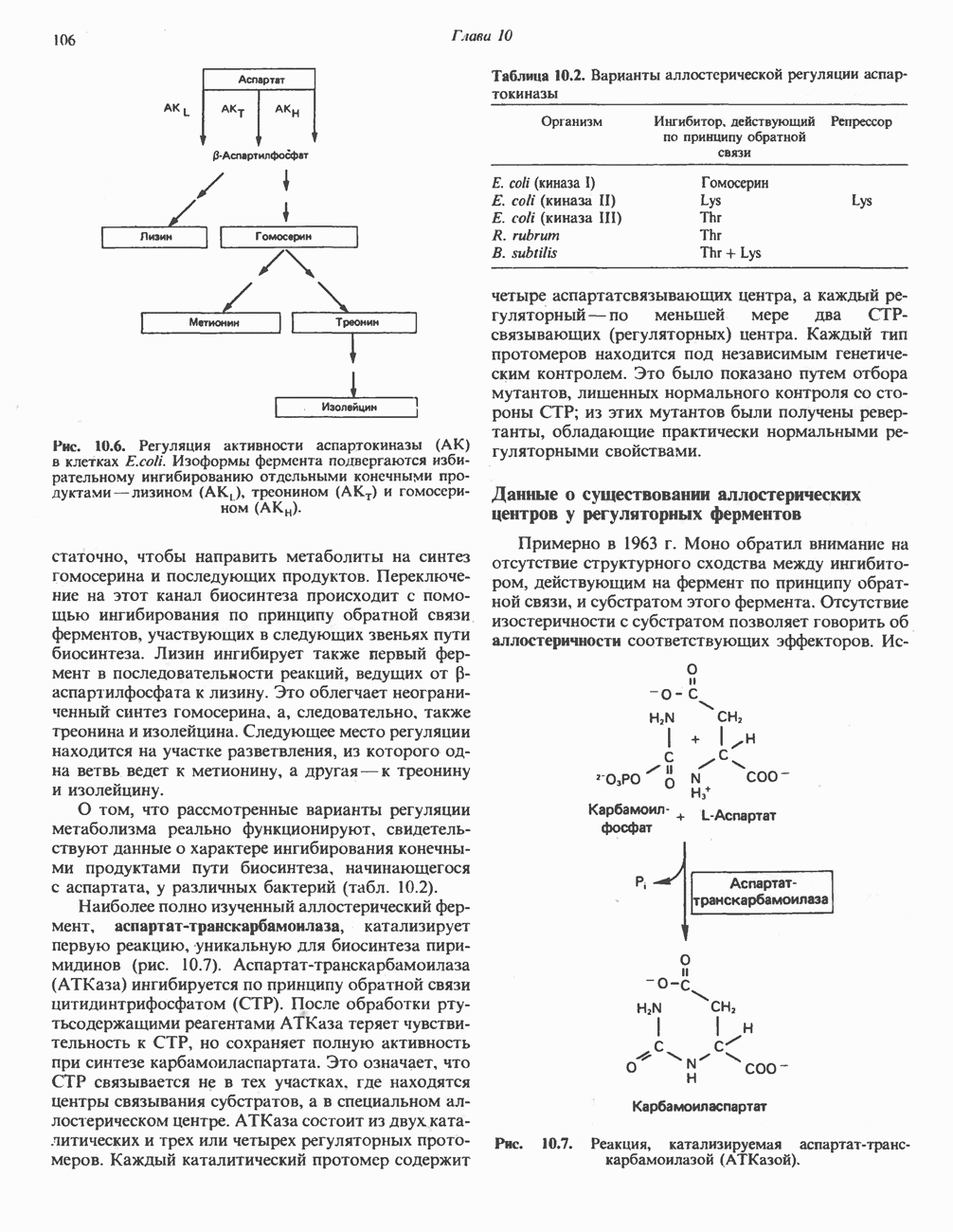
- АЛЛОСТЕРИЧЕСКАЯ РЕГУЛЯЦИЯ
- КОВАЛЕНТНАЯ МОДИФИКАЦИЯ ФЕРМЕНТОВ
- Раздел II. Биоэнергетика и метаболизм углеводов и липидов
- Глава 11. Биоэнергетика
- СВОБОДНАЯ ЭНЕРГИЯ И ЗАКОНЫ ТЕРМОДИНАМИКИ
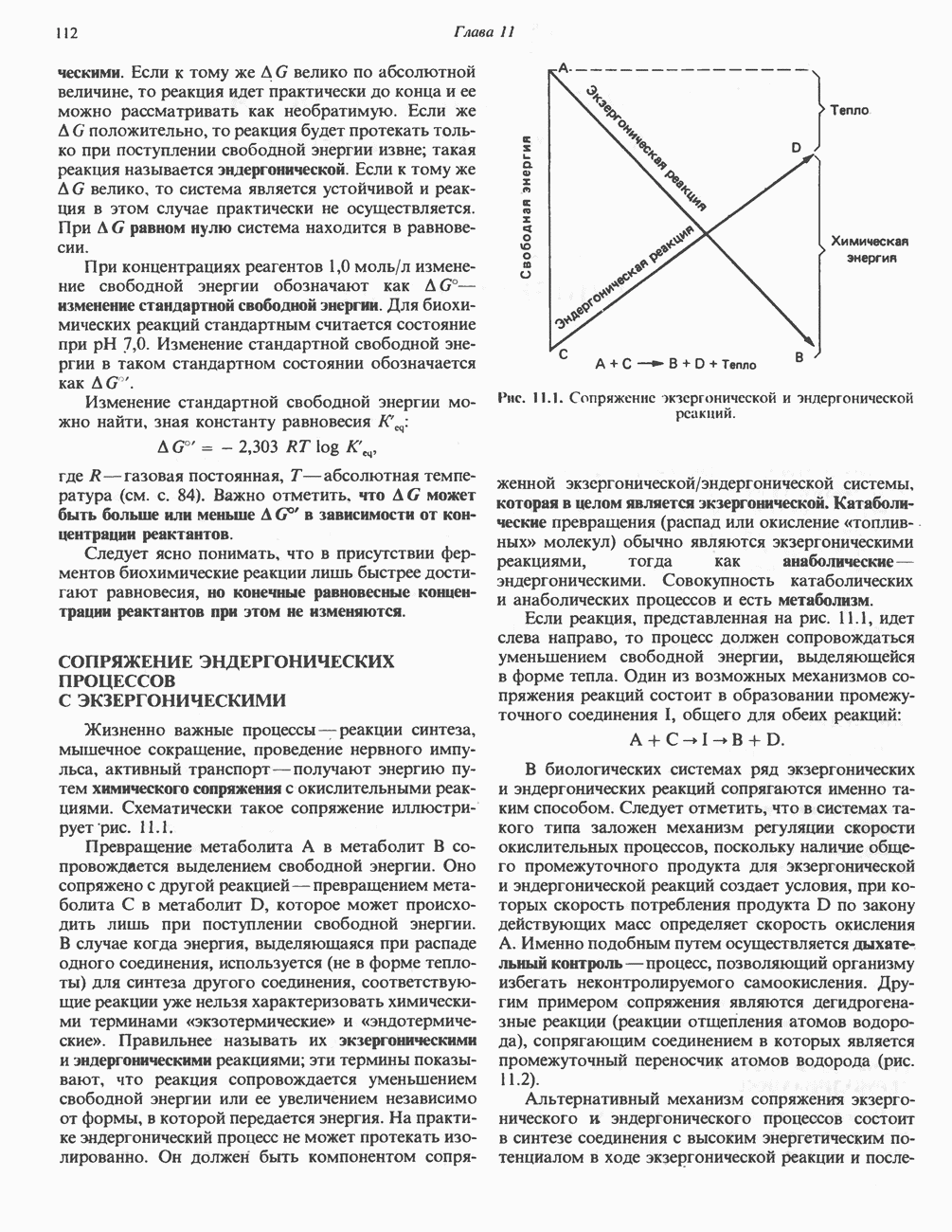
- СОПРЯЖЕНИЕ ЭНДЕРГОНИЧЕСКИХ ПРОЦЕССОВ С ЭКЗЕРГОНИЧЕСКИМИ
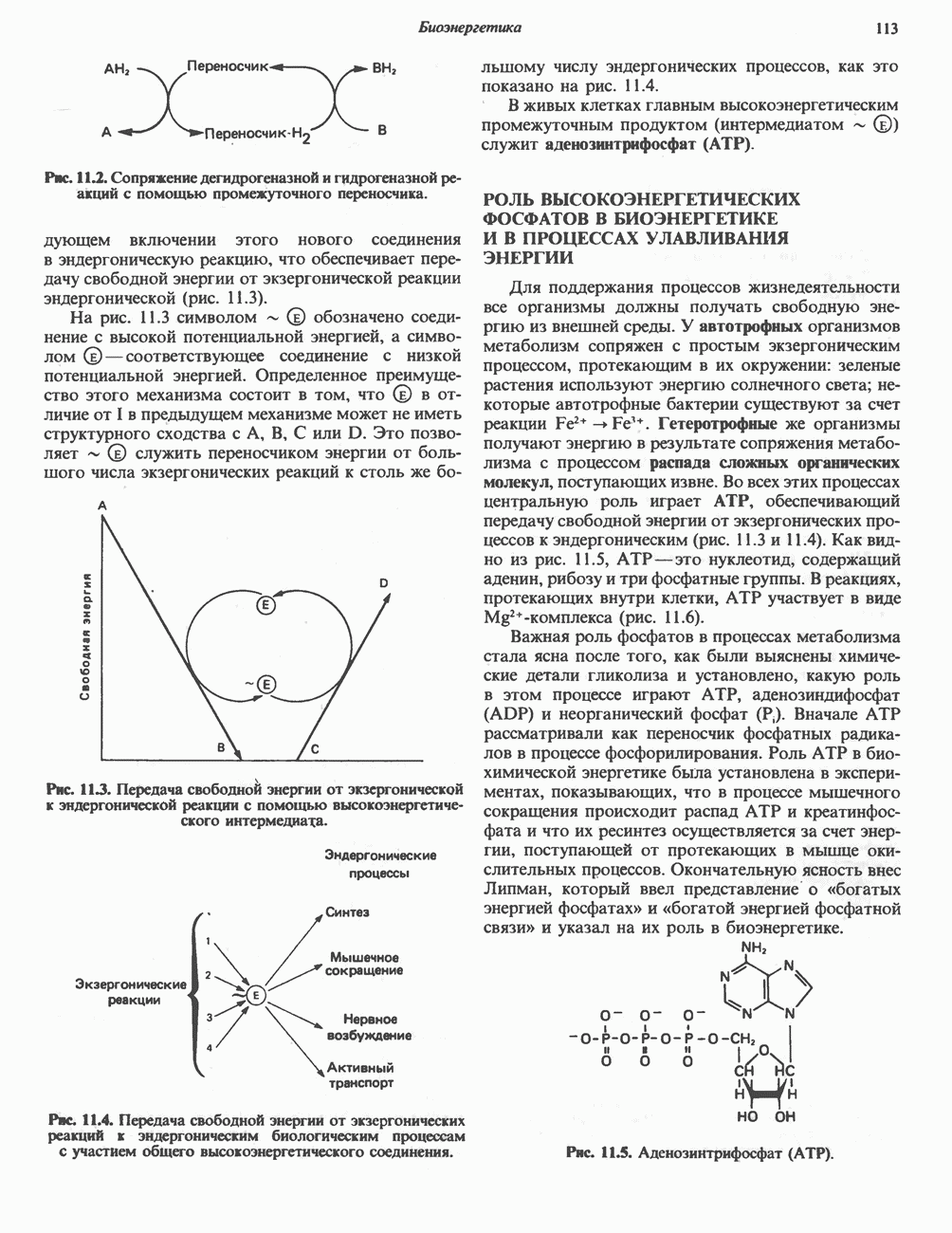
- РОЛЬ ВЫСОКОЭНЕРГЕТИЧЕСКИХ ФОСФАТОВ В БИОЭНЕРГЕТИКЕ И В ПРОЦЕССАХ УЛАВЛИВАНИЯ ЭНЕРГИИ
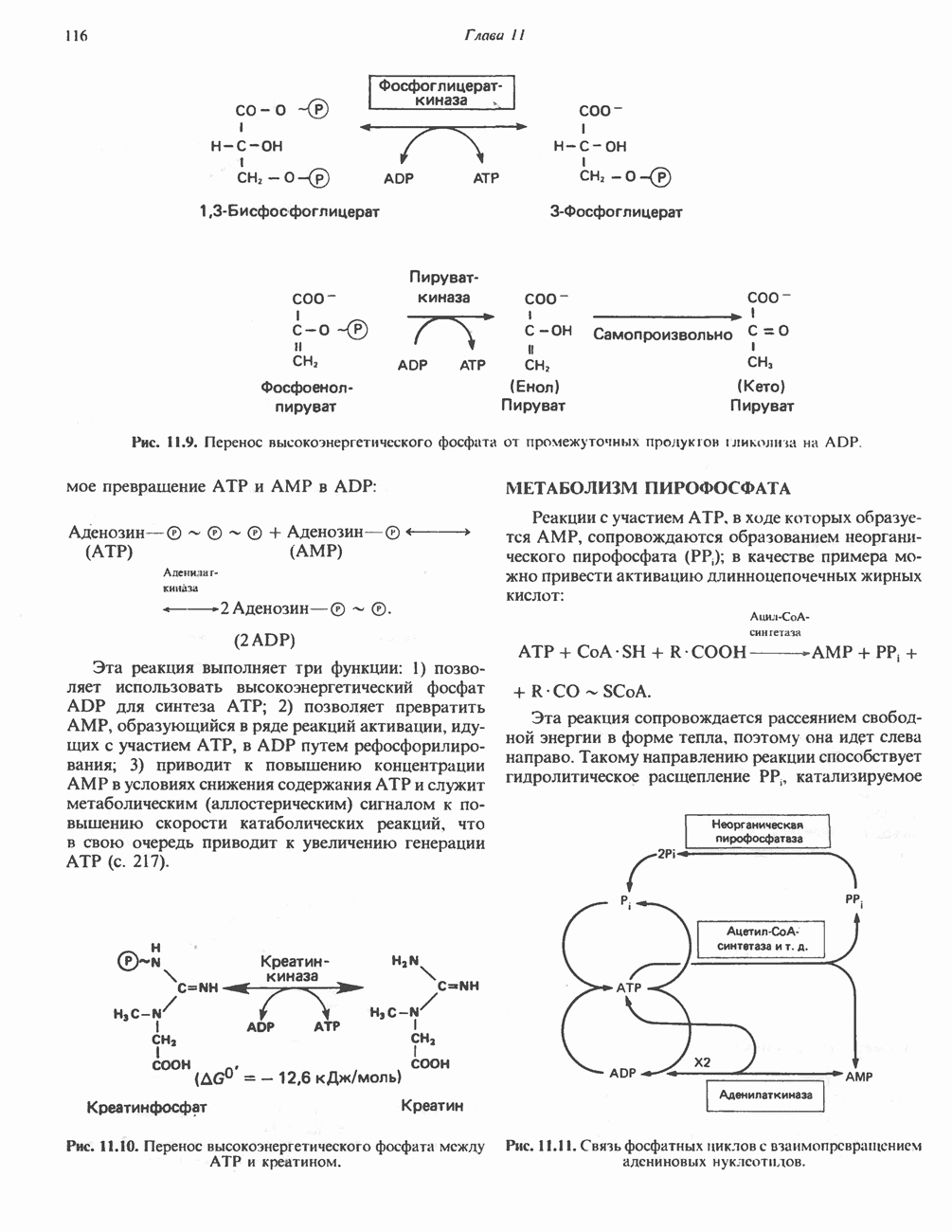
- МЕТАБОЛИЗМ ПИРОФОСФАТА
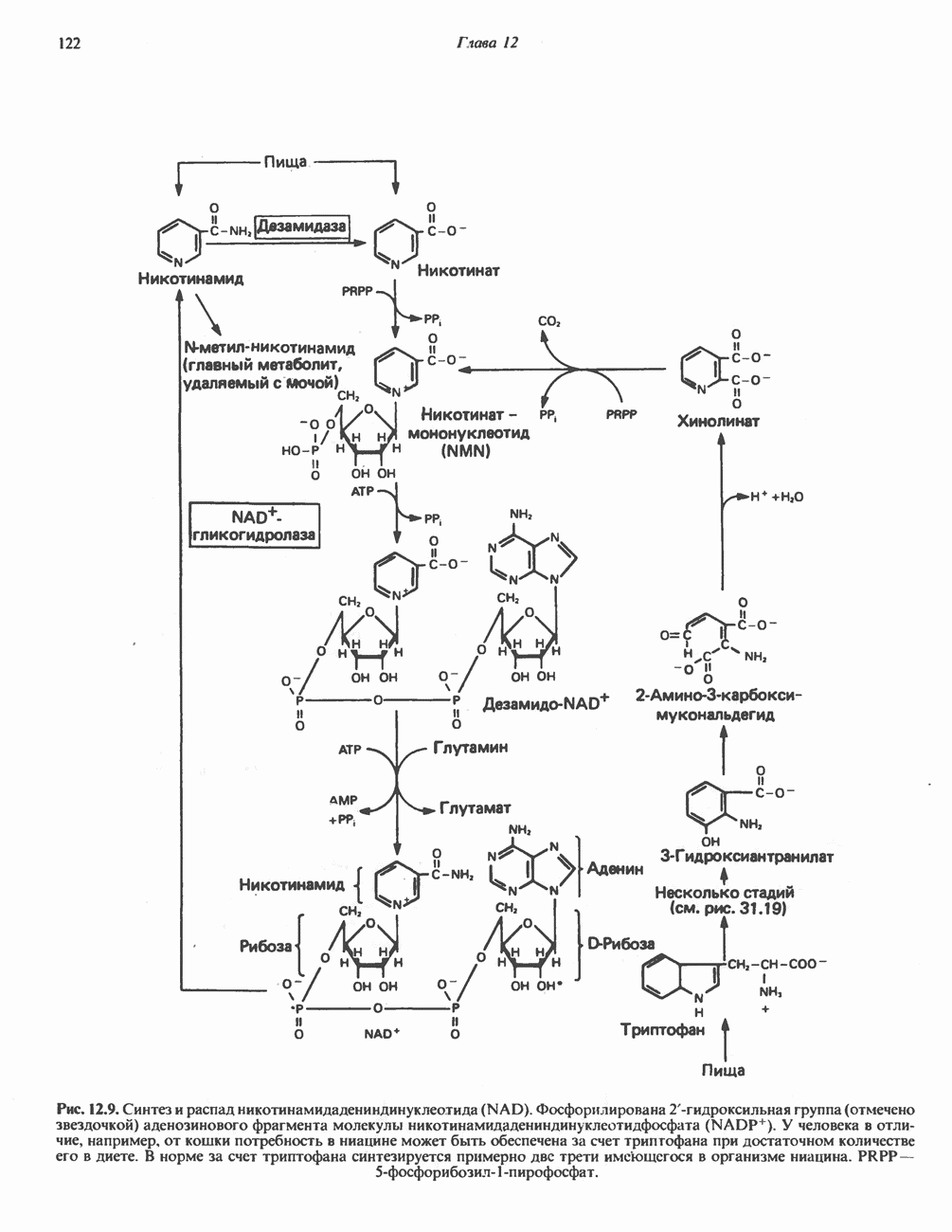
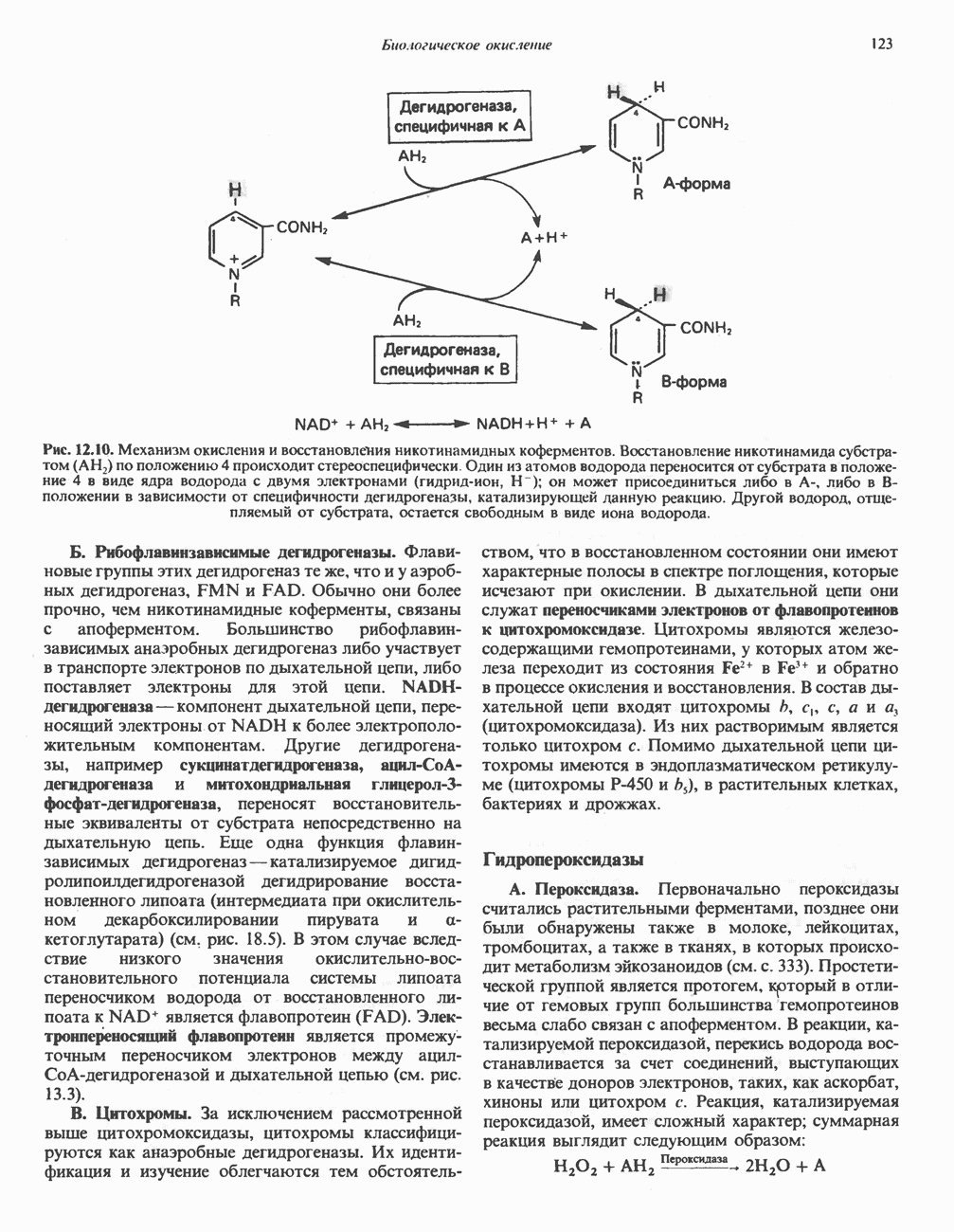
- Глава 12. Биологическое окисление
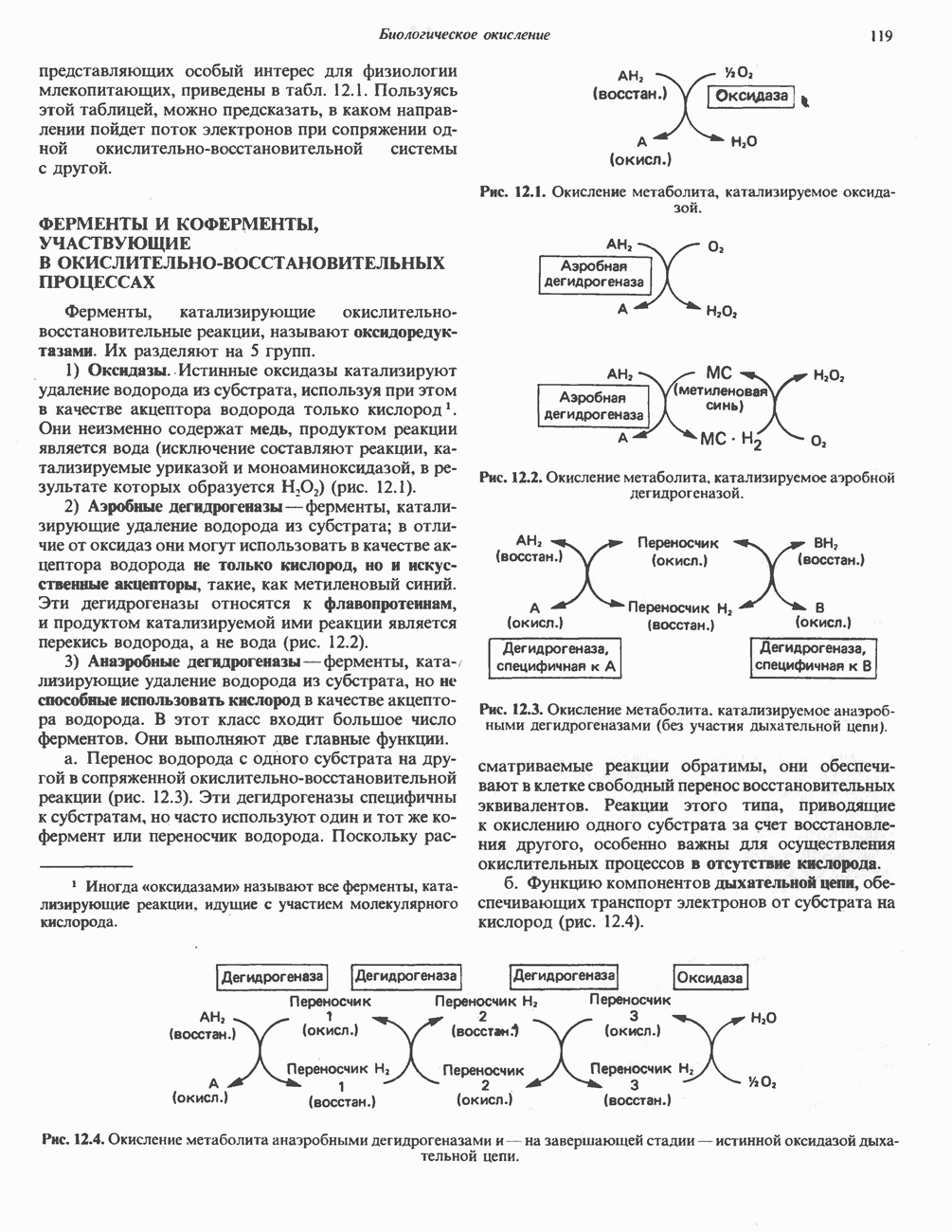
- ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНОЕ РАВНОВЕСИЕ, ОКИСЛИТЕЛЬНОВОССТАНОВИТЕЛЬНЫЙ ПОТЕНЦИАЛ
- ФЕРМЕНТЫ И КОФЕРМЕНТЫ, УЧАСТВУЮЩИЕ В ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ ПРОЦЕССАХ
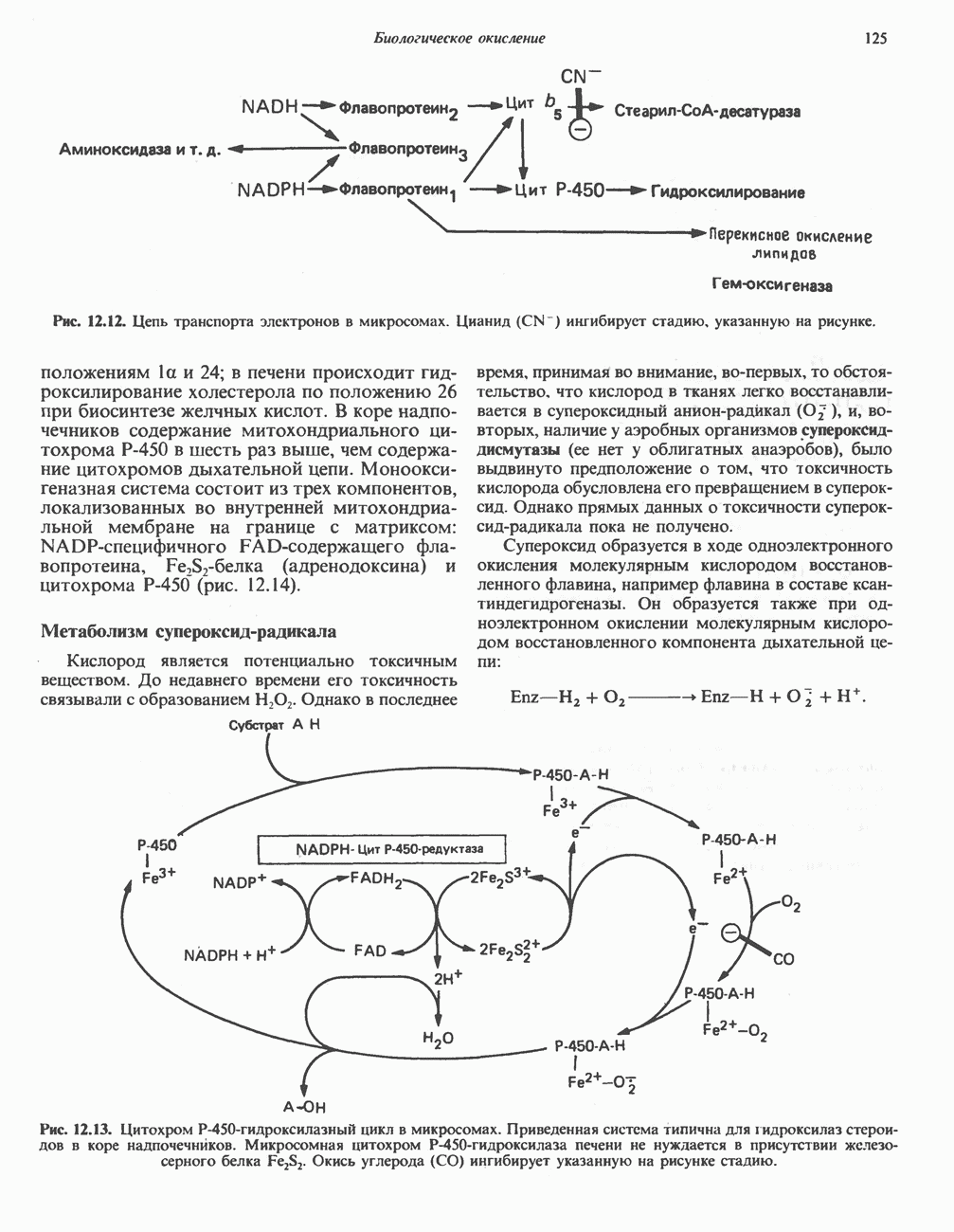
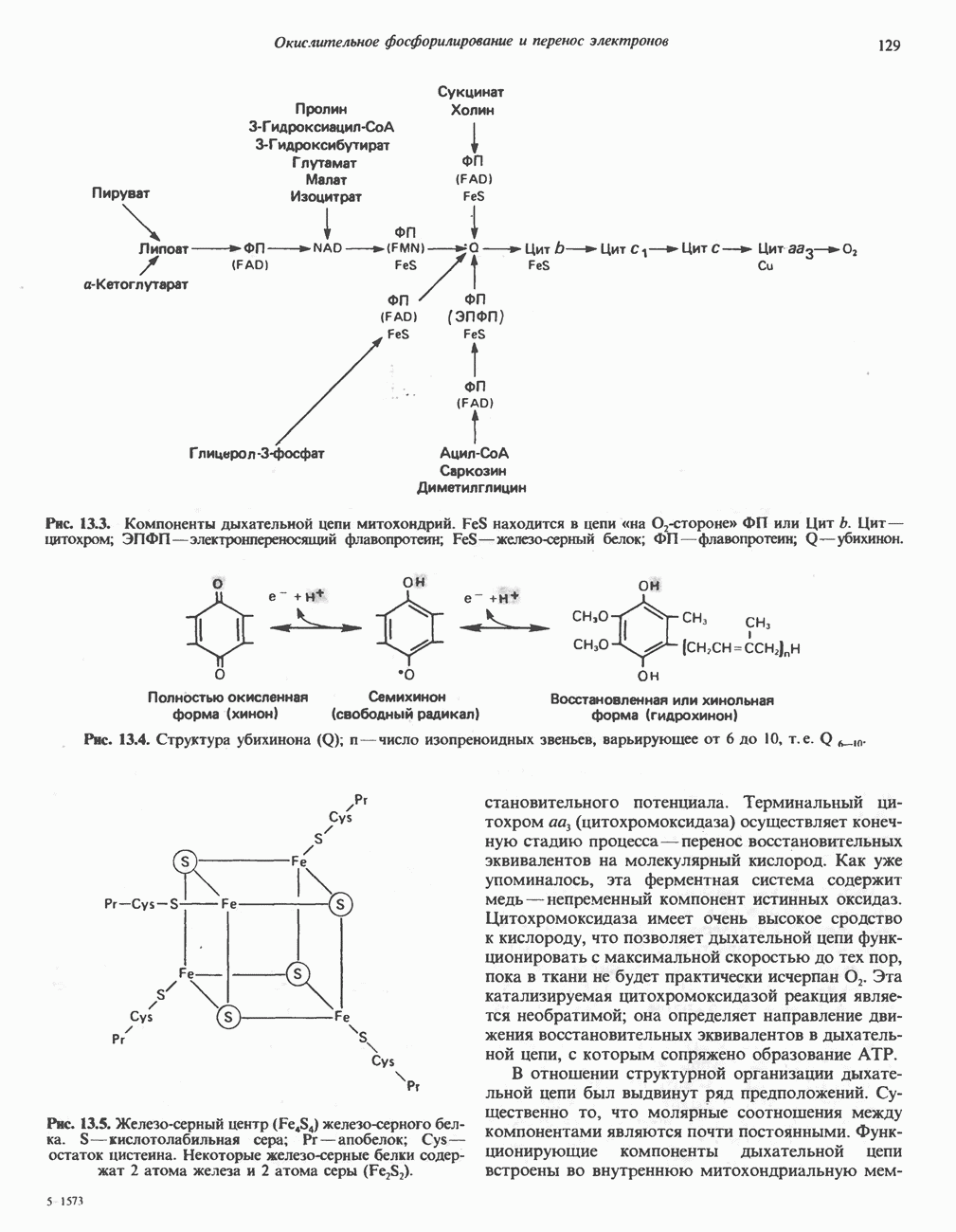
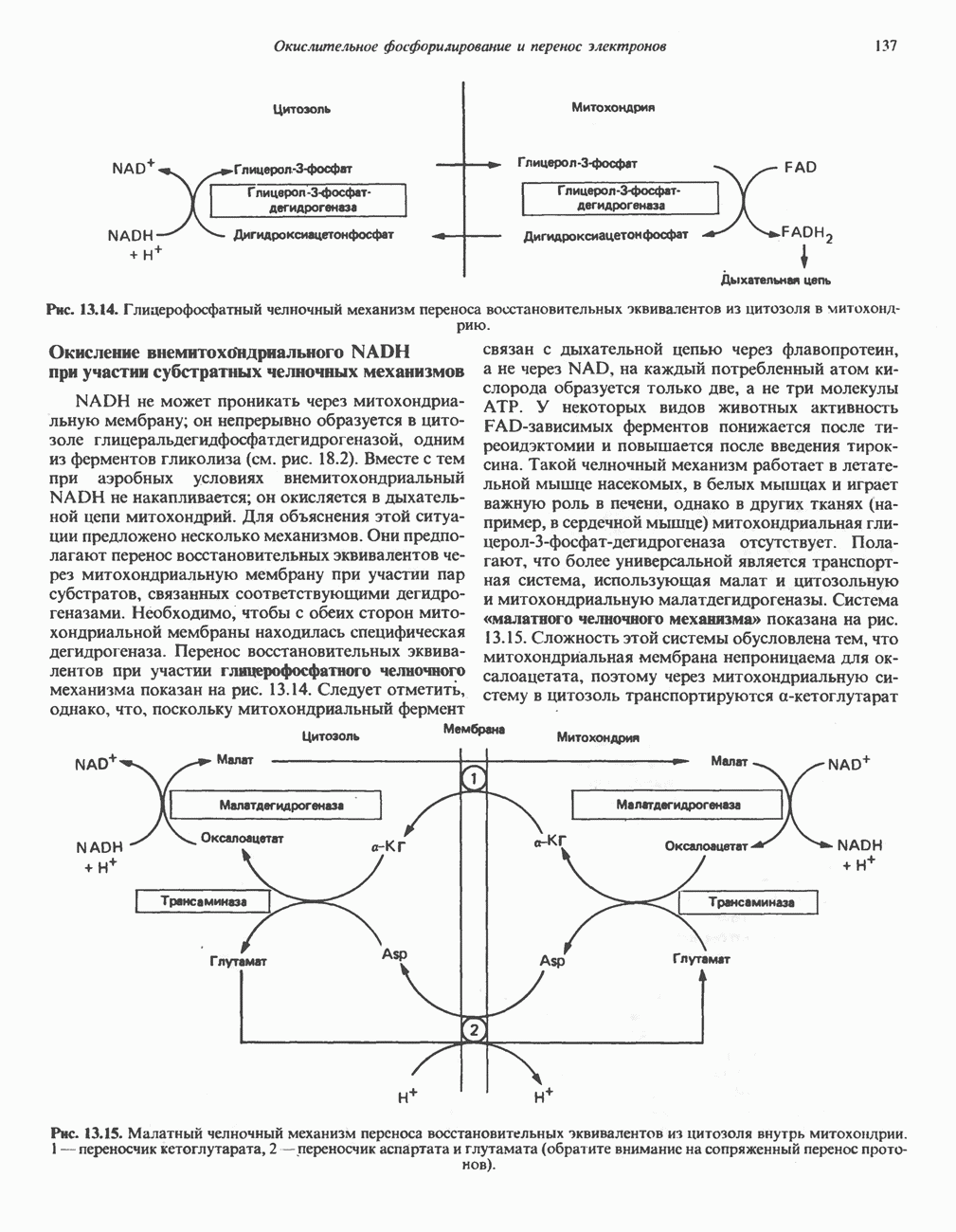
- Глава 13. Окислительное фосфорилирование и транспортные системы митохондрий
- ДЫХАТЕЛЬНАЯ ЦЕПЬ
- ОРГАНИЗАЦИЯ ДЫХАТЕЛЬНОЙ ЦЕПИ В МИТОХОНДРИЯХ
- РОЛЬ ДЫХАТЕЛЬНОЙ ЦЕПИ В УЛАВЛИВАНИИ ЭНЕРГИИ
- ДЫХАТЕЛЬНЫЙ КОНТРОЛЬ
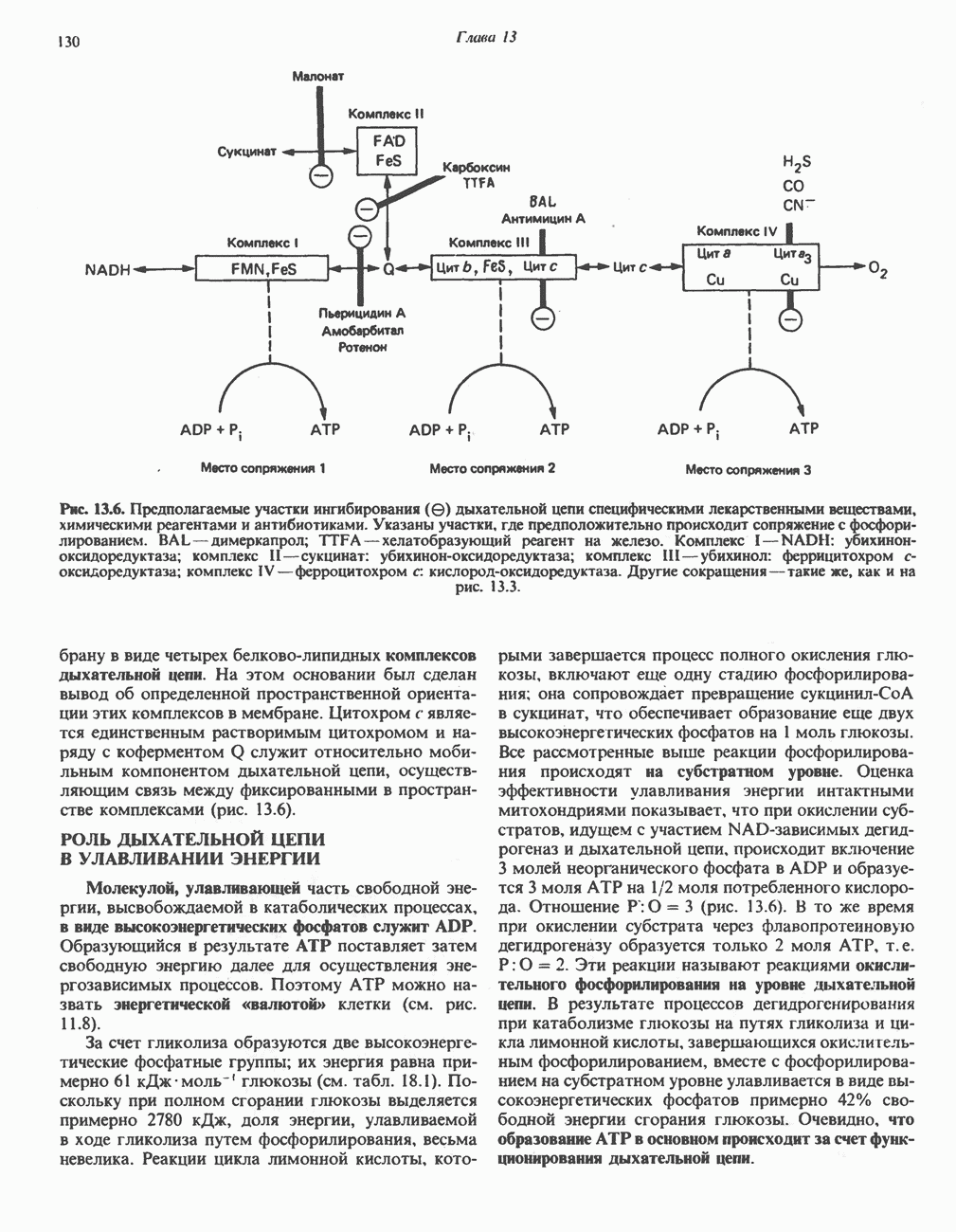
- ИНГИБИТОРЫ ДЫХАТЕЛЬНОЙ ЦЕПИ И ОКИСЛИТЕЛЬНОГО ФОСФОРИЛИРОВАНИЯ
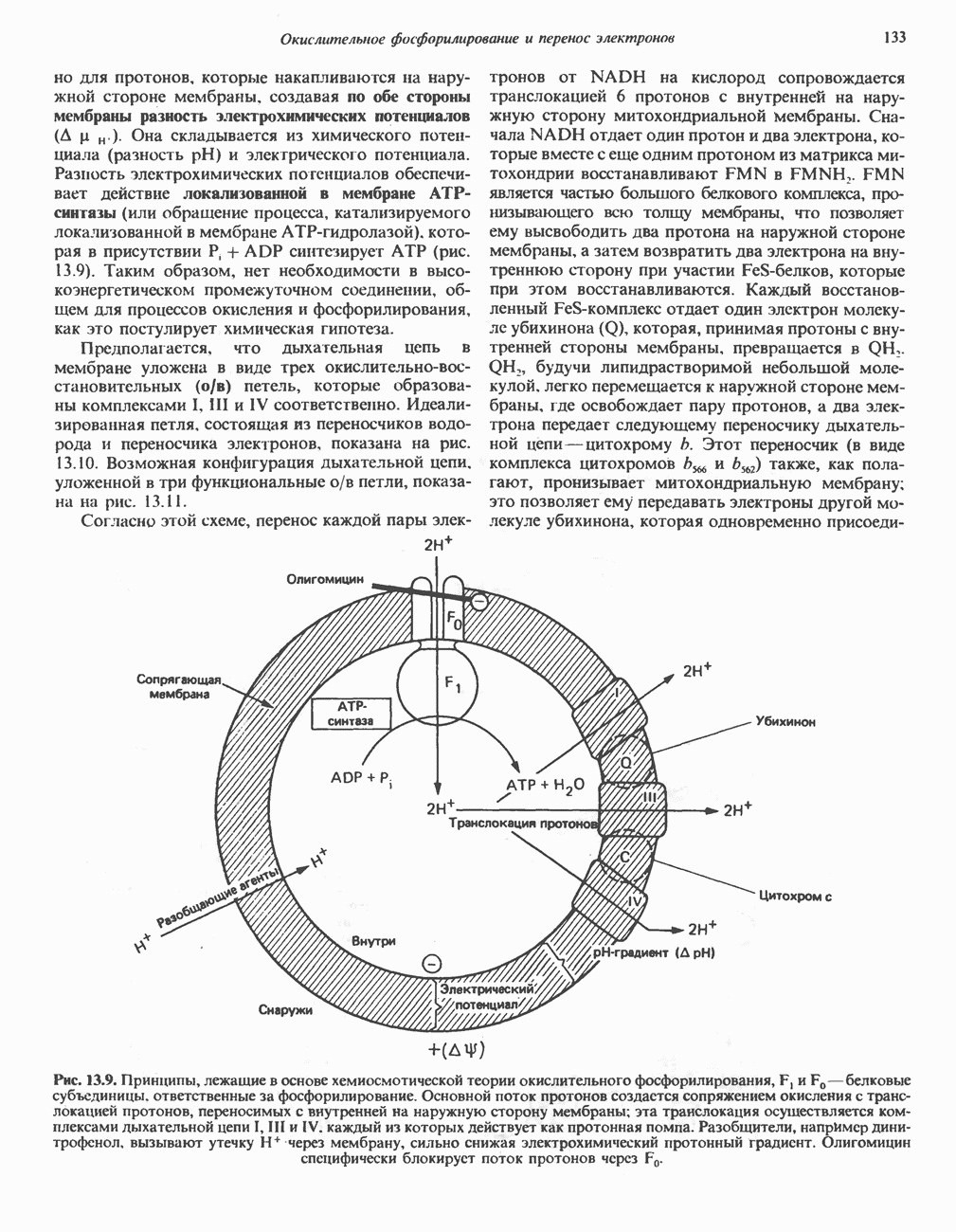
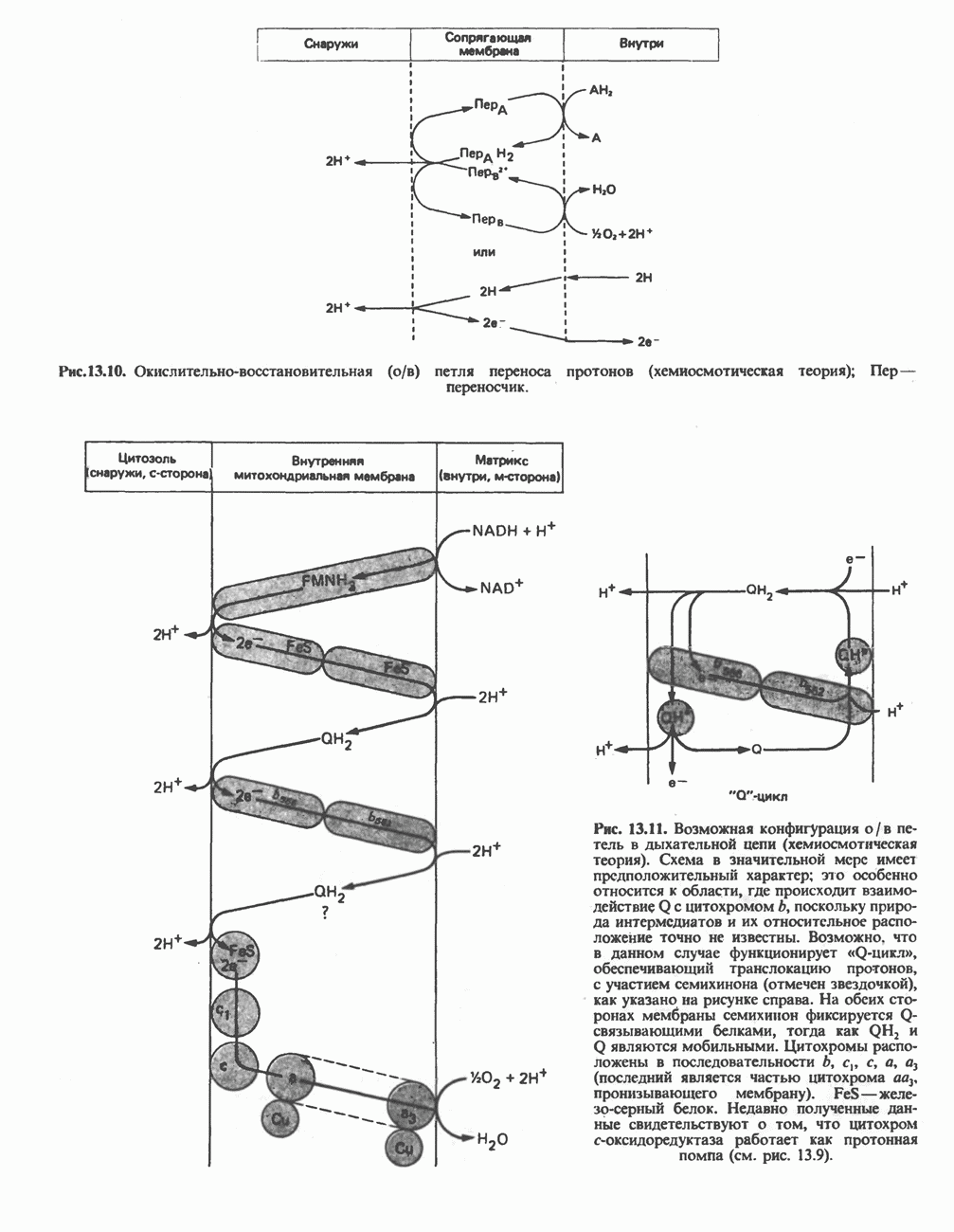
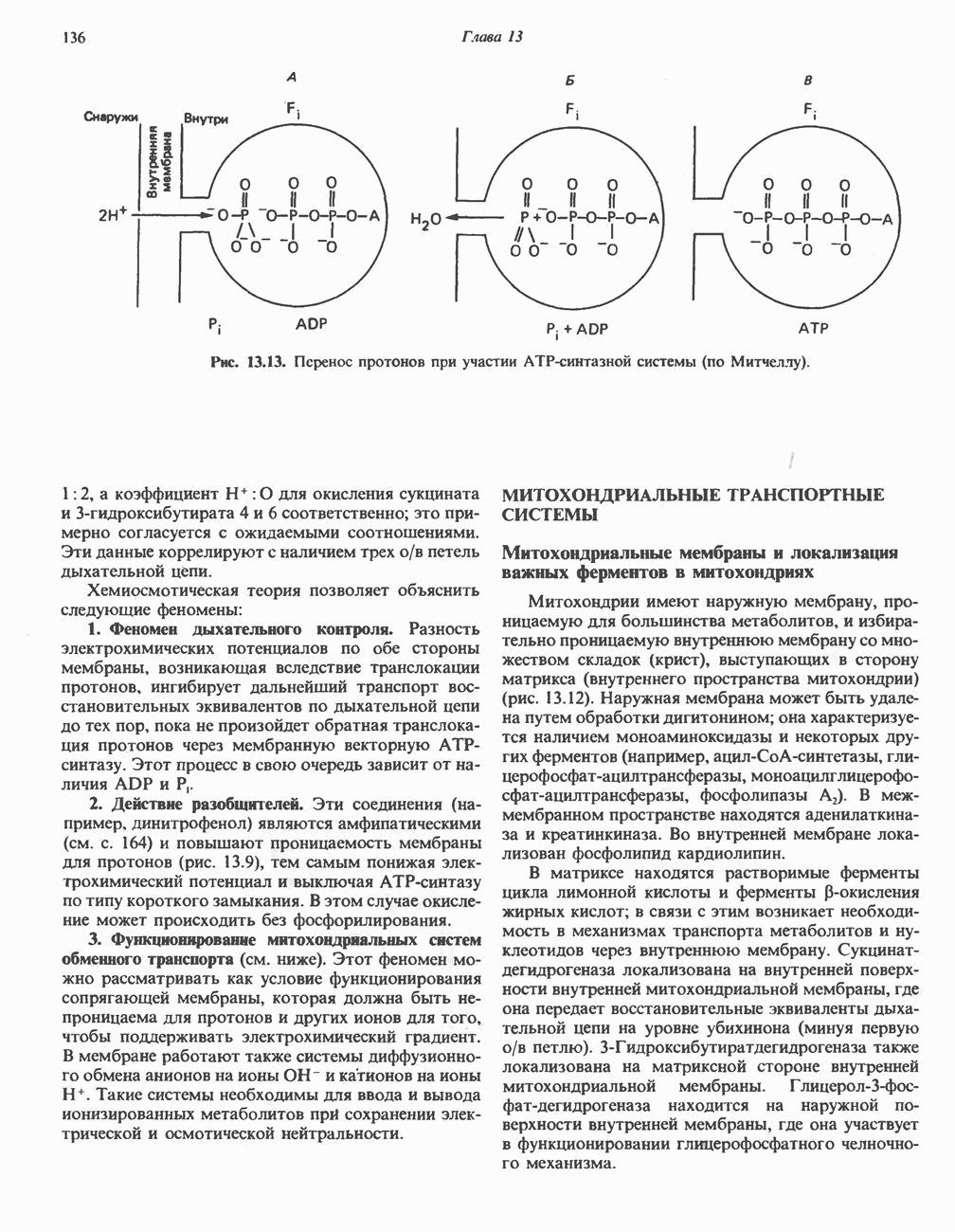
- МЕХАНИЗМ ОКИСЛИТЕЛЬНОГО ФОСФОРИЛИРОВАНИЯ
- МИТОХОНДРИАЛЬНЫЕ ТРАНСПОРТНЫЕ СИСТЕМЫ
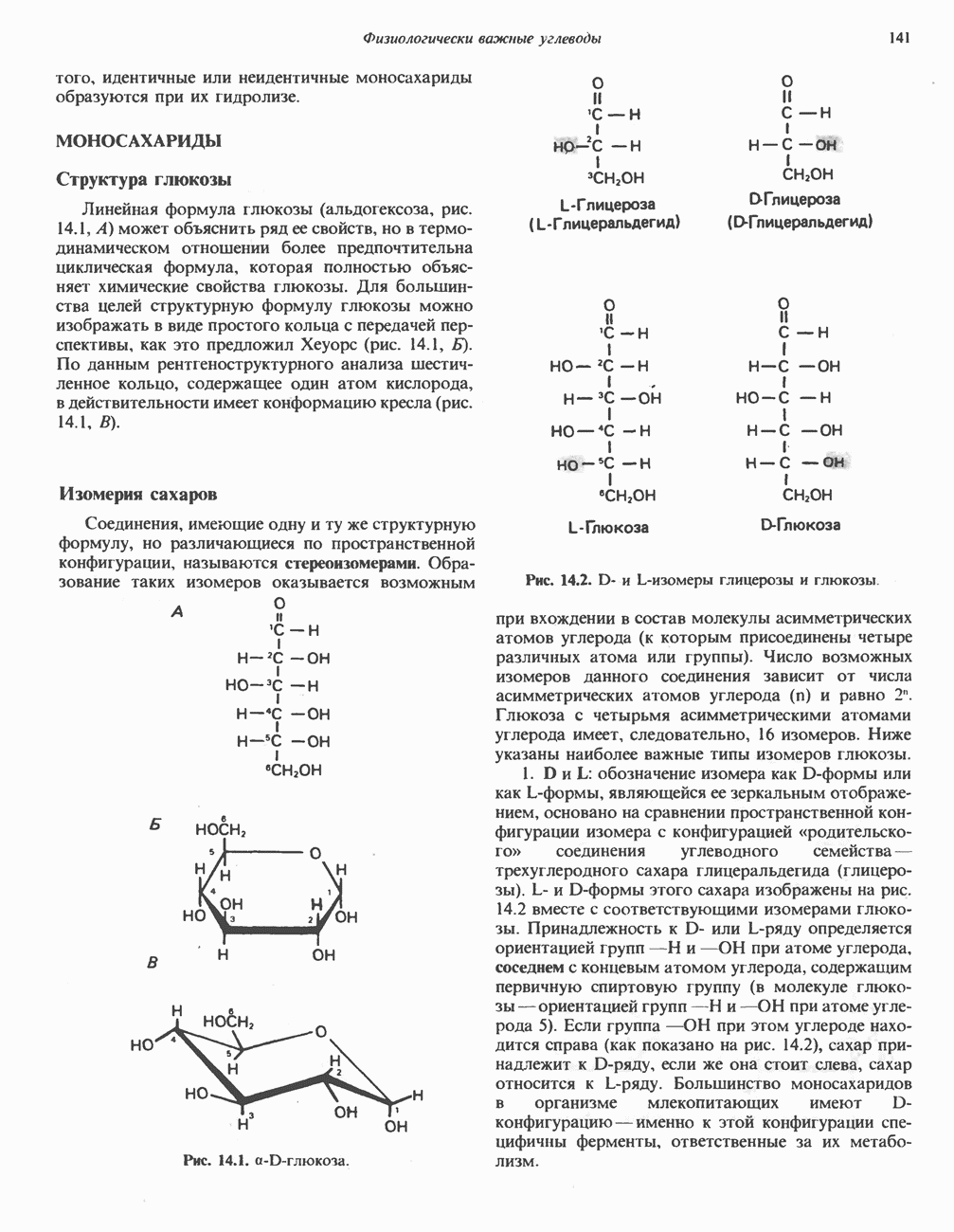
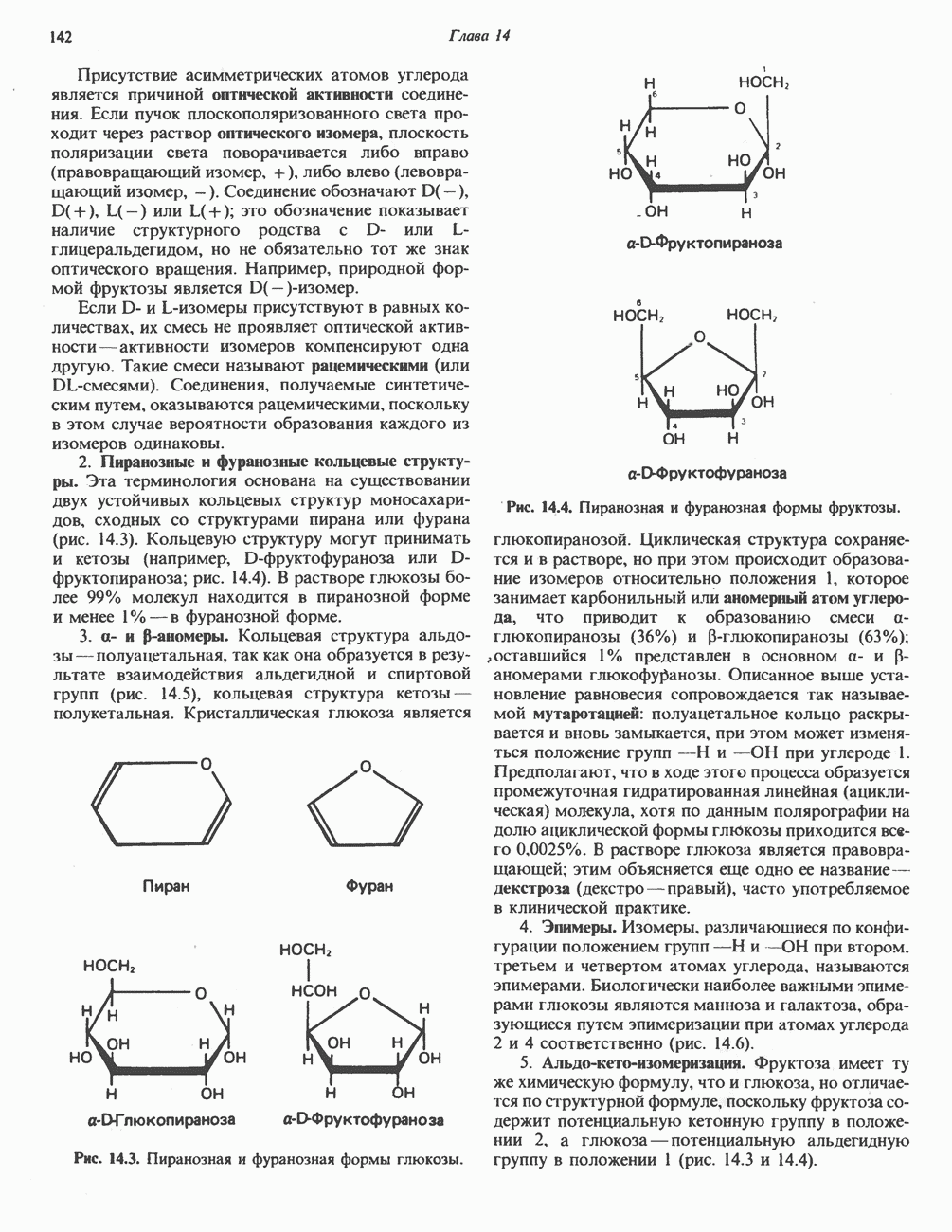
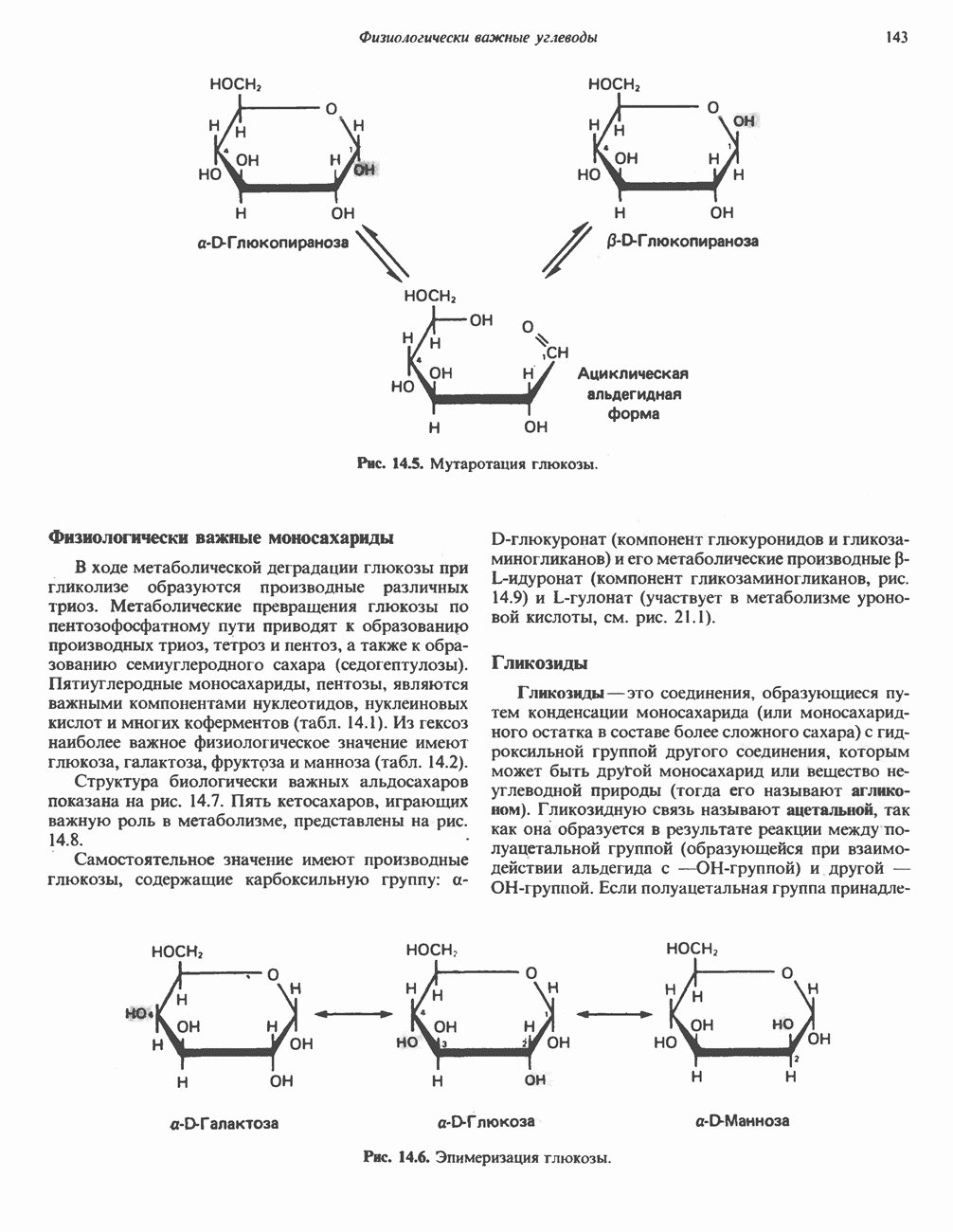
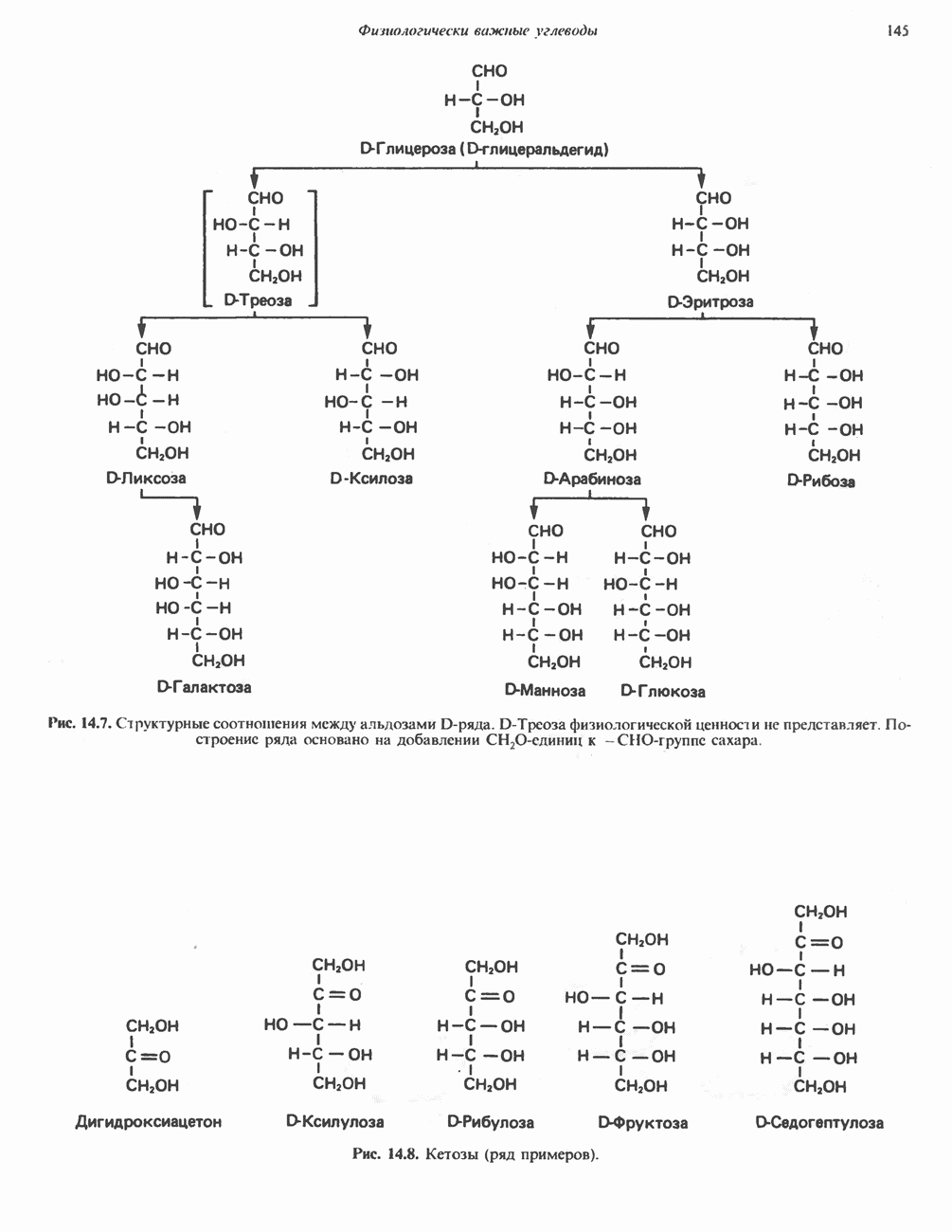
- Глава 14. Физиологически важные углеводы
- КЛАССИФИКАЦИЯ УГЛЕВОДОВ
- МОНОСАХАРИДЫ
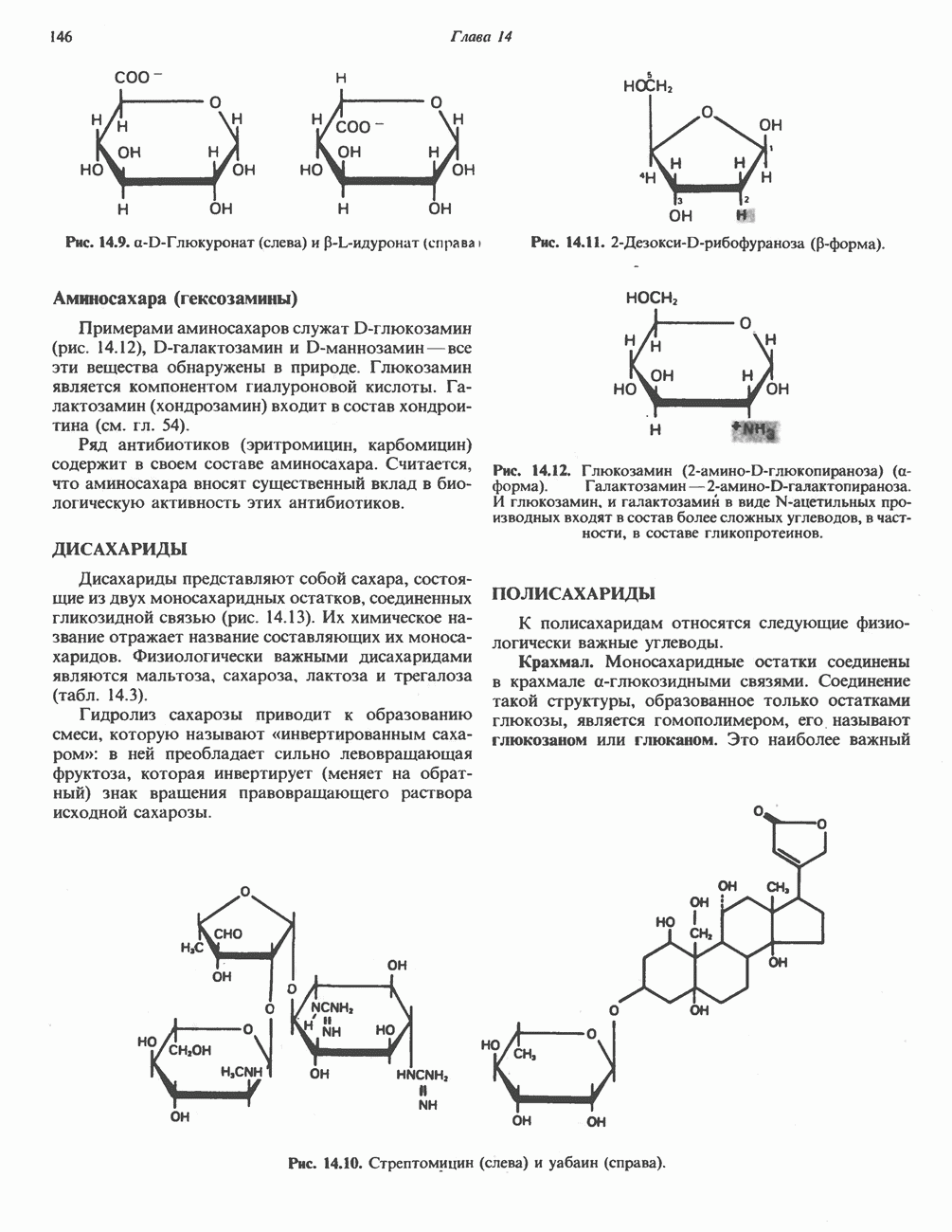
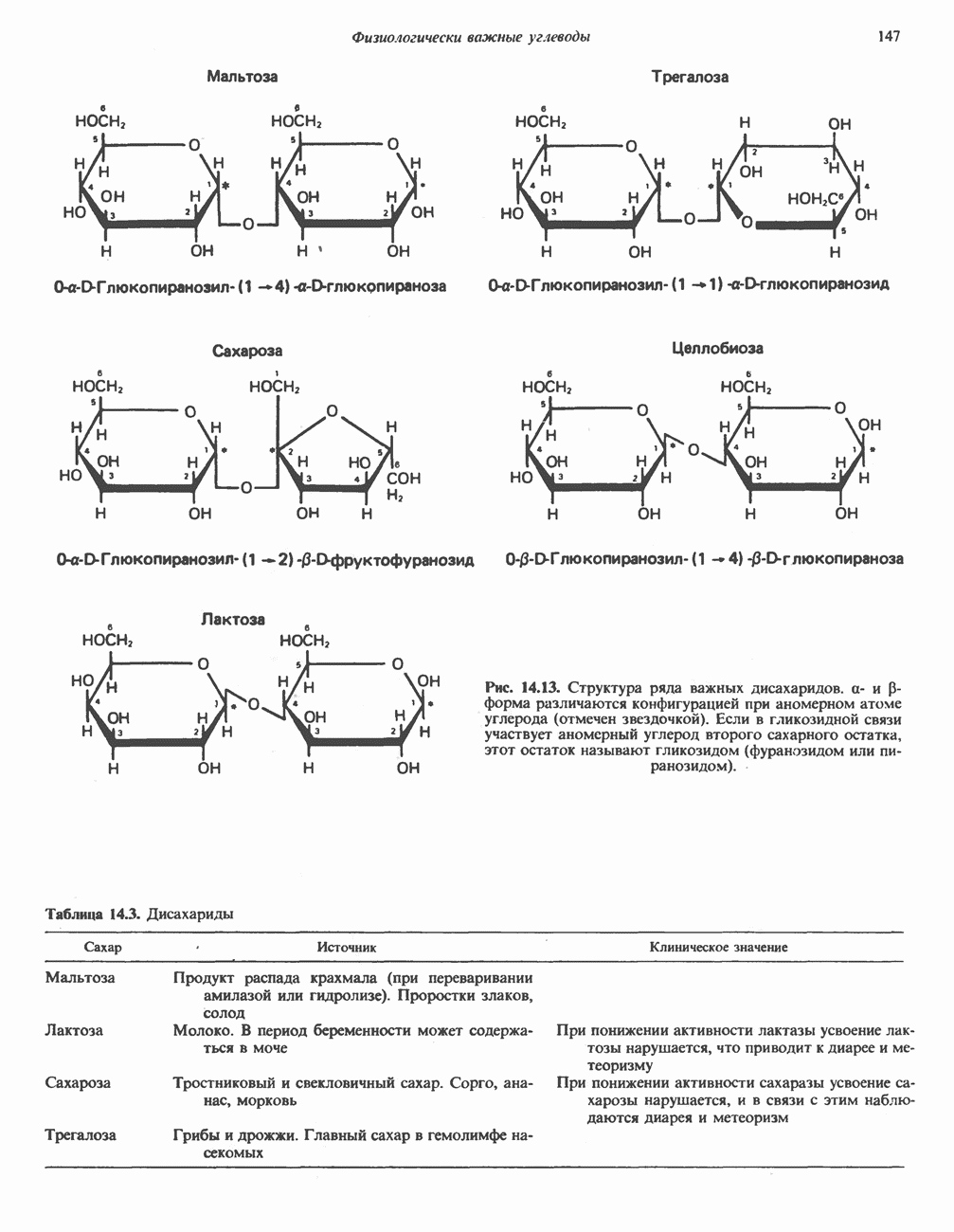
- ДИСАХАРИДЫ
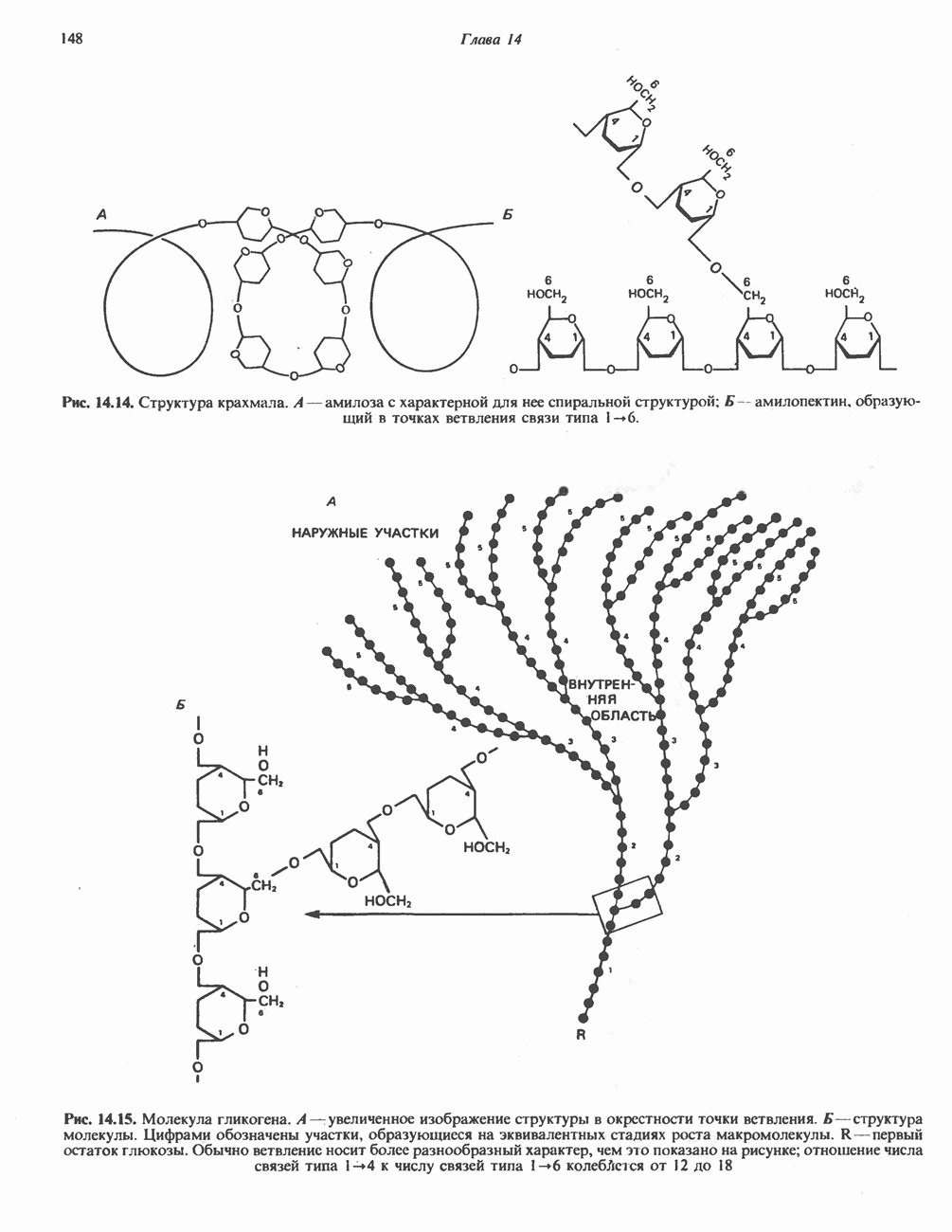
- ПОЛИСАХАРИДЫ
- УГЛЕВОДЫ КЛЕТОЧНЫХ МЕМБРАН
- Глава 15. Физиологически важные липиды
- КЛАССИФИКАЦИЯ ЛИПИДОВ
- ЖИРНЫЕ КИСЛОТЫ
- ТРИАЦИЛГЛИЦЕРОЛЫ (триглицериды)
- ФОСФОЛИПИДЫ
- ГЛИКОЛИПИДЫ (ГЛИКОСФИНГОЛИПИДЫ)
- СТЕРОИДЫ
- ПЕРЕКИСНОЕ ОКИСЛЕНИЕ ЛИПИДОВ
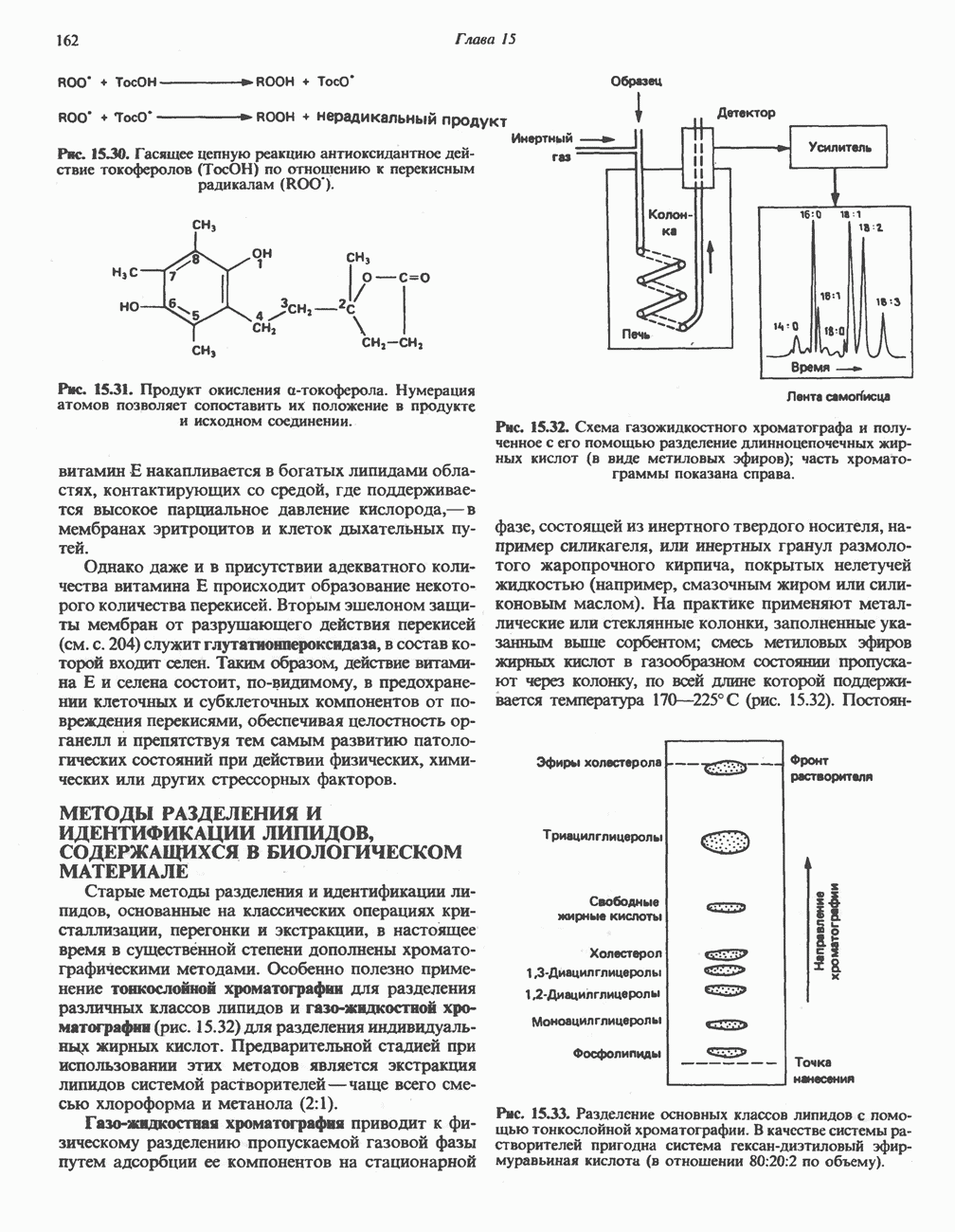
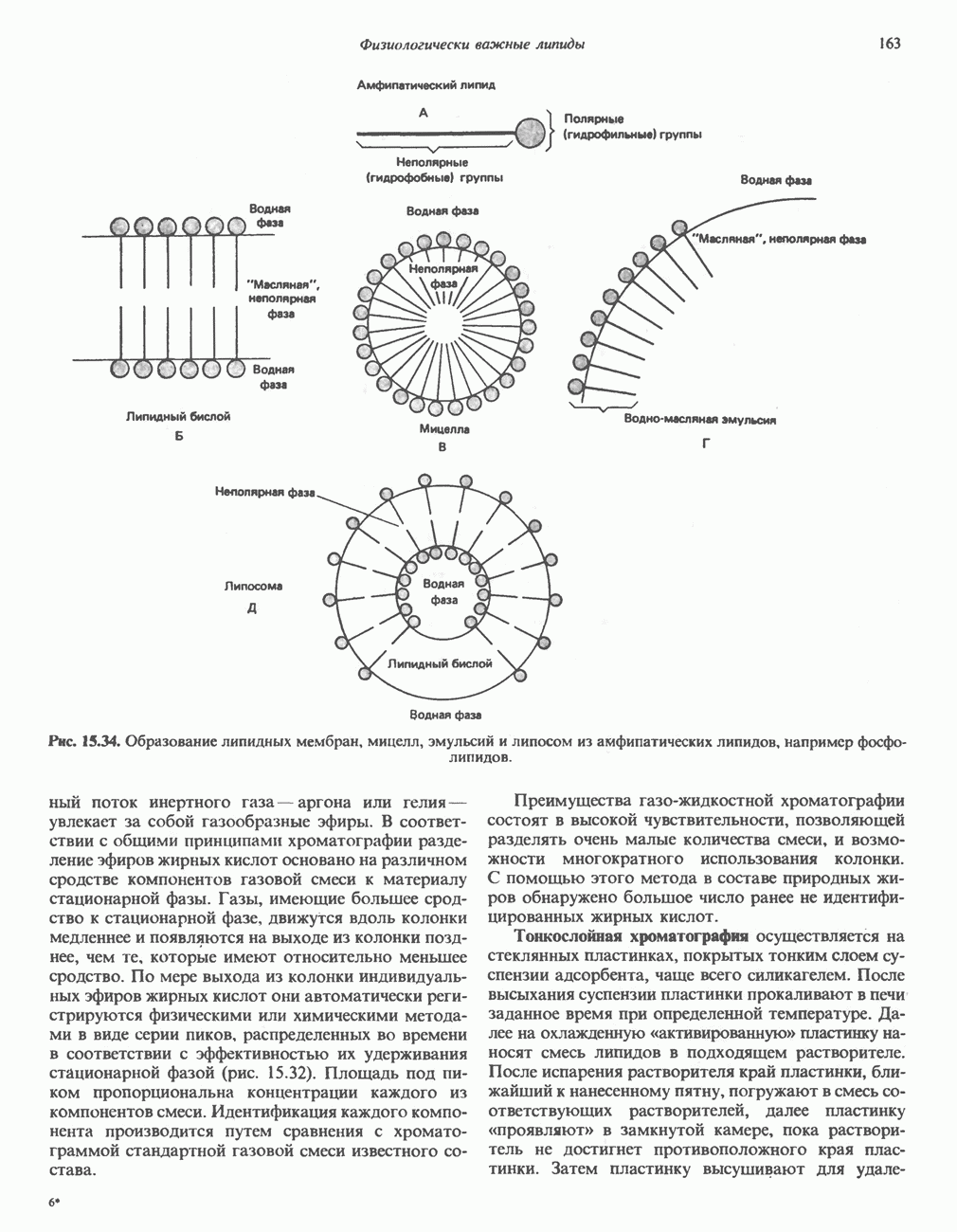
- МЕТОДЫ РАЗДЕЛЕНИЯ И ИДЕНТИФИКАЦИИ ЛИПИДОВ, СОДЕРЖАЩИХСЯ В БИОЛОГИЧЕСКОМ МАТЕРИАЛЕ
- АМФИПАТИЧЕСКИЕ ЛИПИДЫ
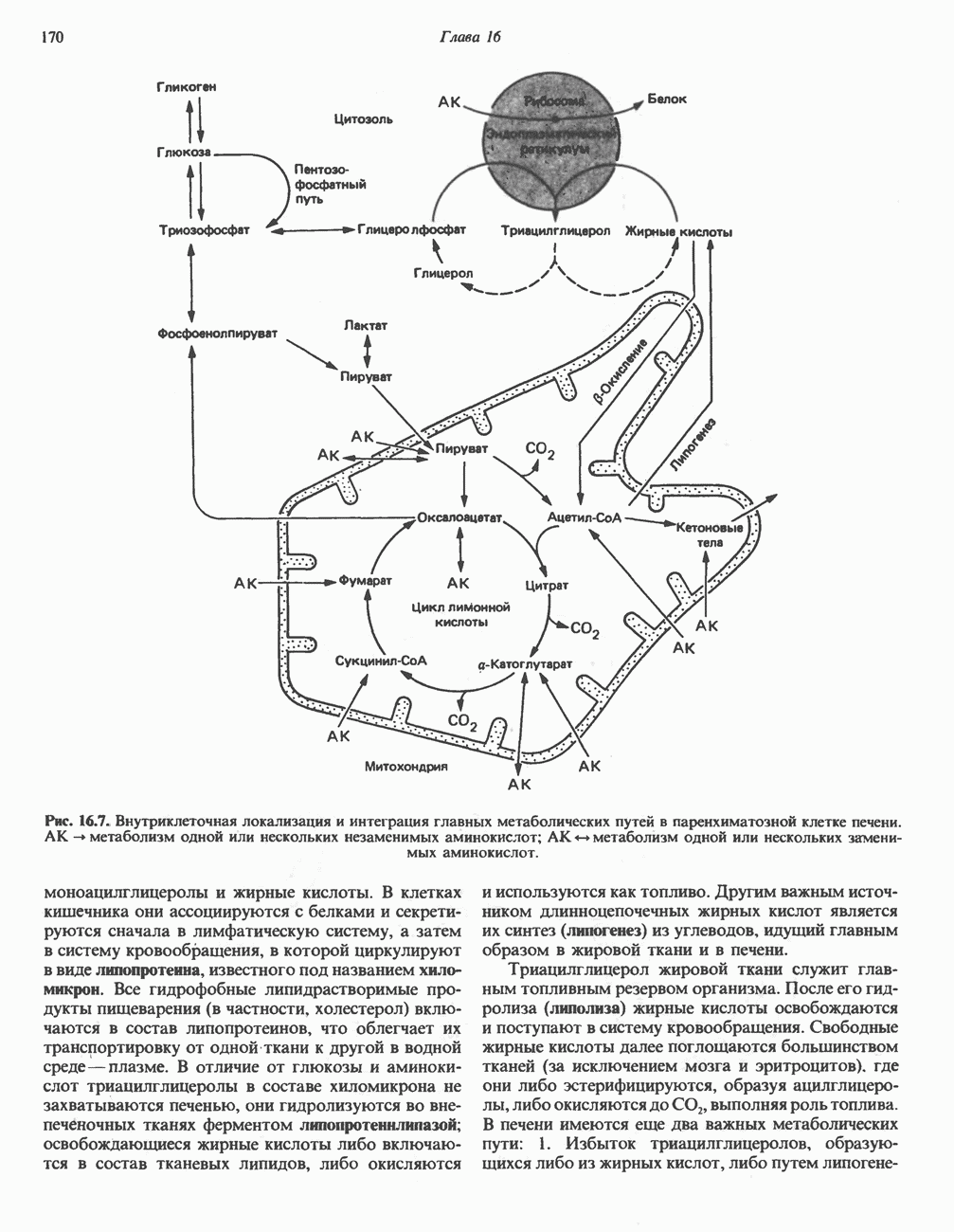
- Глава 16. Промежуточный обмен
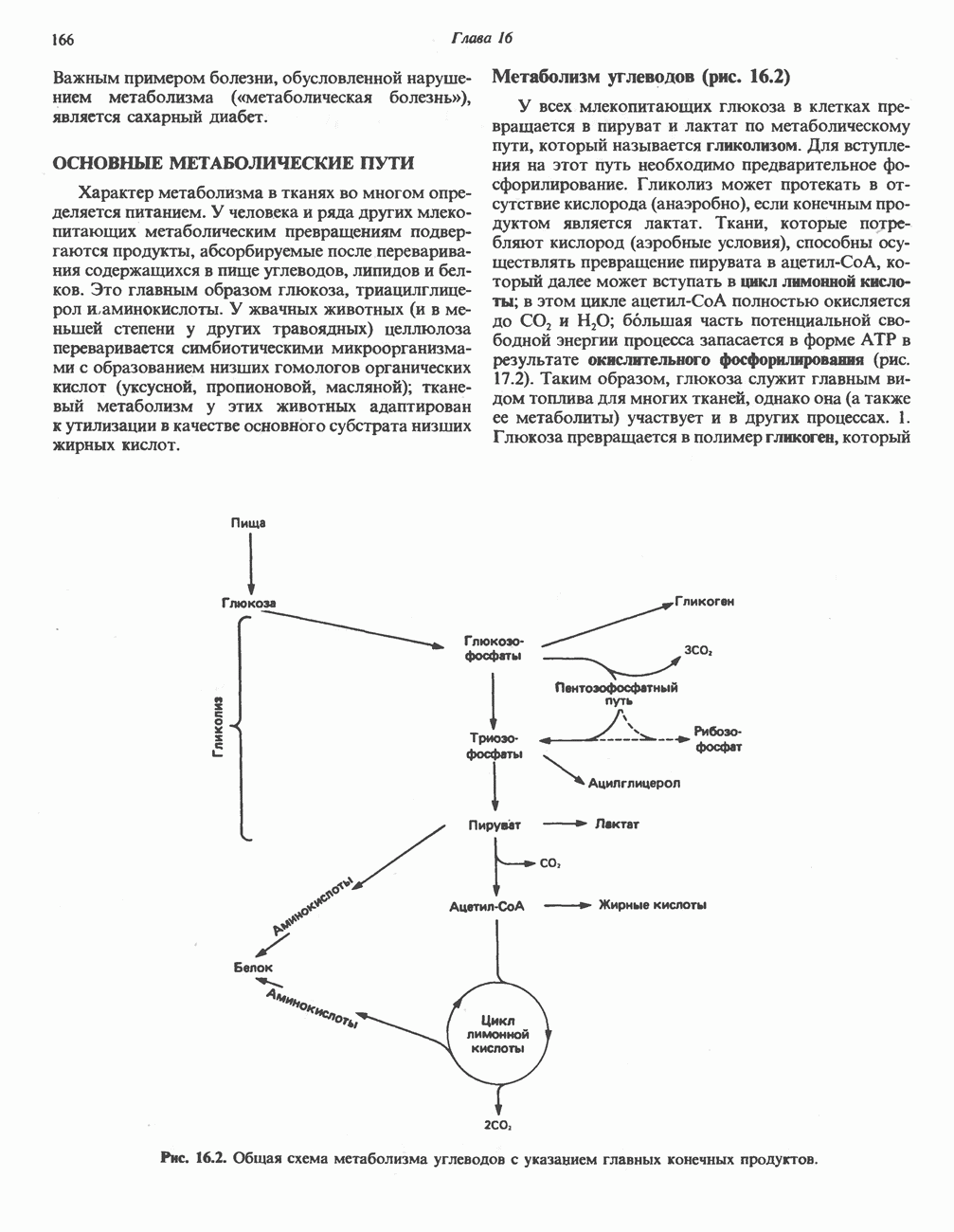
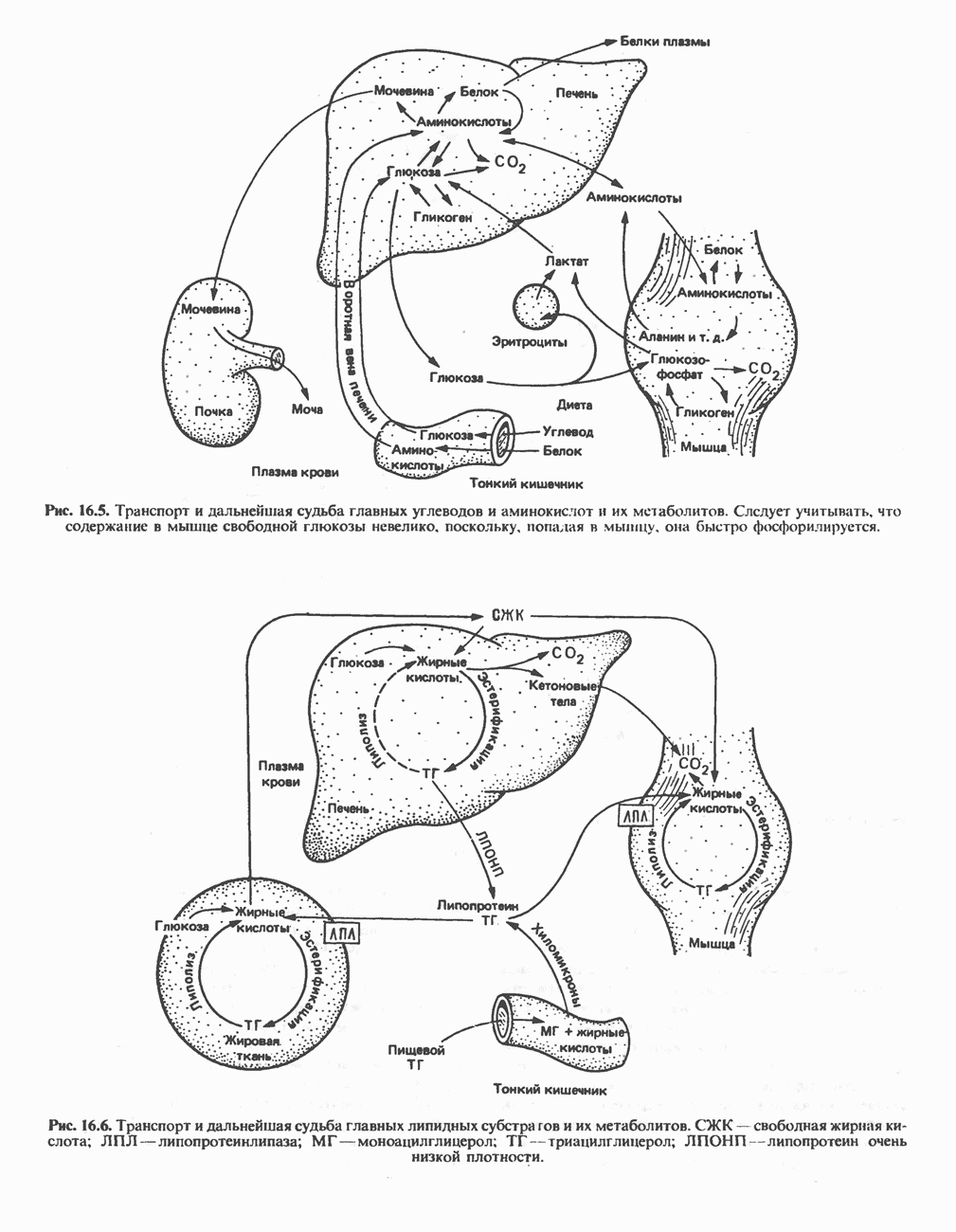
- ОСНОВНЫЕ МЕТАБОЛИЧЕСКИЕ ПУТИ
- ЛОКАЛИЗАЦИЯ МЕТАБОЛИЧЕСКИХ ПУТЕЙ
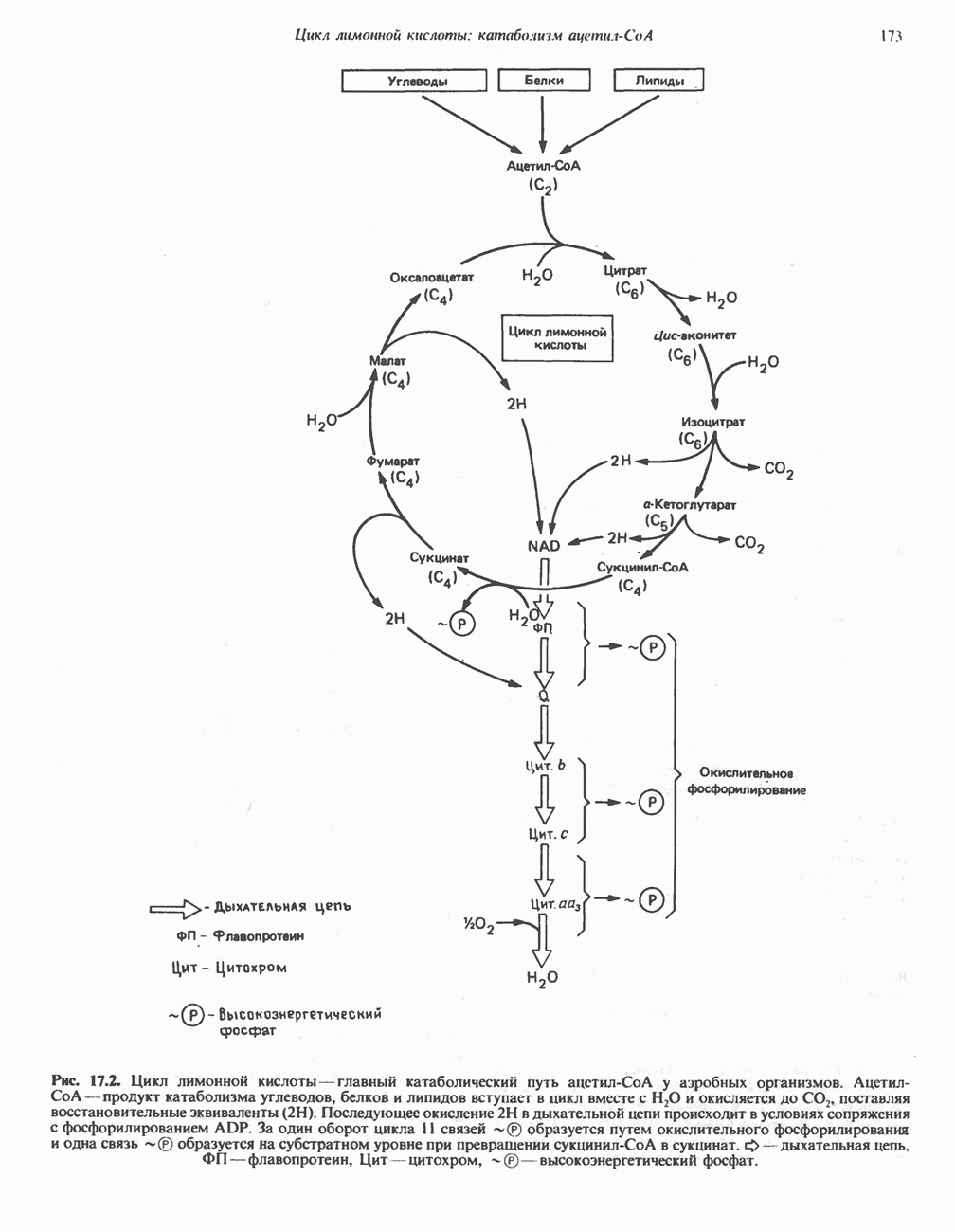
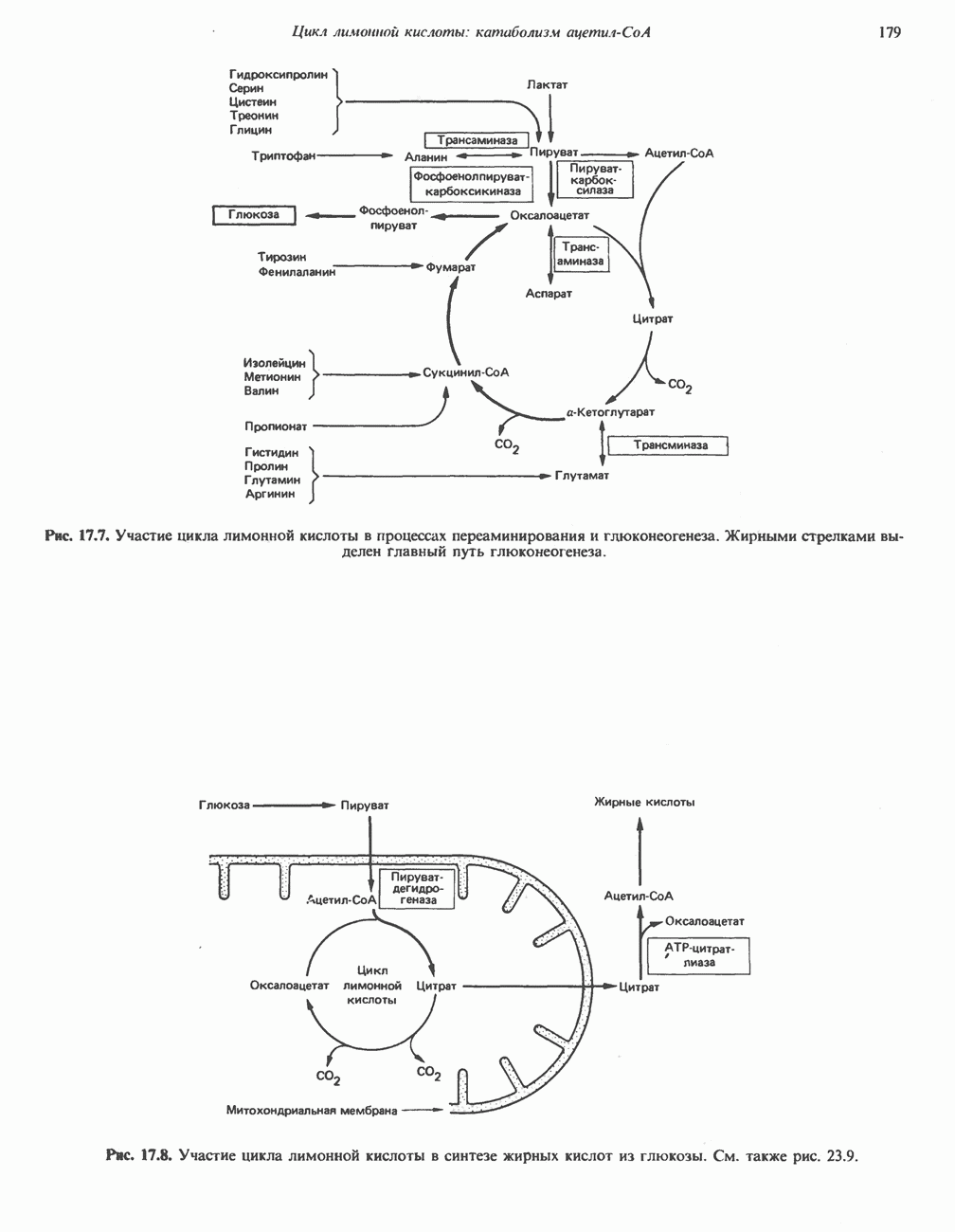
- Глава 17. Цикл лимонной кислоты: катаболизм ацетил-СоА
- КАТАБОЛИЧЕСКАЯ РОЛЬ ЦИКЛА ЛИМОННОЙ КИСЛОТЫ
- РЕАКЦИИ ЦИКЛА ЛИМОННОЙ КИСЛОТЫ (рис. 17.3)
- ЭНЕРГЕТИКА ЦИКЛА ЛИМОННОЙ КИСЛОТЫ
- РОЛЬ ВИТАМИНОВ В ЦИКЛЕ ЛИМОННОЙ КИСЛОТЫ
- АМФИБОЛИЧЕСКАЯ РОЛЬ ЦИКЛА ЛИМОННОЙ КИСЛОТЫ
- Глава 18. Гликолиз и окисление пирувата
- ГЛИКОЛИТИЧЕСКИЙ ПУТЬ
- ПОСЛЕДОВАТЕЛЬНЫЕ СТАДИИ ГЛИКОЛИЗА
- ОКИСЛЕНИЕ ПИРУВАТА В АЦЕТИЛ-СоА
- Глава 19. Метаболизм гликогена
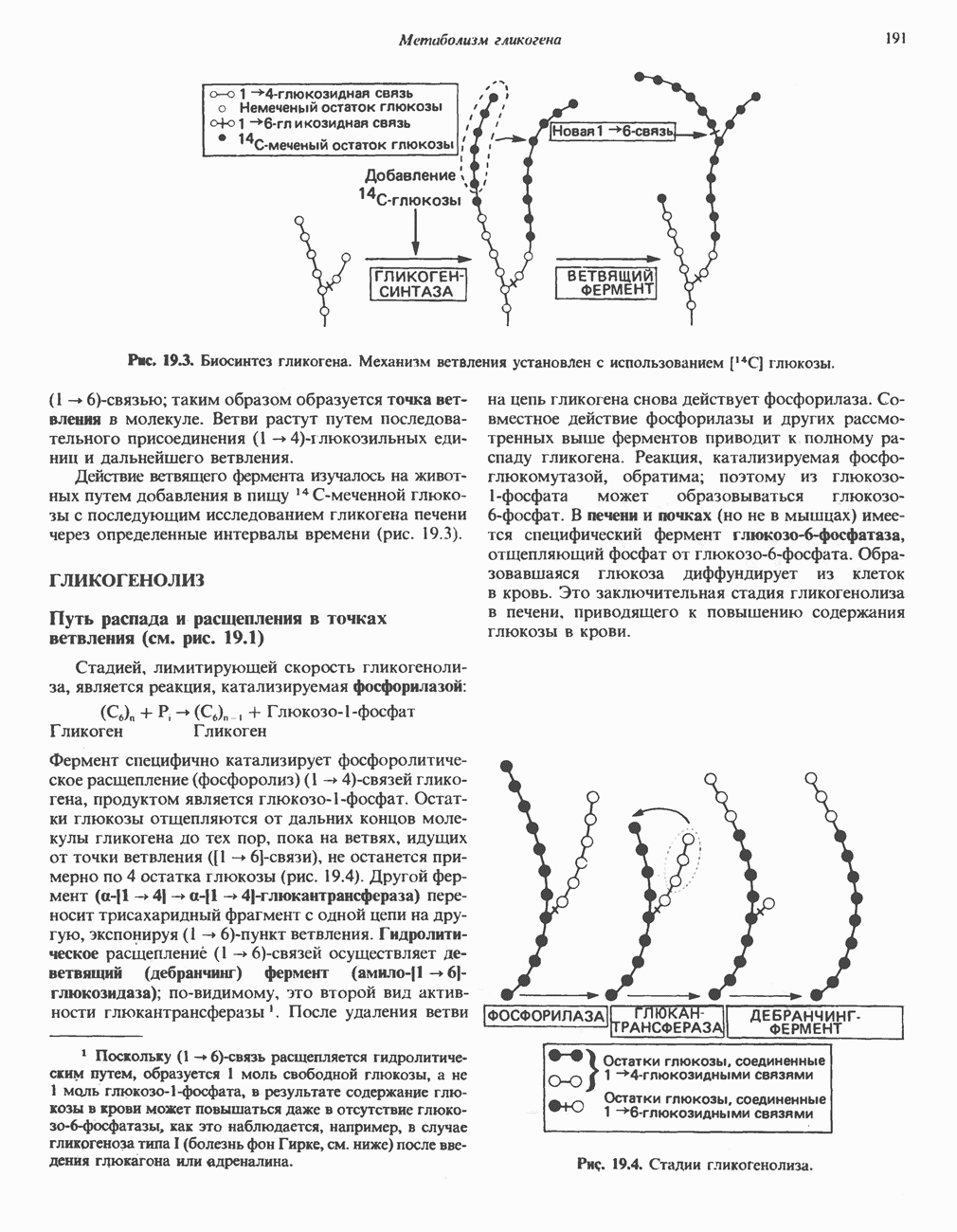
- ГЛИКОГЕНЕЗ
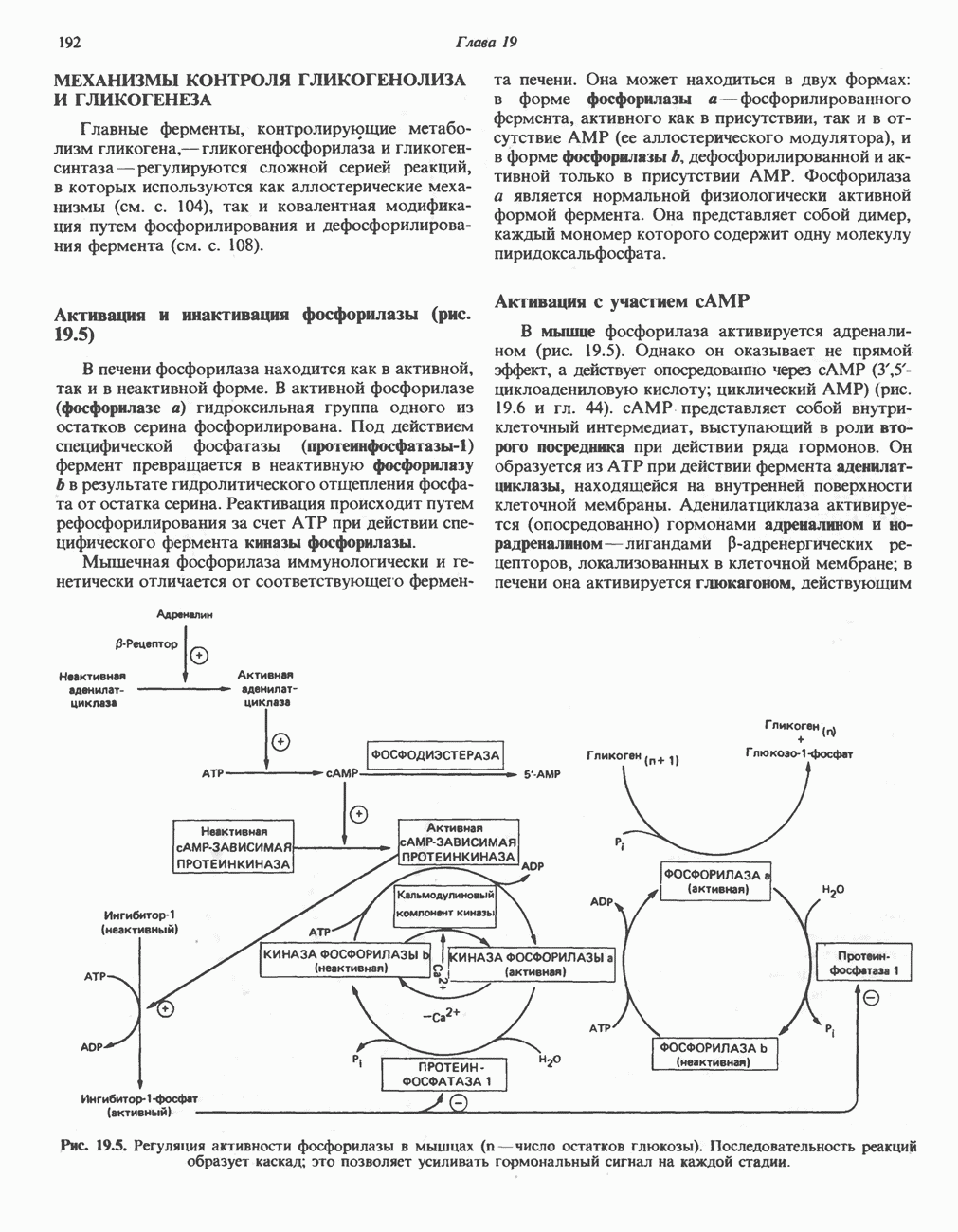
- ГЛИКОГЕНОЛИЗ
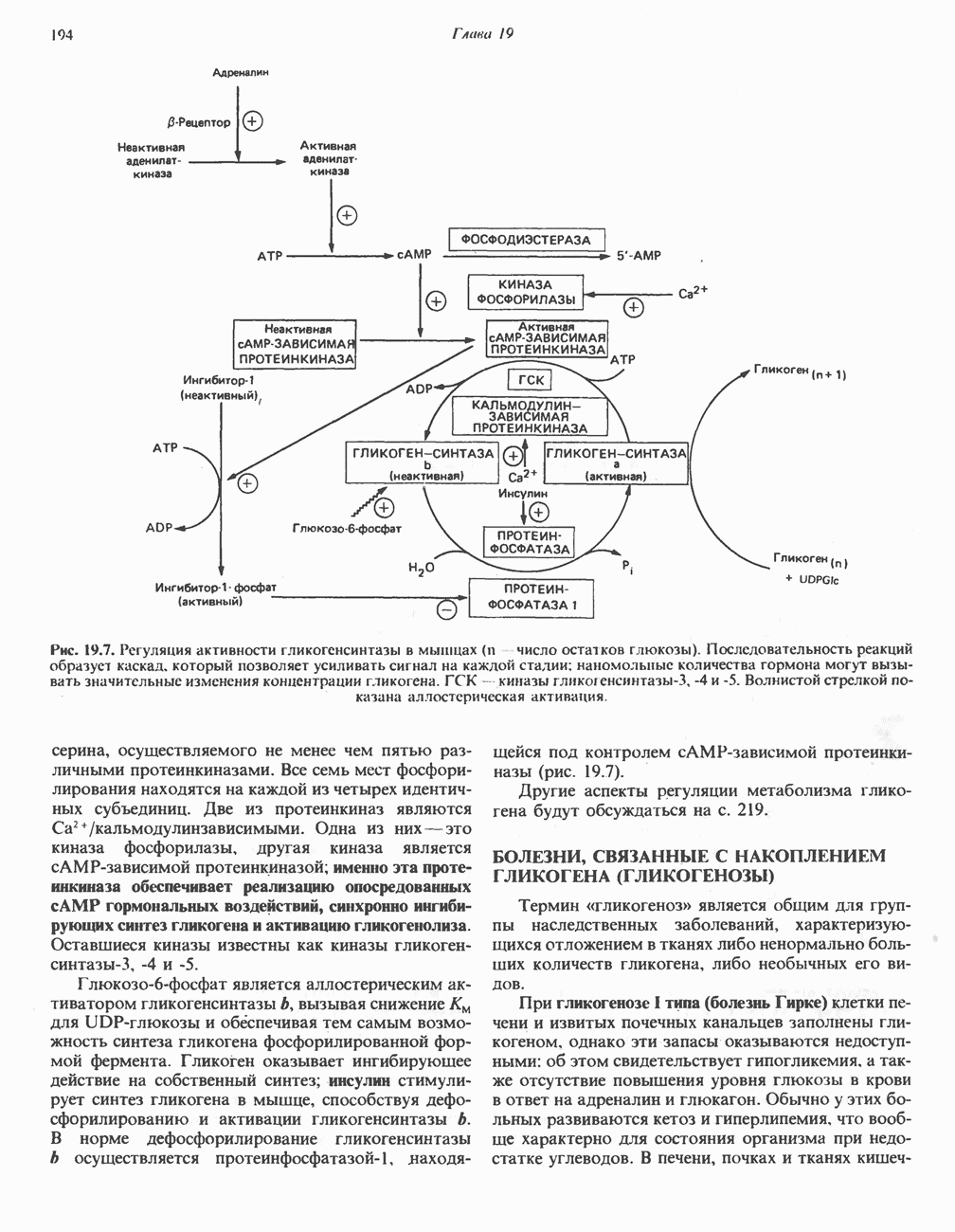
- МЕХАНИЗМЫ КОНТРОЛЯ ГЛИКОГЕНОЛИЗА И ГЛИКОГЕНЕЗА
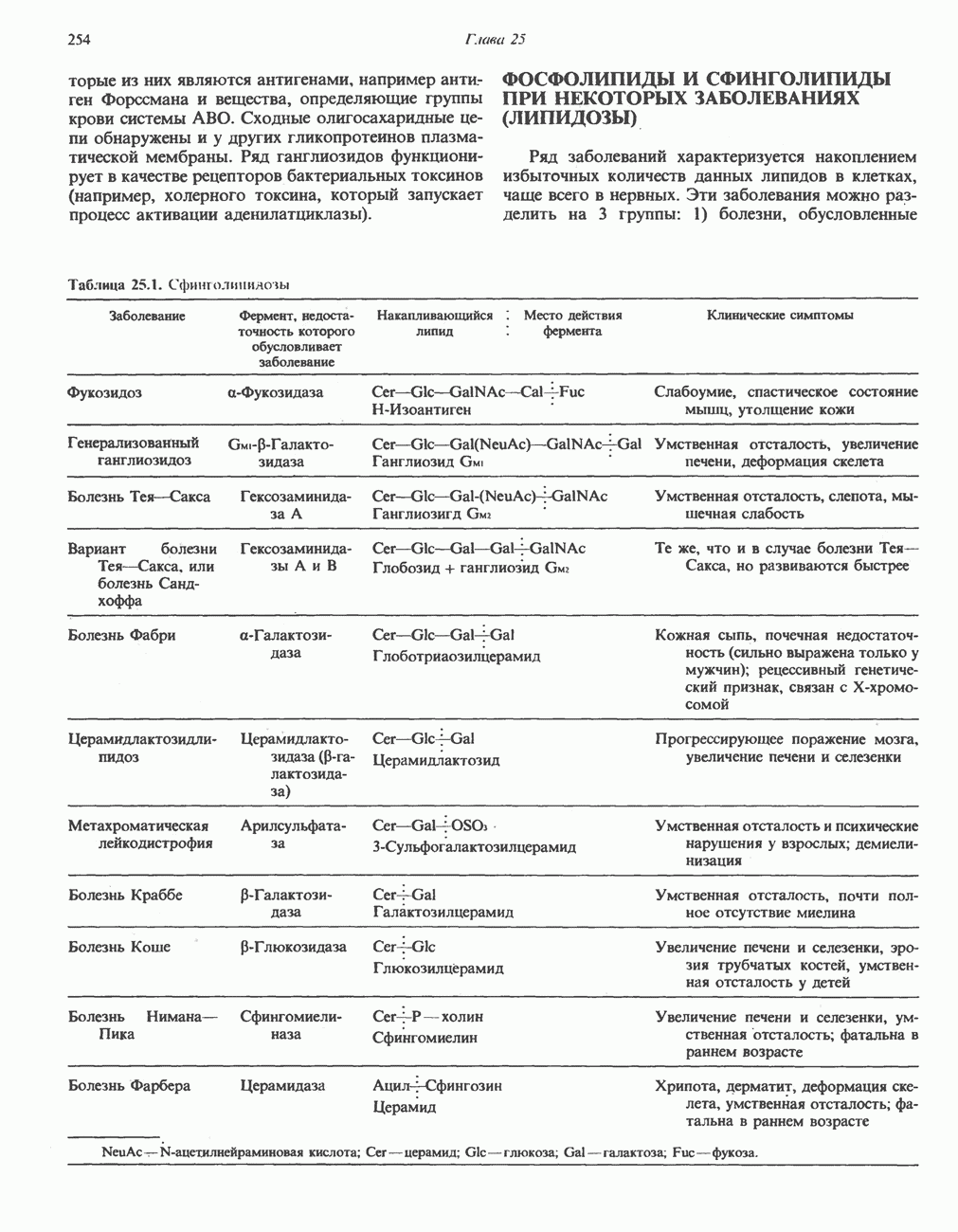
- БОЛЕЗНИ, СВЯЗАННЫЕ С НАКОПЛЕНИЕМ ГЛИКОГЕНА (ГЛИКОГЕНОЗЫ)
- Глава 20. Глюконеогенез и пентозофосфатный путь
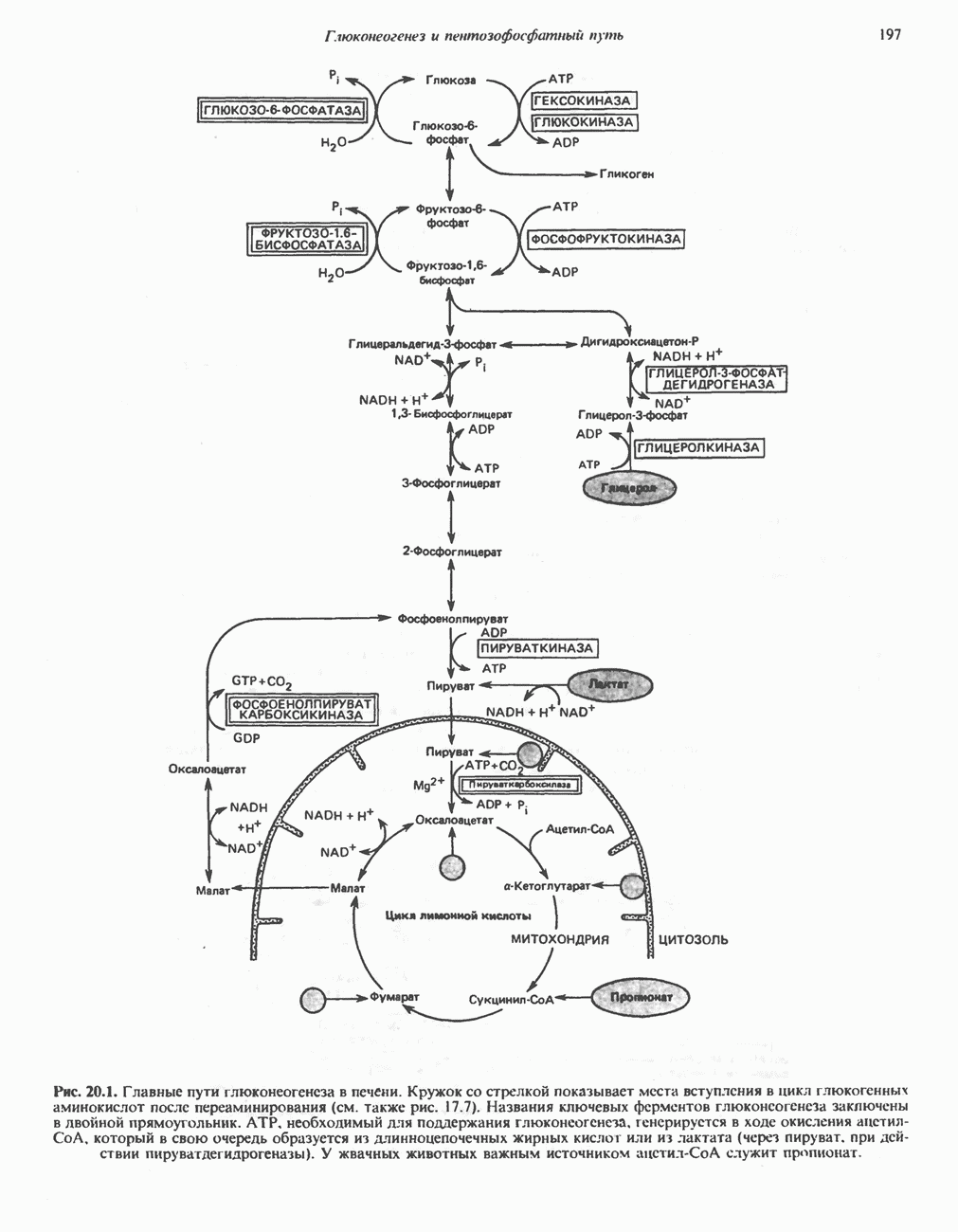
- МЕТАБОЛИЧЕСКИЕ ПУТИ, УЧАСТВУЮЩИЕ В ГЛЮКОНЕОГЕНЕЗЕ (рис. 20.1)
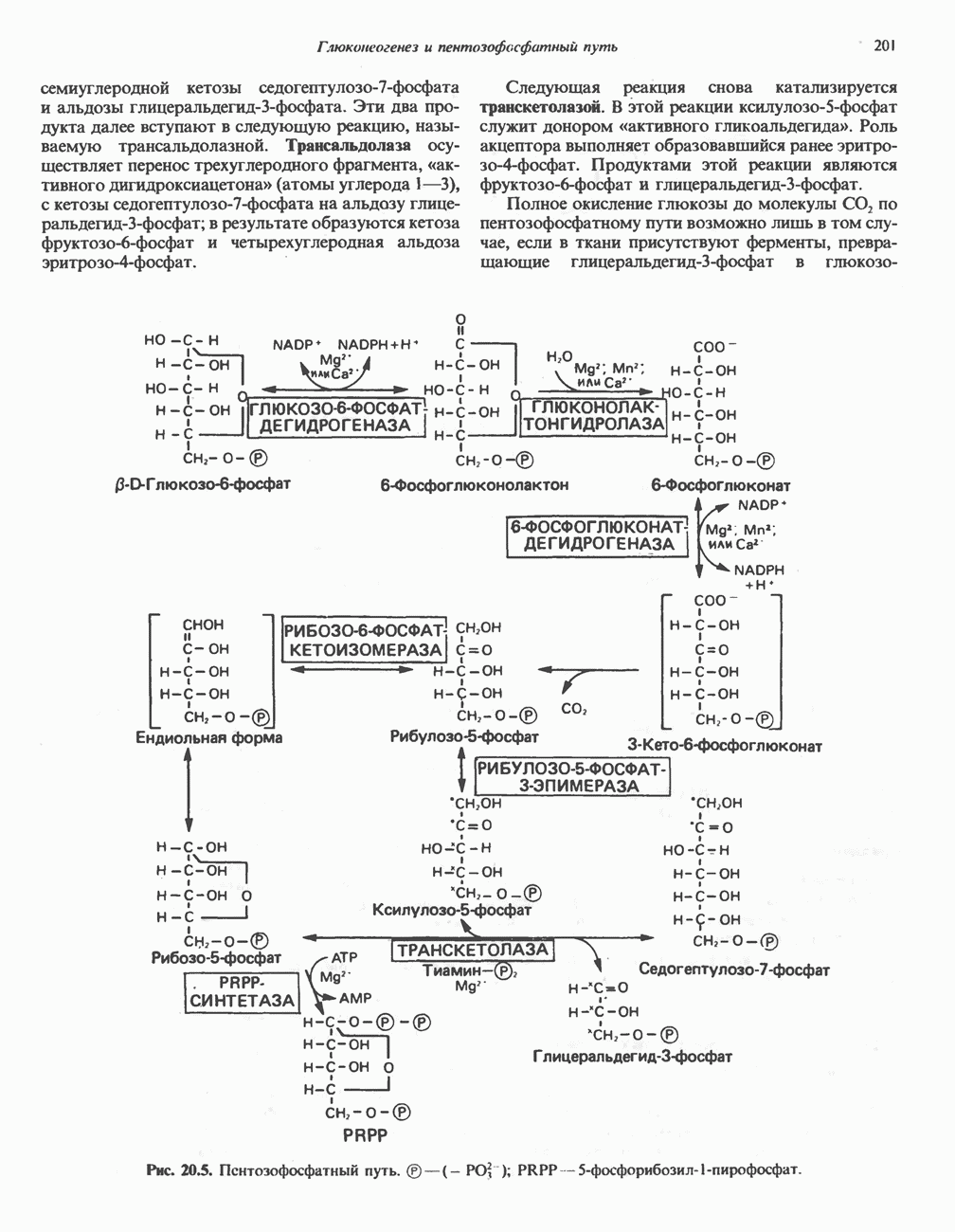
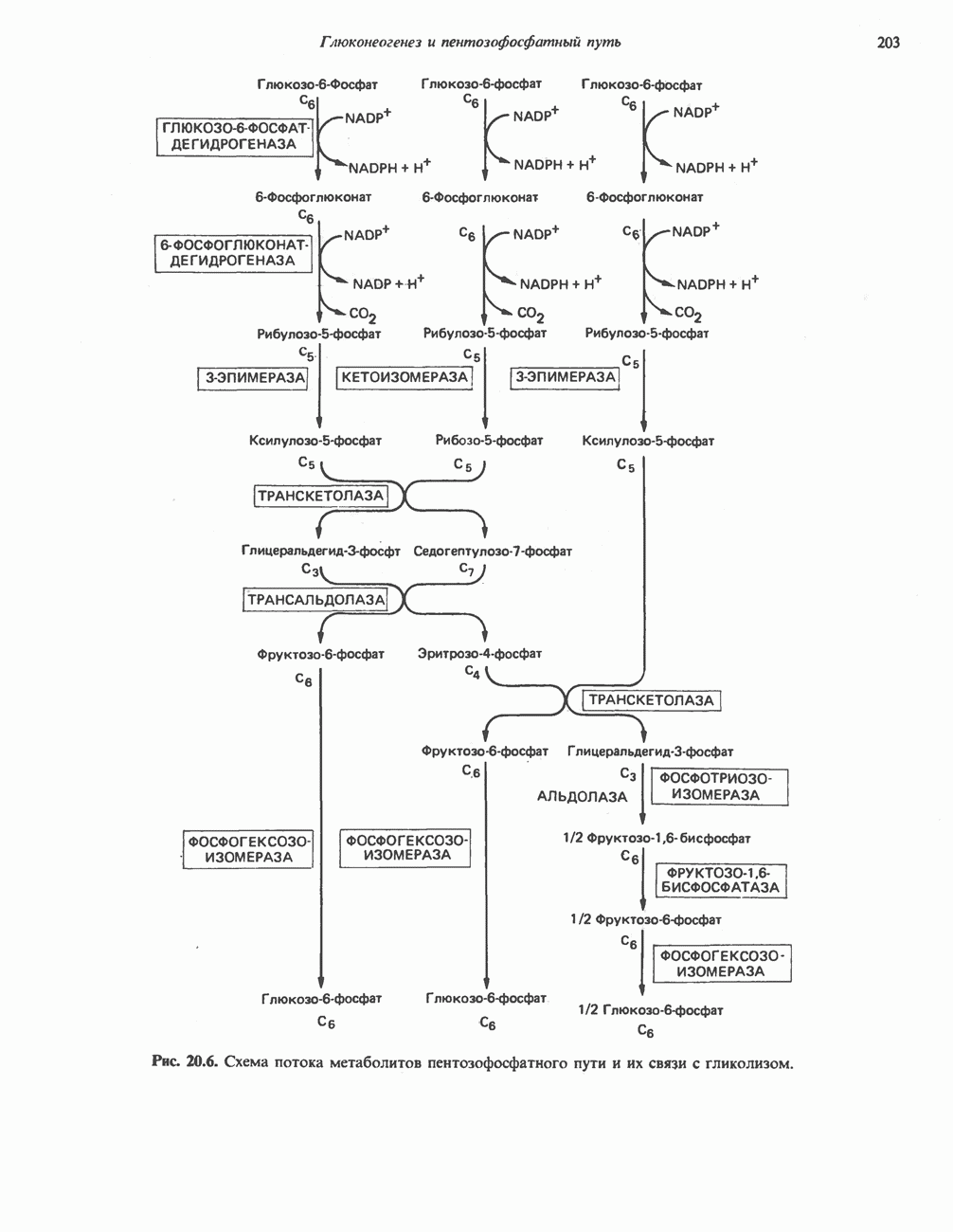
- ПЕНТОЗОФОСФАТНЫЙ ПУТЬ ИЛИ ГЕКСОЗОМОНОФОСФАТНЫЙ ШУНТ
- ПОСЛЕДОВАТЕЛЬНОСТЬ РЕАКЦИЙ
- МЕТАБОЛИЧЕСКОЕ ЗНАЧЕНИЕ ПЕНТОЗОФОСФАТНОГО ПУТИ
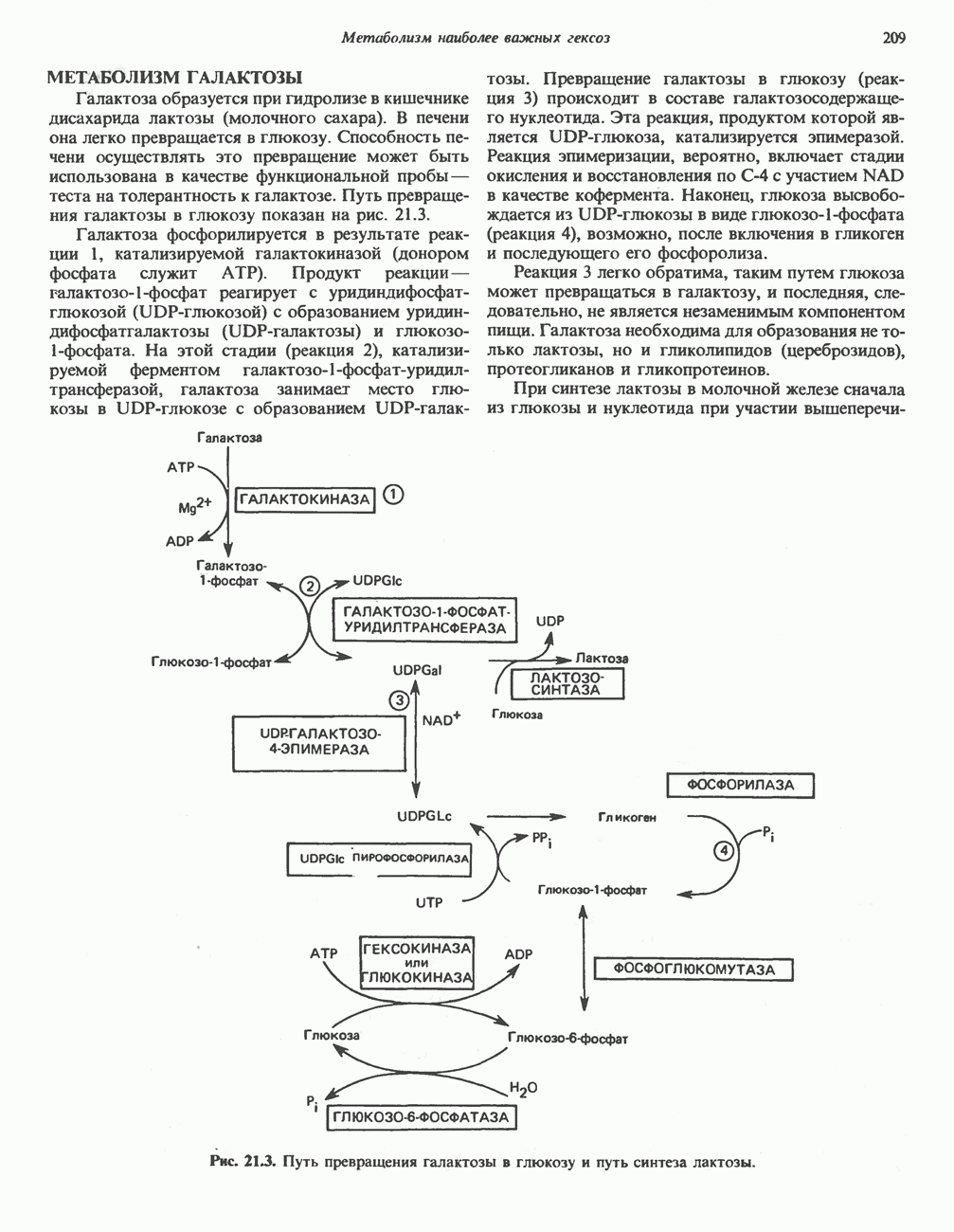
- КЛИНИЧЕСКИЕ АСПЕКТЫ
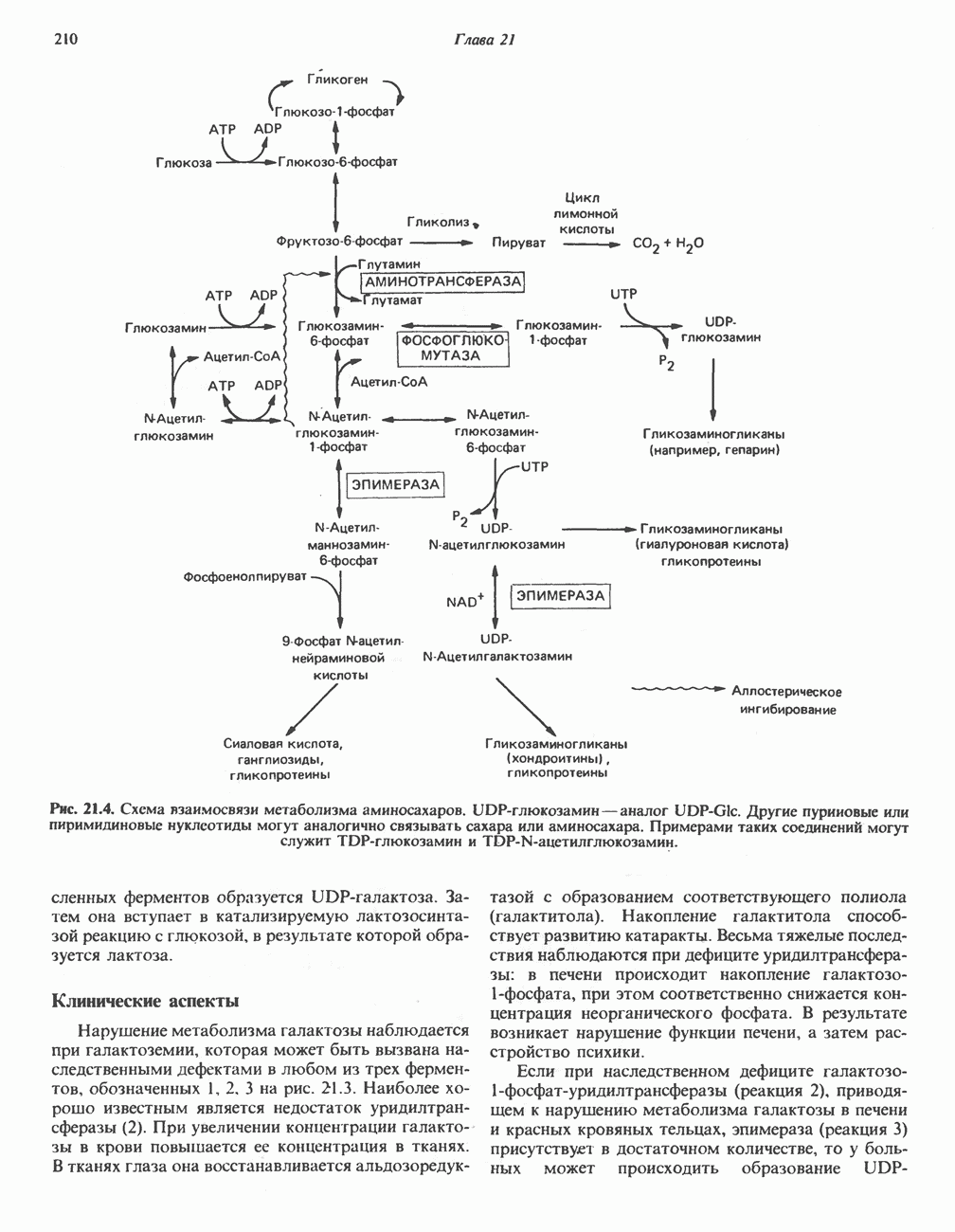
- Глава 21. Метаболизм наиболее важных гексоз
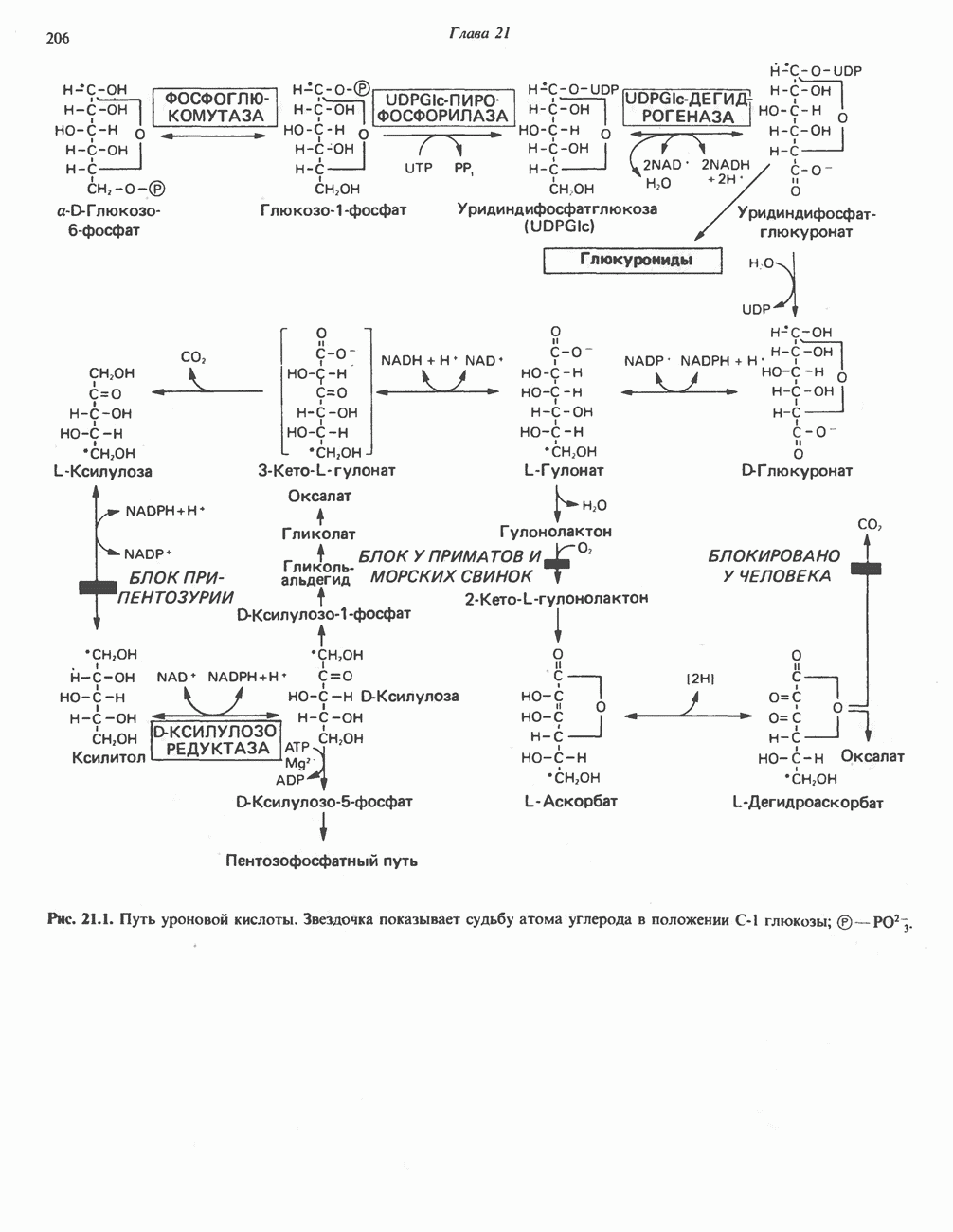
- ПУТЬ УРОНОВЫХ КИСЛОТ
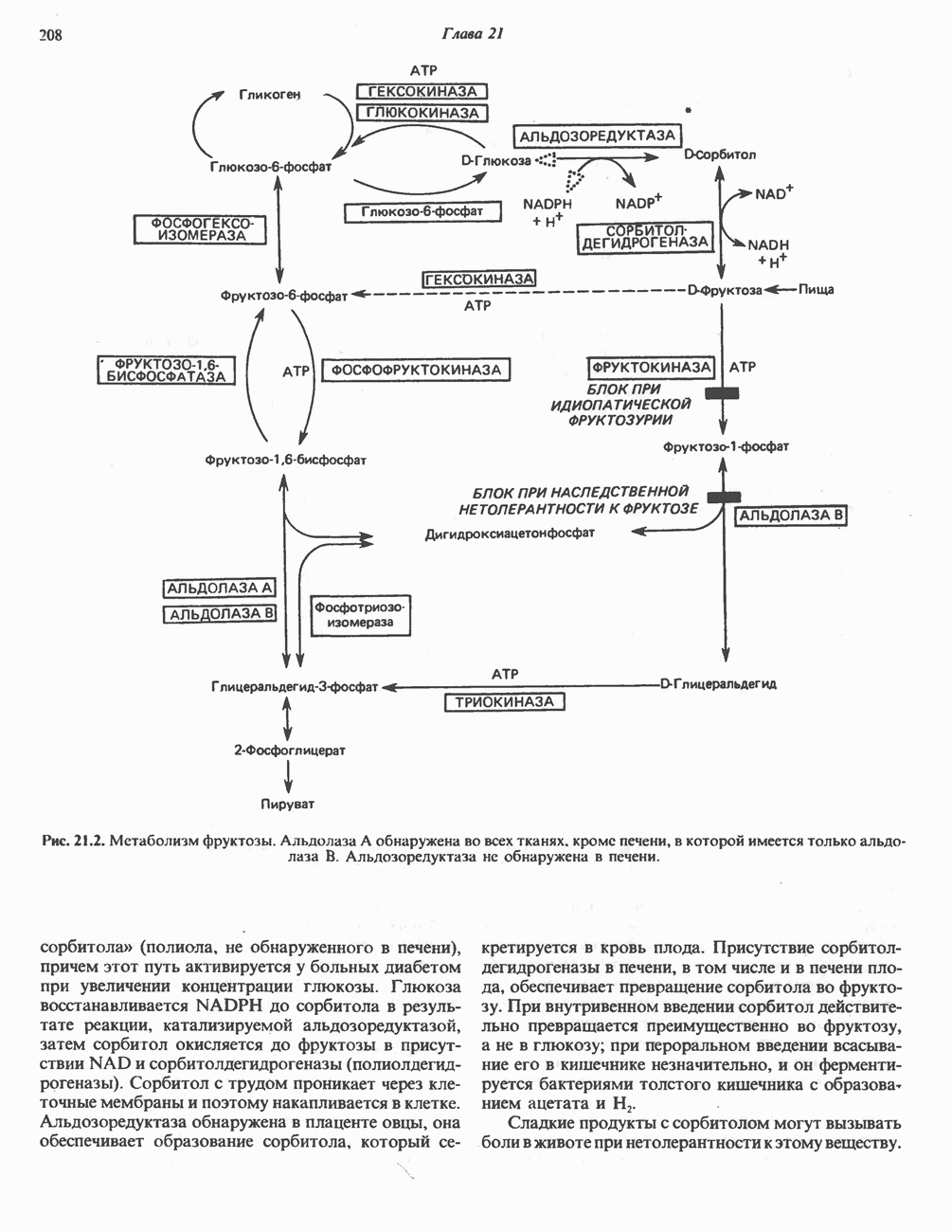
- МЕТАБОЛИЗМ ФРУКТОЗЫ
- МЕТАБОЛИЗМ ГАЛАКТОЗЫ
- Глава 22. Регуляция метаболизма углеводов
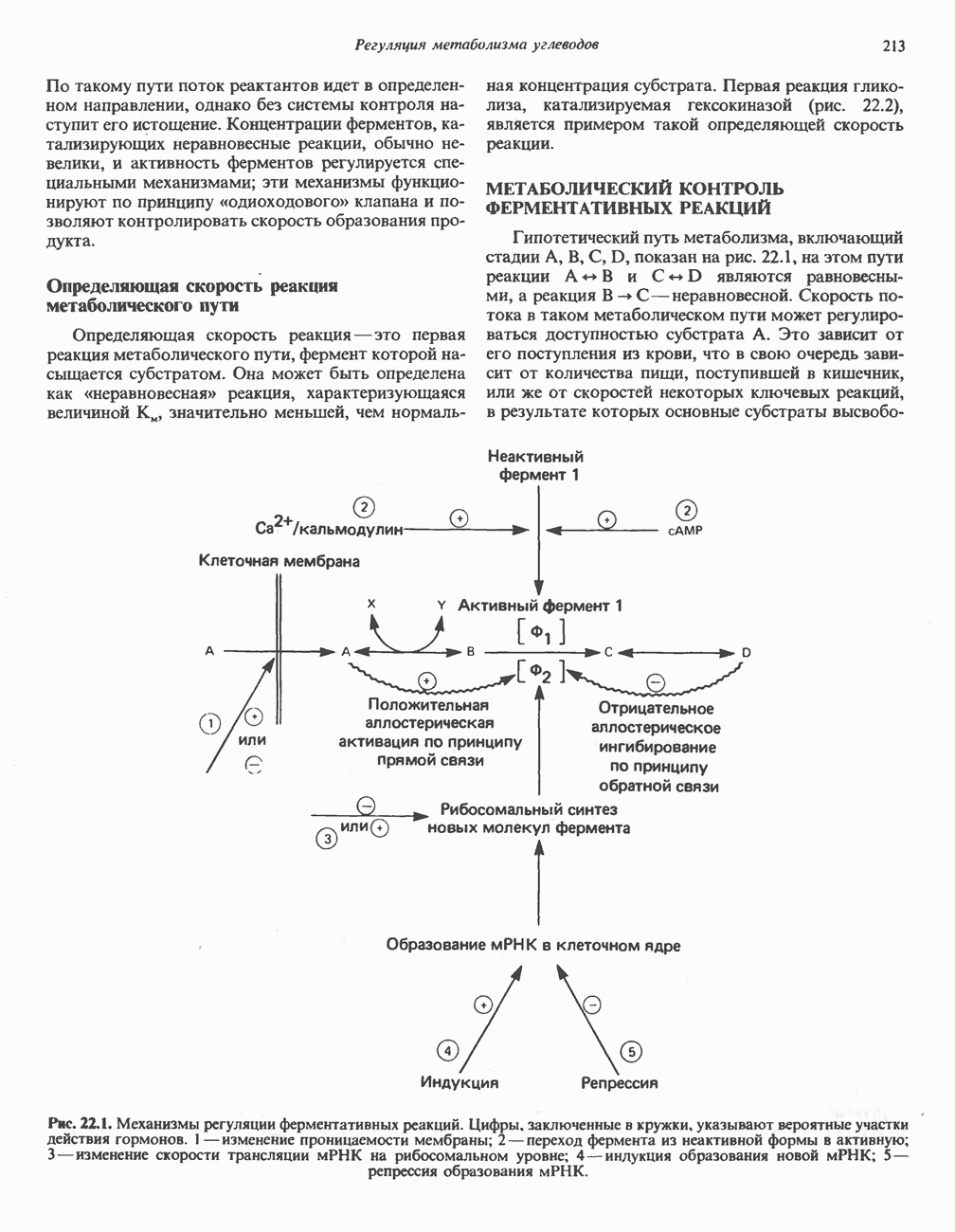
- ОБЩИЕ ПРИНЦИПЫ РЕГУЛЯЦИИ ПУТЕЙ МЕТАБОЛИЗМА
- МЕТАБОЛИЧЕСКИЙ КОНТРОЛЬ ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ
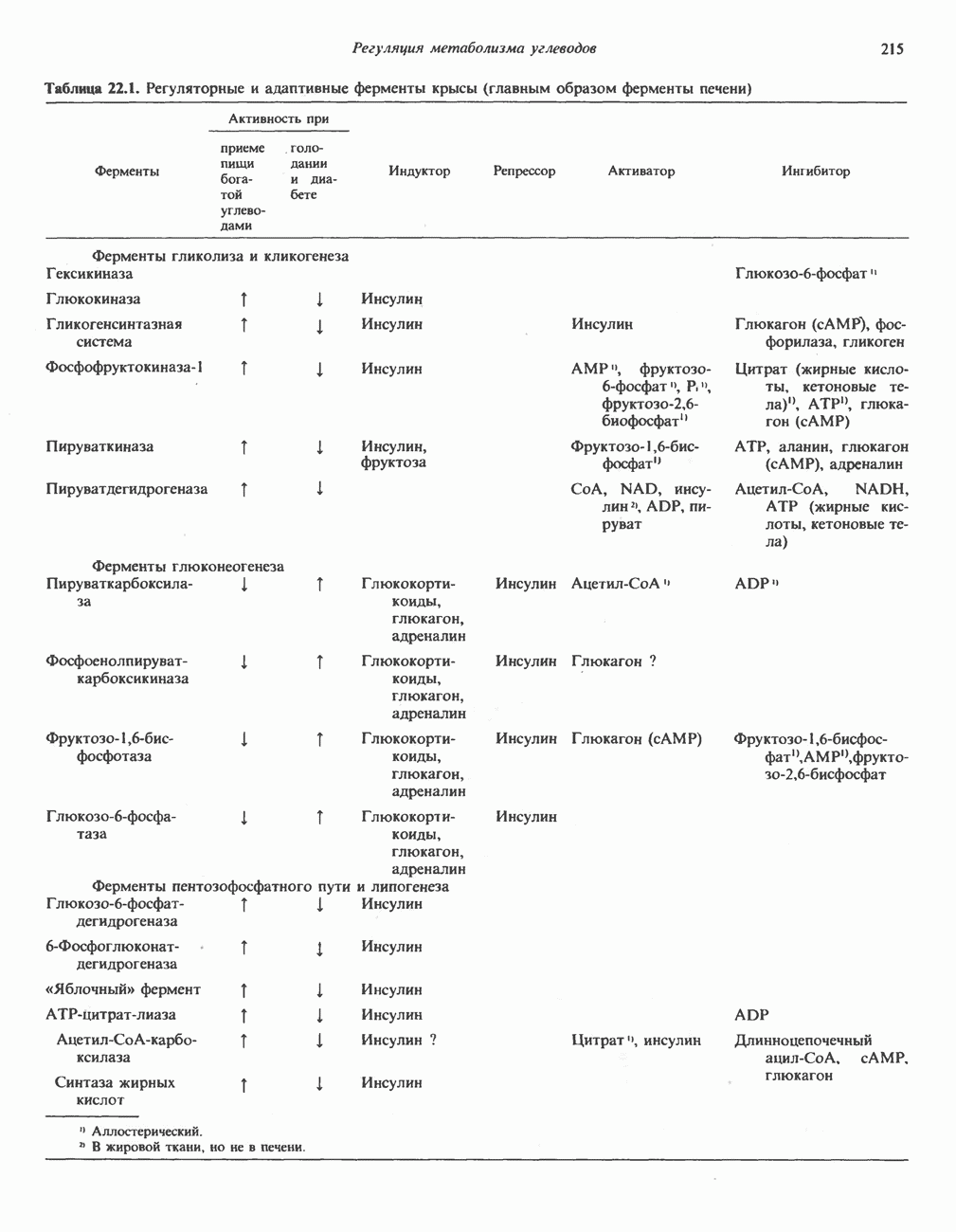
- РЕГУЛЯЦИЯ МЕТАБОЛИЗМА УГЛЕВОДОВ НА КЛЕТОЧНОМ И ФЕРМЕНТНОМ УРОВНЕ
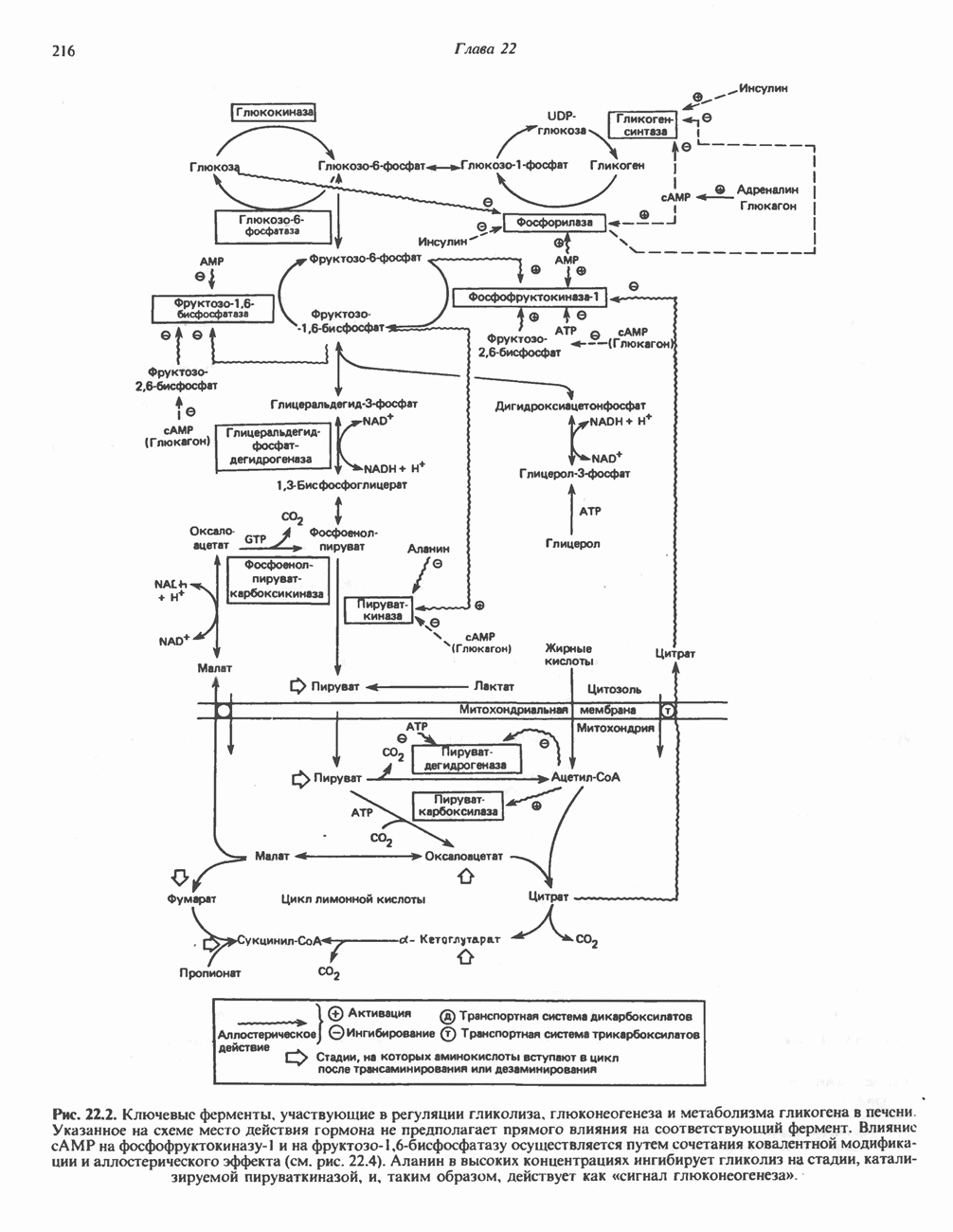
- РЕГУЛЯЦИЯ ГЛИКОЛИЗА, ГЛЮКОНЕОГЕНЕЗА И ПЕНТОЗОФОСФАТНОГО ПУТИ
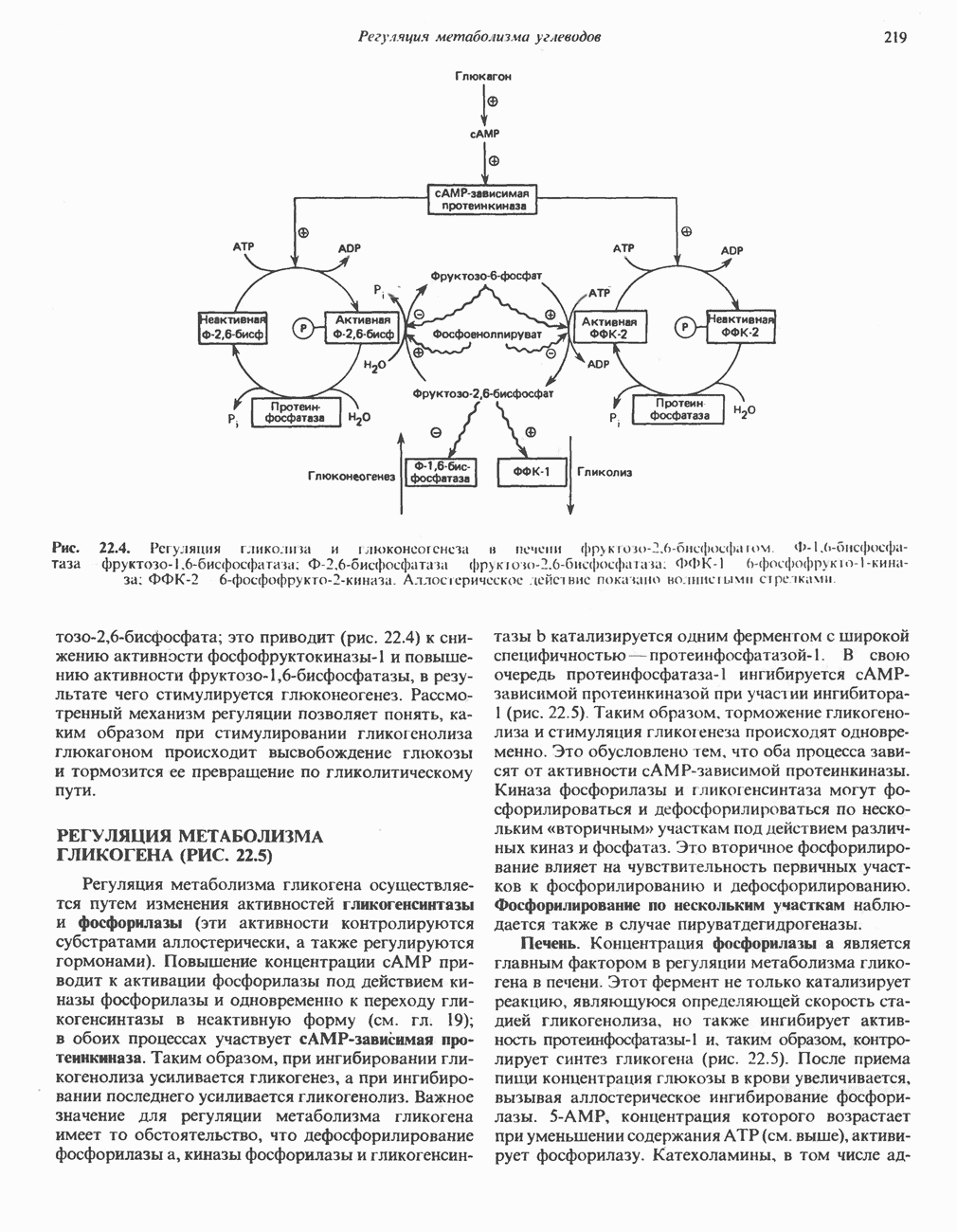
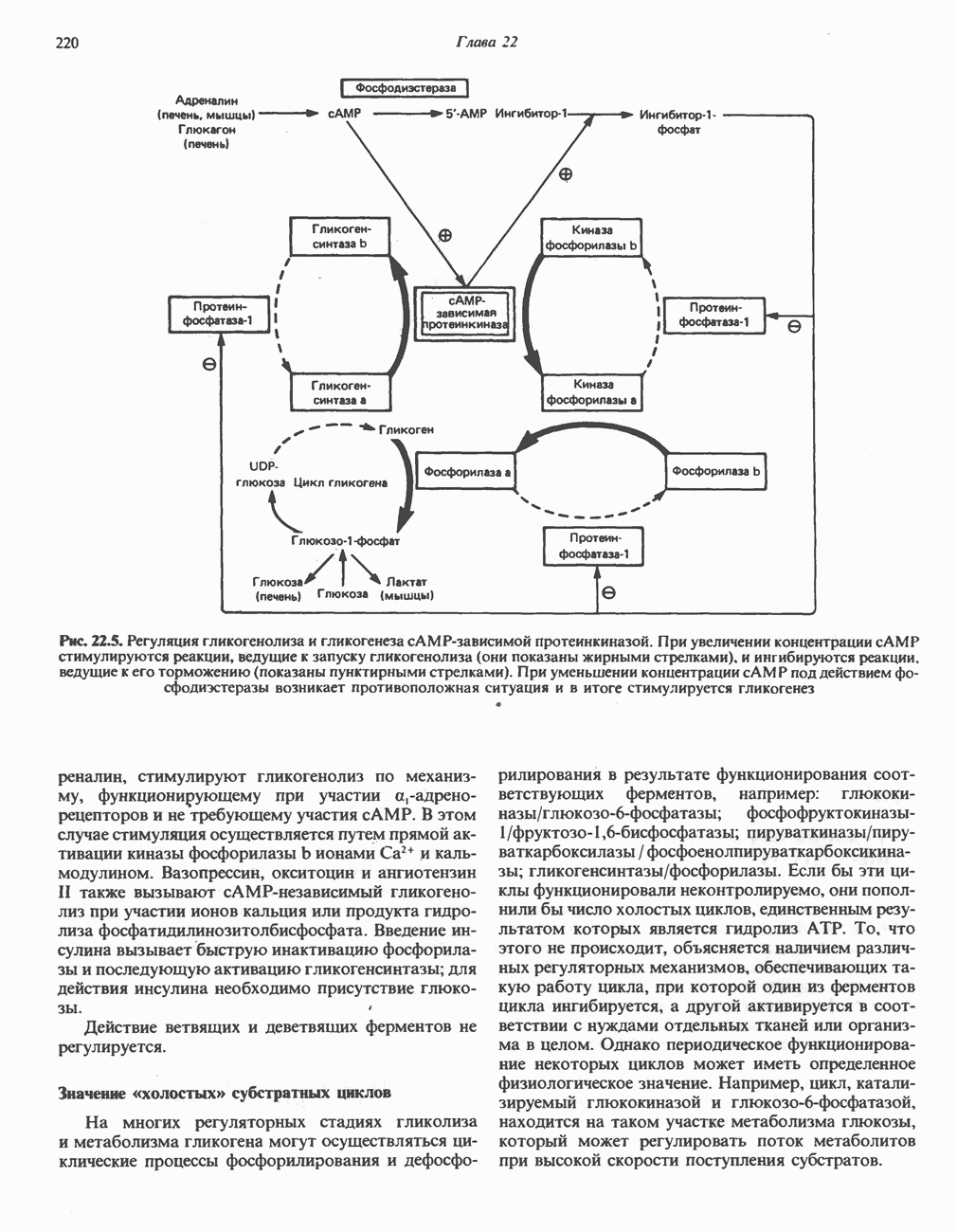
- РЕГУЛЯЦИЯ МЕТАБОЛИЗМА ГЛИКОГЕНА (РИС. 22.5)
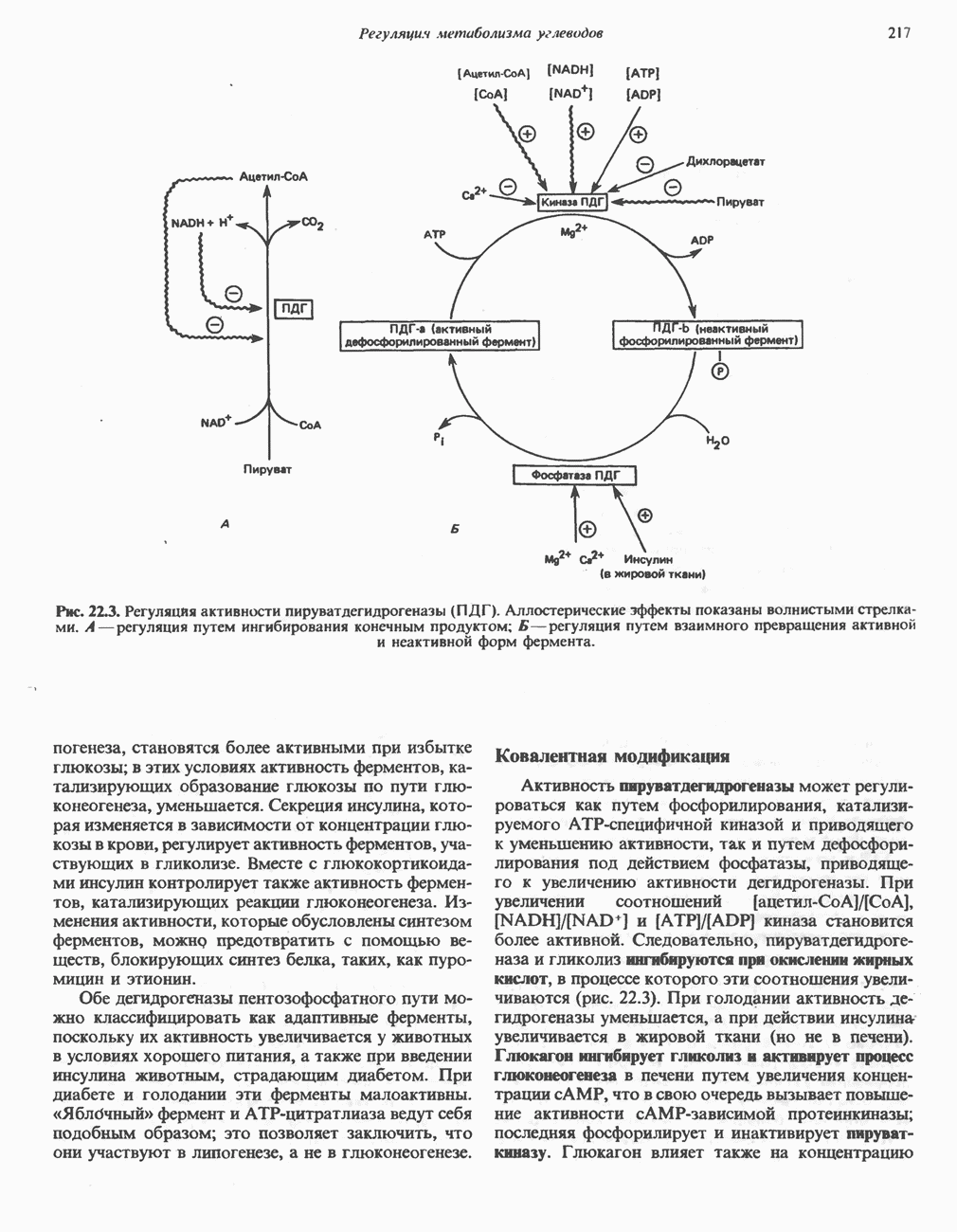
- РЕГУЛЯЦИЯ ЦИКЛА ЛИМОННОЙ КИСЛОТЫ (СМ. РИС. 18.3)
- РЕГУЛЯЦИЯ УРОВНЯ ГЛЮКОЗЫ В КРОВИ
- Глава 23. Окисление и биосинтез жирных кислот
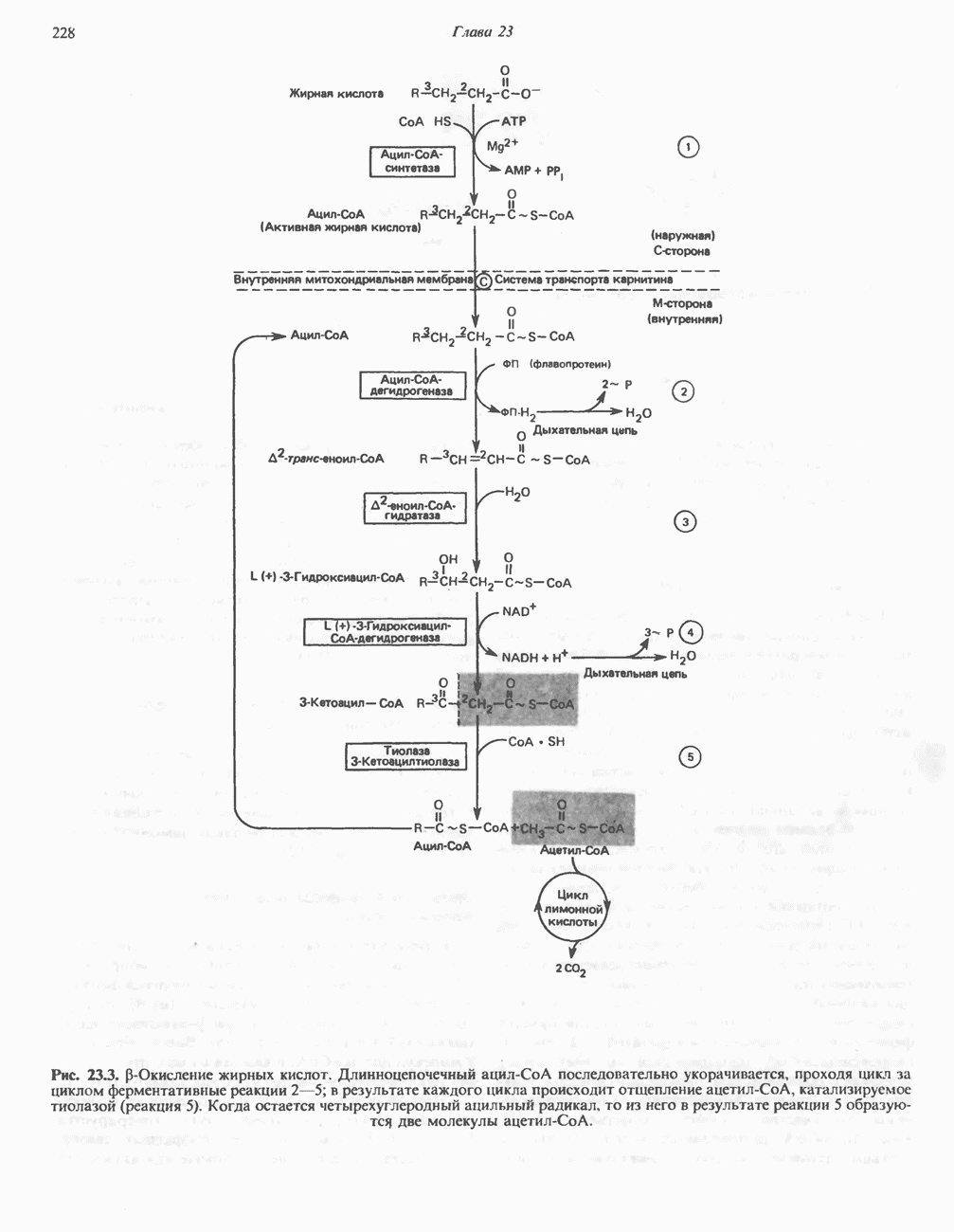
- ОКИСЛЕНИЕ ЖИРНЫХ КИСЛОТ
- БИОСИНТЕЗ НАСЫЩЕННЫХ ЖИРНЫХ КИСЛОТ
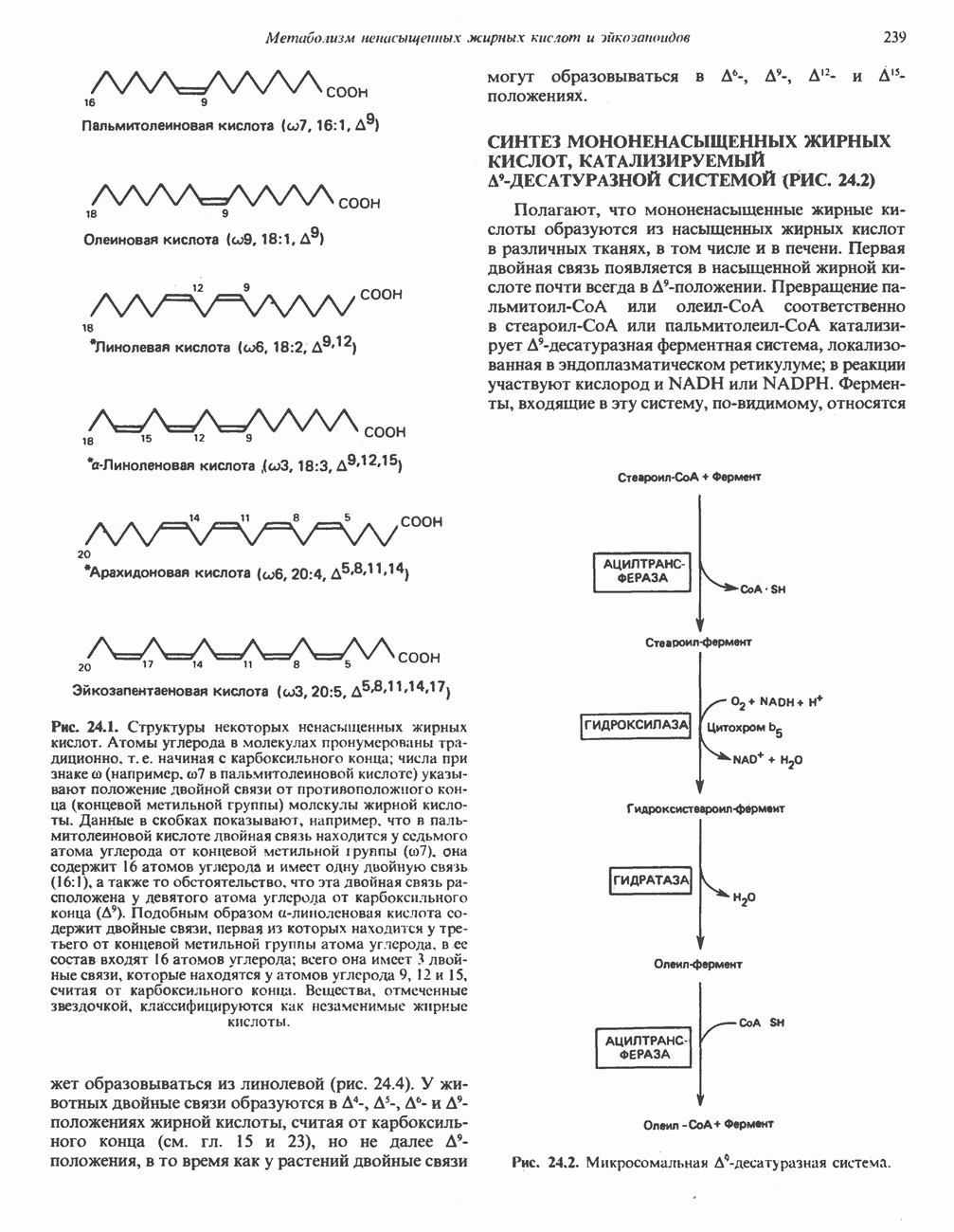
- Глава 24. Метаболизм ненасыщенных жирных кислот и эйкозаноидов
- МЕТАБОЛИЗМ НЕНАСЫЩЕННЫХ ЖИРНЫХ КИСЛОТ
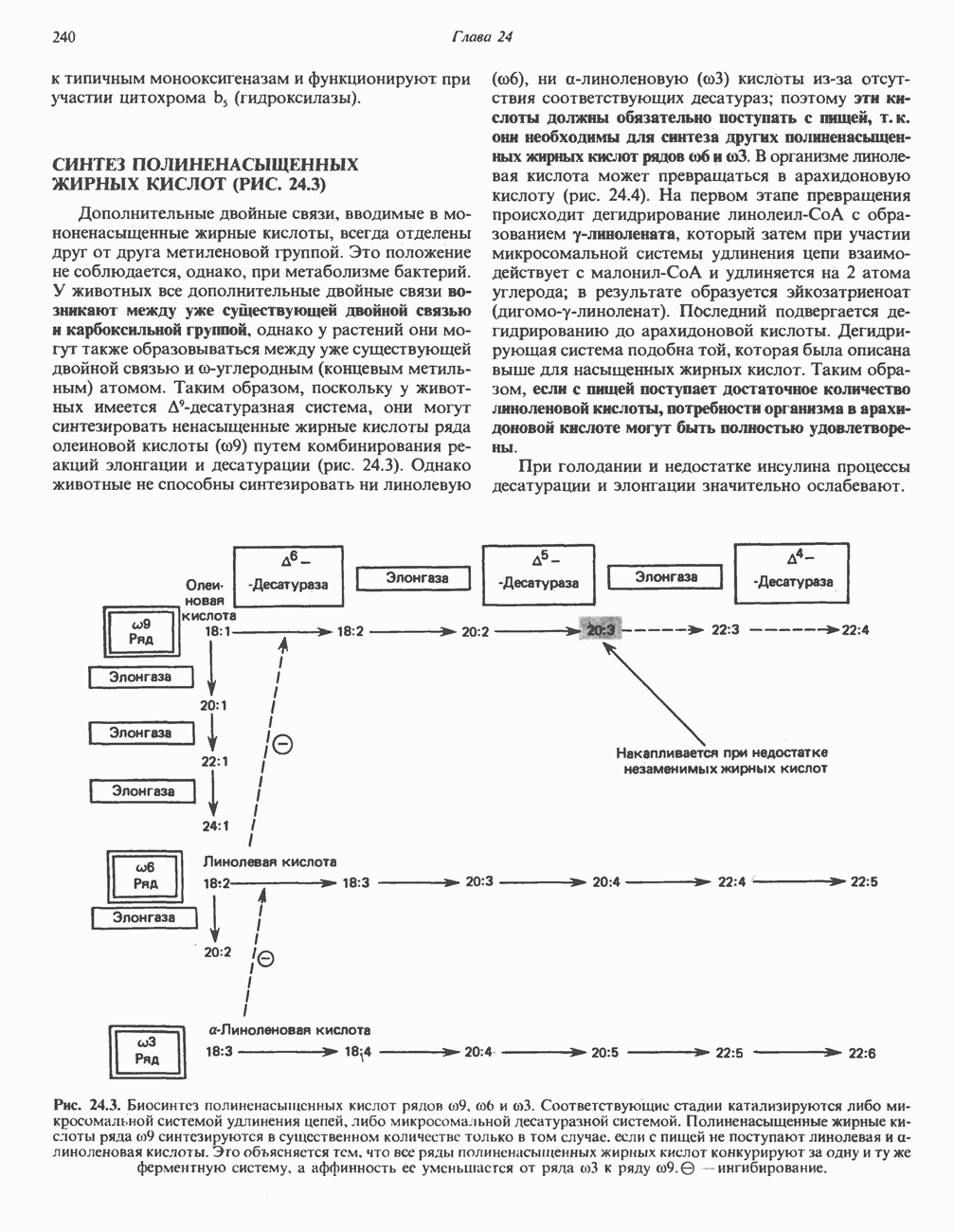
- СИНТЕЗ МОНОНЕНАСЫЩЕННЫХ ЖИРНЫХ КИСЛОТ, КАТАЛИЗИРУЕМЫЙ Д9-ДЕСАТУРАЗНОЙ СИСТЕМОЙ (РИС. 24.2)
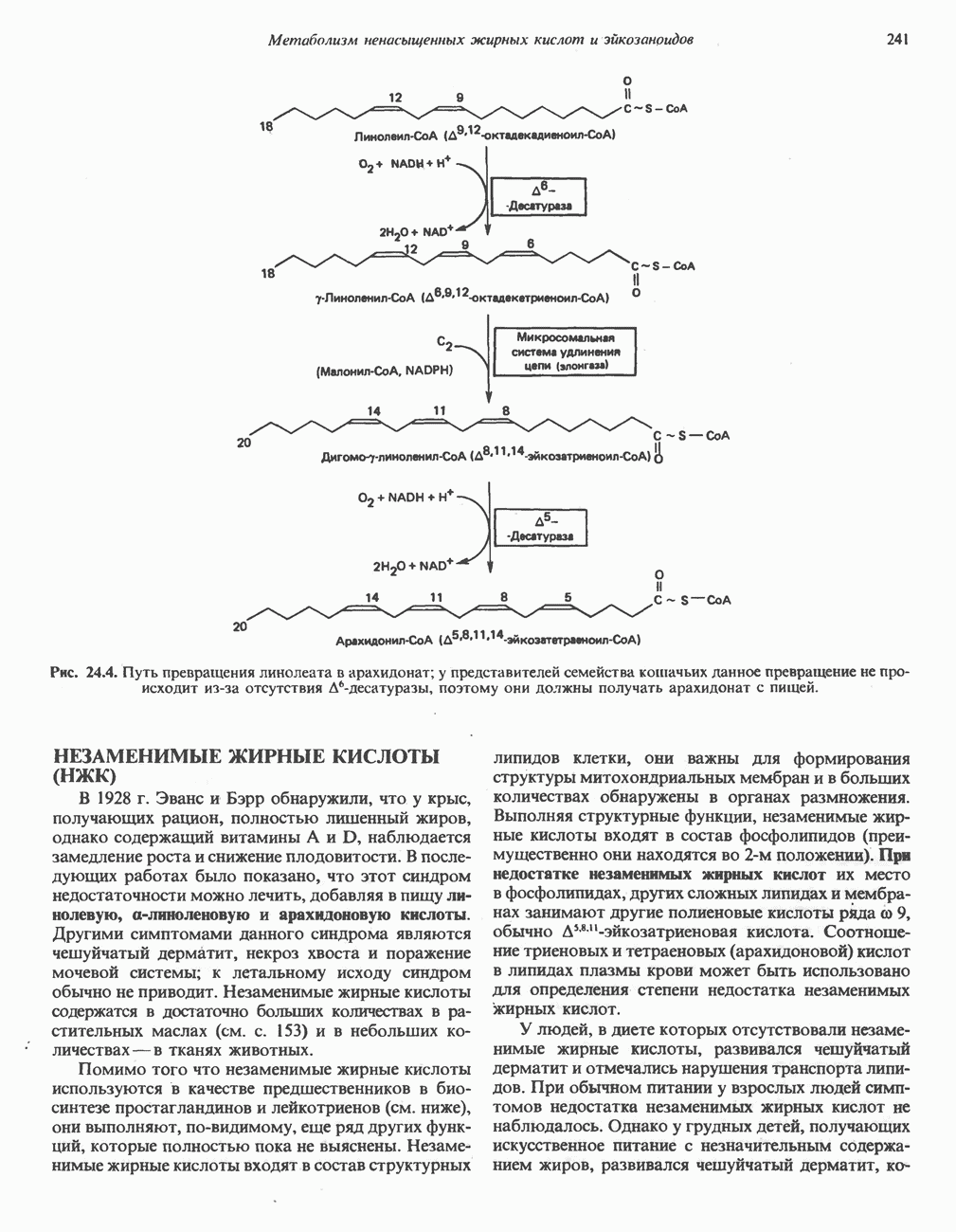
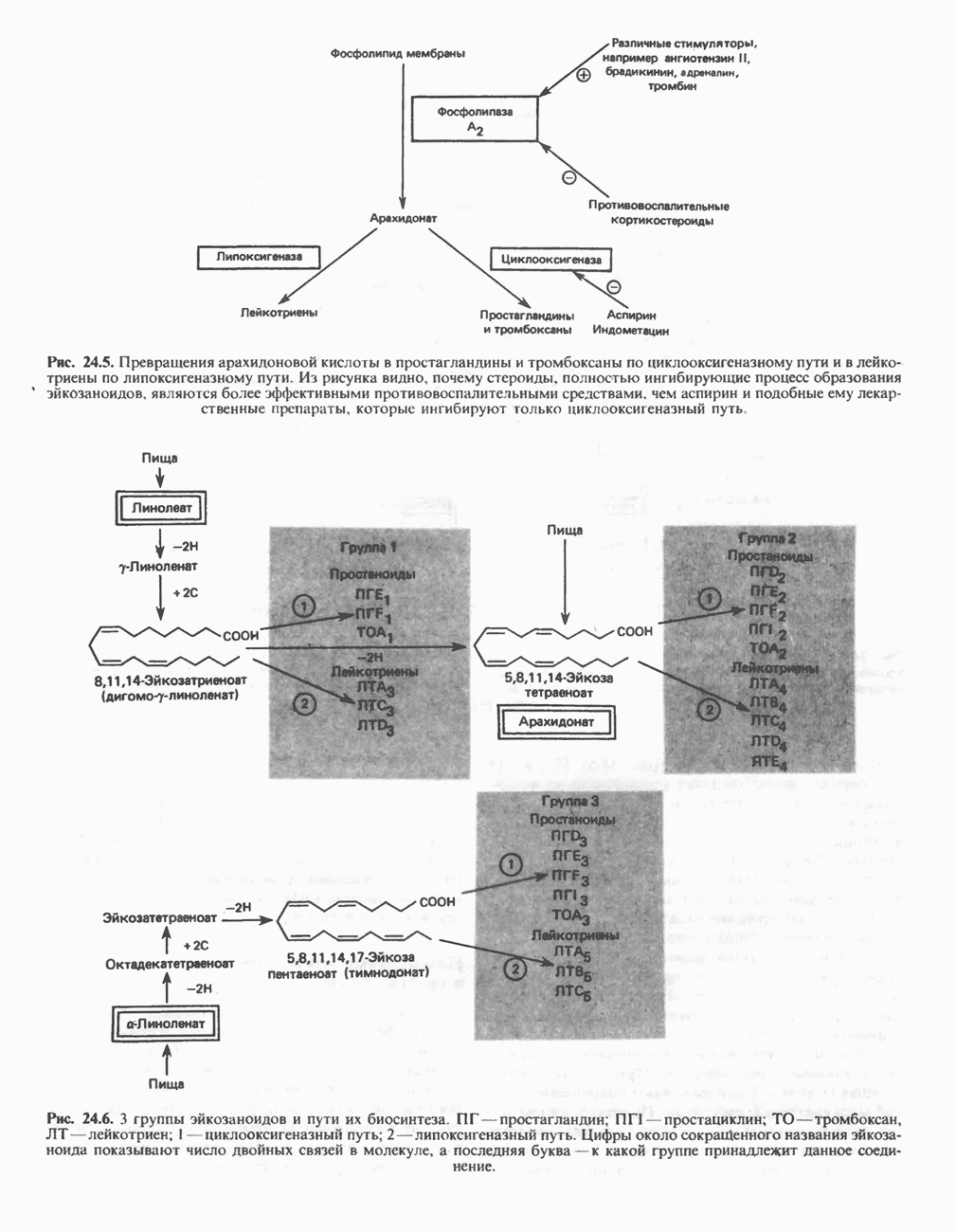
- СИНТЕЗ ПОЛИНЕНАСЫЩЕННЫХ ЖИРНЫХ КИСЛОТ (РИС. 24.3)
- НЕЗАМЕНИМЫЕ ЖИРНЫЕ КИСЛОТЫ (НЖК)
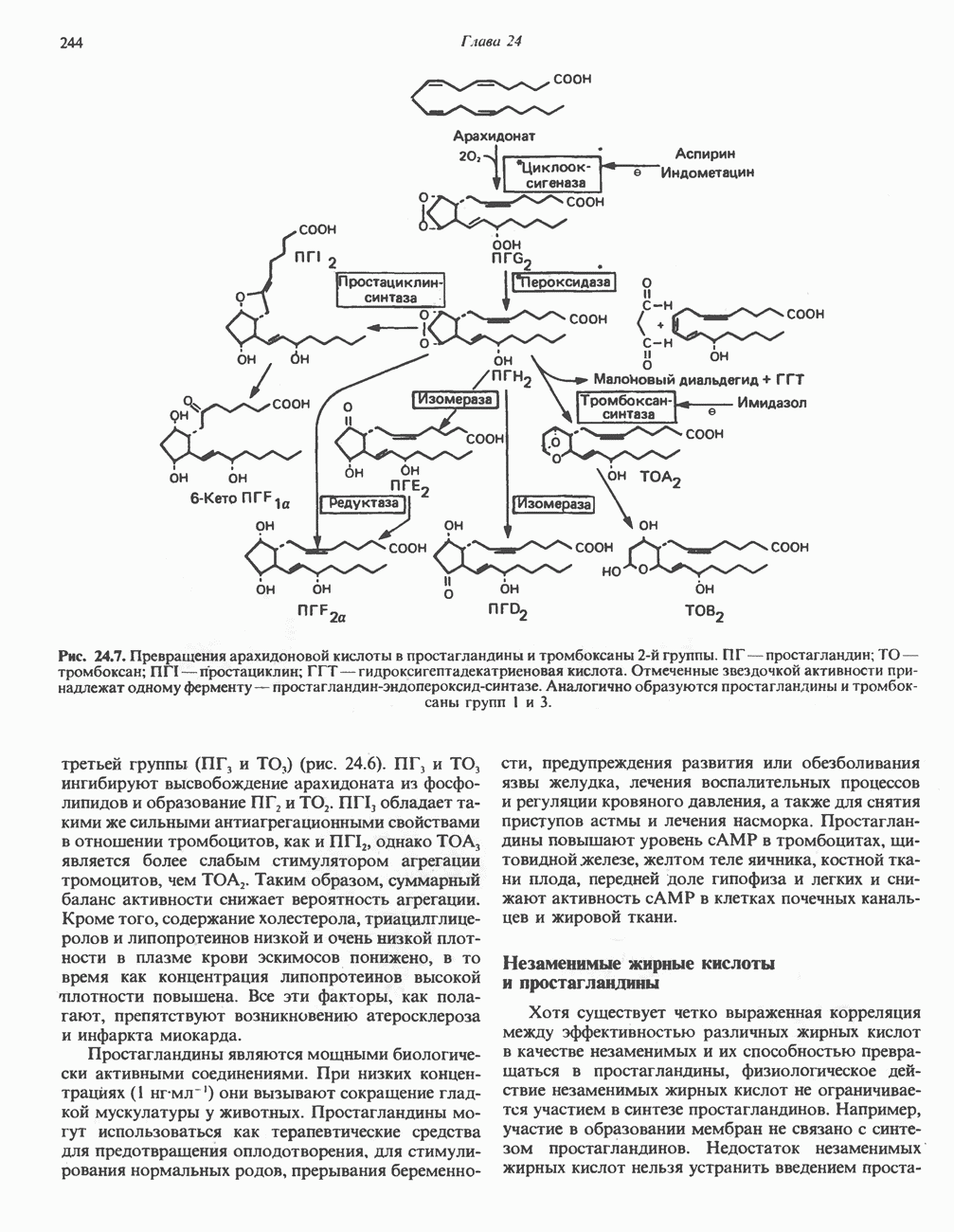
- ЭЙКОЗАНОИДЫ
- ПРОСТАНОИДЫ
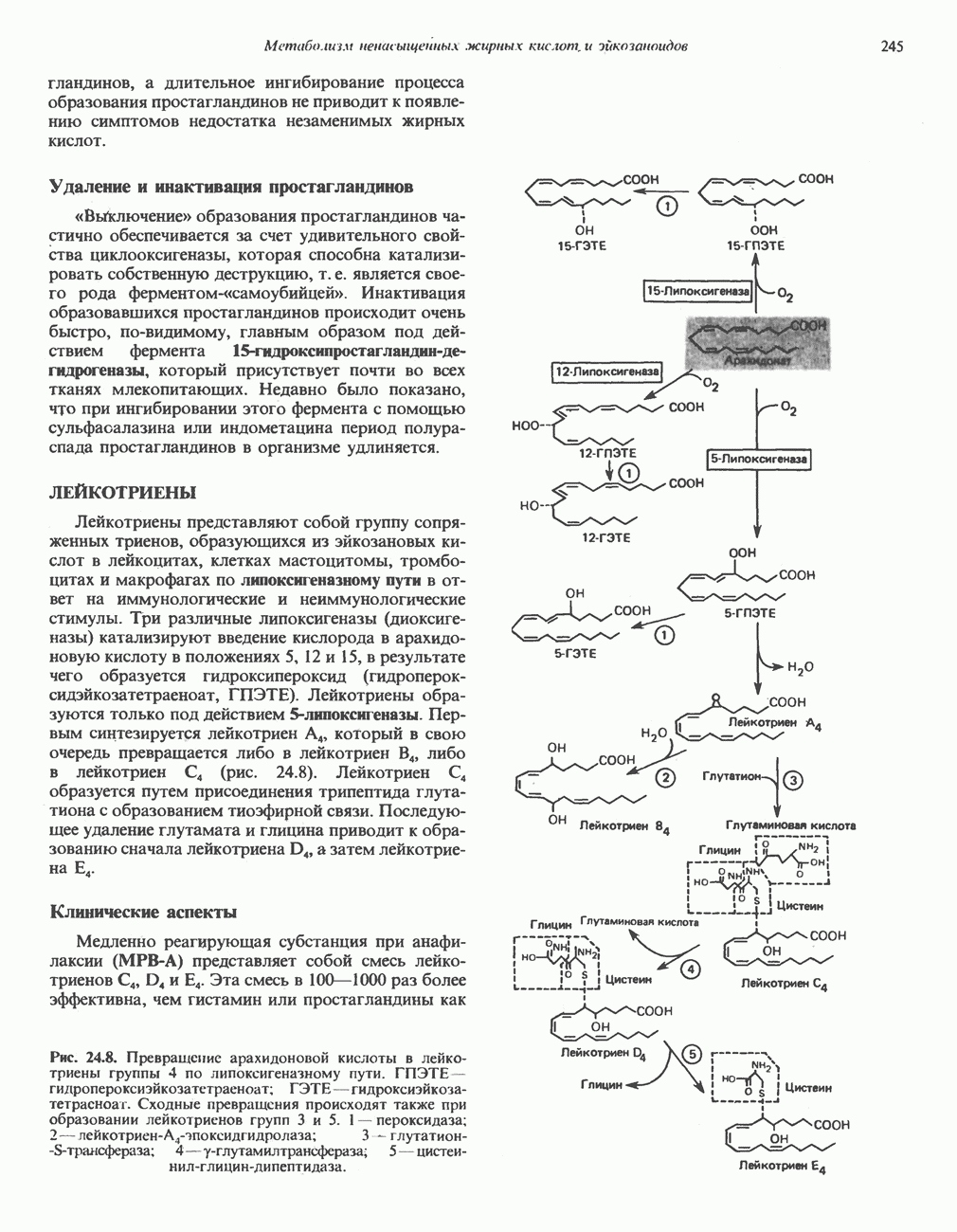
- ЛЕЙКОТРИЕНЫ
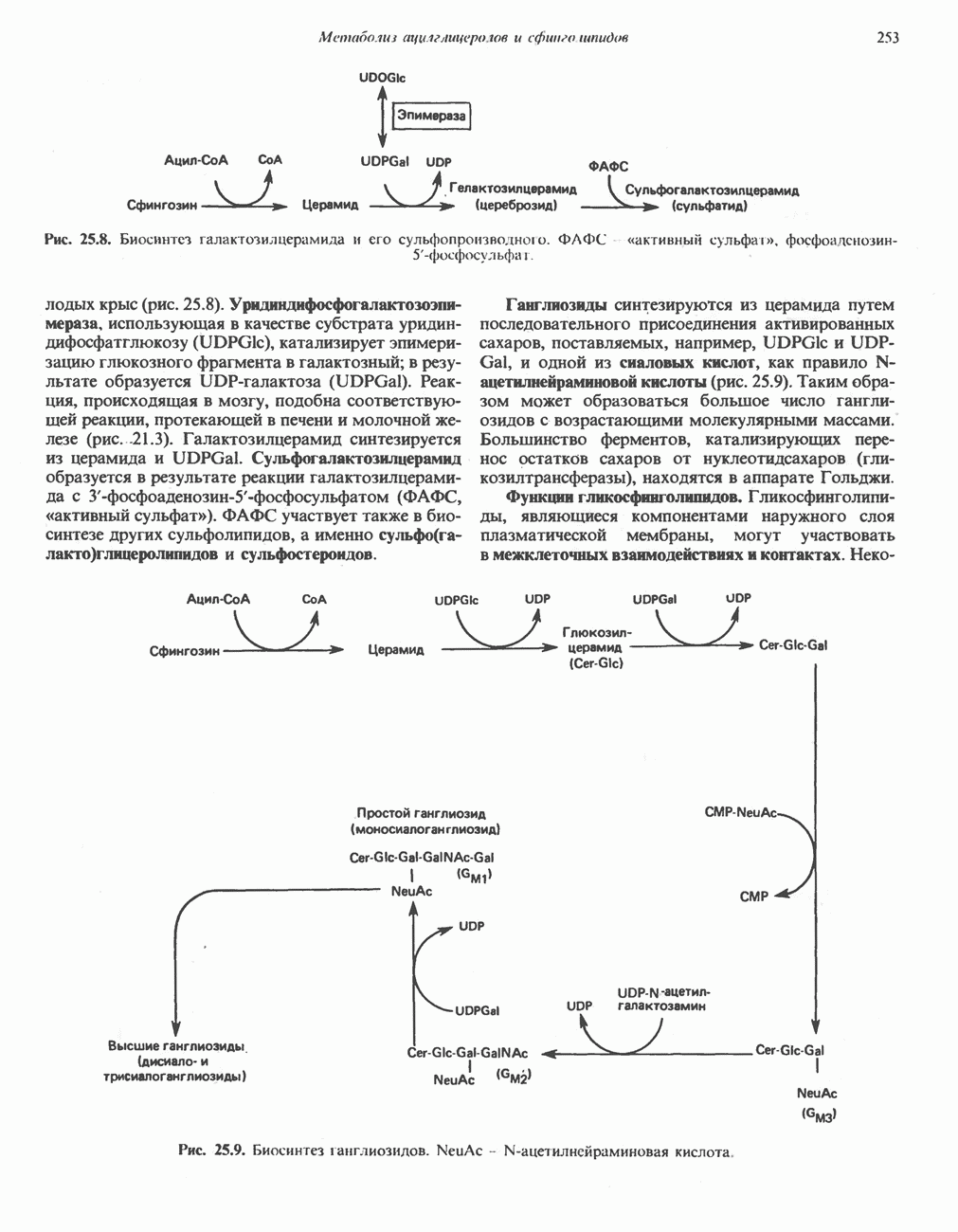
- Глава 25. Метаболизм ацилглицеролов и сфинголипидов
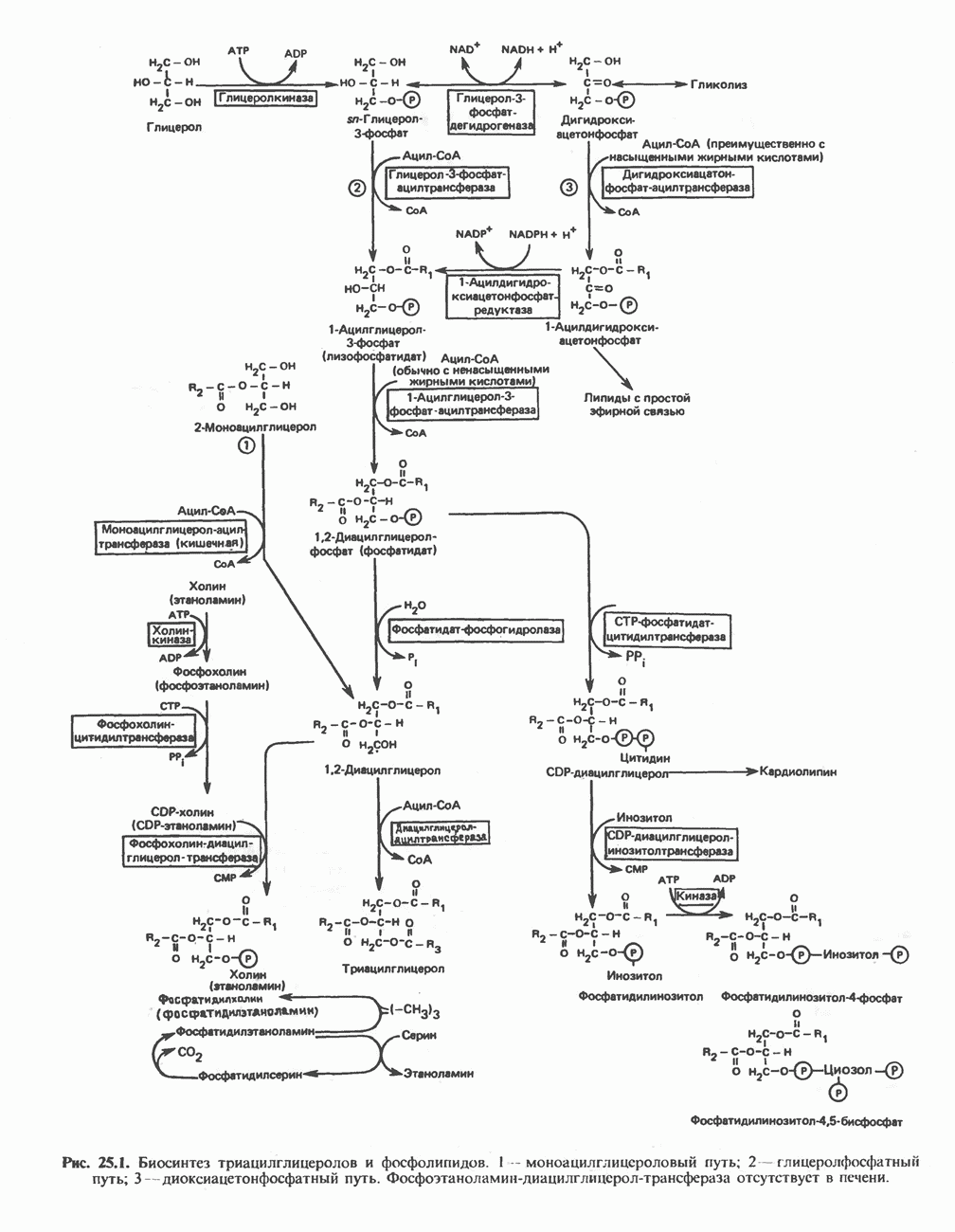
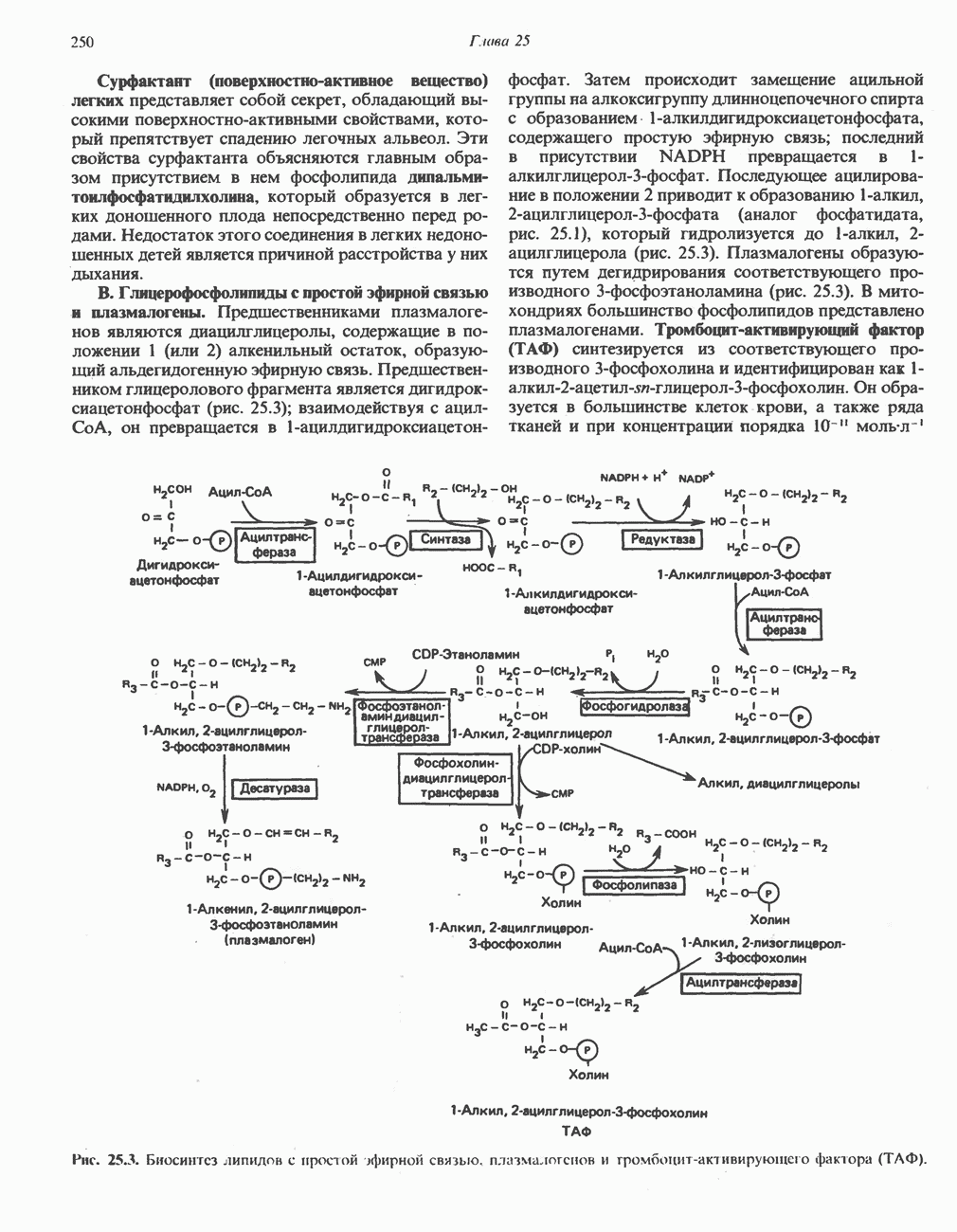
- МЕТАБОЛИЗМ АЦИЛГЛИЦЕРОЛОВ
- МЕТАБОЛИЗМ СФИНГОЛИПИДОВ
- ГЛИКОЛИПИДЫ
- ФОСФОЛИПИДЫ И СФИНГОЛИПИДЫ ПРИ НЕКОТОРЫХ ЗАБОЛЕВАНИЯХ (ЛИПИДОЗЫ)
- Глава 26. Транспорт и запасание липидов
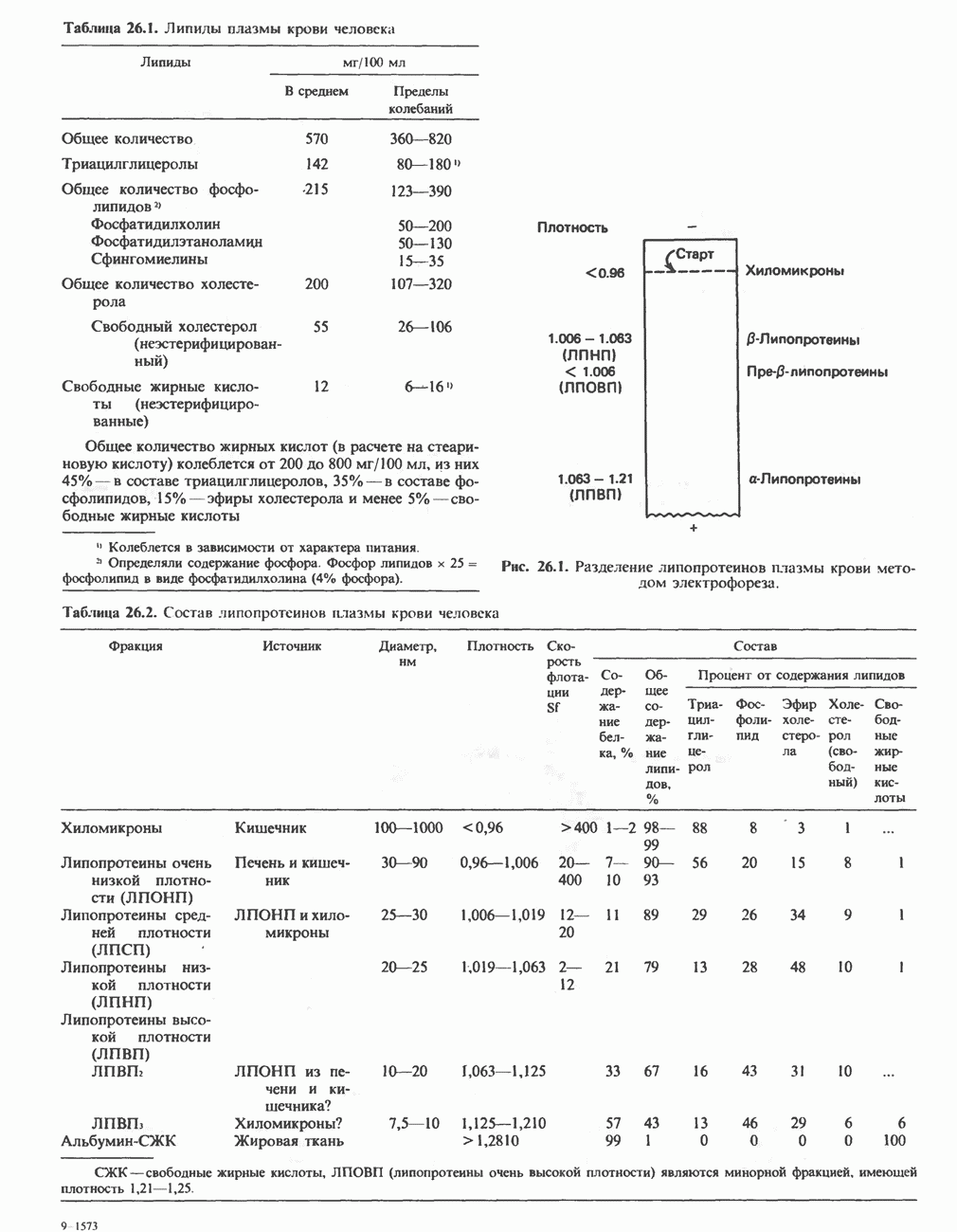
- ЛИПИДЫ ПЛАЗМЫ КРОВИ И ЛИПОПРОТЕИНЫ
- МЕТАБОЛИЗМ ЛИПОПРОТЕИНОВ ПЛАЗМЫ КРОВИ
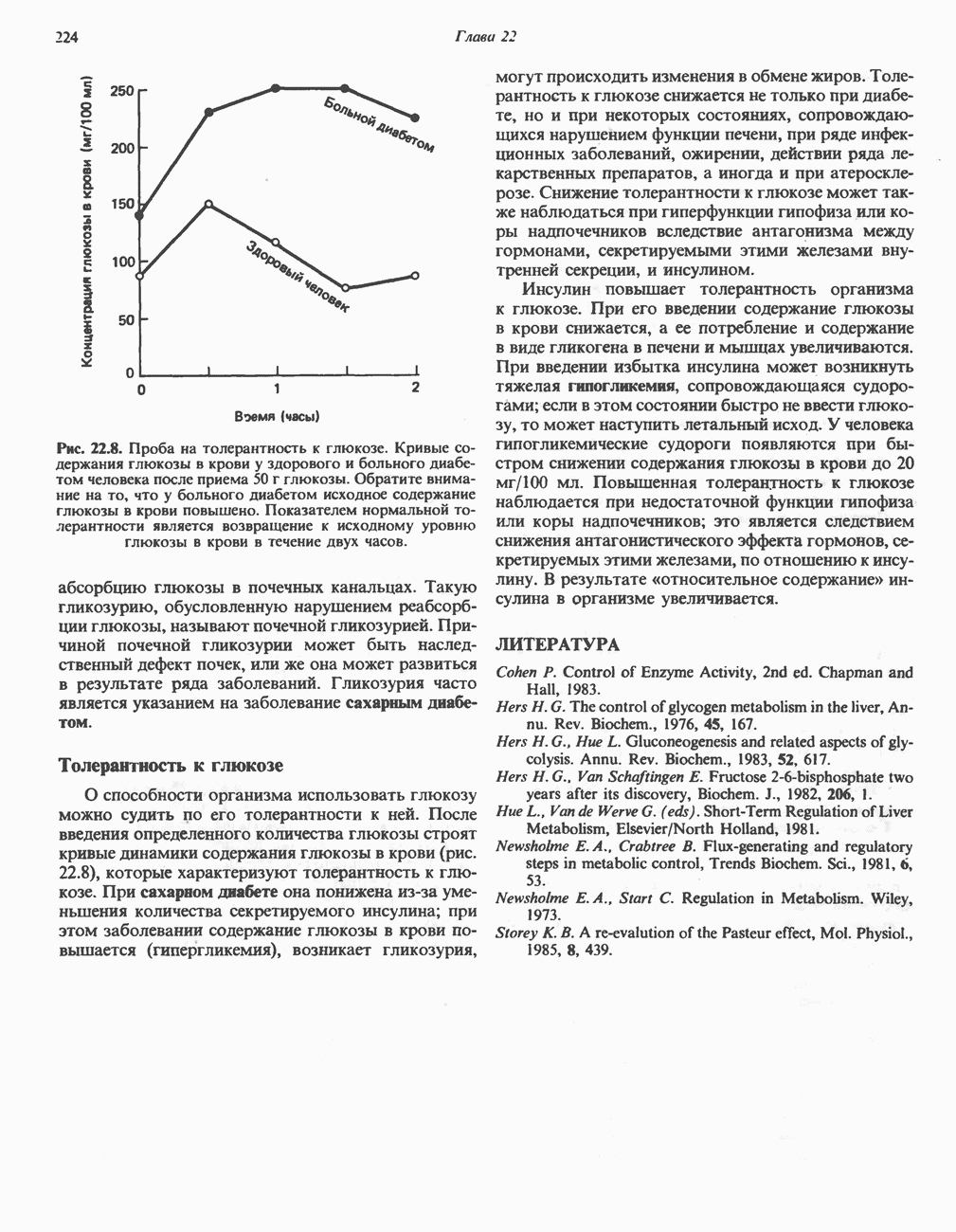
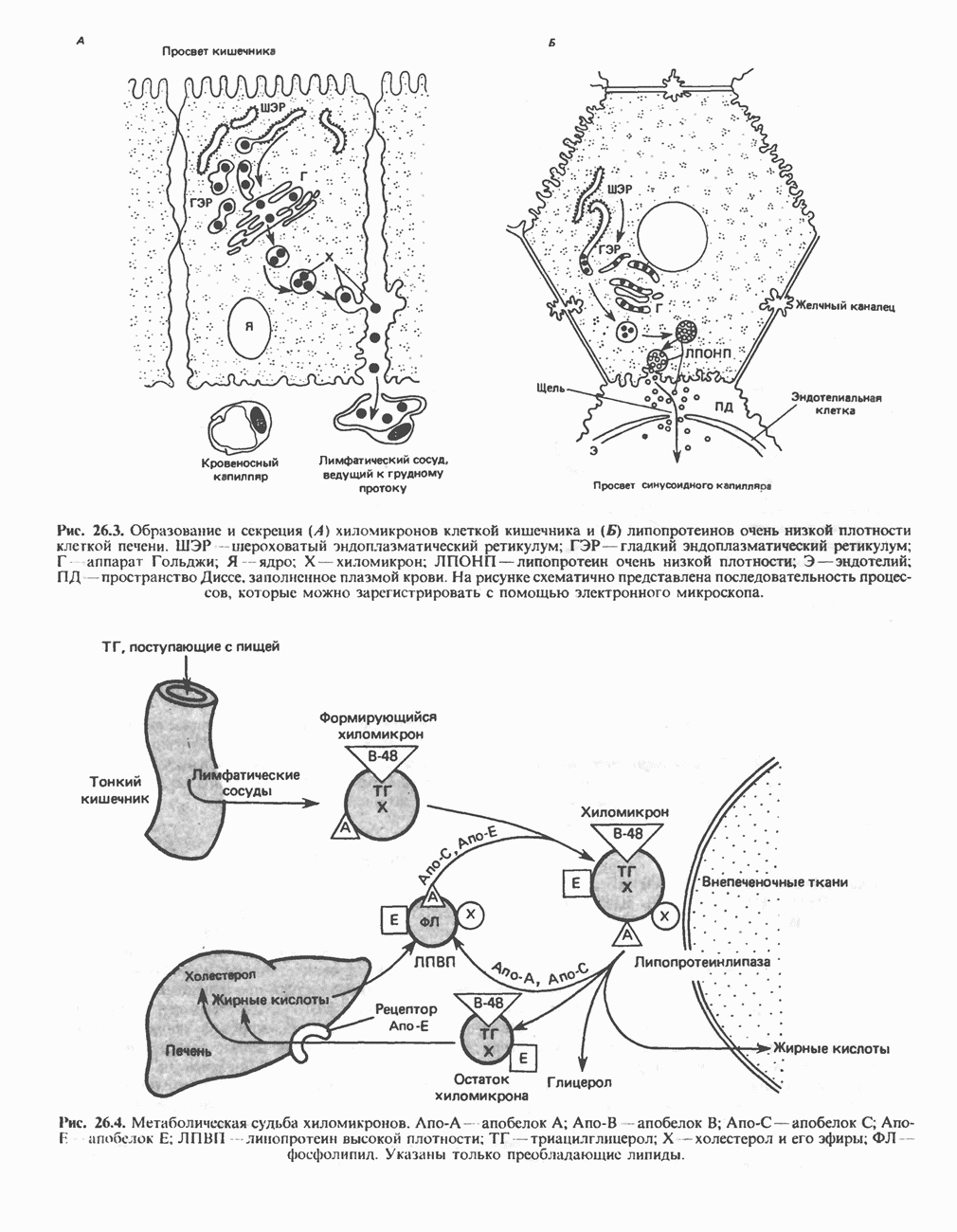
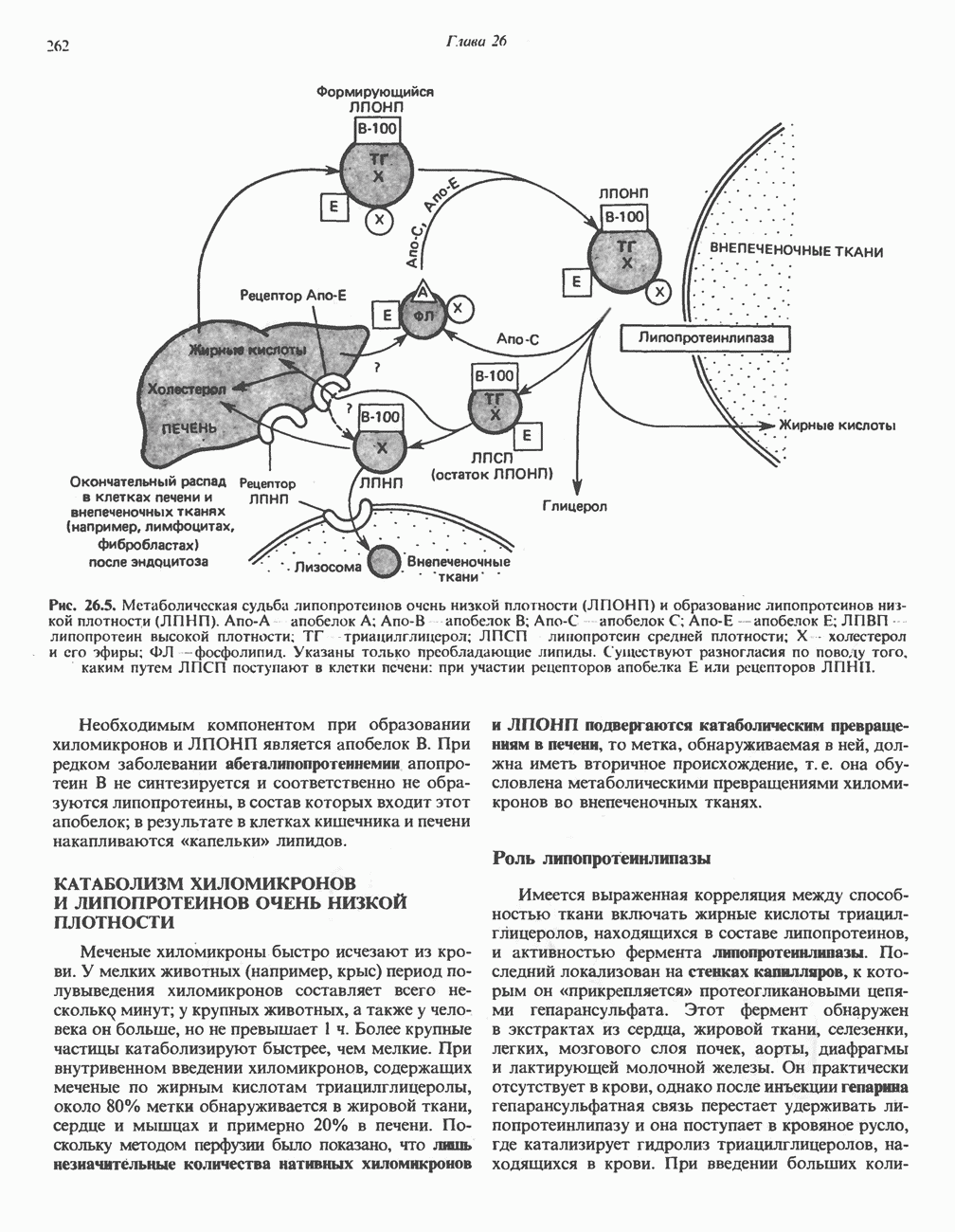
- ОБРАЗОВАНИЕ ХИЛОМИКРОНОВ И ЛИПОПРОТЕИНОВ ОЧЕНЬ НИЗКОЙ ПЛОТНОСТИ (ЛПОНП)
- КАТАБОЛИЗМ ХИЛОМИКРОНОВ И ЛИПОПРОТЕИНОВ ОЧЕНЬ НИЗКОЙ ПЛОТНОСТИ
- МЕТАБОЛИЗМ ЛПНП
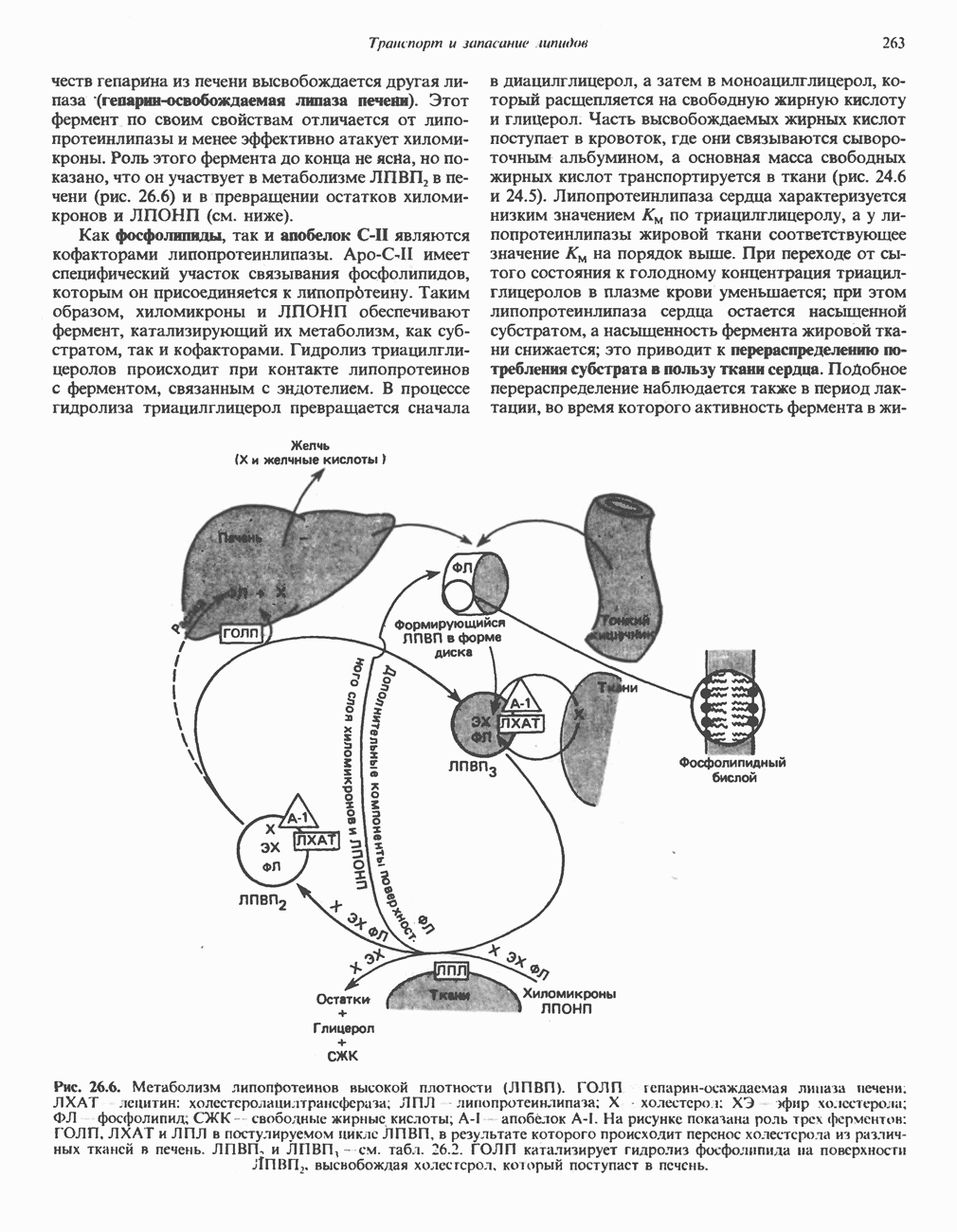
- МЕТАБОЛИЗМ ЛПВП (рис. 26.6)
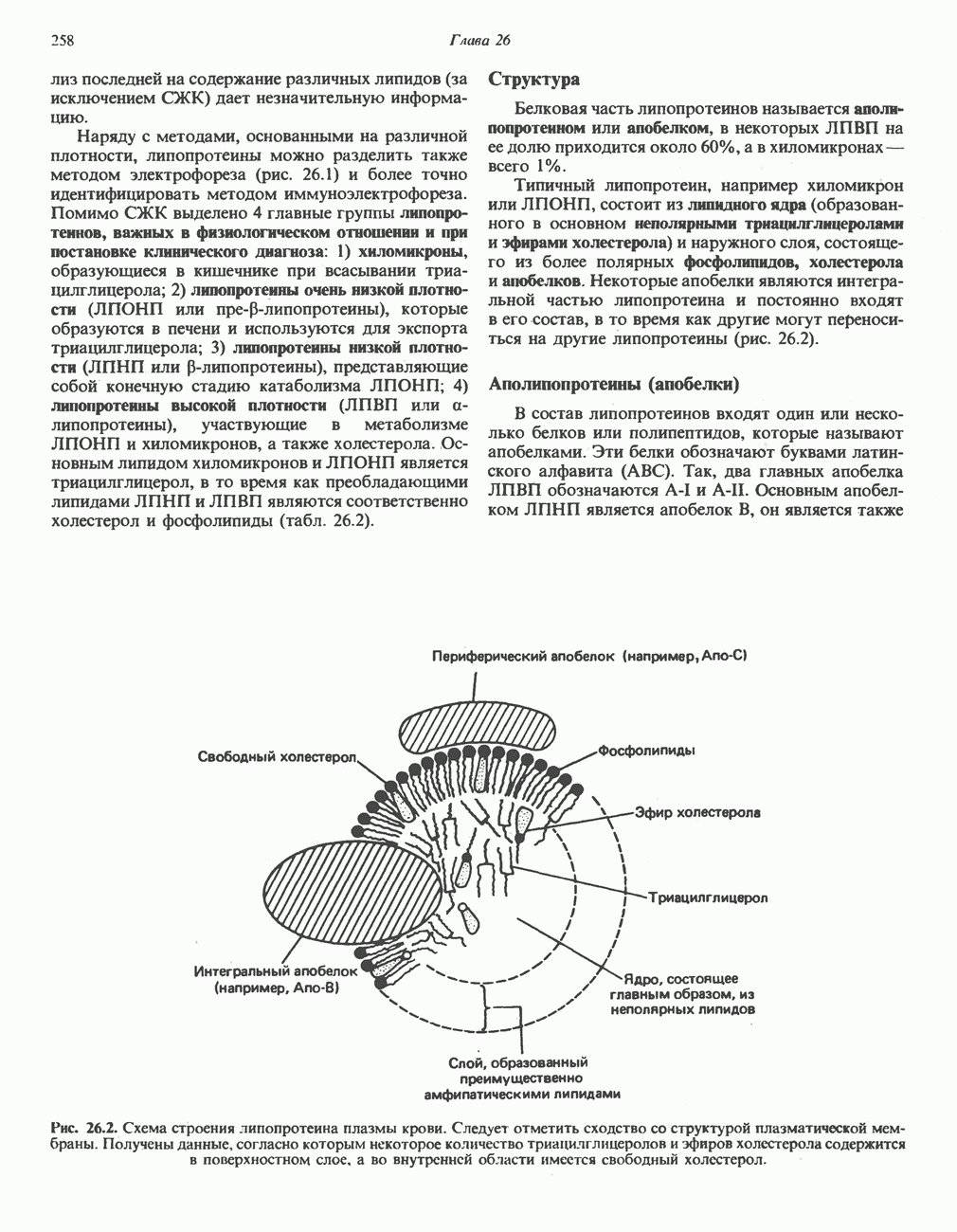
- РОЛЬ ПЕЧЕНИ В ТРАНСПОРТЕ И МЕТАБОЛИЗМЕ ЛИПИДОВ
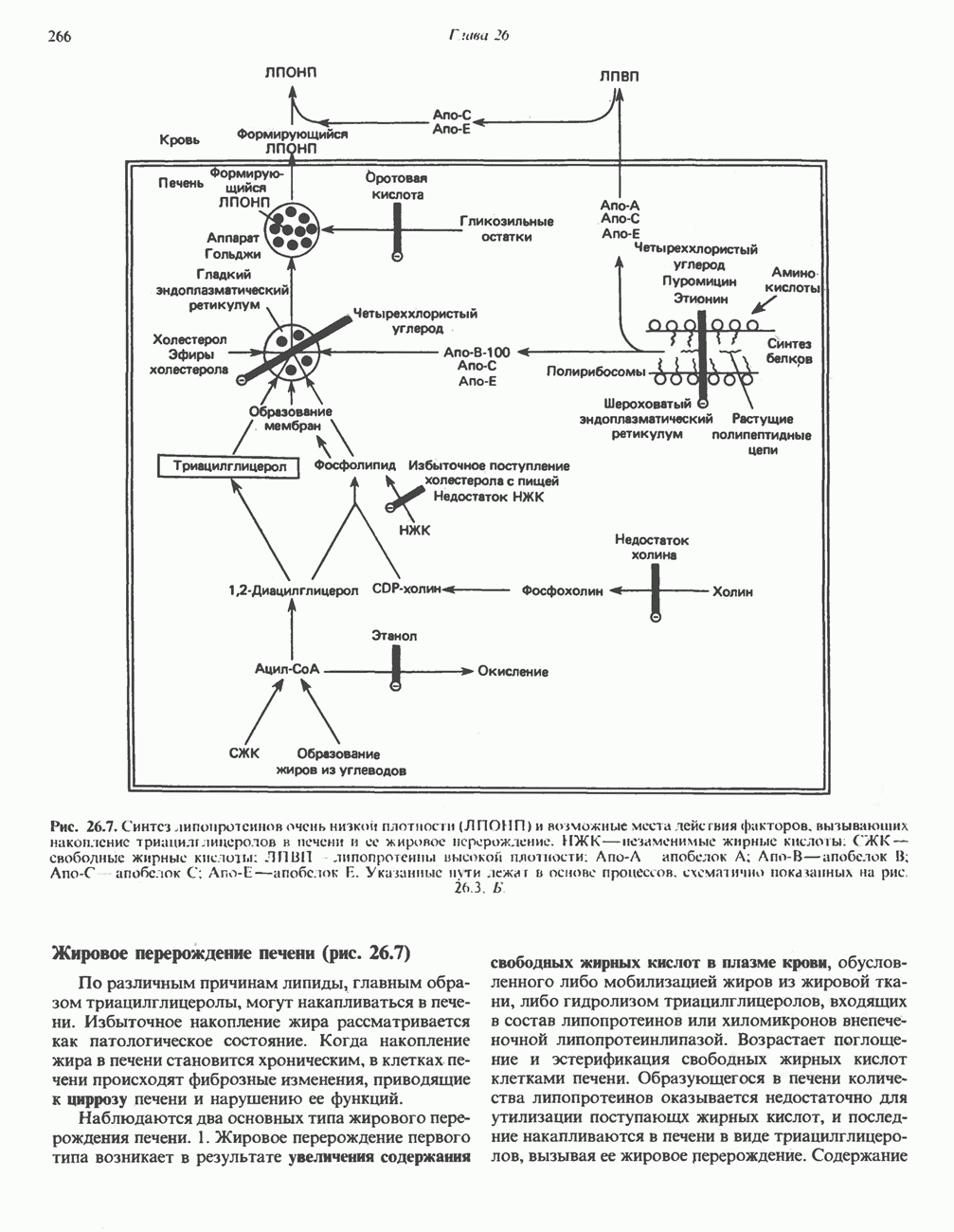
- СИНТЕЗ ТРИАЦИЛГЛИЦЕРОЛОВ И ОБРАЗОВАНИЕ ЛПОНП (рис. 26.7)
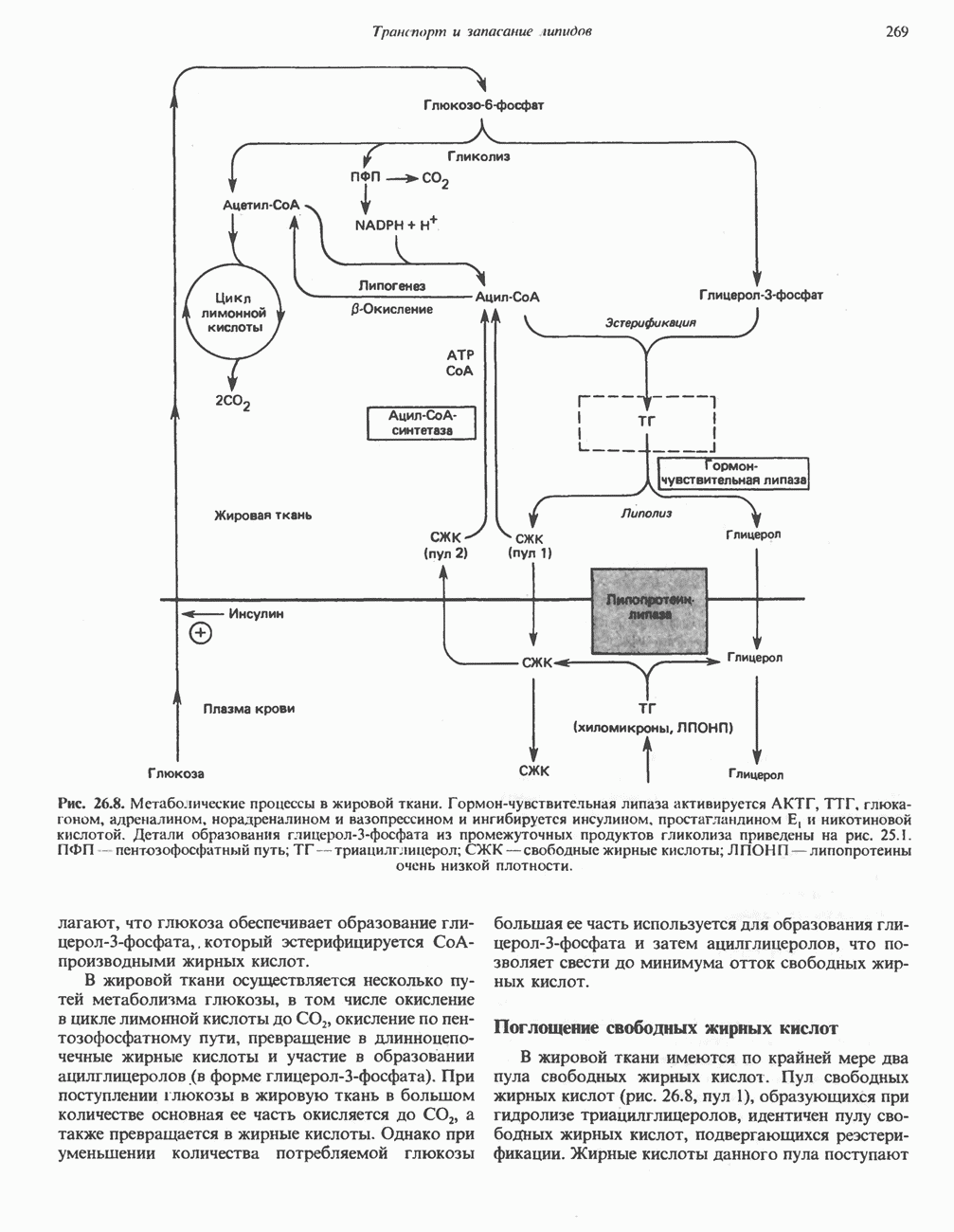
- МЕТАБОЛИЧЕСКИЕ ПРЕВРАЩЕНИЯ В ЖИРОВОЙ ТКАНИ И МОБИЛИЗАЦИЯ ЖИРОВ
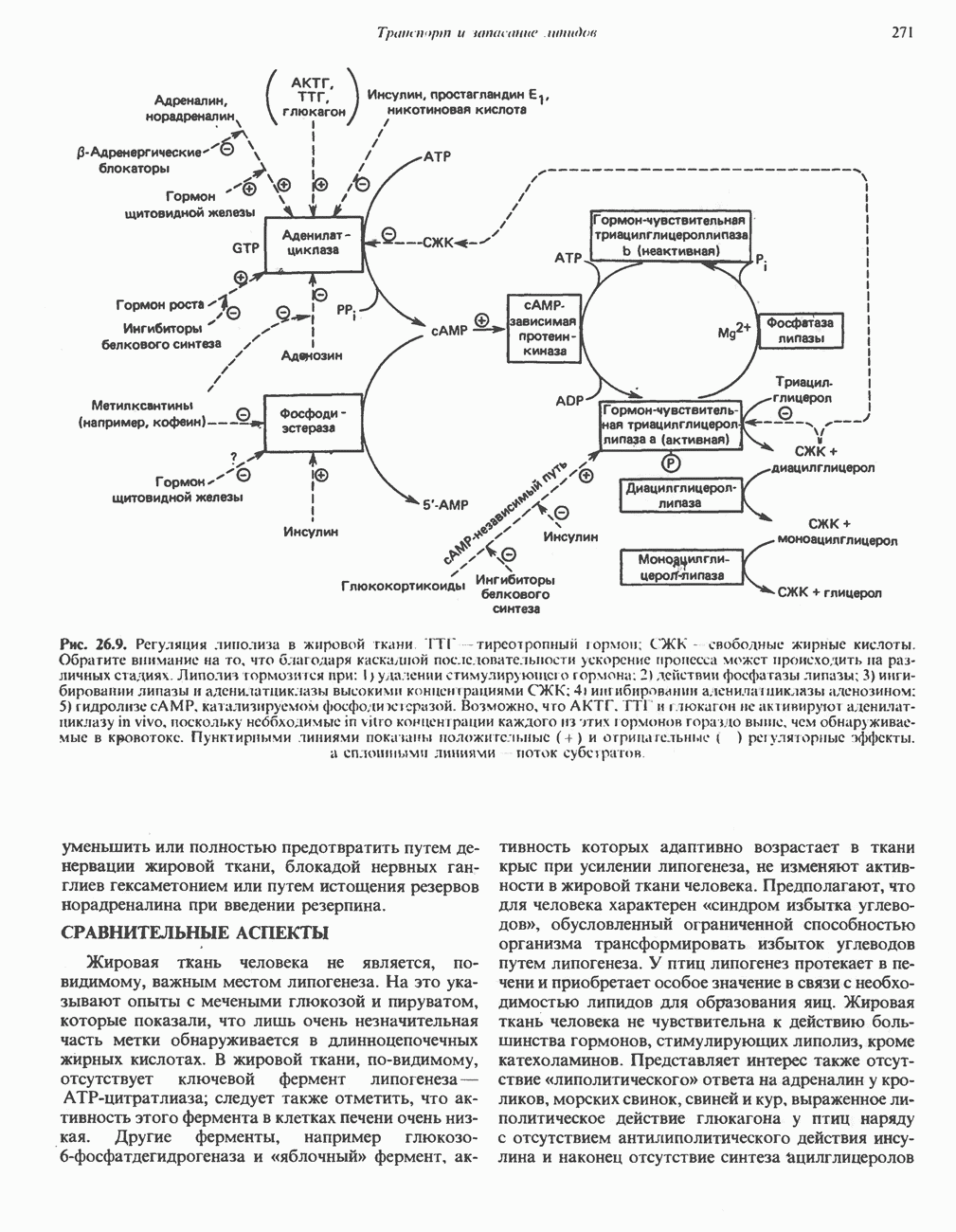
- РОЛЬ ГОРМОНОВ В МОБИЛИЗАЦИИ ЖИРОВ
- СРАВНИТЕЛЬНЫЕ АСПЕКТЫ
- РОЛЬ БУРОЙ ЖИРОВОЙ ТКАНИ В ТЕРМОГЕНЕЗЕ
- Глава 27. Синтез, транспорт и экскреция холестерола
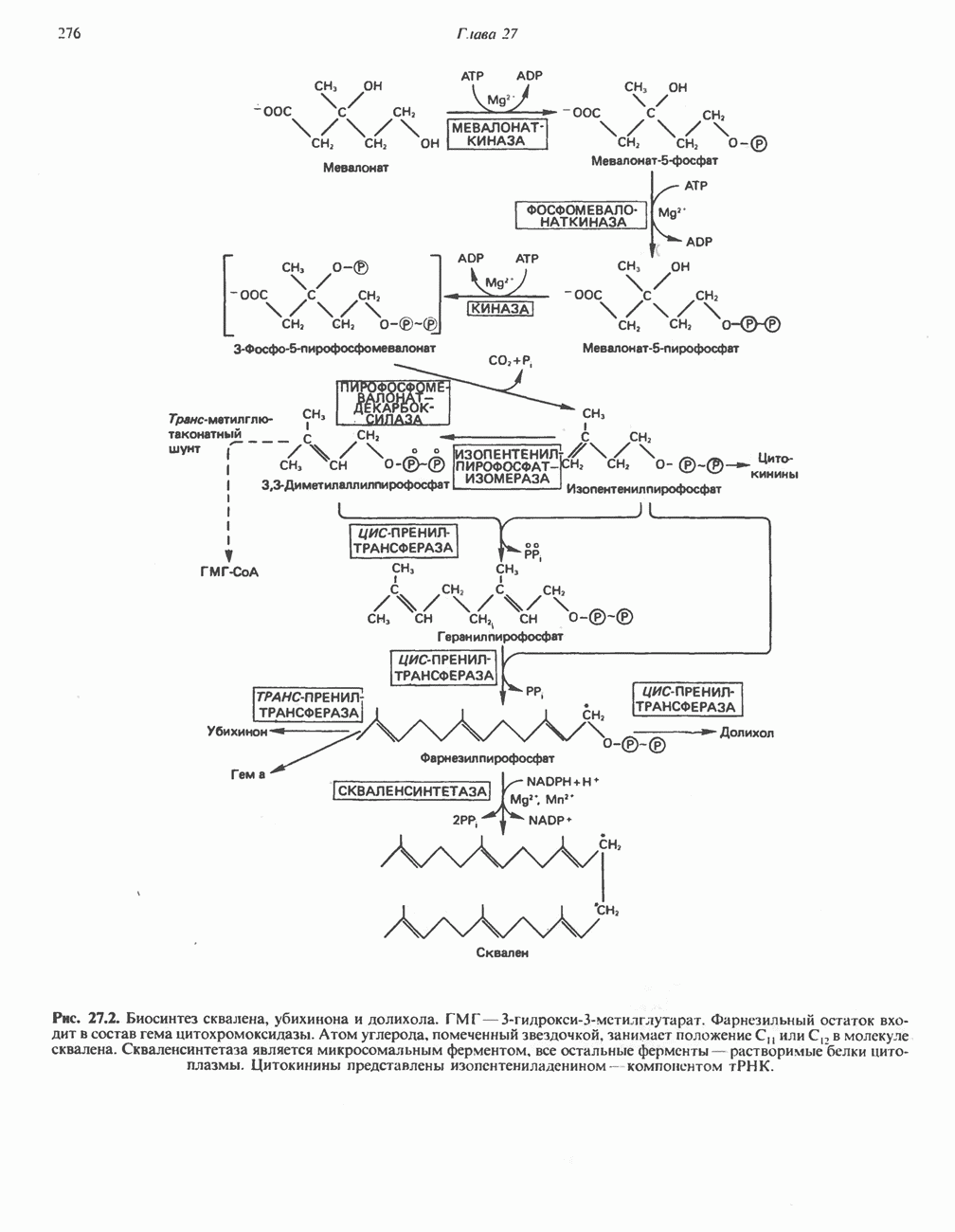
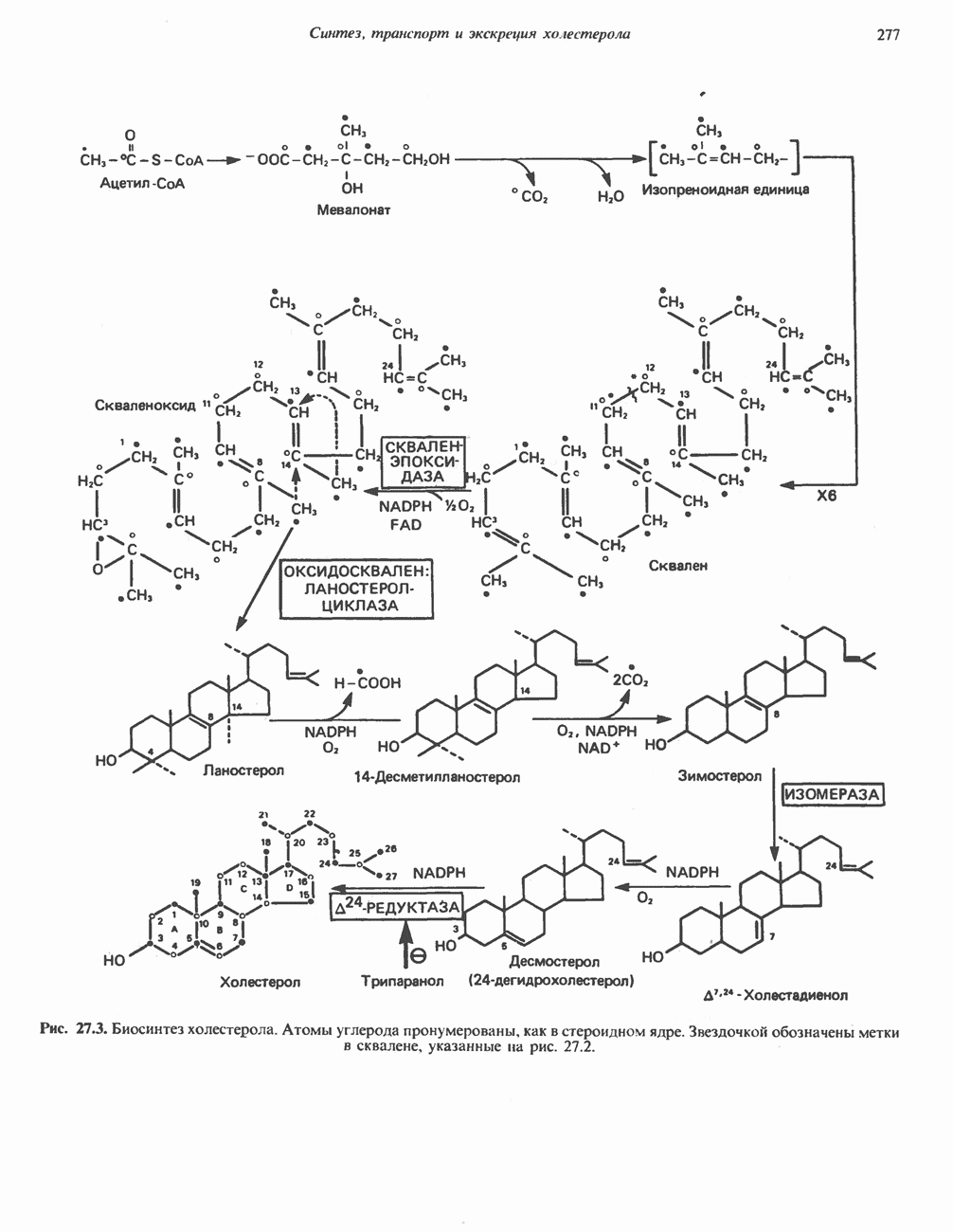
- БИОСИНТЕЗ ХОЛЕСТЕРОЛА
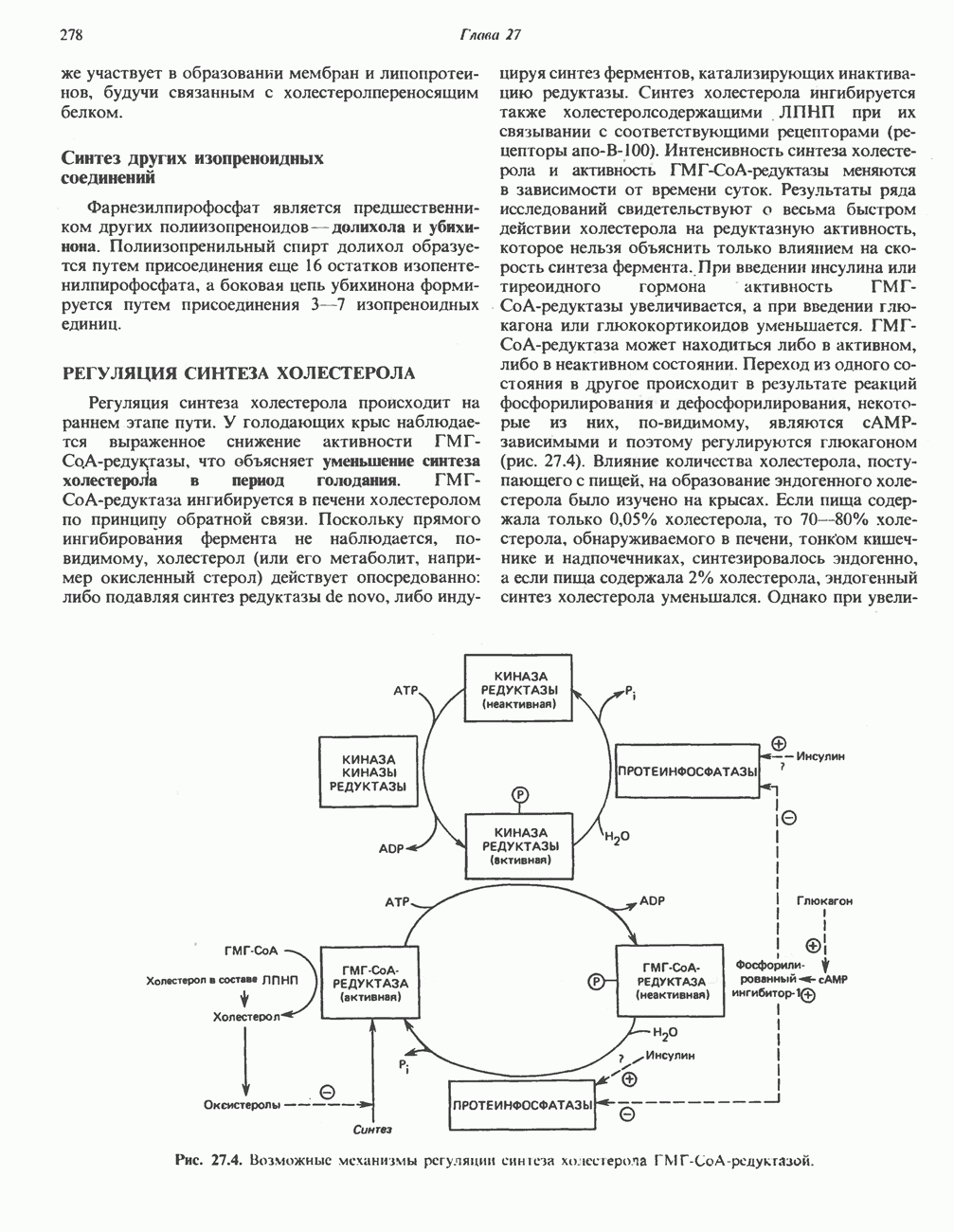
- РЕГУЛЯЦИЯ СИНТЕЗА ХОЛЕСТЕРОЛА
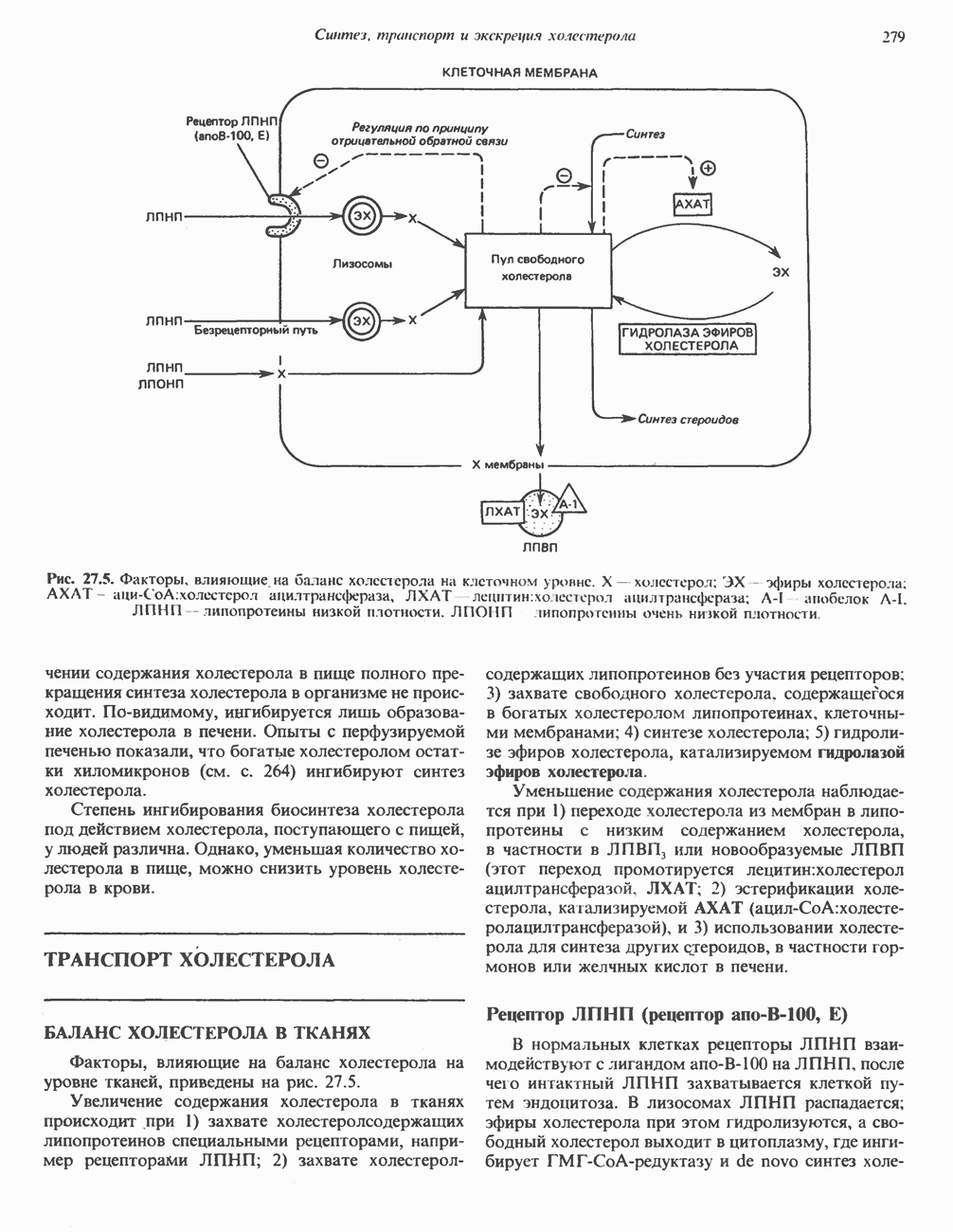
- ТРАНСПОРТ ХОЛЕСТЕРОЛА
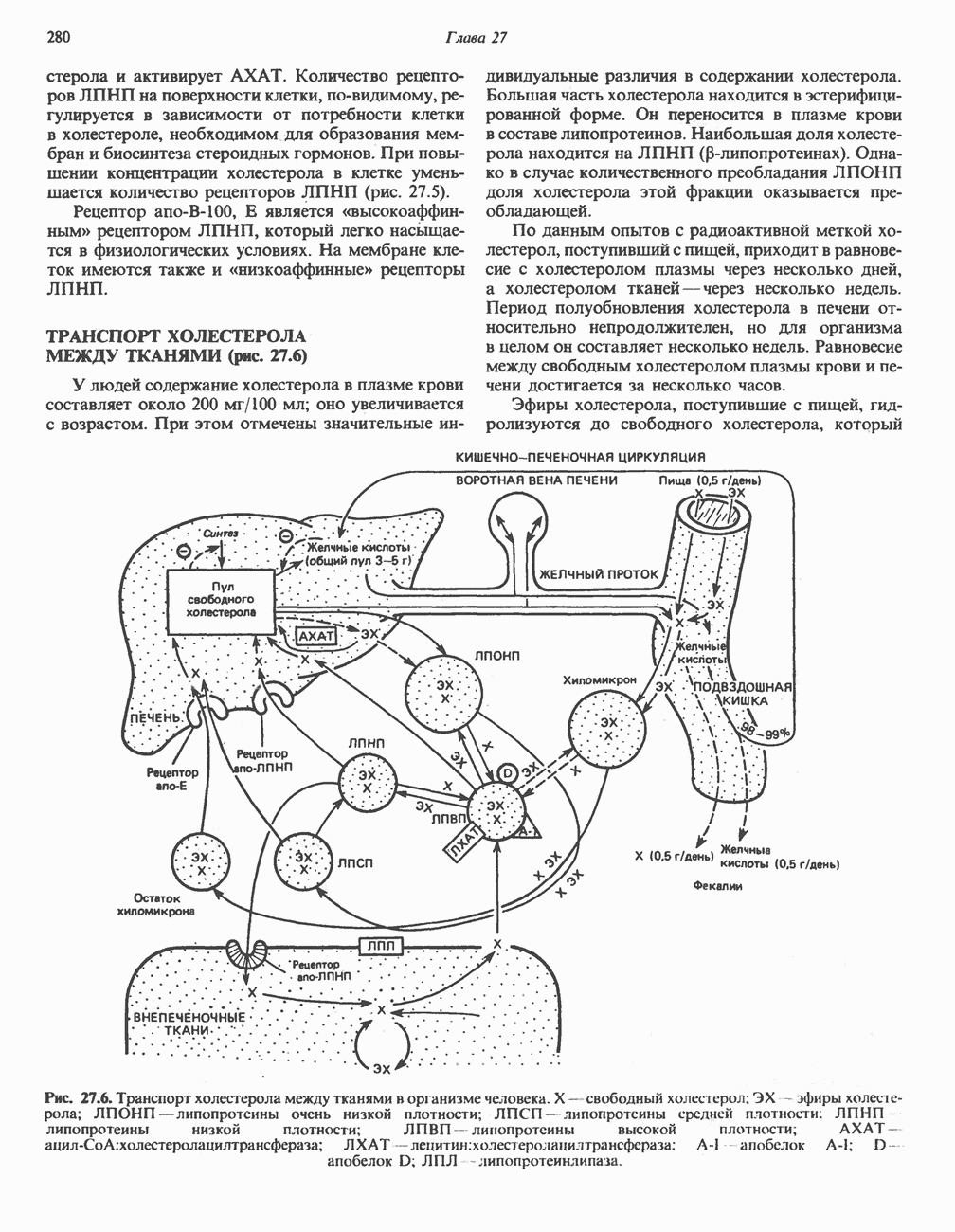
- ТРАНСПОРТ ХОЛЕСТЕРОЛА МЕЖДУ ТКАНЯМИ (рис. 27.6)
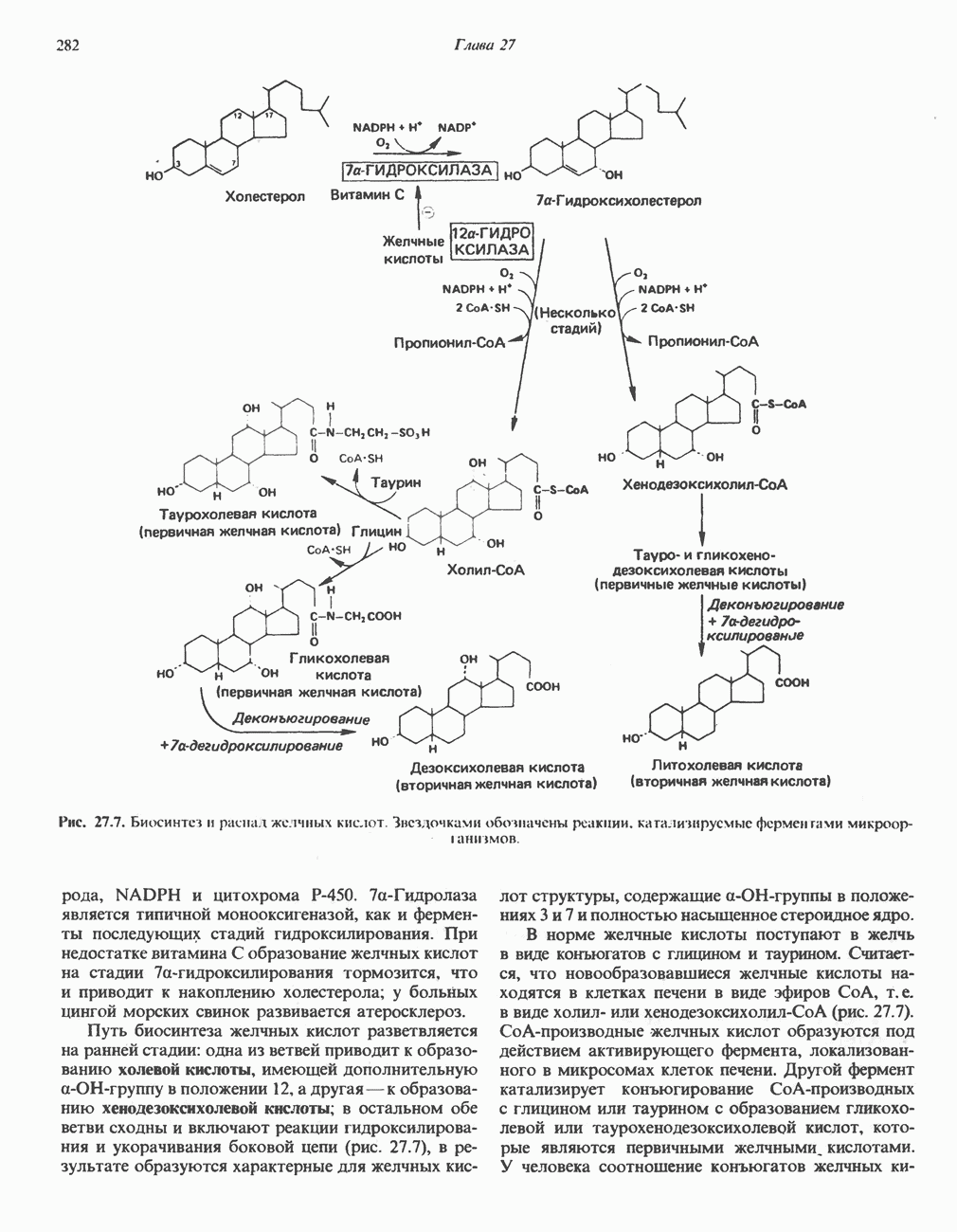
- ВЫВЕДЕНИЕ ХОЛЕСТЕРОЛА И ОБРАЗОВАНИЕ СОЛЕЙ ЖЕЛЧНЫХ КИСЛОТ
- КИШЕЧНО-ПЕЧЕНОЧНАЯ ЦИРКУЛЯЦИЯ ЖЕЛЧНЫХ КИСЛОТ
- КЛИНИЧЕСКИЕ АСПЕКТЫ
- Глава 28. Регуляция метаболизма липидов и источники энергии в тканях
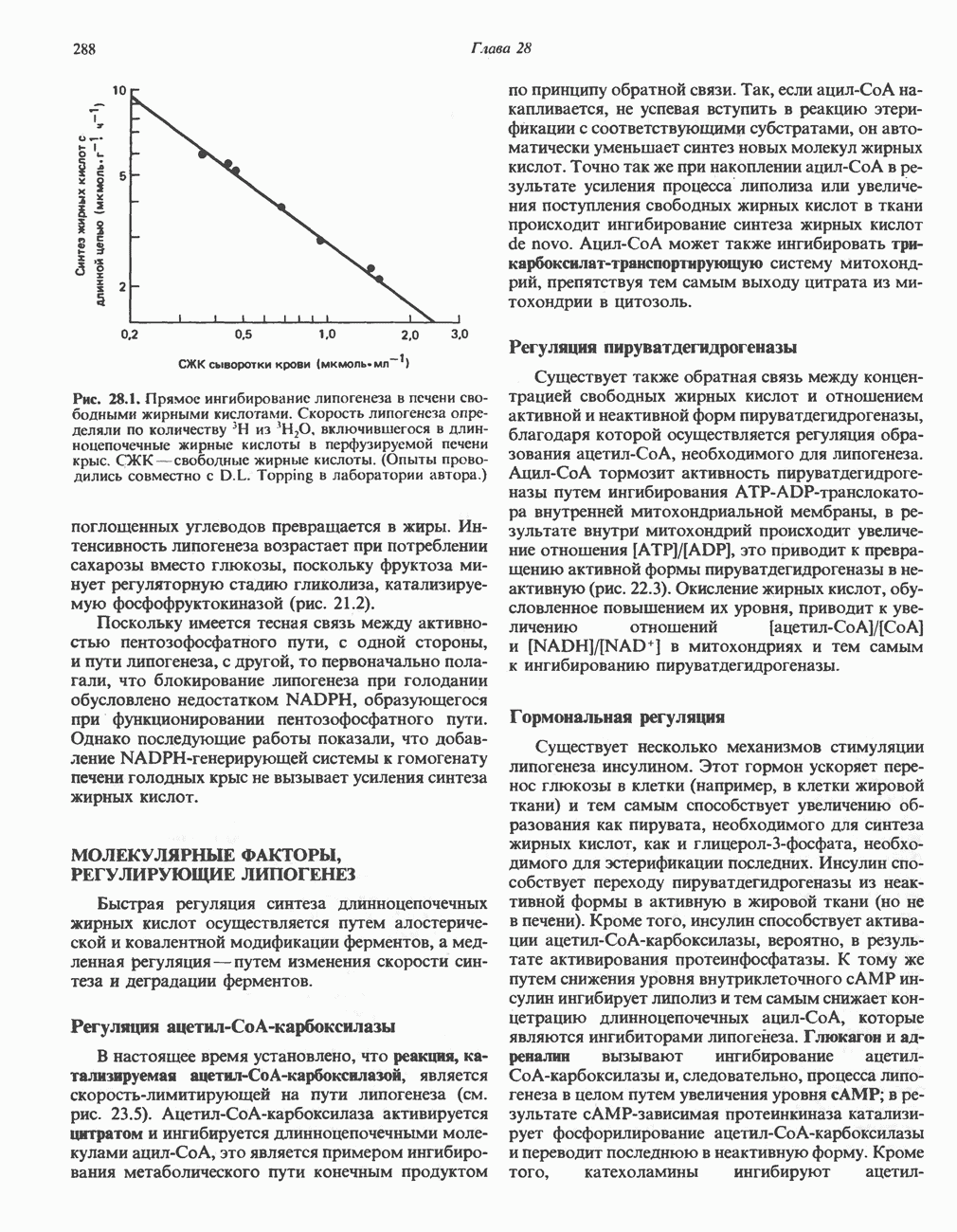
- РЕГУЛЯЦИЯ БИОСИНТЕЗА ЖИРНЫХ КИСЛОТ (ЛИПОГЕНЕЗА)
- МОЛЕКУЛЯРНЫЕ ФАКТОРЫ, РЕГУЛИРУЮЩИЕ ЛИПОГЕНЕЗ
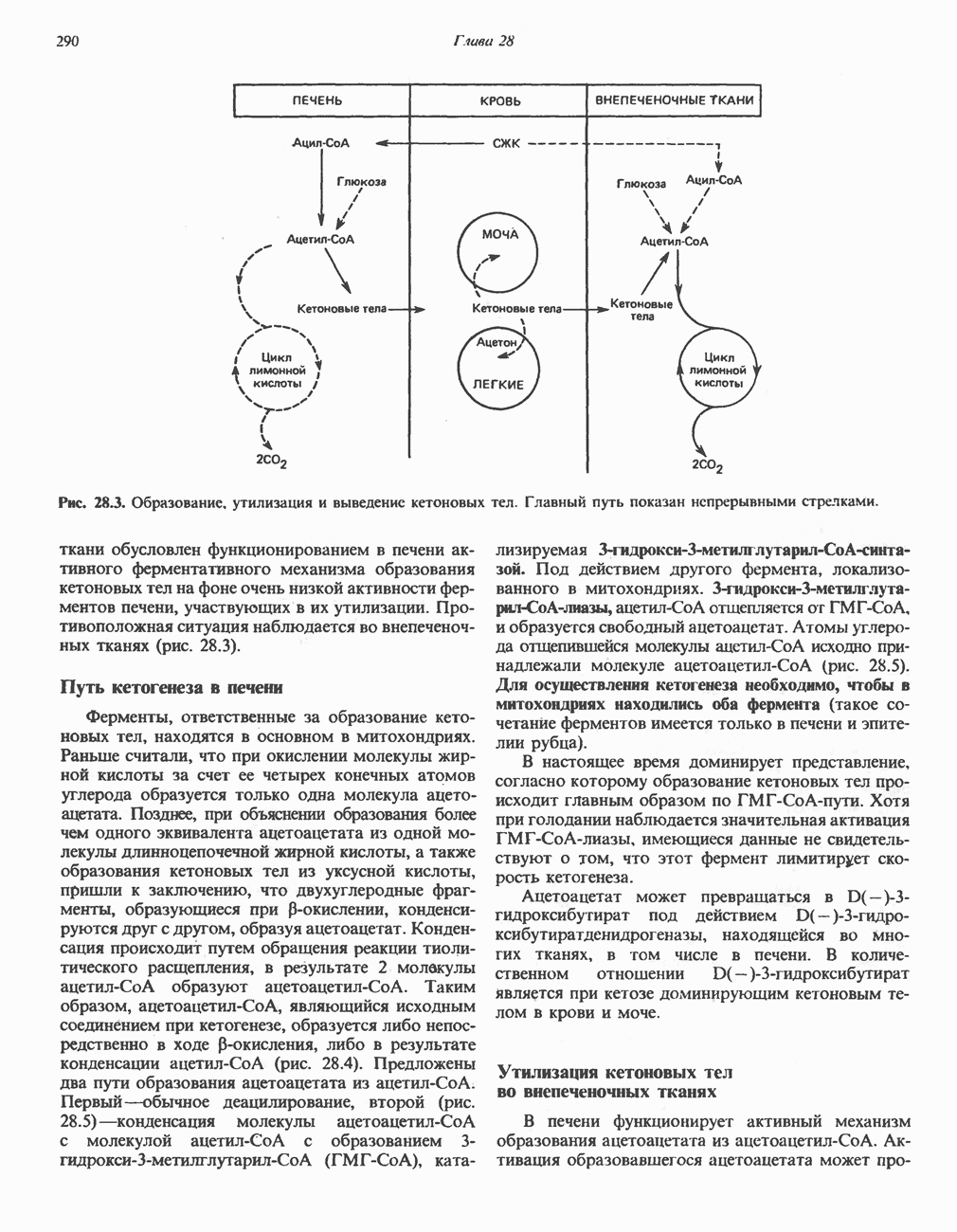
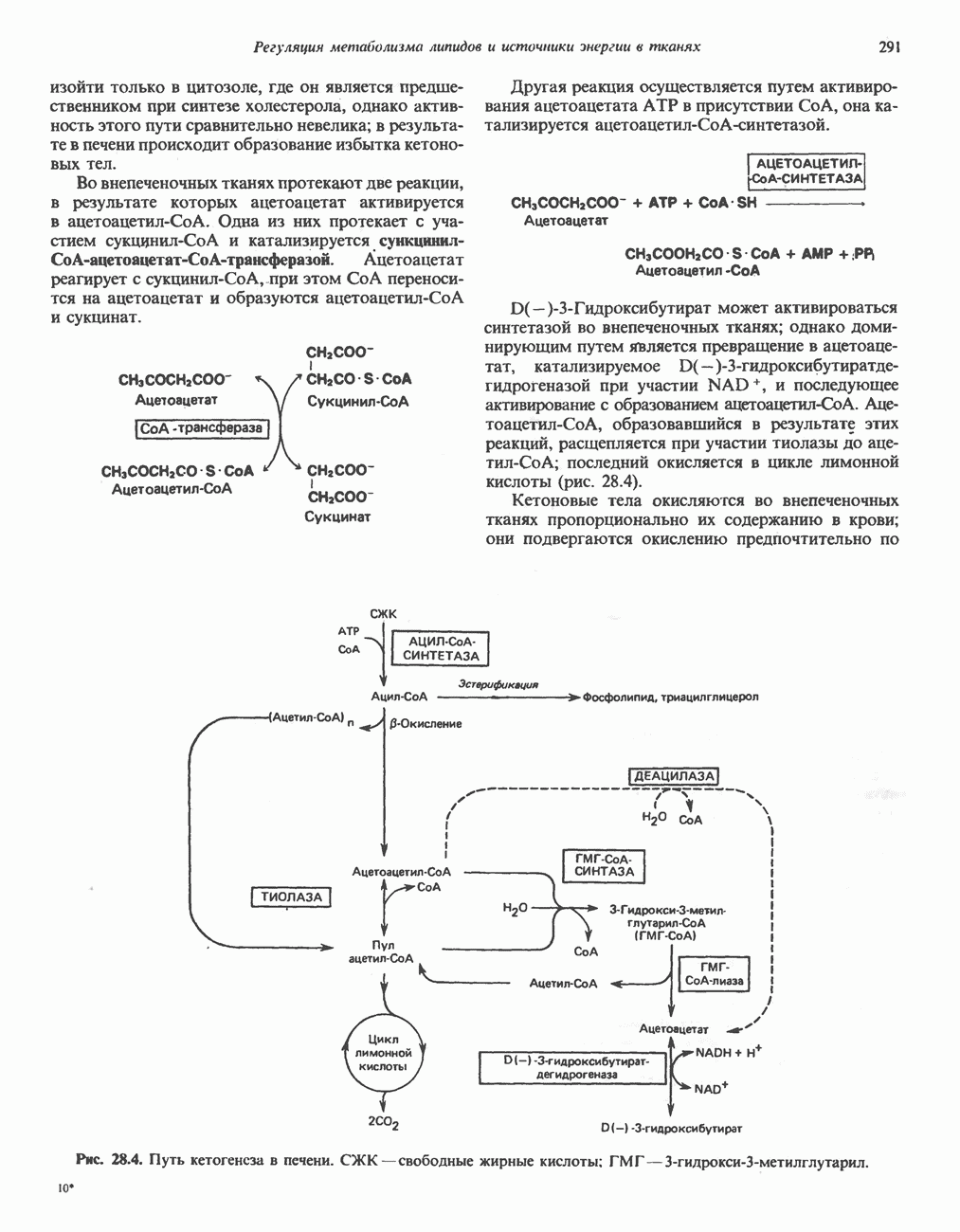
- РЕГУЛЯЦИЯ ОКИСЛЕНИЯ ЖИРНЫХ КИСЛОТ
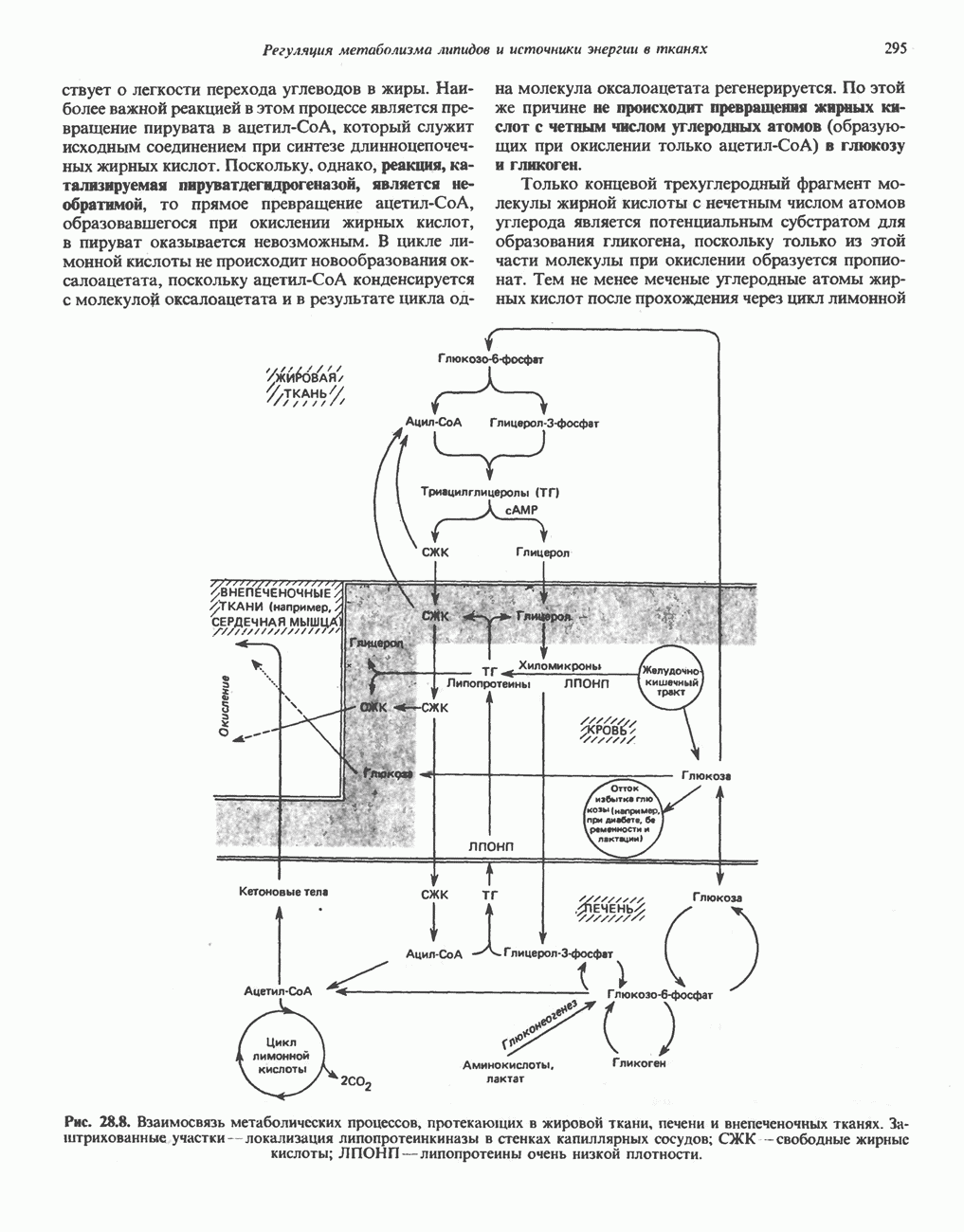
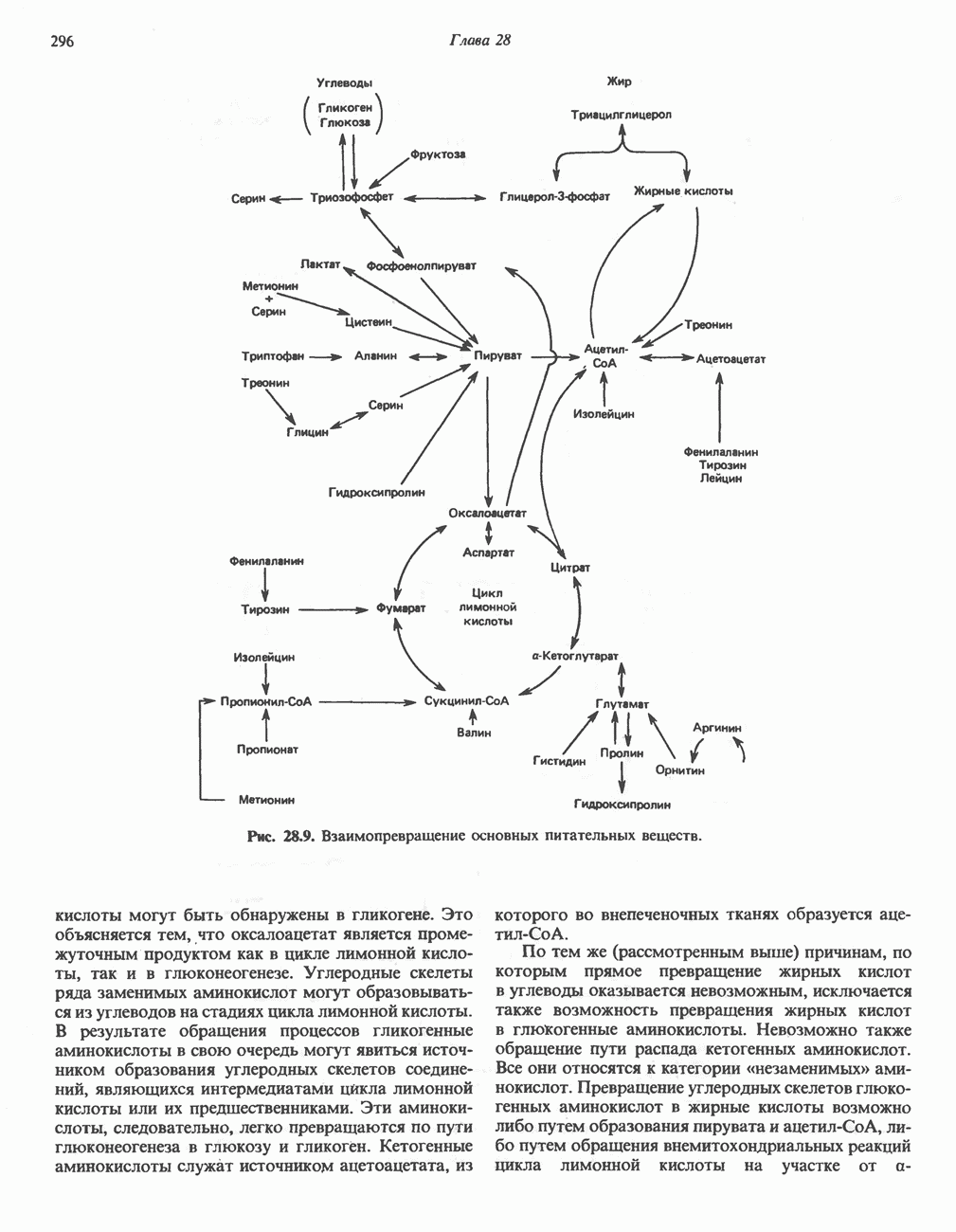
- ВЗАИМНОЕ ПРЕВРАЩЕНИЕ ОСНОВНЫХ ПИТАТЕЛЬНЫХ ВЕЩЕСТВ (рис. 28.9)
- ЭКОНОМИКА УГЛЕВОДНОГО И ЛИПИДНОГО ОБМЕНА В ОРГАНИЗМЕ
- ГОЛОДАНИЕ
- Раздел III. Метаболизм белков и аминокислот
- Глава 29. Биосинтез аминокислот
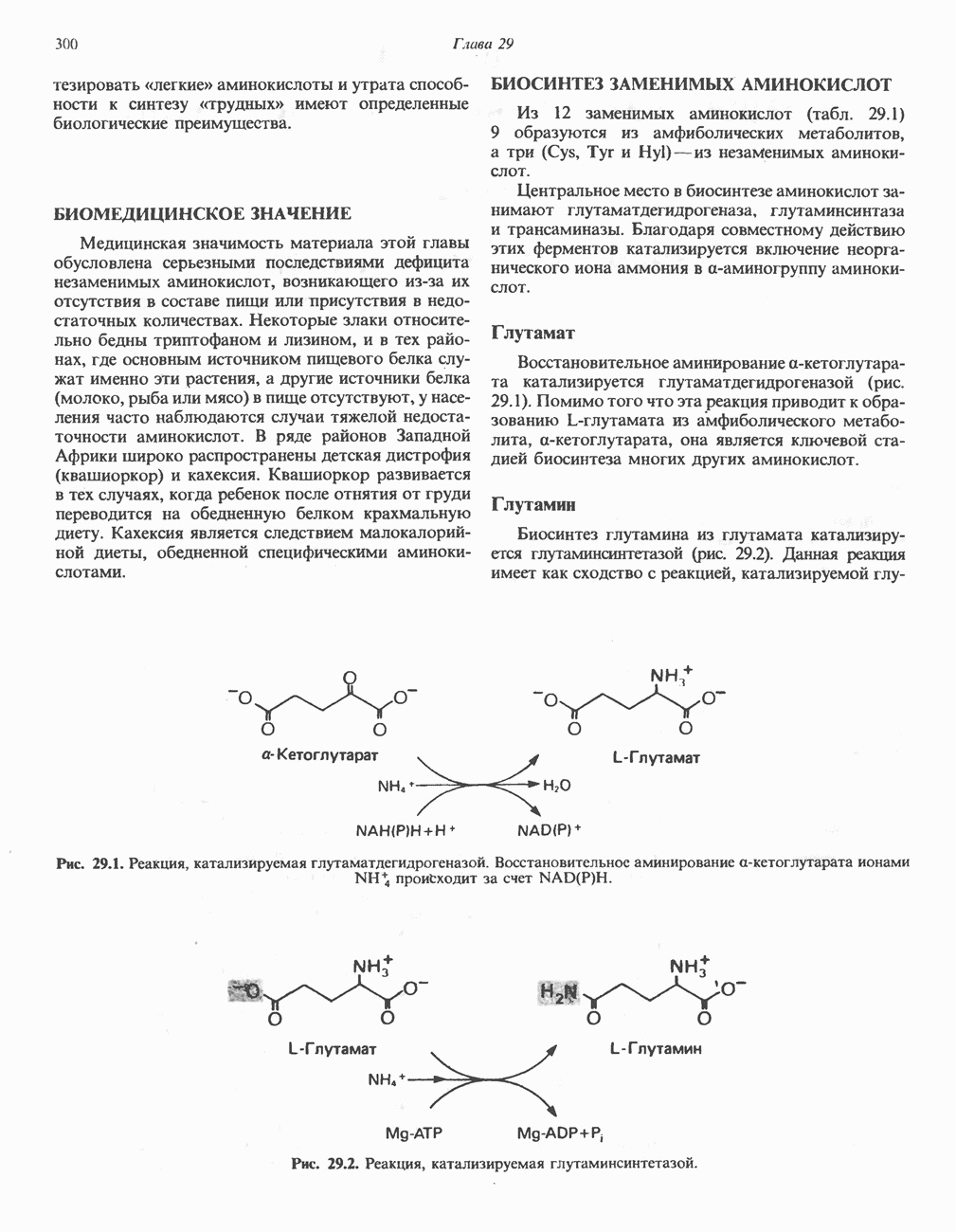
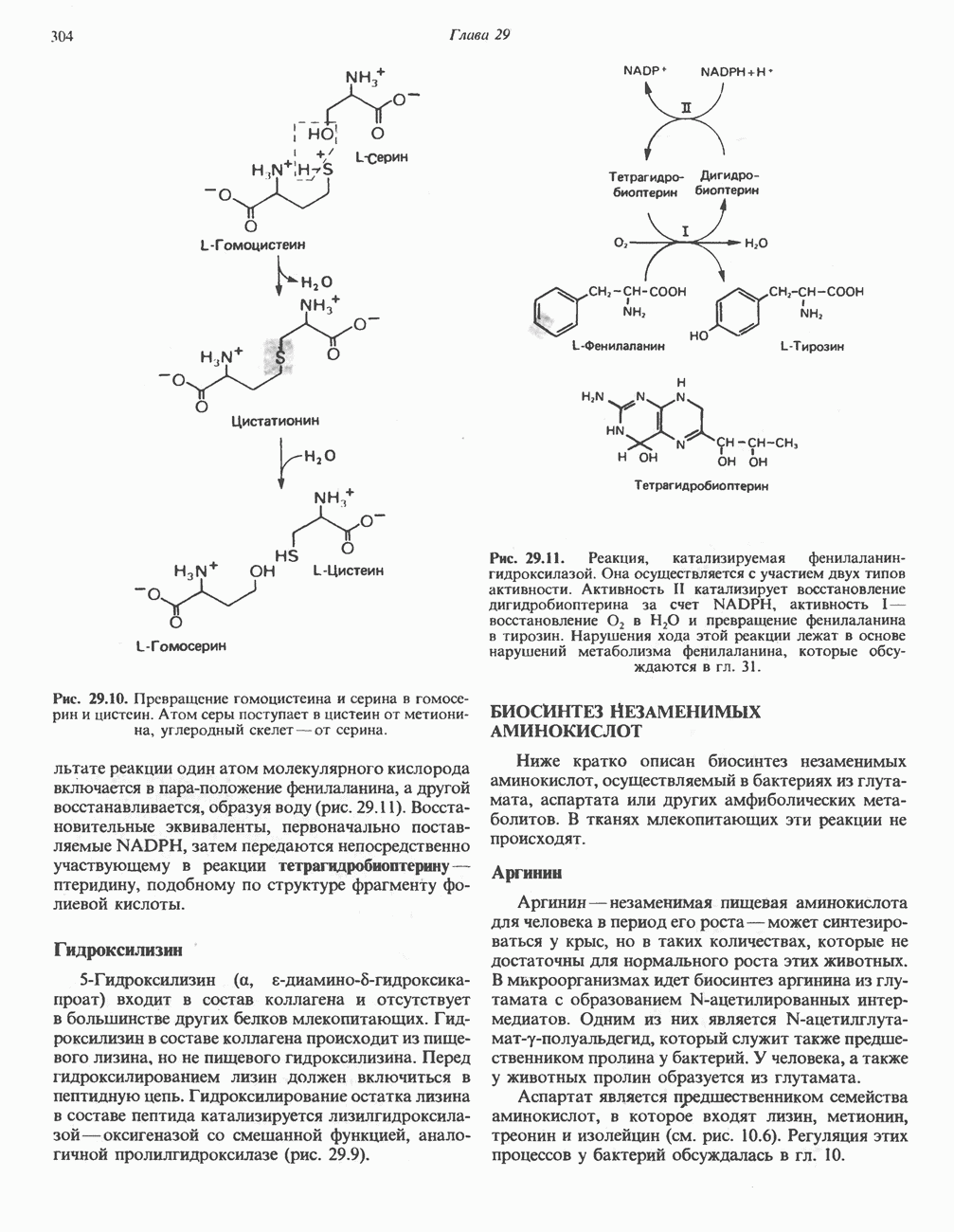
- БИОСИНТЕЗ ЗАМЕНИМЫХ АМИНОКИСЛОТ
- БИОСИНТЕЗ НЕЗАМЕНИМЫХ АМИНОКИСЛОТ
- Глава 30. Катаболизм азота аминокислот
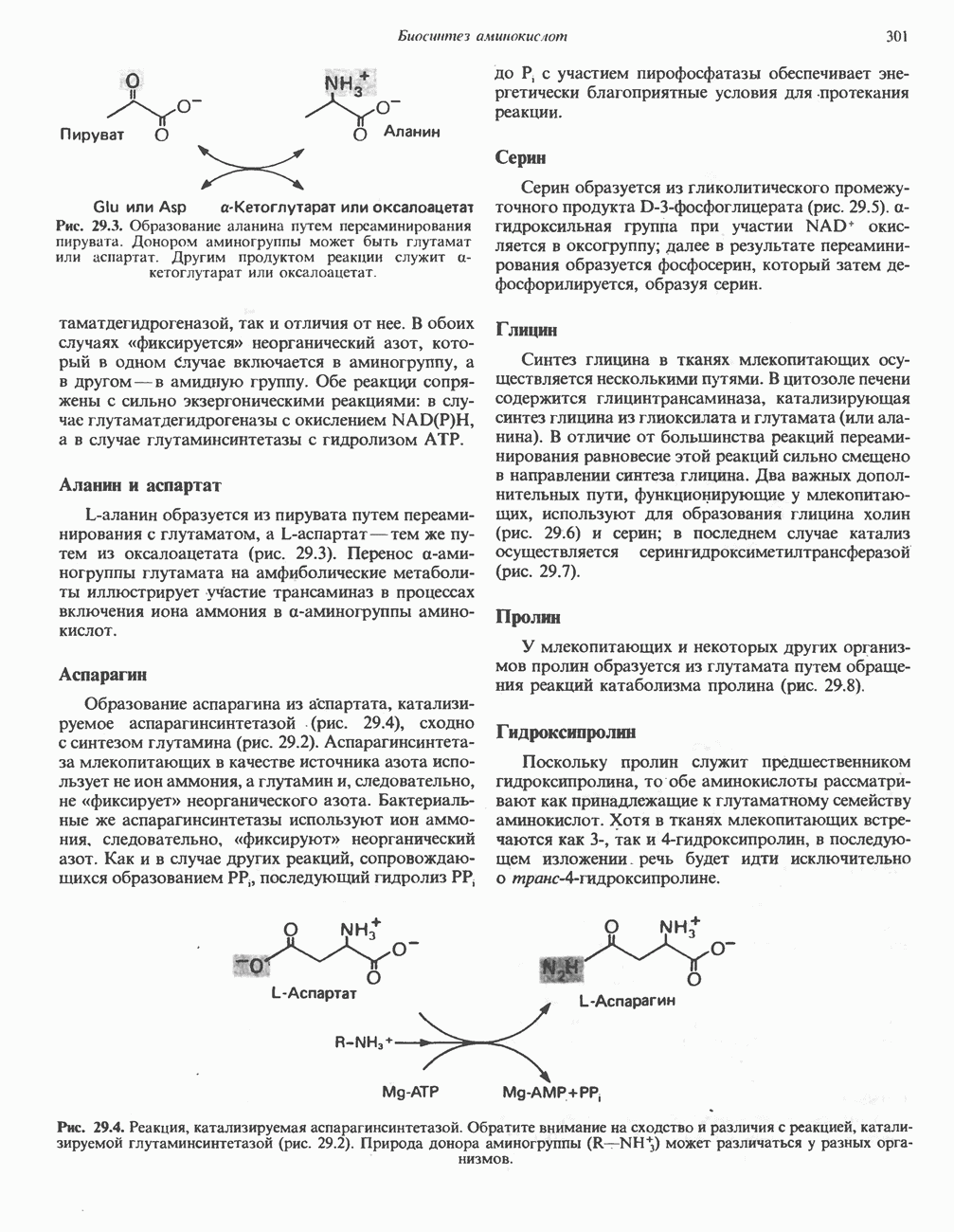
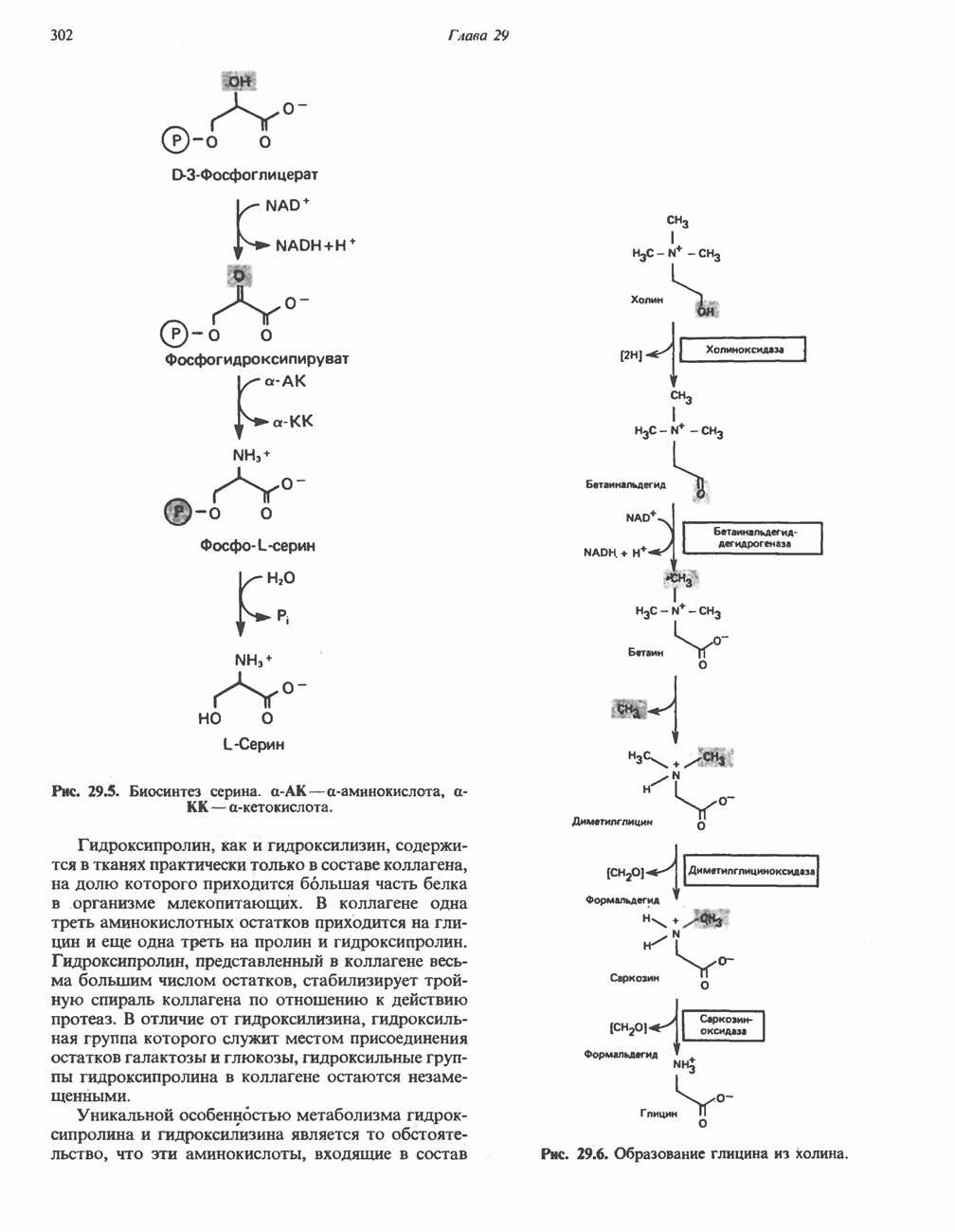
- ПЕРЕАМИНИРОВАНИЕ
- ОКИСЛИТЕЛЬНОЕ ДЕЗАМИНИРОВАНИЕ
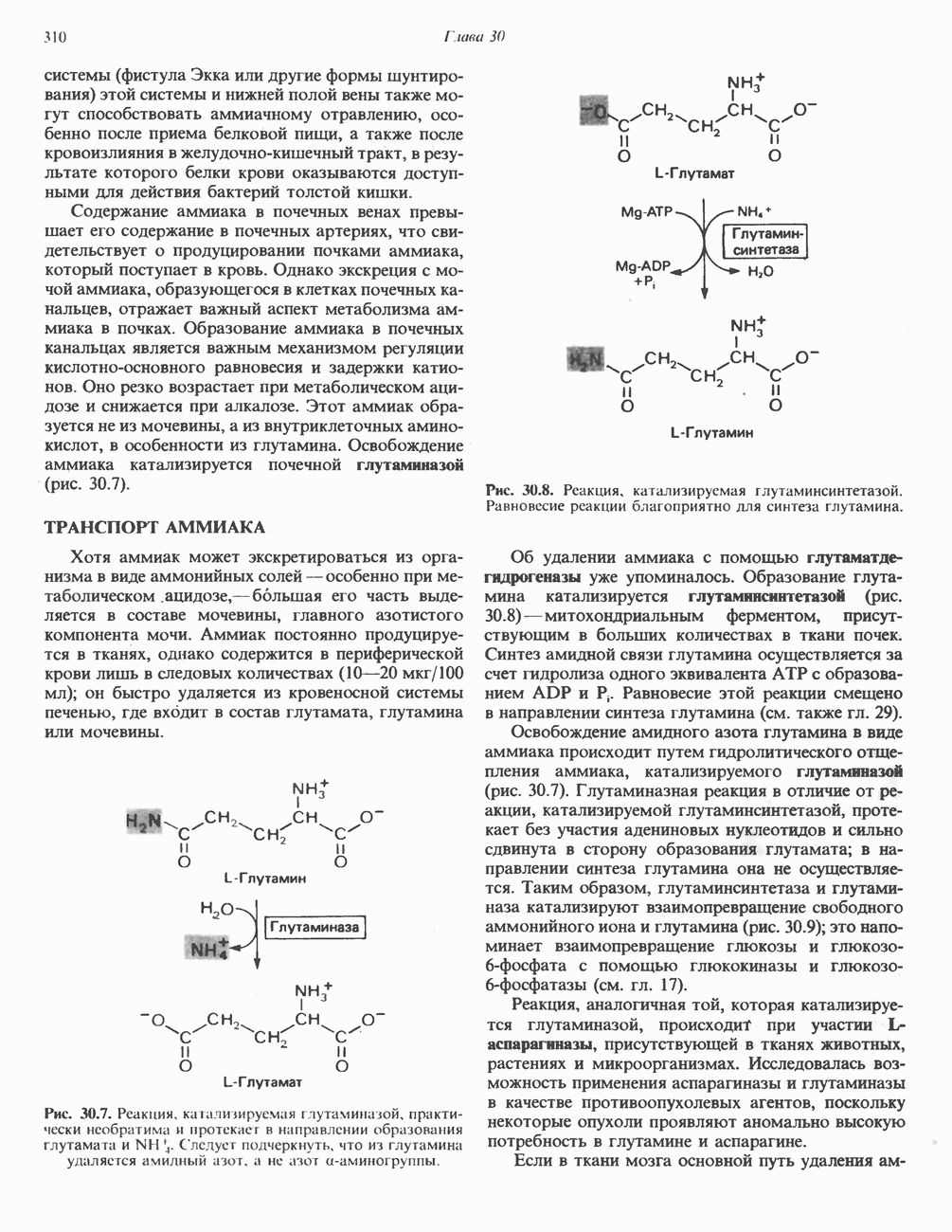
- ОБРАЗОВАНИЕ АММИАКА
- ТРАНСПОРТ АММИАКА
- ОБМЕН АМИНОКИСЛОТАМИ МЕЖДУ ОРГАНАМИ В ПОСТАБСОРБТИВНОМ СОСТОЯНИИ
- ОБМЕН АМИНОКИСЛОТ МЕЖДУ ОРГАНАМИ ПОСЛЕ ПРИЕМА ПИЩИ
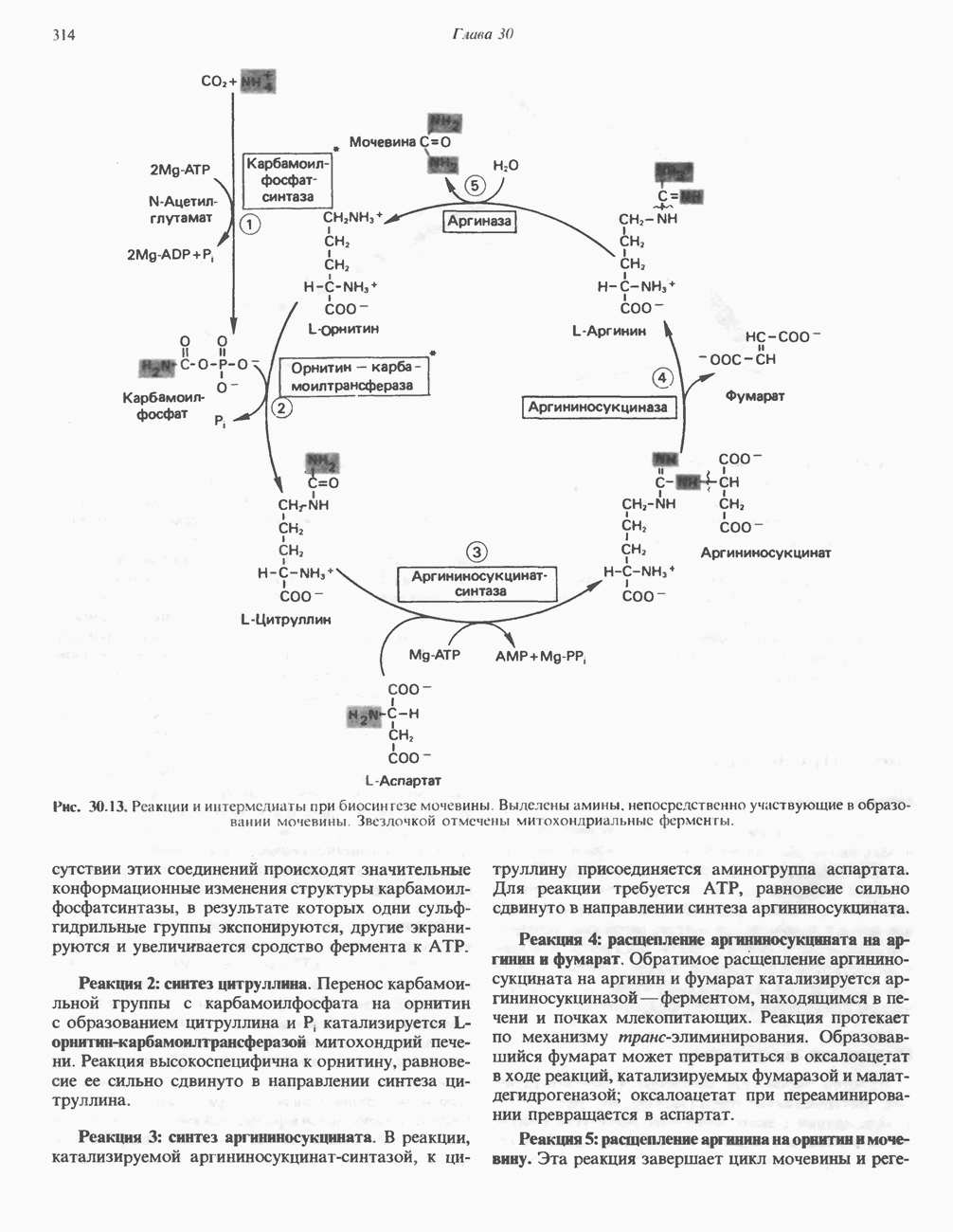
- БИОСИНТЕЗ МОЧЕВИНЫ
- РЕГУЛЯЦИЯ СИНТЕЗА МОЧЕВИНЫ
- МЕТАБОЛИЧЕСКИЕ НАРУШЕНИЯ ЦИКЛА МОЧЕВИНЫ
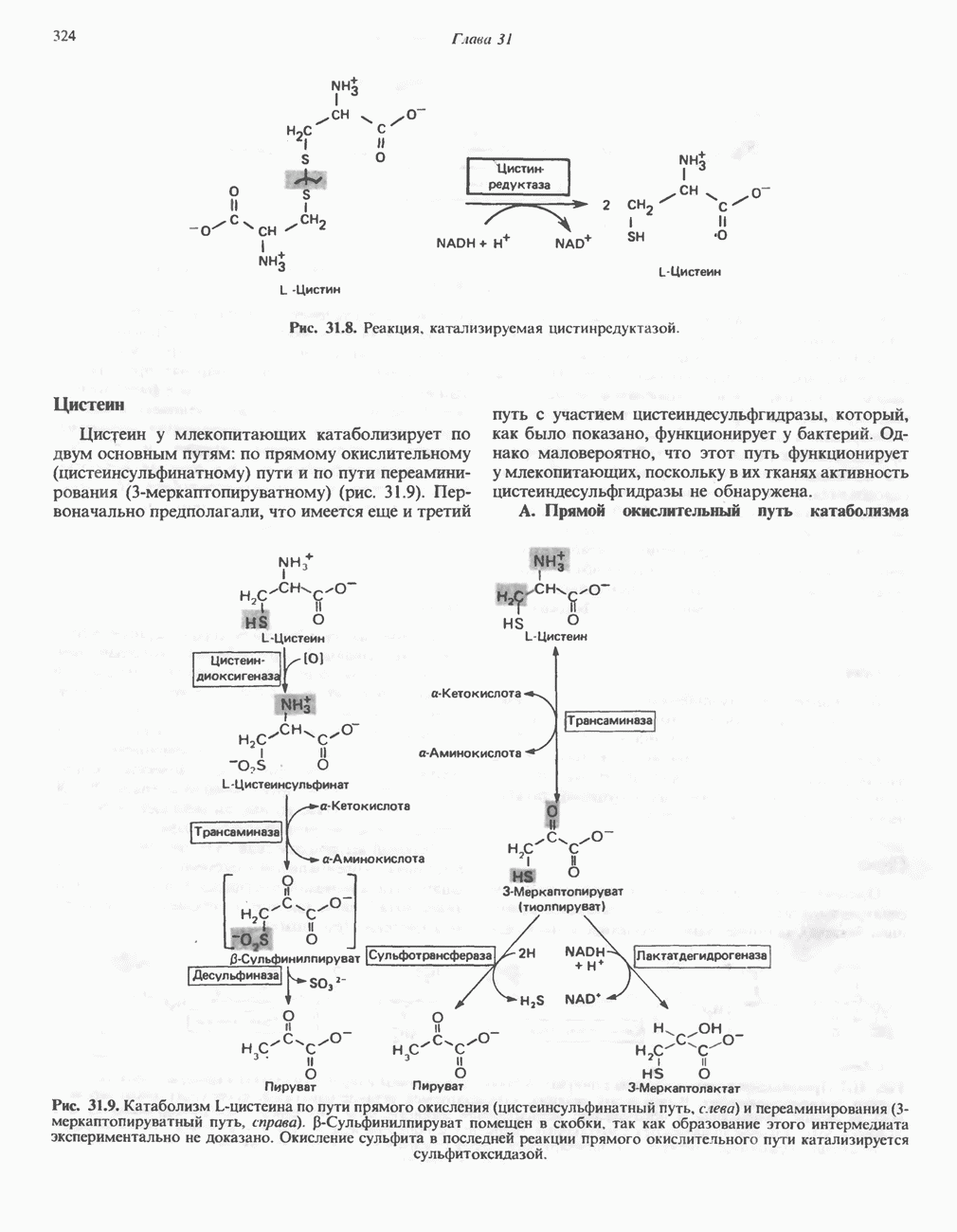
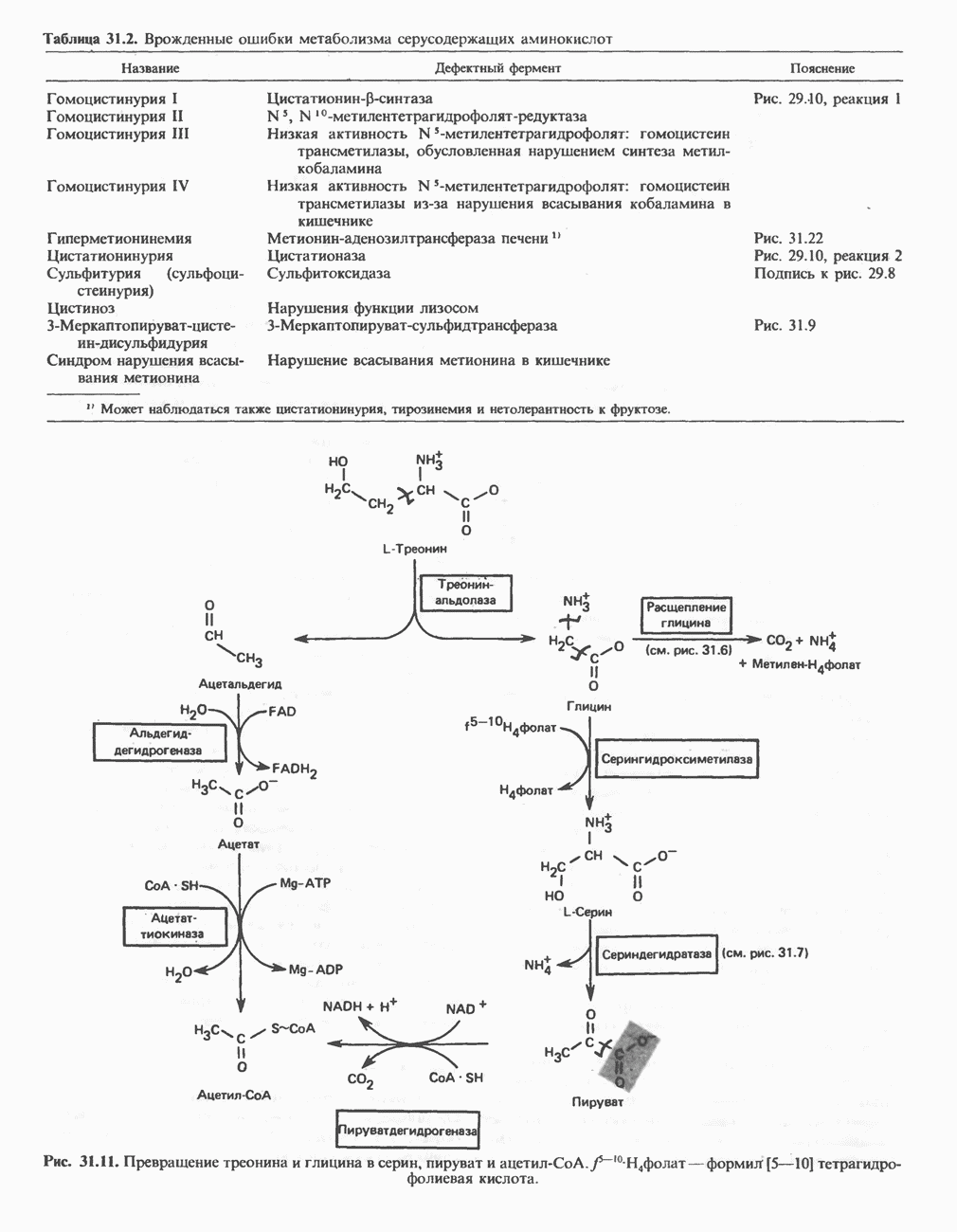
- Глава 31. Катаболизм углеродного скелета аминокислот
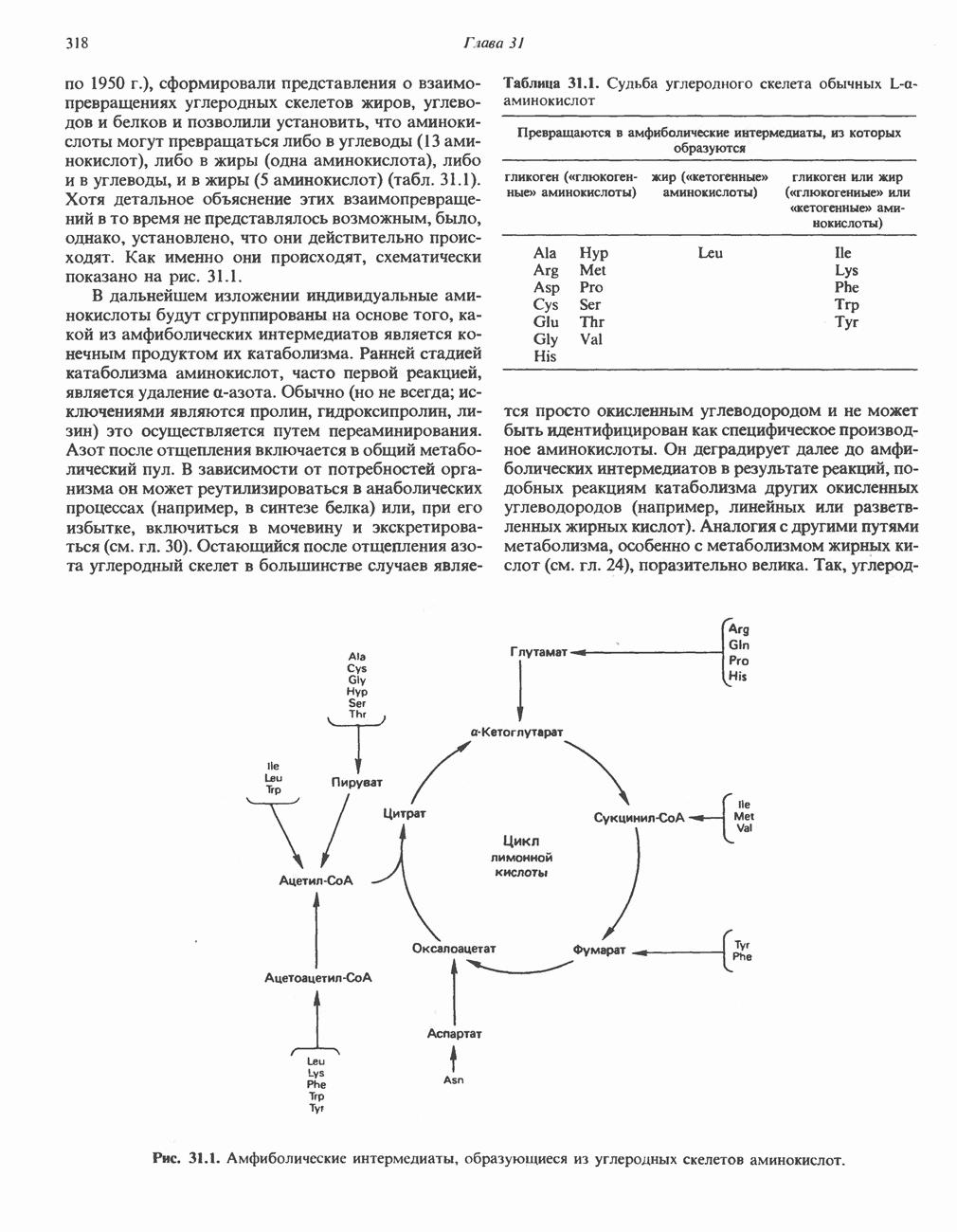
- ПРЕВРАЩЕНИЕ УГЛЕРОДНОГО СКЕЛЕТА ОБЫЧНЫХ L-a-АМИНОКИСЛОТ В АМФИБОЛИЧЕСКИЕ ИНТЕРМЕДИАТЫ
- АМИНОКИСЛОТЫ, ОБРАЗУЮЩИЕ ОКСАЛОАЦЕТАТ
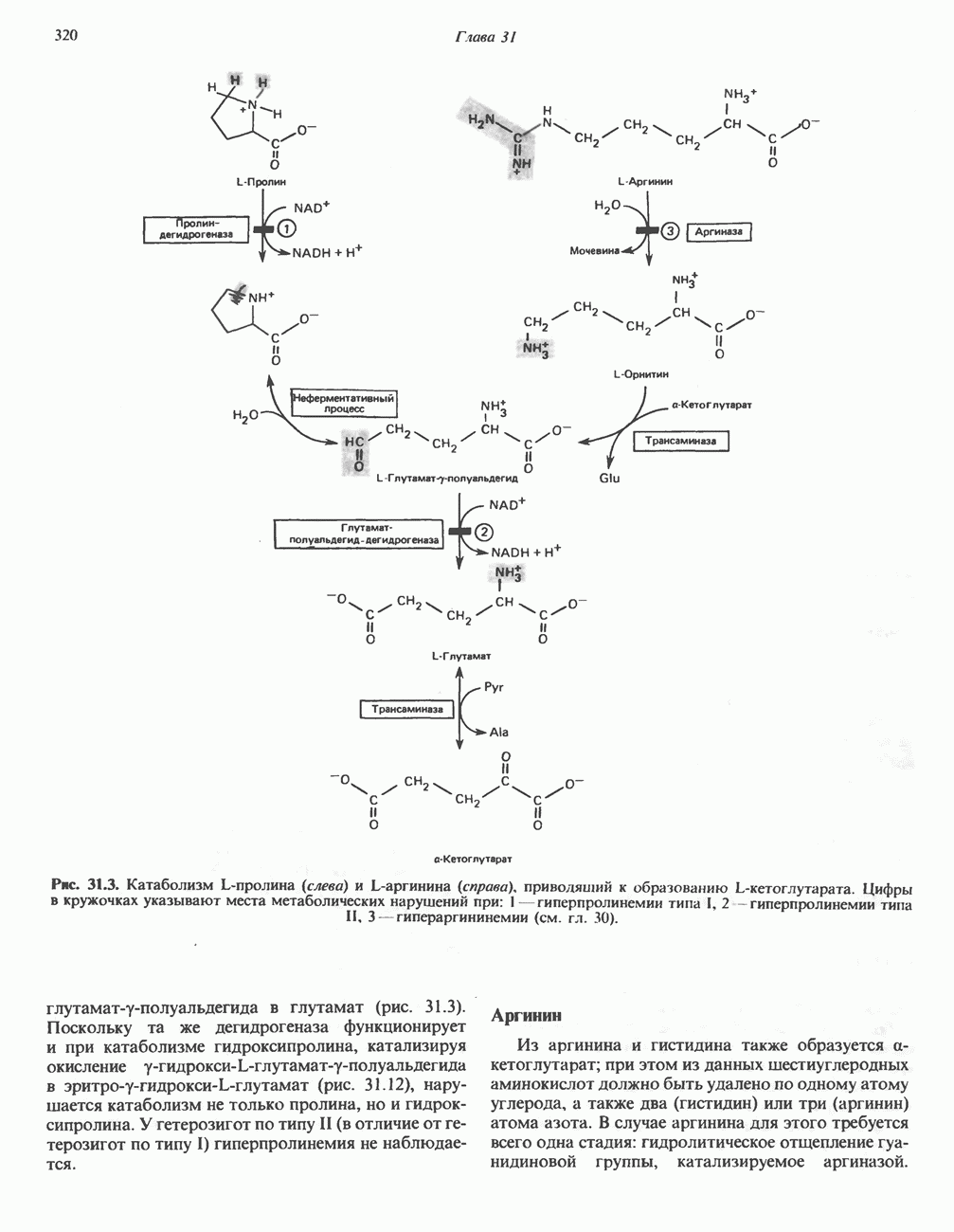
- АМИНОКИСЛОТЫ, ОБРАЗУЮЩИЕ а-КЕТОГЛУТАРАТ
- АМИНОКИСЛОТЫ, ОБРАЗУЮЩИЕ ПИРУВАТ
- АМИНОКИСЛОТЫ, ОБРАЗУЮЩИЕ АЦЕТИЛ-КОФЕРМЕНТ А
- АМИНОКИСЛОТЫ, ОБРАЗУЮЩИЕ СУКЦИНИЛ-КОФЕРМЕНТ А
- Глава 32. Превращение аминокислот в специализированные продукты
- ГЛИЦИН
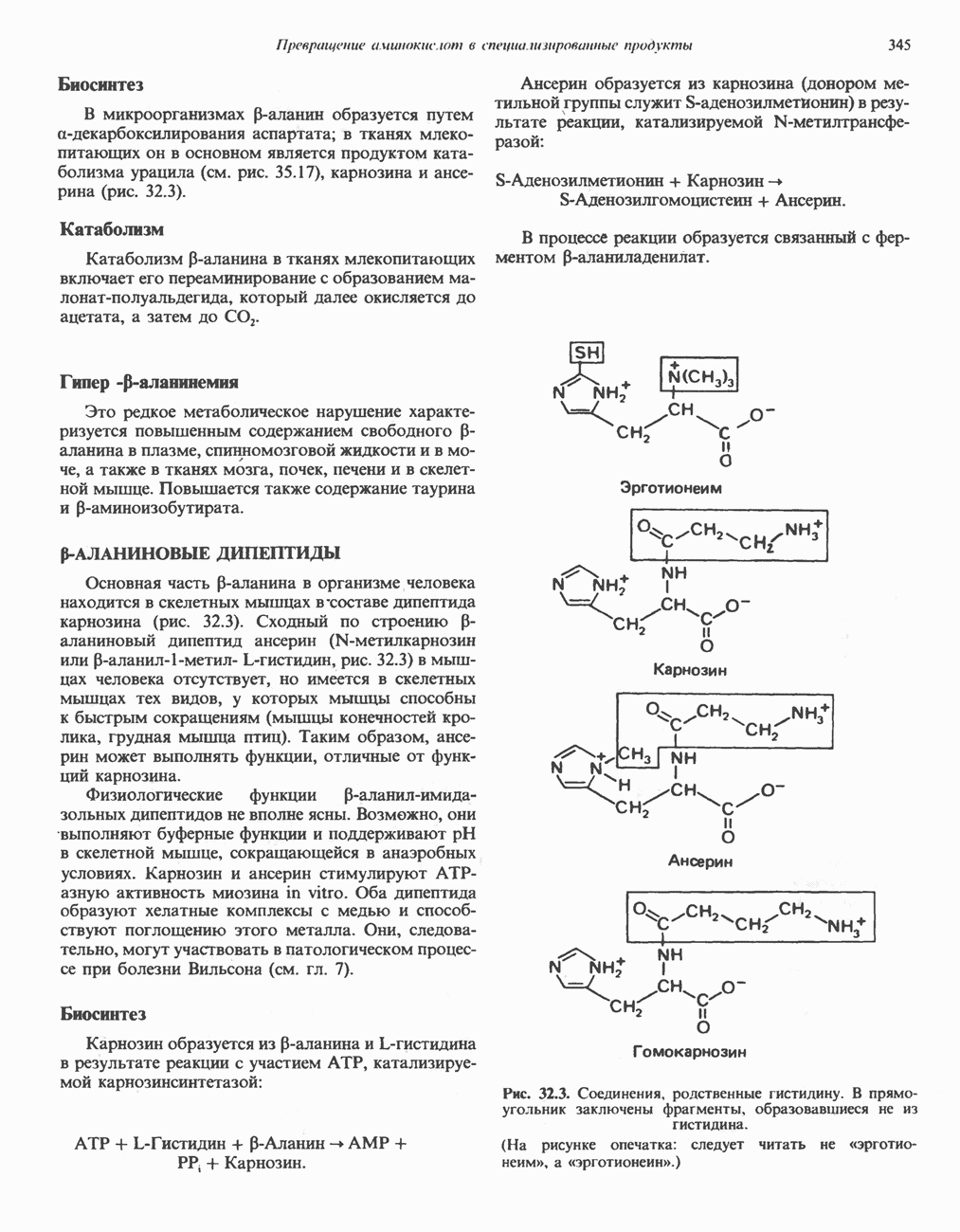
- р-АЛАНИНОВЫЕ ДИПЕПТИДЫ
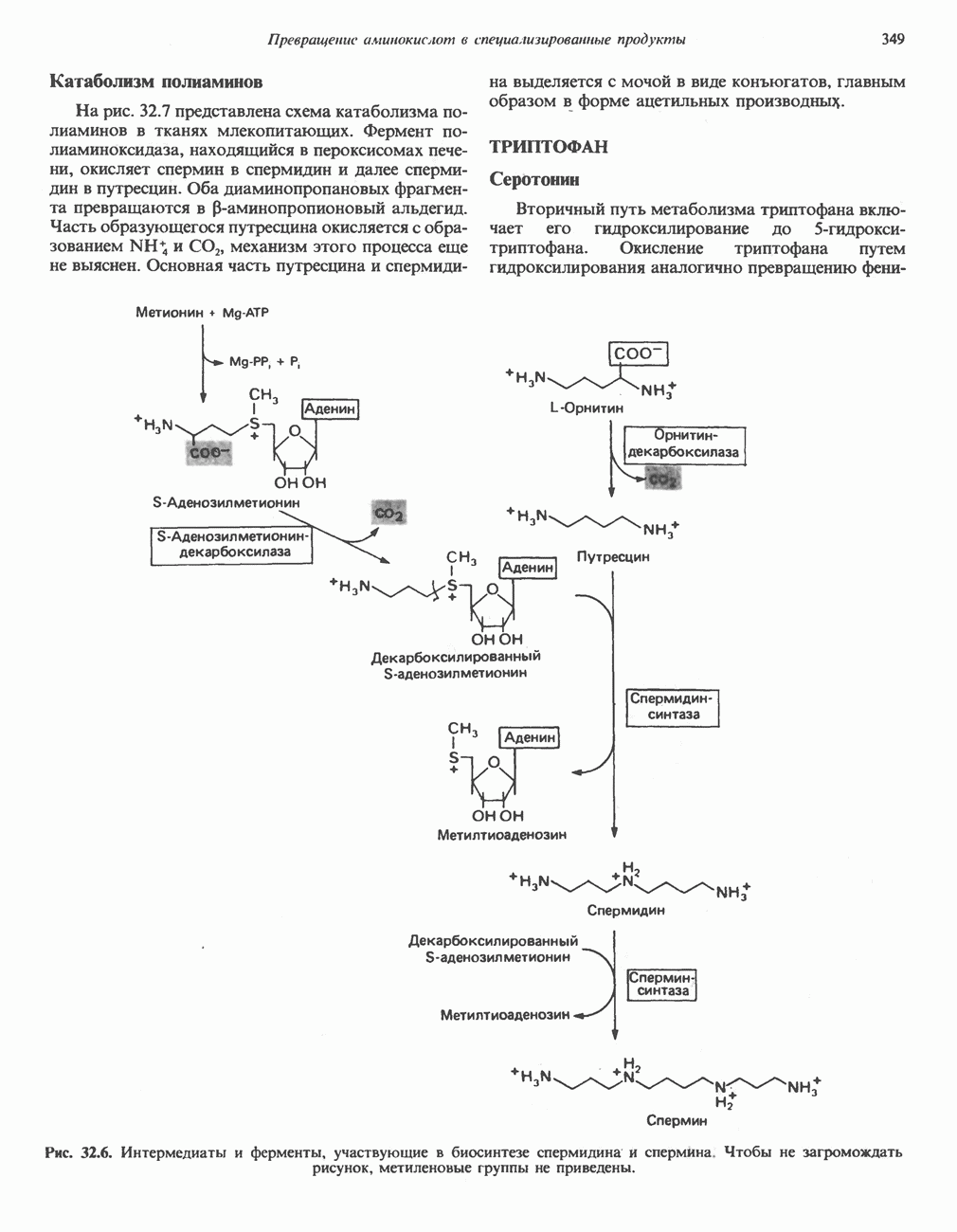
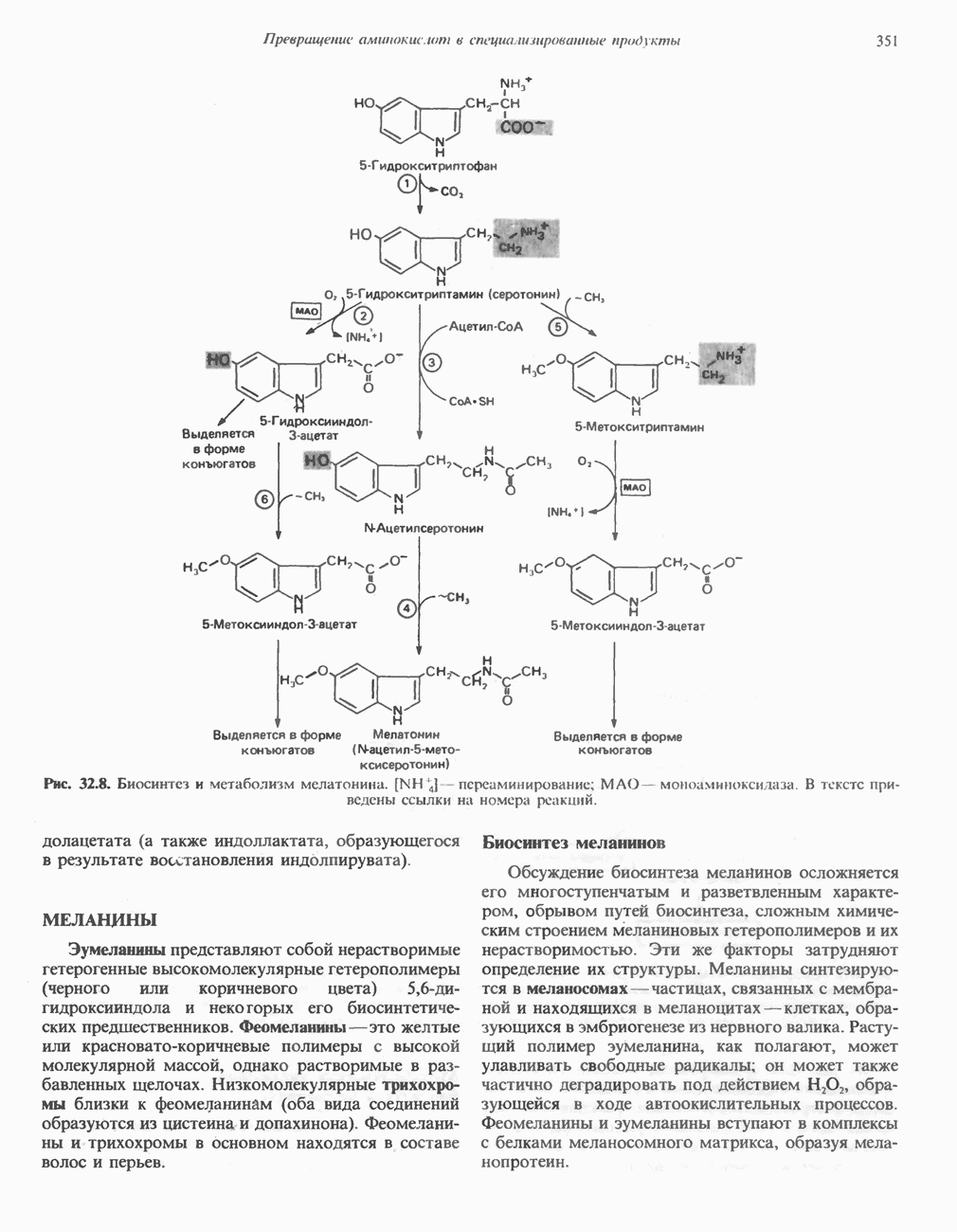
- ТРИПТОФАН
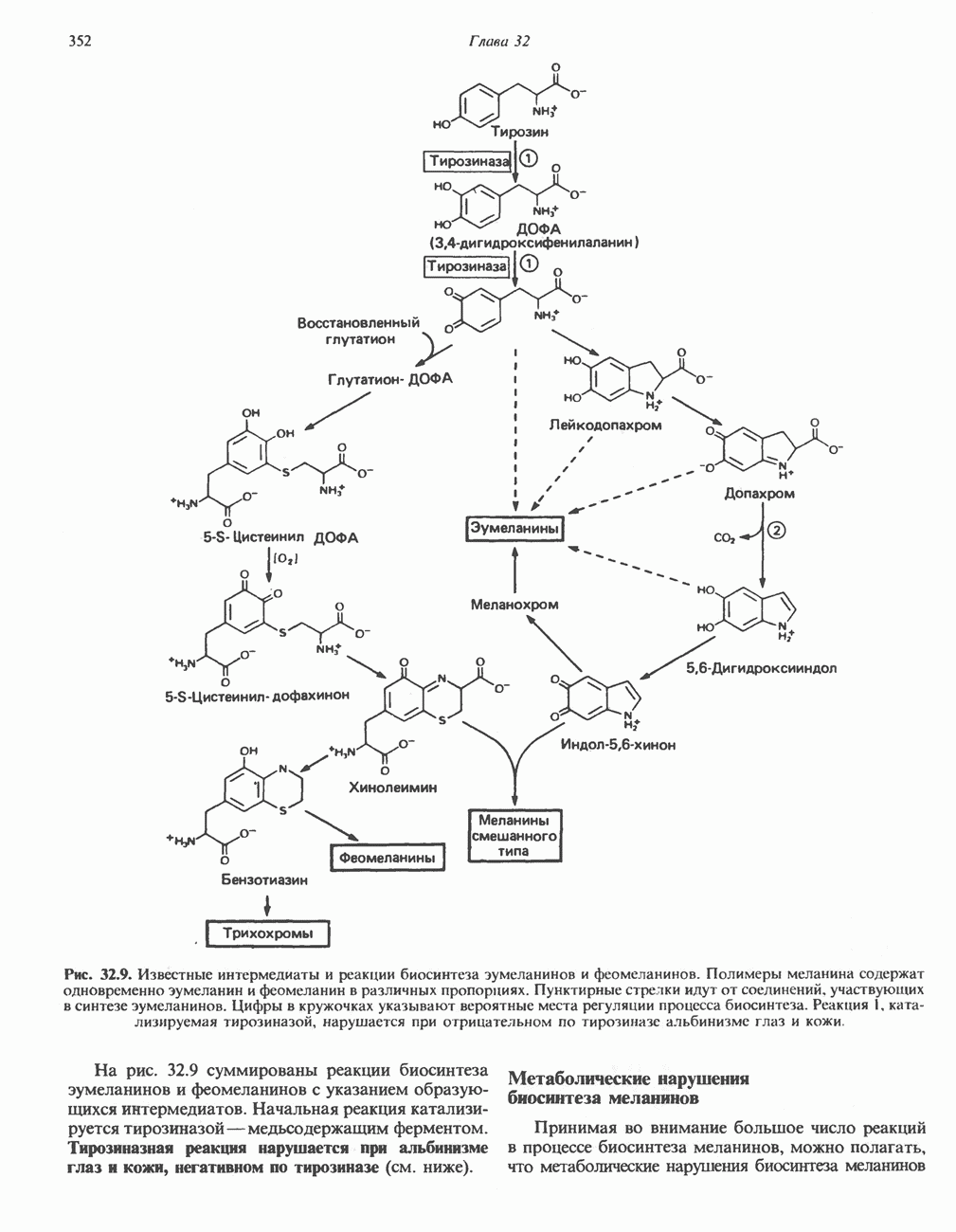
- МЕЛАНИНЫ
- ТИРОЗИН
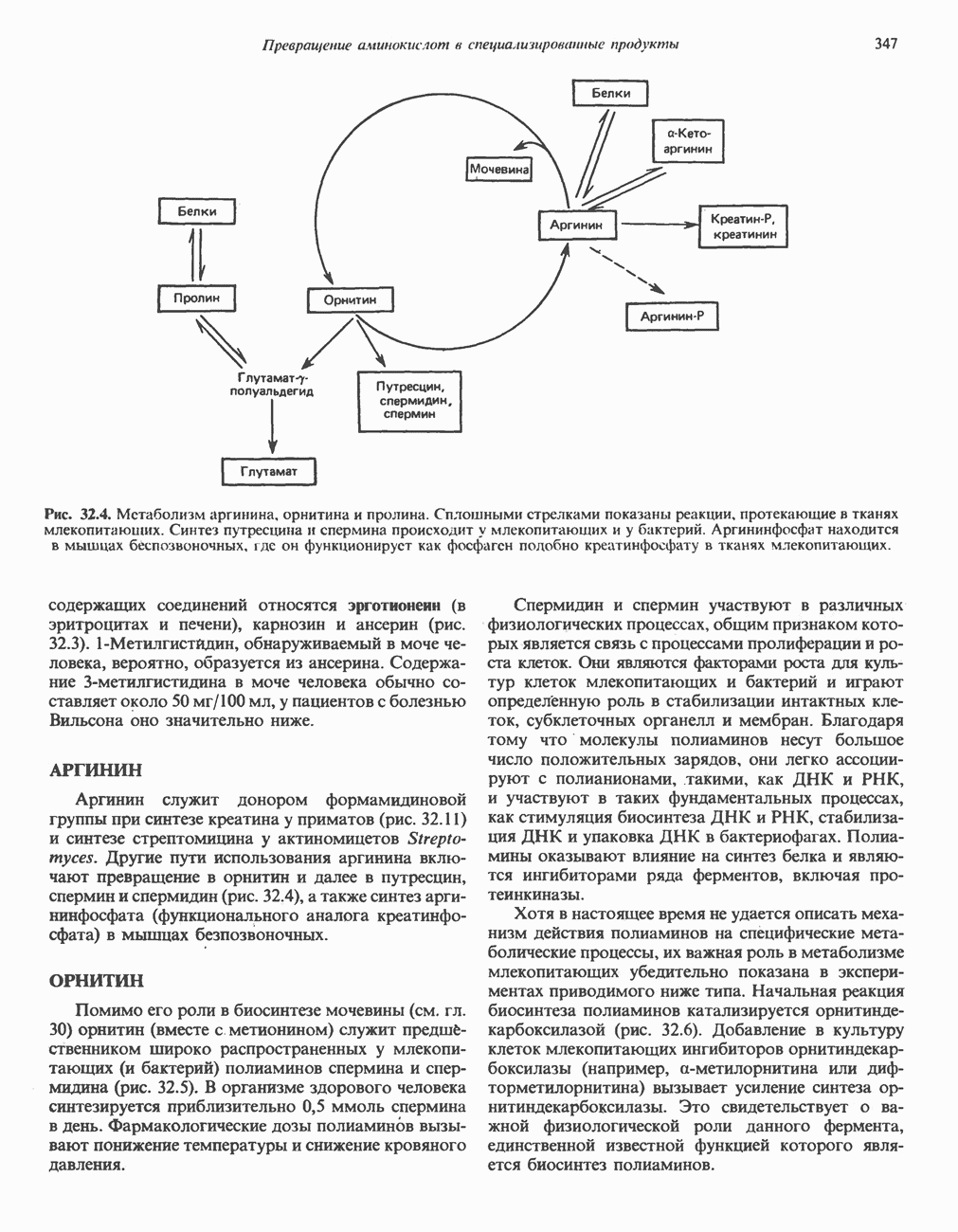
- КРЕАТИН И КРЕАТИНИН
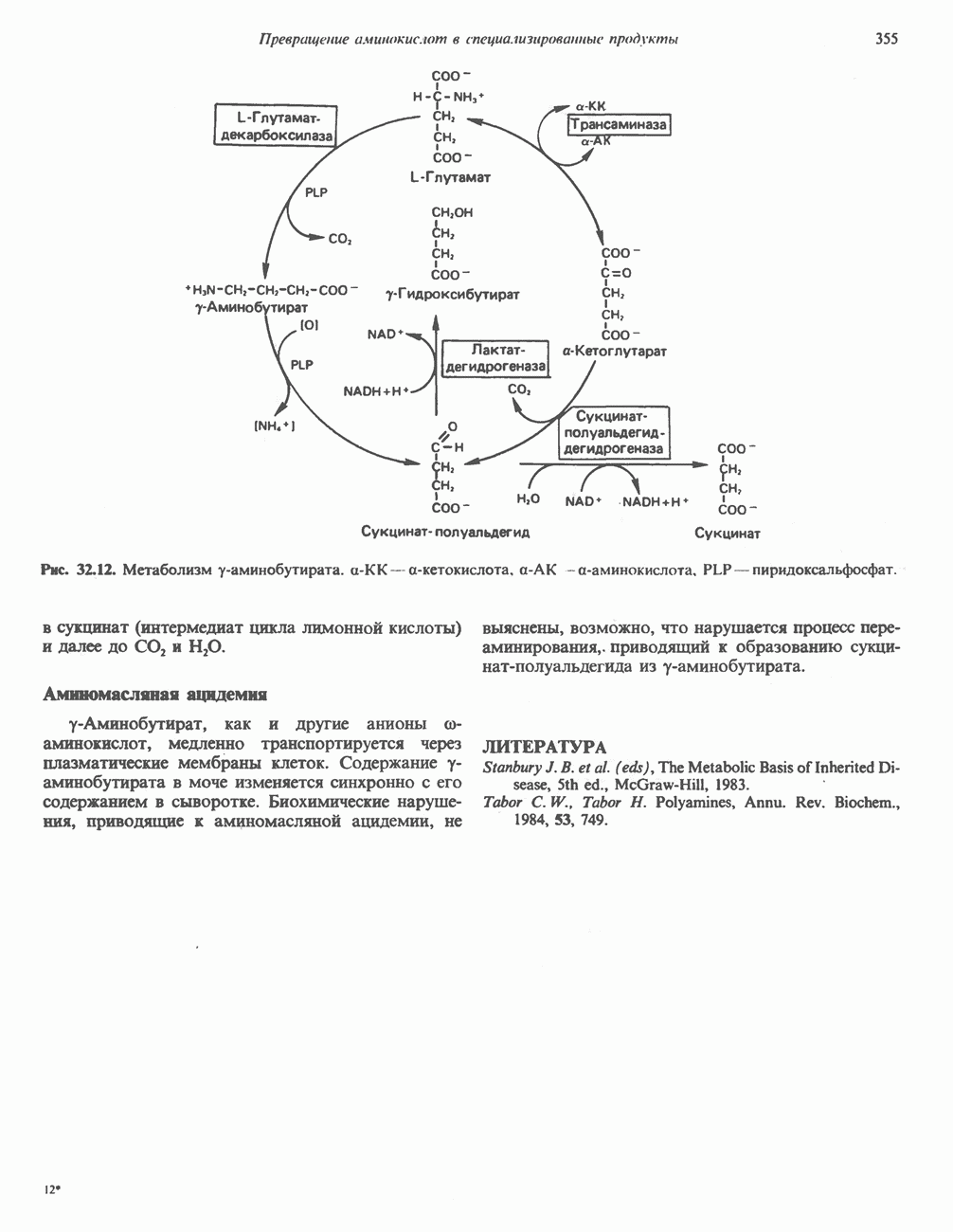
- у-АМИНОБУТИРАТ
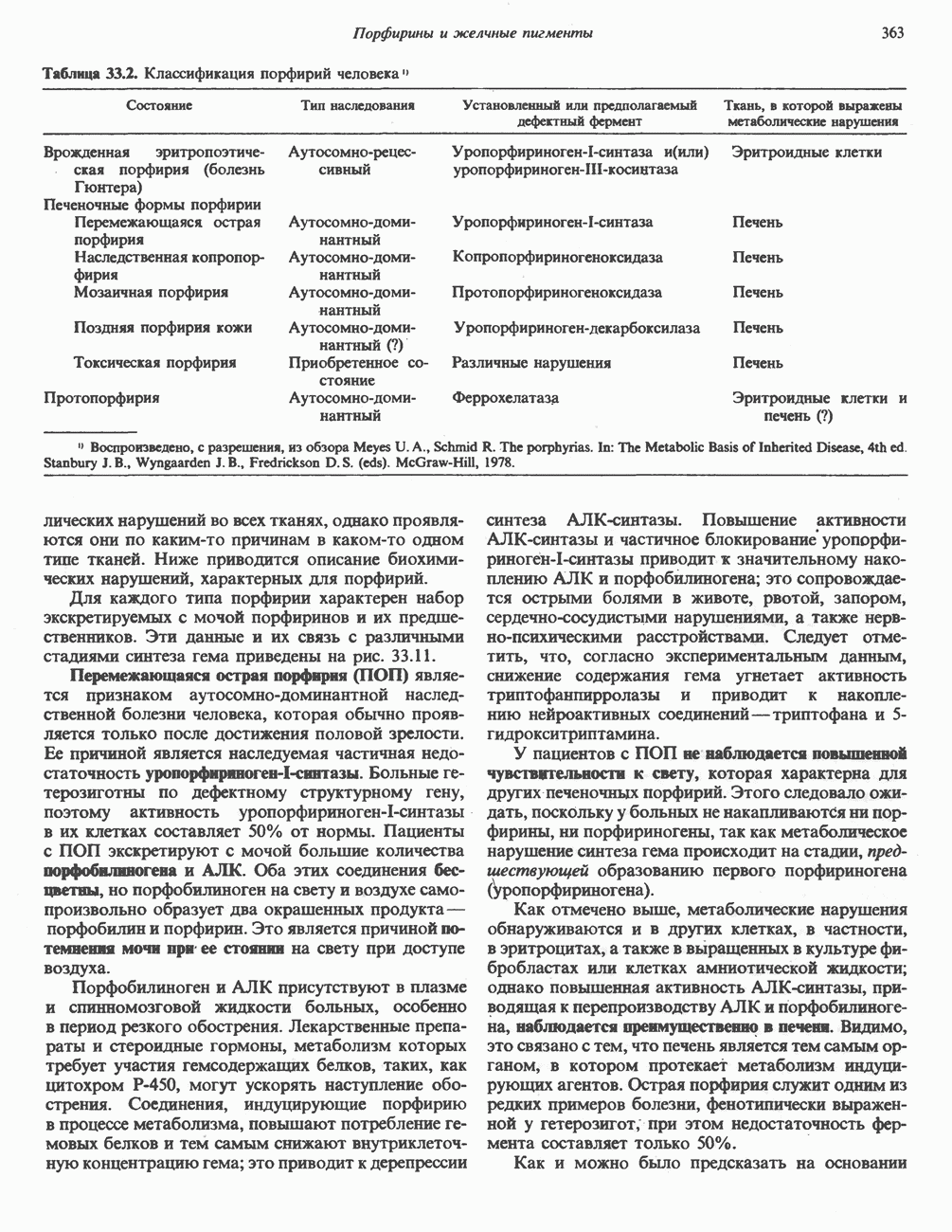
- Глава 33. Порфирины и желчные пигменты
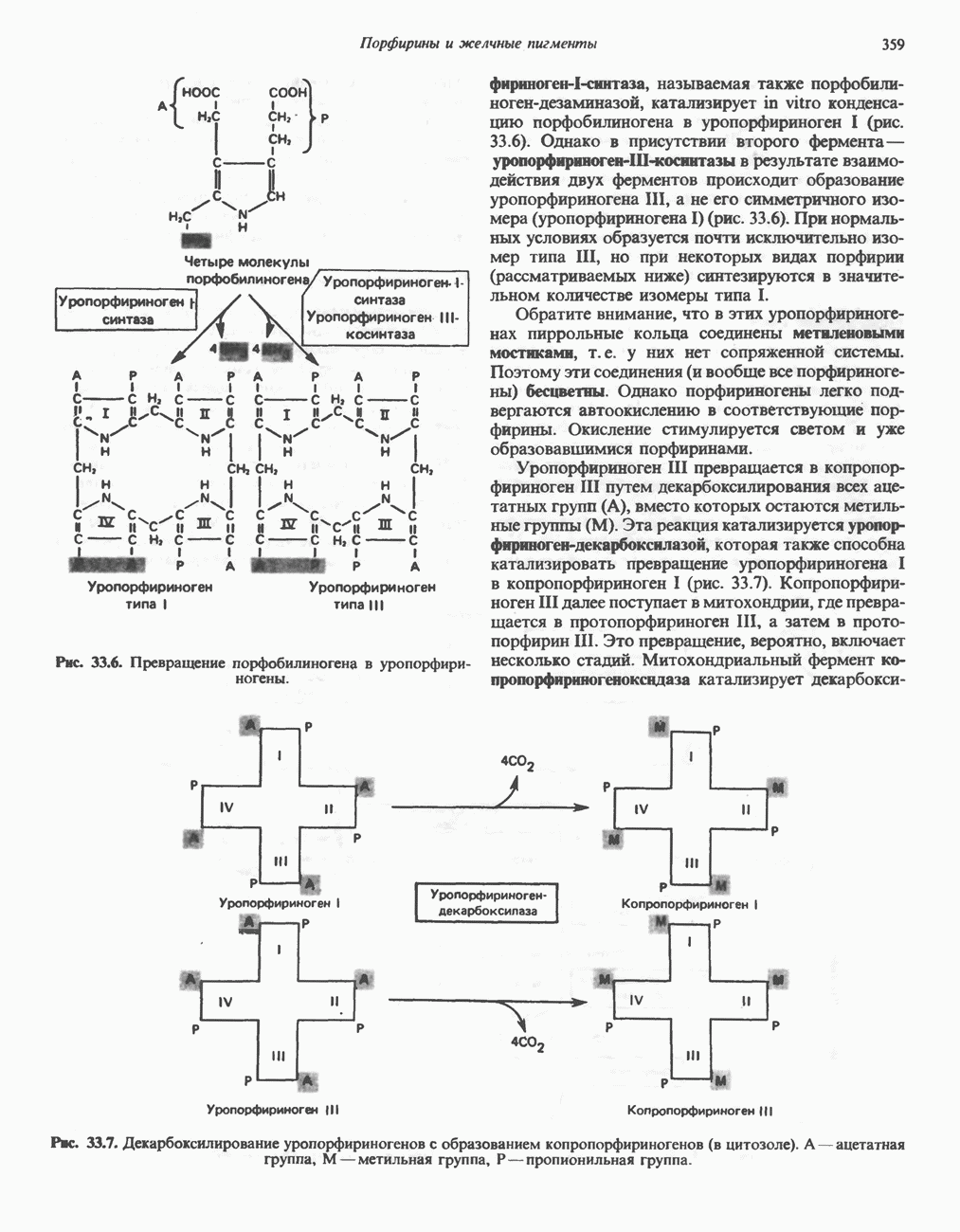
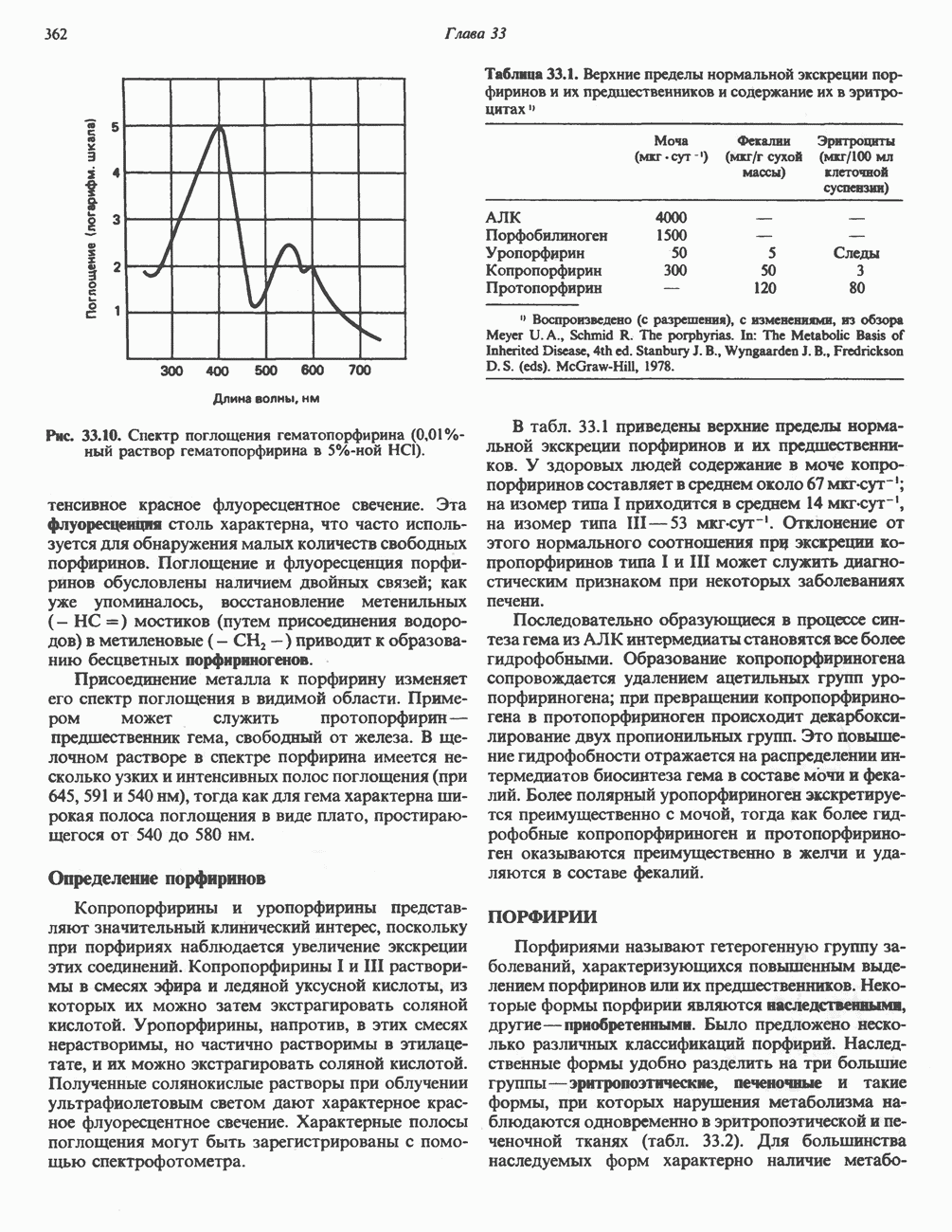
- ПОРФИРИНЫ
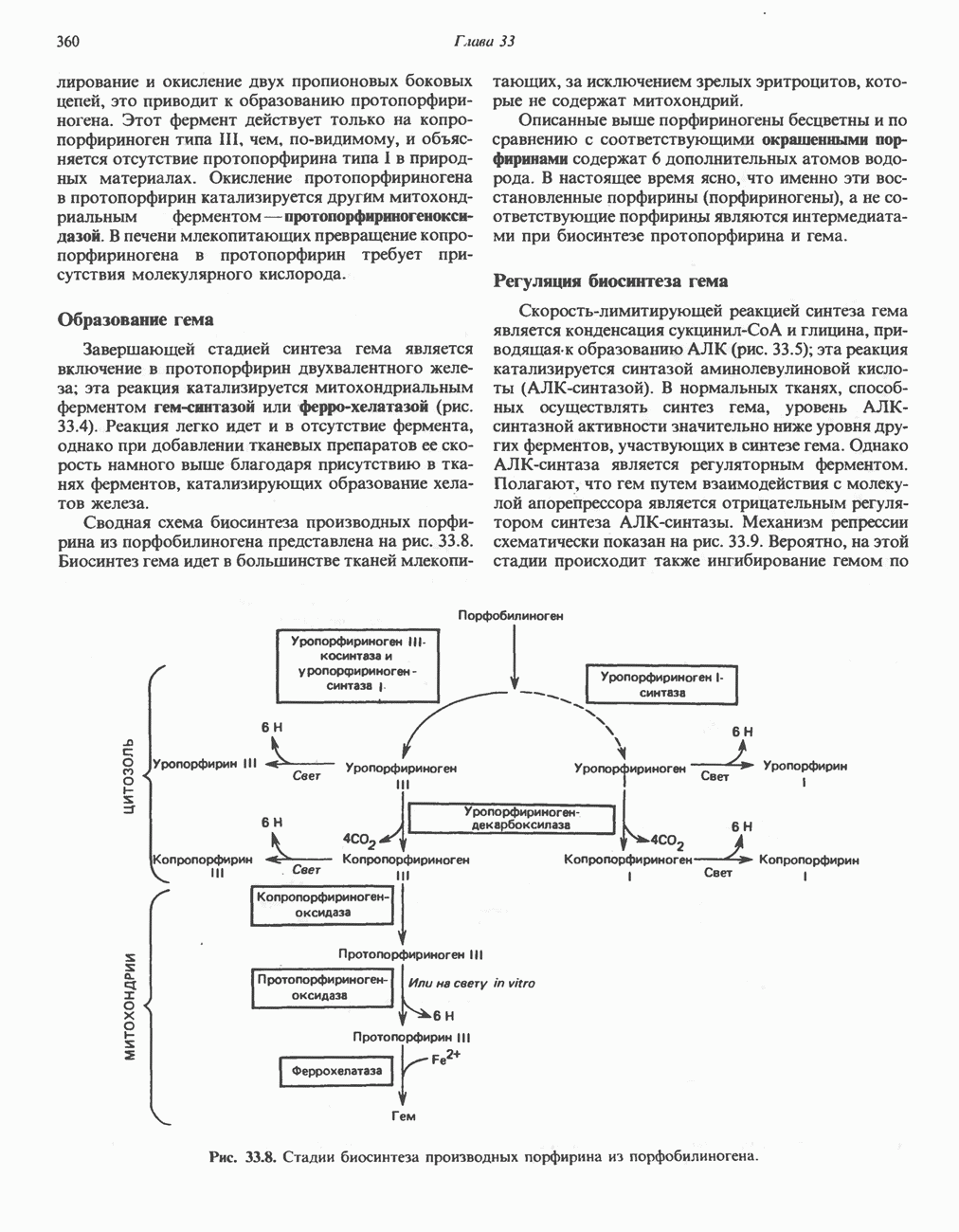
- ПОРФИРИН
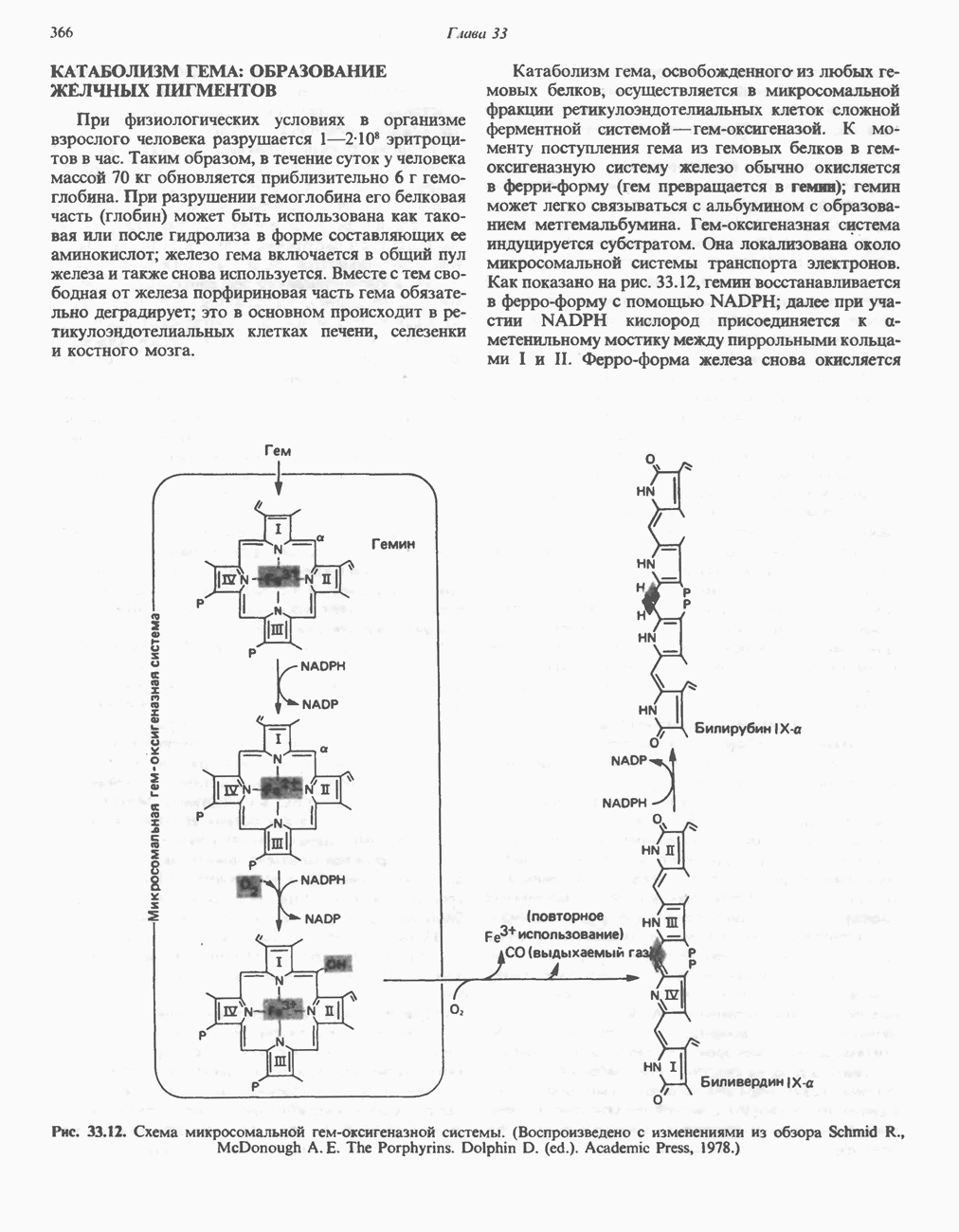
- КАТАБОЛИЗМ ГЕМА: ОБРАЗОВАНИЕ ЖЕЛЧНЫХ ПИГМЕНТОВ
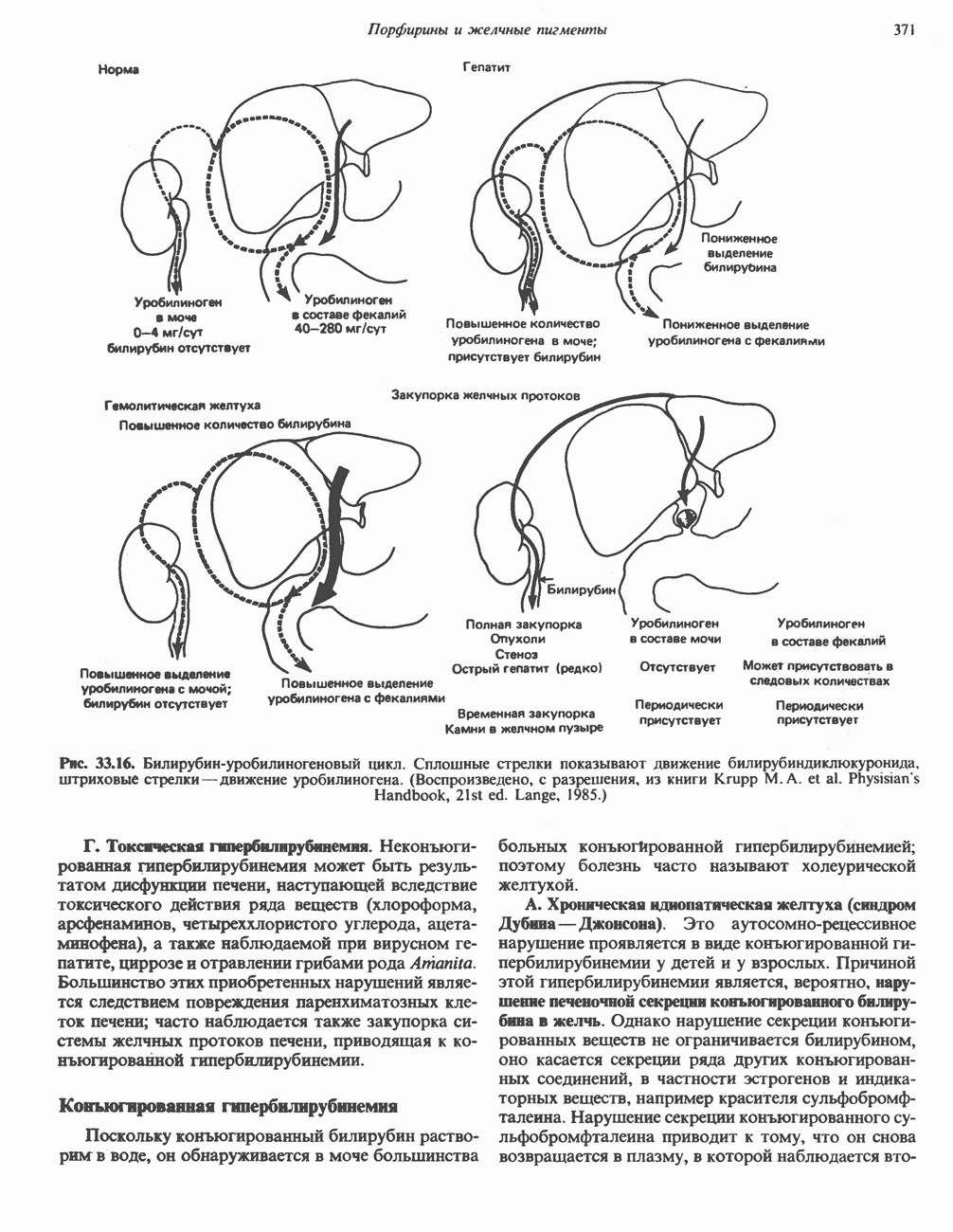
- МЕТАБОЛИЗМ БИЛИРУБИНА В КИШЕЧНИКЕ
- ГИПЕРБИЛИРУБИНЕМИЯ
- Список сокращений