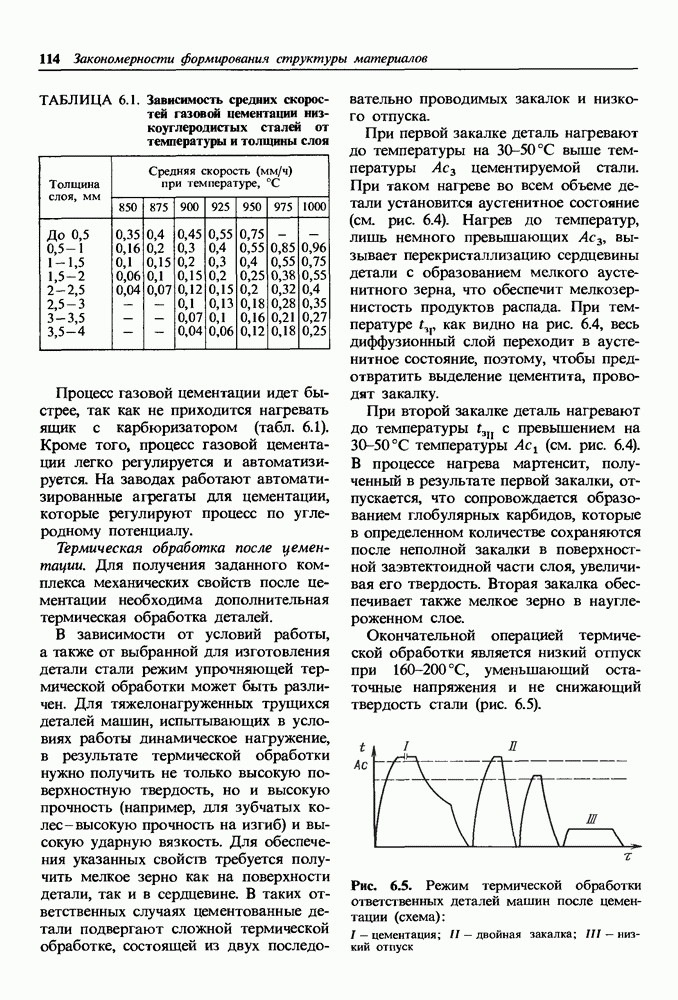
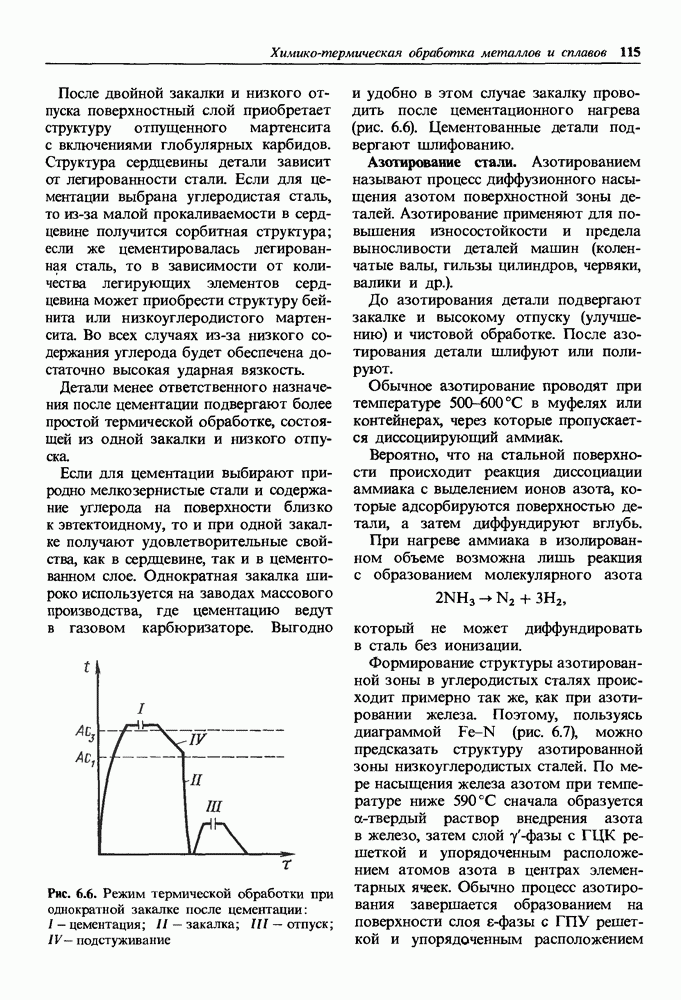
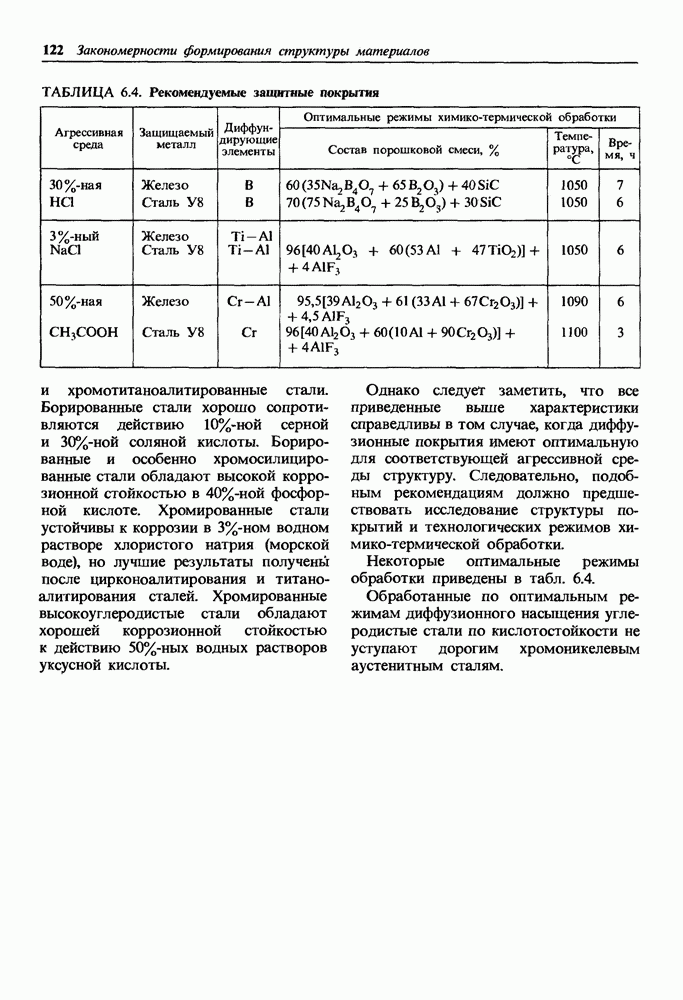
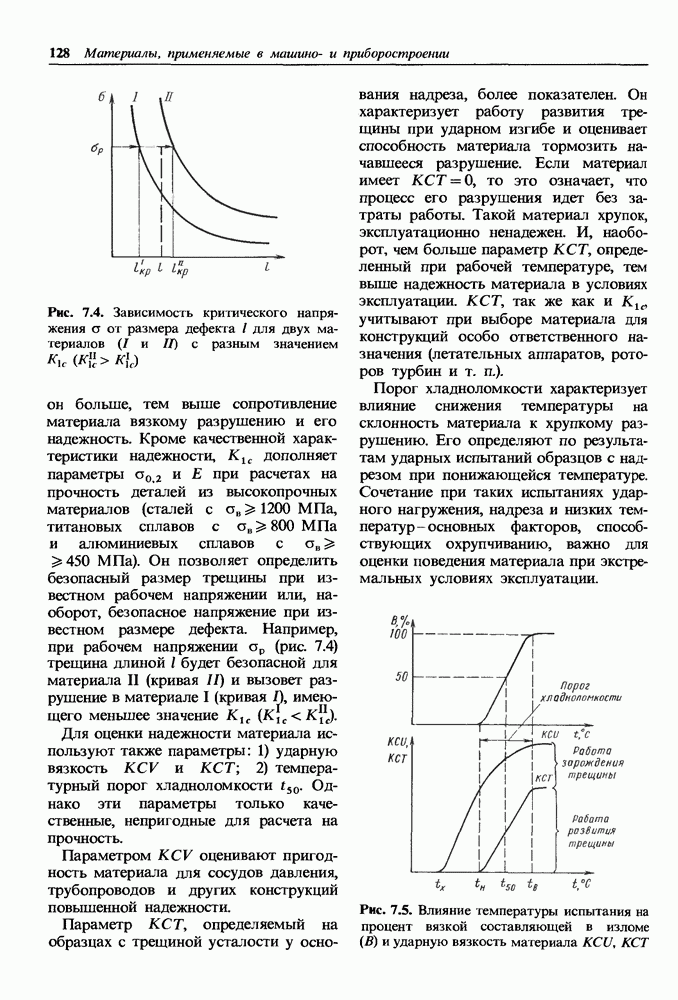
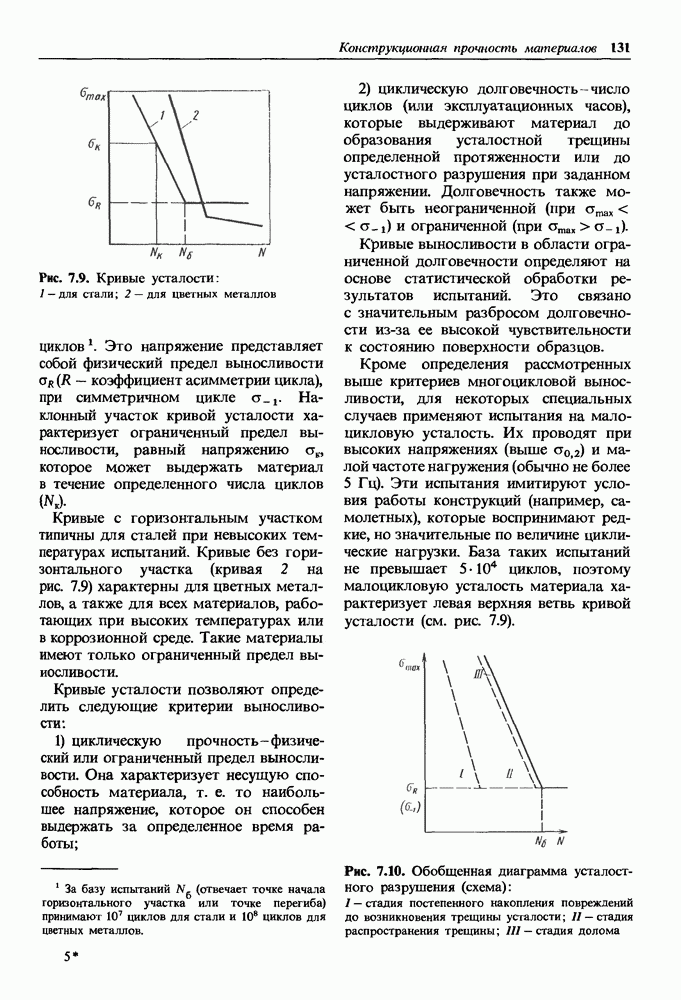
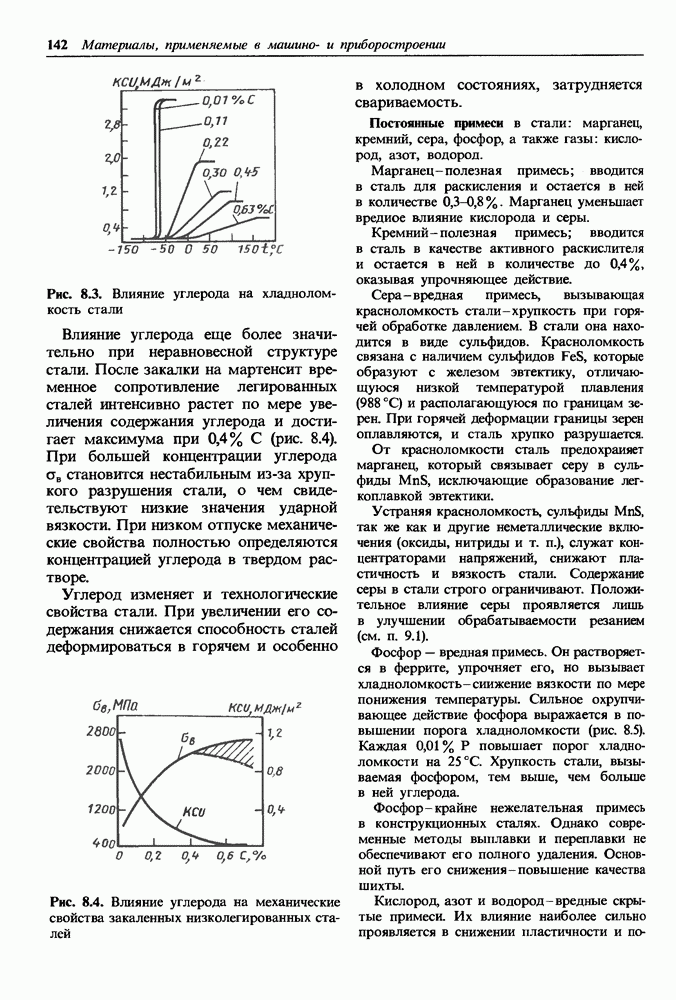
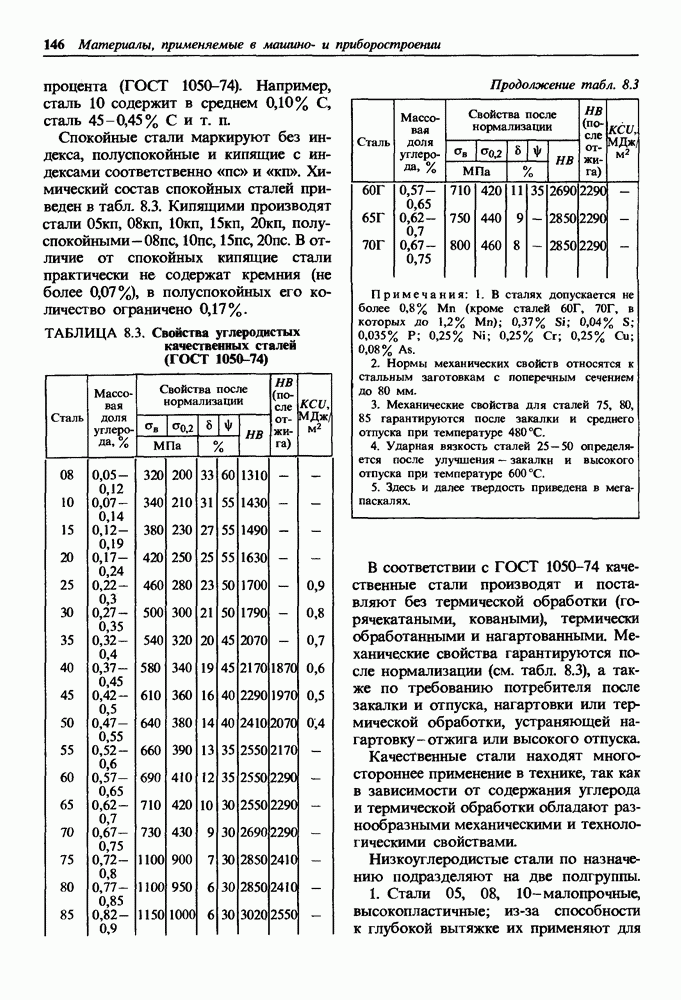
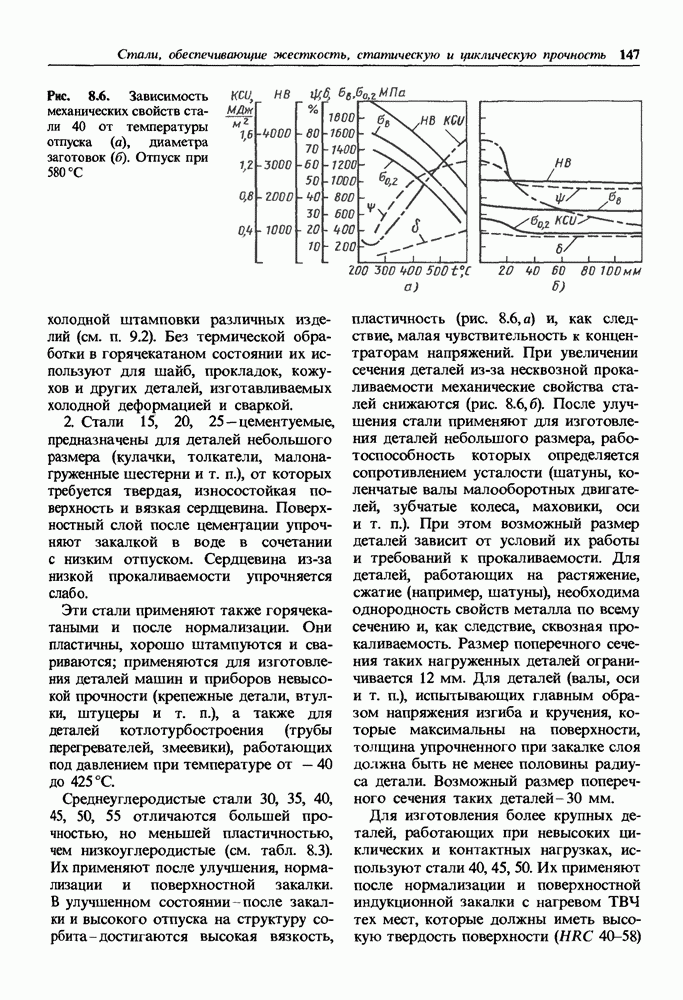
| << Предыдущий параграф | Следующий параграф >> |
Пред.
След.
Макеты страниц
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
ДЛЯ СТУДЕНТОВ И ШКОЛЬНИКОВ ЕСТЬ
ZADANIA.TO
Ковалентные кристаллы.
Это кристаллы, в которых преобладает ковалентный тип связи. Их образуют элементы IV, V, VI подгруппы В. Они электроотрицательны, так как имеют большой потенциал ионизации, и, вступая во взаимодействие с элементами других групп, отбирают валентные электроны, достраивая свою валентную зону; при взаимодействии друг с другом атомы обобществляют свои валентные электроны с соседними атомами, достраивая таким образом валентную зону.
Ковалентные кристаллы образуют атомы углерода, кремния, германия, сурьмы, висмута и др.
Число атомов, с которыми

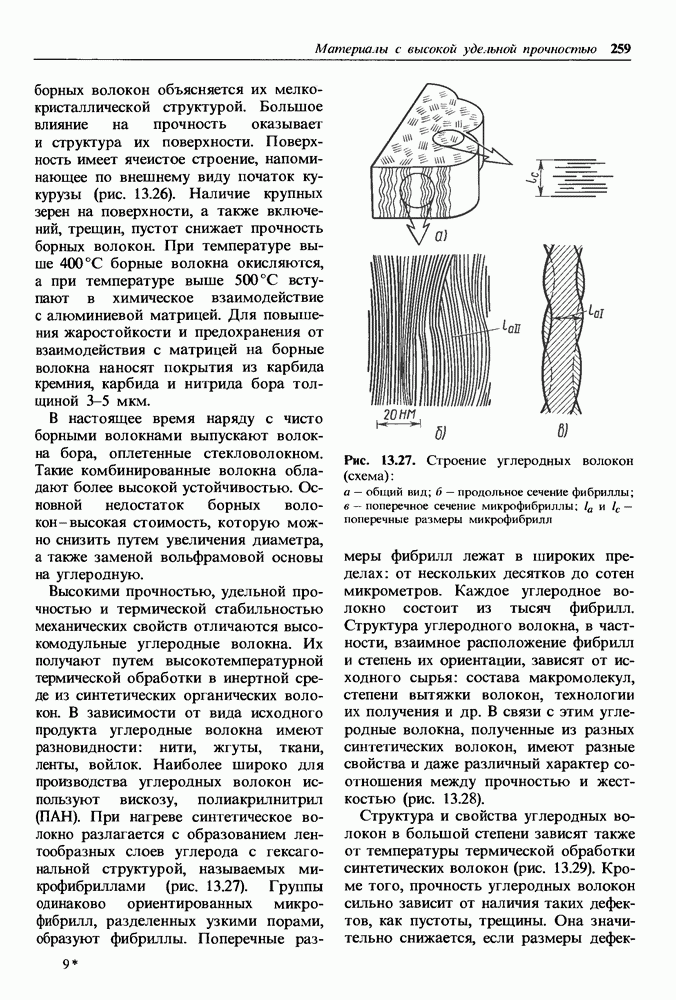
Рис. 1.11. Кристаллическая решетка иода: а — схема; б — пространственное изображение
происходит обобществление электронов, зависит от валентности элемента и может быть определено согласно правилу  где
где  — валентность элемента. Например, для углерода это число равно 4.
— валентность элемента. Например, для углерода это число равно 4.
Рассмотрение такого обобществления проще начать с простейшей системы — молекулы водорода. Этот случай представляет типичный пример ковалентной связи, осуществляемой двумя электронами с антинаправленными спинами. В электрическом поле двух протонов находятся два электрона. Оба электрона молекулы водорода принадлежат обоим атомам и, вследствие перекрытия валентных зон, все время «кочуют» от одного атома к другому, образуя обменные ковалентные силы.
В ковалентных кристаллах в узлах кристаллической решетки располагаются атомы, между которыми действуют те же силы.
Например, атом углерода имеет четыре валентных электрона, посредством которых он образует четыре направленные связи и вступает в обменное взаимодействие с четырьмя соседними атомами. Между каждой парой атомов происходит обмен валентными электронами, подобно атомам в молекуле водорода.
В природе углерод встречается в двух кристаллических формах (рис. 1.12). Обе кристаллические решетки характеризует наличие у каждого атома четырех соседей. В сложной решетке алмаза все четыре соседа располагаются на одинаковом расстоянии от центрального атома (хорошо видно в элементе, показанном штриховой линией).
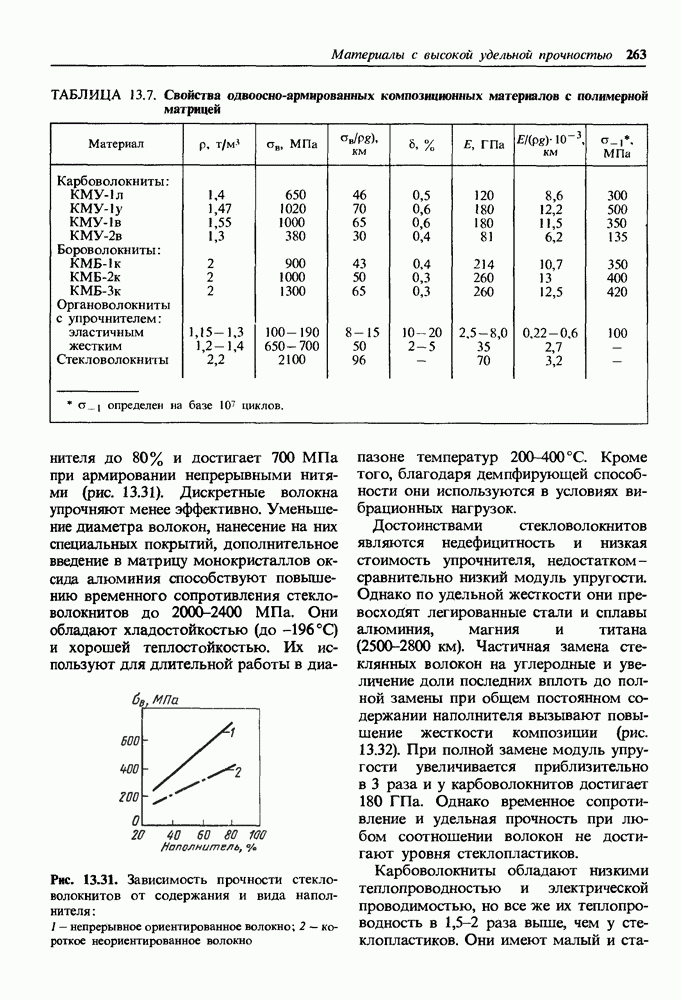
В слоистой гексагональной решетке графита один из четырех соседей (см. жирные линии на рис. 1.12) находится на значительном удалении. Между тремя атомами в плоскости основания решетки действуют ковалентные силы, а между основаниями-слабые силы Ван-дер-Ваальса. При деформации графита в первую очередь разрушаются связи между слоями, чем и объясняется низкая твердость графита. Коэффициент линейного расширения велик в направлении действия сил Ван-дер-Ваальса (см. табл. 1.2).
Ковалентная связь характеризуется направленностью, так как каждый атом вступает в обменное взаимодействие с определенным числом соседних атомов. Вследствие этого атомы в ковалентных кристаллах укладываются некомпактно и образуют кристаллические структуры с небольшим координационным числом. Так, кубическая решетка алмаза имеет координационное число 
Направленность межатомных связей и неплотноупакованные кристаллические структуры приводят к низкой пластичности и высокой твердости (алмаз самый твердый материал).
Вследствие большой энергии связи ковалентные кристаллы характеризуются высокими температурами плавления (у алмаза она равна 5000 °С) и испарения.
Образование заполненных валентных зон при такой связи превращает ковалентные кристаллы в полупроводники и даже диэлектрики. Алмаз - полупроводник. Хорошая электрическая проводимость графита объясняется заменой одной из четырех ковалентных связей связью Ван-дер-Ваальса, в результате чего появляются свободные носители электрического тока.

Рис. 1.12. Кристаллические решетки алмаза (а) и графита (б)
Температурный коэффициент электрического сопротивления у ковалентных кристаллов имеет отрицательное значение, т. е. при нагреве электрическое сопротивление снижается. К ковалентным кристаллам относятся многие сложные кристаллические вещества, состоящие из разнородных атомов, например, карбид кремния, нитрид алюминия и др.
| << Предыдущий параграф | Следующий параграф >> |
Оглавление
- Введение
- Глава 1. СТРОЕНИЕ И СВОЙСТВА МАТЕРИАЛОВ
- 1.1. Элементы кристаллографии
- 1.2. Влияние типа связи на структуру и свойства кристаллов
- Молекулярные кристаллы.
- Ковалентные кристаллы.
- Металлические кристаллы.
- Ионные кристаллы.
- 1.3. Фазовый состав сплавов
- Твердые растворы.
- Промежуточные фазы.
- 1.4. Дефекты кристаллов
- Линейные дефекты.
- Поверхностные дефекты.
- 1.5. Диффузия в металлах и сплавах
- 1.6. Жидкие кристаллы
- 1.7. Структура полимеров, стекла и керамики
- Глава 2. ФОРМИРОВАНИЕ СТРУКТУРЫ ЛИТЫХ МАТЕРИАЛОВ
- 2.1. Самопроизвольная кристаллизация
- 2.2. Несамопроизвольная кристаллизация
- 2.3. Форма кристаллов и строение слитков
- 2.4. Получение монокристаллов
- 2.5. Аморфное состояние металлов
- Глава 3. ВЛИЯНИЕ ХИМИЧЕСКОГО СОСТАВА НА РАВНОВЕСНУЮ СТРУКТУРУ СПЛАВОВ
- 3.1. Методы построения диаграмм состояния
- 3.2. Основные равновесные диаграммы состояния двойных сплавов
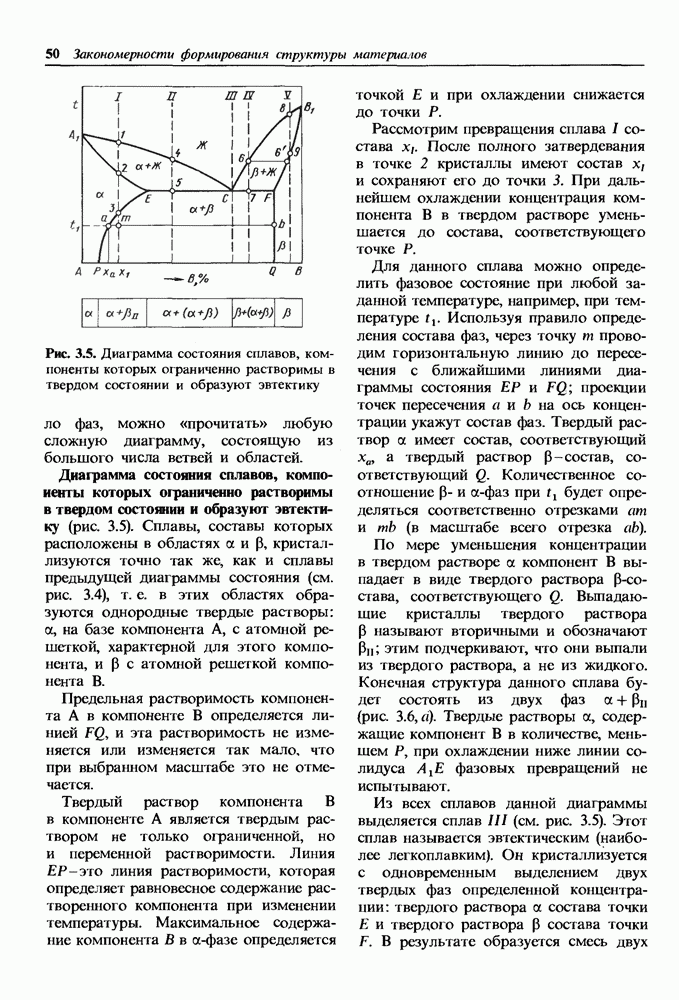
- Диаграмма состояния сплавов, компоненты которых ограниченно растворимы в твердом состоянии и образуют эвтектику
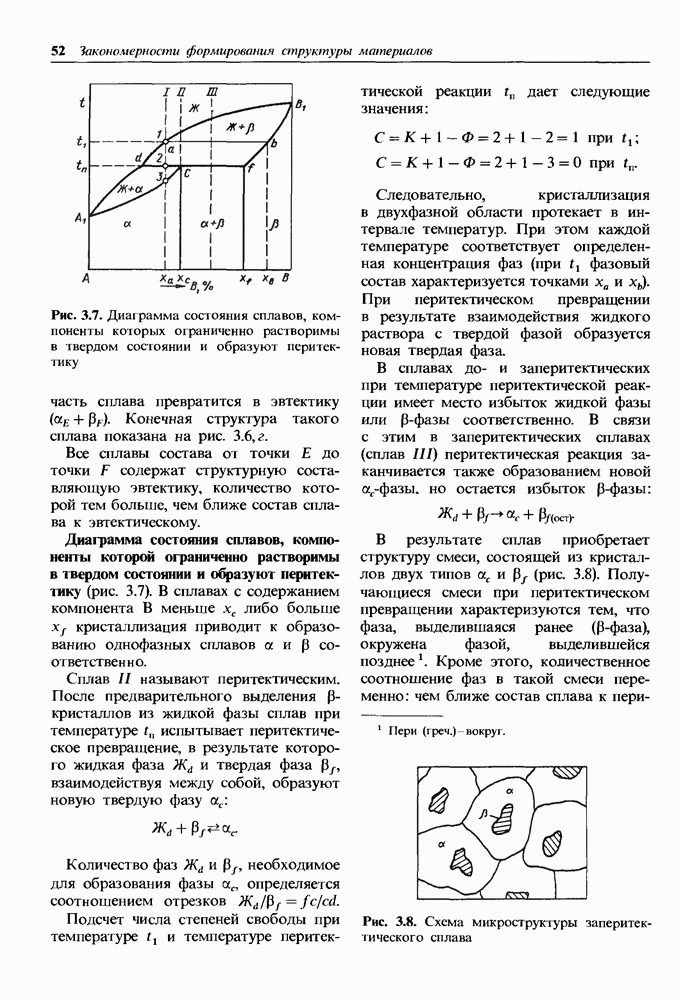
- Диаграмма состояния сплавов, компоненты которой ограниченно растворимы в твердом состоянии и образую! перитектику
- Диаграмма состояния сплавов с полиморфным превращением одного из компонентов.
- Диаграмма состояния сплавов с полиморфными превращениями компонентов и эвтектоидным превращением.
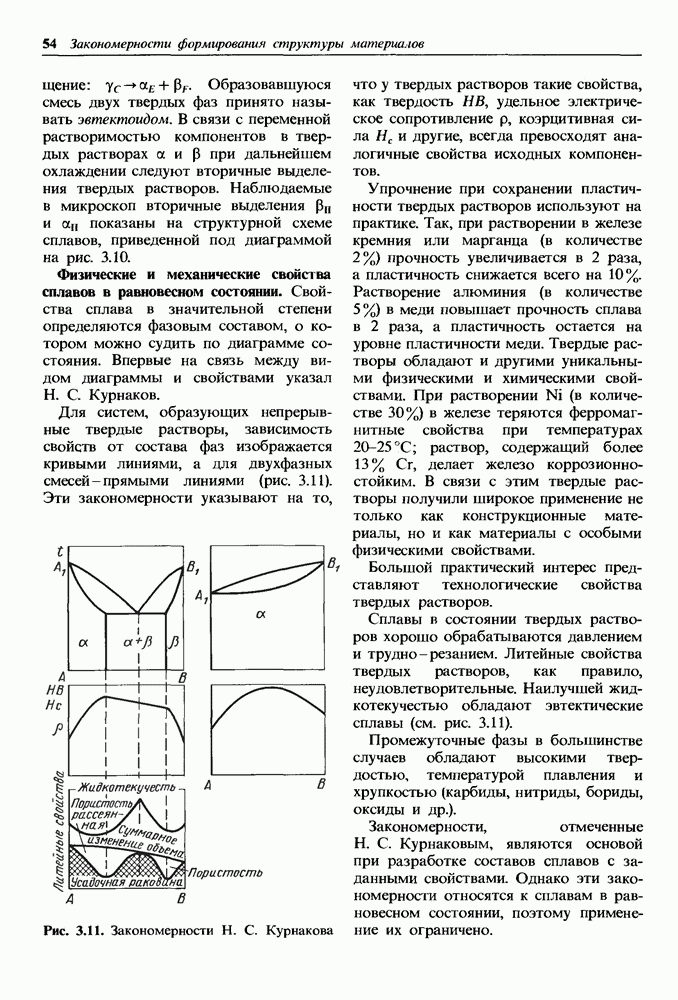
- Физические и механические свойства сплавов в равновесном состоянии.
- 3.3. Диаграмма состояния железоуглеродистых сплавов
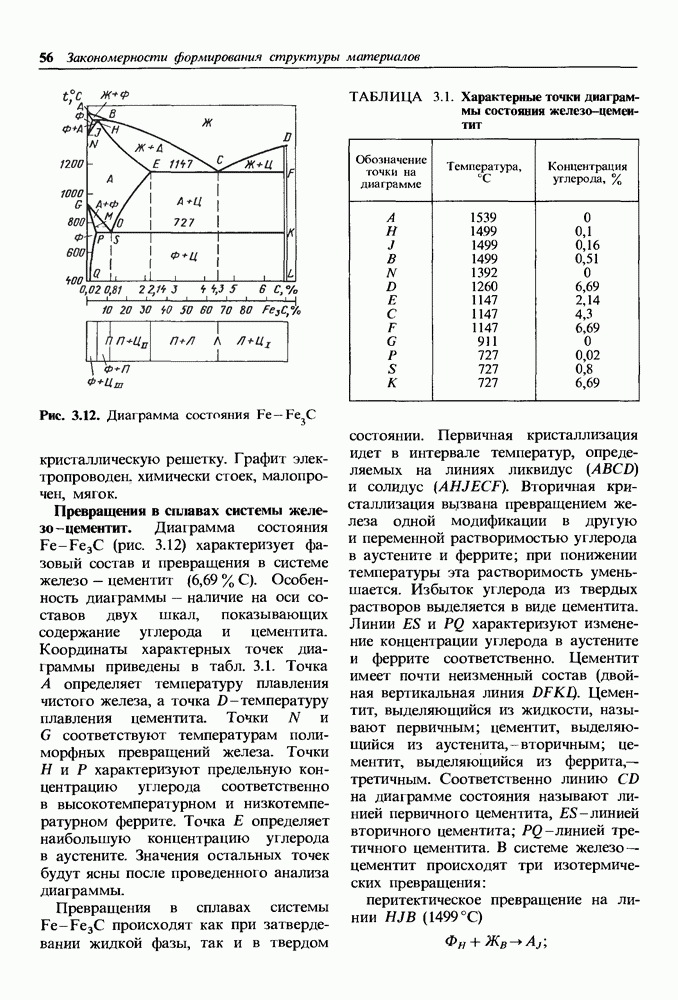
- Превращения в сплавах системы железо-цементит.
- Превращения в сплавах системы железо-графит.
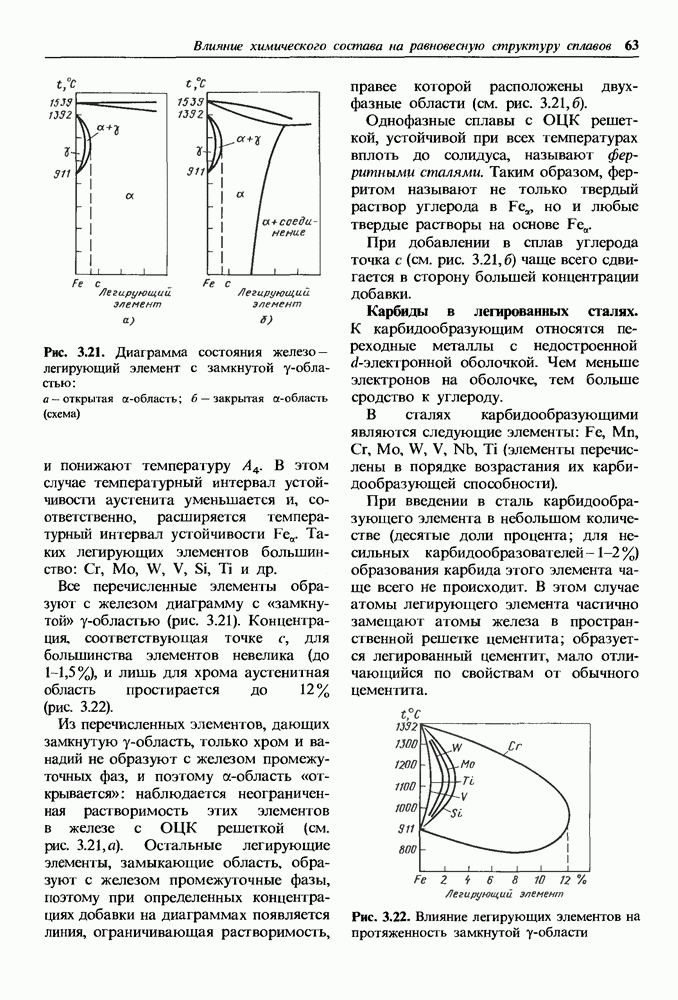
- 3.4. Влияние легирующих элементов на равновесную структуру сталей
- Карбиды в легированных сталях.
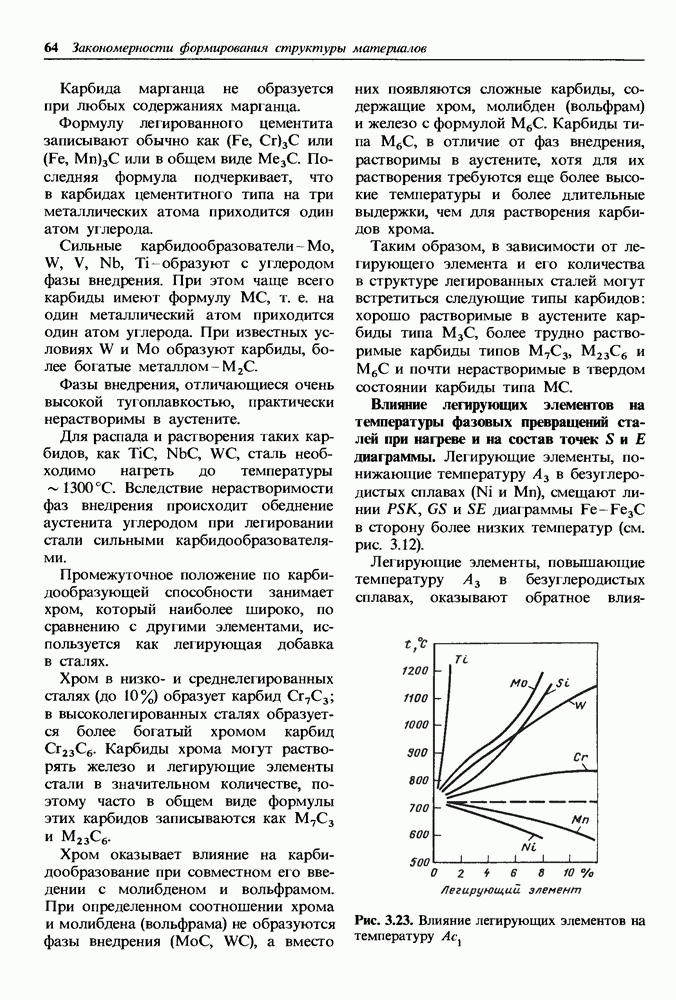
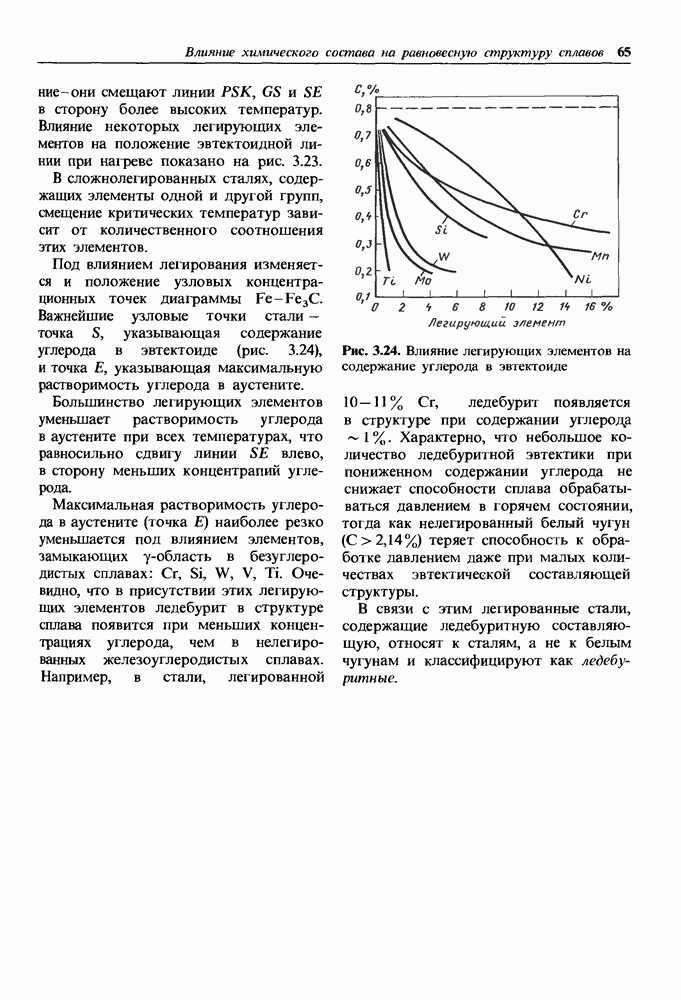
- Влияние легирующих элементов на температуры фазовых превращений сталей при нагреве и на состав точек S и Е диаграммы.
- Глава 4. ФОРМИРОВАНИЕ СТРУКТУРЫ ДЕФОРМИРОВАННЫХ МЕТАЛЛОВ И СПЛАВОВ
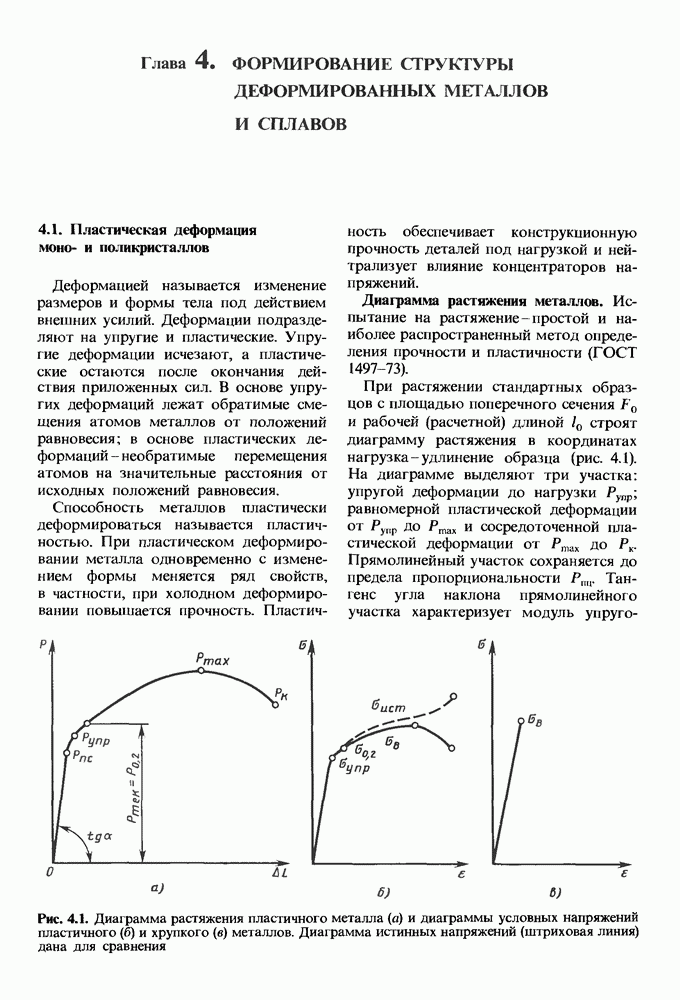
- 4.1. Пластическая деформация моно- и поликристаллов
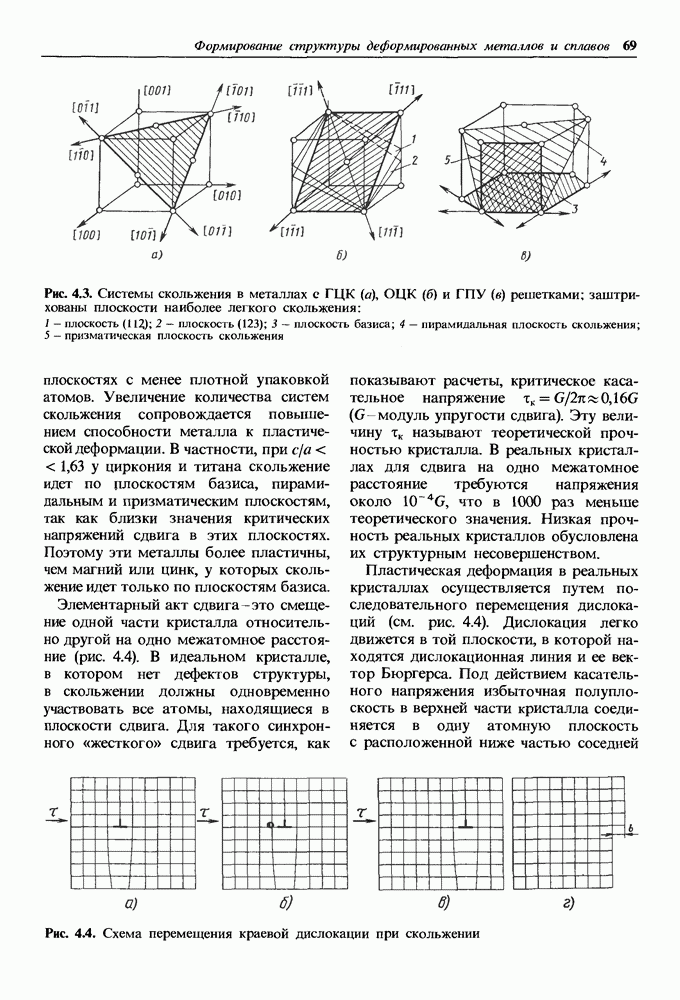
- Механизм пластической деформации
- Пластическая деформация поликристаллических металлов.
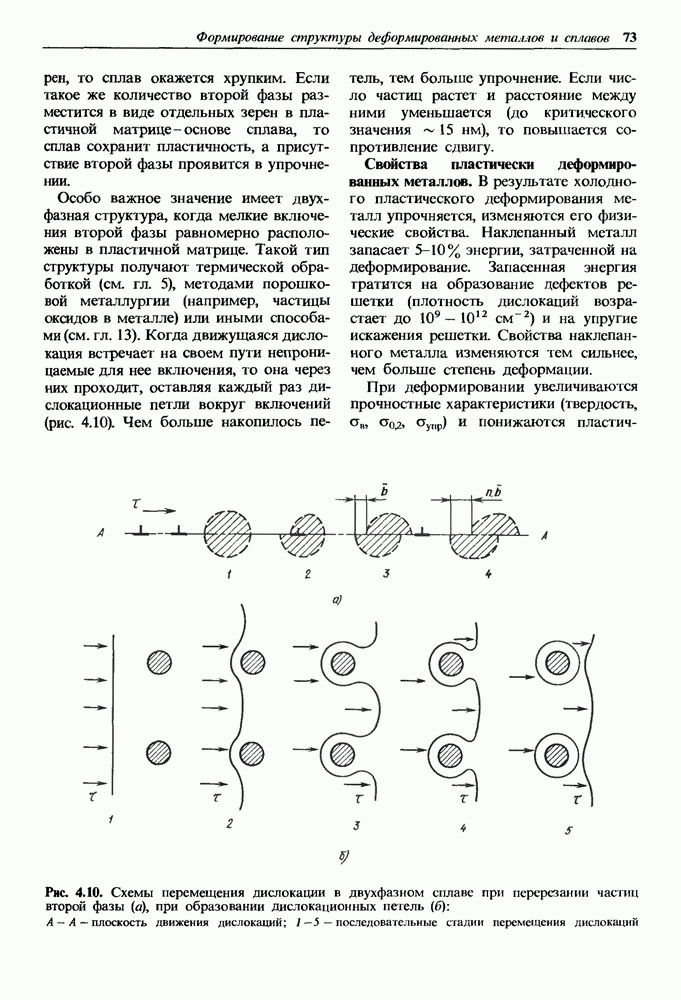
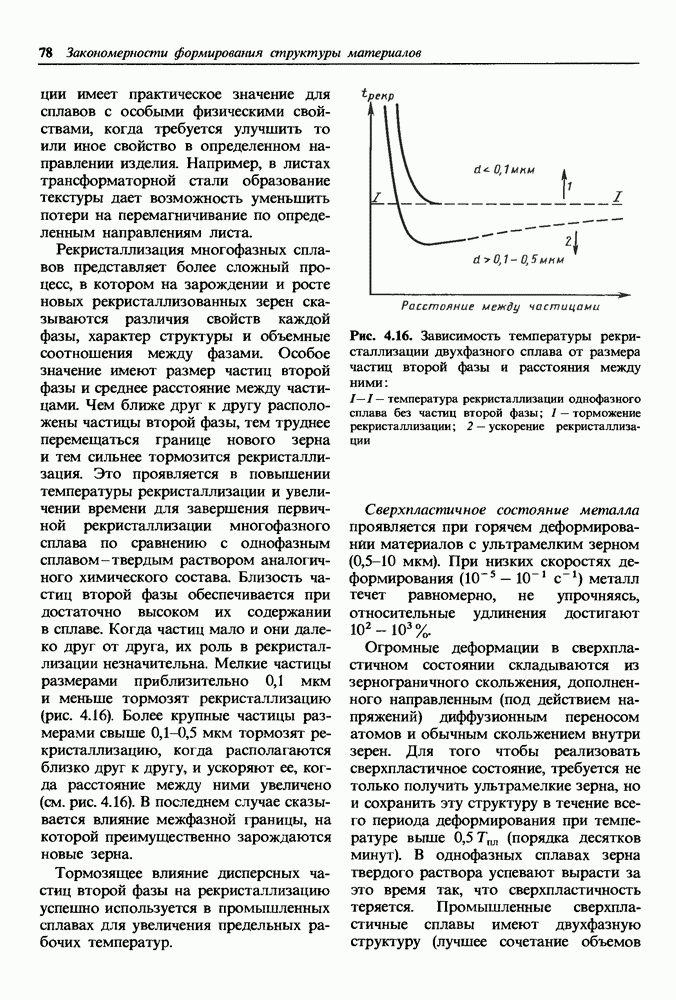
- Деформирование двухфазных сплавов оказывается более сложным.
- Свойства наклепанного металла изменяются тем сильнее, чем больше степень деформации.
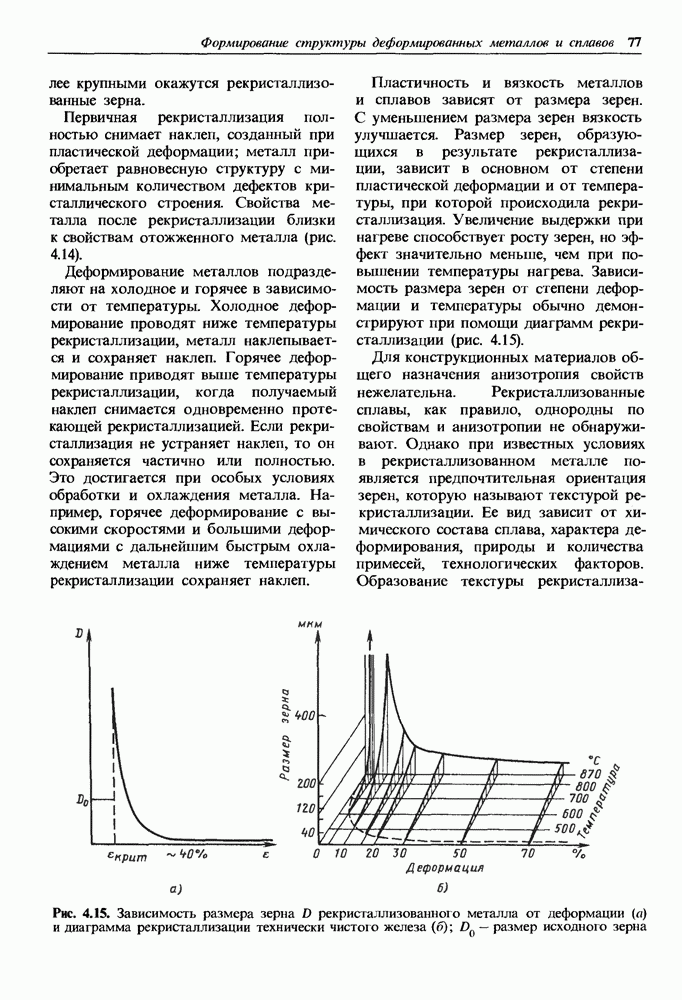
- 4.2. Возврат и рекристаллизация
- Глава 5. ТЕРМИЧЕСКАЯ ОБРАБОТКА МЕТАЛЛОВ И СПЛАВОВ
- 5.2. Основное оборудование для термической обработки
- 5.3. Термическая обработка сплавов, не связанная с фазовыми превращениями в твердом состоянии
- Рекристаллизационный отжиг.
- Диффузионный отжиг (гомогенизация).
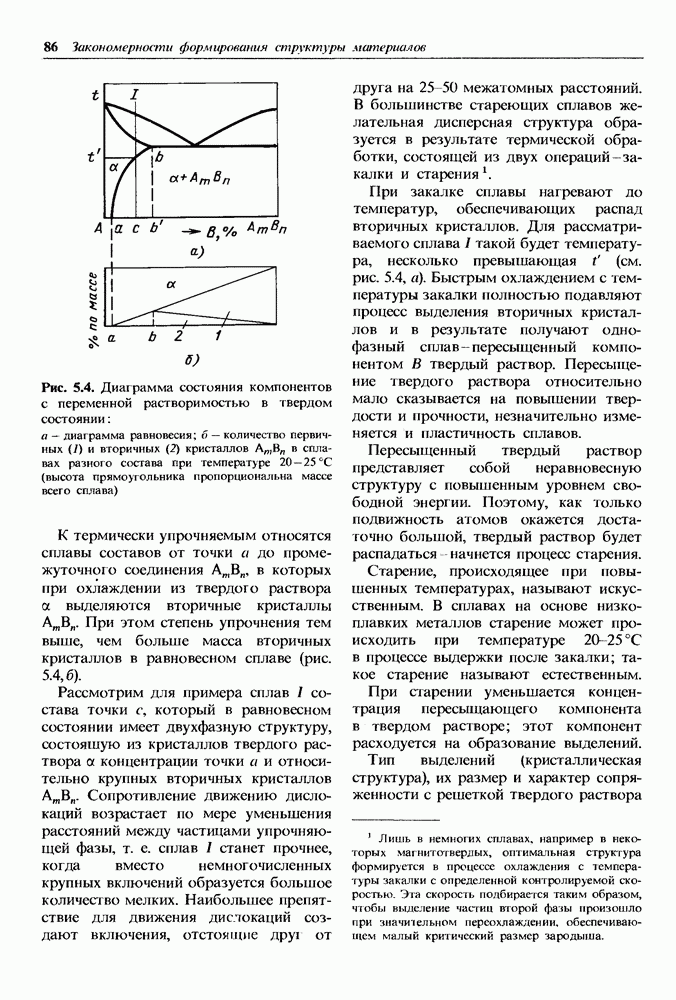
- 5.4. Термическая обработка сплавов с переменной растворимостью компонентов в твердом состоянии
- 5.5. Термическая обработка сталей с эвтектоидным превращением
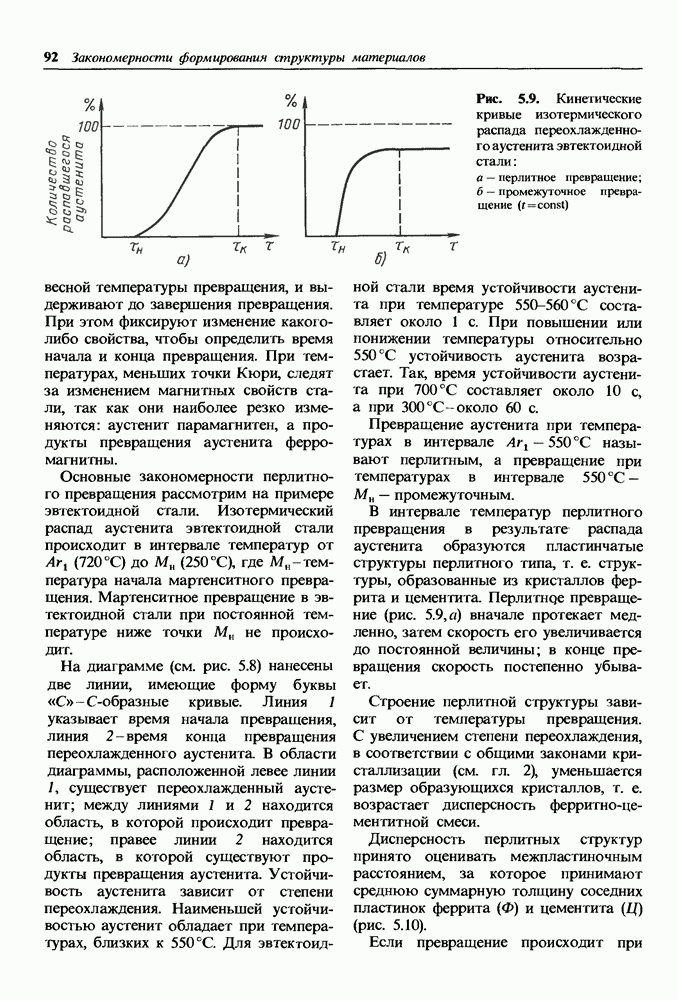
- Превращения аустенита при различных степенях переохлаждения.
- 5.6. Основные виды термической обработки стали
- Нормализация сталей.
- Закалка сталей.
- Закаливаемость в прокаливаемость сталей.
- Отпуск закаленных сталей.
- Глава 6. ХИМИКО-ТЕРМИЧЕСКАЯ ОБРАБОТКА МЕТАЛЛОВ И СПЛАВОВ
- 6.2. Диффузионное насыщение углеродом и азотом
- Азотирование стали.
- Ионное азотирование и цементация.
- Одновременное насыщение поверхности стали углеродом и азотом.
- 6.3. Диффузионное насыщение сплавов металлами и неметаллами
- Раздел первый. Конструкционные материалы
- 7.1. Общие требования, предъявляемые к конструкционным материалам
- 7.2. Конструкционная прочность материалов и критерии ее оценки
- 7.3. Методы повышения конструкционной прочности
- 7.4. Классификация конструкционных материалов
- Глава 8. СТАЛИ, ОБЕСПЕЧИВАЮЩИЕ ЖЕСТКОСТЬ, СТАТИЧЕСКУЮ И ЦИКЛИЧЕСКУЮ ПРОЧНОСТЬ
- 8.1. Классификация конструкционных сталей
- 8.2. Влияние углерода и постоянных примесей на свойства стали
- 8.3. Углеродистые стали
- 8.4. Легированные стали
- Легированные стали нормальной и повышенной статической прочности.
- Легированные высокопрочные стали.
- Легированные стали с повышенной циклической прочностью.
- Глава 9. МАТЕРИАЛЫ С ОСОБЫМИ ТЕХНОЛОГИЧЕСКИМИ СВОЙСТВАМИ
- 9.1. Стали с улучшенной обрабатываемостью резанием
- 9.2. Стали с высокое технологической пластичностью и свариваемостью
- 9.3. Железоуглеродистые сплавы с высокими литейными свойствами
- Серые чугуны.
- Высокопрочные чугуны.
- Ковкие чугуны.
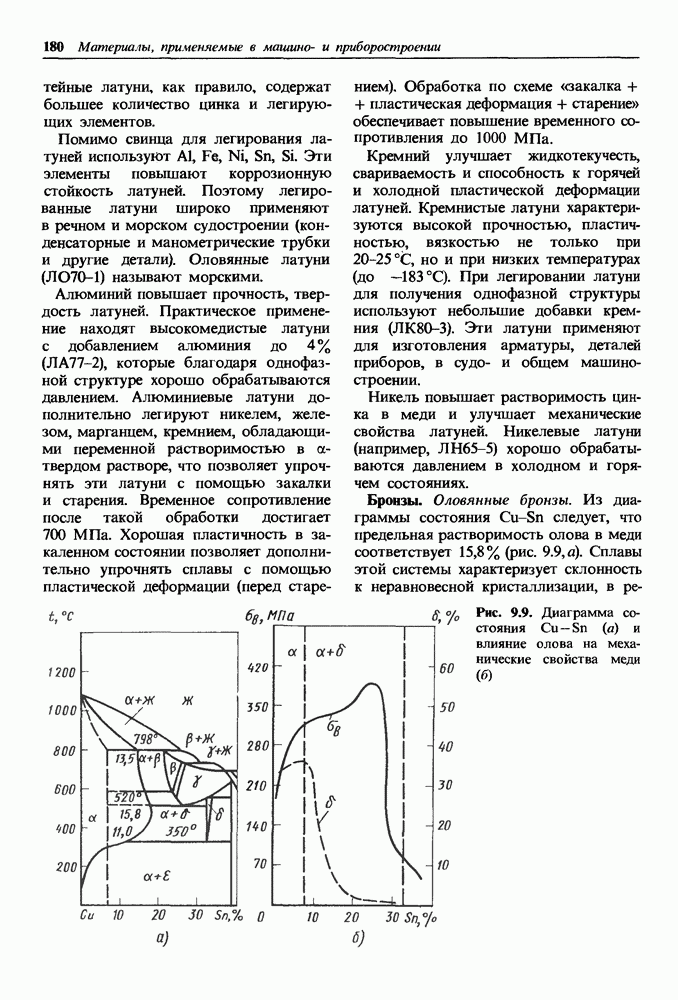
- 9.4. Медные сплавы
- Общая характеристика и классификация медных сплавов.
- Латуни.
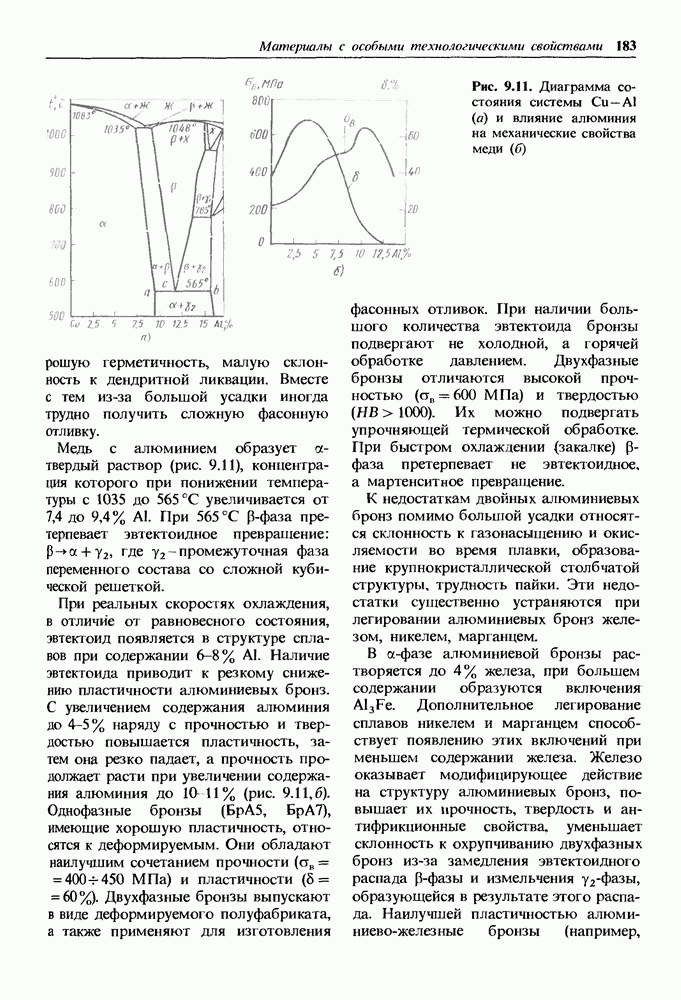
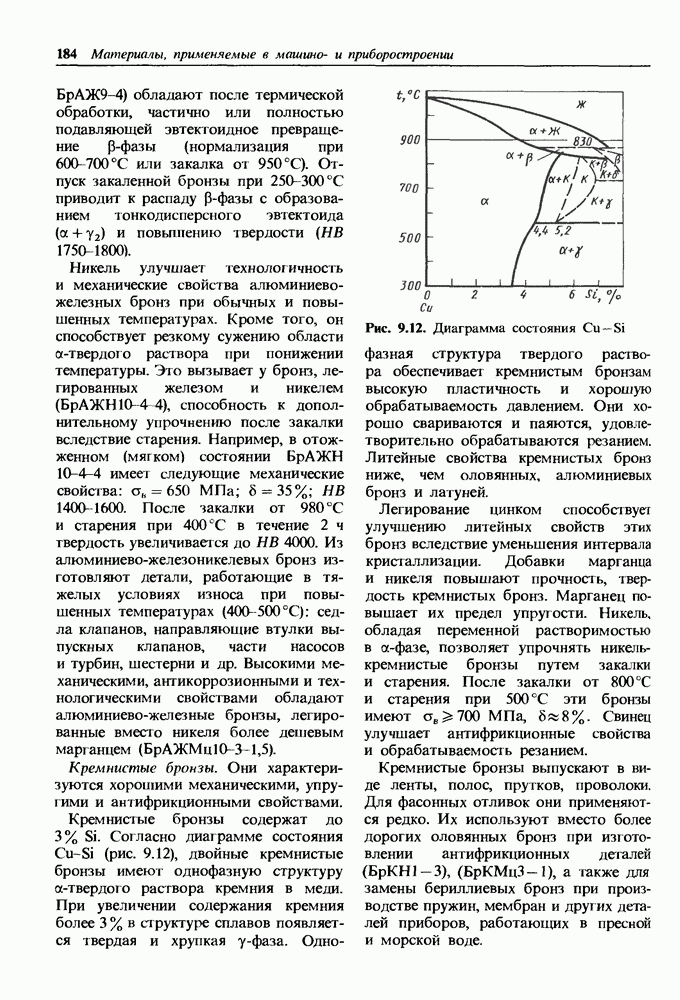
- Бронзы.
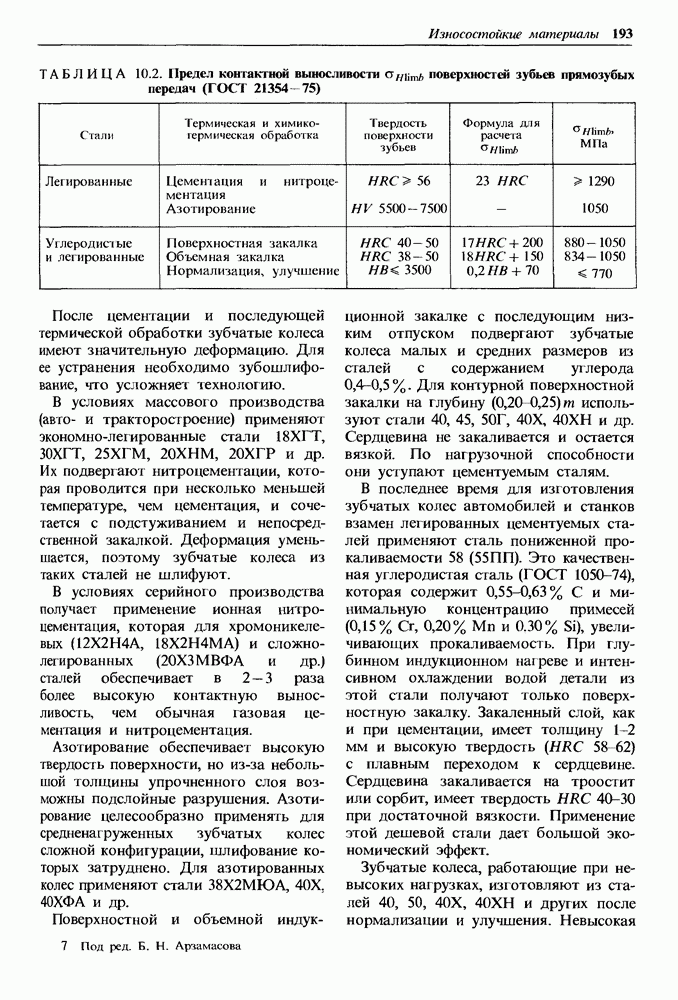
- Глава 10. ИЗНОСОСТОЙКИЕ МАТЕРИАЛЫ
- 10.2. Закономерности изнашивания деталей, образующих пары трения, и пути уменьшения их износа
- 10.3. Материалы с высокой твердостью поверхности
- Материалы, устойчивые к усталостному виду изнашивания.
- Материалы, устойчивые к изнашиванию в условиях больших давлений и ударных нагрузок.
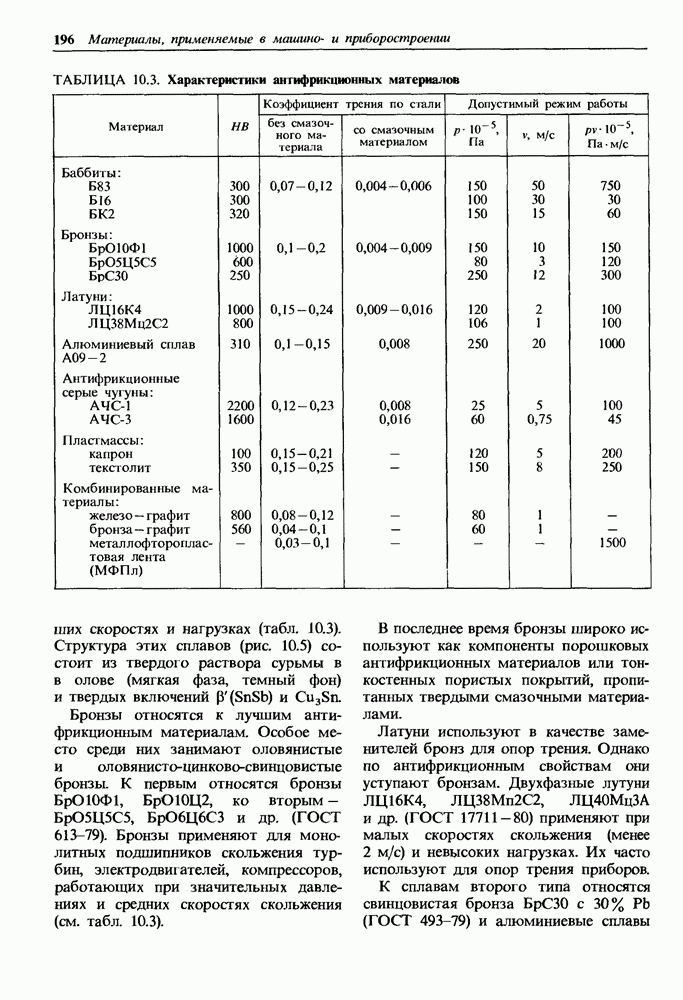
- 10.4. Антифрикционные материалы
- Неметаллические материалы.
- Комбинированные материалы.
- Минералы.
- 10.5. Фрикционные материалы
- Глава 11. МАТЕРИАЛЫ С ВЫСОКИМИ УПРУГИМИ СВОЙСТВАМИ
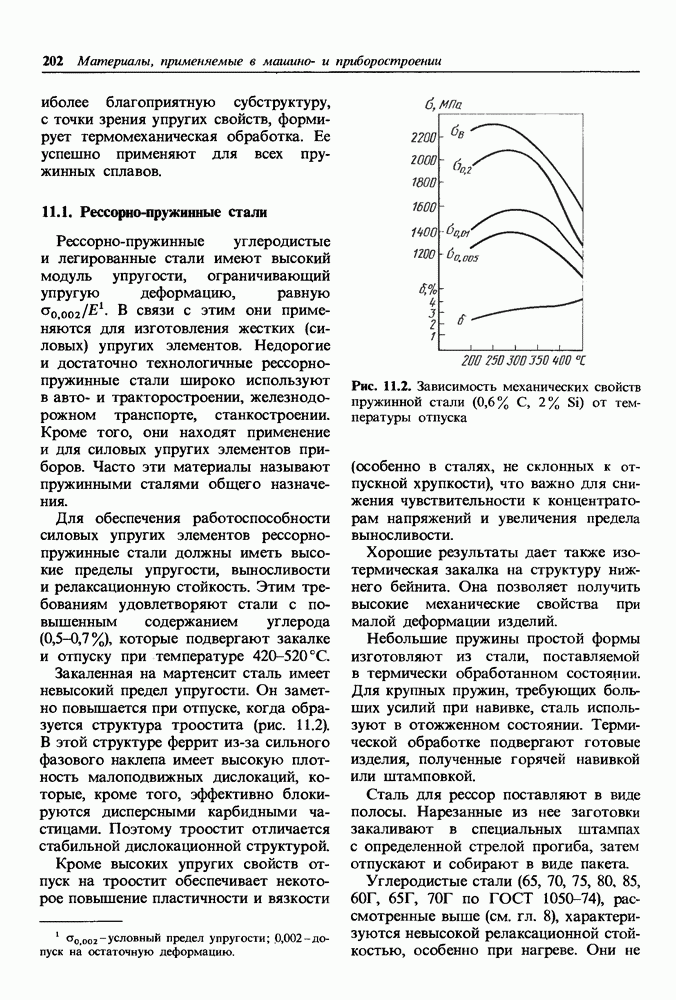
- 11.1. Рессорно-пружинные стали
- 11.2. Пружинные материалы приборостроения
- Глава 12. МАТЕРИАЛЫ С МАЛОЙ ПЛОТНОСТЬЮ
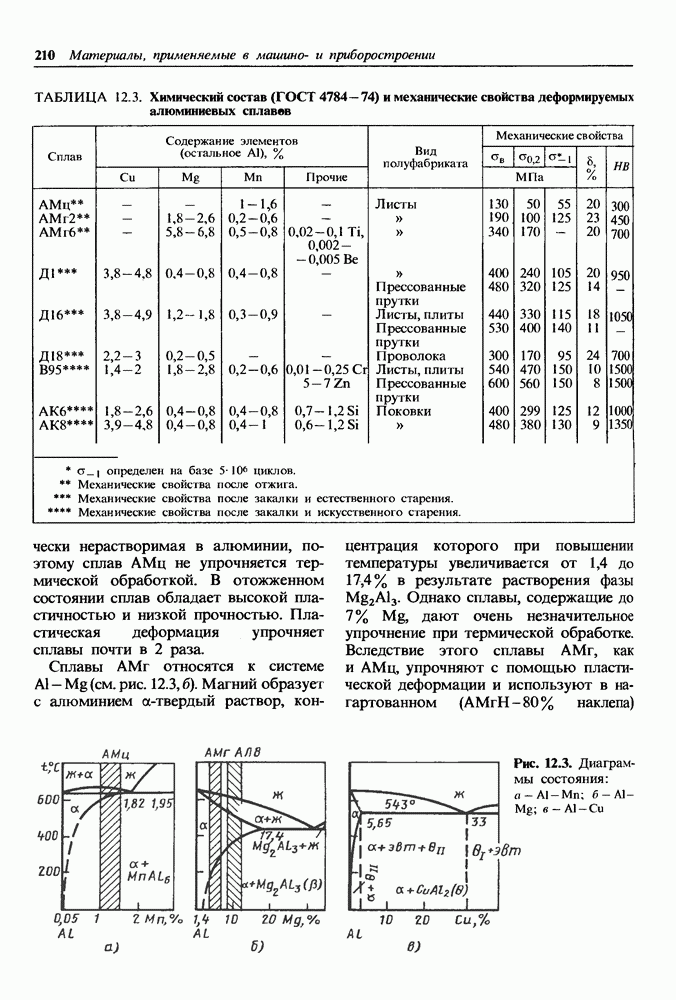
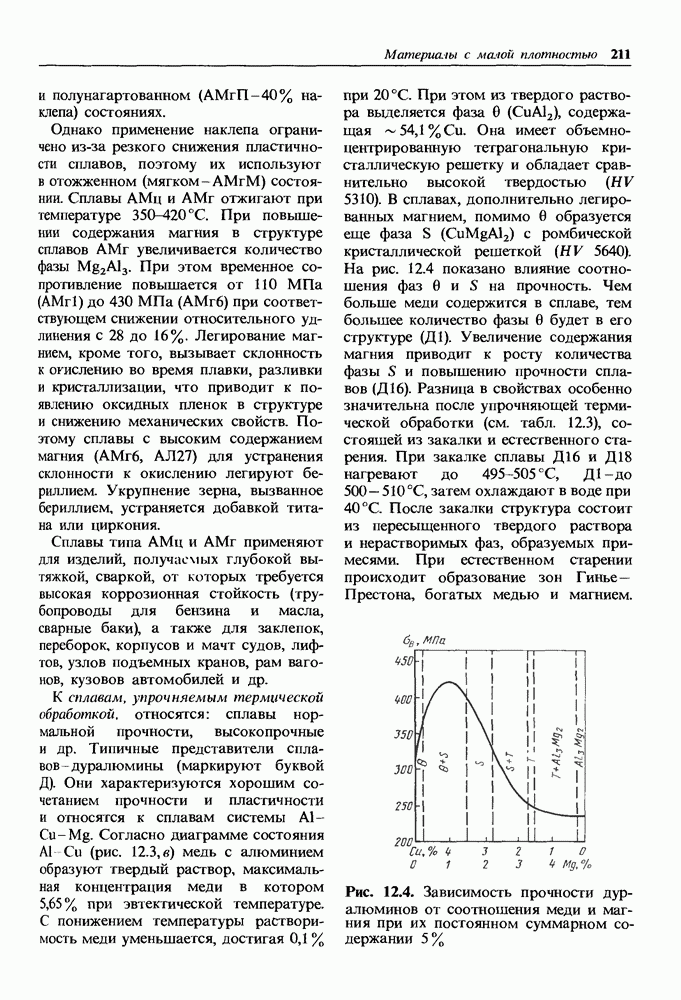
- 12.1. Сплавы на основе алюминия
- Общая характеристика и классификация алюминиевых сплавов.
- Деформируемые алюминиевые сплавы.
- Литейные алюминиевые сплавы.
- Гранулированные сплавы.
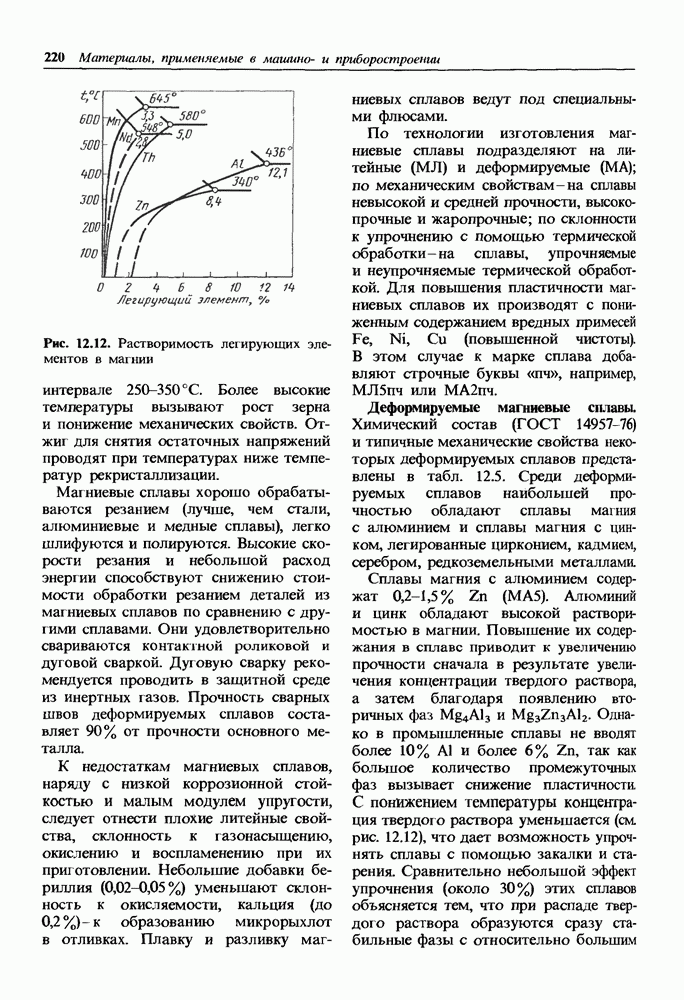
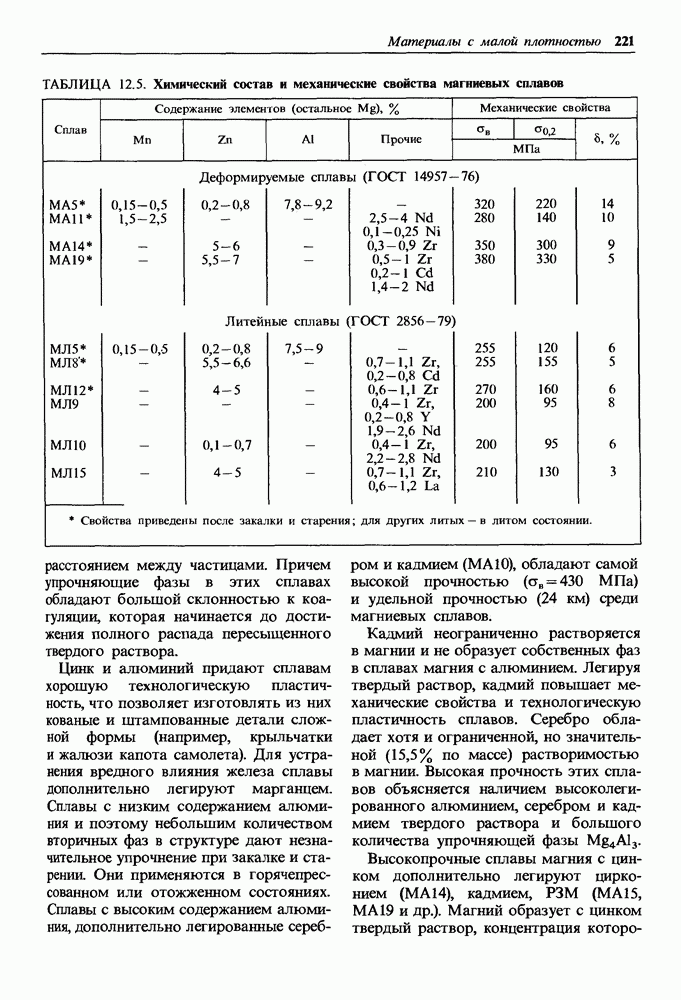
- 12.2. Сплавы на основе магния
- Общая характеристика и классификация магниевых сплавов.
- Деформируемые магниевые сплавы.
- Литейные магниевые сплавы.
- 12.3. Неметаллические материалы
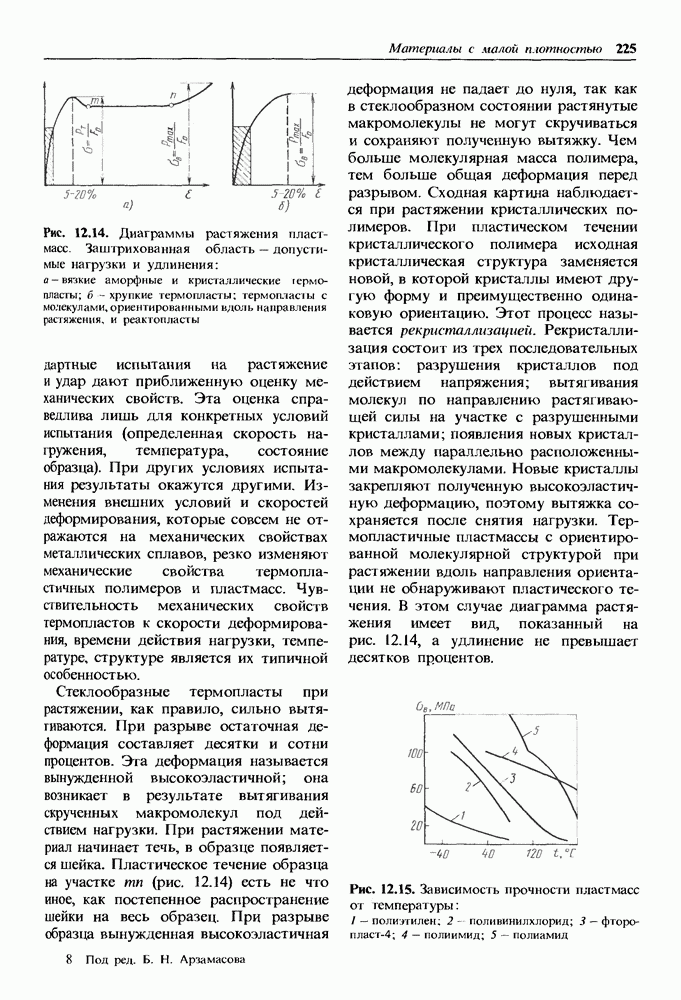
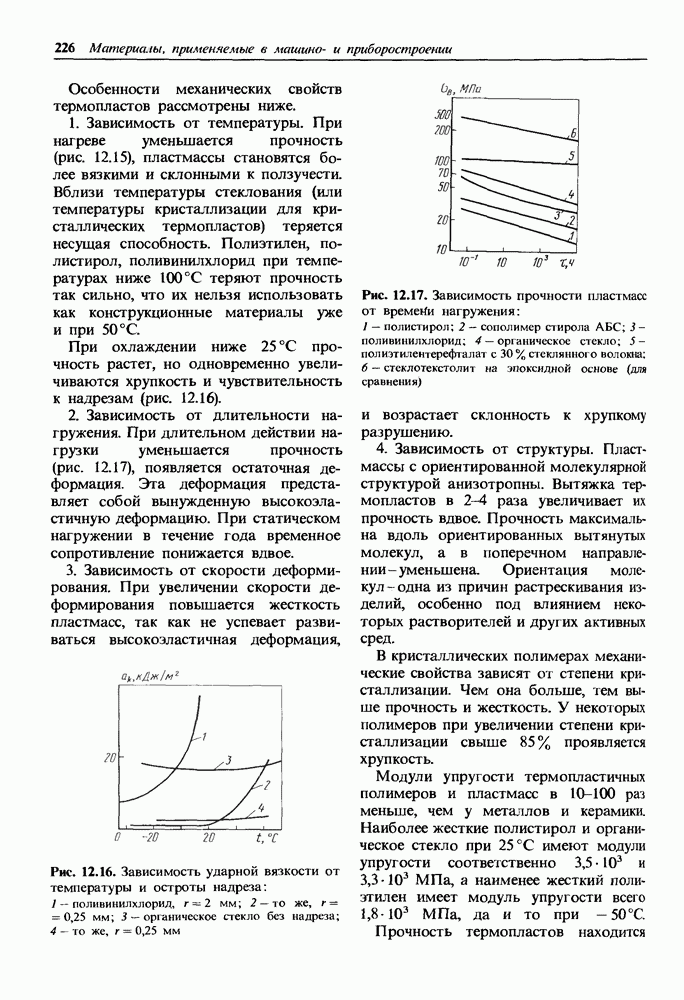
- Механические свойства термопластичных пластмасс.
- Механические свойства термореактивных пластмасс.
- Глава 13. МАТЕРИАЛЫ С ВЫСОКОЙ УДЕЛЬНОЙ ПРОЧНОСТЬЮ
- 13.1. Титан и сплавы на его основе
- Влияние легирующих элементов на структуру и свойства титановых сплавов.
- Особенности термической обработки титановых сплавов.
- Промышленные титановые сплавы.
- 13.2. Бериллий и сплавы на его основе
- Бериллиевые сплавы.
- 13.3. Композиционные материалы
- Дисперсно-упрочненные композиционные материалы.
- Волокнистые композиционные материалы.
- Композиционные материалы на неметаллической основе.
- Композиционные материалы на металлической основе.
- Глава 14. МАТЕРИАЛЫ, УСТОЙЧИВЫЕ К ВОЗДЕЙСТВИЮ ТЕМПЕРАТУРЫ И РАБОЧЕЙ СРЕДЫ
- 14.1. Коррозионно-стойкие материалы
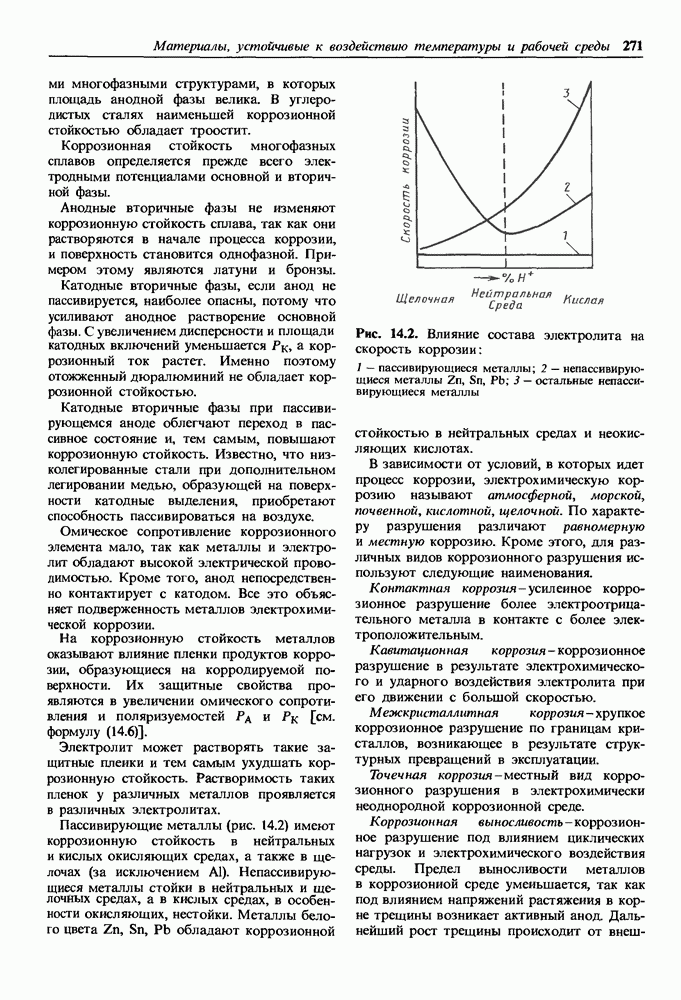
- Коррозионно-стойкие непассивирующиеся металлы.
- Коррозионностойкие пассивирующиеси металлы.
- Коррозионно-стойкие покрытия.
- 14.2. Жаростойкие материалы
- Жаростойкость металлов.
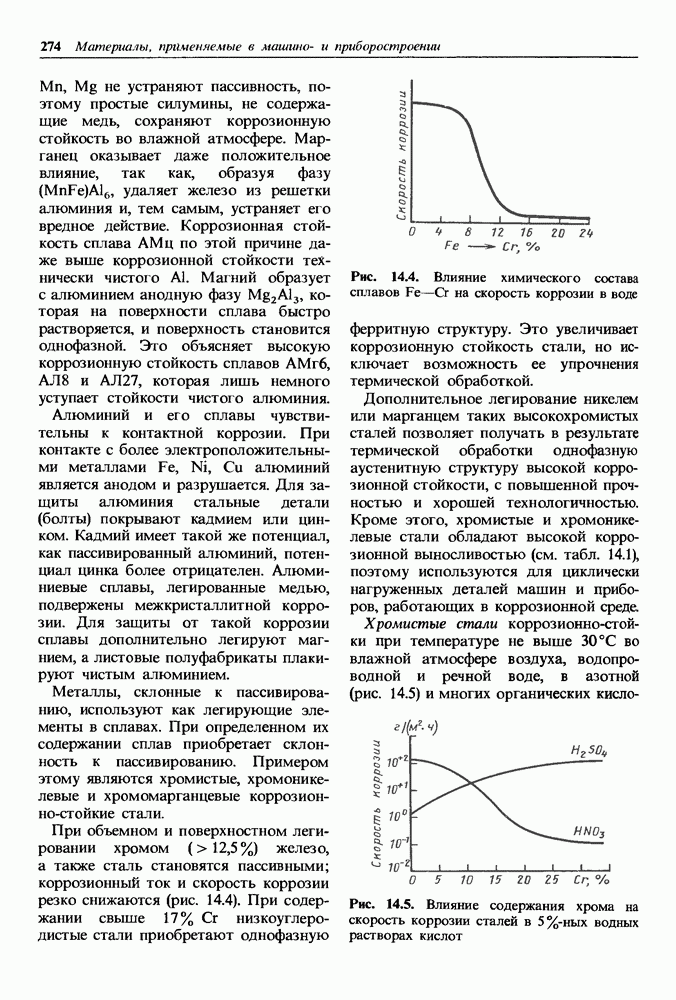
- Жаростойкость сплавов.
- 14.3. Жаропрочные материалы
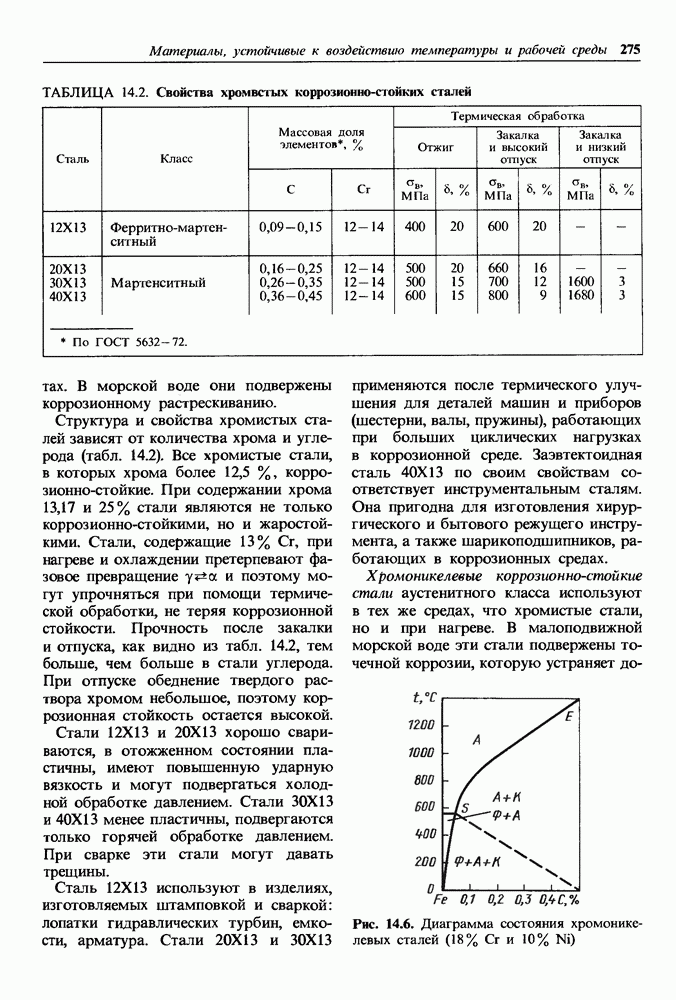
- Основные группы жаропрочных материалов.
- 14.4. Хладостойкие материалы
- Основные группы хладостойких материалов.
- 14.5. Радиационно-стойкие материалы
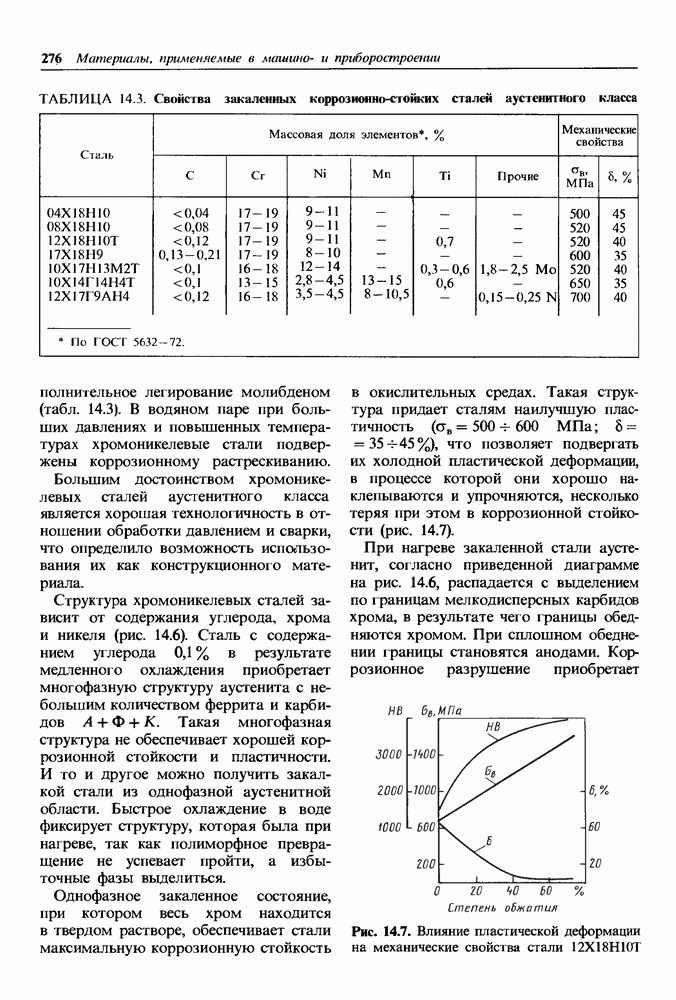
- Влияние облучения на коррозионную стойкость.
- Раздел второй. Материалы с особыми физическими свойствами
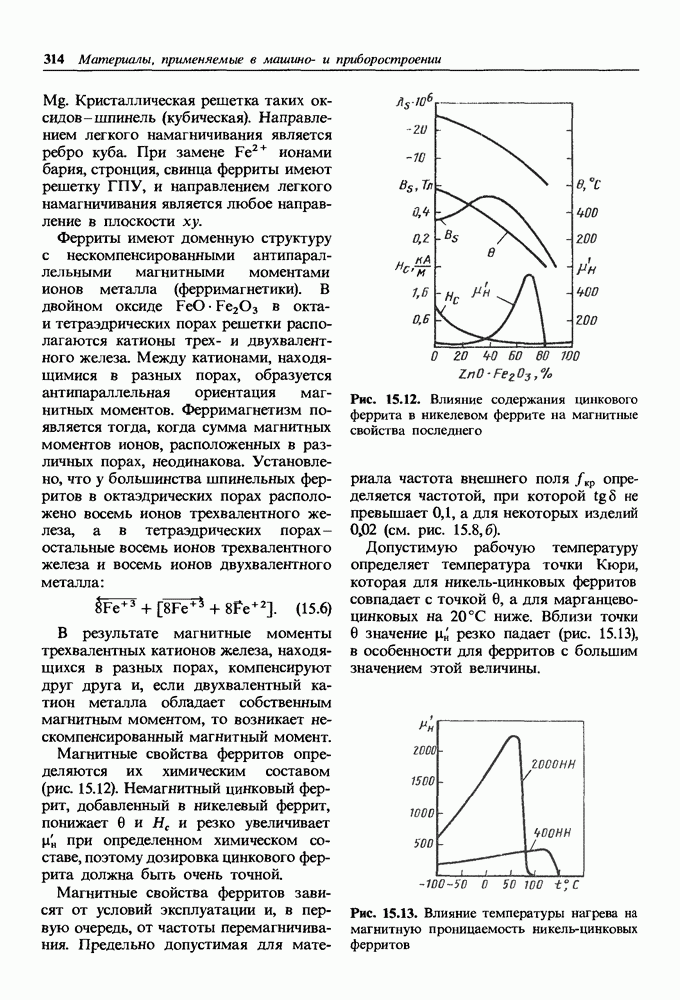
- 15.1. Общие сведения о ферромагнетиках
- 15.2. Магнитно-мягкие материалы
- Низкочастотные магнитно-мягкие материалы
- Высокочастотные магнитно-мягкие материалы.
- Материалы со специальными магнитными свойствами.
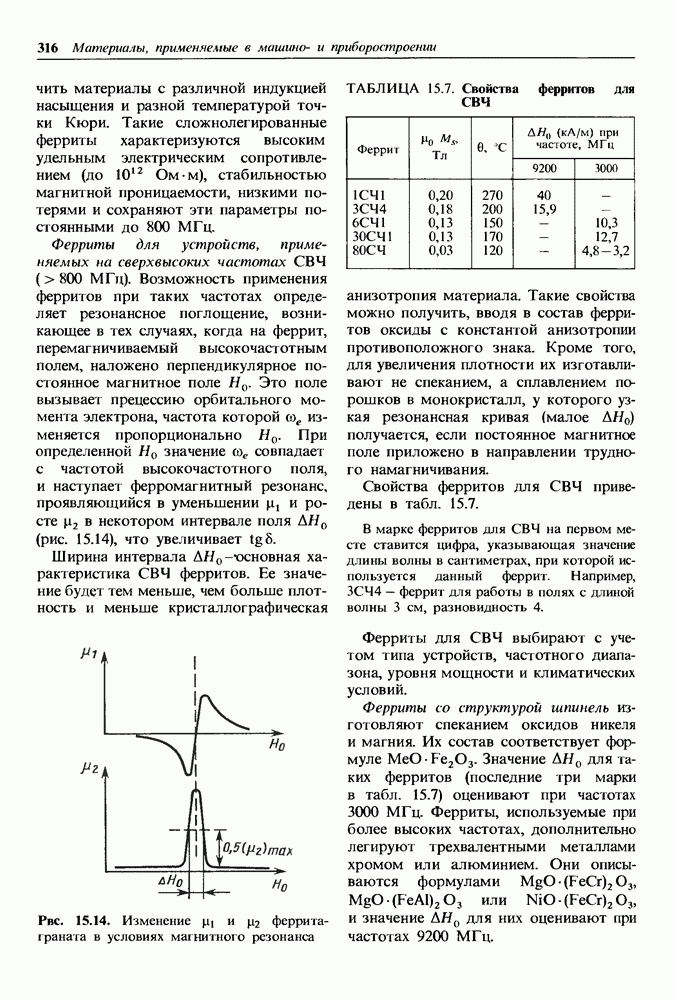
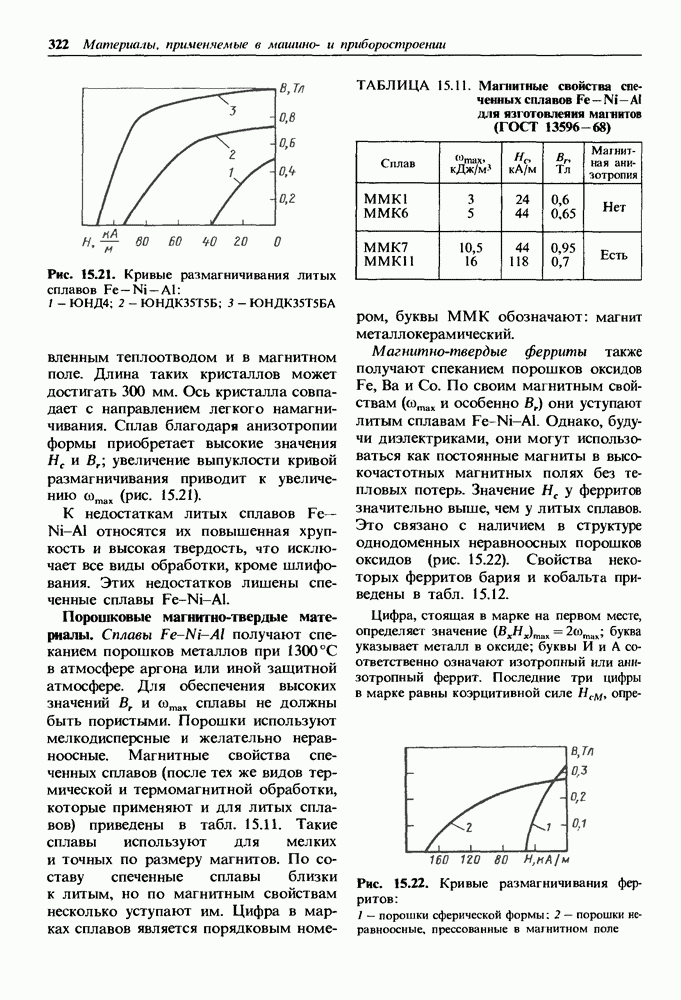
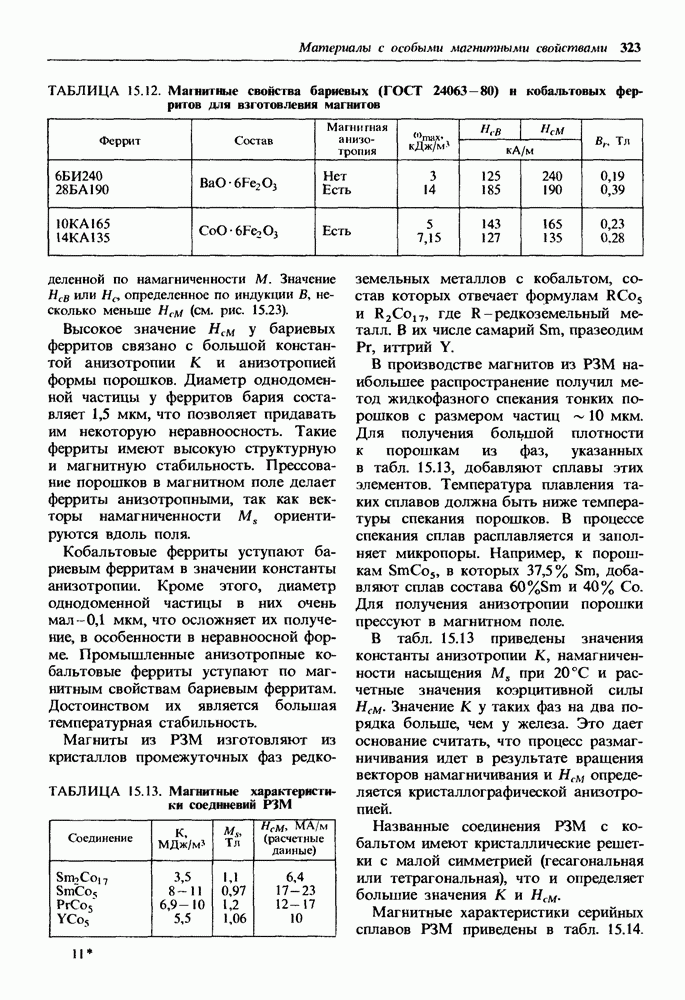
- 15.3. Магнитно-твердые материалы
- Магнитно-твердые лнтые материалы.
- Порошковые магнитно-твердые материалы.
- Деформируемые магнитно-твердые сплавы.
- Глава 16. МАТЕРИАЛЫ С ОСОБЫМИ ТЕПЛОВЫМИ СВОЙСТВАМИ
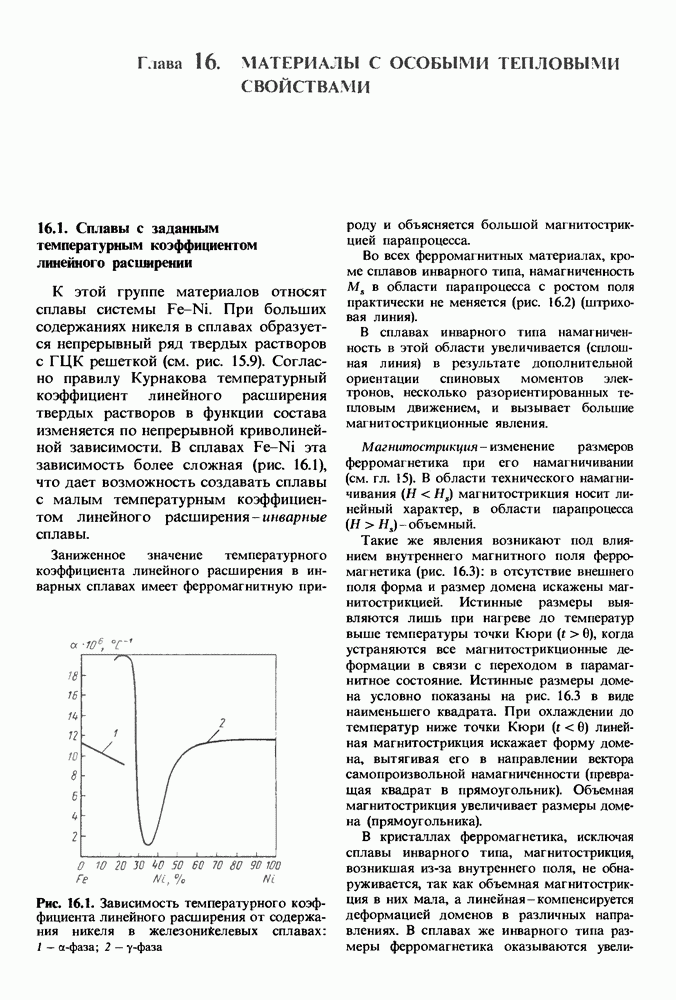
- 16.1. Сплавы с заданным температурным коэффициентом линейного расширении
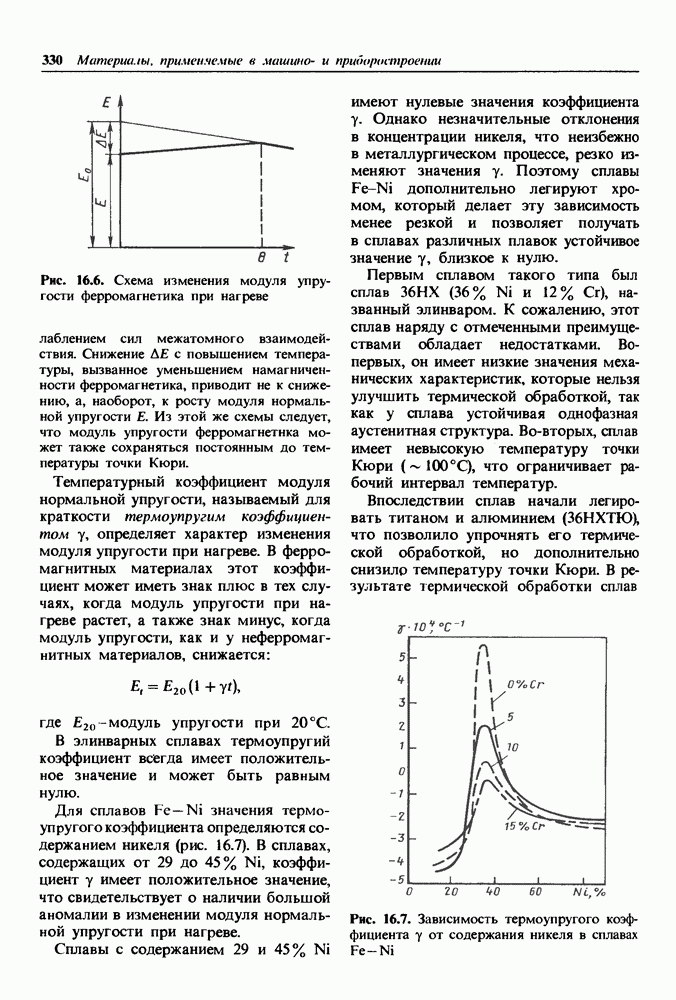
- 16.2. Сплавы с заданным температурным коэффициентом модуля упругости
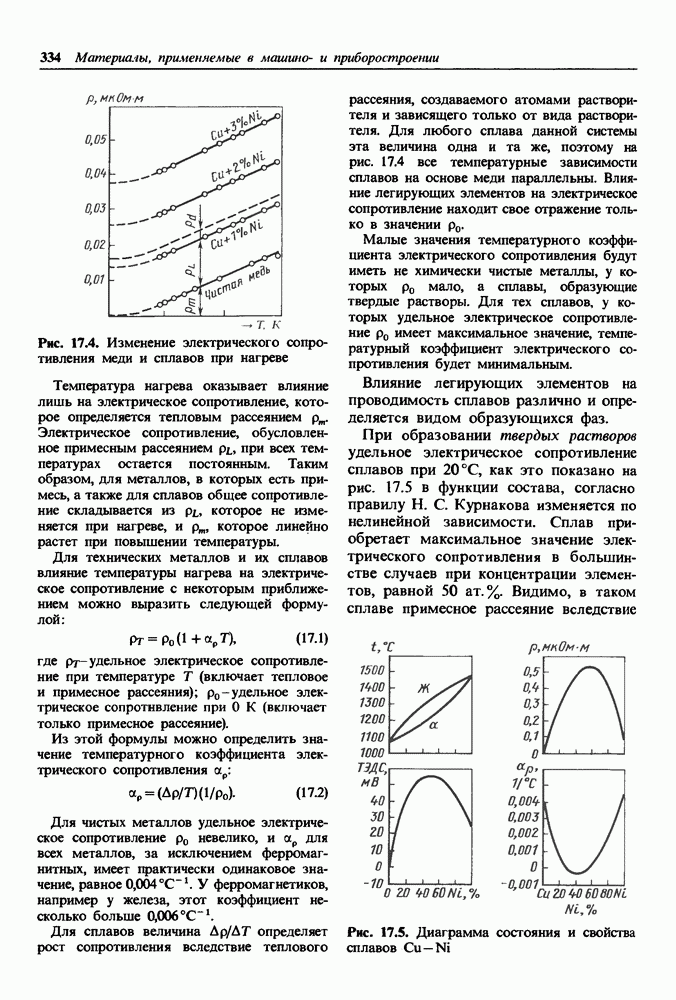
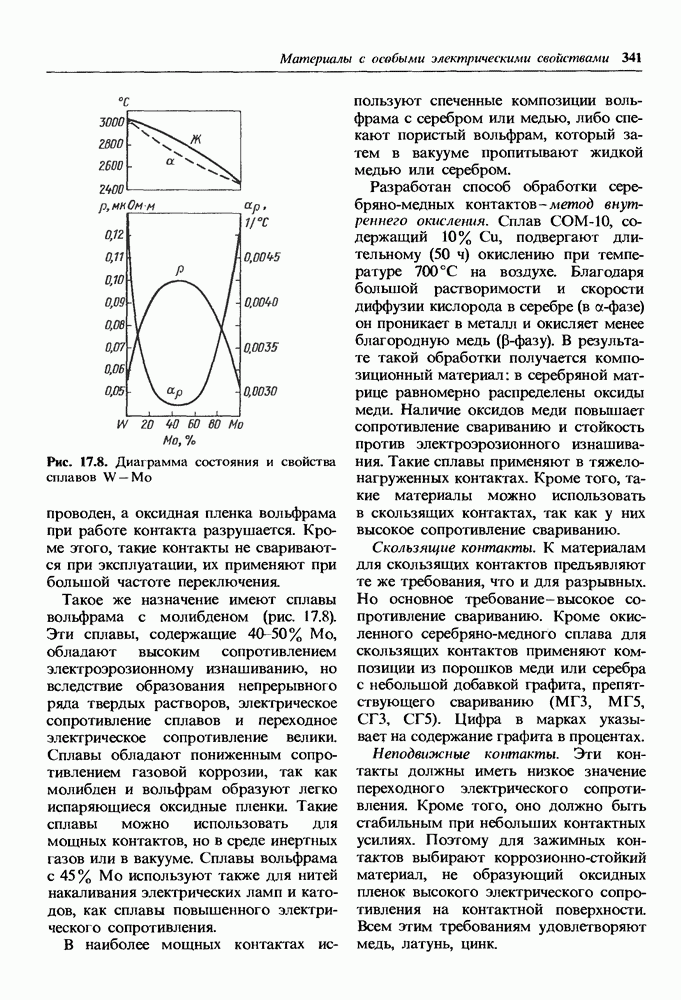
- Глава 17. МАТЕРИАЛЫ С ОСОБЫМИ ЭЛЕКТРИЧЕСКИМИ СВОЙСТВАМИ
- 17.1. Материалы высокой электрической проводимости
- Проводниковые материалы.
- 17.2. Полупроводниковые материалы
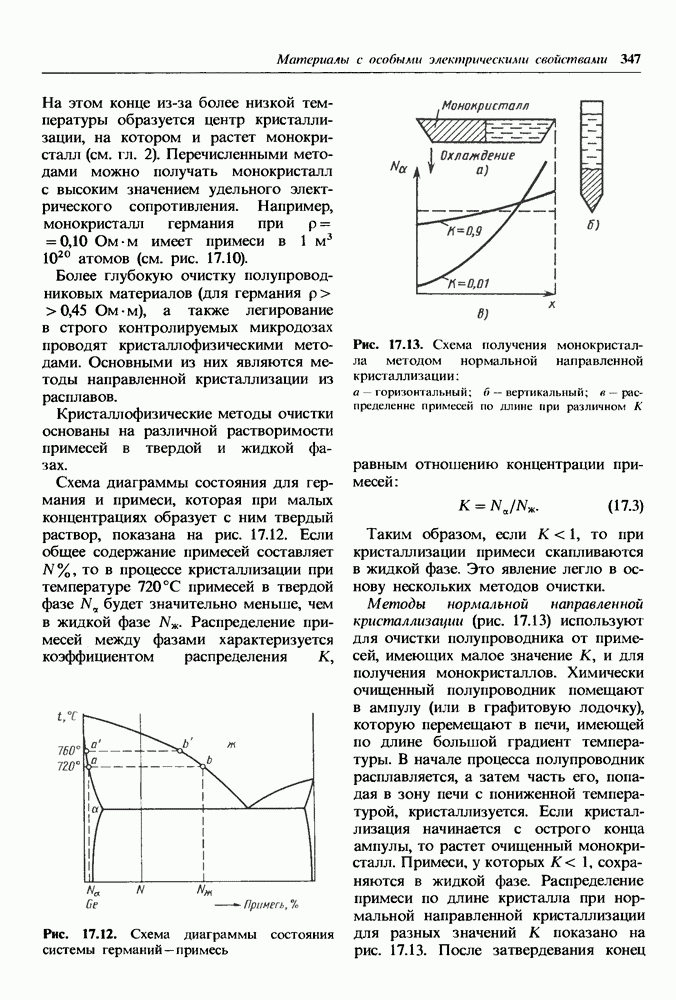
- Кристаллофизические методы получения сверхчистых материалов.
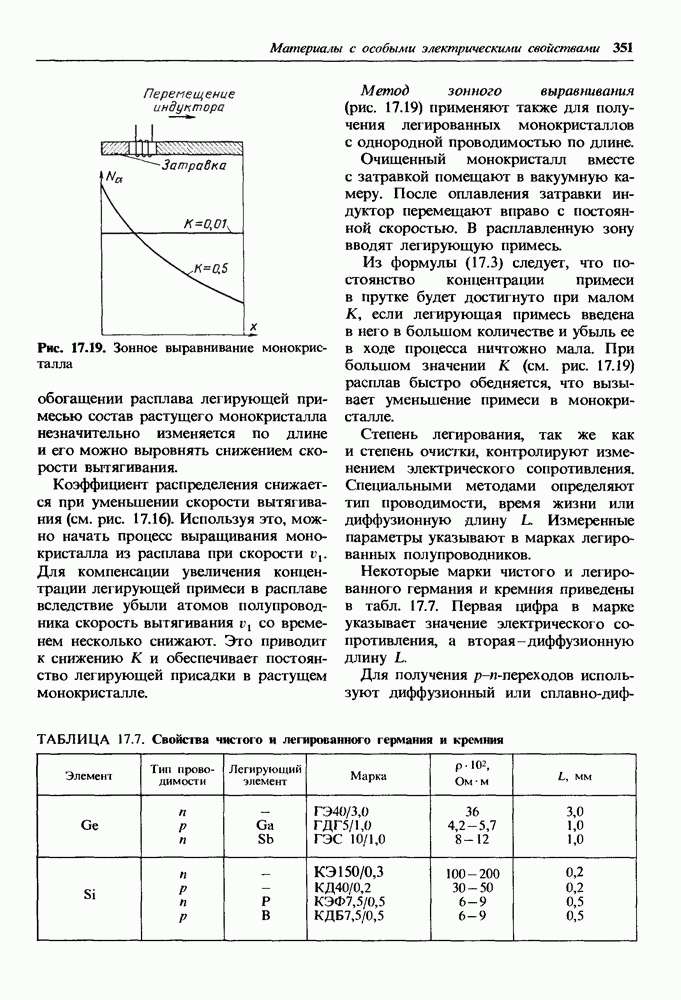
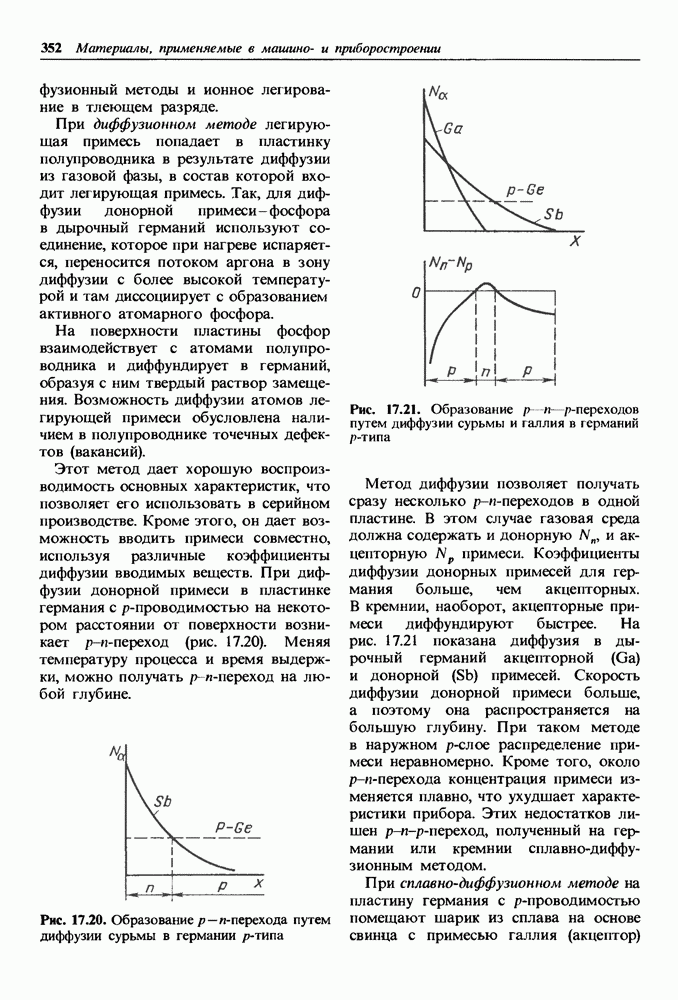
- Легирование полупроводников и получение p-n-переходов.
- 17.3. Диэлектрики
- Раздел третий. Инструментальные материалы
- Глава 18. МАТЕРИАЛЫ ДЛЯ РЕЖУЩИХ И ИЗМЕРИТЕЛЬНЫХ ИНСТРУМЕНТОВ
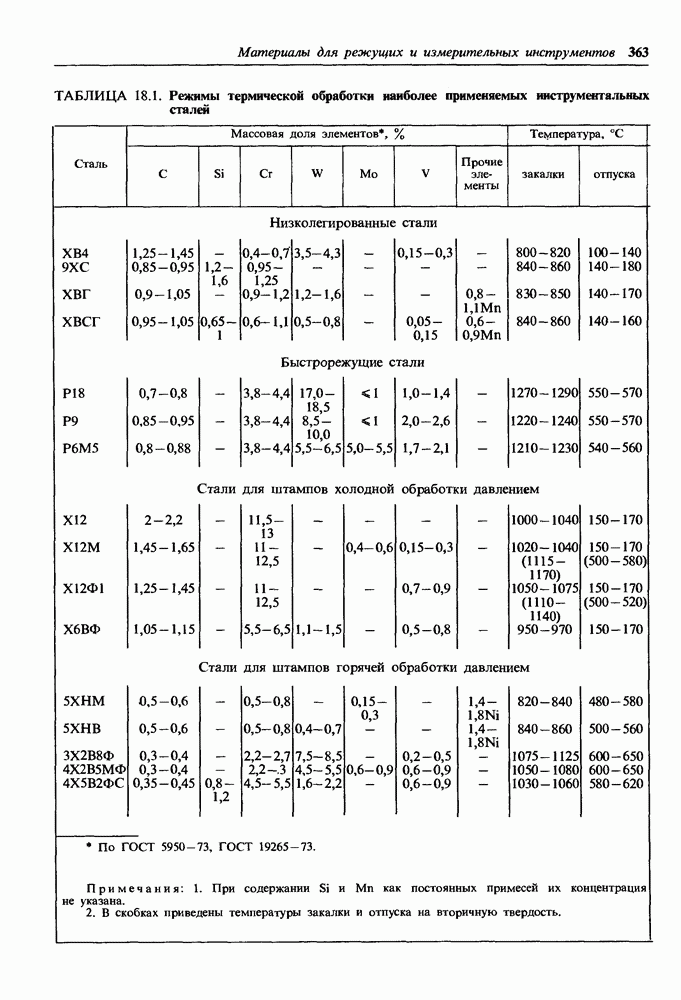
- 18.1. Материалы для режущих инструментов
- Низколегированные стали.
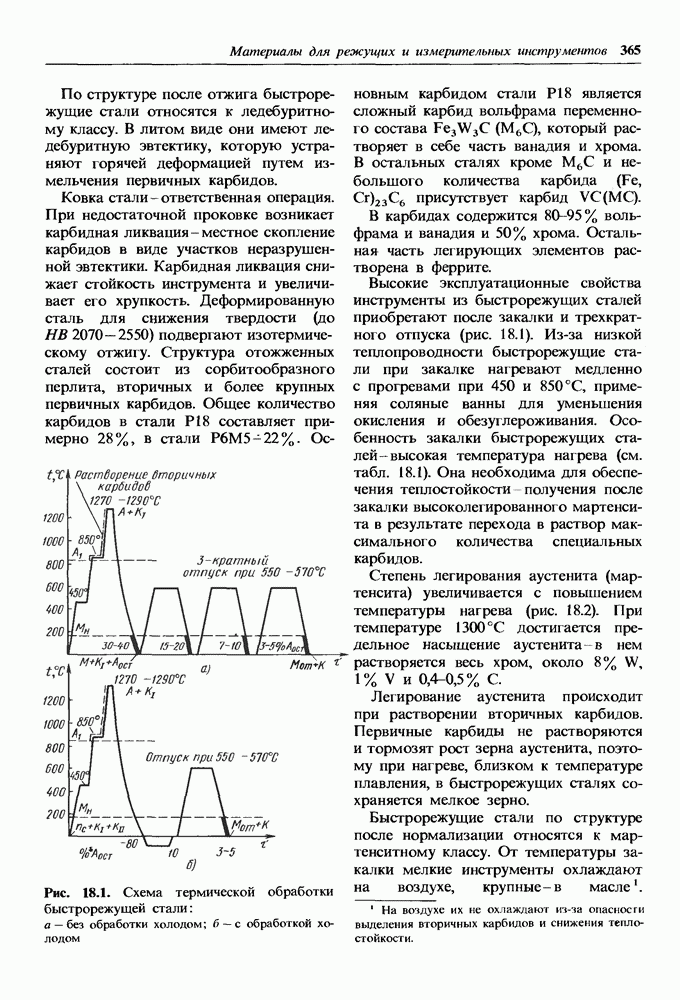
- Быстрорежущие стали.
- Спеченные твердые сплавы.
- Сверхтвердые материалы.
- 18.2. Стали для измерительных инструментов
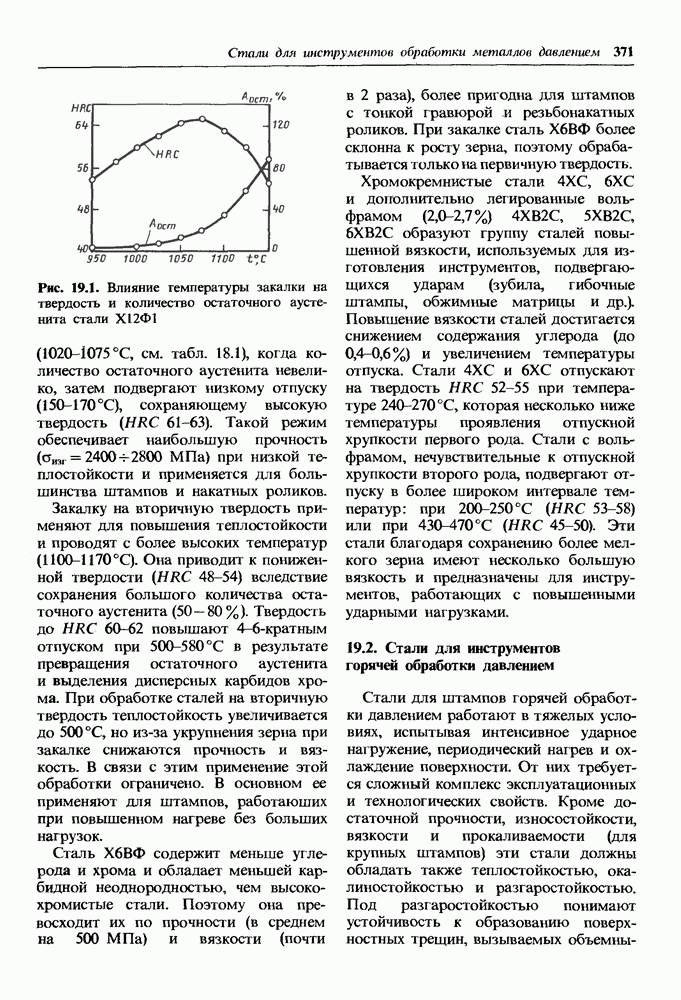
- Глава 19. СТАЛИ ДЛЯ ИНСТРУМЕНТОВ ОБРАБОТКИ МЕТАЛЛОВ ДАВЛЕНИЕМ
- 19.1. Стали для инструментов холодной обработки давлением
- 19.2. Стали для инструментов горячей обработки давлением
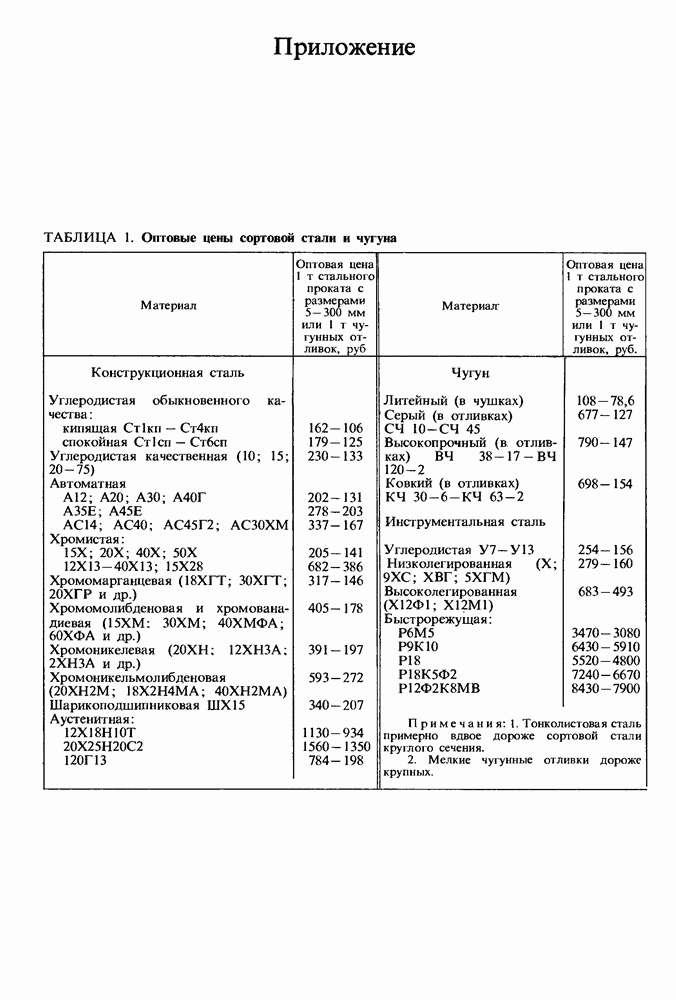
- Приложение
- Список литературы