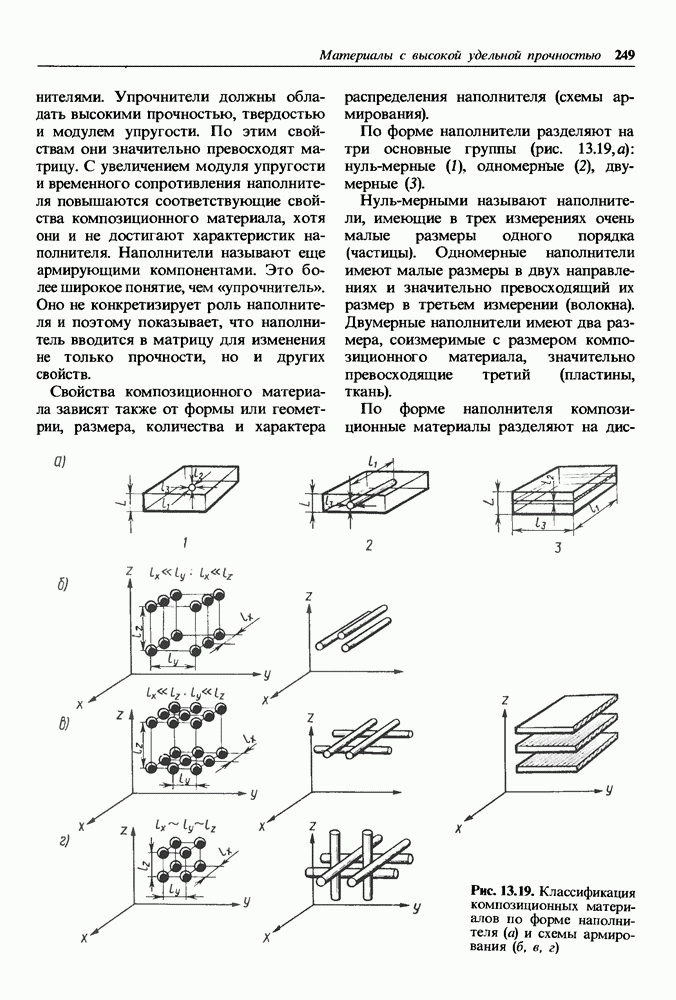
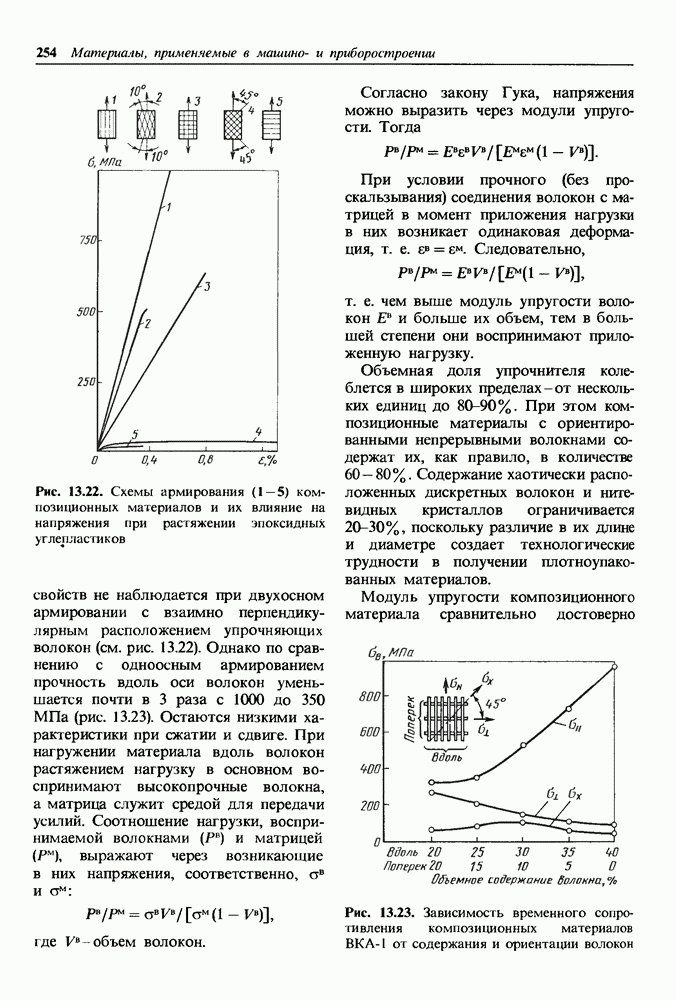
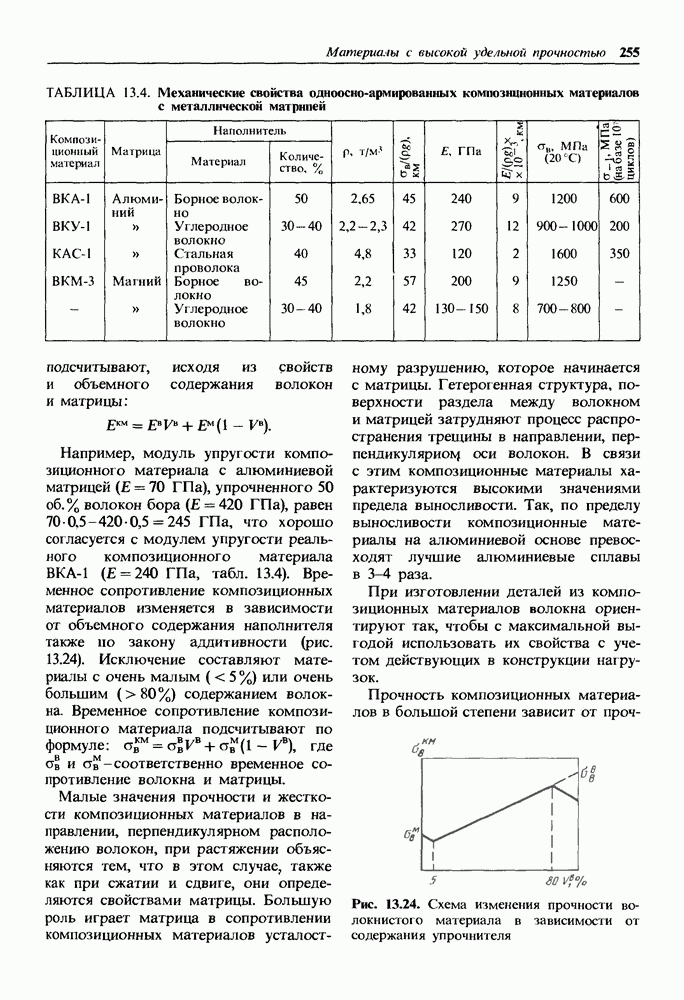
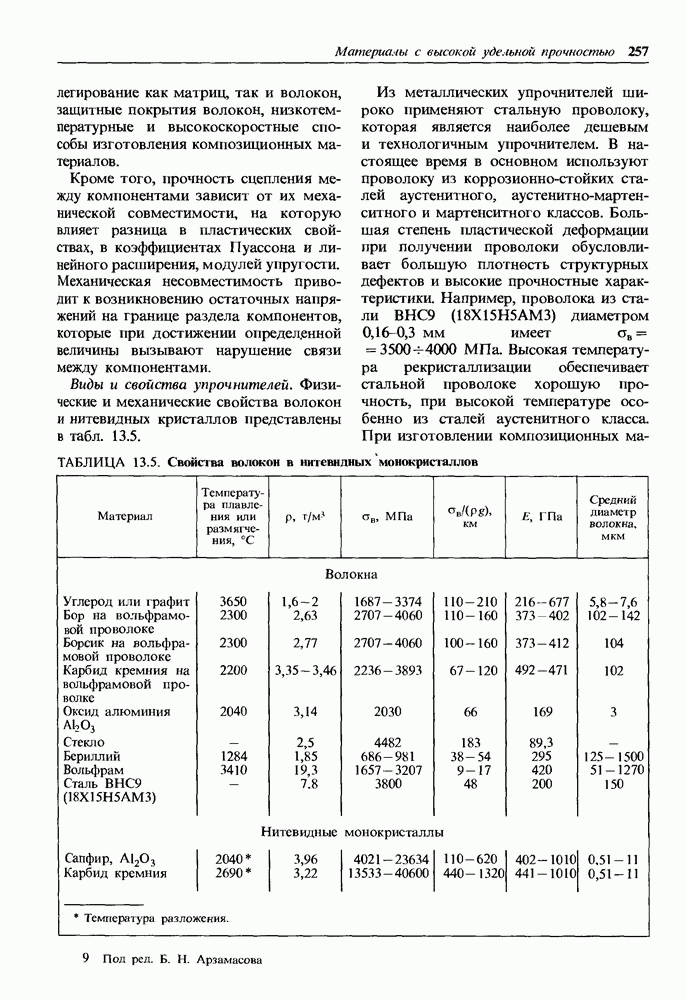
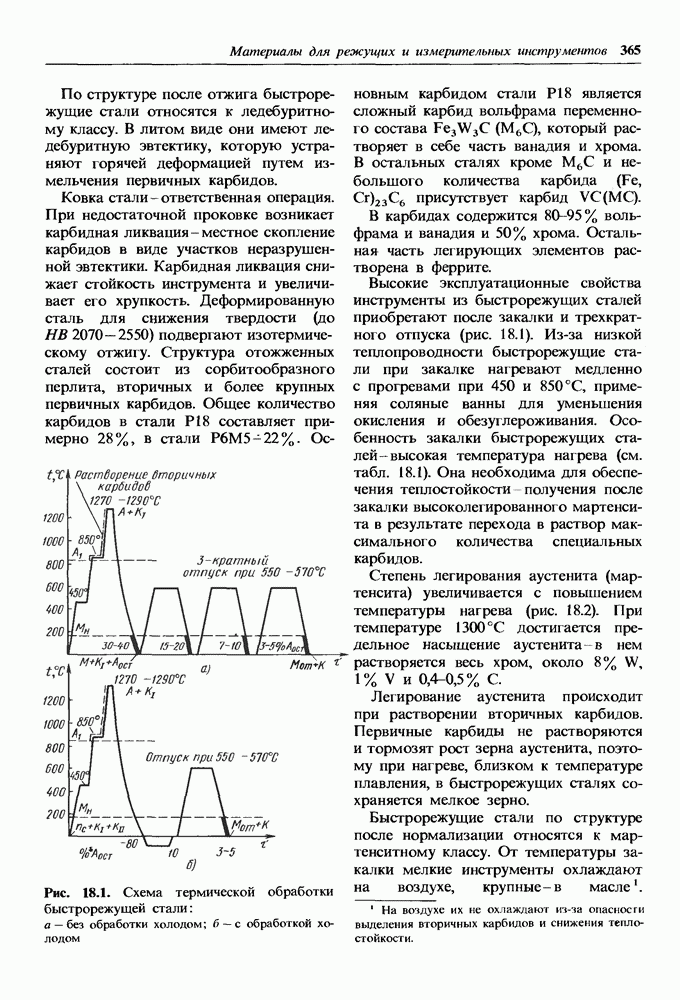
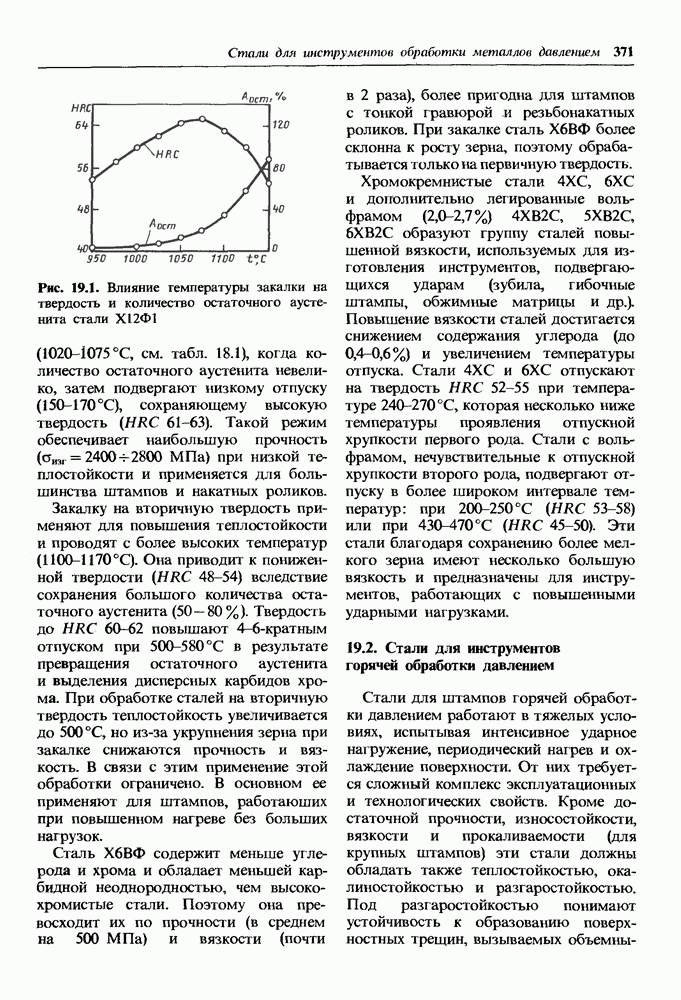
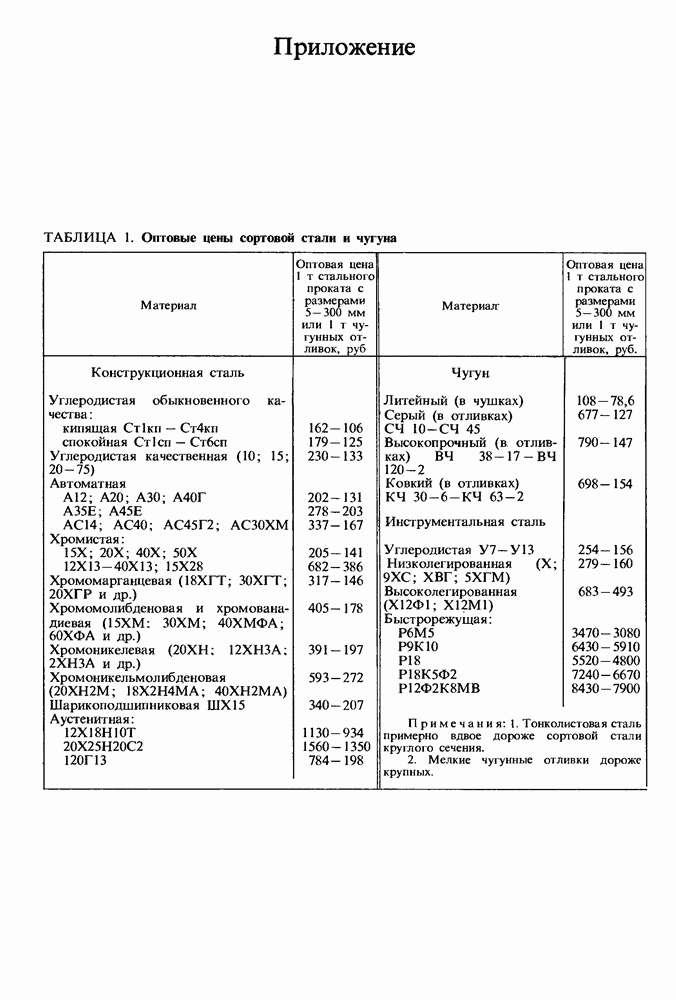
| << Предыдущий параграф | Следующий параграф >> |
Пред.
След.
Макеты страниц
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
ДЛЯ СТУДЕНТОВ И ШКОЛЬНИКОВ ЕСТЬ
ZADANIA.TO
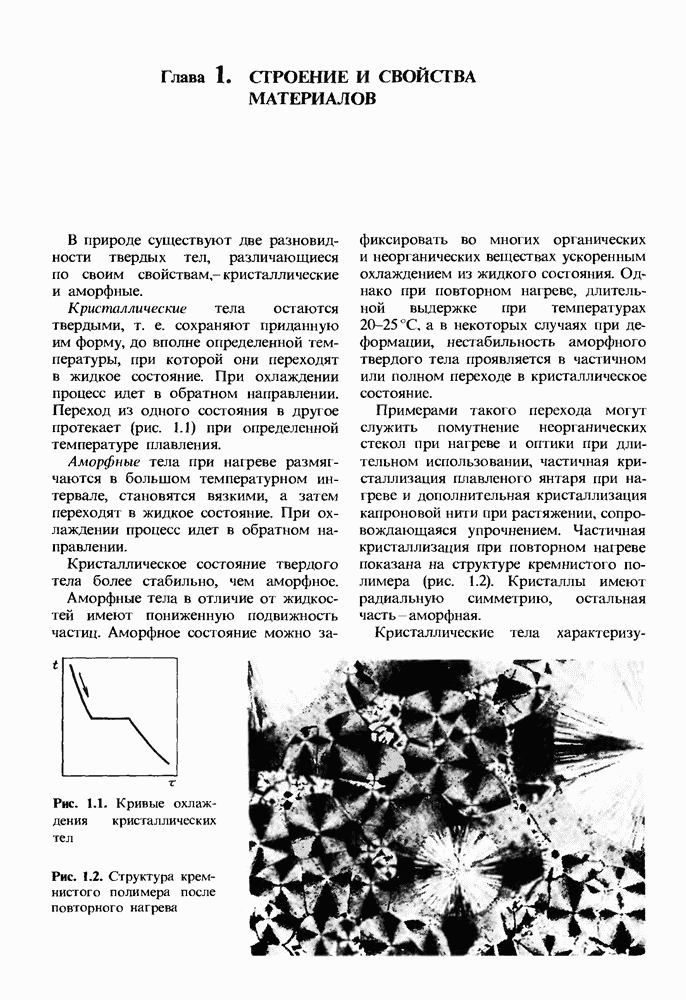
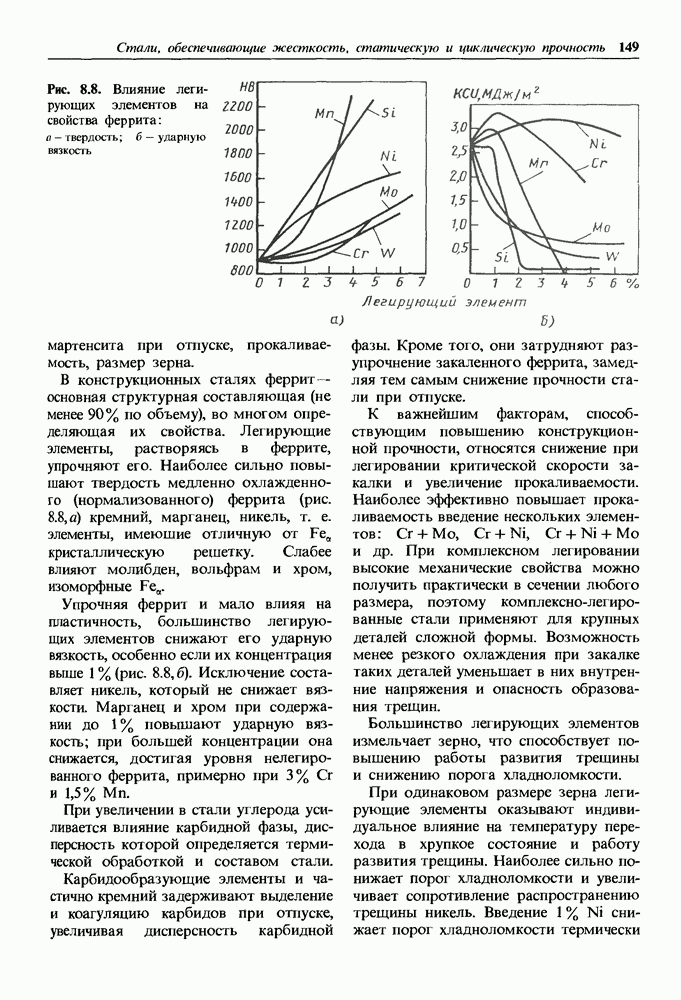
Ионные кристаллы.
В сложных кристаллах, состоящих из элементов различной валентности, возможно образование ионного типа связи. Такие кристаллы называют ионными.
При сближении атомов и перекрытии валентных энергетических зон между элементами происходит перераспределение электронов. Электроположительный элемент теряет валентные электроны, превращаясь в положительный ион, а электроотрицательный — приобретает его, достраивая тем самым свою валентную зону до устойчивой конфигурации, как у инертных газов. Таким образом, в узлах ионного кристалла располагаются ионы.
Представитель этой группы — кристалл оксида  решетка которого состоит из отрицательно заряженных ионов кислорода и положительно заряженных ионов железа.
решетка которого состоит из отрицательно заряженных ионов кислорода и положительно заряженных ионов железа.
Перераспределение валентных электронов при ионной связи происходит между атомами одной молекулы (одним атомом железа и одним атомом кислорода).
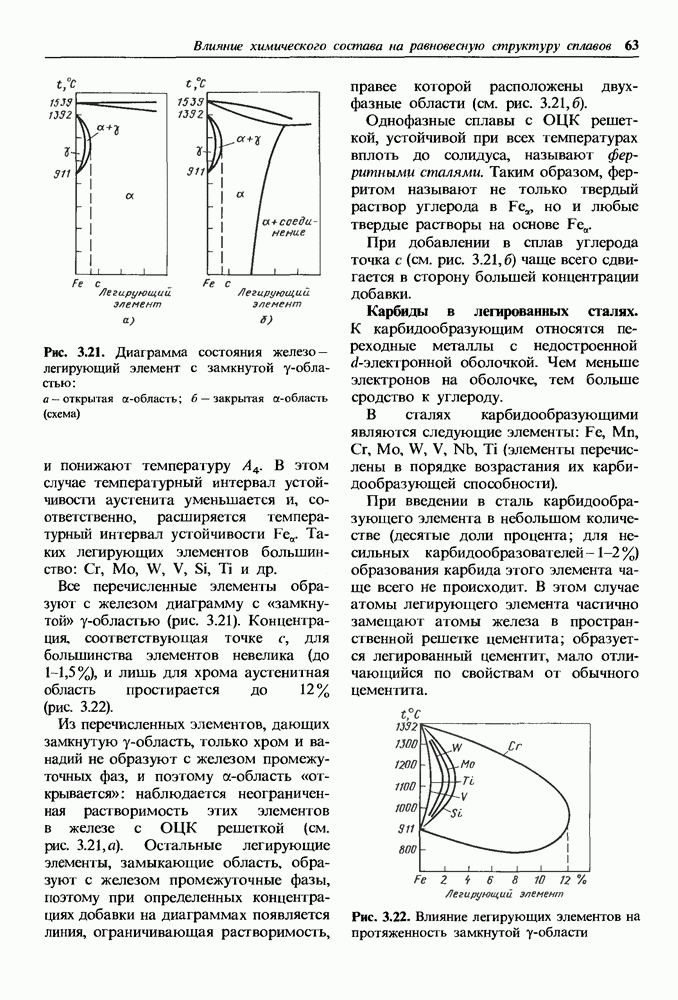
Для ковалентных кристаллов координационное число К, а слелователыю, и возможный тип решетки определяются валентностью элемента. Для ионных кристаллов координационное число определяется соотношением радиусов металлического и неметаллического ионов, так как каждый ион стремится притянуть к себе как можно больше ионов противоположного знака. Ионы в решетке укладываются как шары разных диаметров.
Радиус неметаллического иона больше радиуса металлического, и поэтому металлические ионы заполняют поры в кристаллической решетке, образованной ионами неметалла. В ионных кристаллах координационное число
определяет число ионов противоположного знака, которые окружают данный ион.
Приведенные ниже значения отношений радиуса металла  к радиусу неметалла
к радиусу неметалла  и соответствующие им координационные числа вытекают из геометрии упаковки шаров разных диаметров.
и соответствующие им координационные числа вытекают из геометрии упаковки шаров разных диаметров.

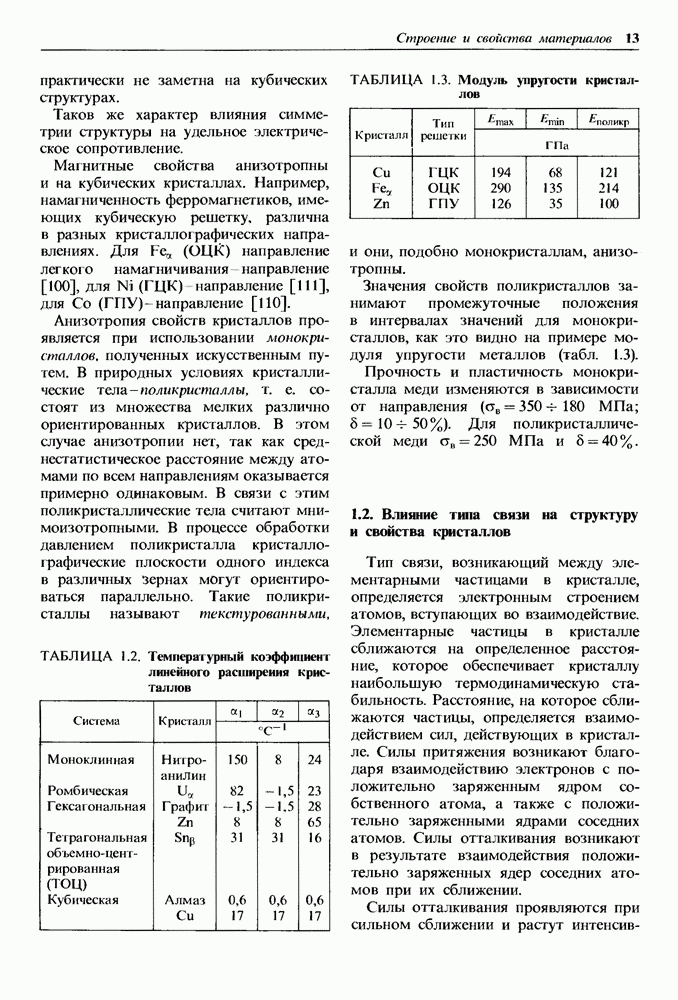
Для  координационное число будет равно 6, так как указанное соотношение равно 0,54. На рис. 1.14 приведена кристаллическая решетка
координационное число будет равно 6, так как указанное соотношение равно 0,54. На рис. 1.14 приведена кристаллическая решетка  Ионы кислорода образуют ГЦК решетку, ионы железа занимают в ней поры. Каждый ион железа окружен шестью ионами кислорода, и, наоборот, каждый ион кислорода окружен шестью ионами железа, В связи с этим в ионных кристаллах нельзя выделить пару ионов, которые можно было бы считать молекулой. При испарении такой кристалл распадается на молекулы.
Ионы кислорода образуют ГЦК решетку, ионы железа занимают в ней поры. Каждый ион железа окружен шестью ионами кислорода, и, наоборот, каждый ион кислорода окружен шестью ионами железа, В связи с этим в ионных кристаллах нельзя выделить пару ионов, которые можно было бы считать молекулой. При испарении такой кристалл распадается на молекулы.
При нагреве соотношение ионных радиусов может изменяться, так как ионный радиус неметалла растет интенсивнее, чем радиус металлического иона. Это приводит к изменению типа кристаллической структуры, т. е. к полиморфизму. Например, у оксида  при нагреве шпинельная кристаллическая решетка изменяется на ромбоэдрическую решетку (см. п. 14.2),
при нагреве шпинельная кристаллическая решетка изменяется на ромбоэдрическую решетку (см. п. 14.2),

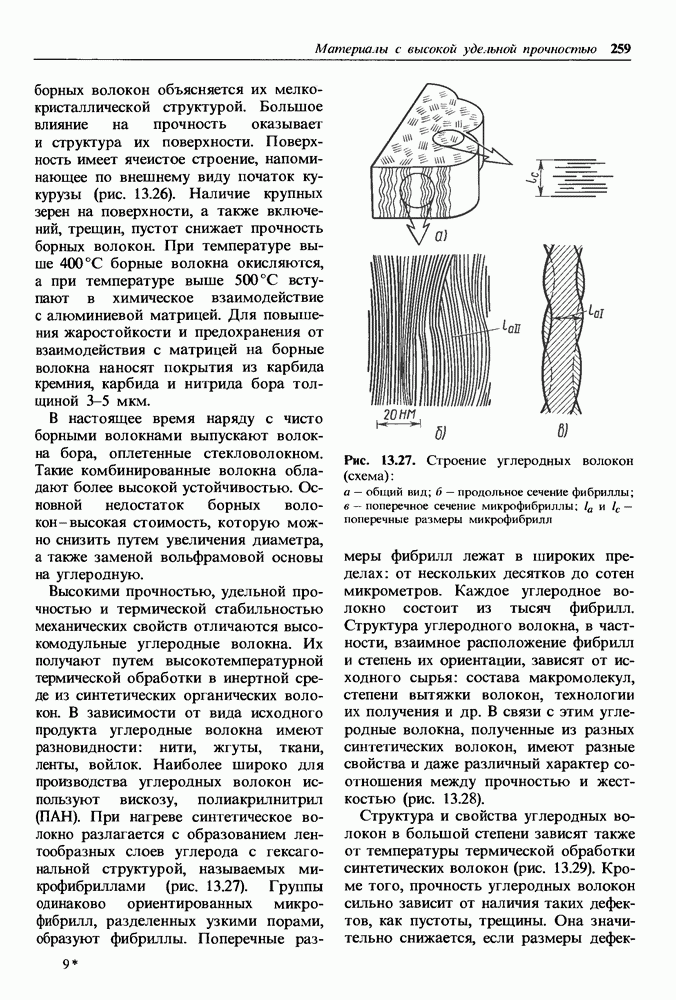
Рис. 1.14. Кристаллическая решетка  а — схема; б — пространственное изображение
а — схема; б — пространственное изображение
Энергия связи ионного кристалла по своей величине близка к энергии связи ковалентных кристаллов и превышает энергию связи металлических и тем более молекулярных кристаллов. В связи с этим ионные кристаллы имеют высокую температуру плавления и испарения, высокий модуль упругости и низкие коэффициенты сжимаемости и линейного расширения.
Заполнение энергетических зон вследствие перераспределения электронов делает ионные кристаллы полупроводниками или диэлектриками.
Во многих ионных кристаллах имеется доля ковалентной связи. Под действием электромагнитных полей друг друга происходит поляризация ионов и возникает смешанная ионно-ковалентная связь. Поляризация деформирует электронные зоны, в результате чего ионы теряют сферическую симметрию. С изменением доли ковалентной связи в ионных кристаллах изменяются и свойства. В кристаллах, образованных элементами различных групп  доля ковалентной связи растет от
доля ковалентной связи растет от  до
до  . В последних соединениях, образованных элементами четвертой группы, доля ковалентной связи составляет 90% и кристаллы преимущественно являются ковалентными. Увеличение доли ковалентной связи вызывает увеличение электрической проводимости. Кристаллы
. В последних соединениях, образованных элементами четвертой группы, доля ковалентной связи составляет 90% и кристаллы преимущественно являются ковалентными. Увеличение доли ковалентной связи вызывает увеличение электрической проводимости. Кристаллы  — диэлектрики, а кристаллы
— диэлектрики, а кристаллы  — полупроводники.
— полупроводники.
| << Предыдущий параграф | Следующий параграф >> |
Оглавление
- Введение
- Глава 1. СТРОЕНИЕ И СВОЙСТВА МАТЕРИАЛОВ
- 1.1. Элементы кристаллографии
- 1.2. Влияние типа связи на структуру и свойства кристаллов
- Молекулярные кристаллы.
- Ковалентные кристаллы.
- Металлические кристаллы.
- Ионные кристаллы.
- 1.3. Фазовый состав сплавов
- Твердые растворы.
- Промежуточные фазы.
- 1.4. Дефекты кристаллов
- Линейные дефекты.
- Поверхностные дефекты.
- 1.5. Диффузия в металлах и сплавах
- 1.6. Жидкие кристаллы
- 1.7. Структура полимеров, стекла и керамики
- Глава 2. ФОРМИРОВАНИЕ СТРУКТУРЫ ЛИТЫХ МАТЕРИАЛОВ
- 2.1. Самопроизвольная кристаллизация
- 2.2. Несамопроизвольная кристаллизация
- 2.3. Форма кристаллов и строение слитков
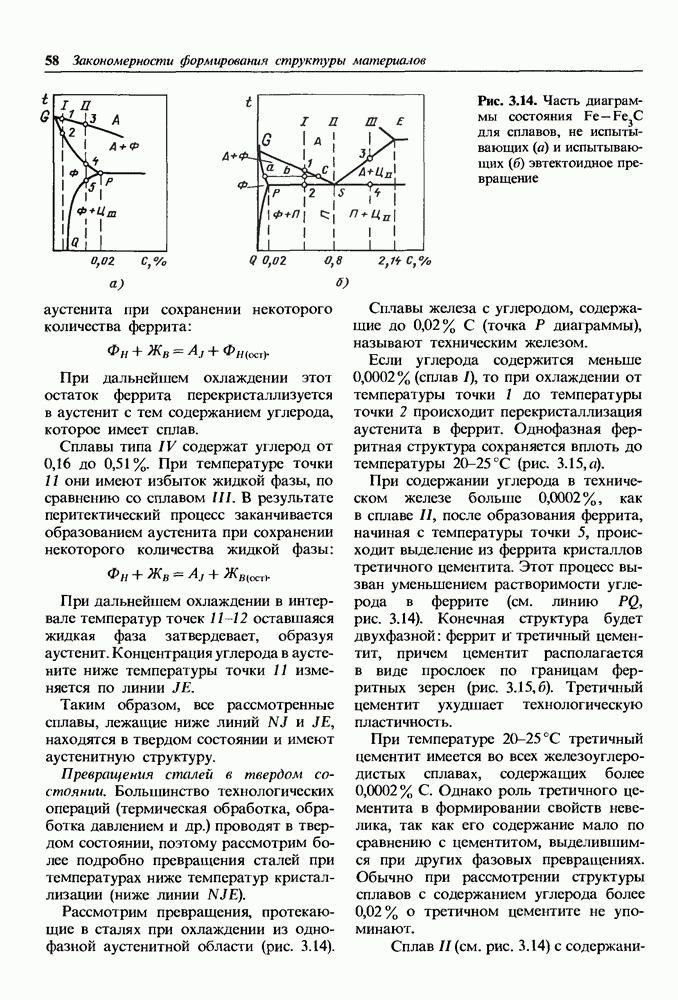
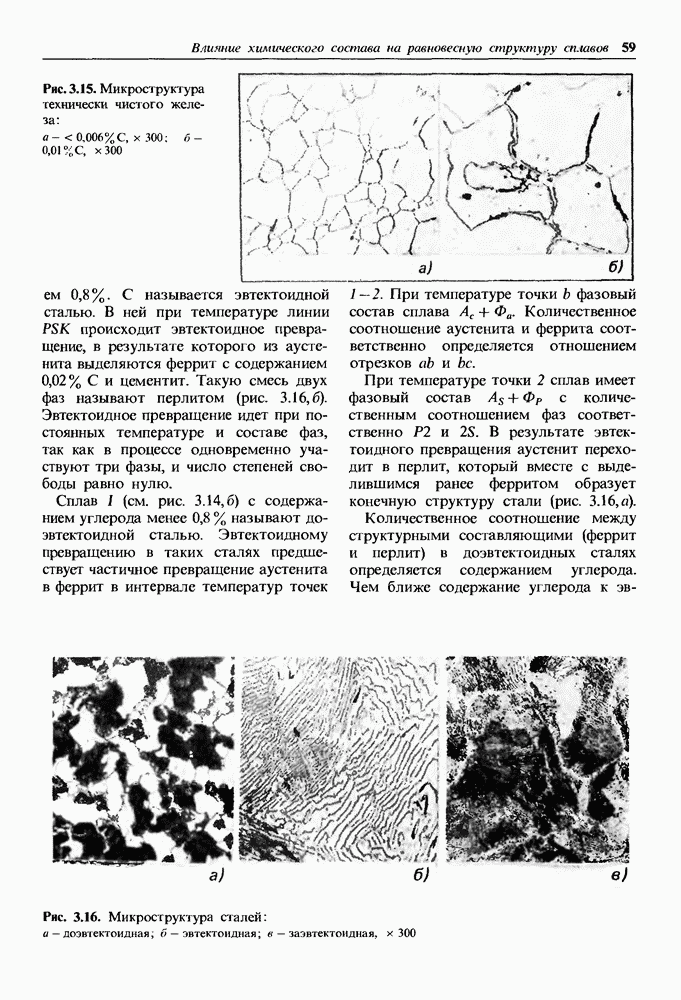
- 2.4. Получение монокристаллов
- 2.5. Аморфное состояние металлов
- Глава 3. ВЛИЯНИЕ ХИМИЧЕСКОГО СОСТАВА НА РАВНОВЕСНУЮ СТРУКТУРУ СПЛАВОВ
- 3.1. Методы построения диаграмм состояния
- 3.2. Основные равновесные диаграммы состояния двойных сплавов
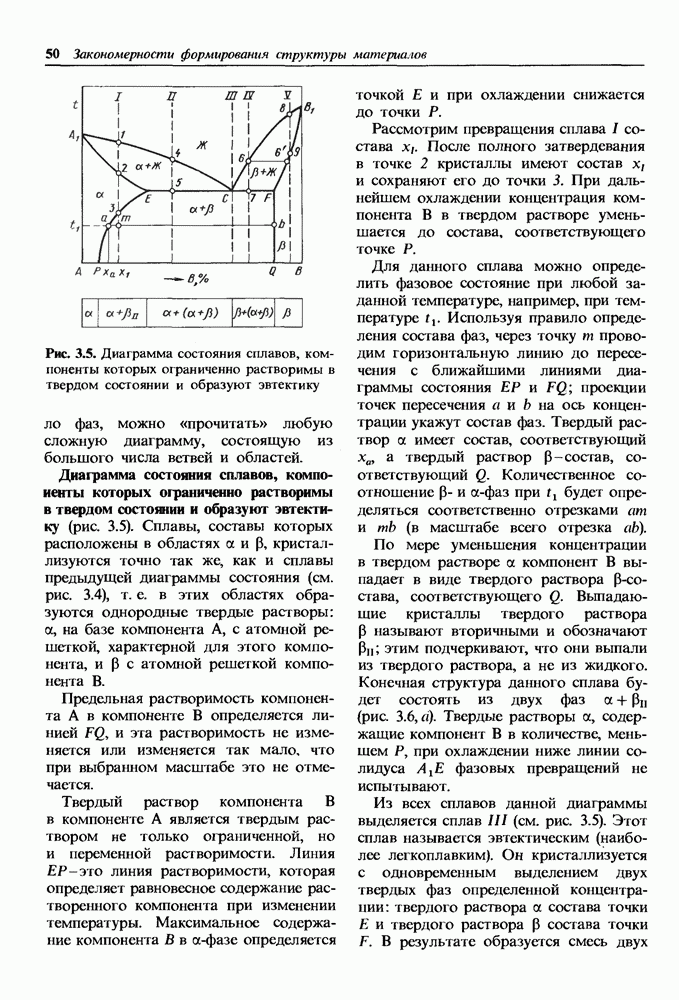
- Диаграмма состояния сплавов, компоненты которых ограниченно растворимы в твердом состоянии и образуют эвтектику
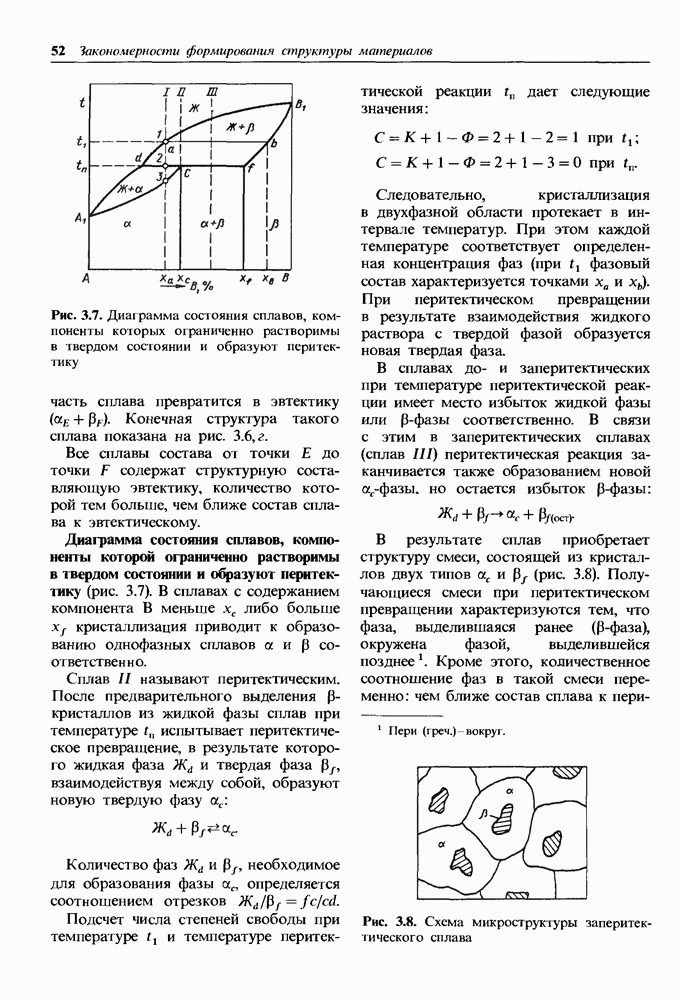
- Диаграмма состояния сплавов, компоненты которой ограниченно растворимы в твердом состоянии и образую! перитектику
- Диаграмма состояния сплавов с полиморфным превращением одного из компонентов.
- Диаграмма состояния сплавов с полиморфными превращениями компонентов и эвтектоидным превращением.
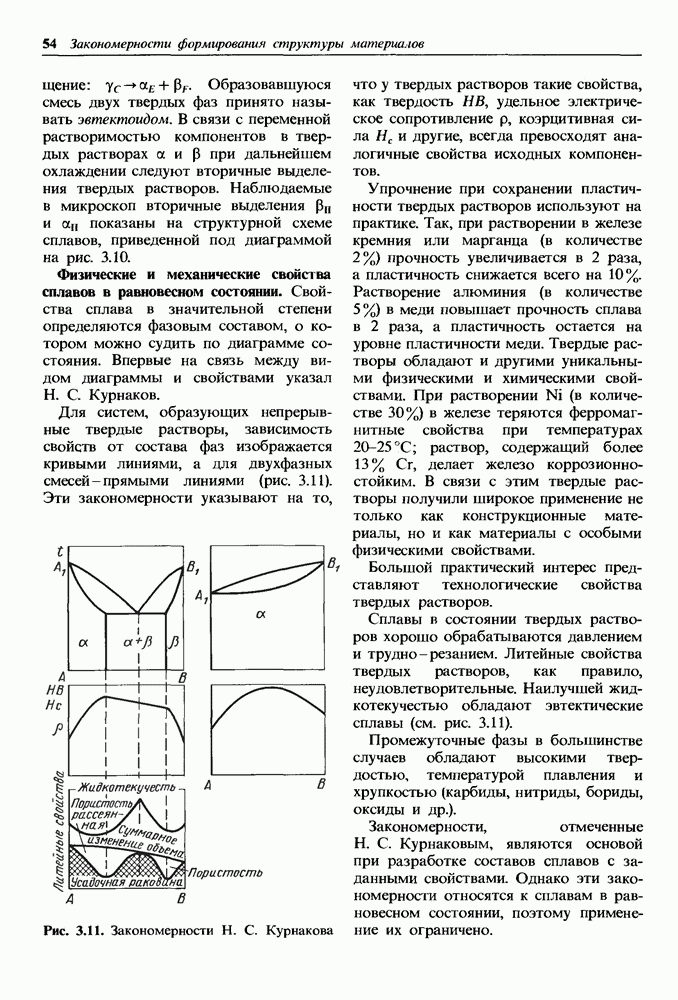
- Физические и механические свойства сплавов в равновесном состоянии.
- 3.3. Диаграмма состояния железоуглеродистых сплавов
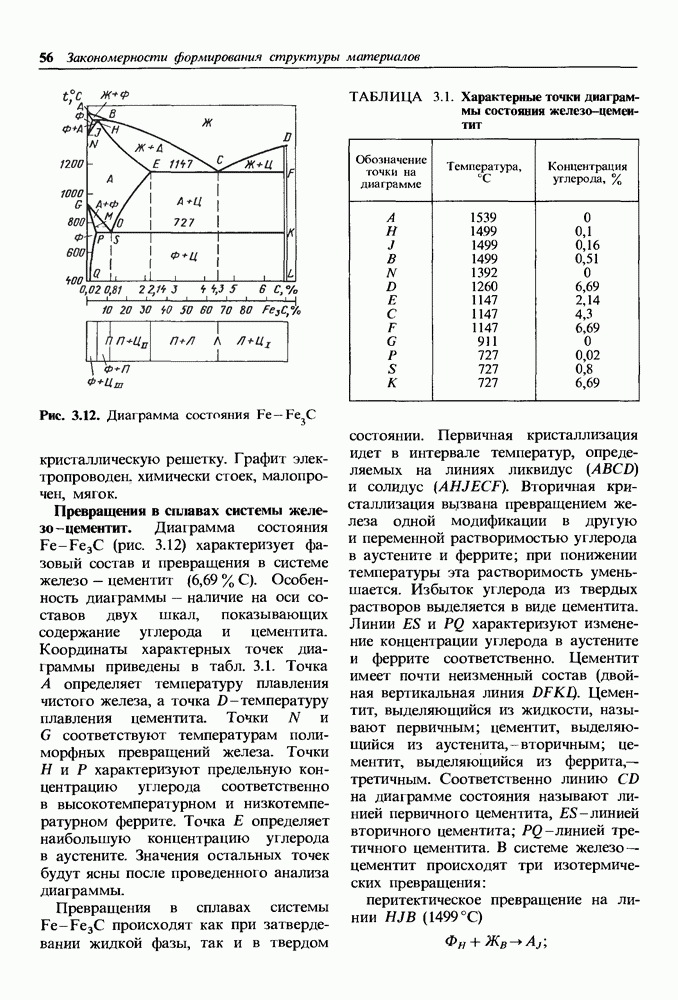
- Превращения в сплавах системы железо-цементит.
- Превращения в сплавах системы железо-графит.
- 3.4. Влияние легирующих элементов на равновесную структуру сталей
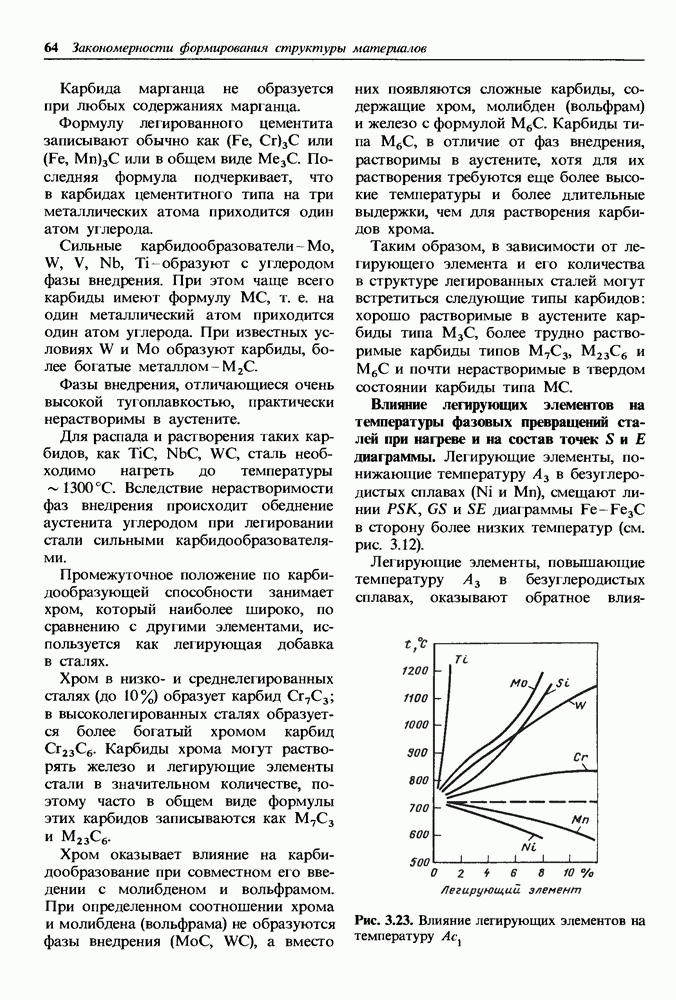
- Карбиды в легированных сталях.
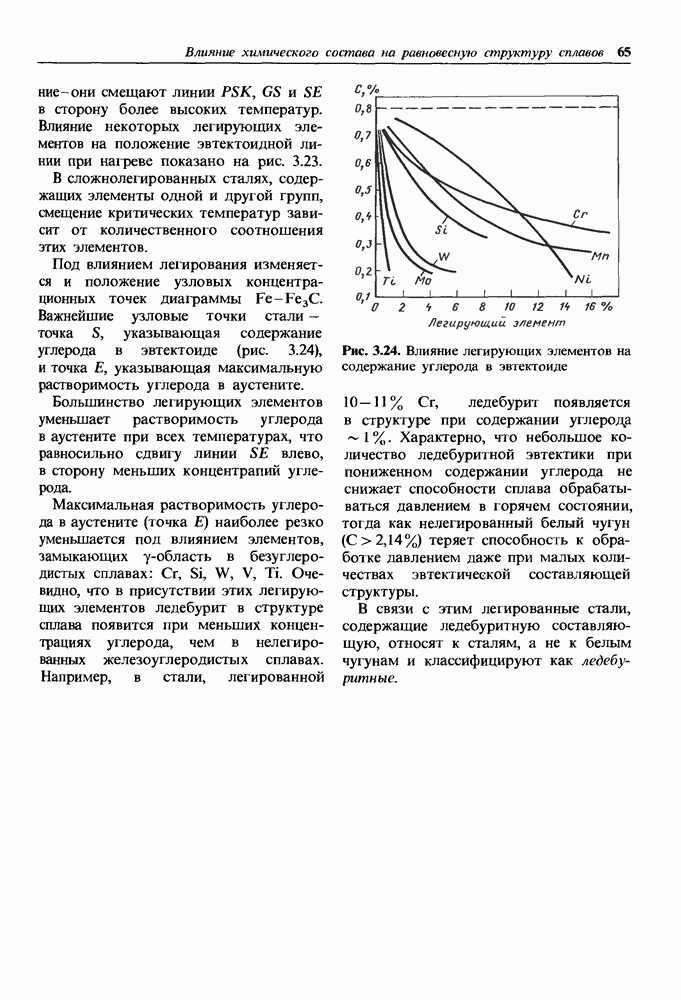
- Влияние легирующих элементов на температуры фазовых превращений сталей при нагреве и на состав точек S и Е диаграммы.
- Глава 4. ФОРМИРОВАНИЕ СТРУКТУРЫ ДЕФОРМИРОВАННЫХ МЕТАЛЛОВ И СПЛАВОВ
- 4.1. Пластическая деформация моно- и поликристаллов
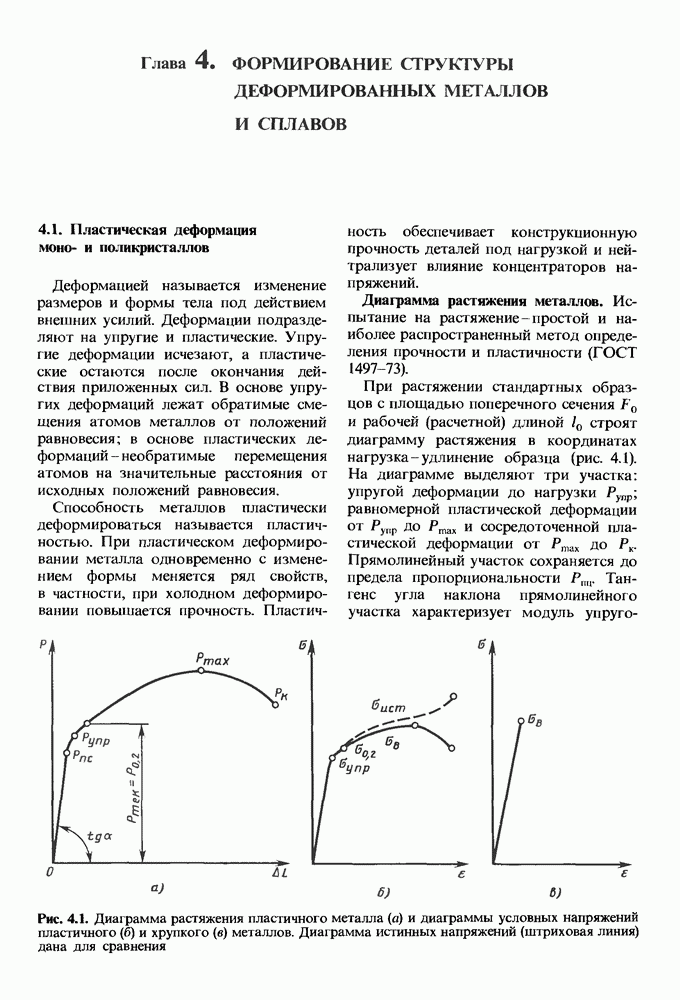
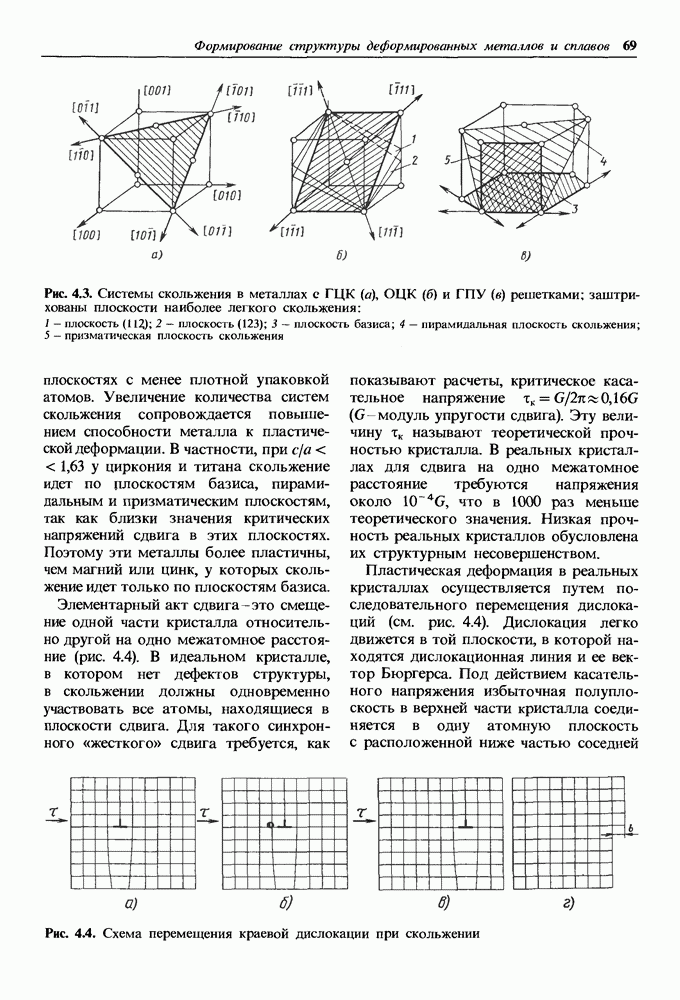
- Механизм пластической деформации
- Пластическая деформация поликристаллических металлов.
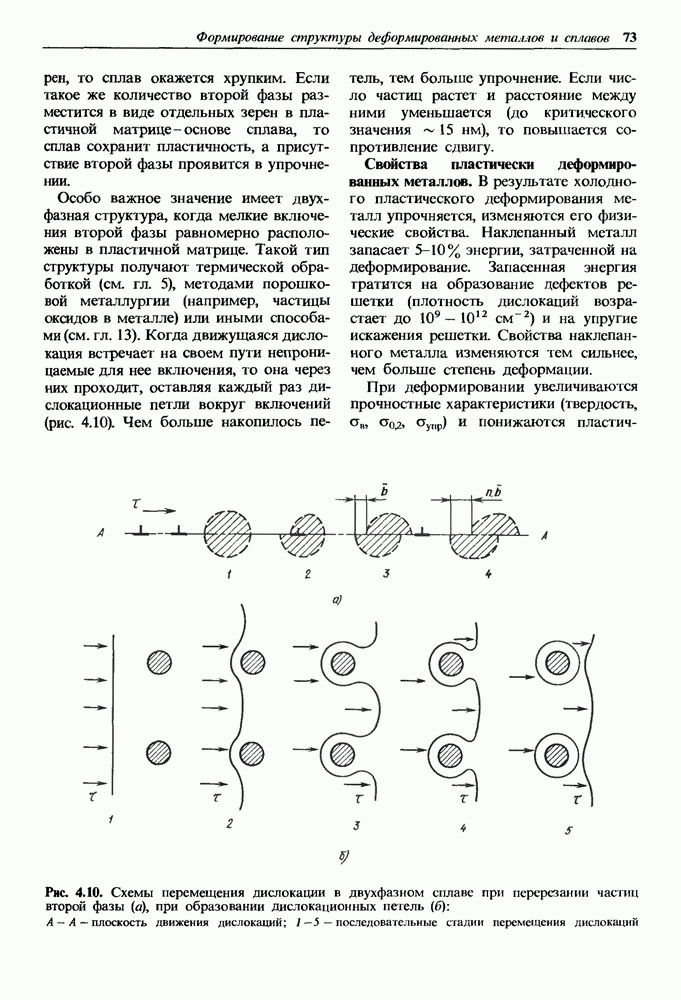
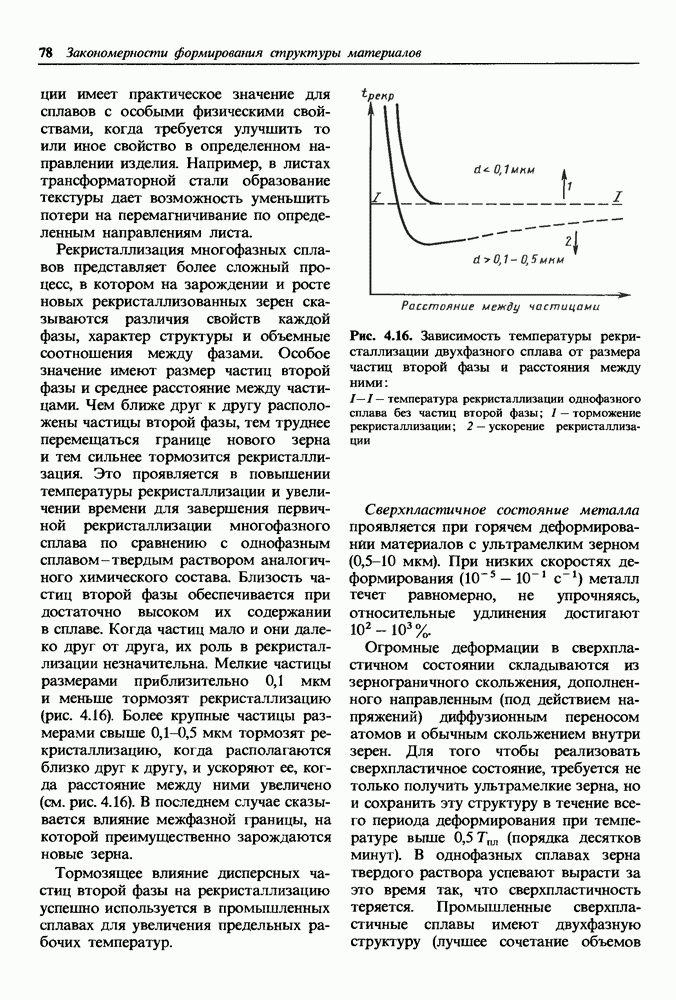
- Деформирование двухфазных сплавов оказывается более сложным.
- Свойства наклепанного металла изменяются тем сильнее, чем больше степень деформации.
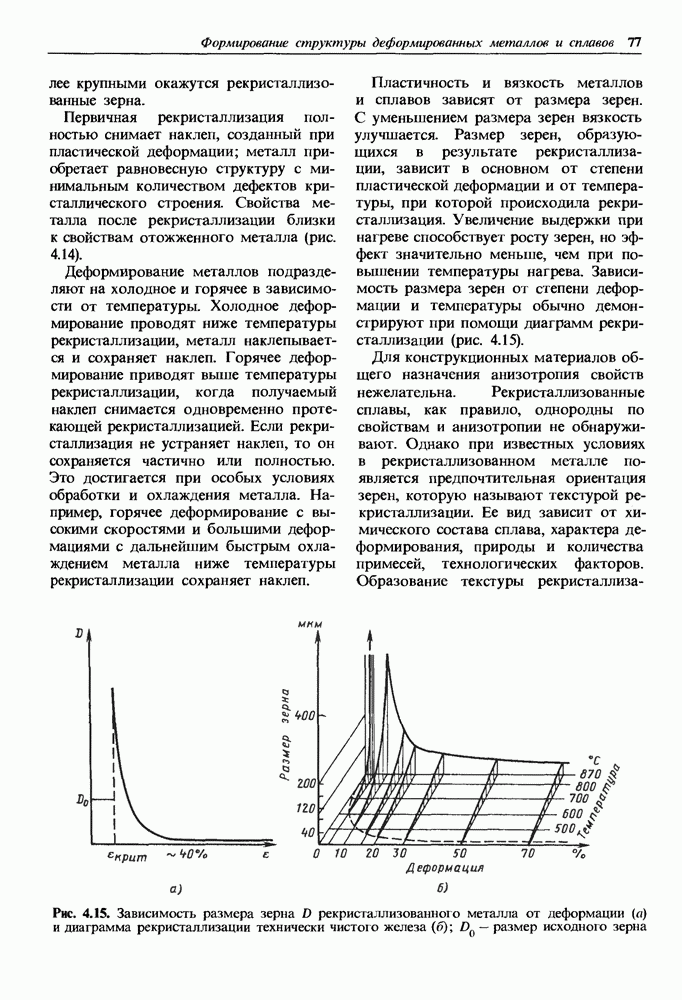
- 4.2. Возврат и рекристаллизация
- Глава 5. ТЕРМИЧЕСКАЯ ОБРАБОТКА МЕТАЛЛОВ И СПЛАВОВ
- 5.2. Основное оборудование для термической обработки
- 5.3. Термическая обработка сплавов, не связанная с фазовыми превращениями в твердом состоянии
- Рекристаллизационный отжиг.
- Диффузионный отжиг (гомогенизация).
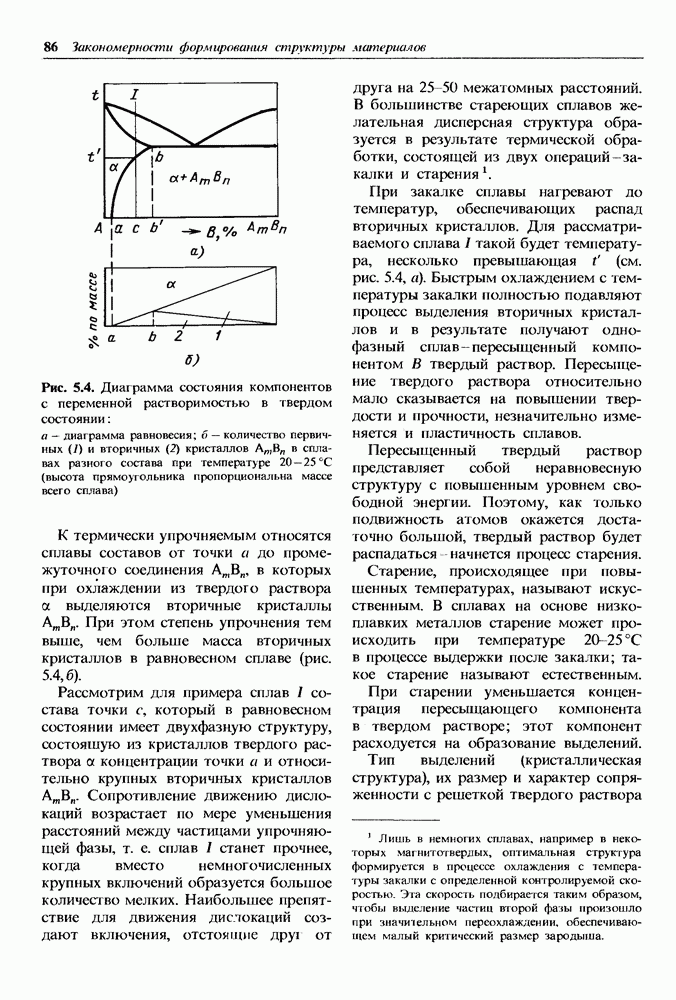
- 5.4. Термическая обработка сплавов с переменной растворимостью компонентов в твердом состоянии
- 5.5. Термическая обработка сталей с эвтектоидным превращением
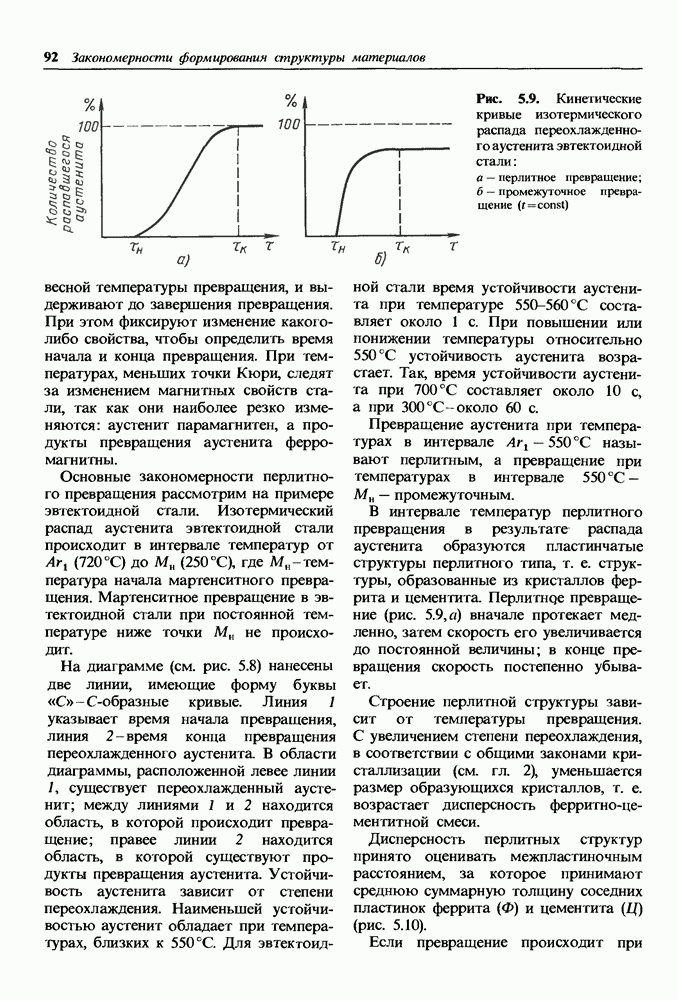
- Превращения аустенита при различных степенях переохлаждения.
- 5.6. Основные виды термической обработки стали
- Нормализация сталей.
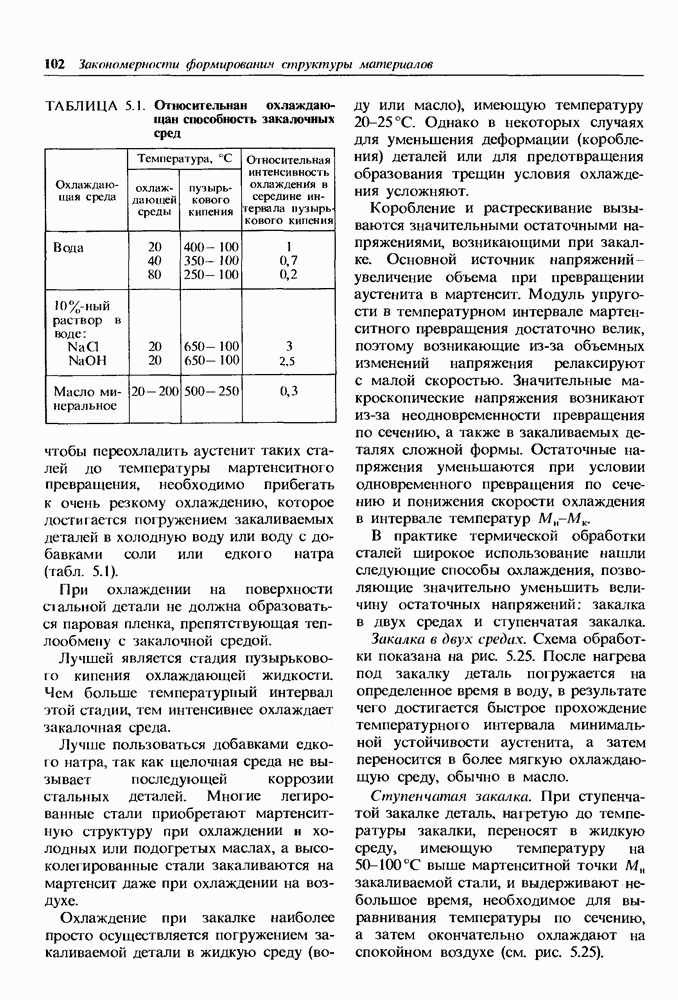
- Закалка сталей.
- Закаливаемость в прокаливаемость сталей.
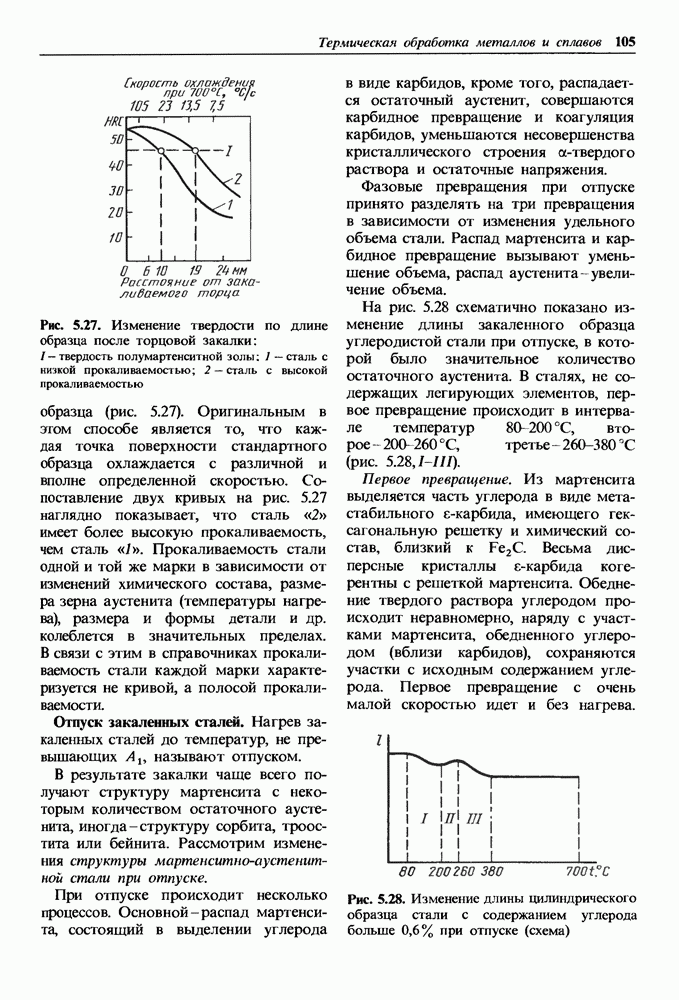
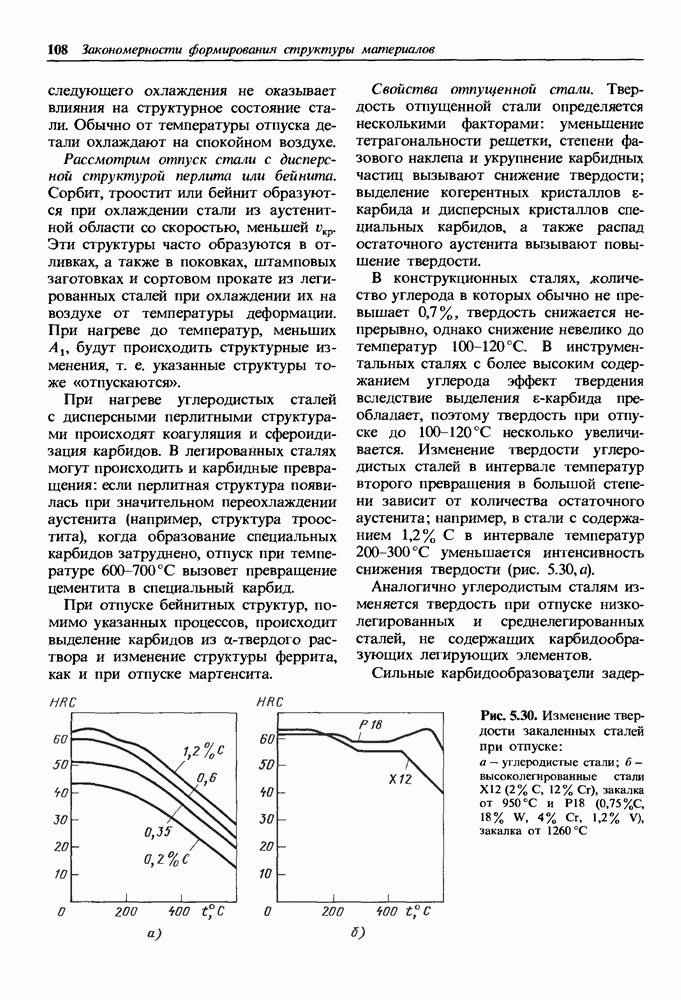
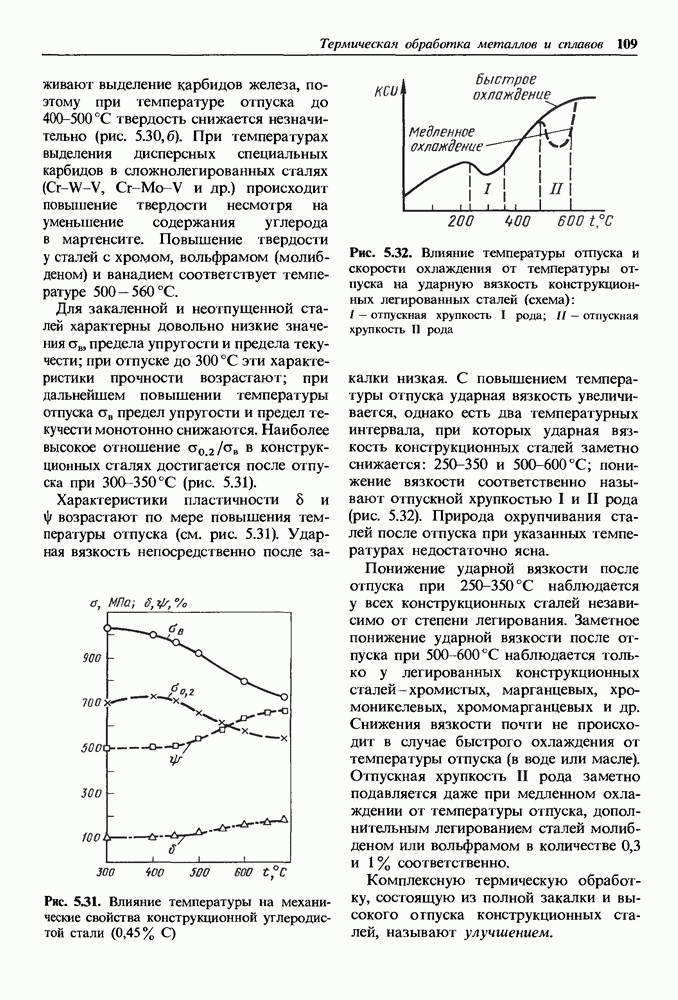
- Отпуск закаленных сталей.
- Глава 6. ХИМИКО-ТЕРМИЧЕСКАЯ ОБРАБОТКА МЕТАЛЛОВ И СПЛАВОВ
- 6.2. Диффузионное насыщение углеродом и азотом
- Азотирование стали.
- Ионное азотирование и цементация.
- Одновременное насыщение поверхности стали углеродом и азотом.
- 6.3. Диффузионное насыщение сплавов металлами и неметаллами
- Раздел первый. Конструкционные материалы
- 7.1. Общие требования, предъявляемые к конструкционным материалам
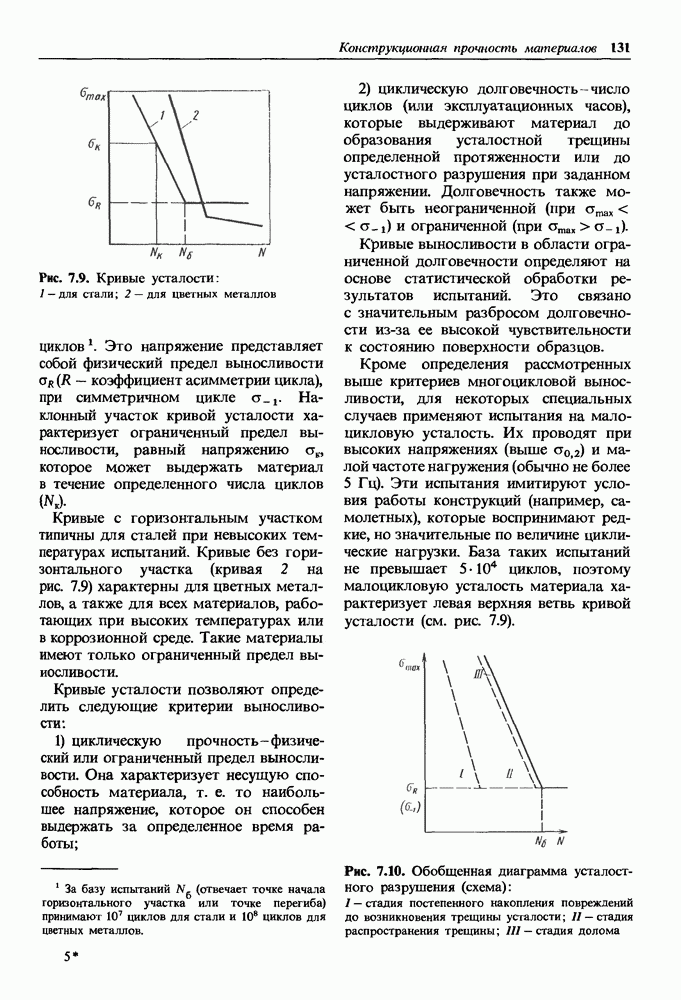
- 7.2. Конструкционная прочность материалов и критерии ее оценки
- 7.3. Методы повышения конструкционной прочности
- 7.4. Классификация конструкционных материалов
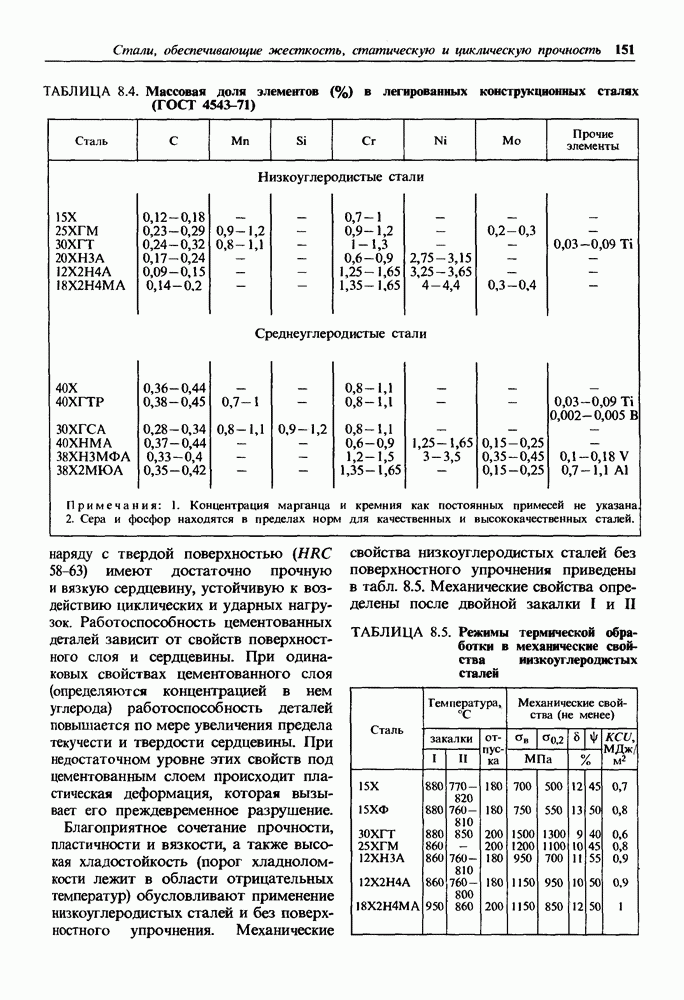
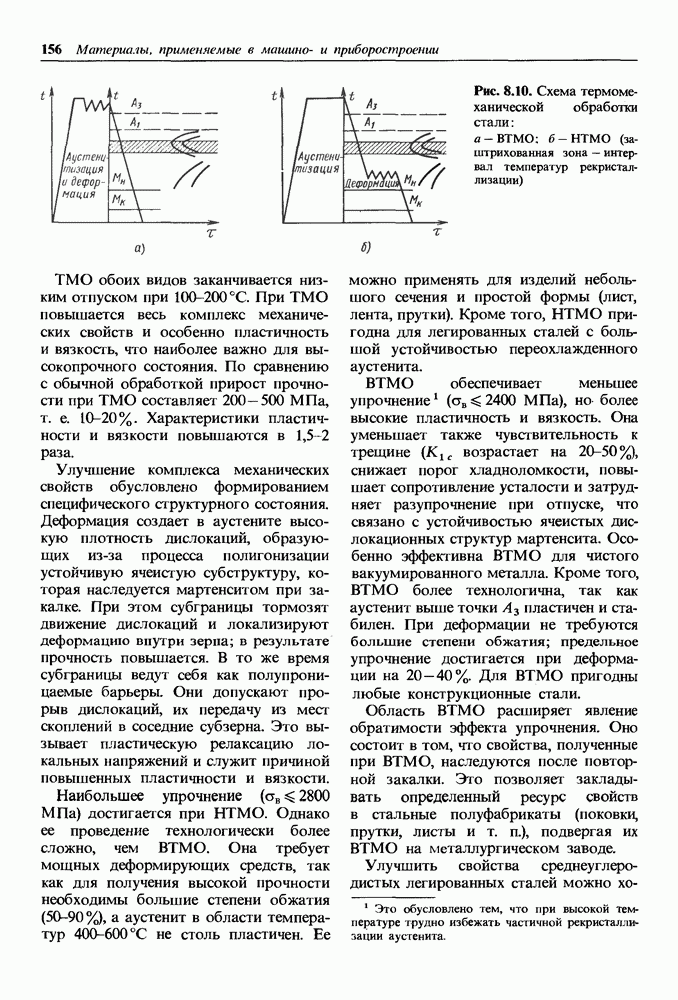
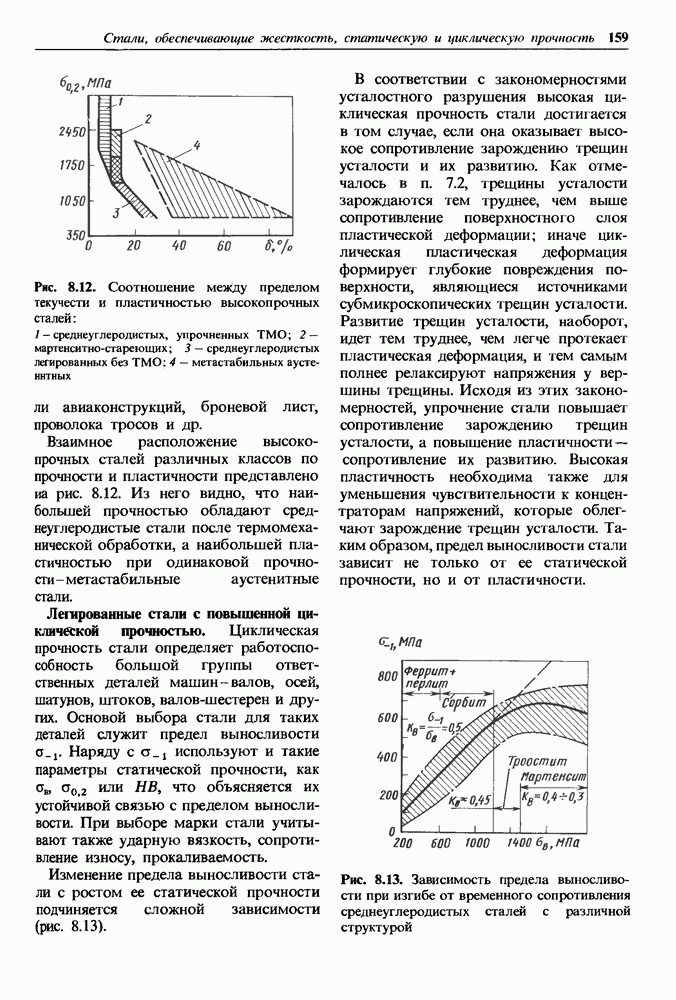
- Глава 8. СТАЛИ, ОБЕСПЕЧИВАЮЩИЕ ЖЕСТКОСТЬ, СТАТИЧЕСКУЮ И ЦИКЛИЧЕСКУЮ ПРОЧНОСТЬ
- 8.1. Классификация конструкционных сталей
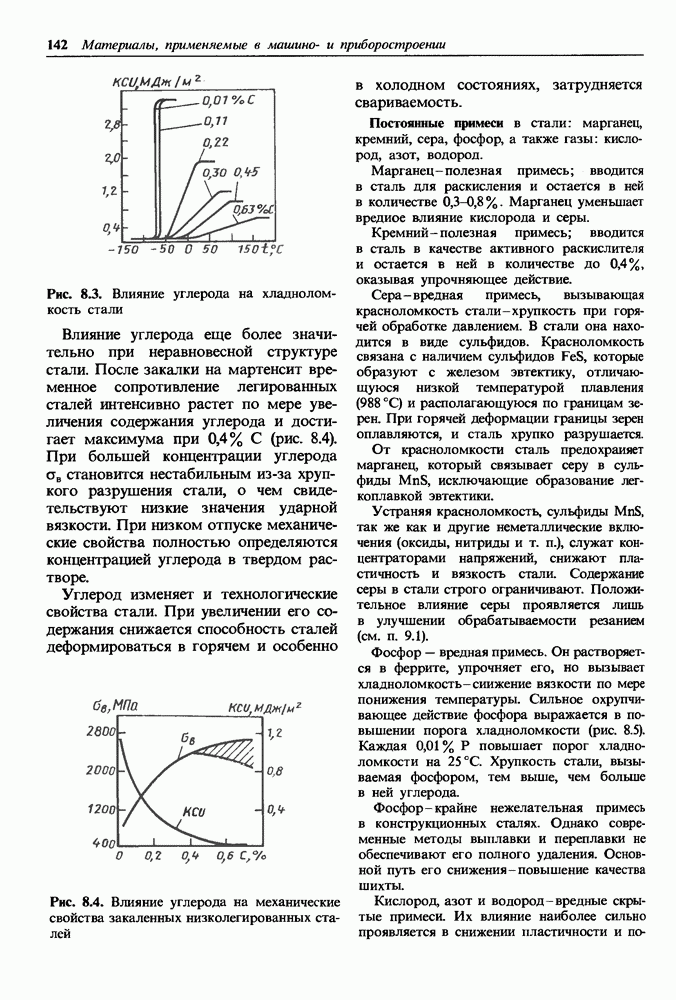
- 8.2. Влияние углерода и постоянных примесей на свойства стали
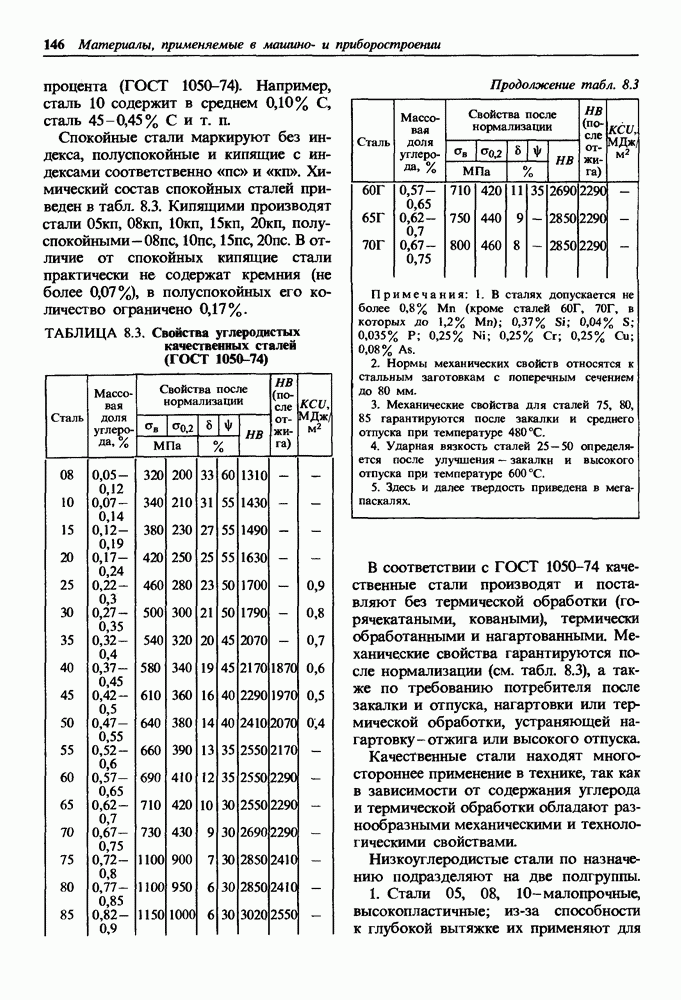
- 8.3. Углеродистые стали
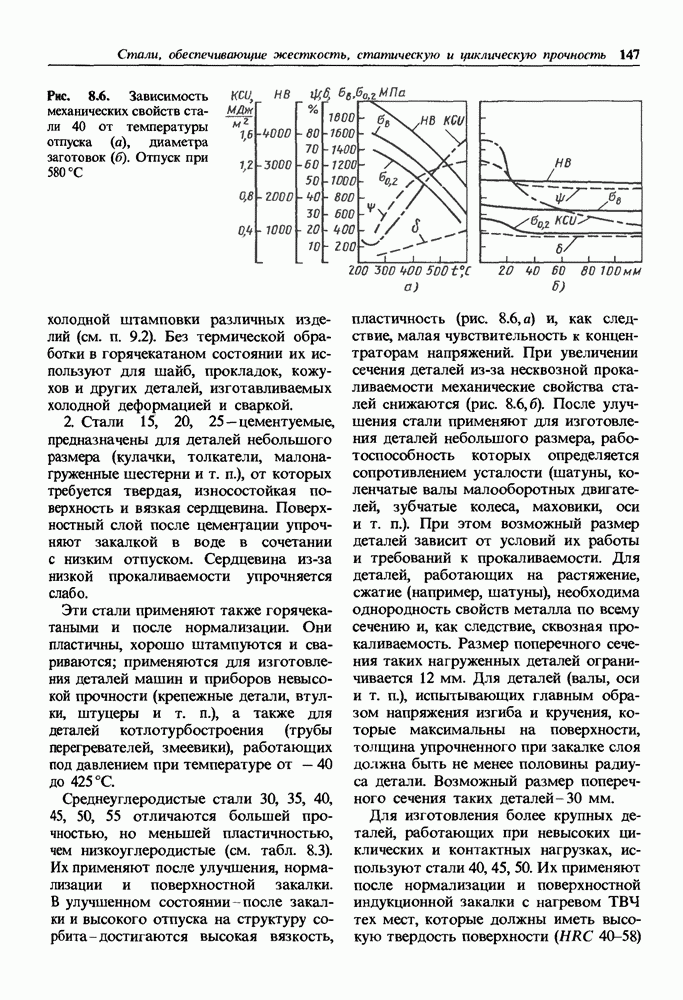
- 8.4. Легированные стали
- Легированные стали нормальной и повышенной статической прочности.
- Легированные высокопрочные стали.
- Легированные стали с повышенной циклической прочностью.
- Глава 9. МАТЕРИАЛЫ С ОСОБЫМИ ТЕХНОЛОГИЧЕСКИМИ СВОЙСТВАМИ
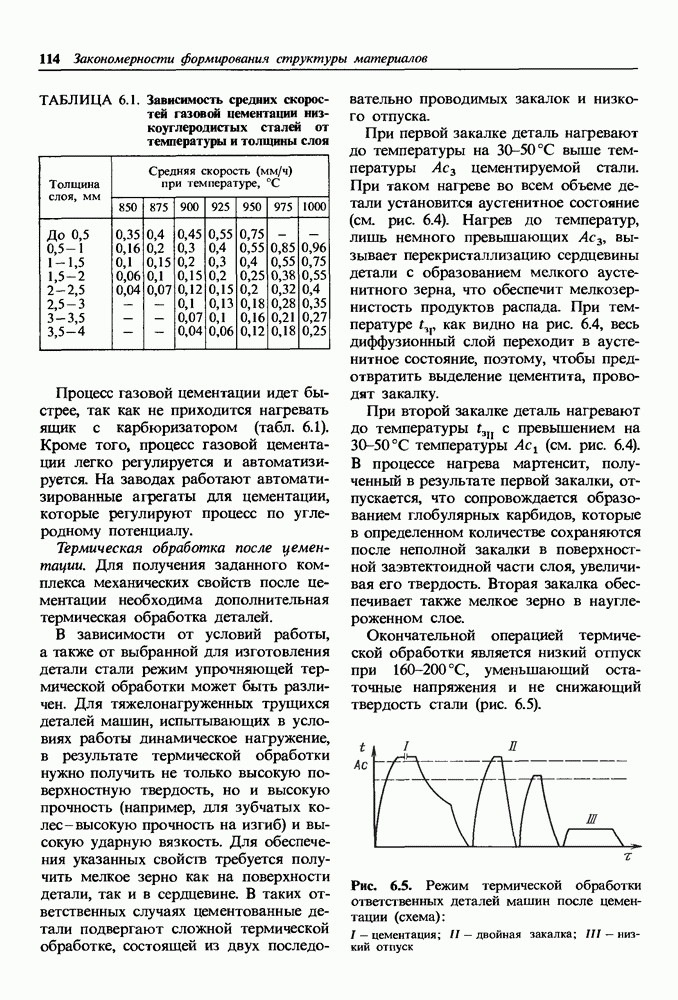
- 9.1. Стали с улучшенной обрабатываемостью резанием
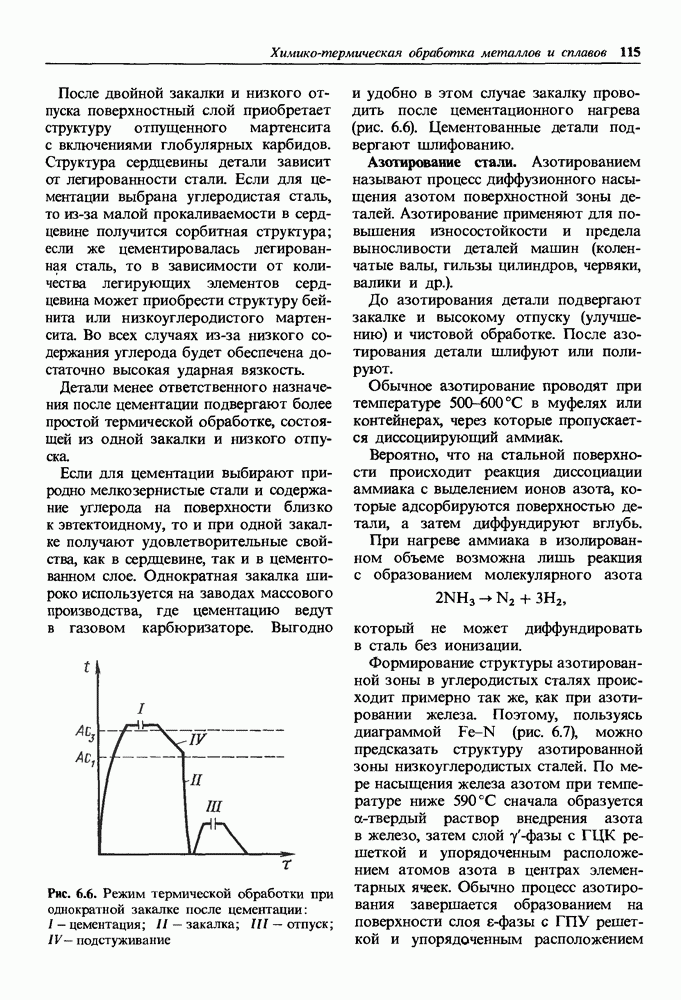
- 9.2. Стали с высокое технологической пластичностью и свариваемостью
- 9.3. Железоуглеродистые сплавы с высокими литейными свойствами
- Серые чугуны.
- Высокопрочные чугуны.
- Ковкие чугуны.
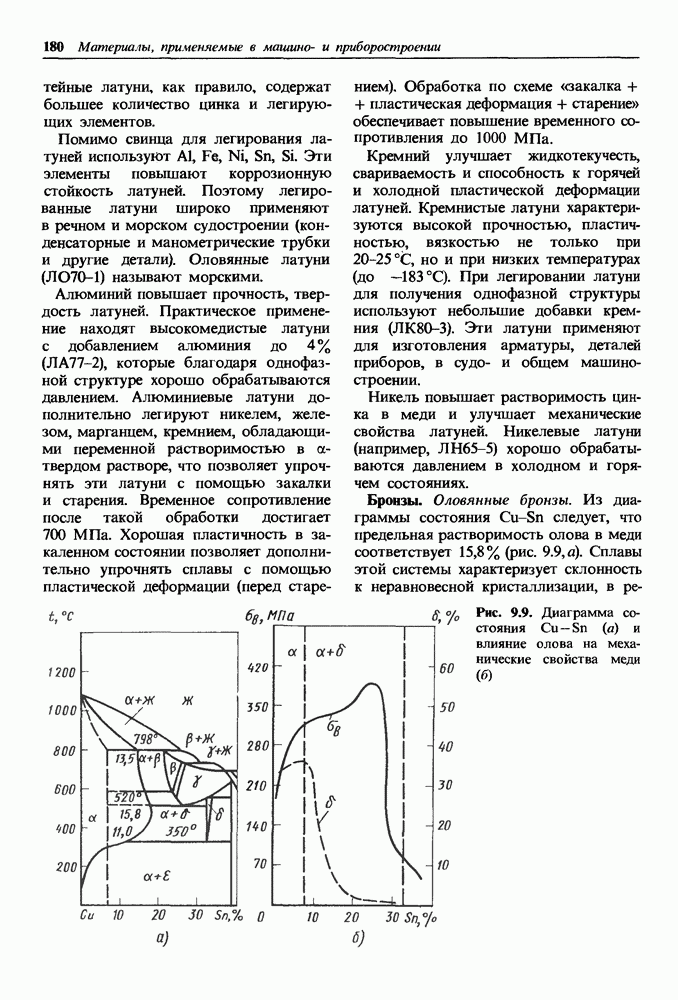
- 9.4. Медные сплавы
- Общая характеристика и классификация медных сплавов.
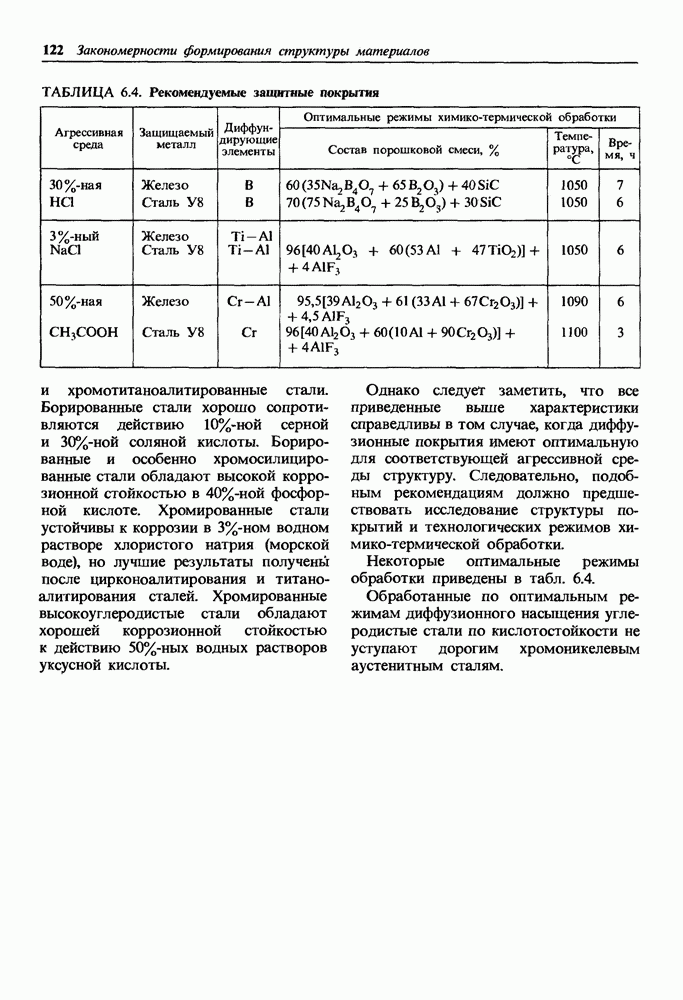
- Латуни.
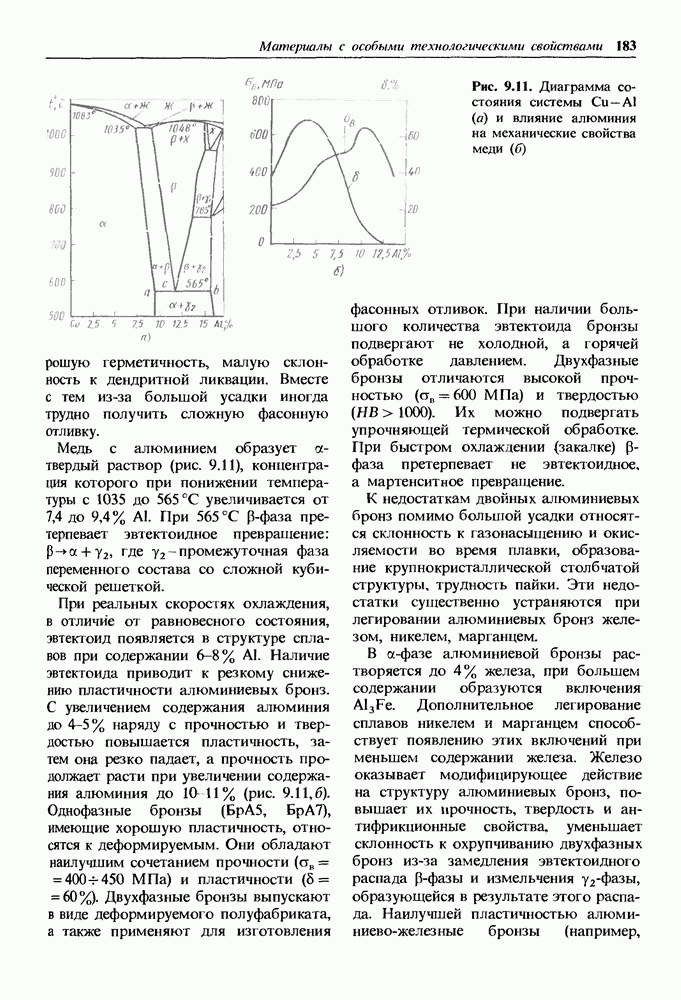
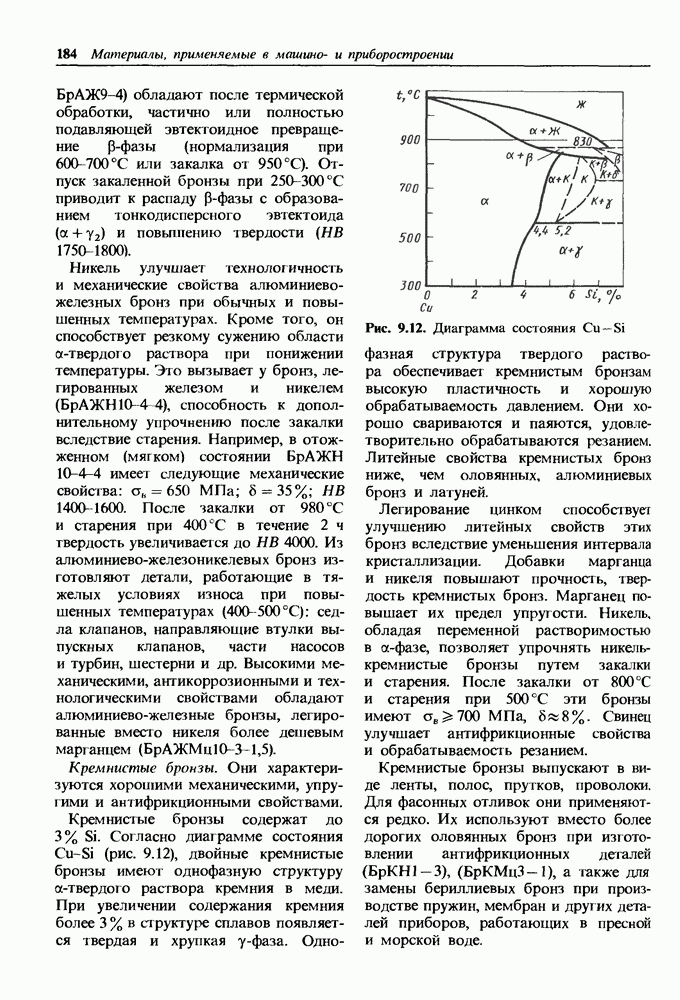
- Бронзы.
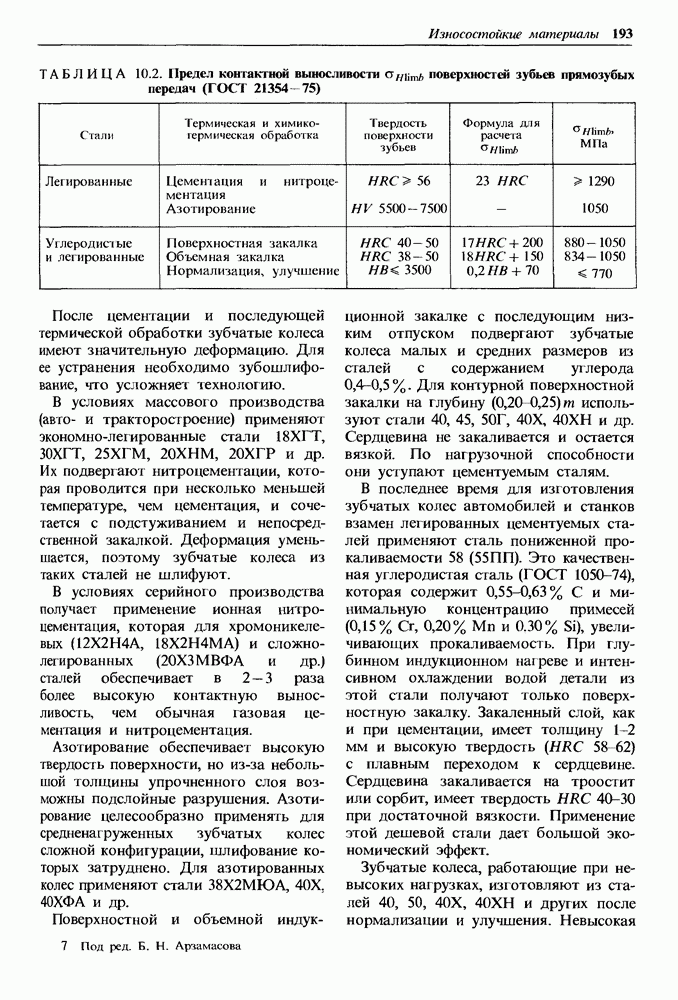
- Глава 10. ИЗНОСОСТОЙКИЕ МАТЕРИАЛЫ
- 10.2. Закономерности изнашивания деталей, образующих пары трения, и пути уменьшения их износа
- 10.3. Материалы с высокой твердостью поверхности
- Материалы, устойчивые к усталостному виду изнашивания.
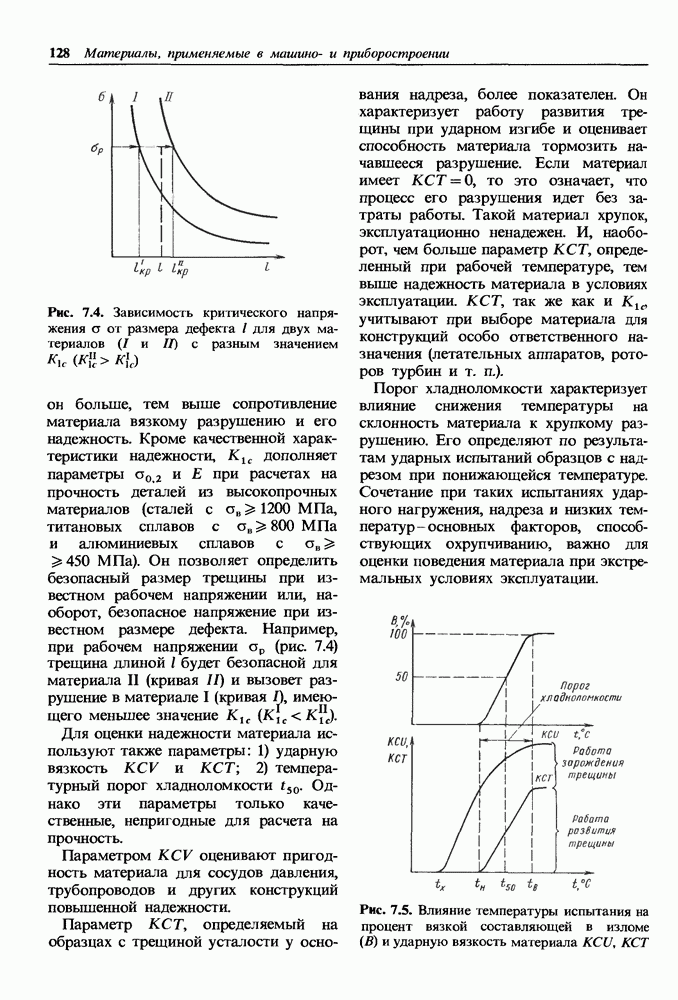
- Материалы, устойчивые к изнашиванию в условиях больших давлений и ударных нагрузок.
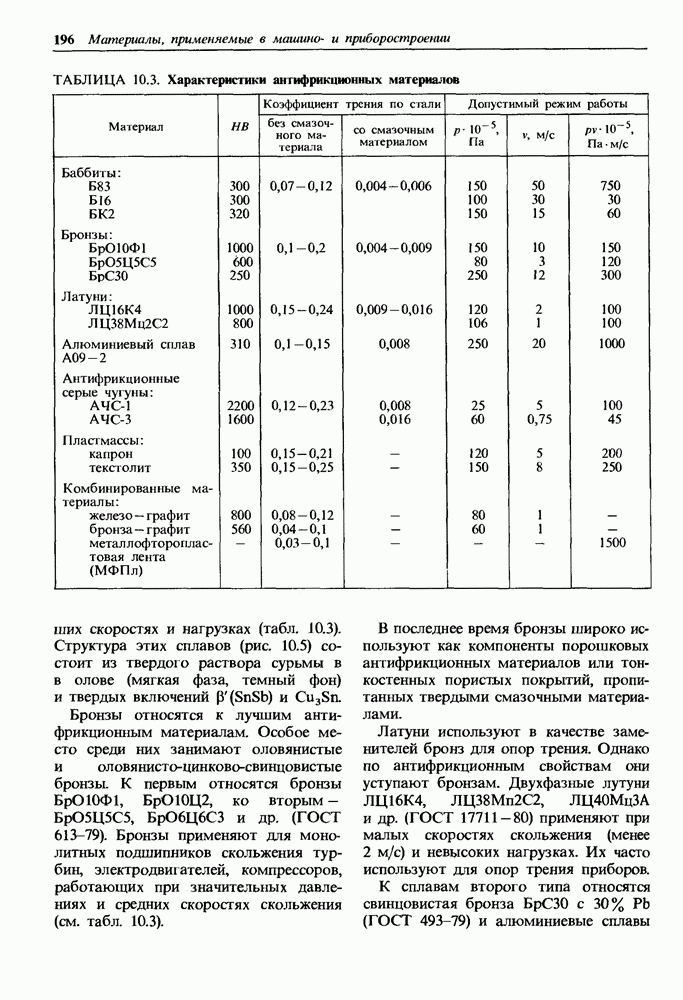
- 10.4. Антифрикционные материалы
- Неметаллические материалы.
- Комбинированные материалы.
- Минералы.
- 10.5. Фрикционные материалы
- Глава 11. МАТЕРИАЛЫ С ВЫСОКИМИ УПРУГИМИ СВОЙСТВАМИ
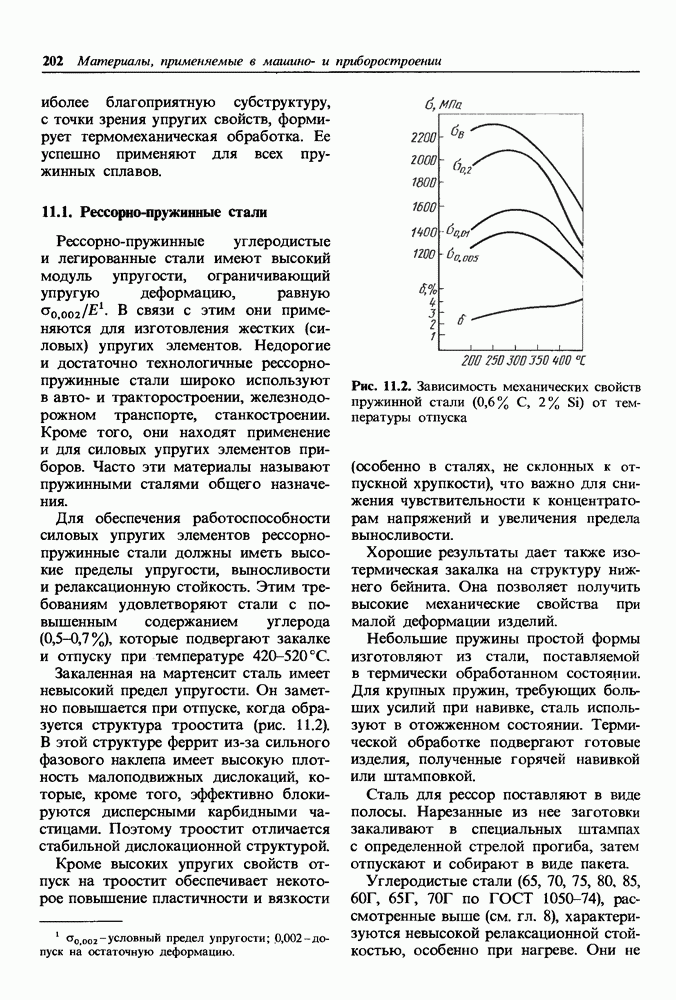
- 11.1. Рессорно-пружинные стали
- 11.2. Пружинные материалы приборостроения
- Глава 12. МАТЕРИАЛЫ С МАЛОЙ ПЛОТНОСТЬЮ
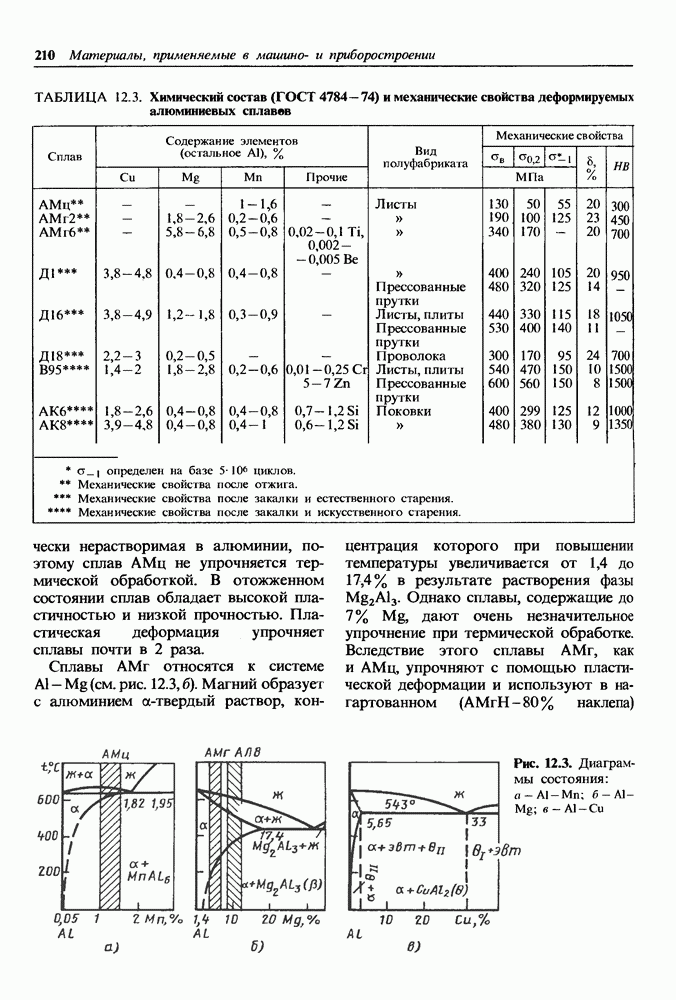
- 12.1. Сплавы на основе алюминия
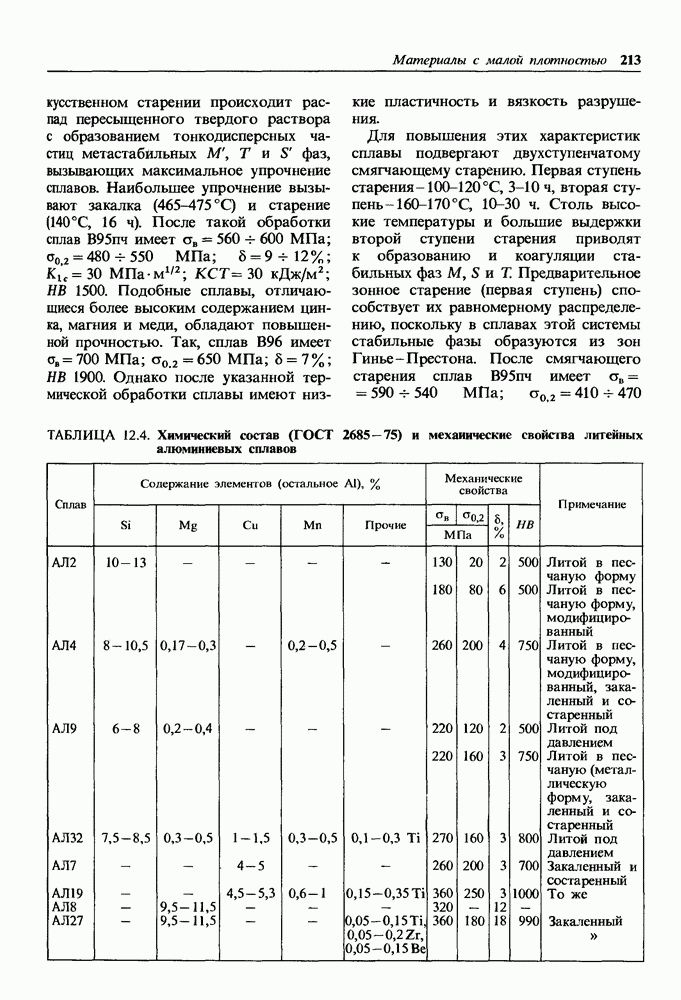
- Общая характеристика и классификация алюминиевых сплавов.
- Деформируемые алюминиевые сплавы.
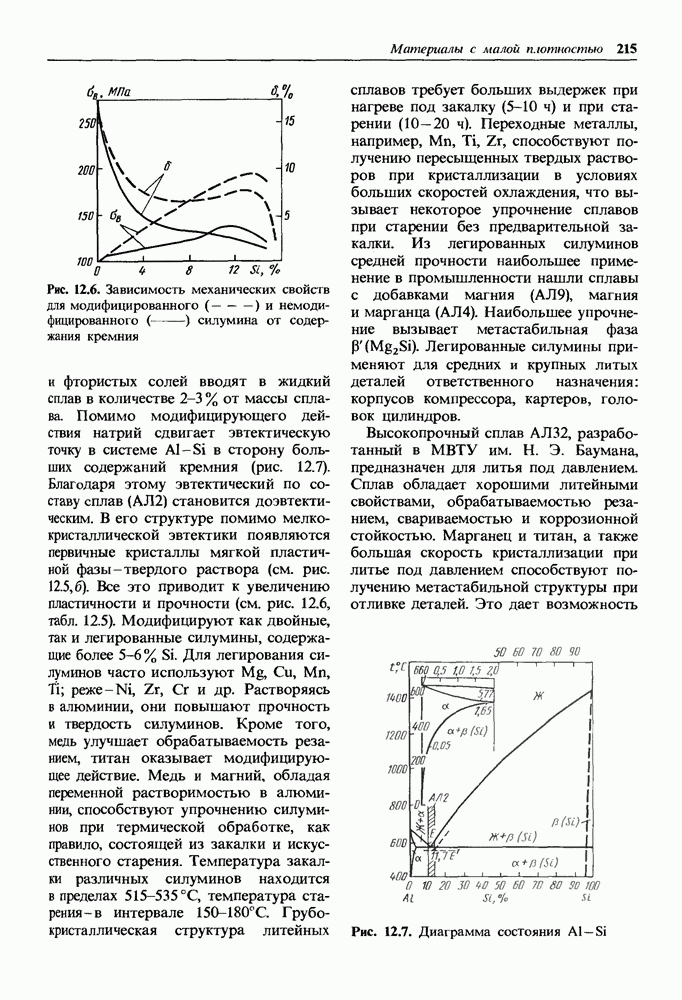
- Литейные алюминиевые сплавы.
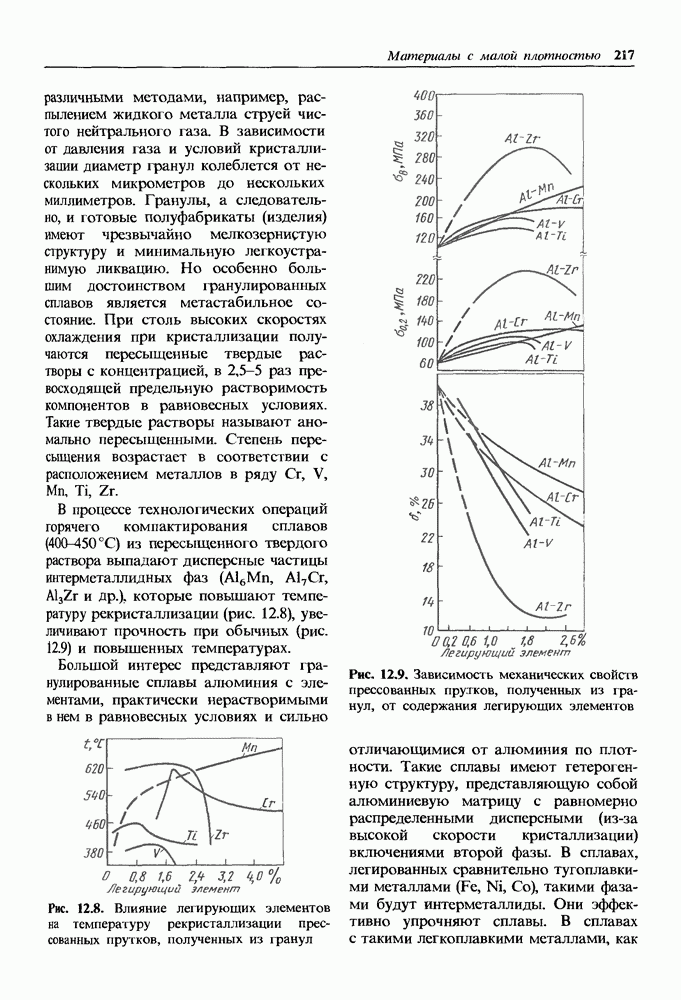
- Гранулированные сплавы.
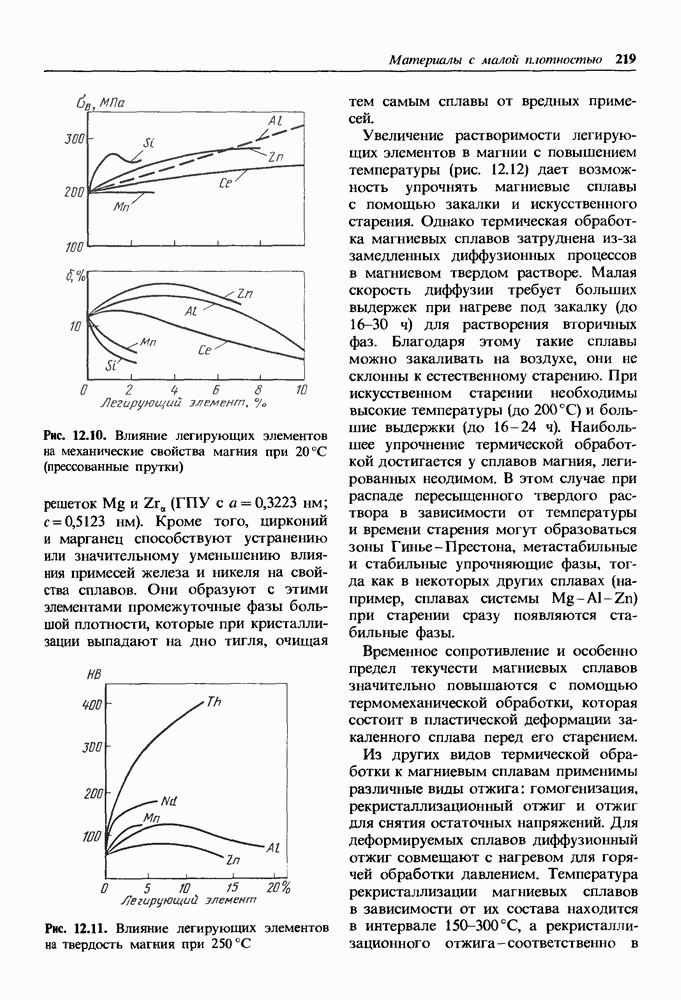
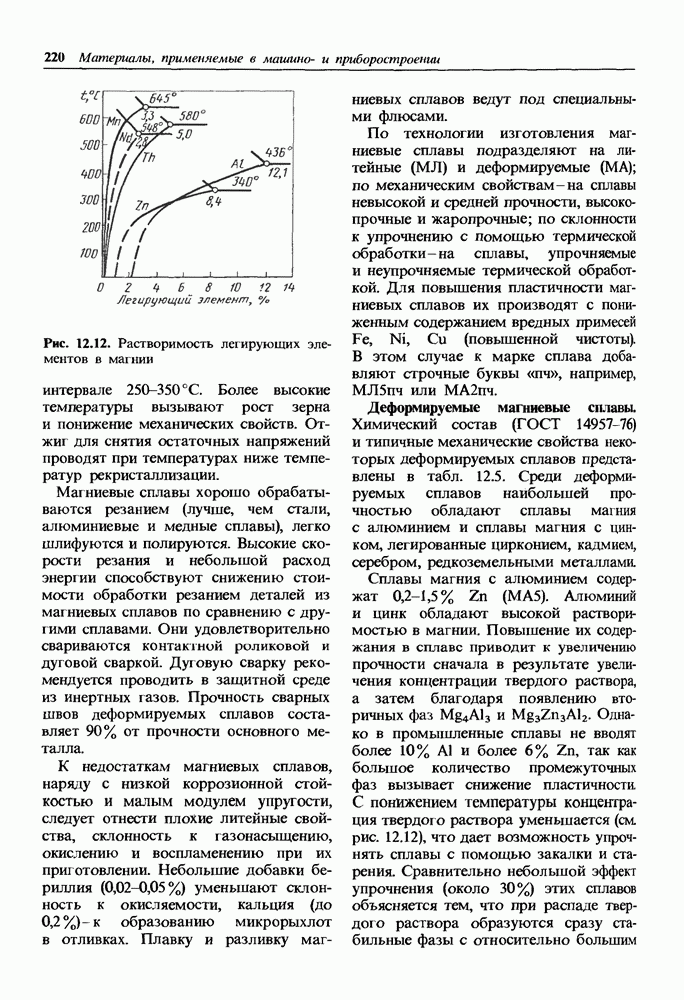
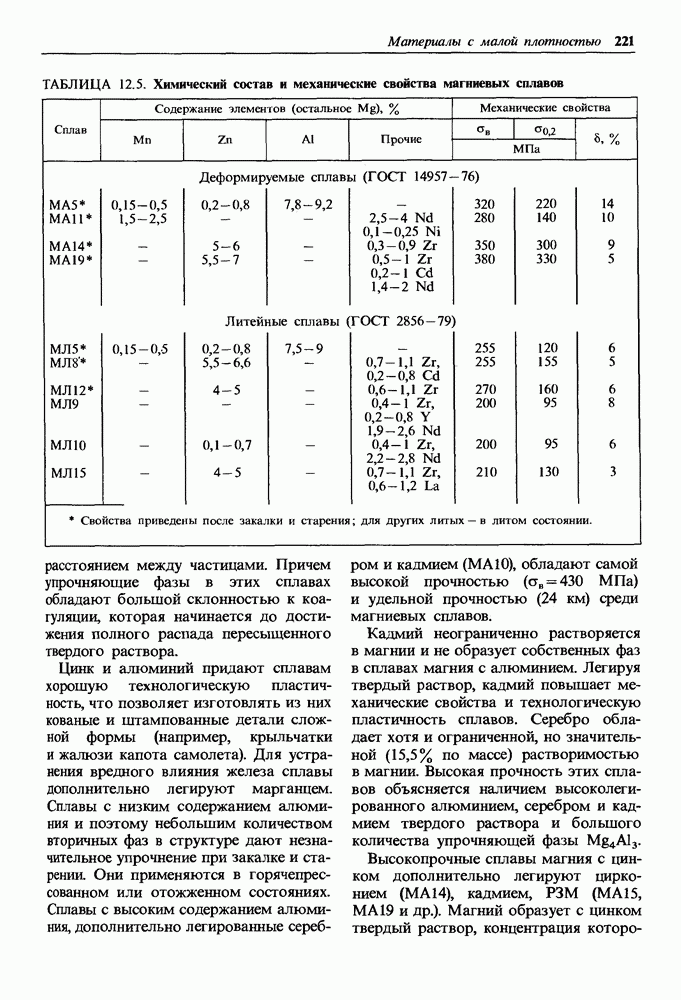
- 12.2. Сплавы на основе магния
- Общая характеристика и классификация магниевых сплавов.
- Деформируемые магниевые сплавы.
- Литейные магниевые сплавы.
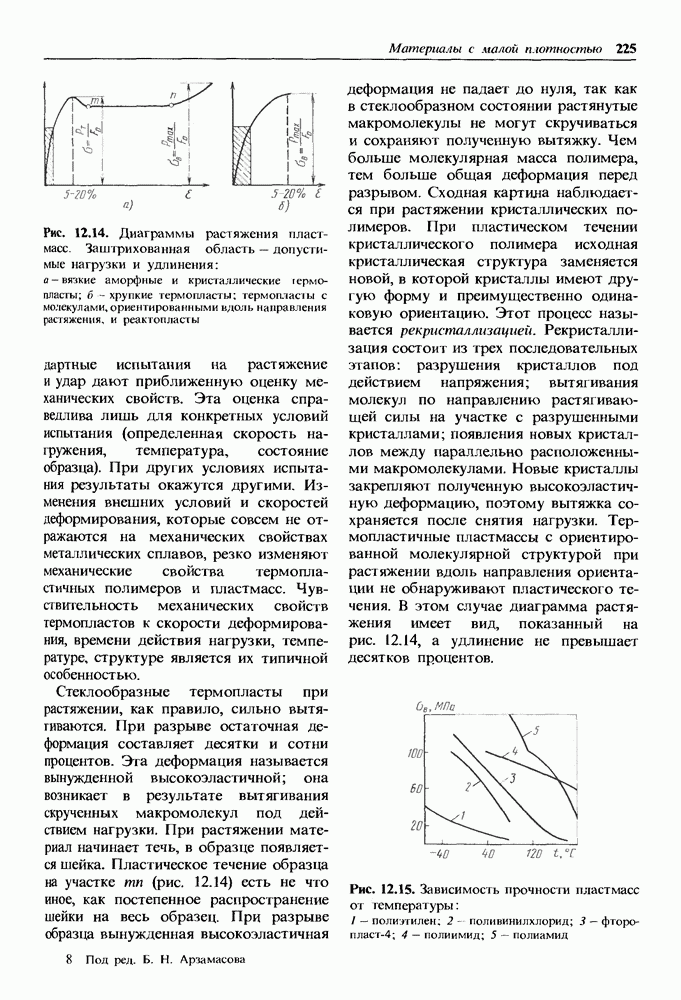
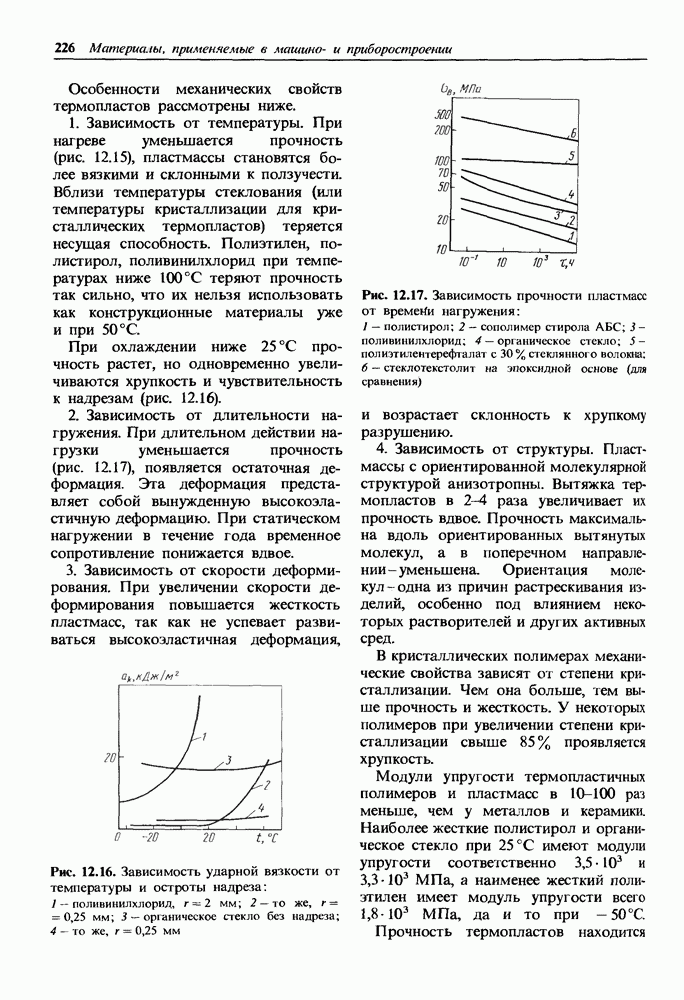
- 12.3. Неметаллические материалы
- Механические свойства термопластичных пластмасс.
- Механические свойства термореактивных пластмасс.
- Глава 13. МАТЕРИАЛЫ С ВЫСОКОЙ УДЕЛЬНОЙ ПРОЧНОСТЬЮ
- 13.1. Титан и сплавы на его основе
- Влияние легирующих элементов на структуру и свойства титановых сплавов.
- Особенности термической обработки титановых сплавов.
- Промышленные титановые сплавы.
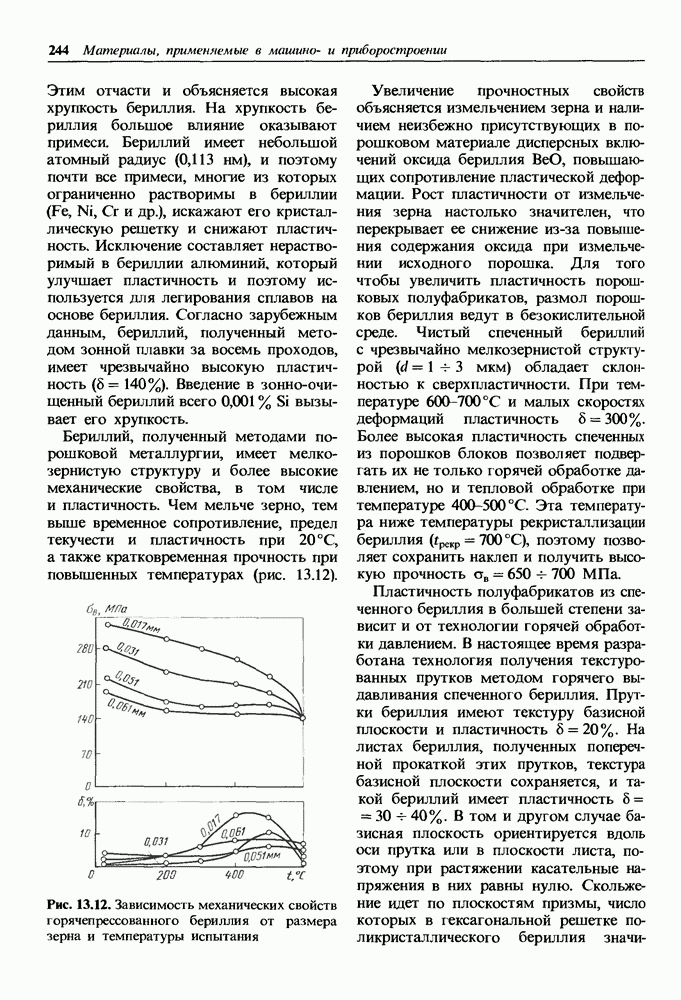
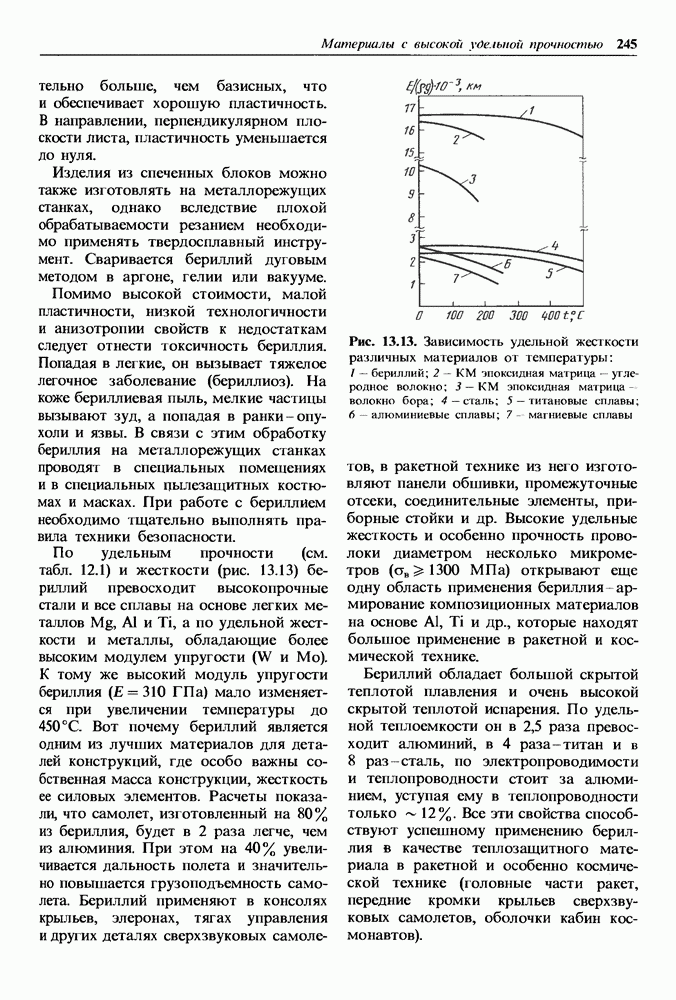
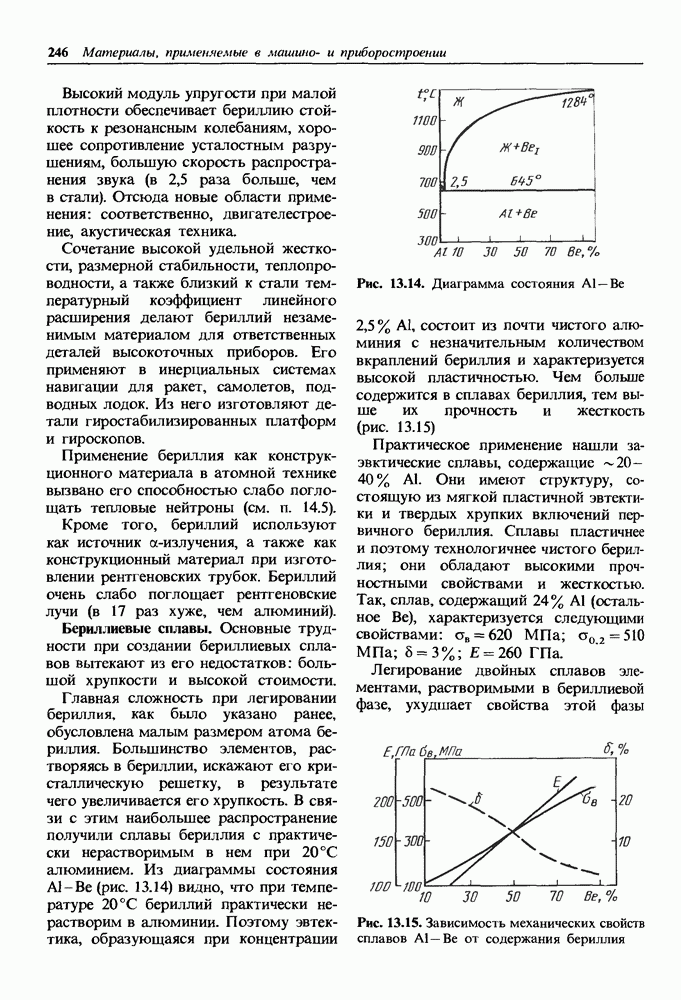
- 13.2. Бериллий и сплавы на его основе
- Бериллиевые сплавы.
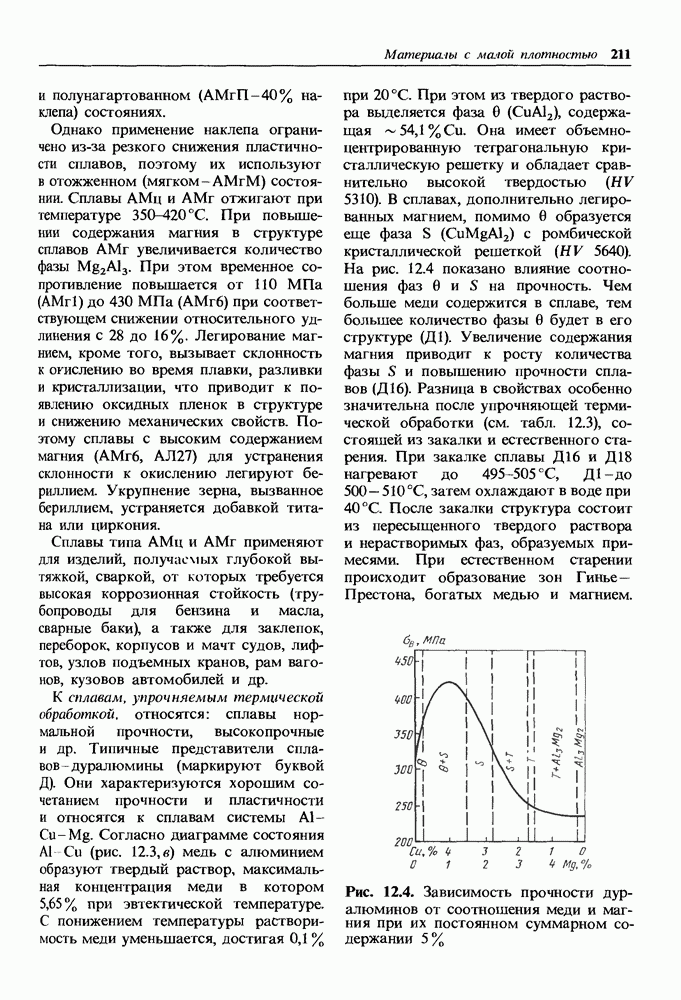
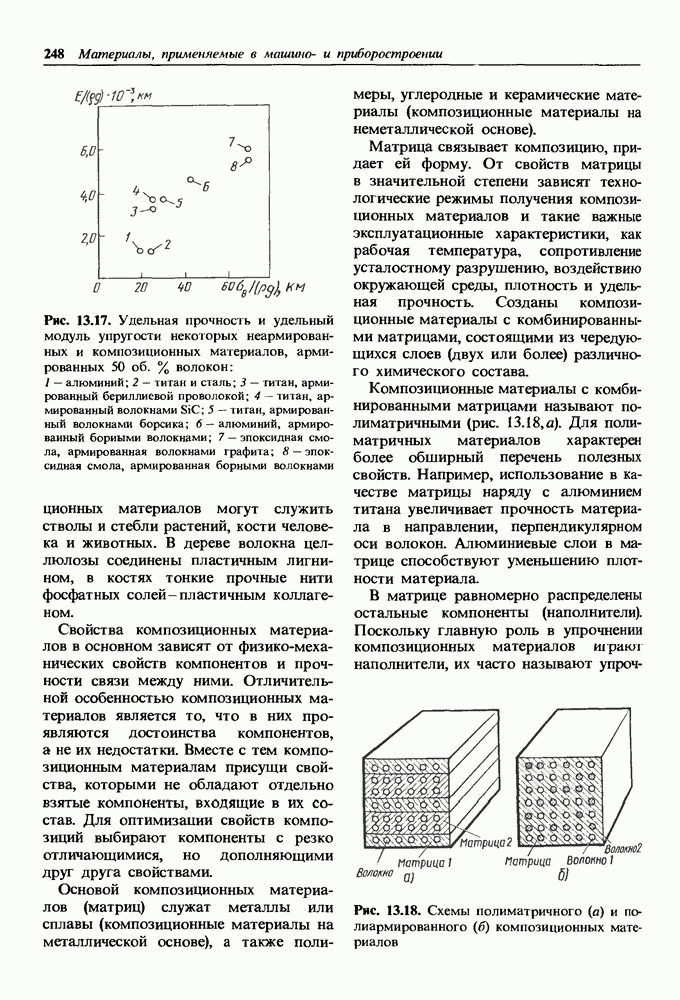
- 13.3. Композиционные материалы
- Дисперсно-упрочненные композиционные материалы.
- Волокнистые композиционные материалы.
- Композиционные материалы на неметаллической основе.
- Композиционные материалы на металлической основе.
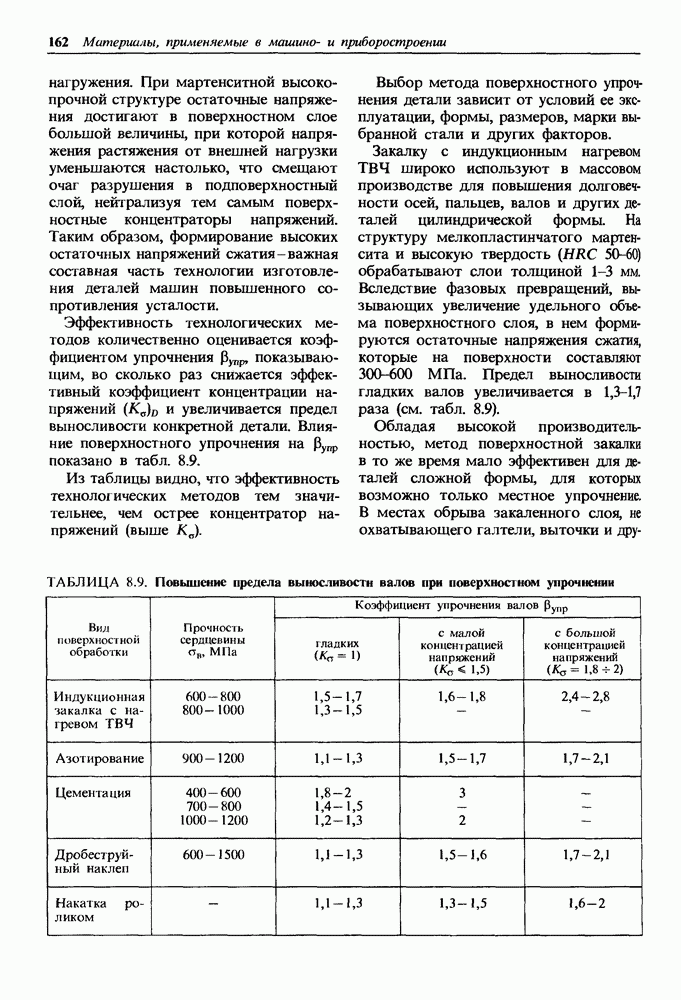
- Глава 14. МАТЕРИАЛЫ, УСТОЙЧИВЫЕ К ВОЗДЕЙСТВИЮ ТЕМПЕРАТУРЫ И РАБОЧЕЙ СРЕДЫ
- 14.1. Коррозионно-стойкие материалы
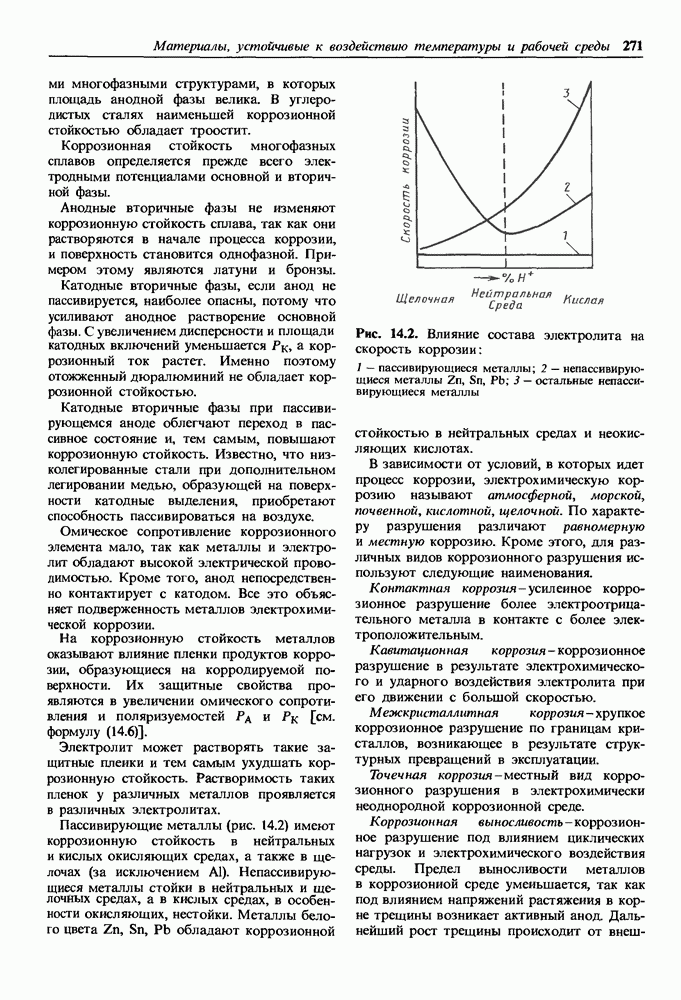
- Коррозионно-стойкие непассивирующиеся металлы.
- Коррозионностойкие пассивирующиеси металлы.
- Коррозионно-стойкие покрытия.
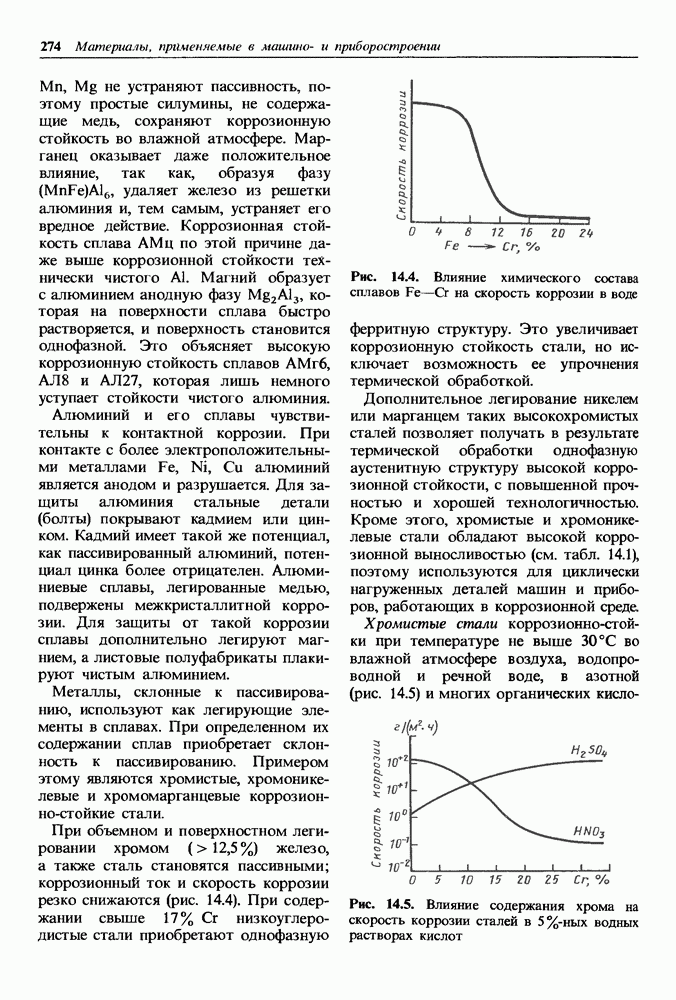
- 14.2. Жаростойкие материалы
- Жаростойкость металлов.
- Жаростойкость сплавов.
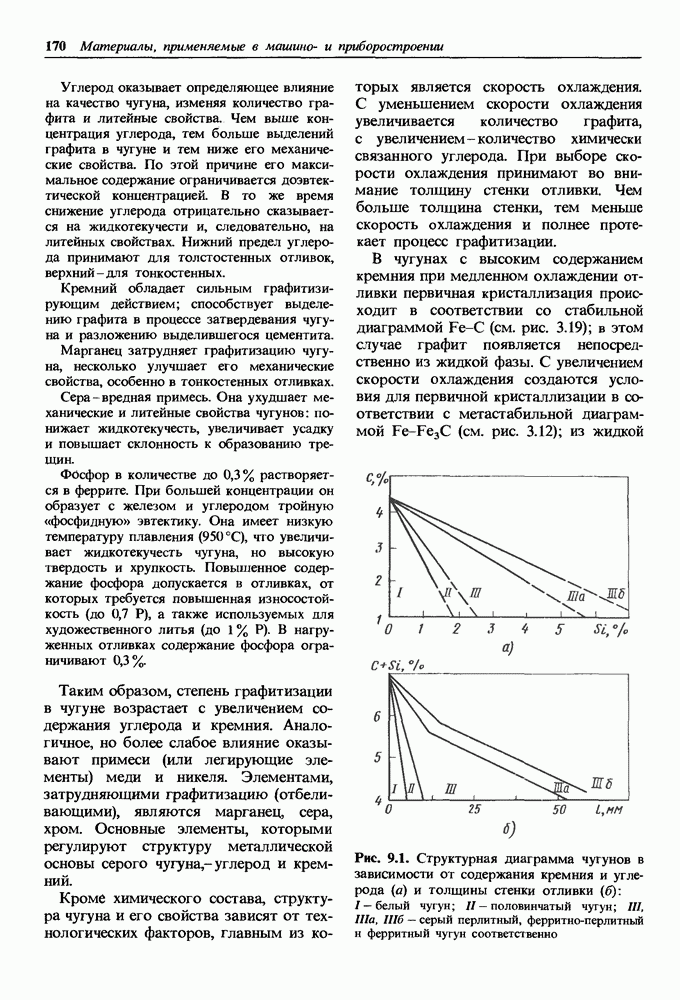
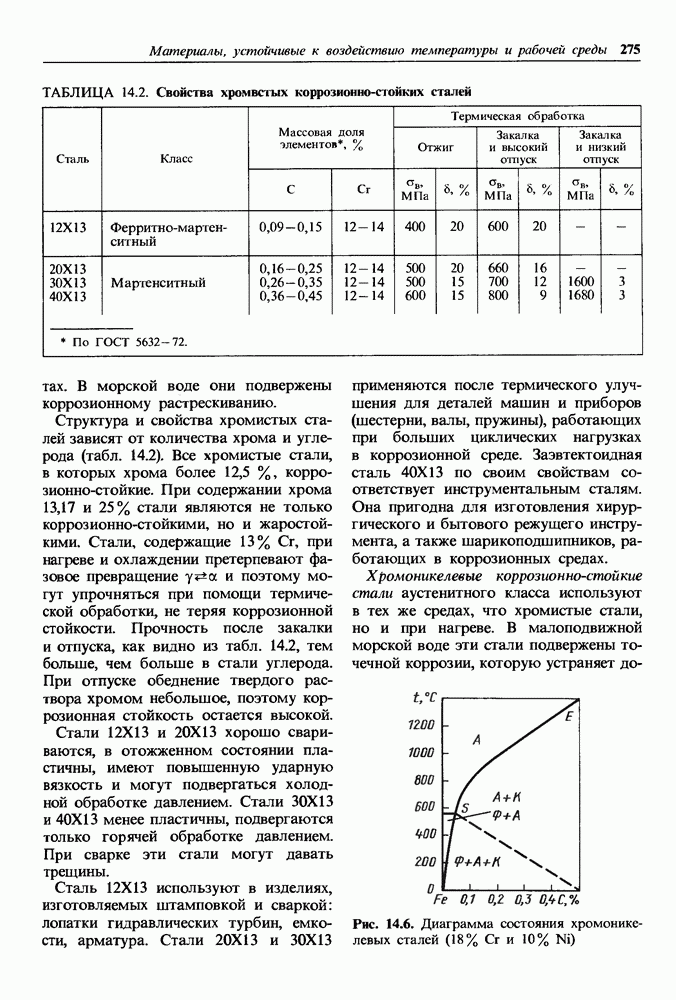
- 14.3. Жаропрочные материалы
- Основные группы жаропрочных материалов.
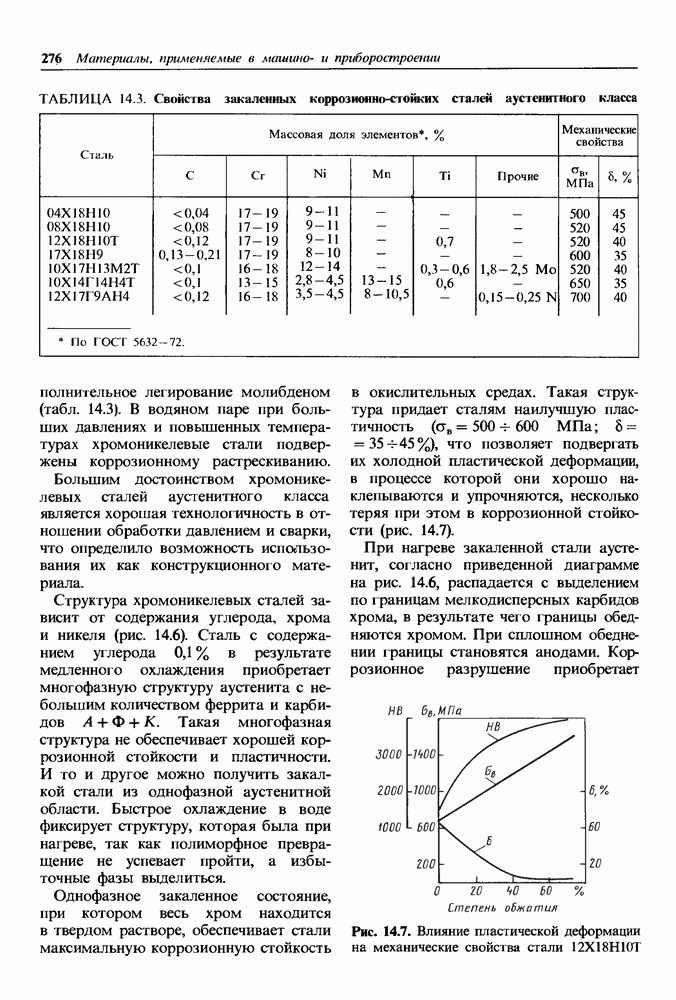
- 14.4. Хладостойкие материалы
- Основные группы хладостойких материалов.
- 14.5. Радиационно-стойкие материалы
- Влияние облучения на коррозионную стойкость.
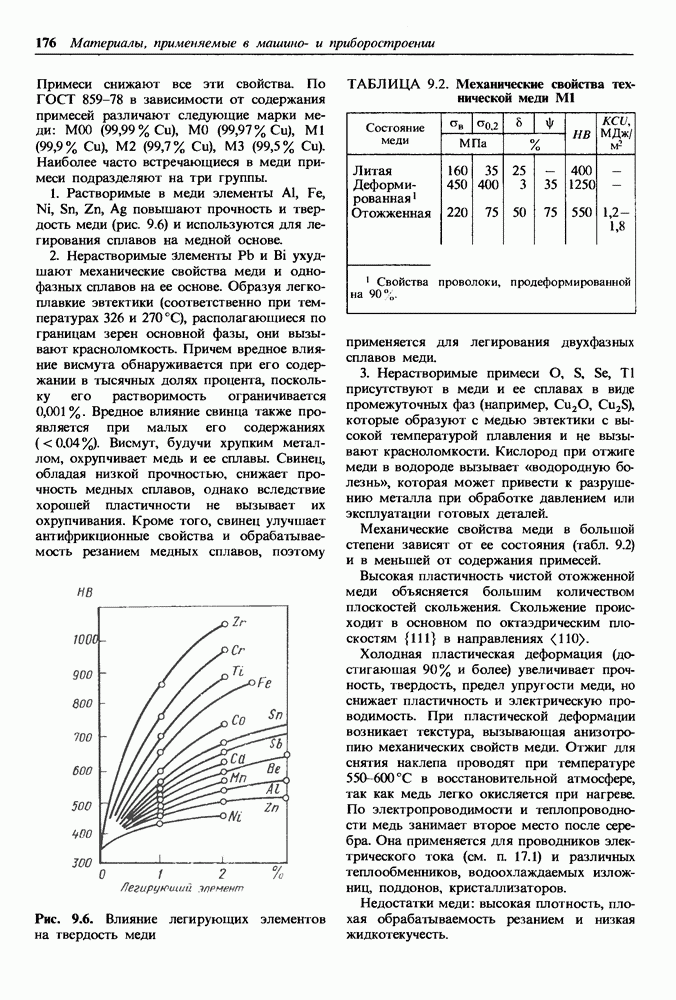
- Раздел второй. Материалы с особыми физическими свойствами
- 15.1. Общие сведения о ферромагнетиках
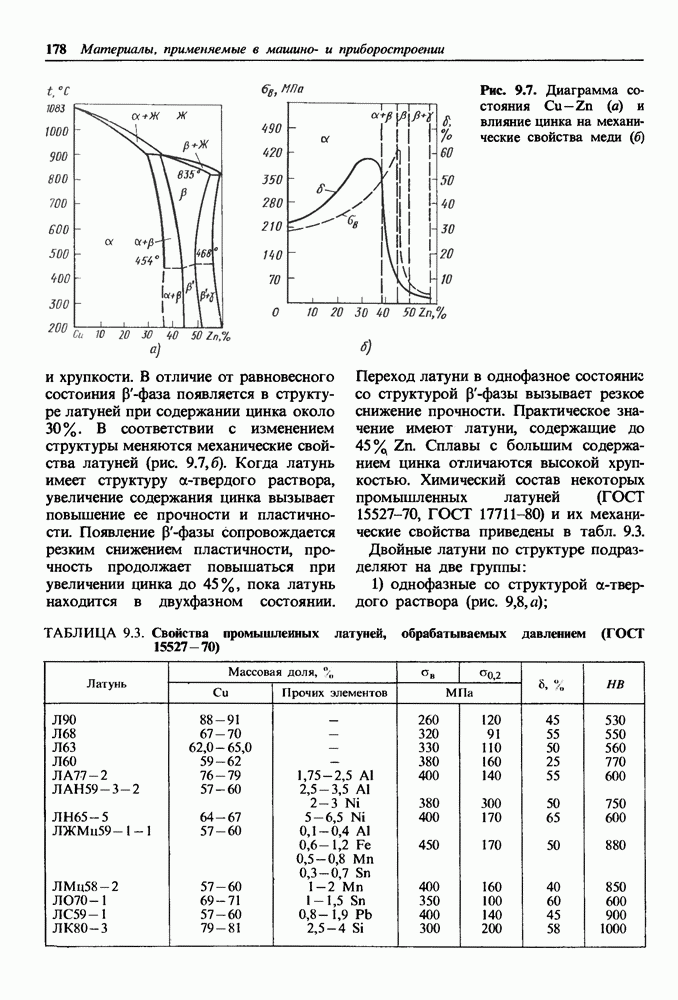
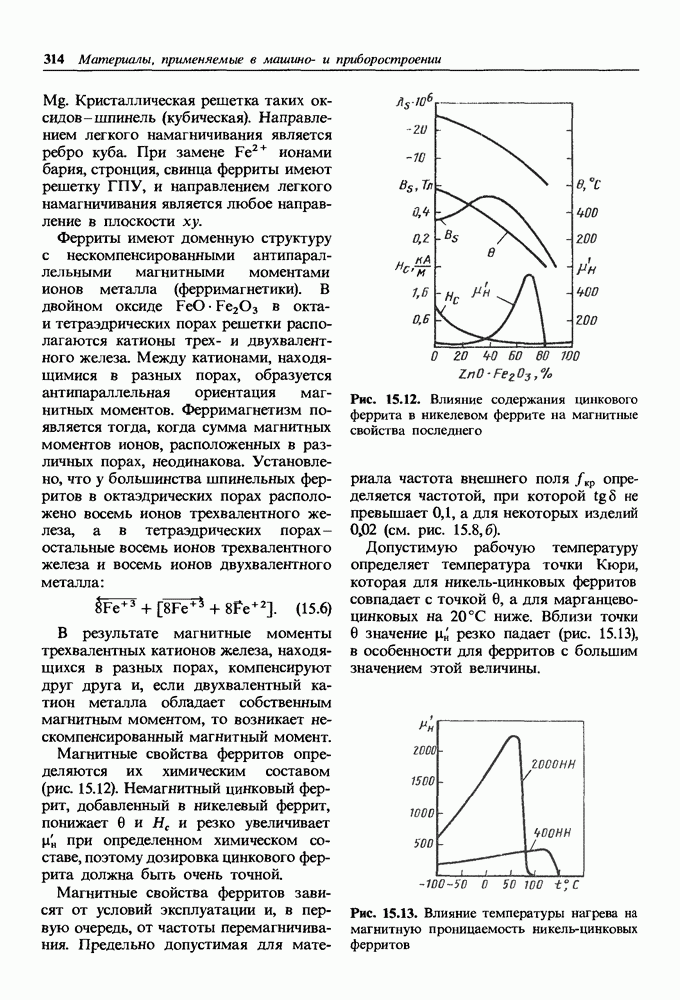
- 15.2. Магнитно-мягкие материалы
- Низкочастотные магнитно-мягкие материалы
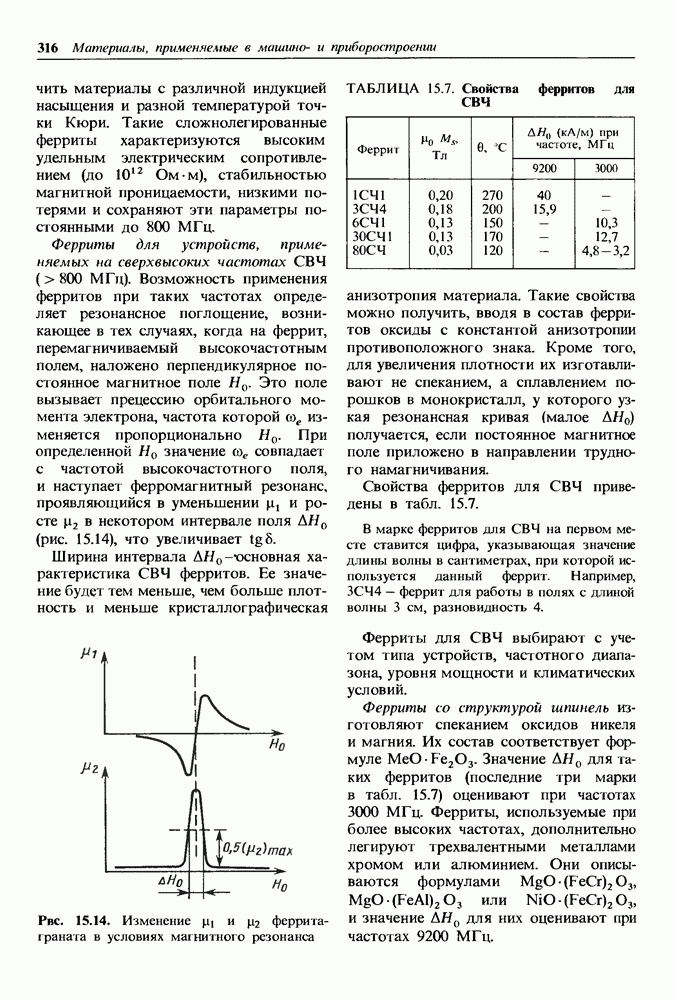
- Высокочастотные магнитно-мягкие материалы.
- Материалы со специальными магнитными свойствами.
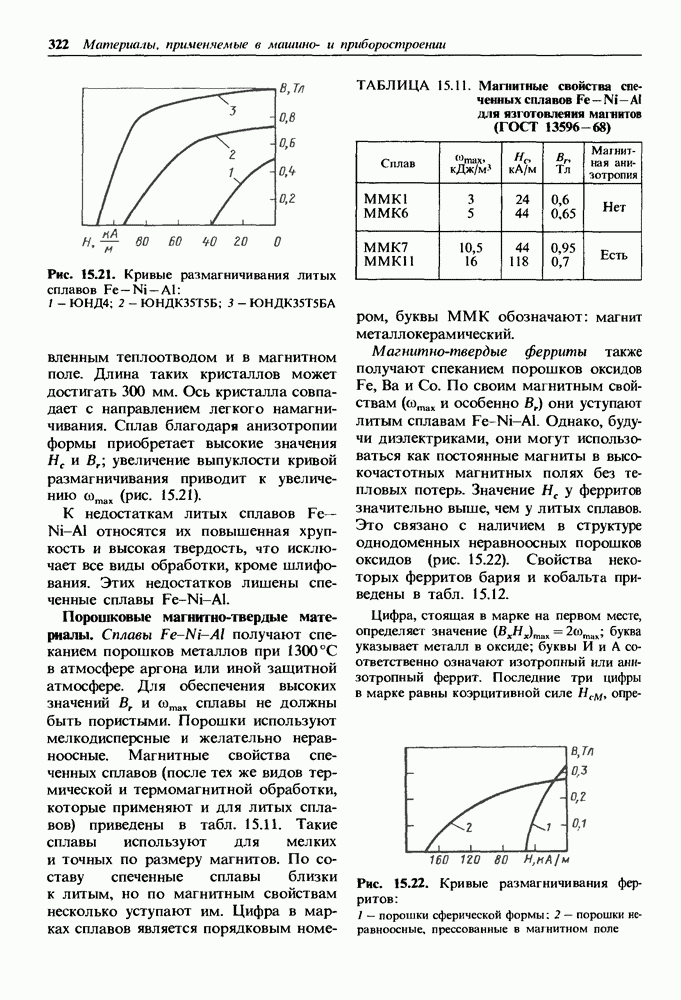
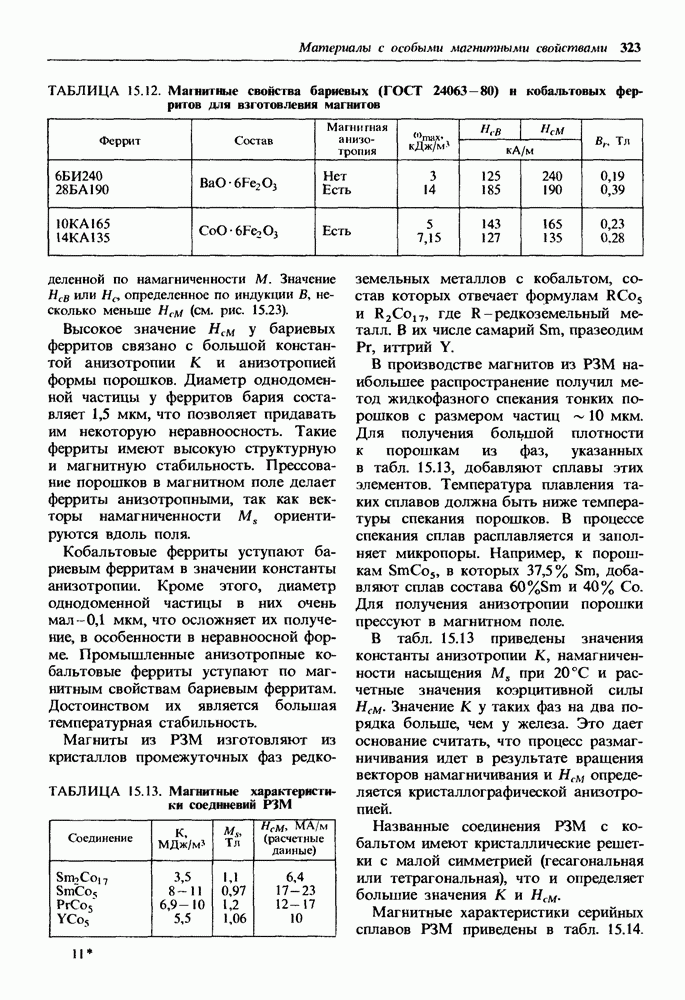
- 15.3. Магнитно-твердые материалы
- Магнитно-твердые лнтые материалы.
- Порошковые магнитно-твердые материалы.
- Деформируемые магнитно-твердые сплавы.
- Глава 16. МАТЕРИАЛЫ С ОСОБЫМИ ТЕПЛОВЫМИ СВОЙСТВАМИ
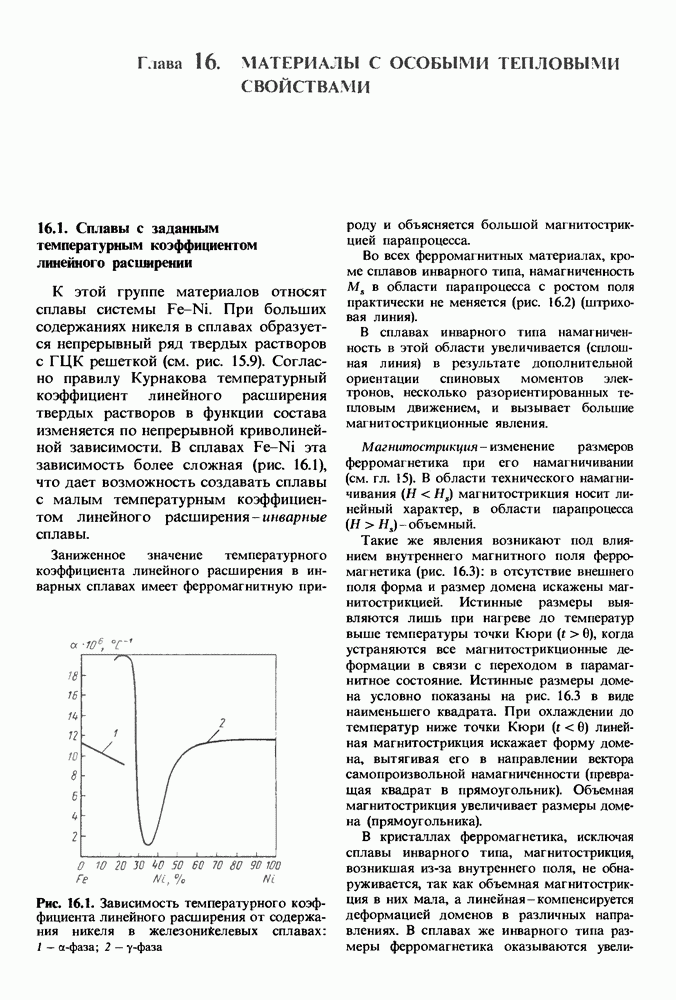
- 16.1. Сплавы с заданным температурным коэффициентом линейного расширении
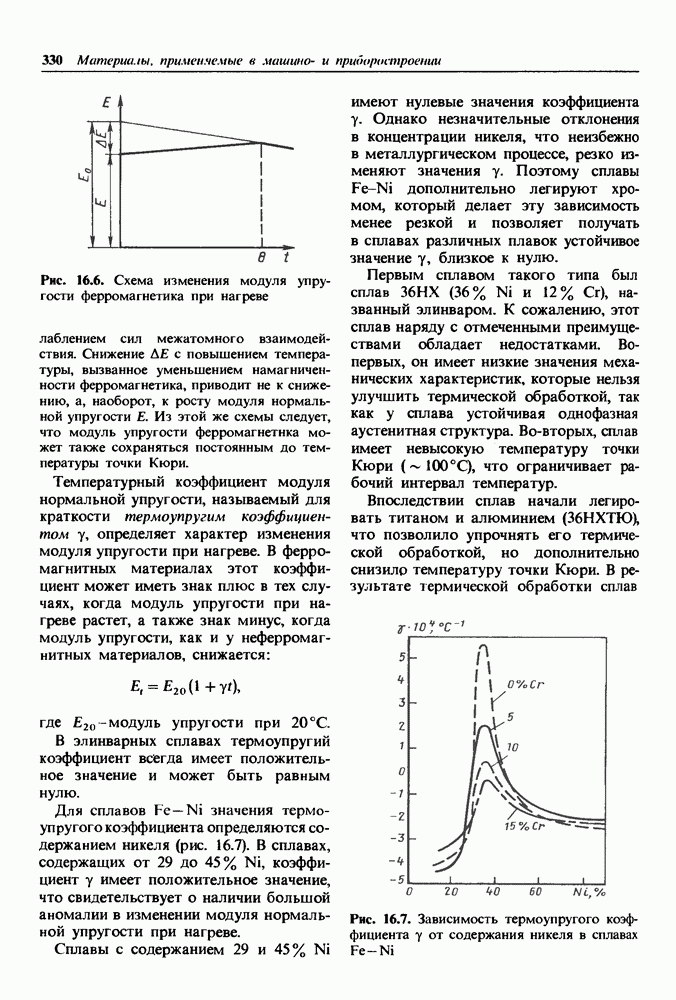
- 16.2. Сплавы с заданным температурным коэффициентом модуля упругости
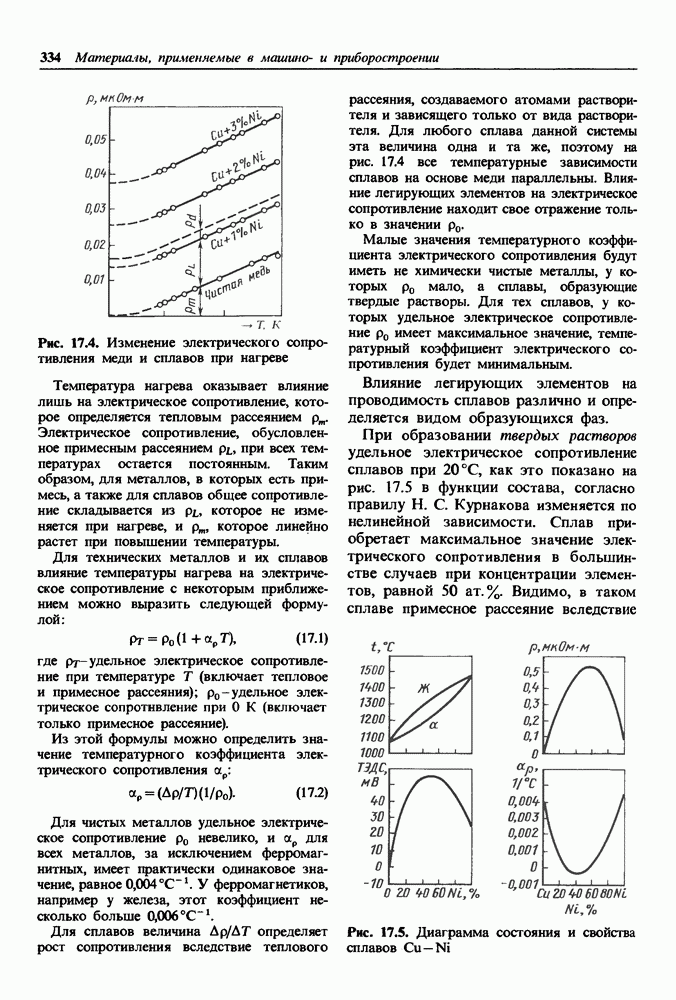
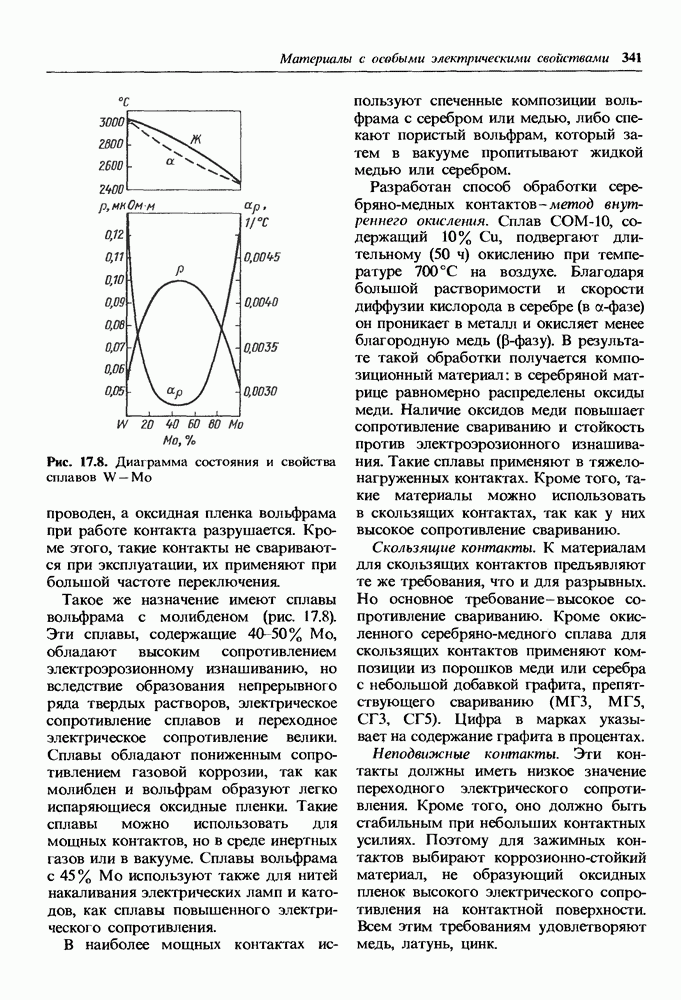
- Глава 17. МАТЕРИАЛЫ С ОСОБЫМИ ЭЛЕКТРИЧЕСКИМИ СВОЙСТВАМИ
- 17.1. Материалы высокой электрической проводимости
- Проводниковые материалы.
- 17.2. Полупроводниковые материалы
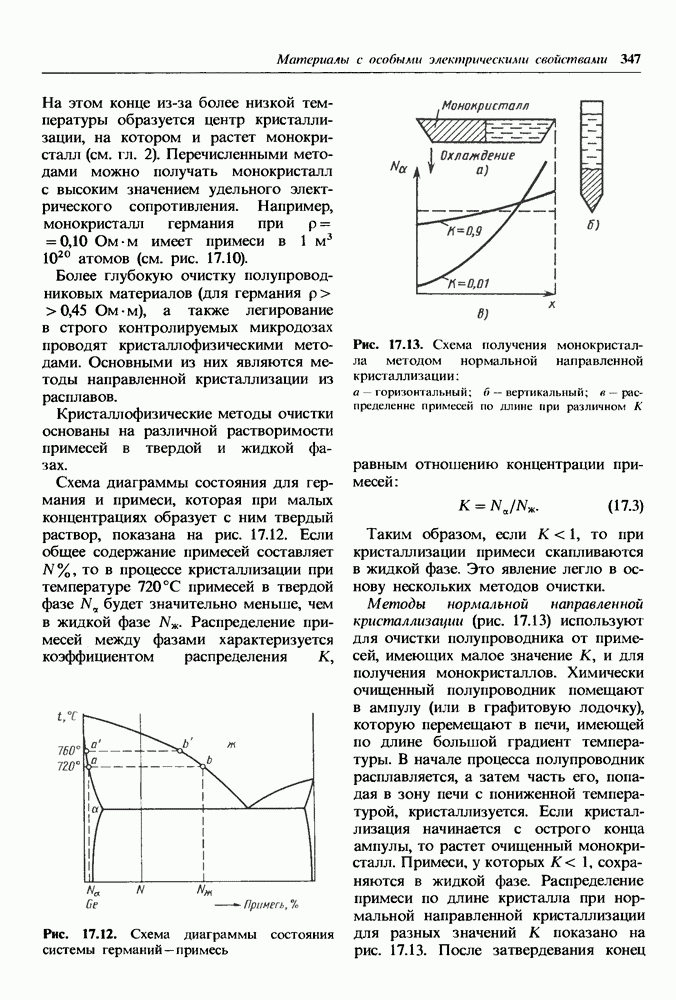
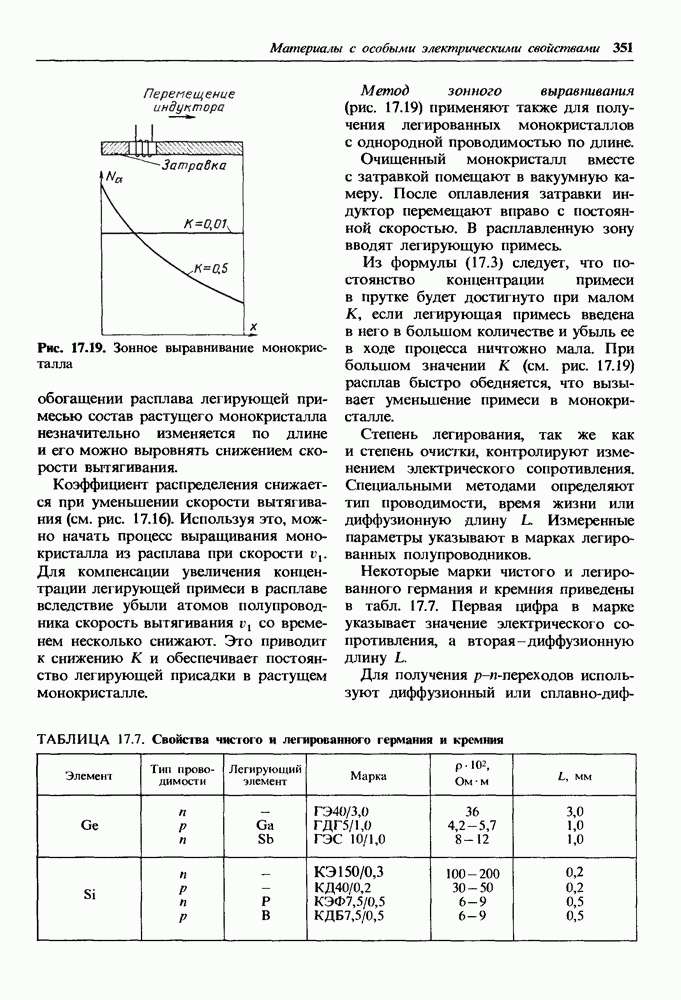
- Кристаллофизические методы получения сверхчистых материалов.
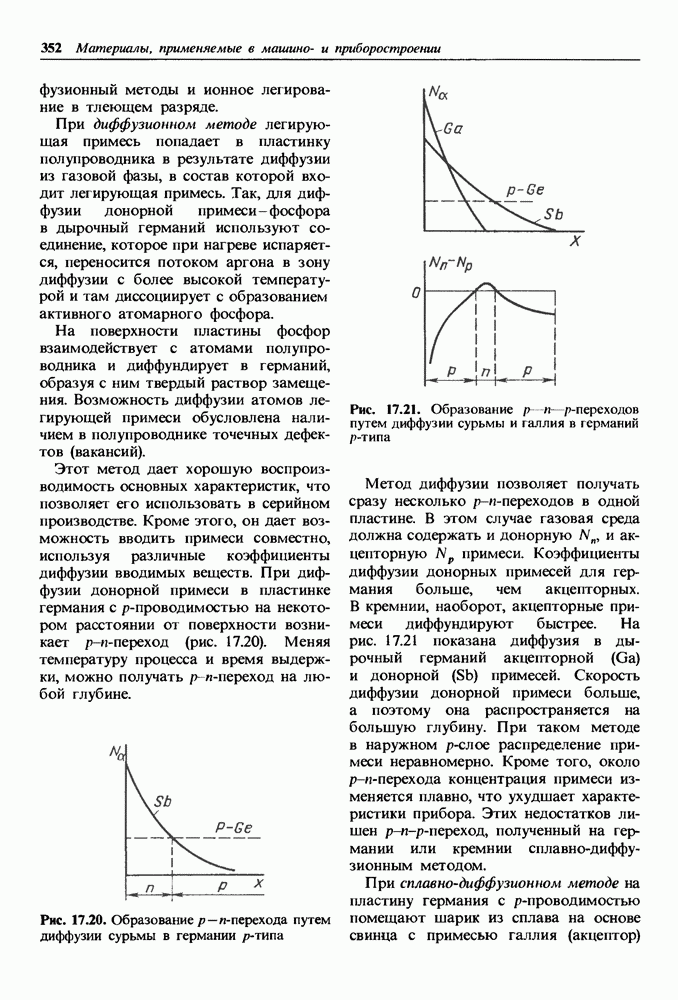
- Легирование полупроводников и получение p-n-переходов.
- 17.3. Диэлектрики
- Раздел третий. Инструментальные материалы
- Глава 18. МАТЕРИАЛЫ ДЛЯ РЕЖУЩИХ И ИЗМЕРИТЕЛЬНЫХ ИНСТРУМЕНТОВ
- 18.1. Материалы для режущих инструментов
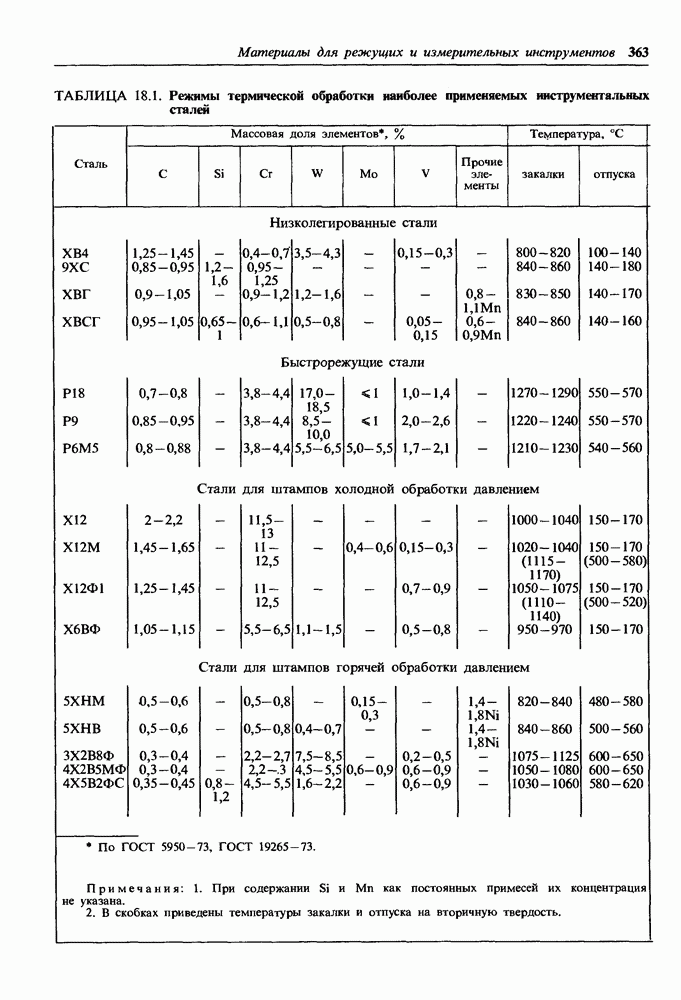
- Низколегированные стали.
- Быстрорежущие стали.
- Спеченные твердые сплавы.
- Сверхтвердые материалы.
- 18.2. Стали для измерительных инструментов
- Глава 19. СТАЛИ ДЛЯ ИНСТРУМЕНТОВ ОБРАБОТКИ МЕТАЛЛОВ ДАВЛЕНИЕМ
- 19.1. Стали для инструментов холодной обработки давлением
- 19.2. Стали для инструментов горячей обработки давлением
- Приложение
- Список литературы