| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
§ 40. Гальванические элементы. Электрохимическая природа коррозии
При погружении металла в электролит обычно наблюдается их взаимная электризация и между ними устанавливается определенная контактная разность потенциалов: металл заряжается отрицательно, жидкость — положительно. Это объясняется электролитической упругостью растворения металлов — их способностью переходить в раствор в виде ионов. Электроны, принадлежавшие атомам металла, остаются при этом в металле и сообщают ему отрицательный заряд:

Особенность данного случая растворения твердого тела в жидкости заключается в том, что перешедшие в раствор ионы металла не удаляются от металлической пластинки, а удерживаются возле нее силами притяжения, исходящими от оставшихся в металле электронов. Вдоль поверхности металлической пластинки образуется двойной электрический слой из электронов и ионов. Металл заряжается отрицательно, раствор — положительно.
Переход ионов из металла в раствор, очевидно, будет продолжаться лишь до тех пор, пока между металлом и раствором не возникнет напряжение, достаточное для того, чтобы воспрепятствовать дальнейшему «растворению» металла. Сколько ионов перейдет таким образом в раствор и какова будет вследствие этого разность потенциалов между металлом и раствором, — зависит от природы металла и растворяющей его жидкости и от того, имелись ли уже ранее в растворе ионы данного металла в виде какой-либо его соли. Если концентрация последней достаточно велика, двойной слой может и не образоваться, раствор как бы насыщен ионами данного металла. В этом случае следует предположить, что упругость растворения металла численно равна осмотическому давлению ионов металла в растворе. Отсюда: для численной характеристики электролитической упругости растворения, недоступной прямому измерению, можно измерять вместо нее осмотическое давление ионов металла в таком растворе его соли, в котором металл самопроизвольно не растворяется и из которого он самопроизвольно не высаживается.
Сказаннце можно также сформулировать следующим образом. Равновесие между металлом и электролитом устанавливается тогда, когда достигается равенство термодинамических потенциалов ионов металла в обеих средах, т. е. в растворе и в кристаллической решетке. Удобной, однако не вполне точной мерой этих термодинамических потенциалов металлических ионов служат: для раствора —
осмотическое давление ионов, для кристаллической решетки — электролитическая упругость растворения.
Если металл погрузить в раствор его соли, еще более концентрированный, т. е. как бы пересыщенный его ионами, некоторая часть последних выделится на металле и металл зарядится положительно; анионы же скопятся близ поверхности металла в растворе, и последний зарядится отрицательно.
На рис. 138 представлена схема простого опыта, в котором контактная разность потенциалов, устанавливающаяся на границе металл — электролит, проявляется в наличии электрического поля между металлической пластинкой и электролитом, поднятым полоской фильтровальной бумаги  Силовые линии этого поля начинаются на зарядах поверхности электролита в фильтровальной бумаге и кончаются на зарядах, распределенных по выступающей части металлической пластинки.
Силовые линии этого поля начинаются на зарядах поверхности электролита в фильтровальной бумаге и кончаются на зарядах, распределенных по выступающей части металлической пластинки.

Рис 138. Электрическое поле между металлом и электролитом, поднятым полоской фильтровальной бумаги 
Когда металл погружают в электролит, происходит частичное растворение металла, заключающееся в переходе в раствор положительных ионов металла и связанной с этим электризации металла и раствора. Получающиеся при этом заряды сосредоточены в месте соприкосновения металла и электролита, в слое молекулярной толщины. Поэтому возникает вопрос: каково происхождение зарядов, обнаруживаемых в описанном выше опыте на свободной поверхности жидкости и на выступающем из раствора конце металлической пластинки? Легко понять, что появление в растворе у погруженного в него металла положительных ионов, перешедших в раствор из металла, должно вызвать перераспределение уже имевшихся в растворе ионов. Скопление положительных ионов около металла вызовет перемещение в этот слой из соседнего слоя раствора отрицательных ионов, и в то же время часть положительных ионов из этого слоя будет оттеснена в более удаленный от металла слой. Подобные же смещения произойдут и в соседнем слое: часть имевшихся в нем отрицательных ионов перейдет в первый слой и взамен их сюда прибудут отрицательные ионы из следующего, третьего, слоя, а избыток положительных ионов вытеснится в третий слой и т. д. Таким образом, для каждого из внутренних слоев раствора убыль ионов каждого знака в один соседний слой будет компенсирована прибылью их из другого, соседнего, слоя, прилежащего с противоположной стороны. Это не будет иметь места лишь для последнего слоя, непосредственно прилежащего к свободной поверхности жидкости; следовательно, в этом слое получится некоторый избыток положительных ионов, и он окажется положительно заряженным.
С другой стороны, отрицательные ионы, переместившиеся в ближайший к металлу слой, примут на себя часть силовых линий, исходящих из перешедших в раствор положительных ионов металла, и тем самым «освободят» часть электронов двойного слоя. Эти электроны получат возможность перейти в выступающий над уровнем жидкости конец металлической пластинки и зарядят его отрицательно.
Грубая схема описанного перераспределения ионов в растворе при переходе в раствор положительных ионов металла дана на рис. 139.

Рис. 139. Схема перераспределения (смещения) ионов в электролите при переходе в раствор положительных ионов металла.
Металл и раствор, в который он погружен, представляют собой полуэлемент; несмотря на наличие разностей потенциалов и электропроводность всех своих составных частей, «полуэлемент» не дает электрического тока, так как все здесь находится в состоянии равновесия. Возьмем теперь два подобных полуэлемента, например медь в растворе медного купороса и цинк в растворе цинкового купороса, приведем их в соприкосновение через пористую перегородку (рис. 140) и соединим цинковую и медную пластинки какой-либо металлической проволокой.

Рис. 140. Элемент Даниэля и его схема; а — пористый сосуд  в).
в).
Цинк имеет несравненно большую упругость растворения, чем медь, поэтому цинковая пластинка приобретает более сильный отрицательный заряд, чем медная. Электроны с цинковой пластинки переместятся
по проволоке на медную. Тем самым нарушится равновесие в двойном слое цинковой пластинки; часть образующих его ионов цинка устремится в раствор. Точно так же нарушится равновесие в двойном слое медной пластинки, отрицательный заряд которой усилился за счет электронов, прибывших из цинка. Здесь, наоборот, часть ионов меди, образующих двойной слой, соединится с избыточными электронами и осядет на пластинку уже в виде атомов.
Однако указанными процессами равновесие не будет восстановлено. «Двойной слой» цинка разрушен. Цинк стремится восстановить его, посылая в раствор новые ионы, но он не в состоянии удержать эти ионы близ своей поверхности, так как электроны, которые были связаны с этими ионами силами притяжения, непрерывно будут удаляться в медную пластинку, где они нейтрализуют прибывающие из раствора ионы меди. Так будет продолжаться до тех пор, пока либо не растворится весь цинк, либо не израсходуются все ионы меди.
В течение процесса раствор в цинковом полуэлементе обогащается положительными ионами, а в медном — обедняется ими. Вследствие этого раствор должен был бы получить в одной части положительный, а в другой — отрицательный заряд. На самом деле этого не происходит, так как одновременно с движением электронов по проволоке от цинкового электрода к медному в растворе от медного электрода к цинковому движутся через пористую перегородку отрицательные ионы. В конечном счете в описанном элементе протекает, следовательно, превращение цинка в сульфат цинка, а медь осаждается из раствора сульфата меди:

Из всего сказанного выше ясно, что напряжение на полюсах разомкнутого гальванического элемента (электродвижущая сила) зависит не от его геометрических свойств (величина и форма электродов, объемы омывающих электроды жидкостей, способ их разобщения), но исключительно от химической природы материалов, взятых для электродов и электролитических растворов, а также от концентрации последних.
Мы рассмотрели простейший гальванический элемент, известный под названием элемента Даниэля (см. рис. 140). Оценим, что существенно и что несущественно в его конструкции. Цинковый электрод, конечно, необходим, так как цинк является прямым участником химической реакции, энергия которой питает элемент. Наоборот, несущественно, что в качестве второго электрода мы взяли именно медь. Этот второй электрод в химической реакции не участвует; он служит лишь передатчиком электронов, нейтрализующих ионы меди. Поэтому ничто не изменилось бы, если бы в качестве второго электрода мы взяли какой-либо другой
электропроводящий материал с низкой упругостью растворения, например платину или уголь. Тотчас по замыкании тока на платине или на угле осадился бы тончайший слой меди, и в последующем элемент работал бы так же, как если бы электрод с самого начала был медным.
Из двух примененных электролитов, наоборот, наибольшее значение имеет медный купорос, так как именно он является наряду с цинком участником реакции, энергия которой питает элемент. Однако вместо сернокислой меди мы могли бы взять любую другую соль меди. Существенно лишь, чтобы имелись ионы меди независимо оттого, в виде какой соли они введены в раствор. Сернокислый же цинк опять-таки может быть заменен солью какого-либо другого металла, например поваренной солью.

Рис. 141, Часто применяемое устройство элемента Даниэля (элемент Мейдингера).
Заменяя цинк другими металлами с высокой упругостью растворения или медный купорос солями других металлов с низкой упругостью растворения, мы получаем ряд новых гальванических элементов.
Следует указать на роль пористой перегородки. Ее назначение заключается лишь в том, чтобы воспрепятствовать непосредственному действию медного купороса на цинк. При непосредственном действии медного купороса на цинк энергия реакции выделилась бы в виде теплоты в самом гальваническом элементе, вместо того чтобы превратиться в электрический ток. В некоторых конструкциях гальванических элементов пористая перегородка не нужна. Она не была бы нужна и в рассмотренном элементе Даниэля, если бы применяемый в нем цинк был идеально чист; химически чистый цинк, как показывает опыт, не взаимодействует с медным купоросом при непосредственном соприкосновении. Скопившиеся вблизи поверхности цинка в двойном слое положительные ионы цинка отталкивают одноименно заряженные ионы меди и препятствуют их соприкосновению с металлическим цинком.
На рис. 141 показана схема одного из применяемых в технике вариантов элемента Даниэля — элемента Мейдингера. Здесь цинк находится в растворе сернокислого магния  медь — в насыщенном растворе медного купороса. Расход медного купороса при работе элемента автоматически пополняется растворением запасенных в элементе кристаллов
медь — в насыщенном растворе медного купороса. Расход медного купороса при работе элемента автоматически пополняется растворением запасенных в элементе кристаллов  Пористая перегородка в этом элементе отсутствует, так как смешиванию растворов противодействует разность их плотностей.
Пористая перегородка в этом элементе отсутствует, так как смешиванию растворов противодействует разность их плотностей.
В технике чаще всего применяют элементы Лекланше, водоналивные и сухие. Схема водоналивного элемента Лекланше дана на рис. 142. В этом элементе цинк помещен в раствор нашатыря  Растворяясь, цинк вытесняет ионы
Растворяясь, цинк вытесняет ионы  образуется хлористый цинк. Для устранения выделения пузырьков водорода на аноде, которым служит угольный стержень, этот угольный стержень помещают в смесь перекиси марганца и графита (графит служит для придания смеси электропроводности, а перекись марганца, реагируя с водородом, образует воду и окись марганца). Сухой элемент Лекланше не нуждается в заливке водой, так как он содержит готовый электролит в виде сгущенного крахмалом раствора нашатыря.
образуется хлористый цинк. Для устранения выделения пузырьков водорода на аноде, которым служит угольный стержень, этот угольный стержень помещают в смесь перекиси марганца и графита (графит служит для придания смеси электропроводности, а перекись марганца, реагируя с водородом, образует воду и окись марганца). Сухой элемент Лекланше не нуждается в заливке водой, так как он содержит готовый электролит в виде сгущенного крахмалом раствора нашатыря.
Сухие батареи, широко применяемые для питания анодных цепей радиоаппаратов  дают приблизительно
дают приблизительно  ампер-часа на
ампер-часа на  веса батареи; они рассчитаны на сопротивление цепи в несколько тысяч омов.
веса батареи; они рассчитаны на сопротивление цепи в несколько тысяч омов.

Рис. 142. Водоналивной элемент Лекланше 

Рис. 143. Кадмиевый нормальный элемент Вестона. Электродвижущая сила при 18° равна 
В лабораторной практике для измерительных установок часто применяют кадмиевый нормальный элемент Вестона, устройство которого пояснено рисунком 143.
Гальванические элементы возникают также, вопреки нашему желанию, всюду, где мы имеем дело с металлическими конструкциями, созданными из разнородных металлов с различной упругостью растворения. Это приводит к коррозии металлов. На поверхности металла всегда имеется тончайшая адсорбированная из воздуха пленка влаги, содержащая водородные ионы, получающиеся частью от диссоциации самой воды, частью от насыщения пленки углекислотой из воздуха.
Например, в металлической конструкции, состоящей из медных и железных частей, мы имеем гальванический элемент следующего рода;

который должен действовать согласно следующей реакции:

т. е. железо будет разрушаться, выделяя в раствор ионы, вследствие чего образуется (в итоге вторичных реакций) ржавчина, а на поверхности меди будет выделяться водород. Благодаря медленности процесса кислород из атмосферы успевает диффундировать к местам выделения водорода и окислять последний в воду. Следовательно, такая конструкция уподобляется короткозамкнутому элементу с деполяризатором.
Вообще говоря, необходимо всячески избегать соприкосновения металлов, имеющих сильно разнящиеся упругости растворения. Однако в известных случаях это становится, наоборот, желательным и используется именно как мера борьбы с коррозией. Довольно широко применяется для защиты ответственных частей той или иной металлической конструкции так называемый метод протекторов. В паровые котлы вводятся листы цинка, металлически связанные со стенками котла. Цинк обладает большей упругостью растворения, чем железо.
Он становится в получившемся гальваническом элементе отрицательным электродом и подвергается растворению, в то время как на стенках котла и в дымогарных трубах выделяется водород. На рис. 144 показано, как применяется способ протекторов для защиты ответственных частей морских судов.
Для борьбы с коррозией часто применяют лакокрасочные и эмалевые покрытия металла. Широко распространено также покрытие железа цинком, оловом и хромом. Оцинкованное или хромированное железо не разрушается коррозией даже в том случае, если в слое покрытия имеются глубокие царапины. Это объясняется тем, что в данном случае (когда железо покрыто более электроотрицательным металлом) в гальваническом микроэлементе, возникающем у царапины, железо является анодом и не растворяется, а, напротив, покрывается пленкой цинка или хрома. Таким образом происходит самовосстановление покрытия в том месте, где оно оказалось случайно нарушенным (рис. 145). В связи со сказанным покрытия металла более электроотрицательным металлом называют анодными покрытиями.

Рис. 144. Метод протекторов.

Рис. 145. Гальванические микроэлементы в царапине оцинкованного железа в некоторой мере восстанавливают пленку покрытия.

Рис. 146. В местах царапин луженого железа происходит быстрая коррозия металла.
Противоположная картина наблюдается при нарушении слоя полуды  слоя олова на железе. Такое покрытие называют катодным (железо в гальванических микроэлементах, возникающих в царапинах луженого железа, является катодом); в местах, где полуда поцарапана, железо, как известно, быстро ржавеет (рис. 146),
слоя олова на железе. Такое покрытие называют катодным (железо в гальванических микроэлементах, возникающих в царапинах луженого железа, является катодом); в местах, где полуда поцарапана, железо, как известно, быстро ржавеет (рис. 146),
| << Предыдущий параграф | Следующий параграф >> |
- ЧАСТЬ ТРЕТЬЯ. УЧЕНИЕ ОБ ЭЛЕКТРИЧЕСТВЕ
- § 2. Количество электричества. Закон Кулона
- § 3. Атомное строение электричества
- § 4. Напряженность электрического поля
- § 5. Теорема Острогдадского — Гаусса
- § 6. Вектор электрической индукции
- § 7. Примеры применения теоремы Остроградского — Гаусса
- § 8. Потенциал электрического поля
- § 9. Формулы электростатики в практической системе единиц
- ГЛАВА II. ПРОВОДНИКИ В ЭЛЕКТРИЧЕСКОМ ПОЛЕ
- § 10. Распределение электричества по поверхностй заряженных проводников
- § 11. Электризация проводников в поле и деформация поля проводниками
- § 12. Контактная разность потенциалов
- § 13. Электроемкость
- § 14. Расчет электроемкости конденсаторов
- § 15. Электрическая энергия
- § 16. Энергия поля
- § 17. Электрометры
- § 18. О природе электрических явлений
- ГЛАВА III. ДИЭЛЕКТРИКИ В ЭЛЕКТРИЧЕСКОМ ПОЛЕ
- § 19. Дипольная и электронная поляризация диэлектриков. Сегнетоэлектрики
- § 20. Деформация поля диэлектриками
- § 21. Электрическая восприимчивость
- § 22. Электронная теория диэлектриков
- § 23. Пьезоэлектрические и пироэлектрические явления
- § 24. Электроконвекционные явления (электрофорез, электроэндосмос и др.)
- ГЛАВА IV. ПОСТОЯННЫЙ ТОК
- § 25. Величина тока. Электродвижущая сила и напряжение
- § 26. Закон Ома. Законы Кирхгофа
- § 27. Закон Джоуля — Ленца
- § 28. Дифференциальная форма законов Ома и Джоуля — Ленца. Соотношение аналогии между проводимостью и емкостью
- ГЛАВА V. ТОК В МЕТАЛЛАХ
- § 29. Сведения об электропроводности. Термометры сопротивления, болометры, тензометры
- § 30. Закон Видемана — Франца. Теория электропроводности металлов
- § 31. Сверхпроводимость
- § 32. Термоэлектрические явления и их применение
- § 33. Зависимость термоэлектродвижущей силы от температуры спаев. Явление Пельтье
- ГЛАВА VI. ТОК В ПОЛУПРОВОДНИКАХ
- § 34. Полупроводники
- § 35. Понятие о зонной теории электропроводности
- § 36. Применения полупроводников
- ГЛАВА VII. ТОК В ЭЛЕКТРОЛИТАХ
- § 37. Электролиз. Законы Фарадея. Электрохимические эквиваленты. Потенциалы разложения
- § 38. Вторичные реакции на электрэдах. Применения электролиза
- § 39. Подвижность ионов и электропроводность растворов
- § 40. Гальванические элементы. Электрохимическая природа коррозии
- § 41. Электродные потенциалы
- § 42. Аккумуляторы
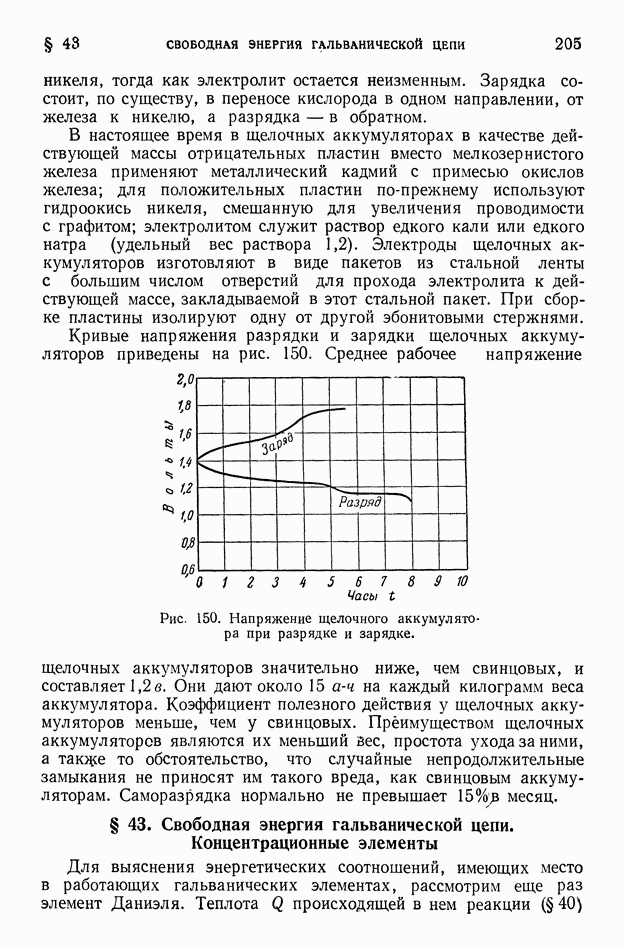
- § 43. Свободная энергия гальванической цепи. Концентрационные элементы
- ГЛАВА VIII. ТОК В ГАЗАХ
- § 44. Ионизация и электропроводность газов
- § 45. Типы и механизм разряда в газах
- § 46. Катодные и анодные лучи
- § 47. Тлеющий разряд
- § 48. Дуговой разряд
- § 49. Искровой разряд. Молния
- ГЛАВА IX. ТОК ЭЛЕКТРОННОЙ ЭМИССИИ. ЭЛЕКТРОННЫЕ ЛАМПЫ
- § 50. Термоэлектронная эмиссия. Формула Ричардсона — Дёшмена
- § 51. Торможение электронного потока. Рентгеновы трубки
- § 52. Пустотные выпрямители тока (диоды, кенотроны)
- § 53. Усилительные электронные лампы (триоды)
- § 54. Фотоэлектрический эффект. Фотоэлементы. Фотореле
- § 55. Вторичная электронная эмиссия. Электронные умножители
- § 56. Динатронный эффект. Экранированные радиолампы
- ГЛАВА X. МАГНИТНОЕ ПОЛЕ
- § 57. Исторические сведения. Закон Кулона для магнитных полюсов
- § 58. Магнитные величины и соотношения, аналогичные электрическим
- § 59. Магнитное поле Земли
- § 60. Магнитное поле тока
- § 61. Закон Био и Савара
- § 62. Магнитодвижущая сила. Поток индукции электромагнита
- § 63. Магнитные свойства веществ и их использование
- § 64. Электронная теория магнетизма
- ГЛАВА XI. ДЕЙСТВИЕ МАГНИТНОГО ПОЛЯ НА ТОК
- § 65. Формула Ампера и ее трактовка по Фарадею
- § 66. Работа, производимая током при перемещении проводника в магнитном поле. Электромоторы
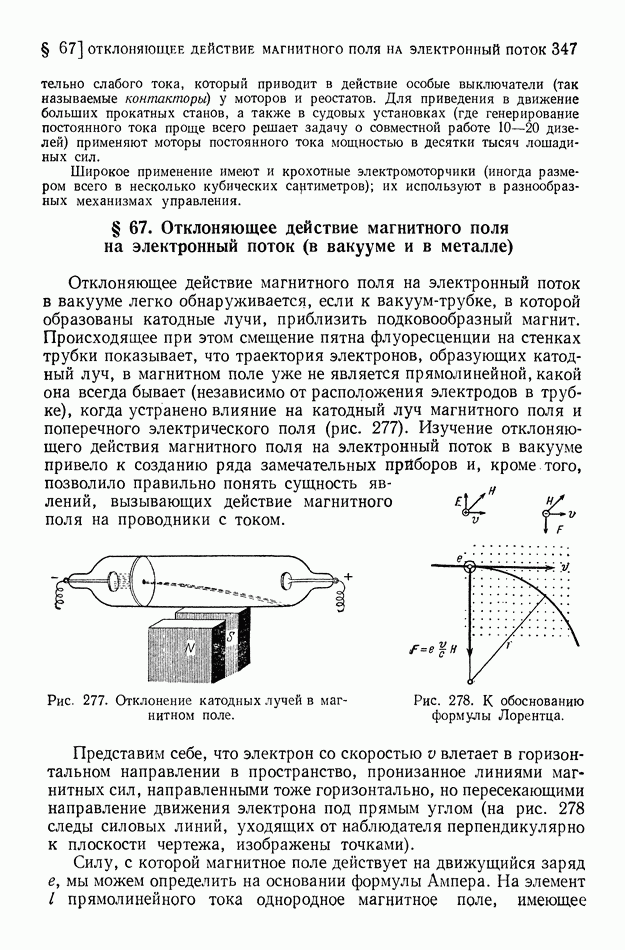
- § 67. Отклоняющее действие магнитного поля на электронный поток (в вакууме и в металле)
- § 68. Электродинамические измерительные приборы. Гальванометры, Осциллографы
- § 69. Формулы электродинамики в практической системе единиц
- ГЛАВА XII. ЭЛЕКТРОМАГНИТНАЯ ИНДУКЦИЯ. ЭЛЕКТРОМАГНИТНОЕ ПОЛЕ
- § 70. Понятие об электромагнитном поле. Электромагнитная индукция
- § 71. Закон Ленца. Картина электромагнитного поля по Фарадею
- § 72. Закон Фарадея. Индукционное измерение магнитного потока и магнитодвижущей силы. Вихревые токи
- § 73. Явление самоиндукции. Индуктивность. Законы нарастания и спада тока при включении и выключении цепи
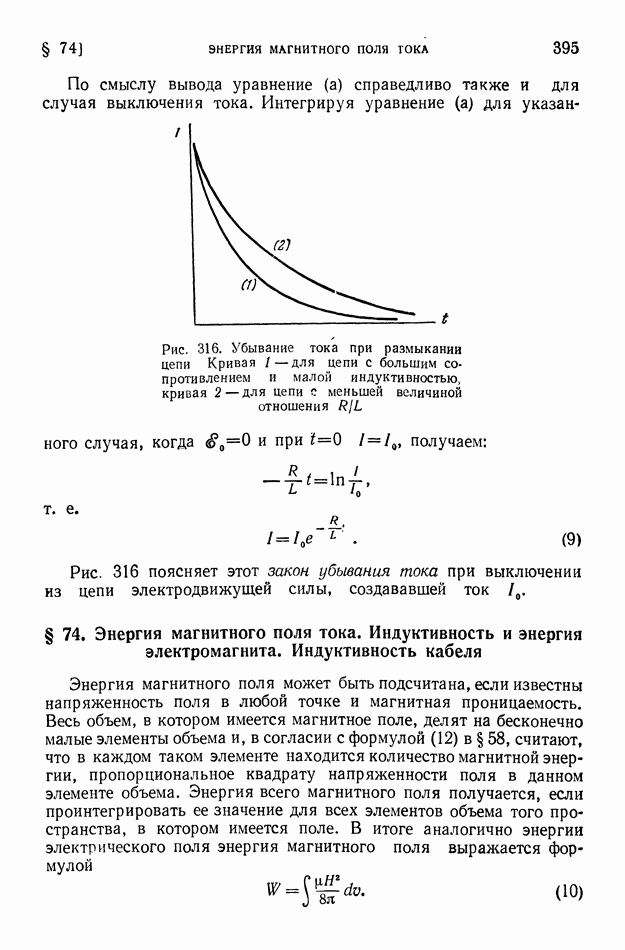
- § 74. Энергия магнитного поля тока. Индуктивность и энергия электромагнита. Индуктивность кабеля
- § 75. Взаимная индуктивность. Энергия взаимодействия токов. Коэффициент взаимной индукции катушек с общим сердечником
- § 76. Уравнения Максвелла и уравнения Лорентца
- § 77. Электромагнитное происхождение массы электрона
- ГЛАВА XIII. ПЕРЕМЕННЫЙ ТОК
- § 78. Генерирование переменного тока
- § 79. Работа генератора электрической энергии на нагрузку Эффективные значения напряжения и величины тока
- § 80. Емкостное сопротивление и индуктивное сопротивление
- § 81. Активные и реактивные токи. Коэффициент мощности (cos f). Потери (tg b)
- § 82. Обобщенный закон Ома
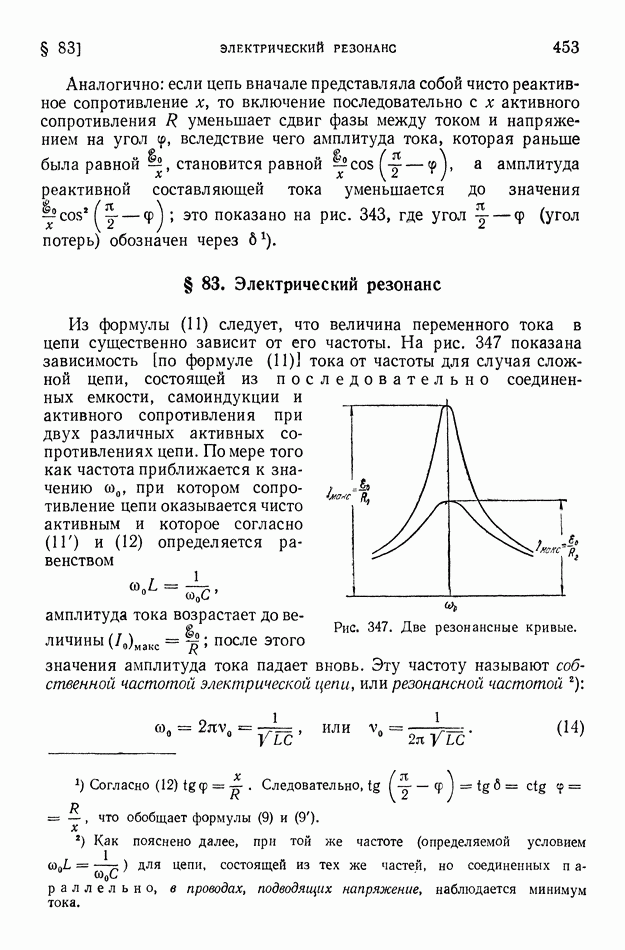
- § 83. Электрический резонанс
- § 84. Трансформация тока
- § 85. Трехфазный ток. Синхронные и асинхронные моторы
- ГЛАВА XIV. ЭЛЕКТРИЧЕСКИЕ КОЛЕБАНИЯ И ИХ ПРИМЕНЕНИЕ
- § 86. Индуктор
- § 87. Колебательный контур
- § 88. Вибратор Герца (возбуждение колебательного контура индуктором). Токи Тесла
- § 89. Электромагнитные волны. Вектор Умова — Пойнтинга
- § 90. Излучение электрического диполя. Волны в двухпроводной линии. Антенны
- § 91. Распространение электромагнитных волн. Роль ионосферы. «Радиоокно» в космос
- § 92. Ламповые генераторы электрических колебаний
- § 93. Модуляция электрических колебаний
- § 94. Прием, детектирование и усиление радиосигналов. Супергетеродины
- § 95. Преобразование звуковых колебаний в электрические и электрических в звуковые. Электрозапись и воспроизведение звука
- § 96. Телевидение
- § 97. Сантиметровые волны и их распространение в волноводах
- § 98. Радиолокация. Генерирование ультракоротких волн (клистроны и магнетроны)