| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
§ 43. Свободная энергия гальванической цепи. Концентрационные элементы
Для выяснения энергетических соотношений, имеющих место в работающих гальванических элементах, рассмотрим еще раз элемент Даниэля. Теплота Q происходящей в нем реакции (§ 40)
определена калориметрическим путем и составляет  на каждый грамм-эквивалент. Энергия, доставляемая элементом Даниэля, может быть в свою очередь рассчитана путем следующего рассуждения. Замкнув элемент на достаточно большое сопротивление, мы можем практически всю доставляемую им энергию реализовать во внешней цепи. При этом напряжение на полюсах элемента практически останется равным 1,08 в, как и в разомкнутом элементе. Использование каждого грамм-эквивалента цинка связано с перемещением во внешней цепи 96 500 кулонов и, следовательно, доставляет работу
на каждый грамм-эквивалент. Энергия, доставляемая элементом Даниэля, может быть в свою очередь рассчитана путем следующего рассуждения. Замкнув элемент на достаточно большое сопротивление, мы можем практически всю доставляемую им энергию реализовать во внешней цепи. При этом напряжение на полюсах элемента практически останется равным 1,08 в, как и в разомкнутом элементе. Использование каждого грамм-эквивалента цинка связано с перемещением во внешней цепи 96 500 кулонов и, следовательно, доставляет работу

Следовательно, здесь практически 
Подобная эквивалентность между количеством энергии  выделяемой химической реакцией в калориметре, и электроэнергией
выделяемой химической реакцией в калориметре, и электроэнергией  отдаваемой ею же в гальваническом элементе, наблюдается не всегда. Часто энергия реакции не может быть полностью реализована в виде работы электрического тока и частично выделяется внутри элемента в форме тепла.
отдаваемой ею же в гальваническом элементе, наблюдается не всегда. Часто энергия реакции не может быть полностью реализована в виде работы электрического тока и частично выделяется внутри элемента в форме тепла.
Однако наибольший интерес представляет собой возможность конструировать элементы, для которых  т. е. производимая элементом работа превышает теплоту совершающейся в нем реакции. Осуществимы даже гальванические элементы, работающие за счет реакций с отрицательным «тепловым эффектом реакции». Во всех подобных случаях, помещая работающий элемент в калориметр, можно установить понижение температуры. Это указывает на то, что источником работы гальванического элемента, если не исключен теплообмен его с окружающей средой, является не внутренняя, а свободная энергия F (т. I, § 105). Если от элемента берется ток очень малой величины, то элемент действительно удовлетворяет термодинамическому определению изотермически обратимо работающей машины и производимая им работа должна быть равна убыли его свободной энергии.
т. е. производимая элементом работа превышает теплоту совершающейся в нем реакции. Осуществимы даже гальванические элементы, работающие за счет реакций с отрицательным «тепловым эффектом реакции». Во всех подобных случаях, помещая работающий элемент в калориметр, можно установить понижение температуры. Это указывает на то, что источником работы гальванического элемента, если не исключен теплообмен его с окружающей средой, является не внутренняя, а свободная энергия F (т. I, § 105). Если от элемента берется ток очень малой величины, то элемент действительно удовлетворяет термодинамическому определению изотермически обратимо работающей машины и производимая им работа должна быть равна убыли его свободной энергии.
Когда при работе гальванического элемента не происходит выделения газов, то эту термодинамическую систему, поставленную в условия неизменной температуры и неизменного давления, с большим приближением можно считать имеющей неизменный объем. Поэтому в этом случае можно применить уравнение Гиббса-Гельмгольца в том виде, в каком оно выведено в т. I [§ 107, формула (29)].
Подставляя в уравнение Гиббса-Гельмгольца выражение изотермической работы гальванического элемента как произведения электродвижущей силы на заряд Фарадея и обозначая теплоту реакции, выраженную в джоулях и отнесенную к одному грамм-эквиваленту, через  получаем нижеследующее термодинамическое уравнение, связывающее электродвижущую силу в вольтах и температурный коэффициент электродвижущей силы с теплотой реакции:
получаем нижеследующее термодинамическое уравнение, связывающее электродвижущую силу в вольтах и температурный коэффициент электродвижущей силы с теплотой реакции:

Мы видим, что в зависимости от того, увеличиваются ли при повышении температуры производимая элементом работа и пропорциональная ей электродвижущая сила элемента или они уменьшаются с повышением температуры, т. е., в зависимости от знака производимая элементом работа  может быть меньше или больше, чем тепловой эффект реакции, причем в последнем случае добавочная энергия заимствуется в форме притекающего к элементу тепла из окружающей среды.
может быть меньше или больше, чем тепловой эффект реакции, причем в последнем случае добавочная энергия заимствуется в форме притекающего к элементу тепла из окружающей среды.
Так как 1 калория равна  и
и  то
то

Поскольку изменение свободной энергии равно изотермической работе, а работа, производимая «электрифицированной» химической реакцией в гальваническом элементе, равна произведению электродвижущей силы на переносимый заряд, то очевидно, что разность свободных энергий  исходных веществ и продуктов реакции можно вычислить на основании измерения электродвижущей силы гальванической цепи:
исходных веществ и продуктов реакции можно вычислить на основании измерения электродвижущей силы гальванической цепи:

Таким образом, свободная энергия различных процессов становится доступ, ной непосредственному измерению, если для рассматриваемого процесса можно построить гальванический элемент и измерить его напряжение. Ценность этого, в сущности единственного, способа прямого измерения свободной энергии умаляется лишь сравнительно узким кругом процессов, доступных подобной электрификации. К числу их, кроме рассматривавшихся нами до сих пор химических реакций, могут быть присоединены и некоторые физические процессы. Применяя чувствительный вольтметр, можно измерить, например, энергетический эффект наклепа металлической пластинки, кручения или растягивания проволоки и тому подобных механических деформаций металла. Для этого составляется гальванический элемент из деформированного и недеформированного кусков металла, погруженных в раствор соответствующей соли. Различное содержание энергии в электродах обнаруживается появлением между ними определенной разности потенциалов. Деформированный электрод как обладающий большей удельной энергией при этом растворяется, а на недеформированном осаждается металл из раствора. Два вполне тождественных образца металла, помещенных в растворе его солей один над другим и соединенных проволокой, также могут служить источником тока, поддающегося измерению прецизионными измерительными приборами; здесь растворяется верхний электрод, наращивается нижний, а источником электрической энергии является разность гравитационных потенциалов.
Большой интерес представляют собой так называемые концентрационные элементы, в которых для совершения работы используются разности концентраций растворов.
В обычных условиях выравнивание концентраций происходит путем диффузии. Диффузия принадлежит к числу типично необратимых процессов. Но, разделяя участки раствора с различной концентрацией и соответственно с различным осмотическим давлением полупроницаемой перегородкой, мы могли бы провести
процесс выравнивания концентраций обратимо и заставить существующую в растворе разность осмотических давлений совершить определенную работу, причем необходимая для этого энергия была бы заимствована в форме тепла из внешней среды (выравнивание концентрации в растворах, подобно расширению газов в пустоту, практически не сопровождается изменением внутренней энергии системы).
Та же цель может быть достигнута следующим образом. Введем в оба участка раствора — с большой и малой концентрацией — по электроду из того металла, соль которого содержится в растворе (рис. 151). Каждый электрод примет вполне определенный равновесный потенциал, величина которого зависит от концентрации, или, точнее, от осмотического давления ионов этого металла в растворе, причем электрод, погруженный в более слабый раствор, зарядится, очевидно, сильнее, чем погруженный в крепкий раствор (§ 40). Если оба электрода соединить теперь проволокой, первый электрод будет выделять ионы в раствор и посылать электроны в проволоку; второй, наоборот, будет принимать электроны и собирать ионы из раствора, отлагая их на себе в виде металлического слоя. Это будет продолжаться, очевидно, до тех пор, пока концентрация обоих омывающих электроды растворов (благодаря непрерывной убыли соли в концентрированном растворе и прибыли эквивалентного количества ее в разбавленном растворе) не сравняются. Итак, выравнивание концентраций совершилось и при этом (если мы озаботились, чтобы тепловые потери во внешней цепи тока были малы) совершилось обратимо.

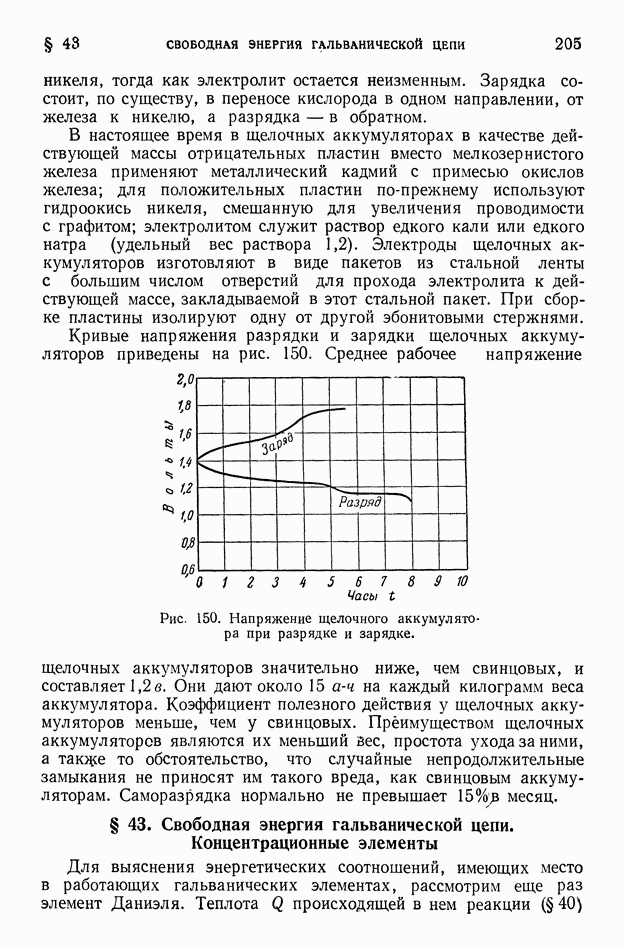
Рис. 151. Концентрационный элемент»
Рассчитаем напряжение на полюсах концентрационного элемента, один полюс которого омывается раствором с концентрацией ионов  другой — с концентрацией ионов
другой — с концентрацией ионов  Предположим, что объемы обоих растворов настолько велики, что прибыль некоторого количества соли в одном и убыль ее в другом растворе существенно не изменяют концентрации ионов
Предположим, что объемы обоих растворов настолько велики, что прибыль некоторого количества соли в одном и убыль ее в другом растворе существенно не изменяют концентрации ионов  Тогда перенос во внешней цепи 2X96 500 кулонов, где
Тогда перенос во внешней цепи 2X96 500 кулонов, где  валентность ионов в растворе, соответствует перемещению 1 моля соли из раствора
валентность ионов в растворе, соответствует перемещению 1 моля соли из раствора  в раствор
в раствор  Так как осмотические давления растворов пропорциональны их концентрациям, то при этом производится работа (т. I, §§ 79 и 120)
Так как осмотические давления растворов пропорциональны их концентрациям, то при этом производится работа (т. I, §§ 79 и 120)

Именно эта работа «осмотического расширения», произведенного обратимо и изотермично, а реализуется в виде электрической энергии элемента.
Следовательно

(где  — искомое напряжение), или, использовав числовое значение в джоулях и введя модуль перехода от натуральных логарифмов к десятичным:
— искомое напряжение), или, использовав числовое значение в джоулях и введя модуль перехода от натуральных логарифмов к десятичным:

Мы пренебрегли здесь скачком потенциала в месте соприкосновения концентрированного и разбавленного растворов. Он также легко может быть рассчитан и равен, как показывает теория, нулю, если подвижности аниона и катиона соли одинаковы; если же они значительно разнятся друг от друга (как это, например, имеет место в практически важном случае кислот), выражение, связывающее осмотическую и электрическую энергию, нуждается в исправлении и принимает следующий вид:

где  подвижность катиона,
подвижность катиона,  подвижность аниона.
подвижность аниона.
Подсчитаем, с какими порядками потенциала мы имеем здесь дело. Формула  показывает, что абсолютные значения концентраций несущественны; электродвижущая сила определяется их отношением. Пусть один раствор в 10 раз крепче другого; подвижности ионов одинаковы, температура — комнатная
показывает, что абсолютные значения концентраций несущественны; электродвижущая сила определяется их отношением. Пусть один раствор в 10 раз крепче другого; подвижности ионов одинаковы, температура — комнатная  Тогда
Тогда 
Итак, электродвижущие силы концентрационных элементов — такого порядка, что легко доступны измерению. Результаты подобных измерений обычно хорошо согласуются с электродвижущими силами, вычисленными по формуле (12). Учитывая это и пользуясь таблицей нормальных потенциалов, легко можно вычислить электродвижущие силы любых элементов, электроды которых омываются не нормальными по концентрации ионов (1 грамм-эквивалент ионов в  растворами их солей, а растворами любой, но известной концентрации. Следует лишь сообразить, что увеличению (уменьшению) концентрации ионов соли в 10" раз близ электрода соответствует уменьшение (увеличение) его потенциала примерно
растворами их солей, а растворами любой, но известной концентрации. Следует лишь сообразить, что увеличению (уменьшению) концентрации ионов соли в 10" раз близ электрода соответствует уменьшение (увеличение) его потенциала примерно
на  Геометрической прогрессии концентраций — при полной диссоциации на ионы — соответствует, следовательно, арифметическая прогрессия потенциалов.
Геометрической прогрессии концентраций — при полной диссоциации на ионы — соответствует, следовательно, арифметическая прогрессия потенциалов.
Однако уравнение (12) не является строгим соотношением. В самом деле, раз мы воспользовались при его выводе выражением работы расширения идеального газа, мы тем самым пренебрегли электростатическими взаимодействиями между ионами. Уравнение (12) должно поэтому давать достаточно точные результаты лишь применительно к разбавленным растворам. Более строгий расчет электродных потенциалов с учетом ионных взаимодействий излагается в учебниках физической химии.
Самым важным из практических применений концентрационных элементов является применение их для измерения ионных концентраций в растворах. Установлено, что во многих, преимущественно химических, производственных процессах концентрация определенных разновидностей ионов, особенно ионов водорода, или, точнее, ионов гидроксония (активная кислотность среды), является столь же важным фактором нормального режима процесса, как, например, температура, и поэтому должна непрерывно контролироваться. Контроль осуществляют путем измерения электродвижущей силы концентрационного элемента, который составляется следующим образом.
Два платиновых электрода, непрерывно насыщаемых водородом, погружают: один — во взятую пробу жидкости, другой — в стандартный раствор кислоты, содержащий 1 грамм-эквивалент  -ионов в литре. Измеряют электродвижущую силу
-ионов в литре. Измеряют электродвижущую силу  этого элемента и далее производят расчет по формуле (11).
этого элемента и далее производят расчет по формуле (11).
В данном случае концентрация  -ионов в стандартном полуэлементе равна единице
-ионов в стандартном полуэлементе равна единице  Следовательно,
Следовательно,  т. е. электродвижущая сила элемента, разделенная на коэффициент пропорциональности формулы
т. е. электродвижущая сила элемента, разделенная на коэффициент пропорциональности формулы  дает значение взятого со знаком минус логарифма искомой концентрации
дает значение взятого со знаком минус логарифма искомой концентрации  -ионов в испытуемой жидкости. Эту величину — отрицательный десятичный логарифм концентрации водородных ионов
-ионов в испытуемой жидкости. Эту величину — отрицательный десятичный логарифм концентрации водородных ионов  обозначают через
обозначают через  и называют водородным показателем:
и называют водородным показателем:

Очевидно, что водородный показатель нормального раствора  -ионов
-ионов  равен нулю; при меньшей кислотности
равен нулю; при меньшей кислотности  водородный показатель положителен и тем более велик, чем меньше кислотность; при кислотности большей, чем кислотность нормального раствора
водородный показатель положителен и тем более велик, чем меньше кислотность; при кислотности большей, чем кислотность нормального раствора  -ионов
-ионов  водородный показатель отрицателен и алгебраически тем более мал, чем больше кислотность.
водородный показатель отрицателен и алгебраически тем более мал, чем больше кислотность.
Опыт показывает, что концентрация  -ионов в химически чистой воде при комнатной температуре соответствует значению 7, т. е. концентрация
-ионов в химически чистой воде при комнатной температуре соответствует значению 7, т. е. концентрация  -ионов рана
-ионов рана  нормального раствора ионов. Такова же, конечно, и концентрация ионов
нормального раствора ионов. Такова же, конечно, и концентрация ионов  Если испытуемая жидкость имеет еще меньшую концентрацию
Если испытуемая жидкость имеет еще меньшую концентрацию  -ионов (водородный показатель больше 7), то это свидетельствует о щелочной реакции жидкости.
-ионов (водородный показатель больше 7), то это свидетельствует о щелочной реакции жидкости.
Для измерения водородных показателей пользуются также наборами органических красок, обладающих свойством изменять оттенок в определенном для каждой краски относительно узком интервале значений водородного показателя.
Например, лакмус меняет свой цвет из красного в синий через разные оттенки фиолетового при изменении водородного показателя от 6 до 8.
При этих и других подобных измерениях и работах приходится часто иметь дело со стандартными растворами, водородный показатель которых точно известен. Приготовлять их не всегда легко.
Чрезвычайно трудно приготовить, например, химически чистую воду, водородный показатель которой был бы действительно равен 7. Если бы она и была приготовлена, то при первом соприкосновении с воздухом она поглотила бы углекислоту, и водородный показатель резко понизился бы. Но можно приготовить растворы, водородный показатель которых сохраняется даже при некотором нарушении первоначального состава раствора благодаря определенным регулирующим его химическим реакциям.
| << Предыдущий параграф | Следующий параграф >> |
- ЧАСТЬ ТРЕТЬЯ. УЧЕНИЕ ОБ ЭЛЕКТРИЧЕСТВЕ
- § 2. Количество электричества. Закон Кулона
- § 3. Атомное строение электричества
- § 4. Напряженность электрического поля
- § 5. Теорема Острогдадского — Гаусса
- § 6. Вектор электрической индукции
- § 7. Примеры применения теоремы Остроградского — Гаусса
- § 8. Потенциал электрического поля
- § 9. Формулы электростатики в практической системе единиц
- ГЛАВА II. ПРОВОДНИКИ В ЭЛЕКТРИЧЕСКОМ ПОЛЕ
- § 10. Распределение электричества по поверхностй заряженных проводников
- § 11. Электризация проводников в поле и деформация поля проводниками
- § 12. Контактная разность потенциалов
- § 13. Электроемкость
- § 14. Расчет электроемкости конденсаторов
- § 15. Электрическая энергия
- § 16. Энергия поля
- § 17. Электрометры
- § 18. О природе электрических явлений
- ГЛАВА III. ДИЭЛЕКТРИКИ В ЭЛЕКТРИЧЕСКОМ ПОЛЕ
- § 19. Дипольная и электронная поляризация диэлектриков. Сегнетоэлектрики
- § 20. Деформация поля диэлектриками
- § 21. Электрическая восприимчивость
- § 22. Электронная теория диэлектриков
- § 23. Пьезоэлектрические и пироэлектрические явления
- § 24. Электроконвекционные явления (электрофорез, электроэндосмос и др.)
- ГЛАВА IV. ПОСТОЯННЫЙ ТОК
- § 25. Величина тока. Электродвижущая сила и напряжение
- § 26. Закон Ома. Законы Кирхгофа
- § 27. Закон Джоуля — Ленца
- § 28. Дифференциальная форма законов Ома и Джоуля — Ленца. Соотношение аналогии между проводимостью и емкостью
- ГЛАВА V. ТОК В МЕТАЛЛАХ
- § 29. Сведения об электропроводности. Термометры сопротивления, болометры, тензометры
- § 30. Закон Видемана — Франца. Теория электропроводности металлов
- § 31. Сверхпроводимость
- § 32. Термоэлектрические явления и их применение
- § 33. Зависимость термоэлектродвижущей силы от температуры спаев. Явление Пельтье
- ГЛАВА VI. ТОК В ПОЛУПРОВОДНИКАХ
- § 34. Полупроводники
- § 35. Понятие о зонной теории электропроводности
- § 36. Применения полупроводников
- ГЛАВА VII. ТОК В ЭЛЕКТРОЛИТАХ
- § 37. Электролиз. Законы Фарадея. Электрохимические эквиваленты. Потенциалы разложения
- § 38. Вторичные реакции на электрэдах. Применения электролиза
- § 39. Подвижность ионов и электропроводность растворов
- § 40. Гальванические элементы. Электрохимическая природа коррозии
- § 41. Электродные потенциалы
- § 42. Аккумуляторы
- § 43. Свободная энергия гальванической цепи. Концентрационные элементы
- ГЛАВА VIII. ТОК В ГАЗАХ
- § 44. Ионизация и электропроводность газов
- § 45. Типы и механизм разряда в газах
- § 46. Катодные и анодные лучи
- § 47. Тлеющий разряд
- § 48. Дуговой разряд
- § 49. Искровой разряд. Молния
- ГЛАВА IX. ТОК ЭЛЕКТРОННОЙ ЭМИССИИ. ЭЛЕКТРОННЫЕ ЛАМПЫ
- § 50. Термоэлектронная эмиссия. Формула Ричардсона — Дёшмена
- § 51. Торможение электронного потока. Рентгеновы трубки
- § 52. Пустотные выпрямители тока (диоды, кенотроны)
- § 53. Усилительные электронные лампы (триоды)
- § 54. Фотоэлектрический эффект. Фотоэлементы. Фотореле
- § 55. Вторичная электронная эмиссия. Электронные умножители
- § 56. Динатронный эффект. Экранированные радиолампы
- ГЛАВА X. МАГНИТНОЕ ПОЛЕ
- § 57. Исторические сведения. Закон Кулона для магнитных полюсов
- § 58. Магнитные величины и соотношения, аналогичные электрическим
- § 59. Магнитное поле Земли
- § 60. Магнитное поле тока
- § 61. Закон Био и Савара
- § 62. Магнитодвижущая сила. Поток индукции электромагнита
- § 63. Магнитные свойства веществ и их использование
- § 64. Электронная теория магнетизма
- ГЛАВА XI. ДЕЙСТВИЕ МАГНИТНОГО ПОЛЯ НА ТОК
- § 65. Формула Ампера и ее трактовка по Фарадею
- § 66. Работа, производимая током при перемещении проводника в магнитном поле. Электромоторы
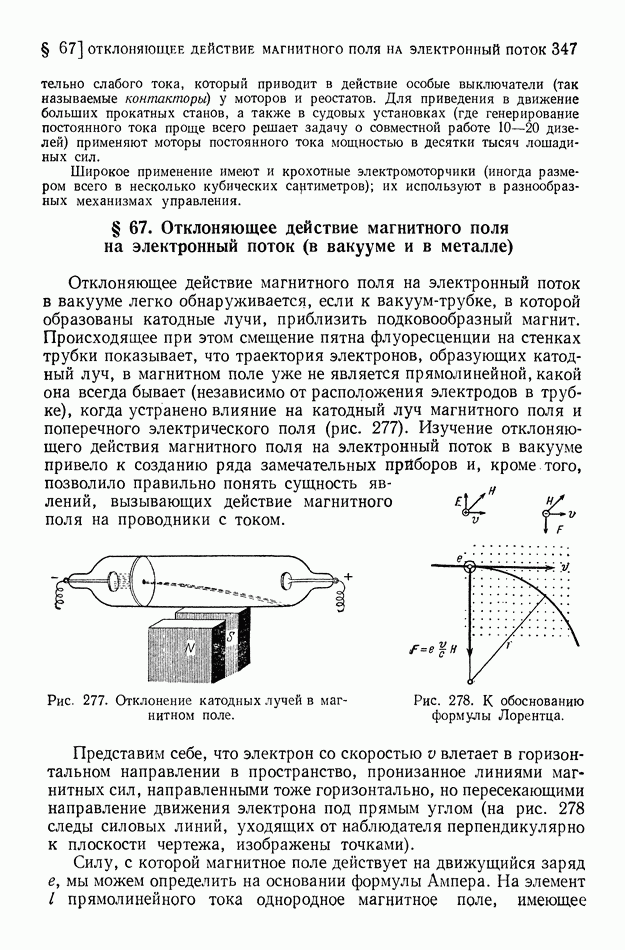
- § 67. Отклоняющее действие магнитного поля на электронный поток (в вакууме и в металле)
- § 68. Электродинамические измерительные приборы. Гальванометры, Осциллографы
- § 69. Формулы электродинамики в практической системе единиц
- ГЛАВА XII. ЭЛЕКТРОМАГНИТНАЯ ИНДУКЦИЯ. ЭЛЕКТРОМАГНИТНОЕ ПОЛЕ
- § 70. Понятие об электромагнитном поле. Электромагнитная индукция
- § 71. Закон Ленца. Картина электромагнитного поля по Фарадею
- § 72. Закон Фарадея. Индукционное измерение магнитного потока и магнитодвижущей силы. Вихревые токи
- § 73. Явление самоиндукции. Индуктивность. Законы нарастания и спада тока при включении и выключении цепи
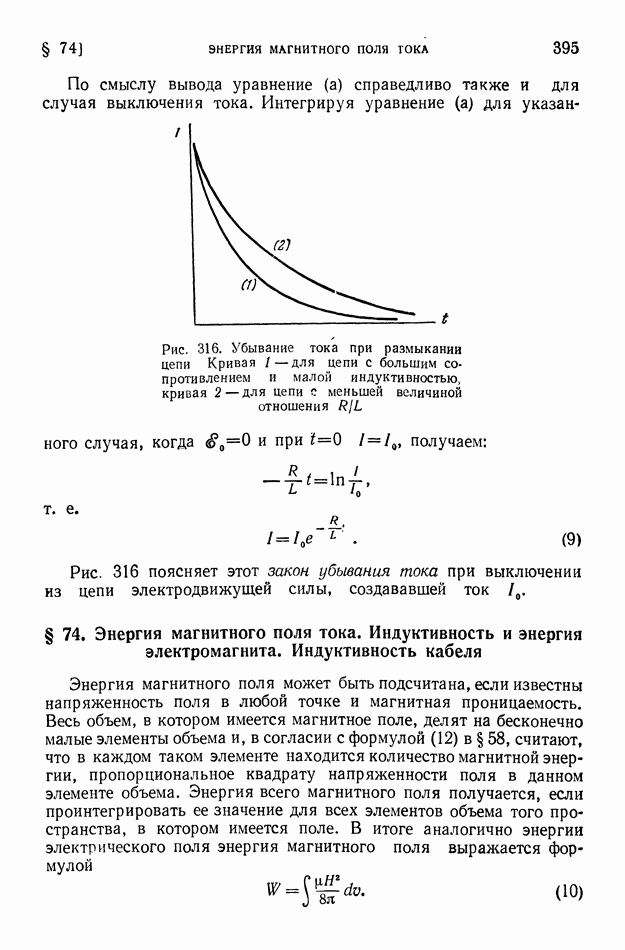
- § 74. Энергия магнитного поля тока. Индуктивность и энергия электромагнита. Индуктивность кабеля
- § 75. Взаимная индуктивность. Энергия взаимодействия токов. Коэффициент взаимной индукции катушек с общим сердечником
- § 76. Уравнения Максвелла и уравнения Лорентца
- § 77. Электромагнитное происхождение массы электрона
- ГЛАВА XIII. ПЕРЕМЕННЫЙ ТОК
- § 78. Генерирование переменного тока
- § 79. Работа генератора электрической энергии на нагрузку Эффективные значения напряжения и величины тока
- § 80. Емкостное сопротивление и индуктивное сопротивление
- § 81. Активные и реактивные токи. Коэффициент мощности (cos f). Потери (tg b)
- § 82. Обобщенный закон Ома
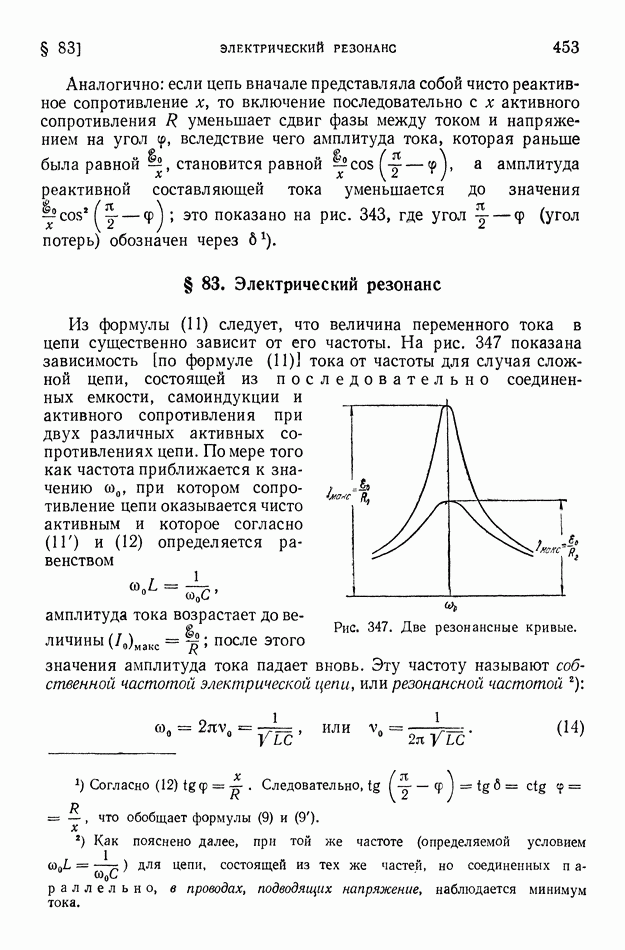
- § 83. Электрический резонанс
- § 84. Трансформация тока
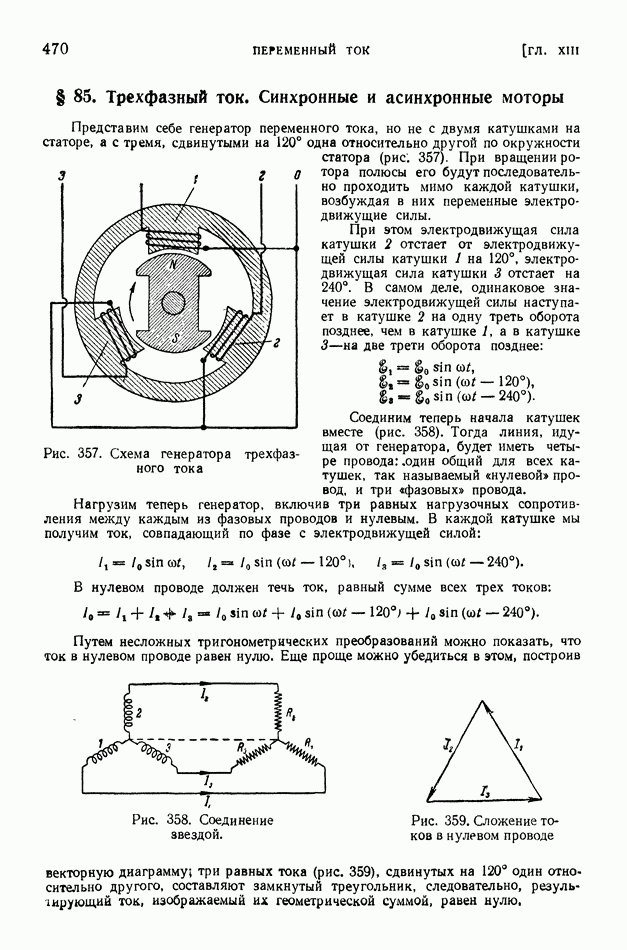
- § 85. Трехфазный ток. Синхронные и асинхронные моторы
- ГЛАВА XIV. ЭЛЕКТРИЧЕСКИЕ КОЛЕБАНИЯ И ИХ ПРИМЕНЕНИЕ
- § 86. Индуктор
- § 87. Колебательный контур
- § 88. Вибратор Герца (возбуждение колебательного контура индуктором). Токи Тесла
- § 89. Электромагнитные волны. Вектор Умова — Пойнтинга
- § 90. Излучение электрического диполя. Волны в двухпроводной линии. Антенны
- § 91. Распространение электромагнитных волн. Роль ионосферы. «Радиоокно» в космос
- § 92. Ламповые генераторы электрических колебаний
- § 93. Модуляция электрических колебаний
- § 94. Прием, детектирование и усиление радиосигналов. Супергетеродины
- § 95. Преобразование звуковых колебаний в электрические и электрических в звуковые. Электрозапись и воспроизведение звука
- § 96. Телевидение
- § 97. Сантиметровые волны и их распространение в волноводах
- § 98. Радиолокация. Генерирование ультракоротких волн (клистроны и магнетроны)