| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
§ 2. НЕОБХОДИМОСТЬ «МНОГОЭЛЕКТРОННОЙ ТЕОРИИ»
Квантовая химия основывается на орбиталях: достаточно упомянуть метод Гайтлера — Лондона (Н. L.) или метод молекулярных орбиталей (МО).
Рассматривая какую-либо проблему, можно с равным правом применять оба метода; и если мы внесем достаточное количество поправок, то придем к эквивалентным результатам. Метод Гайтлера — Лондона оказывается весьма громоздким для больших молекул, особенно при применении в теории спектров. Наилучшими молекулярными орбиталями являются орбитали, полученные с помощью метода Хартри - Фока [1], который дает уравнение для волновой функции каждого электрона в самосогласованном среднем поле всех других электронов. В качестве исходных мы возьмем хартрифоковские молекулярные орбитали  или же аппроксимации к ним, например молекулярные орбитали — линейные комбинации атомных орбиталей
или же аппроксимации к ним, например молекулярные орбитали — линейные комбинации атомных орбиталей  Это приведет к максимальному упрощению теории остающихся эффектов.
Это приведет к максимальному упрощению теории остающихся эффектов.
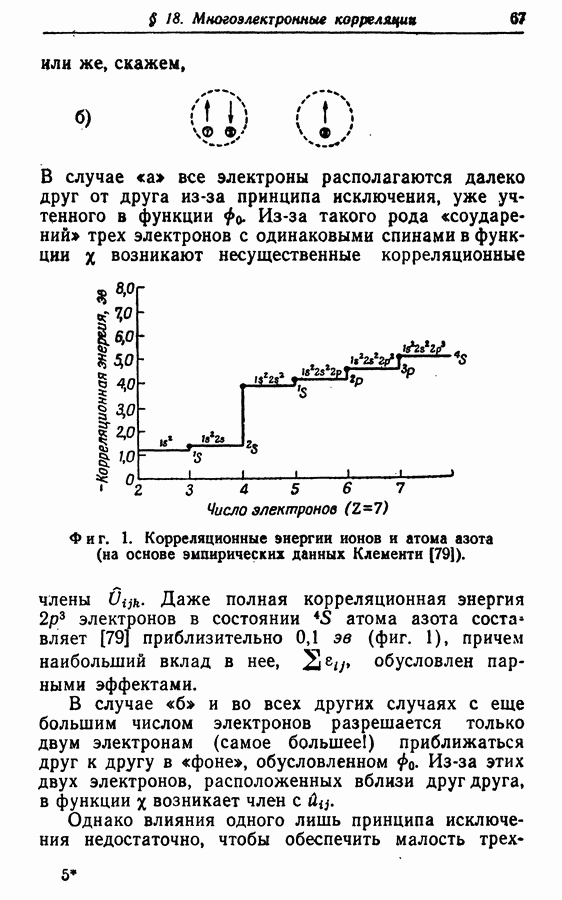
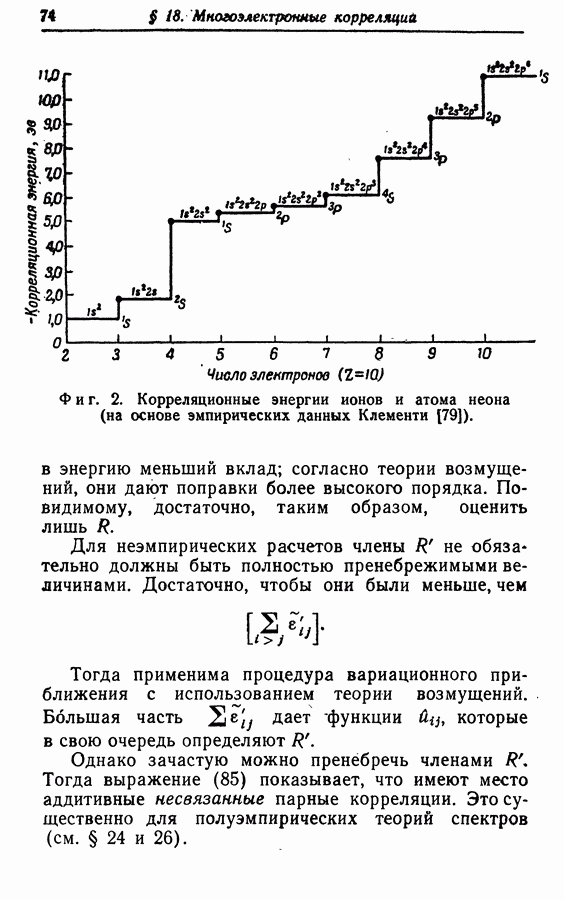
В орбиталях не учитываются одновременные отталкивания — «столкновения» — между электронами. Результирующая ошибка, т. е. «разница между точной нерелятивистской энергией и хартрифоковской энергией» многоэлектронной системы, определяется как «корреляционная энергия» [1]. Как подчеркнули Лёвдин [1] и Питцер [2], этиошибки по величине сравнимы с энергией, которой мы интересуемся. По этой причине, по-видимому, нам придется иметь дело со сложной многоэлектронной проблемой и отказаться от приближения с помощью орбиталей. Однако по двум причинам ситуация не настолько плоха, как может показаться на первый взгляд. Во-первых, на некоторые свойства, например на распределения заряда, корреляция влияет гораздо слабее, нежели на разности энергий. Во-вторых, принцип исключения и влияние атомного остова приводят к тому, что, несмотря на большой радиус кулоновского отталкивания, в каждый момент «сталкиваются» в основном два электрона. «Многоэлектронная» проблема в таком случае представляет собой в действительности ряд «малоэлектронных» проблем.
Электронная корреляция ответственна за следующие эффекты;
1. Ошибку приблизительно от 1 до  на дважды занятое хартри-фоковское состояние. Например, для
на дважды занятое хартри-фоковское состояние. Например, для  состояния в Не ошибка составляет
состояния в Не ошибка составляет  для
для  равновесном межатомном расстоянии
равновесном межатомном расстоянии  и для
и для  Относительная ошибка сравнима с энергией связи, например, в
Относительная ошибка сравнима с энергией связи, например, в 
2. «Поляризацию остова» валентными электронами. Так, например,  -электрон мгновенно поляризует сигма-остов; подобные же эффекты вызывают сдвиг уровней в спектрах щелочей. Такого рода
-электрон мгновенно поляризует сигма-остов; подобные же эффекты вызывают сдвиг уровней в спектрах щелочей. Такого рода  -корреляция в литии составляет около
-корреляция в литии составляет около 
3. Если при вычислении энергии диссоциации использовать для всех межъядерных расстояний  потенциальную кривую
потенциальную кривую  -состояния молекулы
-состояния молекулы  полученную методом Хартри — Фока, то это приведет к ошибке, составляющей около
полученную методом Хартри — Фока, то это приведет к ошибке, составляющей около  Если одну и ту же электронную конфигурацию рассматривать в рамках метода Хартри — Фока как при больших
Если одну и ту же электронную конфигурацию рассматривать в рамках метода Хартри — Фока как при больших  так и вблизи равновесного значения
так и вблизи равновесного значения  то окажется, что большинство молекул будет диссоциировать в неверные состояния (см. пример с
то окажется, что большинство молекул будет диссоциировать в неверные состояния (см. пример с  работа [5]).
работа [5]).
4. Зачастую для электронных спектров, например, для которых правила Хунда выполняются, хартри-фоковские молекулярные орбитали приводят к правильной схеме уровней. Каждый уровень, однако, оказывается сдвинутым вверх на величину ошибок корреляции («адиабатические» сдвиги уровней).
5. «Почти вырождение», или «резонанс», между конфигурациями может изменить схему уровней, даваемую методом Хартри — Фока, что проявляется в нарушении правил Хунда, например, в случае  уровней
уровней  [55]. Такие «неадиабатические» сдвиги уровней возникают из-за эффектов «конфигурационного взаимодействия
[55]. Такие «неадиабатические» сдвиги уровней возникают из-за эффектов «конфигурационного взаимодействия  первого порядка»
первого порядка»  Эффект, описанный в п. 3, такого же типа.
Эффект, описанный в п. 3, такого же типа.
6. Вандермальсово притяжение лондоновского дисперсионного типа, например, между двумя  аргона или между двумя концами
аргона или между двумя концами  -бутана является строго корреляционным эффектом [2]. Такие взаимодействия имеют порядок
-бутана является строго корреляционным эффектом [2]. Такие взаимодействия имеют порядок  Корреляцию между различными оболочками атома или молекулы (описанные в п. 2) можно также рассматривать как «вандерваальсово» притяжение.
Корреляцию между различными оболочками атома или молекулы (описанные в п. 2) можно также рассматривать как «вандерваальсово» притяжение.
7. В металлах и высокосопряженных молекулах красителей многие электроны коррелируют одновременно и ведут себя как «электронный газ» с коллективными эффектами экранировки и колебаний [7].
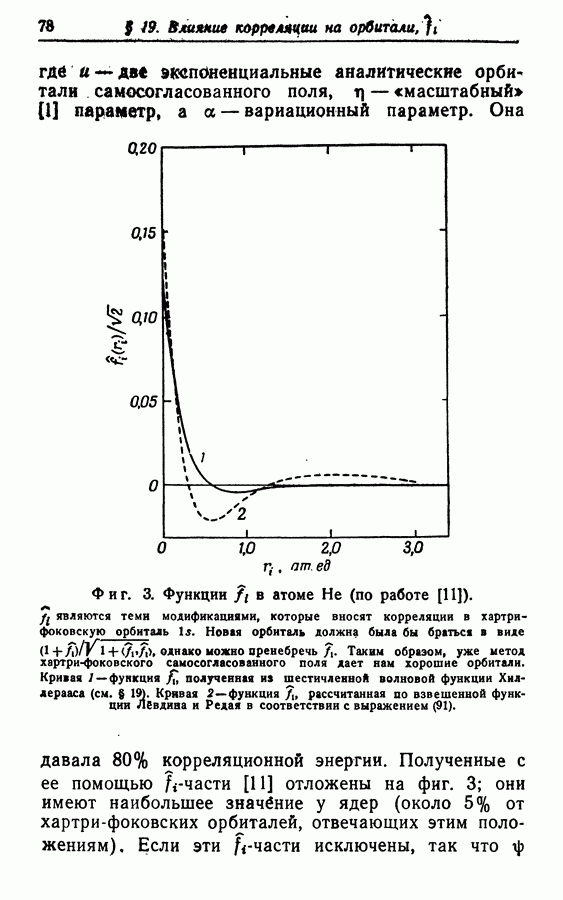
8. При обосновании применимости самих орбиталей в качественных вопросах квантовой химии важно выяснить, меняет ли корреляция хартри-фоковские орбитали? То есть являются ли орбитали (полученные с учетом корреляционных эффектов) лучшим приближением к точной волновой функции, нежели, хартри-фоковские молекулярные орбитали?
Чтобы разобраться в эффектах, перечисленных выше, необходимо изучить электронную корреляцию.
Лёвдин [1] сделал обзор состояния теории вплоть до 1959 г., акцентируя внимание на методах, которые давали высокую точность для двухэлектронных систем. Питцер [2] рассмотрел корреляцию между неперекрывающимися оболочками электронов и дал полуэмпирическую оценку меж- и внутримолекулярных притяжений Лондона — ван дер Ваальса.
Данная работа представляет собой обзор «многоэлектронной теории», развитой за последние несколько лет [8—12]. Сходные приближения обсуждаются по ходу дела. Предварительное рассмотрение принятых полу- и неэмпирических схем делают ясным цели и причины специфического направления атаки, выбранного «многоэлектронной теорией».
| << Предыдущий параграф | Следующий параграф >> |
- ОТ РЕДАКТОРА ПЕРЕВОДА
- § 1. ВВЕДЕНИЕ
- § 2. НЕОБХОДИМОСТЬ «МНОГОЭЛЕКТРОННОЙ ТЕОРИИ»
- § 3. ПОЛУЭМПИРИЧЕСКИЕ ТЕОРИИ
- § 4. НЕЭМПИРИЧЕСКИЕ ТЕОРИИ
- § 5. СХЕМА ПОСТРОЕНИЯ «МНОГОЭЛЕКТРОННОЙ ТЕОРИИ»
- § 6. ОРБИТАЛИ
- § 7. АНТИСИММЕТРИЯ И ОТНОСИТЕЛЬНЫЕ ЭЛЕКТРОННЫЕ РАСПРЕДЕЛЕНИЯ
- § 8. УРАВНЕНИЯ ХАРТРИ — ФОКА
- § 9. ТОЧНАЯ МНОГОЭЛЕКТРОННАЯ ВОЛНОВАЯ ФУНКЦИЯ
- § 10. ОРТОГОНАЛЬНОСТЬ ОРБИТАЛЕЙ
- § 11. НЕСВЯЗАННЫЕ КОМПЛЕКСЫ
- § 12. ВАРИАЦИОННЫЙ ПРИНЦИП И ТОЧНАЯ ЭНЕРГИЯ
- § 13. РАЗЛИЧНЫЕ КОРРЕЛЯЦИОННЫЕ ЭФФЕКТЫ В ТОЧНОЙ ВОЛНОВОЙ ФУНКЦИИ И ЭНЕРГИИ
- § 14. ВАРИАЦИОННЫЙ ПОДХОД, ИСПОЛЬЗУЮЩИЙ ТЕОРИЮ ВОЗМУЩЕНИЙ
- § 15. РАЗЛИЧНЫЕ ТЕОРИИ МНОГИХ ЧАСТИЦ
- § 16. ВОЛНОВАЯ ФУНКЦИЯ «МНОГОЭЛЕКТРОННОЙ ТЕОРИИ»
- § 17. ВАРИАЦИОННАЯ ЭНЕРГИЯ «МНОГОЭЛЕКТРОННОЙ ТЕОРИИ»
- § 18. МНОГОЭЛЕКТРОННЫЕ КОРРЕЛЯЦИИ
- § 19. ВЛИЯНИЕ КОРРЕЛЯЦИИ НА ОРБИТАЛИ
- § 20. НЕЗАМКНУТЫЕ ОБОЛОЧКИ
- § 21. ПОЧТИ ВЫРОЖДЕННЫЕ СОСТОЯНИЯ
- § 22. ПАРНЫЕ КОРРЕЛЯЦИИ
- § 23. СВОЙСТВА СИММЕТРИИ
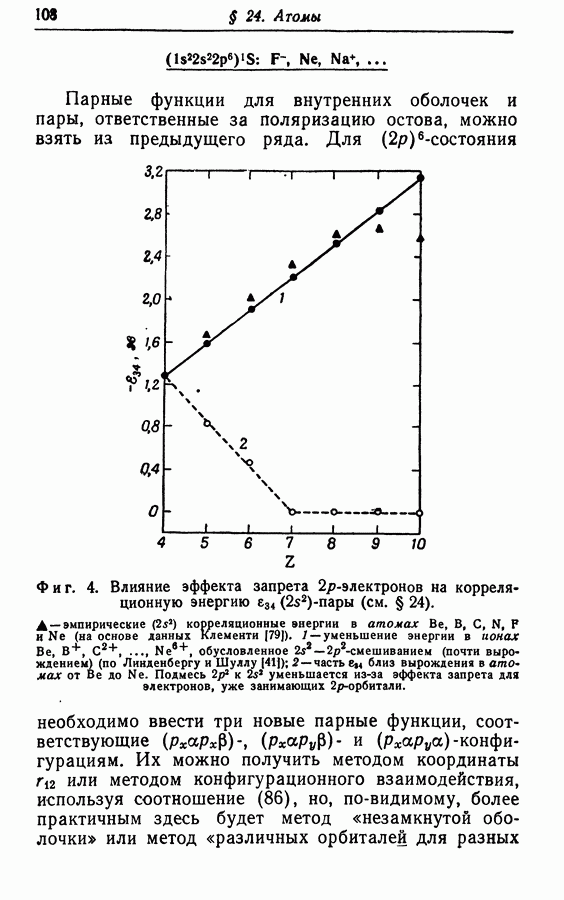
- § 24. АТОМЫ
- § 25. МАЛЫЕ МОЛЕКУЛЫ
- § 26. «пи»-ЭЛЕКТРОННЫЕ СИСТЕМЫ
- § 27. СВЯЗИ-ЛОКАЛИЗАЦИЯ, ОТДЕЛЬНЫЕ ПАРЫ, ИОННЫЕ ОСТОВЫ
- § 28. ВАНДЕРВААЛЬСОВЫ ПРИТЯЖЕНИЯ
- § 29. РЕЛЯТИВИСТСКИЕ ЭФФЕКТЫ
- § 30. ЗАКЛЮЧЕНИЕ
- ДОПОЛНЕНИЕ АВТОРА