| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
§ 6. Растворы. Электролитическая диссоциация. Гидролиз солей
Растворы
Растворами называются гомогенные (однородные) системы, содержащие не менее двух веществ. Согласно этому определению, могут существовать растворы твердых, жидких и газообразных веществ в жидких растворителях, а также однородные смеси (растворы) твердых, жидких и газообразных веществ. Наибольшее значение имеют жидкие смеси, в которых растворителем является жидкость. Поэтому в дальнейшем мы будем рассматривать только такие системы.
В процессе растворения частицы (ионы или молекулы) растворяемого вещества под действием хаотически движущихся частиц растворителя переходят в раствор, образуя качественно новую однородную систему.
Способность к образованию растворов выражена у разных веществ в различной степени. Одни вещества способны смешиваться друг с другом в любых количествах (вода и спирт), другие — в ограниченных количествах (хлорид натрия и вода).
По соотношению преобладания числа частиц, переходящих в раствор и удаляющихся из раствора, различают растворы насыщенные, ненасыщенные и пересыщенные. С другой стороны, по относительным количествам растворенного вещества и растворителя растворы подразделяют на разбавленные и концентрированные.
Раствор, в котором данное вещество при данной температуре больше не растворяется, т.е. раствор, находящийся в равновесии с растворяемым веществом, называют насыщенным, а раствор, в котором еще можно растворить добавочное количество данного вещества, — ненасыщенным.
Отношение массы вещества, образующего насыщенный раствор при данной температуре, к массе растворителя называют растворимостью этого вещества или коэффициентом растворимости.
Растворимость веществ существенно зависит от природы растворяемого вещества и растворителя, температуры и давления. Причины различной растворимости веществ до конца не выяснены, хотя их связывают с характером взаимодействия молекул растворителя и растворенного вещества. Например, известно, что молекулярные кристаллы, структурными единицами которых являются молекулы с ковалентным неполярным типом связи (сера и др.), практически нерастворимы в воде, так как энергия разрушения кристаллической решетки настолько велика, что не может быть компенсирована теплотой сольватации, которая очень мала.
Еще до обоснования теории растворов опытным путем было установлено правило, согласно которому подобное растворяется в подобном. Так, вещества с ионным (соли, щелочи) или полярным (спирты, альдегиды) типом связи хорошо растворимы в полярных растворителях, в первую очередь в воде. И наоборот, растворимость кислорода в бензоле, например, на порядок выше, чем в воде, так как молекулы  неполярны.
неполярны.
Для подавляющего большинства твердых тел растворимость увеличивается с повышением температуры. Если раствор, насыщенный при нагревании, осторожно охладить так, чтобы не выделялись кристаллы соли, то образуется пересыщенный раствор.
Пересыщенным называют раствор, в котором при данной температуре содержится большее количество растворенного вещества, чем в насыщенном растворе. Пересыщенный раствор неустойчив, и при изменении условий (при встряхивании или внесении в раствор затравки для кристаллизации) выпадает осадок, над которым остается насыщенный раствор.
В отличие от твердых тел, растворимость газов в воде с повышением температуры уменьшается, что обусловлено непрочностью связи между молекулами растворенного вещества и растворителя. Другой важной закономерностью, описывающей растворимость газов в жидкостях, является закон Генри:
Растворимость газа прямо пропорциональна его давлению над жидкостью.
Способы выражения концентрации растворов.
Концентрация растворов определяется количеством вещества, заключенным в определенном объеме (или определенной массе) раствора или растворителя в зависимости от того, что выбрано в качестве меры измерения.
Жидкости удобнее измерять по объему, а не по массе, поэтому химики чаще всего используют объемные концентрации и, в первую очередь, молярную концентрацию.
Молярная концентрация (молярность) — это число молей растворенного вещества, содержащееся в 1 литре раствора:

Для различных практических расчетов широко используются также массовые концентрации.
Массовая доля вещества — это отношение массы растворенного вещества к общей массе раствора:

Массовую долю обычно выражают в долях единицы. Не следует смешивать растворимость веществ и массовую долю растворенного вещества. Растворимость вещества показывает, сколько вещества может раствориться в 100 г растворителя.
Единицей растворимости является грамм на 100 г растворителя. Массовая доля растворенного вещества показывает долю этого вещества, содержащуюся в растворе, и является безразмерной величиной.
Иногда массовую долю растворенного вещества выражают не в долях единицы, а в процентах (процентная концентрация).
| << Предыдущий параграф | Следующий параграф >> |
- ВВЕДЕНИЕ
- Глава I. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИИ
- § 1. Предмет химии. Важнейшие понятия и законы химии
- Основные стехиометрические законы химии
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 2. Строение атома
- Электронные конфигурации атомов
- Ядро атома и радиоактивные превращения
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 3. Строение молекул. Химическая связь. Валентность элементов
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 4. Агрегатные состояния вещества
- Характерные свойства газов, жидкостей и твердых тел
- Газообразное состояние. Газовые законы
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 5. Закономерности протекания химических реакций
- Химическая кинетика
- Химическое равновесие
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 6. Растворы. Электролитическая диссоциация. Гидролиз солей
- Электролиты и электролитическая диссоциация
- Гидролиз солей
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 7. Классификация химических реакций. Окислительно-восстановительные процессы. Электролиз
- Окислительно-восстановительные реакции
- Электролиз
- ЗАДАЧИ И УПРАЖНЕНИЯ
- Глава II. НЕОРГАНИЧЕСКАЯ ХИМИЯ
- § 8. Номенклатура, классификация неорганических веществ. Свойства и способы получения
- Оксиды
- Основания (гидроксиды металлов)
- Кислоты
- Соли
- § 9. Водород. Галогены и их соединения
- Галогены и их соединения
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 10. Подгруппа кислорода
- Сера и ее соединения
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 11. Подгруппа азота
- Фосфор и его соединения
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 12. Подгруппа углерода
- Углерод и его соединения
- Кремний и его соединения
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 13. Свойства s-элементов (щелочных и щелочноземельных металлов) и их соединений
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 14. Алюминий — типичный р-металл
- Соединения алюминия и их свойства
- ЗАДАЧИ И УПРАЖНЕНИЯ
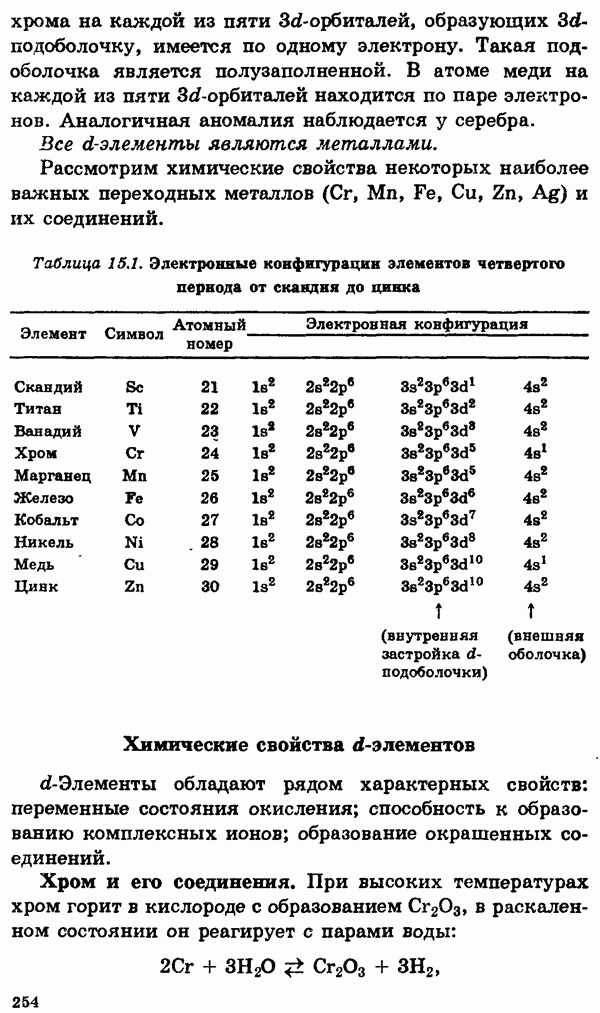
- § 15. Главные переходные металлы (d-элементы) и их соединения
- Химические свойства d-элементов
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 16. Задачи для повторения по неорганической химии
- Глава III. ОРГАНИЧЕСКАЯ ХИМИЯ
- § 17. Основные понятия и закономерности в органической химии. Предмет органической химии
- Классификация и номенклатура органических соединений
- Изомерия органических соединений
- Взаимное влияние атомов в молекуле и реакционная способность органических соединений
- Общая характеристика органических реакций
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 18. Предельные (насыщенные) углеводороды
- Циклоалканы
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 19. Алкены. Диеновые углеводороды
- Диеновые углеводороды (алкадиены)
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 20. Алкины
- ЗАДАЧИ И УПРАЖНЕНИЯ
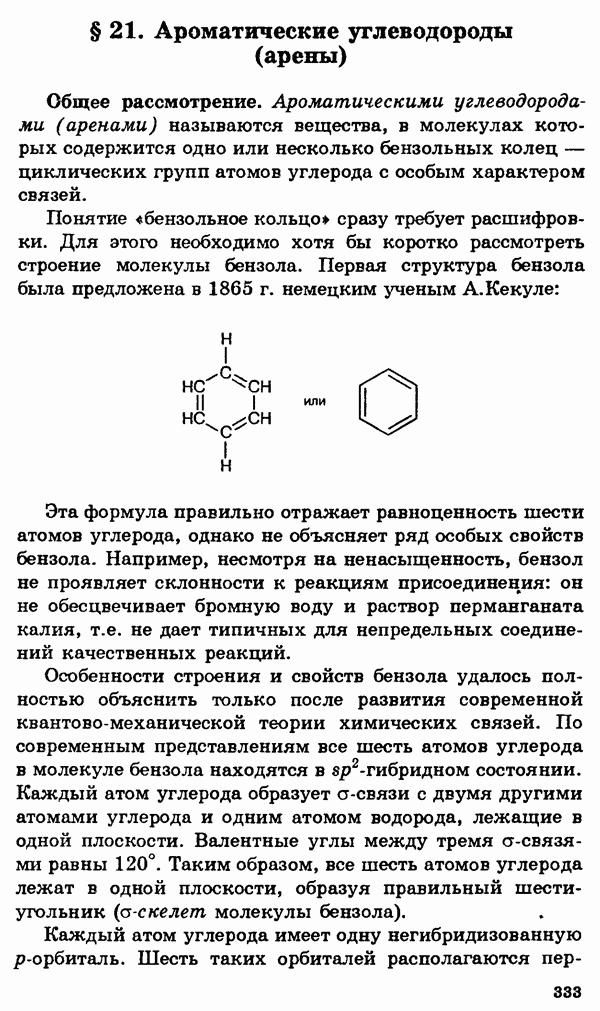
- § 21. Ароматические углеводороды (арены)
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 22. Спирты и фенолы
- Многоатомные спирты
- Фенолы
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 23. Карбонильные соединения — альдегиды и кетоны
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 24. Карбоновые кислоты. Сложные эфиры. Жиры
- Сложные эфиры. Жиры
- ЗАДАЧИ И УПРАЖНЕНИЯ
- Глава 4. ОСНОВНЫЕ ПРИЕМЫ РЕШЕНИЯ ЗАДАЧ
- Определение молекулярной формулы веществ
- Определение состава и разделение смесей
- Задачи на газовые законы
- Способы выражения концентрации растворов
- Ионные реакции в растворах
- Задачи на окислительно-восстановительные реакции
- Разные задачи
- ПРОГРАММА ПО ХИМИИ ДЛЯ ПОСТУПАЮЩИХ В УНИВЕРСИТЕТЫ
- ОТВЕТЫ
- Рекомендуемая литература