| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
Сера и ее соединения
Свойства серы.
Известно несколько аллотропных модификаций серы — сера ромбическая, моноклинная, пластическая. Наиболее устойчивой модификацией является ромбическая сера, в нее самопроизвольно через некоторое время превращаются все остальные модификации.
Сера может отдавать свои электроны при взаимодействии с более сильными окислителями:

В этих реакциях сера является восстановителем.
Нужно подчеркнуть, что оксид серы (VI) может образовываться только в присутствии  или
или  и высоком давлении (см. ниже).
и высоком давлении (см. ниже).
При взаимодействии с металлами сера проявляет окислительные свойства:

С большинством металлов сера реагирует при нагревании, но в реакции со ртутью взаимодействие происходит уже при комнатной температуре.
Это обстоятельство используется в лабораториях для удаления разлитой ртути, пары которой являются сильным ядом.
Сероводород, сероводородная кислота, сульфиды.
При нагревании серы с водородом происходит обратимая реакция

с очень малым выходом сероводорода  . Обычно
. Обычно  получают действием разбавленных кислот на сульфиды:
получают действием разбавленных кислот на сульфиды:

Сероводород  — бесцветный газ с запахом тухлых яиц, ядовит. Один объем воды при обычных условиях растворяет 3 объема сероводорода.
— бесцветный газ с запахом тухлых яиц, ядовит. Один объем воды при обычных условиях растворяет 3 объема сероводорода.
Сероводород — типичный восстановитель. В кислороде он сгорает (см. выше). Раствор сероводорода в воде представляет собой очень слабую сероводородную кислоту, которая диссоциирует ступенчато и в основном по первой ступени:

Сероводородная кислота так же, как и сероводород, — типичный восстановитель.
Сероводородная кислота окисляется не только сильными окислителями, например хлором,

но и более слабыми, например сернистой кислотой

или ионами трехвалентного железа:

Сероводородная кислота может реагировать с основаниями, основными оксидами или солями, образуя два ряда солей: средние — сульфиды, кислые — гидросульфиды.
Большинство сульфидов (за исключением сульфидов щелочных и щелочноземельных металлов, а также сульфида аммония) плохо растворимо в воде. Сульфиды, как соли очень слабой кислоты, подвергаются гидролизу.
Оксид серы (IV). Сернистая кислота.
SO2 образуется при сжигании серы в кислороде или при обжиге сульфидов; это бесцветный газ с резким запахом, хорошо растворим в воде (40 объемов в 1 объеме воды при 20 °С).
Оксид серы (IV) — ангидрид сернистой кислоты  поэтому при растворении
поэтому при растворении  в воде частично происходит реакция с водой и образуется слабая сернистая кислота:
в воде частично происходит реакция с водой и образуется слабая сернистая кислота:

которая малоустойчива, легко распадается вновь на  . В водном растворе сернистого газа одновременно существуют следующие равновесия:
. В водном растворе сернистого газа одновременно существуют следующие равновесия:

Константа диссоциации  по первой ступени равна
по первой ступени равна  по второй —
по второй —  Являясь двухосновной кислотой, она дает два ряда солей: средние — сульфиты и кислые — гидросульфиты.
Являясь двухосновной кислотой, она дает два ряда солей: средние — сульфиты и кислые — гидросульфиты.
Химические реакции, характерные для  сернистой кислоты и ее солей, можно разделить на три группы:
сернистой кислоты и ее солей, можно разделить на три группы:
1. Реакции, протекающие без изменения степени окисления, например:

2. Реакции, сопровождающиеся повышением степени окисления серы от  до
до  например:
например:

3. Реакции, протекающие с понижением степени окисления серы, например уже отмеченное выше взаимодействие  .
.
Таким образом,  сернистая кислота и ее соли могут проявлять как окислительные, так и восстановительные
сернистая кислота и ее соли могут проявлять как окислительные, так и восстановительные
Оксид серы (VI). Серная кислота.
SO3 — ангидрид серной кислоты — вещество с 
Оксид серы (VI) получают окислением  кислородом только в присутствии катализатора:
кислородом только в присутствии катализатора:

Необходимость использования катализатора в этой обратимой реакции обусловлена тем, что хороший выход  (т.е. смещение равновесия вправо) можно получить только при понижении температуры, однако при низких температурах очень сильно падает скорость протекания реакции.
(т.е. смещение равновесия вправо) можно получить только при понижении температуры, однако при низких температурах очень сильно падает скорость протекания реакции.
Оксид серы (VI) энергично соединяется с водой, образуя серную кислоту:

SO3 очень хорошо растворяется в 100%-ной серной кислоте. Раствор  в такой кислоте называется олеумом.
в такой кислоте называется олеумом.
Серная кислота  — одно из самых важных веществ, находящих исключительно широкое применение в различных отраслях промышленности.
— одно из самых важных веществ, находящих исключительно широкое применение в различных отраслях промышленности.
При взаимодействии концентрированной серной кислоты с различными металлами, как правило, происходит ее восстановление до  Например:
Например:

Концентрированная серная кислота окисляет медь, серебро, углерод, фосфор:

Разбавленная серная кислота окисляет только металлы, стоящие в ряду напряжений левее водорода, за счет ионов  , например:
, например:

В заключение отметим, что из всех сульфатов наименьшей растворимостью обладает сульфат бария — именно поэтому его образование в виде белого осадка используют как качественную реакцию на сульфат-ион:

Рекомендуемая литература: [Кузьменко, 1977, гл. 13], [Третьяков, § 47—51], [Фримантл, т. 2, гл. 15.4], [Хомченко, 1993, гл. 9].
| << Предыдущий параграф | Следующий параграф >> |
- ВВЕДЕНИЕ
- Глава I. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИИ
- § 1. Предмет химии. Важнейшие понятия и законы химии
- Основные стехиометрические законы химии
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 2. Строение атома
- Электронные конфигурации атомов
- Ядро атома и радиоактивные превращения
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 3. Строение молекул. Химическая связь. Валентность элементов
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 4. Агрегатные состояния вещества
- Характерные свойства газов, жидкостей и твердых тел
- Газообразное состояние. Газовые законы
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 5. Закономерности протекания химических реакций
- Химическая кинетика
- Химическое равновесие
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 6. Растворы. Электролитическая диссоциация. Гидролиз солей
- Электролиты и электролитическая диссоциация
- Гидролиз солей
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 7. Классификация химических реакций. Окислительно-восстановительные процессы. Электролиз
- Окислительно-восстановительные реакции
- Электролиз
- ЗАДАЧИ И УПРАЖНЕНИЯ
- Глава II. НЕОРГАНИЧЕСКАЯ ХИМИЯ
- § 8. Номенклатура, классификация неорганических веществ. Свойства и способы получения
- Оксиды
- Основания (гидроксиды металлов)
- Кислоты
- Соли
- § 9. Водород. Галогены и их соединения
- Галогены и их соединения
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 10. Подгруппа кислорода
- Сера и ее соединения
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 11. Подгруппа азота
- Фосфор и его соединения
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 12. Подгруппа углерода
- Углерод и его соединения
- Кремний и его соединения
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 13. Свойства s-элементов (щелочных и щелочноземельных металлов) и их соединений
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 14. Алюминий — типичный р-металл
- Соединения алюминия и их свойства
- ЗАДАЧИ И УПРАЖНЕНИЯ
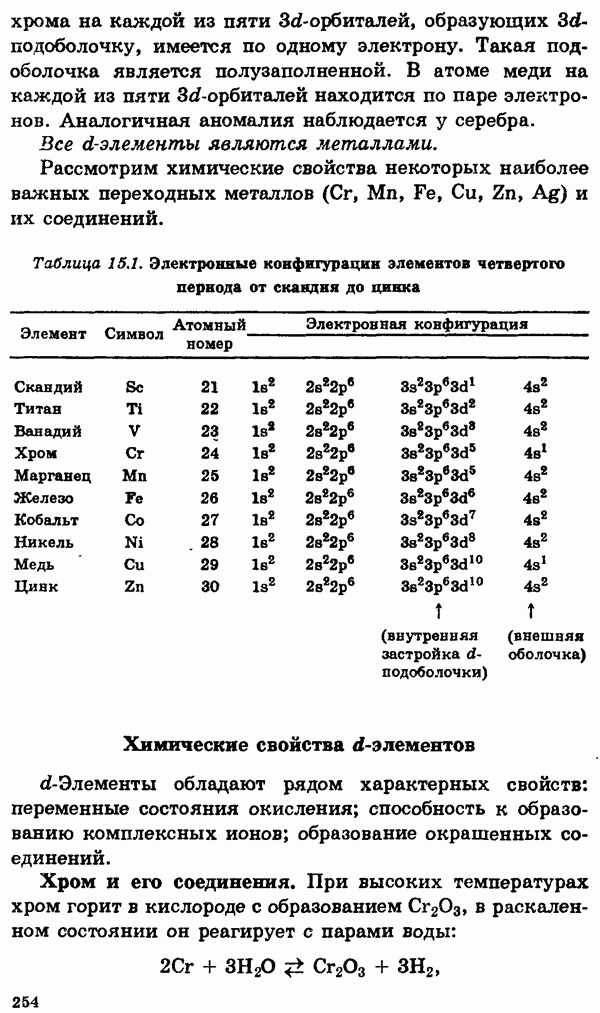
- § 15. Главные переходные металлы (d-элементы) и их соединения
- Химические свойства d-элементов
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 16. Задачи для повторения по неорганической химии
- Глава III. ОРГАНИЧЕСКАЯ ХИМИЯ
- § 17. Основные понятия и закономерности в органической химии. Предмет органической химии
- Классификация и номенклатура органических соединений
- Изомерия органических соединений
- Взаимное влияние атомов в молекуле и реакционная способность органических соединений
- Общая характеристика органических реакций
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 18. Предельные (насыщенные) углеводороды
- Циклоалканы
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 19. Алкены. Диеновые углеводороды
- Диеновые углеводороды (алкадиены)
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 20. Алкины
- ЗАДАЧИ И УПРАЖНЕНИЯ
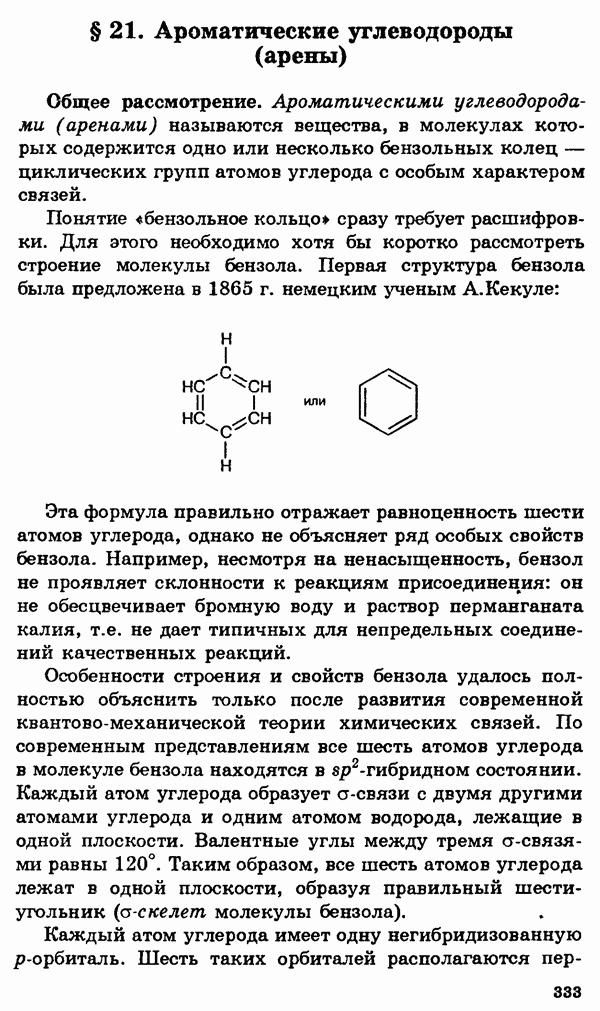
- § 21. Ароматические углеводороды (арены)
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 22. Спирты и фенолы
- Многоатомные спирты
- Фенолы
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 23. Карбонильные соединения — альдегиды и кетоны
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 24. Карбоновые кислоты. Сложные эфиры. Жиры
- Сложные эфиры. Жиры
- ЗАДАЧИ И УПРАЖНЕНИЯ
- Глава 4. ОСНОВНЫЕ ПРИЕМЫ РЕШЕНИЯ ЗАДАЧ
- Определение молекулярной формулы веществ
- Определение состава и разделение смесей
- Задачи на газовые законы
- Способы выражения концентрации растворов
- Ионные реакции в растворах
- Задачи на окислительно-восстановительные реакции
- Разные задачи
- ПРОГРАММА ПО ХИМИИ ДЛЯ ПОСТУПАЮЩИХ В УНИВЕРСИТЕТЫ
- ОТВЕТЫ
- Рекомендуемая литература