| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
§ 21. Ароматические углеводороды (арены)
Общее рассмотрение.
Ароматическими углеводородами (аренами) называются вещества, в молекулах которых содержится одно или несколько бензольных колец — циклических групп атомов углерода с особым характером связей.
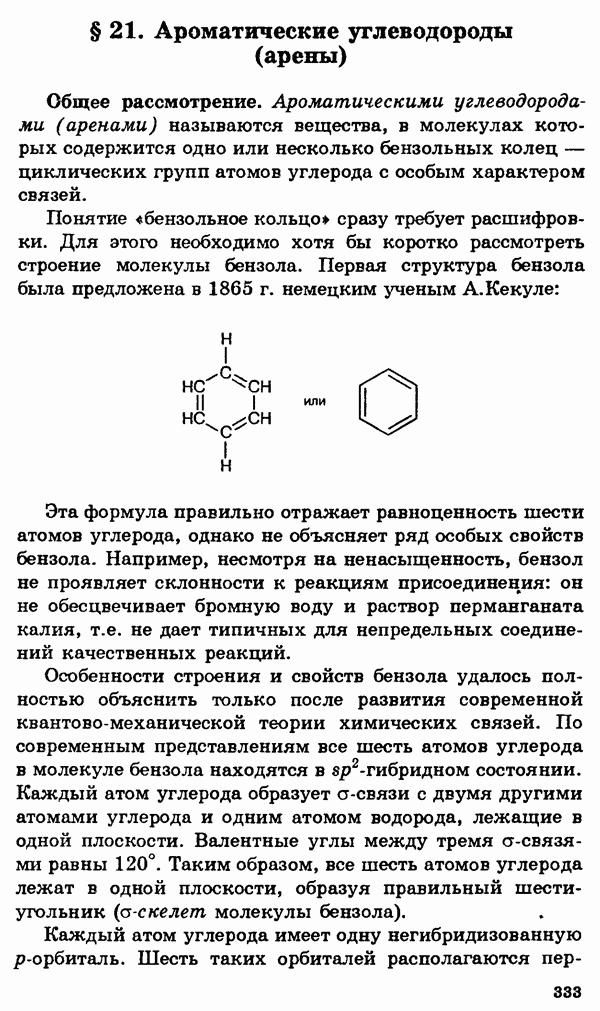
Понятие «бензольное кольцо» сразу требует расшифровки. Для этого необходимо хотя бы коротко рассмотреть строение молекулы бензола. Первая структура бензола была предложена в 1865 г. немецким ученым А. Кекуле:

Эта формула правильно отражает равноценность шести атомов углерода, однако не объясняет ряд особых свойств бензола. Например, несмотря на ненасыщенность, бензол не проявляет склонности к реакциям присоединения: он не обесцвечивает бромную воду и раствор перманганата калия, т.е. не дает типичных для непредельных соединений качественных реакций.
Особенности строения и свойств бензола удалось полностью объяснить только после развития современной квантово-механической теории химических связей. По современным представлениям все шесть атомов углерода в молекуле бензола находятся в  -гибридном состоянии. Каждый атом углерода образует
-гибридном состоянии. Каждый атом углерода образует  -связи с двумя другими атомами углерода и одним атомом водорода, лежащие в одной плоскости. Валентные углы между тремя
-связи с двумя другими атомами углерода и одним атомом водорода, лежащие в одной плоскости. Валентные углы между тремя  -связями равны 120°. Таким образом, все шесть атомов углерода лежат в одной плоскости, образуя правильный шестиугольник (
-связями равны 120°. Таким образом, все шесть атомов углерода лежат в одной плоскости, образуя правильный шестиугольник ( -скелет молекулы бензола).
-скелет молекулы бензола).
Каждый атом углерода имеет одну негибридизованную p-орбиталь.
Шесть таких орбиталей располагаются перпендикулярно плоскому  -скелету и параллельно друг другу (рис. 21.1, а). Все шесть р-электронов взаимодействуют между собой, образуя
-скелету и параллельно друг другу (рис. 21.1, а). Все шесть р-электронов взаимодействуют между собой, образуя  -связи, не локализованные в пары, как при образовании обычных двойных связей, а объединенные в единое
-связи, не локализованные в пары, как при образовании обычных двойных связей, а объединенные в единое  -электронное облако. Таким образом, в молекуле бензола осуществляется круговое сопряжение (см. § 19). Наибольшая
-электронное облако. Таким образом, в молекуле бензола осуществляется круговое сопряжение (см. § 19). Наибольшая  -электронная плотность в этой сопряженной системе располагается над и под плоскостью
-электронная плотность в этой сопряженной системе располагается над и под плоскостью  -скелета (рис. 21.1, б).
-скелета (рис. 21.1, б).

Рис. 21.1. Строение молекулы бензола
В результате все связи между атомами углерода в бензоле выравнены и имеют длину 0,139 нм. Эта величина является промежуточной между длиной одинарной связи в алканах (0,154 нм) и длиной двойной связи в алкенах (0,133 нм). Равноценность связей принято изображать кружком внутри цикла (рис. 21.1, в). Круговое сопряжение дает выигрыш в энергии 150 кДж/моль. Эта величина составляет энергию сопряжения — количество энергии, которое нужно затратить, чтобы нарушить ароматическую систему бензола (сравните — энергия сопряжения в бутадиене равна всего 12 кДж/моль).
Такое электронное строение объясняет все особенности бензола. В частности, понятно, почему бензол трудно вступает в реакции присоединения — это привело бы к нарушению сопряжения. Такие реакции возможны только в очень жестких условиях.
Номенклатура и изомерия.
Условно арены можно разделить на два ряда. К первому относят производные бензола (например, толуол или дифенил), ко второму — конденсированные (полиядерные) арены (простейший из них — нафталин):

Мы рассмотрим только гомологический ряд бензола с общей формулой  .
.
Структурная изомерия в гомологическом ряду бензола обусловлена взаимным расположением заместителей в ядре. Монозамещенные производные бензола не имеют изомеров положения, так как все атомы в бензольном ядре равноценны. Дизамещенные производные существуют в виде трех изомеров, различающихся взаимным расположением заместителей. Положение заместителей указывают цифрами или приставками:

Радикалы ароматических углеводородов называют арильными радикалами. Радикал  называется фенил.
называется фенил.
Физические свойства.
Первые члены гомологического ряда бензола (например, толуол, этилбензол и др.) — бесцветные жидкости со специфическим запахом. Они легче воды и в воде не растворимы. Хорошо растворяются в органических растворителях. Бензол и его гомологи сами являются хорошими растворителями для многих органических веществ. Все арены горят коптящим пламенем ввиду высокого содержания углерода в их молекулах.
Способы получения.
1. Получение из алифатических углеводородов. При пропускании алканов с неразветвленной цепью, имеющих не менее 6 атомов углерода в молекуле, над нагретой платиной или оксидом хрома происходит дегидроциклизация — образование арена с выделением водорода:

2. Дегидрирование циклоалканов. Реакция происходит при пропускании паров циклогексана и его гомологов над нагретой платиной:

3. Получение бензола тримеризацией ацетилена — см. § 20.
4. Получение гомологов бензола по реакции Фриделя—Крафтса — см. ниже.
5. Сплавление солей ароматических кислот со щелочью:

Химические свойства.
Общее рассмотрение. Обладая подвижной шестеркой  -электронов, ароматическое ядро является удобным объектом для атаки электрофильными реагентами. Этому способствует также пространственное расположение
-электронов, ароматическое ядро является удобным объектом для атаки электрофильными реагентами. Этому способствует также пространственное расположение  -электронного облака с двух сторон плоского
-электронного облака с двух сторон плоского  -скелета молекулы (рис. 21.1, б)
-скелета молекулы (рис. 21.1, б)
Для аренов наиболее характерны реакции, протекающие по механизму электрофильного замещения, обозначаемого символом  (от англ. substitution electrophilic).
(от англ. substitution electrophilic).
Механизм электрофильного замещения можно представить следующим образом. Электрофильный реагент XY (X является электрофилом) атакует электронное облако, и за счет слабого электростатического взаимодействия образуется неустойчивый  -комплекс. Ароматическая система при этом еще не нарушается. Эта стадия протекает быстро. На второй, более медленной стадии формируется ковалентная связь между электрофилом X и одним из атомов углерода кольца за счет двух
-комплекс. Ароматическая система при этом еще не нарушается. Эта стадия протекает быстро. На второй, более медленной стадии формируется ковалентная связь между электрофилом X и одним из атомов углерода кольца за счет двух  -электронов кольца. Этот атом углерода переходит из
-электронов кольца. Этот атом углерода переходит из  в
в  -гибридное состояние. Ароматичность системы при этом нарушается. Четыре оставшиеся
-гибридное состояние. Ароматичность системы при этом нарушается. Четыре оставшиеся  -электрона распределяются между пятью другими атомами углерода, и молекула бензола образует карбокатион, или
-электрона распределяются между пятью другими атомами углерода, и молекула бензола образует карбокатион, или  -комплекс.
-комплекс.

Нарушение ароматичности энергетически невыгодно, поэтому структура  -комплекса менее устойчива, чем ароматическая структура. Для восстановления ароматичности происходит отщепление протона от атома углерода, связанного с электрофилом (третья стадия). При этом два электрона возвращаются в
-комплекса менее устойчива, чем ароматическая структура. Для восстановления ароматичности происходит отщепление протона от атома углерода, связанного с электрофилом (третья стадия). При этом два электрона возвращаются в  -систему, и тем самым восстанавливается ароматичность:
-систему, и тем самым восстанавливается ароматичность:

Реакции электрофильного замещения широко используются для синтеза многих производных бензола.
Химические свойства бензола.
1. Галогенирование. Бензол не взаимодействует с хлором или бромом в обычных условиях. Реакция может протекать только в присутствии катализаторов — безводных  . В результате реакции образуются галогенозамещенные арены:
. В результате реакции образуются галогенозамещенные арены:

Роль катализатора заключается в поляризации нейтральной молекулы галогена с образованием из нее электрофильной частицы:

2. Нитрование. Бензол очень медленно реагирует с концентрированной азотной кислотой даже при сильном нагревании. Однако при действии так называемой нитрующей смеси (смесь концентрированных азотной и серной кислот) реакция нитрования проходит достаточно легко:

3. Сульфирование. Реакция легко проходит под действием «дымящей» серной кислоты (олеума):

4. Алкилирование по Фриделю—Крафтсу. В результате реакции происходит введение в бензольное ядро алкильной группы с получением гомологов бензола. Реакция протекает при действии на бензол галогеналканов  в присутствии катализаторов — галогенидов алюминия. Роль катализатора сводится к поляризации молекулы
в присутствии катализаторов — галогенидов алюминия. Роль катализатора сводится к поляризации молекулы  с образованием электрофильной частицы:
с образованием электрофильной частицы:

В зависимости от строения радикала в галогеналкане можно получить разные гомологи бензола:

5. Алкилирование алкенами. Эти реакции широко используются в промышленности для получения этилбензола и изопропилбензола (кумола). Алкилирование проводят в присутствии катализатора  . Механизм реакции сходен с механизмом предыдущей реакции:
. Механизм реакции сходен с механизмом предыдущей реакции:

Все рассмотренные выше реакции протекают по механизму электрофильного замещения  .
.
Реакции присоединения к аренам приводят к разрушению ароматической системы и требуют больших затрат энергии, поэтому протекают только в жестких условиях.
6. Гидрирование. Реакция присоединения водорода к аренам идет при нагревании и высоком давлении в присутствии металлических катализаторов (Ni, Pt, Pd). Бензол превращается в циклогексан, а гомологи бензола — в производные циклогексана:

7. Радикальное галогенирование. Взаимодействие паров бензола с хлором протекает по радикальному механизму только под воздействием жесткого ультрафиолетового излучения. При этом бензол присоединяет три молекулы хлора и образует твердый продукт — гексахлорциклогексан  :
:

8. Окисление кислородом воздуха. По устойчивости к действию окислителей бензол напоминает алканы. Только при сильном нагревании (400 °С) паров бензола с кислородом воздуха в присутствии катализатора  получается смесь малеиновой кислоты и ее ангидрида:
получается смесь малеиновой кислоты и ее ангидрида:

Химические свойства гомологов бензола.
Гомологи бензола имеют целый ряд особых химических свойств, связанных со взаимным влиянием алкильного радикала на бензольное кольцо, и наоборот.
Реакции в боковой цепи. По химическим свойствам алкильные радикалы подобны алканам. Атомы водорода в них замещаются на галоген по свободно-радикальному механизму. Поэтому в отсутствие катализатора при нагревании или УФ облучении идет радикальная реакция замещения в боковой цепи. Влияние бензольного кольца на алкильные заместители приводит к тому, что замещается всегда атом водорода у атома углерода, непосредственно связанного с бензольным кольцом (а-атома углерода).

Замещение в бензольном кольце возможно только по механизму  в присутствии катализатора
в присутствии катализатора  :
:

Ниже вы узнаете, какие из трех изомеров хлортолуола образуются в этой реакции.
При действии на гомологи бензола перманганата калия и других сильных окислителей боковые цепи окисляются. Какой бы сложной ни была цепь заместителя, она разрушается, за исключением  -атома углерода, который окисляется в карбоксильную группу.
-атома углерода, который окисляется в карбоксильную группу.
Гомологи бензола с одной боковой цепью дают бензойную кислоту:

Гомологи, содержащие две боковые цепи, дают двухосновные кислоты:

Правила ориентации (замещения) в бензольном кольце.
Важнейшим фактором, определяющим химические свойства молекулы, является распределение в ней электронной плотности. Характер распределения зависит от взаимного влияния атомов.
В молекулах, имеющих только  -связи, взаимное влияние атомов осуществляется через индуктивный эффект (см. § 17). В молекулах, представляющих собой сопряженные системы, проявляется действие мезомерного эффекта.
-связи, взаимное влияние атомов осуществляется через индуктивный эффект (см. § 17). В молекулах, представляющих собой сопряженные системы, проявляется действие мезомерного эффекта.
Влияние заместителей, передающееся по сопряженной системе  -связей, называется мезомерным (М) эффектом.
-связей, называется мезомерным (М) эффектом.
В молекуле бензола  -электронное облако распределено равномерно по всем атомам углерода за счет сопряжения.
-электронное облако распределено равномерно по всем атомам углерода за счет сопряжения.
Если же в бензольное кольцо ввести какой-нибудь заместитель, это равномерное распределение нарушается, и происходит перераспределение электронной плотности в кольце. Место вступления второго заместителя в бензольное кольцо определяется природой уже имеющегося заместителя.
Заместители подразделяют на две группы в зависимости от проявляемого ими эффекта (мезомерного или индуктивного): электронов опорные и электроноакцепторные.
Электронодонорные заместители проявляют  эффект и повышают электронную плотность в сопряженной системе. К ним относятся гидроксильная группа —ОН и аминогруппа
эффект и повышают электронную плотность в сопряженной системе. К ним относятся гидроксильная группа —ОН и аминогруппа  Неподеленная пара электронов в этих группах вступает в общее сопряжение с
Неподеленная пара электронов в этих группах вступает в общее сопряжение с  -электронной системой бензольного кольца и увеличивает длину сопряженной системы. В результате электронная плотность сосредоточивается в орто- и параположениях:
-электронной системой бензольного кольца и увеличивает длину сопряженной системы. В результате электронная плотность сосредоточивается в орто- и параположениях:

Алкильные группы не могут участвовать в общем сопряжении, но они проявляют  эффект, под действием которого происходит аналогичное перераспределение
эффект, под действием которого происходит аналогичное перераспределение  -электронной плотности.
-электронной плотности.
Электроноакцепторные заместители проявляют -М эффект и снижают электронную плотность в сопряженной системе. К ним относятся нитрогруппа  сульфогруппа
сульфогруппа  альдегидная —СНО и карбоксильная —СООН группы. Эти заместители образуют с бензольным кольцом общую сопряженную систему, но общее электронное облако смещается в сторону этих групп. Таким образом, общая электронная плотность в кольце уменьшается, причем меньше всего она уменьшается в метаположениях:
альдегидная —СНО и карбоксильная —СООН группы. Эти заместители образуют с бензольным кольцом общую сопряженную систему, но общее электронное облако смещается в сторону этих групп. Таким образом, общая электронная плотность в кольце уменьшается, причем меньше всего она уменьшается в метаположениях:

Полностью галогенизированные алкильные радикалы (например,  ) проявляют —I эффект и также способствуют понижению электронной плотности кольца.
) проявляют —I эффект и также способствуют понижению электронной плотности кольца.
Закономерности преимущественного направления замещения в бензольном кольце называют правилами ориентации.
Заместители, обладающие  эффектом или
эффектом или  эффектом, способствуют электрофильному замещению в орто- и пара-положения бензольного кольца и называются заместителями (ориентантами) первого рода:
эффектом, способствуют электрофильному замещению в орто- и пара-положения бензольного кольца и называются заместителями (ориентантами) первого рода:

Заместители, обладающие -I эффектом или -M эффектом, направляют электрофильное замещение в мета-положения бензольного кольца и называются заместителями (ориентантами) второго рода:

Например, толуол, содержащий заместитель первого рода, нитруется и бромируется в пара- и орто-положения:

Нитробензол, содержащий заместитель второго рода, нитруется и бромируется в мета-положение:

Помимо ориентирующего действия, заместители оказывают влияние и на реакционную способность бензольного кольца: ориентанты 1-го рода (кроме галогенов) облегчают вступление второго заместителя; ориентанты 2-г о рода (и галогены) затрудняют его.
Рекомендуемая литература: [Цветков, гл. 4], [Тюкавкина, гл. 3.2], [Потапов, гл. 7], [Третьяков, § 86], [Хомченко, 1993, гл. 16.11, 16.12].
| << Предыдущий параграф | Следующий параграф >> |
- ВВЕДЕНИЕ
- Глава I. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИИ
- § 1. Предмет химии. Важнейшие понятия и законы химии
- Основные стехиометрические законы химии
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 2. Строение атома
- Электронные конфигурации атомов
- Ядро атома и радиоактивные превращения
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 3. Строение молекул. Химическая связь. Валентность элементов
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 4. Агрегатные состояния вещества
- Характерные свойства газов, жидкостей и твердых тел
- Газообразное состояние. Газовые законы
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 5. Закономерности протекания химических реакций
- Химическая кинетика
- Химическое равновесие
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 6. Растворы. Электролитическая диссоциация. Гидролиз солей
- Электролиты и электролитическая диссоциация
- Гидролиз солей
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 7. Классификация химических реакций. Окислительно-восстановительные процессы. Электролиз
- Окислительно-восстановительные реакции
- Электролиз
- ЗАДАЧИ И УПРАЖНЕНИЯ
- Глава II. НЕОРГАНИЧЕСКАЯ ХИМИЯ
- § 8. Номенклатура, классификация неорганических веществ. Свойства и способы получения
- Оксиды
- Основания (гидроксиды металлов)
- Кислоты
- Соли
- § 9. Водород. Галогены и их соединения
- Галогены и их соединения
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 10. Подгруппа кислорода
- Сера и ее соединения
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 11. Подгруппа азота
- Фосфор и его соединения
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 12. Подгруппа углерода
- Углерод и его соединения
- Кремний и его соединения
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 13. Свойства s-элементов (щелочных и щелочноземельных металлов) и их соединений
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 14. Алюминий — типичный р-металл
- Соединения алюминия и их свойства
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 15. Главные переходные металлы (d-элементы) и их соединения
- Химические свойства d-элементов
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 16. Задачи для повторения по неорганической химии
- Глава III. ОРГАНИЧЕСКАЯ ХИМИЯ
- § 17. Основные понятия и закономерности в органической химии. Предмет органической химии
- Классификация и номенклатура органических соединений
- Изомерия органических соединений
- Взаимное влияние атомов в молекуле и реакционная способность органических соединений
- Общая характеристика органических реакций
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 18. Предельные (насыщенные) углеводороды
- Циклоалканы
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 19. Алкены. Диеновые углеводороды
- Диеновые углеводороды (алкадиены)
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 20. Алкины
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 21. Ароматические углеводороды (арены)
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 22. Спирты и фенолы
- Многоатомные спирты
- Фенолы
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 23. Карбонильные соединения — альдегиды и кетоны
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 24. Карбоновые кислоты. Сложные эфиры. Жиры
- Сложные эфиры. Жиры
- ЗАДАЧИ И УПРАЖНЕНИЯ
- Глава 4. ОСНОВНЫЕ ПРИЕМЫ РЕШЕНИЯ ЗАДАЧ
- Определение молекулярной формулы веществ
- Определение состава и разделение смесей
- Задачи на газовые законы
- Способы выражения концентрации растворов
- Ионные реакции в растворах
- Задачи на окислительно-восстановительные реакции
- Разные задачи
- ПРОГРАММА ПО ХИМИИ ДЛЯ ПОСТУПАЮЩИХ В УНИВЕРСИТЕТЫ
- ОТВЕТЫ
- Рекомендуемая литература