| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
§ 20. Алкины
Алкинами называются ненасыщенные углеводороды, молекулы которых содержат одну тройную связь. Общая формула алкинов 
По номенклатуре ИЮПАК наличие тройной связи в молекуле обозначается суффиксом -ин, который заменяет суффикс -ан в названии соответствующего алкана.
Структурная изомерия алкинов, как и алкенов, обусловлена строением углеродной цепи и положением в ней тройной связи.
Строение тройной связи детально рассмотрено в § 3 (см. рис. 3.6, 3.7).
Физические свойства.
По физическим свойствам алкины напоминают алканы и алкены. Низшие алкины  представляют собой газы,
представляют собой газы,  — жидкости, высшие алкины — твердые вещества. Температуры кипения алкинов несколько выше, чем у соответствующих алкенов.
— жидкости, высшие алкины — твердые вещества. Температуры кипения алкинов несколько выше, чем у соответствующих алкенов.
Способы получения.
1. Общим способом получения алкинов является реакция дегидропалогенироваиия — отщепления двух молекул галогеноводорода от дигалогензамещенных алканов, которые содержат два атома галогена либо у соседних атомов углерода (например,  -дибромпропан), либо у одного атома углерода (
-дибромпропан), либо у одного атома углерода ( -дибромпропан). Реакция происходит под действием спиртового раствора гидроксида калия:
-дибромпропан). Реакция происходит под действием спиртового раствора гидроксида калия:

2. Важнейший из алкинов — ацетилен — получают в промышленности путем высокотемпературного крекинга метана:

В лаборатории ацетилен можно получить гидролизом карбида кальция:

Химические свойства.
Тройная связь образуется двумя атомами углерода в  -гибридном состоянии. Две
-гибридном состоянии. Две  -связи расположены под углом 180°, а две
-связи расположены под углом 180°, а две  -связи расположены во взаимно перпендикулярных областях (см. § 3). Наличие
-связи расположены во взаимно перпендикулярных областях (см. § 3). Наличие  -связей обусловливает способность алкинов вступать в реакции электрофильного присоединения. Однако эти реакции для алкинов протекают медленнее, чем для алкенов. Это объясняется тем, что
-связей обусловливает способность алкинов вступать в реакции электрофильного присоединения. Однако эти реакции для алкинов протекают медленнее, чем для алкенов. Это объясняется тем, что  -электронная плотность тройной связи расположена более компактно, чем в алкенах, и поэтому менее доступна для взаимодействия с различными реагентами.
-электронная плотность тройной связи расположена более компактно, чем в алкенах, и поэтому менее доступна для взаимодействия с различными реагентами.
1. Галогенирование. Галогены присоединяются к алкинам в две стадии.
Например, присоединение брома к ацетилену приводит к образованию дибромэтена, который, в свою очередь, реагирует с избытком брома с образованием тетрабромэтана:

2. Гидрогалогенирование. Галогеноводороды присоединяются к тройной связи труднее, чем к двойной. Для активации галогеноводорода используют  — сильную кислоту Льюиса. Из ацетилена при этом можно получить винилхлорид (хлорэтен), который используется для получения важного полимера — поливинилхлорида:
— сильную кислоту Льюиса. Из ацетилена при этом можно получить винилхлорид (хлорэтен), который используется для получения важного полимера — поливинилхлорида:

3. Гидратация. Присоединение воды к алкинам катализируется солями ртути (II):

На первой стадии реакции образуется непредельный спирт, в котором гидроксогруппа находится непосредственно у атома углерода при двойной связи. Такие спирты принято называть виниловыми или енолами.
Отличительной чертой большинства енолов является их неустойчивость. В момент образования они изомеризуюгпся в более стабильные карбонильные соединения (альдегиды или кетоны) за счет переноса протона от гидроксильной группы к соседнему атому углерода при двойной связи. При этом  -связь между атомами углерода разрывается, и образуется
-связь между атомами углерода разрывается, и образуется  -связь между атомом углерода и атомом кислорода. Причиной изомеризации является большая прочность двойной связи
-связь между атомом углерода и атомом кислорода. Причиной изомеризации является большая прочность двойной связи  по сравнению с двойной связью
по сравнению с двойной связью 
В результате реакции гидратации только ацетилен превращается в альдегид, гидратация гомологов ацетилена протекает по правилу Марковникова, и образующиеся енолы изомеризуются в кетоны. Так, например, пропин превращается в ацетон:

4. Кислотные свойства. Особенностью алкинов, имеющих концевую тройную связь, является их способность отщеплять протон под действием сильных оснований, т.е. проявлять слабые кислотные свойства. Возможность отщепления протона обусловлена сильной поляризацией  -связи
-связи  Причиной поляризации является высокая электроотрицательность атома углерода в
Причиной поляризации является высокая электроотрицательность атома углерода в  -гибридном состоянии. Поэтому алкины, в отличие от алкенов и алканов, способны образовывать соли, называемые ацетиленидами:
-гибридном состоянии. Поэтому алкины, в отличие от алкенов и алканов, способны образовывать соли, называемые ацетиленидами:

Ацетилениды серебра и меди (I) легко образуются и выпадают в осадок при пропускании ацетилена через аммиачный раствор оксида серебра или хлорида меди (I) (см. образование этих комплексов в § 15). Эта реакция служит для обнаружения алкинов с тройной связью на конце цепи:

Ацетилениды серебра и меди как соли очень слабых кислот легко разлагаются при действии хлороводородной кислоты с выделением исходного алкина:

Таким образом, используя реакции образования и разложения ацетиленидов, можно выделять алкины из смесей с другими углеводородами.
5. Полимеризация. В присутствии катализаторов алкины могут реагировать друг с другом, причем в зависимости от условий образуются различные продукты. Так, под действием водного раствора  ацетилен димеризуется, давая винилацетилен:
ацетилен димеризуется, давая винилацетилен:

Винилацетилен обладает большой реакционноспособностью; присоединяя хлороводород, он образует хлоропрен, используемый для получения искусственного каучука:

При пропускании ацетилена над активированным углем при 600 °С происходит тримеризация ацетилена с образованием бензола:

6. Реакции окисления и восстановления. Алкины окисляются различными окислителями, в частности перманганатом калия. При этом раствор перманганата калия обесцвечивается, что служит указанием на наличие тройной связи. При окислении обычно происходит расщепление тройной связи, и образуются карбоновые кислоты:

В присутствии металлических катализаторов алкины восстанавливаются путем последовательного присоединения молекул водорода, превращаясь сначала в алкены, а затем в алканы:

Рекомендуемая литература: [Цветков, § 16], [Ткжавкина, гл. 2.4], [Потапов, гл. 5], [Третьяков, § 84], [Хомченко, 1993, гл. 16.8].
| << Предыдущий параграф | Следующий параграф >> |
- ВВЕДЕНИЕ
- Глава I. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИИ
- § 1. Предмет химии. Важнейшие понятия и законы химии
- Основные стехиометрические законы химии
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 2. Строение атома
- Электронные конфигурации атомов
- Ядро атома и радиоактивные превращения
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 3. Строение молекул. Химическая связь. Валентность элементов
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 4. Агрегатные состояния вещества
- Характерные свойства газов, жидкостей и твердых тел
- Газообразное состояние. Газовые законы
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 5. Закономерности протекания химических реакций
- Химическая кинетика
- Химическое равновесие
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 6. Растворы. Электролитическая диссоциация. Гидролиз солей
- Электролиты и электролитическая диссоциация
- Гидролиз солей
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 7. Классификация химических реакций. Окислительно-восстановительные процессы. Электролиз
- Окислительно-восстановительные реакции
- Электролиз
- ЗАДАЧИ И УПРАЖНЕНИЯ
- Глава II. НЕОРГАНИЧЕСКАЯ ХИМИЯ
- § 8. Номенклатура, классификация неорганических веществ. Свойства и способы получения
- Оксиды
- Основания (гидроксиды металлов)
- Кислоты
- Соли
- § 9. Водород. Галогены и их соединения
- Галогены и их соединения
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 10. Подгруппа кислорода
- Сера и ее соединения
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 11. Подгруппа азота
- Фосфор и его соединения
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 12. Подгруппа углерода
- Углерод и его соединения
- Кремний и его соединения
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 13. Свойства s-элементов (щелочных и щелочноземельных металлов) и их соединений
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 14. Алюминий — типичный р-металл
- Соединения алюминия и их свойства
- ЗАДАЧИ И УПРАЖНЕНИЯ
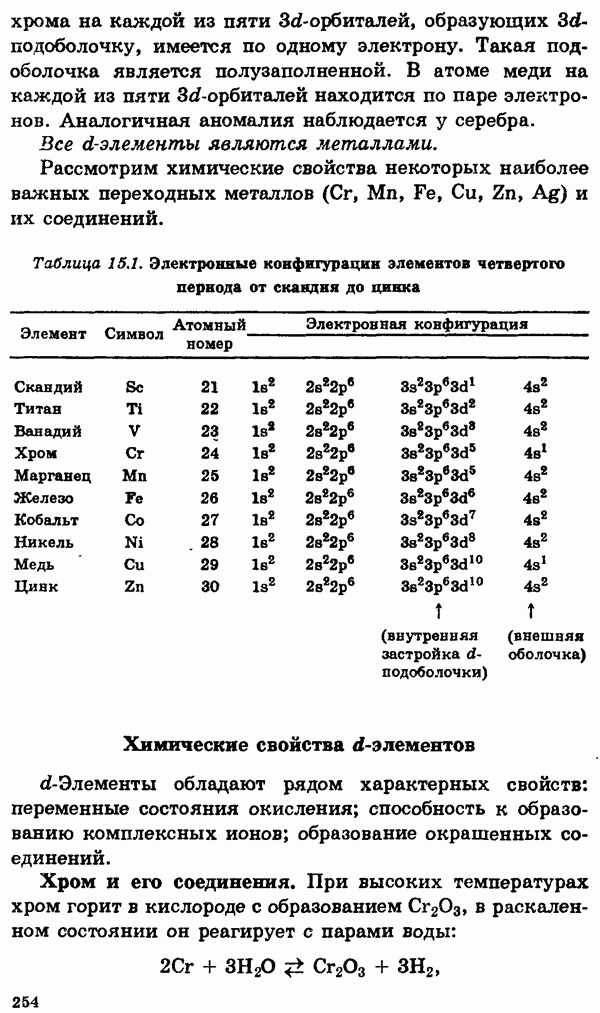
- § 15. Главные переходные металлы (d-элементы) и их соединения
- Химические свойства d-элементов
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 16. Задачи для повторения по неорганической химии
- Глава III. ОРГАНИЧЕСКАЯ ХИМИЯ
- § 17. Основные понятия и закономерности в органической химии. Предмет органической химии
- Классификация и номенклатура органических соединений
- Изомерия органических соединений
- Взаимное влияние атомов в молекуле и реакционная способность органических соединений
- Общая характеристика органических реакций
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 18. Предельные (насыщенные) углеводороды
- Циклоалканы
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 19. Алкены. Диеновые углеводороды
- Диеновые углеводороды (алкадиены)
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 20. Алкины
- ЗАДАЧИ И УПРАЖНЕНИЯ
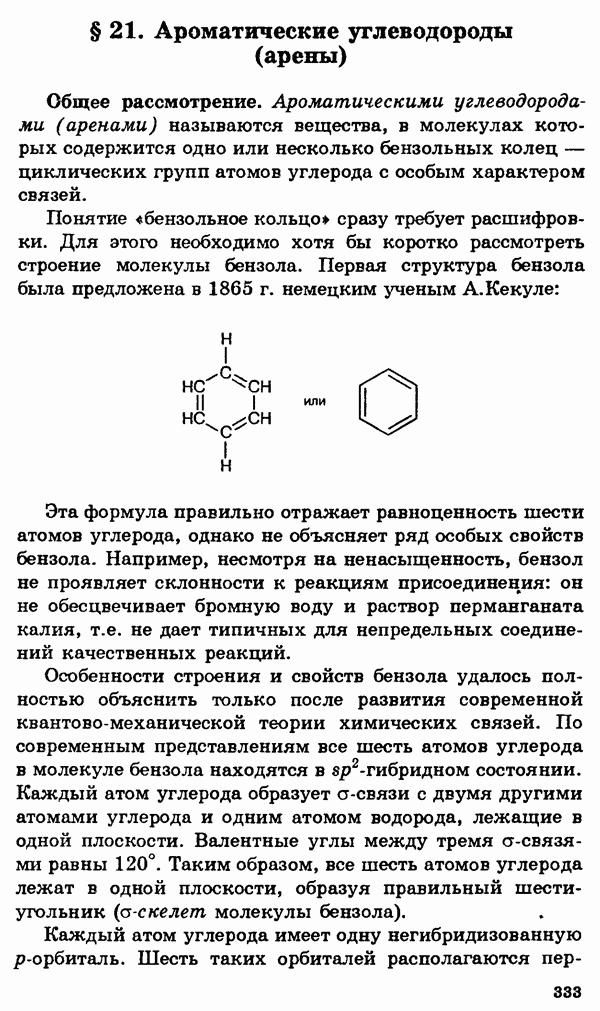
- § 21. Ароматические углеводороды (арены)
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 22. Спирты и фенолы
- Многоатомные спирты
- Фенолы
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 23. Карбонильные соединения — альдегиды и кетоны
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 24. Карбоновые кислоты. Сложные эфиры. Жиры
- Сложные эфиры. Жиры
- ЗАДАЧИ И УПРАЖНЕНИЯ
- Глава 4. ОСНОВНЫЕ ПРИЕМЫ РЕШЕНИЯ ЗАДАЧ
- Определение молекулярной формулы веществ
- Определение состава и разделение смесей
- Задачи на газовые законы
- Способы выражения концентрации растворов
- Ионные реакции в растворах
- Задачи на окислительно-восстановительные реакции
- Разные задачи
- ПРОГРАММА ПО ХИМИИ ДЛЯ ПОСТУПАЮЩИХ В УНИВЕРСИТЕТЫ
- ОТВЕТЫ
- Рекомендуемая литература