| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
§ 5. Закономерности протекания химических реакций
(тепловой эффект реакций, скорость реакций, химическое равновесие)
Тепловой эффект химической реакции
Химическая реакция заключается в разрыве одних и образовании других связей, поэтому она сопровождается выделением или поглощением энергии в виде теплоты, света, работы расширения образовавшихся газов.
По признаку выделения или поглощения теплоты реакции делятся на экзотермические и эндотермические (см. также § 7).
Количество теплоты, которое выделяется или поглощается в результате реакций между определенными количествами реагентов, называют тепловым эффектом химической реакции и обычно обозначают символом 
Наряду с тепловым эффектом, термохимические процессы очень часто характеризуют разностью энтальпий  продуктов реакции и исходных веществ.
продуктов реакции и исходных веществ.
Энтальпия Н — это определенное свойство вещества, оно является мерой энергии, накапливаемой веществом при его образовании.
Процессы, протекающие при постоянном давлении, встречаются в химии гораздо чаще, чем те, которые протекают при постоянном объеме, так как большинство из них проводится в открытых сосудах. Доказано, что в химических процессах, протекающих при постоянном давлении, выделившееся (или поглощенное) тепло есть мера уменьшения (или, соответственно, увеличения) энтальпии реакции 
Таким образом, при экзотермических реакциях, когда тепло выделяется,  отрицательно. При эндотермических реакциях (тепло поглощается)
отрицательно. При эндотермических реакциях (тепло поглощается)  положительно.
положительно.
Как отмечено выше, на первых этапах изучения химии вы часто пользовались равным по абсолютной величине и противоположным по знаку обозначением, например:

где Q — количество выделенной теплоты.
Если использовать энтальпию (характеристику энергосодержания системы), то это уравнение следует записать иначе:

В справочных таблицах обычно приводят не значения величины Q, а значения величины  измеренные при определенных условиях (чаще всего при 298 К); их обозначают
измеренные при определенных условиях (чаще всего при 298 К); их обозначают 
Теплотой образования соединения называется количество теплоты, которое выделяется или поглощается при образовании одного моля химического соединения из простых веществ при стандартных условиях  . Она измеряется в кДж/моль. Согласно этому определению, теплота образования простого вещества при стандартных условиях равна 0.
. Она измеряется в кДж/моль. Согласно этому определению, теплота образования простого вещества при стандартных условиях равна 0.
Изменение энтальпии  зависит от давления и температуры. Поэтому, для того, чтобы облегчить сравнение термохимических данных для различных реакций, были приняты определенные стандартные состояния (условия).
зависит от давления и температуры. Поэтому, для того, чтобы облегчить сравнение термохимических данных для различных реакций, были приняты определенные стандартные состояния (условия).
Вспомните, например, об энергии плавления льда, теплоемкости и энергии парообразования воды, тогда вам станет понятно, что теплота образования 1 моля паров воды будет отличаться, и довольно заметно, от теплоты образования 1 моля той же воды, но при 25 °С, или льда при 0 °С.
При написании термохимических уравнений твердое вещество, жидкость и газ обязательно обозначаются символами  соответственно, поскольку изменение энтальпии зависит от агрегатного состояния реагирующих веществ и продуктов реакции. Стандартное состояние: для газа — состояние чистого газа при
соответственно, поскольку изменение энтальпии зависит от агрегатного состояния реагирующих веществ и продуктов реакции. Стандартное состояние: для газа — состояние чистого газа при  Па; для жидкости — состояние чистой жидкости при
Па; для жидкости — состояние чистой жидкости при  Па; для твердого вещества — наиболее устойчивое при давлении
Па; для твердого вещества — наиболее устойчивое при давлении  Па кристаллическое состояние, например графит у углерода, ромбическая сера у серы и т.п. Стандартное состояние всегда относится к 298 К. Так, например, термохимическое уравнение образования воды из водорода и кислорода записывается следующим образом:
Па кристаллическое состояние, например графит у углерода, ромбическая сера у серы и т.п. Стандартное состояние всегда относится к 298 К. Так, например, термохимическое уравнение образования воды из водорода и кислорода записывается следующим образом:

Значение 286 кДж является теплотой образования воды в стандартных условиях и означает, что при образовании 1 моля воды выделяется 286 кДж теплоты:

Отметим, что значение теплоты образования газообразной воды уже будет иным:

Важнейшим законом, на котором основано большинство термохимических расчетов, является закон Гесса (его называют также законом суммы тепловых эффектов):
Тепловой эффект химической реакции зависит от состояния исходных веществ и продуктов реакции, но не зависит от промежуточных стадий реакций.
Так, например, тепловой эффект реакции окисления углерода в оксид углерода (IV) не зависит от того, проводится ли это окисление непосредственно:

или через промежуточную стадию образования оксида углерода (II):

Из закона Гесса следует, что если известны общий тепловой эффект реакции и тепловой эффект одной из двух ее промежуточных стадий, то можно вычислить тепловой эффект  второй промежуточной стадии, т.е., если
второй промежуточной стадии, т.е., если  то
то  .
.
Это положение очень важно, так как позволяет рассчитывать тепловые эффекты для реакций, не поддающихся непосредственному экспериментальному изучению.
Например, практически невозможно измерить теплоту сгорания углерода до оксида углерода (И) в ограниченном количестве кислорода, потому что продукт реакции всегда будет состоять из смеси оксида углерода (И) и оксида углерода (IV). Однако теплоту полного сгорания углерода до оксида углерода (IV) измерить можно, она оказывается равной 
Можно также измерить и теплоту сгорания оксида углерода (II) до оксида углерода (IV), она равна  . Имея эти данные, по закону Гесса легко рассчитать теплоту сгорания углерода до оксида углерода (И):
. Имея эти данные, по закону Гесса легко рассчитать теплоту сгорания углерода до оксида углерода (И):

Если теплота образования какого-либо вещества из простых веществ не измерена экспериментально, то для расчета можно воспользоваться значениями  ряда других соединений; комбинируя эти значения, можно получить
ряда других соединений; комбинируя эти значения, можно получить  искомого соединения, как мы это сделали выше при вычислении
искомого соединения, как мы это сделали выше при вычислении  оксида углерода (II).
оксида углерода (II).
Энтальпии образования многих соединений известны с большой точностью. Значения стандартных энтальпий образования некоторых веществ при стандартных условиях приведены в таблице 5.1. Пользуясь данными этой таблицы, можно на основании закона Гесса рассчитать тепловые эффекты многих реакций.
Таблица 5.1. Энтальпии образования при 25 С (298 К)

Особенно удобно проводить такие расчеты, пользуясь следующим общим положением, непосредственно вытекающим из закона Гесса:
Тепловой эффект химической реакции равен разности суммы теплот образования продуктов реакции и суммы теплот образования исходных веществ (суммирование проводится с учетом числа молей веществ, участвующих в реакции, т.е. стехиометрических коэффициентов в уравнении протекающей реакции):

Здесь  — теплоты образования продуктов реакции и исходных веществ, соответственно;
— теплоты образования продуктов реакции и исходных веществ, соответственно;  — стехиометрические коэффициенты в правой и левой частях термохимического уравнения, соответственно.
— стехиометрические коэффициенты в правой и левой частях термохимического уравнения, соответственно.
Аналогичным образом можно записать:

где  — изменение энтальпии соответствующей реакции,
— изменение энтальпии соответствующей реакции,  энтальпии образования продуктов реакции и исходных веществ, соответственно.
энтальпии образования продуктов реакции и исходных веществ, соответственно.
| << Предыдущий параграф | Следующий параграф >> |
- ВВЕДЕНИЕ
- Глава I. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИИ
- § 1. Предмет химии. Важнейшие понятия и законы химии
- Основные стехиометрические законы химии
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 2. Строение атома
- Электронные конфигурации атомов
- Ядро атома и радиоактивные превращения
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 3. Строение молекул. Химическая связь. Валентность элементов
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 4. Агрегатные состояния вещества
- Характерные свойства газов, жидкостей и твердых тел
- Газообразное состояние. Газовые законы
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 5. Закономерности протекания химических реакций
- Химическая кинетика
- Химическое равновесие
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 6. Растворы. Электролитическая диссоциация. Гидролиз солей
- Электролиты и электролитическая диссоциация
- Гидролиз солей
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 7. Классификация химических реакций. Окислительно-восстановительные процессы. Электролиз
- Окислительно-восстановительные реакции
- Электролиз
- ЗАДАЧИ И УПРАЖНЕНИЯ
- Глава II. НЕОРГАНИЧЕСКАЯ ХИМИЯ
- § 8. Номенклатура, классификация неорганических веществ. Свойства и способы получения
- Оксиды
- Основания (гидроксиды металлов)
- Кислоты
- Соли
- § 9. Водород. Галогены и их соединения
- Галогены и их соединения
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 10. Подгруппа кислорода
- Сера и ее соединения
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 11. Подгруппа азота
- Фосфор и его соединения
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 12. Подгруппа углерода
- Углерод и его соединения
- Кремний и его соединения
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 13. Свойства s-элементов (щелочных и щелочноземельных металлов) и их соединений
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 14. Алюминий — типичный р-металл
- Соединения алюминия и их свойства
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 15. Главные переходные металлы (d-элементы) и их соединения
- Химические свойства d-элементов
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 16. Задачи для повторения по неорганической химии
- Глава III. ОРГАНИЧЕСКАЯ ХИМИЯ
- § 17. Основные понятия и закономерности в органической химии. Предмет органической химии
- Классификация и номенклатура органических соединений
- Изомерия органических соединений
- Взаимное влияние атомов в молекуле и реакционная способность органических соединений
- Общая характеристика органических реакций
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 18. Предельные (насыщенные) углеводороды
- Циклоалканы
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 19. Алкены. Диеновые углеводороды
- Диеновые углеводороды (алкадиены)
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 20. Алкины
- ЗАДАЧИ И УПРАЖНЕНИЯ
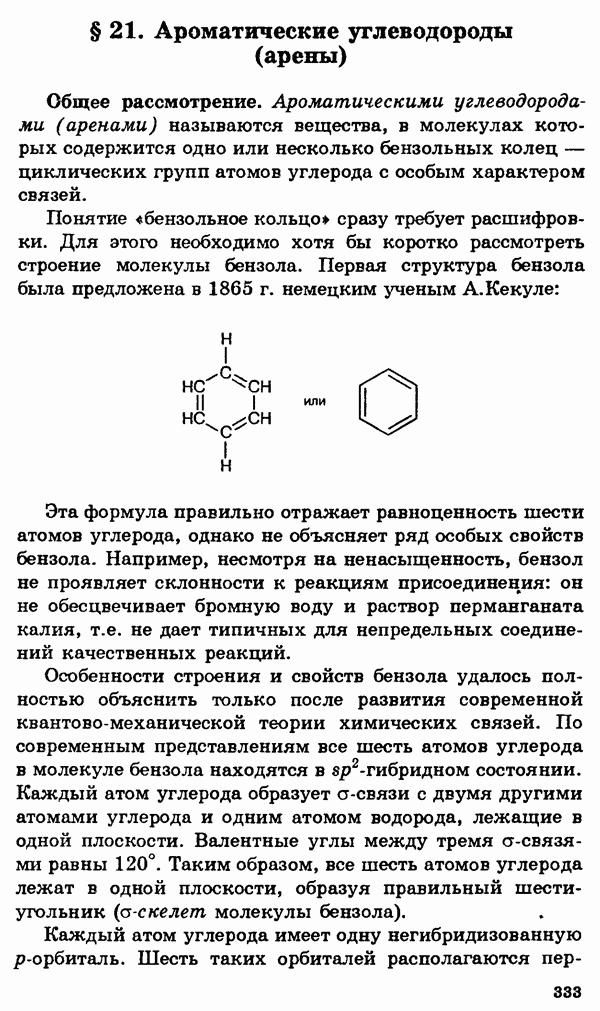
- § 21. Ароматические углеводороды (арены)
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 22. Спирты и фенолы
- Многоатомные спирты
- Фенолы
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 23. Карбонильные соединения — альдегиды и кетоны
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 24. Карбоновые кислоты. Сложные эфиры. Жиры
- Сложные эфиры. Жиры
- ЗАДАЧИ И УПРАЖНЕНИЯ
- Глава 4. ОСНОВНЫЕ ПРИЕМЫ РЕШЕНИЯ ЗАДАЧ
- Определение молекулярной формулы веществ
- Определение состава и разделение смесей
- Задачи на газовые законы
- Способы выражения концентрации растворов
- Ионные реакции в растворах
- Задачи на окислительно-восстановительные реакции
- Разные задачи
- ПРОГРАММА ПО ХИМИИ ДЛЯ ПОСТУПАЮЩИХ В УНИВЕРСИТЕТЫ
- ОТВЕТЫ
- Рекомендуемая литература