| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
Окислительно-восстановительные реакции
Химические реакции, протекающие с изменением степени окисления элементов, входящих в состав реагирующих веществ, называются окислительно-восстановительными.
Окисление — это процесс отдачи электронов атомом, молекулой или ионом. Если атом отдает свои электроны, то он приобретает положительный заряд, например:

Если отрицательно заряженный ион (заряд -1), например  , отдает 1 электрон, то он становится нейтральным атомом:
, отдает 1 электрон, то он становится нейтральным атомом:

Если положительно заряженный ион или атом отдает электроны, то величина его положительного заряда увеличивается соответственно числу отданных электронов:

Восстановление — это процесс присоединения электронов атомом, молекулой или ионом.
Если атом присоединяет электроны, то он превращается в отрицательно заряженный ион:

Если положительно заряженный ион принимает электроны, то величина его заряда уменьшается, например:

или он может перейти в нейтральный атом:

Окислителем является атом, молекула или ион, принимающий электроны. Восстановителем является атом, молекула или ион, отдающий электроны.
Окислитель в процессе реакции восстанавливается, а восстановитель — окисляется.
Следует помнить, что рассмотрение окисления (восстановления) как процесса отдачи (и принятия) электронов атомами или ионами не всегда отражает истинное положение, так как во многих случаях происходит не полный перенос электронов, а только смещение электронного облака от одного атома к другому.
Однако для составления уравнений окислительно-восстановительных реакций не имеет существенного значения, какая связь при этом образуется — ионная или ковалентная. Поэтому для простоты будем говорить о присоединении или отдаче электронов независимо от типа связи.
Составление уравнений окислительно-восстановительных реакций и подбор коэффициентов. При составлении уравнения окислительно-восстановительной реакции необходимо определить восстановитель, окислитель и число отдаваемых и принимаемых электронов.
Как правило, коэффициенты подбирают, используя либо метод электронного баланса, либо метод электронно-ионного баланса (иногда последний называют методом полуреакций).
В качестве примера составления уравнений окислительно-восстановительных реакций рассмотрим процесс окисления пирита концентрированной азотной кислотой:

Прежде всего, определим продукты реакции.  является сильным окислителем, поэтому сера будет окисляться до максимальной степени окисления
является сильным окислителем, поэтому сера будет окисляться до максимальной степени окисления  а железо — до
а железо — до  , при этом
, при этом  может восстанавливаться до
может восстанавливаться до  или
или  . Мы выберем
. Мы выберем  .
.

Где будет находиться  (в левой или правой части), мы пока не знаем.
(в левой или правой части), мы пока не знаем.
1. Применим сначала метод электронно-ионного баланса. В этом методе рассматривают переход электронов от одних атомов или ионов к другим с учетом характера среды (кислая, щелочная или нейтральная), в которой протекает реакция. - При составлении уравнений процессов окисления и восстановления для уравнивания числа атомов водорода и кислорода вводят (в зависимости от среды) или молекулы воды и ионы водорода (если среда кислая), или молекулы воды и гидроксид-ионы (если среда щелочная). Соответственно и в получаемых продуктах в правой части электронно-ионного уравнения будут находиться ионы водорода и молекулы воды (кислая среда) или гидроксид-ионы и молекулы воды (щелочная среда).
Таким образом, при написании электронно-ионных уравнений нужно исходить из состава ионов, действительно имеющихся в растворе. Кроме того, как и при составлении сокращенных ионных уравнений, вещества малодиссоциирующие, плохо растворимые или выделяющиеся в виде газа следует писать в молекулярной форме.
Рассмотрим для нашего случая полуреакцию окисления.
Молекула  превращается в ион
превращается в ион  полностью диссоциирует на ионы, гидролизом пренебрегаем) и два иона
полностью диссоциирует на ионы, гидролизом пренебрегаем) и два иона  (диссоциация
(диссоциация  ):
):

Для того чтобы уравнять кислород, в левую часть добавим 8 молекул  а в правую — 16 ионов
а в правую — 16 ионов  (среда кислая!):
(среда кислая!):

Заряд левой части равен 0, заряд правой  поэтому
поэтому  должен отдать 15 электронов:
должен отдать 15 электронов:

Рассмотрим теперь полуреакцию восстановления нитрат-иона:

Необходимо отнять у  атома О. Для этого к левой части добавим 4 иона
атома О. Для этого к левой части добавим 4 иона  (кислая среда), а к правой — 2 молекулы
(кислая среда), а к правой — 2 молекулы 

Для уравнивания заряда к левой части (заряд  ) добавим 3 электрона:
) добавим 3 электрона:

Окончательно имеем:

Сократив обе части на  получим сокращенное ионное уравнение окислительно-восстановительной реакции:
получим сокращенное ионное уравнение окислительно-восстановительной реакции:

Добавив в обе части уравнения соответствующее количество ионов  находим молекулярное уравнение реакции:
находим молекулярное уравнение реакции:

Обратите внимание, что для определения количества отданных и принятых электронов нам ни разу не пришлось определять степень окисления элементов. Кроме того, мы учли влияние среды и автоматически определили, что  находится в правой части уравнения. Несомненно то, что этот метод гораздо больше соответствует химическому смыслу, чем стандартный метод электронного баланса,
находится в правой части уравнения. Несомненно то, что этот метод гораздо больше соответствует химическому смыслу, чем стандартный метод электронного баланса,  хотя последний несколько проще для понимания.
хотя последний несколько проще для понимания.
2. Уравняем данную реакцию методом электронного баланса. Процесс восстановления описывается просто:

Сложнее составить схему окисления, поскольку окисляются сразу 2 элемента — Fe и S. Можно приписать железу степень окисления  сере
сере  и учесть, что на 1 атом Fe приходится два атома S:
и учесть, что на 1 атом Fe приходится два атома S:

Можно, однако, обойтись без определения степеней окисления и записать схему, напоминающую схему (7.1):

Правая часть имеет заряд +15, левая — 0, поэтому  должен отдать 15 электронов. Записываем общий баланс:
должен отдать 15 электронов. Записываем общий баланс:

5 молекул  идут на окисление
идут на окисление  , и еще 3 молекулы
, и еще 3 молекулы  необходимы для образования
необходимы для образования 

Чтобы уравнять водород и кислород, добавляем в правую часть 2 молекулы  :
:

Метод электронно-ионного баланса более универсален по сравнению с методом электронного баланса и имеет неоспоримое преимущество при подборе коэффициентов во многих окислительно-восстановительных реакциях, в частности, с участием органических соединений, в которых даже процедура определения степеней окисления является очень сложной.
Рассмотрим, например, процесс окисления этилена, происходящий при пропускании его через водный раствор перманганата калия. В результате этилен окисляется до этиленгликоля  , а перманганат восстанавливается до оксида марганца (IV), кроме того, как будет очевидно из итогового уравнения баланса, справа образуется также гидроксид калия:
, а перманганат восстанавливается до оксида марганца (IV), кроме того, как будет очевидно из итогового уравнения баланса, справа образуется также гидроксид калия:

После проведения необходимых сокращений подобных членов, записываем уравнение в окончательном молекулярном виде

Количественная характеристика окислительно-восстановительных реакций. Ряд стандартных электродных потенциалов. Возможность протекания любой окислительно-восстановительной реакции в реальных условиях обусловлена рядом причин: температурой, природой окислителя и восстановителя, кислотностью среды, концентрацией веществ, участвующих в реакции, и т.д.
Учесть все эти факторы бывает трудно, но, помня о том, что любая окислительно-восстановительная реакция протекает с переносом электронов от восстановителя к окислителю, можно установить критерий возможности протекания такой реакции.
Количественной характеристикой окислительно-восста-новительных процессов являются нормальные окислительно-восстановительные потенциалы окислителей и восстановителей (или стандартные потенциалы электродов).
Чтобы понять физико-химический смысл таких потенциалов, необходимо проанализировать так называемые электрохимические процессы.
Химические процессы, сопровождающиеся возникновением электрического тока или вызываемые им, называются электрохимическими.
Чтобы понять природу электрохимических процессов, обратимся к рассмотрению нескольких достаточно простых ситуаций. Представим себе металлическую пластинку, погруженную в воду. Под действием полярных молекул воды ионы металла отрываются от поверхности пластинки и гидратированными переходят в жидкую фазу. Последняя при этом заряжается положительно, а на металлической пластинке появляется избыток электронов. Чем дальше протекает процесс, тем больше становится заряд как пластинки, так и жидкой фазы.
Благодаря электростатическому притяжению катионов раствора и избыточных электронов металла на границе раздела фаз возникает так называемый двойной электрический слой, который тормозит дальнейший переход ионов металла в жидкую фазу. Наконец наступает момент, когда между раствором и металлической пластинкой устанавливается равновесие, которое можно выразить уравнением:

или с учетом гидратации ионов в растворе:

Состояние этого равновесия зависит от природы металла, концентрации его ионов в растворе, от температуры и давления.
При погружении металла не в воду, а в раствор соли этого металла равновесие в соответствии с принципом Ле Шателье смещается влево и тем больше, чем выше концентрация ионов металла в растворе. Активные металлы, ионы которых обладают хорошей способностью переходить в раствор, будут в этом случае заряжаться отрицательно, хотя в меньшей степени, чем в чистой воде.
Равновесие (7.2) можно сместить вправо, если тем или иным способом удалять электроны из металла. Это приведет к растворению металлической пластинки. Наоборот, если к металлической пластинке подводить электроны извне, то на ней будет происходить осаждение ионов из раствора.
Как уже отмечалось, при погружении металла в раствор на границе раздела фаз образуется двойной электрический слой. Разность потенциалов, возникающую между металлом и окружающей его жидкой фазой, называют электродным потенциалом. Этот потенциал является характеристикой .окислительно-восстановительной способности металла в виде твердой фазы.
Заметим, что у изолированного металлического атома (состояние одноатомного пара, возникающее при высоких температурах и высоких степенях разрежения) окислительно-восстановительные свойства характеризуются другой величиной, называемой ионизационным потенциалом. Ионизационный потенциал — это энергия, необходимая для отрыва электрона от изолированного атома.
Абсолютное значение электродного потенциала нельзя измерить непосредственно. Вместе с тем, не представляет труда измерение разности электродных потенциалов, которая возникает в системе, состоящей из двух пар металл—раствор. Такие пары называют полу элементами. Условились определять электродные потенциалы металлов по отношению к так называемому стандартному водородному электроду, потенциал которого произвольно принят за ноль. Стандартный водородный электрод состоит из специально приготовленной платиновой пластинки, погруженной в раствор кислоты с концентрацией ионов водорода  и омываемой струей газообразного во дорода под давлением
и омываемой струей газообразного во дорода под давлением  Па, при температуре
Па, при температуре 
Возникновение потенциала на стандартном водородном электроде можио представить себе следующим образом. Газообразный водород, адсорбируясь платиной, переходит в атомарное состояние:

Между атомарным водородом, образующимся на поверхности пластины, ионами водорода в растворе и платиной (электроны!) реализуется состояние динамического равновесия:

Суммарный процесс выражается уравнением:

Платина не принимает участия в окислительно-восстановительном процессе, а является лишь носителем атомарного водорода.
Если пластинку металла, погруженную в раствор его соли с концентрацией ионов металла, равной 1 моль/л, соединить со стандартным водородным электродом, то получится гальванический элемент. Электродвижущая сила этого элемента (ЭДС), измеренная при  и характеризует стандартный электродный потенциал металла, обозначаемый обычно как
и характеризует стандартный электродный потенциал металла, обозначаемый обычно как  .
.
В таблице 7.1 представлены значения стандартных электродных потенциалов некоторых металлов. Стандартные потенциалы электродов, выступающих как восстановители по отношению к водороду, имеют знак «-», а знаком «+» отмечены стандартные потенциалы электродов, являющихся окислителями.
Металлы, расположенные в порядке возрастания их стандартных электродных потенциалов, образуют так называемый электрохимический ряд напряжений металлов:

Ряд напряжений характеризует химические свойства металлов:
1. Чем более отрицателен электродный потенциал металла, тем больше его восстановительная способность.
2. Каждый металл способен вытеснять (восстанавливать) из растворов солей те металлы, которые стоят в электрохимическом ряду напряжений металлов после него.
3. Все металлы, имеющие отрицательный стандартный электродный потенциал, т.е. находящиеся в электрохимическом ряду напряжений металлов левее водорода, способны вытеснять его из растворов кислот.
Необходимо отметить, что представленный ряд характеризует поведение металлов и их солей только в водных растворах и при комнатной температуре. Кроме того, нужно иметь в виду, что указанные в таблице стандартные электродные потенциалы учитывают особенности взаимодействия того или иного иона с молекулами растворителя. Это может нарушать некоторые ожидаемые закономерности в расположении металлов в электрохимическом ряду напряжений металлов. Например, электрохимический ряд напряжений металлов начинается литием, тогда как более активные в химическом отношении рубидий и калий находятся правее лития. Это связано с исключительно высокой энергией процесса гидратации ионов лития по сравнению с ионами других щелочных металлов.
Одновременно в таблице 7.1 приведены стандартные окислительно-восстановительные потенциалы  которые измерены для неметаллических систем типа (7.3), находящихся в равновесном состоянии по отношению к нормальному водородному электроду.
которые измерены для неметаллических систем типа (7.3), находящихся в равновесном состоянии по отношению к нормальному водородному электроду.
В таблице приведены полуреакции восстановления следующего общего вида:

Как и в случае определения значения  металлов, значения
металлов, значения  неметаллов измеряются при температуре 25 °С и при концентрации всех атомных и молекулярных частиц, участвующих в равновесии, равной 1 моль/л.
неметаллов измеряются при температуре 25 °С и при концентрации всех атомных и молекулярных частиц, участвующих в равновесии, равной 1 моль/л.
Таблица 7.1. Стандартные окислительно-восстановительные потенциалы при 25 °С (298 К)
(см. скан)
Алгебраическое значение стандартного окислительно-восстановительного потенциала характеризует окислительную активность соответствующей окисленной формы. Поэтому сопоставление значений стандартных окислительно-восстановительных потенциалов позволяет ответить на вопрос: протекает ли та или иная окислительно-восстановительная реакция?
Так, все полуреакции окисления галогенид-ионов до свободных галогенов

могут быть реализованы в стандартных условиях при использовании в качестве окислителя оксида свинца (IV)  или перманганата калия
или перманганата калия  . При использовании дихромата калия
. При использовании дихромата калия  удается осуществить только реакции (7.5) и (7.6). Наконец, использование в качестве окислителя азотной кислоты
удается осуществить только реакции (7.5) и (7.6). Наконец, использование в качестве окислителя азотной кислоты  позволяет осуществить только полуреакцию с участием иодид-ионов (7.6).
позволяет осуществить только полуреакцию с участием иодид-ионов (7.6).
Таким образом, количественным критерием оценки возможности протекания той или иной окислительновосстановительной реакции является положительное значение разности стандартных окислительно-восстановительных потенциалов полуреакций окисления и восстановления.
| << Предыдущий параграф | Следующий параграф >> |
- ВВЕДЕНИЕ
- Глава I. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИИ
- § 1. Предмет химии. Важнейшие понятия и законы химии
- Основные стехиометрические законы химии
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 2. Строение атома
- Электронные конфигурации атомов
- Ядро атома и радиоактивные превращения
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 3. Строение молекул. Химическая связь. Валентность элементов
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 4. Агрегатные состояния вещества
- Характерные свойства газов, жидкостей и твердых тел
- Газообразное состояние. Газовые законы
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 5. Закономерности протекания химических реакций
- Химическая кинетика
- Химическое равновесие
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 6. Растворы. Электролитическая диссоциация. Гидролиз солей
- Электролиты и электролитическая диссоциация
- Гидролиз солей
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 7. Классификация химических реакций. Окислительно-восстановительные процессы. Электролиз
- Окислительно-восстановительные реакции
- Электролиз
- ЗАДАЧИ И УПРАЖНЕНИЯ
- Глава II. НЕОРГАНИЧЕСКАЯ ХИМИЯ
- § 8. Номенклатура, классификация неорганических веществ. Свойства и способы получения
- Оксиды
- Основания (гидроксиды металлов)
- Кислоты
- Соли
- § 9. Водород. Галогены и их соединения
- Галогены и их соединения
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 10. Подгруппа кислорода
- Сера и ее соединения
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 11. Подгруппа азота
- Фосфор и его соединения
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 12. Подгруппа углерода
- Углерод и его соединения
- Кремний и его соединения
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 13. Свойства s-элементов (щелочных и щелочноземельных металлов) и их соединений
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 14. Алюминий — типичный р-металл
- Соединения алюминия и их свойства
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 15. Главные переходные металлы (d-элементы) и их соединения
- Химические свойства d-элементов
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 16. Задачи для повторения по неорганической химии
- Глава III. ОРГАНИЧЕСКАЯ ХИМИЯ
- § 17. Основные понятия и закономерности в органической химии. Предмет органической химии
- Классификация и номенклатура органических соединений
- Изомерия органических соединений
- Взаимное влияние атомов в молекуле и реакционная способность органических соединений
- Общая характеристика органических реакций
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 18. Предельные (насыщенные) углеводороды
- Циклоалканы
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 19. Алкены. Диеновые углеводороды
- Диеновые углеводороды (алкадиены)
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 20. Алкины
- ЗАДАЧИ И УПРАЖНЕНИЯ
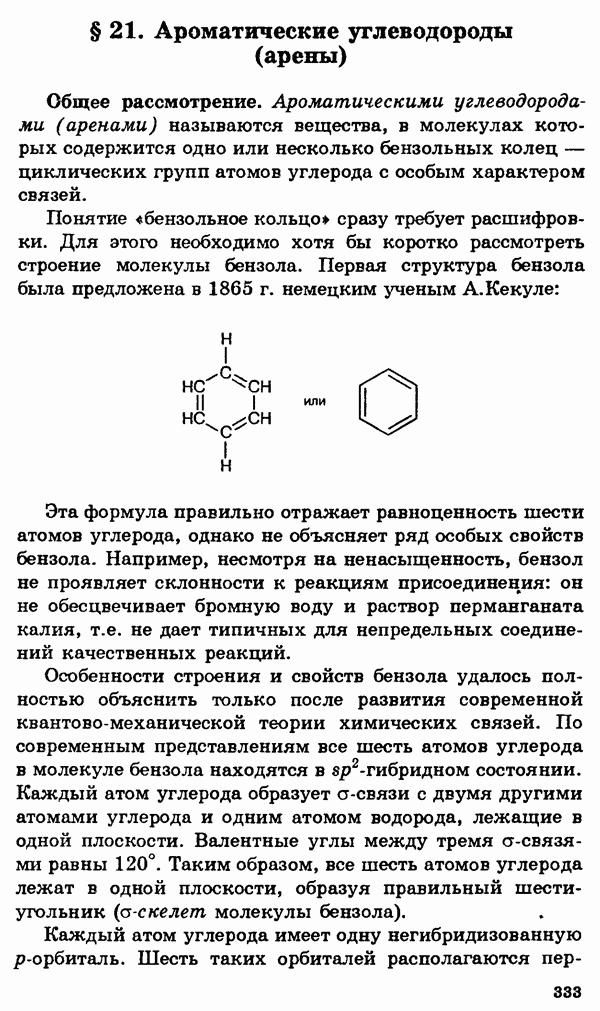
- § 21. Ароматические углеводороды (арены)
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 22. Спирты и фенолы
- Многоатомные спирты
- Фенолы
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 23. Карбонильные соединения — альдегиды и кетоны
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 24. Карбоновые кислоты. Сложные эфиры. Жиры
- Сложные эфиры. Жиры
- ЗАДАЧИ И УПРАЖНЕНИЯ
- Глава 4. ОСНОВНЫЕ ПРИЕМЫ РЕШЕНИЯ ЗАДАЧ
- Определение молекулярной формулы веществ
- Определение состава и разделение смесей
- Задачи на газовые законы
- Способы выражения концентрации растворов
- Ионные реакции в растворах
- Задачи на окислительно-восстановительные реакции
- Разные задачи
- ПРОГРАММА ПО ХИМИИ ДЛЯ ПОСТУПАЮЩИХ В УНИВЕРСИТЕТЫ
- ОТВЕТЫ
- Рекомендуемая литература