| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
§ 10. Подгруппа кислорода
Общая характеристика элементов.
Главную подгруппу шестой группы составляют кислород, сера, селен, теллур и полоний. Все эти элементы имеют электронные конфигурации внешнего валентного слоя типа  (
( соответственно у кислорода, серы, селена и теллура), что обусловливает прежде всего окислительные свойства этих элементов, хотя при переходе от кислорода к теллуру и полонию окислительная способность элементов резко ослабляется.
соответственно у кислорода, серы, селена и теллура), что обусловливает прежде всего окислительные свойства этих элементов, хотя при переходе от кислорода к теллуру и полонию окислительная способность элементов резко ослабляется.
Наибольшей окислительной способностью обладают кислород и сера, которые в виде простых веществ являются типичными неметаллами. Селен и теллур занимают промежуточное положение между неметаллами и металлами, а полоний проявляет типично металлические свойства.
Для всех элементов подгруппы кислорода характерно проявление в соединениях степени окисления, равной 2-. Все элементы этой подгруппы, за исключением кислорода, способны также давать соединения, где степень их окисления равна  или
или  это связано с существованием свободной
это связано с существованием свободной  -орбитали на внешней оболочке.
-орбитали на внешней оболочке.
Кислород во всех своих соединениях (кроме соединений с фтором, где степень его окисления  и пероксидных соединений со степенью окисления 1-), имеет степень окисления 2-.
и пероксидных соединений со степенью окисления 1-), имеет степень окисления 2-.
Кислород
Кислород в природе
Имеет три устойчивых изотопа 160, 170 и 180. В свободном состоянии находится в виде двух аллотропных модификаций — кислород  и озон
и озон  .
.
Аллотропия — способность химического элемента существовать в виде двух или нескольких простых веществ, отличающихся лишь числом атомов в молекуле либо строением.
Кислород относят к первой категории аллотропных элементов. Кислород в нормальных условиях — газ без цвета и запаха, озон — газ с характерным резким, но приятным запахом.
Вместе с азотом и незначительным количеством других газов свободный кислород образует атмосферу Земли (23,15% по массе, или 20,95% по объему).
Получение.
В промышленности кислород получают: 1) фракционной перегонкой жидкого воздуха (азот, обладающий более низкой температурой кипения, испаряется, а жидкий кислород остается); 2) электролизом воды.
В лабораторных условиях кислород получают разложением ряда солей, оксидов и пероксидов:

Особенно легко кислород выделяется в результате последней реакции, поскольку в пероксиде водорода  не двойная; а одинарная связь между атомами кислорода
не двойная; а одинарная связь между атомами кислорода 
В частности, пероксиды щелочных металлов используют на космических станциях для обеспечения космонавтов кислородом за счет его регенерации из выдыхаемого 

Химические свойства.
Кислород образует соединения со всеми элементами, кроме некоторых благородных газов (гелия, неона, аргона). Так, с большинством металлов кислород реагирует уже при комнатной температуре, например:

С неметаллами кислород реагирует, как правило, при нагревании. Так, с фосфором кислород активно реагирует при температуре 

с серой — при температуре около 

с углеродом (в виде графита) — при 

Взаимодействие кислорода с азотом начинается лишь при 1200 °С или в электрическом разряде:

О реакции кислорода с водородом читайте в § 9.
Кислород реагирует и со многими сложными соединениями, например с оксидами азота (II) он реагирует уже при комнатной температуре:

Сероводород, реагируя с кислородом при нагревании, дает серу:

или оксид серы (IV)

в зависимости от соотношения между кислородом и сероводородом.
В приведенных реакциях кислород является окислителем. В большинстве реакций окисления с участием кислорода выделяется тепло и свет — такие процессы называются горением.
Еще более сильным окислителем, чем кислород  , является озон
, является озон  (аллотропическая модификация кислорода). Он образуется в атмосфере при грозовых разрядах, чем объясняется специфический запах свежести после грозы.
(аллотропическая модификация кислорода). Он образуется в атмосфере при грозовых разрядах, чем объясняется специфический запах свежести после грозы.
В лабораториях озон получают пропусканием разряда через кислород (реакция эндотермическая):

При взаимодействии озона с раствором иодида калия выделяется иод, тогда как с кислородом эта реакция не идет:

Реакция часто используется как качественная для обнаружения ионов Г или озона. Для этого в раствор добавляют крахмал, который дает характерный синий комплекс с выделившимся иодом. Реакция качественная еще и потому, что озон не окисляет ионы  .
.
| << Предыдущий параграф | Следующий параграф >> |
- ВВЕДЕНИЕ
- Глава I. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИИ
- § 1. Предмет химии. Важнейшие понятия и законы химии
- Основные стехиометрические законы химии
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 2. Строение атома
- Электронные конфигурации атомов
- Ядро атома и радиоактивные превращения
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 3. Строение молекул. Химическая связь. Валентность элементов
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 4. Агрегатные состояния вещества
- Характерные свойства газов, жидкостей и твердых тел
- Газообразное состояние. Газовые законы
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 5. Закономерности протекания химических реакций
- Химическая кинетика
- Химическое равновесие
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 6. Растворы. Электролитическая диссоциация. Гидролиз солей
- Электролиты и электролитическая диссоциация
- Гидролиз солей
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 7. Классификация химических реакций. Окислительно-восстановительные процессы. Электролиз
- Окислительно-восстановительные реакции
- Электролиз
- ЗАДАЧИ И УПРАЖНЕНИЯ
- Глава II. НЕОРГАНИЧЕСКАЯ ХИМИЯ
- § 8. Номенклатура, классификация неорганических веществ. Свойства и способы получения
- Оксиды
- Основания (гидроксиды металлов)
- Кислоты
- Соли
- § 9. Водород. Галогены и их соединения
- Галогены и их соединения
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 10. Подгруппа кислорода
- Сера и ее соединения
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 11. Подгруппа азота
- Фосфор и его соединения
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 12. Подгруппа углерода
- Углерод и его соединения
- Кремний и его соединения
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 13. Свойства s-элементов (щелочных и щелочноземельных металлов) и их соединений
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 14. Алюминий — типичный р-металл
- Соединения алюминия и их свойства
- ЗАДАЧИ И УПРАЖНЕНИЯ
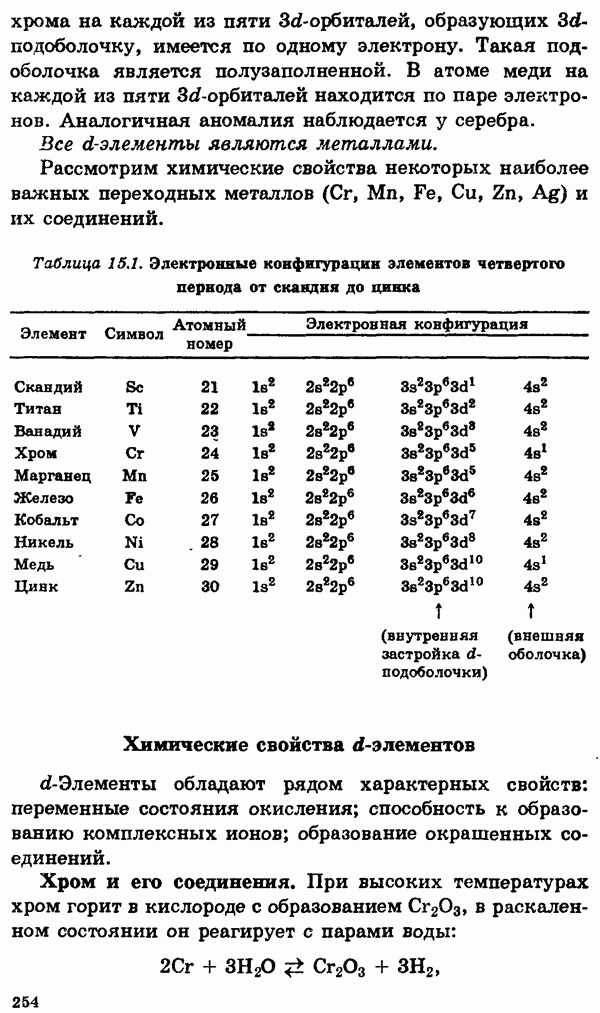
- § 15. Главные переходные металлы (d-элементы) и их соединения
- Химические свойства d-элементов
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 16. Задачи для повторения по неорганической химии
- Глава III. ОРГАНИЧЕСКАЯ ХИМИЯ
- § 17. Основные понятия и закономерности в органической химии. Предмет органической химии
- Классификация и номенклатура органических соединений
- Изомерия органических соединений
- Взаимное влияние атомов в молекуле и реакционная способность органических соединений
- Общая характеристика органических реакций
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 18. Предельные (насыщенные) углеводороды
- Циклоалканы
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 19. Алкены. Диеновые углеводороды
- Диеновые углеводороды (алкадиены)
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 20. Алкины
- ЗАДАЧИ И УПРАЖНЕНИЯ
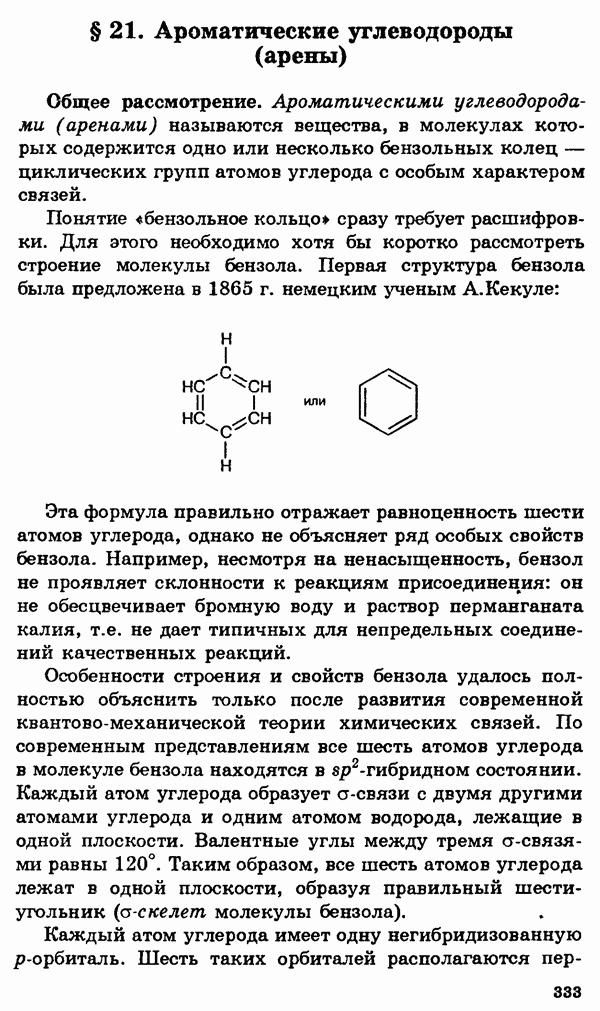
- § 21. Ароматические углеводороды (арены)
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 22. Спирты и фенолы
- Многоатомные спирты
- Фенолы
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 23. Карбонильные соединения — альдегиды и кетоны
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 24. Карбоновые кислоты. Сложные эфиры. Жиры
- Сложные эфиры. Жиры
- ЗАДАЧИ И УПРАЖНЕНИЯ
- Глава 4. ОСНОВНЫЕ ПРИЕМЫ РЕШЕНИЯ ЗАДАЧ
- Определение молекулярной формулы веществ
- Определение состава и разделение смесей
- Задачи на газовые законы
- Способы выражения концентрации растворов
- Ионные реакции в растворах
- Задачи на окислительно-восстановительные реакции
- Разные задачи
- ПРОГРАММА ПО ХИМИИ ДЛЯ ПОСТУПАЮЩИХ В УНИВЕРСИТЕТЫ
- ОТВЕТЫ
- Рекомендуемая литература