| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
Ядро атома и радиоактивные превращения
Рассмотрев электронную структуру атома, приведем теперь некоторые сведения о строении и свойствах ядра атома. Наряду с химическими реакциями, в которых принимают участие только электроны, существуют различные превращения, в которых изменению подвергаются ядра атомов (ядерные реакции).
Согласно современным представлениям, химическим элементом называют вид атомов, характеризующихся одним и тем, же зарядом ядра. Атомы одного и того же элемента, имеющие разную массу (массовое число), называют изотопами. Обычно изотопы различных элементов не имеют специальных названий. Единственным исключением является водород, изотопы которого имеют специальные химические символы и названия:  — протий,
— протий,  — дейтерий,
— дейтерий,  — тритий.
— тритий.

Рис. 2.3. Схема заполнения электронами энергетических уровней и подуровней
Это связано с тем, что относительное отличие масс изотопов для водорода является максимальным среди всех химических элементов.
Устойчивые и неустойчивые изотопы. Все изотопы подразделяются на стабильные и радиоактивные. Стабильные изотопы не подвергаются радиоактивному распаду, поэтому они и сохраняются в природных условиях. Примерами стабильных изотопов являются  . Большинство природных элементов состоит из смеси двух или большего числа стабильных изотопов. Из всех элементов наибольшее число стабильных изотопов имеет олово (10 изотопов).
. Большинство природных элементов состоит из смеси двух или большего числа стабильных изотопов. Из всех элементов наибольшее число стабильных изотопов имеет олово (10 изотопов).
В редких случаях, например у алюминия, в природе встречается только один стабильный изотоп, а остальные изотопы неустойчивы.
Радиоактивные изотопы подразделяются, в свою очередь, на естественные и искусственные — и те и другие самопроизвольно распадаются, испуская при этом  или
или  -частицы до тех пор, пока не образуется стабильный изотоп. Химические свойства всех изотопов в основном одинаковы. Эти свойства определяются, главным образом, зарядом ядра, а не его массой.
-частицы до тех пор, пока не образуется стабильный изотоп. Химические свойства всех изотопов в основном одинаковы. Эти свойства определяются, главным образом, зарядом ядра, а не его массой.
Виды радиоактивного распада.
Существует три основных вида самопроизвольных ядерных превращений.
1.  -распад. Ядро испускает
-распад. Ядро испускает  -частицу, которая представляет собой ядро атома гелия
-частицу, которая представляет собой ядро атома гелия  и состоит из двух протонов и двух нейтронов. При
и состоит из двух протонов и двух нейтронов. При  -распаде массовое число изотопа уменьшается на 4, а заряд ядра — на 2, например
-распаде массовое число изотопа уменьшается на 4, а заряд ядра — на 2, например

2.  -распад. В неустойчивом ядре нейтрон превращается в протон, при этом ядро испускает электрон (
-распад. В неустойчивом ядре нейтрон превращается в протон, при этом ядро испускает электрон ( -частицу) и антинейтрино:
-частицу) и антинейтрино:

При  -распаде массовое число изотопа не изменяется, поскольку общее число протонов и нейтронов сохраняется, а заряд ядра увеличивается на 1, например
-распаде массовое число изотопа не изменяется, поскольку общее число протонов и нейтронов сохраняется, а заряд ядра увеличивается на 1, например

3.  -распад. Возбужденное ядро испускает электромагнитное излучение с очень малой длиной волны и очень высокой частотой (у-излучение), при этом энергия ядра уменьшается, массовое число и заряд ядра остаются неизменными.
-распад. Возбужденное ядро испускает электромагнитное излучение с очень малой длиной волны и очень высокой частотой (у-излучение), при этом энергия ядра уменьшается, массовое число и заряд ядра остаются неизменными.
Скорость радиоактивного распада.
Нужно подчеркнуть, что скорости распада радиоактивных элементов сильно отличаются от одного элемента к другому и не зависят от внешних условий, таких, например, как температура (в этом состоит важное отличие ядерных реакций от обычных химических превращений).
Каждый радиоактивный элемент характеризуется периодом полураспада  т.е. временем, за которое самопроизвольно распадается половина атомов исходного вещества. Для разных элементов период полураспада имеет сильно отличающиеся значения. Так, для урана
т.е. временем, за которое самопроизвольно распадается половина атомов исходного вещества. Для разных элементов период полураспада имеет сильно отличающиеся значения. Так, для урана  период полураспада
период полураспада  лет. Именно поэтому активность урана в течение нескольких лет заметно не меняется. Для радия
лет. Именно поэтому активность урана в течение нескольких лет заметно не меняется. Для радия  период полураспада
период полураспада  лет, поэтому и активность радия больше, чем урана. Ясно, что чем меньше период полураспада, тем быстрее протекает радиоактивный распад. Для разных элементов период полураспада может изменяться от миллионных долей секунды до миллиардов лет.
лет, поэтому и активность радия больше, чем урана. Ясно, что чем меньше период полураспада, тем быстрее протекает радиоактивный распад. Для разных элементов период полураспада может изменяться от миллионных долей секунды до миллиардов лет.
На примере естественного распада урана  покажем превращения, которые через промежуточные радиоактивные элементы приводят к устойчивому элементу — свинцу
покажем превращения, которые через промежуточные радиоактивные элементы приводят к устойчивому элементу — свинцу  (рис. 2.4). Схема на рис. 2.4 хорошо иллюстрирует различие в периодах полураспада
(рис. 2.4). Схема на рис. 2.4 хорошо иллюстрирует различие в периодах полураспада  Для различных элементов (периоды полураспада даны внизу под стрелкой, частицы, испускаемые радиоактивными элементами, — над стрелкой).
Для различных элементов (периоды полураспада даны внизу под стрелкой, частицы, испускаемые радиоактивными элементами, — над стрелкой).
Математическое уравнение, описывающее закон радиоактивного распада, связывает значение массы  радиоактивного изотопа в момент времени t с начальной массой
радиоактивного изотопа в момент времени t с начальной массой 

Заканчивая обсуждение естественной радиоактивности, отметим, что, кроме приведенного на рис. 2.4 естественного ряда радиоактивных элементов (так называемого ряда урана), известны еще два других естественных ряда — это ряд актиния, начинающийся с  и заканчивающийся
и заканчивающийся  и ряд тория, начинающийся с
и ряд тория, начинающийся с  и заканчивающийся
и заканчивающийся  . Существует еще и четвертый ряд радиоактивных изотопов, этот ряд получен искусственно.
. Существует еще и четвертый ряд радиоактивных изотопов, этот ряд получен искусственно.

Рис. 2.4. Схема распада урана-238
Искусственные превращения.
Первая искусственная ядерная реакция была осуществлена Резерфордом путем бомбардировки атомов азота  -частицами
-частицами

В настоящее время, чтобы осуществить искусственные превращения, чаще используют протоны или нейтроны, например:

Надо помнить, что в ядерных реакциях (в случае естественного или искусственного превращения элементов) сумма атомных масс (сумма индексов слева вверху) реагентов и продуктов всегда одинакова. То же самое относится и к зарядам ядер (индексы слева внизу, которые часто опускаются).
В 1930 г. Э. Лоуренс создал первый в мире циклотрон (ускоритель элементарных частиц — «снарядов» для бомбардировки ядер атомов), после чего было открыто и изучено множество разнообразных ядерных реакций. В настоящее время специальная область химии, ядерная химия, занимается изучением превращений элементов.
Особую важность представлял синтез неизвестных ранее элементов: технеция, франция, астата и др., а также всех трансурановых элементов (элементов, порядковый номер которых превышает 92). В настоящее время получено 17 трансурановых элементов (от  до
до  включительно).
включительно).
Периодический закон и периодическая таблица Д.И. Мевделеева.
Открытие периодического закона и разработка периодической системы химических элементов Д.И. Менделеевым явились вершиной развития химии в XIX в. Обширная сумма знаний о свойствах 63 элементов, известных к тому времени, была приведена в стройный порядок.
Попытки классифицировать химические элементы имели место и до Менделеева. Некоторые предшественники Менделеева, замечая сходство некоторых элементов, объединяли их в отдельные группы. Но во всех этих работах не были найдены причины замеченных изменений свойств.
Менделеев считал, что основной характеристикой элементов являются их атомные веса, и в 1869 г. впервые сформулировал периодический закон:
Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины атомных весов элементов.
Мы не будем подробно останавливаться на рассмотрении периодического закона и периодической таблицы в трактовке Менделеева.
Несмотря на всю огромную значимость такого открытия, периодический закон и система Менделеева представляли лишь гениальное эмпирическое обобщение фактов, а их физический смысл долгое время оставался непонятным.
Причина этого заключалась в том, что в XIX в., как мы знаем, совершенно отсутствовали какие-либо представления о сложности строения атома.
Данные о строении ядра и о распределении электронов в атомах позволяют рассмотреть периодический закон и периодическую систему элементов с фундаментальных физических позиций. На базе современных представлений периодический закон формулируется так:
Свойства простых веществ, а также формы и свойства соединений элементов находятся в периодической зависимости от величины заряда ядра атома (порядкового номера).
Периодическая таблица и электронные конфигурации атомов.
Из рассмотрения электронных конфигураций атомов можно наглядно проследить периодичность свойств элементов, открытую впервые Д. И. Менделеевым.
Число электронов, находящихся на внешнем уровне в атомах элементов, располагающихся в порядке увеличения порядкового номера, периодически повторяется. Периодическое изменение свойств элементов с увеличением порядкового номера объясняется периодическим изменением строения их атомов, а именно числом электронов на их внешних энергетических уровнях. По числу энергетических уровней в электронной оболочке атома элементы делятся на семь периодов. Первый период состоит из атомов, в которых электронная оболочка состоит из одного энергетического уровня, во втором периоде — из двух, в третьем — из трех, в четвертом — из четырех и т.д. Каждый новый период начинается тогда, когда начинает заполняться новый энергетический уровень.
В периодической системе каждый период начинается элементами, атомы которых на внешнем уровне имеют один электрон, — атомами щелочных металлов — и заканчивается элементами, атомы которых на внешнем уровне имеют 2 (в первом периоде) или 8 электронов (во всех последующих) — атомами благородных газов.
Далее мы видим, что внешние электронные оболочки сходны у атомов элементов  и т.д.
и т.д.
Именно поэтому каждая из вышеприведенных групп элементов оказывается в определенной главной подгруппе периодической таблицы: Li, Na, K, Rb, Cs в I группе, F, Cl, Br, — в VII и т.д. Именно вследствие сходства строения электронных оболочек атомов, сходны их физические и химические свойства.
Число главных подгрупп определяется максимальным числом элементов на энергетическом уровне и равно 8. Число переходных элементов (элементов побочных подгрупп) определяется максимальным числом электронов на ( -подуровне и равно 10 в каждом из больших периодов.
-подуровне и равно 10 в каждом из больших периодов.
Поскольку в периодической системе химических элементов Д. И. Менделеева одна из побочных подгрупп содержит сразу три переходных элемента, близких по химическим свойствам (так называемые триады Fe-Co-Ni, Ru-Rh-Pd, Os-Ir-Pt), то число побочных подгрупп, так же как и главных, равно 8.
По аналогии с переходными элементами, число лантаноидов и актиноидов, вынесенных внизу периодической системы в виде самостоятельных рядов, равно максимальному числу электронов на  -подуровне, т.е. 14.
-подуровне, т.е. 14.
Таким образом, строгая периодичность расположения элементов в периодической системе химических элементов Д. И. Менделеева полностью объясняется последовательным характером заполнения энергетических уровней.
Рекомендуемая литература: [Кузьменко, 1977, гл. 2], [Третьяков, § 7—9], [Фримантл, т. 1, стр. 11-80], [Хомченко, 1993, гл. 2].
| << Предыдущий параграф | Следующий параграф >> |
- ВВЕДЕНИЕ
- Глава I. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИИ
- § 1. Предмет химии. Важнейшие понятия и законы химии
- Основные стехиометрические законы химии
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 2. Строение атома
- Электронные конфигурации атомов
- Ядро атома и радиоактивные превращения
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 3. Строение молекул. Химическая связь. Валентность элементов
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 4. Агрегатные состояния вещества
- Характерные свойства газов, жидкостей и твердых тел
- Газообразное состояние. Газовые законы
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 5. Закономерности протекания химических реакций
- Химическая кинетика
- Химическое равновесие
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 6. Растворы. Электролитическая диссоциация. Гидролиз солей
- Электролиты и электролитическая диссоциация
- Гидролиз солей
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 7. Классификация химических реакций. Окислительно-восстановительные процессы. Электролиз
- Окислительно-восстановительные реакции
- Электролиз
- ЗАДАЧИ И УПРАЖНЕНИЯ
- Глава II. НЕОРГАНИЧЕСКАЯ ХИМИЯ
- § 8. Номенклатура, классификация неорганических веществ. Свойства и способы получения
- Оксиды
- Основания (гидроксиды металлов)
- Кислоты
- Соли
- § 9. Водород. Галогены и их соединения
- Галогены и их соединения
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 10. Подгруппа кислорода
- Сера и ее соединения
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 11. Подгруппа азота
- Фосфор и его соединения
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 12. Подгруппа углерода
- Углерод и его соединения
- Кремний и его соединения
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 13. Свойства s-элементов (щелочных и щелочноземельных металлов) и их соединений
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 14. Алюминий — типичный р-металл
- Соединения алюминия и их свойства
- ЗАДАЧИ И УПРАЖНЕНИЯ
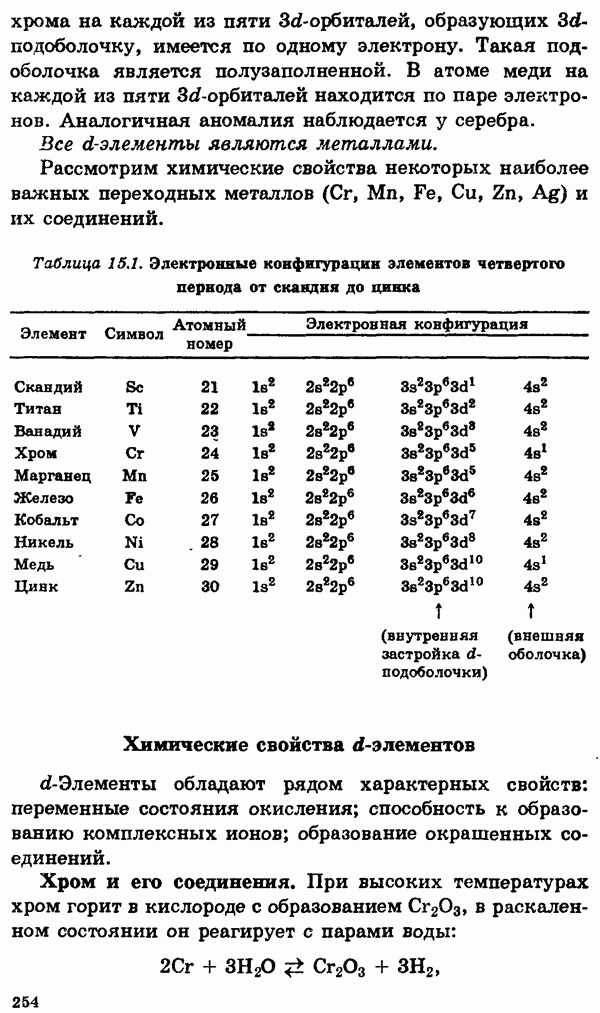
- § 15. Главные переходные металлы (d-элементы) и их соединения
- Химические свойства d-элементов
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 16. Задачи для повторения по неорганической химии
- Глава III. ОРГАНИЧЕСКАЯ ХИМИЯ
- § 17. Основные понятия и закономерности в органической химии. Предмет органической химии
- Классификация и номенклатура органических соединений
- Изомерия органических соединений
- Взаимное влияние атомов в молекуле и реакционная способность органических соединений
- Общая характеристика органических реакций
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 18. Предельные (насыщенные) углеводороды
- Циклоалканы
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 19. Алкены. Диеновые углеводороды
- Диеновые углеводороды (алкадиены)
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 20. Алкины
- ЗАДАЧИ И УПРАЖНЕНИЯ
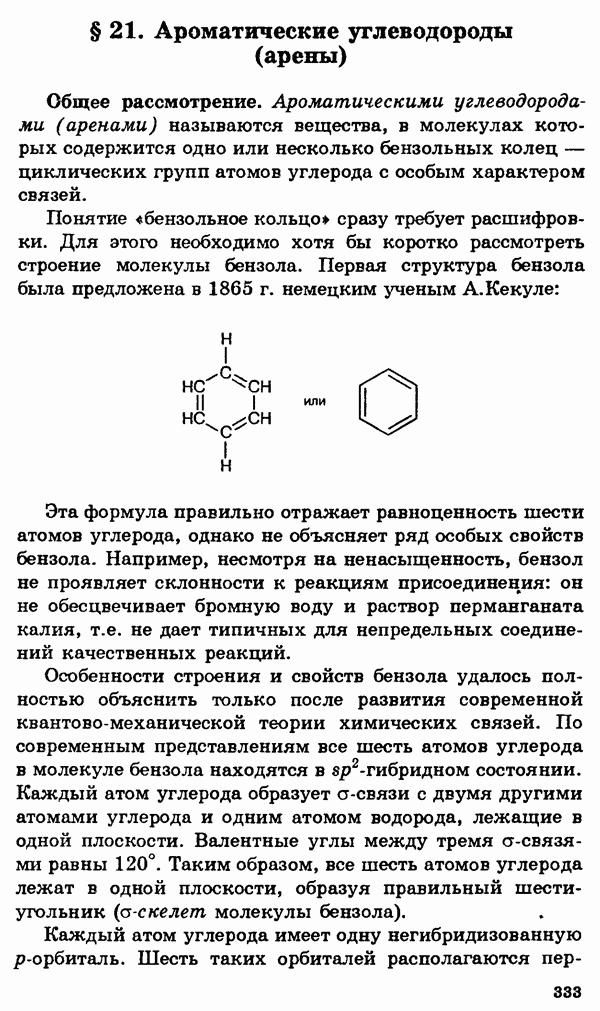
- § 21. Ароматические углеводороды (арены)
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 22. Спирты и фенолы
- Многоатомные спирты
- Фенолы
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 23. Карбонильные соединения — альдегиды и кетоны
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 24. Карбоновые кислоты. Сложные эфиры. Жиры
- Сложные эфиры. Жиры
- ЗАДАЧИ И УПРАЖНЕНИЯ
- Глава 4. ОСНОВНЫЕ ПРИЕМЫ РЕШЕНИЯ ЗАДАЧ
- Определение молекулярной формулы веществ
- Определение состава и разделение смесей
- Задачи на газовые законы
- Способы выражения концентрации растворов
- Ионные реакции в растворах
- Задачи на окислительно-восстановительные реакции
- Разные задачи
- ПРОГРАММА ПО ХИМИИ ДЛЯ ПОСТУПАЮЩИХ В УНИВЕРСИТЕТЫ
- ОТВЕТЫ
- Рекомендуемая литература