| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
Задачи на газовые законы
Задача 24. При каком молярном соотношении аргона и азота получается смесь, плотность которой равна плотности воздуха?
Решение. Средняя молярная масса смеси равна средней молярной массе воздуха, т.е. 29 г/моль.
Пусть в смеси содержится  моль
моль  и у моль
и у моль  Тогда, пользуясь определением средней молярной массы, можно записать соотношение
Тогда, пользуясь определением средней молярной массы, можно записать соотношение

откуда  .
.
Мы видим, что средняя молярная масса газовой смеси зависит от относительного, а не абсолютного количества компонентов смеси, т.е. не от х и у по отдельности, а только от их отношения.
Ответ. 
Задача 25. Плотность смеси кислорода и озона по водороду равна 20. Определите массовую, объемную и мольную доли кислорода в смеси.
Решение. Средняя молярная масса смеси равна 20•2 = 40 г/моль. Пусть в смеси содержится х моль  и у моль
и у моль  . Тогда, пользуясь определением средней молярной массы, можно записать соотношение
. Тогда, пользуясь определением средней молярной массы, можно записать соотношение

откуда  Следовательно, количества кислорода и озона в смеси равны, т.е. мольная доля кислорода равна 50%.
Следовательно, количества кислорода и озона в смеси равны, т.е. мольная доля кислорода равна 50%.
По закону Авогадро, объем газа прямо пропорционален его количеству, причем коэффициент пропорциональности одинаков для всех газов и зависит только от температуры и давления, поэтому объемная доля газа в смеси всегда равна его мольной доле.
Найдем теперь массовую долю кислорода.  Массовая доля равна
Массовая доля равна 
Мы видим, что мольная, объемная и массовая доли вещества в смеси не зависят от общего количества смеси (от х). Поэтому для расчетов часто выбирают любое удобное количество смеси, например 1 моль, или  или 100 г и т.д.
или 100 г и т.д.
Ответ. Мольная и объемная доли  , массовая доля
, массовая доля  .
.
Задача 26. Найдите плотность по водороду воздуха, имеющего следующий объемный состав: 
Решение. Поскольку объемы газов пропорциональны их количествам (закон Авогадро), то среднюю молярную массу смеси можно выражать не только через моли, но и через объемы:

Возьмем  смеси, тогда
смеси, тогда  Подставляя эти значения в формулу (1), получим
Подставляя эти значения в формулу (1), получим

Ответ. 
Задача 27. (ММА, леч. ф-т, 1989). Имеется смесь азота и углекислого газа. При добавлении какого газа к этой смеси ее плотность: а) увеличится; б) уменьшится? Приведите по два примера в каждом случае.
Решение. Это — очень красивая задача на верхнюю и нижнюю границу средней молярной массы смеси. Идея задачи состоит в том, что мы не можем точно рассчитать среднюю молярную массу, поскольку мы не знаем относительные количества веществ. Однако существует простая математическая теорема, согласно которой при любом содержании компонентов средняя молярная масса всегда больше наименьшей молярной массы среди всех компонентов смеси и меньше наибольшей молярной массы:

В применении к данной задаче это означает, что

Для того чтобы плотность смеси увеличилась, надо добавить газ с молярной массой, большей, чем  .
.
Для этого достаточно, чтобы  г/моль, например
г/моль, например 
Аналогично,  того, чтобы плотность смеси уменьшилась, надо добавить газ с молярной массой, меньшей, чем
того, чтобы плотность смеси уменьшилась, надо добавить газ с молярной массой, меньшей, чем  Для этого достаточно, чтобы
Для этого достаточно, чтобы  г/моль, например СН4 (М = 16) и Не (М = 4).
г/моль, например СН4 (М = 16) и Не (М = 4).
Ответ: 
Задача 28. (МГУ, хим. ф-т, 1994). Определите плотность этаналя при выбранных вами условиях.
Решение. Идея задачи состоит в том, что надо выбрать условия (температуру и давление), при которых  является газом. Достаточно взять нормальное давление
является газом. Достаточно взять нормальное давление  кПа и не очень высокую температуру, например
кПа и не очень высокую температуру, например  После этого плотность можно вычислить по уравнению Менделеева—Клапейрона:
После этого плотность можно вычислить по уравнению Менделеева—Клапейрона:

Многие делают в этой задаче естественную ошибку, выбирая нормальные условия, при которых этаналь является жидкостью, и его плотность нельзя определить по газовым законам.
Задача 29. (ММА, леч. ф-т, 1990). При дегидрировании бутана объемом 100 л выделилось 200 л водорода. Установите молекулярную формулу образовавшегося продукта. Объемы газов измерены при 150 °С и 101 кПа.
Решение. Уравнение дегидрирования бутана можно записать в общем виде:

Мы должны найти х. Для этого можно определить количества молей бутана и водорода по уравнению Менделеева—Клапейрона и найти их отношение. Однако решение многих газовых задач сильно облегчается использованием закона Авогадро, согласно которому отношение количеств газов равно отношению их объемов.

Следовательно, формула образовавшегося углеводорода — 
Ответ.  .
.
Задача 30. (ММА, леч. ф-т, 1993). Какой объем воздуха расходуется для полного сжигания смеси циклобутана и бутена объемом  ? Объемы газов измерены при одинаковых условиях.
? Объемы газов измерены при одинаковых условиях.
Решение. Циклобутан и бутен являются изомерами (общая формула  ), поэтому количество кислорода, необходимого для полного сжигания смеси, определяется только общим количеством углеводородов и не зависит от индивидуального содержания каждого из них в смеси. Общее уравнение реакций:
), поэтому количество кислорода, необходимого для полного сжигания смеси, определяется только общим количеством углеводородов и не зависит от индивидуального содержания каждого из них в смеси. Общее уравнение реакций:

Согласно уравнению, количество  в 6 раз превосходит количество
в 6 раз превосходит количество  поэтому по закону Авогадро для сжигания
поэтому по закону Авогадро для сжигания  требуется 6-кратный объем
требуется 6-кратный объем  , т.е.
, т.е.  Поскольку объемная доля
Поскольку объемная доля  в воздухе равна 20%, то необходимый объем воздуха равен
в воздухе равна 20%, то необходимый объем воздуха равен 
Ответ. 300 л воздуха.
Задача 31. (МГУ, биол. ф-т, 1992). Пары этаналя смешали с водородом в молярном отношении 1:2 при давлении 300 кПа и температуре 400 °С в замкнутом реакторе, предназначенном для синтеза этанола. После окончания процесса давление газов в реакторе при неизменной температуре уменьшилось на 20%. Определите объемную долю паров этанола в реакционной смеси и процент превращения уксусного альдегида в этанол.
Решение.

Пусть в исходной смеси содержалось х моль этаналя,  тогда, по условию,
тогда, по условию,  Общее число молей газов равно
Общее число молей газов равно 
Реакция этаналя с водородом обратима. Пусть в эту реакцию вступает у моль  , тогда водорода расходуется также у моль, и образуется у моль
, тогда водорода расходуется также у моль, и образуется у моль  .
.
В конечной смеси содержатся:  . Общее число молей газов равно
. Общее число молей газов равно  .
.
По условию, давление в конечной смеси уменьшилось на 20% по сравнению с исходным. Поскольку температура в процессе реакции не изменяется и объем реактора постоянен, то уменьшение давления вызвано только уменьшением числа молей газов. Таким образом,  или
или

то
По закону Авогадро, объемная доля газа равна его мольной доле, поэтому объемная доля паров этанола равна:

Процент превращения уксусного альдегида в этанол (т.е. практический выход этанола) равен 
Ответ.  процент превращения
процент превращения  .
.
Задача 32. (МГУ, почв, ф-т, 1992). Плотность по аммиаку газовой смеси, состоящей из оксида углерода (II) и водорода, до пропускания через контактный аппарат для синтеза метанола была равна 0,5, а после пропускания стала равна 0,625. Определите объемную долю паров метанола в реакционной смеси и процент превращения оксида углерода (II) в метанол.
Решение.

Пусть в 1 моле исходной смеси содержалось  моль СО и (1-х) моль
моль СО и (1-х) моль  . Средняя молярная масса данной смеси равна
. Средняя молярная масса данной смеси равна  г/моль, следовательно 1 моль весит 8,5 г:
г/моль, следовательно 1 моль весит 8,5 г:

откуда 
Реакция СО с водородом обратима. Пусть в эту реакцию вступает у моль СО, тогда водорода расходуется  моль, и образуется у моль
моль, и образуется у моль 
В конечной смеси содержатся:

Общее число молей газов равно  . Масса конечной смеси равна массе исходной смеси (8,5 г), поскольку из системы ничего не уходит и в нее ничего не добавляют.
. Масса конечной смеси равна массе исходной смеси (8,5 г), поскольку из системы ничего не уходит и в нее ничего не добавляют.
Средняя молярная масса конечной смеси равна 0,62517 - 10,625 г/моль:

откуда 
По закону Авогадро, объемная доля газа равна его мольной доле, поэтому объемная доля паров метайола равна:

Процент превращения СО в метанол (т.е. практический выход метанола) равен  .
.
Ответ.  превращения СО.
превращения СО.
| << Предыдущий параграф | Следующий параграф >> |
- ВВЕДЕНИЕ
- Глава I. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИИ
- § 1. Предмет химии. Важнейшие понятия и законы химии
- Основные стехиометрические законы химии
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 2. Строение атома
- Электронные конфигурации атомов
- Ядро атома и радиоактивные превращения
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 3. Строение молекул. Химическая связь. Валентность элементов
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 4. Агрегатные состояния вещества
- Характерные свойства газов, жидкостей и твердых тел
- Газообразное состояние. Газовые законы
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 5. Закономерности протекания химических реакций
- Химическая кинетика
- Химическое равновесие
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 6. Растворы. Электролитическая диссоциация. Гидролиз солей
- Электролиты и электролитическая диссоциация
- Гидролиз солей
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 7. Классификация химических реакций. Окислительно-восстановительные процессы. Электролиз
- Окислительно-восстановительные реакции
- Электролиз
- ЗАДАЧИ И УПРАЖНЕНИЯ
- Глава II. НЕОРГАНИЧЕСКАЯ ХИМИЯ
- § 8. Номенклатура, классификация неорганических веществ. Свойства и способы получения
- Оксиды
- Основания (гидроксиды металлов)
- Кислоты
- Соли
- § 9. Водород. Галогены и их соединения
- Галогены и их соединения
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 10. Подгруппа кислорода
- Сера и ее соединения
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 11. Подгруппа азота
- Фосфор и его соединения
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 12. Подгруппа углерода
- Углерод и его соединения
- Кремний и его соединения
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 13. Свойства s-элементов (щелочных и щелочноземельных металлов) и их соединений
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 14. Алюминий — типичный р-металл
- Соединения алюминия и их свойства
- ЗАДАЧИ И УПРАЖНЕНИЯ
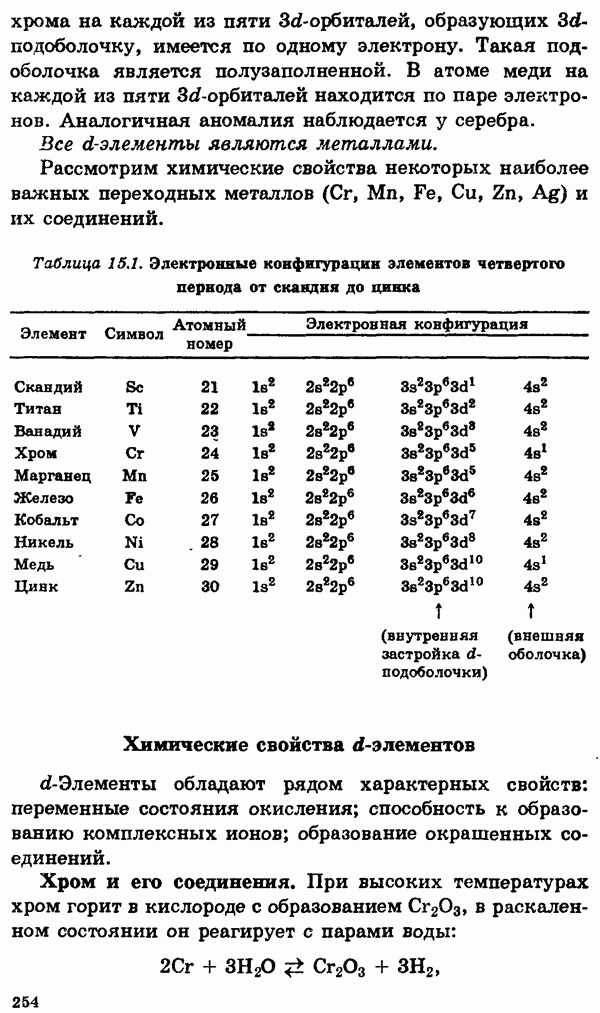
- § 15. Главные переходные металлы (d-элементы) и их соединения
- Химические свойства d-элементов
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 16. Задачи для повторения по неорганической химии
- Глава III. ОРГАНИЧЕСКАЯ ХИМИЯ
- § 17. Основные понятия и закономерности в органической химии. Предмет органической химии
- Классификация и номенклатура органических соединений
- Изомерия органических соединений
- Взаимное влияние атомов в молекуле и реакционная способность органических соединений
- Общая характеристика органических реакций
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 18. Предельные (насыщенные) углеводороды
- Циклоалканы
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 19. Алкены. Диеновые углеводороды
- Диеновые углеводороды (алкадиены)
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 20. Алкины
- ЗАДАЧИ И УПРАЖНЕНИЯ
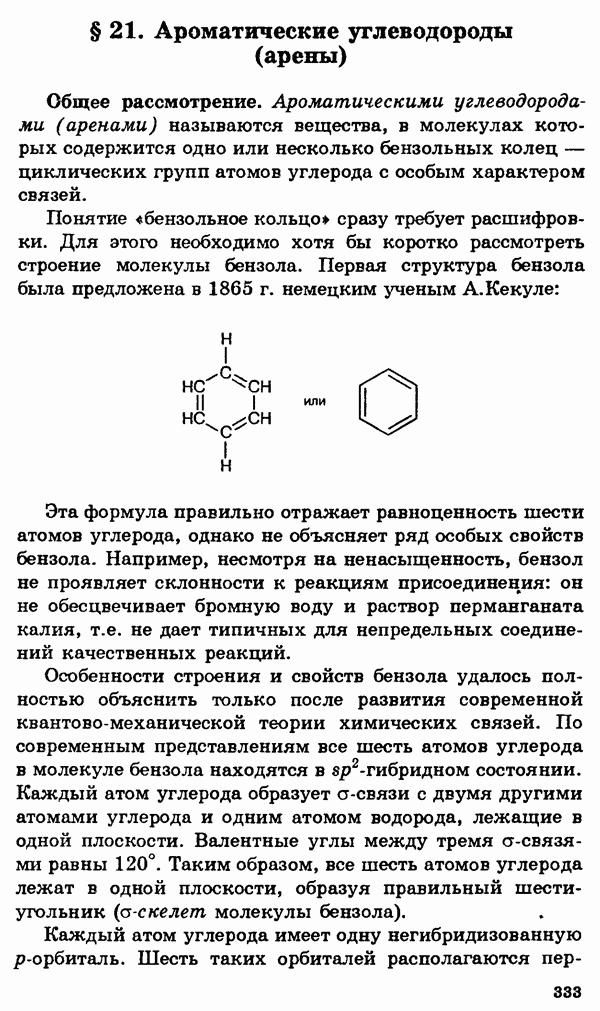
- § 21. Ароматические углеводороды (арены)
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 22. Спирты и фенолы
- Многоатомные спирты
- Фенолы
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 23. Карбонильные соединения — альдегиды и кетоны
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 24. Карбоновые кислоты. Сложные эфиры. Жиры
- Сложные эфиры. Жиры
- ЗАДАЧИ И УПРАЖНЕНИЯ
- Глава 4. ОСНОВНЫЕ ПРИЕМЫ РЕШЕНИЯ ЗАДАЧ
- Определение молекулярной формулы веществ
- Определение состава и разделение смесей
- Задачи на газовые законы
- Способы выражения концентрации растворов
- Ионные реакции в растворах
- Задачи на окислительно-восстановительные реакции
- Разные задачи
- ПРОГРАММА ПО ХИМИИ ДЛЯ ПОСТУПАЮЩИХ В УНИВЕРСИТЕТЫ
- ОТВЕТЫ
- Рекомендуемая литература