| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
ПРОГРАММА ПО ХИМИИ ДЛЯ ПОСТУПАЮЩИХ В УНИВЕРСИТЕТЫ
Общие указания
На экзамене по химии поступающий в университет должен:
показать знание основных теоретических положений химии;
уметь применять теоретические положения химии при рассмотрении основных классов неорганических и органических веществ;
уметь раскрывать зависимость свойств веществ от их состава и строения;
знать свойства важнейших веществ, применяемых в промышленности и в быту;
понимать основные научные принципы важнейших химических производств (не углубляясь в детали устройства химической аппаратуры);
решать типовые и комбинированные задачи по основным разделам химии.
На экзамене можно пользоваться следующими таблицами: «Периодическая система химических элементов Д. И. Менделеева», «Растворимость оснований, кислот и солей в воде», «Электрохимический ряд стандартных электродных потенциалов». При решении задач разрешается пользоваться калькулятором.
В экзаменационные билеты для устного экзамена включаются четыре вопроса: первый — по теоретическим основам химии, второй — по неорганической химии, третий — по органической химии, четвертый — задача. Возможно включение в билеты трех вопросов.
Билеты письменного экзамена могут содержать до 10 заданий с дифференцированной оценкой, охватывающих все разделы программы для поступающих.
Теоретические основы химии
1. Предмет и задачи химии. Явления физические и химические. Место химии среди естественных наук. Химия и экология.
2. Основы атомно-молекулярной теории. Понятие атома, элемента, вещества. Относительная атомная и относительная молекулярная массы. Моль — единица количества вещества. Молярная масса. Законы стехиометрии: закон сохранения массы вещества, закон постоянства состава. Относительная плотность газа.
3. Химические элементы. Знаки химических элементов и химические формулы. Простое вещество, сложное вещество. Аллотропия.
4. Строение атома. Атомное ядро. Изотопы. Стабильные и нестабильные ядра. Радиоактивные превращения, деление ядер и ядерный синтез. Уравнение радиоактивного распада. Период полураспада.
5. Двойственная природа электрона. Строение электронных оболочек атомов. Квантовые числа. Атомные орбитали. Электронные конфигурации атомов в основном и возбужденном состояниях.
6. Открытие Д. И. Менделеевым периодического закона и создание периодической системы химических элементов. Современная формулировка периодического закона. Строение периодической системы: большие и малые периоды, группы и подгруппы. Зависимость свойств элементов и образуемых ими соединений от положения элемента в периодической системе.
7. Виды химической связи: ковалентная (полярная и неполярная), ионная, металлическая, водородная. Механизмы образования ковалентной связи: обменный и донорно-акцепторный. Энергия связи. Электроотрицательность. Полярность связи, индуктивный эффект. Кратные связи. Модель гибридизации орбиталей. Связь электронной структуры молекул с их геометрическим строением (на примере соединений элементов 2-го периода). Делокализация электронов в сопряженных системах, мезомерный эффект.
8. Валентность и степень окисления. Структурные формулы. Изомерия. Виды изомерии, структурная и пространственная изомерия.
9. Агрегатные состояния веществ и переходы между ними в зависимости от температуры и давления. Газы. Газовые законы. Уравнение Менделеева—Клапейрона.
Закон Авогадро, молярный объем. Жидкости. Ассоциация молекул в жидкостях. Твердые тела. Основные типы кристаллических решеток: кубические и гексагональные.
10. Классификация химических реакций: реакции соединения, разложения, замещения, обмена. Окислительно-восстановительные реакции. Определение стехиометрических коэффициентов в уравнениях окислительно-восстановительных реакций. Ряд стандартных электродных потенциалов.
11. Тепловые эффекты химических реакций. Термохимические уравнения. Теплота (энтальпия) образования химических соединений. Закон Гесса и следствия из него.
12. Скорость химических реакций. Зависимость скорости реакции от природы и концентрации реагирующих веществ, температуры. Константа скорости химической реакции. Энергия активации. Катализ и катализаторы.
13. Обратимость химических реакций. Химическое равновесие и условия его смещения, принцип Ле Шателье. Константа равновесия, степень превращения.
14. Растворы. Растворимость веществ и ее зависимость от температуры, давления, природы растворителя. Способы выражения концентрации растворов: массовая доля, мольная доля, молярная концентрация. Твердые растворы. Сплавы.
15. Сильные и слабые электролиты. Электролитическая диссоциация. Константа диссоциации. Степень диссоциации. Ионные уравнения реакций. Свойства кислот, оснований и солей в свете теории электролитической диссоциации Аррениуса. Гидролиз солей. Электролиз водных растворов и расплавов солей. Процессы, протекающие у катода и анода.
Неорганическая химия
На основании периодического закона абитуриенты должны уметь давать сравнительную характеристику элементов в группах и периодах.
Характеристика элемента включает: электронную конфигурацию атома; возможные валентности и степени окисления элемента в соединениях; формы простых веществ и основные типы соединений, их физические и химические свойства, лабораторные и промышленные способы получения; распространенность элемента и его соединений в природе, практическое значение и области применения его соединений. При описании химических свойств должны быть отражены реакции с участием неорганических и органических соединений (кислотно-основные и окислительно-восстановительные превращения), а также качественные реакции.
1. Основные классы неорганических веществ, их названия (номенклатура), связь между ними.
2. Оксиды и пероксиды. Типы оксидов. Способы получения, свойства оксидов и пероксидов.
3. Основания, способы получения, свойства.
4. Кислоты, их классификация, общие свойства, способы получения.
5. Соли, их состав, химические свойства, способы получения.
6. Металлы, их положение в периодической системе. Физические и химические свойства. Основные способы получения. Металлы и сплавы в технике.
7. Общая характеристика щелочных металлов. Оксиды, пероксиды, гидроксиды и соли щелочных металлов. Калийные удобрения.
8. Общая характеристика элементов главной подгруппы II группы периодической системы. Кальций и его соединения. Жесткость воды и способы ее устранения.
9. Общая характеристика элементов главной подгруппы III группы периодической системы. Алюминий. Амфотерность оксида и гидроксида алюминия.
10. Железо, его оксиды и гидроксиды, зависимость их свойств от степени окисления железа. Химические реакции, лежащие в основе получения чугуна и стали. Роль железа и его сплавов в технике.
11. Водород, его взаимодействие с металлами, неметаллами, оксидами, органическими соединениями.
12. Кислород, его аллотропные формы. Свойства озона. Оксиды и пероксиды.
13. Вода, строение воды. Физические и химические свойства воды. Кристаллогидраты. Пероксид водорода.
14. Общая характеристика галогенов. Галогеноводороды. Галогениды. Кислородсодержащие соединения хлора.
15. Общая характеристика элементов главной подгруппы VI группы периодической системы. Сера. Сероводород, сульфиды. Оксиды серы (IV) и (VI), получение, свойства. Сернистая и серная кислоты, их свойства. Соли сернистой и серной кислот. Производство серной кислоты.
16. Общая характеристика элементов главной подгруппы V группы периодической системы. Азот. Аммиак, его промышленный синтез. Соли аммония. Нитриды. Оксиды азота. Азотистая и азотная кислоты и их соли. Азотные удобрения.
17. Фосфор, его аллотропные формы. Фосфин, фосфиды. Оксид фосфора (V). Орто-, мета- и дифосфорная кислоты. Ортофосфаты. Фосфорные удобрения.
18. Общая характеристика элементов главной подгруппы IV группы периодической системы. Углерод, его аллотропные формы. Оксиды углерода (II) и (IV). Угольная кислота и ее соли. Карбиды кальция и алюминия.
19. Кремний. Силан. Силицид магния. Оксид кремния (IV). Кремниевая кислота и ее сояи.
Органическая химия
Характеристика каждого класса органических соединений включает: особенности электронного и пространственного строения соединений данного класса, закономерности изменения физических и химических свойств в гомологическом ряду, номенклатуру, виды изомерии, основные типы химических реакций и их механизмы.
Характеристика конкретных соединений включает физические и химические свойства, лабораторные и промышленные способы получения, области применения. При описании химических свойств необходимо учитывать реакции с участием как радикала, так и функциональной группы.
1. Теория строения органических соединений А. М. Бутлерова. Зависимость свойств веществ от их строения. Виды изомерии. Природа химической связи в молекулах органических соединений, гомо- и гетеролитические способы разрыва связей. Понятие о свободных радикалах.
2. Предельные углеводороды (алканы и циклоалканы), их электронное и пространственное строение ( -гибри-дизация). Номенклатура, изомерия.
-гибри-дизация). Номенклатура, изомерия.
3. Алкены, их электронное и пространственное строение ( -гибридизация,
-гибридизация,  и
и  -связи). Номенклатура, изомерия. Правило Марковникова. Циклоалкены. Сопряженные диеновые углеводороды, особенности их химических свойств.
-связи). Номенклатура, изомерия. Правило Марковникова. Циклоалкены. Сопряженные диеновые углеводороды, особенности их химических свойств.
4. Ацетиленовые углеводороды (алкины), их электронное и пространственное строение ( -гибридизация,
-гибридизация,  и
и  -связи). Номенклатура. Кислотные свойства алкинов. Реакция Кучерова.
-связи). Номенклатура. Кислотные свойства алкинов. Реакция Кучерова.
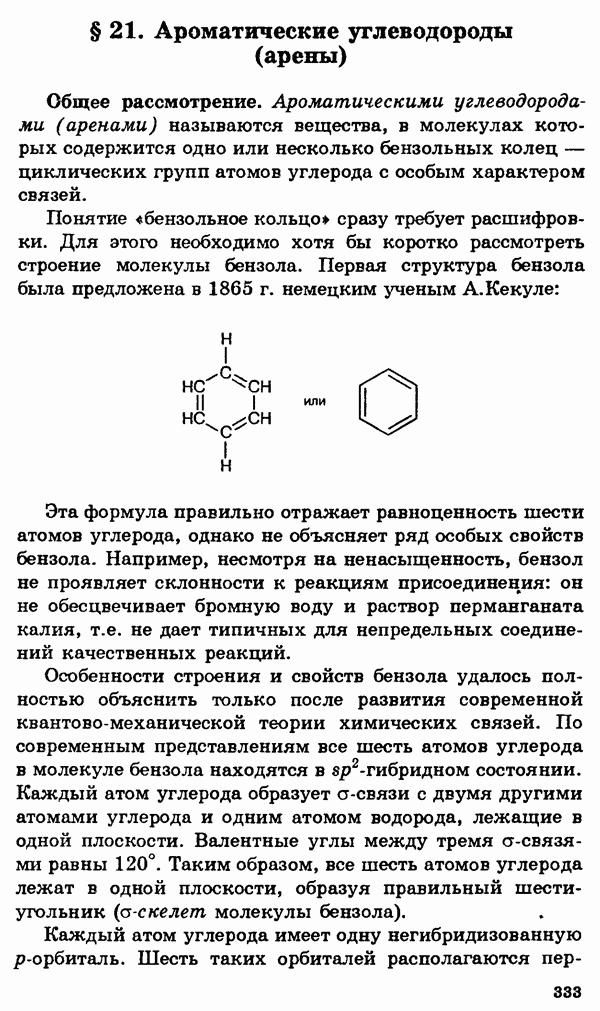
5. Ароматические углеводороды (арены). Бензол, электронное и пространственное строение ( -гибридизация). Гомологи бензола. Понятие о взаимном влиянии атомов на примере толуола (реакции ароматической системы и углеводородного радикала).
-гибридизация). Гомологи бензола. Понятие о взаимном влиянии атомов на примере толуола (реакции ароматической системы и углеводородного радикала).
6. Природные источники углеводородов: нефть, природный и попутный нефтяной газы, уголь. Перегонка нефти. Крекинг. Продукты, получаемые из нефти, их применение.
7. Спирты. Первичные, вторичные и третичные спирты. Номенклатура, строение, химические свойства одноатомных спиртов. Промышленный синтез этанола. Многоатомные спирты (этиленгликоль, глицерин), особенности химических свойств.
8. Фенол, его строение, взаимное влияние атомов в молекуле. Химические свойства фенола, сравнение со свойствами алифатических спиртов.
9. Альдегиды. Номенклатура, строение, физические и химические свойства. Особенности карбонильной группы. Муравьиный и уксусный альдегиды, получение, применение. Понятие о кетонах.
10. Карбоновые кислоты. Номенклатура, строение, физические и химические свойства.
Взаимное влияние карбоксильной группы и углеводородного радикала. Предельные, непредельные и ароматические кислоты. Примеры кислот: муравьиная кислота (ее особенности), уксусная, бензойная, стеариновая, олеиновая кислоты.
11. Сложные эфиры. Строение, химические свойства. Реакция этерификации. Жиры, их роль в природе, химическая переработка жиров (гидролиз, гидрирование).
12. Углеводы. Моносахариды: рибоза, дезоксирибоза, глюкоза, фруктоза, их строение, физические и химические свойства, роль в природе. Циклические формы моносахаридов. Полисахариды: крахмал и целлюлоза.
13. Амины. Алифатические и ароматические амины. Взаимное влияние атомов на примере анилина. Первичные, вторичные и третичные амины.
14. Аминокислоты и оксикислоты. Строение, химические свойства, изомерия. Примеры оксикислот: молочная, винная и салициловая кислоты. Альфа-аминокислоты — структурные единицы белков. Пептиды. Строение и биологическая роль белков.
15. Пиррол. Пиридин. Пиримидиновые и пуриновые основания, входящие в состав нуклеиновых кислот. Представление о структуре нуклеиновых кислот.
16. Реакции полимеризации и поликонденсации. Общие понятия химии высокомолекулярных соединений (ВМС): мономер, полимер, элементарное звено, степень полимеризации (поликонденсации). Примеры различных типов ВМС: полиэтилен, полипропилен, полистирол, поливинилхлорид, политетрафторэтилен, каучуки, фенол-формальдегидные смолы, полипептиды, искусственные и синтетические волокна.
| << Предыдущий параграф | Следующий параграф >> |
- ВВЕДЕНИЕ
- Глава I. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИИ
- § 1. Предмет химии. Важнейшие понятия и законы химии
- Основные стехиометрические законы химии
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 2. Строение атома
- Электронные конфигурации атомов
- Ядро атома и радиоактивные превращения
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 3. Строение молекул. Химическая связь. Валентность элементов
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 4. Агрегатные состояния вещества
- Характерные свойства газов, жидкостей и твердых тел
- Газообразное состояние. Газовые законы
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 5. Закономерности протекания химических реакций
- Химическая кинетика
- Химическое равновесие
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 6. Растворы. Электролитическая диссоциация. Гидролиз солей
- Электролиты и электролитическая диссоциация
- Гидролиз солей
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 7. Классификация химических реакций. Окислительно-восстановительные процессы. Электролиз
- Окислительно-восстановительные реакции
- Электролиз
- ЗАДАЧИ И УПРАЖНЕНИЯ
- Глава II. НЕОРГАНИЧЕСКАЯ ХИМИЯ
- § 8. Номенклатура, классификация неорганических веществ. Свойства и способы получения
- Оксиды
- Основания (гидроксиды металлов)
- Кислоты
- Соли
- § 9. Водород. Галогены и их соединения
- Галогены и их соединения
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 10. Подгруппа кислорода
- Сера и ее соединения
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 11. Подгруппа азота
- Фосфор и его соединения
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 12. Подгруппа углерода
- Углерод и его соединения
- Кремний и его соединения
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 13. Свойства s-элементов (щелочных и щелочноземельных металлов) и их соединений
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 14. Алюминий — типичный р-металл
- Соединения алюминия и их свойства
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 15. Главные переходные металлы (d-элементы) и их соединения
- Химические свойства d-элементов
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 16. Задачи для повторения по неорганической химии
- Глава III. ОРГАНИЧЕСКАЯ ХИМИЯ
- § 17. Основные понятия и закономерности в органической химии. Предмет органической химии
- Классификация и номенклатура органических соединений
- Изомерия органических соединений
- Взаимное влияние атомов в молекуле и реакционная способность органических соединений
- Общая характеристика органических реакций
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 18. Предельные (насыщенные) углеводороды
- Циклоалканы
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 19. Алкены. Диеновые углеводороды
- Диеновые углеводороды (алкадиены)
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 20. Алкины
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 21. Ароматические углеводороды (арены)
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 22. Спирты и фенолы
- Многоатомные спирты
- Фенолы
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 23. Карбонильные соединения — альдегиды и кетоны
- ЗАДАЧИ И УПРАЖНЕНИЯ
- § 24. Карбоновые кислоты. Сложные эфиры. Жиры
- Сложные эфиры. Жиры
- ЗАДАЧИ И УПРАЖНЕНИЯ
- Глава 4. ОСНОВНЫЕ ПРИЕМЫ РЕШЕНИЯ ЗАДАЧ
- Определение молекулярной формулы веществ
- Определение состава и разделение смесей
- Задачи на газовые законы
- Способы выражения концентрации растворов
- Ионные реакции в растворах
- Задачи на окислительно-восстановительные реакции
- Разные задачи
- ПРОГРАММА ПО ХИМИИ ДЛЯ ПОСТУПАЮЩИХ В УНИВЕРСИТЕТЫ
- ОТВЕТЫ
- Рекомендуемая литература