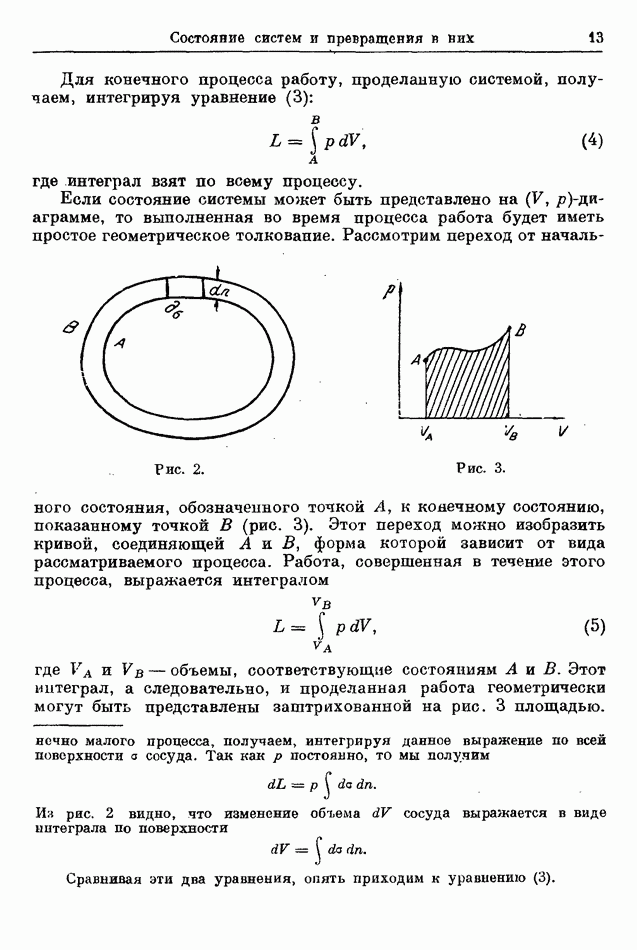
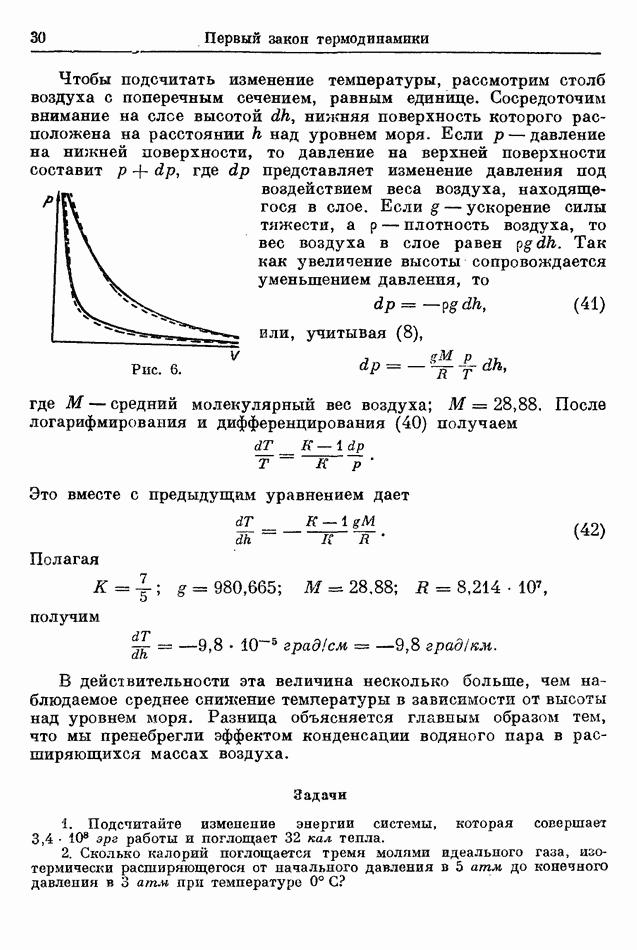
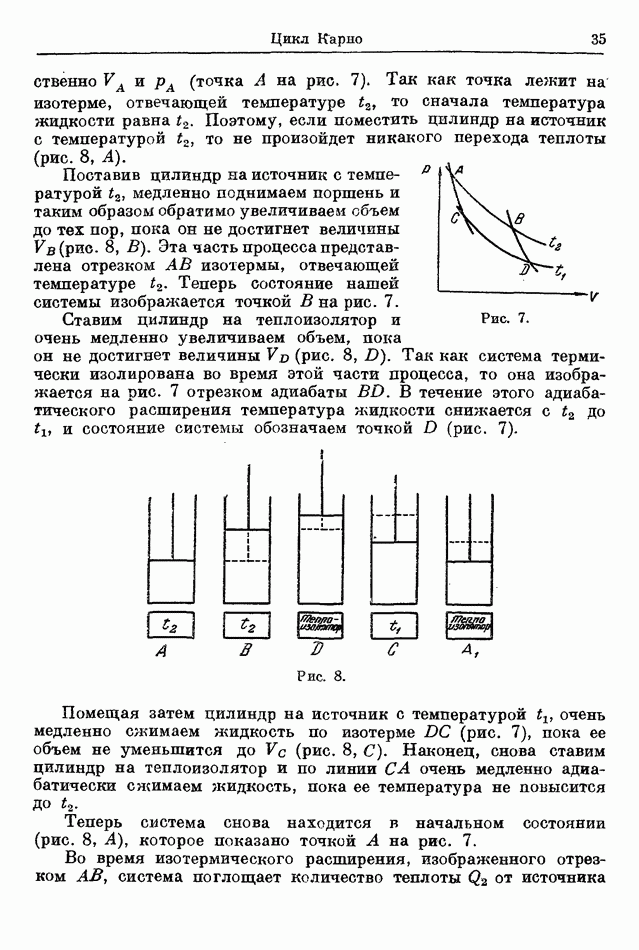
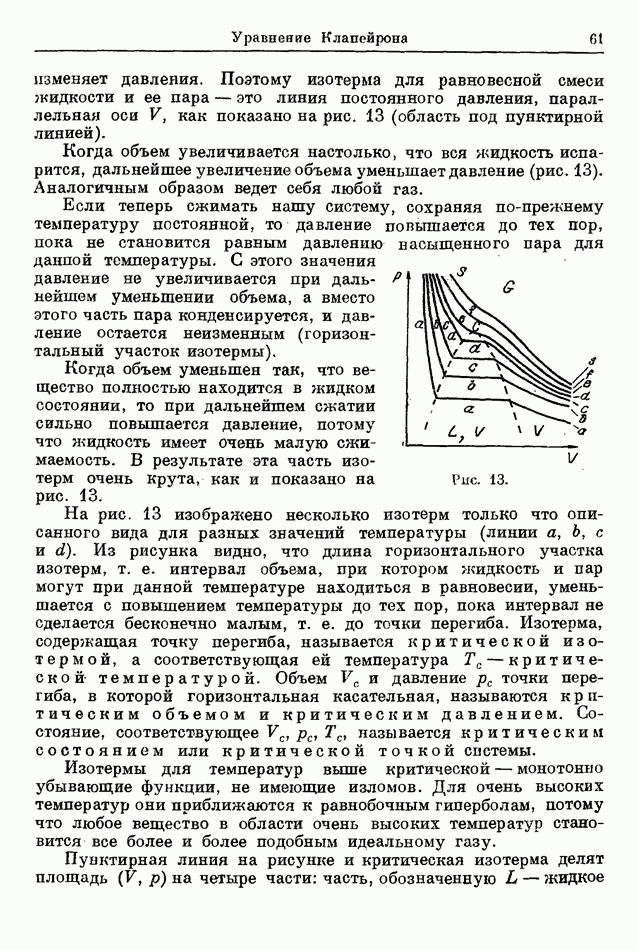
| << Предыдущий параграф |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
33. ТЕРМИЧЕСКАЯ ИОНИЗАЦИЯ ГАЗА. ТЕРМОИОННЫЙ ЭФФЕКТ
В главе VI мы установили закон действующих масс (уравнение  для химического равновесия в газовых системах. Постоянный коэффициент (множитель, который не включает температуру) в левой части уравнения (139) содержит константы
для химического равновесия в газовых системах. Постоянный коэффициент (множитель, который не включает температуру) в левой части уравнения (139) содержит константы
энтропии газов, принимающих участие в реакции. Знание констант энтропии дает нам возможность вычислить этот коэффициент полностью.
Так как нам известно выражение константы энтропии только для одноатомных газов, то надо выбрать такую реакцию, в которой принимают участие лишь одноатомные газы. Очевидно, что таких реакций в химии нет. Поэтому рассмотрим следующий нехимический процесс.
Когда такие газы, как, например, пары щелочных металлов, нагреваются до очень высокой температуры, то некоторые из атомов ионизируются, т. е. теряют один из своих электронов и превращаются, таким образом, в ионы. Если, например, обозначить через  соответственно атом натрия, ион натрия и электрон, то процесс можно изобразить реакцией
соответственно атом натрия, ион натрия и электрон, то процесс можно изобразить реакцией

Установлено, что при каждой температуре эта ионизация достигает состояния теплового равновесия, которое вполне аналогично химическому равновесию для обычных химических реакций.
В парах натрия при очень высоких температурах действительно имеется смесь трех различных газов: нейтрального натрия  концентрация которого
концентрация которого  ионов натрия
ионов натрия  с концентрацией
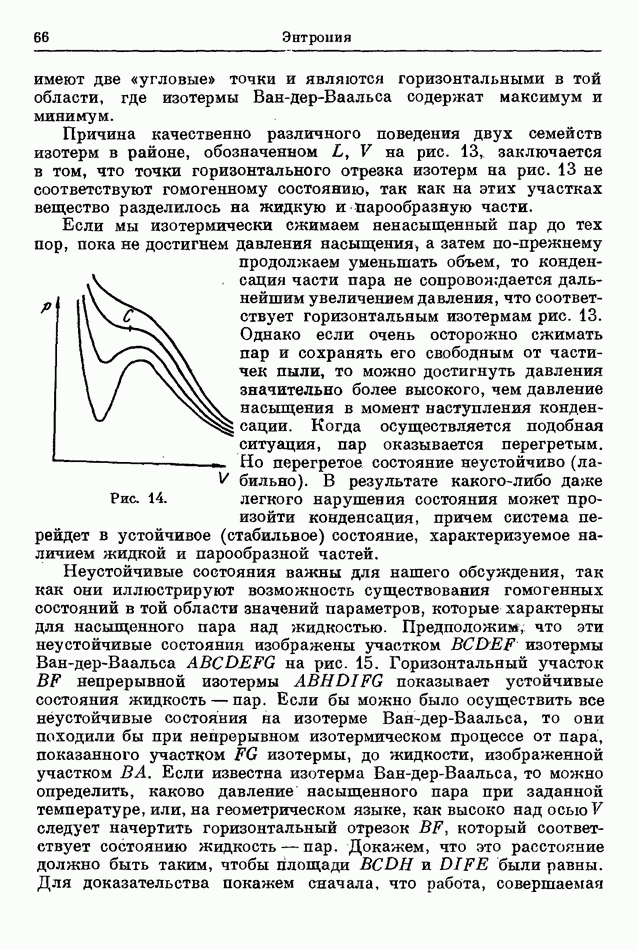
с концентрацией  и электронного газа (газа, составленного из электронов) с концентрацией
и электронного газа (газа, составленного из электронов) с концентрацией  Каждое из этих трех веществ ведет себя подобно одноатомному газу. Поэтому к процессу ионизации (208) можно применить общие результаты теории химических равновесий в газообразных системах, в частности уравнение (139).
Каждое из этих трех веществ ведет себя подобно одноатомному газу. Поэтому к процессу ионизации (208) можно применить общие результаты теории химических равновесий в газообразных системах, в частности уравнение (139).
Так как все газы в смеси одноатомные, мы должны применить первое из выражений (34) для молярной теплоемкости газов. Константы энтропии можно найти при помощи уравнения (205). Статистический вес  равен 2 для нейтрального натрия, 1 — для иона натрия и 2 — для электрона. Мы примем, что
равен 2 для нейтрального натрия, 1 — для иона натрия и 2 — для электрона. Мы примем, что  (атомный вес натрия) и пренебрежем очень малой разницей в массах атома и иона натрия, поэтому атомный вес натриевого иона также принимается равным
(атомный вес натрия) и пренебрежем очень малой разницей в массах атома и иона натрия, поэтому атомный вес натриевого иона также принимается равным 
Атомный вес электрона (т. е. масса электронов, разделенная на 1/16 массы кислорода) составляет  Обозначим, наконец, через
Обозначим, наконец, через  энергию, необходимую для ионизации всех атомов в одном моле натриевого пара. Тогда
энергию, необходимую для ионизации всех атомов в одном моле натриевого пара. Тогда

Сделав все необходимые подстановки в уравнение (139), получим условие теплового равновесия при термической
ионизации натриевых паров в виде следующего уравнения:

Эту формулу можно записать в более удобной форме: пусть  степень ионизации, т. е. отношение числа ионов к полному числу атомов
степень ионизации, т. е. отношение числа ионов к полному числу атомов

и пусть  общее число атомов натрия
общее число атомов натрия  ионы). Тогда
ионы). Тогда

Так как очевидно, что имеется один электрон для каждого натриевого иона, то имеем

и, наконец,

Степень ионизации может быть найдена с помощью этой формулы.
Уравнение (209), впервые выведенное Саха, нашло различные важные применения в физике звездной атмосферы.
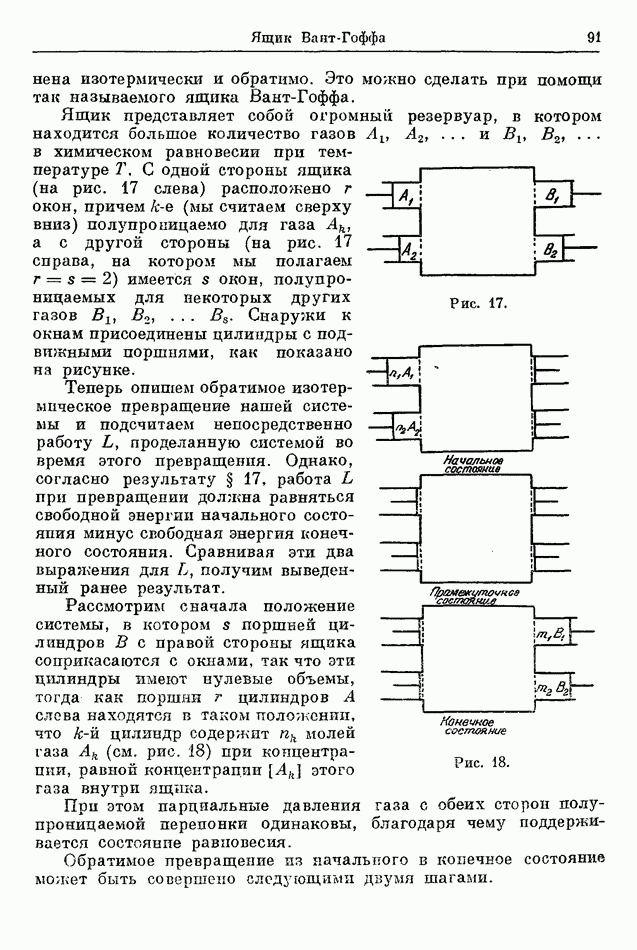
В качестве еще одного применения формулы Сакэ-Тетрода получим выражение для плотности электронного газа, который находится в равновесии с горячей металлической поверхностью. Когда металл нагрет до достаточно высокой температуры, он испускает непрерывный поток электронов. При нагревании бруска металла, содержащего полость, электроны, выходящие из металла, будут наполнять полость до тех пор, пока не наступит состояние равновесия, при котором количество электронов, поглощенных металлом за единицу времени, равно количеству испущенных электронов. Мы намереваемся вычислить равновесную концентрацию электронов внутри полости как функцию температуры.
Пусть  число молей электронов внутри полости объема
число молей электронов внутри полости объема  Энтропию этих электронов получаем из (204), умножая это выражение на
Энтропию этих электронов получаем из (204), умножая это выражение на  и заменяя
и заменяя  на
на  так как представляет объем, занимаемый одним молем электронного газа. Используя (34) и (29), получаем для энергии электронов
так как представляет объем, занимаемый одним молем электронного газа. Используя (34) и (29), получаем для энергии электронов

где  энергия, необходимая для того, чтобы из металла извлечь один моль электронов.
энергия, необходимая для того, чтобы из металла извлечь один моль электронов.
Теперь для свободной энергии электронного газа находим

где атомный вес электрона  а значение
а значение  для электронов равно 2.
для электронов равно 2.
Свободная энергия  всей системы — сумма свободной энергии электронов и свободной энергии
всей системы — сумма свободной энергии электронов и свободной энергии  металла:
металла:

Условием равновесия является минимум  при данной температуре и данном объеме. Полагая, что
при данной температуре и данном объеме. Полагая, что  не зависит от
не зависит от  получаем
получаем

Потенцируя, получаем уравнение

которое дает то, что требовалось, — концентрацию электронов внутри полости.
Задачи
(см. скан)
| << Предыдущий параграф |
- ПРЕДИСЛОВИЕ РЕДАКТОРА ПЕРЕВОДА
- ВВЕДЕНИЕ
- ГЛАВА I. ТЕРМОДИНАМИЧЕСКИЕ СИСТЕМЫ
- 2. ИДЕАЛЬНЫЕ ГАЗЫ
- ГЛАВА II. ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ
- 3. ФОРМУЛИРОВКА ПЕРВОГО ЗАКОНА ТЕРМОДИНАМИКИ
- 4. ПРИМЕНЕНИЕ ПЕРВОГО ЗАКОНА К СИСТЕМАМ, СОСТОЯНИЕ КОТОРЫХ МОЖЕТ БЫТЬ ИЗОБРАЖЕНО НА ДИАГРАММЕ (V, p)
- 5. ПРИМЕНЕНИЕ ПЕРВОГО ЗАКОНА К ГАЗАМ
- 6. АДИАБАТИЧЕСКИЕ ПРОЦЕССЫ В ГАЗАХ
- ГЛАВА III. ВТОРОЙ ЗАКОН ТЕРМОДИНАМИКИ
- 7. ФОРМУЛИРОВКА ВТОРОГО ЗАКОНА ТЕРМОДИНАМИКИ
- 8. ЦИКЛ КАРНО
- 9. АБСОЛЮТНАЯ ТЕРМОДИНАМИЧЕСКАЯ ТЕМПЕРАТУРА
- 10. ТЕПЛОВЫЕ МАШИНЫ
- ГЛАВА IV. ЭНТРОПИЯ
- 11. НЕКОТОРЫЕ СВОЙСТВА ЦИКЛОВ
- 12. ЭНТРОПИЯ
- 18. НЕКОТОРЫЕ ДАЛЬНЕЙШИЕ СВОЙСТВА ЭНТРОПИИ
- 14. ЭНТРОПИЯ СИСТЕМЫ, СОСТОЯНИЕ КОТОРОЙ МОЖЕТ БЫТЬ ИЗОБРАЖЕНО НА ДИАГРАММЕ (V, p)
- 15. УРАВНЕНИЕ КЛАПЕЙРОНА
- 16. УРАВНЕНИЕ ВАН-ДЕР-ВААЛЬСА
- ГЛАВА V. ТЕРМОДИНАМИЧЕСКИЕ ПОТЕНЦИАЛЫ
- 18. ТЕРМОДИНАМИЧЕСКИЙ ПОТЕНЦИАЛ ПРИ ПОСТОЯННОМ ДАВЛЕНИИ
- 19. ПРАВИЛО ФАЗ
- 20. ТЕРМОДИНАМИКА ОБРАТИМОГО ГАЛЬВАНИЧЕСКОГО ЭЛЕМЕНТА
- ГЛАВА VI. РЕАКЦИИ В ГАЗОВОЙ ФАЗЕ
- 21. ХИМИЧЕСКОЕ РАВНОВЕСИЕ В ГАЗАХ
- 22. ЯЩИК ВАНТ-ГОФФА
- 23. ДРУГОЕ ДОКАЗАТЕЛЬСТВО УРАВНЕНИЯ ГАЗОВОГО РАВНОВЕСИЯ
- 24. ОБСУЖДЕНИЕ УРАВНЕНИЯ ГАЗОВОГО РАВНОВЕСИЯ. ПРИНЦИП ЛЕ ШАТЕЛЬЕ
- ГЛАВА VII. ТЕРМОДИНАМИКА СЛАБЫХ РАСТВОРОВ
- 28. ОСМОТИЧЕСКОЕ ДАВЛЕНИЕ
- 27. ХИМИЧЕСКОЕ РАВНОВЕСИЕ В РАСТВОРАХ
- 28. РАСПРЕДЕЛЕНИЕ РАСТВОРЕННОГО ВЕЩЕСТВА МЕЖДУ ДВУМЯ ФАЗАМИ
- 29. ДАВЛЕНИЕ ПАРА, ТОЧКА КИПЕНИЯ И ТОЧКА ЗАМЕРЗАНИЯ РАСТВОРА
- ГЛАВА VIII. ПОСТОЯННАЯ В ЗАВИСИМОСТИ ЭНТРОПИИ ОТ ТЕМПЕРАТУРЫ
- 30. ТЕОРЕМА НЕРНСТА
- 31. ПРИМЕНЕНИЕ ТЕОРЕМЫ НЕРНСТА К ТВЕРДЫМ ТЕЛАМ
- 32. ЭНТРОПИЙНАЯ КОНСТАНТА ГАЗОВ
- 33. ТЕРМИЧЕСКАЯ ИОНИЗАЦИЯ ГАЗА. ТЕРМОИОННЫЙ ЭФФЕКТ