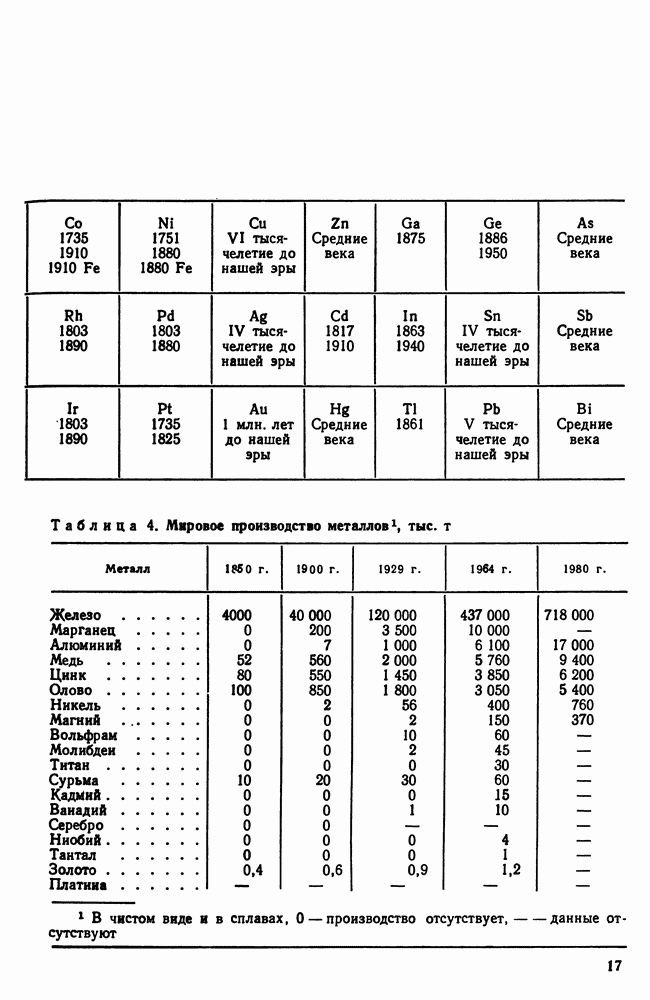
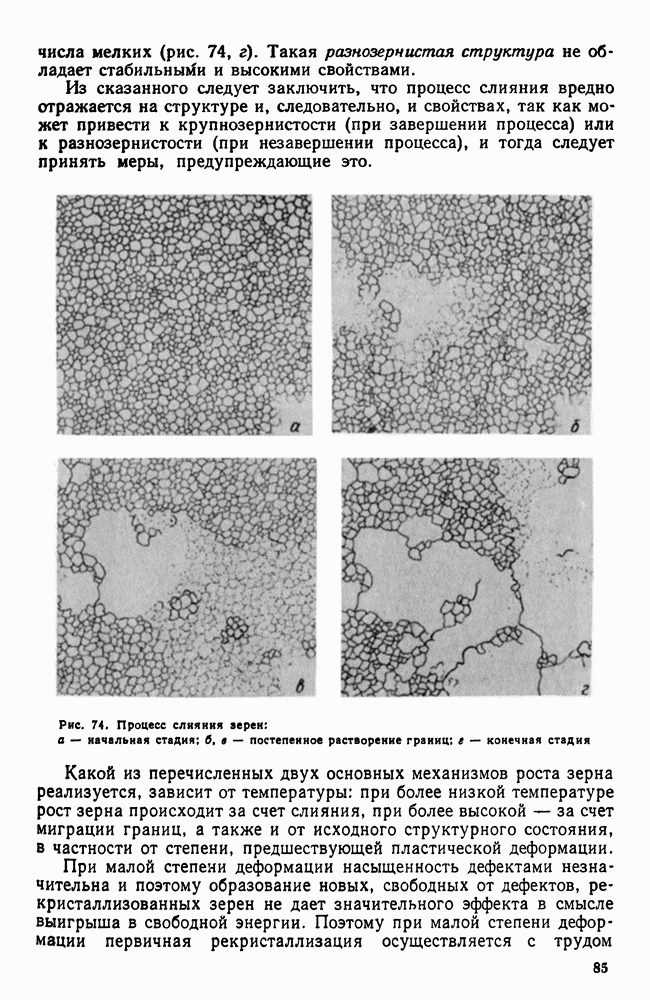
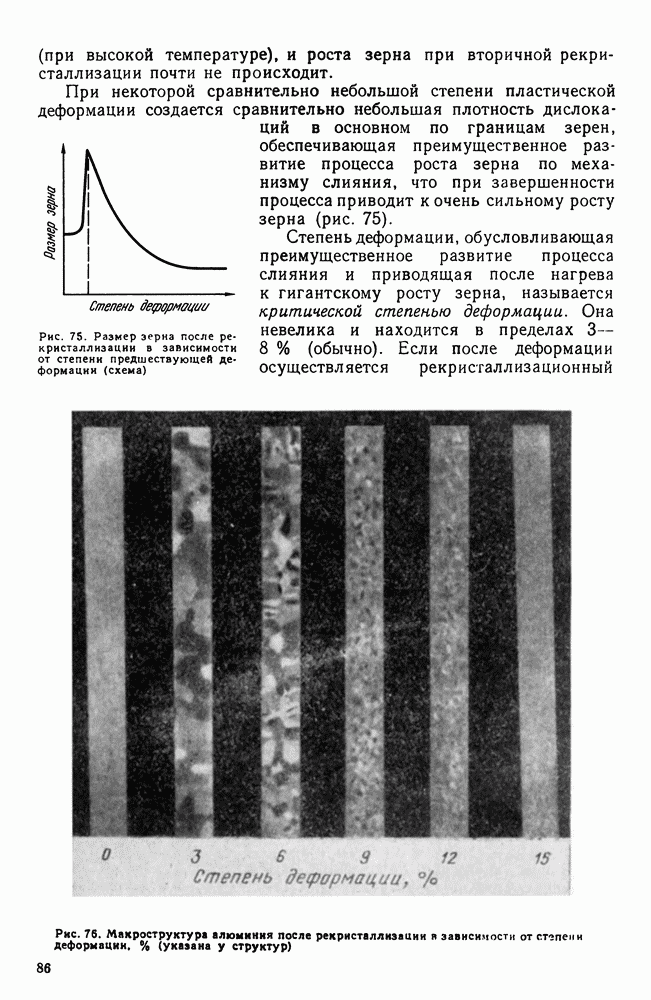
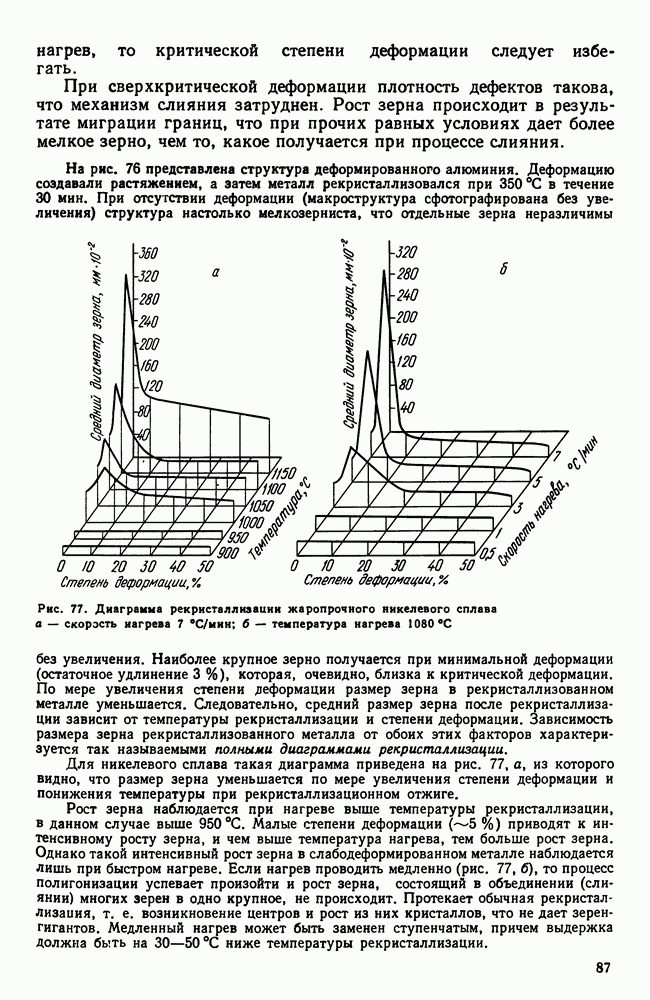
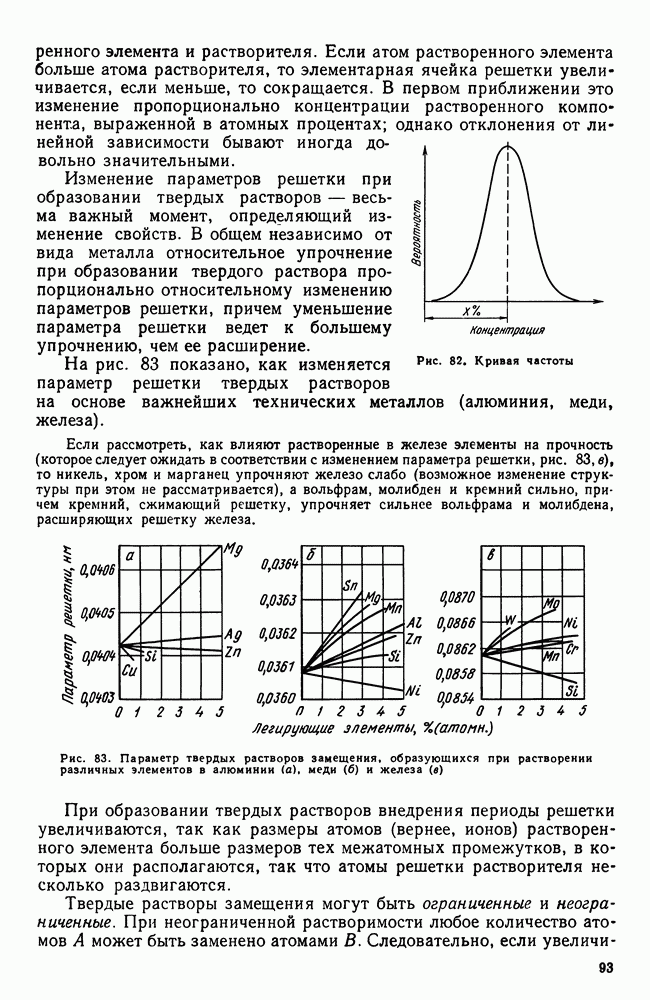
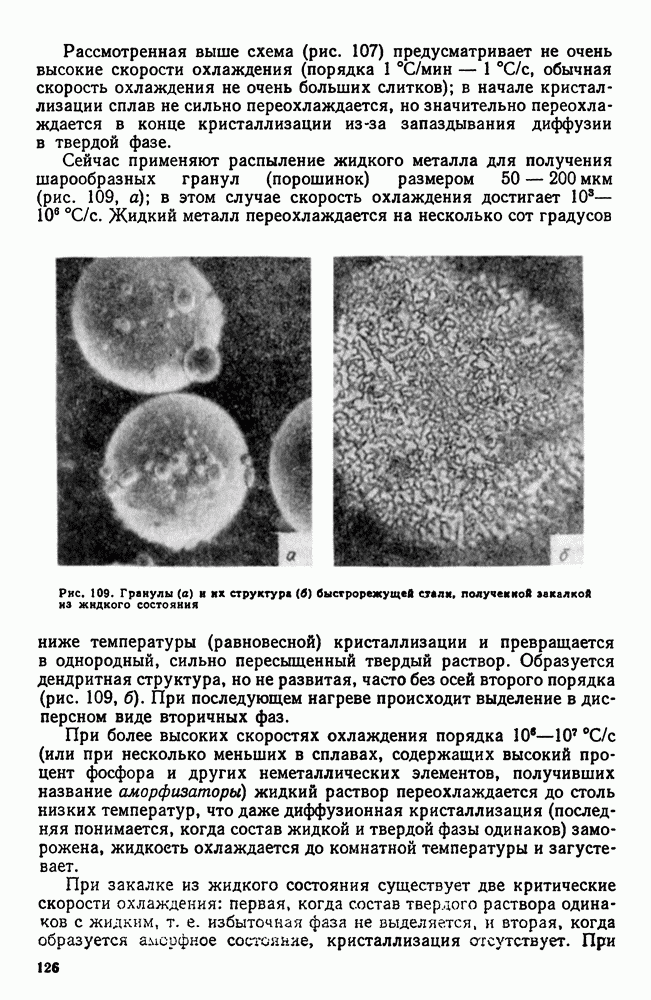
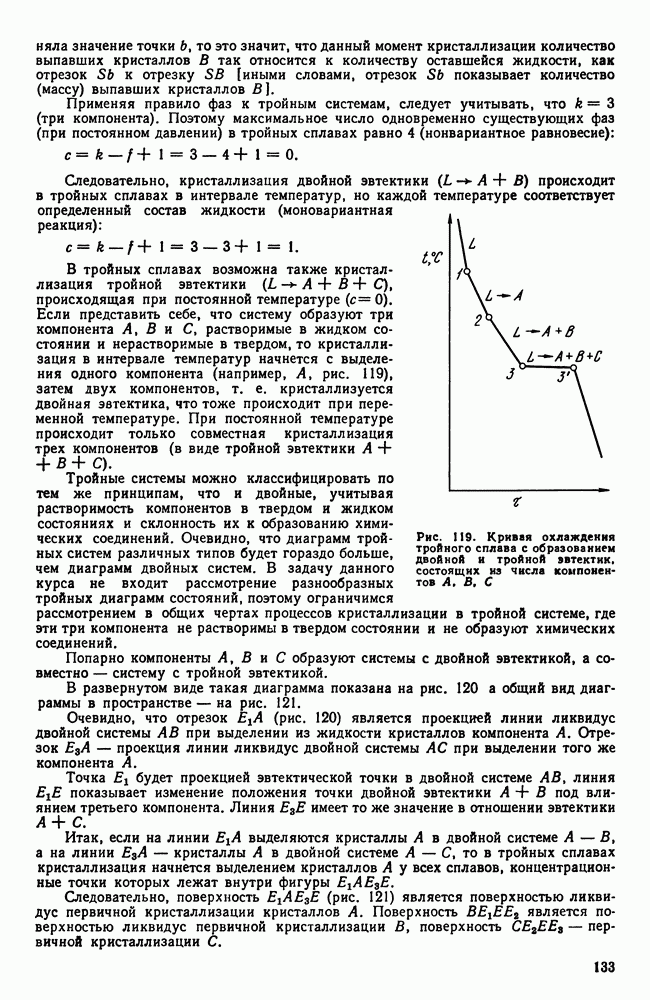
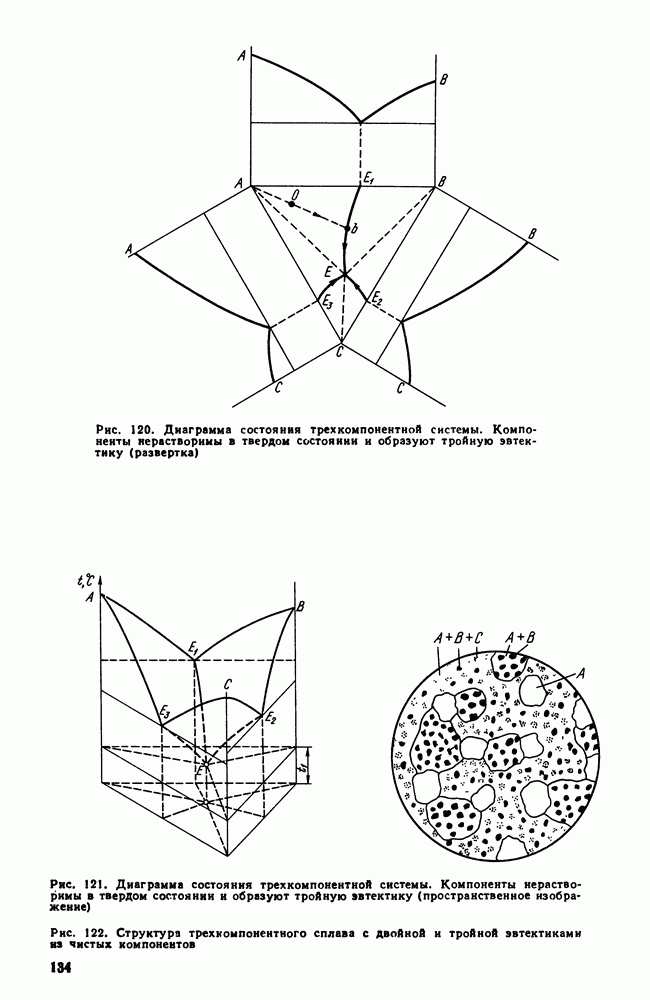
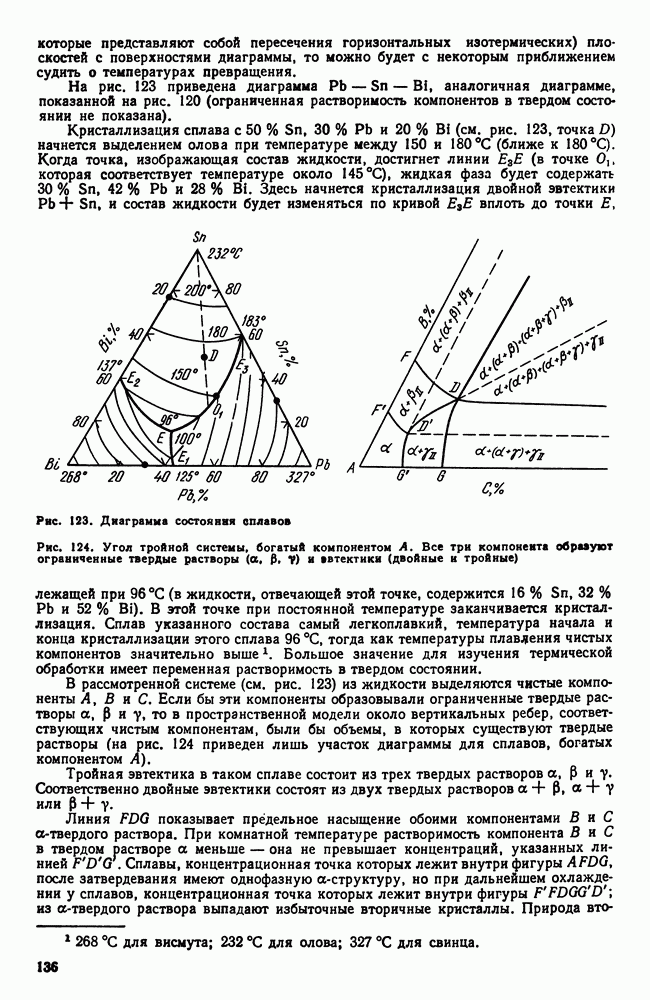
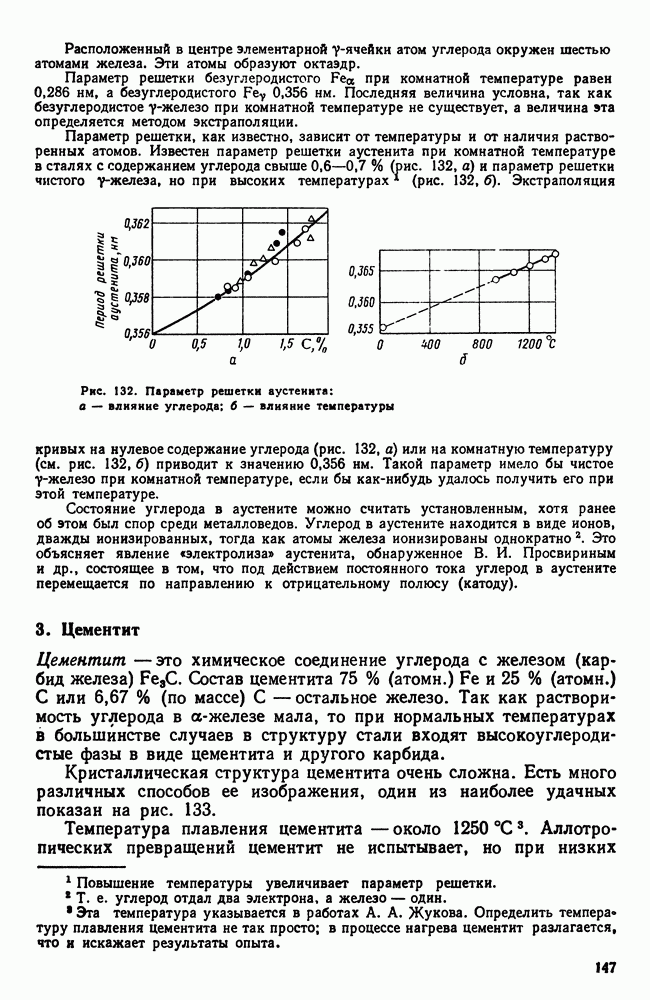
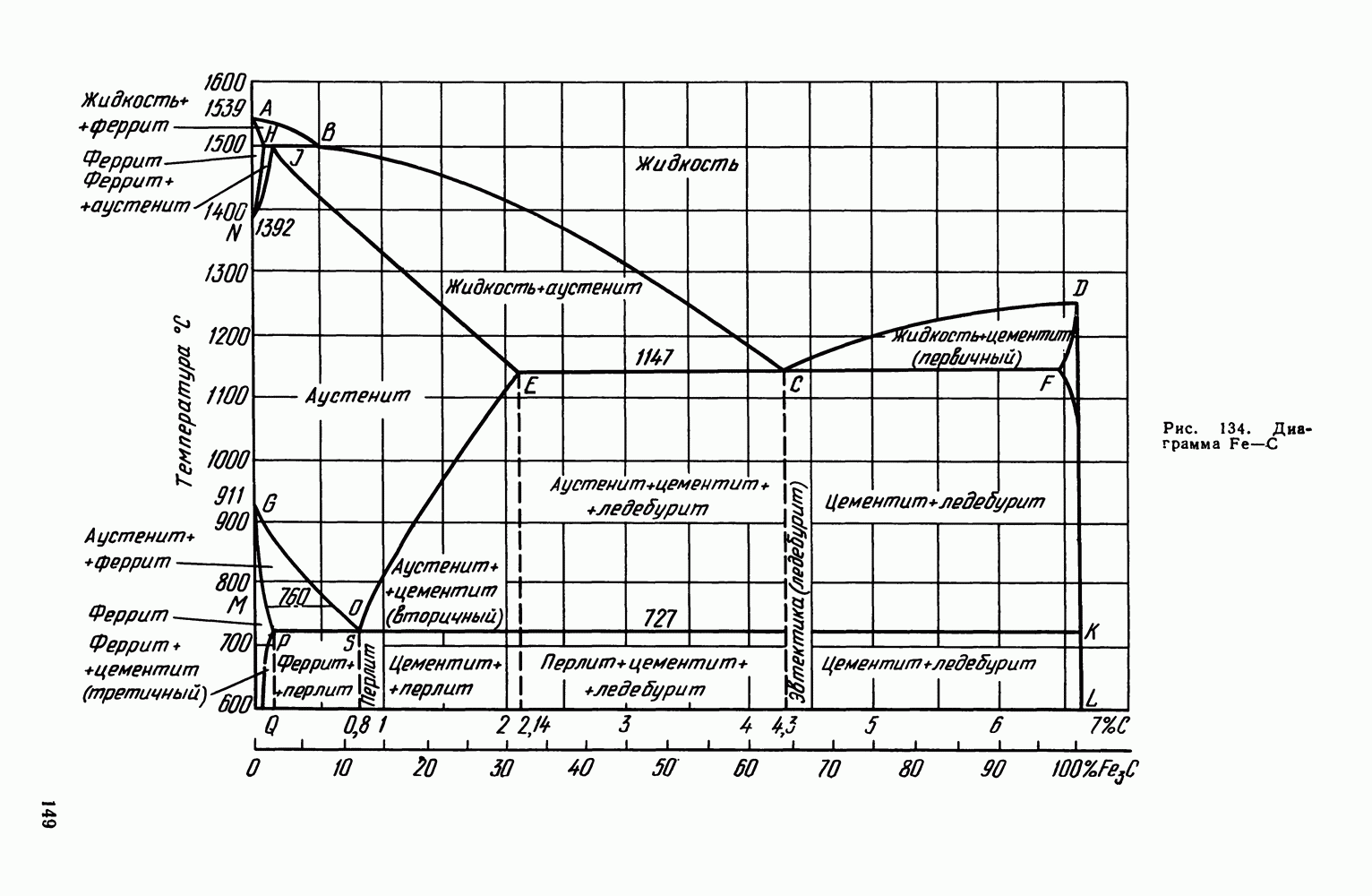
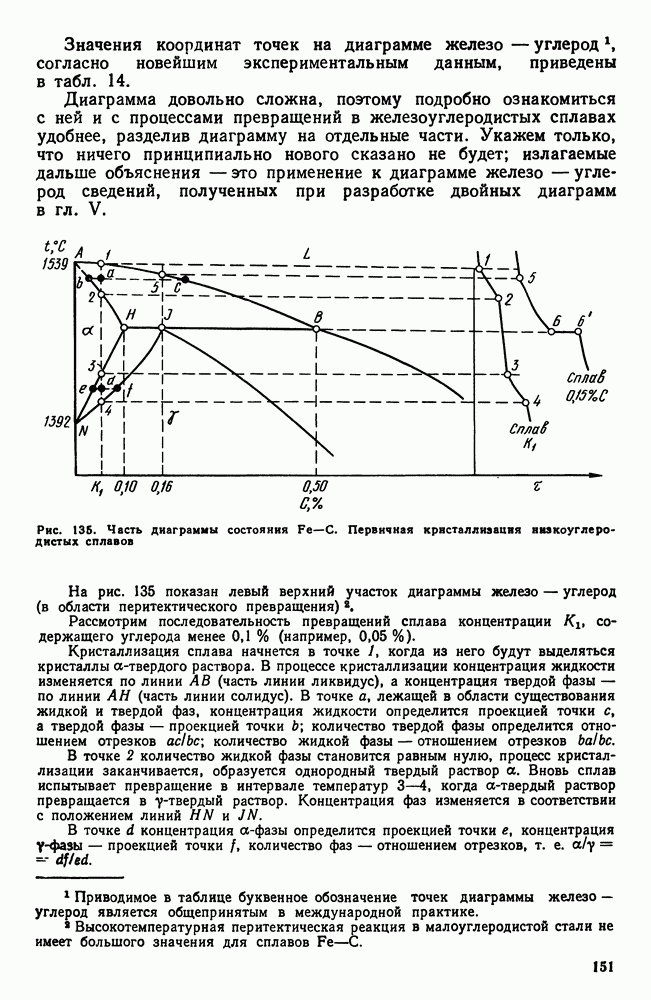
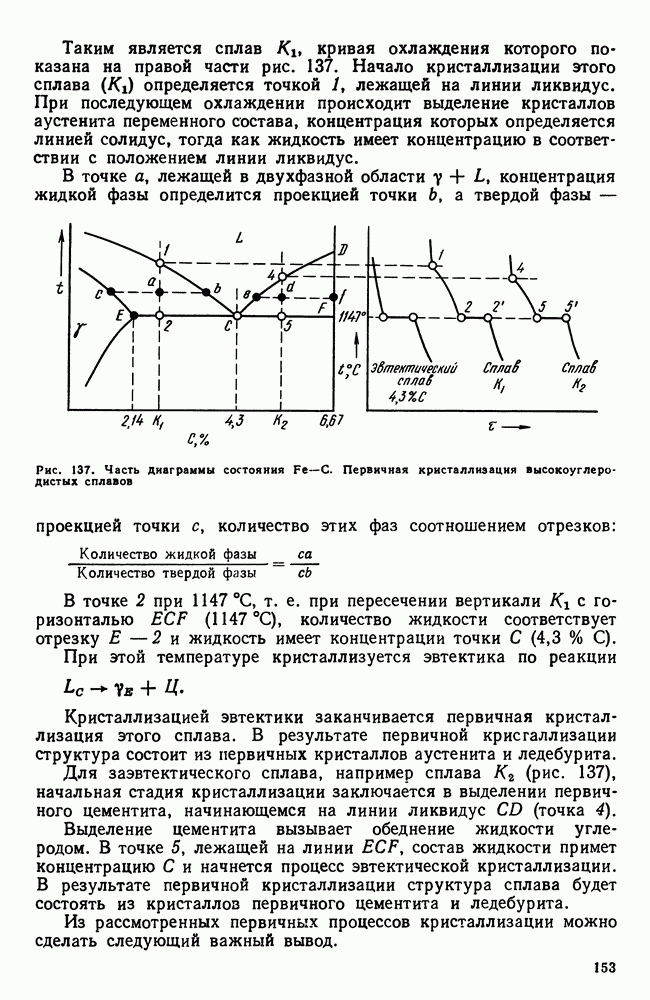
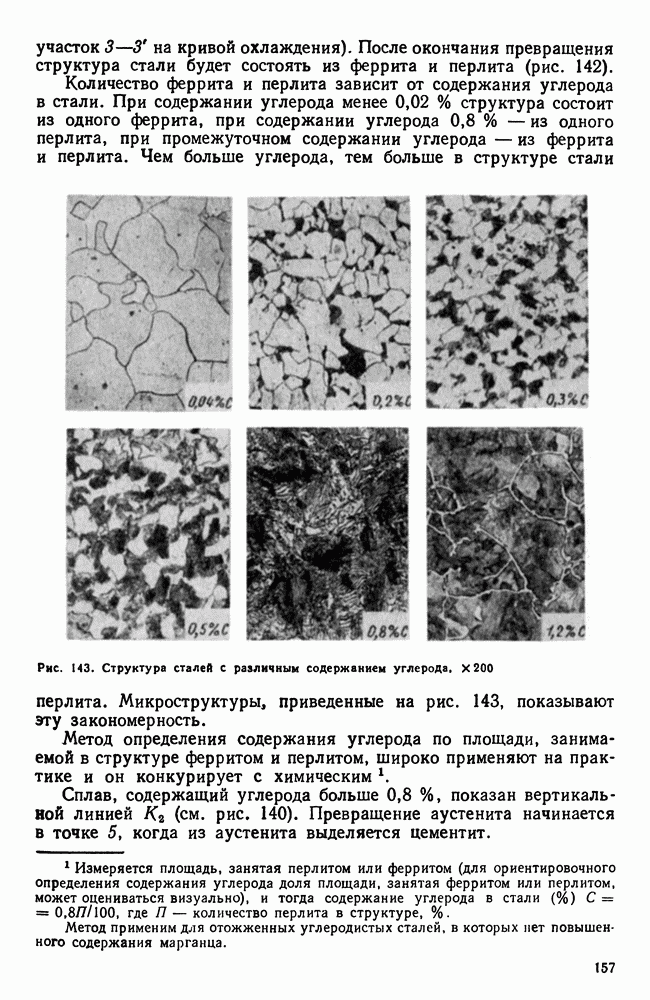
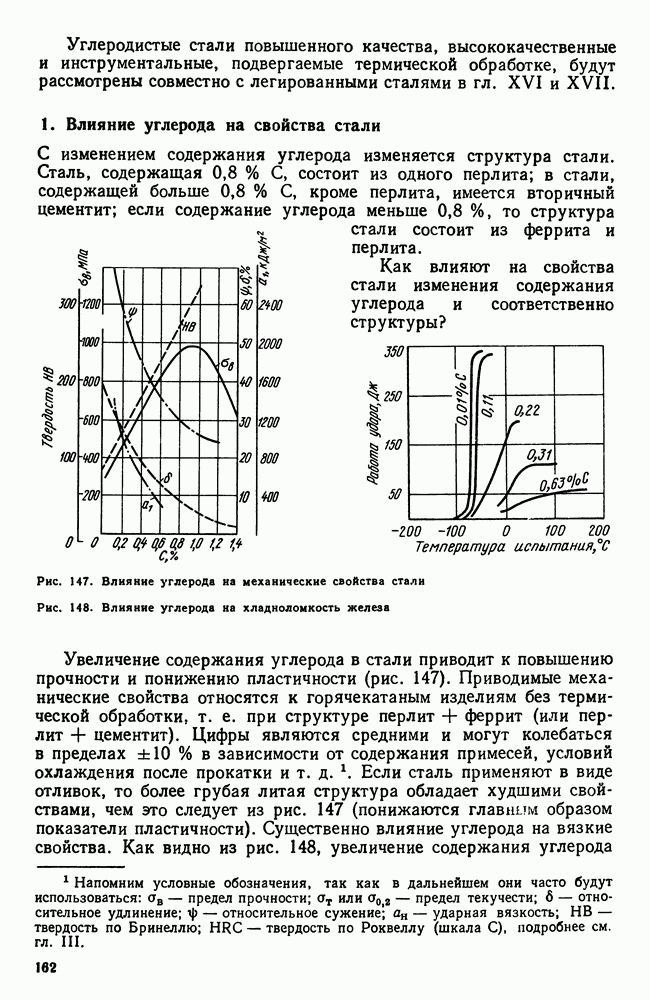
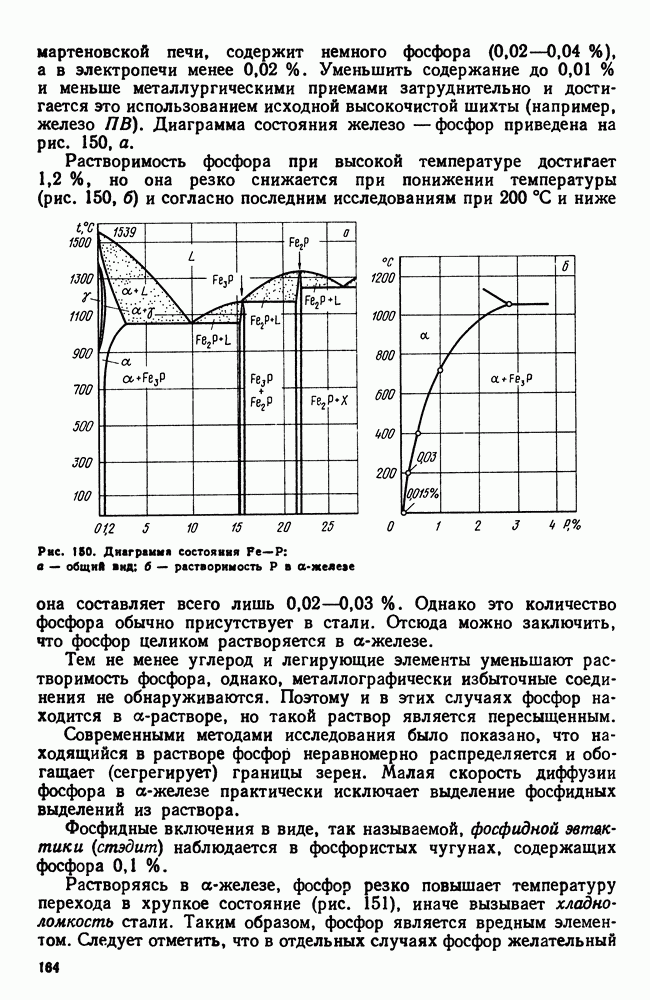
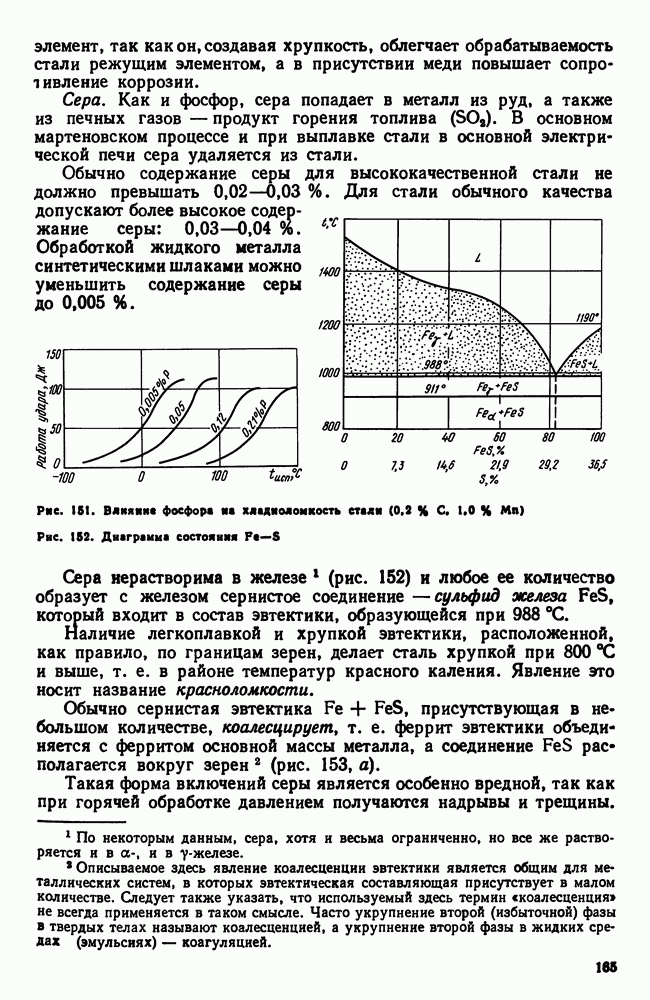
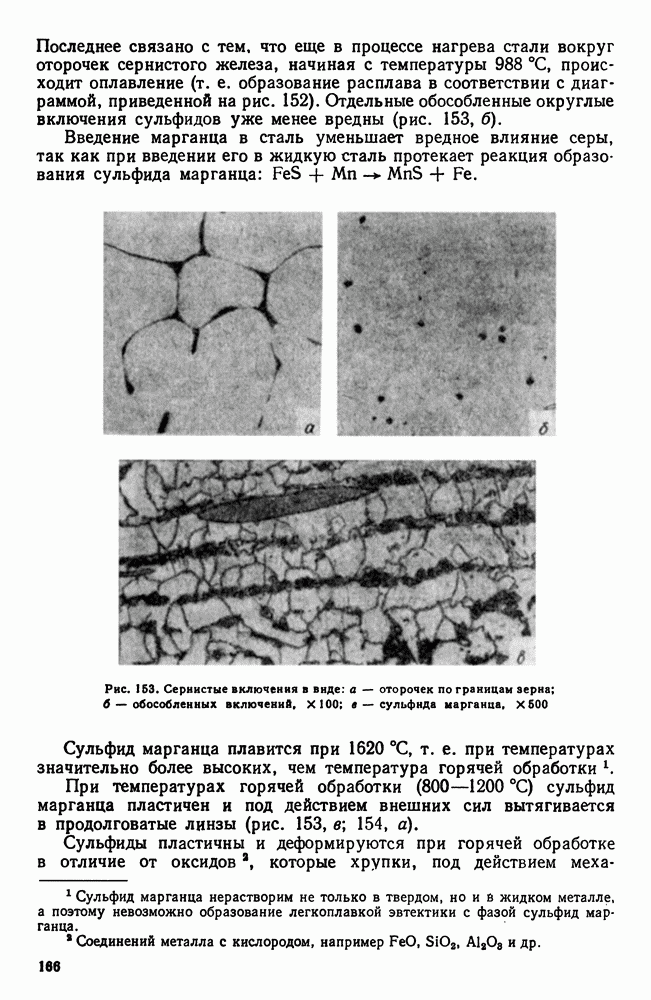
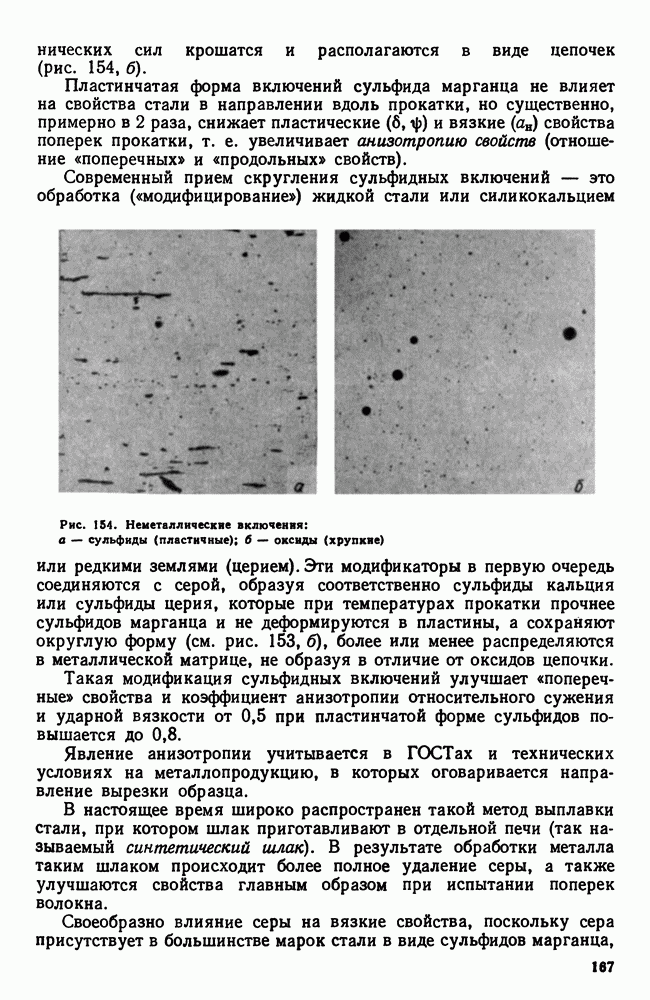
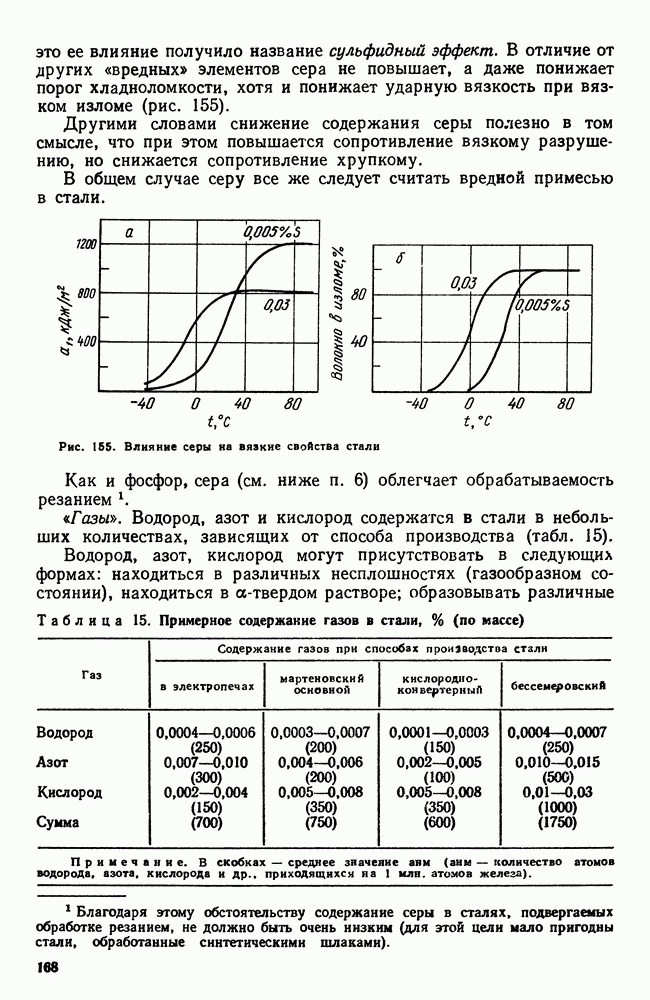
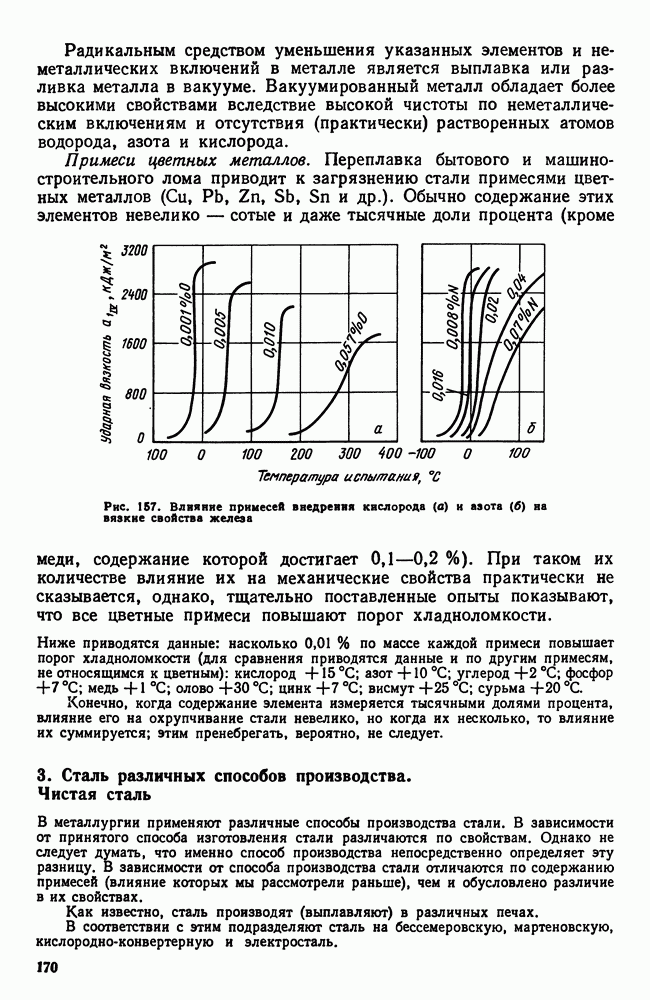
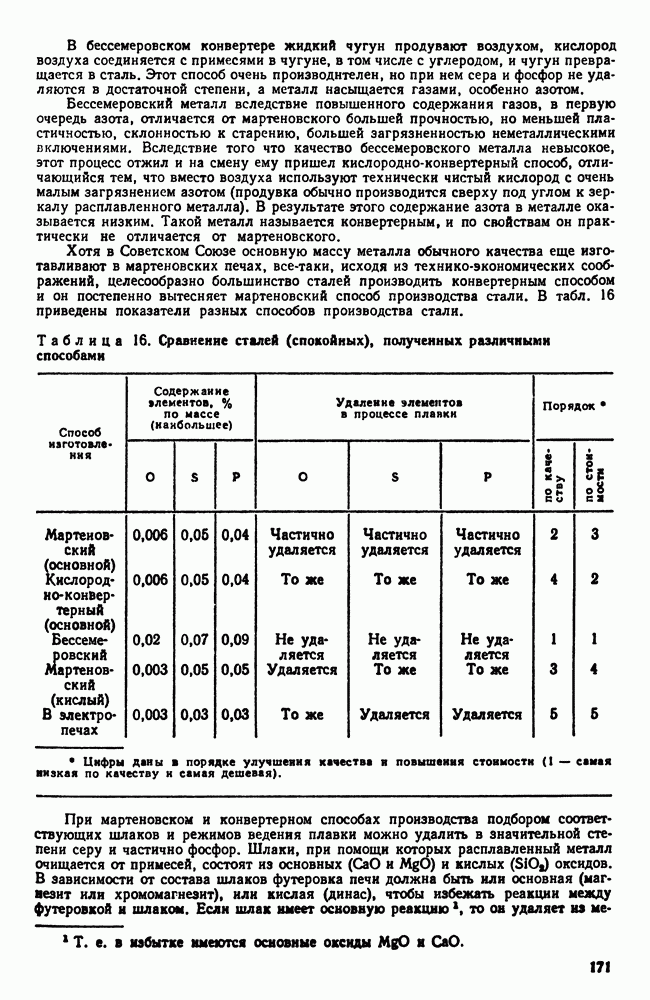
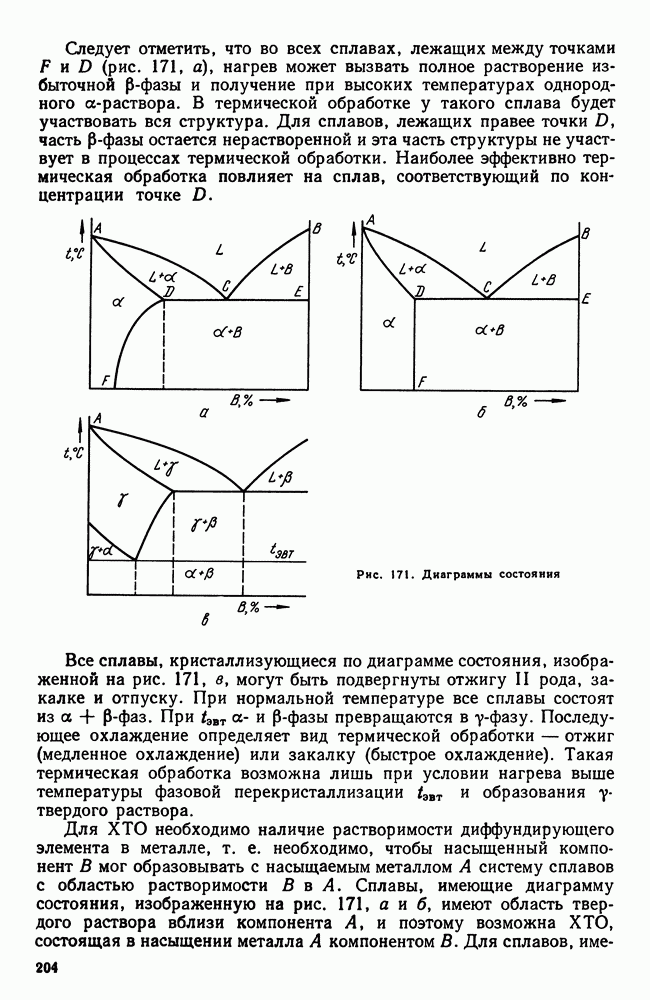
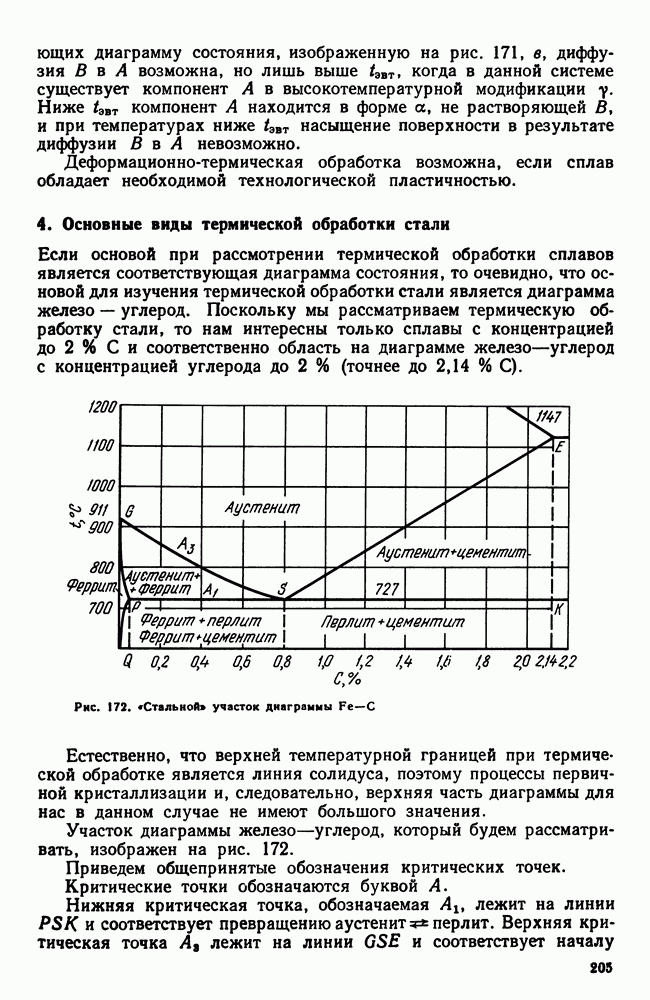
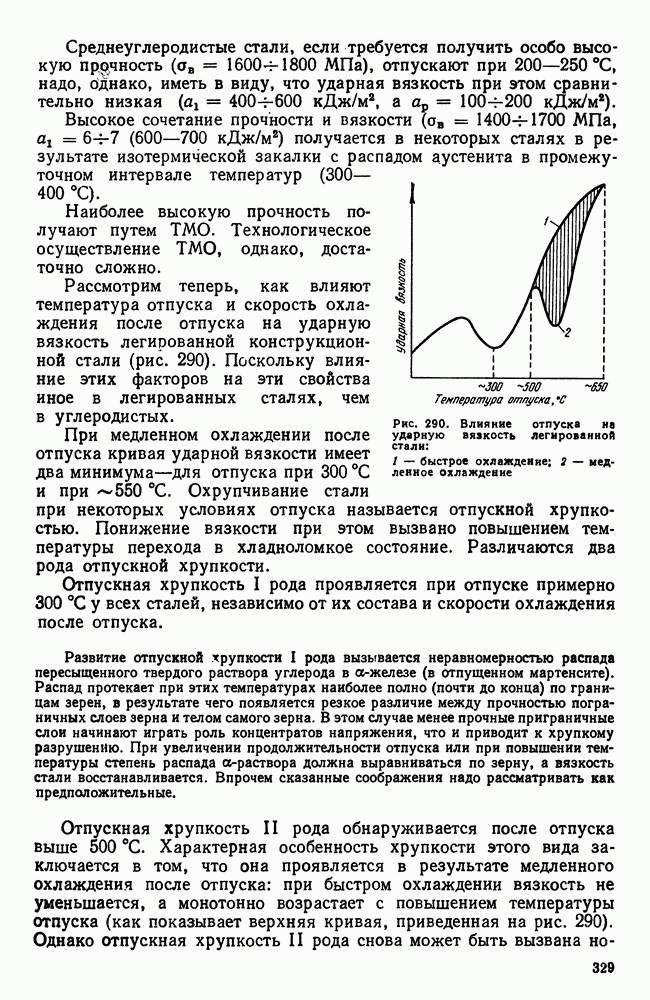
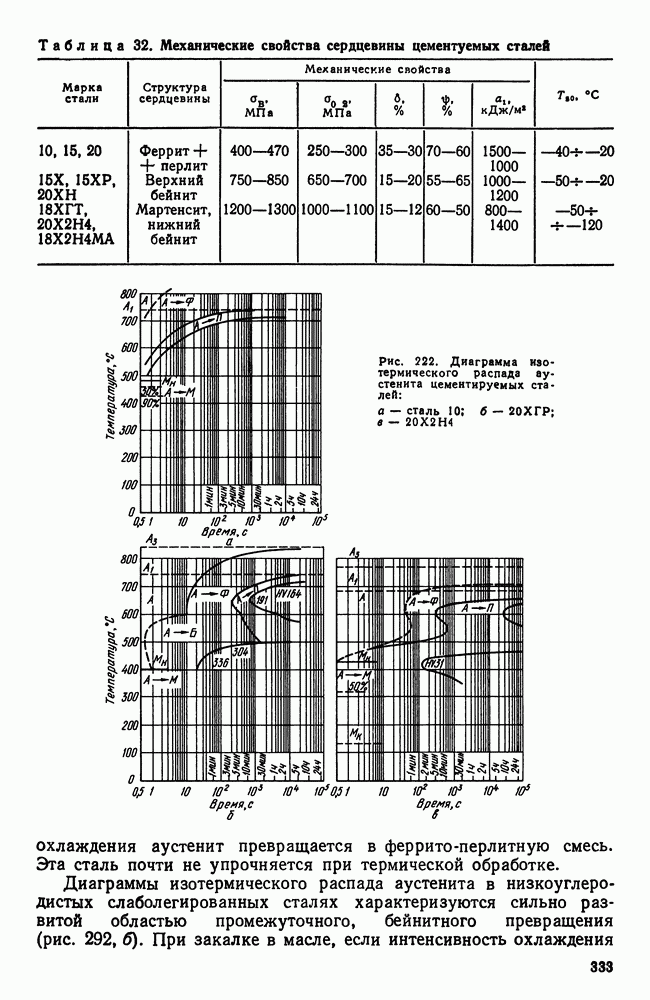
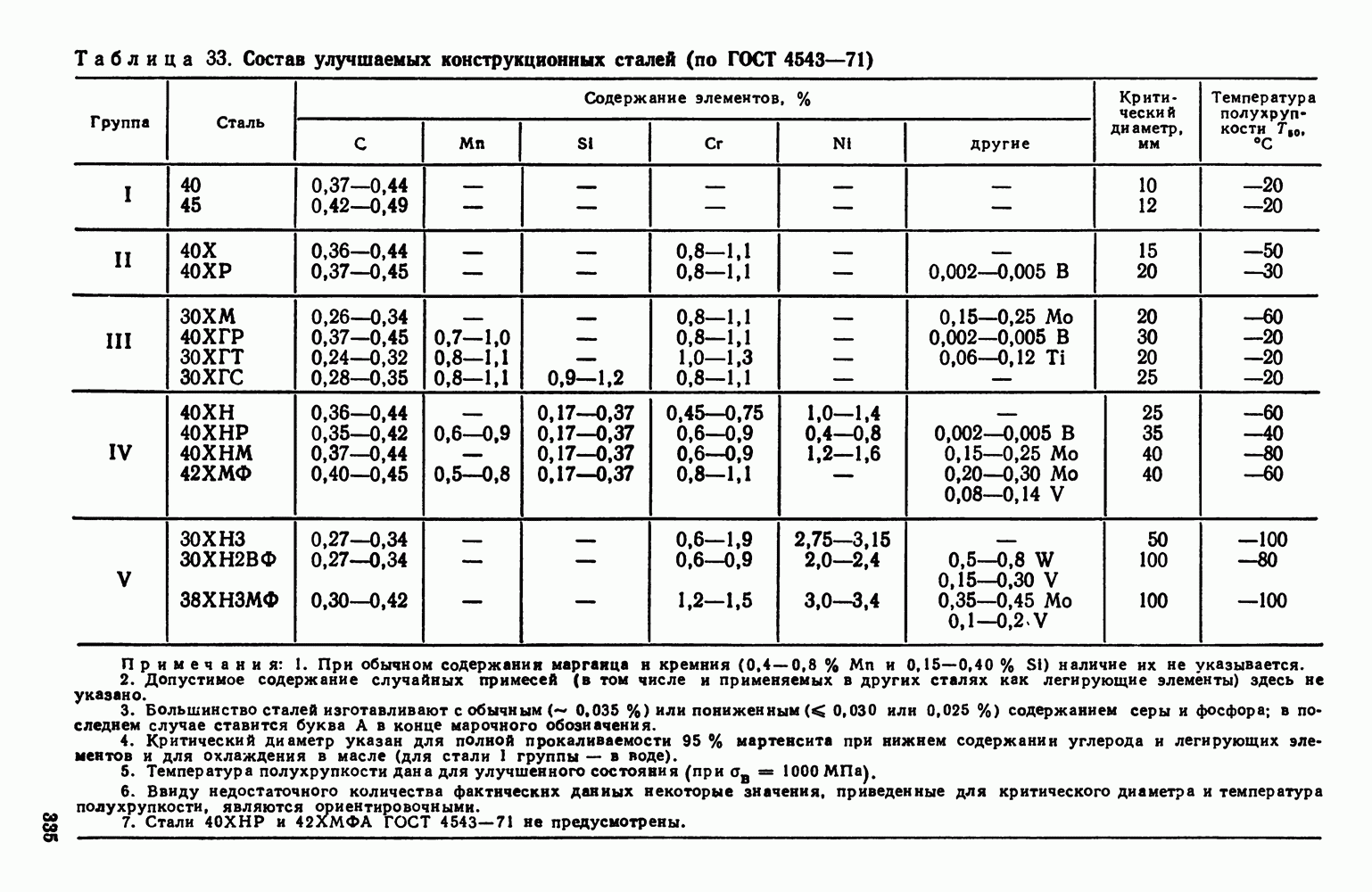
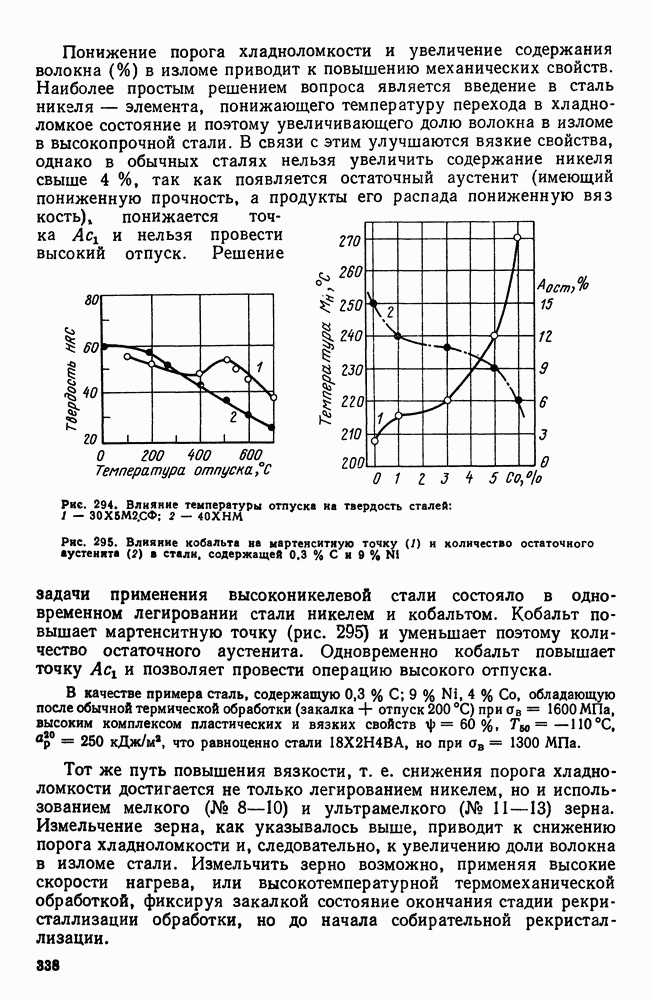
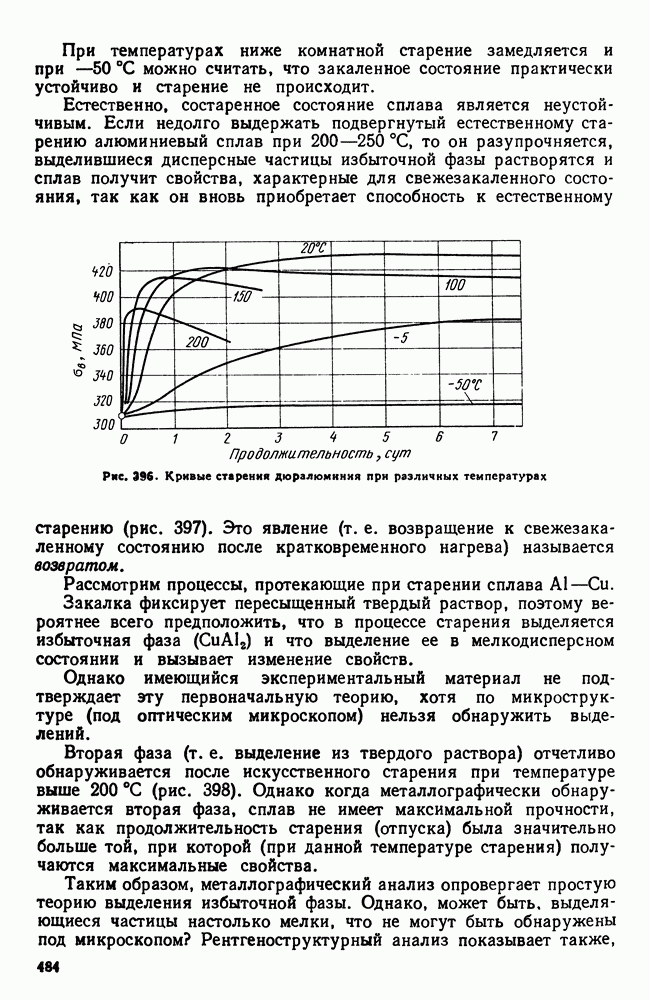
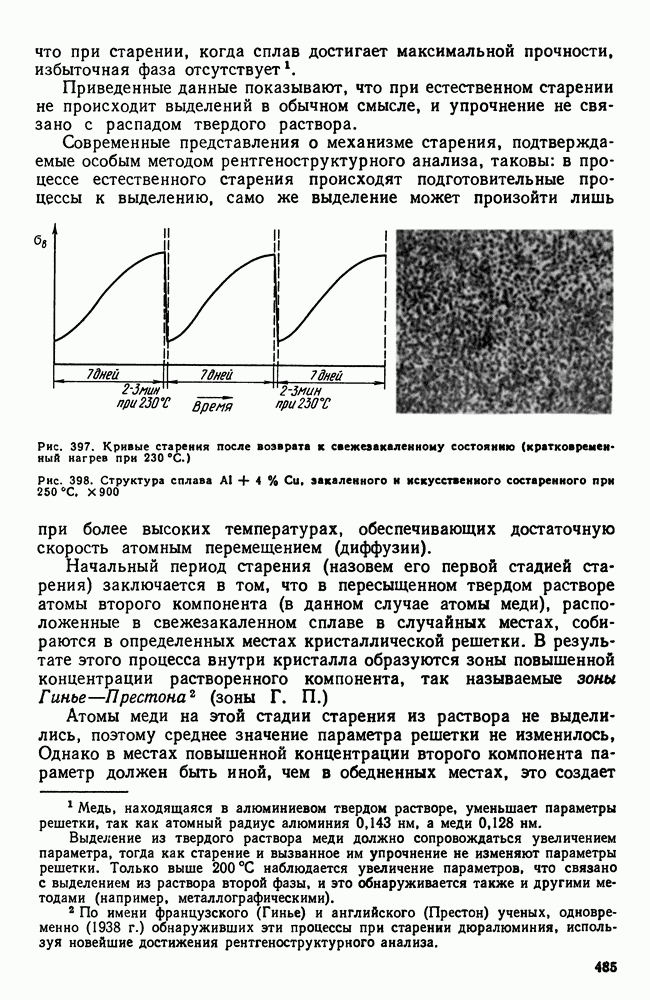
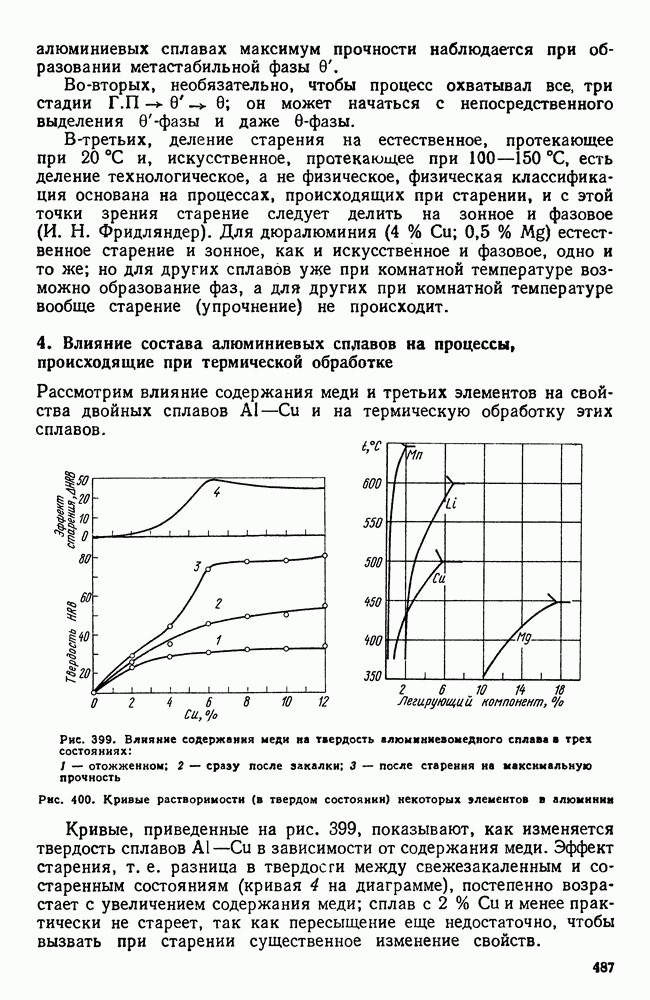
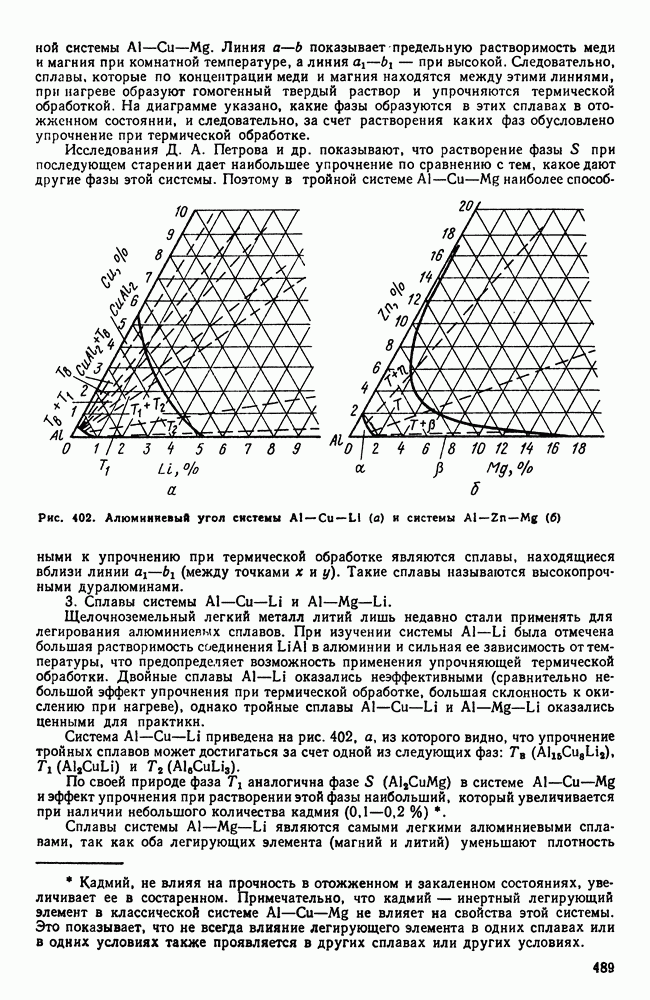
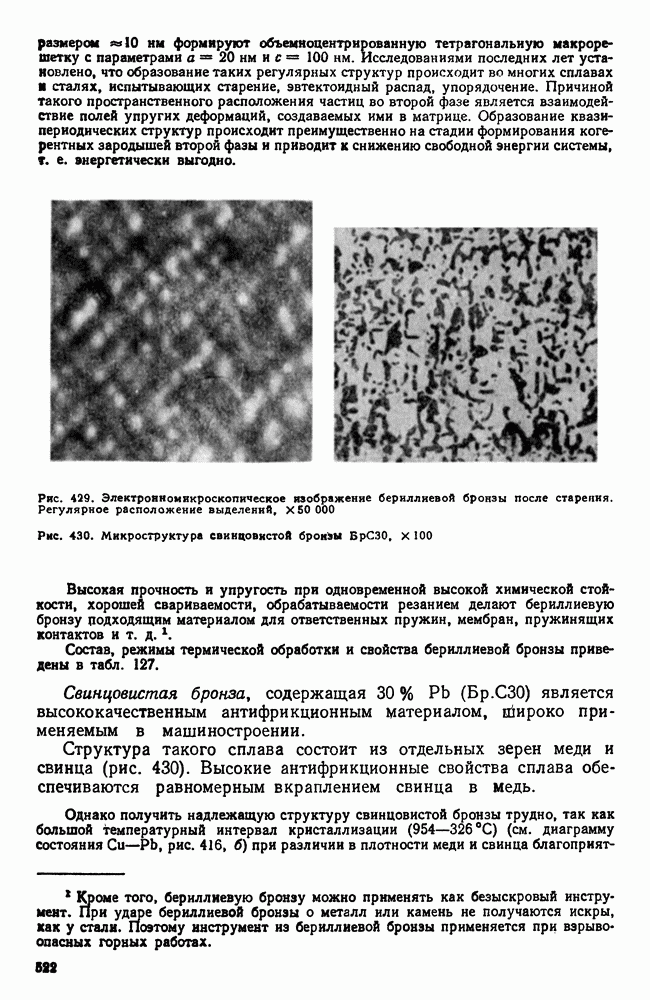
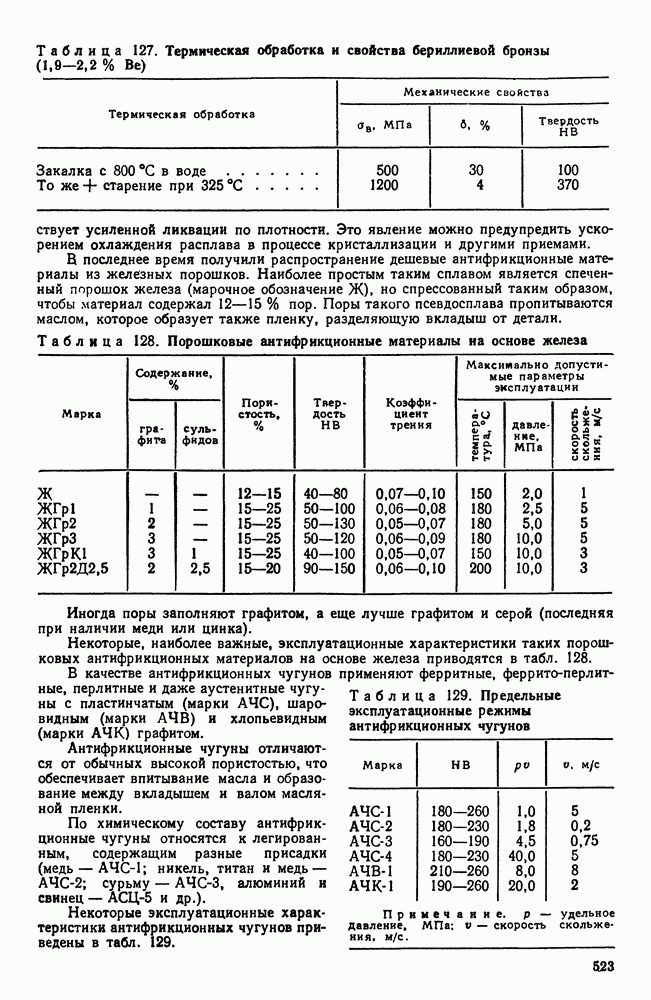
| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
3. Механизм процесса кристаллизации
Еще в 1878 г. Д. К. Чернов, изучая структуру литой стали, указал, что процесс кристаллизации состоит из двух элементарных процессов. Первый процесс заключается в зарождении мельчайших частиц кристаллов, которые Чернов называл «зачатками», а теперь их называют зародышами, или центрами кристаллизации. Второй процесс состоит в росте кристаллов из этих центров.
Систематическое исследование процесса образования центров кристаллизации и их роста вначале на прозрачных органических веществах, а затем и металлах было проведено Г. Тамманом. Им установлена в общем виде зависимость между числом центров кристаллизации, скоростью роста и степенью переохлаждения. Одна ко более поздние исследования процессов кристаллизации, особенно исследования А. А. Бочвара, К. П. Бунина и др., показали ограниченное значение схемы Таммана для процесса кристаллизации реальных жидких металлов, поскольку они содержат нерастворенные (взвешенные) частицы, служащие центрами
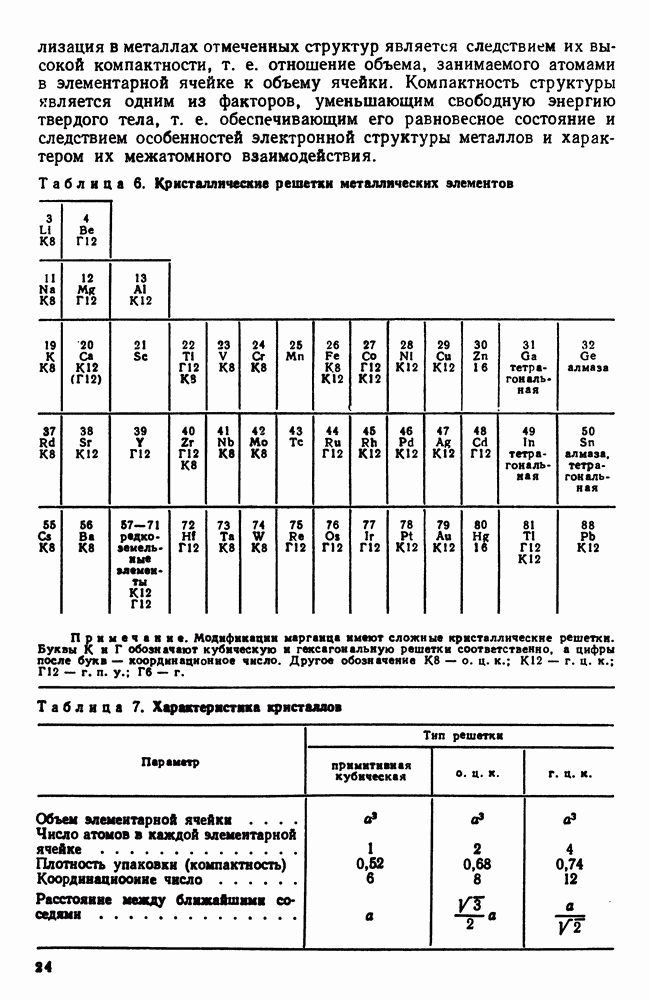
кристаллизации. Все же многие закономерности, установленные Тамманом на основе его опытов, нашли качественное подтверждение в последующих работах и оказываются полезными при анализе процессов кристаллизации.
Процесс образования кристаллов путем зарождения центров кристаллизации и их роста можно изучать с помощью рассмотрения моделей (схем), что с успехом применялось И. Л. Миркиным. Подобная модель кристаллизации представлена на рис. 28. Предположим, что на площади, изображенной на рис. 28 за секунду возникает пять зародышей, которые растут с определенной скоростью.

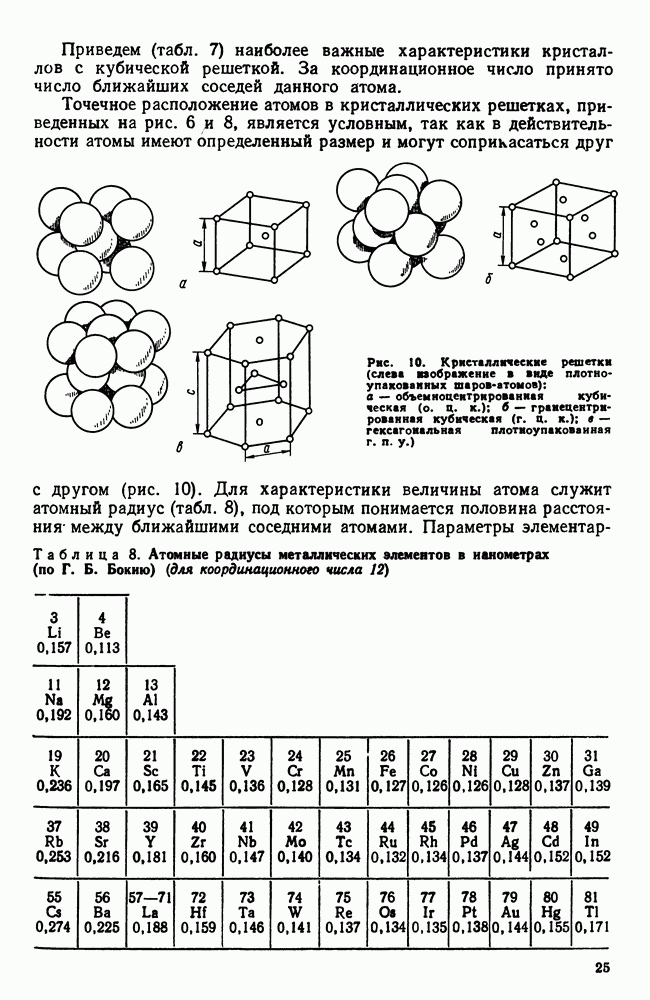
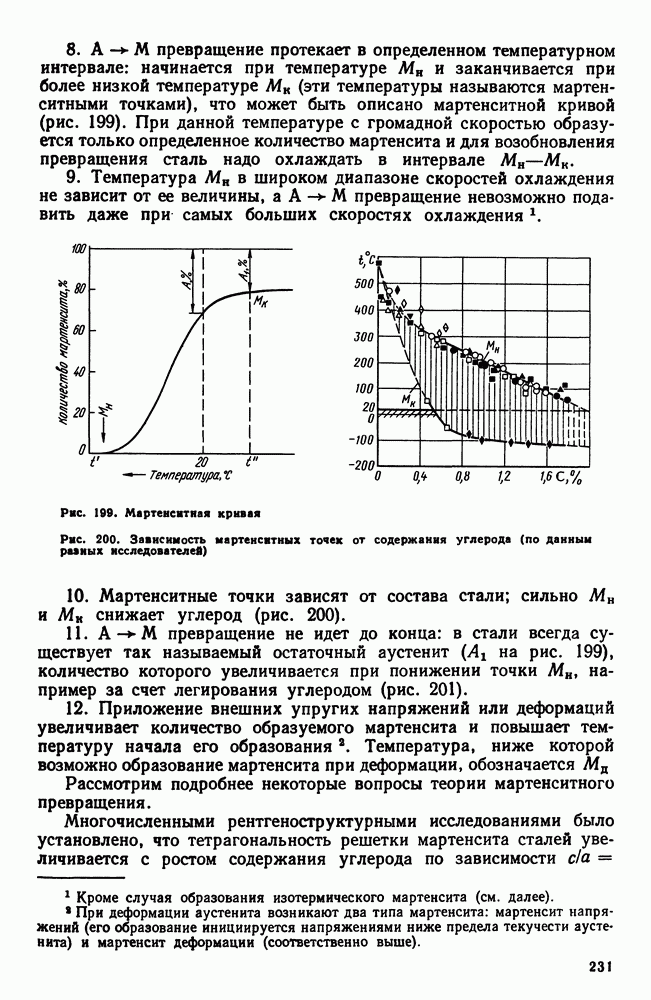
Рис. 28. Модель процесса кристаллизации
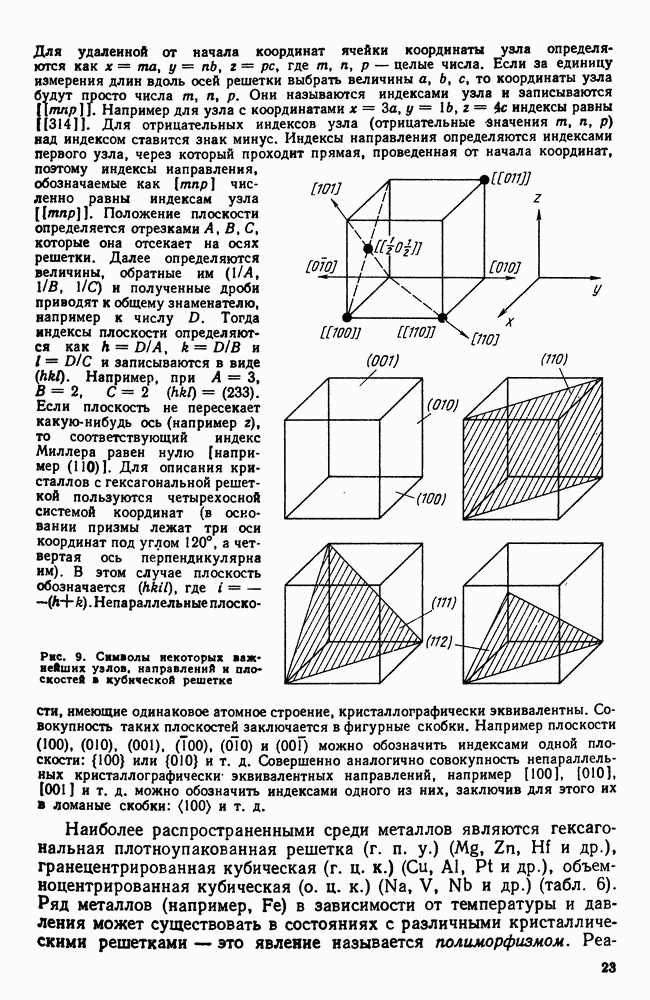
К концу первой секунды образовалось пять зародышей, к концу второй секунды они выросли и одновременно с этим возникло еще пять новых зародышей будущих кристаллов. Так, в результате возникновения зародышей и их роста происходит процесс кристаллизации, который, как видно в данном примере, заканчивается на седьмой секунде.
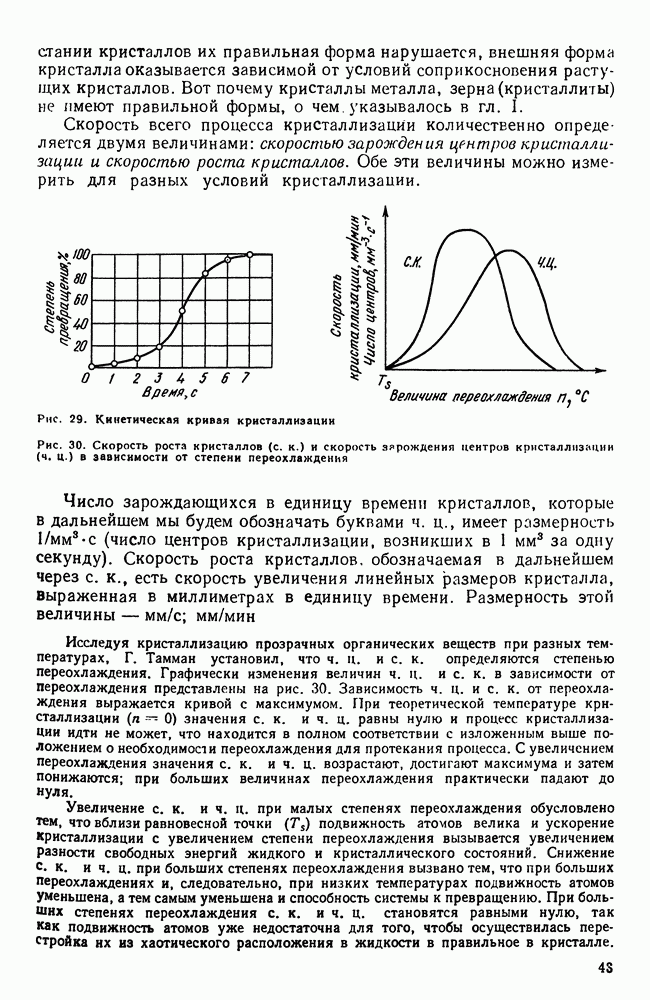
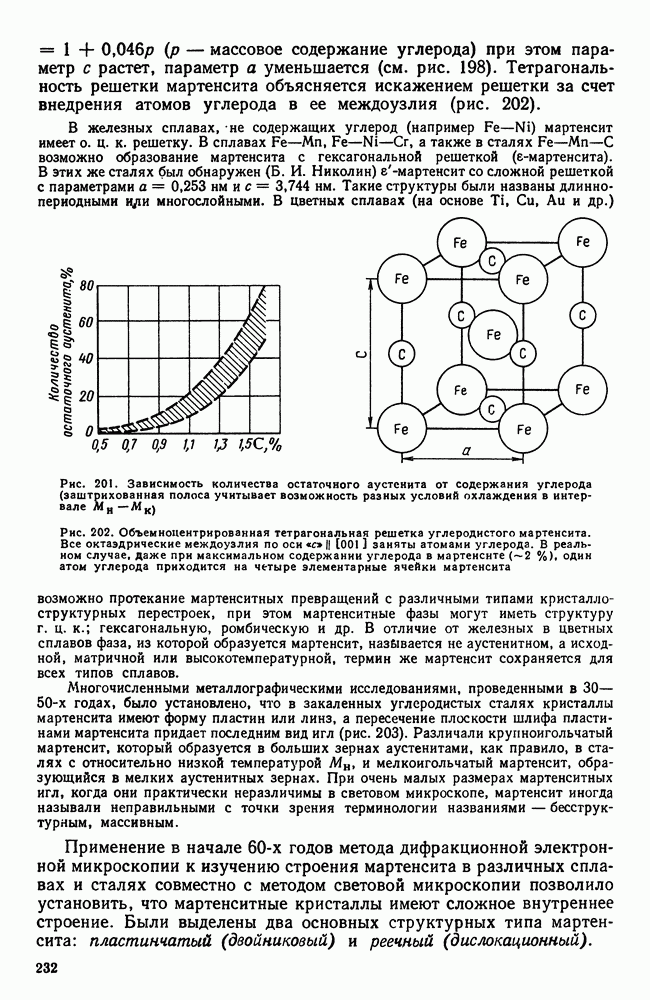
Качественная схема процесса кристаллизации, изображенная на рис. 28, может быть представлена количественно кинетической кривой (рис. 29).
Рассмотрение подобных схем кристаллизации позволяет объяснить два важных момента:
1. По мере развития процесса кристаллизации в нем участвует все большее и большее число кристаллов. Поэтому процесс вначале ускоряется, пока в какой-то момент 1 взаимное столкновение растущих кристаллов не начинает заметно препятствовать их росту; рост кристаллов замедляется, тем более, что и жидкости, в которой образуются новые кристаллы, становится все меньше.
2. В процессе кристаллизации, пока кристалл окружен жидкостью, он часто имеет правильную форму, но при столкновении и
срастании кристаллов их правильная форма нарушается, внешняя форма кристалла оказывается зависимой от условий соприкосновения растущих кристаллов. Вот почему кристаллы металла, зерна (кристаллиты) не имеют правильной формы, о чем. указывалось в гл. I.
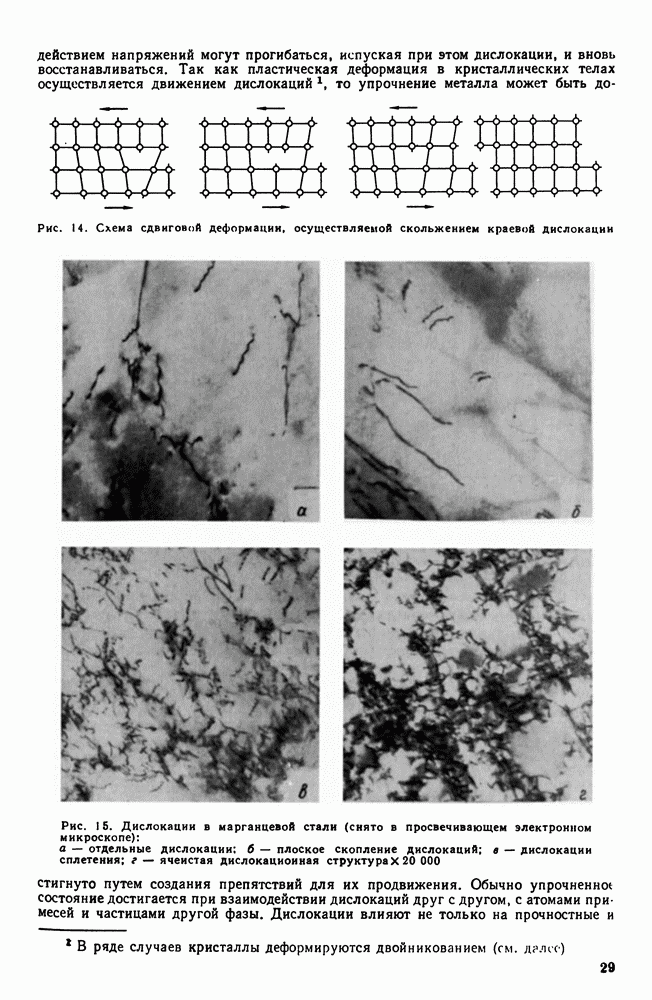
Скорость всего процесса кристаллизации количественно определяется двумя величинами: скоростью зарождения центров кристаллизации и скоростью роста кристаллов. Обе эти величины можно измерить для разных условий кристаллизации.

Рис. 29. Кинетическая кривая кристаллизации

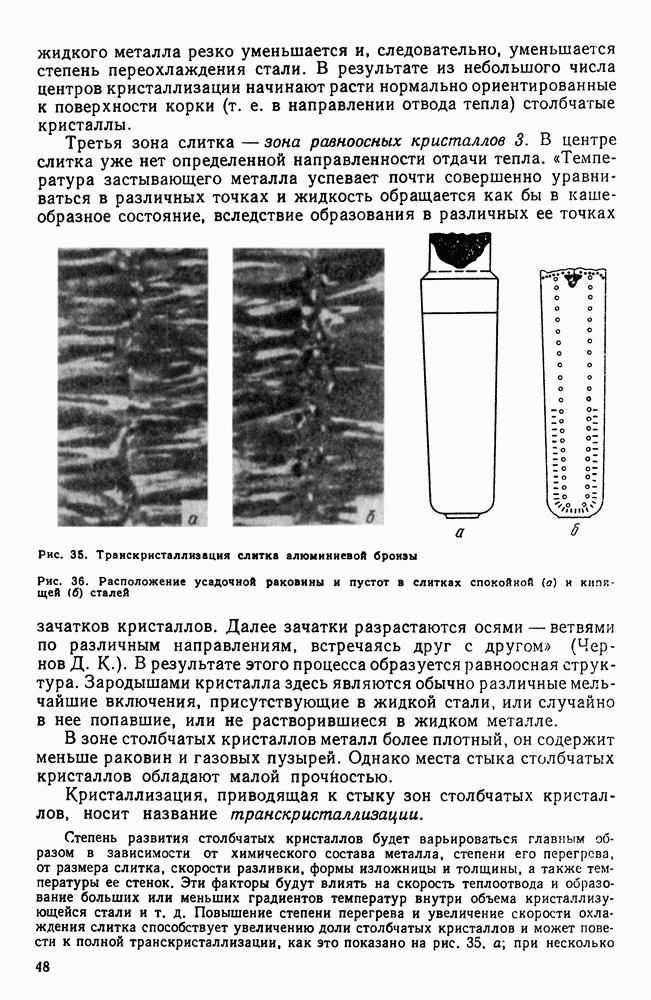
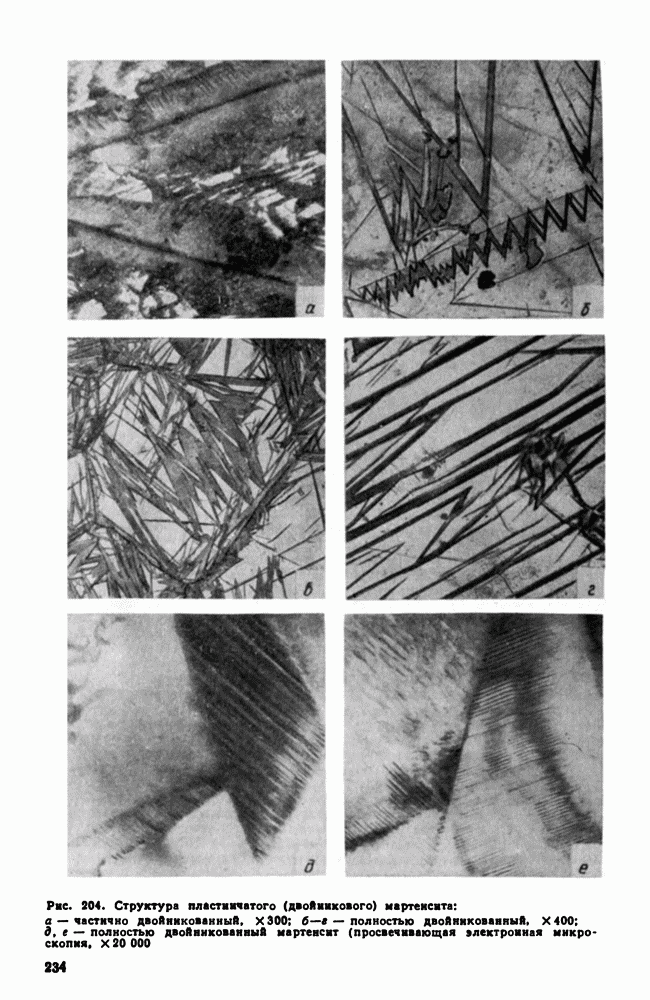
Рис. 30. Скорость роста кристаллов (с. к.) и скорость зарождения центров кристаллизации (ч. ц.) в зависимости от степени переохлаждения
Число зарождающихся в единицу времени кристаллов, которые в дальнейшем мы будем обозначать буквами ч. ц., имеет размерность  (число центров кристаллизации, возникших в
(число центров кристаллизации, возникших в  за одну секунду). Скорость роста кристаллов, обозначаемая в дальнейшем через с. к., есть скорость увеличения линейных размеров кристалла, выраженная в миллиметрах в единицу времени. Размерность этой величины —
за одну секунду). Скорость роста кристаллов, обозначаемая в дальнейшем через с. к., есть скорость увеличения линейных размеров кристалла, выраженная в миллиметрах в единицу времени. Размерность этой величины — 
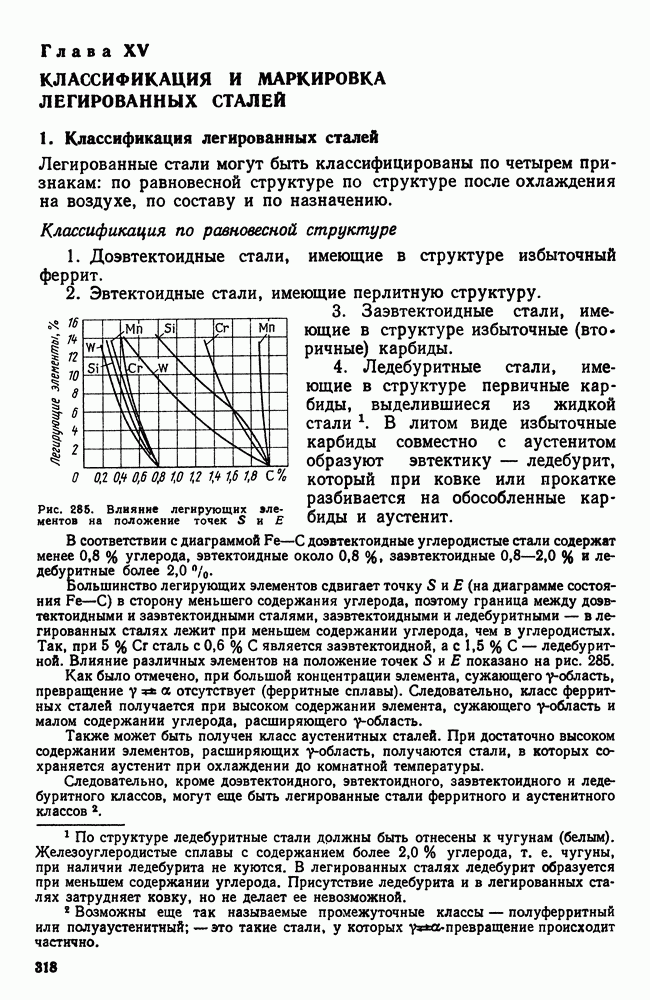
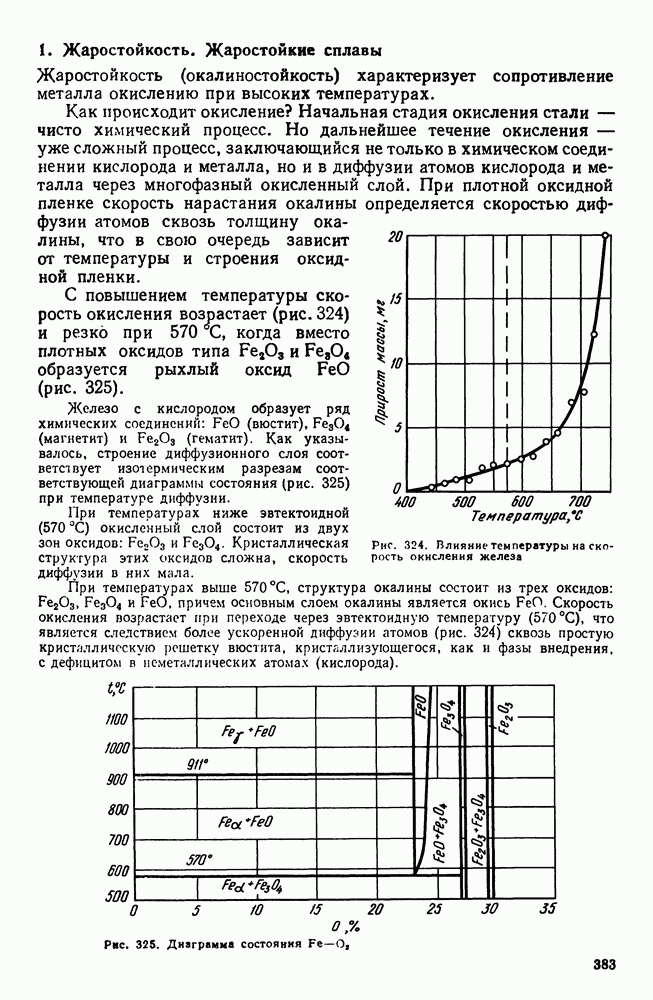
Исследуя кристаллизацию прозрачных органических веществ при разных температурах, Г. Тамман установил, что ч. ц. и с. к. определяются степенью переохлаждения. Графически изменения величин ч. ц. и с. к. в зависимости от переохлаждения представлены на рис. 30. Зависимость ч. ц. и с. к. от переохлаждения выражается кривой с максимумом. При теоретической температуре кристаллизации  значения с. к. и ч. ц. равны нулю и процесс кристаллизации идти не может, что находится в полном соответствии с изложенным выше положением о необходимости переохлаждения для протекания процесса. С увеличением переохлаждения значения с. к. и ч. ц. возрастают, достигают максимума и затем понижаются; при больших величинах переохлаждения практически падают до нуля.
значения с. к. и ч. ц. равны нулю и процесс кристаллизации идти не может, что находится в полном соответствии с изложенным выше положением о необходимости переохлаждения для протекания процесса. С увеличением переохлаждения значения с. к. и ч. ц. возрастают, достигают максимума и затем понижаются; при больших величинах переохлаждения практически падают до нуля.
Увеличение с. к. и ч. ц. при малых степенях переохлаждения обусловлено тем, что вблизи равновесной точки  подвижность атомов велика и ускорение Кристаллизации с увеличением степени переохлаждения вызывается увеличением разности свободных энергий жидкого и кристаллического состояний. Снижение с. к. и ч. ц. при больших степенях переохлаждения вызвано тем, что при больших переохлаждениях и, следовательно, при низких температурах подвижность атомов уменьшена, а тем самым уменьшена и способность системы к превращению. При больших степенях переохлаждения с. к. и ч. ц. становятся равными нулю, так как подвижность атомов уже недостаточна для того, чтобы осуществилась перестройка их из хаотического расположения в жидкости в правильное в кристалле.
подвижность атомов велика и ускорение Кристаллизации с увеличением степени переохлаждения вызывается увеличением разности свободных энергий жидкого и кристаллического состояний. Снижение с. к. и ч. ц. при больших степенях переохлаждения вызвано тем, что при больших переохлаждениях и, следовательно, при низких температурах подвижность атомов уменьшена, а тем самым уменьшена и способность системы к превращению. При больших степенях переохлаждения с. к. и ч. ц. становятся равными нулю, так как подвижность атомов уже недостаточна для того, чтобы осуществилась перестройка их из хаотического расположения в жидкости в правильное в кристалле.
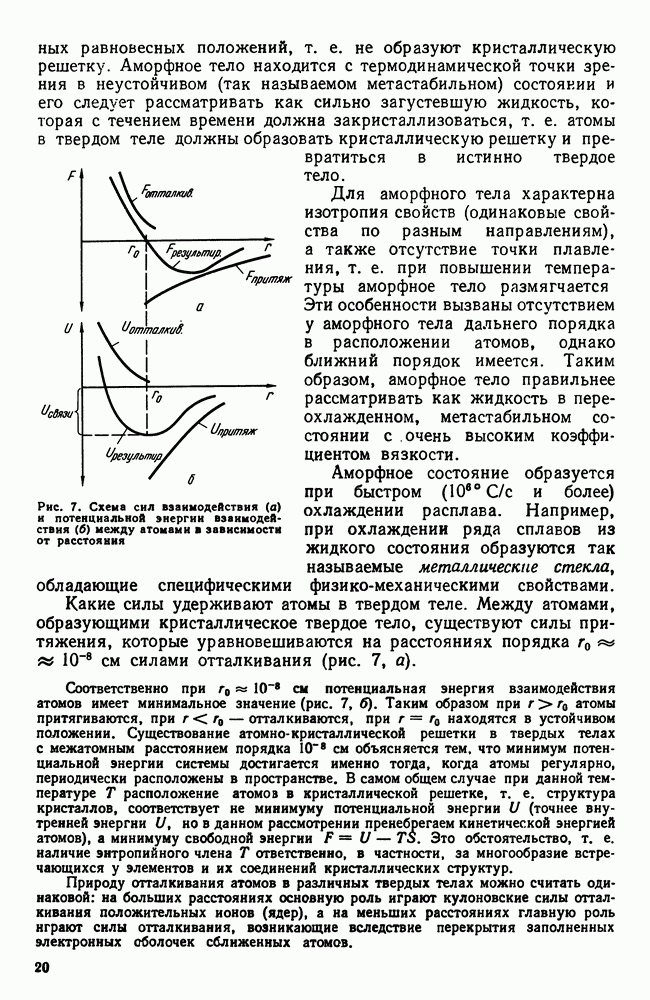
Размер образовавшихся кристаллов зависит от соотношения величин с. к. и ч. ц. при температуре кристаллизации, при данной степени переохлаждения. При большом значении с. к. и малом значении ч. ц. (например, при малых степенях переохлаждения, рис. 30), образуются немногочисленные крупные кристаллы; при малых значениях с. к. и больших ч. ц. (большое переохлаждение) образуется большое число мелких кристаллов. Наконец, в соответствии с кривыми Таммана, если удается очень сильно переохладить жидкость без кристаллизации, то с. к. и ч. ц. становятся равными нулю, жидкость сохраняется непревращенной, незакристаллизовавшейся. Соли, силикаты, органические вещества весьма склонны к переохлаждению. Для металлов же требуется переохладить жидкость до температуры, когда подвижность атомов станет мала и такое состояние окажется достаточно устойчивым.
Обычное прозрачное «твердое» стекло представляет собой переохлажденную загустевшую жидкость. Такое состояние, как указывалось выше, является аморфным и характеризуется отсутствием определенной температуры плавления и отсутствием правильного расположения атомов в виде определенной кристаллической решетки.
Было показано, что не только в жидких расплавах, но и при превращении в твердом состоянии новая форма также образуется путем зарождения и роста кристаллов; скорость этих процессов зависит от переохлаждения. В отличие от кристаллизации из жидкости процесс превращения в твердом состоянии (перекристаллизация) обычно протекает при сильном переохлаждении, и таммановская зависимость с. к. и ч. ц. для этого случая даже более приемлема, чем для случая первичной кристаллизации из жидкого состояния.
Учитывая изложенное, можно отметить, что переход из одного состояния в другое, например из жидкого в твердое, возможен тогда, когда твердое состояние более устойчиво, имеет более низкое значение свободной энергии. Но сам переход из одного состояния в другое требует затраты энергии на образование поверхности раздела жидкость — кристалл.
Превращение произойдет тогда, когда выигрыш в энергии от перехода в более устойчивое состояние будет больше потери энергии, идущей на образование поверхности раздела.
Другими словами, свободная энергия системы  определяется как алгебраическая сумма двух членов, характеризующих поверхность
определяется как алгебраическая сумма двух членов, характеризующих поверхность  и объемную
и объемную  энергии:
энергии:

где  — поверхность;
— поверхность;  — поверхностное натяжение; V — объем;
— поверхностное натяжение; V — объем;  — разность свободных энергий жидкого и кристаллического состояний, приходящаяся на единицу объема.
— разность свободных энергий жидкого и кристаллического состояний, приходящаяся на единицу объема.
По мере увеличения зародыша (для зародыша сферической формы) поверхностный член увеличивается пропорционально квадрату радиуса, а объемный — кубу, т. е. если поверхность и объем частицы выразить через ее радиус, то получим

где  — радиус частицы новой фазы;
— радиус частицы новой фазы;  — число частиц.
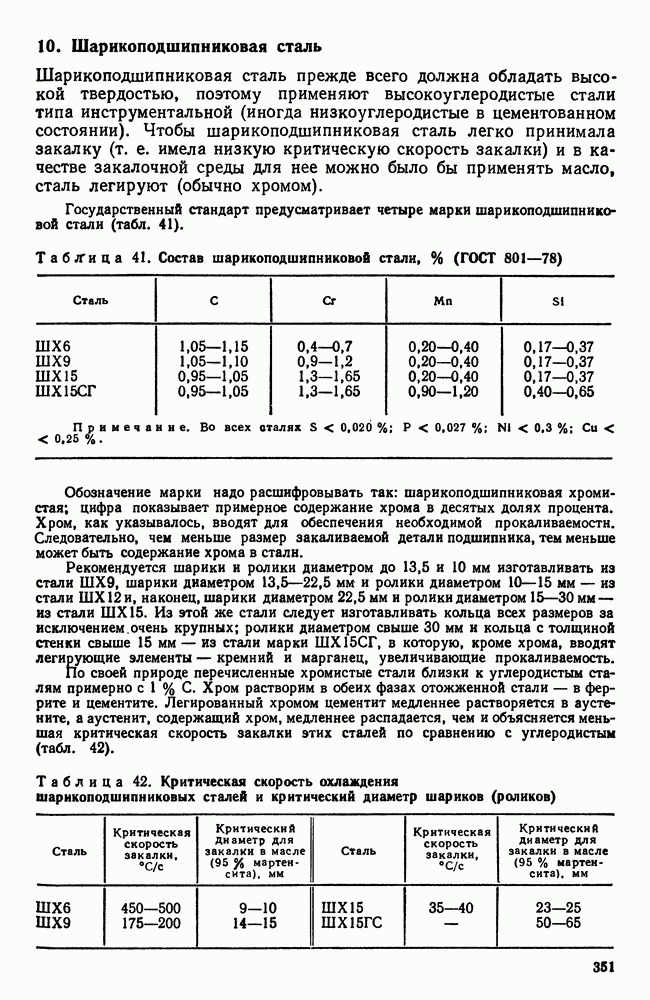
— число частиц.
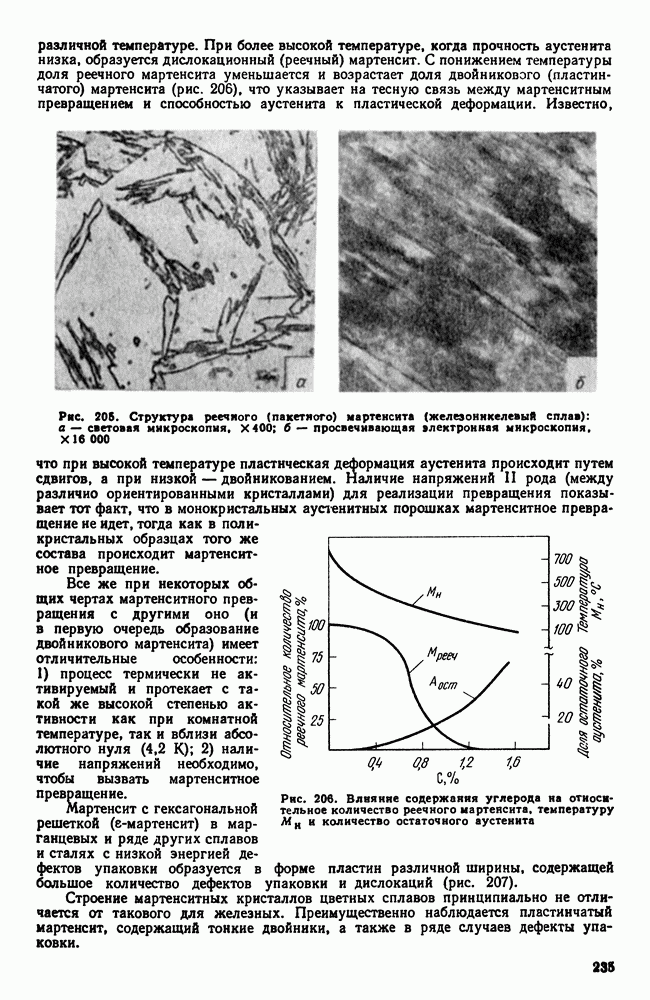
Увеличение размера зарождающегося кристалла вначале приводит к росту свободной энергии (так как объем У мал, а поверхность  относительно велика) (рис. 31). Но при некотором критическом значении увеличение размера зародыша приведет к уменьшению
относительно велика) (рис. 31). Но при некотором критическом значении увеличение размера зародыша приведет к уменьшению 
Процесс кристаллизации может протекать только при условии уменьшения свободной энергии, поэтому, если образуется зародыш размером меньше  (см. рис. 31), он расти не может, так как это повело бы к увеличению энергии системы. Если же образуется зародыш размером
(см. рис. 31), он расти не может, так как это повело бы к увеличению энергии системы. Если же образуется зародыш размером  и более, то его рост возможен, так как это приведет к уменьшению свободной энергии.
и более, то его рост возможен, так как это приведет к уменьшению свободной энергии.
Минимальный размер способного к росту зародыша называется критическим размером зародыша, а такой зародыш называется устойчивым.

Рис. 31. Изменение свободной энергии в зависимости от размера зародыша
Каждой температуре кристаллизации (степени переохлаждения) отвечает определенный размер устойчивого зародыша; более мелкие если они и возникнут, тут же растворяются в жидкости, а более крупные растут, превращаясь в зерна — кристаллы. Чем ниже температура (больше степень переохлаждения), тем меньший размер имеет устойчивый зародыш, тем больше число центров кристаллизации образуется в единицу времени, тем быстрее протекает процесс кристаллизации. Таким образом, с увеличением степени переохлаждения быстро возрастают величина ч. ц. и общая скорость кристаллизации.
| << Предыдущий параграф | Следующий параграф >> |
- ПРЕДИСЛОВИЕ
- Часть первая. ТЕОРИЯ СПЛАВОВ
- Глава I. КРИСТАЛЛИЧЕСКОЕ СТРОЕНИЕ МЕТАЛЛОВ
- 2. Классификация металлов
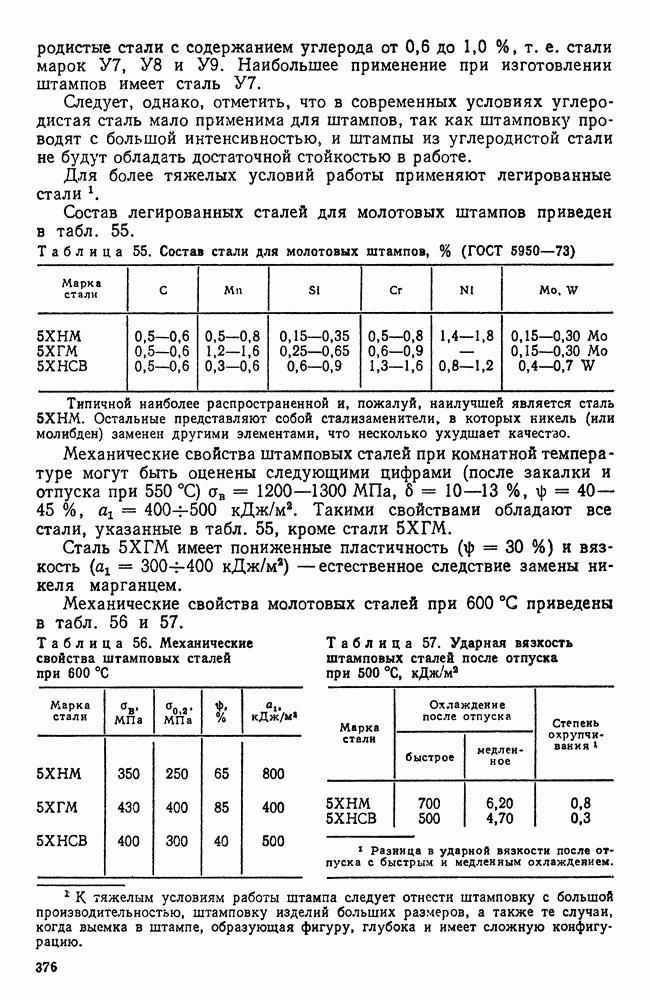
- 3. Кристаллическое строение металлов
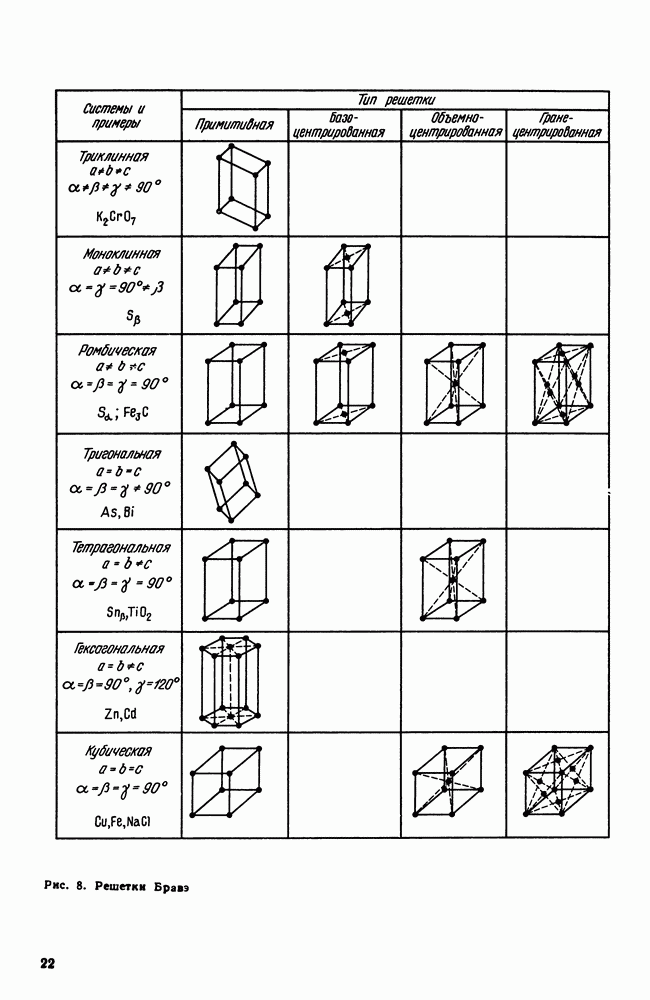
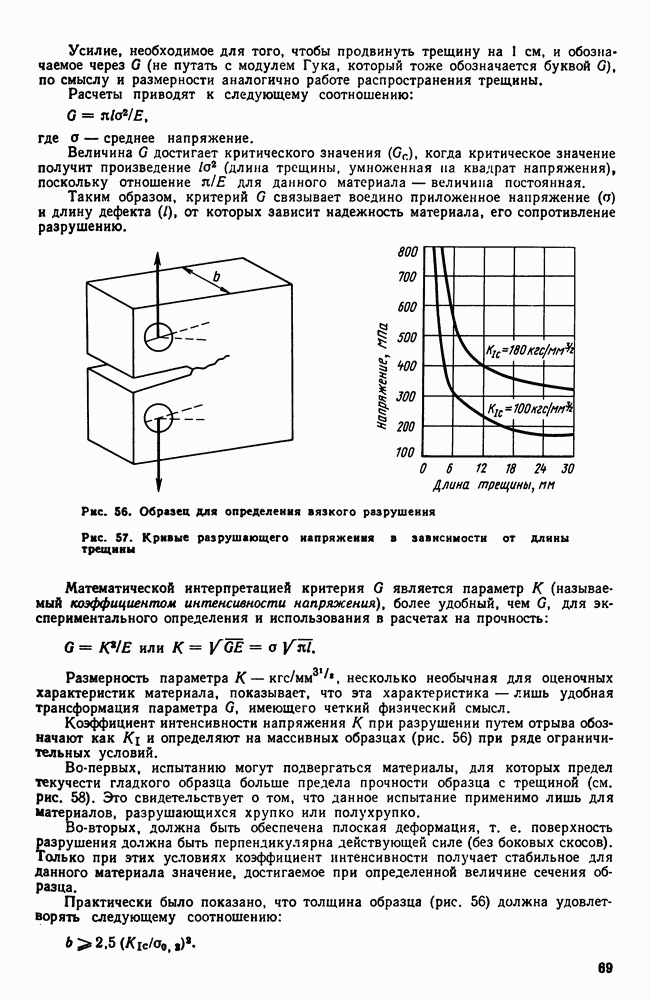
- 4. Кристаллические решетки металлов
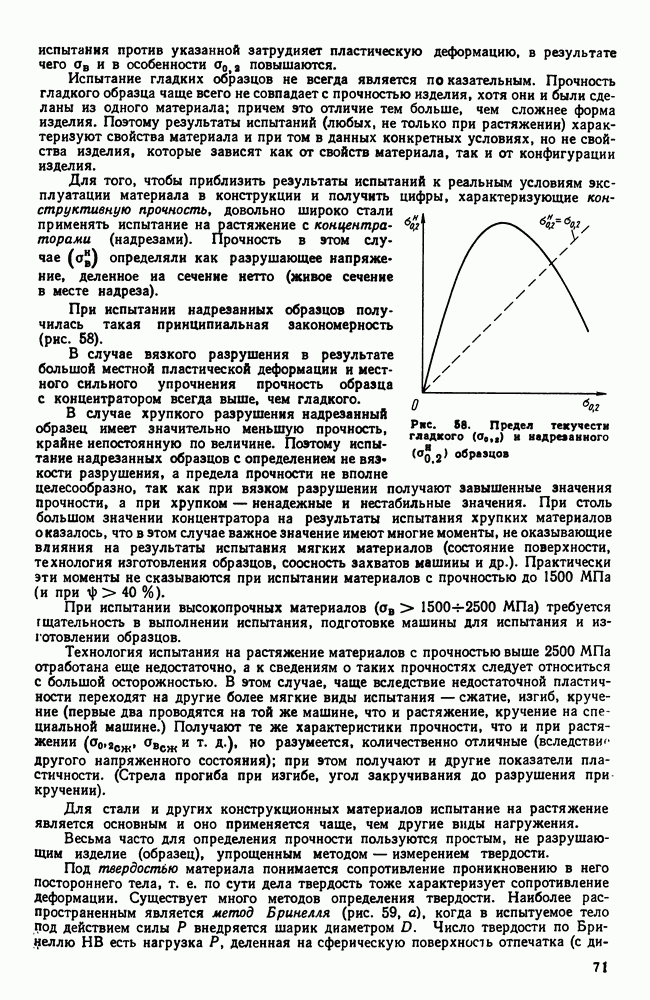
- 5. Реальное строение металлических кристаллов
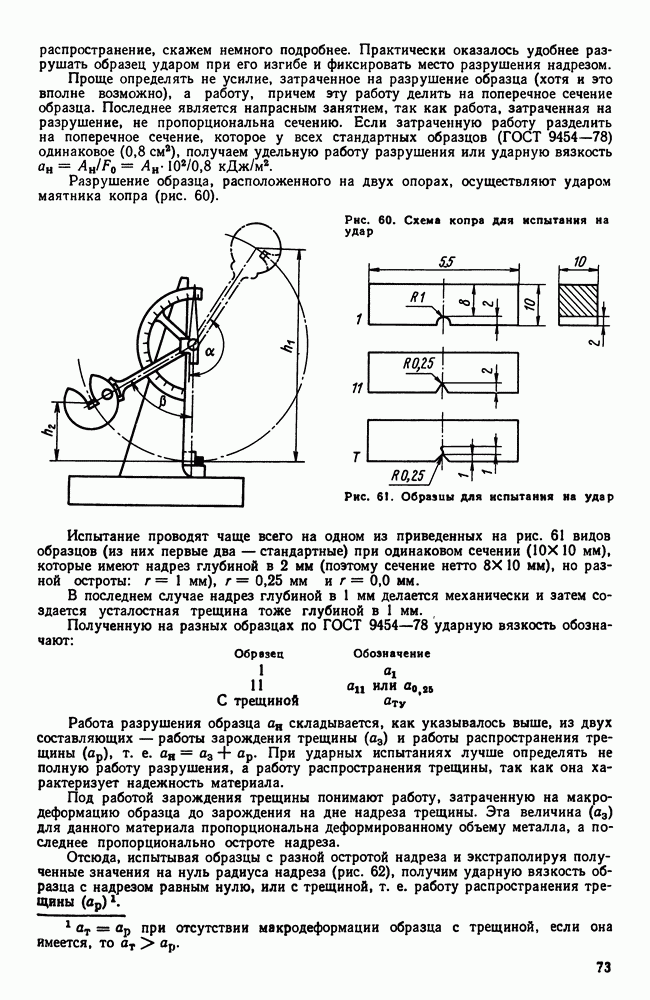
- 6. Анизотропия свойств кристаллов
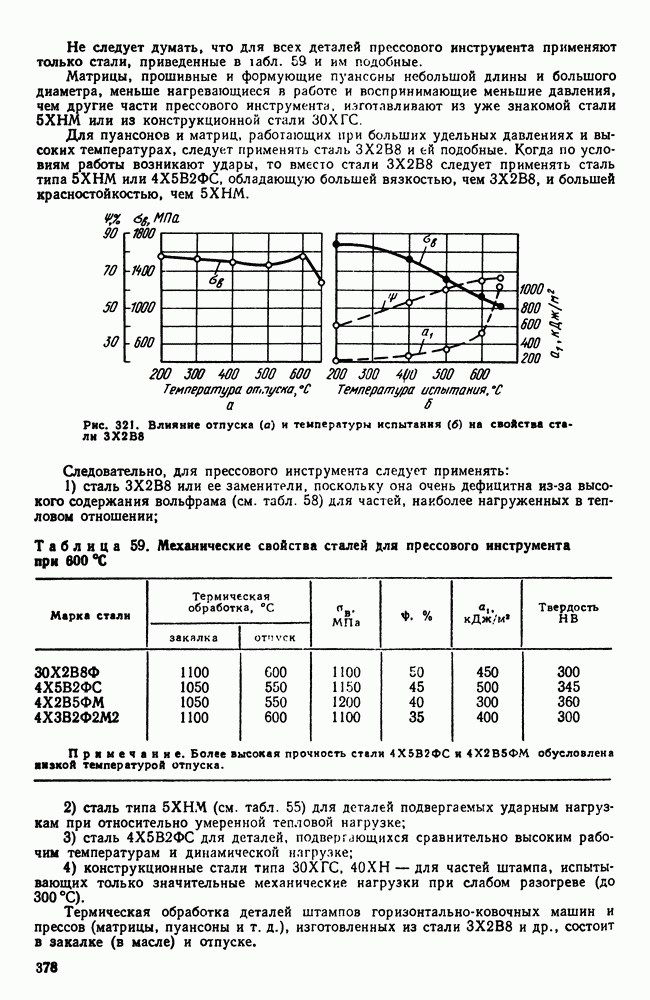
- 7. Методы изучения строения металлов
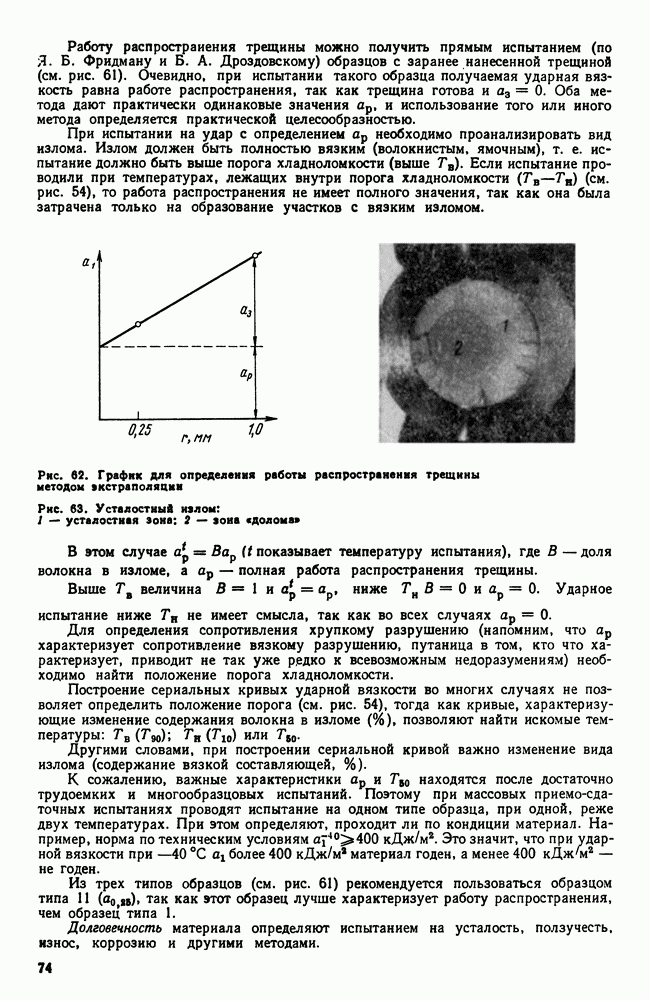
- Глава II. КРИСТАЛЛИЗАЦИЯ
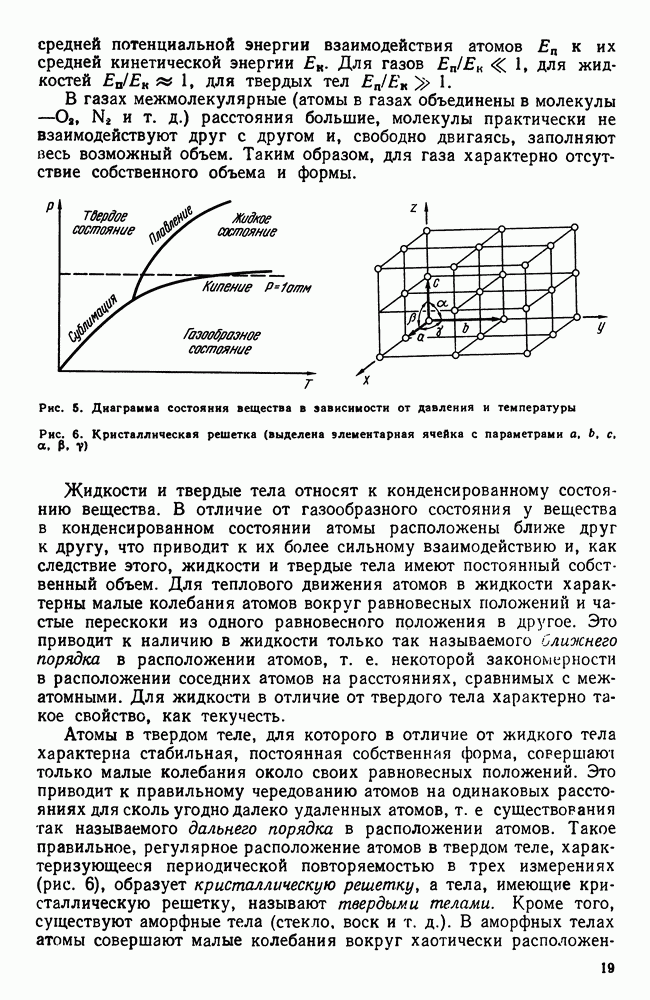
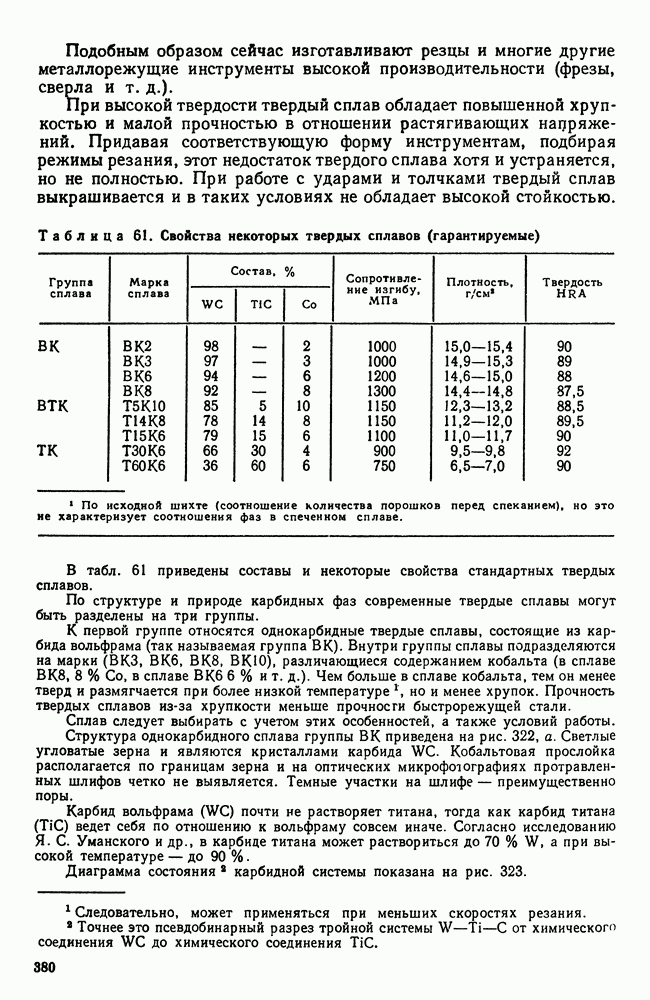
- 1. Три состояния вещества
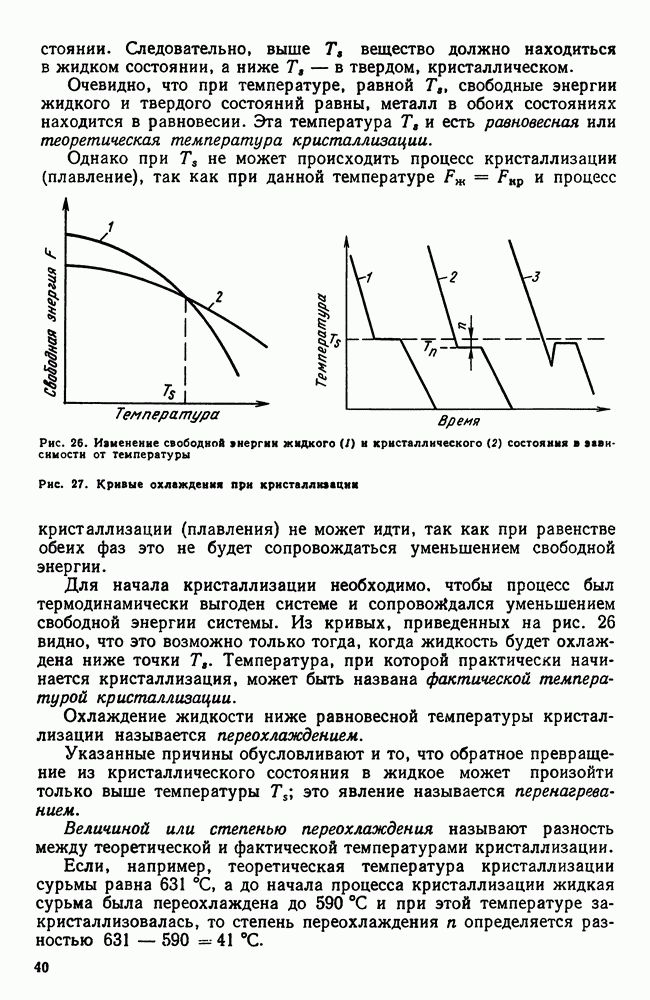
- 2. Энергетические условия процесса кристаллизации
- 3. Механизм процесса кристаллизации
- 4. Форма кристаллических образований
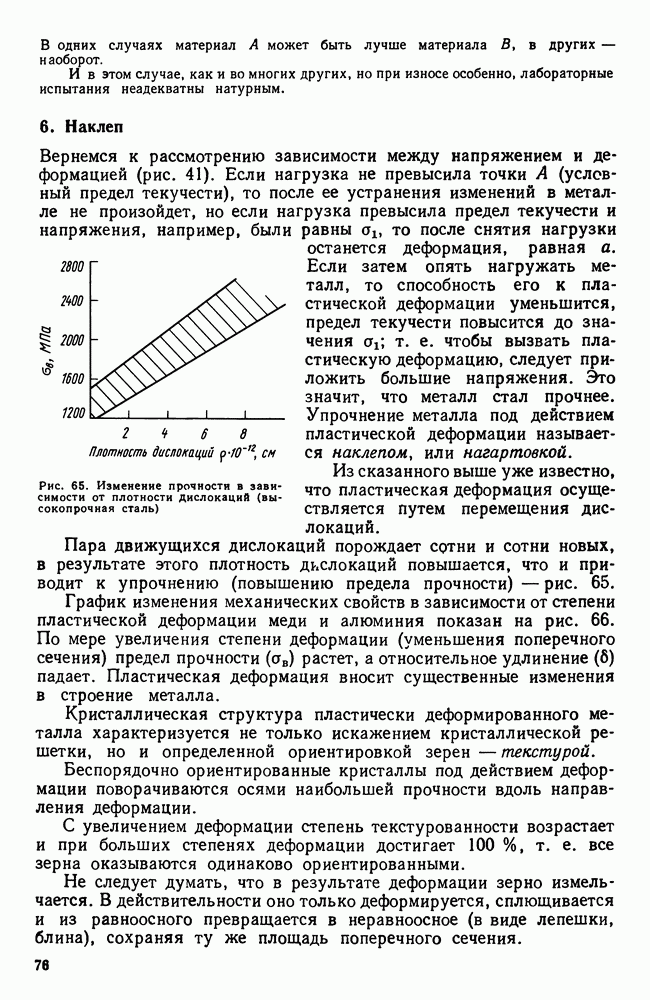
- 5. Строение слитка
- 6. Превращения в твердом состояние. Полиморфизм
- 7. Магнитные превращения
- 8. Закалка из жидкого состояния. Аморфное состояние
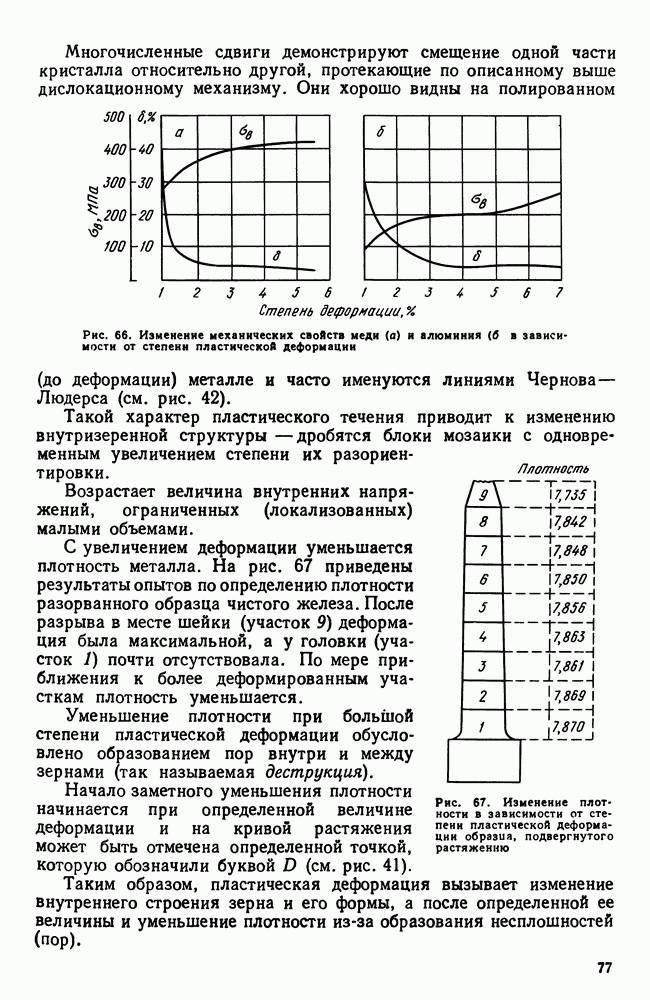
- Глава III. МЕХАНИЧЕСКИЕ СВОЙСТВА. НАКЛЕП И РЕКРИСТАЛЛИЗАЦИЯ
- 2. Упругая и пластическая деформация. Несовершенства решетки и прочность металлов
- 3. Сверхпластичность
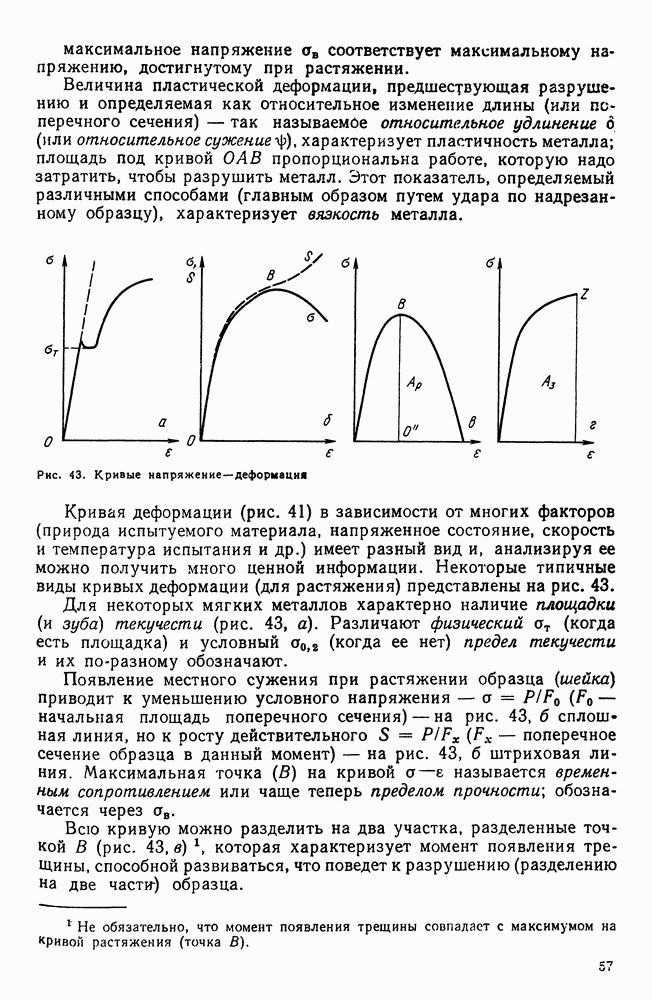
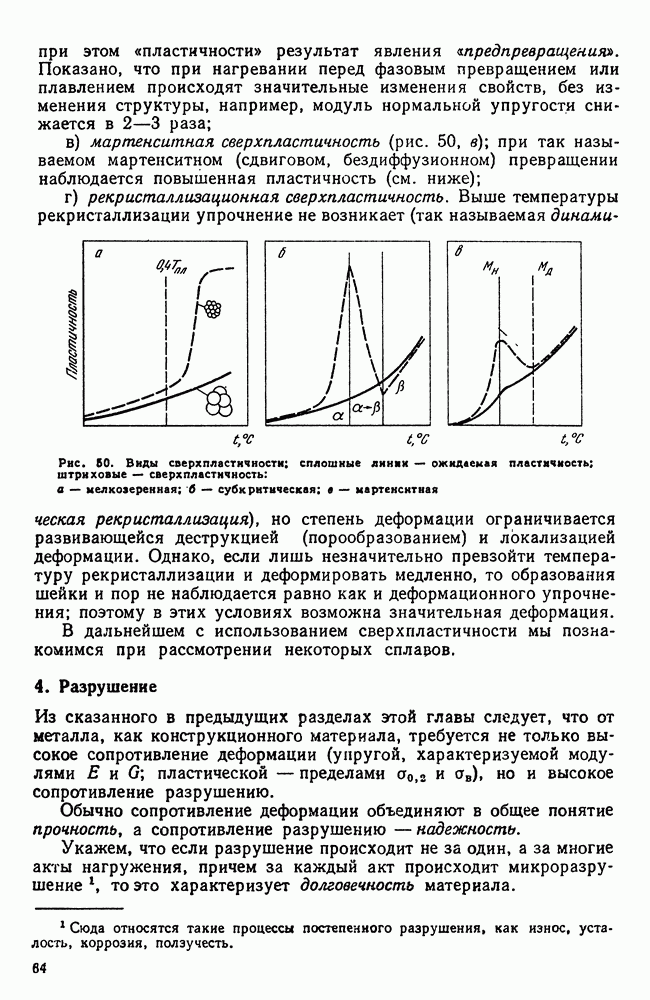
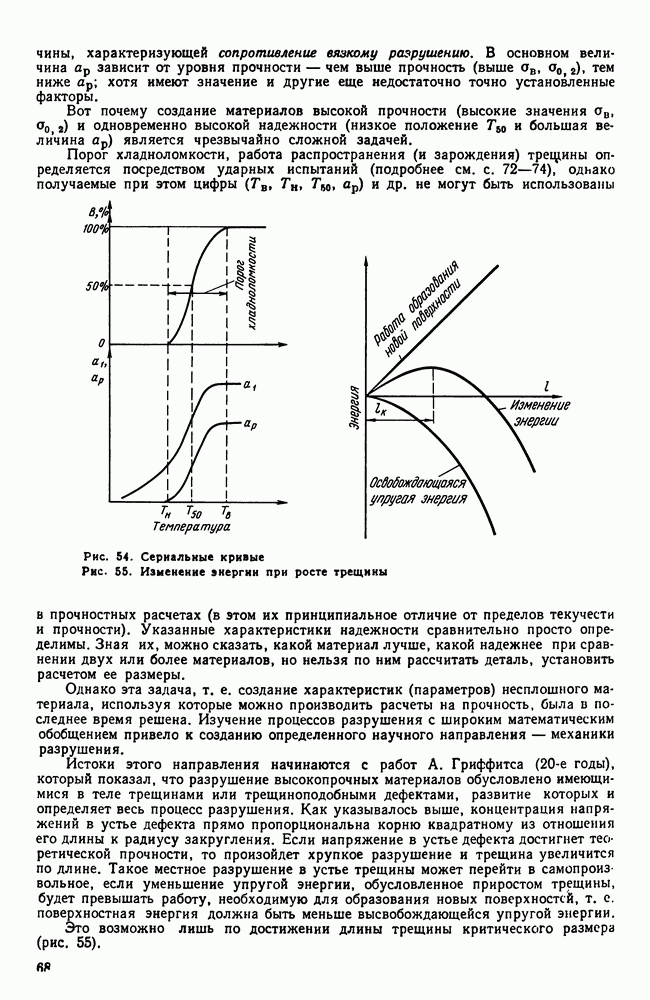
- 4. Разрушение
- 5. Методы определения механических свойств
- 6. Наклеп
- 7. Влияние нагрева на строение и свойства деформированного металла (рекристаллизационные процессы)
- Глава IV. СТРОЕНИЕ СПЛАВОВ
- 2. Химическое соединение
- 3. Твердый раствор на основе одного из компонентов сплава
- 4. Твердый раствор на основе химического соединения
- 5. Упорядоченные твердые растворы
- 6. Электронные соединения (фазы Юм-Розери)
- 7. Фазы Лавеса
- 8. Фазы внедрения
- Глава V. ДИАГРАММА СОСТОЯНИЯ
- 2. Общие замечания о построении диаграмм состояния
- 3. Экспериментальное построение диаграмм
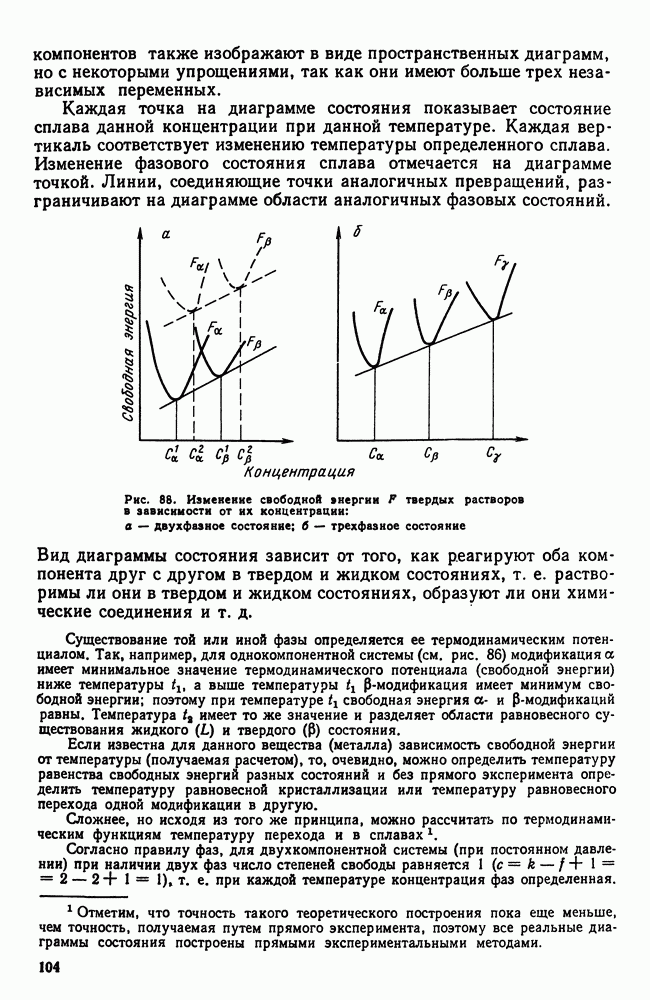
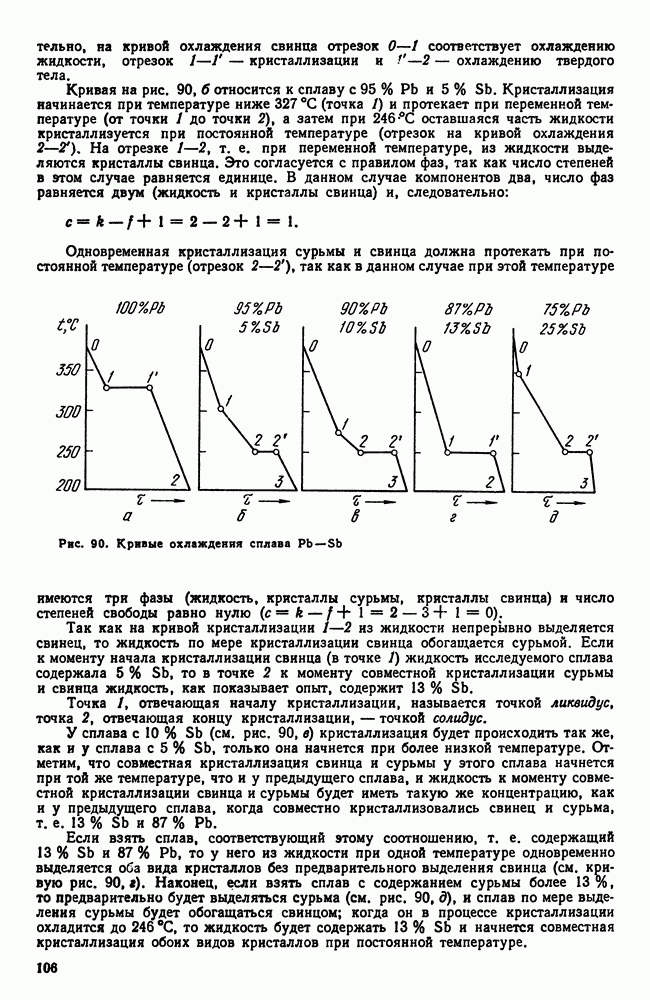
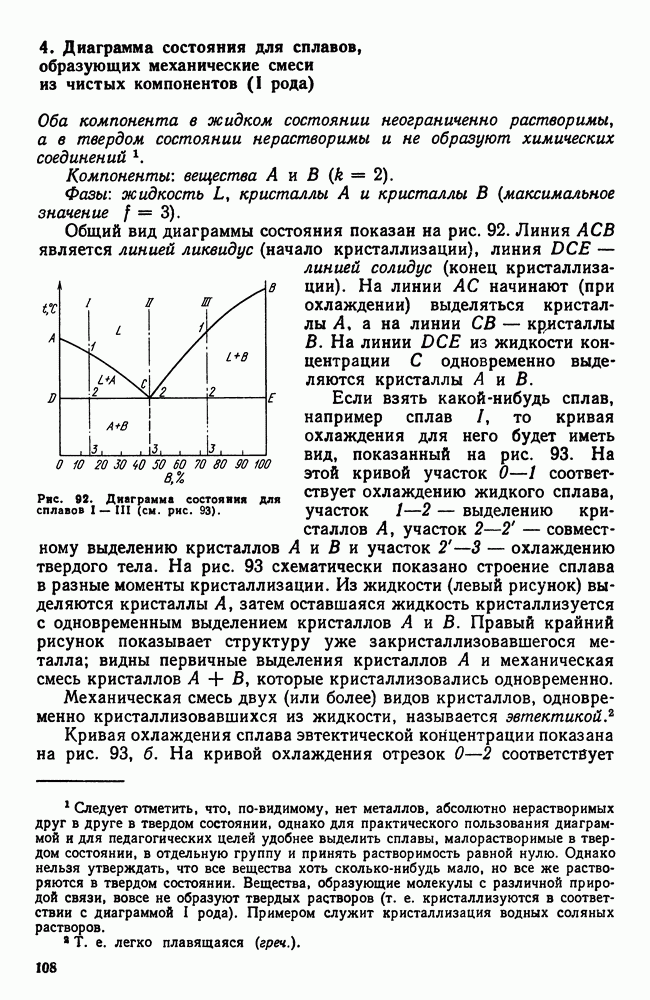
- 4. Диаграмма состояния для сплавов, образующих механические смеси из чистых компонентов (I рода)
- 5. Правило отрезков
- 6. Диаграмма состояния для сплавов с неограниченной растворимостью в твердом состоянии (II рода)
- 7. Диаграмма состояния для сплавов с ограниченной растворимостью в твердом состоянии (III рода)
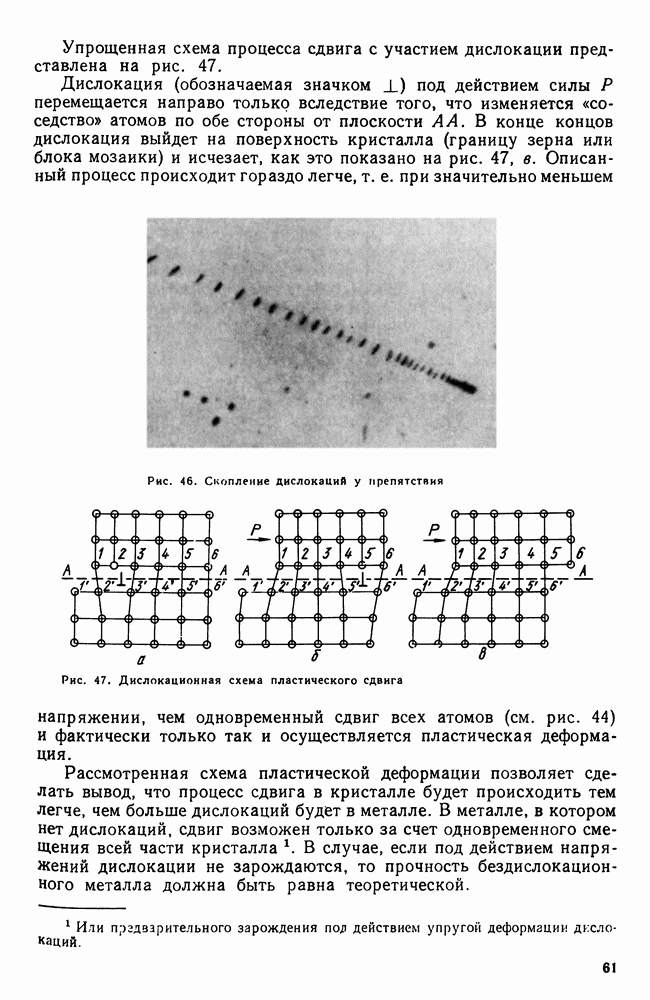
- 8. Диаграмма состояния для сплавов, образующих химические соединения (IV рода)
- 9. Диаграмма состояния для сплавов, испытывающих полиморфные превращения
- 10. Кристаллизация сплавов в неравновесных условиях
- 11. Системы с тремя компонентами
- 12. Упрощенные методы изучения многокомпонентных систем
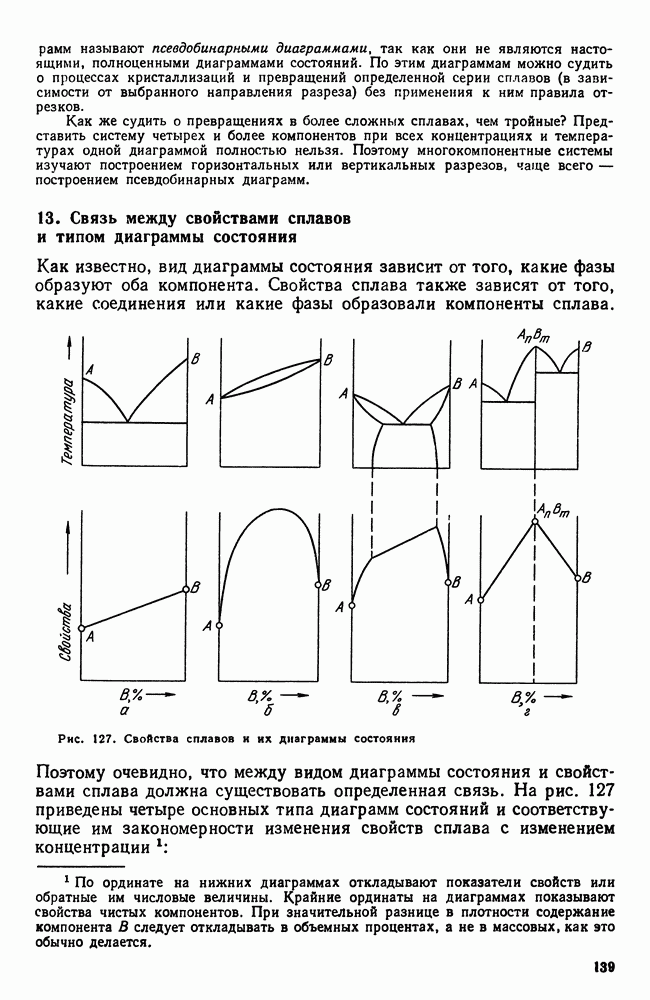
- 13. Связь между свойствами сплавов и типом диаграммы состояния
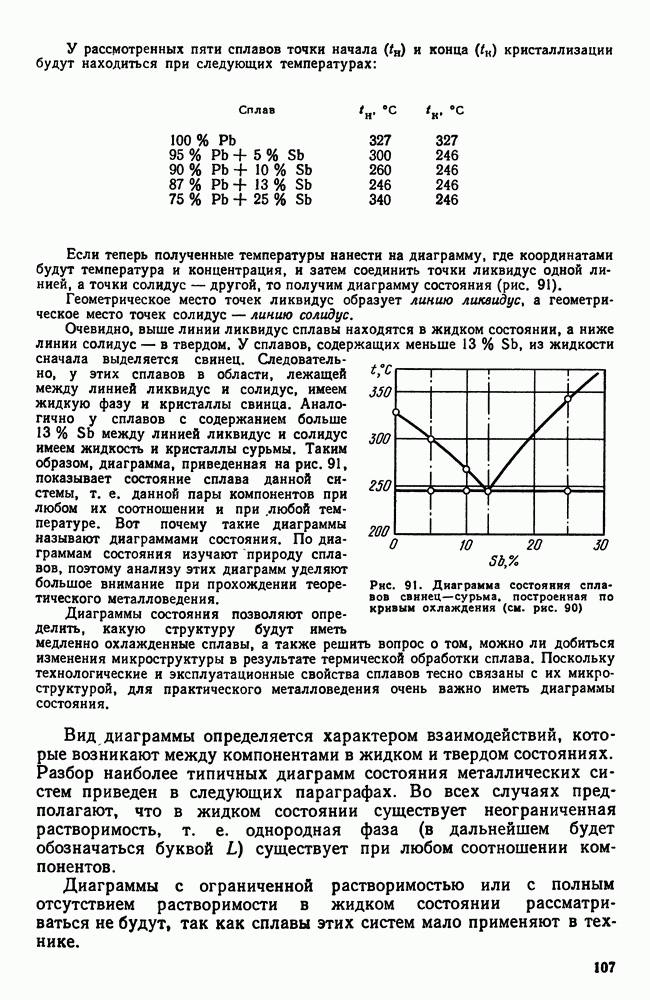
- Часть вторая. ЖЕЛЕЗОУГЛЕРОДИСТЫЕ СПЛАВЫ
- Глава VI. ДИАГРАММА ЖЕЛЕЗО—УГЛЕРОД
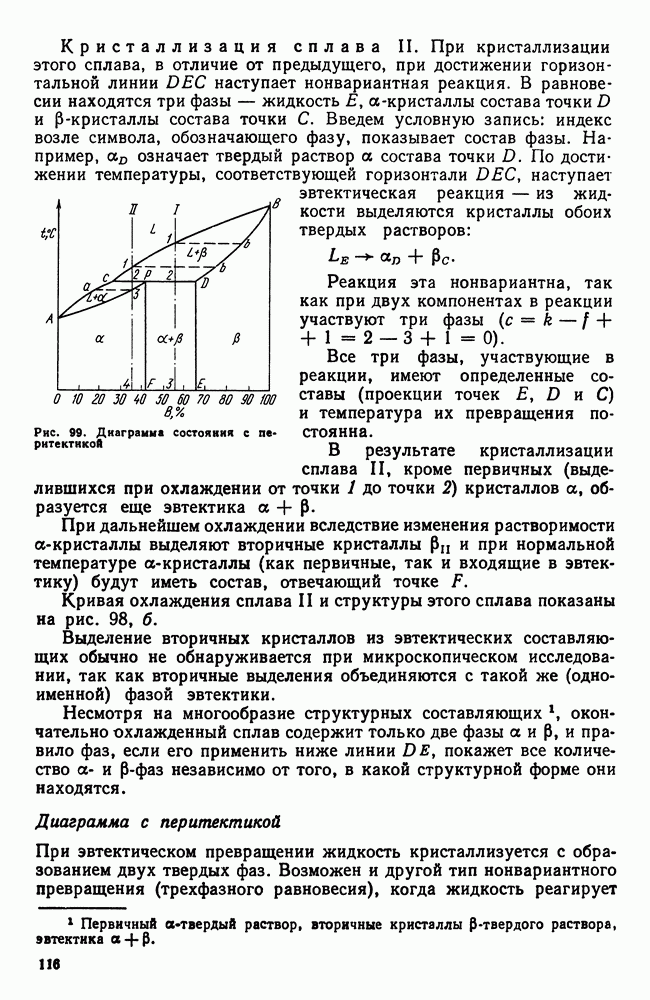
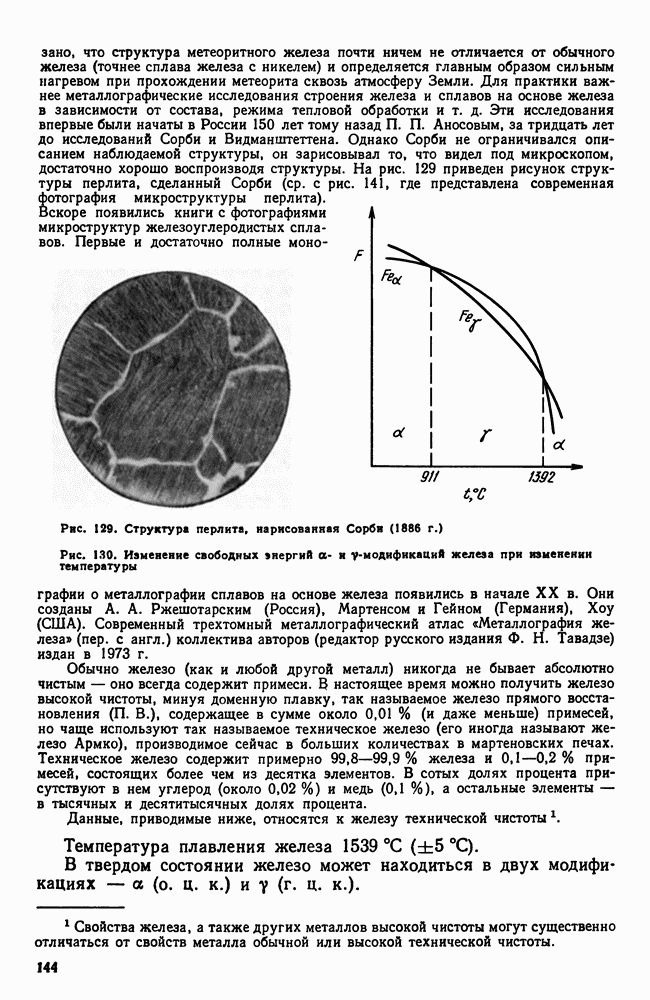
- 2. Железо
- 3. Цементит
- 4. Диаграмма состояния
- Глава VII. УГЛЕРОДИСТЫЕ СТАЛИ
- 1. Влияние углерода на свойства стали
- 2. Влияние постоянных примесей на свойства стали
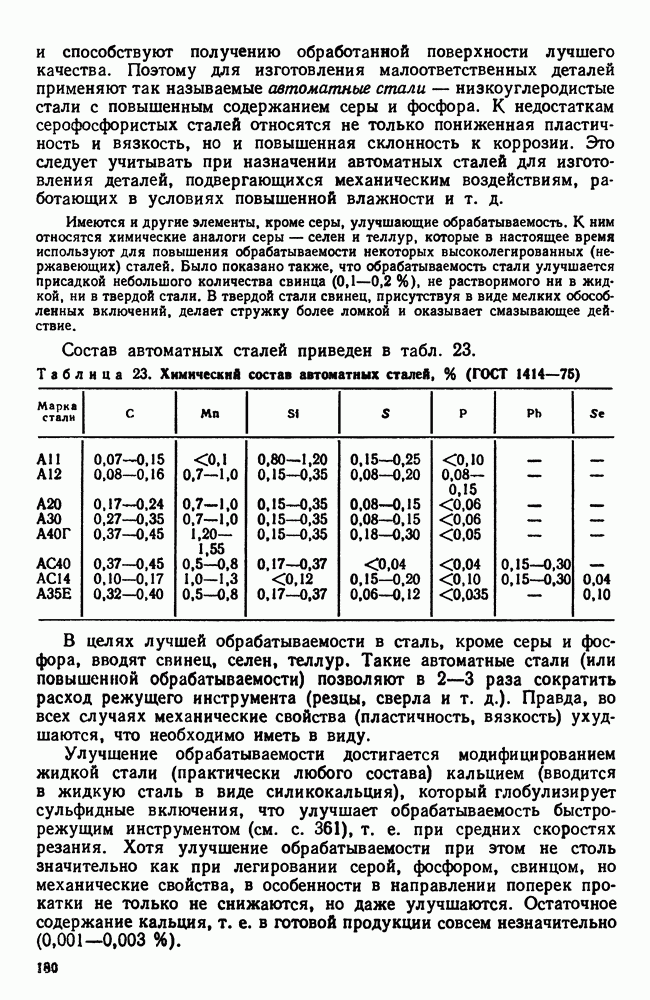
- 3. Сталь различных способов производства. Чистая сталь
- 4. Углеродистая сталь общего назначения
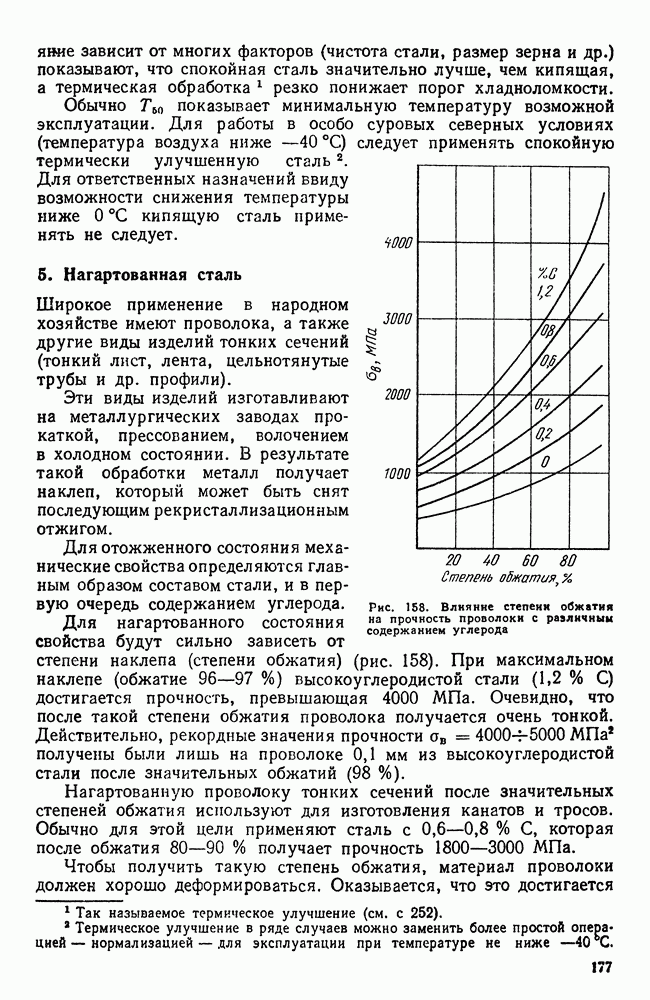
- 5. Нагартованная сталь
- 6. Листовая сталь для холодной штамповки
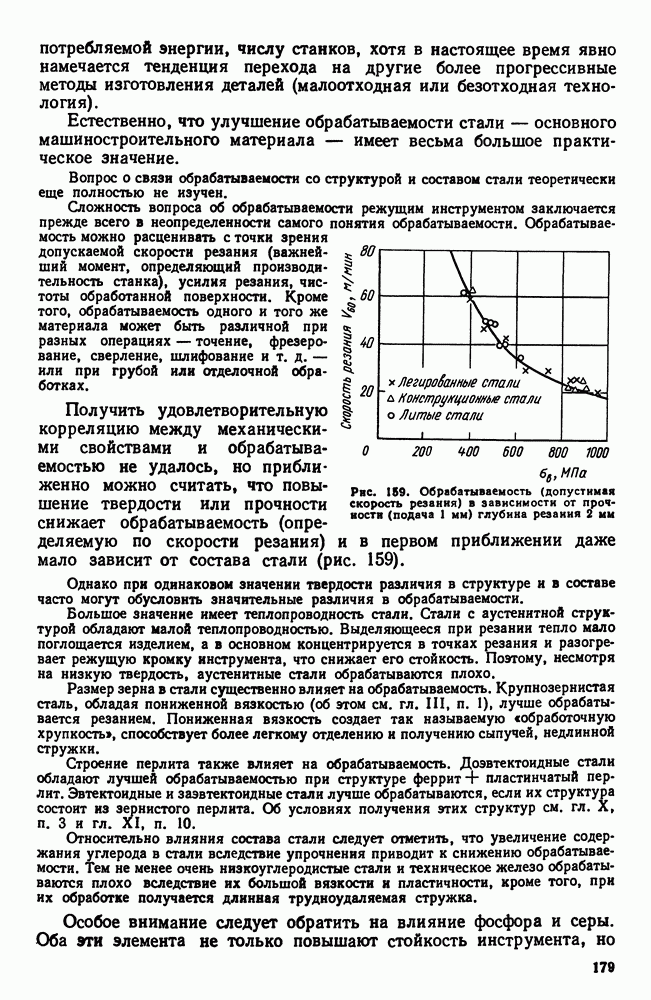
- 7. Обрабатываемость резанием. Автоматные стали
- Глава VIII. ЧУГУН
- 2. Структура чугуна. Формы графита
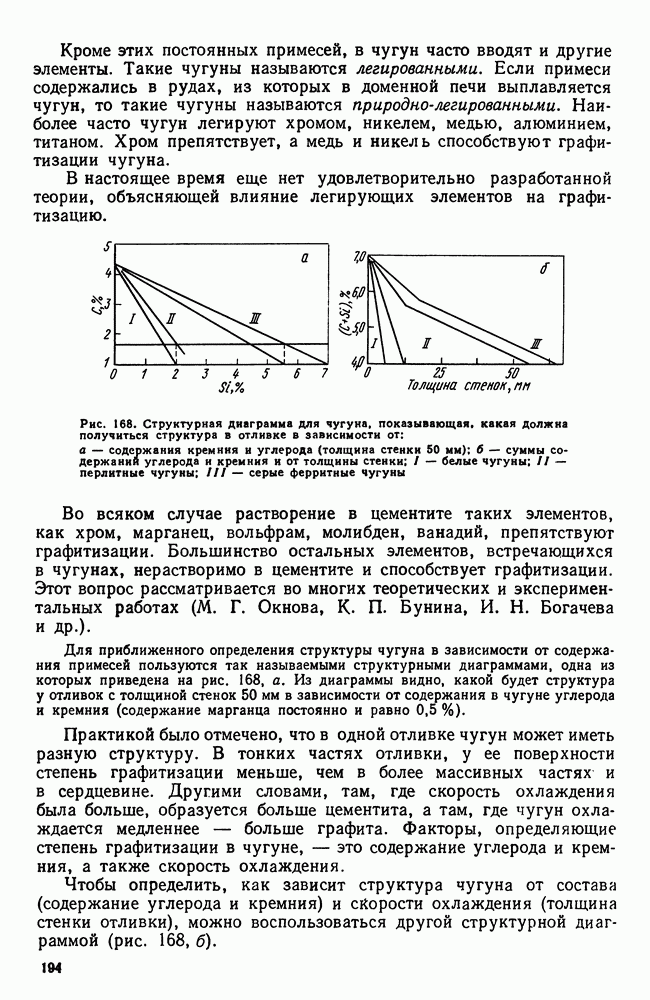
- 3. Структура и свойства чугуна
- 4. Примеси в чугуне
- 5. Марки серых и высокопрочных чугунов
- 6. Ковкий чугун
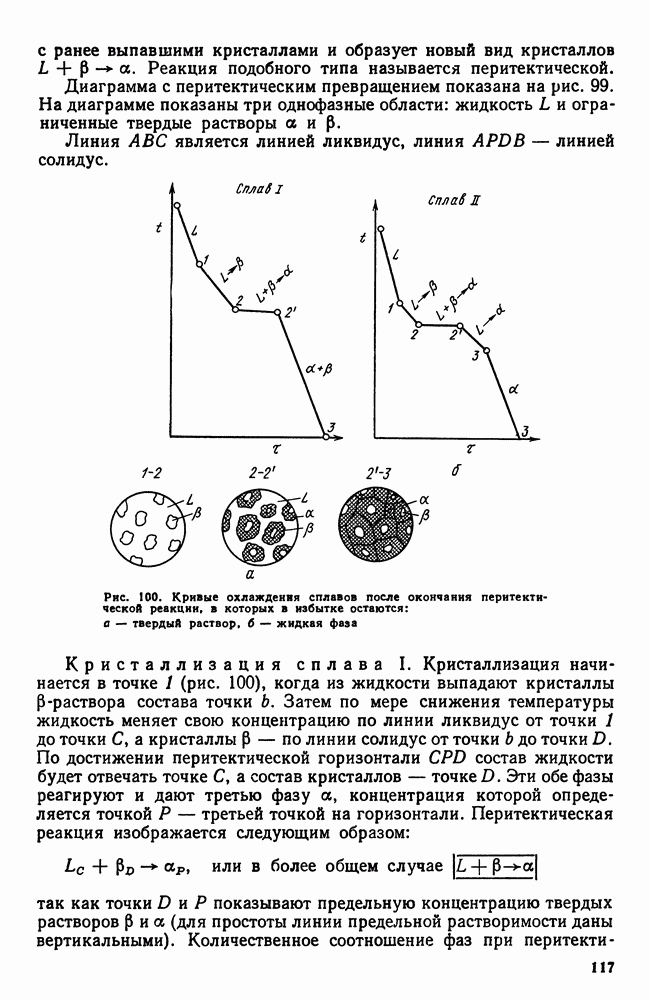
- Часть третья. ТЕРМИЧЕСКАЯ ОБРАБОТКА
- Глава IX. ОБЩИЕ ПОЛОЖЕНИЯ ТЕРМИЧЕСКОЙ ОБРАБОТКИ
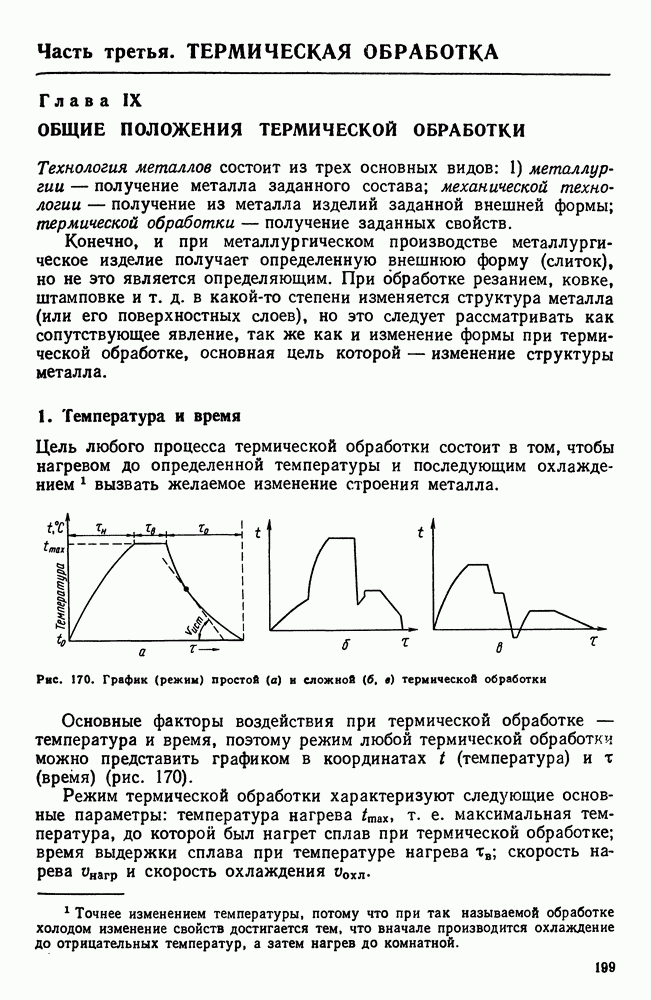
- 2. Классификация видов термической обработки
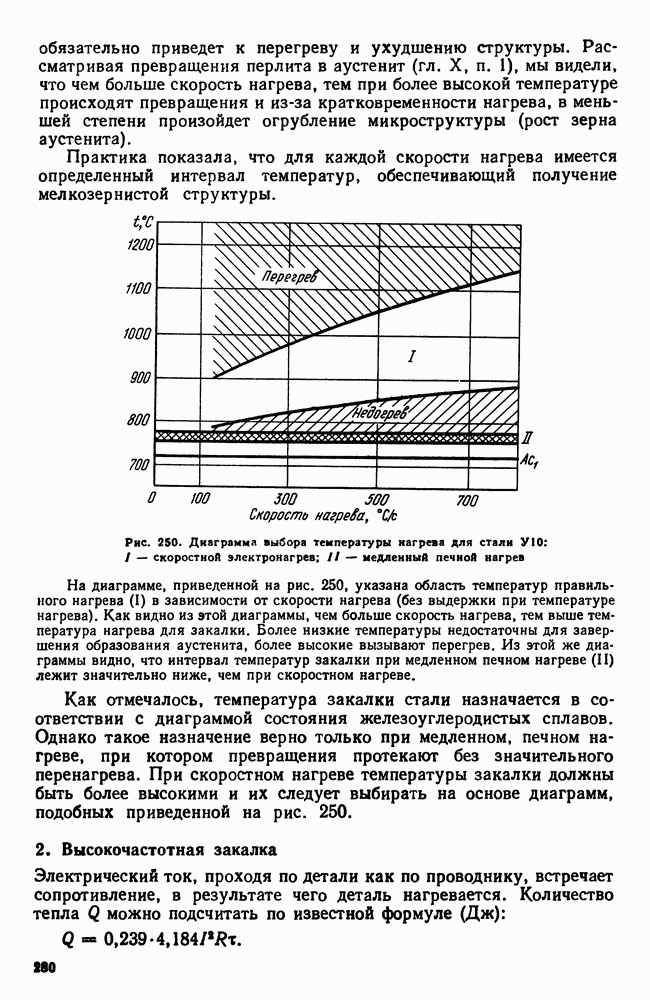
- 3. Термическая обработка и диаграмма состояния
- 4 Основные виды термической обработки стали
- 5. Четыре основных превращения в стали
- Глава X. ТЕОРИЯ ТЕРМИЧЕСКОЙ ОБРАБОТКИ СТАЛИ
- 2. Рост аустенитного зерна
- 3. Распад аустенита
- 4. Мартенситное превращение
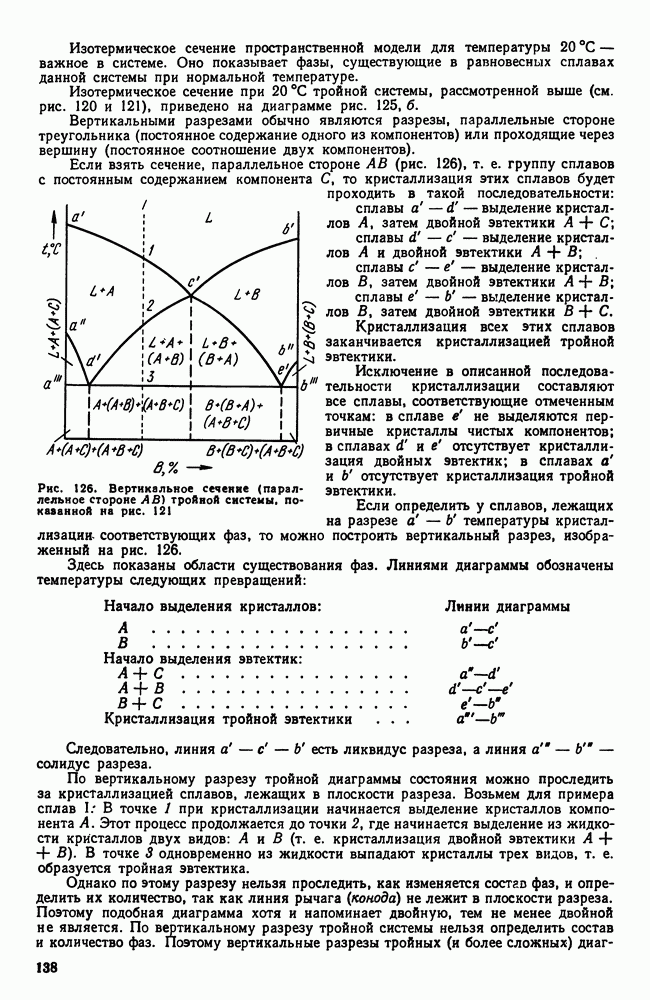
- 5. Бейнитное превращение
- 6. Превращения при отпуске
- 7. Влияние термической обработки на свойства стали
- 8. Термомеханическая обработка
- Глава XI. ПРАКТИКА ТЕРМИЧЕСКОЙ ОБРАБОТКИ СТАЛИ
- 2. Время нагрева
- 3. Химическое воздействие нагревающей среды
- 4. Закалочные среды
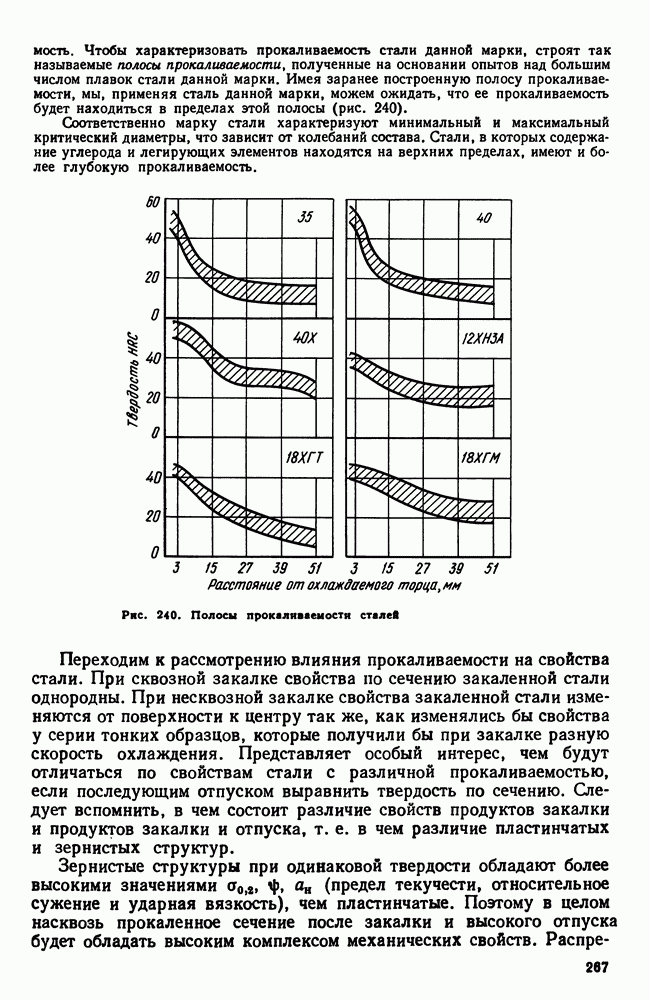
- 5. Прокаливаемость
- 6. Внутренние напряжения
- 7. Способы закалки
- 8. Обработка стали холодом
- 9. Дефекты, возникающие при закалке
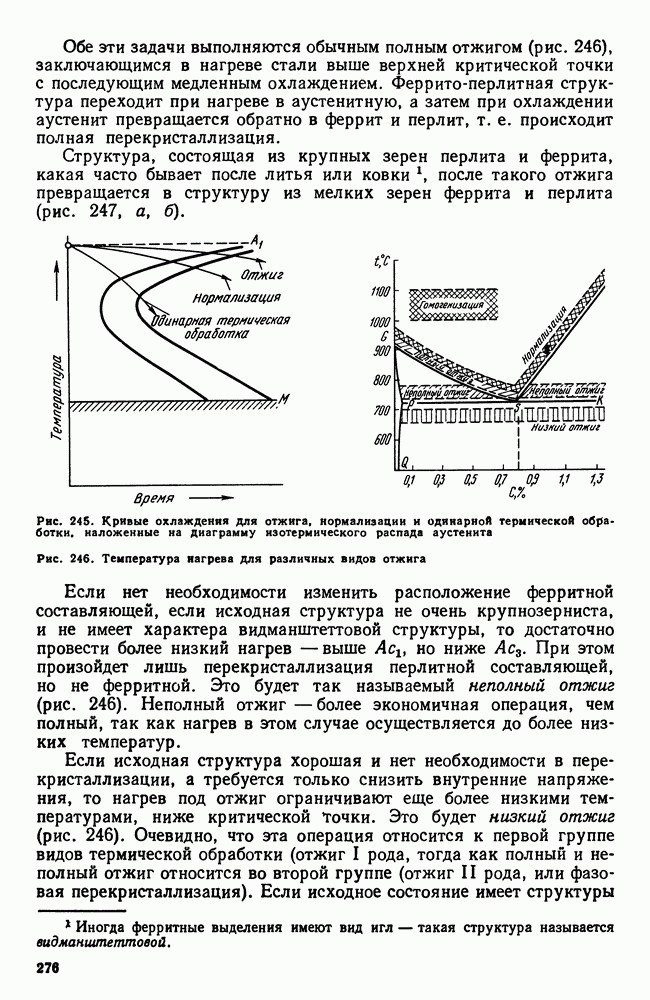
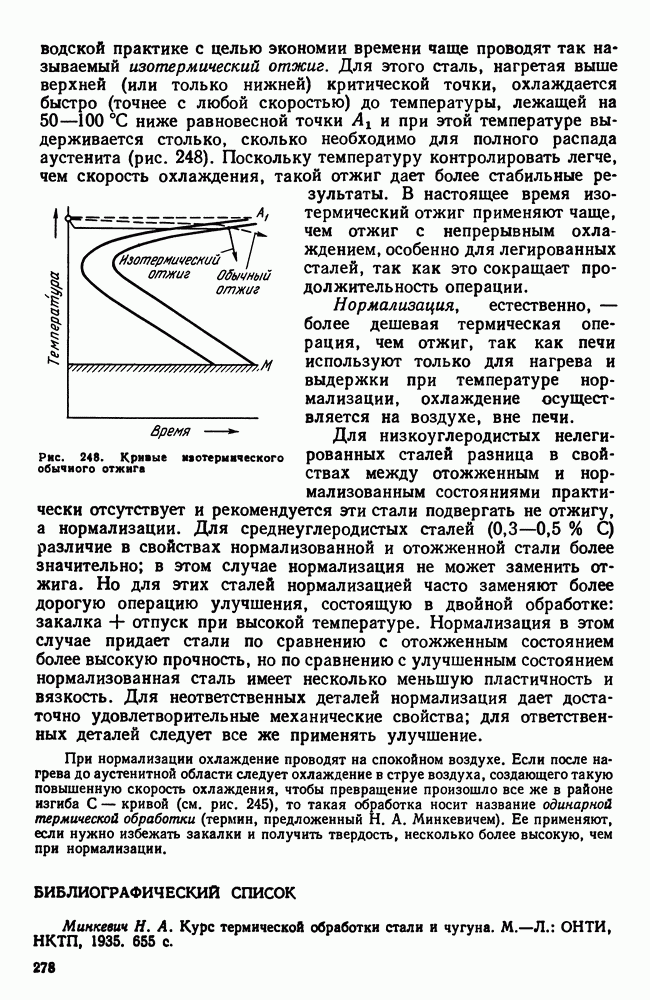
- 10. Отжиг и нормализация
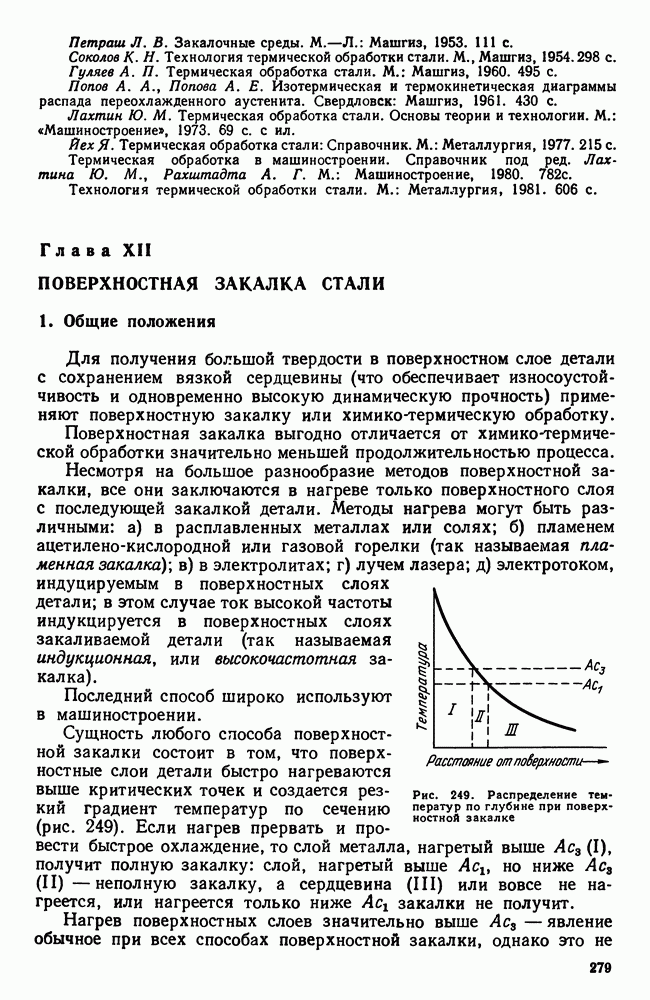
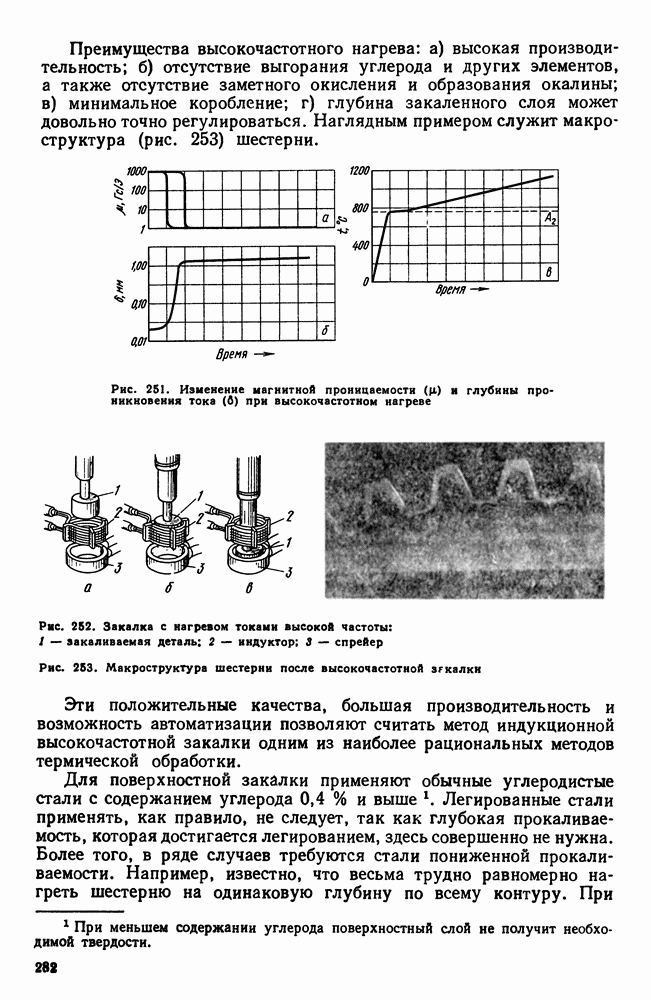
- Глава XII. ПОВЕРХНОСТНАЯ ЗАКАЛКА СТАЛИ
- 2. Высокочастотная закалка
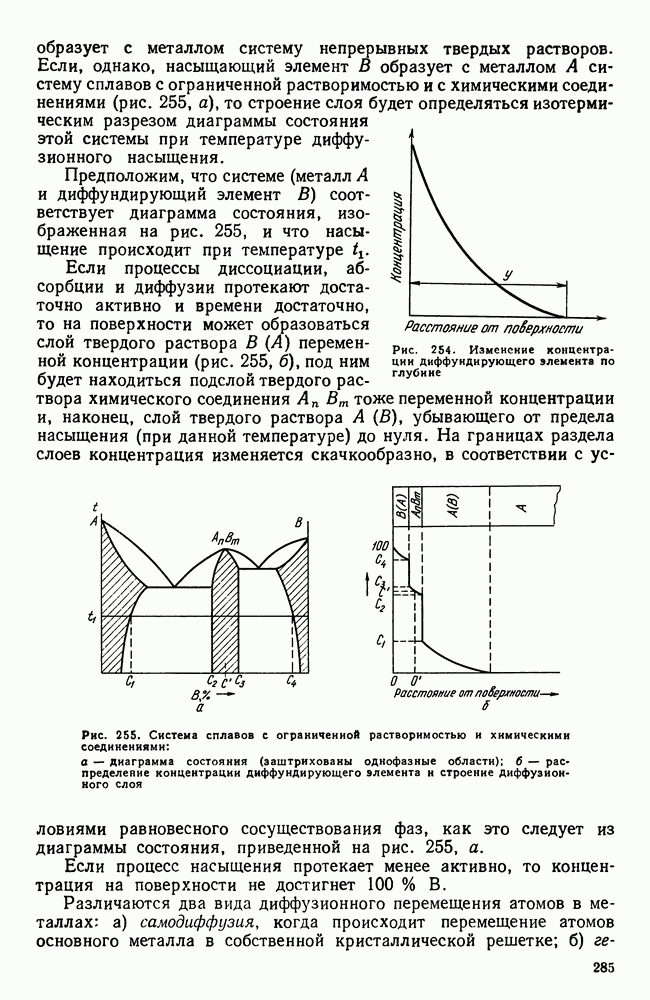
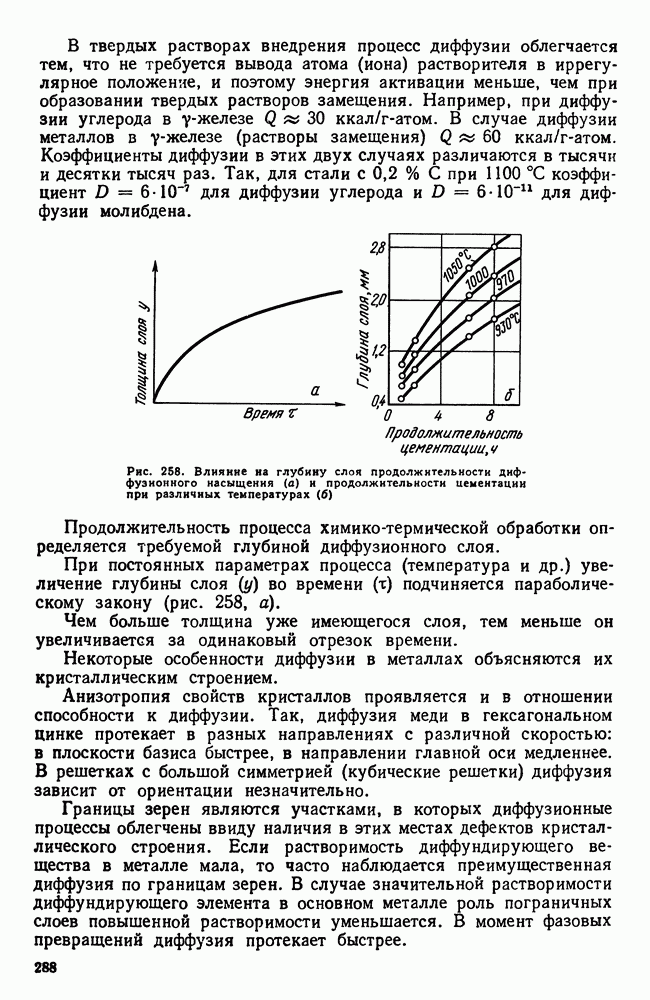
- Глава XIII. ХИМИКО-ТЕРМИЧЕСКАЯ ОБРАБОТКА СТАЛИ
- 2. Цементация стали
- 3. Азотирование стали
- 4. Цианирование стали
- 5. Диффузионная металлизация
- Часть четвертая. ЛЕГИРОВАННЫЕ СТАЛИ И СПЛАВЫ
- Глава XIV. ВЛИЯНИЕ ЛЕГИРУЮЩИХ ЭЛЕМЕНТОВ
- 2. Влияние элементов на полиморфизм железа
- 3. Распределение легирующих элементов в стали
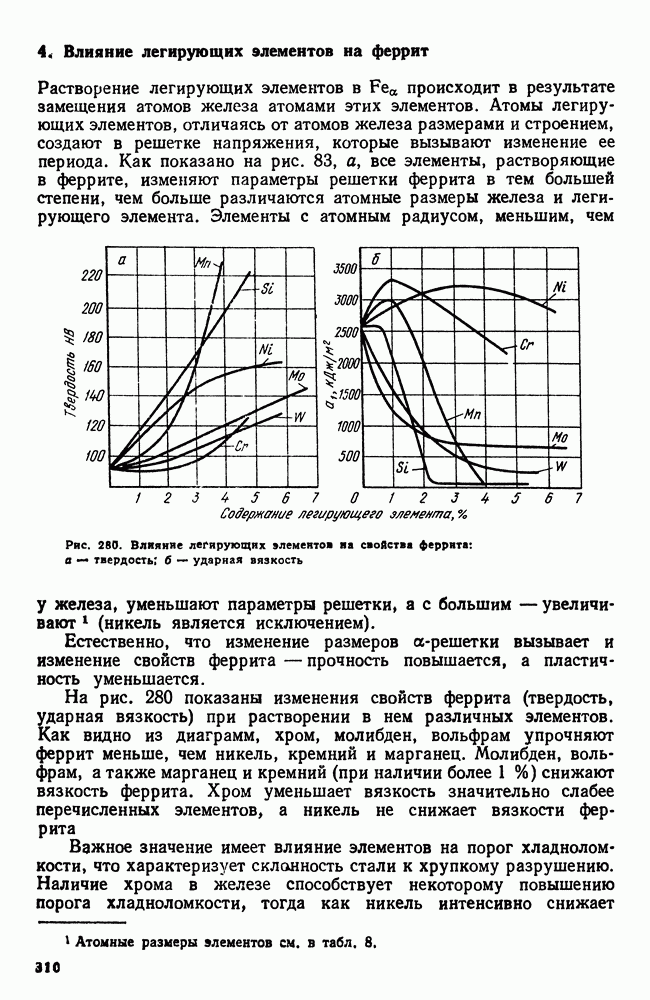
- 4. Влияние легирующих элементов на феррит
- 5. Карбидная фаза в легированных сталях
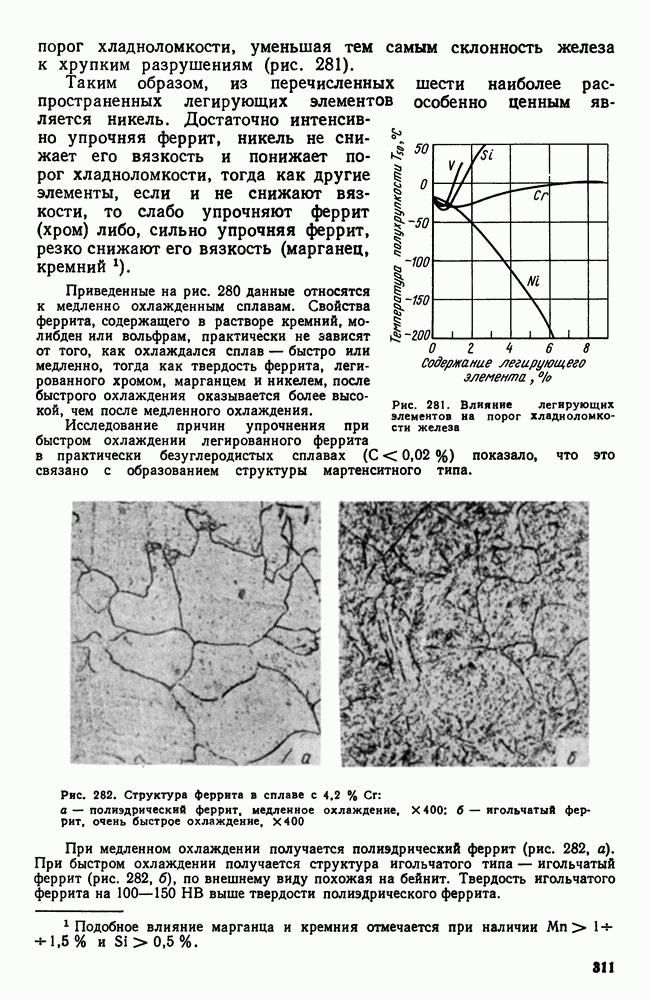
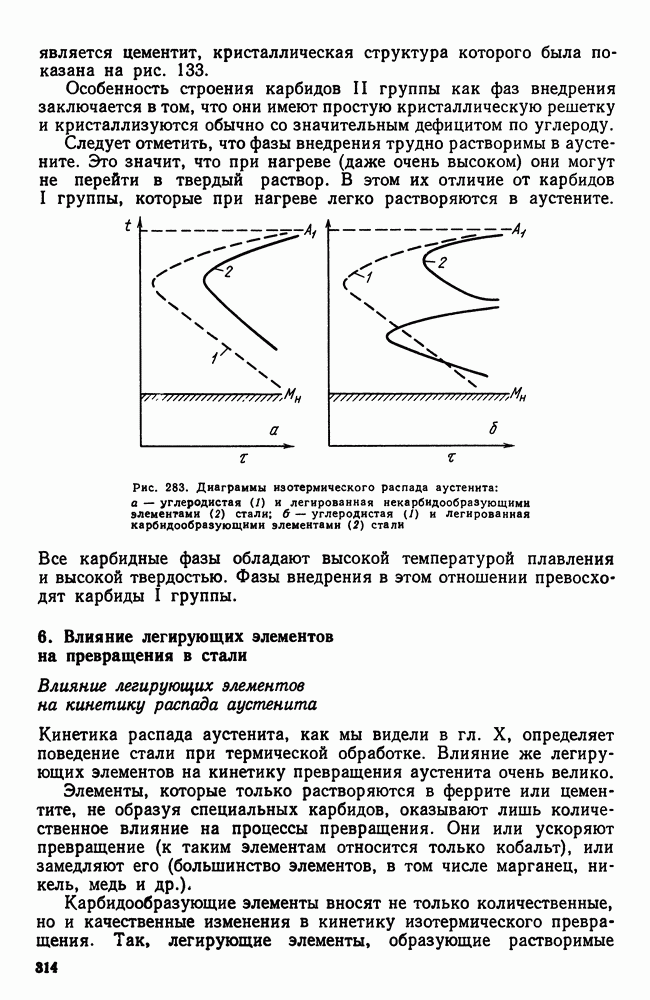
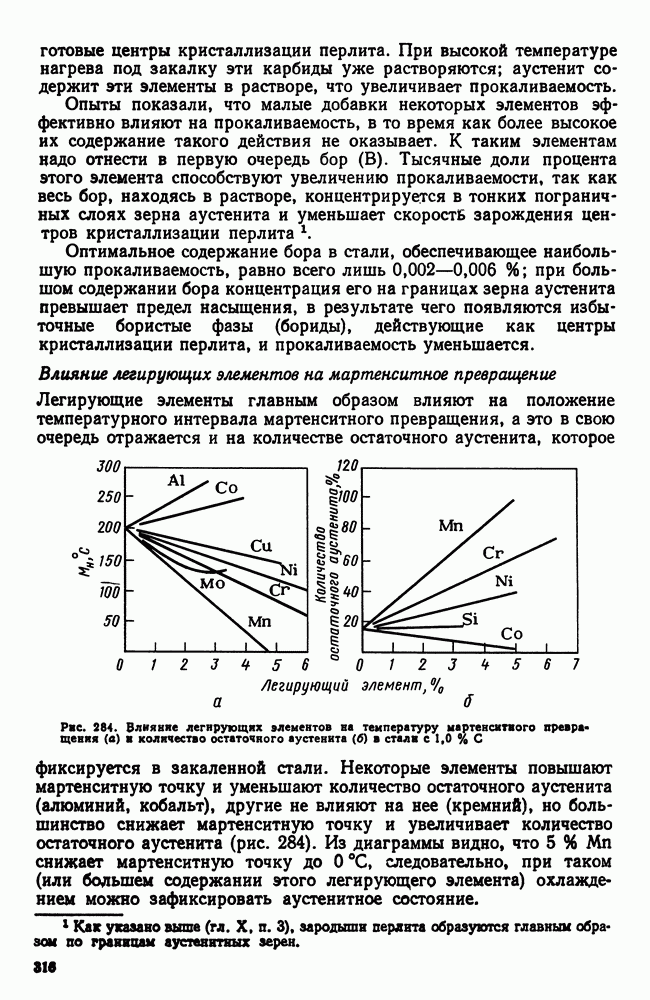
- 6. Влияние легирующих элементов на превращения в стали
- Глава XV. КЛАССИФИКАЦИЯ И МАРКИРОВКА ЛЕГИРОВАННЫХ СТАЛЕЙ
- 2. Маркировка легированных сталей
- Глава XVI. КОНСТРУКЦИОННЫЕ СТАЛИ
- 1. Механические свойства стали, влияние структуры и легирующих элементов
- 2. Термическая обработка конструкционных сталей
- 3. Цементуемые (низкоуглеродистые) стали
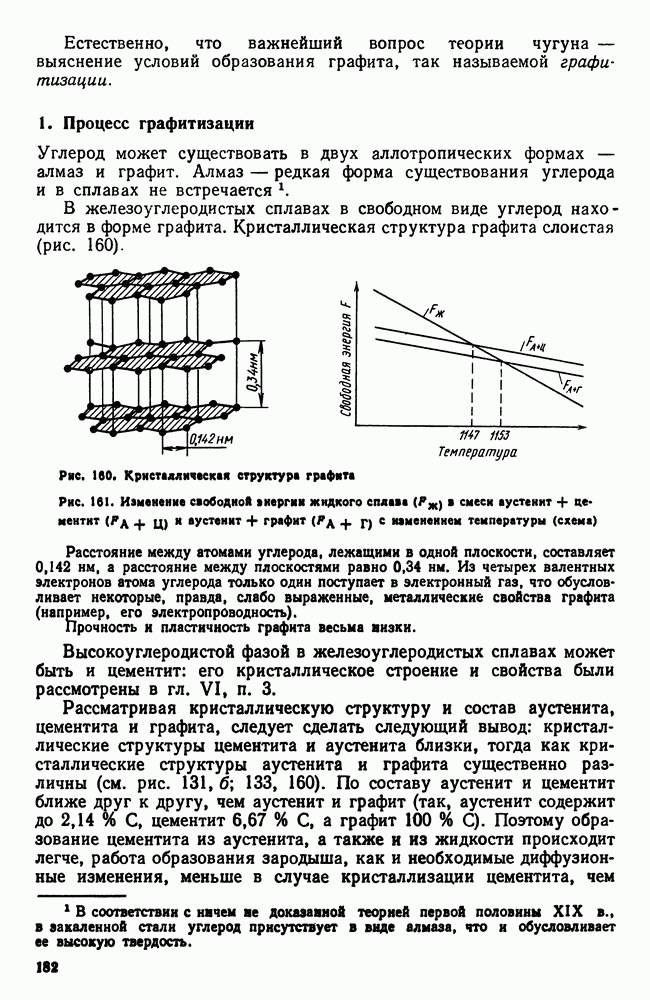
- 4. Улучшаемые (среднеуглеродистые) стали
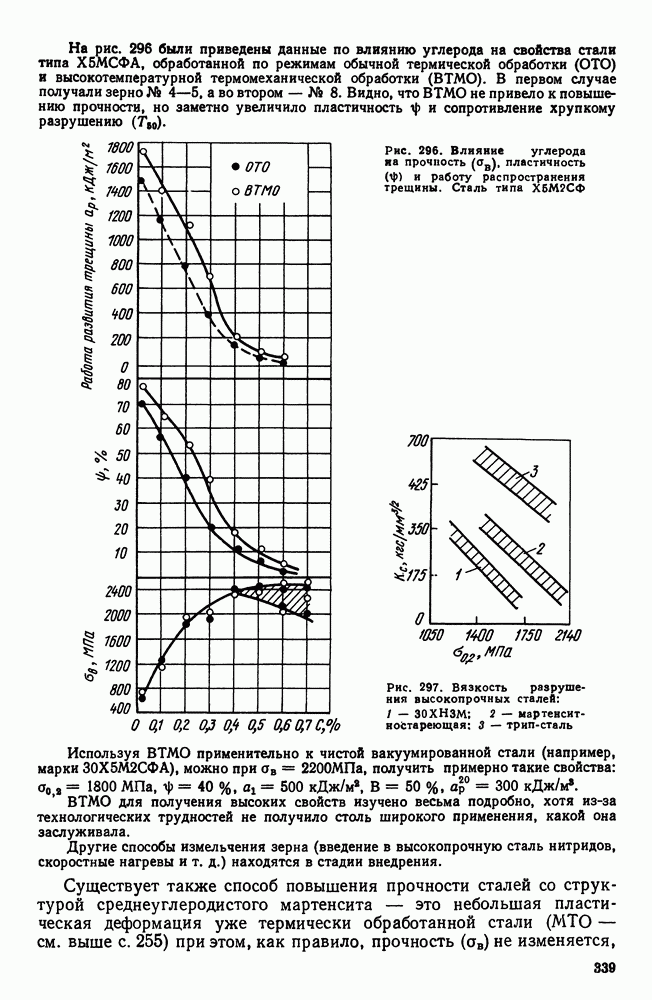
- 5. Высокопрочные стали
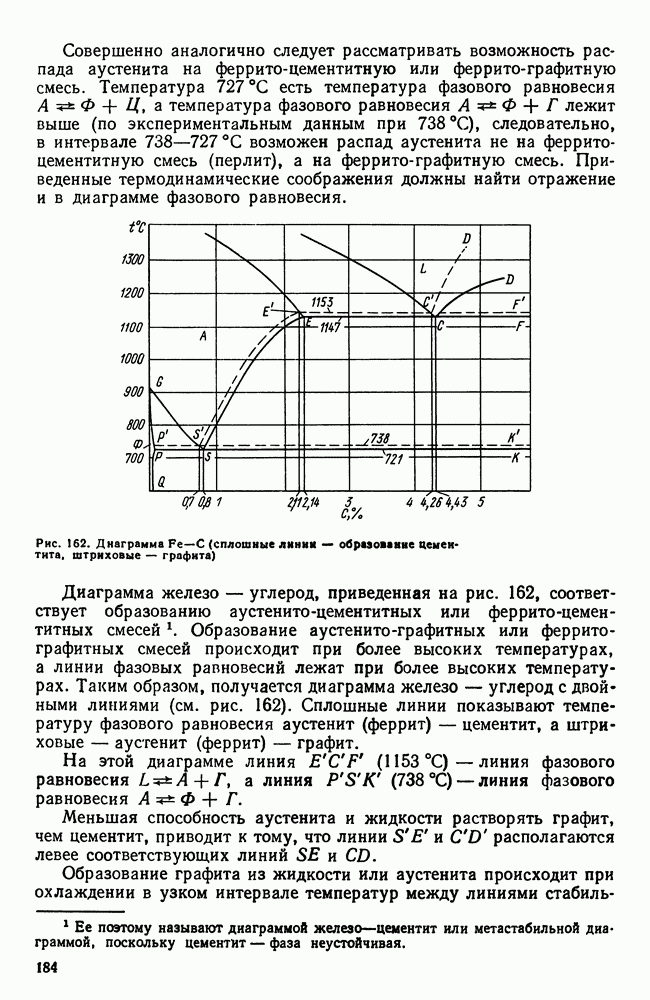
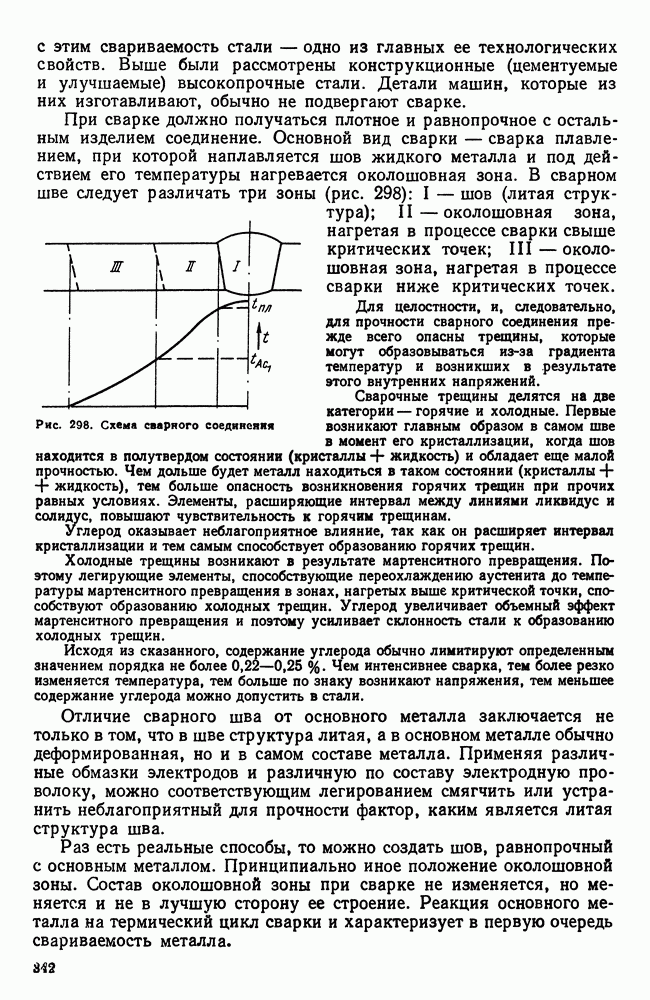
- 6. Свариваемость стали
- 7. Строительная сталь
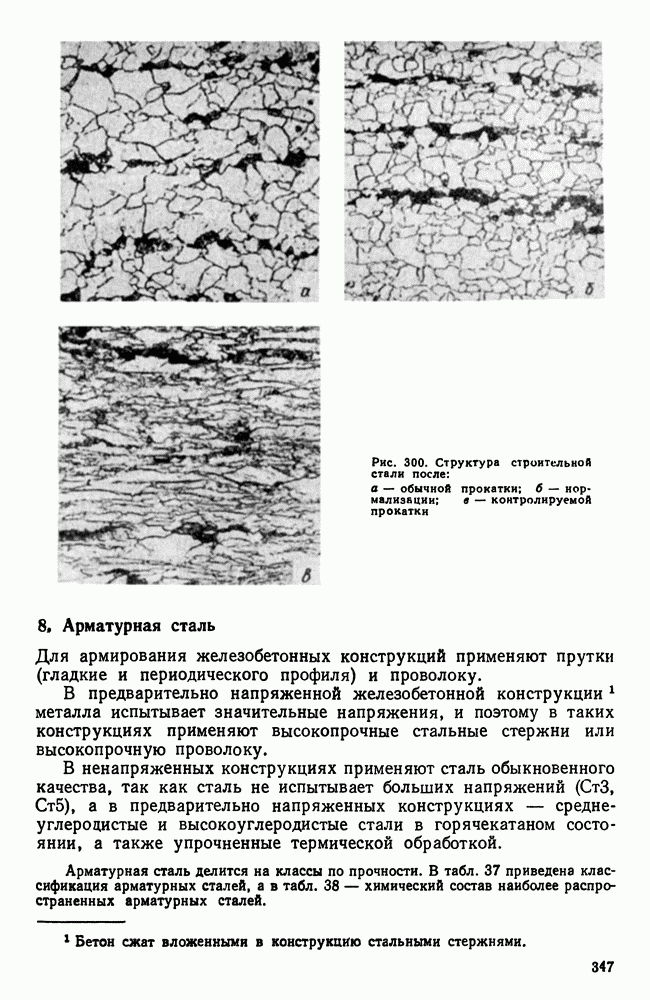
- 8. Арматурная сталь
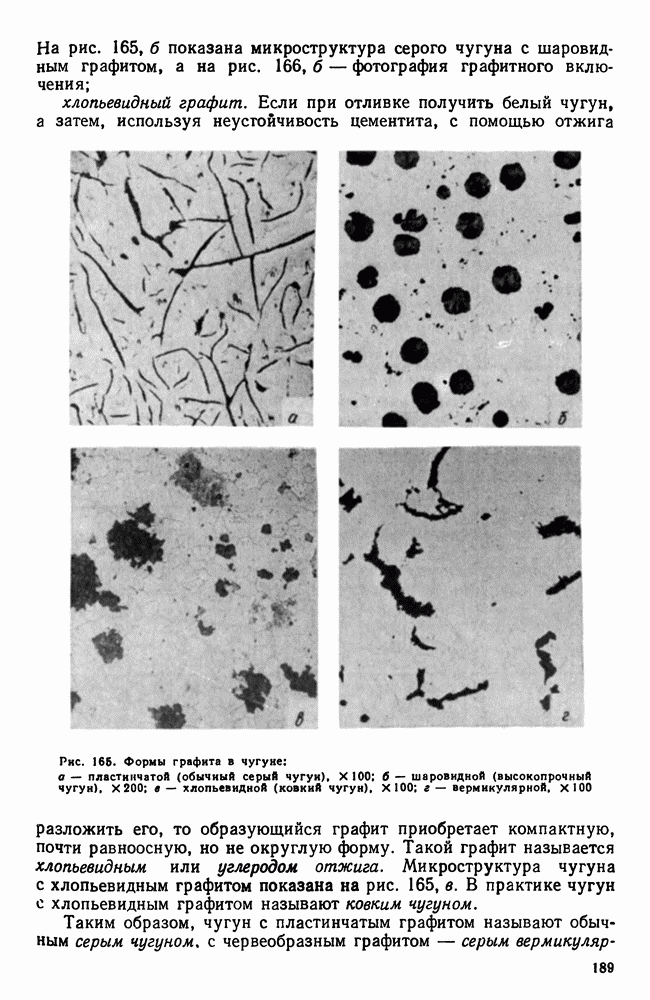
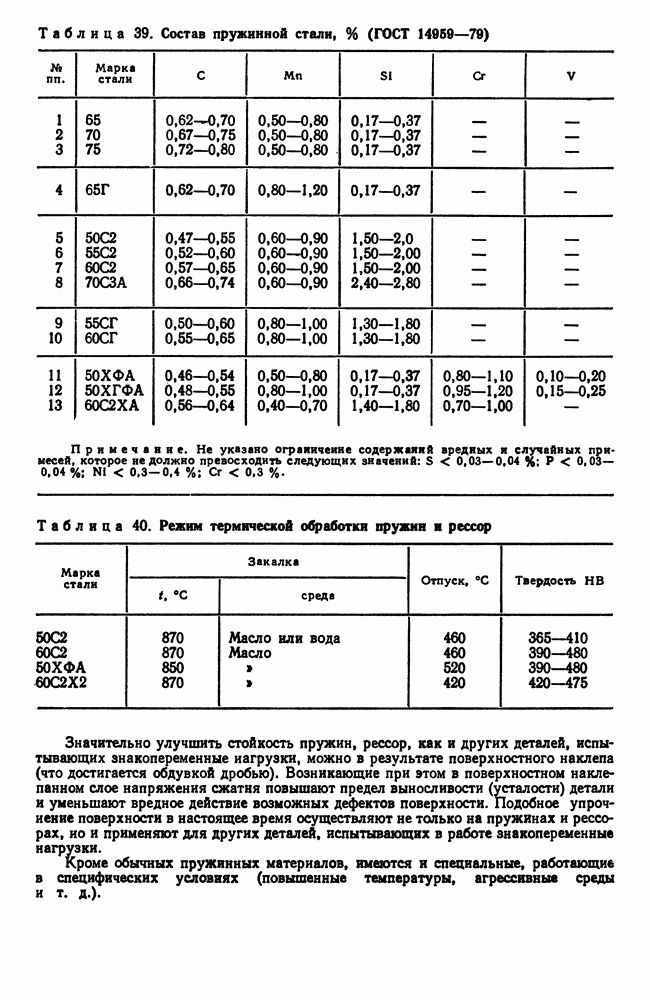
- 9. Пружинная сталь
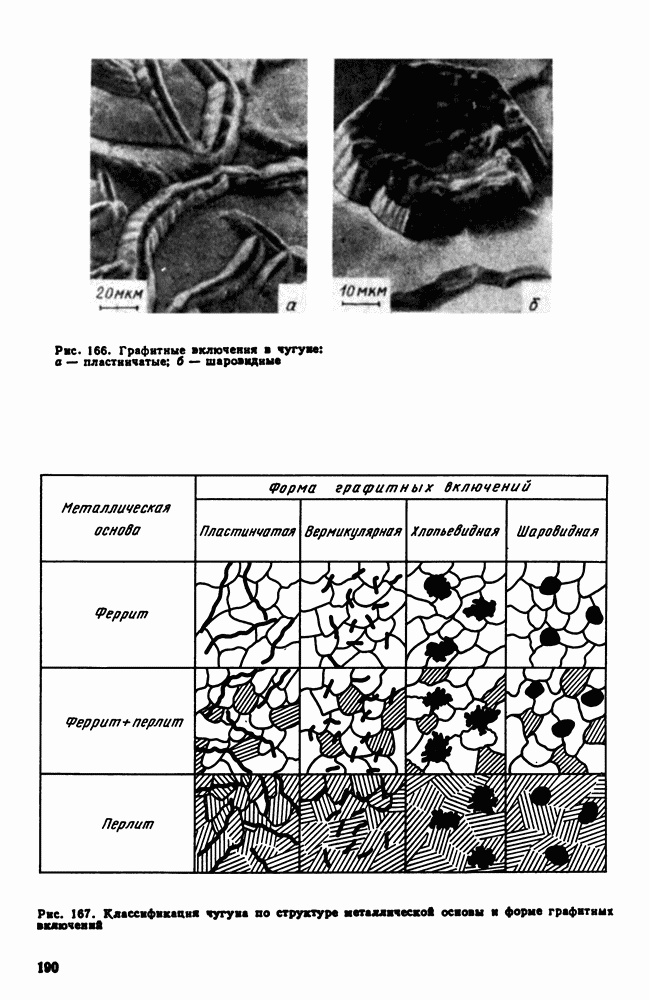
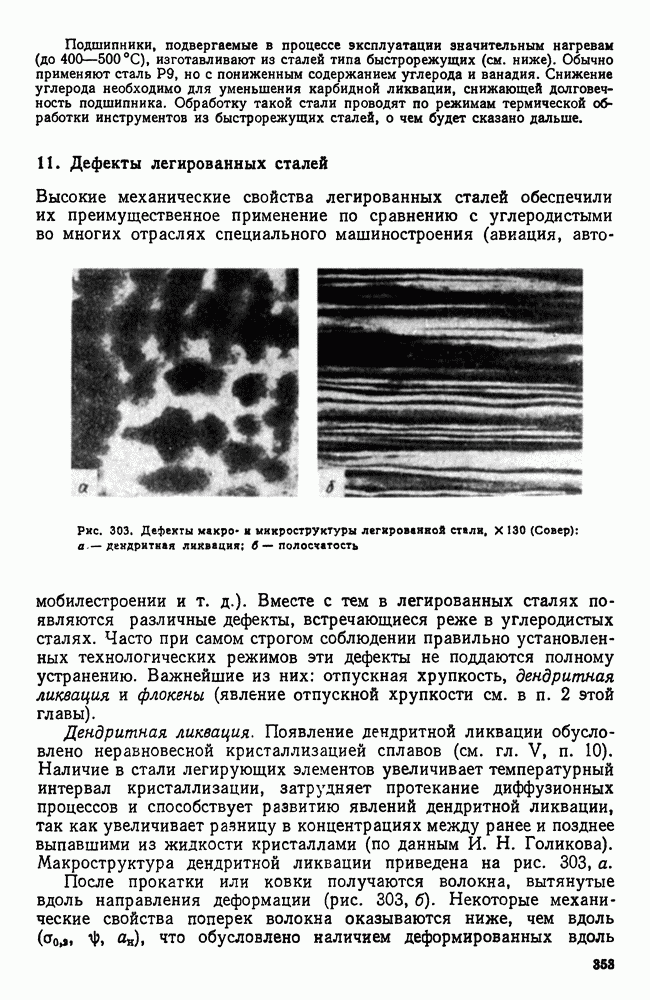
- 10. Шарикоподшипниковая сталь
- 11. Дефекты легированных сталей
- Глава XVII. ИНСТРУМЕНТАЛЬНЫЕ СТАЛИ
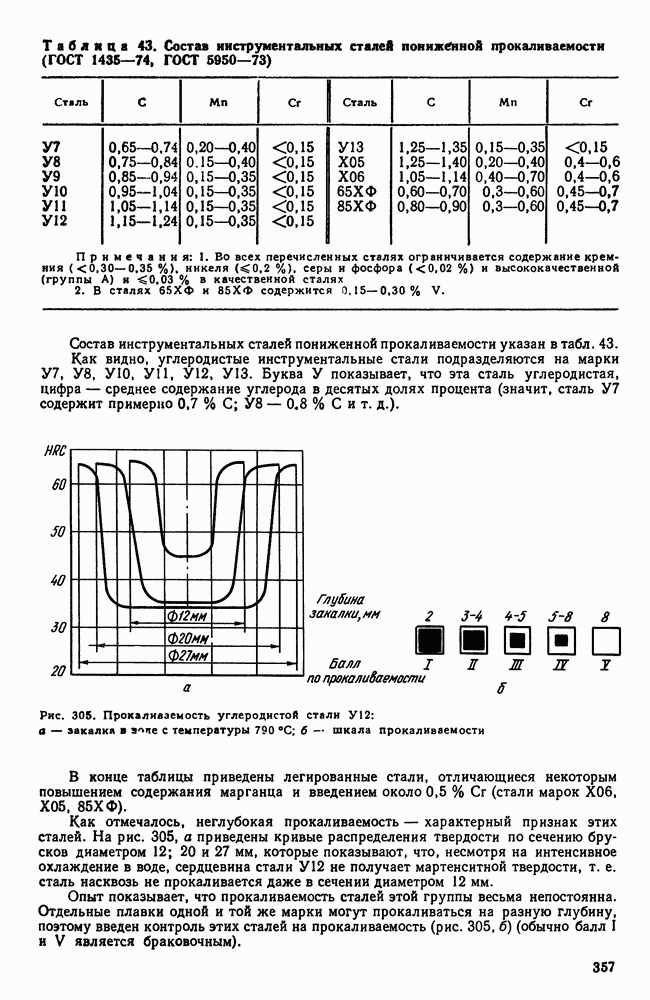
- 2. Инструментальные стали пониженной прокаливаемости
- 3. Инструментальные стали повышенной прокаливаемости (легированные инструментальные стали)
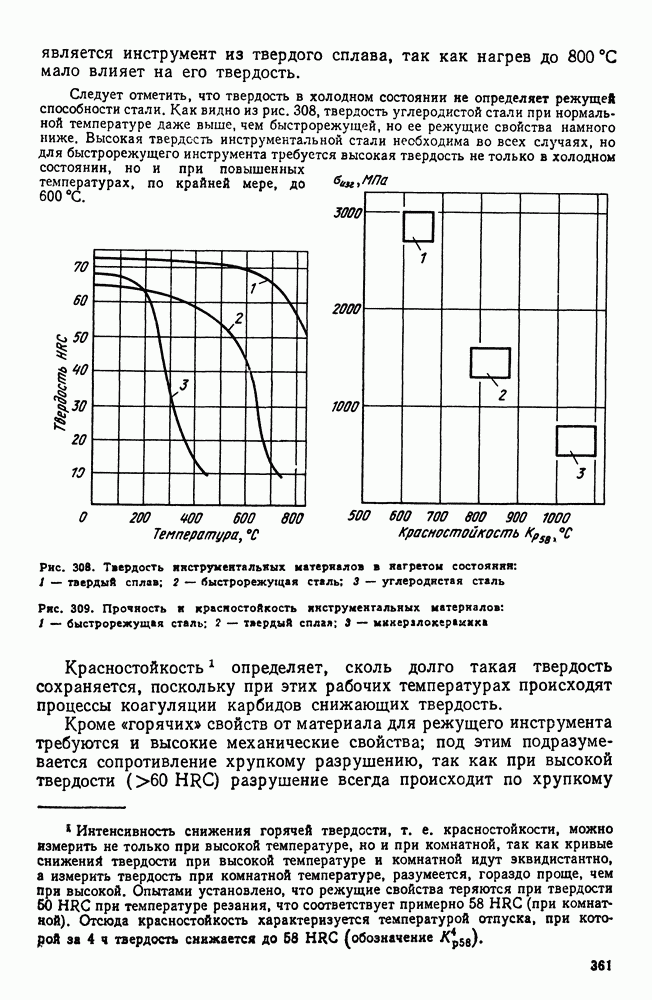
- 4. Быстрорежущие стали
- 5. Штамповые стали
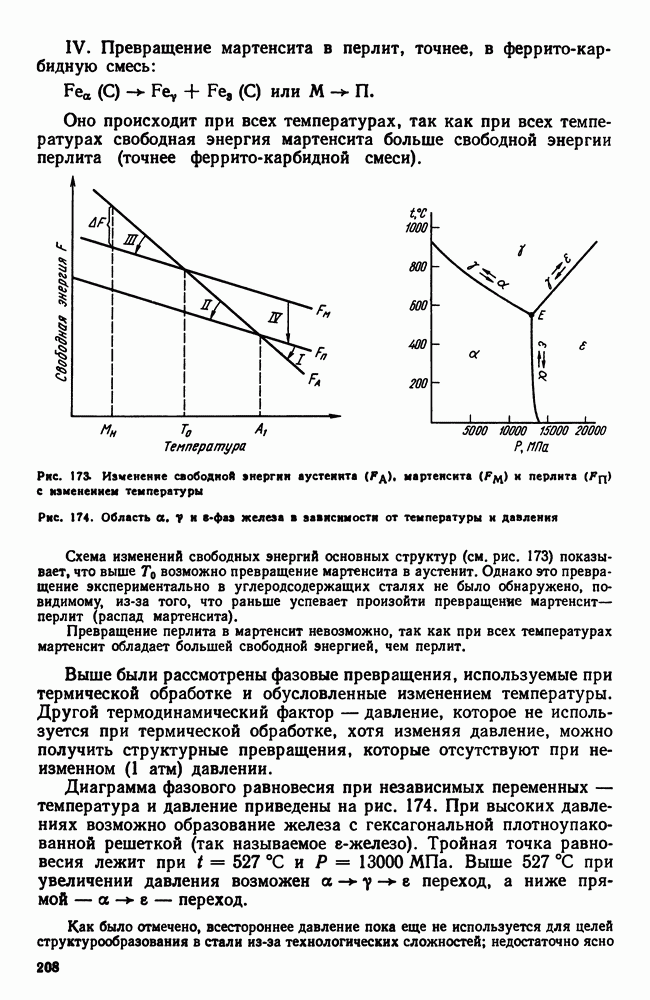
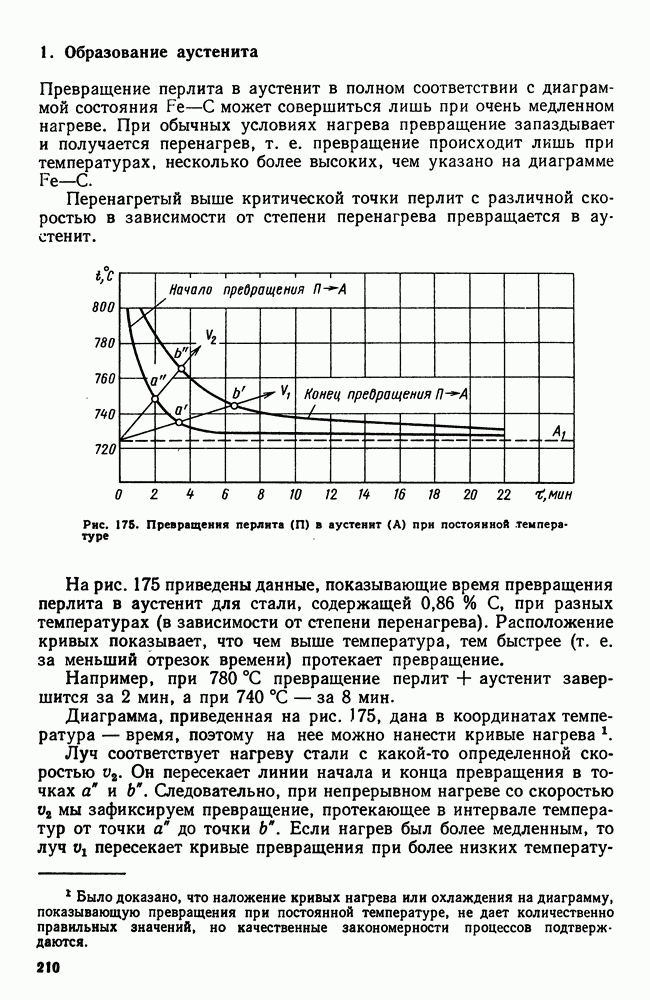
- 6. Твердые сплавы
- Глава XVIII. ЖАРОСТОЙКИЕ И ЖАРОПРОЧНЫЕ СТАЛИ И СПЛАВЫ
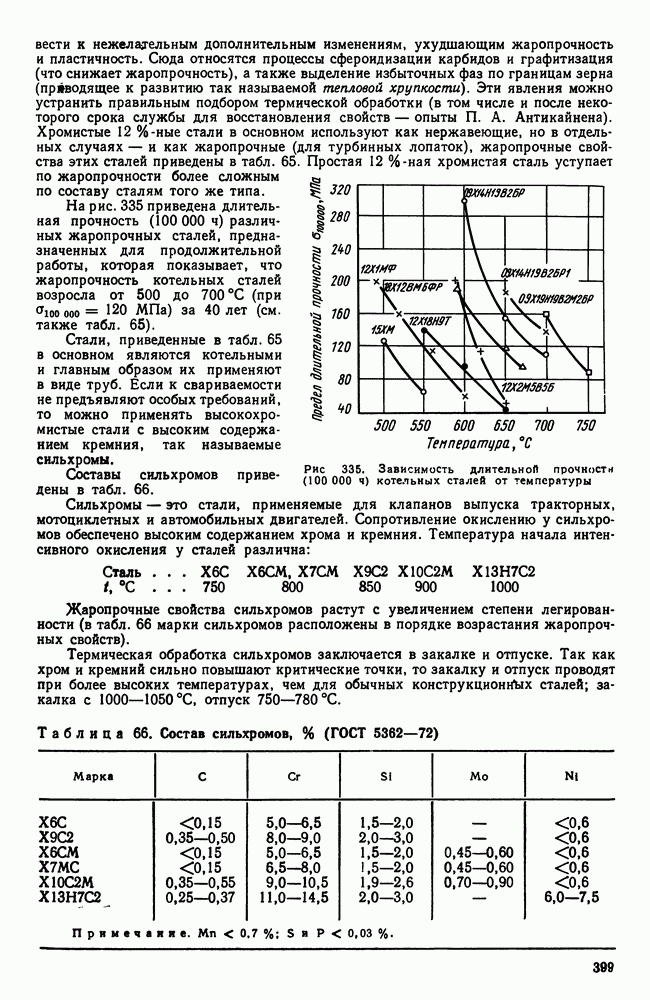
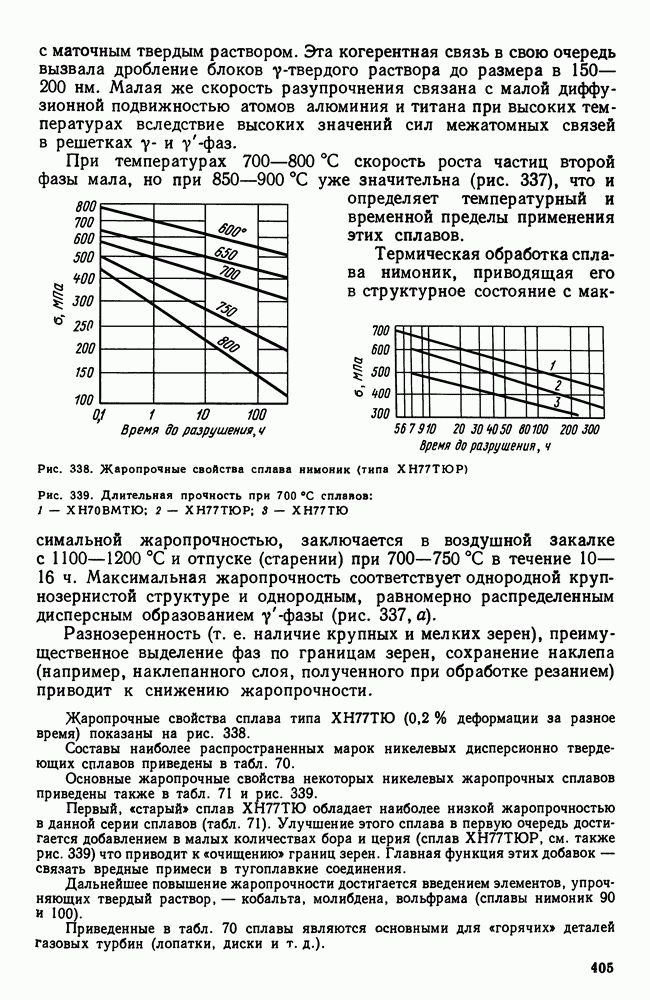
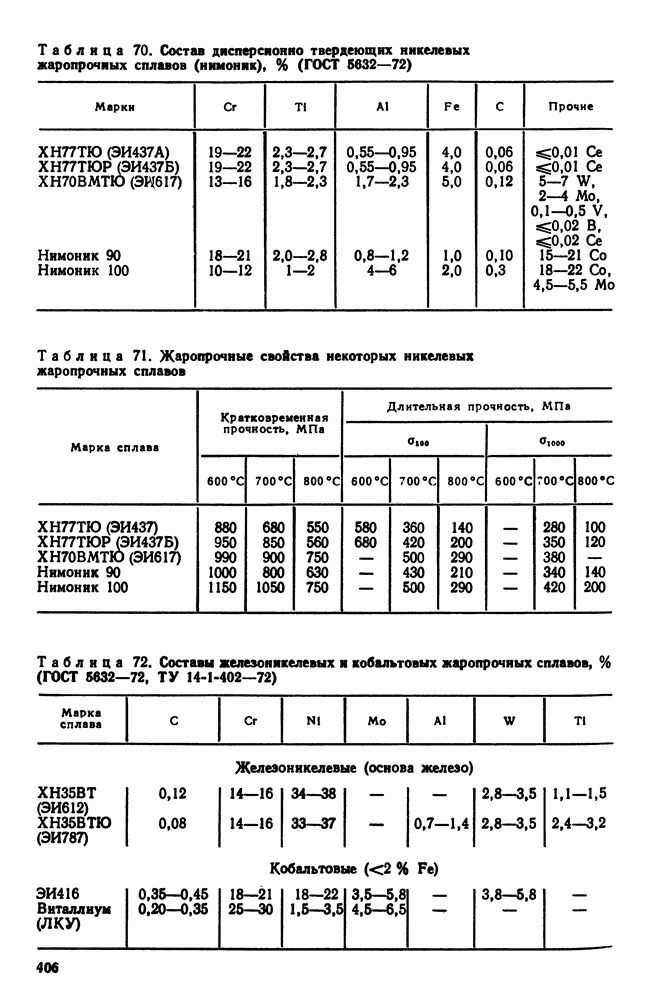
- 2. Жаропрочность
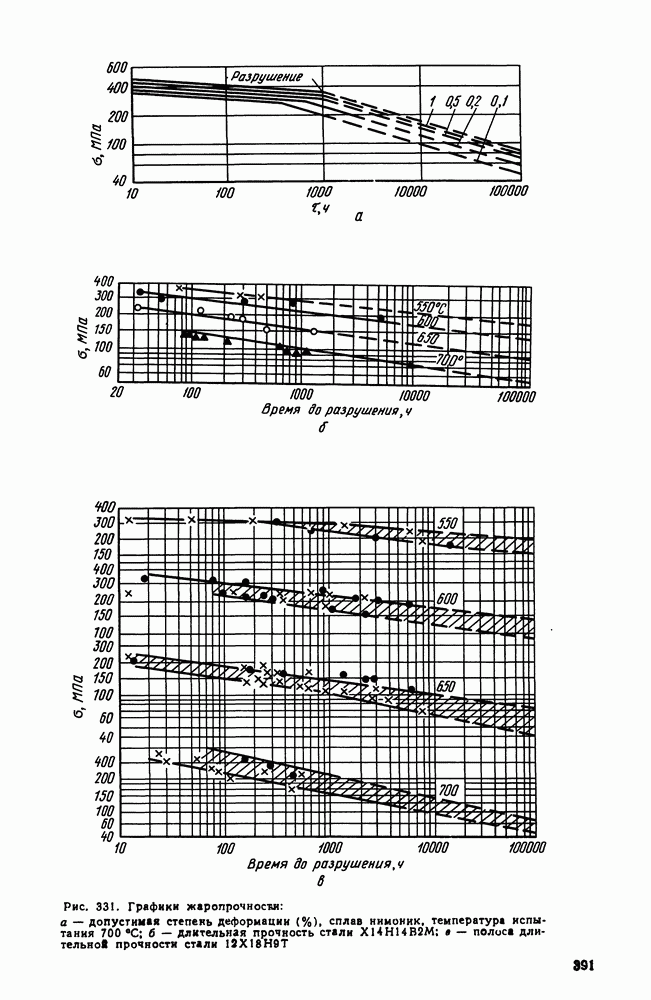
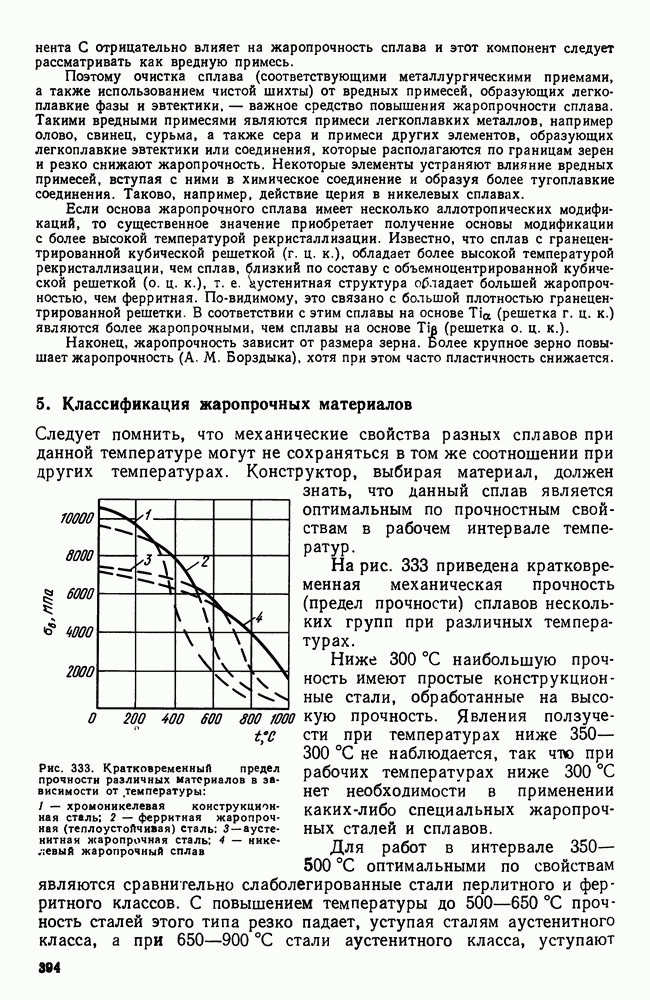
- 3. Оценка жаропрочных свойств
- 4. Влияние структуры и состава на жаропрочность
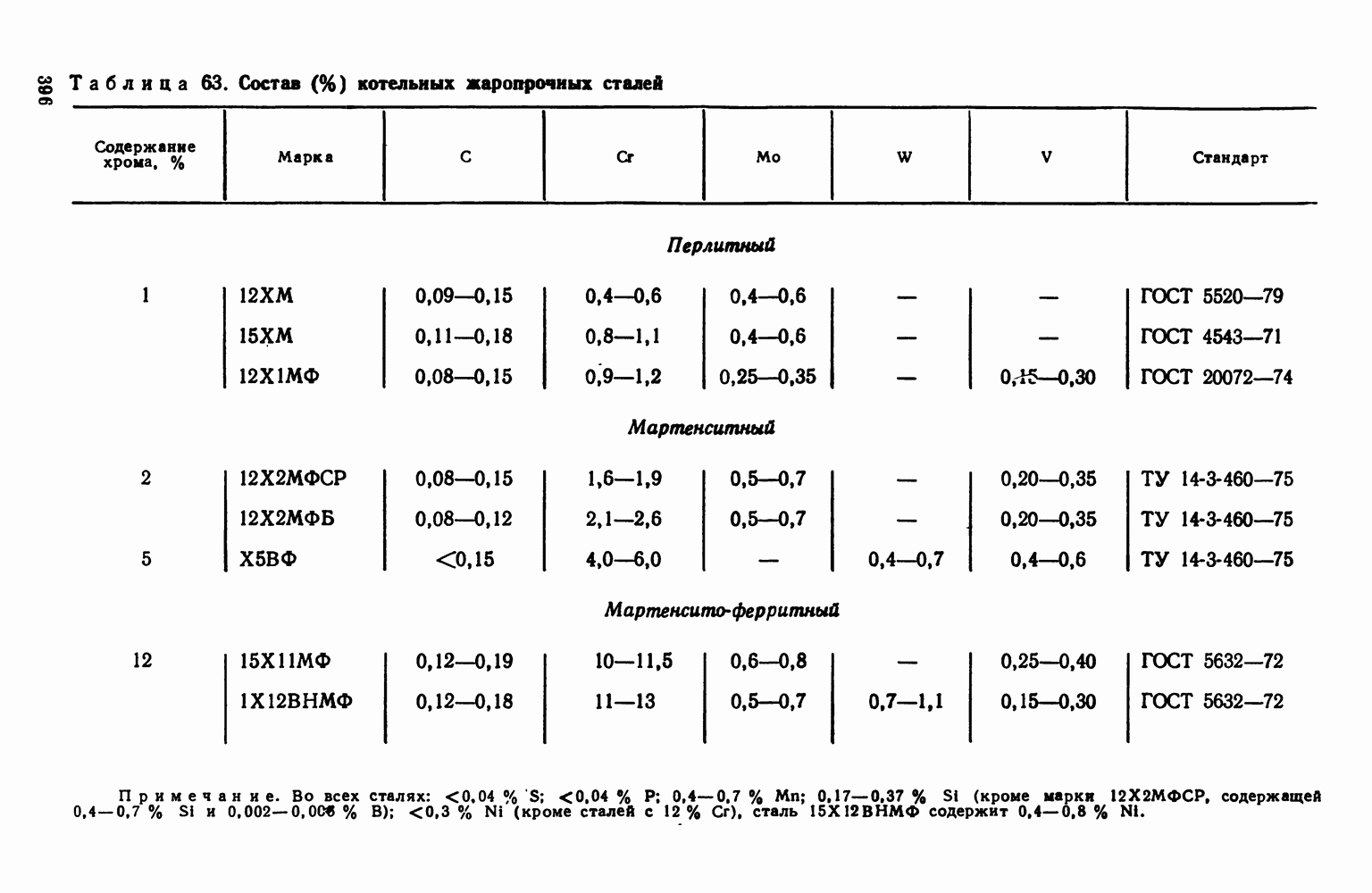
- 5. Классификация жаропрочных материалов
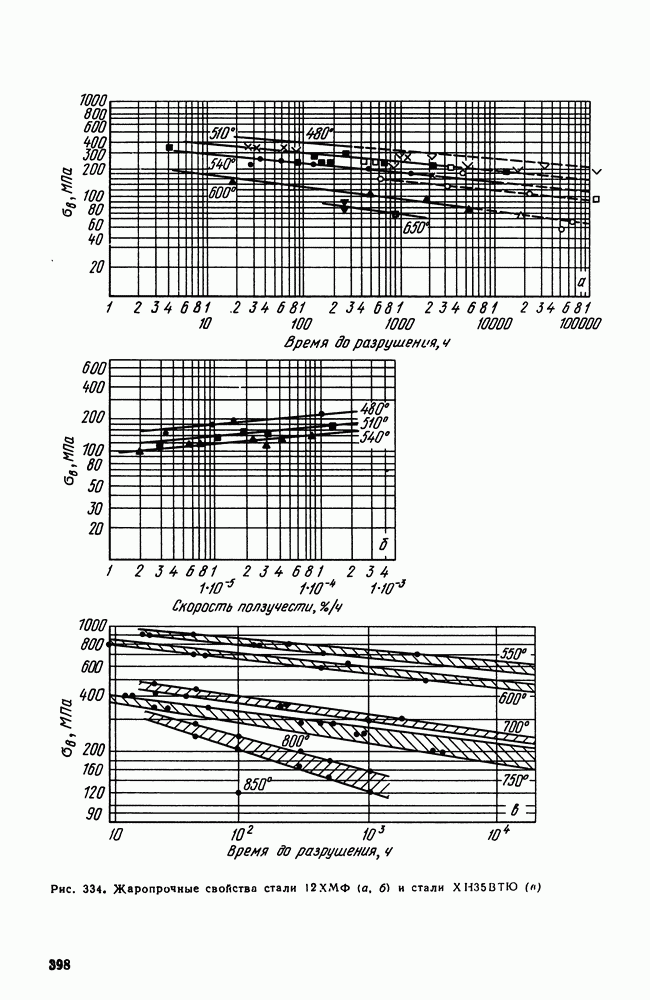
- 6. Перлитные и мартенситные жаропрочные стали
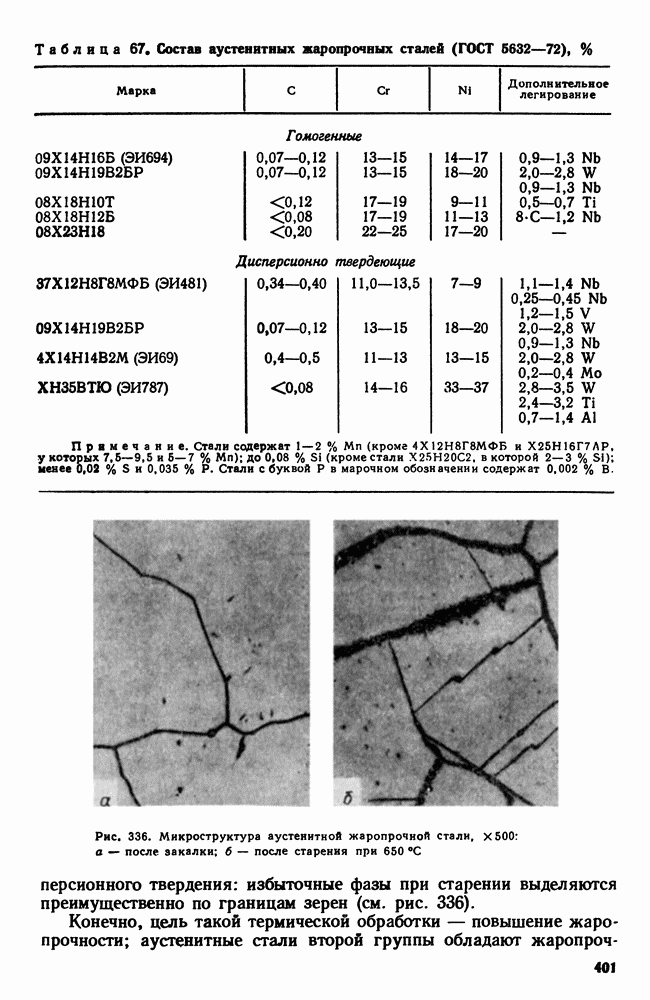
- 7. Аустенитные жаропрочные стали
- 8. Никелевые и кобальтовые жаропрочные сплавы
- Глава XIX. КОРРОЗИОННОСТОЙКИЕ (НЕРЖАВЕЮЩИЕ) СТАЛИ И СПЛАВЫ
- 2. Хромоникелевые нержавеющие стали
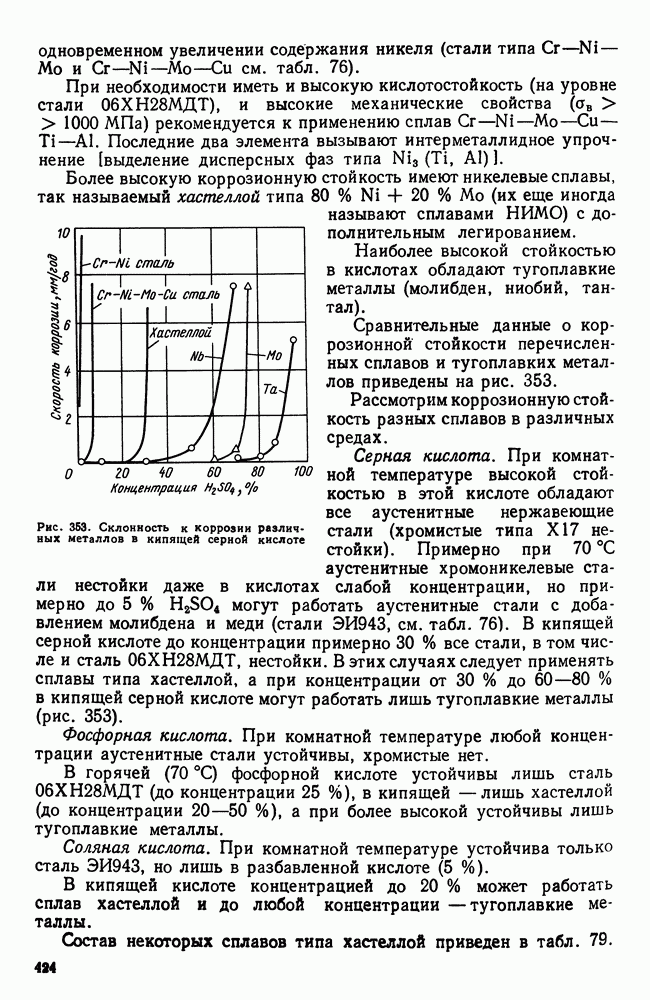
- 3. Кислотостойкие стали и сплавы
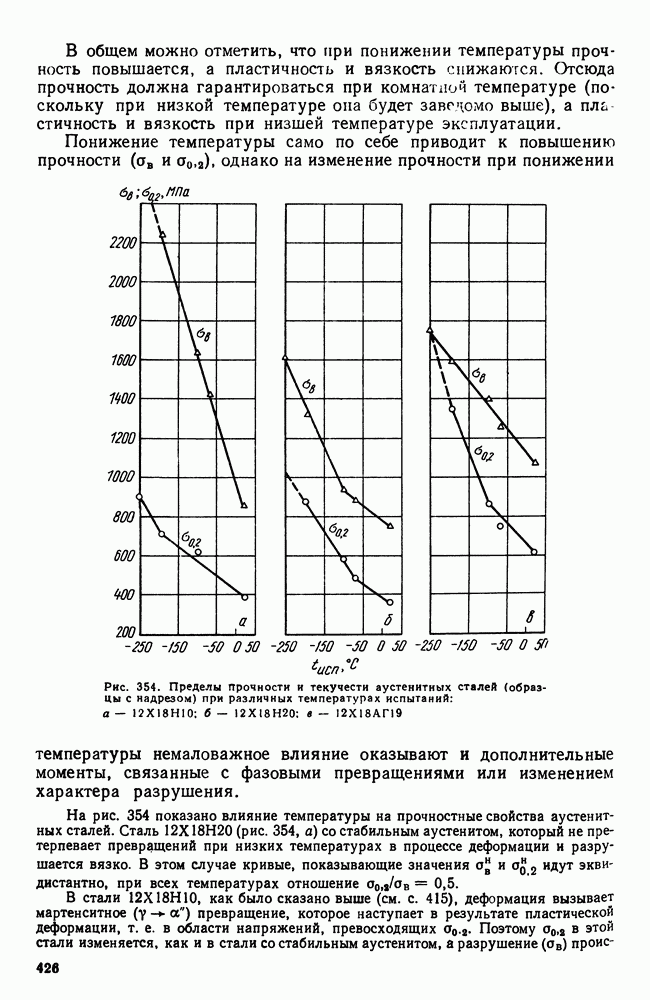
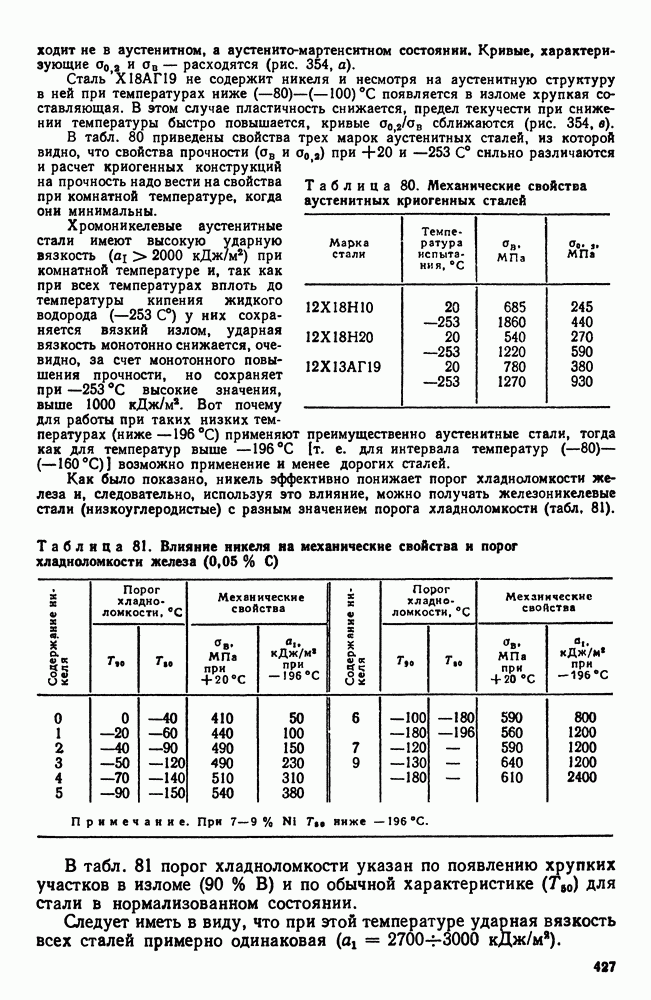
- 4. Криогенные стали и сплавы
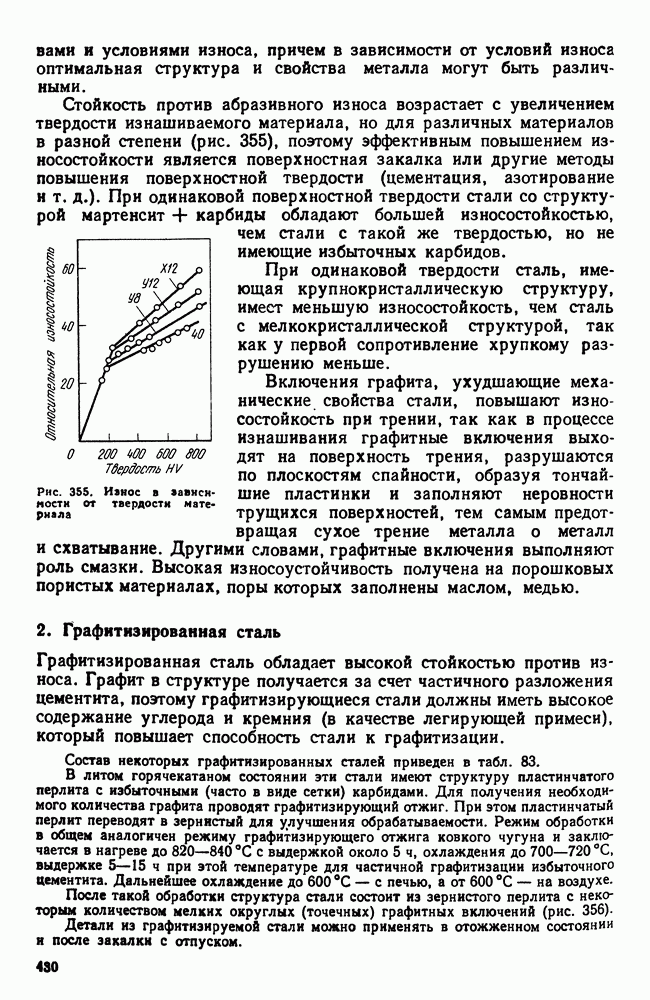
- Глава XX. ИЗНОСОСТОЙКИЕ СТАЛИ И СПЛАВЫ
- 2. Графитизированная сталь
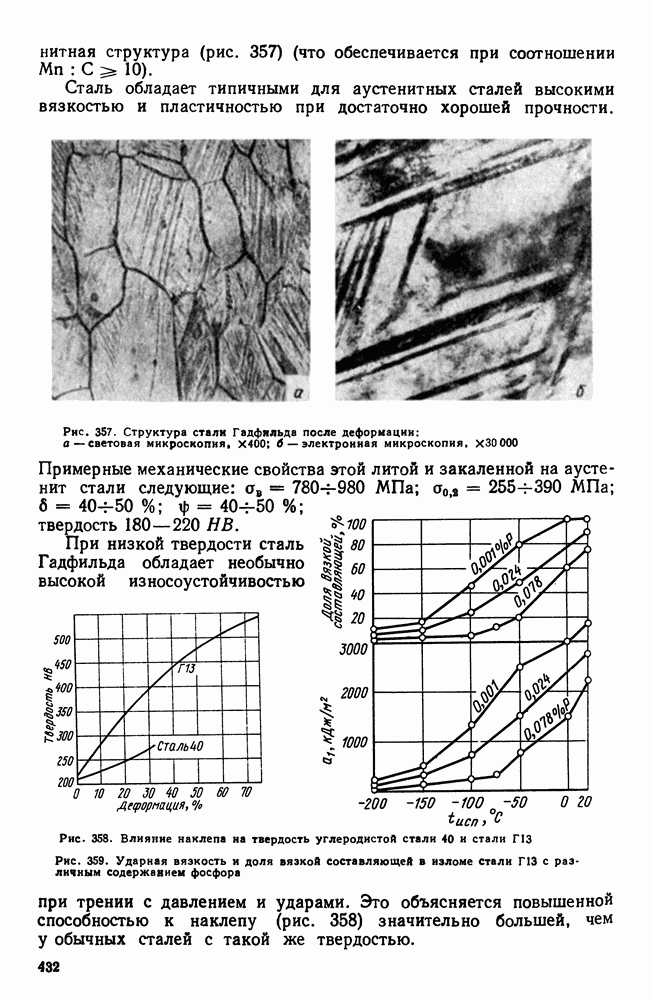
- 3. Высокомарганцовистая сталь
- 4. Наплавочные материалы
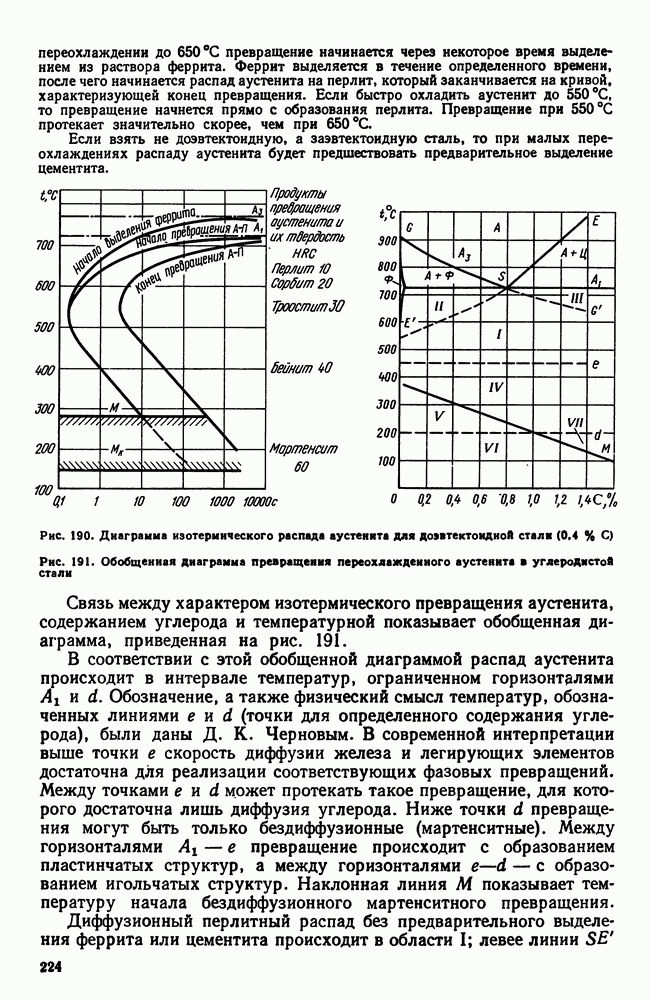
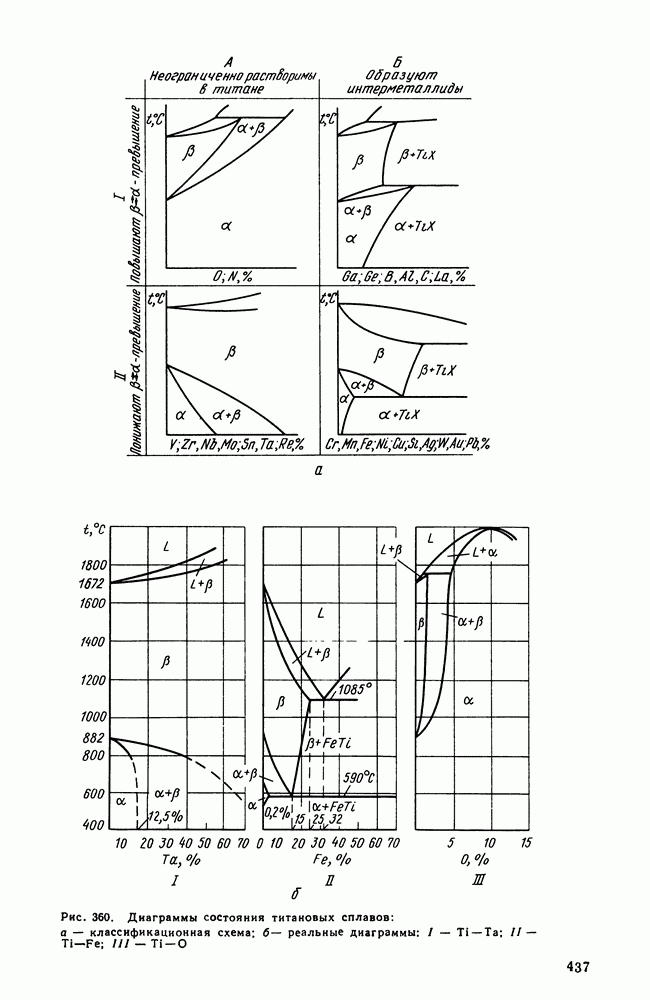
- Глава XXI. ТИТАН И ЕГО СПЛАВЫ
- 2. Легирование титана
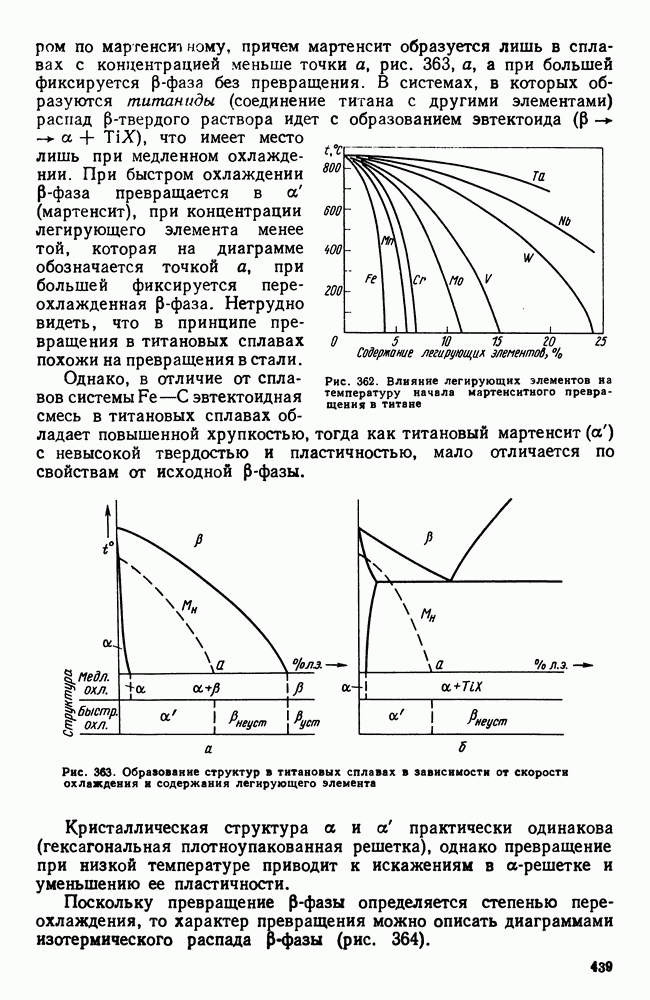
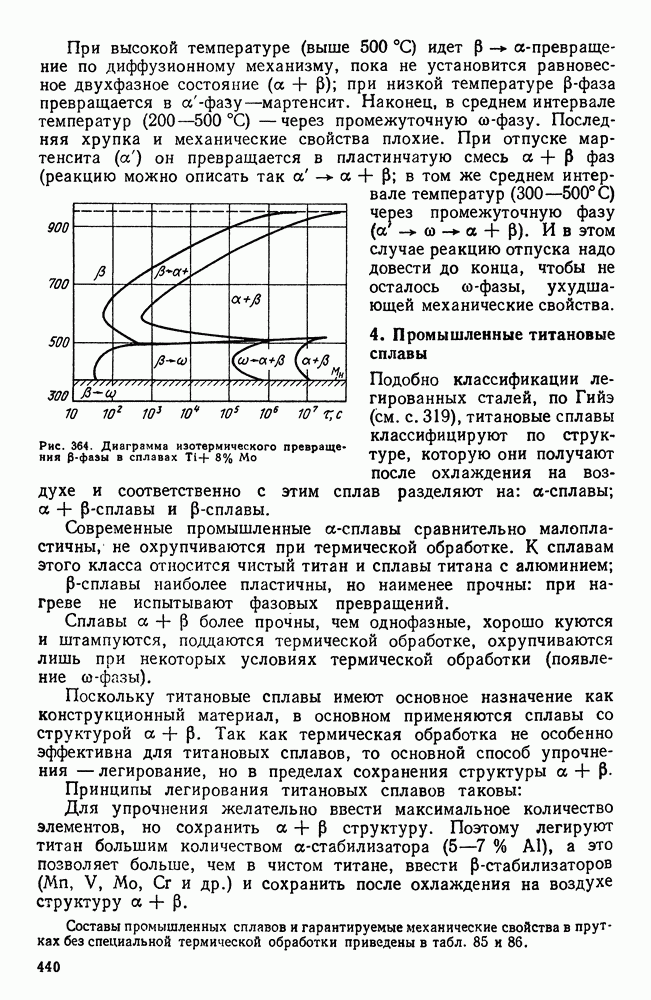
- 3. Фазовые превращения в титановых сплавах
- 5. Термическая обработка титановых сплавов
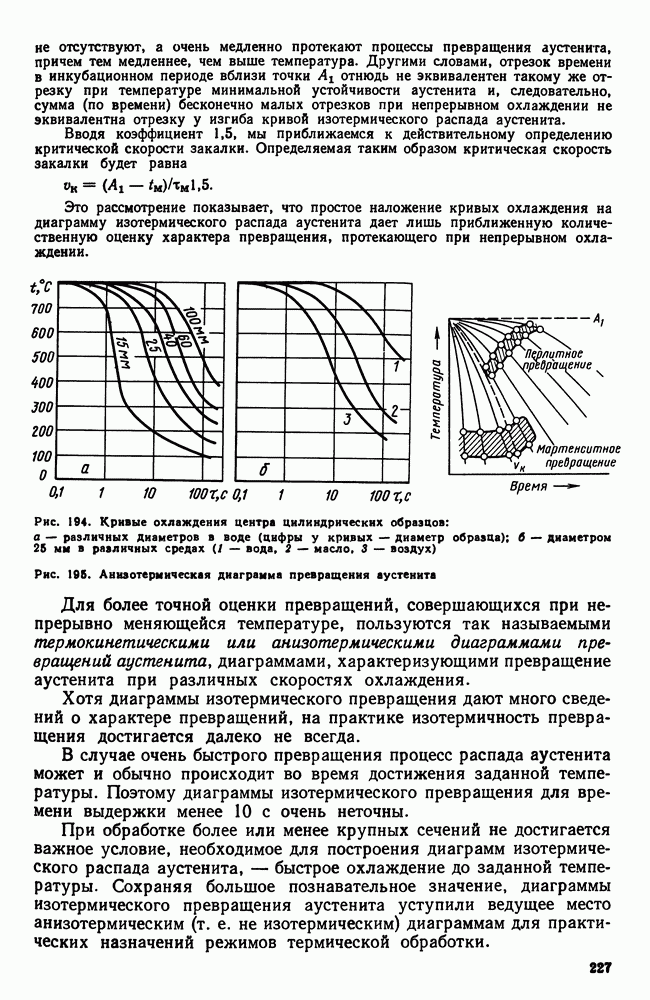
- 6. Примеси в титановых сплавах
- 7. Коррозионная стойкость титана
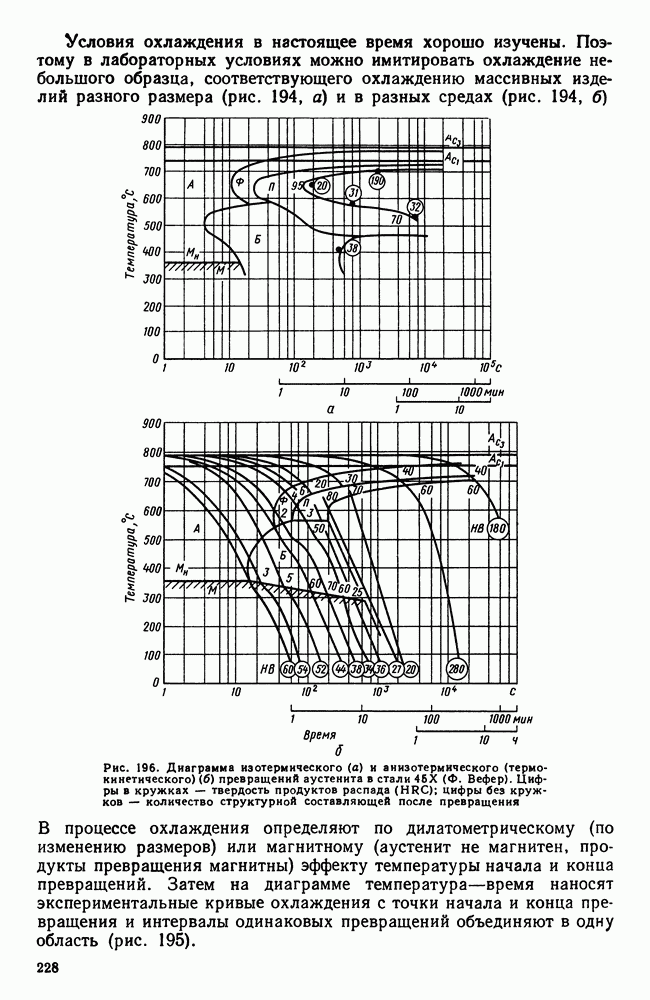
- Глава XXII. ТУГОПЛАВКИЕ МЕТАЛЛЫ
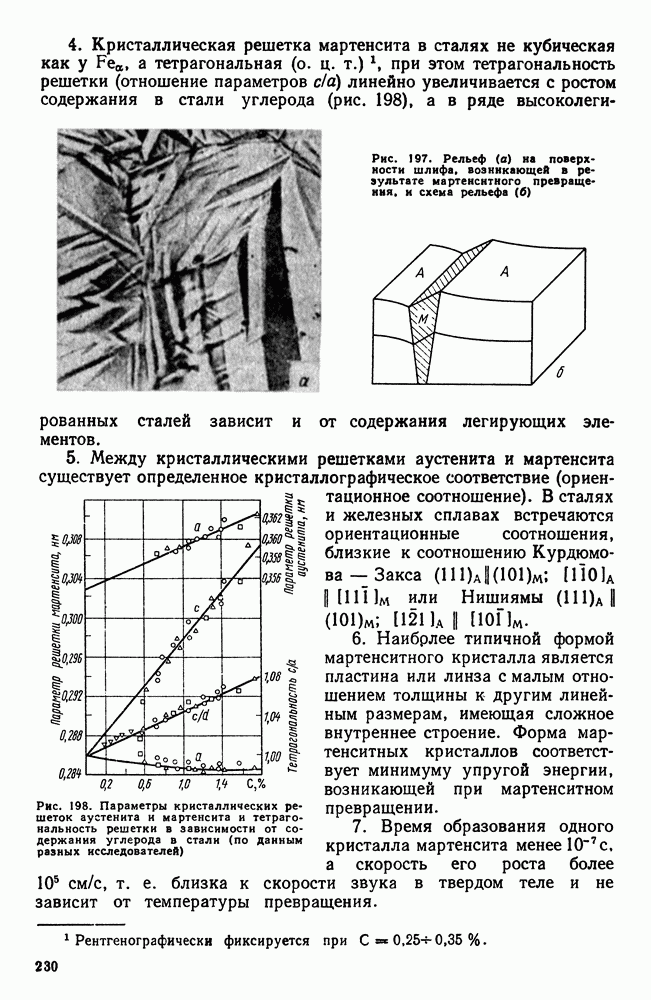
- 2. Взаимодействие тугоплавких металлов с другими элементами и между собой
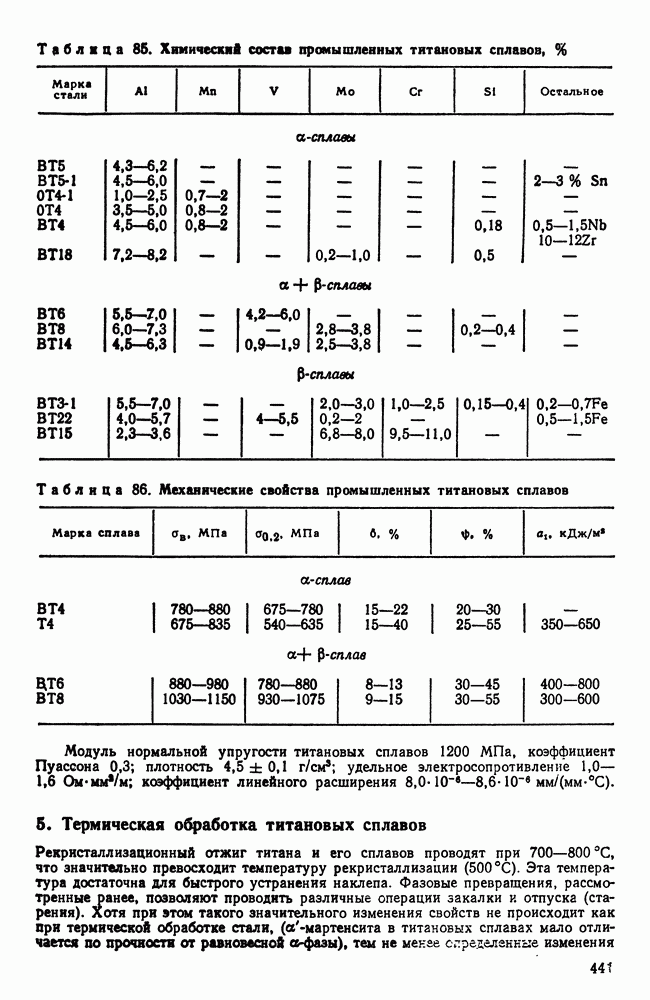
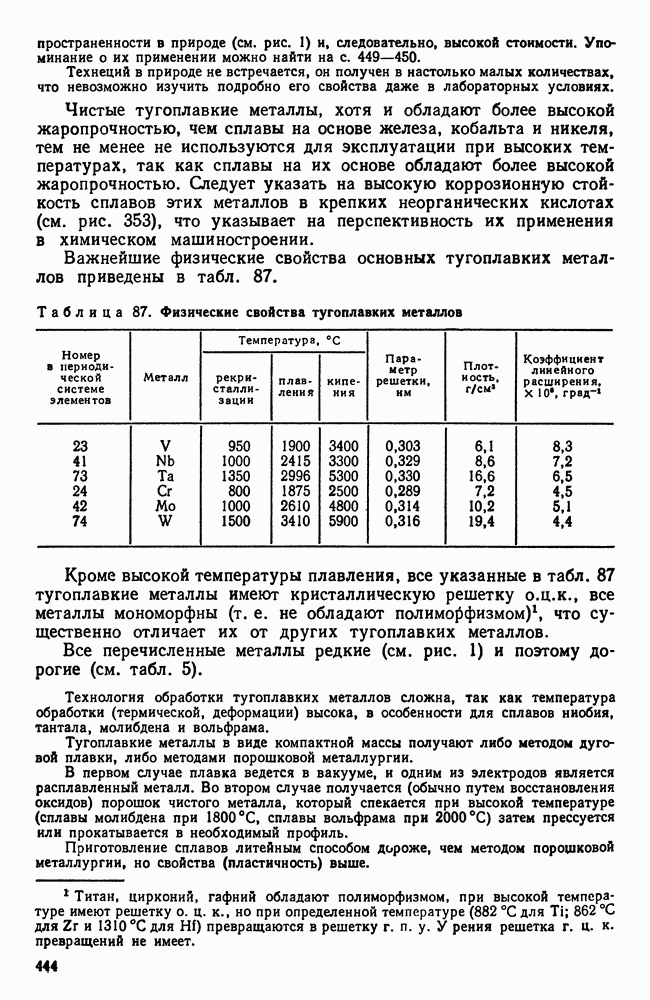
- 3. Механические свойства и жаропрочность
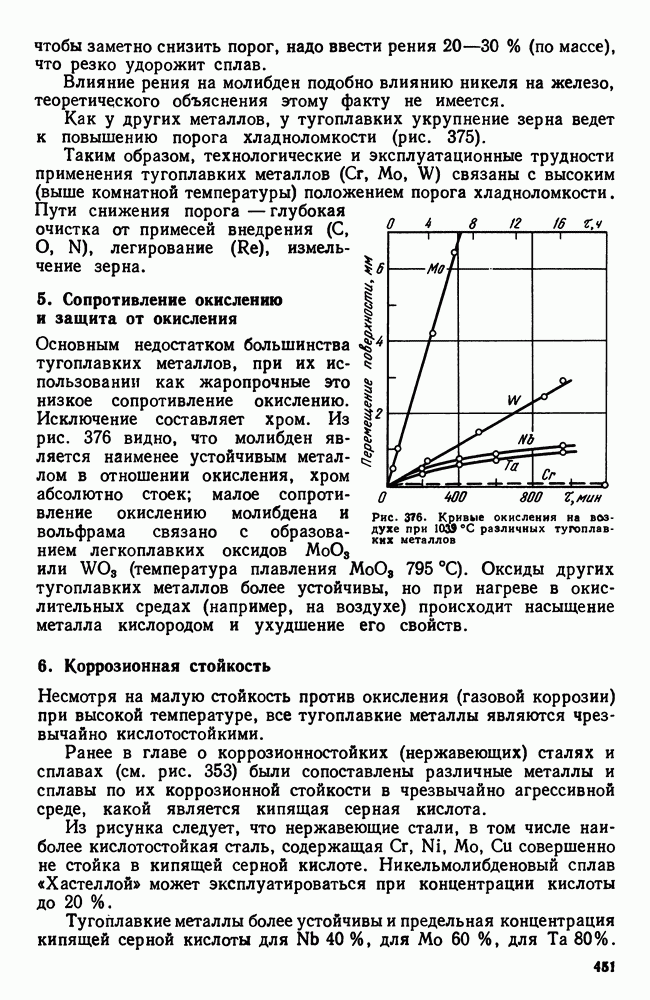
- 4. Хладноломкость тугоплавких металлов
- 5. Сопротивление окислению и защита от окисления
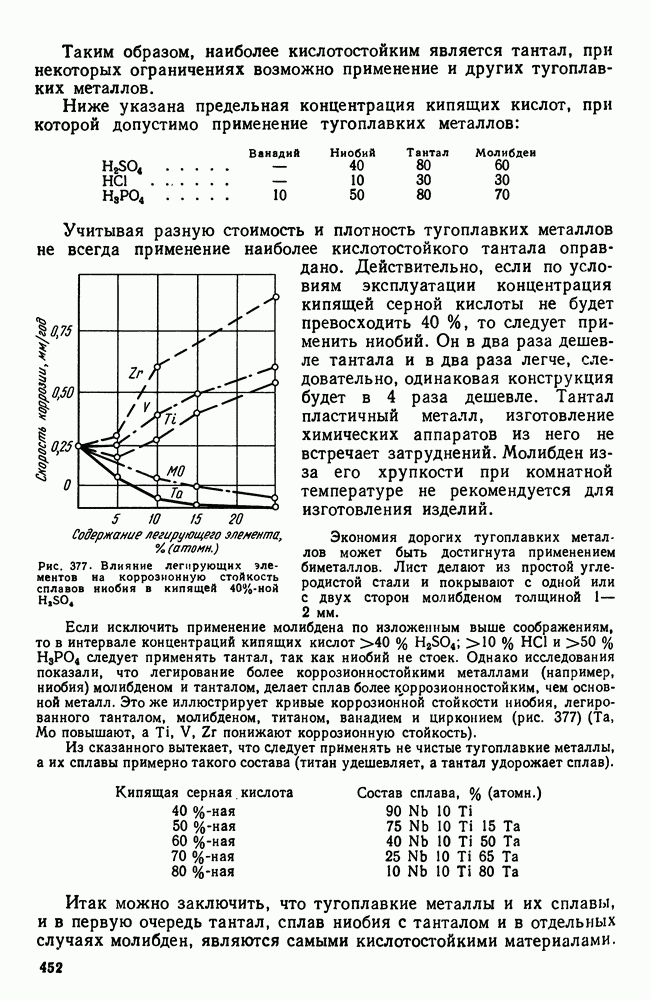
- 6. Коррозионная стойкость
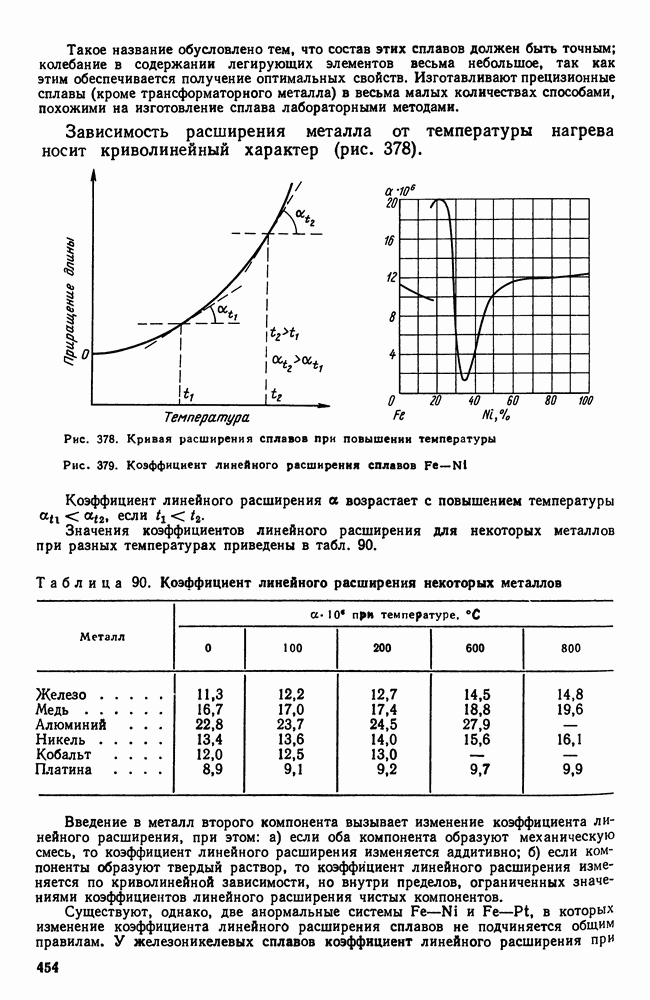
- Глава XXIII. СПЛАВЫ С ОСОБЫМИ ТЕПЛОВЫМИ И УПРУГИМИ СВОЙСТВАМИ
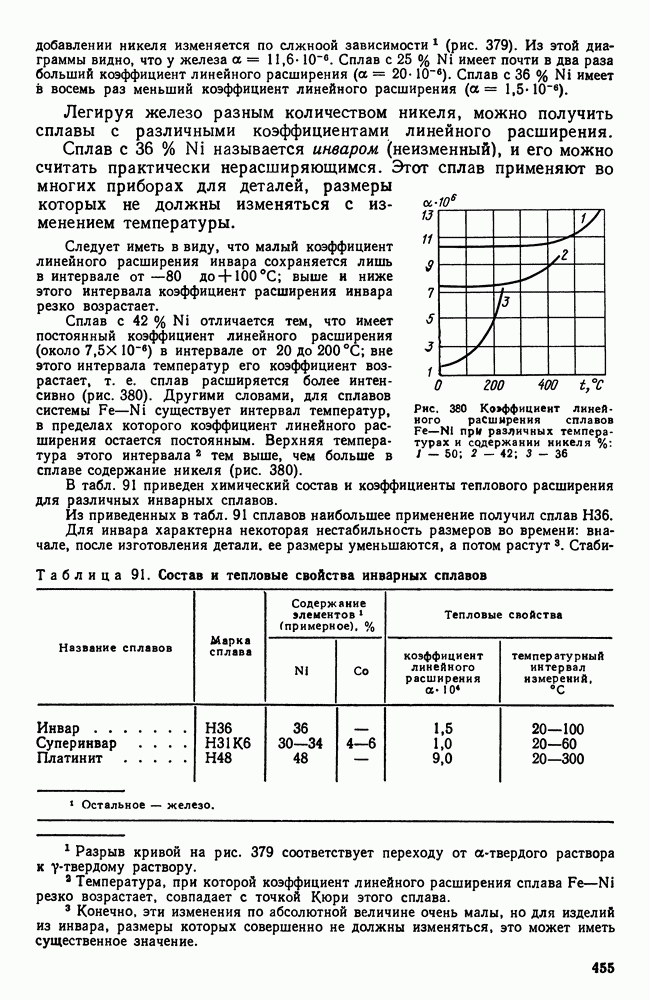
- 2. Сплавы с постоянным модулем упругости
- Глава XXIV. МАГНИТНЫЕ СТАЛИ И СПЛАВЫ
- 2. Стали и сплавы для постоянных магнитов (магнитнотвердые сплавы)
- 3. Магнитномягкие сплавы
- 4. Немагнитные стали
- 5. Электротехнические сплавы
- Глава XXV. СПЛАВЫ АТОМНОЙ ЭНЕРГЕТИКИ
- 2. Конструкционные материалы. Теплоносители
- 3. Ядерное горючее (уран, плутоний, торий)
- Часть пятая. Цветные металлы и сплавы
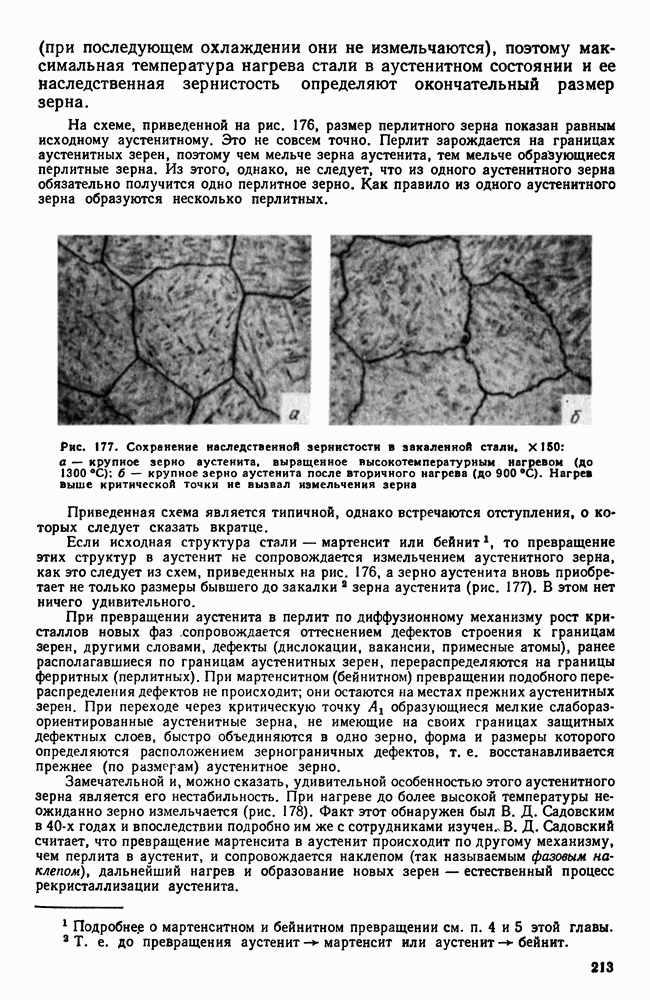
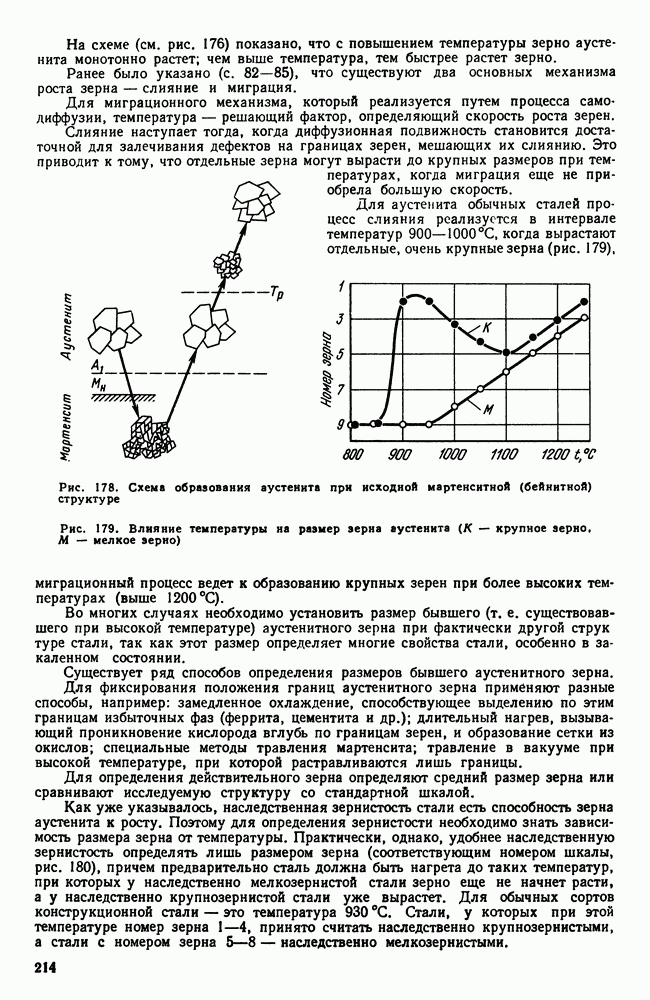
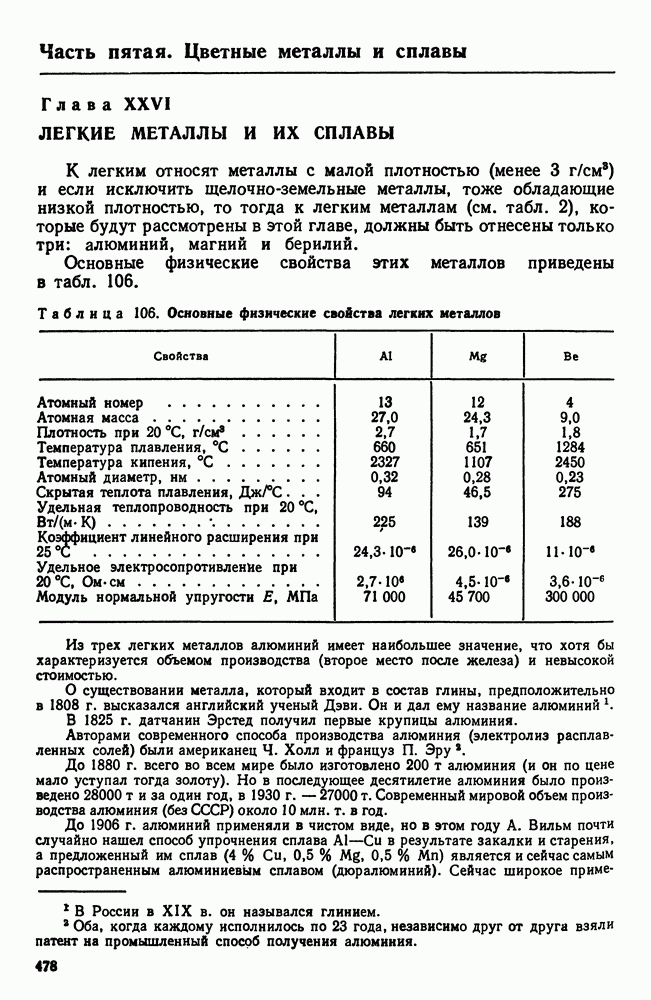
- Глава XXVI. ЛЕГКИЕ МЕТАЛЛЫ И ИХ СПЛАВЫ
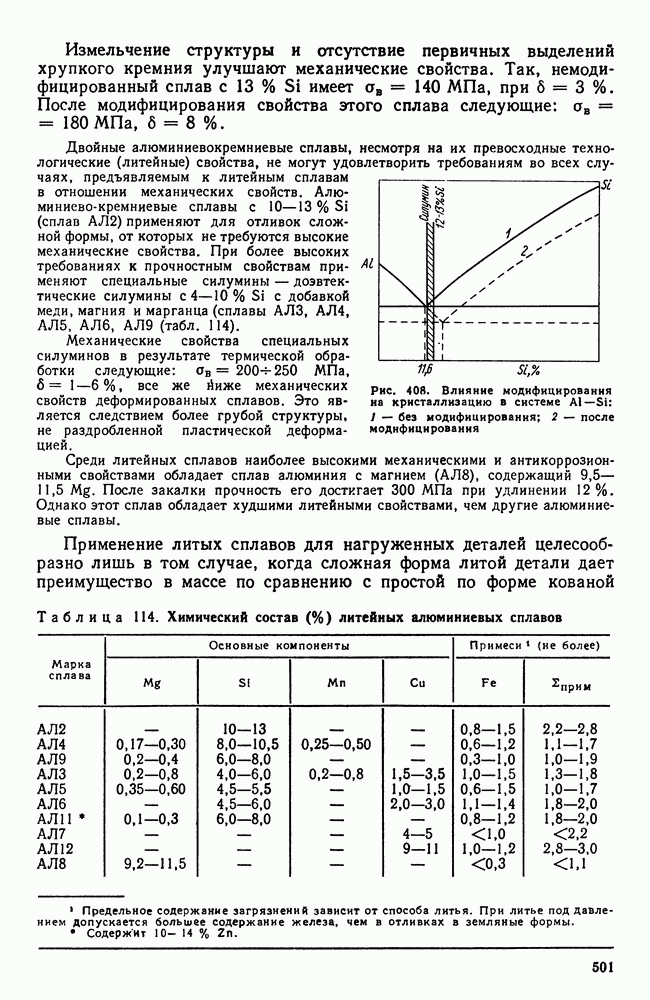
- 1. Свойства алюминия
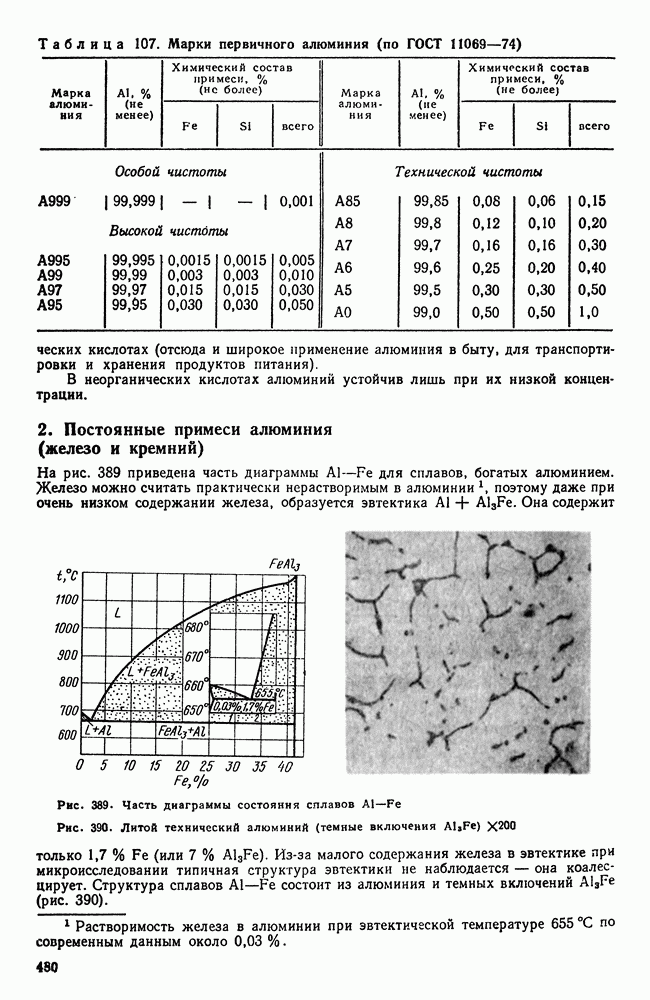
- 2. Постоянные примеси алюминия (железо и кремний)
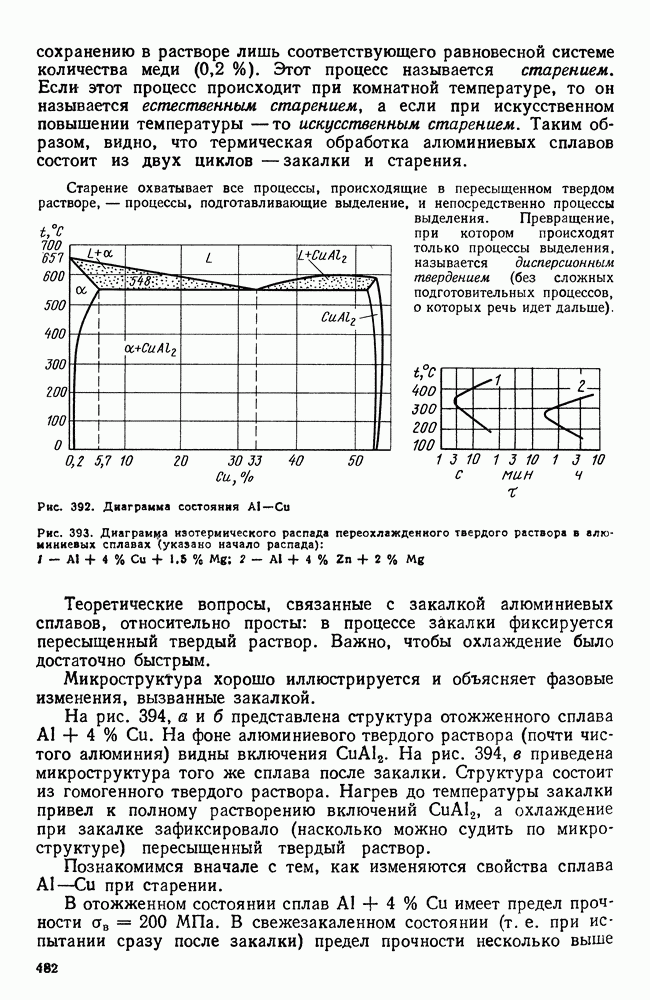
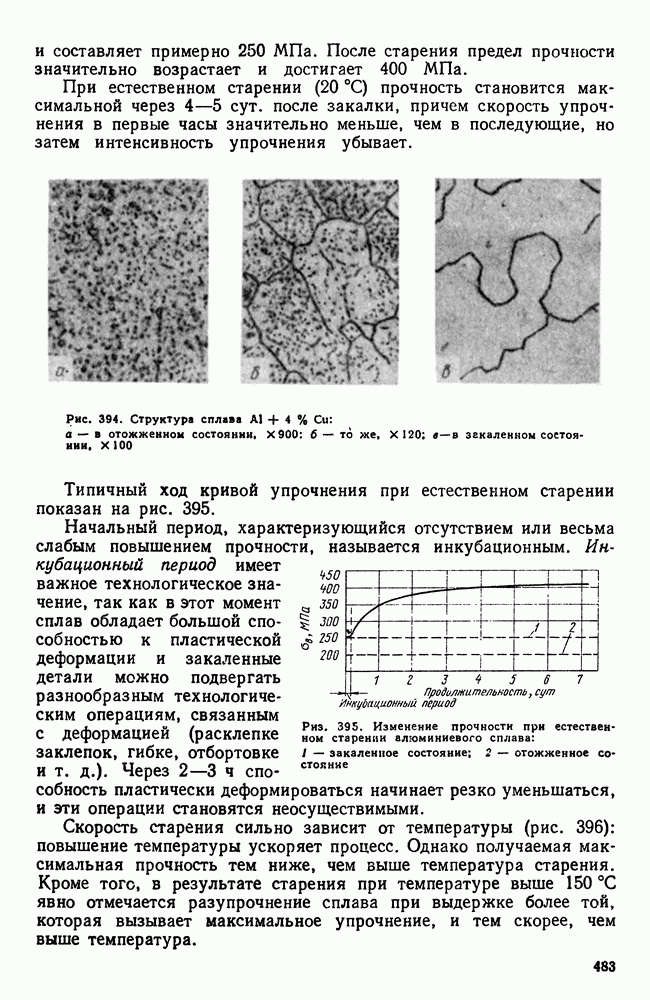
- 3. Термическая обработка сплавов Al-Cu
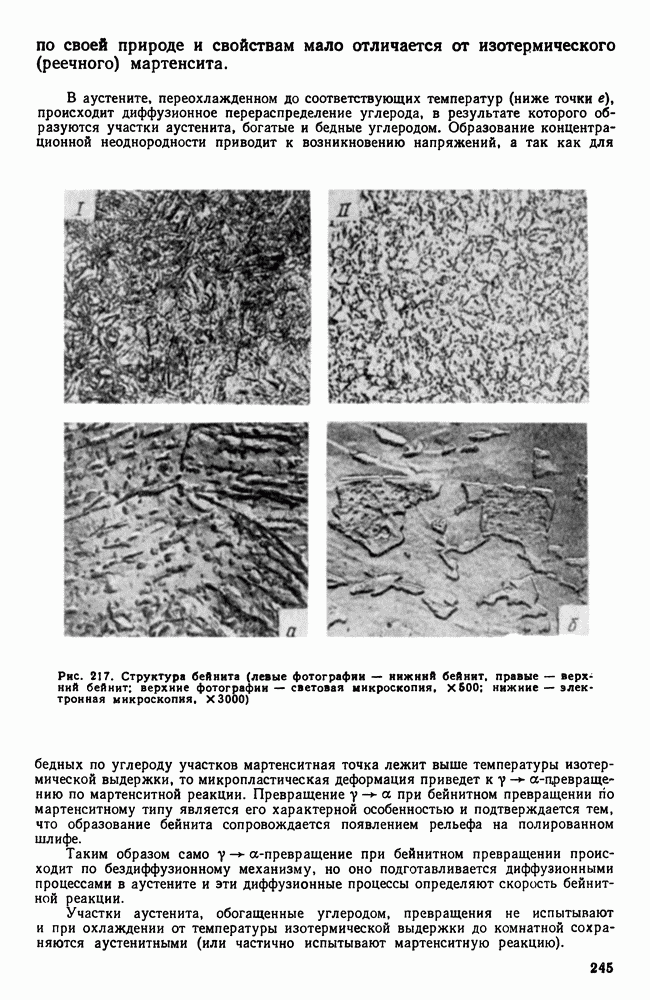
- 4. Влияние состава алюминиевых сплавов на процессы, происходящие при термической обработке
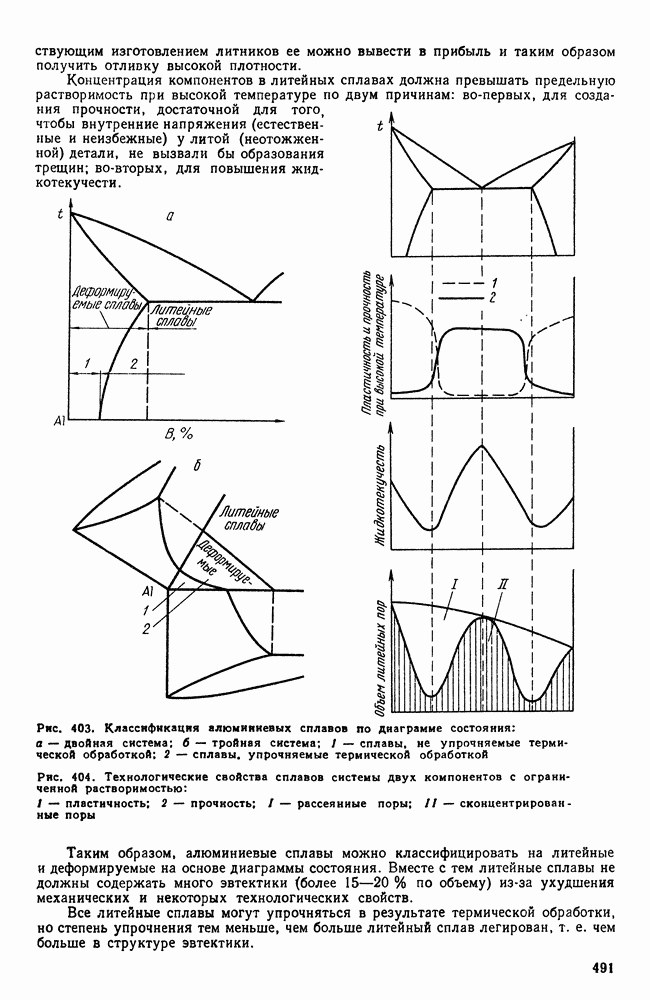
- 5. Классификация алюминиевых сплавов
- 6. Деформируемые сплавы, не упрочняемые термической обработкой
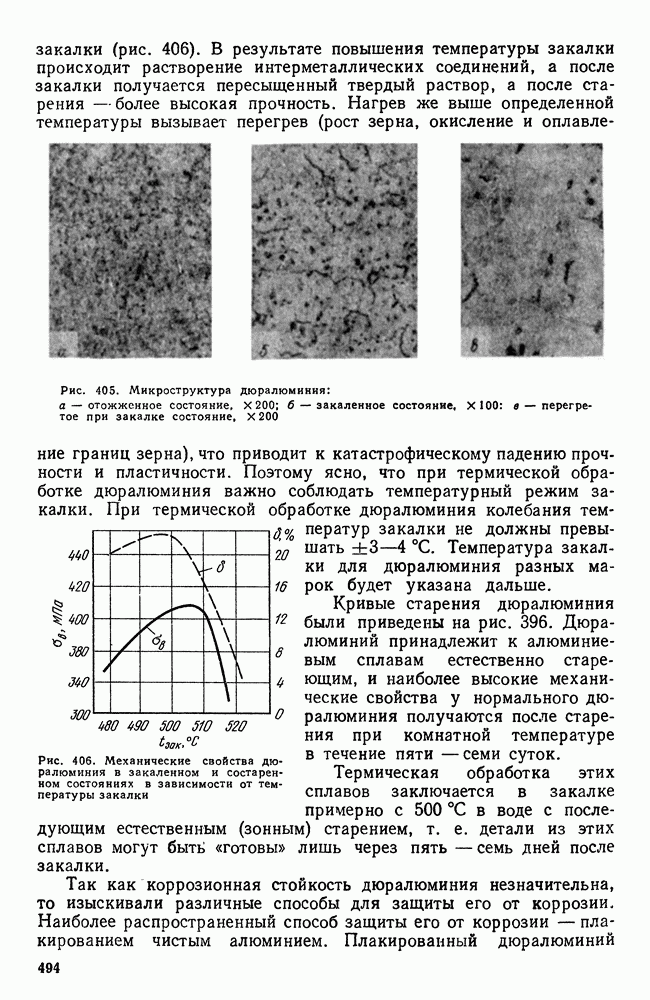
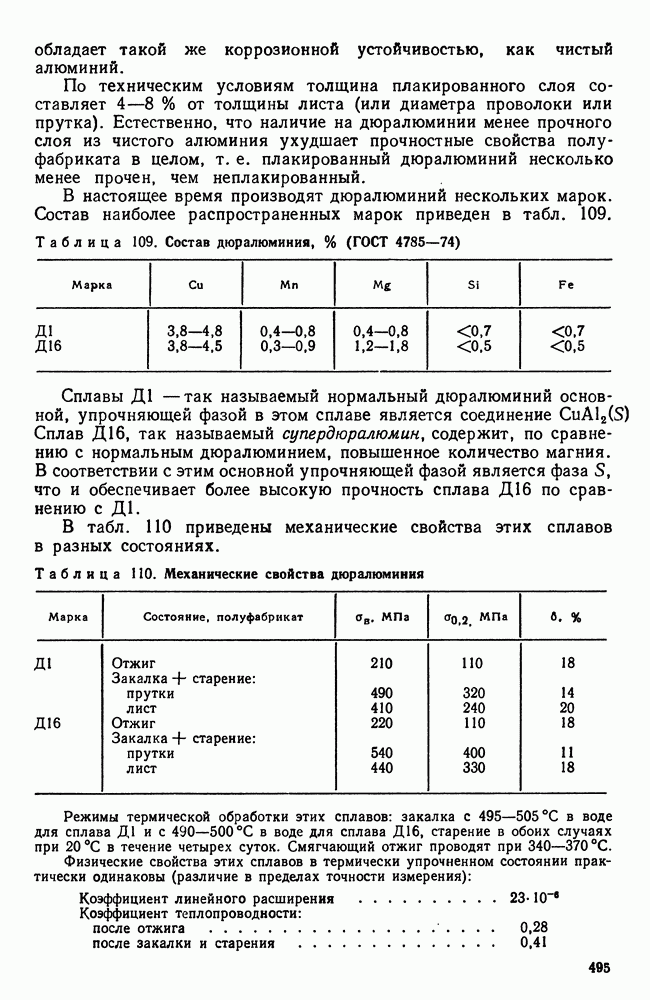
- 7. Дюралюминий и другие деформируемые сплавы, упрочняемые термической обработкой
- 8. Алюминиевые сплавы для поковок и штамповок
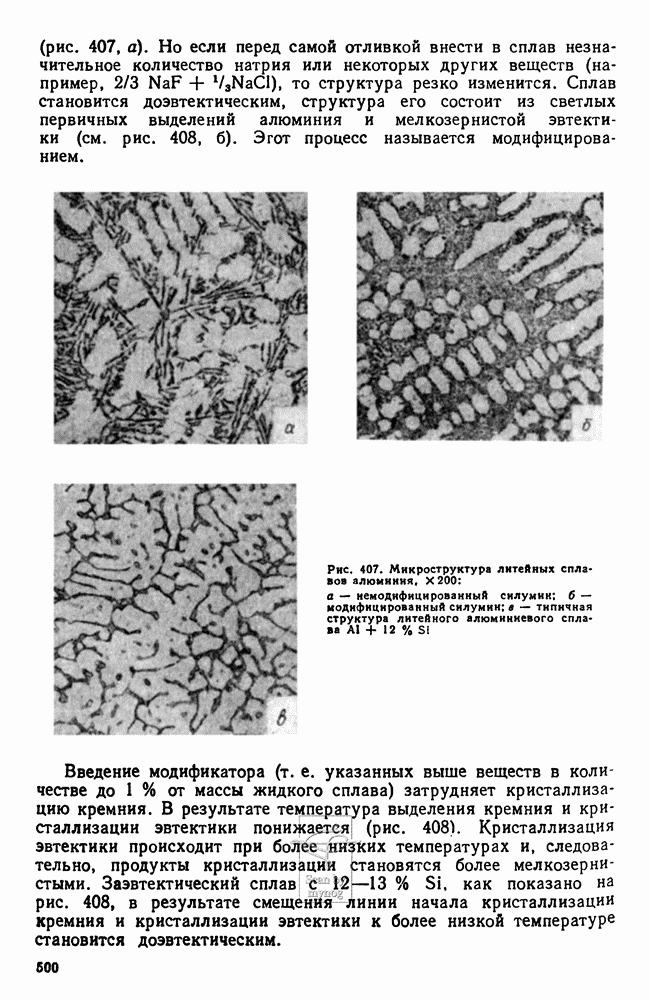
- 9. Силумины и другие алюминиевые сплавы для фасонного литья
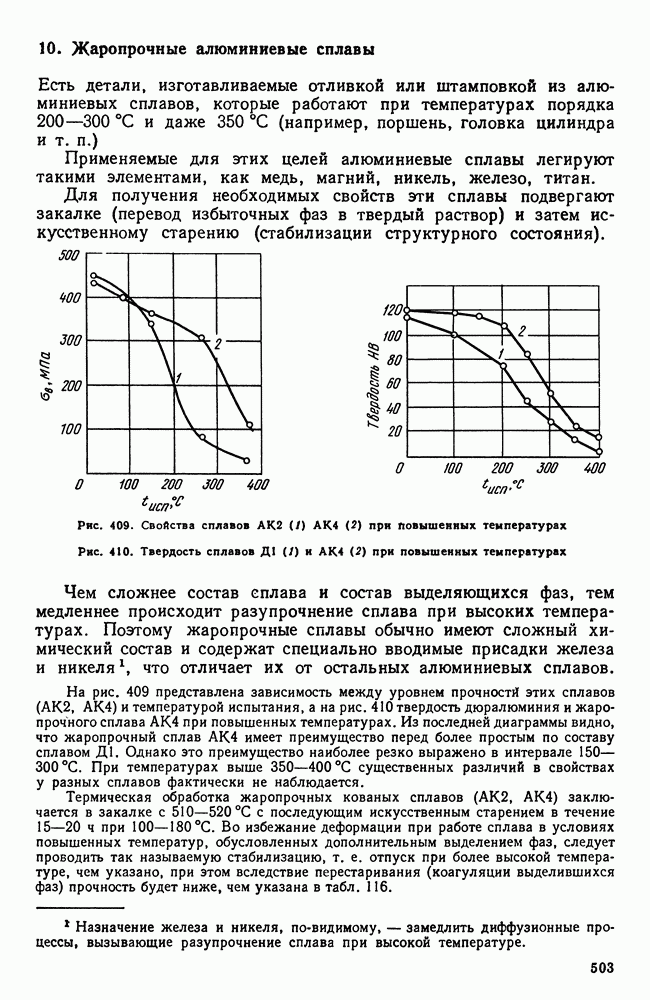
- 10. Жаропрочные алюминиевые сплавы
- 11. Магний
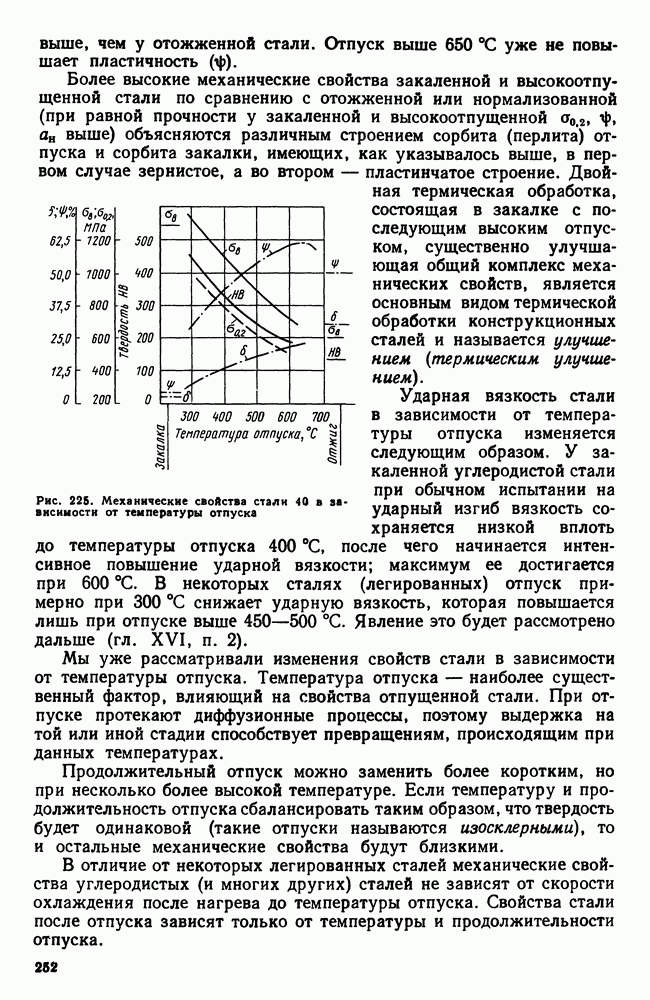
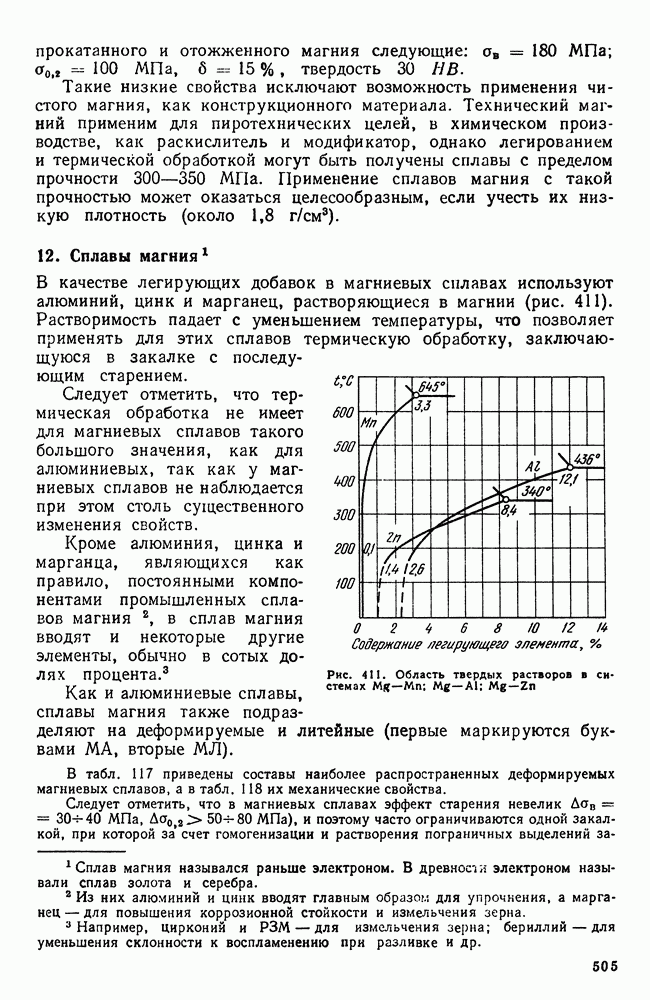
- 12. Сплавы магния
- 13. Бериллий
- 14. Сплавы бериллия
- Глава XXVII. МЕДЬ И ЕЕ СПЛАВЫ
- 2. Сплавы меди с цинком (латуни)
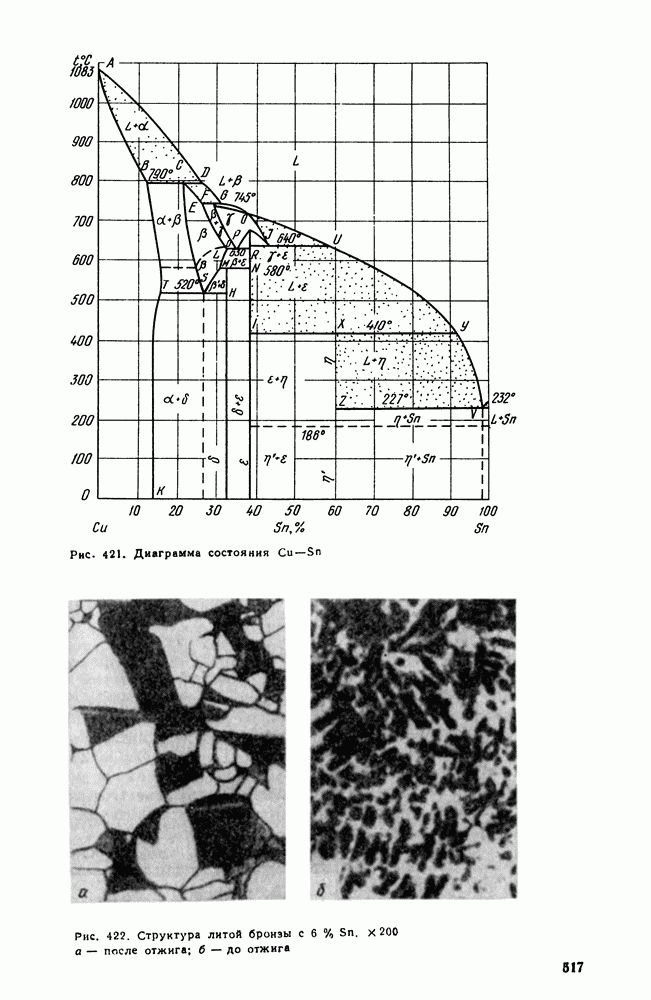
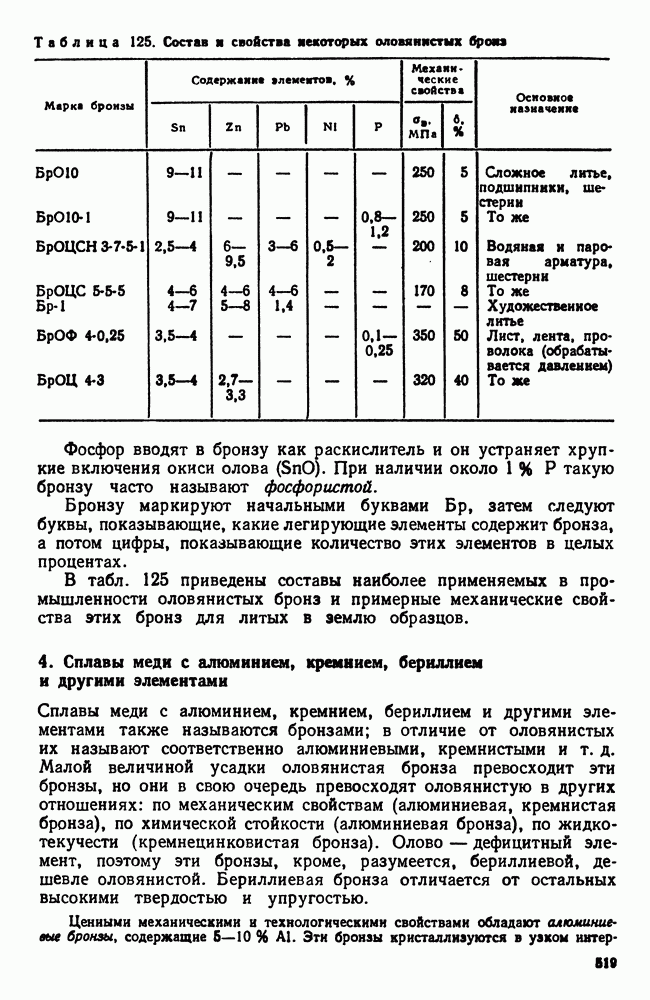
- 3. Сплавы меди с оловом (оловянистые бронзы)
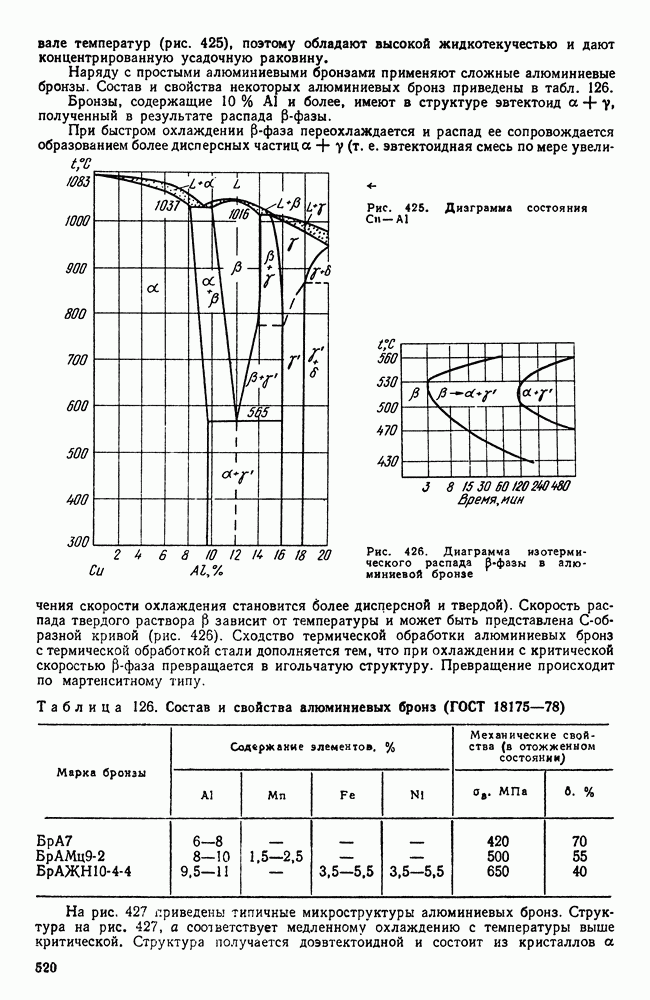
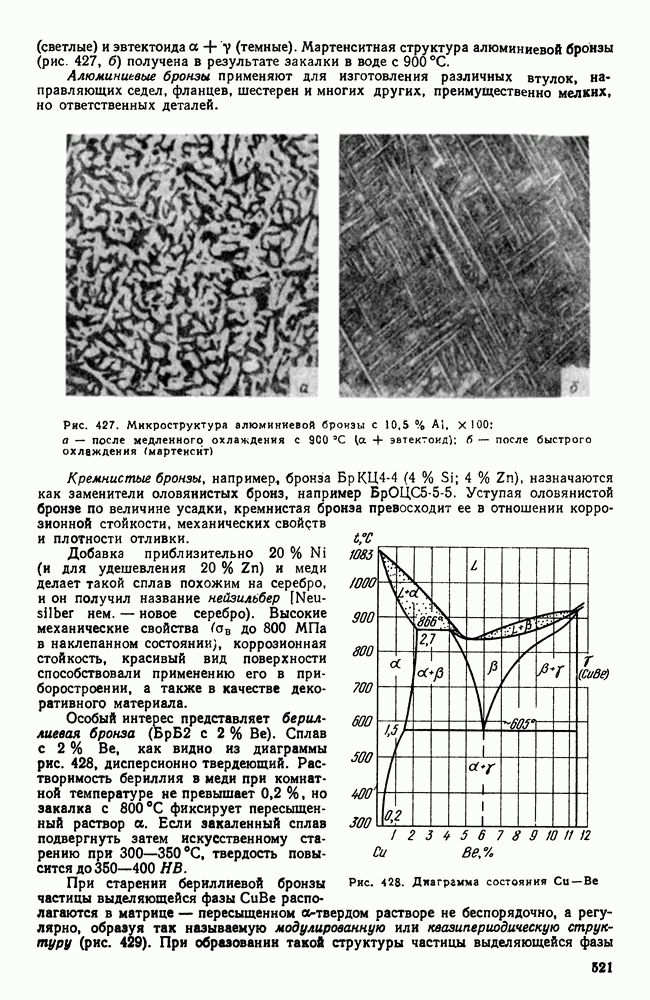
- 4. Сплавы меди с алюминием, кремнием, бериллием и другими элементами
- ГЛАВА XXVIII. ПОДШИПНИКОВЫЕ СПЛАВЫ И ПРИПОИ
- 2. Легкоплавкие подшипниковые сплавы (баббиты)
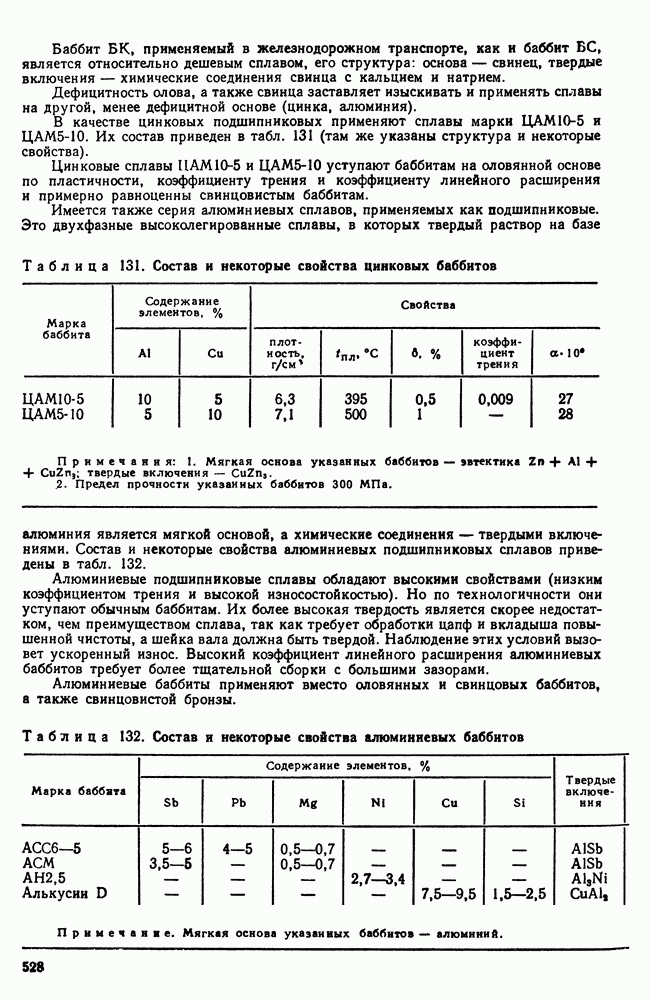
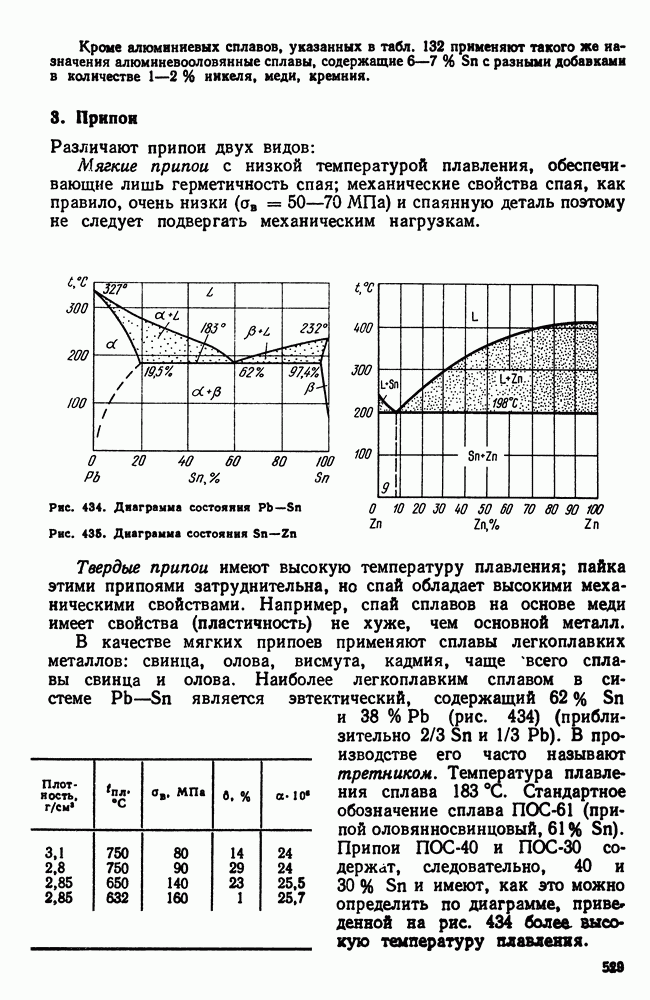
- 3. Припои
- 4. Легкоплавкие сплавы
- Глава XXIX. НЕКОТОРЫЕ СПЛАВЫ ЦВЕТНЫХ МЕТАЛЛОВ
- 2. Типографские сплавы
- 3. Благородные металлы