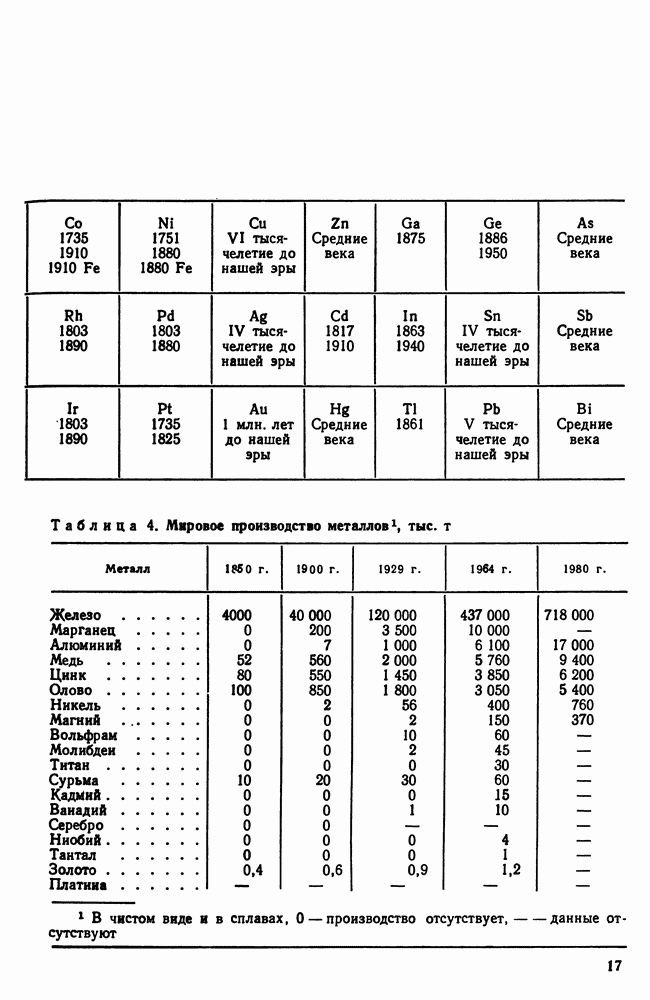
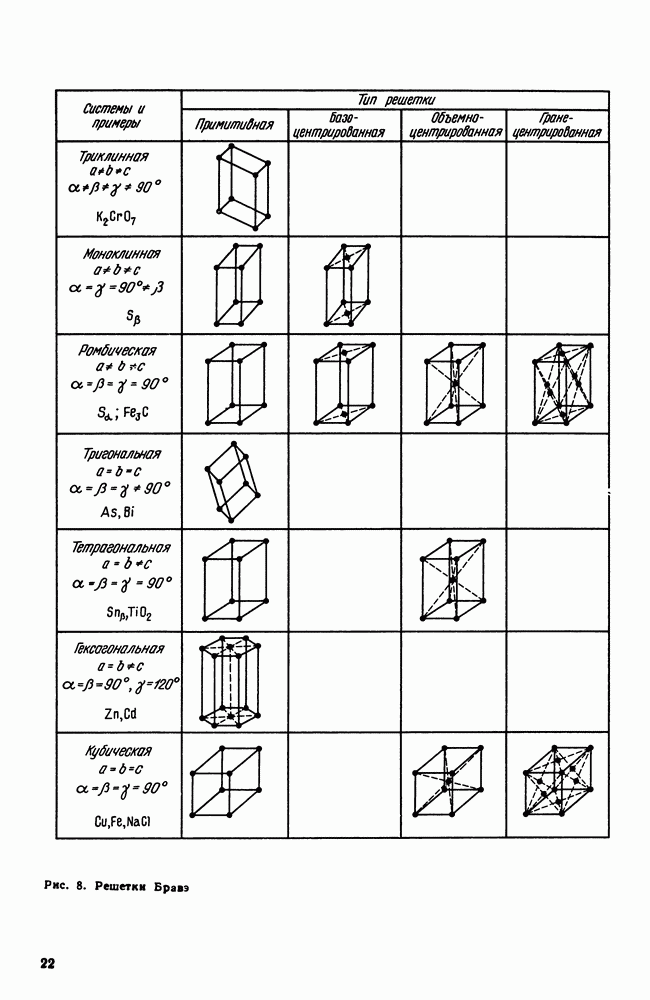
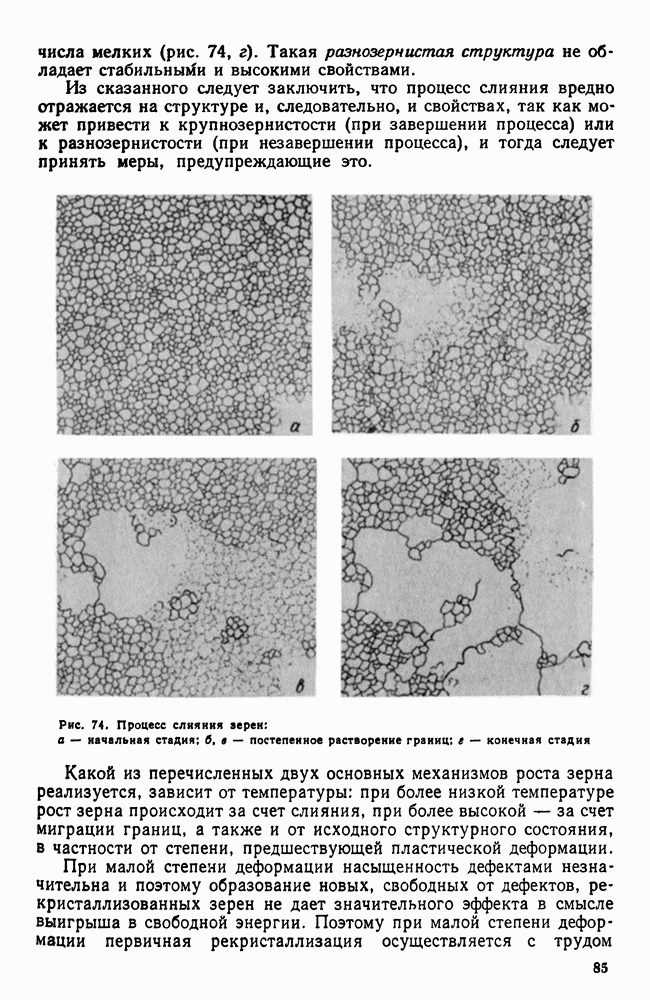
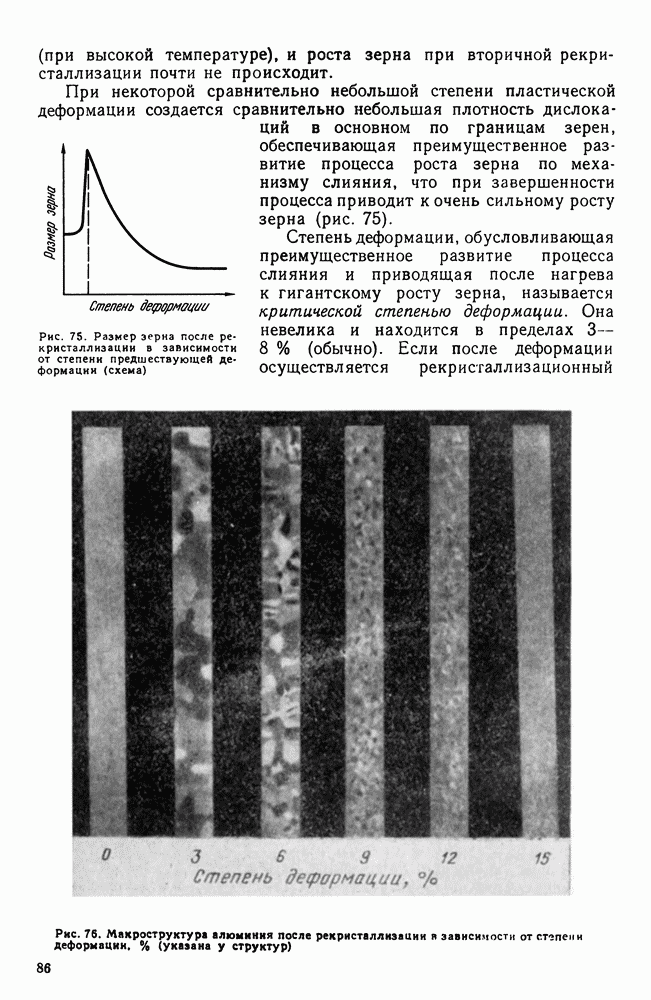
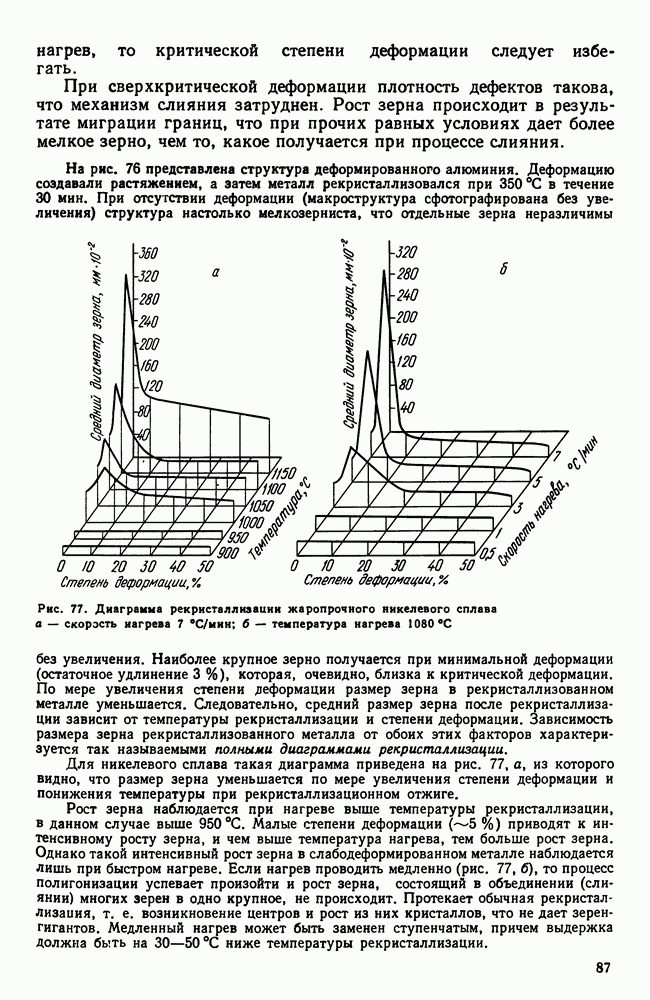
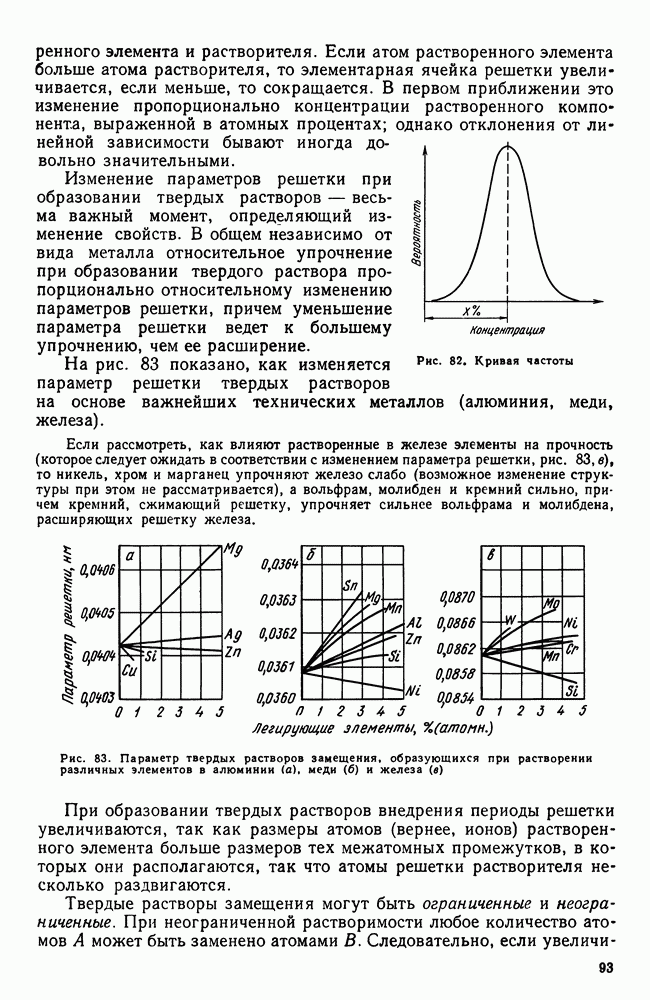
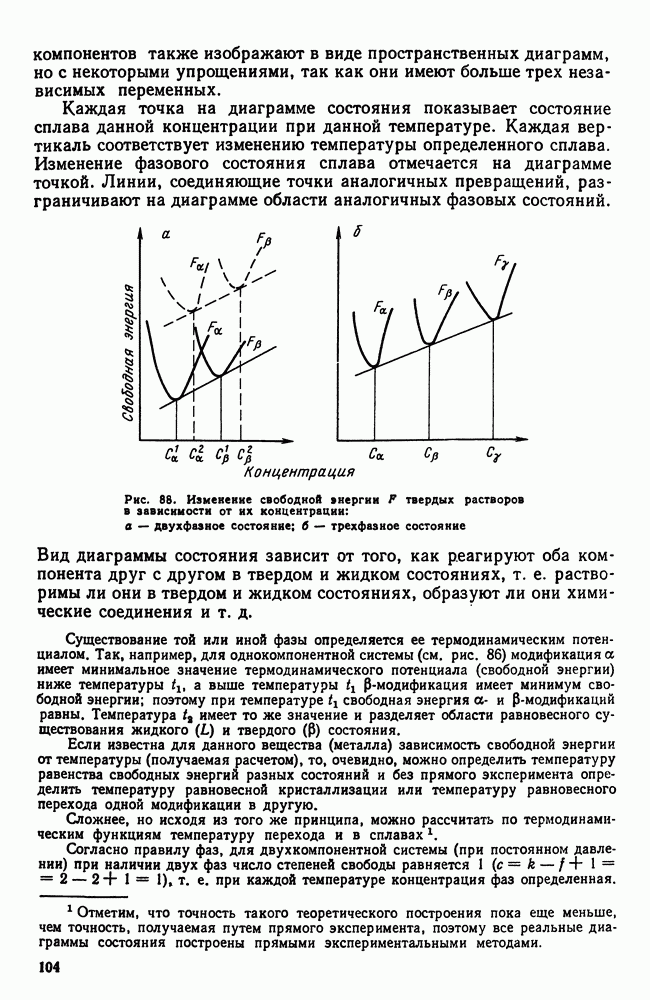
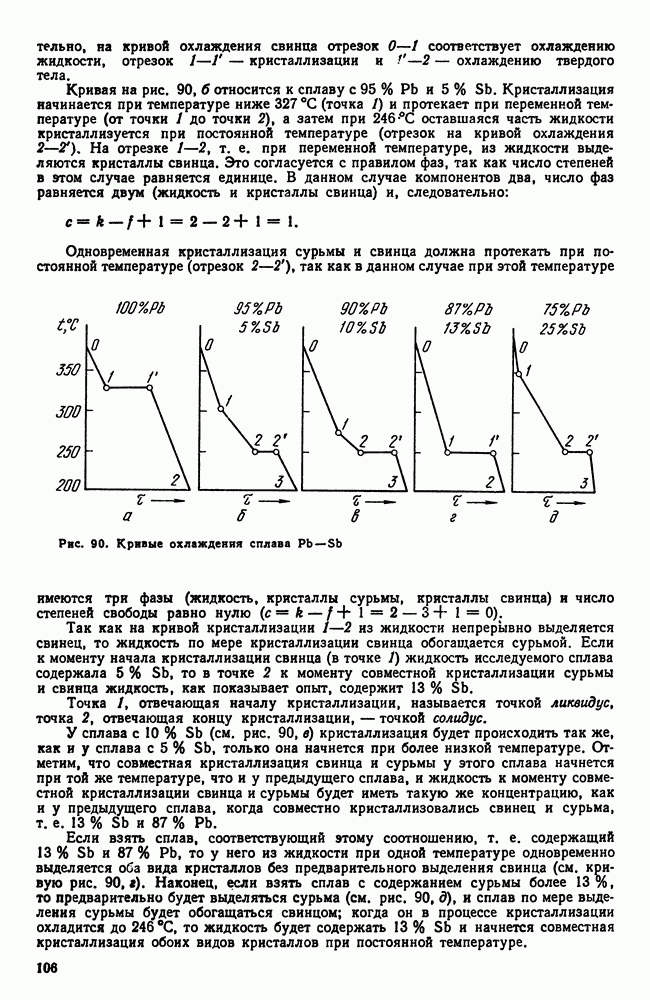
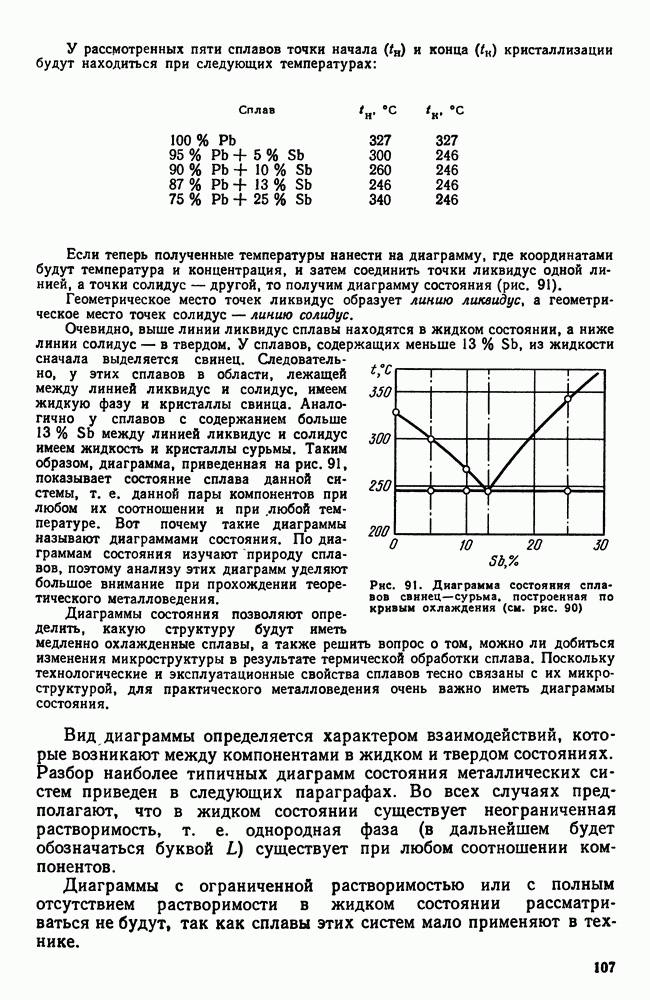
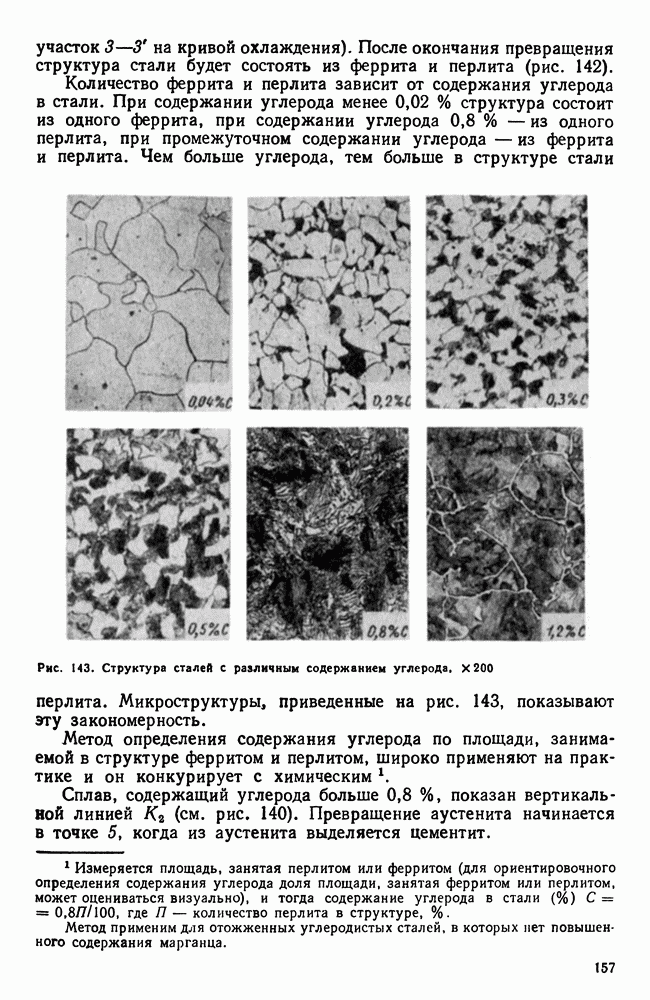
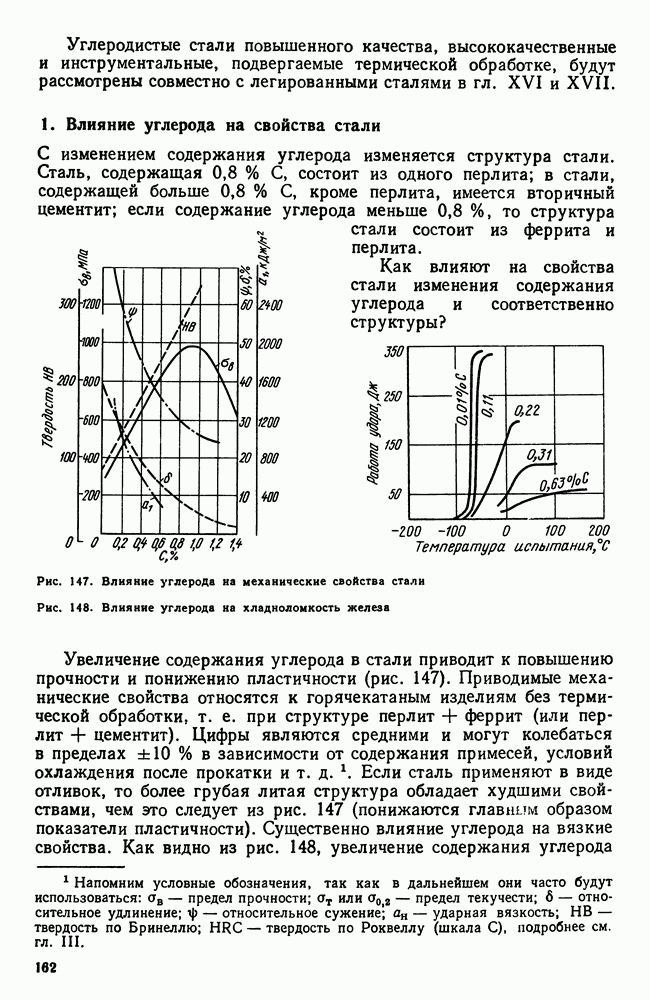
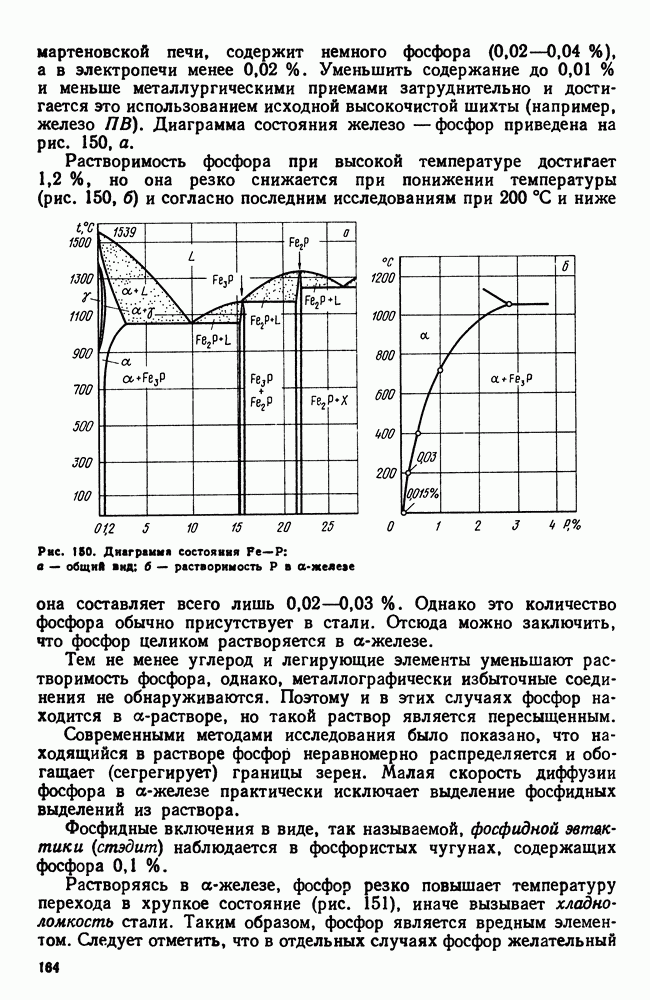
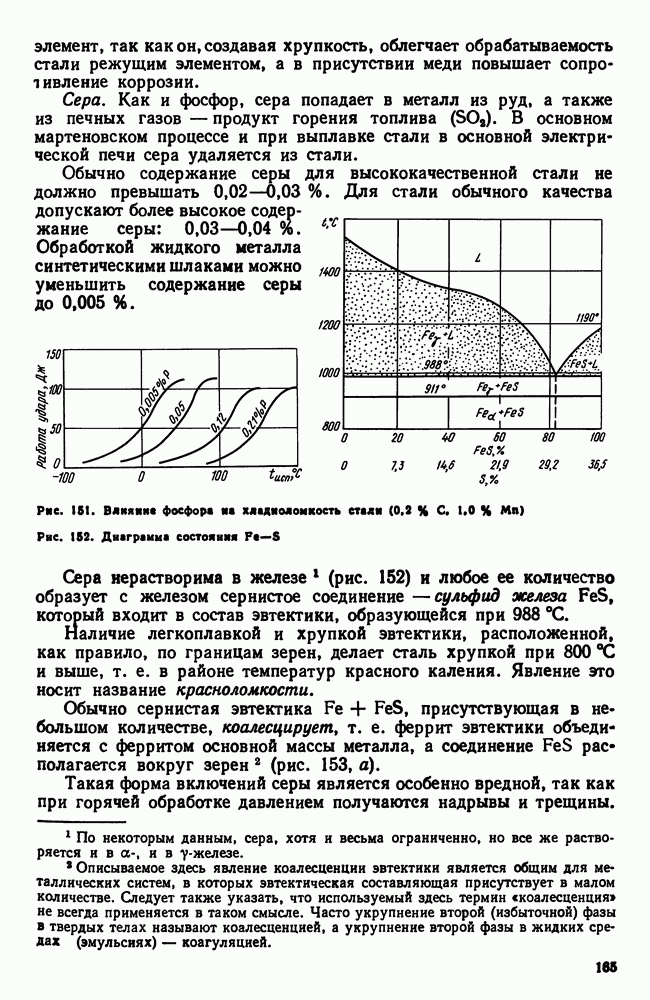
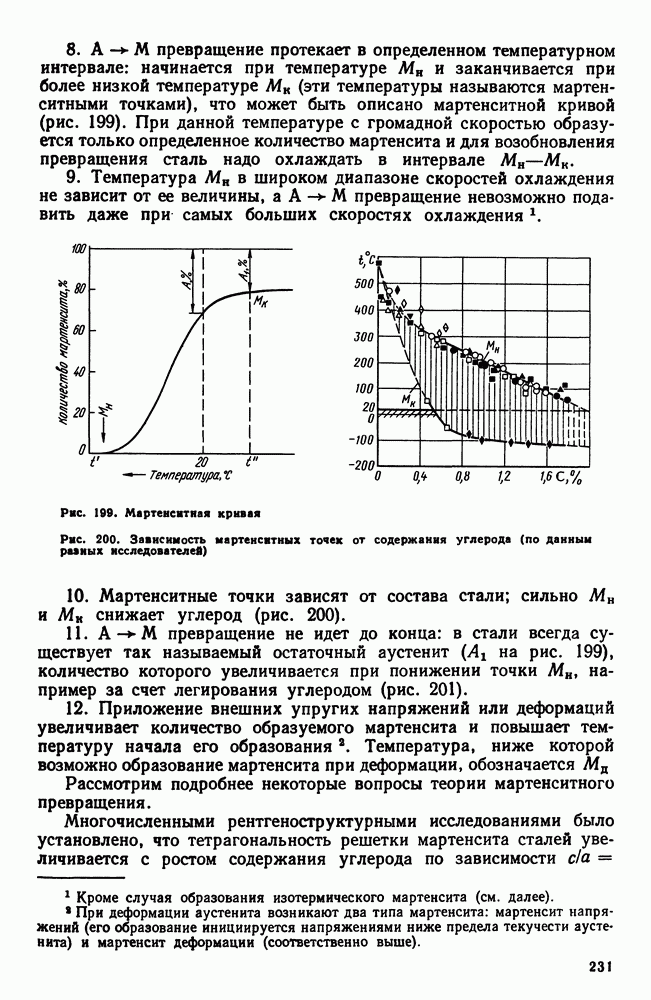
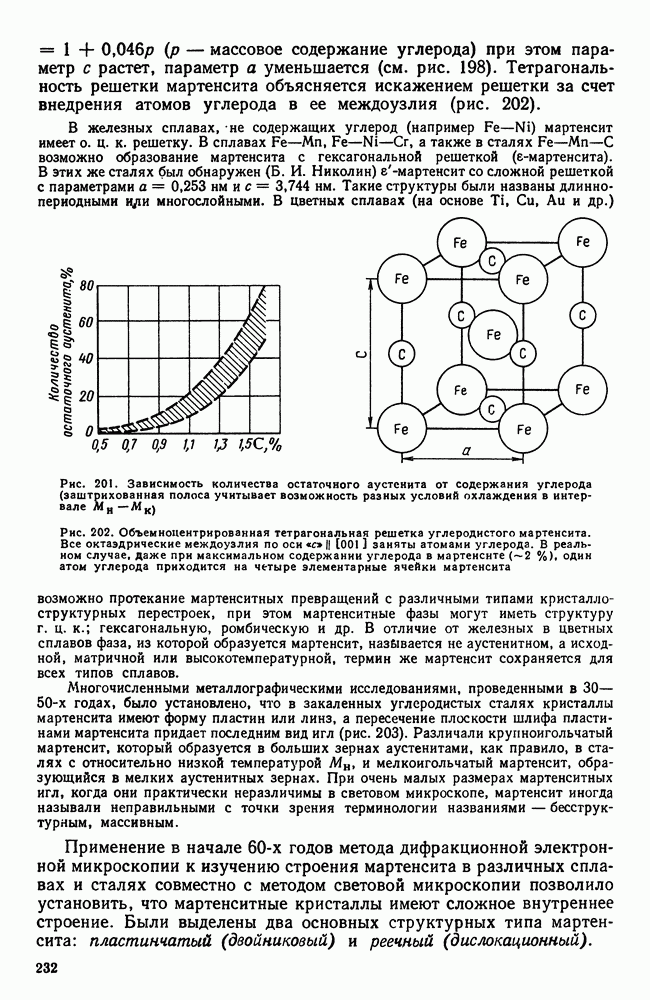
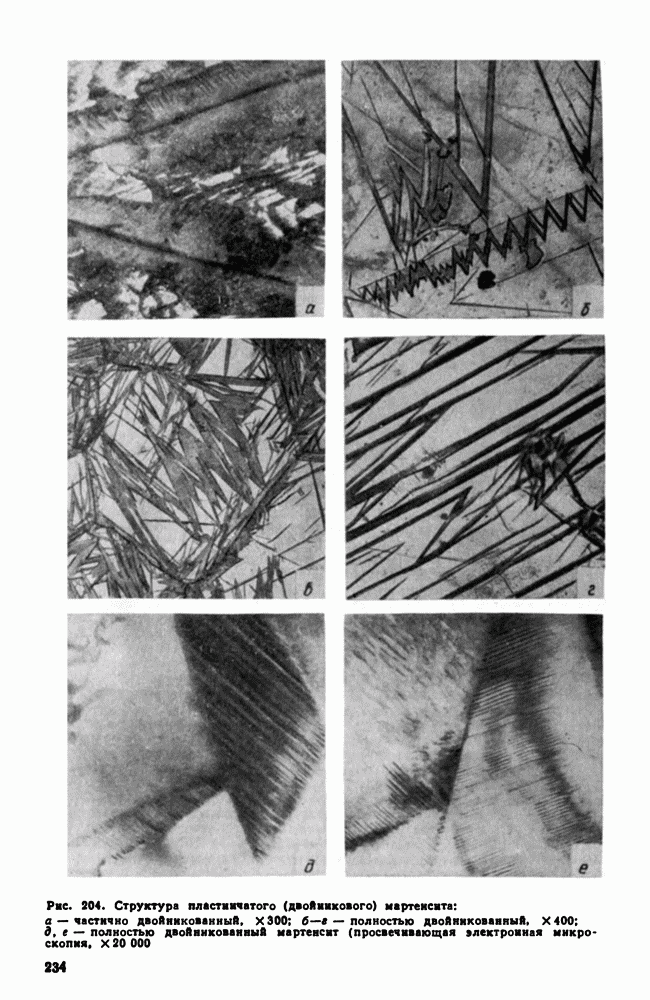
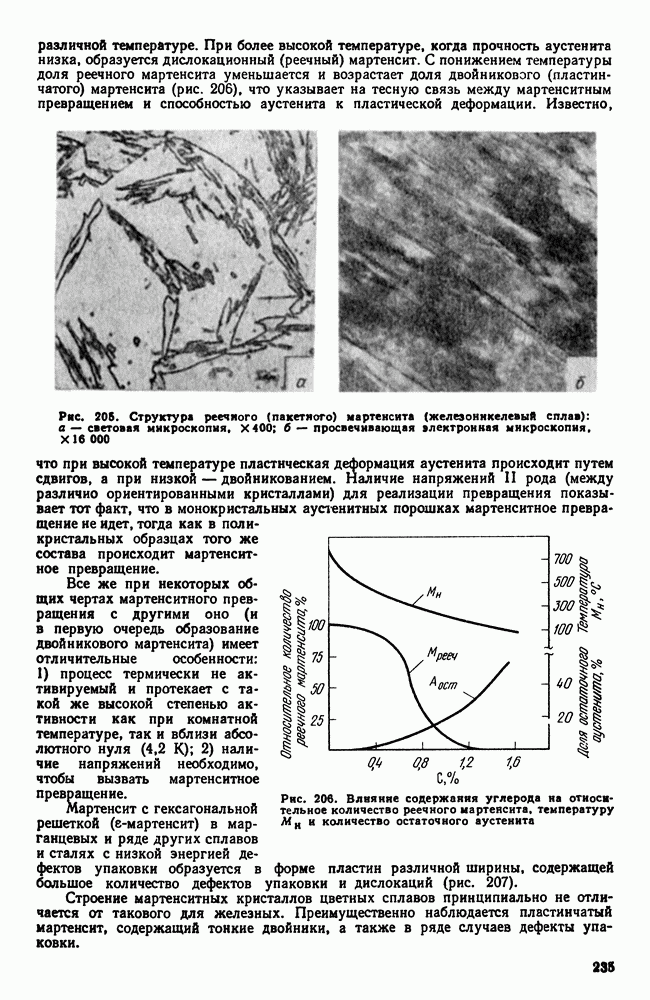
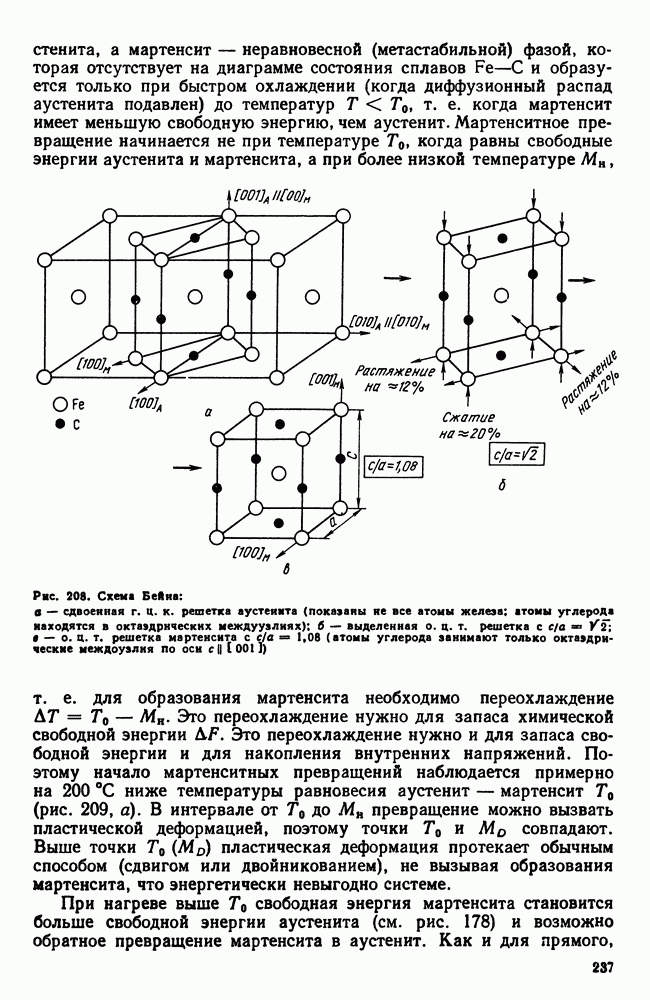
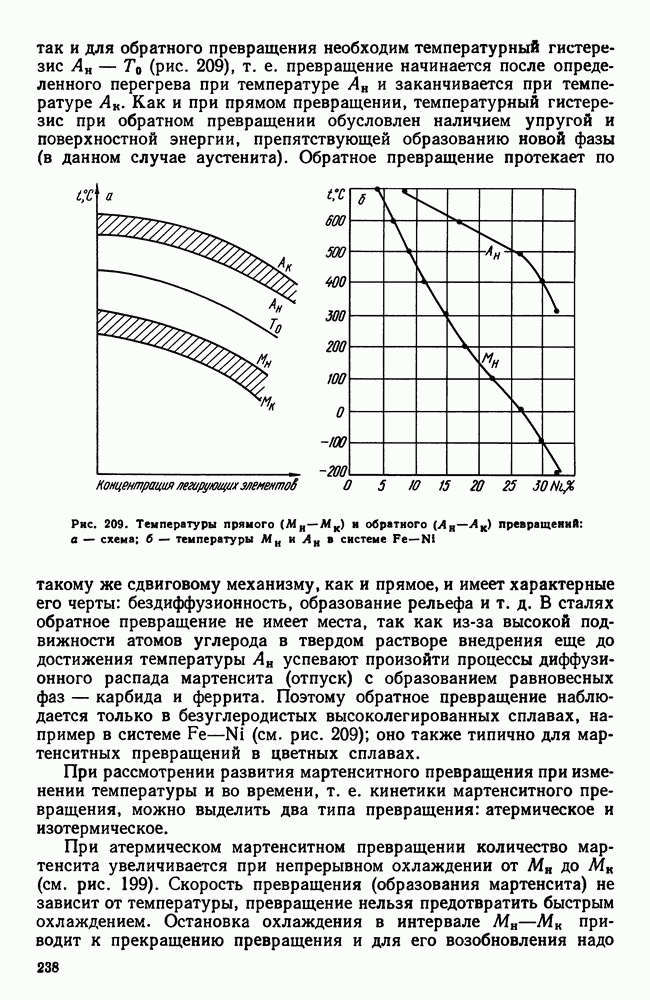
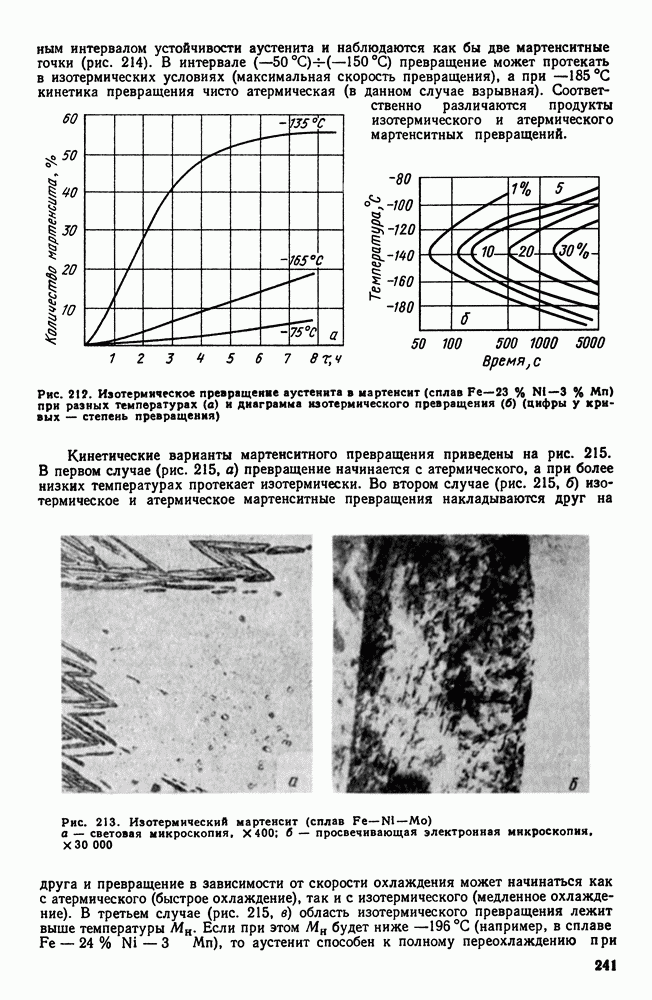
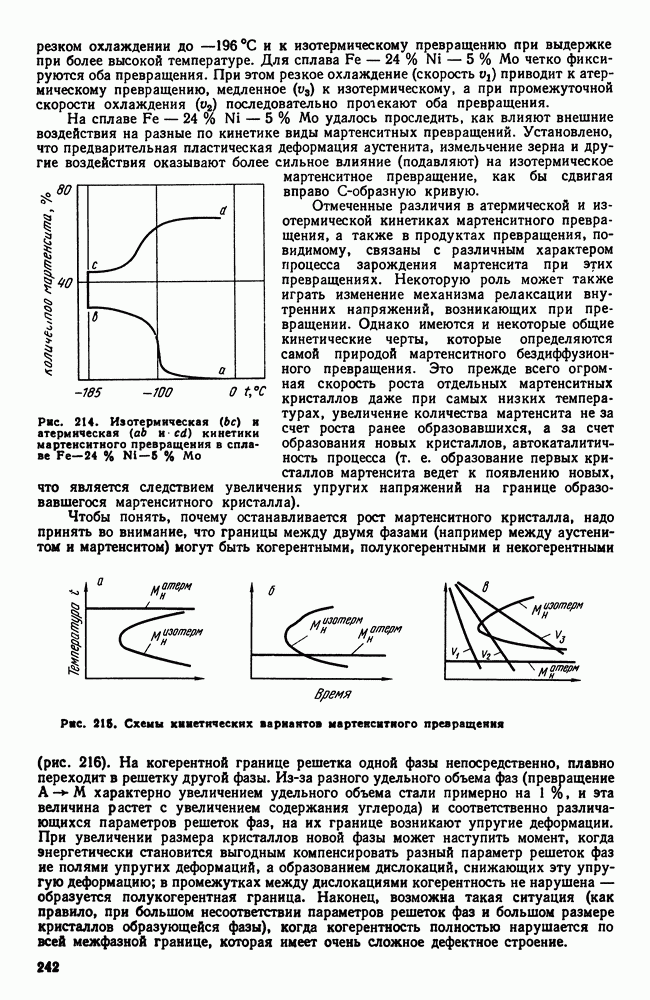
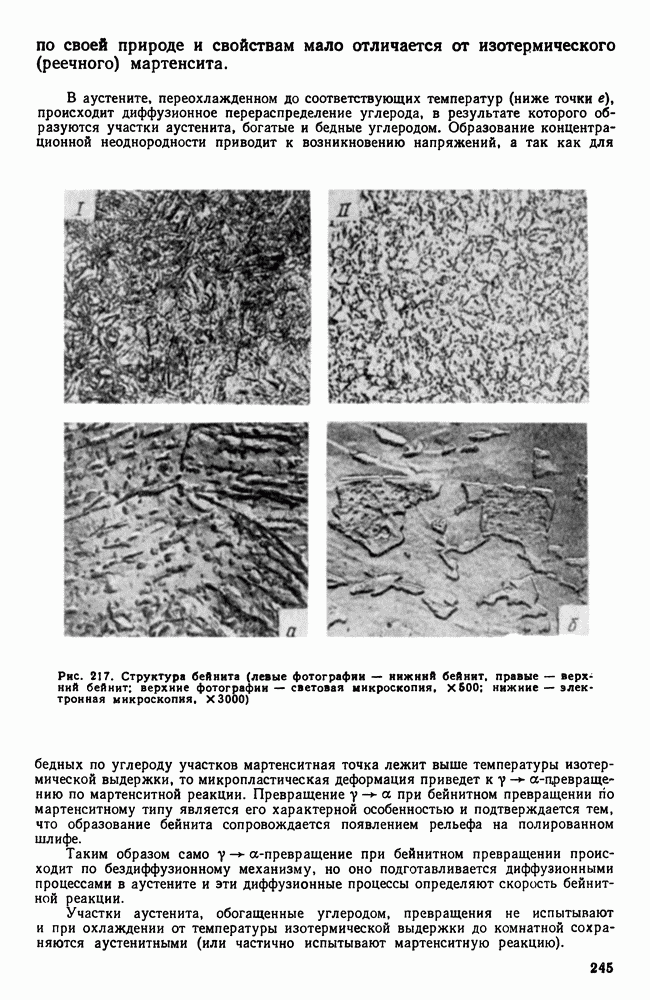
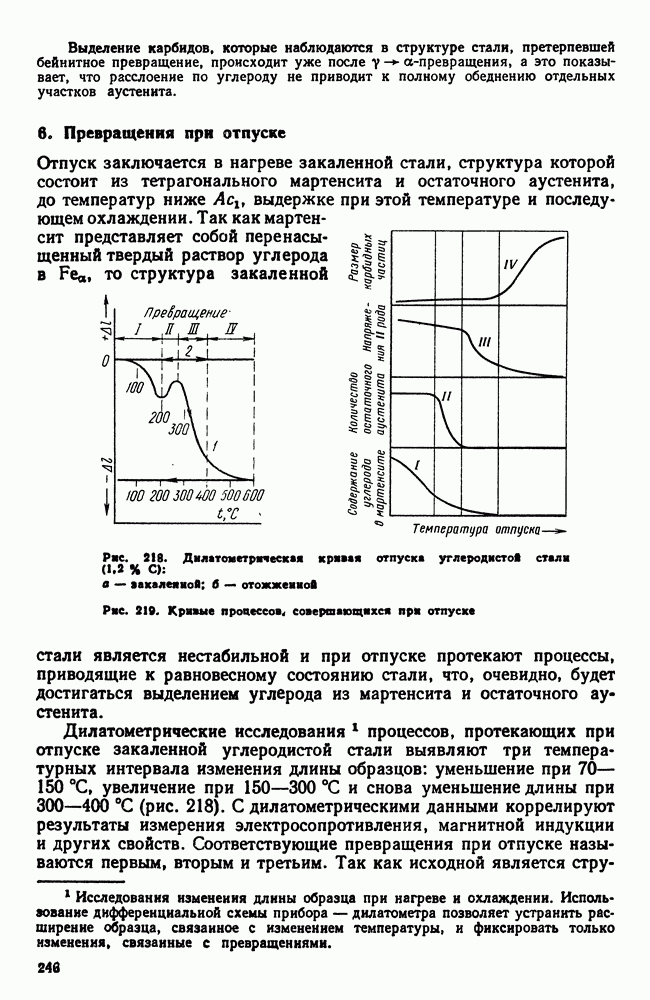
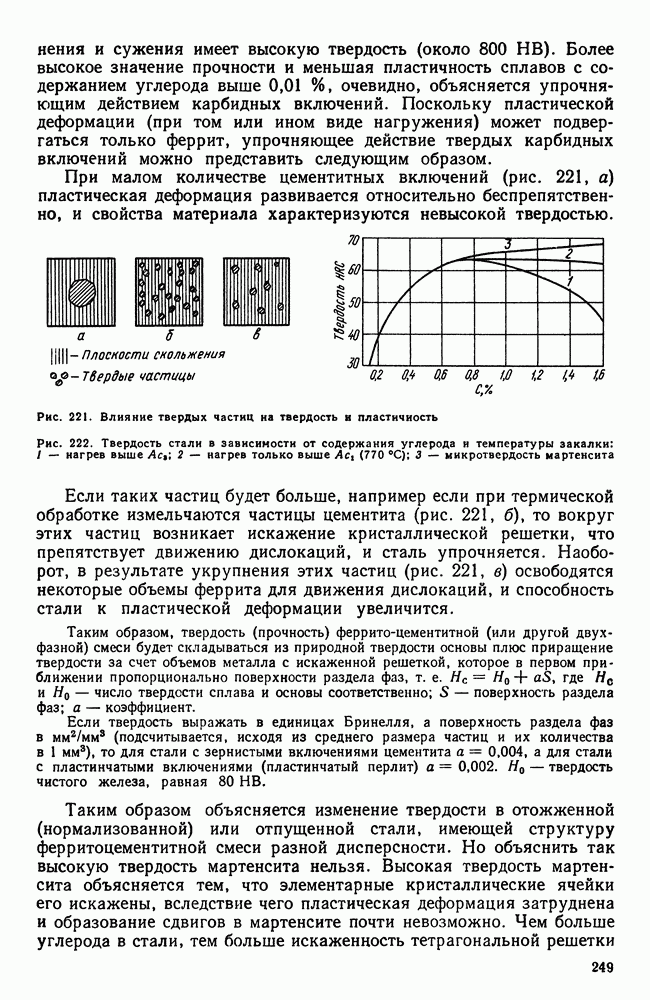
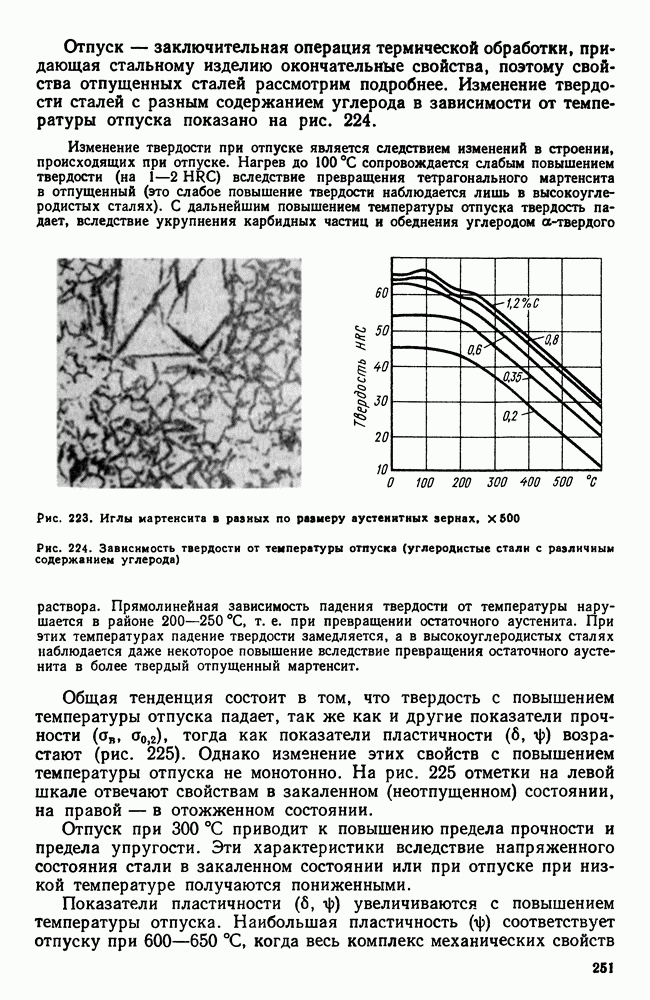
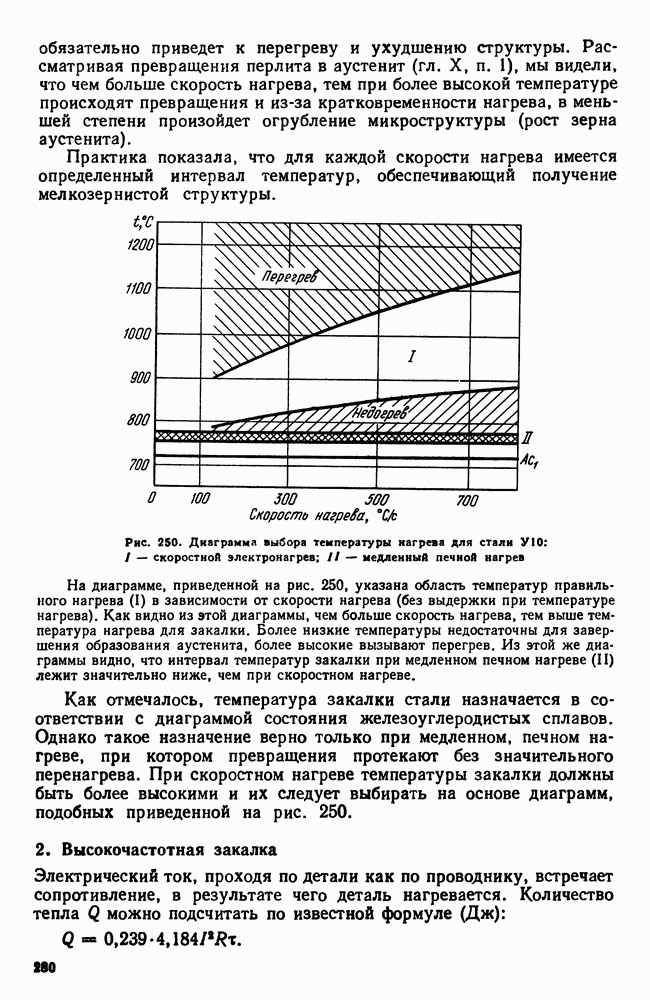
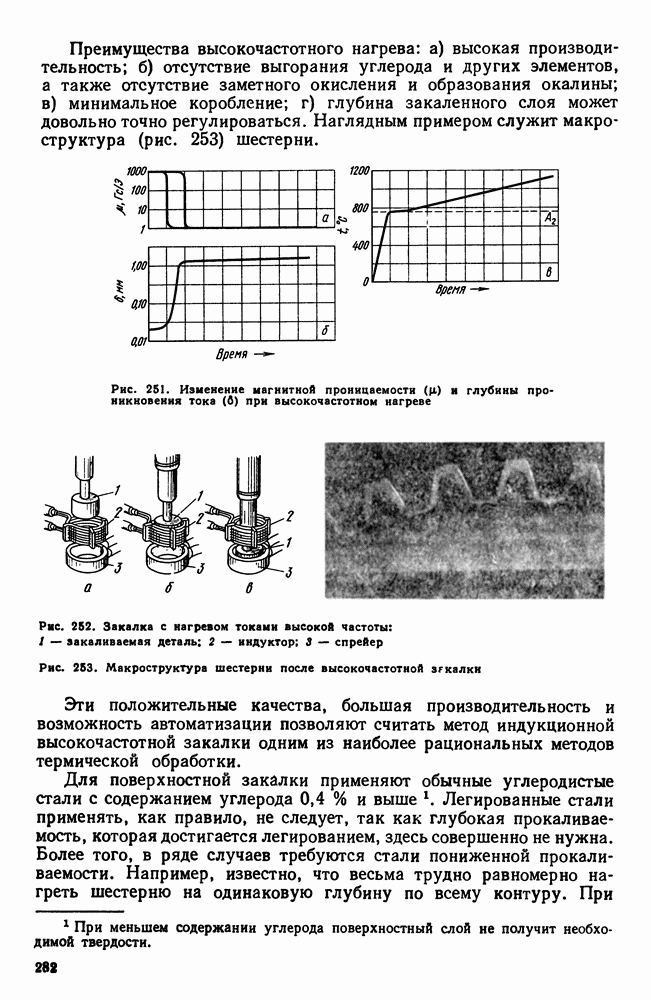
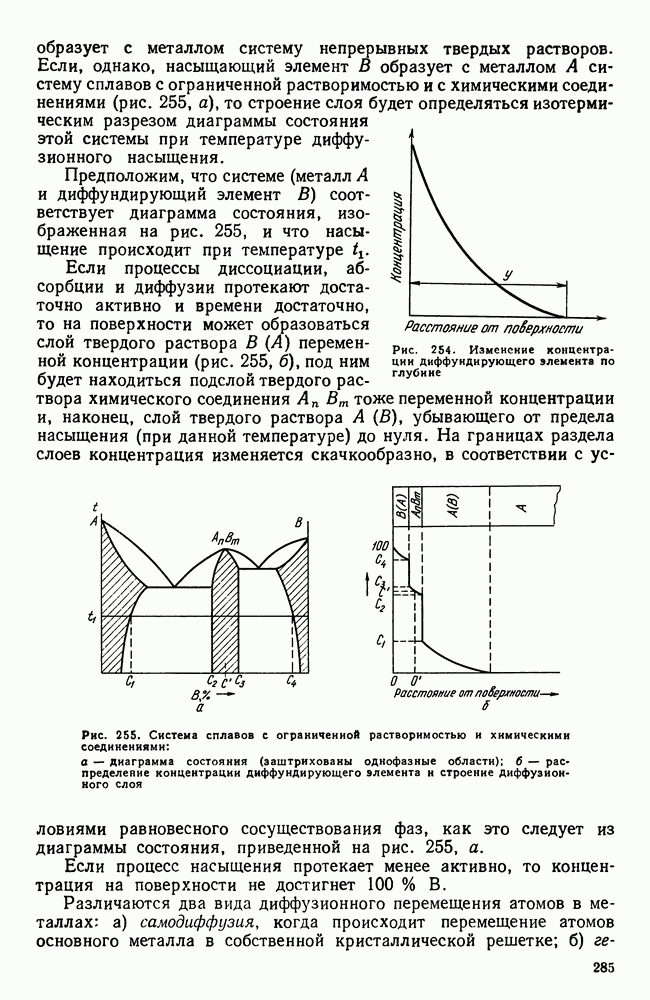
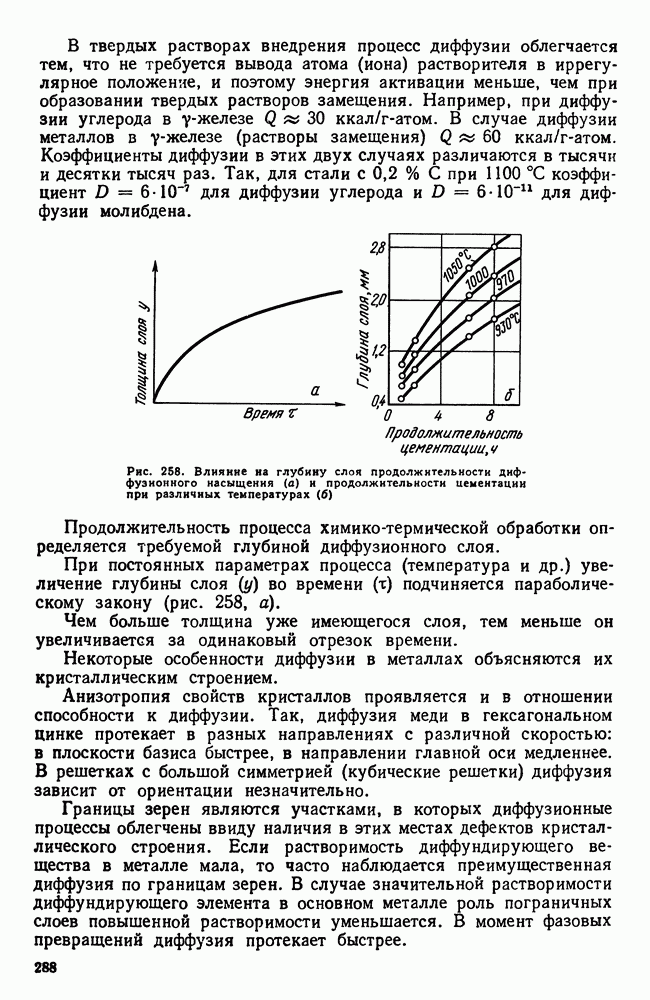
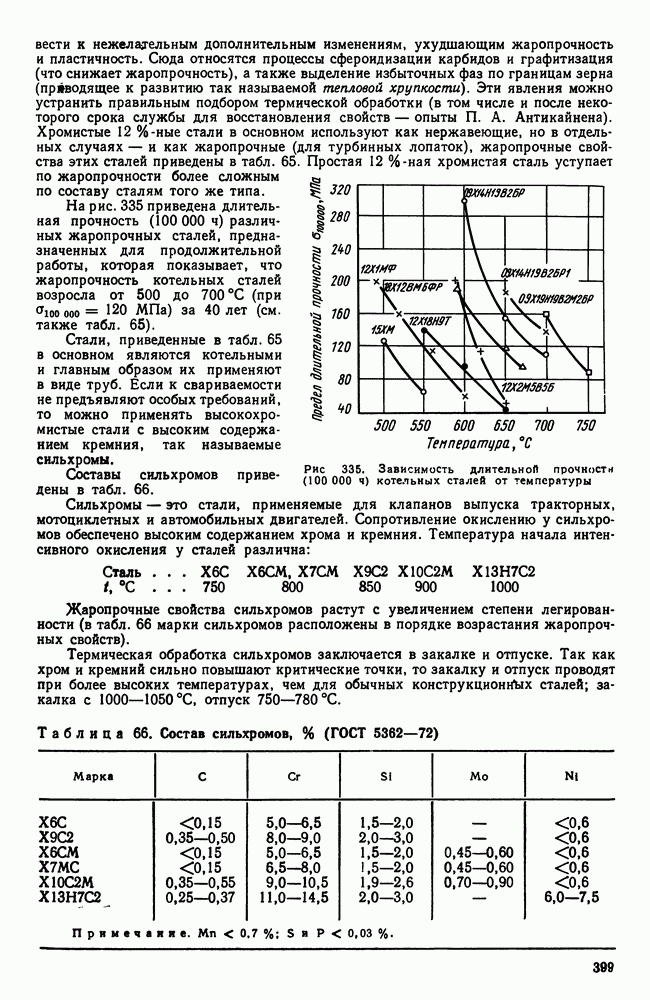
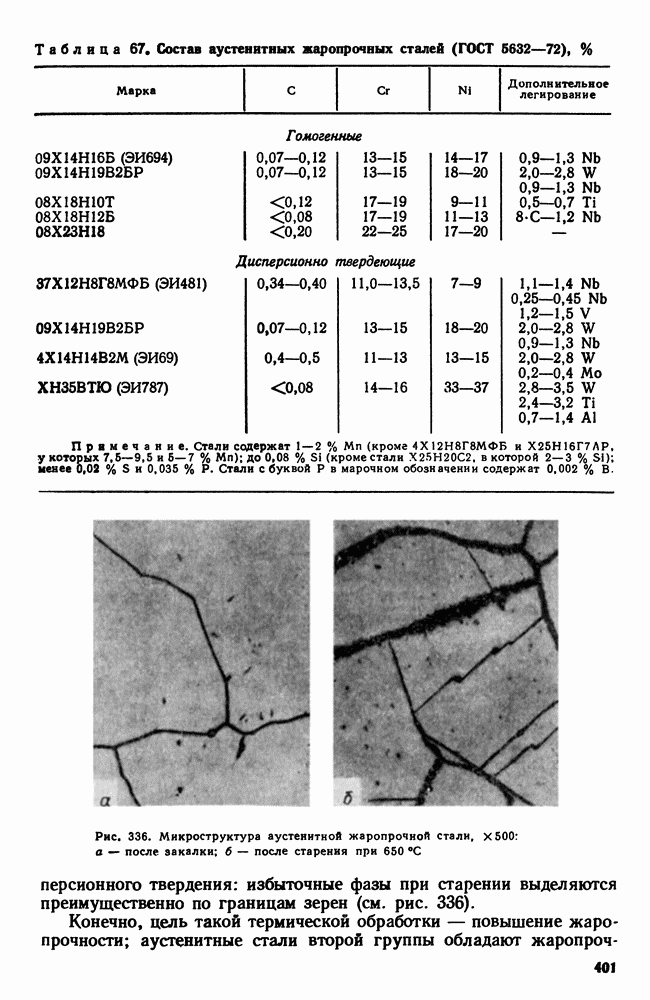
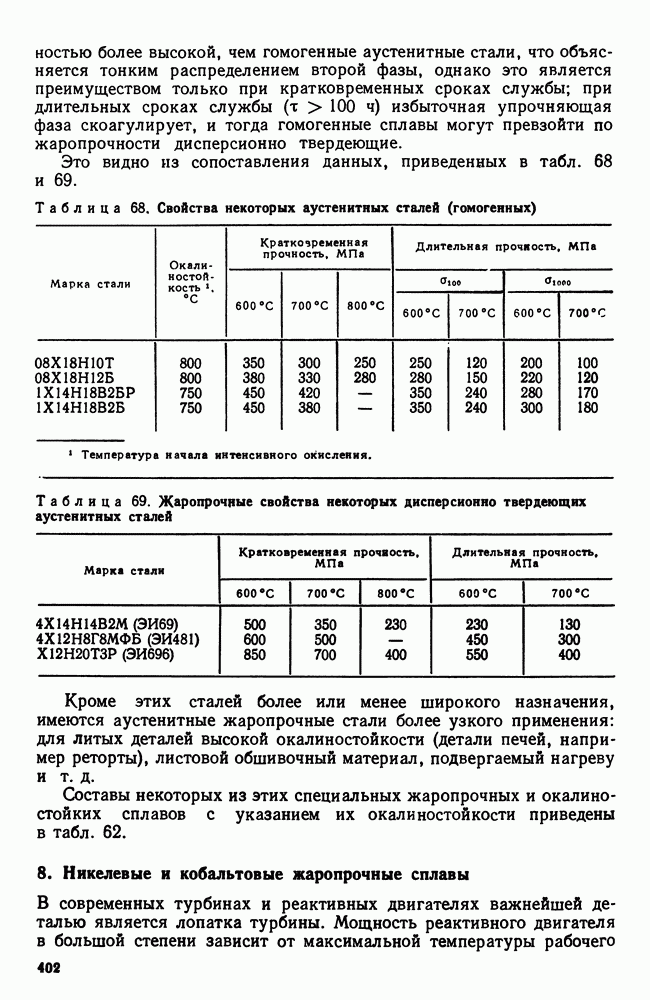
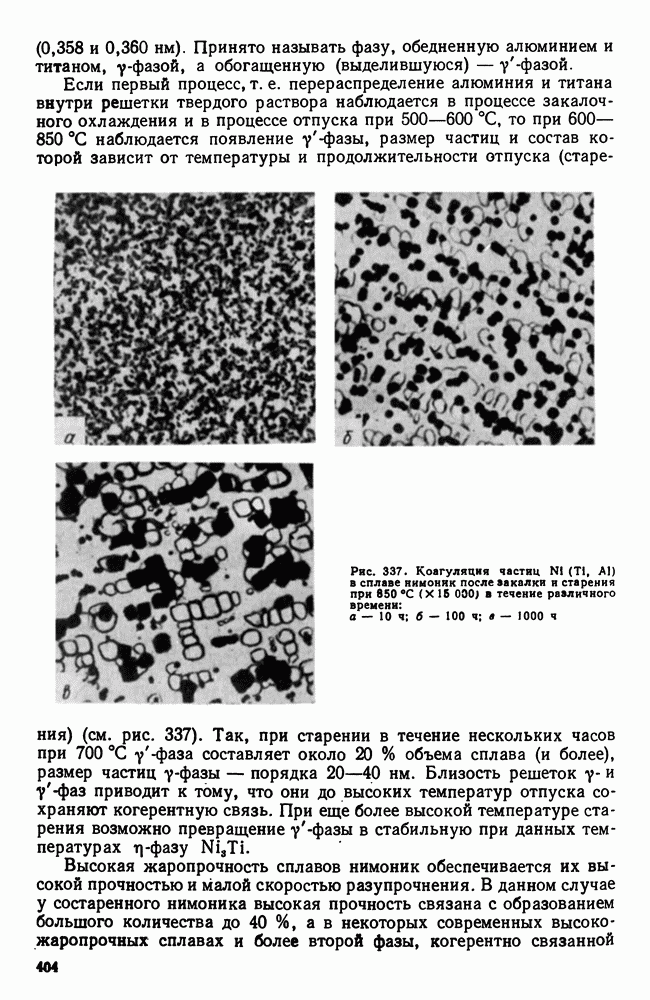
| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
3. Кристаллическое строение металлов
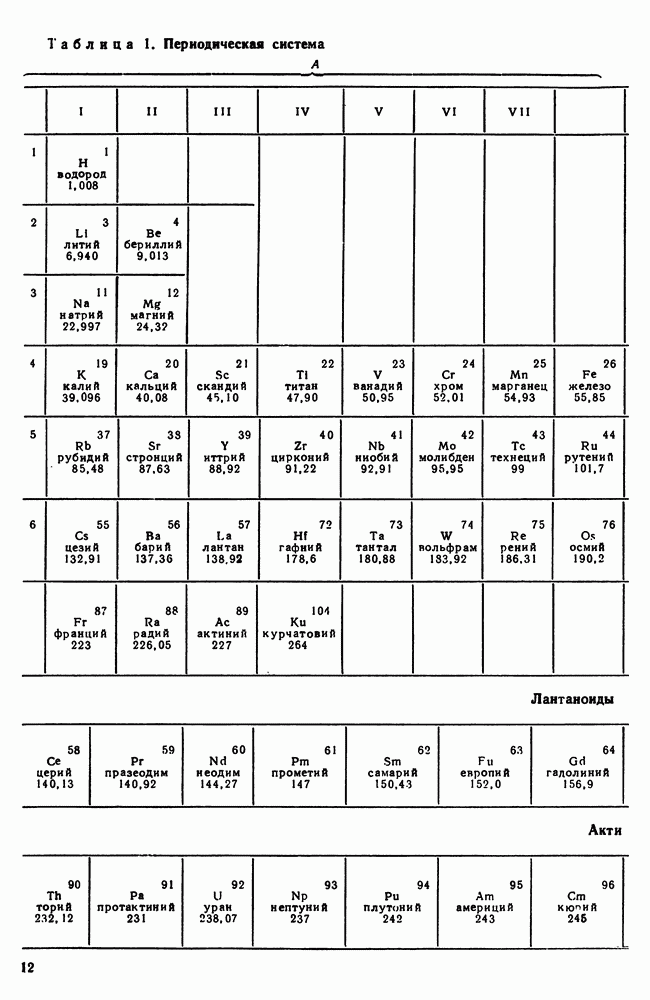
Все вещества могут находиться в трех агрегатных состояниях: твердом, жидком и газообразном, переходы между которыми (так называемые фазовые переходы) сопровождаются скачкообразными изменениями свободной энергии  где
где  — внутренняя энергия; Т — температура;
— внутренняя энергия; Т — температура;  — энтропия), энтропии, плотности и других физических свойств. Четвертым агрегатным состоянием часто называют плазму — сильно ионизированный газ (т. е. газ заряженных частиц — ионов, электронов), образующийся при высоких температурах (свыше 108 К). Однако это утверждение неточно, так как между плазмой и газом нет фазового перехода. Тем не менее, плазма резко отличается от газа прежде всего сильным электрическим взаимодействием ионов и электронов, проявляющимся на больших расстояниях.
— энтропия), энтропии, плотности и других физических свойств. Четвертым агрегатным состоянием часто называют плазму — сильно ионизированный газ (т. е. газ заряженных частиц — ионов, электронов), образующийся при высоких температурах (свыше 108 К). Однако это утверждение неточно, так как между плазмой и газом нет фазового перехода. Тем не менее, плазма резко отличается от газа прежде всего сильным электрическим взаимодействием ионов и электронов, проявляющимся на больших расстояниях.
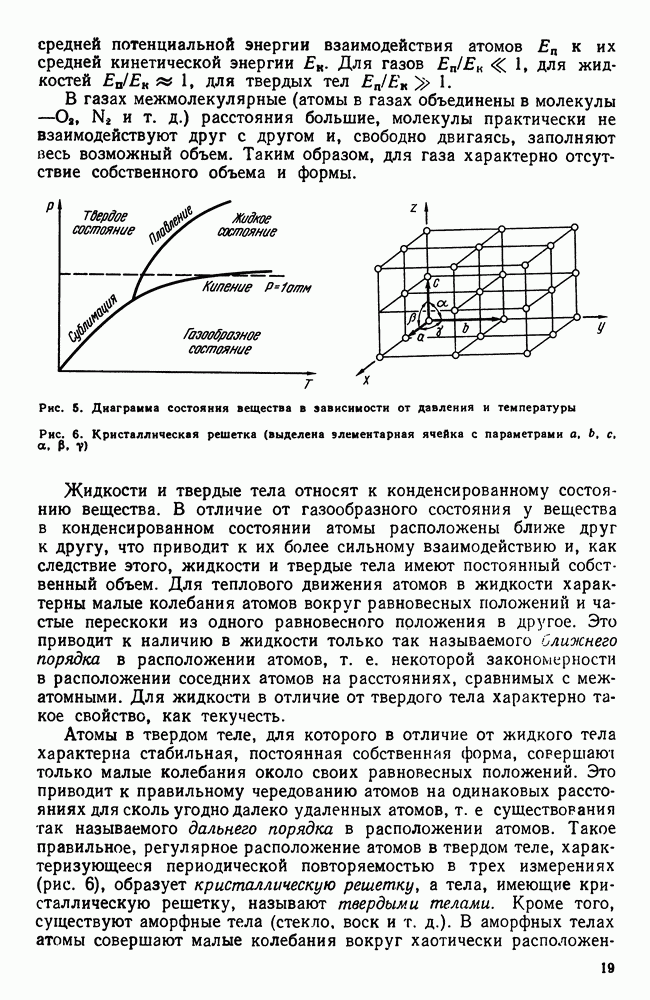
Реализация того или иного агрегатного состояния вещества зависит главным образом от температуры и давления, при которых оно находится (рис. 5). Важной характеристикой является отношение
средней потенциальной энергии взаимодействия атомов  к их средней кинетической энергии
к их средней кинетической энергии  Для газов
Для газов  , для жидкостей
, для жидкостей  Для твердых тел
Для твердых тел  .
.
В газах межмолекулярные (атомы в газах объединены в молекулы N, и т. д.) расстояния большие, молекулы практически не взаимодействуют друг с другом и, свободно двигаясь, заполняют весь возможный объем. Таким образом, для газа характерно отсутствие собственного объема и формы.

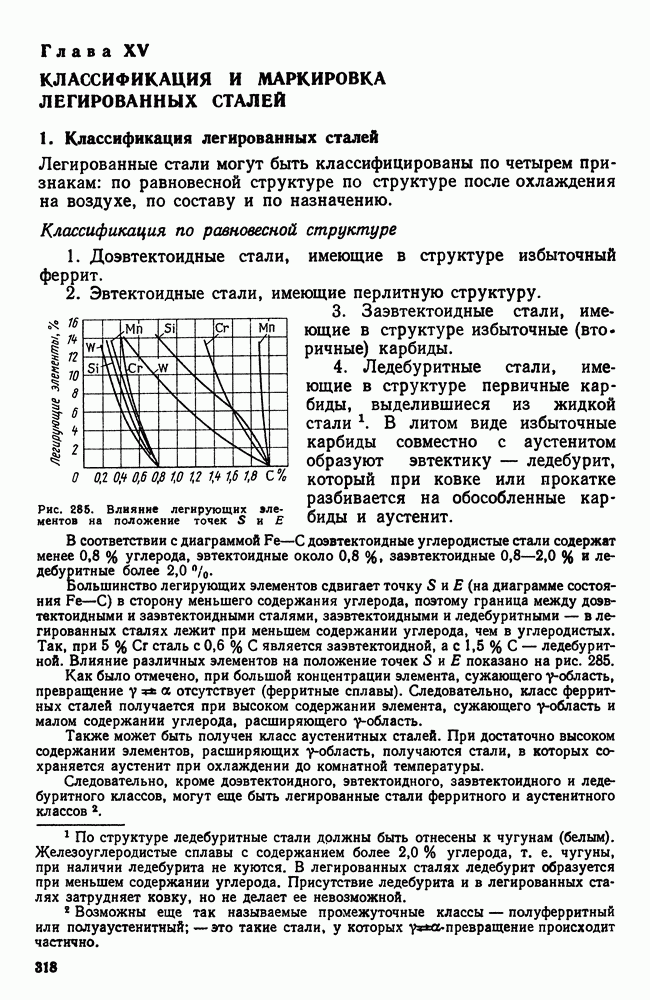
Рис. 5. Диаграмма состояния вещества в зависимости от давления и температуры

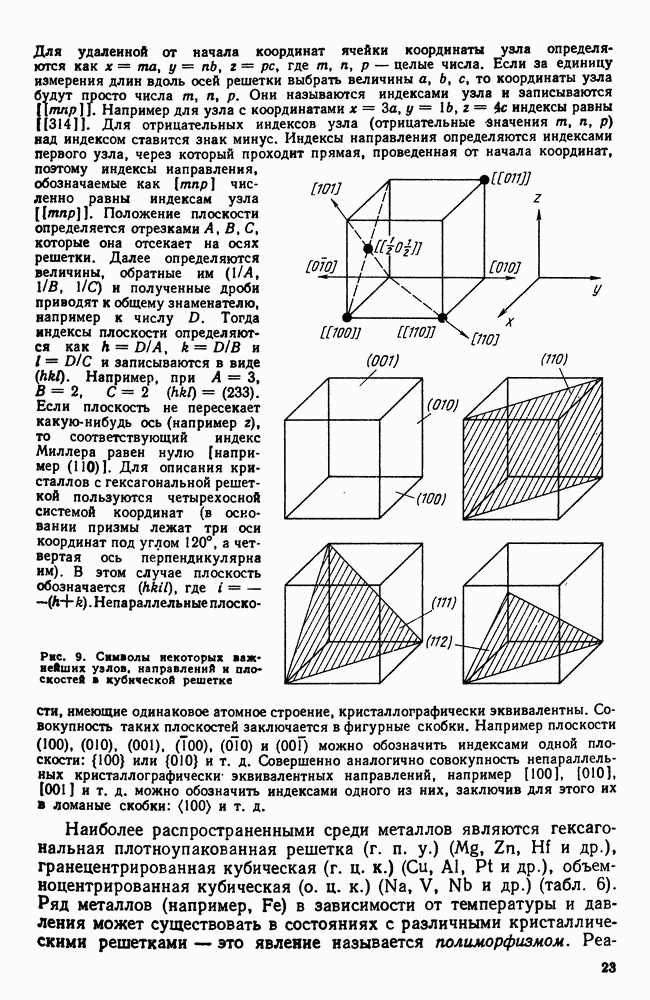
Рис. 6. Кристаллическая решетка (выделена элементарная ячейка с параметрами 
Жидкости и твердые тела относят к конденсированному состоянию вещества. В отличие от газообразного состояния у вещества в конденсированном состоянии атомы расположены ближе друг к другу, что приводит к их более сильному взаимодействию и, как следствие этого, жидкости и твердые тела имеют постоянный собственный объем. Для теплового движения атомов в жидкости характерны малые колебания атомов вокруг равновесных положений и частые перескоки из одного равновесного положения в другое. Это приводит к наличию в жидкости только так называемого ближнего порядка в расположении атомов, т. е. некоторой закономерности в расположении соседних атомов на расстояниях, сравнимых с межатомными. Для жидкости в отличие от твердого тела характерно такое свойство, как текучесть.
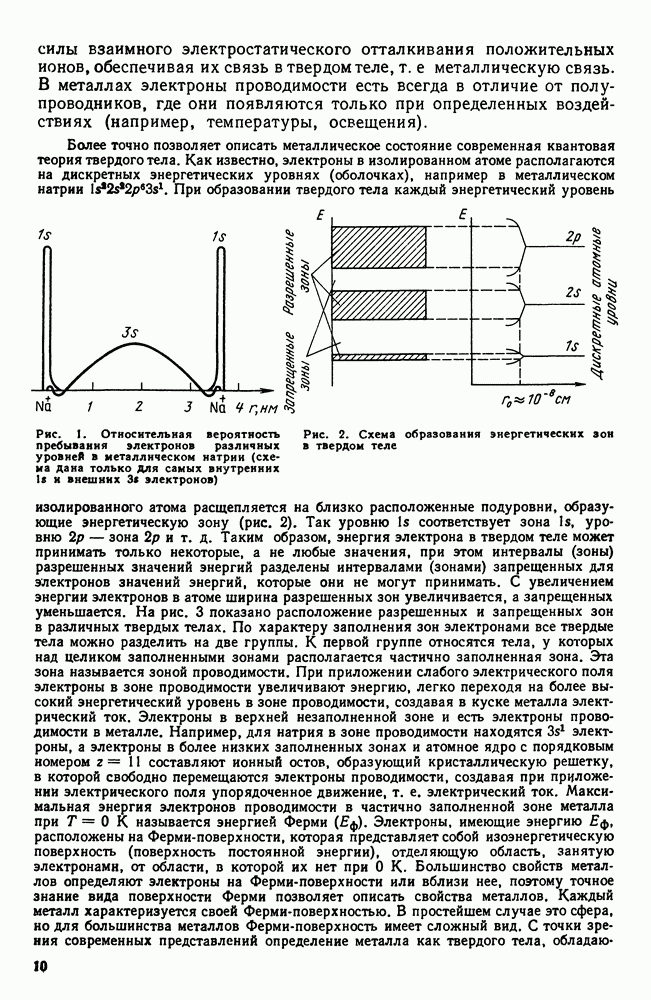
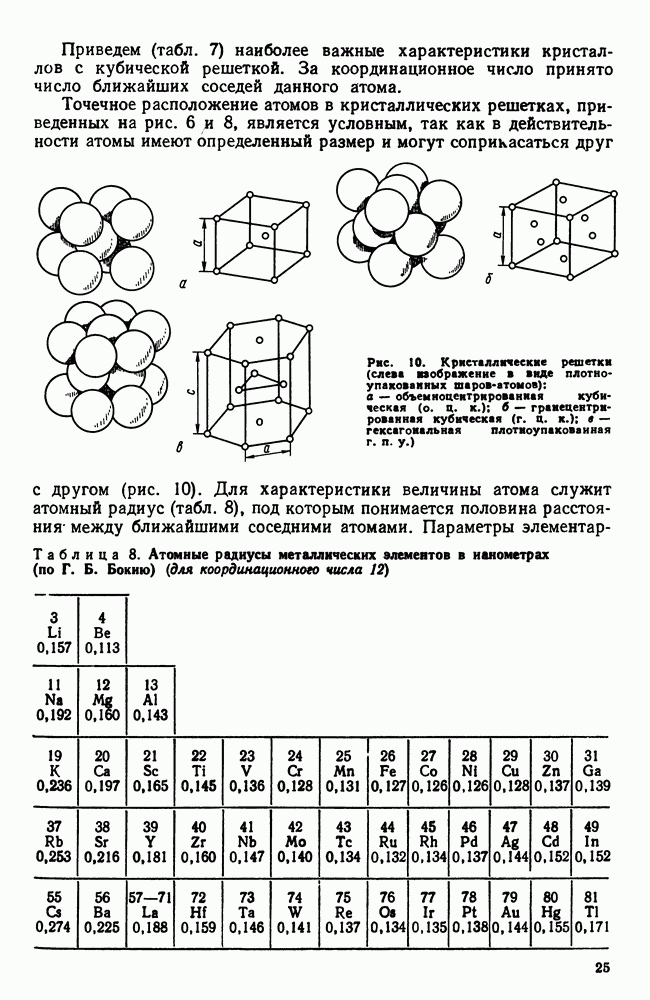
Атомы в твердом теле, для которого в отличие от жидкого тела характерна стабильная, постоянная собственная форма, совершают только малые колебания около своих равновесных положений. Это приводит к правильному чередованию атомов на одинаковых расстояниях для сколь угодно далеко удаленных атомов, т. е. существования так называемого дальнего порядка в расположении атомов. Такое правильное, регулярное расположение атомов в твердом теле, характеризующееся периодической повторяемостью в трех измерениях (рис. 6), образует кристаллическую решетку, а тела, имеющие кристаллическую решетку, называют твердыми телами. Кроме того, существуют аморфные тела (стекло, воск и т. д.). В аморфных телах атомы совершают малые колебания вокруг хаотически
расположенных равновесных положений, т. е. не образуют кристаллическую решетку. Аморфное тело находится с термодинамической точки зрения в неустойчивом (так называемом метастабильном) состоянии и его следует рассматривать как сильно загустевшую жидкость, которая с течением времени должна закристаллизоваться, т. е. атомы в твердом теле должны образовать кристаллическую решетку и превратиться в истинно твердое тело.
Для аморфного тела характерна изотропия свойств (одинаковые свойства по разным направлениям), а также отсутствие точки плавления, т. е. при повышении температуры аморфное тело размягчается Эти особенности вызваны отсутствием у аморфного тела дальнего порядка в расположении атомов, однако ближний порядок имеется. Таким образом, аморфное тело правильнее рассматривать как жидкость в переохлажденном, метастабильном состоянии с очень высоким коэффициентом вязкости.

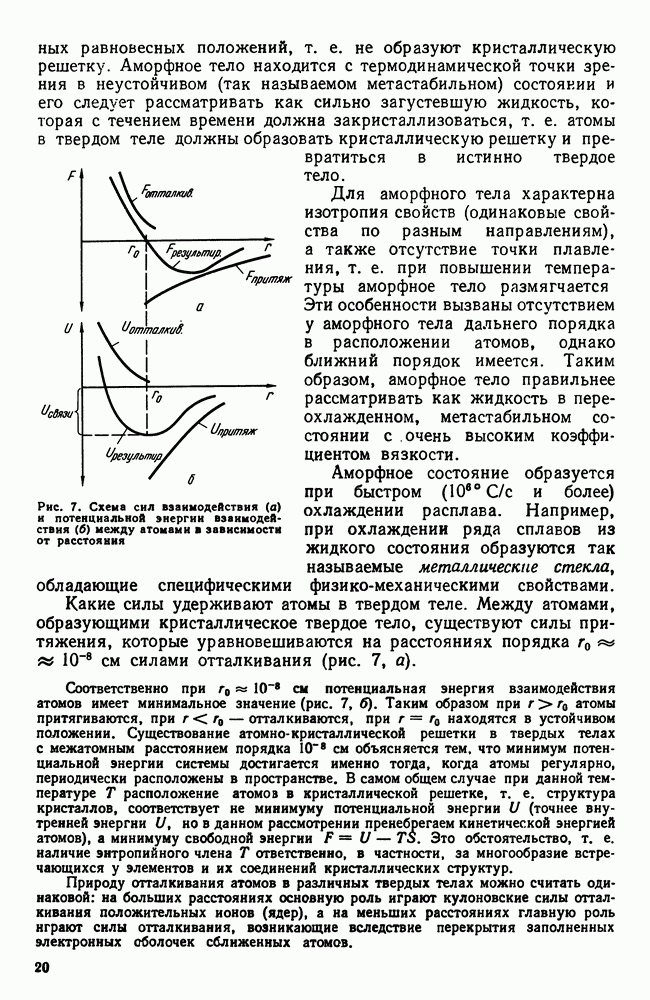
Рис. 7. Схема сил взаимодействия (а) и потенциальной энергии взаимодействия (б) между атомами в зависимости от расстояния
Аморфное состояние образуется при быстром  и более) охлаждении расплава. Например, при охлаждении ряда сплавов из жидкого состояния образуются так называемые металлические стекла, обладающие специфическими физико-механическими свойствами.
и более) охлаждении расплава. Например, при охлаждении ряда сплавов из жидкого состояния образуются так называемые металлические стекла, обладающие специфическими физико-механическими свойствами.
Какие силы удерживают атомы в твердом теле. Между атомами, образующими кристаллическое твердое тело, существуют силы притяжения, которые уравновешиваются на расстояниях порядка  см силами отталкивания (рис. 7, а).
см силами отталкивания (рис. 7, а).
Соответственно при  см потенциальная энергия взаимодействия атомов имеет минимальное значение (рис. 7, б). Таким образом при
см потенциальная энергия взаимодействия атомов имеет минимальное значение (рис. 7, б). Таким образом при  атомы притягиваются, при
атомы притягиваются, при  — отталкиваются, при
— отталкиваются, при  находятся в устойчивом положении. Существование атомно-кристаллической решетки в твердых телах с межатомным расстоянием порядка
находятся в устойчивом положении. Существование атомно-кристаллической решетки в твердых телах с межатомным расстоянием порядка  см объясняется тем, что минимум потенциальной энергии системы достигается именно тогда, когда атомы регулярно, периодически расположены в пространстве. В самом общем случае при данной температуре Т расположение атомов в кристаллической решетке, т. е. структура кристаллов, соответствует не минимуму потенциальной энергии
см объясняется тем, что минимум потенциальной энергии системы достигается именно тогда, когда атомы регулярно, периодически расположены в пространстве. В самом общем случае при данной температуре Т расположение атомов в кристаллической решетке, т. е. структура кристаллов, соответствует не минимуму потенциальной энергии  (точнее внутренней энергии
(точнее внутренней энергии  но в данном рассмотрении пренебрегаем кинетической энергией атомов), а минимуму свободной энергии
но в данном рассмотрении пренебрегаем кинетической энергией атомов), а минимуму свободной энергии  . Это обстоятельство, т. е. наличие энтропийного члена Т ответственно, в частности, за многообразие встречающихся у элементов и их соединений кристаллических структур.
. Это обстоятельство, т. е. наличие энтропийного члена Т ответственно, в частности, за многообразие встречающихся у элементов и их соединений кристаллических структур.
Природу отталкивания атомов в различных твердых телах можно считать одинаковой: на больших расстояниях основную роль играют кулоновские силы отталкивания положительных ионов (ядер), а на меньших расстояниях главную роль играют силы отталкивания, возникающие вследствие перекрытия заполненных электронных оболочек сближенных атомов.
Силы притяжения (силы связи) в твердых телах существенно отличаются по своей природе. Обычно рассматривают четыре основных типа связи в твердых телах: металлическую, ионную, ковалентную и связь Ван-дер-Ваальса. В большинстве случаев связи в твердых телах носят смешанный характер. В металлах и сплавах определяющее значение имеет металлический тип связи. Связь в металлах обусловлена взаимодействием положительных ионов с коллективизированными электронами. Свободные электроны проводимости, находясь между ионами, как бы «стягивают» их, компенсируя силы отталкивания. У ряда металлов (например, переходных) определенный вклад вносит также ковалентная связь, при которой объединяются два атома, временно передающие друг другу валентный электрон и удерживаемые поэтому силами электростатического притяжения. При ионной связи соседние атомы уже постоянно обменялись электронами.
| << Предыдущий параграф | Следующий параграф >> |
- ПРЕДИСЛОВИЕ
- Часть первая. ТЕОРИЯ СПЛАВОВ
- Глава I. КРИСТАЛЛИЧЕСКОЕ СТРОЕНИЕ МЕТАЛЛОВ
- 2. Классификация металлов
- 3. Кристаллическое строение металлов
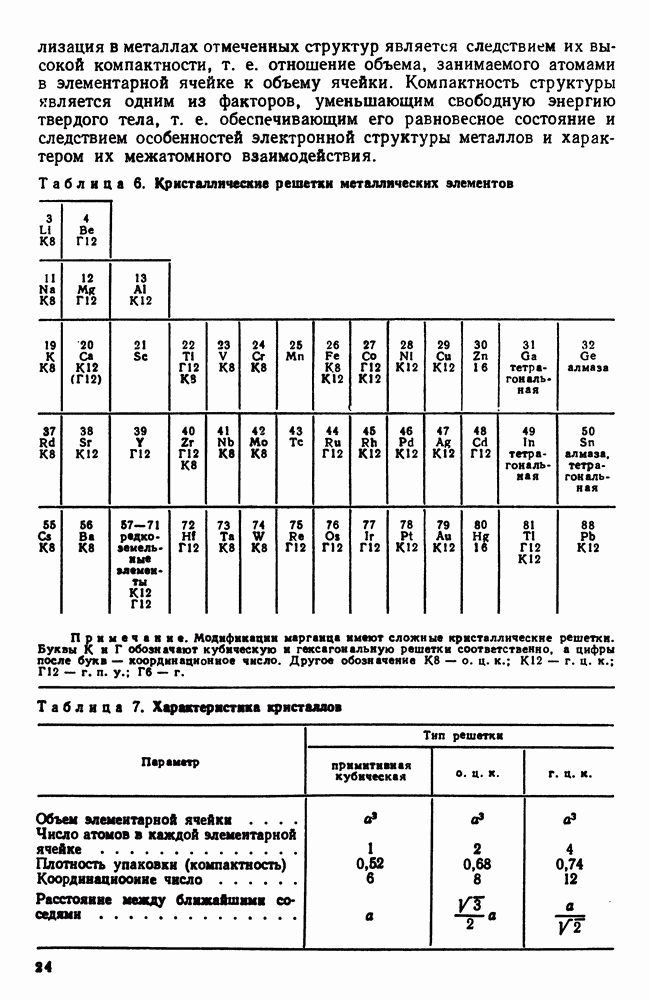
- 4. Кристаллические решетки металлов
- 5. Реальное строение металлических кристаллов
- 6. Анизотропия свойств кристаллов
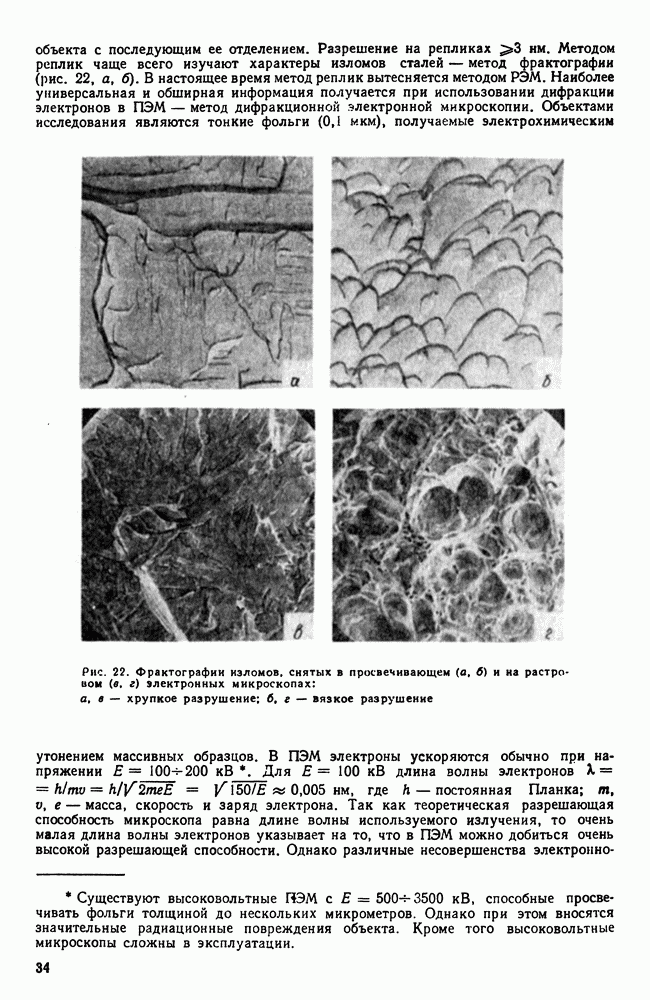
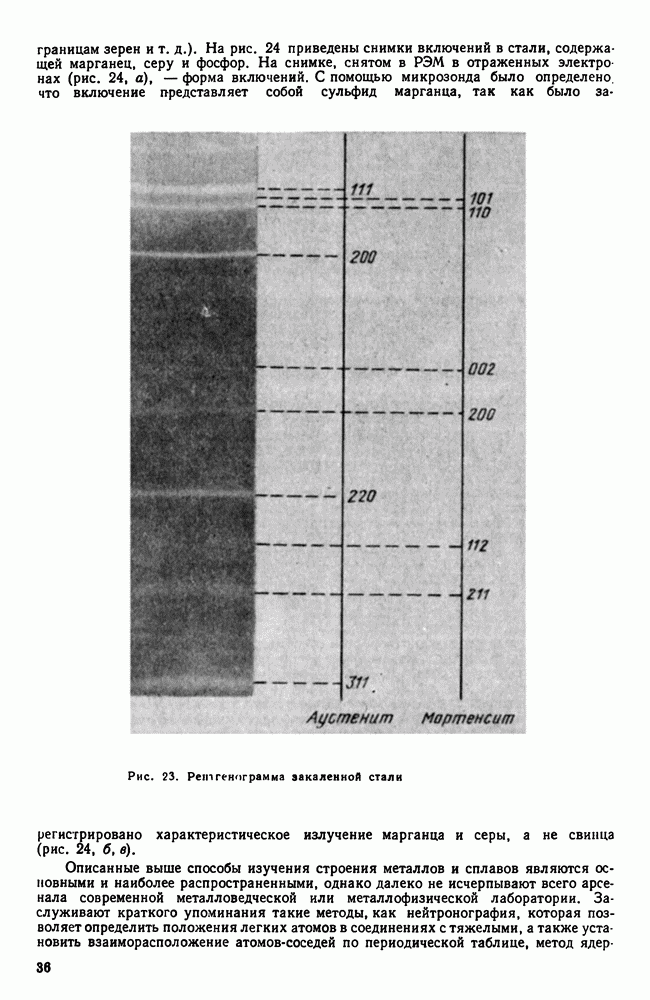
- 7. Методы изучения строения металлов
- Глава II. КРИСТАЛЛИЗАЦИЯ
- 1. Три состояния вещества
- 2. Энергетические условия процесса кристаллизации
- 3. Механизм процесса кристаллизации
- 4. Форма кристаллических образований
- 5. Строение слитка
- 6. Превращения в твердом состояние. Полиморфизм
- 7. Магнитные превращения
- 8. Закалка из жидкого состояния. Аморфное состояние
- Глава III. МЕХАНИЧЕСКИЕ СВОЙСТВА. НАКЛЕП И РЕКРИСТАЛЛИЗАЦИЯ
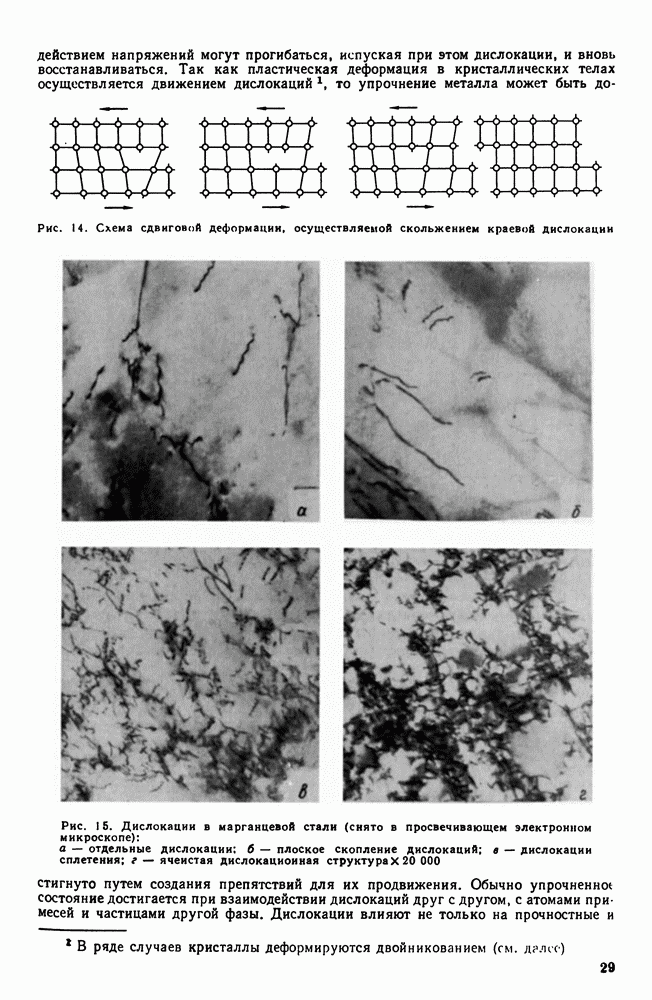
- 2. Упругая и пластическая деформация. Несовершенства решетки и прочность металлов
- 3. Сверхпластичность
- 4. Разрушение
- 5. Методы определения механических свойств
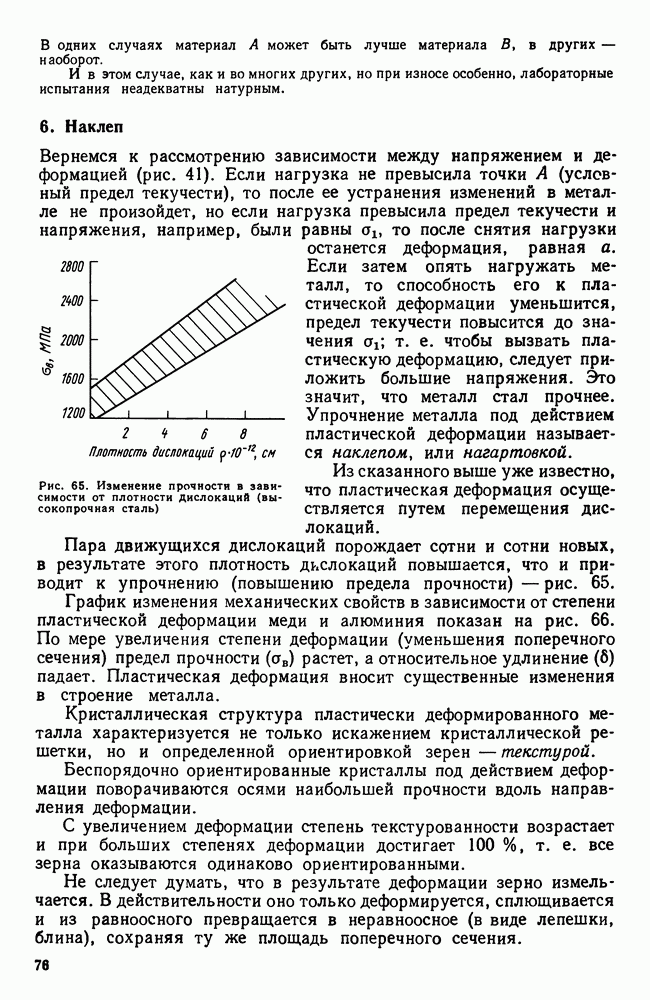
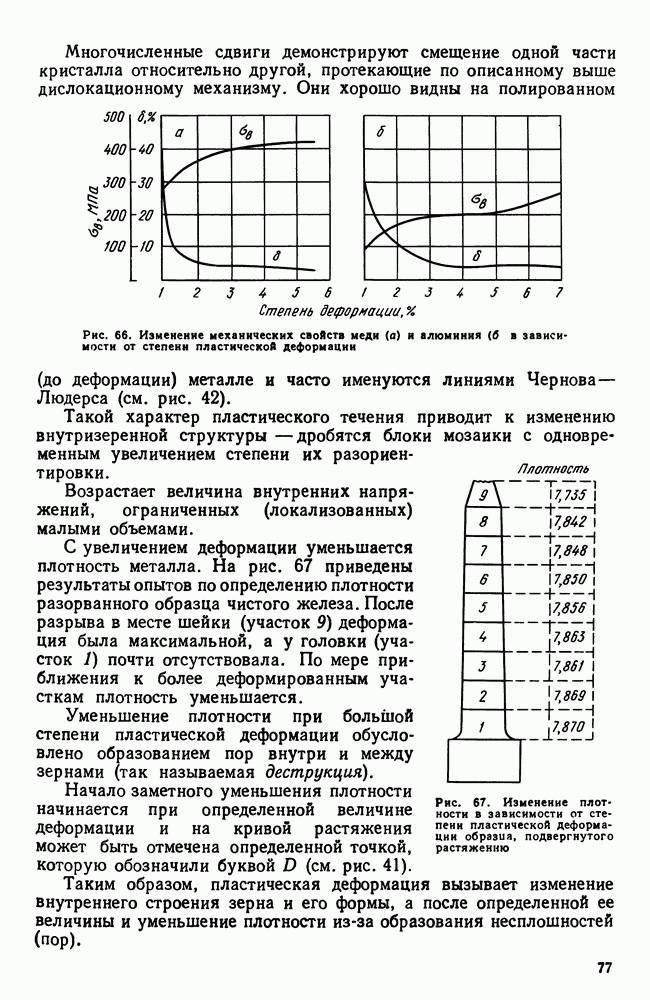
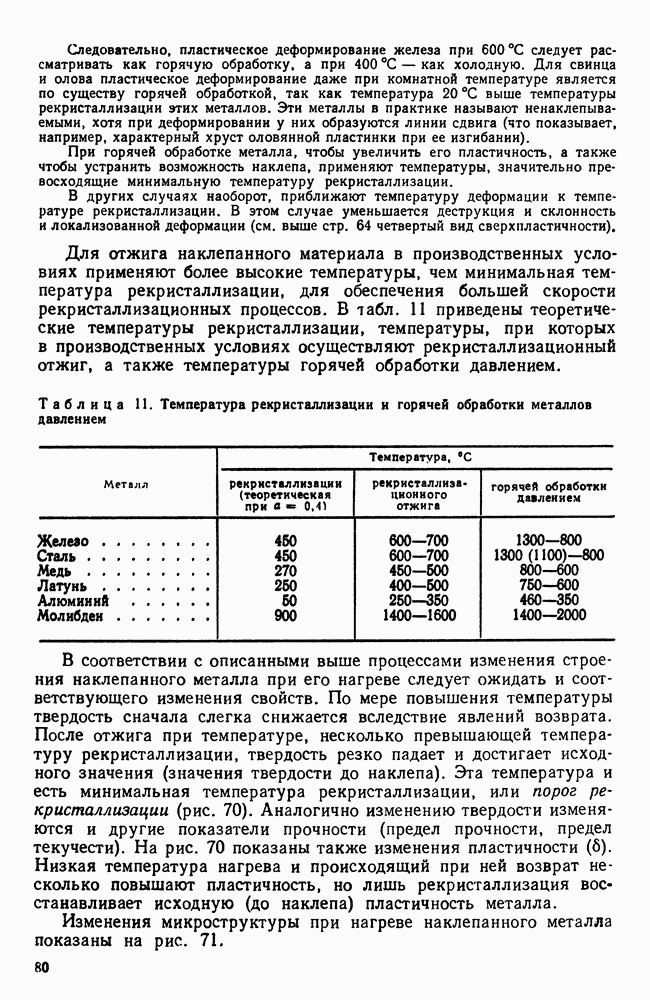
- 6. Наклеп
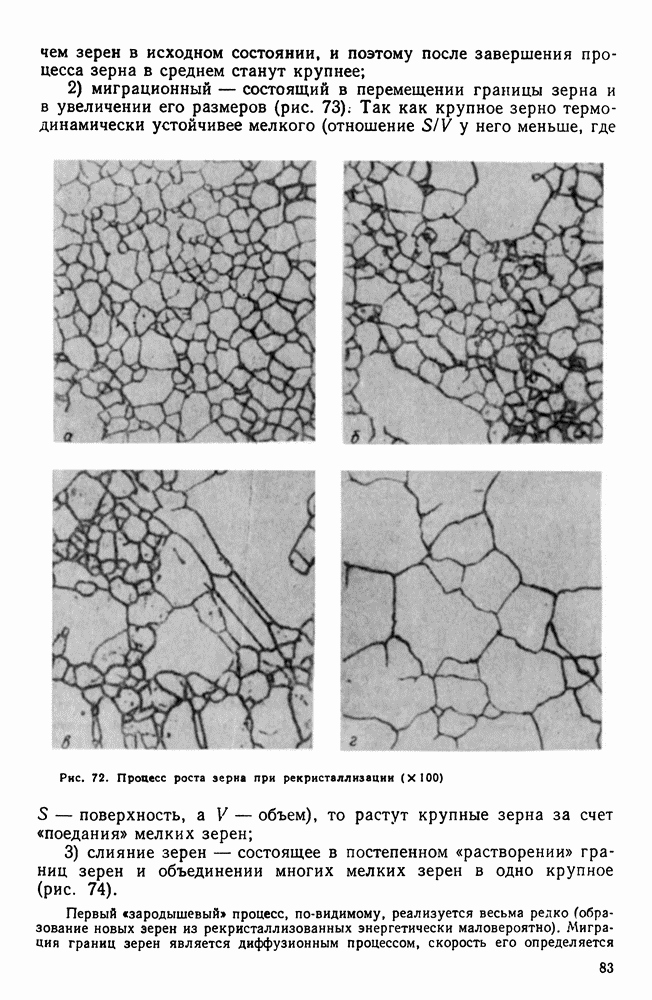
- 7. Влияние нагрева на строение и свойства деформированного металла (рекристаллизационные процессы)
- Глава IV. СТРОЕНИЕ СПЛАВОВ
- 2. Химическое соединение
- 3. Твердый раствор на основе одного из компонентов сплава
- 4. Твердый раствор на основе химического соединения
- 5. Упорядоченные твердые растворы
- 6. Электронные соединения (фазы Юм-Розери)
- 7. Фазы Лавеса
- 8. Фазы внедрения
- Глава V. ДИАГРАММА СОСТОЯНИЯ
- 2. Общие замечания о построении диаграмм состояния
- 3. Экспериментальное построение диаграмм
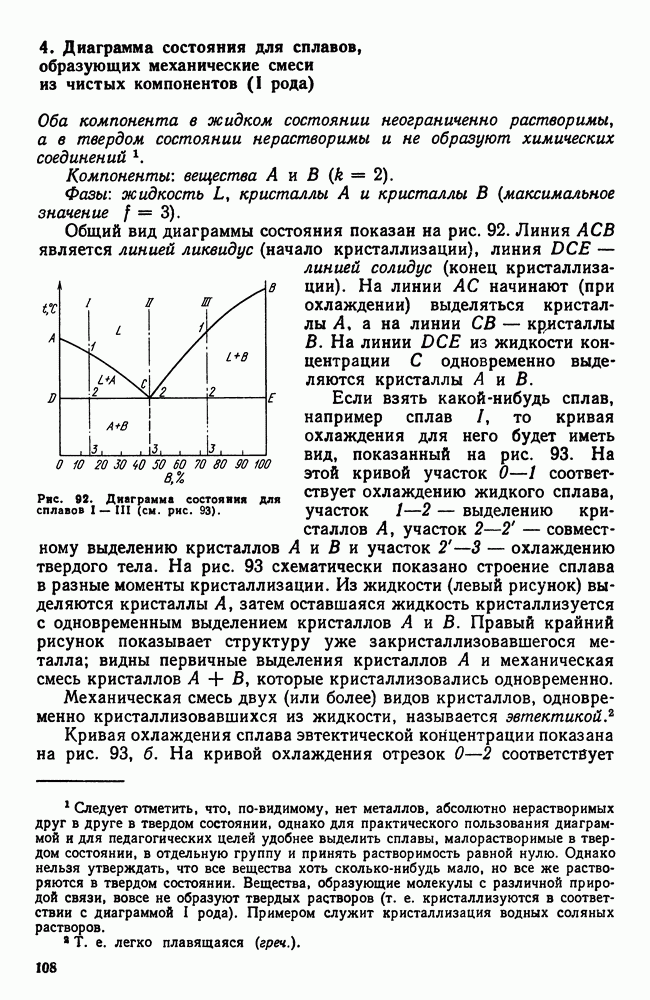
- 4. Диаграмма состояния для сплавов, образующих механические смеси из чистых компонентов (I рода)
- 5. Правило отрезков
- 6. Диаграмма состояния для сплавов с неограниченной растворимостью в твердом состоянии (II рода)
- 7. Диаграмма состояния для сплавов с ограниченной растворимостью в твердом состоянии (III рода)
- 8. Диаграмма состояния для сплавов, образующих химические соединения (IV рода)
- 9. Диаграмма состояния для сплавов, испытывающих полиморфные превращения
- 10. Кристаллизация сплавов в неравновесных условиях
- 11. Системы с тремя компонентами
- 12. Упрощенные методы изучения многокомпонентных систем
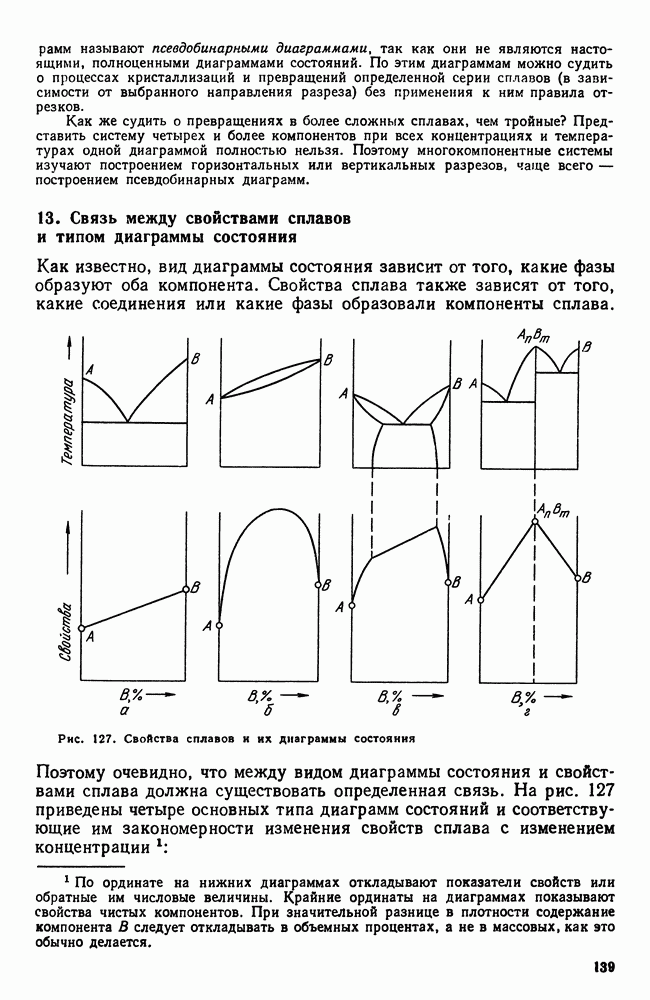
- 13. Связь между свойствами сплавов и типом диаграммы состояния
- Часть вторая. ЖЕЛЕЗОУГЛЕРОДИСТЫЕ СПЛАВЫ
- Глава VI. ДИАГРАММА ЖЕЛЕЗО—УГЛЕРОД
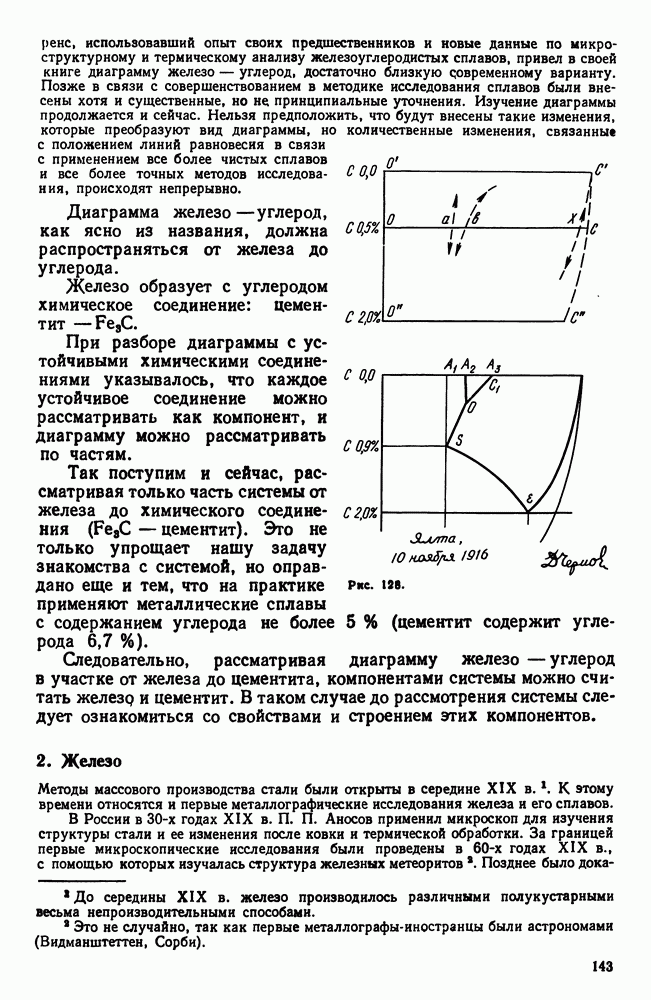
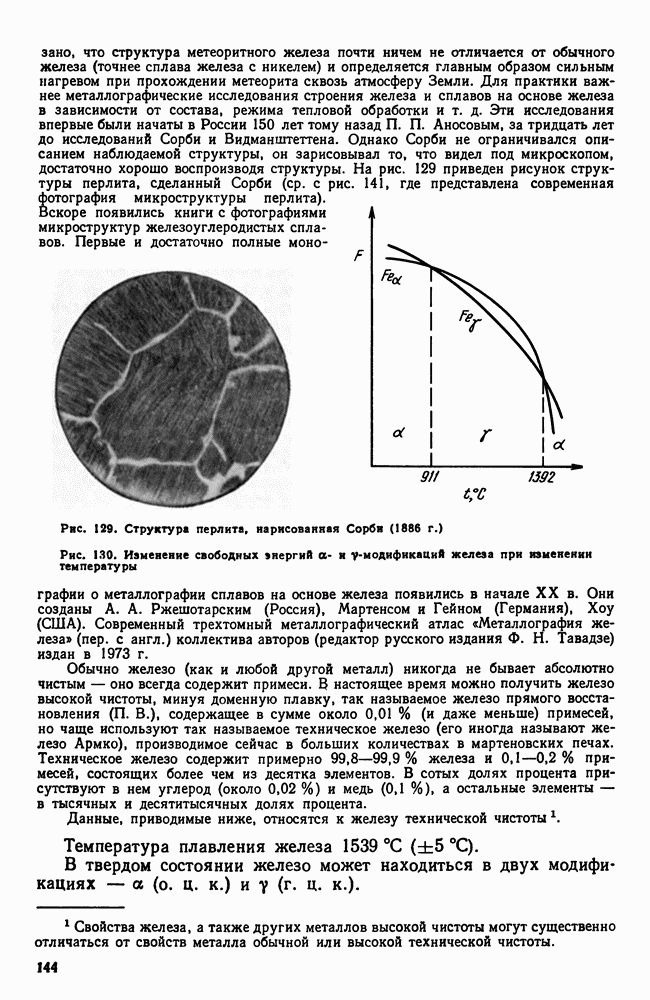
- 2. Железо
- 3. Цементит
- 4. Диаграмма состояния
- Глава VII. УГЛЕРОДИСТЫЕ СТАЛИ
- 1. Влияние углерода на свойства стали
- 2. Влияние постоянных примесей на свойства стали
- 3. Сталь различных способов производства. Чистая сталь
- 4. Углеродистая сталь общего назначения
- 5. Нагартованная сталь
- 6. Листовая сталь для холодной штамповки
- 7. Обрабатываемость резанием. Автоматные стали
- Глава VIII. ЧУГУН
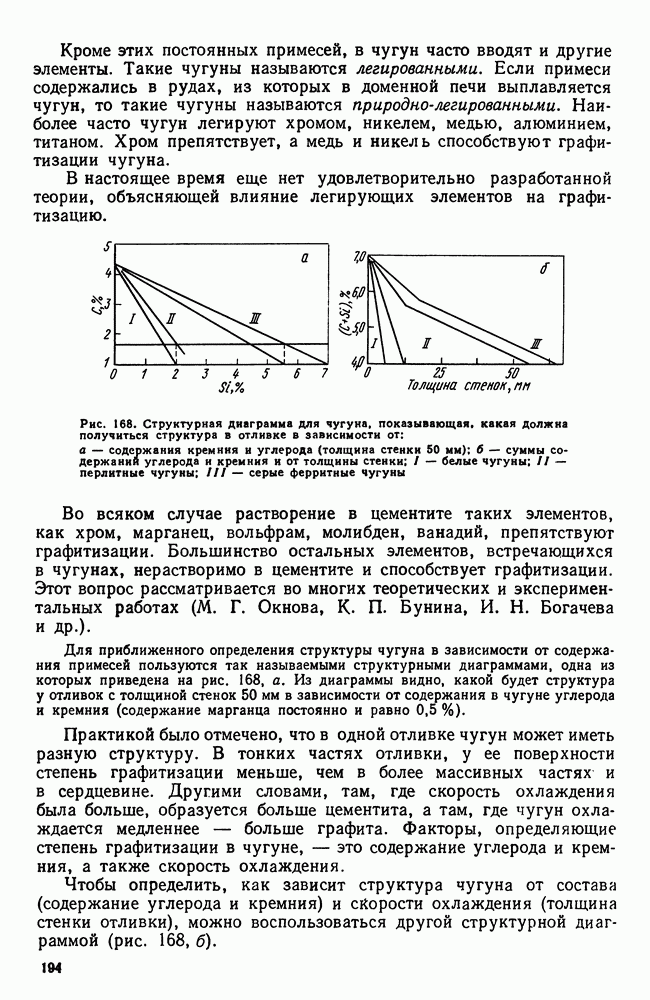
- 2. Структура чугуна. Формы графита
- 3. Структура и свойства чугуна
- 4. Примеси в чугуне
- 5. Марки серых и высокопрочных чугунов
- 6. Ковкий чугун
- Часть третья. ТЕРМИЧЕСКАЯ ОБРАБОТКА
- Глава IX. ОБЩИЕ ПОЛОЖЕНИЯ ТЕРМИЧЕСКОЙ ОБРАБОТКИ
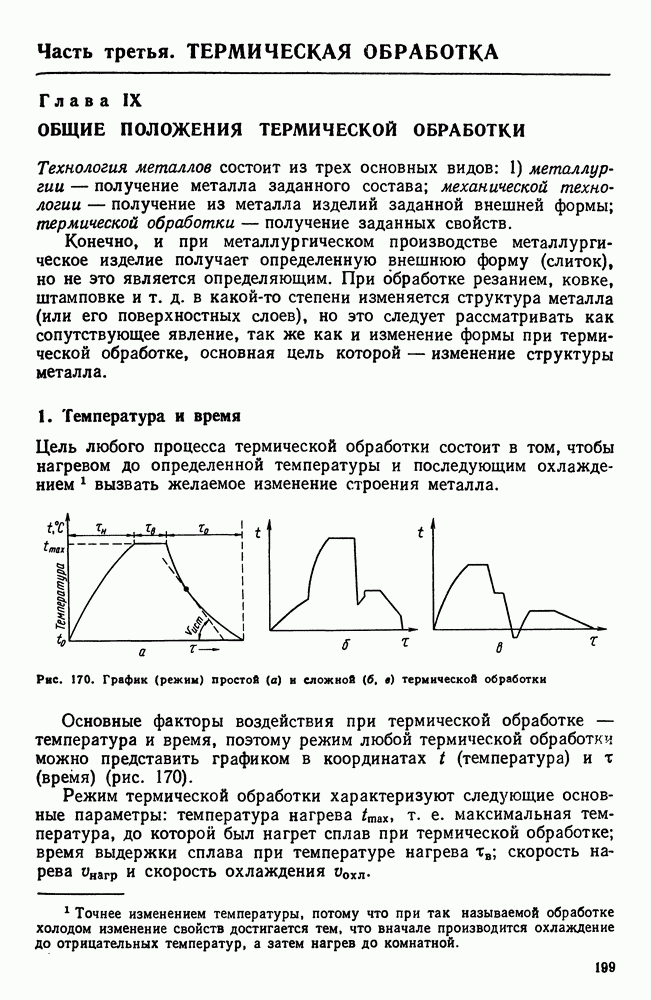
- 2. Классификация видов термической обработки
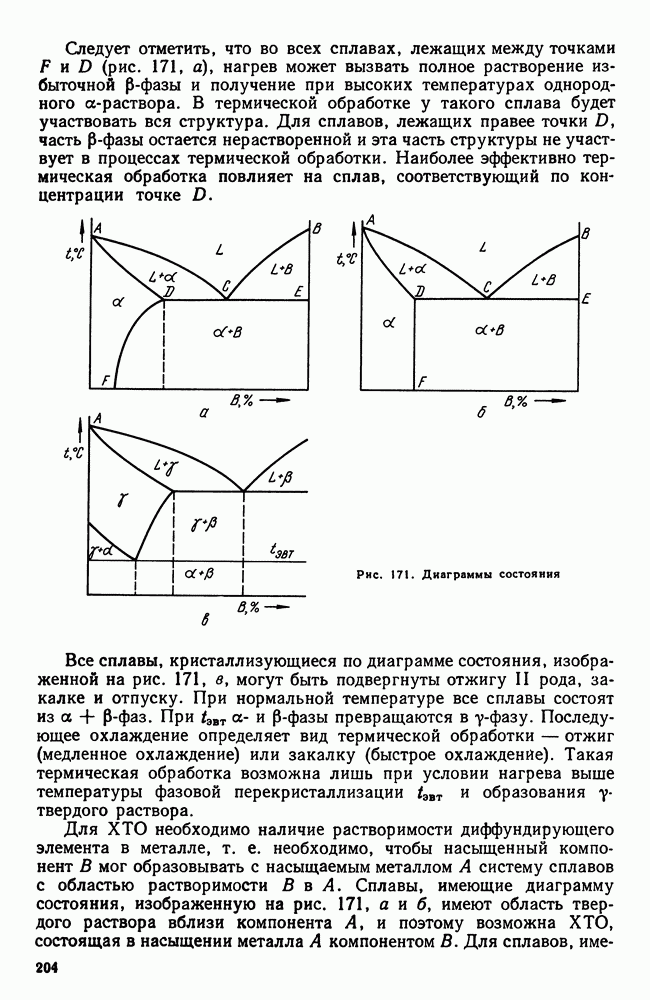
- 3. Термическая обработка и диаграмма состояния
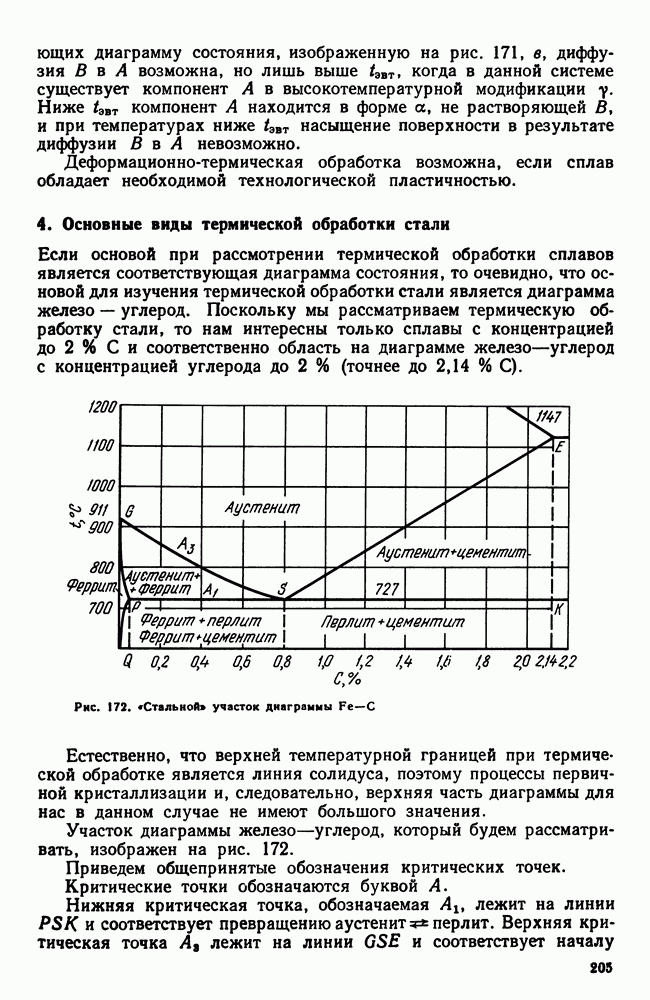
- 4 Основные виды термической обработки стали
- 5. Четыре основных превращения в стали
- Глава X. ТЕОРИЯ ТЕРМИЧЕСКОЙ ОБРАБОТКИ СТАЛИ
- 2. Рост аустенитного зерна
- 3. Распад аустенита
- 4. Мартенситное превращение
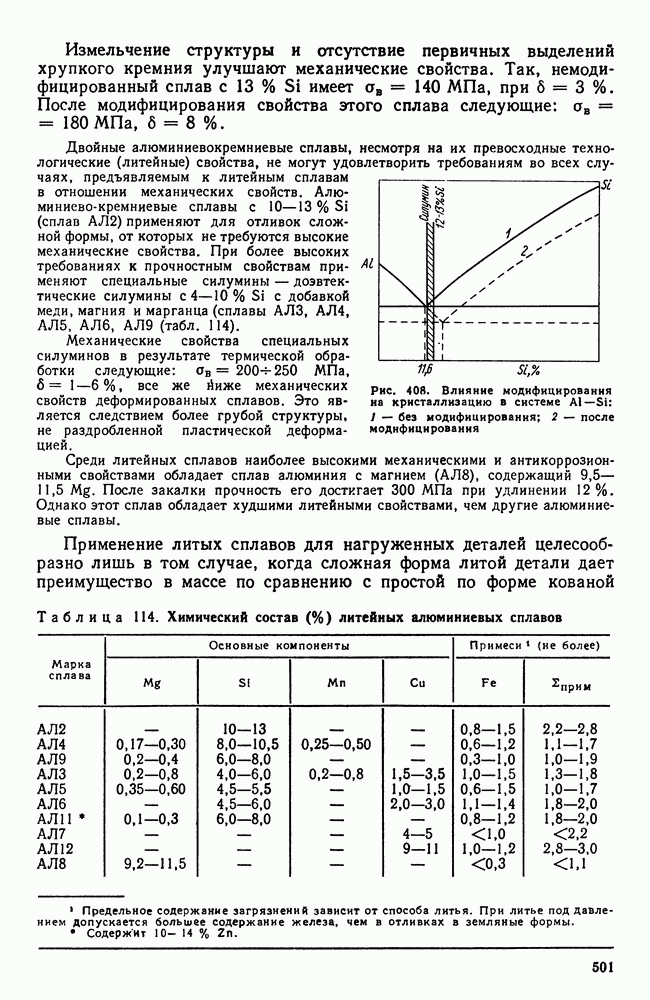
- 5. Бейнитное превращение
- 6. Превращения при отпуске
- 7. Влияние термической обработки на свойства стали
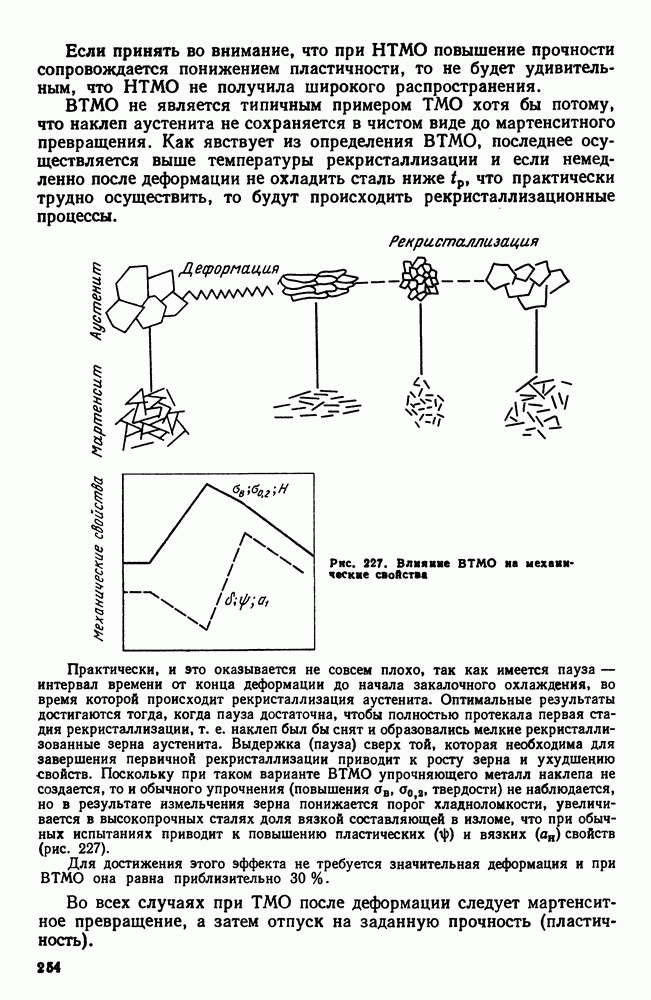
- 8. Термомеханическая обработка
- Глава XI. ПРАКТИКА ТЕРМИЧЕСКОЙ ОБРАБОТКИ СТАЛИ
- 2. Время нагрева
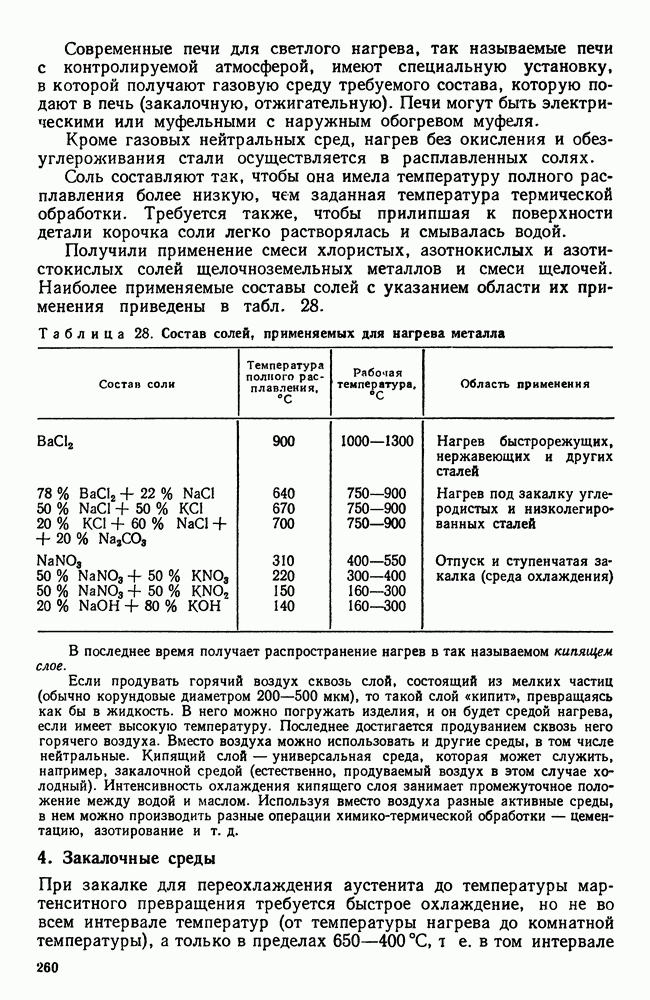
- 3. Химическое воздействие нагревающей среды
- 4. Закалочные среды
- 5. Прокаливаемость
- 6. Внутренние напряжения
- 7. Способы закалки
- 8. Обработка стали холодом
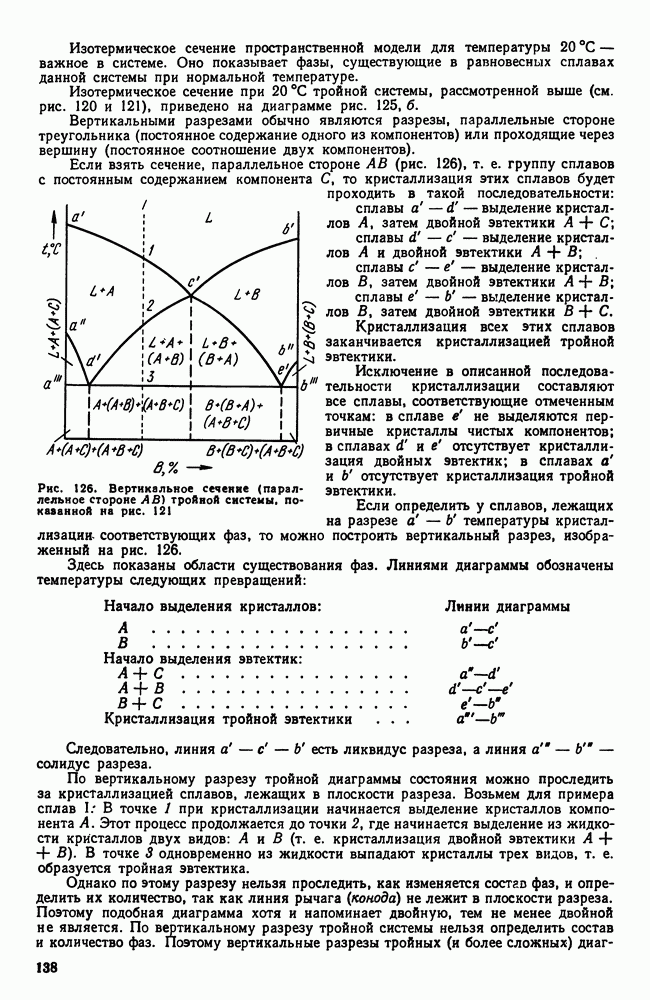
- 9. Дефекты, возникающие при закалке
- 10. Отжиг и нормализация
- Глава XII. ПОВЕРХНОСТНАЯ ЗАКАЛКА СТАЛИ
- 2. Высокочастотная закалка
- Глава XIII. ХИМИКО-ТЕРМИЧЕСКАЯ ОБРАБОТКА СТАЛИ
- 2. Цементация стали
- 3. Азотирование стали
- 4. Цианирование стали
- 5. Диффузионная металлизация
- Часть четвертая. ЛЕГИРОВАННЫЕ СТАЛИ И СПЛАВЫ
- Глава XIV. ВЛИЯНИЕ ЛЕГИРУЮЩИХ ЭЛЕМЕНТОВ
- 2. Влияние элементов на полиморфизм железа
- 3. Распределение легирующих элементов в стали
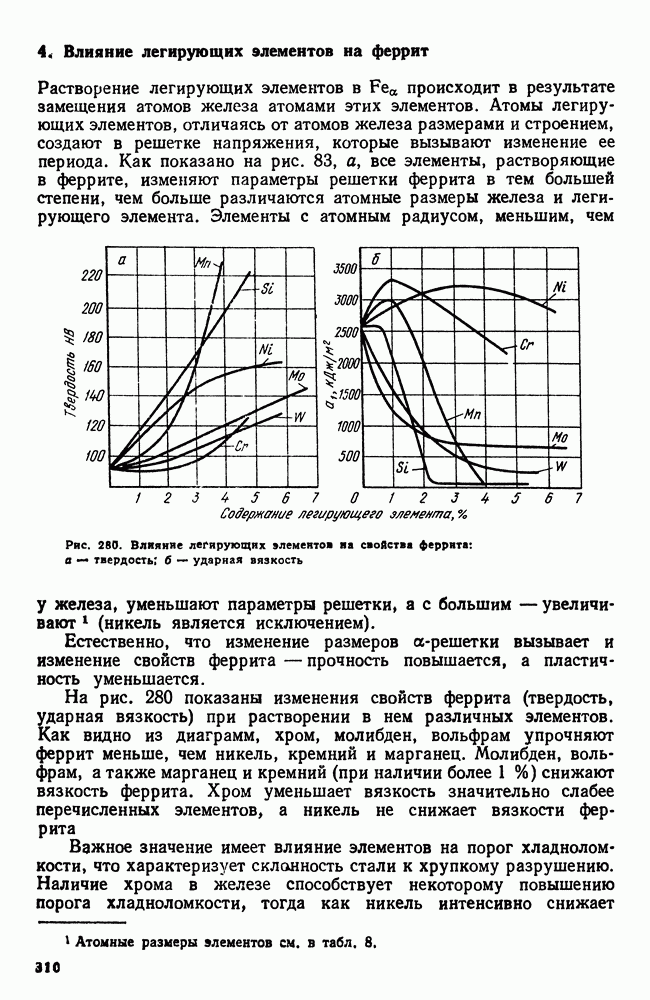
- 4. Влияние легирующих элементов на феррит
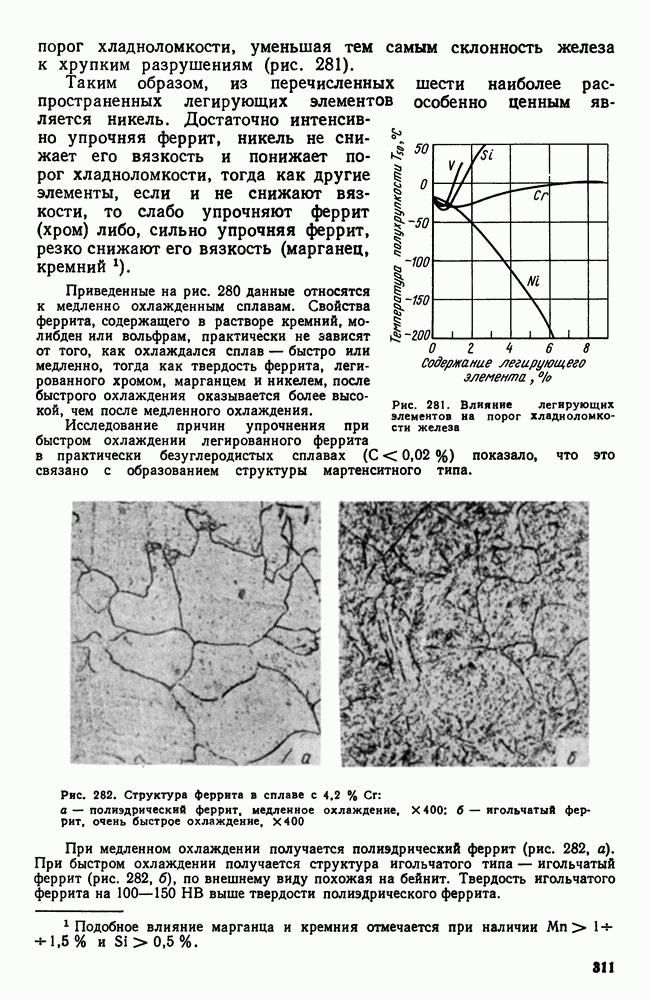
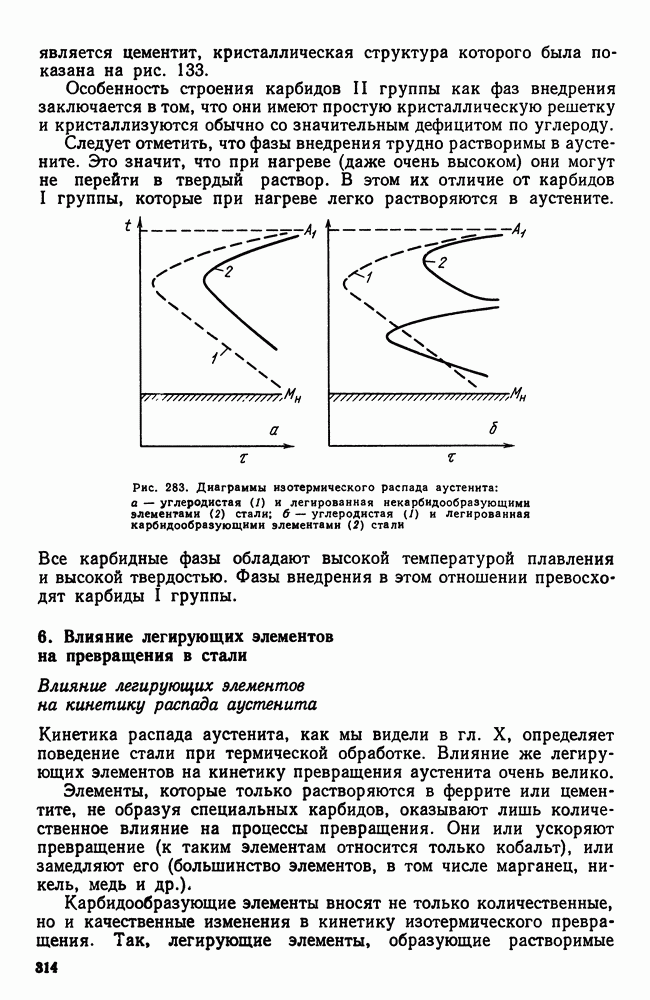
- 5. Карбидная фаза в легированных сталях
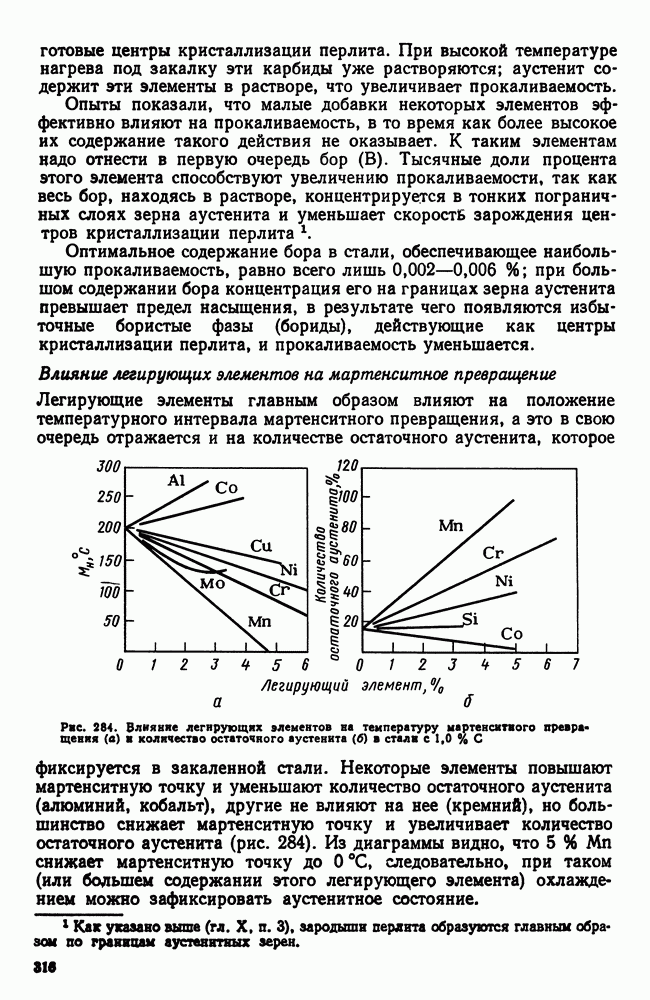
- 6. Влияние легирующих элементов на превращения в стали
- Глава XV. КЛАССИФИКАЦИЯ И МАРКИРОВКА ЛЕГИРОВАННЫХ СТАЛЕЙ
- 2. Маркировка легированных сталей
- Глава XVI. КОНСТРУКЦИОННЫЕ СТАЛИ
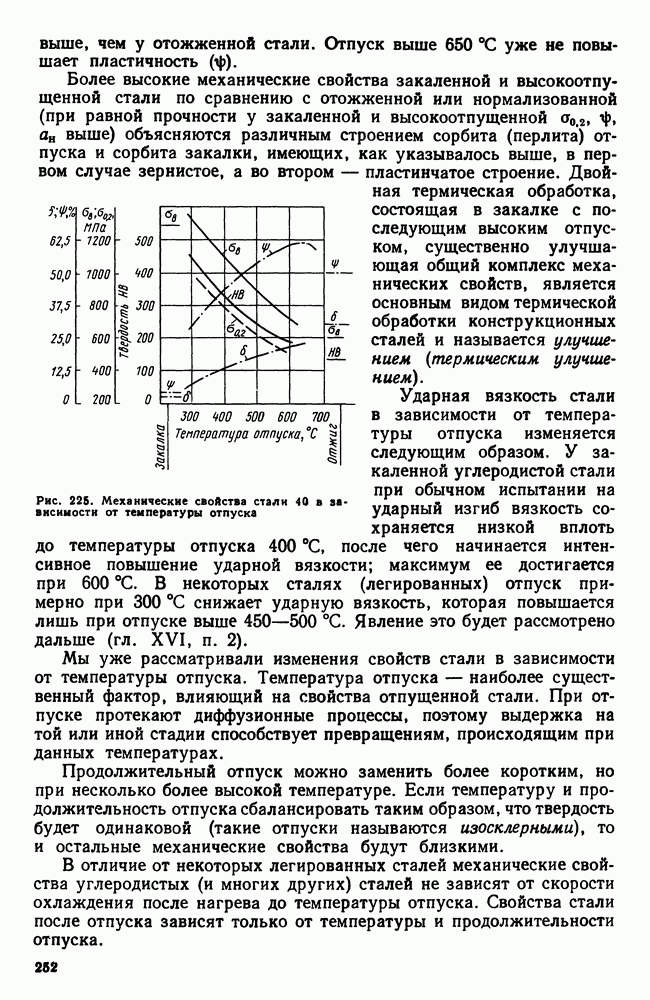
- 1. Механические свойства стали, влияние структуры и легирующих элементов
- 2. Термическая обработка конструкционных сталей
- 3. Цементуемые (низкоуглеродистые) стали
- 4. Улучшаемые (среднеуглеродистые) стали
- 5. Высокопрочные стали
- 6. Свариваемость стали
- 7. Строительная сталь
- 8. Арматурная сталь
- 9. Пружинная сталь
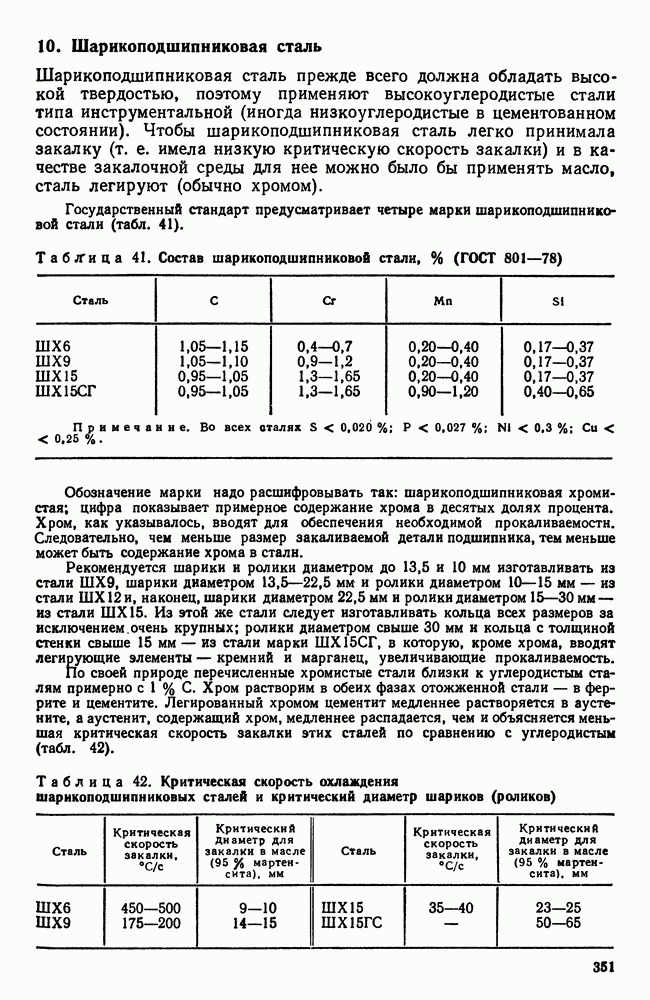
- 10. Шарикоподшипниковая сталь
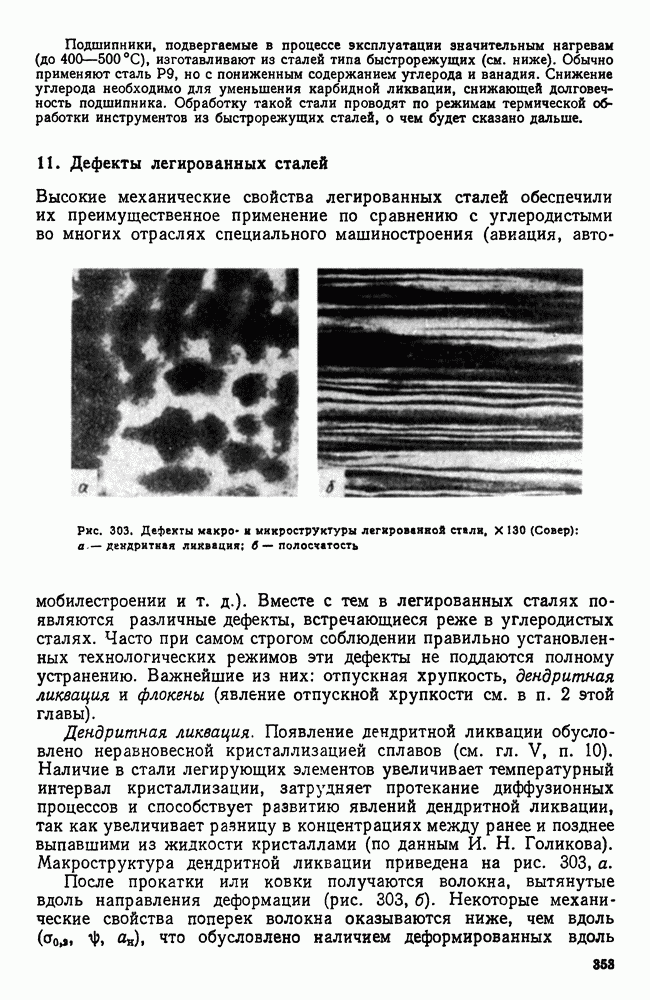
- 11. Дефекты легированных сталей
- Глава XVII. ИНСТРУМЕНТАЛЬНЫЕ СТАЛИ
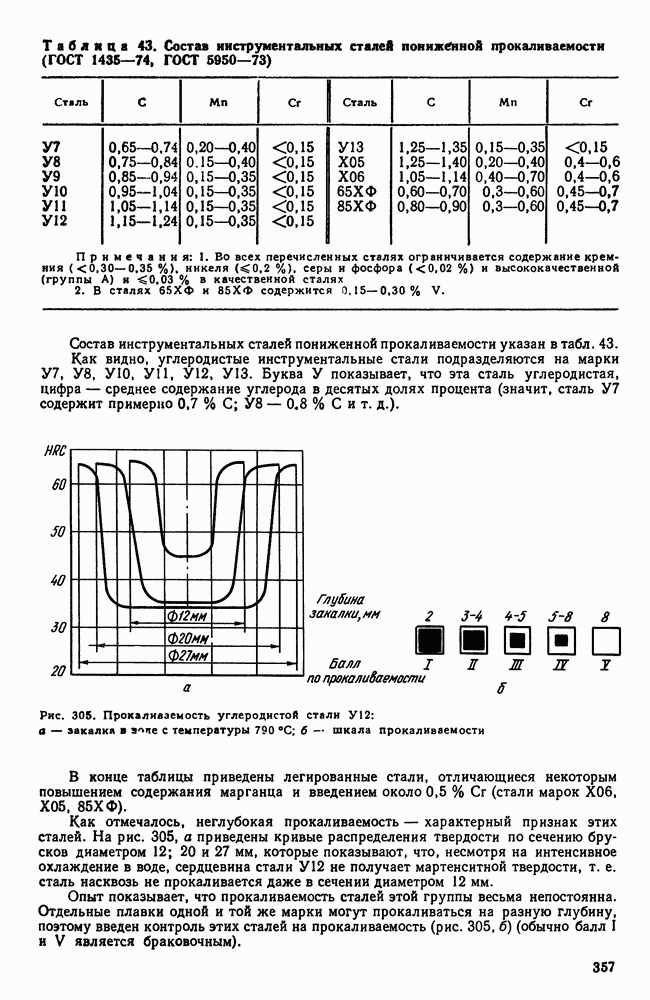
- 2. Инструментальные стали пониженной прокаливаемости
- 3. Инструментальные стали повышенной прокаливаемости (легированные инструментальные стали)
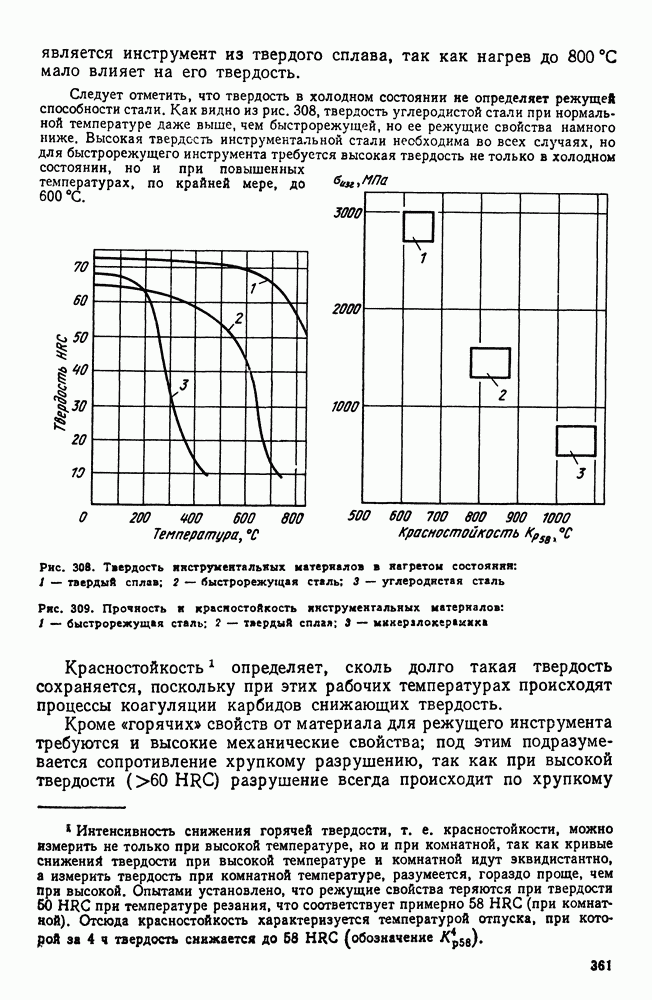
- 4. Быстрорежущие стали
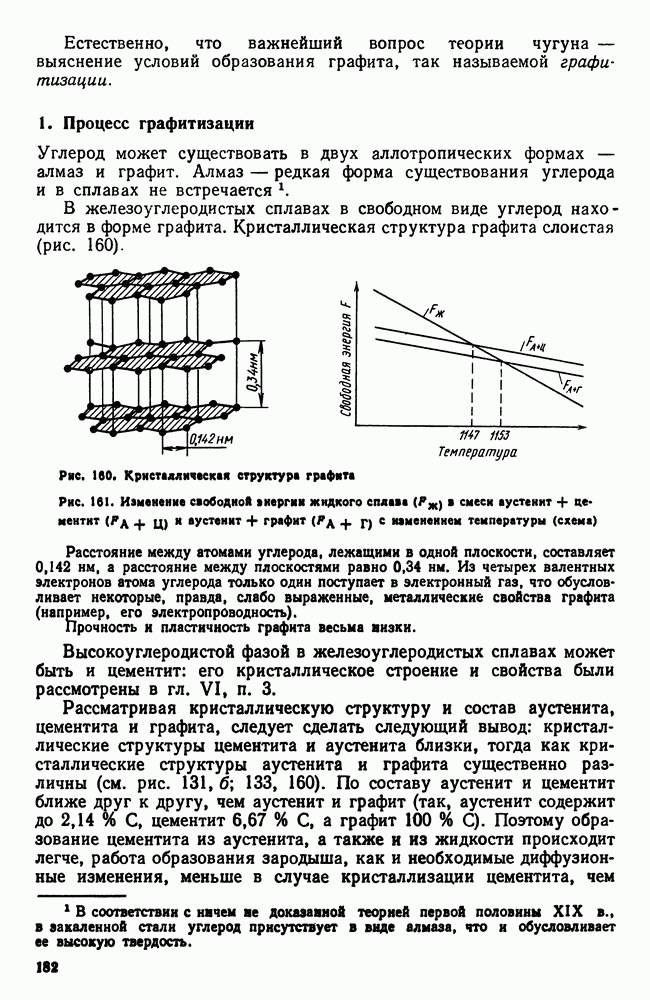
- 5. Штамповые стали
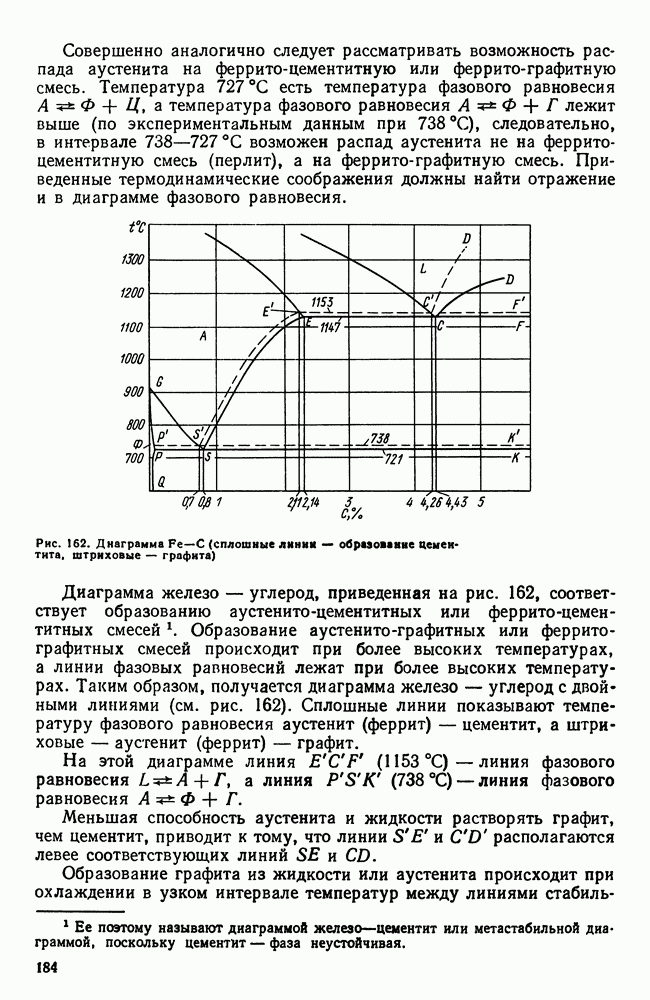
- 6. Твердые сплавы
- Глава XVIII. ЖАРОСТОЙКИЕ И ЖАРОПРОЧНЫЕ СТАЛИ И СПЛАВЫ
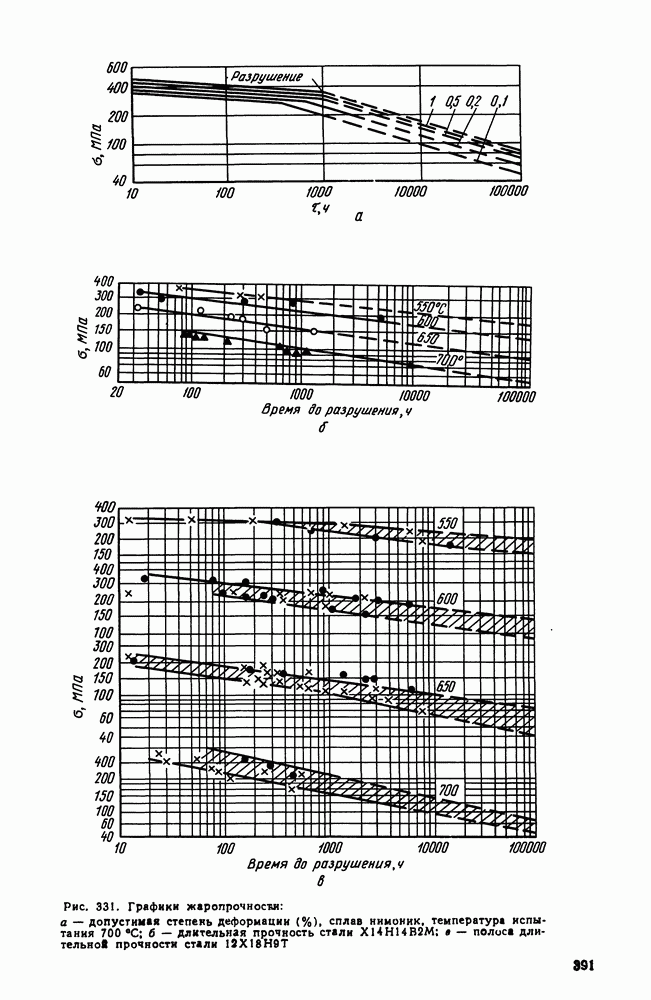
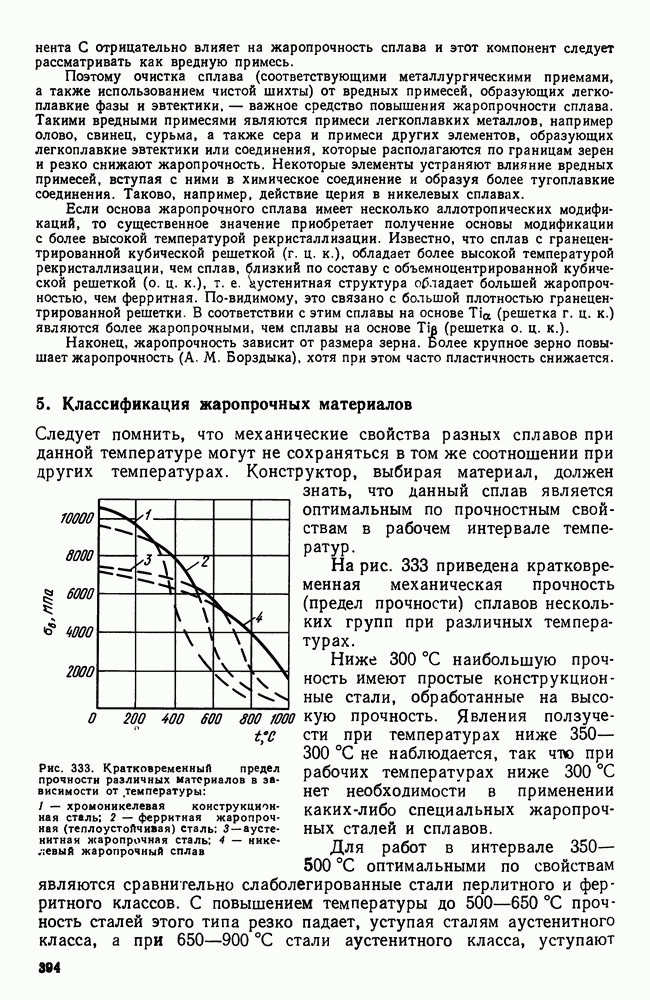
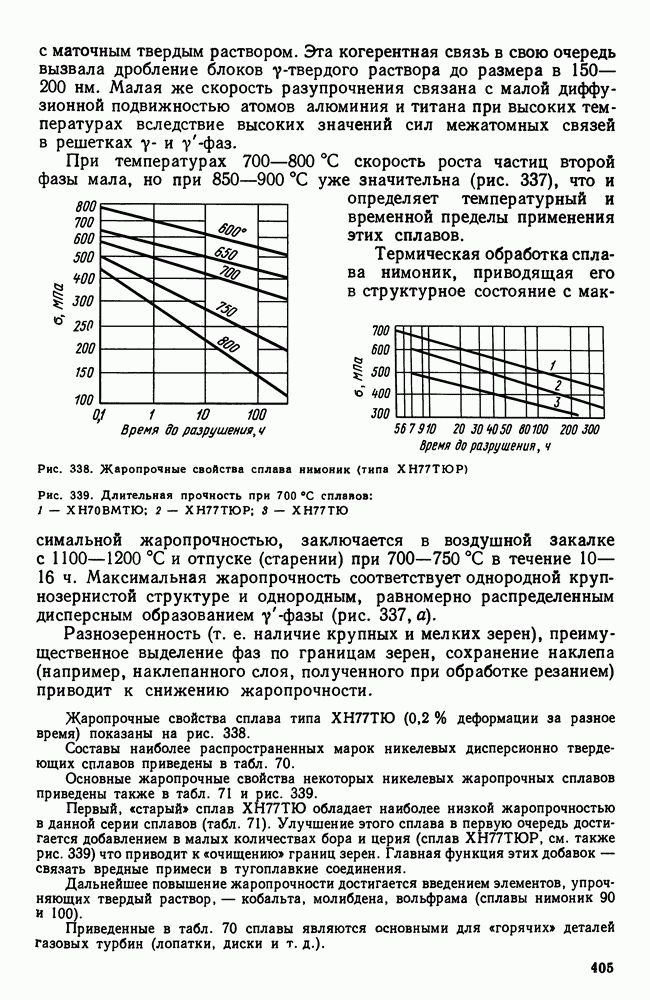
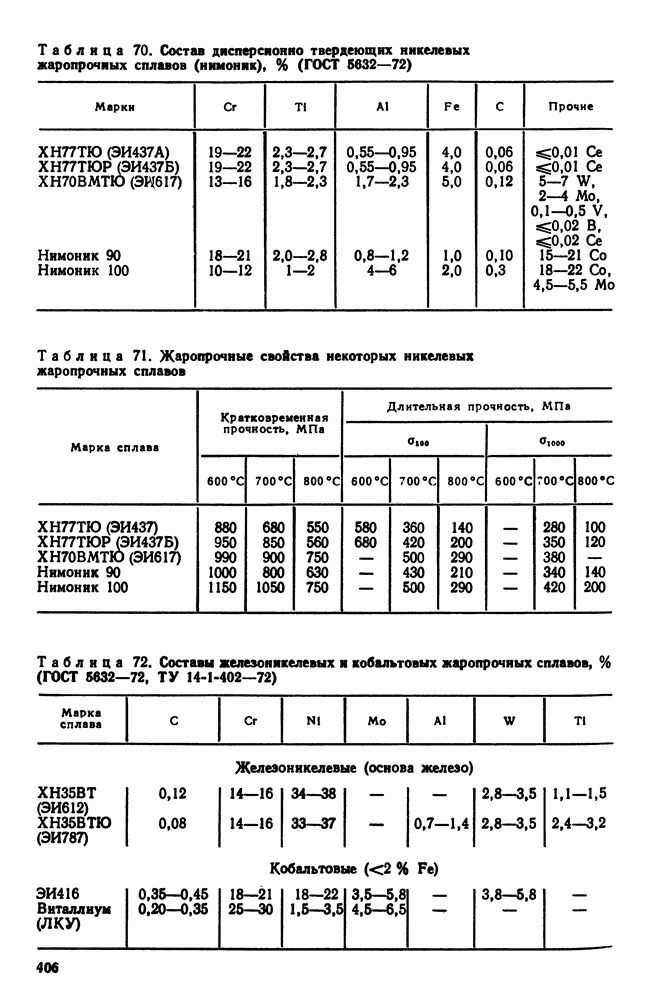
- 2. Жаропрочность
- 3. Оценка жаропрочных свойств
- 4. Влияние структуры и состава на жаропрочность
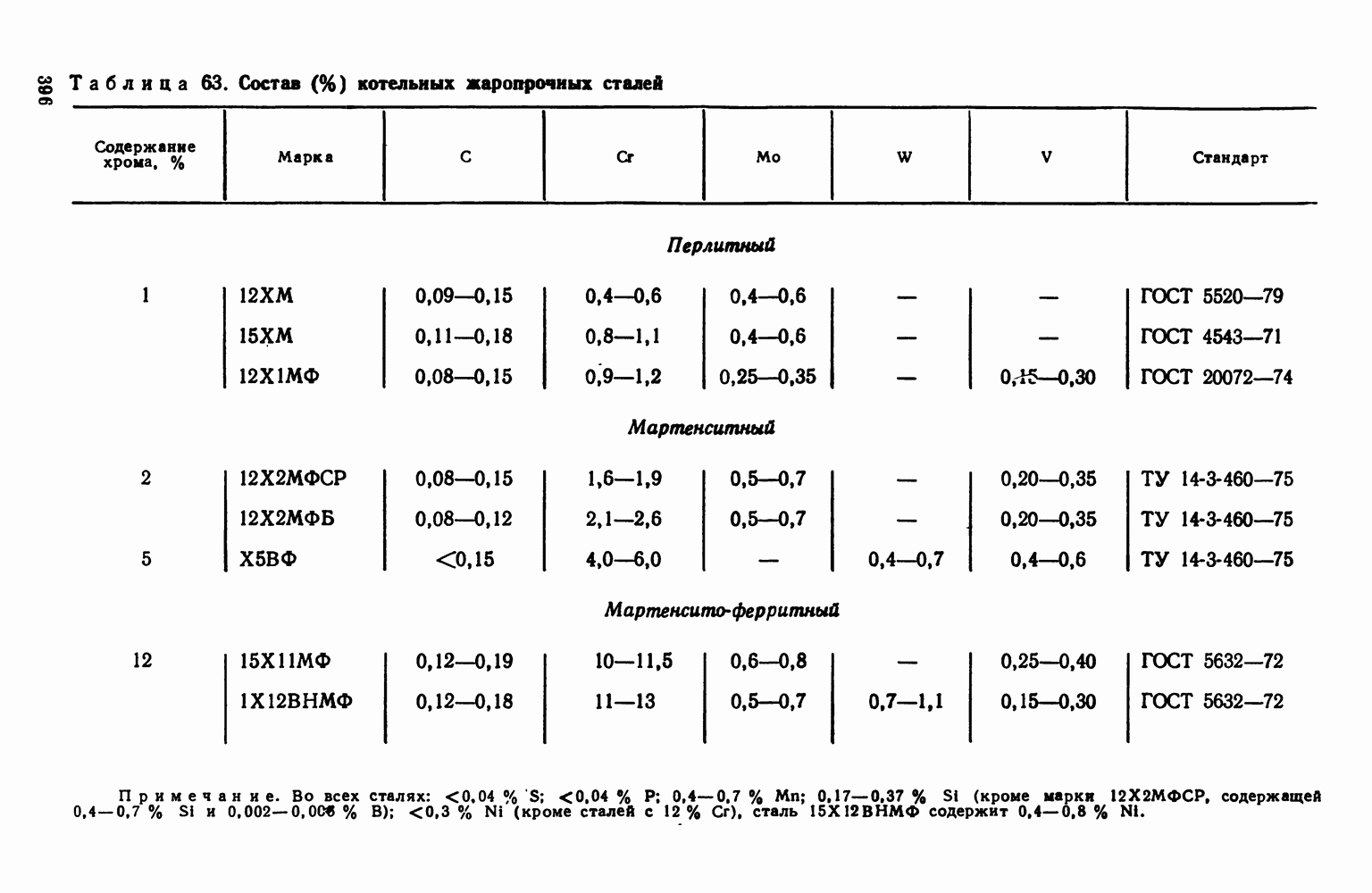
- 5. Классификация жаропрочных материалов
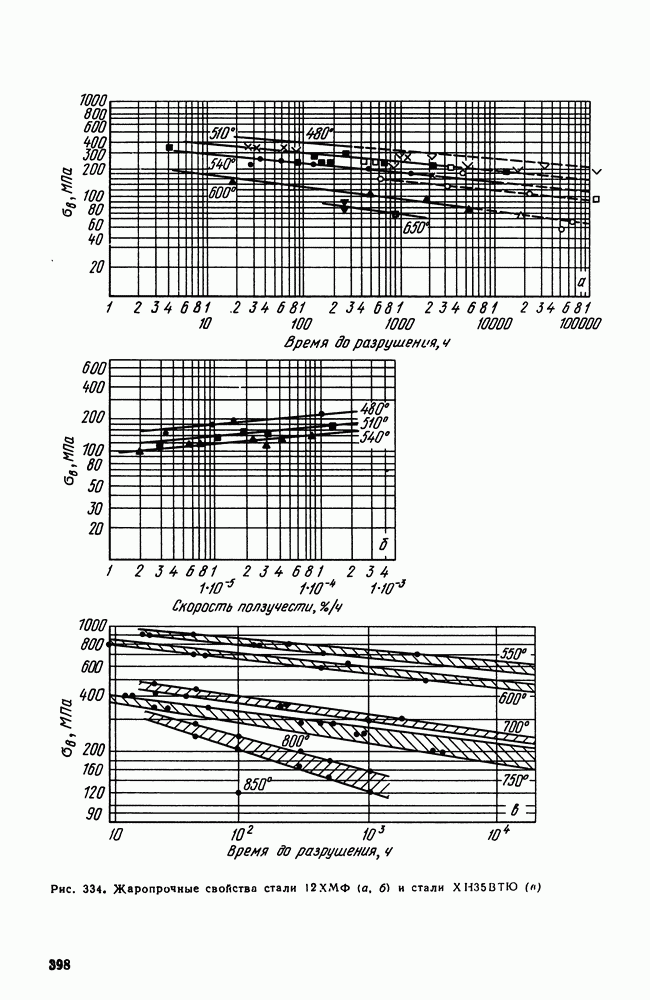
- 6. Перлитные и мартенситные жаропрочные стали
- 7. Аустенитные жаропрочные стали
- 8. Никелевые и кобальтовые жаропрочные сплавы
- Глава XIX. КОРРОЗИОННОСТОЙКИЕ (НЕРЖАВЕЮЩИЕ) СТАЛИ И СПЛАВЫ
- 2. Хромоникелевые нержавеющие стали
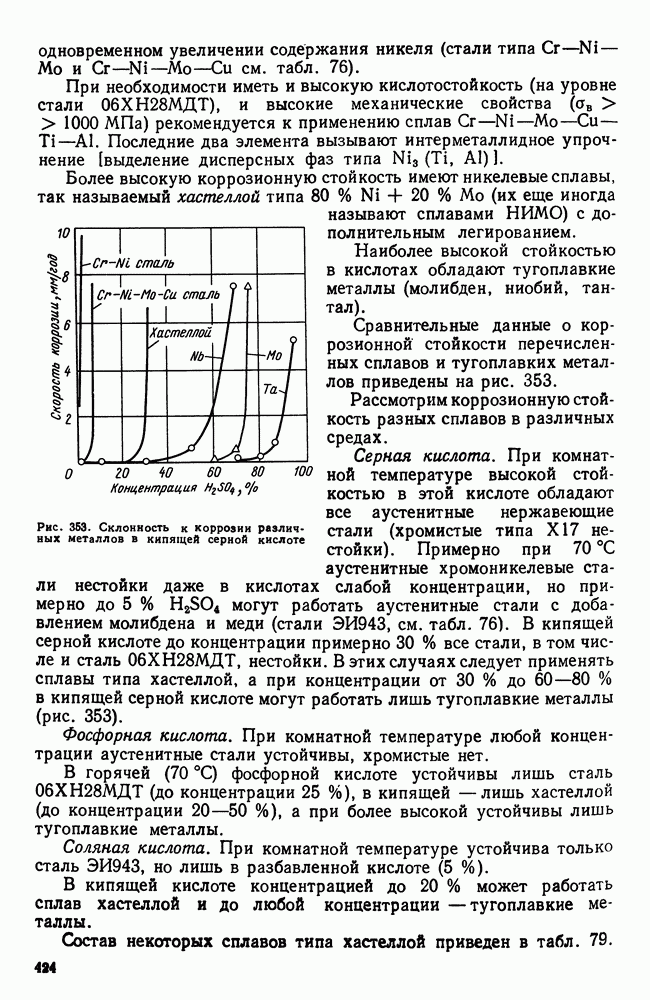
- 3. Кислотостойкие стали и сплавы
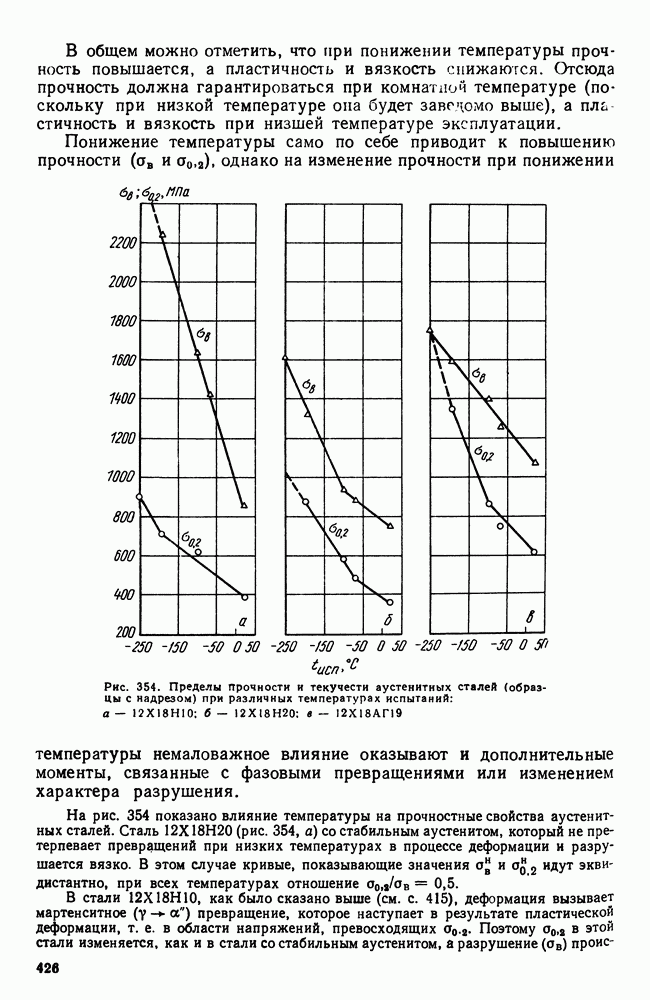
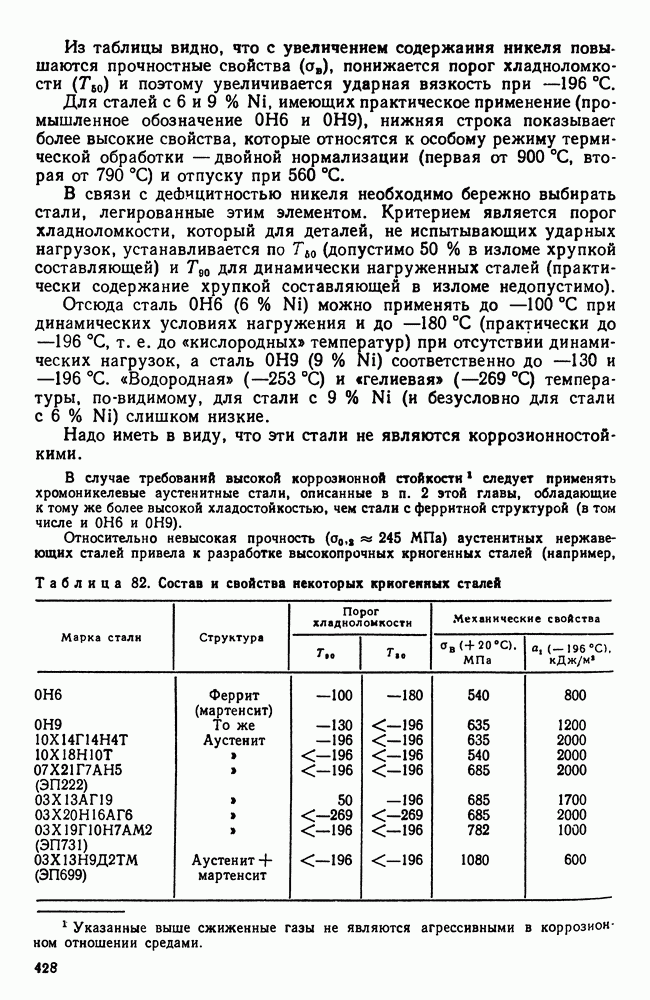
- 4. Криогенные стали и сплавы
- Глава XX. ИЗНОСОСТОЙКИЕ СТАЛИ И СПЛАВЫ
- 2. Графитизированная сталь
- 3. Высокомарганцовистая сталь
- 4. Наплавочные материалы
- Глава XXI. ТИТАН И ЕГО СПЛАВЫ
- 2. Легирование титана
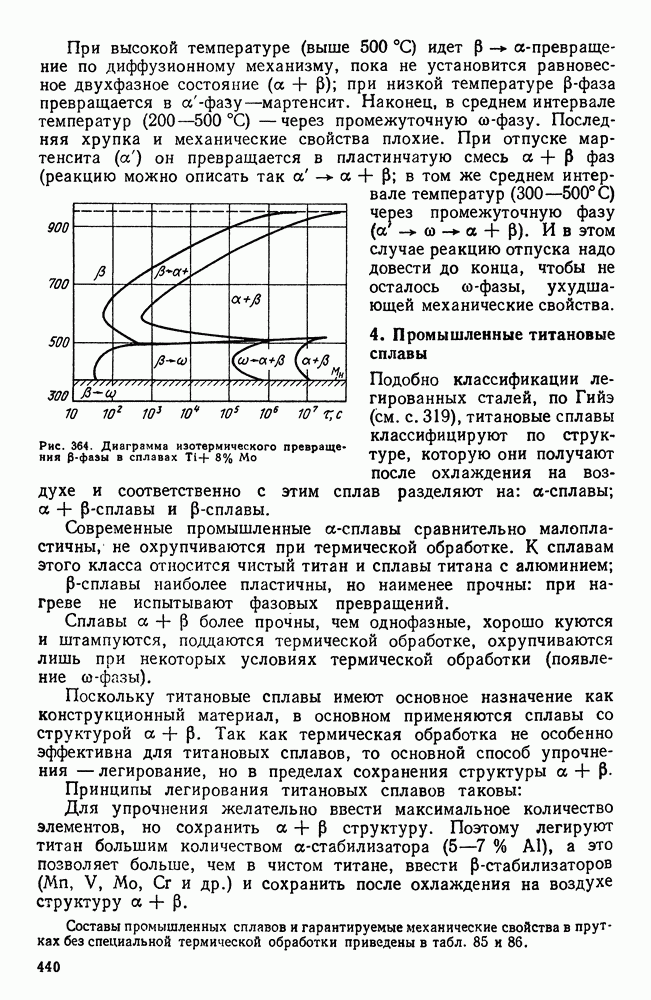
- 3. Фазовые превращения в титановых сплавах
- 5. Термическая обработка титановых сплавов
- 6. Примеси в титановых сплавах
- 7. Коррозионная стойкость титана
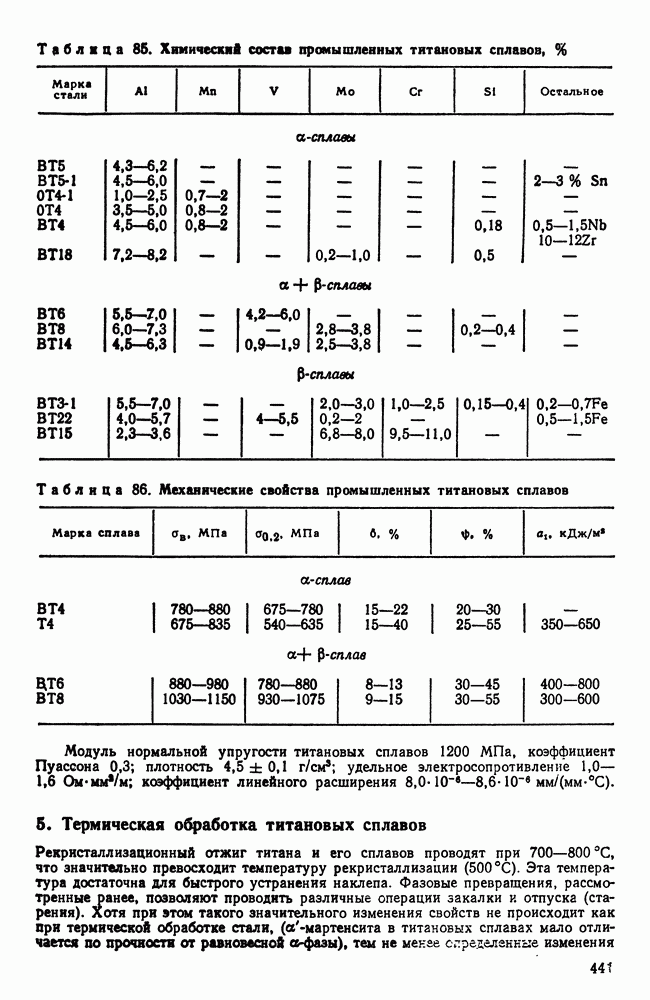
- Глава XXII. ТУГОПЛАВКИЕ МЕТАЛЛЫ
- 2. Взаимодействие тугоплавких металлов с другими элементами и между собой
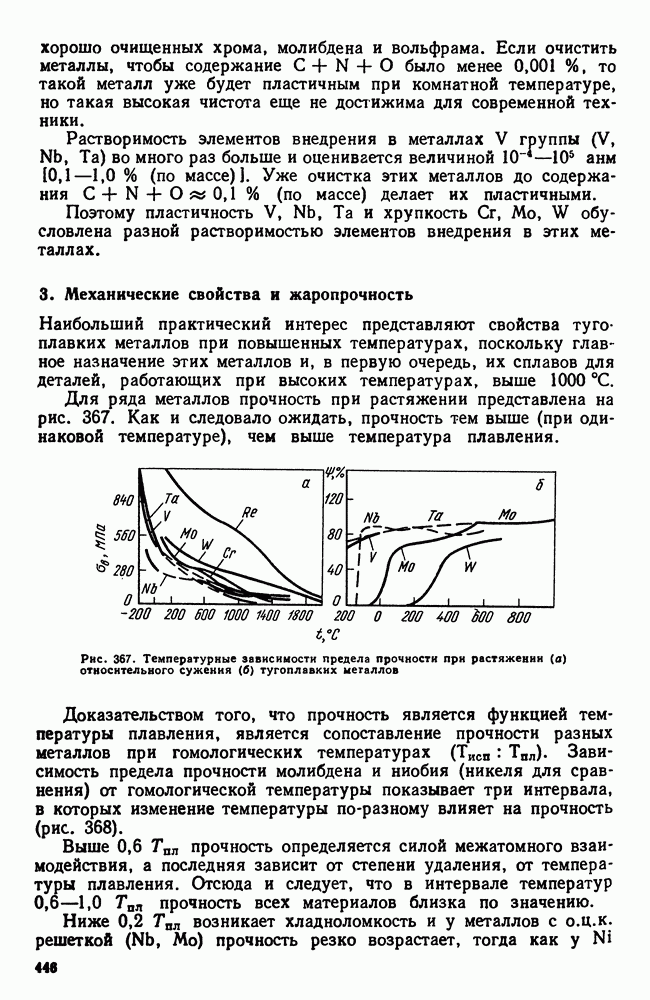
- 3. Механические свойства и жаропрочность
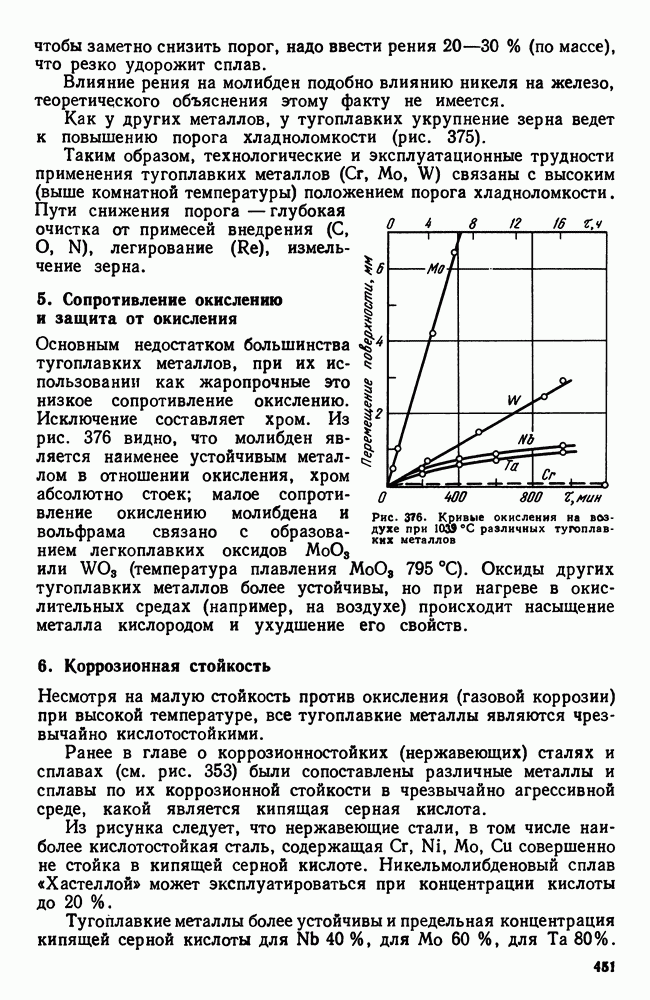
- 4. Хладноломкость тугоплавких металлов
- 5. Сопротивление окислению и защита от окисления
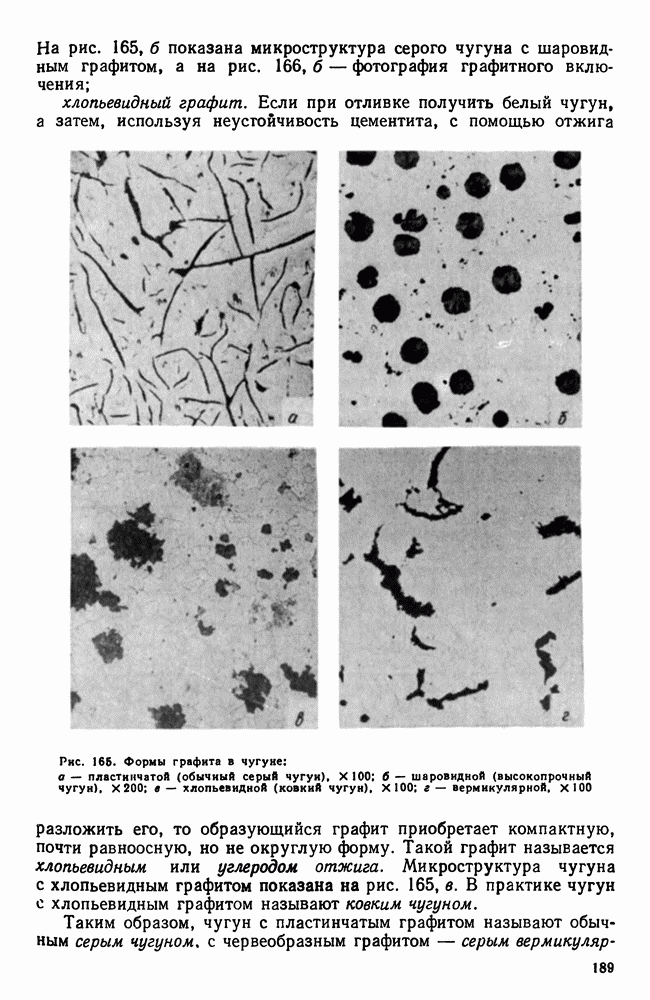
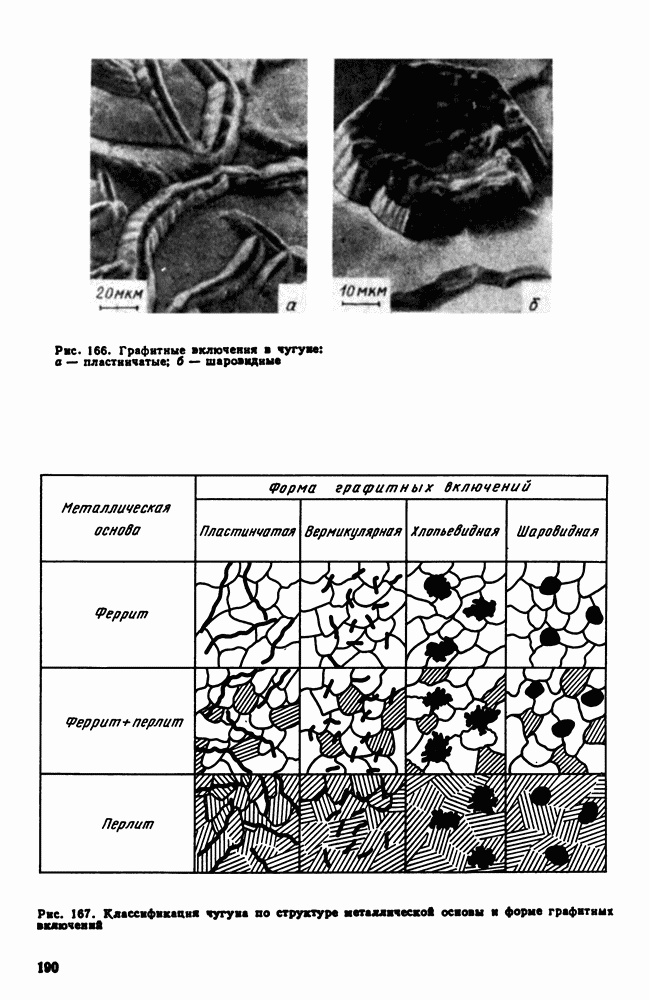
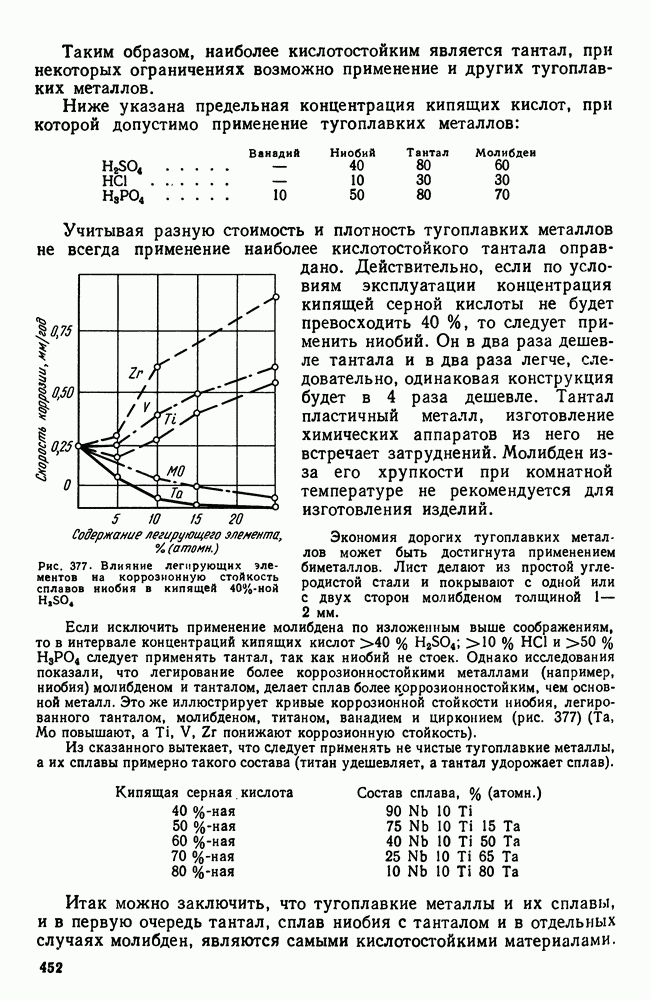
- 6. Коррозионная стойкость
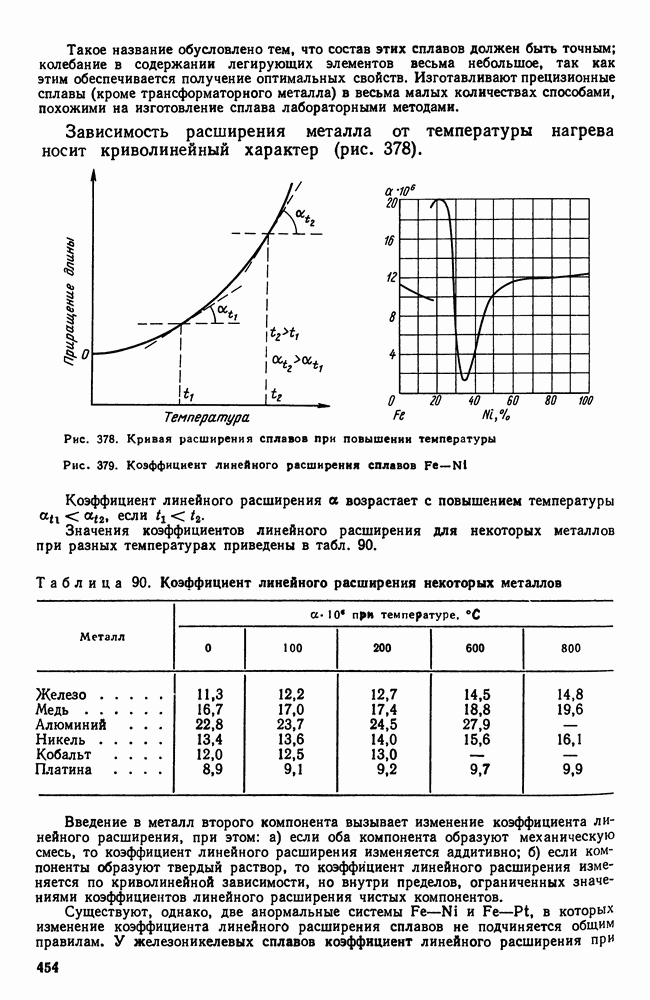
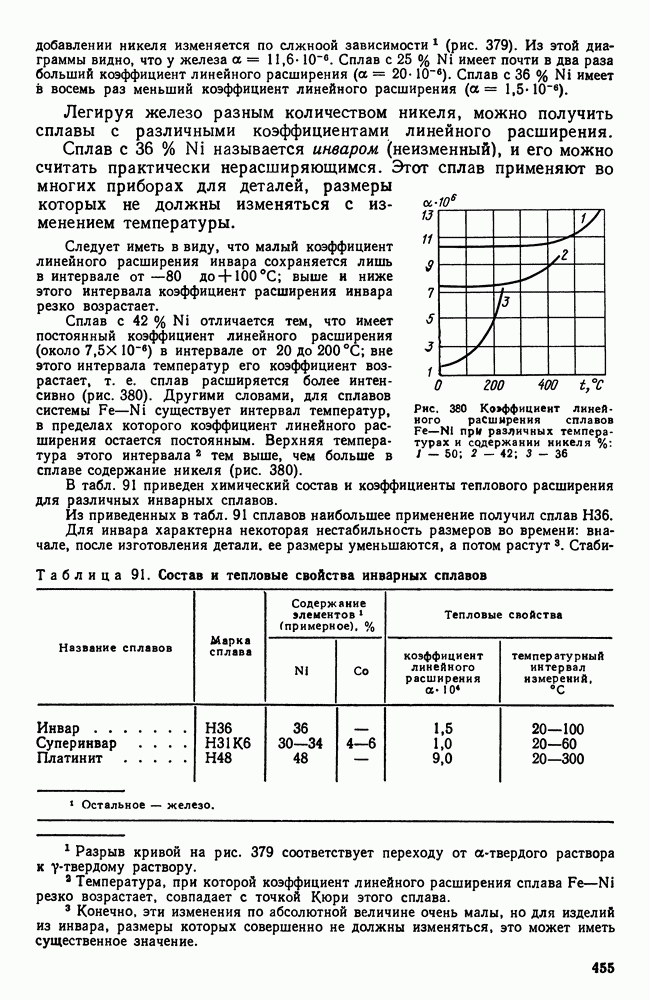
- Глава XXIII. СПЛАВЫ С ОСОБЫМИ ТЕПЛОВЫМИ И УПРУГИМИ СВОЙСТВАМИ
- 2. Сплавы с постоянным модулем упругости
- Глава XXIV. МАГНИТНЫЕ СТАЛИ И СПЛАВЫ
- 2. Стали и сплавы для постоянных магнитов (магнитнотвердые сплавы)
- 3. Магнитномягкие сплавы
- 4. Немагнитные стали
- 5. Электротехнические сплавы
- Глава XXV. СПЛАВЫ АТОМНОЙ ЭНЕРГЕТИКИ
- 2. Конструкционные материалы. Теплоносители
- 3. Ядерное горючее (уран, плутоний, торий)
- Часть пятая. Цветные металлы и сплавы
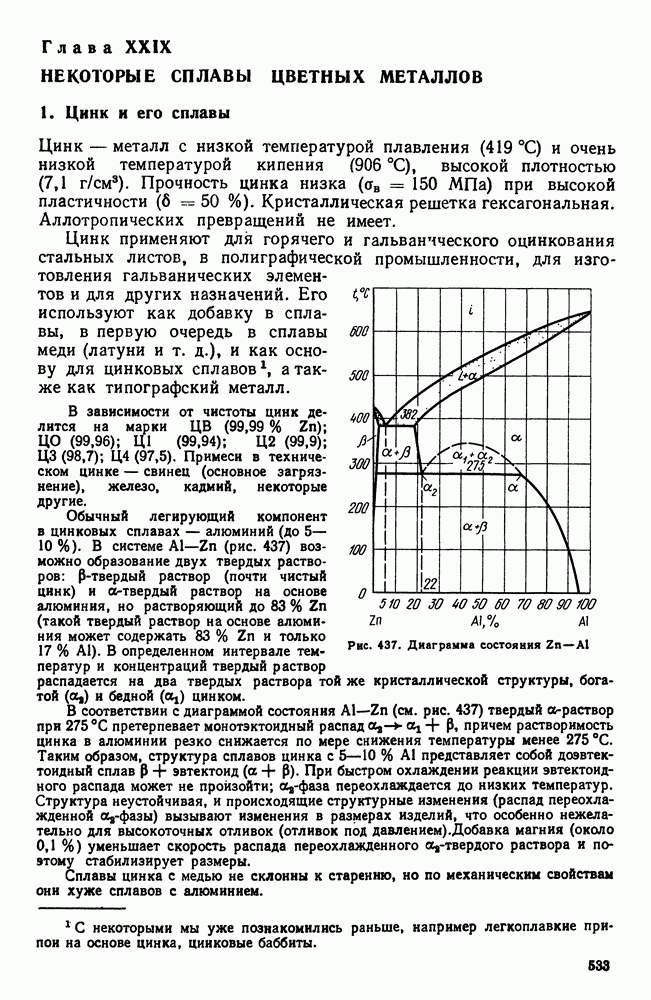
- Глава XXVI. ЛЕГКИЕ МЕТАЛЛЫ И ИХ СПЛАВЫ
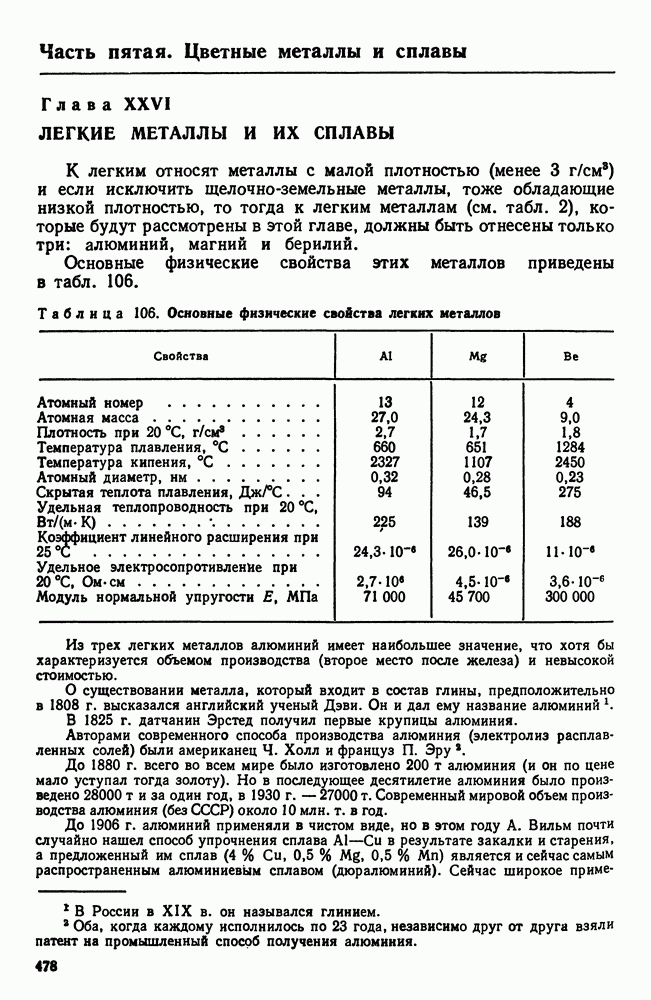
- 1. Свойства алюминия
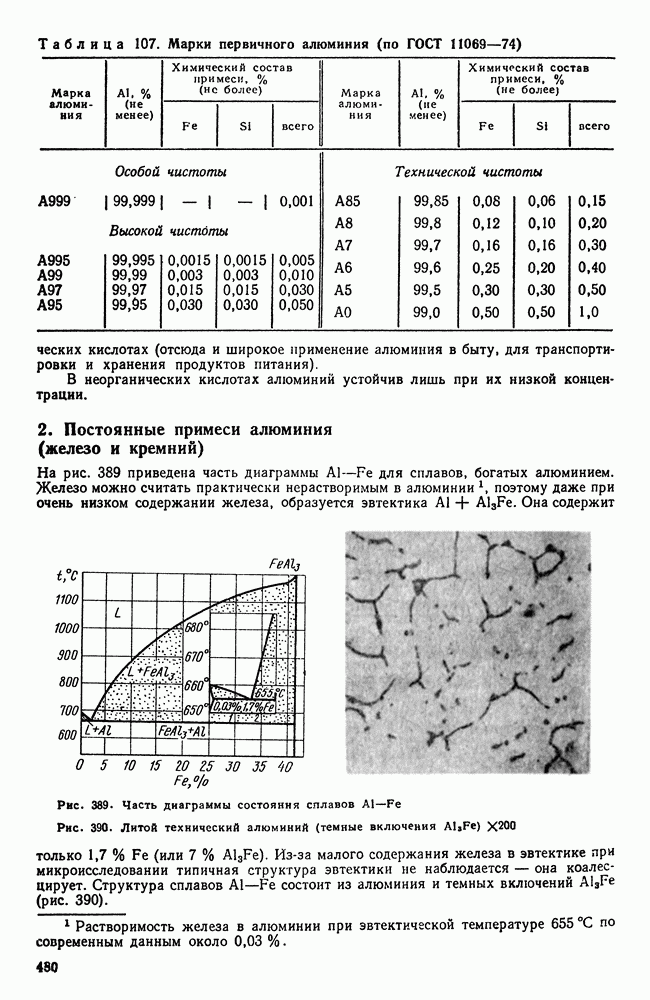
- 2. Постоянные примеси алюминия (железо и кремний)
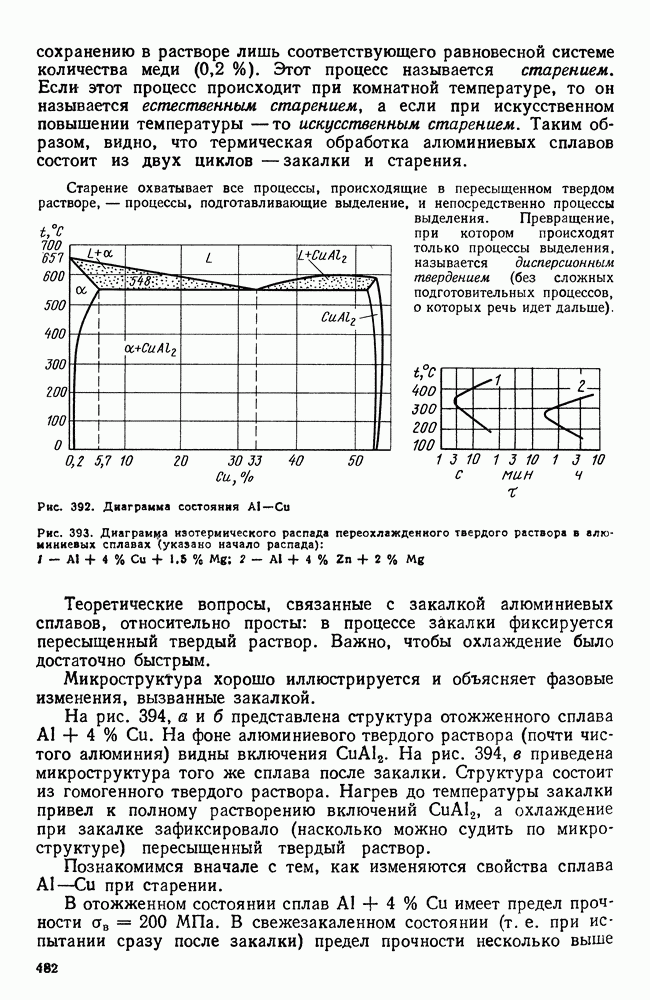
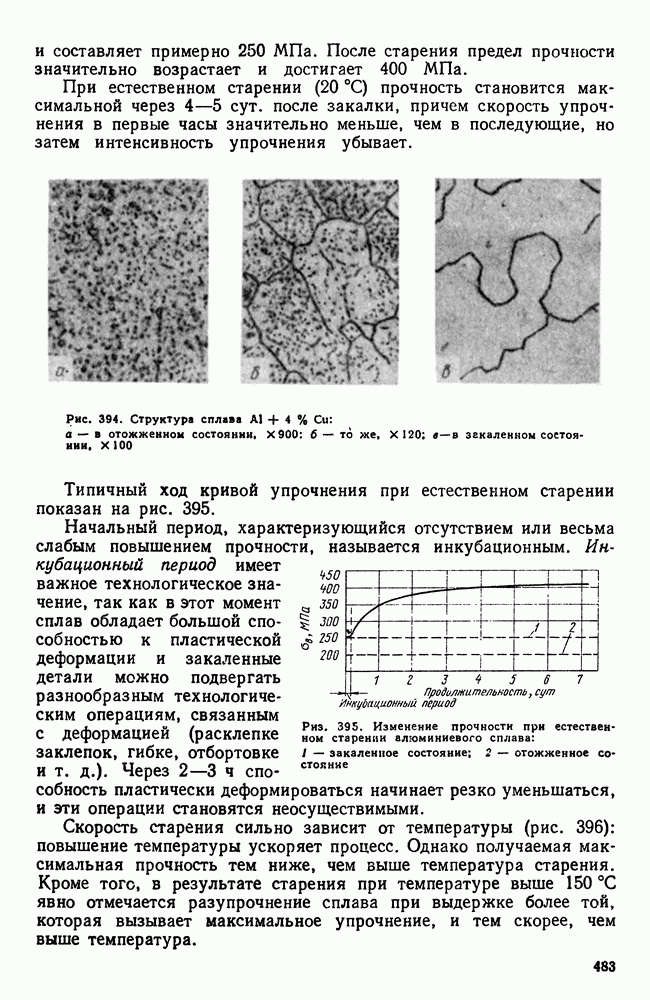
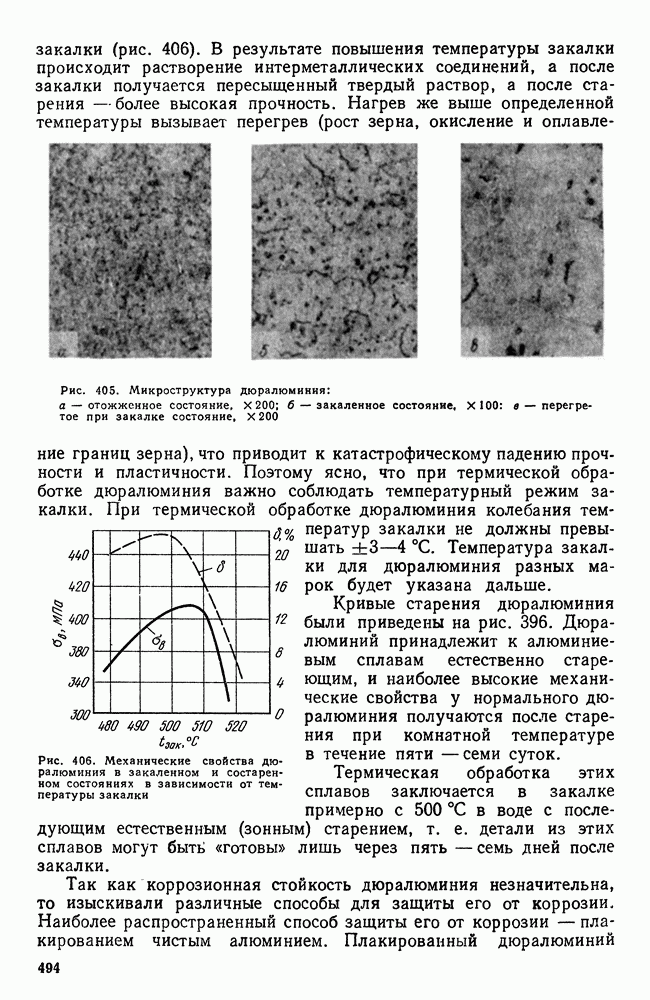
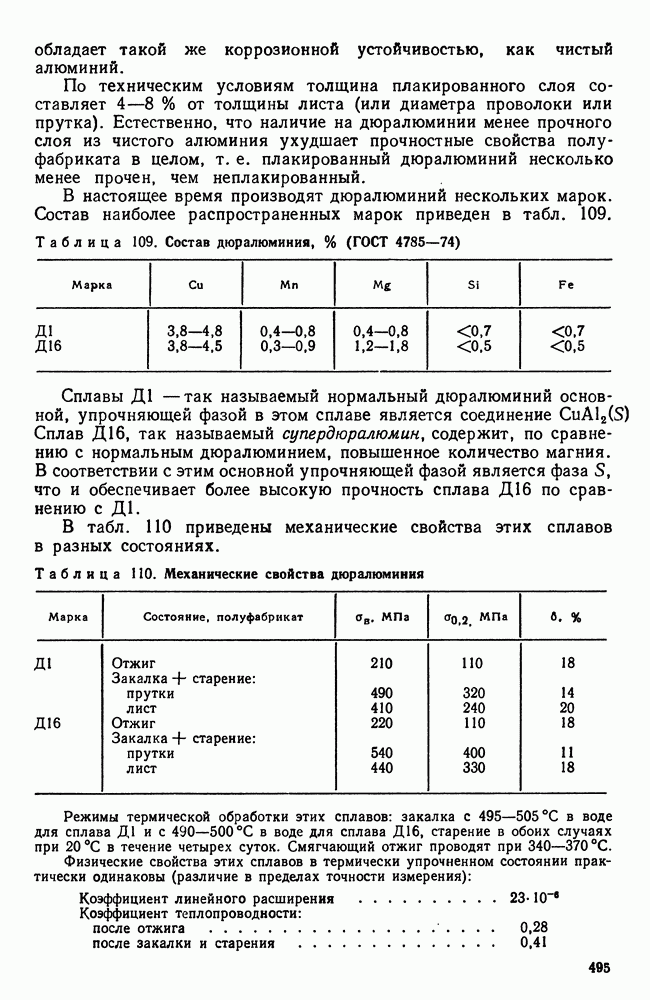
- 3. Термическая обработка сплавов Al-Cu
- 4. Влияние состава алюминиевых сплавов на процессы, происходящие при термической обработке
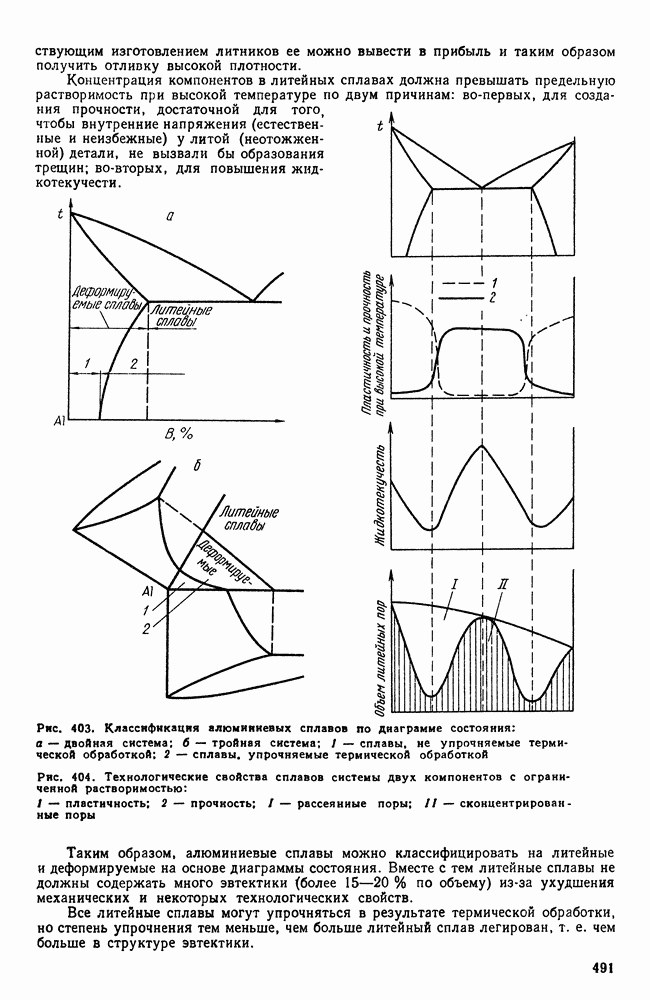
- 5. Классификация алюминиевых сплавов
- 6. Деформируемые сплавы, не упрочняемые термической обработкой
- 7. Дюралюминий и другие деформируемые сплавы, упрочняемые термической обработкой
- 8. Алюминиевые сплавы для поковок и штамповок
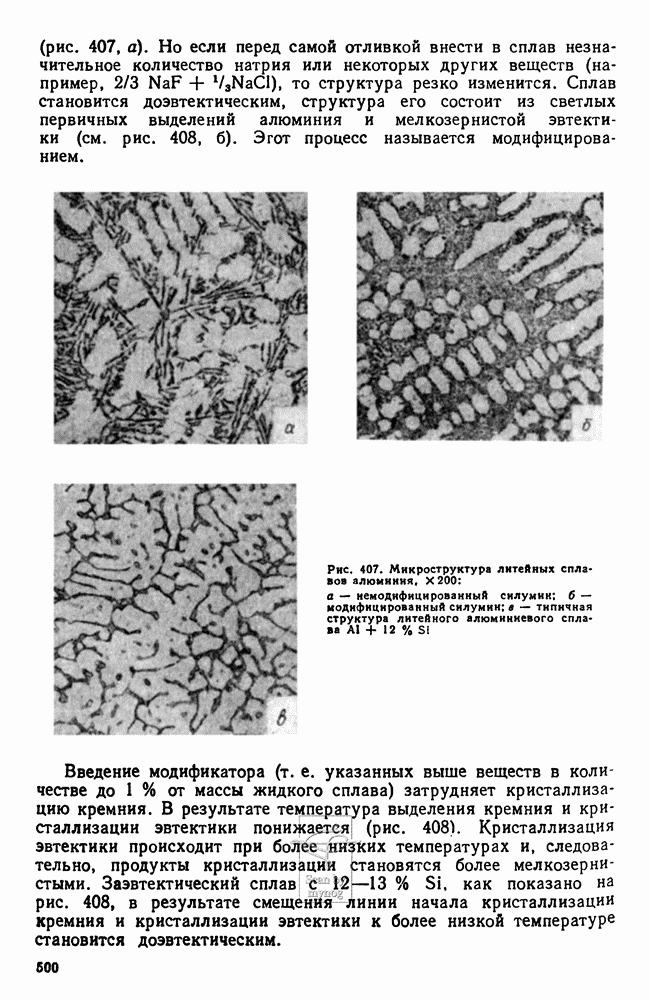
- 9. Силумины и другие алюминиевые сплавы для фасонного литья
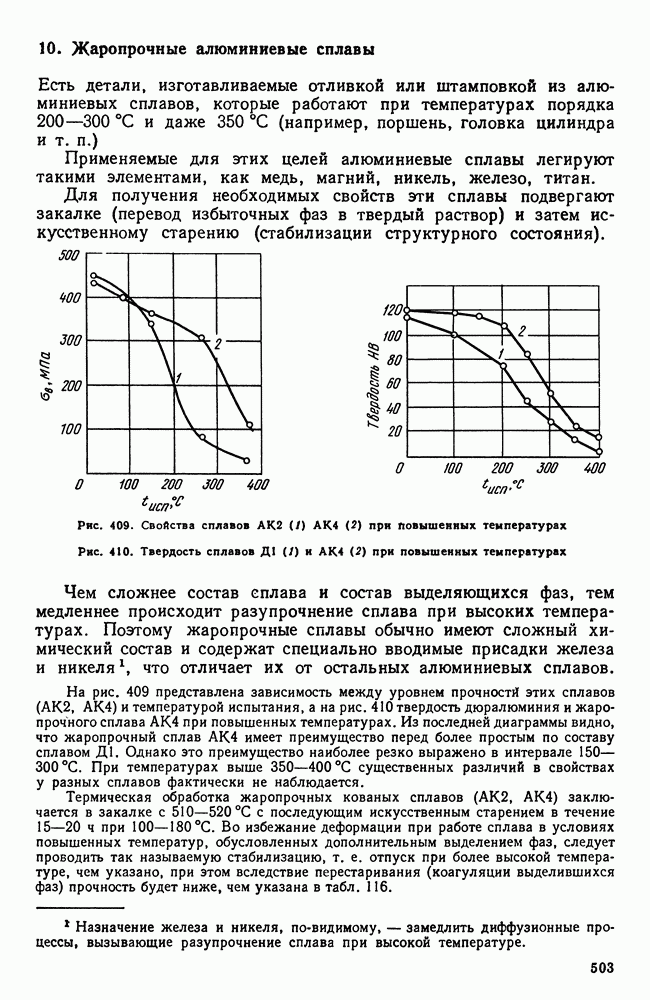
- 10. Жаропрочные алюминиевые сплавы
- 11. Магний
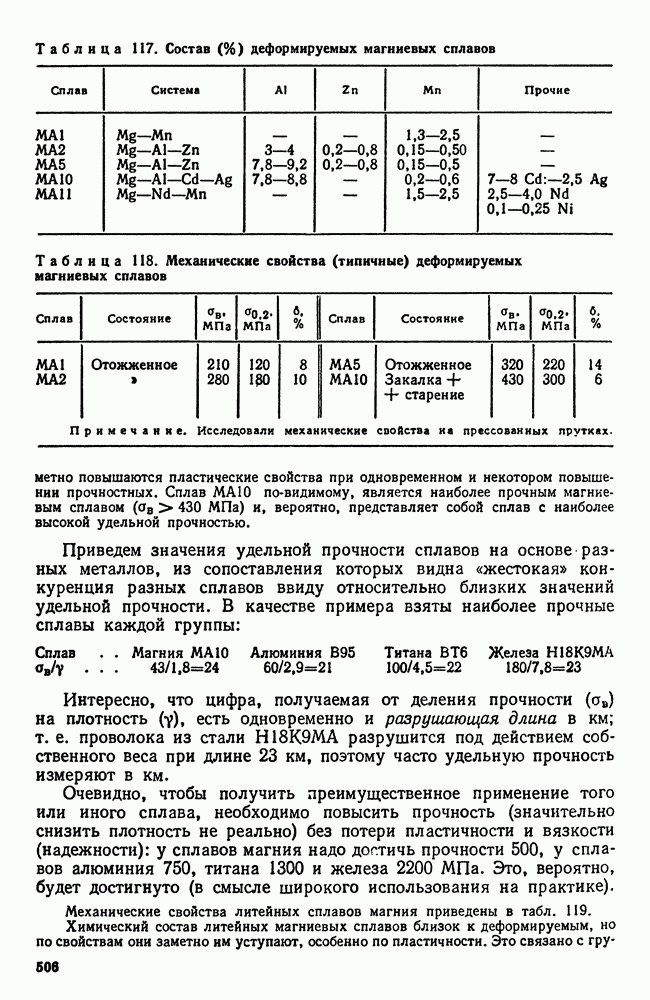
- 12. Сплавы магния
- 13. Бериллий
- 14. Сплавы бериллия
- Глава XXVII. МЕДЬ И ЕЕ СПЛАВЫ
- 2. Сплавы меди с цинком (латуни)
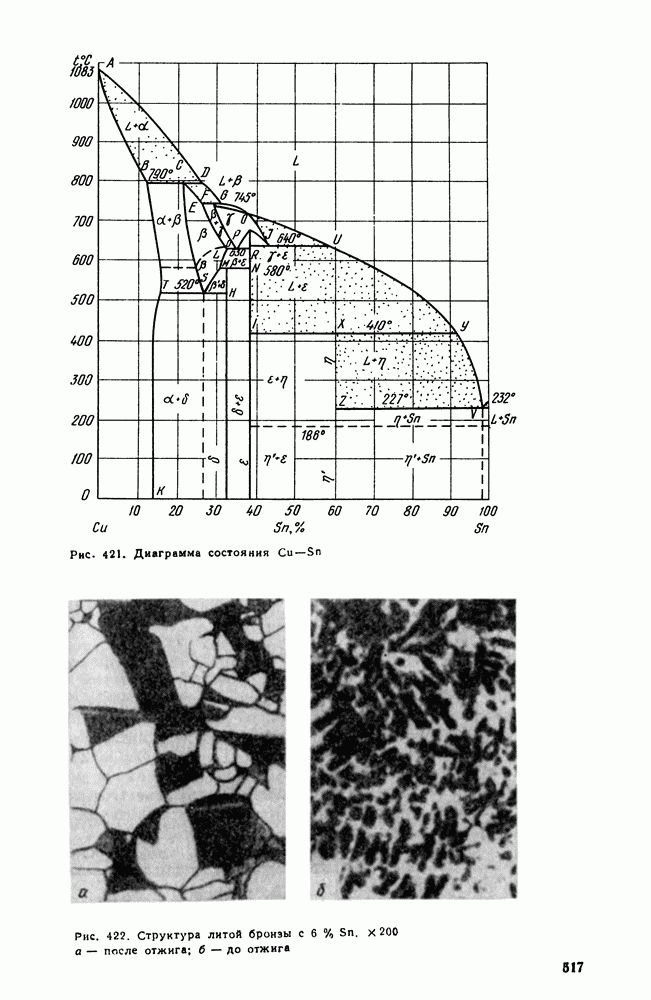
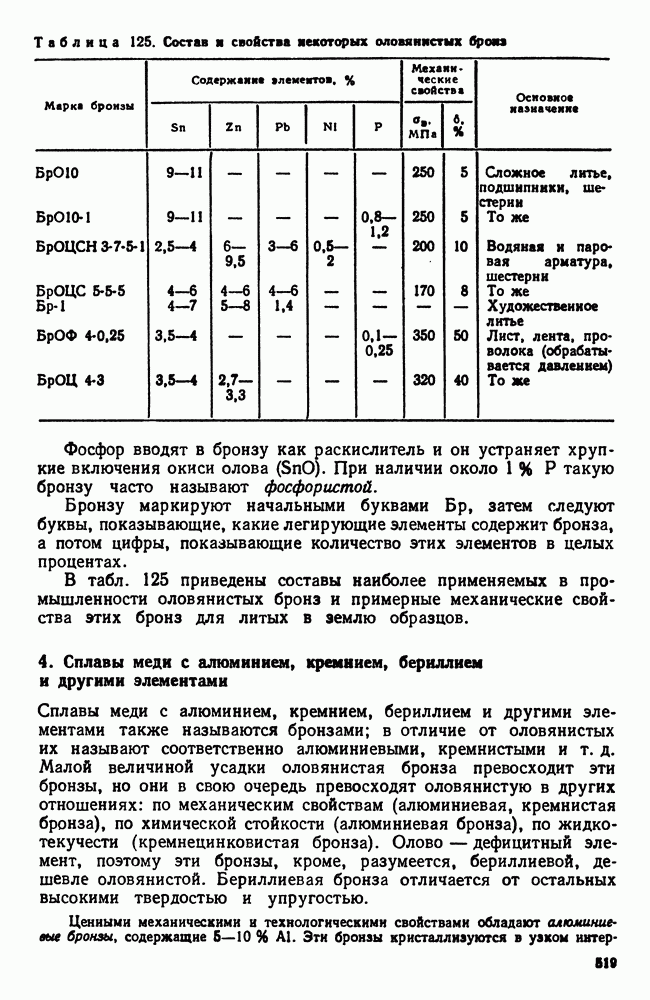
- 3. Сплавы меди с оловом (оловянистые бронзы)
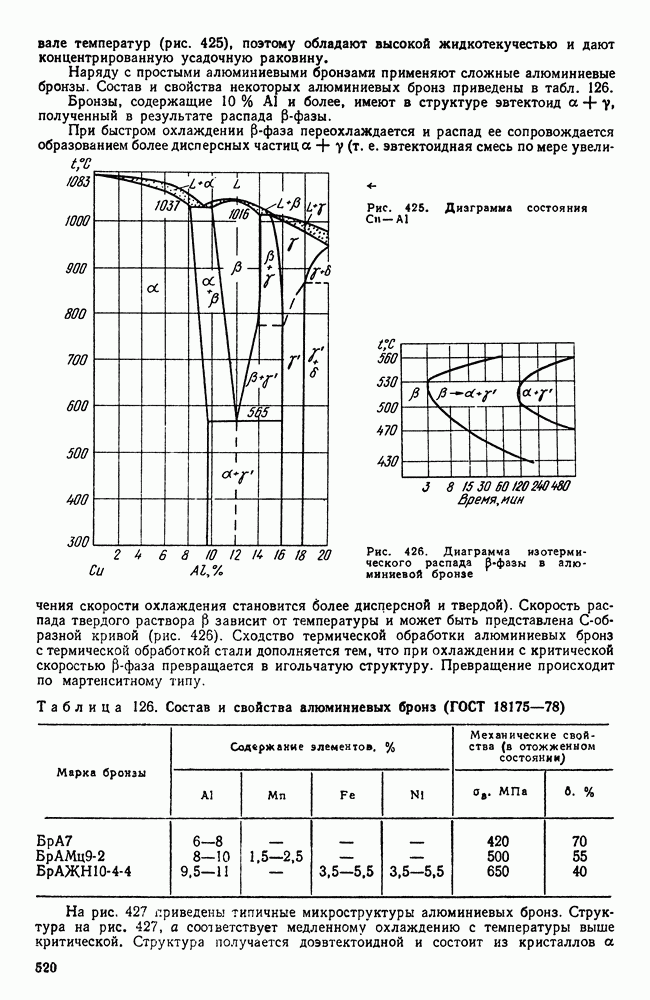
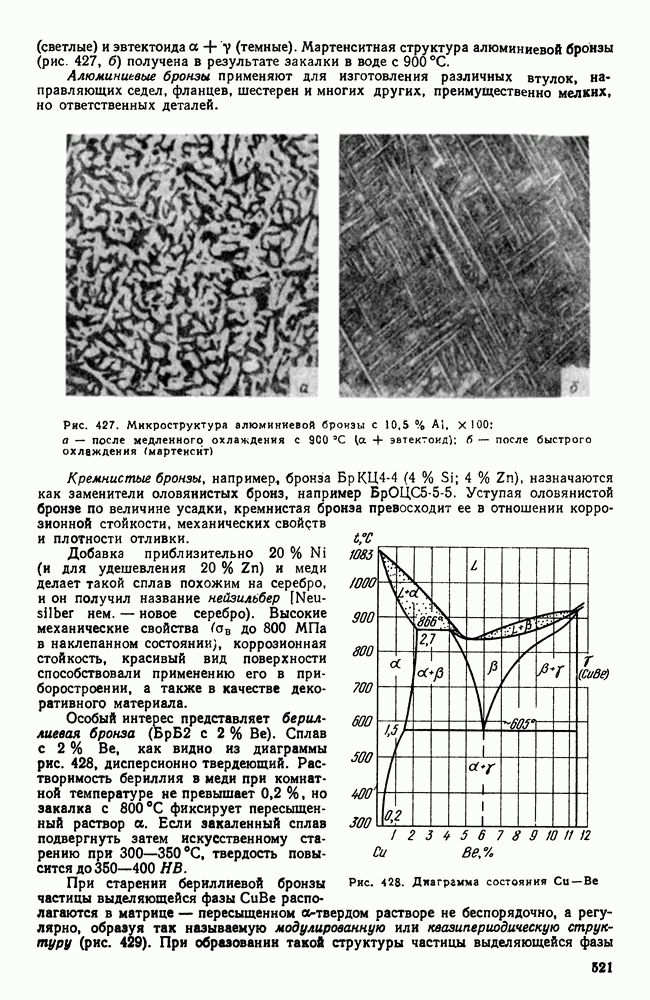
- 4. Сплавы меди с алюминием, кремнием, бериллием и другими элементами
- ГЛАВА XXVIII. ПОДШИПНИКОВЫЕ СПЛАВЫ И ПРИПОИ
- 2. Легкоплавкие подшипниковые сплавы (баббиты)
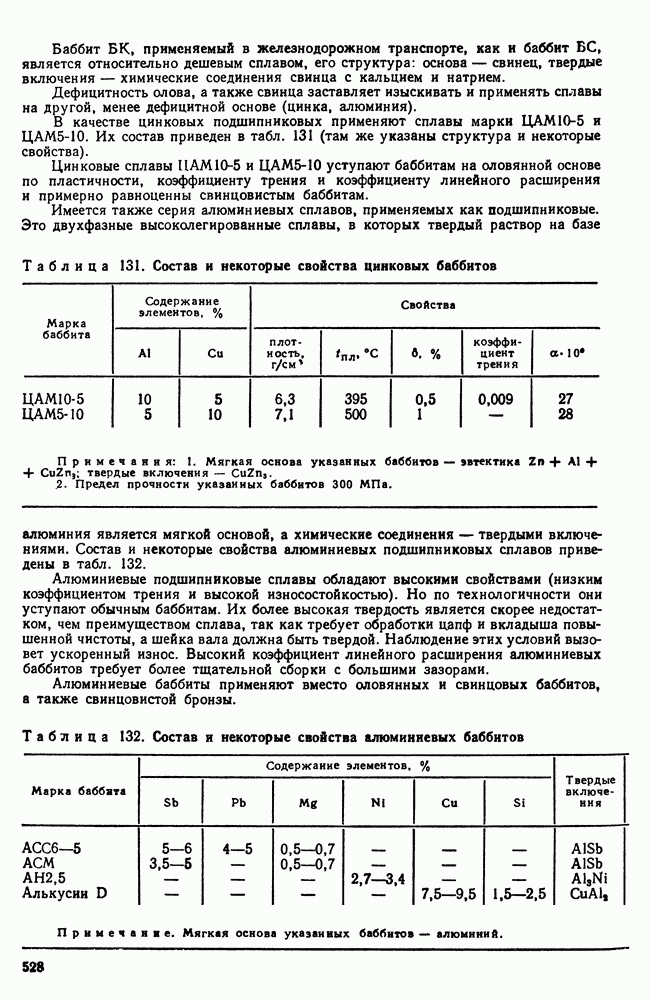
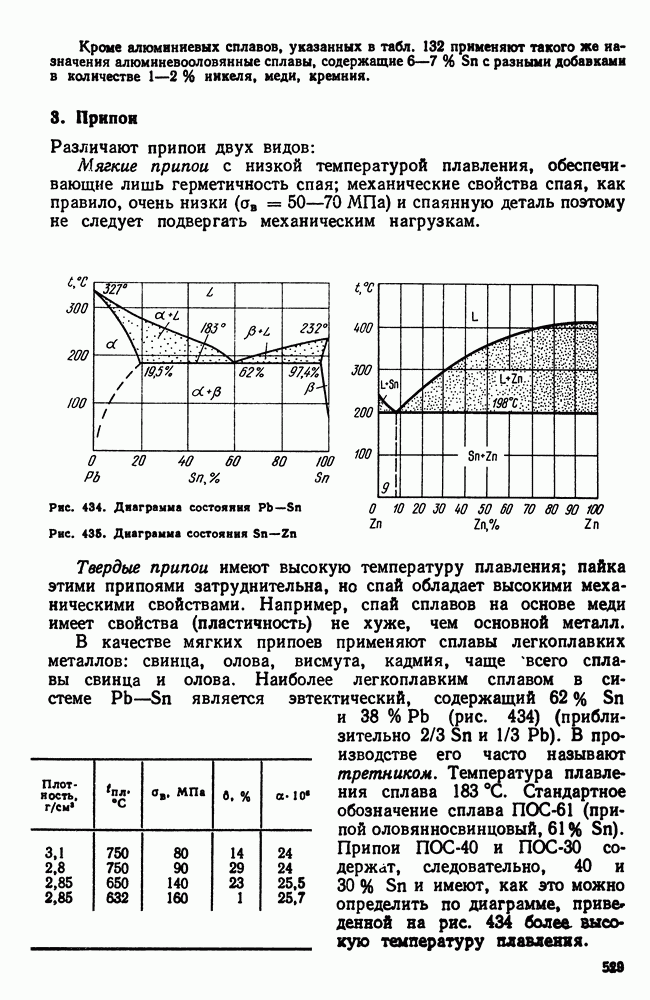
- 3. Припои
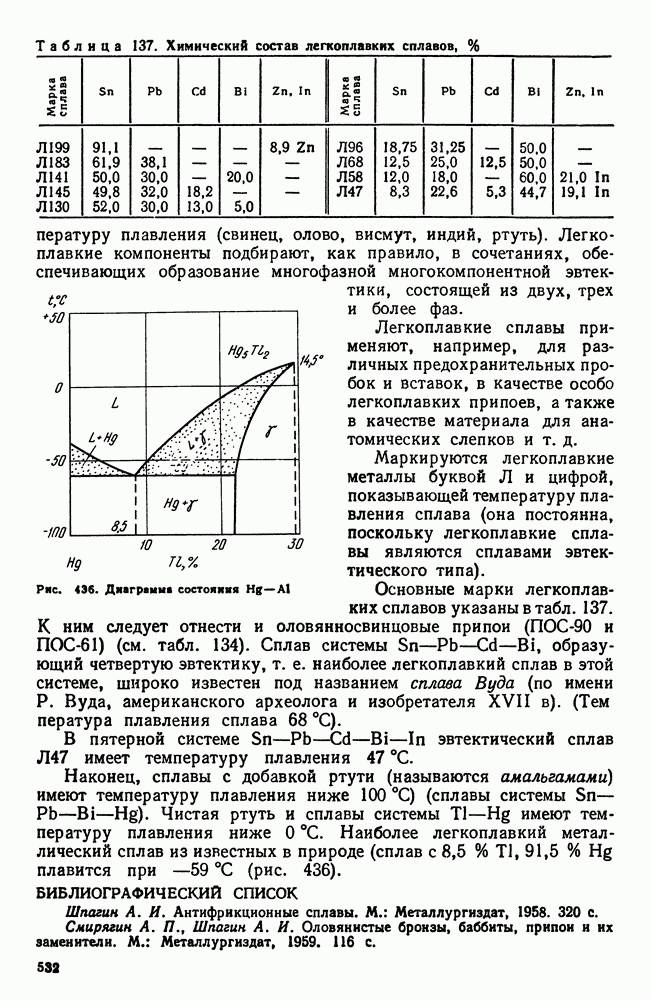
- 4. Легкоплавкие сплавы
- Глава XXIX. НЕКОТОРЫЕ СПЛАВЫ ЦВЕТНЫХ МЕТАЛЛОВ
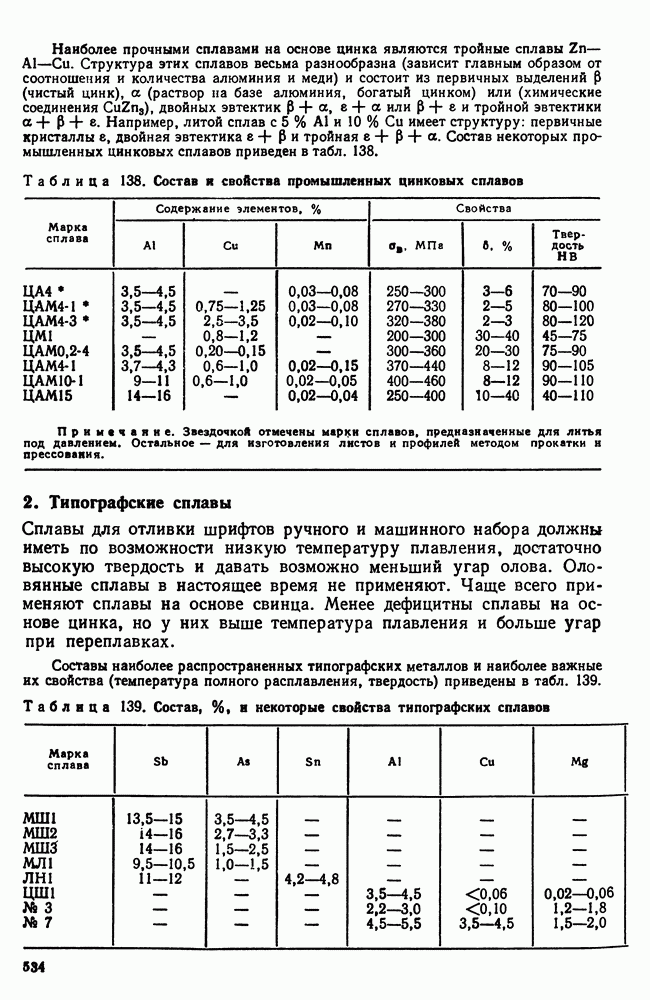
- 2. Типографские сплавы
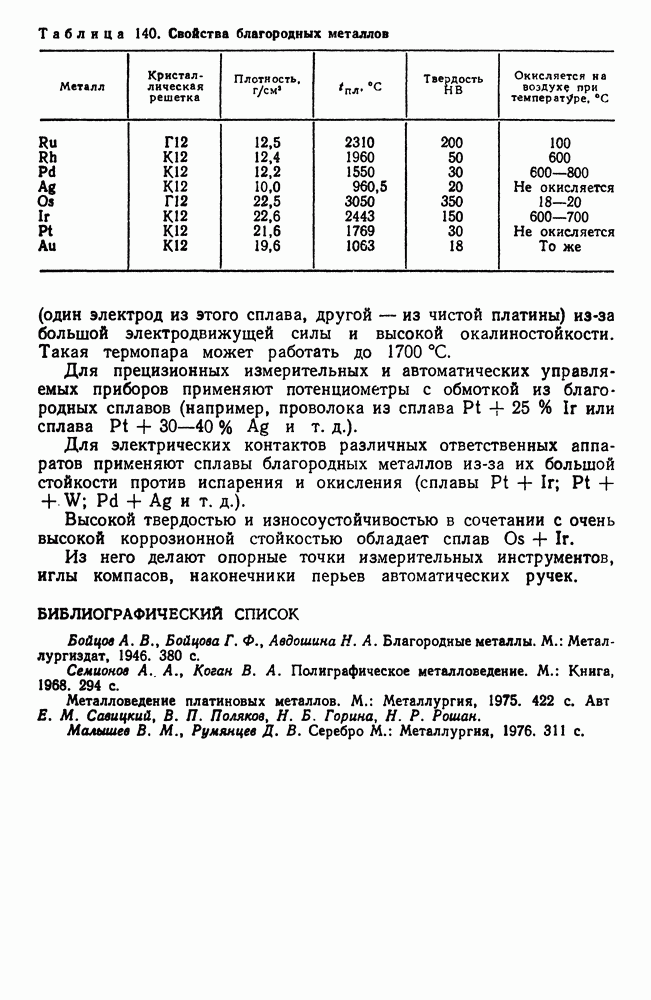
- 3. Благородные металлы