| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
МЕМБРАННЫЕ БЕЛКИ
Белки, ассоциированные с бислоем
Мембранные фосфолипиды играют роль растворителя для мембранных белков, создавая микроокружение, в котором последние могут функционировать. Из 20 аминокислот, входящих в состав белков, шесть являются в высшей степени гидрофобными из-за боковых групп, присоединенных к а-атому углерода, несколько аминокислот слабо гидрофобны, а остальные гидрофильны. Как мы видели в гл. 5, при образовании а-спирали гидрофобность самих пептидных групп минимизируется. Таким образом, белки могут образовывать единое целое с мембраной. Для этого нужно, чтобы их гидрофильные участки выступали из мембраны внутрь клетки и наружу, а гидрофобные пронизывали гидрофобную сердцевину бислоя. И в самом деле, те участки белковых молекул, которые погружены в мембрану, содержат большое количество гидрофобных аминокислот и характеризуются высоким содержанием а-спиралей или  -слоев.
-слоев.
Таблица 42.2. Ферментные маркеры различных мембран

Число разных белков в мембране варьирует от 6—8 в саркоплазматическом ретикулуме до более чем 100 в плазматической мембране. Это ферменты, транспортные белки, структурные белки, антигены (т. е. белки, определяющие гистосовместимость) и рецепторы для разных молекул. Поскольку каждая мембрана характеризуется своим набором белков, говорить о существовании некой типичной структуры мембран нельзя. В табл. 42.2 представлены ферментативные активности, присущие некоторым типам мембран.
Мембраны являются динамическими структурами. Мембранные белки и липиды постоянно обновляются. Скорости обновления разных липидов, как и разных белков, варьируют в широком диапазоне. Сами мембраны могут обновляться даже быстрее, чем любой их компонент. Более подробно этот вопрос будет рассмотрен в разделе, посвященном эндоцитозу.
Асимметрия мембран
Асимметрия является важным свойством мембран и, по-видимому, отчасти связана с неравномерным распределением белков в мембране. Трансмембранная асимметрия может быть обусловлена и разной локализацией углеводов, связанных с мембранными белками. Кроме того, на внешней или внутренней стороне мембраны могут быть расположены какие-то специфические ферменты; это касается как митохондриальных, так и плазматических мембран.
Мембраны обладают также локальной асимметрией. В некоторых случаях (например, в щеточной каемке клеток слизистых оболочек) она проявляется почти на макроскопическом уровне. В других случаях (например, в области щелевых контактов, плотных контактов и синапсов, занимающих очень небольшую часть площади мембраны) области локальной асимметрии невелики.
Наблюдается также асимметрия в распределении фосфолипидов между наружной и внутренней сторонами мембран (поперечная асимметрия). Так, холинсодержащие фосфолипиды (фосфатидилхолин и сфингомиелин) располагаются в основном в наружном молекулярном слое, а аминофосфолипиды
(фосфатидилсерин и фосфатидилэтаноламин) — преимущественно во внутреннем. Холестерол обычно содержится в наружном слое в больших количествах, чем во внутреннем. Очевидно, что если такая асимметрия в принципе существует, то поперечная подвижность (флип-флоп) мембранных фосфолипидов должна быть ограничена. И в самом деле, для фосфолипидов в синтетических бислоях характерна исключительно низкая скорость перескоков — время существования асимметрии может измеряться днями или неделями. Однако при искусственном включении в синтетические бислои некоторых мембранных белков, например эритроцитарного белка гликофорина, частота флип-флоп-переходов фосфолипидов может возрасти в сотню раз.
Механизмы асимметричного распределения липидов пока не установлены. Участвующие в синтезе фосфолипидов ферменты локализованы на цитоплазматической стороне мембран микросомных везикул. Таким образом, можно предположить, что существуют транслоказы, переносящие определенные фосфолипиды от внутреннего слоя к наружному. Кроме того, в обоих слоях могут присутствовать специфические белки, преимущественно связывающие те или иные фосфолипиды и приводящие к их асимметричному распределению.
Интегральные и периферические мембранные белки
Большинство мембранных белков являются интегральными компонентами мембран (они взаимодействуют с фосфолипидами); почти все достаточно полно изученные белки имеют протяженность, превышающую 5—10 нм, — величину, равную толщине бислоя. Эти интегральные белки обычно представляют собой глобулярные амфифильные структуры. Оба их конца гидрофильны, а участок, пересекающий сердцевину бислоя, гидрофобен. После установления структуры интегральных мембранных белков стало ясно, что некоторые из них (например, молекулы белков-переносчиков) могут пересекать бислой многократно, как это показано на рис. 42.7.
Интегральные белки распределены в бислое асимметрично (рис. 42.8). Если мембрану, содержащую асимметрично распределенные интегральные белки, растворить в детергенте, а затем детергент медленно удалить, то произойдет самоорганизация фосфолипидов и интегральных белков и сформируется мембранная структура, но белки в ней уже не будут специфическим образом ориентированы. Таким образом, асимметричная ориентация в мембране по крайней мере некоторых белков может задаваться при их включении в липидный бислой. Наружная гидрофильная часть амфифильного белка, которая, конечно, синтезируется внутри клетки, должна затем пересечь гидрофобный слой мембраны и в конечном итоге оказаться снаружи.

Рис. 42.7. Предполагаемая модель переносчика глюкозы у человека. Предполагается, что переносчик пересекает мембрану 12 раз. Пересекающие мембрану участки могут образовывать амфифильные а-спирали с амидной и гидроксильной боковыми группами и, по-видимому, связывают глюкозу или образуют канал для ее переноса. Амино - и карбоксильный концы цепи находятся на цитоплазматической поверхности. (Из работы Mueckler et al.: Sequence and structure of a human glucose transporter. Science, 1985. 229, 941, с любезного разрешения.)
Молекулярные механизмы организации мембран мы обсудим позже.
Периферические белки не взаимодействуют с фосфолипидами в бислое непосредственно; вместо этого они образуют слабые связи с гидрофильными участками специфических интегральных белков. Например, анкирин, периферический белок, связан с интегральным белком полосы III эритроцитарной мембраны. Спектрин, образующий скелет мембраны эритроцита, в свою очередь связан с анкирином и, таким образом, играет важную роль в поддержании двояковогнутой формы эритроцита. Молекулы иммуноглобулина являются интегральными белками плазматической мембраны и высвобождаются только вместе с небольшим фрагментом мембраны. Интегральными белками являются многие рецепторы различных гормонов, и специфические полипептидные гормоны, связывающиеся с этими рецепторами, можно, таким образом, считать периферическими белками. Такие периферические белки, как пептидные гормоны, могут даже детерминировать распределение в плоскости бислоя интегральных белков — их рецепторов (см. ниже).
| << Предыдущий параграф | Следующий параграф >> |
- Раздел IV. Структура, функция и репликация информационных макромолекул
- СТРУКТУРА ПУРИНОВЫХ И ПИРИМИДИНОВЫХ ОСНОВАНИЙ
- ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА ПУРИНОВЫХ И ПИРИМИДИНОВЫХ ОСНОВАНИЙ
- НУКЛЕОЗИДЫ И НУКЛЕОТИДЫ
- ПРИРОДНЫЕ НУКЛЕОТИДЫ
- СИНТЕТИЧЕСКИЕ АНАЛОГИ НУКЛЕОТИДОВ
- Глава 35. Метаболизм пуриновых и пиримидиновых нуклеотидов
- УСВОЕНИЕ
- ПУРИНЫ
- ПИРИМИДИНЫ
- КЛИНИЧЕСКИЕ НАРУШЕНИЯ МЕТАБОЛИЗМА ПУРИНОВ (ТАБЛ. 35.1)
- ЗАБОЛЕВАНИЯ, СВЯЗАННЫЕ С НАРУШЕНИЕМ МЕТАБОЛИЗМА ПИРИМИДИНОВ (ТАБЛ. 35.3)
- Глава 36. Технология рекомбинантных ДНК
- ОСНОВНЫЕ СВОЙСТВА ДНК
- ОСНОВНЫЕ ПОНЯТИЯ ГЕННОЙ ИНЖЕНЕРИИ
- НЕКОТОРЫЕ ПРАКТИЧЕСКИЕ ПРИЛОЖЕНИЯ ТЕХНОЛОГИИ РЕКОМБИНАНТНОЙ ДНК
- ГЕННАЯ ИНЖЕНЕРИЯ И АНАЛИЗ МОЛЕКУЛЯРНОЙ ПРИРОДЫ ЗАБОЛЕВАНИЙ
- СЛОВАРЬ-СПРАВОЧНИК
- ЛИТЕРАТУРА
- Глава 37. Структура и функция нуклеиновых кислот
- ДНК
- РНК
- Глава 38. Организация и репликация ДНК
- ХРОМАТИН
- ГИСТОНЫ И НУКЛЕОСОМЫ
- ГЕНЕТИЧЕСКАЯ ОРГАНИЗАЦИЯ ГЕНОМА МЛЕКОПИТАЮЩИХ
- ИЗМЕНЕНИЯ И ПЕРЕСТРОЙКИ ГЕНЕТИЧЕСКОГО МАТЕРИАЛА
- СИНТЕЗ И РЕПЛИКАЦИЯ ДНК
- Глава 39. Синтез и процессинг РНК
- СИНТЕЗ РНК
- ПРОЦЕССИНГ МОЛЕКУЛ РНК
- НУКЛЕАЗЫ
- Глава 40. Синтез белка и генетический код
- ИНФОРМАЦИОННЫЙ ПОТОК
- КОДОНЫ И СИНТЕЗ БЕЛКА
- ТРАНСПОРТНЫЕ РНК И СИНТЕЗ БЕЛКА
- МУТАЦИИ
- ПРОЦЕСС СИНТЕЗА БЕЛКА
- Глава 41. Регуляция экспрессии генов
- РЕГУЛЯЦИЯ ЭКСПРЕССИИ ГЕНОВ У ПРОКАРИОТ
- РЕГУЛЯЦИЯ ЭКСПРЕССИИ ГЕНОВ У ЭУКАРИОТ
- Раздел V. Биохимия внутри- и межклеточных коммуникаций
- Глава 42. Мембраны: структура, сборка и функции
- ПОДДЕРЖАНИЕ НОРМАЛЬНОГО СОСТАВА СРЕДЫ
- СТРУКТУРА МЕМБРАН
- ОРГАНИЗАЦИЯ МЕМБРАННЫХ ЛИПИДОВ
- МЕМБРАННЫЕ БЕЛКИ
- ИСКУССТВЕННЫЕ МЕМБРАНЫ
- ЖИДКОСТНО-МОЗАИЧНАЯ МОДЕЛЬ МЕМБРАН
- СБОРКА МЕМБРАН
- СПЕЦИАЛИЗИРОВАННЫЕ ФУНКЦИИ МЕМБРАН
- ТРАНСМЕМБРАННЫЙ ПЕРЕНОС МАЛЫХ МОЛЕКУЛ
- ТРАНСМЕМБРАННОЕ ПЕРЕМЕЩЕНИЕ МАКРОМОЛЕКУЛ
- ПЕРЕДАЧА ИНФОРМАЦИИ В КЛЕТКУ
- МЕЖКЛЕТОЧНЫЕ КОНТАКТЫ И КОММУНИКАЦИИ
- Глава 43. Характеристика эндокринной системы
- ОБЩИЕ СВОЙСТВА
- РАЗНООБРАЗИЕ ЭНДОКРИННОЙ СИСТЕМЫ
- КОНЦЕПЦИЯ ЖЕЛЕЗЫ-МИШЕНИ
- КОНЦЕПЦИЯ РЕГУЛЯТОРНОГО МЕХАНИЗМА ОБРАТНОЙ СВЯЗИ
- РЕЦЕПТОРЫ ГОРМОНОВ
- Глава 44. Действие гормонов
- КЛАССИФИКАЦИЯ ГОРМОНОВ
- МЕХАНИЗМ ДЕЙСТВИЯ ГОРМОНОВ I ГРУППЫ
- МЕХАНИЗМ ДЕЙСТВИЯ ГОРМОНОВ II ГРУППЫ (ПЕПТИДНЫХ ГОРМОНОВ)
- 1. сАМР КАК ВТОРОЙ ПОСРЕДНИК
- 2. ДЕЙСТВИЕ ГОРМОНОВ, ОПОСРЕДОВАННОЕ КАЛЬЦИЕМ И ФОСФОИНОЗИТИДАМИ
- 3. ГОРМОНЫ С НЕИЗВЕСТНЫМ ВНУТРИКЛЕТОЧНЫМ ПОСРЕДНИКОМ
- Глава 45. Гормоны гипофиза и гипоталамуса
- ГОРМОНЫ ГИПОТАЛАМУСА
- ГОРМОНЫ ПЕРЕДНЕЙ ДОЛИ ГИПОФИЗА
- I. ГРУППА ГОРМОН РОСТА — ПРОЛАКТИН—ХОРИОНИЧЕСКИЙ СОМАТОМАММОТРОПИН
- 2. ГРУППА ГЛИКОПРОТЕИНОВЫХ ГОРМОНОВ
- 3. СЕМЕЙСТВО ПЕПТИДОВ ПРООПИОМЕЛАНОКОРТИНА (ПОМК)
- ГОРМОНЫ ЗАДНЕЙ ДОЛИ ГИПОФИЗА
- 1. ОКСИТОЦИН
- 2. АНТИДИУРЕТИЧЕСКИЙ ГОРМОН (АДГ; ВАЗОПРЕССИН)
- Глава 46. Гормоны щитовидной железы
- БИОСИНТЕЗ ТИРЕОИДНЫХ ГОРМОНОВ
- 1. МЕТАБОЛИЗМ ТИРЕОГЛОБУЛИНА
- 2. МЕТАБОЛИЗМ ИОДИДА
- ТРАНСПОРТ И МЕТАБОЛИЗМ ГОРМОНОВ ЩИТОВИДНОЙ ЖЕЛЕЗЫ
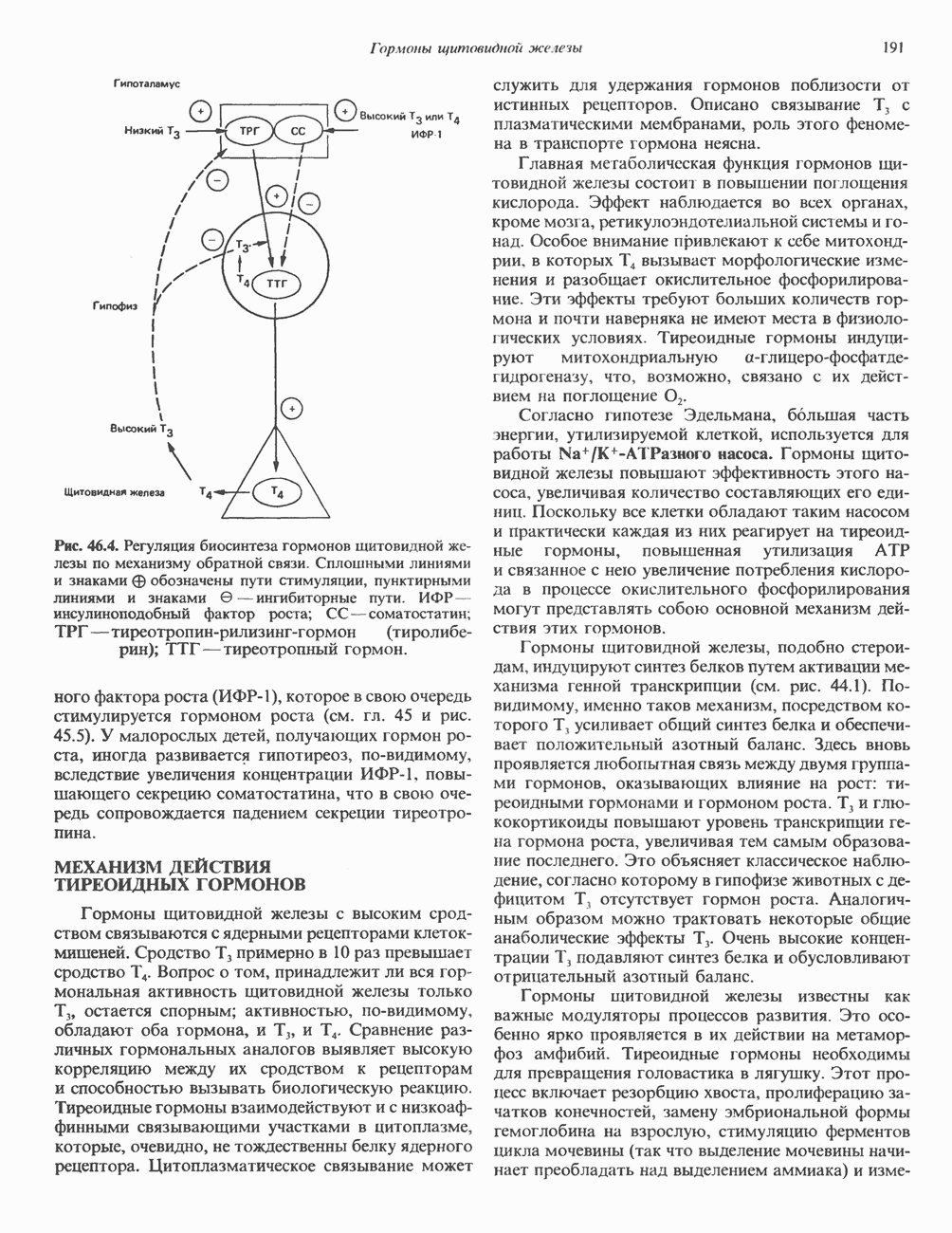
- РЕГУЛЯЦИЯ СИНТЕЗА И ВЫСВОБОЖДЕНИЯ ГОРМОНОВ ЩИТОВИДНОМ ЖЕЛЕЗЫ
- МЕХАНИЗМ ДЕЙСТВИЯ ТИРЕОИДНЫХ ГОРМОНОВ
- ПАТОФИЗИОЛОГИЯ
- Глава 47. Гормоны, регулирующие метаболизм кальция
- ОБЩИЕ ХАРАКТЕРИСТИКИ
- ГОМЕОСТАЗ КАЛЬЦИЯ
- ГОРМОНЫ, УЧАСТВУЮЩИЕ В ГОМЕОСТАЗЕ КАЛЬЦИЯ
- 2. КАЛЬЦИТРИОЛ
- 3. КАЛЬЦИТОНИН (КТ)
- Глава 48. Гормоны коры надпочечников
- ГОРМОНЫ
- НОМЕНКЛАТУРА И ХИМИЯ СТЕРОИДОВ
- БИОСИНТЕЗ СТЕРОИДНЫХ ГОРМОНОВ НАДПОЧЕЧНИКОВ
- СЕКРЕЦИЯ, ТРАНСПОРТ И МЕТАБОЛИЗМ СТЕРОИДНЫХ ГОРМОНОВ НАДПОЧЕЧНИКОВ
- РЕГУЛЯЦИЯ СИНТЕЗА СТЕРОИДНЫХ ГОРМОНОВ НАДПОЧЕЧНИКОВ
- ВОЗДЕЙСТВИЕ СТЕРОИДНЫХ ГОРМОНОВ НАДПОЧЕЧНИКОВ НА МЕТАБОЛИЗМ
- КЛАССИФИКАЦИЯ И МЕХАНИЗМ ДЕЙСТВИЯ СТЕРОИДНЫХ ГОРМОНОВ
- ПАТОФИЗИОЛОГИЯ КОРЫ НАДПОЧЕЧНИКОВ
- Глава 49. Гормоны мозгового вещества надпочечников
- БИОСИНТЕЗ КАТЕХОЛАМИНОВ
- ЗАПАСАНИЕ И СЕКРЕЦИЯ КАТЕХОЛАМИНОВ
- МЕТАБОЛИЗМ КАТЕХОЛАМИНОВ
- РЕГУЛЯЦИЯ СИНТЕЗА КАТЕХОЛАМИНОВ
- КЛАССИФИКАЦИЯ И МЕХАНИЗМ ДЕЙСТВИЯ КАТЕХОЛАМИНОВ
- ПАТОФИЗИОЛОГИЯ МОЗГОВОГО СЛОЯ НАДПОЧЕЧНИКОВ
- Глава 50. Гормоны половых желез
- ГОРМОНЫ СЕМЕННИКОВ
- РЕГУЛЯЦИЯ ФУНКЦИИ СЕМЕННИКОВ
- ФИЗИОЛОГИЧЕСКИЕ ЭФФЕКТЫ ГОРМОНОВ СЕМЕННИКОВ
- МЕХАНИЗМ ДЕЙСТВИЯ ГОРМОНОВ СЕМЕННИКОВ
- ПАТОФИЗИОЛОГИЯ РЕПРОДУКТИВНОЙ СИСТЕМЫ У МУЖЧИН
- БИОСИНТЕЗ И МЕТАБОЛИЗМ ГОРМОНОВ ЯИЧНИКОВ
- РЕГУЛЯЦИЯ И ФИЗИОЛОГИЧЕСКОЕ ДЕЙСТВИЕ ГОРМОНОВ ЯИЧНИКОВ
- МЕХАНИЗМ ДЕЙСТВИЯ ГОРМОНОВ ЯИЧНИКОВ
- ПАТОФИЗИОЛОГИЯ ЖЕНСКОЙ РЕПРОДУКТИВНОЙ СИСТЕМЫ
- ГОРМОНЫ ПОЛОВЫХ ЖЕЛЕЗ И ПОЛОВАЯ ДИФФЕРЕНЦИРОВКА
- ФЕНОТИПИЧЕСКИЙ ПОЛ
- Глава 51. Гормоны поджелудочной железы
- ИНСУЛИН
- ИНСУЛИНОПОДОБНЫЕ ФАКТОРЫ РОСТА
- ГЛЮКАГОН
- СОМАТОСТАТИН
- ПАНКРЕАТИЧЕСКИЙ ПОЛИПЕПТИД
- Глава 52. Гормоны желудочно-кишечного тракта
- СВОЙСТВА ГОРМОНОВ ЖЕЛУДОЧНО-КИШЕЧНОГО ТРАКТА
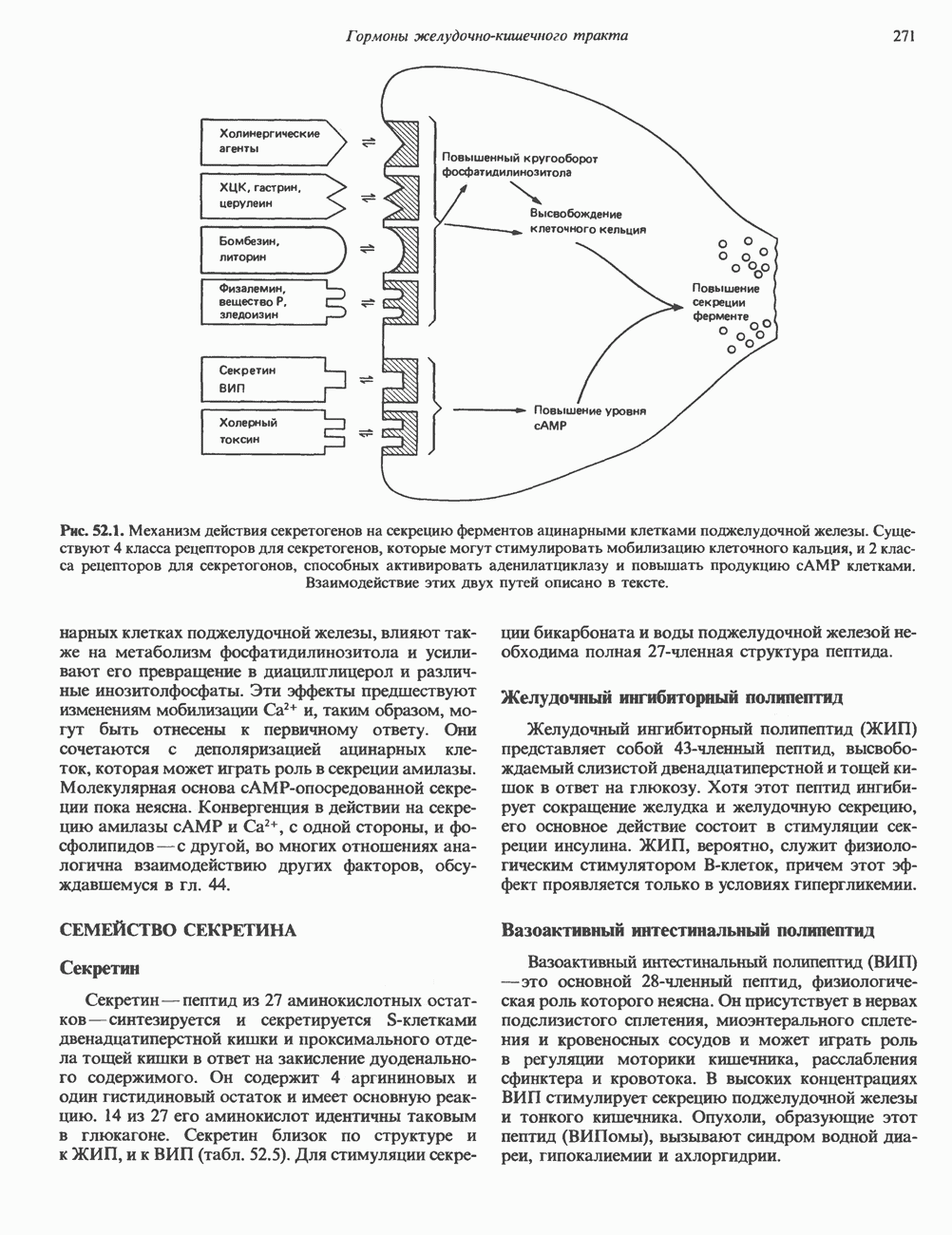
- СЕМЕЙСТВО СЕКРЕТИНА
- СЕМЕЙСТВО ГАСТРИН—ХОЛЕЦИСТОКИНИН
- ДРУГИЕ ПЕПТИДЫ ЖЕЛУДОЧНО-КИШЕЧНОГО ТРАКТА
- Раздел VI. Частные вопросы
- Питание, пищеварение и всасывание
- ПИТАНИЕ
- РАСХОД ЭНЕРГИИ
- АЗОТ АМИНОКИСЛОТ И ПОТРЕБНОСТЬ В СПЕЦИФИЧЕСКИХ АМИНОКИСЛОТАХ
- ПОТРЕБНОСТЬ В УГЛЕВОДАХ
- ПОТРЕБНОСТЬ В ПИЩЕВЫХ ВОЛОКНАХ
- ПОТРЕБНОСТЬ В ЛИПИДАХ
- ПОТРЕБНОСТЬ В ВИТАМИНАХ
- ПОТРЕБНОСТЬ В МИНЕРАЛЬНЫХ ВЕЩЕСТВАХ
- РЕКОМЕНДАЦИИ В ОБЛАСТИ ДИЕТЫ
- ПИЩЕВАРЕНИЕ
- ПИЩЕВАРЕНИЕ В ЖЕЛУДКЕ
- ПАНКРЕАТИЧЕСКОЕ И КИШЕЧНОЕ ПИЩЕВАРЕНИЕ
- ВСАСЫВАНИЕ В ЖЕЛУДОЧНО-КИШЕЧНОМ ТРАКТЕ
- ВСАСЫВАНИЕ ГЛЮКОЗЫ
- ВСАСЫВАНИЕ ЛИПИДОВ
- ВСАСЫВАНИЕ АМИНОКИСЛОТ И БЕЛКА
- ПРОЦЕССЫ ГНИЕНИЯ И БРОЖЕНИЯ В КИШЕЧНИКЕ
- Глава 54. Гликопротеины и протеогликаны
- ГЛИКОПРОТЕИНЫ
- ОПРЕДЕЛЕНИЕ, ОЧИСТКА И СТРУКТУРНЫЙ АНАЛИЗ ГЛИКОПРОТЕИНОВ
- САХАРА, ПРИСУТСТВУЮЩИЕ В ГЛИКОПРОТЕИНАХ
- НУКЛЕОТИДСАХАРА
- ЭКЗОГЛИКОЗИДАЗЫ И ЭНДОГЛИКОЗИДАЗЫ
- ЛЕКТИНЫ
- КЛАССИФИКАЦИЯ ГЛИКОПРОТЕИНОВ
- I-КЛЕТОЧНАЯ БОЛЕЗНЬ
- АНТИГЕНЫ ГРУПП КРОВИ
- ПРОТЕОГЛИКАНЫ И ГЛИКОЗАМИНОГЛИКАНЫ
- ДЕГРАДАЦИЯ ПОЛИСАХАРИДНЫХ КОМПОНЕНТОВ ГЛИКОПРОТЕИНОВ И ПРОТЕОГЛИКАНОВ
- ФУНКЦИИ ГЛИКОЗАМИНОГЛИКАНОВ И ПРОТЕОГЛИКАНОВ
- Глава 55. Плазма крови и процесс свертывания
- ФУНКЦИИ КРОВИ
- БЕЛКИ ПЛАЗМЫ
- СВЕРТЫВАНИЕ КРОВИ
- Глава 56. Сократительные и структурные белки
- МЫШЦЫ
- КЛЕТОЧНАЯ ПОДВИЖНОСТЬ И ЦИТОСКЕЛЕТ
- Глава 57. Рак, онкогены, факторы роста
- БИОХИМИЧЕСКИЕ ЛАБОРАТОРНЫЕ ТЕСТЫ И РАК
- ПРИЧИНЫ ВОЗНИКНОВЕНИЯ РАКОВЫХ ОПУХОЛЕЙ
- ОНКОГЕННЫЕ ВИРУСЫ
- ТРАНСФОРМАЦИЯ
- ОНКОГЕНЫ
- ПОЛИПЕПТИДНЫЕ ФАКТОРЫ РОСТА
- ДЕЙСТВИЕ ФАКТОРОВ РОСТА ПО ЭНДОКРИННОМУ, ПАРАКРИННОМУ ИЛИ АУТОКРИННОМУ ТИПУ
- БИОХИМИЧЕСКИЕ МЕХАНИЗМЫ ДЕЙСТВИЯ ФАКТОРОВ РОСТА
- ФАКТОРЫ РОСТА И ОНКОГЕНЫ
- ПРОГРЕССИЯ ОПУХОЛЕЙ
- МЕТАСТАЗИРОВАНИЕ
- Приложение
- ХИМИЧЕСКИЙ СОСТАВ КРОВИ И ЖИДКИХ СРЕД ОРГАНИЗМА
- СТАНДАРТНЫЕ КЛИНИКО-ЛАБОРАТОРНЫЕ ПОКАЗАТЕЛИ В ТРАДИЦИОННОЙ СИСТЕМЕ И СИСТЕМЕ СИ
- НОРМАЛЬНЫЕ ЛАБОРАТОРНЫЕ ПОКАЗАТЕЛИ
- Список сокращений