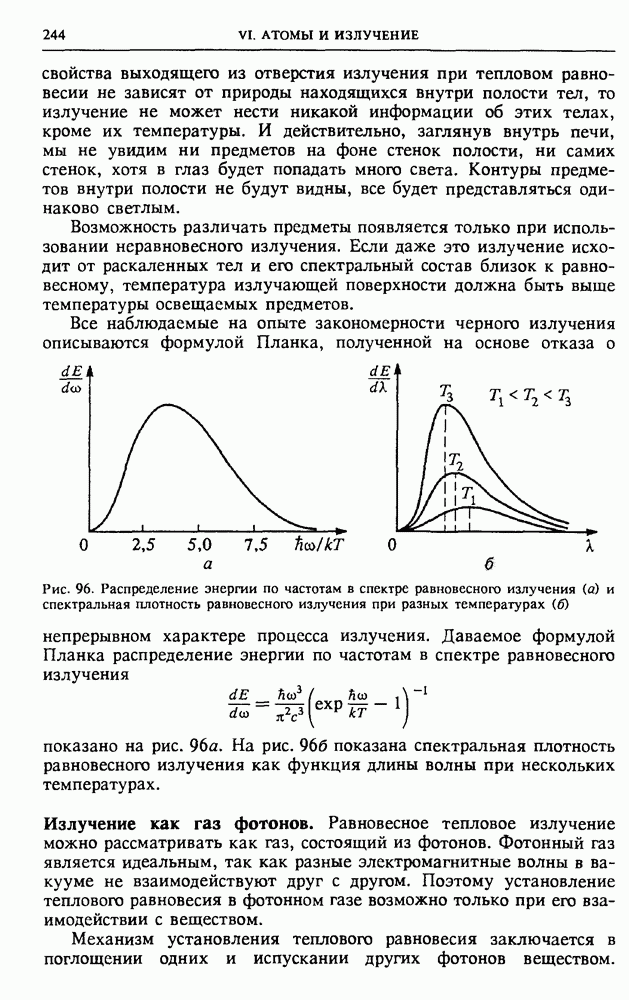
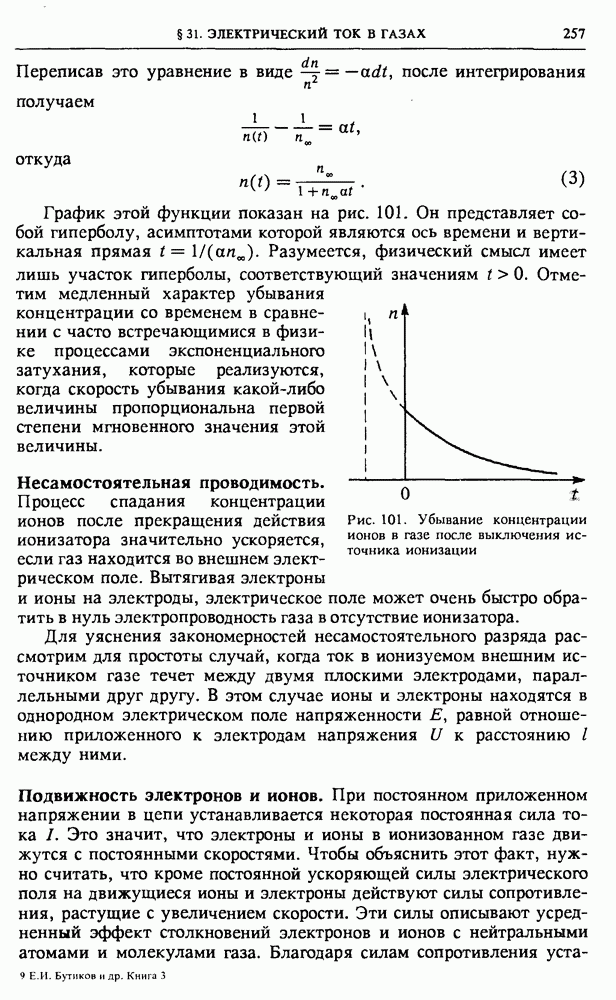
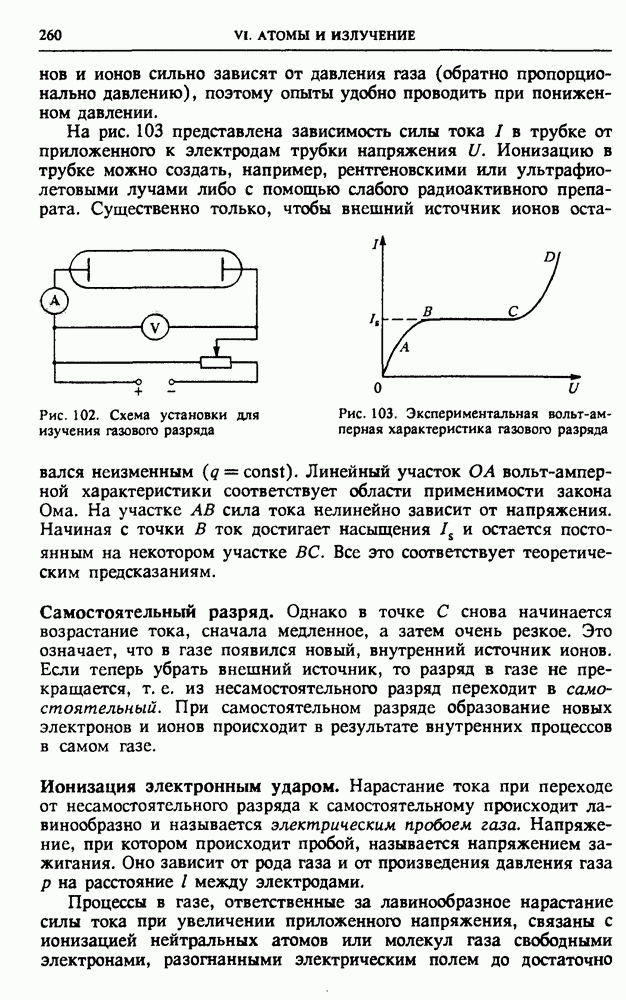
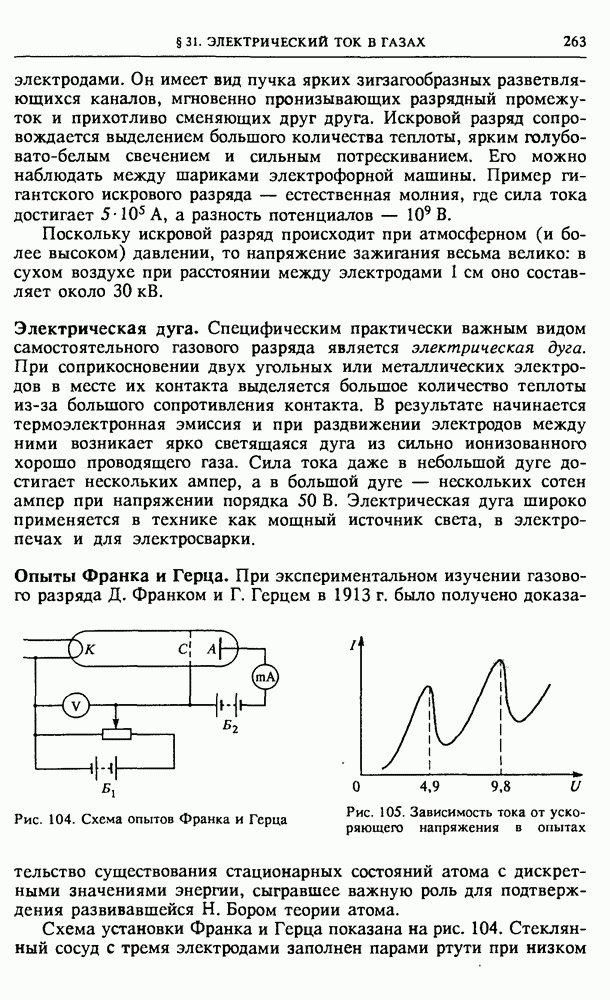
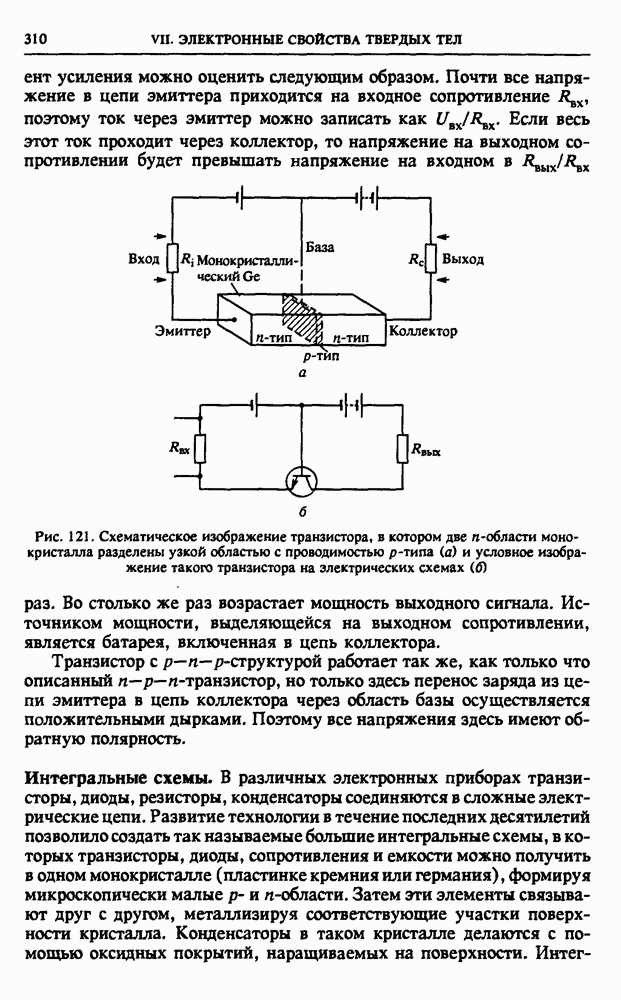
| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
§ 12. Молекулы
Все тела состоят из атомов или молекул. Что удерживает атомы в молекуле? Атомы соединяются в молекулы силами, которые обычно называют химическими. Конечно, никаких фундаментальных «химических» взаимодействий в природе не существует. Эти силы всегда сводятся к известным нам фундаментальным физическим взаимодействиям, причем определяющую роль в формировании химических связей играют электромагнитные силы. Проявления этих сил, несмотря на единую физическую природу, чрезвычайно разнообразны. Богатейший опыт изучения результатов действия сил между атомами накоплен в химии, но лишь с развитием квантовых представлений удалось дать объяснение разнообразным проявлениям этих сил на основе фундаментальных физических законов.
Химические силы и физика. Многие молекулы состоят всего из нескольких атомов. Однако существуют и гигантские молекулы, например молекулы белков, которые содержат десятки или даже сотни тысяч атомов. Роль физики состоит в том, чтобы объяснить
химическое взаимодействие атомов, т. е. то, как атомы соединяются в молекулы, а затем образуют макроскопические тела. Оказывается, что при переходе от микроскопических явлений к макроскопическим в некоторых случаях роль квантовых эффектов сохраняется, т. е. квантовая природа проявляется не только в микромире, но и в многочисленных свойствах макрообъектов. Например, высокая электропроводность меди и ее практически полное отсутствие у кварца объясняются в конечном счете именно квантовыми эффектами. Существование постоянных магнитов и сверхпроводников представляет собой особенно яркие примеры проявления квантовых эффектов в макромире.
Можно выделить два принципиально различных механизма, обеспечивающих связь атомов в молекулах: это так называемые ионная и ковалентная связи.
Ионная связь между атомами. Типичный представитель ионной связи — хорошо известная поваренная соль, называемая в химии хлористым натрием  Каким образом два разнородных атома — атом металла натрия и атом газа хлора — образуют устойчивое соединение?
Каким образом два разнородных атома — атом металла натрия и атом газа хлора — образуют устойчивое соединение?
Атом натрия имеет один электрон на внешней оболочке; атом хлора имеет семь электронов на внешней оболочке, где в принципе может находиться восемь электронов, т. е. ему недостает одного электрона до заполнения внешней оболочки. Если один электрон атома натрия передать атому хлора, то и у того, и у другого образуются максимально устойчивые электронные конфигурации из целиком заполненных оболочек. Чтобы отнять электрон у атома натрия, нужно затратить энергию 5,1 эВ. При захвате этого электрона нейтральным атомом хлора образуется отрицательный ион  и при этом освобождается энергия 3,7 эВ.
и при этом освобождается энергия 3,7 эВ.
Казалось бы, образование молекулы  энергетически невыгодно, и такое соединение не может быть устойчивым. Однако между ионами с зарядами противоположных знаков существует электростатическое притяжение, и при их сближении потенциальная энергия взаимодействия убывает. При расстоянии между центрами двух ионов, равном 1,1 нм, убыль потенциальной энергии взаимодействия компенсирует затраты энергии в 1,4 эВ, необходимые для перехода электрона от атома натрия к атому хлора с образованием двух ионов. При дальнейшем сближении ионов появляется уже выигрыш в энергии, что приводит к более сильной связи ионов в молекуле.
энергетически невыгодно, и такое соединение не может быть устойчивым. Однако между ионами с зарядами противоположных знаков существует электростатическое притяжение, и при их сближении потенциальная энергия взаимодействия убывает. При расстоянии между центрами двух ионов, равном 1,1 нм, убыль потенциальной энергии взаимодействия компенсирует затраты энергии в 1,4 эВ, необходимые для перехода электрона от атома натрия к атому хлора с образованием двух ионов. При дальнейшем сближении ионов появляется уже выигрыш в энергии, что приводит к более сильной связи ионов в молекуле.
Однако ионы могут сближаться лишь до некоторого предела (0,24 нм), соответствующего равновесному расстоянию между ионами в молекуле. На таком расстоянии кулоновские силы притяжения уравновешиваются силами отталкивания, имеющими неэлектростатическое происхождение и связанными с проявлением принципа
Паули. Дело в том, что при сближении ионов доступная для движения их электронов область пространства уменьшается, а это в свою очередь неизбежно ведет к увеличению кинетической энергии электронов. Это сугубо квантовый эффект, который можно объяснить с помощью соотношения неопределенностей Гейзенберга: при уменьшении области движения, т. е. неопределенности значения координат, неизбежно растет неопределенность значения импульса, а следовательно, и сам импульс.
Обусловленные принципом Паули силы отталкивания пренебрежимо малы, пока расстояние между ионами больше равновесного значения, и резко возрастают при попытке сблизить ионы на меньшее расстояние. Именно о таком характере зависимости сил отталкивания от расстояния говорит тот факт, что расчет энергии связи ионной молекулы  в котором учитывается только электростатическое взаимодействие ионов, дает хорошо согласующееся с опытом значение 5,5 эВ. Ситуация здесь аналогична распределению потенциальной энергии упругой деформации двух последовательно соединенных пружин разной жесткости: в основном энергию запасает менее жесткая пружина, т. е. та, у которой меньше коэффициент жесткости к. Это обстоятельство позволяет считать ионы твердыми шарами определенного радиуса.
в котором учитывается только электростатическое взаимодействие ионов, дает хорошо согласующееся с опытом значение 5,5 эВ. Ситуация здесь аналогична распределению потенциальной энергии упругой деформации двух последовательно соединенных пружин разной жесткости: в основном энергию запасает менее жесткая пружина, т. е. та, у которой меньше коэффициент жесткости к. Это обстоятельство позволяет считать ионы твердыми шарами определенного радиуса.
Ковалентная связь. Ионная связь, возникающая в результате перехода одного или нескольких электронов от одного атома к другому, характерна для соединений, в которых участвуют химические элементы из противоположных концов периода системы Менделеева. Ковалентная связь возникает вследствие обобществления атомами одного или нескольких электронов и характерна для одинаковых или близких по своим химическим свойствам атомов.
В простейшем виде ковалентная связь реализуется в молекулярном ионе водорода  в котором оба протона имеют всего один общий электрон. Электростатическое отталкивание протонов стремится развалить молекулу. Но, с другой стороны, энергия связи электрона в поле двух протонов, конечно, больше, чем при наличии только одного протона. При определенном расстоянии между протонами (0,1 нм) второй фактор оказывается более существенным, что обеспечивает устойчивость такой системы. Для удаления одного из протонов и образования атома водорода в основном состоянии требуется энергия 2,55 эВ. Еще прочнее оказывается ковалентная связь в нейтральной молекуле водорода (4,48 эВ), где она образуется двумя электронами.
в котором оба протона имеют всего один общий электрон. Электростатическое отталкивание протонов стремится развалить молекулу. Но, с другой стороны, энергия связи электрона в поле двух протонов, конечно, больше, чем при наличии только одного протона. При определенном расстоянии между протонами (0,1 нм) второй фактор оказывается более существенным, что обеспечивает устойчивость такой системы. Для удаления одного из протонов и образования атома водорода в основном состоянии требуется энергия 2,55 эВ. Еще прочнее оказывается ковалентная связь в нейтральной молекуле водорода (4,48 эВ), где она образуется двумя электронами.
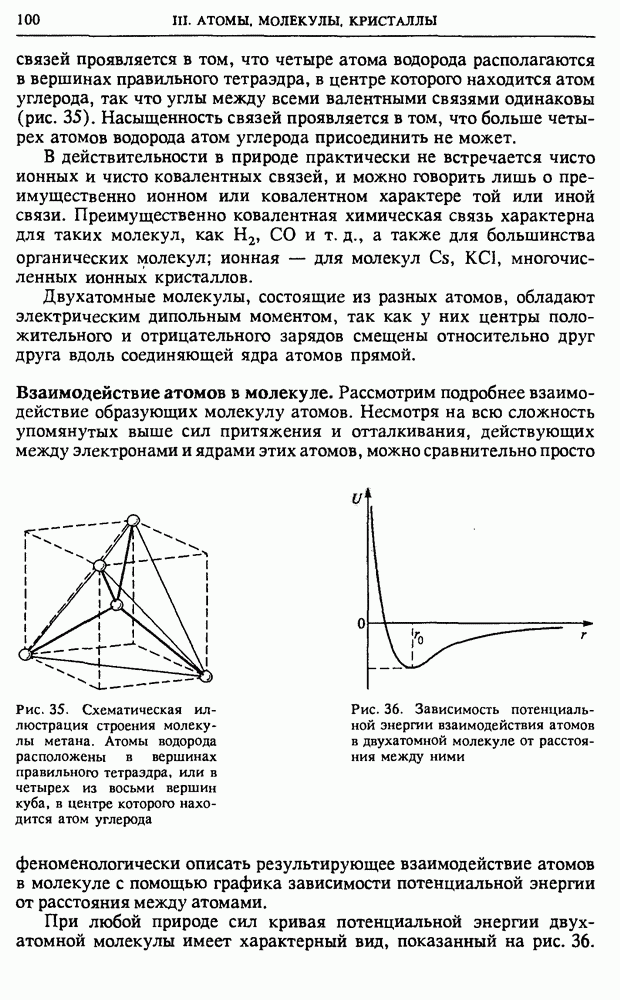
Для ковалентной связи характерна определенная пространственная направленность и насыщаемость. У атома углерода есть четыре электрона, способных участвовать в образовании ковалентных связей. Простейший пример углеродных соединений дает молекула метана  в которой пространственная направленность ковалентных
в которой пространственная направленность ковалентных
связей проявляется в том, что четыре атома водорода располагаются в вершинах правильного тетраэдра, в центре которого находится атом углерода, так что углы между всеми валентными связями одинаковы (рис. 35). Насыщенность связей проявляется в том, что больше четырех атомов водорода атом углерода присоединить не может.
В действительности в природе практически не встречается чисто ионных и чисто ковалентных связей, и можно говорить лишь о преимущественно ионном или ковалентном характере той или иной связи. Преимущественно ковалентная химическая связь характерна для таких молекул, как  и т. д., а также для большинства органических молекул; ионная — для молекул
и т. д., а также для большинства органических молекул; ионная — для молекул  многочисленных ионных кристаллов.
многочисленных ионных кристаллов.
Двухатомные молекулы, состоящие из разных атомов, обладают электрическим дипольным моментом, так как у них центры положительного и отрицательного зарядов смещены относительно друг друга вдоль соединяющей ядра атомов прямой.
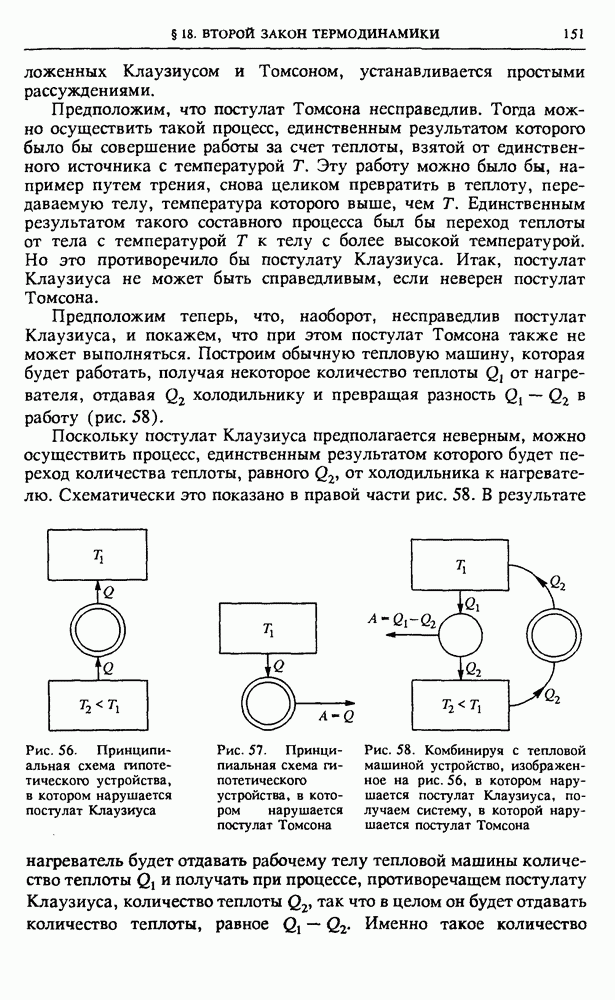
Взаимодействие атомов в молекуле. Рассмотрим подробнее взаимодействие образующих молекулу атомов.

Рис. 35. Схематическая иллюстрация строения молекулы метана. Атомы водорода расположены в вершинах правильного тетраэдра, или в четырех из восьми вершин куба, в центре которого находится атом углерода

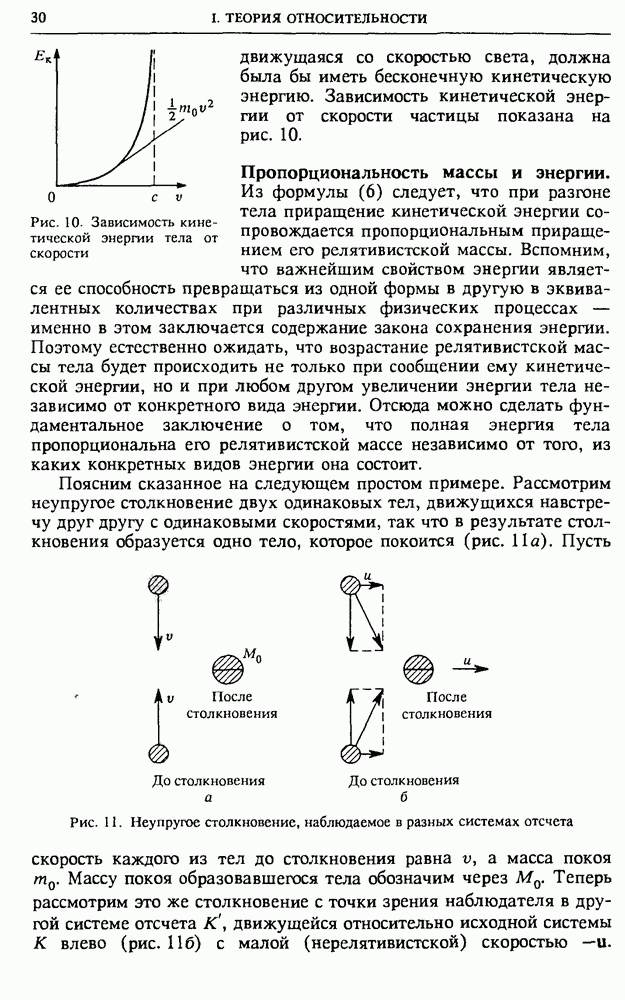
Рис. 36. Зависимость потенциальной энергии взаимодействия атомов в двухатомной молекуле от расстояния между ними
Несмотря на всю сложность упомянутых выше сил притяжения и отталкивания, действующих между электронами и ядрами этих атомов, можно сравнительно просто феноменологически описать результирующее взаимодействие атомов в молекуле с помощью графика зависимости потенциальной энергии от расстояния между атомами.
При любой природе сил кривая потенциальной энергии двухатомной молекулы имеет характерный вид, показанный на рис. 36.
Эта кривая описывает все детали взаимодействия между атомами. Для находящихся на больших расстояниях атомов преобладает сила притяжения, причем эта сила быстро уменьшается с увеличением расстояния между ними. При сближении атомов крутизна графика (наклон касательной) увеличивается, что говорит о возрастании силы притяжения атомов. При дальнейшем сближении атомов сила притяжения начинает убывать и обращается в нуль при некотором значении  расстояния между ними. В этой точке потенциальная энергия имеет минимум. На расстояниях, меньших
расстояния между ними. В этой точке потенциальная энергия имеет минимум. На расстояниях, меньших  результирующая сила уже имеет характер отталкивания, причем она резко возрастает при сближении атомов, о чем свидетельствует быстрый рост крутизны графика
результирующая сила уже имеет характер отталкивания, причем она резко возрастает при сближении атомов, о чем свидетельствует быстрый рост крутизны графика  левее точки
левее точки 
Колебания атомов в молекуле. Расстояние  (рис. 36) соответствует устойчивому положению равновесия атомов. На таком расстоянии друг от друга в молекуле находятся неподвижные атомы. В непосредственной окрестности точки
(рис. 36) соответствует устойчивому положению равновесия атомов. На таком расстоянии друг от друга в молекуле находятся неподвижные атомы. В непосредственной окрестности точки  кривую
кривую  можно аппроксимировать параболой, т. е. считать зависимость потенциальной энергии от смещения из этого положения квадратичной. Это означает, что движение атомов в молекуле при малых смещениях из положения равновесия, рассматриваемое на основе классической механики, представляет собой почти гармоническое колебание. Но в отличие от потенциальной энергии гармонического осциллятора потенциальная яма на графике
можно аппроксимировать параболой, т. е. считать зависимость потенциальной энергии от смещения из этого положения квадратичной. Это означает, что движение атомов в молекуле при малых смещениях из положения равновесия, рассматриваемое на основе классической механики, представляет собой почти гармоническое колебание. Но в отличие от потенциальной энергии гармонического осциллятора потенциальная яма на графике  в действительности асимметрична. Это значит, что с увеличением амплитуды колебаний они становятся ангармоническими. Ангармонизм колебаний проявляется в том, что среднее расстояние между атомами, а тем самым и средний размер молекулы, возрастает с увеличением энергии колебаний.
в действительности асимметрична. Это значит, что с увеличением амплитуды колебаний они становятся ангармоническими. Ангармонизм колебаний проявляется в том, что среднее расстояние между атомами, а тем самым и средний размер молекулы, возрастает с увеличением энергии колебаний.
Глубина потенциальной ямы на рис. 36 характеризует энергию связи атомов в молекуле, т. е. энергию, необходимую для того, чтобы развести атомы и тем самым разрушить молекулу. Эта энергия определяет тепловой эффект химических реакций. При таких реакциях из молекул одного сорта образуются другие молекулы, т. е. одни химические связи разрываются, а другие возникают. Что больше — работа разрыва или работа образования новых связей? В природе мы сталкиваемся с реакциями обоих типов.
Энергия химических превращений. Тепловые эффекты реакций, т. е. результирующее выделение или поглощение энергии — это большей частью величины порядка нескольких сотен килоджоулей на моль, что составляет около одного электронвольта на одну молекулу. Например, реакция сгорания углерода (графита) с учетом выделения энергии записывается так:

т. е. при образовании каждой молекулы углекислого газа выделяется энергия 4,1 эВ.
С помощью таких уравнений можно найти тепловые эффекты химических превращений, для которых по тем или иным причинам не годятся прямые способы измерений. Например, если бы два атома углерода (графита) соединились с одной молекулой водорода, то образовался бы газ ацетилен:

Напрямую такая реакция не идет. Тем не менее можно рассчитать ее тепловой эффект. Наряду с рассмотренной выше реакцией окисления углерода запишем еще две известные реакции окисления водорода и ацетилена:

Эти равенства можно по существу трактовать как уравнения для энергии связи молекул и оперировать с ними, как с обычными алгебраическими равенствами. Вычтем почленно из (4) сначала равенство (3), а затем умноженное на 4 равенство (1). Тогда получим

Это означает, что для интересующего нас превращения двух атомов углерода и молекулы водорода в молекулу метана необходимо затратить энергию 2,35 эВ.
Взаимодействие между молекулами. Между молекулами действуют силы, очень похожие на силы между атомами, о которых говорилось выше. Эти силы также имеют электромагнитную природу. Кривая потенциальной энергии взаимодействия атомов (см. рис. 36) качественно правильно передает и основные черты взаимодействия молекул. Однако между этими взаимодействиями имеются и существенные различия.
Прежде всего, существенно различаются равновесные расстояния между атомами одной молекулы и атомами двух соседних взаимодействующих молекул. Например, атомы кислорода в молекуле  находятся на расстоянии 0,12 нм. Атомы кислорода разных молекул в затвердевшем кислороде находятся друг от друга на расстоянии 0,29 нм.
находятся на расстоянии 0,12 нм. Атомы кислорода разных молекул в затвердевшем кислороде находятся друг от друга на расстоянии 0,29 нм.
Большое различие есть не только в равновесных расстояниях, но и в глубине потенциальной ямы: для «чужих» атомов эта яма существенно мельче. Поэтому молекулы легче оторвать одну от другой, чем разделить молекулу на атомы. Если энергия, необходимая для разрыва связей между атомами кислорода,
образующими молекулу, составляет около 4,3 эВ, то для удаления на большое расстояние двух молекул кислорода необходимая энергия в 50 раз меньше.
Однако различия межатомных сил в молекуле и молекулярных сил проявляются не только в количественных характеристиках потенциальной кривой. Как уже отмечалось выше, атомы соединяются в молекулу с вполне определенным числом других атомов. Если два атома водорода образовали молекулу, то третий уже не может присоединиться к ним для этой цели. Ничего подобного мы не находим в межмолекулярном взаимодействии. Здесь отсутствует насыщаемость сил взаимодействия. Притянув к себе одного соседа, молекула ни в коей мере не утрачивает способности притягивать других.
Модельные потенциалы. Квантовая механика на основе известного строения атомов позволяет приближенно рассчитывать потенциальные кривые их взаимодействия в молекулах. Однако сделать это для межмолекулярного взаимодействия значительно сложнее. Поэтому для его теоретического описания обычно исходят не из первых принципов, а используют некоторые модельные потенциалы, подбирая входящие в выражение для  параметры таким образом, чтобы расчеты на основе этих потенциалов хорошо согласовывались с экспериментальными данными. При таком феноменологическом подходе чаще всего пользуются потенциалом Леннарда-Джонса:
параметры таким образом, чтобы расчеты на основе этих потенциалов хорошо согласовывались с экспериментальными данными. При таком феноменологическом подходе чаще всего пользуются потенциалом Леннарда-Джонса:

Первое слагаемое описывает притяжение между молекулами, преобладающее на больших расстояниях  Зависимость сил притяжения от расстояния такая же, как у двух электрических диполей, хотя эта модель может применяться и для молекул, не обладающих собственным постоянным дипольным моментом. Второе слагаемое в правой части (6), имеющее более сильную зависимость от
Зависимость сил притяжения от расстояния такая же, как у двух электрических диполей, хотя эта модель может применяться и для молекул, не обладающих собственным постоянным дипольным моментом. Второе слагаемое в правой части (6), имеющее более сильную зависимость от  описывает преобладающее на малых расстояниях отталкивание молекул. К хорошему согласию с данными экспериментов приводит допущение, что потенциальная энергия сил отталкивания возрастает с уменьшением расстояния именно по закону
описывает преобладающее на малых расстояниях отталкивание молекул. К хорошему согласию с данными экспериментов приводит допущение, что потенциальная энергия сил отталкивания возрастает с уменьшением расстояния именно по закону  что соответствует силе отталкивания, пропорциональной
что соответствует силе отталкивания, пропорциональной  Силы отталкивания связаны с принципом Паули и не имеют наглядного классического объяснения. Качественный вид потенциальной кривой, описываемой формулой (6), совпадает с показанным на рис. 36. Параметры а и
Силы отталкивания связаны с принципом Паули и не имеют наглядного классического объяснения. Качественный вид потенциальной кривой, описываемой формулой (6), совпадает с показанным на рис. 36. Параметры а и  в (6) связаны простыми соотношениями с положением и глубиной потенциальной ямы. Они определяются из различных экспериментальных данных, полученных при измерении диффузии, теплопроводности, вязкости и т. д.
в (6) связаны простыми соотношениями с положением и глубиной потенциальной ямы. Они определяются из различных экспериментальных данных, полученных при измерении диффузии, теплопроводности, вязкости и т. д.
Проведенные в последние годы квантовомеханические расчеты позволили обосновать используемые модельные потенциалы и в
значительной степени разобраться в физической природе сил межмолекулярного взаимодействия.
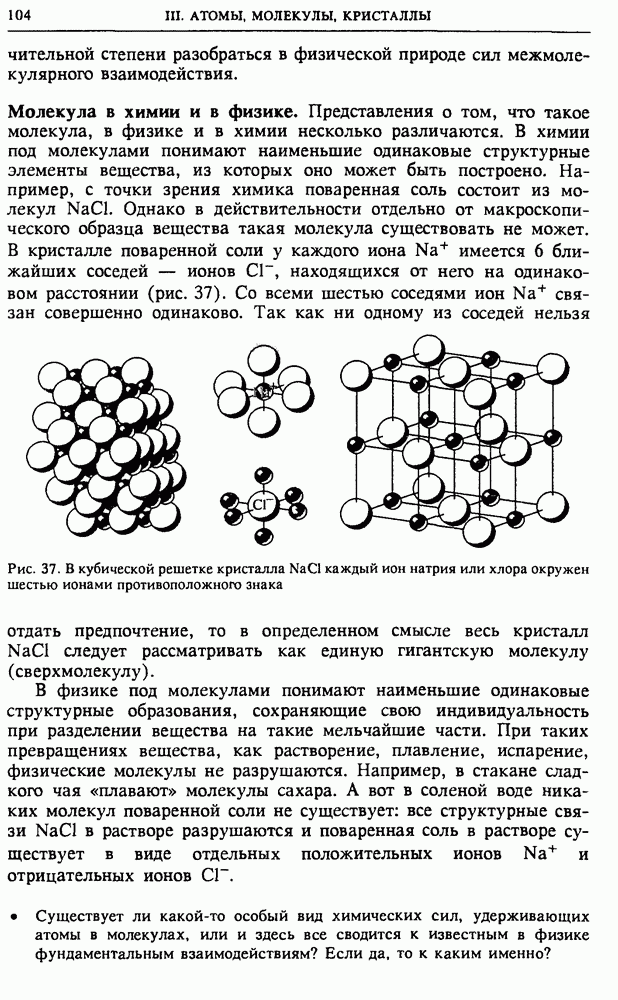
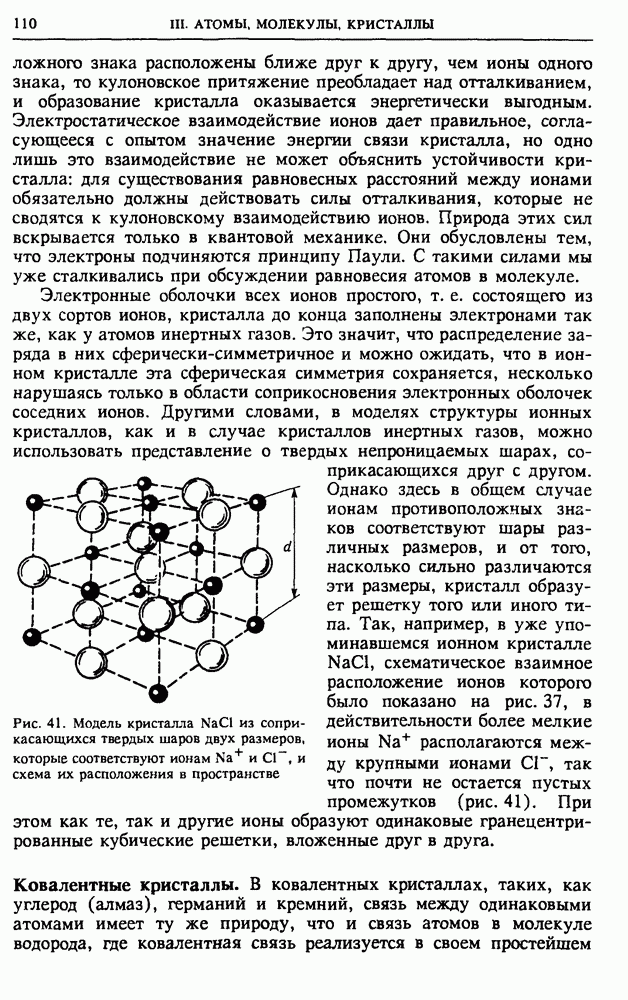
Молекула в химии и в физике. Представления о том, что такое молекула, в физике и в химии несколько различаются. В химии под молекулами понимают наименьшие одинаковые структурные элементы вещества, из которых оно может быть построено. Например, с точки зрения химика поваренная соль состоит из молекул  Однако в действительности отдельно от макроскопического образца вещества такая молекула существовать не может. В кристалле поваренной соли у каждого иона
Однако в действительности отдельно от макроскопического образца вещества такая молекула существовать не может. В кристалле поваренной соли у каждого иона  имеется 6 ближайших соседей — ионов
имеется 6 ближайших соседей — ионов  находящихся от него на одинаковом расстоянии (рис. 37). Со всеми шестью соседями ион
находящихся от него на одинаковом расстоянии (рис. 37). Со всеми шестью соседями ион  связан совершенно одинаково.
связан совершенно одинаково.

Рис. 37. В кубической решетке кристалла  каждый ион натрия или хлора окружен шестью ионами противоположного знака
каждый ион натрия или хлора окружен шестью ионами противоположного знака
Так как ни одному из соседей нельзя отдать предпочтение, то в определенном смысле весь кристалл  следует рассматривать как единую гигантскую молекулу (сверхмолекулу).
следует рассматривать как единую гигантскую молекулу (сверхмолекулу).
В физике под молекулами понимают наименьшие одинаковые структурные образования, сохраняющие свою индивидуальность при разделении вещества на такие мельчайшие части. При таких превращениях вещества, как растворение, плавление, испарение, физические молекулы не разрушаются. Например, в стакане сладкого чая «плавают» молекулы сахара. А вот в соленой воде никаких молекул поваренной соли не существует: все структурные связи  в растворе разрушаются и поваренная соль в растворе существует в виде отдельных положительных ионов
в растворе разрушаются и поваренная соль в растворе существует в виде отдельных положительных ионов  и отрицательных ионов
и отрицательных ионов  .
.
• Существует ли какой-то особый вид химических сил, удерживающих атомы в молекулах, или и здесь все сводится к известным в физике фундаментальным взаимодействиям? Если да, то к каким именно?
• Покажите, что энергия, которую нужно затратить для того, чтобы развести на бесконечность ионы  и
и  с расстояния 1,1 нм, составляет 1,4 эВ?
с расстояния 1,1 нм, составляет 1,4 эВ?
• Поясните аналогию сил притяжения и отталкивания между ионами в молекуле с силами упругости последовательно соединенных пружин разной жесткости. Покажите, что запасаемая в них потенциальная энергия обратно пропорциональна жесткости.
• Чем объясняется пространственная направленность и насыщаемость ковалентных связей?
• По графику зависимости потенциальной энергии двухатомной молекулы от расстояния (рис. 36) постройте качественный график зависимости от расстояния действующей между атомами силы.
• Как выбрано начало отсчета потенциальной энергии на графике  показанном на рис. 36?
показанном на рис. 36?
• Поясните, почему движение атомов в молекуле при малых смещениях представляет собой гармоническое колебание. Чем определяется частота этого колебания? Как она связана с крутизной кривой  вблизи дна потенциальной ямы?
вблизи дна потенциальной ямы?
• Почему при учете энгармонизма колебаний атомов средний размер молекулы увеличивается с ростом энергии колебаний? Где при колебаниях в асимметричной потенциальной яме атомы проводят больше времени: на расстояниях — меньших или больших равновесного значения  ?
?
• Поясните, где использовался закон сохранения энергии в приведенном в тексте примере косвенного расчета теплового эффекта химической реакции.
• Опишите различие потенциальных кривых для взаимодействия атомов в молекуле и атомов различных молекул.
• Как связать глубину и положение потенциальной ямы для кривой  описываемой потенциалом (6), со значениями феноменологических параметров
описываемой потенциалом (6), со значениями феноменологических параметров  ?
?
• Опишите различие представлений о молекулах в физике и в химии.
| << Предыдущий параграф | Следующий параграф >> |
- I. ТЕОРИЯ ОТНОСИТЕЛЬНОСТИ
- § 2. Релятивистская кинематика
- § 3. Преобразования Лоренца
- § 4. Релятивистская динамика
- § 5. Примеры релятивистского движения частиц
- II. ЗАКОНЫ МИКРОМИРА. ЧАСТИЦЫ И ВОЛНЫ
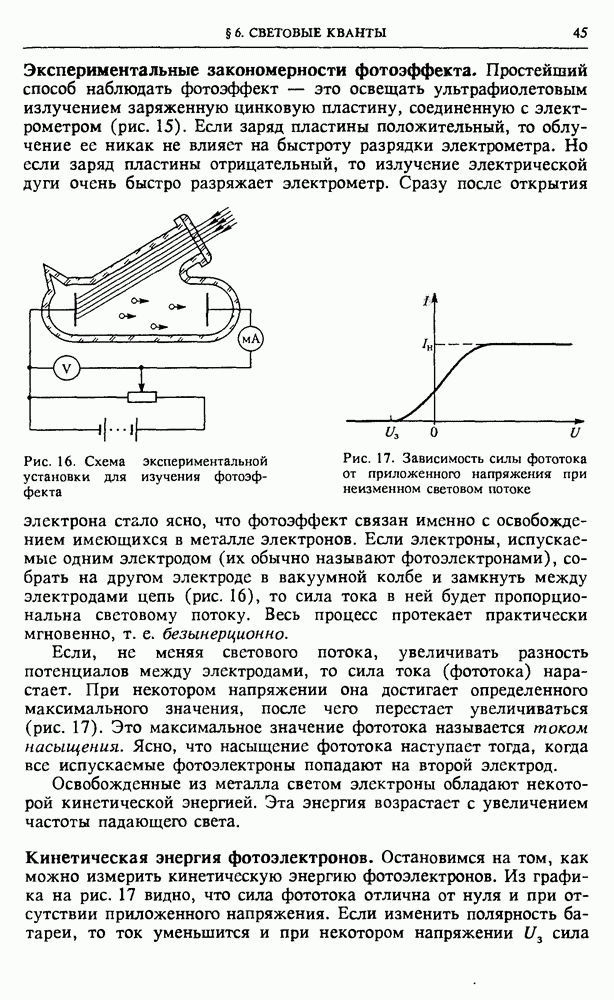
- § 6. Световые кванты
- § 7. Границы применимости классической физики
- § 8. Свет — частицы или волны?
- § 9. Законы движения в квантовой физике
- III. АТОМЫ, МОЛЕКУЛЫ, КРИСТАЛЛЫ
- § 10. Строение атома
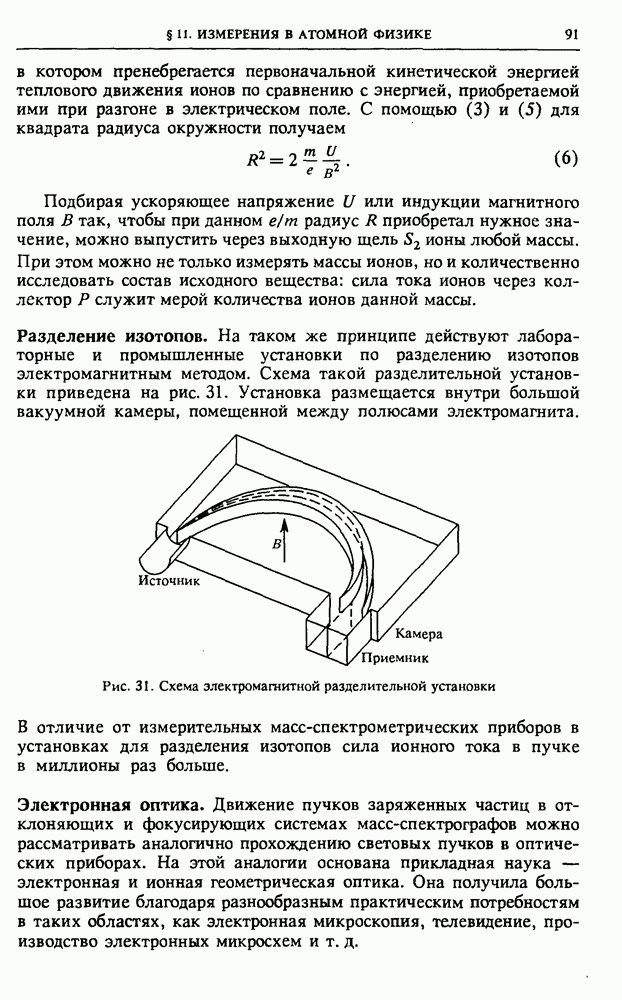
- § 11. Измерения в атомной физике
- § 12. Молекулы
- § 13. Кристаллы
- IV. ОСНОВЫ ТЕРМОДИНАМИКИ
- § 14. Основные понятия термодинамики
- § 15. Уравнение состояния газа
- § 16. Первый закон термодинамики
- § 17. Примеры применения первого закона термодинамики
- § 18. Второй закон термодинамики
- § 19. Методы термодинамики и их применения
- V. ОСНОВЫ МОЛЕКУЛЯРНО-КИНЕТИЧЕСКОЙ ТЕОРИИ
- § 20. Экспериментальные основания статистической механики
- § 21. Молекулярно-кинетическая теория идеального газа
- § 22. Статистические распределения
- § 23. Тепловое равновесие в статистической механике
- § 24. Статистическая природа необратимости тепловых процессов
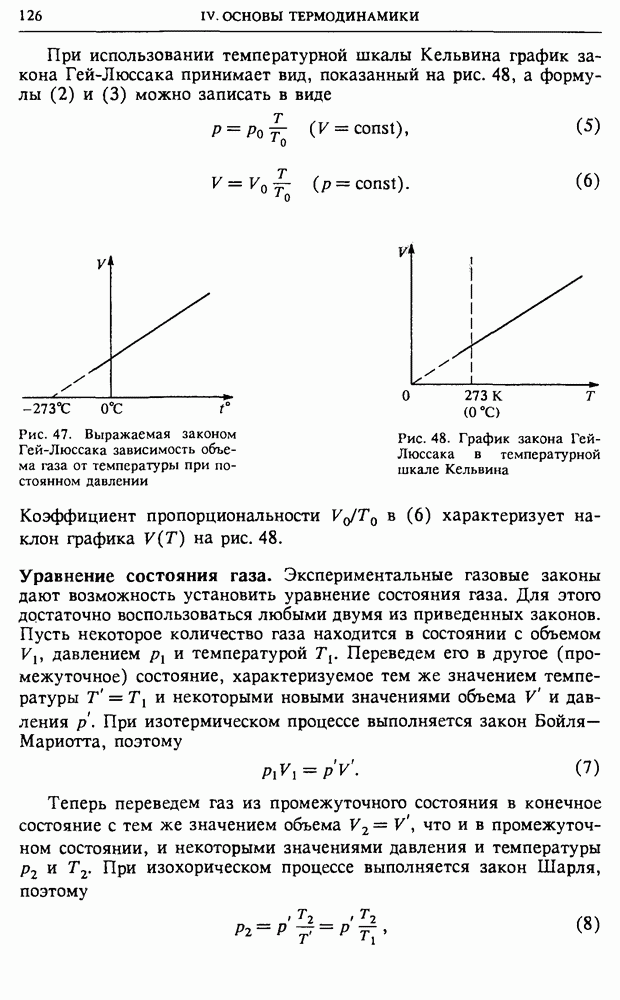
- § 25. Газы, жидкости, фазовые переходы
- § 26. Реальные газы. Уравнение Ван-дер-Ваальса
- § 27. Фазовые переходы
- VI. АТОМЫ И ИЗЛУЧЕНИЕ
- § 28. Излучение света атомами
- § 29. Излучение света нагретыми телами
- § 30. Вынужденное излучение. Квантовые усилители и генераторы света
- § 31. Электрический ток в газах
- § 32. Электрический ток в жидкостях
- § 33. Плазма
- VII. ЭЛЕКТРОННЫЕ СВОЙСТВА ТВЕРДЫХ ТЕЛ
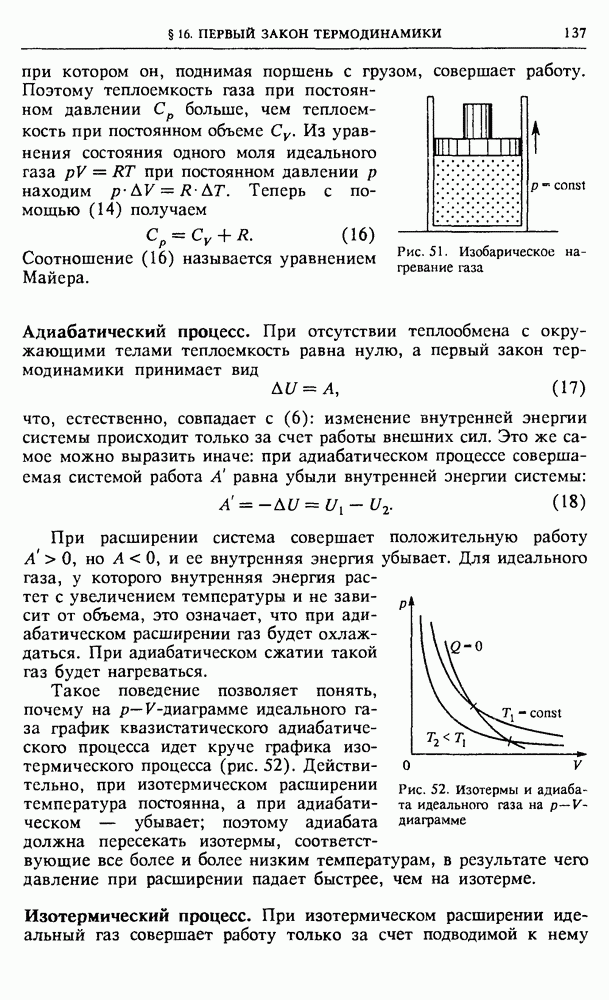
- § 34. Электронная структура кристаллов
- § 35. Электронные свойства металлов
- § 36. Электронные свойства полупроводников
- § 37. Полупроводниковые приборы
- VIII. АТОМНОЕ ЯДРО И ЭЛЕМЕНТАРНЫЕ ЧАСТИЦЫ
- § 38. Строение атомного ядра
- § 39. Радиоактивность. Ядерные реакции
- § 40. Элементарные частицы